إنتاج الكلور (تفاعل برمنجنات البوتاسيوم وحمض الهيدروكلوريك)
تبدأ تجارب الكلور عادة بإنتاج الكلور. في السابق، كانت بعض الجامعات والمعاهد البحثية تمتلك أسطوانات الكلور، لكن لم تتح لي الفرصة حتى لرؤيتها. تعود معظم طرق إنتاج غاز الكلور إلى أكسدة الكلوريدات في بيئة حمضية (في الواقع، إلى أكسدة حمض الهيدروكلوريك). يمكن أن تكون بمثابة عوامل مؤكسدة مجموعة واسعة من المواد: برمنجنات البوتاسيوم، ثاني كرومات البوتاسيوم (عند تسخينها)، هيبوكلوريت الكالسيوم (المبيض)، كلورات البوتاسيوم، ثاني أكسيد المنغنيز (عند تسخينها) وغيرها.
في السابق، كان برمنجنات البوتاسيوم وحمض الهيدروكلوريك يستخدمان في أغلب الأحيان لإنتاج الكلور في المختبرات. على وجه الخصوص، تم عرض هذه التجربة في دروس الكيمياء في المدارس. كان اختيار حمض الهيدروكلوريك وبرمنجنات يرجع إلى حقيقة أن هذه المواد كانت رخيصة ومتاحة بسهولة: تم بيع البرمنجنات في أي صيدلية، ويمكن شراء حمض الهيدروكلوريك التقني في متاجر الأجهزة (تم استخدامه كوسيلة رخيصة وفعالة لإزالة الترسبات الكلسية ، إلخ.) .
لكن اختيار البرمنجنات وحمض الهيدروكلوريك لإنتاج الكلور تم تفسيره أيضًا بحقيقة أن هاتين المادتين تتفاعلان جيدًا بالفعل في درجة حرارة الغرفة، بينما في حالة ثاني أكسيد المنغنيز أو ثنائي كرومات البوتاسيوم، فإن التسخين ضروري حتى يتم إطلاق الكلور.
عامل مؤكسد جيد ورخيص لإنتاج الكلور هو المبيض (المبيض). يمكن كتابة صيغتها بشكل تقليدي على النحو التالي: CaCl 2 ·Ca(ClO) 2، أي. تحتوي هذه المادة على كلوريد وهيبوكلوريت. لكي يبدأوا في التفاعل مع إطلاق الكلور، يكفي إضافة حمض قوي (وليس بالضرورة حمض الهيدروكلوريك - حمض الكبريتيك سيفي بالغرض أيضًا). ولكن هذا كله نظري فقط: في الممارسة العملية، غالبًا ما تبيع المتاجر الآن كميات منخفضة من الكلور. مبيض عالي الجودة، والذي تحلل منذ فترة طويلة. عند تعرضه للحمض، يطلق هذا "المبيض" الكلور، ولكن بكميات قليلة جدًا. ولم يعد التبييض الآن رخيصًا كما كان من قبل.
يمكن الحصول على كميات صغيرة من الكلور عن طريق إضافة حمض إلى محلول هيبوكلوريت الصوديوم (بيليزنا). لسوء الحظ، فإن قصة "Belizna" هي نفسها تقريبًا مع "المبيض": يقوم المصنعون والبائعين بتخفيفه بالماء بلا خجل (ونتيجة لذلك، بدلاً من 5٪ من الكلور النشط، غالبًا ما يحتوي على 1-2٪).
في معظم التجارب الموضحة أدناه، كان مصدر الكلور هو برمنجنات البوتاسيوم وحمض الهيدروكلوريك. وفي عصرنا هذا أمر غير عقلاني للغاية، ولكني أردت أن أبدأ بتجارب الكلور، وألا أضيع الوقت والجهد في إتقان طريقة إنتاج الكلور من مواد أخرى. في بعض الحالات، بدلًا من حمض الهيدروكلوريك (الذي كان على وشك الانتهاء)، استخدمت 40% من حمض الكبريتيك وكلوريد الصوديوم. في هذه الحالة، يجب تسخين الخليط على الموقد.
تم إجراء التفاعل في دورق مخروطي سعة 300 مل، تم صب البرمنجنات فيه مسبقًا. تمت تغطية الدورق بشريط على أقسام رفيعة، تم ربط أنبوب السيليكون به لإزالة الكلور. تم إغلاق الجزء العلوي من الونج (الذي يتم توصيل الثلاجة به أثناء التقطير) بسدادة بأنبوب زجاجي. تم توصيل حقنة تحتوي على حمض الهيدروكلوريك المركز بالأنبوب باستخدام أنبوب PVC (حلت المحقنة محل قمع الإسقاط).
في طريق الكلور، وضعت زجاجة غسيل بمحلول مشبع من كلوريد الصوديوم - لإزالة كلوريد الهيدروجين من الغاز (كلوريد الهيدروجين قابل للذوبان بدرجة عالية ليس فقط في الماء، ولكن أيضًا في محلول ملحي مشبع - على عكس الكلور الذي هو أقل قابلية للذوبان في المحلول الملحي المشبع منه في الماء). لجمع الكلور، استخدمت قوارير وجرار مختلفة (وعند جمع الكلور، من المستحسن تغطية الوعاء بسدادة أو صوف قطني - لم أفهم ذلك على الفور).
إذا تم استخدام الكلور في تجارب الاحتراق، فمن المستحسن صب الرمل مسبقًا في قاع القارورة - وإلا فقد يتشقق الزجاج. لم يكن لدي رمل في متناول اليد، لذلك تناولت ملح الطعام الجاف - وهو جيد أيضًا، لكن الصوديوم يحول اللهب إلى اللون الأصفر (يتداخل هذا أحيانًا).
يمكن وصف إنتاج الكلور وتجارب الكلور بأنها كثيفة العمالة ومرهقة في بعض الأحيان. ولا ينبغي أن ننسى أن الكلور هو أول عامل حرب كيميائي يتم استخدامه بنجاح على نطاق واسع، لذلك يجب إجراء جميع التجارب تحت تيار جيد أو في الهواء الطلق. الكلور ليس مادة سامة بشكل خاص، لكنه قادر تماما على التسبب في حروق الأغشية المخاطية، وفي حالة العمل الإهمال، من الممكن حدوث عواقب أسوأ. أخبرني أحد معارفي أنه تلقى الكلور أثناء التدريب العملي للطلاب. عندما بدأ إطلاق الكلور، استنشق القارورة وفقًا للقواعد: بموجة من راحة يده وجه الهواء نحو وجهه. لم أشم رائحته. ثم انحنى المجرب المؤسف على القارورة وأخذ نفسا عميقا - فقد أنفاسه على الفور: لولا مساعدة طالبين آخرين، لكان من الممكن أن ينتهي الأمر بالموت من الاختناق.
__________________________________________________
عند تفاعل حمض الهيدروكلوريك وبرمنجنات البوتاسيوم في المرحلة النهائية، لا يزال التسخين مرغوبًا فيه، لأنه وإلا فإن البرمنجنات سوف تتحول إلى أكسيد المنغنيز البني المائي (IV)، مما يؤدي إلى زيادة استهلاك البرمنجنات. لكي يتحول ثاني أكسيد المنغنيز إلى كلوريد المنغنيز (II)، هناك حاجة إلى التسخين وزيادة الحمض.
تكمن عمليات الأكسدة والاختزال في أهم ظواهر الطبيعة الحية وغير الحية: الاحتراق وتحلل المواد المعقدة وتخليق المركبات العضوية. برمنجنات البوتاسيوم، التي سندرس خصائصها في مقالتنا، هي واحدة من تلك المستخدمة في الظروف المختبرية والصناعية. وتعتمد قدراته المؤكسدة على حالة أكسدة الذرة التي تتغير أثناء التفاعل. دعونا نفكر في ذلك باستخدام أمثلة محددة للأحداث التي تتضمن جزيئات KMnO 4.
خصائص المادة
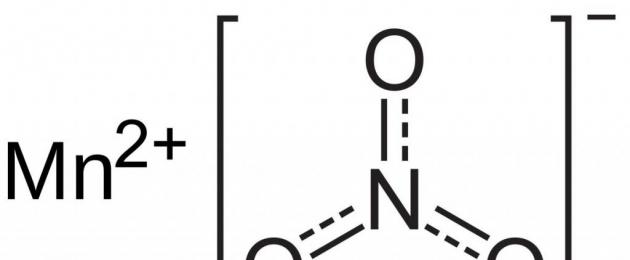
المركب الذي ندرسه (برمنجنات البوتاسيوم) هو أحد المواد الأكثر استخدامًا في الصناعة - مركبات المنغنيز. يتم تمثيل الملح بواسطة بلورات على شكل موشورات أرجوانية داكنة منتظمة. يذوب جيدًا في الماء ويشكل محلولًا قرمزيًا ذو خصائص ممتازة للجراثيم. لذلك، وجدت المادة استخدامًا واسع النطاق في الطب وفي الحياة اليومية كعامل مبيد للجراثيم. مثل مركبات المنغنيز سباعي التكافؤ الأخرى، فإن الملح قادر على أكسدة العديد من المركبات ذات الطبيعة العضوية وغير العضوية. يستخدم تحلل برمنجنات البوتاسيوم في المختبرات الكيميائية للحصول على كميات صغيرة من الأكسجين النقي. يقوم المركب بأكسدة حمض الكبريتيت إلى حمض الكبريتات. وفي الصناعة، يستخدم KMnO 4 لفصل غاز الكلور عن حمض الهيدروكلوريك. كما أنه يؤكسد معظم المواد العضوية، وهو قادر على تحويل أملاح الحديد ثنائي التكافؤ إلى شكل مركباته ثلاثية التكافؤ.

تجارب مع برمنجنات البوتاسيوم
تتحلل المادة، التي تسمى عادة برمنجنات البوتاسيوم، عند تسخينها. تحتوي منتجات التفاعل على الأكسجين الحر وثاني أكسيد المنغنيز وملح جديد - K 2 MnO 4 . وفي المختبر تتم هذه العملية للحصول على الأكسجين النقي. يمكن تمثيل المعادلة الكيميائية لتحلل برمنجنات البوتاسيوم على النحو التالي:
2KMnO 4 = K 2 MnO 4 + MnO 2 + O 2.
يتم تسخين المادة الجافة، وهي بلورات أرجوانية على شكل منشورات منتظمة، إلى درجة حرارة +200 درجة مئوية. كاتيون المنغنيز الموجود في الملح لديه حالة أكسدة +7. ينخفض في منتجات التفاعل إلى قيم +6 و +4 على التوالي.

أكسدة الإيثيلين
تنتمي الهيدروكربونات الغازية إلى فئات مختلفة من المركبات العضوية، ولها روابط مفردة ومتعددة بين ذرات الكربون في جزيئاتها. كيفية تحديد وجود روابط باي الكامنة وراء الطبيعة غير المشبعة للمركب العضوي؟ للقيام بذلك، يتم إجراء تجارب كيميائية عن طريق تمرير المادة قيد الدراسة (على سبيل المثال، الإيثين أو الأسيتيلين) من خلال اللون البنفسجي، ويتم ملاحظة تغير لونها، حيث يتم تدمير الرابطة غير المشبعة. يتأكسد جزيء الإيثيلين ويتحول من هيدروكربون غير مشبع إلى كحول مشبع ثنائي هيدرو - إيثيلين جلايكول. يعتبر هذا التفاعل نوعيًا لوجود روابط مزدوجة أو ثلاثية.
ملامح المظاهر الكيميائية لـ KMnO4
إذا تغيرت حالات الأكسدة للمواد المتفاعلة ومنتجات التفاعل، يحدث تفاعل الأكسدة والاختزال. وتقوم على ظاهرة انتقال الإلكترونات من ذرة إلى أخرى. كما هو الحال في تحلل برمنجنات البوتاسيوم وفي التفاعلات الأخرى، تظهر المادة خصائص مؤكسدة واضحة. على سبيل المثال، في محلول محمض من كبريتيد الصوديوم وبرمنجنات البوتاسيوم، يتم تشكيل كبريتات الصوديوم والبوتاسيوم والمنغنيز، وكذلك الماء:
5Na 2 SO 3 + 2KMnO 4 + 3H 2 SO 4 = 2MnSO 4 + 5Na 2 SO 4 + K 2 SO 4 + 3H 2 0.
في هذه الحالة، أيون الكبريت هو عامل اختزال، والمنغنيز، وهو جزء من أنيون معقد MnO 4 -، يعرض خصائص عامل مؤكسد. فهو يقبل خمسة إلكترونات، فتقل حالة الأكسدة فيه من +7 إلى +2.
تأثير البيئة على سير التفاعل الكيميائي
اعتمادًا على تركيز أيونات الهيدروجين أو مجموعات الهيدروكسيل، يتم تمييز الطبيعة الحمضية أو القلوية أو المحايدة للمحلول الذي يحدث فيه تفاعل الأكسدة والاختزال. على سبيل المثال، مع وجود محتوى زائد من كاتيونات الهيدروجين، فإن أيون المنغنيز ذو حالة الأكسدة +7 في برمنجنات البوتاسيوم يقلله إلى +2. في بيئة قلوية، مع تركيز عال من مجموعات الهيدروكسيل، يتأكسد كبريتيت الصوديوم، الذي يتفاعل مع برمنجنات البوتاسيوم، إلى كبريتات. يتحول أيون المنغنيز بحالة أكسدة +7 إلى كاتيون بشحنة +6، وهو جزء من K 2 MnO 4، وهو محلول أخضر اللون. في بيئة محايدة، يتفاعل كبريتيت الصوديوم وبرمنجنات البوتاسيوم مع بعضهما البعض، ويترسب ثاني أكسيد المنغنيز. تنخفض حالة أكسدة كاتيون المنغنيز من +7 إلى +4. تحتوي منتجات التفاعل أيضًا على كبريتات الصوديوم وهيدروكسيد الصوديوم القلوي.

تطبيق أملاح حمض المنغنيز
غالبًا ما تستخدم برمنجنات البوتاسيوم عند تسخينها وعمليات الأكسدة والاختزال الأخرى التي تتضمن أملاح حمض المنغنيز في الصناعة. على سبيل المثال، أكسدة العديد من المركبات العضوية، وإطلاق غاز الكلور من حمض الهيدروكلوريك، وتحول أملاح الحديد ثنائي التكافؤ إلى حديديك. في الزراعة، يتم استخدام محلول KMnO 4 في المعالجة المسبقة للبذور والتربة؛ وفي الطب، يتم استخدامه لعلاج سطح الجروح، ولتطهير الأغشية المخاطية الملتهبة في تجويف الأنف، ولتطهير أدوات النظافة الشخصية.
في مقالتنا، لم ندرس بالتفصيل عملية تحلل برمنجنات البوتاسيوم فحسب، بل درسنا أيضًا خصائصها المؤكسدة واستخدامها في الحياة اليومية والصناعة.
عامل مؤكسدهي جسيمات (ذرات أو جزيئات أو أيونات). تقبل الإلكتروناتأثناء التفاعل الكيميائي. في هذه الحالة، حالة الأكسدة للعامل المؤكسد يذهب للأسفل. عامل مؤكسد يتم استعادتها.
المرممون هي جسيمات (ذرات أو جزيئات أو أيونات). التبرع بالإلكتروناتأثناء التفاعل الكيميائي. في هذه الحالة، حالة الأكسدة لعامل الاختزال يرتفع. التخفيضات في هذه الحالة أكسد.
يمكن تقسيم المواد الكيميائية إلى عوامل مؤكسدة نموذجية, عوامل التخفيض النموذجيةوالمواد التي قد تظهر كل من خصائص الأكسدة والاختزال. لا تظهر بعض المواد أي نشاط الأكسدة والاختزال.
ل عوامل مؤكسدة نموذجية يشمل:
- مواد بسيطة - غير المعادن مع أقوى خصائص الأكسدة (الفلور F 2، الأكسجين O 2، الكلور Cl 2)؛
- الأيوناتالمعادن أو غير المعادنمع حالات الأكسدة الإيجابية العالية (عادة أعلى). : الأحماض (HN +5 O 3، HCl +7 O 4)، الأملاح (KN +5 O 3، KMn +7 O 4)، الأكاسيد (S +6 O 3، Cr +6 O 3)
- مركبات تحتوي على بعض الكاتيونات المعدنيةنأخذ حالات الأكسدة العالية: الرصاص 4+، الحديد 3+، الاتحاد الأفريقي 3+، الخ.
عوامل التخفيض النموذجية - وهذا كقاعدة عامة:
- مواد بسيطة - المعادن(يتم تحديد قدرات الاختزال للمعادن من خلال عدد من الأنشطة الكهروكيميائية)؛
- المواد المعقدة التي تحتوي على ذرات أو أيونات من اللافلزات ذات حالة أكسدة سلبية (عادةً ما تكون الأدنى).: مركبات الهيدروجين الثنائية (H 2 S، HBr)، أملاح الأحماض الخالية من الأكسجين (K 2 S، NaI)؛
- تحتوي على بعض المركبات الكاتيونات مع الحد الأدنى من حالة الأكسدة الإيجابية(Sn 2+، Fe 2+، Cr 2+)، والتي تتخلى عن الإلكترونات، يمكن أن تزيد من حالة الأكسدة الخاصة بهم;
- مركبات تحتوي على أيونات معقدة تتكون من اللافلزات مع حالة الأكسدة الإيجابية المتوسطة(S +4 O 3) 2–، (НР +3 O 3) 2–، حيث يمكن للعناصر عن طريق التبرع بالإلكترونات، زيادة حالة الأكسدة الإيجابية.
قد تظهر معظم المواد الأخرى كل من خصائص الأكسدة والاختزال.

يتم عرض عوامل الأكسدة والاختزال النموذجية في الجدول.

في الممارسة المختبرية الأكثر استخدامًا هي التالية عامل مؤكسد :
برمنجنات البوتاسيوم (KMnO 4)؛
ثاني كرومات البوتاسيوم (K 2 Cr 2 O 7)؛
حمض النيتريك (HNO3)؛
حامض الكبريتيك المركز (H 2 SO 4) ؛
بيروكسيد الهيدروجين (H 2 O 2)؛
أكاسيد المنغنيز (IV) والرصاص (IV) (MnO 2، PbO 2)؛
نترات البوتاسيوم المنصهرة (KNO3) ويذوب بعض النترات الأخرى.
ل عمال الترميم ، والتي تنطبق الخامس الممارسة المخبرية يتصل:
- المغنيسيوم (Mg)، الألومنيوم (Al)، الزنك (Zn) والمعادن النشطة الأخرى؛
- الهيدروجين (H 2) والكربون (C)؛
- يوديد البوتاسيوم (KI)؛
- كبريتيد الصوديوم (Na 2 S) وكبريتيد الهيدروجين (H 2 S)؛
- كبريتيت الصوديوم (Na 2 SO 3)؛
- كلوريد القصدير (SnCl2).
تصنيف تفاعلات الأكسدة والاختزال
تنقسم تفاعلات الأكسدة والاختزال عادةً إلى أربعة أنواع: تفاعلات بين الجزيئات، وداخل الجزيئات، وتفاعلات عدم التناسب (الأكسدة الذاتية-الاختزال الذاتي)، وتفاعلات عدم التناسب المضاد.
التفاعلات بين الجزيئات تحدث مع تغير في حالة الأكسدة عناصر مختلفةمن الكواشف المختلفة. في هذه الحالة، منتجات الأكسدة والاختزال المختلفة .
2Al 0 + الحديد +3 2 يا 3 → آل +3 2 يا 3 + 2Fe 0,
C 0 + 4HN +5 O 3 (conc) = C +4 O 2 + 4N +4 O 2 + 2H 2 O.
التفاعلات داخل الجزيئات - دي ردود أفعال فيها عناصر مختلفةمن كاشف واحداذهب إلى منتجات مختلفة، على سبيل المثال:
( ن -3 ح 4 ) 2 الكروم +6 2 يا 7 → ن 2 0 + كروم +3 2 يا 3 + 4 ح 2 يا,
2 NaN +5 O -2 3 → 2 NaN +3 O 2 + O 0 2 .
تفاعلات عدم التناسب (الأكسدة الذاتية – الشفاء الذاتي) هي تفاعلات يكون فيها العامل المؤكسد والعامل المختزل نفس العنصر من نفس الكاشف،والذي يتحول بعد ذلك إلى منتجات مختلفة:
3Br 2 + 6 KOH → 5KBr + KBrO 3 + 3 H 2 O،
التناسب (التناسب، عدم التناسب المضاد ) هي التفاعلات التي يوجد فيها العامل المؤكسد والعامل المختزل نفس العنصر، أي واحد من الكواشف المختلفةيدخل واحد منتج. رد الفعل هو عكس عدم التناسب.
2H 2 ق -2 + ق +4 يا 2 = 3س + 2 ح 2 يا

القواعد الأساسية لتكوين تفاعلات الأكسدة والاختزال
تفاعلات الأكسدة والاختزال مصحوبة بعمليات الأكسدة والاختزال:
أكسدةهي عملية التبرع بالإلكترونات بواسطة عامل اختزال.
استعادة هي عملية اكتساب الإلكترونات بواسطة عامل مؤكسد.
مؤكسد يتم استعادته، وعامل الاختزال يتأكسد .
في تفاعلات الأكسدة والاختزال لوحظ ذلك توازن إلكتروني: عدد الإلكترونات التي يتخلى عنها العامل المختزل يساوي عدد الإلكترونات التي يكتسبها العامل المؤكسد. إذا تم إعداد الميزانية العمومية بشكل غير صحيح، فلن تتمكن من إنشاء إجماليات إجمالية معقدة.
يتم استخدام عدة طرق لتكوين تفاعلات الأكسدة والاختزال (ORR): طريقة توازن الإلكترون، وطريقة توازن الإلكترون والأيون (طريقة نصف التفاعل) وغيرها.
دعونا نلقي نظرة فاحصة طريقة التوازن الالكتروني .
من السهل جدًا "تحديد" ORR - ما عليك سوى ترتيب حالات الأكسدة في جميع المركبات وتحديد أن الذرات تغير حالة الأكسدة:
ك + 2 ق -2 + 2 ك + من +7 يا -2 4 = 2 ك + 2 من +6 يا -2 4 + س 0
نكتب بشكل منفصل ذرات العناصر التي تغير حالة الأكسدة، في الحالة قبل التفاعل وبعد التفاعل.
تتغير حالة الأكسدة بواسطة ذرات المنغنيز والكبريت:
ق -2 -2ه = ق 0
من +7 + 1ه = من +6
يمتص المنغنيز إلكترونًا واحدًا، ويعطي الكبريت إلكترونين. في هذه الحالة، من الضروري الامتثال توازن إلكتروني. ولذلك فمن الضروري مضاعفة عدد ذرات المنجنيز، وترك عدد ذرات الكبريت دون تغيير. نشير إلى معاملات التوازن قبل الكواشف وقبل المنتجات!
مخطط لتجميع معادلات OVR باستخدام طريقة التوازن الإلكتروني:

انتباه!قد يكون هناك العديد من العوامل المؤكسدة أو المختزلة في التفاعل. يجب أن يتم وضع الرصيد بحيث يكون إجمالي عدد الإلكترونات المقدمة والمستقبلة هو نفسه.
الأنماط العامة لتفاعلات الأكسدة والاختزال
غالبًا ما تعتمد منتجات تفاعلات الأكسدة والاختزال على شروط العملية. دعونا نفكر العوامل الرئيسية التي تؤثر على مسار تفاعلات الأكسدة والاختزال.
العامل الحاسم الأكثر وضوحا هو بيئة حل التفاعل — . عادة (ولكن ليس بالضرورة)، يتم إدراج المادة التي تحدد الوسط ضمن الكواشف. الخيارات التالية ممكنة:
- النشاط التأكسدي يتم تعزيزه في بيئة أكثر حمضية ويتم تقليل العامل المؤكسد بشكل أعمق(على سبيل المثال، برمنجنات البوتاسيوم، KMnO 4، حيث يتم تقليل Mn +7 في بيئة حمضية إلى Mn +2، وفي بيئة قلوية - إلى Mn +6)؛
- النشاط التأكسدي يزداد في بيئة أكثر قلوية، ويتم تقليل العامل المؤكسد بشكل أعمق (على سبيل المثال، نترات البوتاسيوم KNO 3، حيث يتم تقليل N +5، عند التفاعل مع عامل اختزال في بيئة قلوية، إلى N -3)؛
- أو أن العامل المؤكسد لا يخضع عمليا للتغيرات في البيئة.

تتيح بيئة التفاعل إمكانية تحديد تكوين وشكل وجود منتجات OVR المتبقية. المبدأ الأساسي هو أن المنتجات تتكون بحيث لا تتفاعل مع الكواشف!
ملحوظة! هإذا كان وسط المحلول حمضيًا، فلا يمكن أن تكون القواعد والأكاسيد الأساسية موجودة بين منتجات التفاعل، لأن تتفاعل مع الحمض. وعلى العكس من ذلك، في بيئة قلوية يتم استبعاد تكوين الحمض وأكسيد الحمض. وهذا من أكثر الأخطاء شيوعاً وأخطرها.
يتأثر أيضًا اتجاه تدفق OVR طبيعة المواد المتفاعلة . على سبيل المثالعندما يتفاعل حمض النيتريك HNO 3 مع عوامل الاختزال، يتم ملاحظة نمط - كلما زاد نشاط عامل الاختزال، كلما انخفض عدد النيتروجين N +5.
عند الزيادة درجة حرارة تميل معظم حالات ODD إلى أن تكون أكثر كثافة وأعمق.
في التفاعلات غير المتجانسة، غالبا ما يتأثر تكوين المنتجات درجة طحن المواد الصلبة . على سبيل المثال، يشكل مسحوق الزنك مع حامض النيتريك بعض المنتجات، بينما يشكل الزنك المحبب منتجات مختلفة تمامًا. كلما زادت درجة طحن الكاشف، زاد نشاطه. عادة.
دعونا نلقي نظرة على العوامل المؤكسدة المختبرية الأكثر شيوعًا.
المخططات الأساسية لتفاعلات الأكسدة والاختزال
مخطط استعادة البرمنجنات
تحتوي البرمنجنات على عامل مؤكسد قوي - المنغنيزفي حالة الأكسدة +7. أملاح المنغنيز +7 تلون المحلول البنفسجيلون.

يتم اختزال البرمنجنات، اعتمادًا على بيئة محلول التفاعل، بطرق مختلفة.
في البيئة الحمضية يحدث التعافي بشكل أعمق من 2+. يُظهر أكسيد المنغنيز في حالة الأكسدة +2 خصائص أساسية، وبالتالي البيئة الحمضية يتكون الملح . أملاح المنغنيز +2 عديم اللون. في حل محايد يتم تقليل المنغنيز إلى حالة الأكسدة +4 ، مع التعليم أكسيد الأمفوتريك MnO2 — بني يترسب غير قابل للذوبان في الأحماض والقلويات. في قلويةالبيئة، يتم استعادة المنغنيز إلى الحد الأدنى - إلى الأقرب الأكسدة +6 . تظهر مركبات المنغنيز +6 خواصًا حمضية وتشكل أملاحًا في بيئة قلوية - المنجنات. المنغنيز نقل إلى الحل اللون الاخضر .

دعونا نفكر في تفاعل برمنجنات البوتاسيوم KMnO 4 مع كبريتيد البوتاسيوم في الوسائط الحمضية والمحايدة والقلوية. في هذه التفاعلات، يكون ناتج أكسدة أيون الكبريتيد هو S0.
5 K 2 S + 2 KMnO 4 + 8 H 2 SO 4 = 5 S + 2 MnSO 4 + 6 K 2 SO 4 + 8 H 2 O،
3 K 2 S + 2 KMnO 4 + 4 H 2 O = 2 MnO 2 ↓ + 3 S↓ + 8 KOH،
من الأخطاء الشائعة في هذا التفاعل الإشارة إلى تفاعل الكبريت والقلويات في منتجات التفاعل. ومع ذلك، يتفاعل الكبريت مع القلويات في ظل ظروف قاسية إلى حد ما (درجة حرارة مرتفعة)، والتي لا تتوافق مع ظروف هذا التفاعل. في ظل الظروف العادية، سيكون من الصحيح الإشارة إلى الكبريت الجزيئي والقلويات بشكل منفصل، وليس منتجات تفاعلهما.
K 2 S + 2 KMnO 4 –(KOH)= 2 K 2 MnO 4 + S↓
تنشأ أيضًا صعوبات عند تكوين رد الفعل هذا. والحقيقة هي أنه في هذه الحالة، ليس من الضروري كتابة جزيء من الوسط (KOH أو قلوي آخر) في الكواشف لمعادلة التفاعل. تشارك القلويات في التفاعل وتحدد ناتج اختزال برمنجنات البوتاسيوم، ولكن يتم تعادل الكواشف والمنتجات دون مشاركتها. يمكن حل هذه المفارقة بسهولة إذا تذكرنا أن التفاعل الكيميائي هو مجرد تدوين تقليدي لا يشير إلى كل عملية تحدث، ولكنه مجرد انعكاس لمجموع كل العمليات. كيف تحدد هذا بنفسك؟ إذا اتبعت المخطط الكلاسيكي - التوازن - معاملات التوازن - معادلة المعادن، فسترى أن المعادن تتساوى بمعاملات التوازن، وسيكون وجود القلويات على الجانب الأيسر من معادلة التفاعل غير ضروري.
البرمنجناتأكسد:
- اللافلزاتمع حالة الأكسدة السلبية إلى مواد بسيطة (مع حالة الأكسدة 0)، استثناءات — الفوسفور والزرنيخ - حتى +5 ;
- اللافلزاتمع حالة الأكسدة المتوسطة إلى أعلى درجة من الأكسدة.
- المعادن النشطة إيجابية مستقرة درجة أكسدة المعدن.
KMnO 4 + neMe (أدنى d.o.) = neMe 0 + منتجات أخرى
KMnO 4 + neMe (d.o. متوسط) = neMe (d.o. أعلى) + منتجات أخرى
KMnO 4 + Me 0 = Me (مستقر) + منتجات أخرى
KMnO 4 + P -3، As -3 = P +5، As +5 + منتجات أخرى
مخطط استعادة الكرومات/ثنائي الكرومات
من السمات الخاصة للكروم ذو التكافؤ السادس أنه يشكل نوعين من الأملاح في المحاليل المائية: الكرومات وثنائي الكرومات، اعتمادًا على بيئة المحلول. كرومات معدنية نشطة (على سبيل المثال، K 2 CrO 4) هي أملاح مستقرة فيها قلويةبيئة. ثنائي كرومات (ثنائي كرومات) من المعادن النشطة (على سبيل المثال، K 2 Cr 2 O 7) - أملاح مستقرة في بيئة حمضية .
يتم تقليل مركبات الكروم (VI) إلى مركبات الكروم (III). . مركبات الكروم Cr +3 هي مركبات مذبذبة، وتوجد حسب بيئة المحلول في أشكال مختلفة: في بيئة حمضية في الشكل أملاح(تشكل المركبات المذبذبة أملاحًا عند تفاعلها مع الأحماض) وغير قابلة للذوبان في بيئة محايدة هيدروكسيد الكروم (III) المذبذب الكروم (OH) 3 ، وفي البيئة القلوية تتشكل مركبات الكروم (III). ملح معقد, على سبيل المثال، هيكساهيدروكسيكرومات البوتاسيوم (III) K 3 .

مركبات الكروم السادسأكسد:
- اللافلزاتفي حالة الأكسدة السلبية إلى مواد بسيطة (مع حالة الأكسدة 0)، استثناءات — الفوسفور والزرنيخ - ما يصل إلى +5;
- اللافلزاتفي حالة الأكسدة المتوسطة إلى أعلى درجة من الأكسدة.
- المعادن النشطة من المواد البسيطة (مرحلة الأكسدة 0) إلى المركبات ذات إيجابية مستقرة درجة أكسدة المعدن.
كرومات/ثنائي كرومات + NeMe (سالب d.o.) = NeMe 0 + منتجات أخرى
كرومات/ثنائي كرومات + neMe (d.o.موجب متوسط) = neMe (d.o. أعلى) + منتجات أخرى
كرومات/ثنائي كرومات + Me 0 = Me (d.o. مستقر) + منتجات أخرى
كرومات/ثنائي كرومات + P، As (سلبي d.o.) = P، As +5 + منتجات أخرى
تحلل النترات
تحتوي على أملاح النترات النيتروجين في حالة الأكسدة +5 - قوي مؤكسد. يمكن لهذا النيتروجين أكسدة الأكسجين (O -2). يحدث هذا عند تسخين النترات. في معظم الحالات، يتأكسد الأكسجين إلى حالة الأكسدة 0، أي. قبل جزيئي الأكسجين O2 .
اعتمادًا على نوع المعدن الذي يشكل الملح، تتشكل منتجات مختلفة أثناء التحلل الحراري (درجة الحرارة) للنترات: إذا المعدن النشط(في سلسلة النشاط الكهروكيميائي هناك إلى المغنيسيوم)، ثم يتم اختزال النيتروجين إلى حالة الأكسدة +3، وأثناء التحلل تتشكل أملاح النتريت والأكسجين الجزيئي .
على سبيل المثال:
2NaNO 3 → 2NaNO 2 + O 2 .
توجد المعادن النشطة في الطبيعة على شكل أملاح (KCl، NaCl).
إذا كان المعدن في سلسلة النشاط الكهروكيميائي على يمين المغنيسيوم وعلى يسار النحاس (بما في ذلك المغنيسيوم والنحاس) ثم بعد التحلل يتكون أكسيد المعادنفي حالة أكسدة مستقرة، أكسيد النيتريك (الرابع)(الغاز البني) و الأكسجين. يتشكل أكسيد المعدن أيضًا أثناء التحلل نترات الليثيوم .
على سبيل المثال، تقسيم نترات الزنك:
2Zn(NO 3) 2 → 2ZnО + 4NO 2 + O 2.
غالبًا ما توجد المعادن ذات النشاط المتوسط في الطبيعة على شكل أكاسيد (Fe 2 O 3، Al 2 O 3، إلخ).
الأيونات المعادن، وتقع في سلسلة النشاط الكهروكيميائي على يمين النحاسهي عوامل مؤكسدة قوية. في تحلل النتراتهم، مثل N +5، يشاركون في أكسدة الأكسجين ويتم تحويلهم إلى مواد بسيطة، أي. يتكون المعدن ويتم إطلاق الغازات - أكسيد النيتريك (IV) والأكسجين .
على سبيل المثال، تقسيم نترات الفضة:
2AgNO3 → 2Ag + 2NO2 + O2.
توجد المعادن غير النشطة في الطبيعة كمواد بسيطة.
بعض الاستثناءات!
تقسيم نترات الأمونيوم :
يحتوي جزيء نترات الأمونيوم على عامل مؤكسد وعامل اختزال: يظهر النيتروجين في حالة الأكسدة -3 خصائص مختزلة فقط، بينما يُظهر النيتروجين في حالة الأكسدة +5 خصائص مؤكسدة فقط.
عند تسخينها، نترات الأمونيوم يتحلل. عند درجات حرارة تصل إلى 270 درجة مئوية، يتم تشكيلها أكسيد النيتريك (I)("الغاز الضاحك") والماء:
NH 4 NO 3 → N 2 O + 2 H 2 O
وهذا مثال على رد الفعل عدم التناسب المضاد .
حالة أكسدة النيتروجين الناتجة هي المتوسط الحسابي لحالة أكسدة ذرات النيتروجين في الجزيء الأصلي.
عند درجات الحرارة المرتفعة، يتحلل أكسيد النيتروجين (I) إلى مواد بسيطة - نتروجينو الأكسجين:
2NH 4 NO 3 → 2N 2 + O 2 + 4H 2 O
في تقسيم نتريت الأمونيوم NH4NO2يحدث أيضًا عدم التناسب المضاد.
حالة الأكسدة الناتجة للنيتروجين تساوي أيضًا المتوسط الحسابي لحالات الأكسدة لذرات النيتروجين الأولية - العامل المؤكسد N +3 وعامل الاختزال N -3
NH 4 NO 2 → N 2 + 2H 2 O
التحلل الحراري نترات المنغنيز (II). يرافقه أكسدة المعادن:
المنغنيز (NO 3) 2 = MnO 2 + 2NO 2
نترات الحديد (II). عند درجات حرارة منخفضة يتحلل إلى أكسيد الحديد (II) عند تسخينه، يتأكسد الحديد إلى حالة الأكسدة +3:
2Fe(NO 3) 2 → 2FeO + 4NO 2 + O 2 عند 60 درجة مئوية
4Fe(NO 3) 2 → 2Fe 2 O 3 + 8NO 2 + O 2 عند > 60 درجة مئوية
نترات النيكل (II).
يتحلل إلى النتريت عند تسخينه.
الخصائص التأكسدية لحمض النيتريك
حمض النيتريك HNO 3 عند التفاعل مع المعادن يكون عملياً لا ينتج الهيدروجين أبدًا على عكس معظم الأحماض المعدنية.
ويرجع ذلك إلى حقيقة أن الحمض يحتوي على عامل مؤكسد قوي جدًا - النيتروجين في حالة الأكسدة +5. عند التفاعل مع عوامل الاختزال - المعادن، يتم تشكيل منتجات اختزال النيتروجين المختلفة.
حمض النيتريك + فلز = ملح فلز + ناتج اختزال النتروجين + H2O
يمكن أن يتحول حمض النيتريك عند التخفيض إلى أكسيد النيتروجين (IV) NO 2 (N +4)؛ أكسيد النيتريك (II) NO (N +2)؛ أكسيد النيتريك (I) N 2 O ("غاز الضحك")؛ النيتروجين الجزيئي ن 2؛ نترات الأمونيوم NH4 NO3. كقاعدة عامة، يتم تشكيل خليط من المنتجات مع غلبة أحدهم. يتم تقليل النيتروجين إلى حالات الأكسدة من +4 إلى −3. عمق الترميم يعتمد في المقام الأول بحكم طبيعة عامل الاختزالو على تركيز حمض النيتريك . تعمل القاعدة: كلما انخفض تركيز الحمض وزاد نشاط المعدن، زاد عدد الإلكترونات التي يستقبلها النيتروجين، وتشكل المنتجات المختزلة أكثر.
ستسمح لك بعض الانتظامات بتحديد المنتج الرئيسي لاختزال حمض النيتريك بالمعادن بشكل صحيح في التفاعل:
- عند العمل حمض النيتريك المخفف جدا على المعادنعادة ما يتم تشكيلها نترات الأمونيوم نه 4 نو 3؛
على سبيل المثالتفاعل الزنك مع حمض النيتريك المخفف جداً :
4Zn + 10HNO 3 = 4Zn(NO 3) 2 + NH 4 NO 3 + 3H 2 O
- حمض النيتريك المركزفي البرد سلبيات بعض المعادن - الكروم Cr والألومنيوم Al والحديد Fe . عندما يتم تسخين المحلول أو تخفيفه، يحدث التفاعل؛
التخميل المعدني - هذا هو نقل سطح المعدن إلى حالة غير نشطة بسبب تكوين طبقات رقيقة من المركبات الخاملة على سطح المعدن، وفي هذه الحالة بشكل رئيسي أكاسيد المعادن التي لا تتفاعل مع حمض النيتريك المركز
- حمض النيتريك لا يتفاعل مع معادن المجموعة الفرعية البلاتينية — ذهبالاتحاد الأفريقي، البلاتينحزب العمال، و البلاديومالمشتريات.
- عند التفاعل حمض مركز مع معادن غير نشطة و معادن متوسطة النشاطنتروجينيتم تقليل الحمض إلى أكسيد النيتريك (الرابع) رقم 2 ;
على سبيل المثالأكسدة النحاس بحمض النيتريك المركز:
Cu+ 4HNO 3 = Cu(NO 3) 2 + 2NO 2 + 2H 2 O
- عند التفاعل حمض النيتريك المركز مع المعادن النشطة لقد تكون أكسيد النيتريك (ط) N2O ;
على سبيل المثالالأكسدة صوديوممركزة حمض النيتريك:
Na+ 10HNO3 = 8NaNO3 + N2O + 5H2O
- عند التفاعل تمييع حمض النيتريك مع المعادن غير النشطة (في سلسلة النشاط على يمين الهيدروجين) يتم اختزال الحمض إلى أكسيد النيتريك (II) NO ;
- عند التفاعل تمييع حمض النيتريك مع معادن متوسطة النشاط يتم تشكيل سواء أكسيد النيتريك (II) NO، أو أكسيد النيتريك N 2 O، أو النيتروجين الجزيئي N 2 - اعتمادًا على عوامل إضافية (نشاط المعدن، درجة طحن المعدن، درجة التخفيف الحمضي، درجة الحرارة).
- عند التفاعل تمييع حمض النيتريك مع المعادن النشطة لقد تكون النيتروجين الجزيئي ن2 .
لتحديد منتجات الاختزال لحمض النيتريك تقريبًا عند التفاعل مع معادن مختلفة، أقترح استخدام مبدأ البندول. العوامل الرئيسية التي تغير موضع البندول هي: تركيز الحمض والنشاط المعدني. للتبسيط، نستخدم 3 أنواع من تركيزات الأحماض: المركزة (أكثر من 30%)، والمخففة (30% أو أقل)، والمخففة جدًا (أقل من 5%). نقسم المعادن حسب نشاطها إلى نشطة (قبل الألومنيوم) ومتوسطة النشاط (من الألومنيوم إلى الهيدروجين) وغير نشطة (بعد الهيدروجين). نقوم بترتيب منتجات اختزال حمض النيتريك ترتيبًا تنازليًا لحالة الأكسدة:
NO2؛ لا؛ أكسيد النيتروز؛ ن 2؛ NH4NO3
كلما كان المعدن أكثر نشاطا، كلما انتقلنا إلى اليمين. كلما زاد تركيز الحمض أو انخفضت درجة تخفيفه، كلما تحولنا إلى اليسار.
على سبيل المثال , يتفاعل الحمض المركز مع معدن النحاس غير النشط. ونتيجة لذلك، ننتقل إلى أقصى اليسار، ويتكون أكسيد النيتروجين (IV)، ونترات النحاس والماء.
تفاعل المعادن مع حامض الكبريتيك
تمييع حمض الكبريتيك يتفاعل مع المعادن مثل حمض معدني عادي. أولئك. يتفاعل مع المعادن الموجودة في سلسلة الفولتية الكهروكيميائية حتى الهيدروجين. العامل المؤكسد هنا هو أيونات H +، والتي يتم اختزالها إلى هيدروجين جزيئي H 2 . في هذه الحالة، تتم أكسدة المعادن، كقاعدة عامة، إلى الحد الأدنى درجة الأكسدة.
على سبيل المثال:
الحديد + H 2 SO 4 (ديل) = FeSO 4 + H 2
يتفاعل مع المعادن في نطاق الجهد قبل وبعد الهيدروجين.
H 2 SO 4 (conc) + فلز = ملح فلز + منتج اختزال الكبريت (SO 2، S، H 2 S) + ماء
عندما يتفاعل حمض الكبريتيك المركز مع المعادن، يتكون ملح المعدن (في حالة أكسدة مستقرة)، والماء ومنتج اختزال الكبريت - ثاني أكسيد الكبريت S +4 O 2 أو الكبريت الجزيئي S أو كبريتيد الهيدروجين H 2 S -2اعتمادًا على درجة التركيز ونشاط المعدن ودرجة طحنه ودرجة الحرارة وما إلى ذلك. عندما يتفاعل حمض الكبريتيك المركز مع المعادن، لا يتكون الهيدروجين الجزيئي!
المبادئ الأساسية لتفاعل حامض الكبريتيك المركز مع المعادن:
1. حمض الكبريتيك المركز سلبيات الألومنيوم والكروم والحديد في درجة حرارة الغرفة أو في البرد.
2. حمض الكبريتيك المركز لا يتفاعل مع الذهب والبلاتين والبلاديوم ;
3. مع المعادن غير النشطةحامض الكبريتيك المركزاستعادة ل أكسيد الكبريت (IV).
على سبيل المثال، يتأكسد النحاس بحمض الكبريتيك المركز:
Cu 0 + 2H 2 S +6 O 4 (conc) = Cu +2 SO 4 + S +4 O 2 + 2H 2 O
4. عند التفاعل مع المعادن النشطة والزنكأشكال حمض الكبريتيك المركزالكبريت S أو كبريتيد الهيدروجين H2S2- (حسب درجة الحرارة ودرجة الطحن ونشاط المعدن).
على سبيل المثال تفاعل حامض الكبريتيك المركز مع الزنك:
8Na 0 + 5H 2 S +6 O 4 (conc) → 4Na 2 + SO 4 + H 2 S — 2 + 4 ح 2 س
بيروكسيد الهيدروجين
يحتوي بيروكسيد الهيدروجين H 2 O 2 على الأكسجين في حالة الأكسدة -1. يمكن لمثل هذا الأكسجين أن يزيد أو يقلل من حالة الأكسدة. وهكذا يظهر بيروكسيد الهيدروجين كل من خصائص الأكسدة والاختزال.
عند التفاعل مع عوامل الاختزال، يُظهر بيروكسيد الهيدروجين خصائص عامل مؤكسد ويتم تقليله إلى حالة أكسدة تبلغ -2. عادةً، يكون ناتج اختزال بيروكسيد الهيدروجين هو الماء أو أيون الهيدروكسيد، اعتمادًا على ظروف التفاعل. على سبيل المثال:
S +4 O 2 + H 2 O 2 -1 → H 2 S +6 O 4 -2
عند التفاعل مع العوامل المؤكسدة، يتأكسد البيروكسيد إلى الأكسجين الجزيئي (حالة الأكسدة 0): O 2 . على سبيل المثال :
2KMn +7 O 4 + 5H 2 O 2 -1 + 3H 2 SO 4 → 5O 2 0 + 2Mn +2 SO 4 + K 2 SO 4 + 8H 2 O
مدرس كيمياء
استمرار. يرى وفي رقم 22/2005؛ 1، 2، 3، 5، 6، 8، 9، 11، 13، 15، 16، 18، 22/2006؛
3, 4, 7, 10, 11, 21/2007;
2, 7, 11, 18, 19/2008
الدرس 26
الصف العاشر(السنة الأولى من الدراسة)
المنغنيز. برمنجنات البوتاسيوم ومنتجات اختزاله
في بيئات مختلفة
1. الموقع في جدول D.I Mendeleev، التكافؤ المحتمل وحالات الأكسدة.
2. تاريخ مختصر لاكتشاف الاسم وأصله.
3. الخصائص الفيزيائية والكيميائية.
4. البحث في الطبيعة والطرق الأساسية للحصول عليها.
5. وأهم مركب المنغنيز هو برمنجنات البوتاسيوم. منتجات تخفيضها تعتمد على بيئة الحل.
يقع المنغنيز في المجموعة الفرعية الثانوية للمجموعة السابعة من الجدول الدوري لـ D.I. مندليف. هذا عنصر ذو تكافؤ متغير. في المركبات، يظهر المنغنيز حالات الأكسدة +2، +3، +4، +6، +7، وأهمها حالات الأكسدة +2 و +4.
تم اكتشاف المنغنيز في عام 1774 من قبل الكيميائيين السويديين K. Scheele وJ. Gann عن طريق تكليس معدن البيرولوسيت (MnO 2) بالفحم. من المحتمل أن يكون اسم العنصر تحريفًا لكلمة "manganes" التي تعني "مبيض، ساطع". هذا الاسم له أصل حرفي ويرتبط بتأثير إزالة اللون من البيرولوسيت على الزجاج عند ذوبانه.
الخصائص الفيزيائية والكيميائية
المنغنيز معدن فضي، وهو معدن مقاوم للحرارة إلى حد ما. يتم تخميله في الهواء والماء، ولكن في حالة الانقسام الدقيق يمكن أكسدته ويتفاعل مع الماء لتكوين هيدروكسيد. بشكل عام، يمكن وصف المنغنيز بأنه معدن نشط إلى حد ما (خاصة في حالة مشتتة بدقة).
من + يا 2 منو 2 ( ر= 400 درجة مئوية).
المعادن (-).
غير المعادن (+):
من + الكلور 2 منكل 2،
3من + ن 2 من 3 ن 2 .
ح 2 يا (+/–):*
![]()
الأكاسيد الأساسية (-).
أكاسيد حمضية (-).
القواعد (-).
الأحماض غير المؤكسدة (+):
Mn + 2HCl = MnCl2 + H2.
الأحماض المؤكسدة (+):
Mn + 2H 2 SO 4 (conc.) = MnSO 4 + SO 2 + 2H 2 O،
3Mn + 8HNO 3 (محلول) = 3Mn (NO 3) 2 + 2NO + 4H 2 O،
Mn + 4HNO 3 (conc.) = Mn (NO 3) 2 + 2NO 2 + 2H 2 O.
الأملاح (+/-):
المنغنيز + CuCl 2 = MnCl 2 + النحاس،
لا يحدث تفاعل Mn + CaCl 2.
في الطبيعة، يوجد المنغنيز بشكل رئيسي في شكل أكاسيد، وبالتالي فإن الطريقة الصناعية الرئيسية للحصول على المنغنيز هي اختزاله (عادة باستخدام السيليكون أو الكربون أو الألومنيوم):
منو 2 + ج من + ثاني أكسيد الكربون 2،
![]()
بالإضافة إلى ذلك يتم الحصول على المنغنيز عن طريق التحليل الكهربائي لمحاليل أملاحه، على سبيل المثال:
وأهم مركب المنغنيز هو برمنجنات البوتاسيوم.
منتجات تخفيضها تعتمد على بيئة الحل
برمنجنات البوتاسيوم (KMnO 4) هو ملح حمض البرمنجانيك HMnO 4. حمض البرمنجانيك قوي جدًا ولا يوجد إلا في محلول مائي. برمنجنات البوتاسيوم هو الملح الأكثر شهرة واستخداما على نطاق واسع لهذا الحمض. هذه المادة البلورية أرجوانية داكنة، سوداء تقريبًا، قابلة للذوبان في الماء بشكل معتدل. محاليل برمنجنات البوتاسيوم ذات التركيز المنخفض لها لون قرمزي مع زيادة التركيز يصبح اللون بنفسجي (هذا اللون هو سمة من سمات أيون برمنجنات). في المحاليل المائية، لا يخضع هذا الملح للتحلل المائي، لأنه يتكون من قاعدة قوية وحمض قوي. عند تسخينها، تتحلل برمنجنات البوتاسيوم بسهولة لتكوين منجنات البوتاسيوم وأكسيد المنغنيز (IV) والأكسجين:
2KMnO 4 K 2 MnO 4 + MnO 2 + O 2.
تعتبر برمنجنات البوتاسيوم عامل مؤكسد قوي بسبب احتواء أيون البرمنجنات على المنغنيز في أعلى حالة أكسدة تبلغ +7. تعتمد طبيعة نواتج الاختزال لـ KMnO 4 على البيئة التي يحدث فيها التفاعل.
في البيئة الحمضية، يتم تقليل أيونات البرمنجنات إلى Mn 2+ أيونات. وبسبب تكوين أملاح المنجنيز غير الملونة يتغير لون المحلول من البنفسجي إلى عديم اللون.
![]()
2KMnO 4 + 5Na 2 SO 3 + 6HCl = 2MnCl 2 + 5Na 2 SO 4 + 2KCl + 3H 2 O.
في بيئة محايدةيتم تقليل أيونات البرمنجنات إلى أكسيد المنغنيز (IV)، ويتشكل راسبًا بنيًا MnO 2، وتنخفض حالة أكسدة المنغنيز من +7 إلى +4.
![]()
2KMnO 4 + 3Na 2 SO 3 + H 2 O = 2MnO 2 + 3Na 2 SO 4 + 2KOH.
في البيئة القلوية، يتم تقليل أيونات البرمنجنات إلى أيونات المنجنات. ونتيجة لذلك، يصبح المحلول أخضر. تنخفض حالة أكسدة المنغنيز من +7 إلى +6.
![]()
2KMnO 4 + Na 2 SO 3 + 2KOH = 2K 2 MnO 4 + Na 2 SO 4 + H 2 O.
كعامل مؤكسد، يستخدم برمنجنات البوتاسيوم على نطاق واسع في الممارسة المختبرية. وبالإضافة إلى ذلك، يستخدم برمنجنات البوتاسيوم على نطاق واسع في الطب كمطهر. يستخدم برمنجنات البوتاسيوم أيضًا كمصدر صلب لإنتاج الأكسجين.
اختبار حول موضوع "المنجنيز ومركباته"
1. أي الأكسيد حمضي؟
لست؛ ب) من 2 يا 3؛
ج) MnO 2؛ د) من 2 يا 7.
2. مركب يحتوي على , في بيئة الرقم الهيدروجيني
3. في تفاعل أكسدة كبريتات الحديد الثنائي مع برمنجنات البوتاسيوم في وسط حمض الكبريتيك، يكون مجموع المعاملات قبل الكواشف يساوي:
أ) 11؛ ب) 15؛ ج) 16؛ د) 20.
4. في أي المركبات التالية تتمتع ذرة المنغنيز بأقصى حالة أكسدة ممكنة؟
أ) برمنجنات البوتاسيوم. ب) منجنات البوتاسيوم.
ج) كبريتيد المنغنيز. د) حمض البرمنجنيك.
5. أيٌّ من أكاسيد المنغنيز يحتوي على أكبر نسبة كتلة من الأكسجين؟
لست؛ ب) من 2 يا 3؛ ج) MnO 2؛ د) من 2 يا 7.
6. تبلغ كثافة محلول حمض الكبريتيك 36.2% 1.27 جم/مل. احسب التركيز المولي (بالمول/لتر) للحمض في هذا المحلول.
أ) لا توجد بيانات كافية لحل المشكلة؛
ب) 4.7؛ ج) 36.2؛ د) 0.0047.
7. ما عدد الإلكترونات التي يحتوي عليها أيون البرمنجنات؟
ج) 58؛ د) 120.
8. ما كتلة يوديد البوتاسيوم (بالجرام) التي تم أكسدتها مع برمنجنات البوتاسيوم في محلول حمض الهيدروكلوريك، إذا أدى ذلك إلى تكوين 6.3 جم من ملح المنغنيز؟
أ) 8.3؛ ب) 4.15؛ ج) 16.6؛ د) 41.5.
9. مجموع جميع المعاملات في تفاعل أكسدة هيدروكسيد الحديد (II) المترسب حديثًا مع برمنجنات البوتاسيوم في محلول مائي هو:
أ) 5؛ ب) 6؛ الساعة 8؛ د) 11.
10. عدد الروابط في جزيء حمض البرمنجنيك يساوي:
أ) 5؛ ب) 3؛ في 6؛ د) 0.
مفتاح الاختبار
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| ز | الخامس | ز | إعلان | ز | ب | الخامس | ز | ز | ب |
المشاكل النوعية للمناقشة
التفاعل الزوجي للمواد
يمكن حل المشاكل من هذا النوع بسهولة باستخدام شبكة بليتنر. في هذه الحالة، من الضروري أن نأخذ في الاعتبار إمكانية حدوث تفاعلات بديلة (في حالة تكوين الأملاح الحمضية والمتوسطة، في حالة تركيز غير معروف من الأحماض المؤكسدة، وما إلى ذلك).
1. ناقش إمكانية التفاعلات الزوجية بين المواد التالية: حمض الهيدروكلوريك، كلوريد الكالسيوم، نترات الفضة، كربونات البوتاسيوم، هيدروكسيد الصوديوم، الكلور. اكتب معادلات التفاعل.
حل
نحن نحل باستخدام شبكة بليتنر.
| مواد | حمض الهيدروكلوريك | CaCl2 | AgNO3 | K2CO3 | هيدروكسيد الصوديوم | Cl2 |
| حمض الهيدروكلوريك | – | – | + (المعادلة الأولى) |
+ (المعادلة الثانية) |
+ (المعادلة الثالثة) |
– |
| CaCl2 | – | – | + (المعادلة الرابعة) |
+ (المعادلة السادسة) |
+ (المعادلة السابعة) |
– |
| AgNO3 | + (المعادلة الأولى) |
+ (المعادلة الرابعة) |
– | + (المعادلة الخامسة) |
+ (المعادلة الثامنة) |
– |
| K2CO3 | + (المعادلة الثانية) |
+ (المعادلة السادسة) |
+ (المعادلة الخامسة) |
– | – | – |
| هيدروكسيد الصوديوم | + (المعادلة الثالثة) |
+ (المعادلة السابعة) |
+ (المعادلة الثامنة) |
– | – | + (المعادلتان التاسعة والعاشرة) |
| Cl2 | – | – | – | – | + (المعادلتان التاسعة والعاشرة) |
– |
1) حمض الهيدروكلوريك + AgNO 3 = AgCl + HNO 3.
2) 2HCl + K2CO3 = 2KCl + H2O + CO2.
3) حمض الهيدروكلوريك + NaOH = NaCl + H2O.
4) CaCl 2 + 2AgNO 3 = 2AgCl + Ca(NO 3) 2.
5) 2AgNO3 + K2CO3 = Ag2CO3 + 2KNO3.
6) CaCl 2 + K 2 CO 3 = CaCO 3 + 2KCl.
7) CaCl 2 + 2NaOH = Ca(OH) 2 + 2NaCl.
8) 2AgNO 3 + 2NaOH = Ag 2 O + 2NaNO 3 + H 2 O.
9) 2NaOH + Cl2 NaCl + NaClO + H2O.
10) 6NaOH + 3Cl 2 5NaCl + NaClO 3 + 3H 2 O.
إجابة. 9 خيارات زوجية ممكنة
2. أي المواد التالية تتفاعل مع بعضها البعض: النحاس، حمض النيتريك المركز، الكربون، الكبريت، الألومنيوم، كلوريد الحديد الثلاثي، كربونات الصوديوم؟ اكتب معادلات التفاعل.
إجابة. 14 خيارًا زوجيًا ممكنًا
التفاعلات (14 معادلات رد فعل).
3. تحديد المواد التي يمكن أن تتفاعل مع بعضها البعض: الزنك، الكلور، أول أكسيد الكربون، أكسيد الصوديوم، هيدروكسيد الصوديوم، حمض النيتريك، كلوريد النحاس (II). اكتب معادلات التفاعل.
إجابة. 12 خيارًا زوجيًا ممكنًا
التفاعلات (15 معادلات رد فعل).
4. أي المواد التالية يمكن أن تتفاعل مع بعضها البعض: البروم، هيدروكسيد البوتاسيوم، الأمونيا، حمض الهيدروكلوريك، يوديد البوتاسيوم، الزنك. اكتب معادلات التفاعل.
إجابة. 8 خيارات زوجية ممكنة
التفاعلات (10 معادلات رد فعل).
5. حدد المواد التي يمكن أن تتفاعل مع بعضها البعض: الكالسيوم، الماء، أكسيد النحاس الثنائي، الهيدروجين، هيدروكسيد الكالسيوم، حمض الكبريتيك المركز، يوديد الصوديوم. اكتب معادلات التفاعل.
إجابة. 7 الخيارات الممكنة في أزواج
التفاعلات (7 معادلات رد فعل).
6. ناقش إمكانية التفاعل الزوجي بين المواد التالية: كبريتات الصوديوم، خلات الرصاص الثنائي، كبريتيد البوتاسيوم، كلوريد الألومنيوم، نترات الباريوم. اكتب معادلات التفاعل.
إجابة. 5 خيارات زوجية ممكنة
التفاعلات (5 معادلات رد فعل).
*العلامة (+/–) تعني أن هذا التفاعل لا يحدث مع جميع الكواشف أو في ظل ظروف معينة.
يتبع