يتم تصنيف سرطان الثدي من قبل منظمة الصحة العالمية وفقًا لنظام TNM، والذي على أساسه يتم تحديد مرحلة سرطان الثدي على أنها مراحل 1 أو 2 أو 3 أو 4. أيضًا، لإجراء التشخيص واختيار أساليب العلاج، يتم استخدام التصنيفات وفقًا للتصنيف الدولي للأمراض 10 والأنسجة ومعدل نمو الورم وتحديد مجموعة المخاطر للجراحة.
تصنيف سرطان الثدي حسب التصنيف الدولي للأمراض ICD 10
C50 مرض خبيث في الثدي.
C50.0 الحلمة والهالة.
C50.1 الجزء المركزي من الغدة الثديية.
C50.2 الربع الداخلي العلوي.
C50.3 الربع الداخلي السفلي.
C50.4 الربع الخارجي العلوي.
C50.5 الربع الخارجي السفلي.
C50.6 المنطقة الإبطية.
C50.8 ينتشر في أكثر من منطقة من المناطق المذكورة أعلاه.
C50.9 التوطين غير محدد.
D05.0 سرطان مفصص في الموقع.
D05.1 سرطان داخل القناة في الموقع.
التصنيف النسيجي لسرطان الثدي
حاليا، يتم استخدام التصنيف النسيجي لمنظمة الصحة العالمية من عام 1984.
أ. السرطان غير الغزوي (في الموقع)
سرطان داخل القناة (داخل القناة) في الموقع .
سرطان مفصص (مفصص) في الموقع.
ب. السرطان الغازي (السرطان المتسلل)
الأقنية.
مفصص.
مخاطية (مخاطية) ؛
النخاعي (مثل الدماغ)؛
أنبوبي؛
المفرزة.
أشكال أخرى (حليمي، حرشفي، شبابي، مغزلي، ساركومي كاذب، إلخ).
ج. الأشكال الخاصة (التشريحية والسريرية).
سرطان باجيت.
السرطان الالتهابي.
الأشكال النسيجية الأكثر شيوعًا للسرطان هي: سرطان الخلايا الحرشفية؛
مرض باجيت (نوع خاص من سرطان الخلايا الحرشفية في منطقة الحلمة)؛ سرطان غدي (ورم غدي). التشخيص الأكثر ملاءمة للدورة والعلاج هو: سرطان الكيسي الأنبوبي والمخاطي والنخاعي والغداني.
إذا لم تنتشر العملية المرضية خارج قناة أو فصيص واحد، فإن السرطان يسمى غير ارتشاحي. إذا انتشر الورم إلى الفصيصات المحيطة به، فإنه يسمى ارتشاحًا. السرطان المتسلل هو الشكل الأكثر شيوعًا (الشكل الأقنوي في 50-70٪ من الحالات والشكل الفصيصي في 20٪).
اقرأ المزيد عن علاج سرطان الثدي والتشخيص على موقعنا.
التصنيف حسب معدل نمو الورم
يتم تحديد معدل نمو ورم الثدي باستخدام طرق التشخيص الإشعاعي؛ ويوضح معدل نمو السرطان مدى خطورة العملية.
السرطان سريع النمو (تتضاعف الكتلة الإجمالية للخلايا السرطانية خلال 3 أشهر).
متوسط معدل النمو (تتضاعف الكتلة خلال سنة).
نمو بطيء (يتضاعف حجم الورم خلال أكثر من عام).
تصنيف TNM لسرطان الثدي
T - تحديد العقدة الورمية الأولية.
ن - تورط العقدة الليمفاوية.
م - وجود الانبثاث.
الورم الأساسي (T)
Tx - بيانات غير كافية لتقييم الورم الرئيسي.
ثم لم يتم تحديد الورم الأساسي.
تيس – السرطان في الموقع.
Tis (DCIS) - سرطان ما قبل التوغل (سرطان الأقنية في الموقع).
Tis (LCIS) هو سرطان مفصص أو داخل القناة غير متسلل (سرطان مفصص في الموقع).
تيس (باجيت) - سرطان باجيت في الحلمة في حالة عدم وجود ورم في الغدة الثديية.
T1 - الورم ≥ 2 سم في البعد الأكبر.
T1mic - سرطان مجهري (أقل من 0.1 سم في البعد الأكبر).
T1a - ورم 0.1 - 0.5 سم.
T1b - ورم 0.5 - 1.0 سم.
T1c - ورم 1 – 2 سم.
T2 – ورم 2.1 – 5 سم.
T3 – ورم > 5 سم.
T4 – ورم من أي حجم مع انتشار مباشر إلى الجلد أو جدار الصدر (اللفافة، العضلات، العظام).
T4a: ينمو الورم في جدار الصدر، لكنه لا ينمو في العضلات الصدرية.
T4b: ورم مع تقرح الجلد و/أو تورم (بما في ذلك علامة قشر البرتقال) و/أو نقائل في جلد الثدي الذي يحمل نفس الاسم؛
T4c: مزيج من T4a وT4b؛
T4d: شكل ذمي أولي من السرطان، وسرطان الثدي الالتهابي (بدون تركيز أساسي).
العقد الليمفاوية الإقليمية (N)
يتم تقييم توطين الغدد الليمفاوية الإقليمية المصابة ومدى عملية الورم باستخدام الجس، والموجات فوق الصوتية، والتصوير المقطعي، والتصوير بالرنين المغناطيسي، والتصوير المقطعي بالإصدار البوزيتروني) ومرضيًا (استنادًا إلى نتائج الفحص النسيجي للغدد الليمفاوية بعد الجراحة).
التصنيف السريري
Nx - لا توجد بيانات كافية لتقييم حالة الغدد الليمفاوية الإقليمية.
لا – لا توجد علامات على وجود ضرر منتشر في الغدد الليمفاوية الإقليمية.
N1 – الانبثاث في الغدد الليمفاوية الإبطية النازحة أو العقدة الليمفاوية على الجانب المصاب.
N2 - نقائل في الغدد الليمفاوية الإبطية المثبتة على بعضها البعض على الجانب المصاب، أو يمكن اكتشافها سريريًا (عن طريق الفحص، الموجات فوق الصوتية، التصوير المقطعي، التصوير بالرنين المغناطيسي، التصوير المقطعي بالإصدار البوزيتروني، ولكن ليس مع التصوير الليمفاوي) النقائل في العقد الليمفاوية الداخلية للغدة الثديية على المنطقة المصابة الجانب في حالة عدم وجود نقائل سريرية يمكن اكتشافها في الغدد الليمفاوية الإبطية:
N2a – نقائل في العقد الليمفاوية الإبطية على الجانب المصاب، مثبتة على بعضها البعض أو على هياكل أخرى (الجلد، جدار الصدر)
N2b - يتم تحديد النقائل سريريًا فقط (عن طريق الفحص، والموجات فوق الصوتية، والتصوير المقطعي المحوسب، والتصوير بالرنين المغناطيسي، والتصوير المقطعي بالإصدار البوزيتروني، ولكن ليس عن طريق التصوير الليمفاوي)، في الغدد الليمفاوية الداخلية للغدة الثديية في حالة عدم وجود نقائل يمكن اكتشافها سريريًا في الغدد الليمفاوية الإبطية على الجانب المصاب؛
N3 - نقائل في العقد الليمفاوية تحت الترقوة على الجانب المصاب مع/بدون نقائل في العقد الليمفاوية الإبطية، أو نقائل يمكن اكتشافها سريريًا (عن طريق الفحص، الموجات فوق الصوتية، التصوير المقطعي المحوسب، التصوير بالرنين المغناطيسي، التصوير المقطعي بالإصدار البوزيتروني، لكن ليس التصوير الومضي اللمفاوي) في العقد الليمفاوية الداخلية للثدي الغدة على الجانب المصاب مع وجود نقائل في الغدد الليمفاوية الإبطية أو نقائل في الغدد الليمفاوية فوق الترقوة على الجانب المصاب مع / بدون نقائل في الغدد الليمفاوية الإبطية أو الداخلية للغدة الثديية:
N3a: النقائل في الغدد الليمفاوية تحت الترقوة على الجانب المصاب.
N3b: النقائل في الغدد الليمفاوية الداخلية للغدة الثديية على الجانب المصاب.
N3c: نقائل في الغدد الليمفاوية فوق الترقوة على الجانب المصاب.
التصنيف المرضي لسرطان الثدي
РNx - لا توجد بيانات كافية لتقييم حالة الغدد الليمفاوية الإقليمية (تمت إزالة العقد في وقت سابق، أو لم تتم إزالتها للفحص المرضي).
Рلا – لا توجد علامات نسيجية لانتشارات العقدة الليمفاوية الإقليمية، ولم يتم إجراء دراسات إضافية على الخلايا السرطانية المعزولة.
إذا كانت هناك خلايا سرطانية معزولة فقط في العقد الليمفاوية الإقليمية، يتم تصنيف هذه الحالة على أنها رقم. عادة ما يتم تشخيص الخلايا السرطانية المفردة على شكل مجموعات صغيرة (لا يزيد حجمها عن 0.2 مم) عن طريق الكيمياء المناعية أو الطرق الجزيئية. كقاعدة عامة، لا تظهر الخلايا السرطانية المعزولة نشاطًا نقيليًا (تكاثر أو تفاعل انسجة)
РNo(I-): لا توجد علامات نسيجية للنقائل التي تؤثر على الغدد الليمفاوية الإقليمية. النتائج السلبية للدراسات المناعية.
PNo(I+): لا توجد علامات نسيجية للنقائل التي تؤثر على الغدد الليمفاوية الإقليمية. نتائج IHC الإيجابية تؤدي إلى عدم وجود مجموعات من الخلايا السرطانية أكبر من 0.2 مم في البعد الأكبر وفقًا لبيانات IHC
РNo(mol-): لا توجد علامات نسيجية للنقائل التي تؤثر على الغدد الليمفاوية الإقليمية. النتائج السلبية لطرق البحث الجزيئي.
РNo(mol+): لا توجد علامات نسيجية للنقائل التي تؤثر على الغدد الليمفاوية الإقليمية. نتائج إيجابية لطرق البحث الجزيئي.
PN1 - نقائل في 1-3 عقد ليمفاوية إبطية على الجانب المصاب و/أو في الغدد الليمفاوية الداخلية للغدة الثديية على الجانب المصاب مع نقائل مجهرية، يتم تحديدها عن طريق استئصال العقدة الليمفاوية الخافرة، ولكن لم يتم اكتشافها سريريًا (أثناء الفحص ، الموجات فوق الصوتية، التصوير المقطعي، التصوير بالرنين المغناطيسي، PET، ولكن ليس التصوير اللمفاوي):
РN1mi: نقائل دقيقة (> 0.2 مم، لكن
- prN1а: النقائل في 1-3 العقد الليمفاوية الإبطية على الجانب المصاب.
PN1b: النقائل المجهرية في الغدد الليمفاوية الداخلية للغدة الثديية على الجانب المصاب، والتي تم تحديدها عن طريق استئصال العقدة الليمفاوية الخافرة، ولكن لم يتم اكتشافها سريريًا (أثناء الفحص، الموجات فوق الصوتية، التصوير المقطعي، التصوير بالرنين المغناطيسي، التصوير المقطعي بالإصدار البوزيتروني، ولكن ليس عن طريق التصوير اللمفاوي)؛
РN1c: النقائل في 1-3 العقد الليمفاوية الإبطية وفي الغدد الليمفاوية الداخلية للغدة الثديية على الجانب المصاب مع نقائل مجهرية يتم اكتشافها عن طريق استئصال العقدة الليمفاوية الحارسة، ولكن لم يتم اكتشافها سريريًا (أثناء الفحص، الموجات فوق الصوتية، التصوير المقطعي، التصوير بالرنين المغناطيسي، PET، ولكن ليس عن طريق التصوير اللمفاوي).
PN2 - النقائل في 4 - 9 من الغدد الليمفاوية الإبطية على الجانب المصاب، أو النقائل التي يمكن اكتشافها سريريًا (عند الفحص، الموجات فوق الصوتية، التصوير المقطعي، التصوير بالرنين المغناطيسي، التصوير المقطعي بالإصدار البوزيتروني، ولكن ليس مع التصوير الليمفاوي) في الغدد الليمفاوية الداخلية للغدة الثديية على الجانب المصاب. غياب النقائل في الغدد الليمفاوية الإبطية:
N2a – نقائل في 4-9 عقد ليمفاوية إبطية على الجانب المصاب، إحداها أكبر من 2 مم؛
N2b – النقائل التي يمكن اكتشافها سريريًا (عن طريق الفحص، الموجات فوق الصوتية، التصوير المقطعي المحوسب، التصوير بالرنين المغناطيسي، التصوير المقطعي بالإصدار البوزيتروني، ولكن ليس عن طريق التصوير اللمفاوي)، في الغدد الليمفاوية الداخلية للغدة الثديية على الجانب المصاب، في حالة عدم وجود نقائل في الغدد الليمفاوية الإبطية.
RN3 - النقائل في 10 أو أكثر من العقد الليمفاوية الإبطية على الجانب المصاب. أو الانبثاث في الغدد الليمفاوية تحت الترقوة على الجانب المصاب. أو يمكن اكتشافها سريريًا (عن طريق الفحص، الموجات فوق الصوتية، التصوير المقطعي المحوسب، التصوير بالرنين المغناطيسي، التصوير المقطعي بالإصدار البوزيتروني، ولكن ليس عن طريق التصوير الليمفاوي) في الغدد الليمفاوية الداخلية للغدة الثديية على الجانب المصاب في وجود واحدة أو أكثر من الغدد الليمفاوية الإبطية المتأثرة بالانتشارات. أو تلف أكثر من 3 عقد ليمفاوية إبطية مع وجود نقائل سلبية سريريًا ولكن مثبتة مجهريًا في العقد الليمفاوية الداخلية للغدة الثديية. أو الانبثاث في العقد فوق الترقوة على الجانب المصاب:
PN3a: نقائل في 10 عقد ليمفاوية إبطية أو أكثر، واحدة منها أكبر من 2 مم أو نقائل في العقد الليمفاوية تحت الترقوة على الجانب المصاب؛
PN3b: يمكن اكتشافه سريريًا (عن طريق الفحص، والموجات فوق الصوتية، والتصوير المقطعي المحوسب، والتصوير بالرنين المغناطيسي، والتصوير المقطعي بالإصدار البوزيتروني، ولكن ليس عن طريق التصوير الليمفاوي) في الغدد الليمفاوية الداخلية للغدة الثديية على الجانب المصاب في وجود واحدة أو أكثر من العقد الليمفاوية الإبطية المتأثرة بالانتشارات؛ أو تلف أكثر من 3 الغدد الليمفاوية الإبطية والغدد الليمفاوية الداخلية مع سلبية سريرية (عند الفحص، الموجات فوق الصوتية، التصوير المقطعي، التصوير بالرنين المغناطيسي، التصوير المقطعي بالإصدار البوزيتروني، ولكن ليس التصوير اللمفاوي)، ولكن تم إثبات وجود نقائل مجهرية في الغدد الليمفاوية الداخلية للغدة الثديية في خزعة الاستنسل؛
PN3c: نقائل في الغدد الليمفاوية فوق الترقوة على الجانب المصاب.
النقائل البعيدة (M)
Mx – بيانات غير كافية لتقييم وجود النقائل البعيدة
مو – لا توجد علامات على النقائل البعيدة.
M1 – هناك نقائل بعيدة، بما في ذلك آفات جلدية خارج الغدة، في العقد الليمفاوية فوق الترقوة.
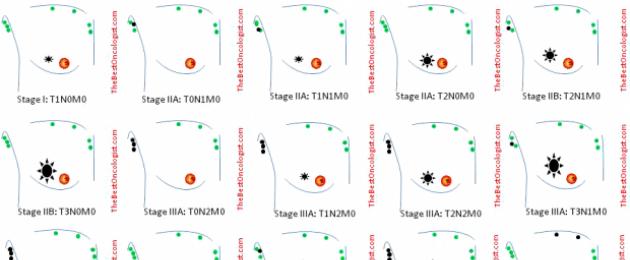
مراحل سرطان الثدي
بناءً على نظام TNM، يتم تحديد مراحل سرطان الثدي. اعتمادا على المرحلة، يتم اختيار أساليب العلاج. يتم عرض مراحل سرطان الثدي في الجدول.
| منصة | الورم الأساسي (T) | العقد الليمفاوية الإقليمية (N) | النقائل البعيدة (M) |
| المرحلة 0 | تيس | لا | شهر |
| المرحلة 1 | T1 (بما في ذلك T1mic) | لا | شهر |
| 2 مرحلة | ل T1 (بما في ذلك T1mic) |
ن1 | شهر |
| المرحلة 2 ب | T2 | ن1 | شهر |
| 3 مرحلة | T2 | ن2 | شهر |
| مرحلة 3V | T4 | لا | شهر |
| 3 ج المرحلة | أي ت | ن3 | شهر |
| المرحلة 4 | أي ت | أي ن | م1 |

المجموعات المعرضة لخطر الإصابة بسرطان الثدي القابل للجراحة
قبل إجراء جراحة الثدي، يتم تحديد مجموعة المخاطر. لا ينبغي اعتبار النساء في سن الحد الأدنى في خطر الحد الأدنى أو الأقصى. يجب تعيين النساء في سن الحد الأدنى مع مستويات منخفضة من مستقبلات هرمون الاستروجين إلى مجموعة المخاطر المناسبة، مع الأخذ في الاعتبار السمات النذير الفردية الأخرى.
| عوامل | مخاطر منخفضة | مخاطر متوسطة | مخاطر عالية |
| حجم الورم (T) | T أقل من أو يساوي 2 سم | تي أكثر من 2 سم | |
| حالة العقدة الإقليمية (N) | لا | لا | N+ (1 – 3 عقد ليمفاوية) |
| درجة الورم الخبيث | الدرجة الأولى | 2-3 درجة | |
| غزو الأوعية الدموية | لا | هنالك | |
| التعبير عن HER-2/neu (بروتين غشائي على سطح خلايا الثدي) | لا أو "1+" | "2+" أو "3+" | "+3" |
| مستقبلات هرمون الاستروجين والبروجستين | إيجابي | إيجابي | سلبي |
| عمر | أكثر من 35 عاما | أقل من 35 سنة | شهر |
| المرحلة 4 | أي ت | أي ن | |
| ملحوظة | كل العوامل موجودة | وجود زوج واحد على الأقل من العوامل مع الرقم | وجود زوج واحد على الأقل من N أو N + (4 أو أكثر من العقد الليمفاوية) |
التصنيف إلى أنواع فرعية لتحديد أساليب علاج سرطان الثدي
| النوع الفرعي البيولوجي لسرطان الثدي | التعريف السريري والمرضي | علاج |
| لومينال أ | ER و/أو PgR – إيجابي (وفقًا لتوصيات ASCO/CAP (2010). HER-2/neu – سلبي (ASCO/CAP) Ki-67 منخفض ( | تم إنشاء هذا "التقسيم الفاصل" لمؤشر Ki-67 عند مقارنة PAM 50 - نوع سرطان الثدي (Cheang، 2009). من المهم مراقبة الجودة المحلية والمركزية لتلطيخ Ki-67. تخضع لعلاج الغدد الصماء. |
| اللمعية B (HER-2 – سلبية) | ER و/أو PgR – إيجابي، HER-2/neu – سلبي. كي-67 طويل القامة. (> 14%) G3 | الجينات التي تظهر تكاثرًا عاليًا هي علامات سوء التشخيص في فحوصات وراثية متعددة. إذا لم يكن من الممكن تحديد Ki-67، فيمكن استخدام بعض التقييمات البديلة لتكاثر الورم، مثل الدرجة، للتمييز بين "Luminal A" و"Luminal B (HER-2/neu سلبي)" مع مراعاة علاج الغدد الصماء +/- السامة للخلايا مُعَالَجَة. |
| اللمعية B (HER-2 – إيجابية) | ER و/أو PgR – إيجابي، أي Ki-67، HER-2 – مفرط التعبير أو مضخم. | يشار إلى العلاج السام للخلايا + العلاج المضاد لـ HER-2 + علاج الغدد الصماء. |
| السرطان القاعدي | "ثلاثي سلبي (أقنوي)": ER وPgR غائبان. الورم سلبي HER-2. | هناك ما يقرب من 80٪ من التداخل بين الأنواع الفرعية الثلاثية السلبية والقاعدية لسرطان الثدي. لكن "الثلاثي السلبي" يشمل أيضًا بعض الأنواع النسيجية الخاصة - مثل سرطان النخاع وسرطان الكيسي الغدي مع انخفاض خطر الإصابة بالانتشار البعيد. يشار إلى العلاج الكيميائي السامة للخلايا. |
| الإفراط في التعبير Erb-B2 | "HER-2 إيجابي (غير لامع)": يتم التعبير عن HER-2 بشكل مفرط أو تضخيمه. ER وPgR غائبان. | العلاج السام للخلايا + العلاج المضاد لـ HER-2 |
خلال عام 2015، أصيبت حوالي 15 ألف امرأة في أوكرانيا بسرطان الثدي من حيث عدد السكان، ولا تختلف بيانات النسبة المئوية في الاتحاد الروسي كثيرًا عن جيرانه.
وبناء على تقرير للجمعية العالمية لأطباء الأورام، فإن نسبة الوفيات بين مريضات سرطان الثدي تصل إلى 35% - 55%، وفي أول 12 شهرا من المرض لا تنخفض عن 15%.
اقرأ في هذا المقال
الإنجازات العلمية للحد من الوفيات الناجمة عن السرطان
ووفقا لإحصائيات منظمة الصحة العالمية، فإن عدد الحالات يتزايد كل عام. ولا يتعلق هذا بالحملات الدعائية المكلفة التي قامت بها منظمة الصحة العالمية، مثل مكافحة الألغام الأرضية، حيث تم إهدار أكثر من 100 مليون دولار على الإعلانات ذات الصلة. بدأت العديد من النساء حول العالم في الاهتمام أكثر بصحتهن؛ فإذا كان لديهن أي مشاكل في الثدي، عليهن استشارة الطبيب المختص على الفور. وفقا لأحدث البيانات، فإن الاعتراف المبكر بعملية الأورام في مؤسسة طبية يبلغ 45٪ فقط.
إن ظهور معدات أكثر حداثة ذات نطاق دقة أكبر، والشيخوخة العامة لسكان العالم، وتحسين طرق التشخيص، قد أدى مؤخرًا إلى زيادة اكتشاف مشاكل سرطان الثدي لدى عدد أكبر من النساء اللاتي تم فحصهن.
المشكلة الرئيسية لأمراض الثدي الخبيثة لدى النساء هي الوصول المتأخر إلى أطباء الأورام، مما يجعل من الممكن تشخيص العملية بالفعل في المراحل 3-4 من السرطان. وفي الوقت نفسه فإن نسبة نجاح العلاج للمرضى لا تتجاوز 35%-40%، وتبلغ نسبة الوفيات خلال السنة الأولى بعد الجراحة الجذرية 22%.
تقوم العديد من النساء بتقييم حالتهن بناءً على الأطروحة الشهيرة القائلة بأن "علم الأورام هو الموت". لكن هذا خطأ جوهري. كان أساس العلاج عالي الجودة لسرطان الثدي في السنوات الأخيرة هو إدخال طرق التشخيص الحديثة، وتوحيد العلاج باستخدام بروتوكولات منظمة الصحة العالمية، وتحسين تلك المستخدمة. تعمل عيادات الأورام الرائدة في العالم وفقًا لهذه المبادئ. وفقا لمعهد السرطان الأمريكي، فإن معدل البقاء على قيد الحياة خلال السنوات الخمس الأولى بعد اكتشاف سرطان الثدي هو 80٪ -85٪.
الكشف عن سرطان الثدي

لتحديد إمكانية المرض، فمن الضروري أن تأخذ بعين الاعتبار عوامل الخطر المختلفة. وبناءً على نوع التأثير على جسم المرأة، فإنها تنقسم إلى ثلاث فئات كبيرة:
- نشاط الجهاز التناسلي لجسم المرأة. وتشمل هذه الأمراض الالتهابية المختلفة للرحم والمبيض، ومشاكل في وظائف الدورة الشهرية والجنسية والرضاعة الطبيعية؛
- الأمراض الجسدية المصاحبة المختلفة للجسم الأنثوي. يمكننا أن نتحدث كثيرا عن هذا. جميع الأمراض المزمنة التي تصيب المرأة يمكن أن تساهم في خباثة العمليات الالتهابية في الغدة الثديية. يمكن أن يكون داء السكري، وتصلب الشرايين في نظام القلب والأوعية الدموية، ومشاكل الكبد والبنكرياس، وبالطبع، الاضطرابات الهرمونية المختلفة للجسم الأنثوي، مثل تضخم الغدد الثديية الهرمونية، سببا لتطوير سرطان الثدي؛
- عوامل وراثية مختلفة إذا كانت المرأة حاملة لجينات BRCA-1 وBRCA-2. قد يشمل ذلك سرطان الثدي الوراثي، والمجموعات المحتملة من سرطان الثدي مع الساركوما، ورم المخ، وسرطان الحنجرة، وسرطان الرئة.
من الأسباب التي لا تقل أهمية لتطور سرطان الثدي هو عمر المرأة والاضطرابات الهرمونية المختلفة. إذا كان خطر الإصابة بالمرض في الفترة من 25 إلى 35 عامًا يبلغ 15٪، فعند عمر 40 عامًا يتحدثون عن 35٪ من الحالات. بعد 55-60 سنة، يصل احتمال الإصابة بالأورام الخبيثة في العمليات الحميدة في الغدة الثديية إلى 80٪.
إن التعرض للهرمونات المختلفة، وبشكل رئيسي الإكسترجينات، يضاعف تقريبًا خطر الإصابة بسرطان الثدي.
ويشمل ذلك إنهاء الحمل والولادة للنساء فوق سن 35 عامًا. وفقا لبعض المؤلفين الأجانب، فإن النساء اللاتي يسمحن لأنفسهن بإنجاب طفل بعد أربعين عاما، يزيد خطر الإصابة بسرطان الثدي 4 مرات.
سرطان الثدي اللمعي
يميز علماء الأنسجة نوعين رئيسيين من الخلايا في ثدي المرأة: القاعدية واللمعية. حسب درجة المشاركة في تطور عملية تنكس نوع معين من الخلايا يتحدثون عن شكل سرطان الثدي:
- النوع اللمعي من مجموعة سرطان الثدي أ (الحالة السلبية)؛
- النوع اللمعي لمجموعة سرطان الثدي ب (الحالة الإيجابية)؛
- النوع القاعدي لتشكيل الورم.
- نوع HER2 إيجابي.
يجب أن نوضح للجميع أن سرطان الثدي اللمعي من النوع أ يتفاعل بشكل إيجابي مع هرمون الاستروجين والبروجستيرون، ويتميز سرطان الثدي اللمعي من النوع ب بمعارضته للهرمونات الأنثوية المذكورة أعلاه.
اللمعية. سرطان الثدي
وهو أكثر شيوعًا ويمثل حوالي 30٪ من حالات الإصابة بالأمراض. في الأساس، تؤثر هذه العملية المرضية على النساء مع بداية فترة غياب الحيض والتغيرات الهرمونية في الجسم المرتبطة بهذه الحالة. الخلفية الهرمونية للمرأة بعد انقطاع الطمث معرضة بشكل خاص لهرمون الاستروجين والبروجستيرون وتأثيرهما على ظهارة خلايا الثدي.
هذه العملية المرضية تستجيب بشكل كبير للعلاجات العلاجية وغالباً لا تتطلب التدخل الجراحي. ومن السمات المميزة الأخرى لهذا النوع من سرطان الثدي انخفاض معدل تكرار الإصابة والانتشار.
سرطان الثدي اللمعي من النوع ب
إنه مضاد عمليًا لتأثيرات الهرمونات الجنسية الأنثوية ويوجد بشكل أقل تكرارًا في الممارسة العامة لطبيب الأورام. فقط 7٪ -9٪ من النساء المصابات بسرطان الثدي يتم اكتشاف هذا النوع من تطور المرض من خلال علم الخلايا. يكون مسار المرض في هذه الحالة أكثر خطورة وطويل الأمد، ويتطلب علاجًا جراحيًا في 90٪ من الحالات، وغالبًا ما يكون مصحوبًا بتضخم الغدد الليمفاوية السريري وفي 40٪ من الحالات يؤدي إلى انتكاس الورم.
لا يوجد علاج محدد لهذه الأشكال من المرض. كما هو الحال مع الأشكال الأخرى من سرطان الثدي، يبقى الشيء الرئيسي هو مجموعة من التدابير التي تهدف إلى إزالة العضو المصاب أو جزء منه من جسم المرأة وإجراء العلاج الدوائي التصالحي.
يعتمد العلاج اللاحق على حالة المريض ويهدف إلى تحسين نوعية الحياة في فترة ما بعد الجراحة، ومشاكل إعادة التأهيل الجسدي والنفسي والحد الأقصى لمواجهة الانتكاسات المحتملة لهذا المرض.
إنه مرض غير متجانس. وهو يتألف من أربعة أنواع فرعية جزيئية، يتطلب كل منها خيارات علاجية مختلفة وله معدلات بقاء متفاوتة. يقول الخبراء إن حدوث هذه الأنواع الفرعية يختلف باختلاف العمر والعرق والعديد من العوامل الأخرى.
هذا التقرير، الذي نُشر مؤخرًا في مجلة المعهد الوطني للسرطان، كتبه فريق مشترك من العلماء من رابطة أمريكا الشمالية لسجلات السرطان (NAACCR)، وجمعية السرطان الأمريكية، ومراكز السيطرة على الأمراض والوقاية منها ومكافحة الأمراض والوقاية منها (CDC). ) والمعهد الوطني للسرطان (NCI).
كتب مؤلفو التقرير، بما في ذلك بيتسي أ. كوهلر من NAACCR، أن تقسيم سرطان الثدي إلى أربعة أنواع فرعية يساعد في تشخيص وعلاج سرطان الثدي، كما يسمح أيضًا بتشخيص أكثر دقة، وهو ما يشكل مصدر قلق كبير للمرضى.
بعد سرطان الجلد، يعد سرطان الثدي هو السرطان الأكثر شيوعا بين النساء الأميركيات. في عام 2015، يقدر الخبراء أنه سيتم تشخيص 231.840 حالة جديدة من سرطان الثدي الغازي في الولايات المتحدة وحدها، وأن أكثر من 40.000 امرأة ستموت بسبب هذا المرض.
في هذا التقرير، قام كوهلر وزملاؤه بتحليل حالات الإصابة بسرطان الثدي الغازية عام 2011 بين النساء بعمر 85 عامًا أو أصغر باستخدام بيانات من سجلات NAACCR.
تشير هذه السجلات إلى أي من الأنواع الفرعية الأربعة للورم ينتمي إليها المريض. يتم تعريف هذه الأنواع الفرعية من خلال وجود مستقبلات الهرمون (HRs) والتعبير الجيني HER2. تتم تسمية الأنواع الفرعية: النوع الفرعي اللمعي A (HR+/HER2-)، والنوع الفرعي اللمعي B (HR+/HER2+)، والنوع الفرعي الإيجابي HER2 (HR-/HER2+)، والنوع الفرعي القاعدي (HR-/HER2-).
وباستخدام هذه البيانات، تمكن العلماء لأول مرة من فحص مدى اعتماد حدوث كل نوع فرعي من سرطان الثدي على عدد من العوامل.
على سبيل المثال، وجد التقرير أن النوع الفرعي لسرطان الثدي، HR+/HER2-، منتشر بشكل كبير بين النساء البيض، والنوع الفرعي الأكثر عدوانية من سرطان الثدي، HR-/HER2-، هو الأكثر انتشارا بين النساء السود.
كان لدى النساء السود أيضًا أعلى معدلات التشخيص المتأخر لسرطان الثدي في جميع الأنواع الفرعية، بالإضافة إلى أعلى معدلات سرطان الثدي ضعيف التمايز وغير المتمايز. كل هذه العوامل تؤدي إلى انخفاض معدلات البقاء على قيد الحياة للمرضى المصابين بسرطان الثدي، وهذا هو السبب في أن معدل الوفيات بسبب سرطان الثدي يكون أعلى بين النساء السود.
وقال مدير المعهد الوطني للسرطان، الدكتور هارولد فارموس، إن تحديد أربعة أنواع فرعية من سرطان الثدي يعد "خطوة مفيدة يمكن أن تحسن الاستراتيجيات العلاجية لهؤلاء المرضى".
ويضيف:
"بالإضافة إلى ذلك، يعد هذا نذيرًا لإنشاء تصنيف أكثر صرامة للسرطان استنادًا إلى السمات الجزيئية، والذي يتم تطويره بشكل منهجي في الوقت الحاضر.
ويجري الآن إنشاء فئات تشخيصية جديدة، وسيسمح لنا إنشاؤها بمعالجة سرطان الثدي وغيره من أنواع السرطان والوقاية منها بشكل أكثر فعالية."
بالإضافة إلى تحليل حالات الإصابة بسرطان الثدي بأنواع فرعية مختلفة في الولايات المتحدة، استخدم مؤلفو التقرير بيانات من NAACCR لتقدير حالات الإصابة والوفيات لبعض أكبر أنواع السرطان والعبء الإجمالي للسرطان.
ووجدوا أنه بين عامي 2002 و2011، انخفض معدل الإصابة بالسرطان بشكل عام بنسبة 0.5% سنويًا. ومن عام 2007 إلى عام 2011، انخفض إجمالي معدل الإصابة بالسرطان لدى الرجال بنسبة 1.8% كل عام. ولوحظ اتجاه مماثل بين النساء بين عامي 1998 و2011، في حين زاد معدل الإصابة بالسرطان بين الأطفال بنسبة 0.8% سنويا على مدى السنوات العشر الماضية.
يقول الدكتور: "إن الانخفاض العام في وفيات السرطان بين الرجال والنساء والأطفال يمنحنا التفاؤل ويعكس فعالية عملنا في الوقاية من السرطان والكشف المبكر عنه وعلاجه". توم فريدن، مدير مركز السيطرة على الأمراض. "ومع ذلك، فإن العبء المرتفع المستمر للسرطان الذي يمكن الوقاية منه، والتفاوت في معدلات الوفيات بين مختلف الأجناس والأعراق، يظهر أنه لا يزال أمامنا طريق طويل لنقطعه في هذا الاتجاه".
وأشار التقرير أيضًا إلى انخفاض معدلات الإصابة بسرطان الرئة والقولون والمستقيم لدى الرجال والنساء. ووفقا لمؤلفي التقرير، كان هذا نتيجة مباشرة لانخفاض معدل انتشار التدخين الذي تحقق من خلال تدابير الصحة العامة.
ومع ذلك، كشف التقرير عن زيادات مثيرة للقلق في حالات الإصابة بسرطان الغدة الدرقية والكلى، فضلا عن زيادة في معدلات الإصابة بالمرض والوفيات الناجمة عن سرطان الكبد.
يحتل سرطان الثدي (BC) المرتبة الأولى بين أمراض السرطان من حيث الانتشار. ويصيب هذا المرض كل عام مليون و600 ألف امرأة في العالم وأكثر من 66 ألف امرأة في الاتحاد الروسي.
ومن المتوقع في السنوات العشرين المقبلة أن تتضاعف معدلات الإصابة بسرطان الثدي بين النساء في جميع البلدان، وهو ما يمكن تفسيره بزيادة متوسط العمر المتوقع وتحسين طرق التشخيص.
في السنوات الأخيرة، وبسبب الاكتشاف المبكر للأورام، انخفضت الوفيات الناجمة عن سرطان الثدي لدى النساء. وفي البلدان المتقدمة التي يتم فيها استخدام فحص التصوير الشعاعي للثدي للسكان، انخفض هذا الرقم بنسبة 30-50%.
الأنواع الفرعية البيولوجية لسرطان الثدي
سرطان الثدي ليس مرضا موحدا. عند العلاج، يأخذ الأطباء في الاعتبار ما إذا كان الورم ينتمي إلى نوع فرعي معين. تتيح الاختبارات الجينية والطرق الكيميائية المناعية تحديد الأنواع الفرعية البيولوجية لسرطان الثدي بشكل موثوق. تتضمن هذه الأنواع الفرعية نفسها العديد من عوامل الخطر والعلامات التنبؤية، مما يسمح لك باختيار العلاج الأكثر فعالية للمريض.
إن التنوع المرضي لسرطان الثدي، والذي تم إثباته باستخدام التحليل الجيني الجزيئي والدراسات الكيميائية المناعية، يسمح بالعلاج الفردي.
لا ترتبط زيادة البقاء على قيد الحياة من سرطان الثدي بالتنفيذ الواسع النطاق لفحص التصوير الشعاعي للثدي فحسب، بل ترتبط أيضًا بالاستخدام المناسب للعلاجات الجهازية.
تشخيص سرطان الثدي
لتحديد أورام الثدي الخبيثة، هناك خوارزمية تشخيصية معينة، وعنصرها الأساسي هو الفحص الشعاعي للثدي. تبلغ حساسية هذه الطريقة التشخيصية للأورام من 2 ملم إلى 5 ملم حوالي 85٪. يتم إجراء الفحص الشعاعي للثدي في إسقاطين.


تحتاج الشابات ذوات بنية الثدي الكثيفة إلى تضمين الموجات فوق الصوتية والتصوير بالرنين المغناطيسي في برنامج المراقبة الخاص بهن.
التصوير بالرنين المغناطيسي
نظرًا لأن فحص التصوير الشعاعي للثدي التقليدي لدى النساء تحت سن 40 عامًا غير فعال، فقد يتطلب الفحص تقنية بديلة - التصوير بالرنين المغناطيسي. يعد التصوير بالرنين المغناطيسي الحديث طريقة حساسة للغاية لتشخيص أمراض الثدي.


تشخيص سرطان الثدي بالرنين المغناطيسي
عوامل الخطر الوراثية للإصابة بسرطان الثدي
فقط 5-10% من حالات سرطان الثدي تكون ناجمة عن جينات BRCA الطافرة. ولكن في الوقت نفسه، بين حاملي الطفرة، يمكن أن يصل خطر الإصابة بالمرض إلى 80٪.
كلما كان عمر تشخيص سرطان الثدي الأولي أصغر، كلما زاد احتمال الإصابة بسرطان المقابل، أي. الغدة الثديية المقابلة.
- "التكوين"، والضغط، والعقدة، والتسلل، والورم، و"الكرة" - لقد وجدت شيئًا مشابهًا لهذا. وهذا ليس سببًا حتى الآن لاتخاذ قرار بإصابتك بسرطان الثدي، بل هو سبب لرؤية أخصائي.
- تشوه محيط الثدي أو الهالة أو الحلمة (تراجع الجلد أو، على العكس من ذلك، انتفاخ)
- تراجع الحلمة. وخاصة إذا ظهرت مؤخرا
- خروج الدم من الحلمة
- تورم جلد الثدي بأكمله أو منطقته المحلية
- ظهور تهيج وقروح وقروح وقشور على الحلمة أو الهالة
- تقرحات (طويلة الأمد، دون سبب واضح) على جلد الصدر
- عدم الراحة في الإبط واكتشاف العقد الليمفاوية ("الكرات") في الإبط
- تغير في لون جلد الثدي – احمرار، زيادة في درجة حرارة الجلد في هذه المنطقة.
كل هذه الأعراض يمكن أن تكون مظاهر لأمراض مختلفة (هناك العشرات منها)، وربما ليست ذات طبيعة خبيثة. ومع ذلك، لا يمكن تحديد ذلك إلا من قبل أخصائي الثدي.

علامات وأعراض سرطان الثدي
مراحل المرض
المرحلة 0
هذه هي المرحلة التي لا يتم فيها تحديد الورم الأساسي أو لا يمكن تقييمه، وكذلك في حالة سرطان الثدي غير الغزوي (مما يعني أن الورم لا يمتد إلى ما بعد ظهوره، وهو ما يسمى بالسرطان الموضعي).
المرحلة 1
تغزو الخلايا السرطانية في هذه المرحلة الأنسجة المجاورة أو تنمو فيها. لا يزيد حجم العقدة الورمية عن 2 سم، ولا تتأثر الغدد الليمفاوية في هذه المرحلة.
المرحلة 2
في هذه المرحلة، يتجاوز حجم العقدة الورمية 2 سم ويمكن أن يصل إلى 5 سم. في هذه المرحلة، قد تتأثر العقد الليمفاوية، ولكن الضرر الذي يصيب العقد الليمفاوية يكون منفردًا، فهي غير ملتحمة مع بعضها البعض وتكون في نفس جانب الورم. في حالة إصابة العقدة الليمفاوية، قد يكون حجم الورم أقل من 2 سم.
المرحلة 3
سرطان غزوي، أكبر من 5 سم أو مع إصابة واضحة وكبيرة في الغدد الليمفاوية. في هذه الحالة، يمكن دمج العقد الليمفاوية معًا.
المرحلة 4
في هذه المرحلة، ينمو الورم إلى جلد الصدر، أو جدار الصدر، أو العقد الليمفاوية الداخلية في الصدر. يمكن أن يكون من أي حجم.
سرطان الثدي في المرحلة الرابعة هو سرطان التهابي، ويحدث في ما يصل إلى 10٪ من جميع الحالات. أعراض الشكل الالتهابي لسرطان الثدي هي احمرار الجلد، وتصبح الغدة دافئة، ويكون هناك تضخم و/أو تصلب في جزء أو كل الثدي. يأخذ الجلد مظهر قشر البرتقال. يجب التمييز بين هذا النوع من السرطان والتهاب الغدة الثديية - التهاب الضرع.
أيضًا، في المرحلة الرابعة، يمكن أن ينتشر الورم خارج الصدر، إلى المنطقة الإبطية، والغدد الليمفاوية الثديية الداخلية. من الممكن حدوث نقائل إلى الغدد الليمفاوية فوق الترقوة، وكذلك إلى الرئتين أو الكبد أو العظام أو الدماغ.
كيف يبدو سرطان الثدي في مراحل مختلفة:





طرق علاج سرطان الثدي
العلاج الجراحي
تعتبر الجراحة هي الطريقة الرئيسية لعلاج أورام الثدي، وتعتمد نتيجة المرض إلى حد كبير على جودة تنفيذه. ووفقا لبعض الولايات الهندية التي لا تقدم العلاج الجراحي لأسباب دينية، فإن معدلات الإصابة بالأمراض تكاد تكون مساوية لمعدلات الوفيات. عادة، يكون معدل الوفيات الناجمة عن سرطان الثدي أقل مرتين إلى أربع مرات من معدل الإصابة.



استئصال الثدي الجذري
ومع ذلك، غالبًا ما يتبع العلاج الجراحي العلاج الإشعاعي. غالبًا ما يؤدي العلاج الموضعي دون العلاج الإشعاعي بعد العملية الجراحية إلى تكرار المرض محليًا وإقليميًا. والحقيقة هي أنه بعد الانتهاء من العملية الجراحية من المستحيل استبعاد وجود نقائل بعيدة مخفية. حتى في المرضى الذين يعانون من أورام يقل قطرها عن 1 سم، فإن تكرار المرض ممكن في 10٪ من الحالات.

توطين النقائل البعيدة في سرطان الثدي
عمليات الحفاظ على الأعضاء
يوجد الآن اتجاه عالمي نحو تقليل حجم التدخل الجراحي دون فقدان الفعالية. يتطور العلاج الجراحي والإشعاعي لسرطان الثدي ويتحسن في اتجاه الحفاظ على الأعضاء.
بفضل إدخال فحص التصوير الشعاعي للثدي، ارتفع بشكل حاد عدد المرضى الذين يعانون من مرحلة مبكرة من المرض، عندما لا تتأثر الغدد الليمفاوية بالانتشارات. في هذه الحالة، فإن الإزالة "الكلاسيكية" لجميع مستويات الغدد الليمفاوية ستكون إجراء تشويه غير ضروري. جاءت طريقة خزعة الغدد الليمفاوية الحارسة لمساعدة الجراحين.
نظرًا لأن النقائل في الغدد الليمفاوية الإبطية تظهر بالتتابع من الأول إلى الثاني، ثم إلى المستوى الثالث، فهذا يكفي لتحديد وجود النقائل في العقدة الليمفاوية الأولى. كان يطلق عليه "الحارس": إذا كانت العقدة الليمفاوية الحارسة لا تحتوي على نقائل، فإن العقد الليمفاوية الأخرى ليست أيضًا منتشرة.
بفضل طريقة الحفاظ على الثدي هذه، تجنب آلاف المرضى إجراء تشريح جراحي كامل غير ضروري؛ ولم تؤدي إزالة الورم السرطاني إلى إزالة الثدي.
أحدث نتائج التجارب السريرية، بما في ذلك بمشاركة معهد أبحاث الأورام الذي يحمل اسمه. ن.ن. بيتروف، أكد سلامة تجنب تشريح الإبط الكامل. تحل خزعة العقدة الليمفاوية الحارسة محل تشريح الإبط تدريجيًا كإجراء قياسي لتحديد مرحلة سرطان الثدي.
أصبح مفهوم خزعة العقدة الحارسة مقبولاً بشكل متزايد وتم إدخاله في معايير العلاج الجراحي للمنظمة الأوروبية لأبحاث وعلاج السرطان (EORTC) للعديد من مواقع الأورام.
العلاج الكيميائي
يعد العلاج الكيميائي، إلى جانب الجراحة، أحد الطرق الرئيسية لعلاج السرطان. العلاج الكيميائي بعد العملية الجراحية يحسن نتائج العلاج الجراحي، وكذلك تشخيص المرض.
في السابق، كان قرار وصف العلاج الكيميائي يعتمد على عاملين:
- مرحلة المرض
- حالة الغدد الليمفاوية الإقليمية.
بفضل العديد من الدراسات التي أجراها العلماء، تتغير الأفكار حول بيولوجيا سرطان الثدي، ويتوسع اختيار أنظمة العلاج الكيميائي بشكل كبير. واليوم، يوصف العلاج الكيميائي حتى في حالة عدم وجود نقائل في الغدد الليمفاوية، إذا كانت الأورام الصغيرة لها خصائص بيولوجية عدوانية.
اللمعية السرطان
بالنسبة للسرطان اللمعي A، يتم تجنب العلاج الكيميائي، خاصة مع الغدد الليمفاوية السلبية، ويتم استخدام علاج الغدد الصماء وحده.
اللمعية للسرطان
تتميز الأورام اللمعية B بالعدوانية العالية. في هذه الحالة، يتم وصف العلاج الكيميائي في أغلب الأحيان، ويعتمد اختيار العلاج على تقييم خطر الانتكاس.
سرطان الثدي الإيجابي HER2
يعتمد علاج سرطان الثدي الإيجابي HER2 على استخدام أنظمة العلاج الكيميائي القياسية - تراستوزوماب والعلاج الكيميائي المعتمد على أنثراسيكلين والتاكسان. ومع ذلك، فإن نسبة صغيرة فقط من المرضى يستفيدون من العلاج، ولكن جميعهم عرضة للتسمم المرتبط به.
سرطان الثدي الثلاثي السلبي
عادة ما يرتبط سرطان الثدي الثلاثي السلبي بسوء التشخيص. بسبب ندرة حدوث أنواع معينة من سرطان الثدي، لا توجد بيانات كافية حول دور العلاج الكيميائي المساعد.
العلاج الكيميائي لسرطان الثدي لدى النساء الشابات جدا
عادةً ما يكون لسرطان الثدي في سن مبكرة مسار عدواني، وغالبًا ما توجد أورام مقاومة للهرمونات وإيجابية HER2 بخصائص مختلفة عن تلك الموجودة في النساء الأكبر سناً. بالنسبة لمثل هؤلاء المرضى الذين تقل أعمارهم عن 35 عامًا، يكون العلاج الكيميائي المساعد هو العلاج الضروري دائمًا تقريبًا.
العلاج الكيميائي للمرضى المسنين
في المرضى المسنين (أكثر من 65 عامًا)، عند اتخاذ قرار بشأن وصف العلاج الكيميائي المساعد، من الضروري مراعاة الحالة العامة للجسم ووجود الأمراض المزمنة المصاحبة.
من الناحية المثالية، يجب أن يخضع المرضى الأكبر سنًا لتقييم الشيخوخة لتحديد مدى ملاءمتهم للعلاج المساعد. يجب موازنة التأثير المحتمل للعلاج مع المخاطر التي يحملها العلاج الكيميائي للجسم. يحدد الطبيب النظام العلاجي الأكثر فعالية والأكثر أمانًا استنادًا إلى نوع الورم الفرعي والخصائص الفردية للمريض.
العلاج الهرموني
تظل الشابات المصابات بسرطان الثدي الإيجابي الهرموني معرضات لخطر تكرار المرض لمدة 15 عامًا على الأقل بعد المرض الأولي. يجب على أطباء الأورام تحديد المرضى الذين يحتاجون إلى علاج مساعد طويل الأمد باستخدام عقار تاموكسيفين أو مثبطات الأروماتيز.
العلاج المساعد الجديد (قبل الجراحة).
يلعب العلاج المساعد الجديد دورًا رائدًا في علاج النساء المصابات بسرطان الثدي غير القابل للجراحة، كما أنه مهم أيضًا للأورام القابلة للجراحة عند إجراء جراحة الحفاظ على الثدي.


تأثير العلاج المساعد الجديد قبل (يسار) وبعد (يمين)
علاج إشعاعي
بعد الجراحة، فإنه يلعب دورا هاما في علاج سرطان الثدي والتشخيص للمرض. في المركز الوطني للبحوث الطبية للأورام الذي يحمل اسمه. ن.ن. أجرى بيتروف دراسة عن دور العلاج الإشعاعي بعد عمليات الحفاظ على الأعضاء (الاستئصال القطاعي مع استئصال العقد اللمفية الإبطية) لدى المرضى الذين يعانون من الحد الأدنى من سرطان الثدي.
أثبت تحليل البقاء على قيد الحياة بدون انتكاسة لمدة عشر سنوات فعالية أعلى للعلاج في مجموعة المرضى الذين تم استخدام العلاج الإشعاعي بعد العملية الجراحية لهم.
استراتيجيات الوقاية من سرطان الثدي
- الوقاية الكيميائية
- التدخلات الجراحية الوقائية
- تصحيح نمط الحياة
يُطلق على استخدام الأدوية لتقليل خطر الإصابة بالمرض اسم الوقاية الكيميائية. الأدوية المعتمدة حاليًا للوقاية من سرطان الثدي هي عقار تاموكسيفين ورالوكسيفين.
يمكن استخدام تاموكسيفين من قبل النساء قبل انقطاع الطمث وبعد انقطاع الطمث. يؤدي تناول عقار تاموكسيفين إلى انخفاض بنسبة 38٪ في خطر الإصابة بسرطان الثدي على مدى أكثر من 10 سنوات. الأحداث السلبية الأكثر شيوعًا أثناء تناول الدواء هي الهبات الساخنة.
تبحث التجارب السريرية حاليًا في دور فئة أخرى من الأدوية، وهي مثبطات الأروماتاز، لتقييم تأثيرات تقليل مخاطر سرطان الثدي، والتي تستخدم حاليًا فقط لعلاج سرطان الثدي. النتائج الأولية واعدة. تعمل مثبطات الهرمونات فقط عند النساء اللاتي يعانين من خلل في المبايض.
يتم إجراء الجراحة الوقائية لإزالة الغدد الثديية في حالة واحدة فقط - إذا كانت المرأة حاملة لطفرات في جينات BRCA1 وBRCA2، المعروفة باسم "". لقد أثبتت الممارسة العالمية أنه عند إزالة الأنسجة من كلا الغدد الثديية، يتم تقليل مخاطر الإصابة بسرطان الثدي بنسبة تزيد عن 90٪. يتم إجراء مثل هذه العمليات في عيادات في الولايات المتحدة الأمريكية وإسرائيل. وفي أوروبا، يعتبر النهج المتبع في التعامل مع هذه القضية أكثر تحفظا.
في المركز الوطني للبحوث الطبية للأورام الذي يحمل اسمه. ن.ن. بيتروف، أثناء العلاج الجراحي، يُعرض على النساء المصابات بطفرات BRCA1 الإزالة الوقائية وإعادة بناء الغدة الثديية.
إن أسلوب الحياة النشط مفيد ويجب تشجيعه بين الناجين من سرطان الثدي. توصل خبراء من مجتمعات عالمية مثل جمعية السرطان الأمريكية والكلية الأمريكية للطب الرياضي إلى هذا الإجماع في أبحاثهم. بالإضافة إلى النشاط البدني المنتظم، يوصي الخبراء النساء بالحفاظ على وزن ثابت والحد من تناول الكحول لتقليل خطر الإصابة بسرطان الثدي.
فيديو: أسئلة وأجوبة حول سرطان الثدي