1447 0
Макрофаги - антигенпрезентирующие клетки, которые вместе с моноцитами объединены в систему мононуклеарных моноцитов на основе единства их происхождения и функций.
Макрофаги образуются в костном мозге из промоноцитов, которые после дифференцировки трансформируются в моноциты, циркулирующие в периферической крови, и тканевые макрофаги.
Созревание и дифференцировка активированных макрофагов происходит при участии цитокинов, в частности GM-CSF, M-CSF, IFNy; под влиянием IL-4 и GM-CSF моноциты периферической крови могут трансформироваться в дендритных клетках (ДК) .
Макрофаги - гетерогенная субпопуляция, клетки которой различаются по фенотипу и функциям.
Большое значение для фенотипических и функциональных особенностей макрофагов имеет их локализация, что особенно отчетливо проявляется при сравнении макрофагов брюшной и плевральной полостей по многим параметрам. Именно макрофаги - одни из основных клеток, которые формируют местный иммунитет и во многом определяют его особенности.
Практически все активированные макрофаги экспрессируют антигены I и II класса главного комплекса гистосовместимости (ГКГ) , адгезивные молекулы (LFA-1, LFA-2, ICAM-1, ICAM-2), ко-стимулирующие молекулы (В7.1, В7.2 и др.), которые связываются со своими лигандами на антигенраспознающих клетках. Покоящиеся макрофаги не экспрессируют антигены II класса ГКГ, и индукция их экспрессии осуществляется антигенами различной природы.
Поверхностная мембрана макрофагов экспрессирует значительное количество рецепторов, опосредующих разнообразные функции макрофагов. Особую роль в противоопухолевой защите выполняют Fc-рецепторы (FcRI, FcPvII, FcRIII), так как именно с их участием макрофаги опосредуют антителозависимую цитотоксичность. На поверхности макрофагов экспрессируется также белок М150, который обладает ко-стимулирующей активностью. Его экспрессия может быть существенно увеличена действием IFNynnH GM-CSF, но уменьшается под влиянием IL-10.
Некоторые антигены, например карбогидратный фиколл, не подвергаются деградации в макрофагах в связи с недостатком соответствующих энзимов. В этих случаях макрофаги маргинальных зон (В-клеточные зоны) или лимфатических узлов (субкапиллярные синусы) поглощают антиген и представляют его непосредственно соответствующим клеткам.
Наряду с тем, что макрофаги вместе с моноцитами и нейтрофилами осуществляют первую линию защиты от различных факторов, одна из их основных функций заключается в презентации антигенов СD4+Т-лимфоцитам.
Процесс презентации антигена состоит из нескольких этапов: прикрепление благодаря наличию молекул адгезии, фагоцитирование антигена и его переваривание (процессинг). От других антигенпрезентирующих клеток (ДК, В-лимфоцитов) макрофаги отличаются способностью к фагоцитозу. Фагоцитированные антигены, в частности их белковая часть, подвергаются протеолизу и распадаются на пептидные фрагменты, которые внутри вакуолей цитоплазмы образуют комплексы с молекулами II класса главного комплекса гистосовместимости.
Образовавшиеся комплексы транспортируются на поверхность антигенпрезентирующих клеток (АПК) и представляются TCR антигенраспознающим клеткам. Антигены, поглощенные макрофагами, частично могут разрушаться в лизосомах, в растворимой форме удаляются из клетки и поглощаются другими антигенпрезентирующими клетками.
В активации макрофагов наряду с антигенами различной природы принимают участие IL-1, TNFa, IL-2, IFNy, GM-CSF. Одна из характерных особенностей активированных макрофагов состоит в способности к синтезу и секреции широкого спектра ферментов, кислородных радикалов, а также различных цитокинов: IL-l,IL-6, IL-8, IL-10, IL-12, IL-18, TNFa, IFNa и др. Основным стимулятором макрофагов является IFNy. Для осуществления функциональной активности макрофагов, как и других клеток, необходимо также наличие многих хемокинов (MIPa, RANTES, МСР-2, МСР-3, МСР-4 и др.).
Эффективность процесса распознавания макрофагами зависит и от прочности межклеточных взаимодействий, которые обеспечиваются молекулами адгезии на макрофагах и их лигандами на CD4+ Т-лимфоцитах.
В отличие от дендритных клетках макрофаги не располагают достаточно высоким уровнем экспрессии ко-стимулирующих молекул, а следовательно, не могут обеспечить необходимый ко-стимулирующий сигнал антигенраспознающим клеткам, что объясняет преимущественное участие макрофагов в презентации антигенов активированным Т-лимфоцитам при вторичном иммунологическом ответе.
Последнее обстоятельство позволяет предполагать, что на начальных этапах злокачественной трансформации клеток, а соответственно на начальных этапах распознавания, роль макрофагов по сравнению с таковой В-лимфоцитов и ДК как антигенпрезентирующих клеток, очевидно, менее существенна. Однако благодаря высокому цитотоксическому потенциалу макрофаги могут включаться в противоопухолевую защиту на всех этапах опухолевого процесса.
Заканчивая обсуждение вопроса о традиционных АПК, нельзя обойти вниманием еще одну популяцию клеток - тучных - и их возможную роль в процессе распознавания. Подобно другим антигенпрезентирующим клеткам тучные клетки обладают способностью к фагоцитозу и экспрессируют молекулы II класса ГКГ, большинство из которых находится в секреторных гранулах.
При этом установлено, что в гранулах могут находиться как зрелые, так и незрелые молекулы антигенов II класса главного комплекса гистосовместимости. Попытка ответить на вопрос, почему гранулы тучных клеток содержат много зрелых и незрелых молекул, приводит к заключению о возможности существования двух механизмов.
Первый - дефект, проявляющийся в медленном созревании молекул в связи с низкой активностью катепсина-В.
Второй - зрелые молекулы не связываются с инвариантной цепью и их последующая ассоциация с пептидами антигенов приводит к тому, что они остаются в гранулах; последовательная стимуляция различными стимулами увеличивает экспрессию молекул II класса ГКГ на поверхности клеток. Авторы указанных исследований предполагают, что тучные клетки могут принимать участие в презентации, активируя Т-лимфоциты.
Малочисленность подобных данных затрудняет оценку условий презентации антигена тучными клетками. Возможность такой презентации представляет особый интерес, так как хорошо известен факт инфильтрации многих опухолей тучными клетками, однако данные исследований нередко противоречивы.
Тем не менее, несмотря на значительную давность интереса к этому вопросу, который обсуждался еще П. Эрлихом, в настоящее время на него нет ответа. Не исключено, что различная оценка инфильтрации опухолевой ткани тучными клетками связана с различиями в их способности к презентации.
В заключение следует подчеркнуть, что роль макрофагов как антигенпрезентирующих клеток при опухолевом процессе в отличие от их цитотоксического действия изучена значительно меньше.
Тем не менее, подводя итог общим представлениям о презентации антигенов этими клетками, можно отметить следующее:
1. Макрофаги - гетерогенная популяция клеток, антигенпрезентирующие свойства которых особенно важны при формировании локального иммунитета. Есть основания полагать, что такое значение макрофагов в презентации антигенов определяет также их важную роль в формировании локального противоопухолевого иммунитета.
2. Для осуществления антигенпрезентирующей функции макрофагов необходима экспрессия главного комплекса гистосовместимости II класса, ко-стимулирующих и адгезивных молекул, а также других структур, способных осуществлять рецепторные функции.
3. Роль макрофагов в первичном и вторичном иммунологическом ответе неодинакова: в связи с недостаточной плотностью антигенов ГКГ значение этих клеток в первичном ответе несколько ниже, чем во вторичном.
Антигенпрезентирующие клетки и процесс классического распознавания
Представленные общие сведения об антигенпрезентирующих клетках и процессе презентации антигена, несмотря на определенную схематичность, дают возможность понять, каким образом происходит процесс классического распознавания.Все рассмотренные данные относятся к распознаванию антигена классическим путем. Наряду с этим нельзя не отметить возможность альтернативного пути распознавания. Вопрос о том, будет ли происходить распознавание классическим путем или альтернативным, зависит от того, какими цитокинами осуществляется регуляция.
При классическом пути происходит активное выделение IFNy, особенно макрофагами и дендритные клетки, а при альтернативном - выделение IL-10 и IL-4 (особенно макрофагами). Альтернативный путь активации может приводить к развитию толерантности. Необходимо обратить особое внимание на то, что опухолевые клетки во многих случаях могут активировать АПК именно альтернативным путем, при котором создаются условия для противодействия регуляторным влияниям цитокинов, продуцируемых Тh1-лимфоцитами, а соответственно и классическому пути активации АПК.
Наконец, стало известно, что активированные ДК, а также макрофаги могут экспрессировать HLA-G-молекулы. Такие данные были получены при исследовании дендритных клеткок, инфильтрирующих карциному легкого. При этом HLA-G-экспрессия не сочеталась с нарушением экспрессии классических HLA-молекул.
Авторы полагают, что экспрессия HLA-G-moлекул на макрофагах и ДК может препятствовать презентации антигена, снижая эффективность иммунологического ответа и тем самым создавая благоприятные условия для прогрессирования опухолевого процесса.
Как следует из представленного материала, при выраженных различиях в морфологии, фенотипе и функциях различных антигенпрезентирующих клеток, процесс презентации этими клетками имеет ряд общих особенностей.
Первое
Для активации всех антигенпрезентирующих клеток необходимы экспрессия антигенов II класса главного комплекса гистосовместимости, экспрессия ко-стимулирующих молекул и активация рецепторов, участвующих в процессе распознавания.Второе
Способность к презентации антигенов антигенпрезентирующими клетками прямо зависит от степени их зрелости.Третье
Все антигенпрезентирующие клетки наряду с презентацией антигена обладают и регуляторными влияниями в отношении других типов клеток с некоторым различием в спектре этих влияний.Четвертое
Реализация процесса распознавания и его направленность обеспечиваются цитокиновой регуляцией.Пятое
В зависимости от условий и особенностей презентируемых антигенов процесс презентации их антигенпрезентирующими клетками может не только индуцировать противоопухолевый ответ, но в ряде случаев способствовать формированию толерантности.Бережная Н.М., Чехун В.Ф.
МАКРОФАГИ МАКРОФАГИ
(от макро... и...фаг), клетки мезенхимного происхождения в животном организме, способные к активному захвату и перевариванию бактерий, остатков погибших клеток и др. чужеродных и токсичных для организма частиц. Термин «М.» введён И. И. Мечниковым (1892). Представляют собой крупные клетки изменчивой формы, с псевдоподиями, содержат множество лизосом. М. имеются в крови (моноциты), соединит, ткани (гистиоциты), кроветворных органах, печени (купферовские клетки), стенке альвеол лёгкого (лёгочные М.), брюшной и плевральной полостях (перитонеальные и плевральные М.). У млекопитающих М. образуются в красном костном мозге из стволовой кроветворной клетки, проходя стадии монобласта, промоноцита, моноцита. Все эти разновидности М. объединяют в систему одноядерных фагоцитов. (см. ФАГОЦИТОЗ , РЕТИКУЛОЭНДОТЕЛИАЛЬНАЯ СИСТЕМА).
.(Источник: «Биологический энциклопедический словарь.» Гл. ред. М. С. Гиляров; Редкол.: А. А. Бабаев, Г. Г. Винберг, Г. А. Заварзин и др. - 2-е изд., исправл. - М.: Сов. Энциклопедия, 1986.)
макрофа́гиКлетки в животном организме, способные к активному захвату и перевариванию бактерий, остатков погибших клеток и других чужеродных и токсичных для организма частиц. Имеются в крови, соединительной ткани, печени, бронхах, лёгких, брюшной полости. Термин введён И.И. Мечниковым , открывшим явление фагоцитоза.
.(Источник: «Биология. Современная иллюстрированная энциклопедия.» Гл. ред. А. П. Горкин; М.: Росмэн, 2006.)
Смотреть что такое "МАКРОФАГИ" в других словарях:
- … Википедия
МАКРОФАГИ - (от греч. makros: большой и phago ем), сип. мегалофаги, макрофагоциты, большие фагоциты. Термин М. предложен Мечниковым, разделившим все клетки, способные к фагоцитозу, на малых фагоцитов, микрофагов (см.), и больших фагоцитов, макрофагов. Под… … Большая медицинская энциклопедия
- (от макро... и...фаг) (полибласты) клетки мезенхимного происхождения у животных и человека, способные к активному захвату и перевариванию бактерий, остатков клеток и др. чужеродных или токсичных для организма частиц (см. Фагоцитоз). К макрофагам … Большой Энциклопедический словарь
Главный тип клеток системы мононуклеарных фагоцитов. Это крупные (10 24 мкм) долгоживущие клетки с хорошо развитым лизосомальным и мембранным аппаратом. На их поверхности имеются рецепторы к Fc фрагменту IgGl и IgG3, C3b фрагменту С, рецепторам В … Словарь микробиологии
МАКРОФАГИ - [от макро... и фаг (и)], организмы, пожирающие, крупную добычу. Ср. Микрофаги. Экологический энциклопедический словарь. Кишинев: Главная редакция Молдавской советской энциклопедии. И.И. Дедю. 1989 … Экологический словарь
макрофаги - Вид лимфоцитов, которые обеспечивают неспецифическую защиту за счет фагоцитоза и участвуют в развитии иммунного ответа как антигенпредставляющие клетки (antigen presenting cells). [Англо русский глоссарий основных терминов по вакцинологии и… … Справочник технического переводчика
Моноциты (макрофаги) тип белых кровяных клеток, участвующих в борьбе с инфекциями. Моноциты, наряду с нейтрофилами, являются двумя основными типами клеток крови, которые поглощают и уничтожают различные микроорганизмы. Когда моноциты покидают… … Медицинские термины
- (от макро... и...фаг) (полибласты), клетки мезенхимного происхождения у животных и человека, способные к активному захвату и перевариванию бактерий, остатков клеток и других чужеродных или токсичных для организма частиц (см. Фагоцитоз).… … Энциклопедический словарь
- (см. макро... + ...фаг) клетки соединительной ткани животных и человека, способные к захватыванию и перевариванию различных посторонних организму частичек (в том числе микробов); и. и. мечников назвал эти клетки макрофагами, в отличие от… … Словарь иностранных слов русского языка
макрофаги - ів, мн. (одн. макрофа/г, а, ч.). Клітини сполучної тканини тваринних організмів, здатні схоплювати й перетравлювати бактерії, рештки загиблих клітин та інші чужорідні або токсичні для організму частинки. Плацента/рні макрофа/ги макрофаги, що… … Український тлумачний словник
Книги
- Плацентарные макрофаги. Морфофункциональные характеристики и роль в гестационном процессе , Павлов Олег Владимирович, Сельков Сергей Алексеевич. В монографии впервые в мировой литературе собраны и систематизированы современные сведения о малоизученной группе клеток плаценты человека - плацентарных макрофагах. Подробно описаны…
Статья на конкурс «био/мол/текст»: Иммунная система - это мощная многослойная защита нашего организма, которая потрясающе эффективна против вирусов, бактерий, грибов и других патогенов извне. Кроме того, иммунитет способен эффективно распознавать и уничтожать трансформированные собственные клетки, которые могут перерождаться в злокачественные опухоли. Однако сбои в работе иммунной системы (по генетическим либо другим причинам) приводят к тому, что однажды злокачественные клетки берут верх. Разросшаяся опухоль становится нечувствительной к атакам организма и не только успешно избегает уничтожения, но и активно «перепрограммирует» защитные клетки для обеспечения собственных нужд. Поняв механизмы, которые опухоль использует для подавления иммунного ответа, мы сможем разработать контрмеры и попытаться сдвинуть баланс в сторону активации собственных защитных сил организма для борьбы с болезнью.
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса - дальновидная компания Генотек .
Конкурс поддержан ОАО «РВК» .
Опухоль и иммунитет - драматический диалог в трех частях с прологом
Долгое время считалось, что причина низкой эффективности иммунного ответа при раке - то, что опухолевые клетки слишком похожи на нормальные, здоровые, чтобы иммунная система, настроенная на поиск «чужаков», могла их как следует распознавать. Этим как раз и объясняется тот факт, что иммунная система успешнее всего противостоит опухолям вирусной природы (их частота резко возрастает у людей, страдающих иммунодефицитом). Однако позже стало ясно, что это не единственная причина.
Если в этой статье речь идет про иммунные аспекты рака, то в работе «Страшней клешней на свете нет... » можно прочесть про особенности ракового метаболизма. - Ред.
Оказалось, что взаимодействие раковых клеток с иммунной системой носит гораздо более разносторонний характер. Опухоль не просто «прячется» от атак, она умеет активно подавлять местный иммунный ответ и перепрограммировать иммунные клетки, заставляя их обслуживать собственные злокачественные нужды.
«Диалог» между переродившейся, вышедшей из-под контроля клеткой с ее потомством (то есть будущей опухолью) и организмом развивается в несколько стадий, и если вначале инициатива почти всецело находится на стороне защитных сил организма, то в конце (в случае развития болезни) - переходит на сторону опухоли. Несколько лет назад учеными-онкоиммунологами была сформулирована концепция «иммуноредактирования» (immunoediting ), описывающая основные этапы этого процесса (рис. 1) .
Рисунок 1. Иммуноредактирование (immunoediting ) в процессе развития злокачественной опухоли.
Первая стадия иммуноредактирования - процесс устранения (elimination ). Под действием внешних канцерогенных факторов или в результате мутаций нормальная клетка «трансформируется» - приобретает способность неограниченно делиться и не отвечать на регуляторные сигналы организма. Но при этом она, как правило, начинает синтезировать на своей поверхности особые «опухолевые антигены» и «сигналы опасности». Эти сигналы привлекают клетки иммунной системы, прежде всего макрофаги , натуральные киллеры и Т-клетки . В большинстве случаев они успешно уничтожают «испортившиеся» клетки, прерывая развитие опухоли. Однако иногда среди таких «предраковых» клеток оказывается несколько таких, у которых иммунореактивность - способность вызывать иммунный ответ - по каким-то причинам оказывается ослабленной, они синтезируют меньше опухолевых антигенов, хуже распознаются иммунной системой и, пережив первую волну иммунного ответа, продолжают делиться.
В этом случае взаимодействие опухоли с организмом выходит на вторую стадию, стадию равновесия (equilibrium ). Здесь иммунная система уже не может полностью уничтожить опухоль, но еще в состоянии эффективно ограничивать ее рост. В таком «равновесном» (и не обнаруживаемом обычными методами диагностики) состоянии микроопухоли могут существовать в организме годами. Однако такие затаившиеся опухоли не статичны - свойства составляющих их клеток постепенно меняются под действием мутаций и последующего отбора: преимущество среди делящихся опухолевых клеток получают такие, которые способны лучше противостоять иммунной системе, и в конце концов в опухоли появляются клетки-иммуносупрессоры . Они в состоянии не только пассивно избегать уничтожения, но и активно подавлять иммунный ответ. По сути, это эволюционный процесс, в котором организм невольно «выводит» именно тот вид рака, который его убьет.
Этот драматический момент знаменует собой переход опухоли к третьей стадии развития - избегания (escape ), - на которой опухоль уже малочувствительна к активности клеток иммунной системы, более того - обращает их активность себе на пользу. Она принимается расти и метастазировать. Именно такая опухоль обычно диагностируется медиками и изучается учеными - две предыдущие стадии протекают скрыто, и наши представления о них основаны главным образом на интерпретации целого ряда косвенных данных.
Дуализм иммунного ответа и его значение в канцерогенезе
Существует множество научных статей, описывающих, как иммунная система борется с опухолевыми клетками, но не меньшее количество публикаций демонстрирует, что присутствие клеток иммунной системы в ближайшем опухолевом окружении является негативным фактором, коррелирующим с ускоренным ростом и метастазированием рака , . В рамках концепции иммуноредактирования, описывающей, как изменяется характер иммунного ответа по мере развития опухоли, подобное двойственное поведение наших защитников получило, наконец, свое объяснение.
Мы рассмотрим некоторые механизмы того, как это происходит, на примере макрофагов. Похожие приемы опухоль использует и для того, чтобы обманывать другие клетки врожденного и приобретенного иммунитета.
Макрофаги - «клетки-воины» и «клетки-целители»
Макрофаги, пожалуй, самые знаменитые клетки врожденного иммунитета - именно с изучения их способностей к фагоцитозу Мечниковым и началась классическая клеточная иммунология. В организме млекопитающих макрофаги - боевой авангард: первыми обнаруживая врага, они не только пытаются уничтожить его собственными силами, но также привлекают к месту сражения другие клетки иммунной системы, активируя их. А после уничтожения чужеродных агентов принимаются активно участвовать в ликвидации причиненных повреждений, вырабатывая факторы, способствующие заживлению ран. Эту двойственную природу макрофагов опухоли используют себе на пользу.
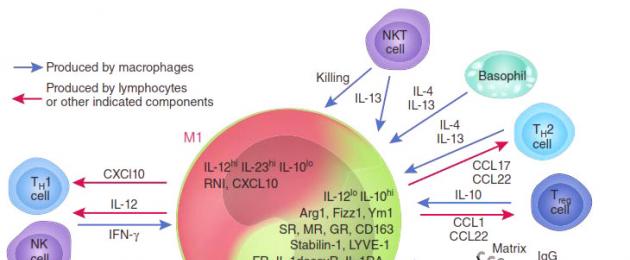
В зависимости от преобладающей активности различают две группы макрофагов: М1 и М2. М1-макрофаги (их еще называют классически активированными макрофагами) - «воины» - отвечают за уничтожение чужеродных агентов (в том числе и опухолевых клеток), как напрямую, так и за счет привлечения и активации других клеток иммунной системы (например, Т-киллеров). М2 макрофаги - «целители» - ускоряют регенерацию тканей и обеспечивают заживление ран , .
Присутствие в опухоли большого количества М1-макрофагов тормозит ее рост , а в некоторых случаях может вызвать даже практически полную ремиссию (уничтожение). И наоборот: М2-макрофаги выделяют молекулы - факторы роста, которые дополнительно стимулируют деление опухолевых клеток, то есть благоприятствуют развитию злокачественного образования. Экспериментально было показано, что в опухолевом окружении обычно преобладают именно М2-клетки («целители»). Хуже того: под действием веществ, выделяемых опухолевыми клетками, активные М1-макрофаги «перепрограммируются» в М2-тип , перестают синтезировать антиопухолевые цитокины, такие как интерлейкин-12 (IL12) или фактор некроза опухолей (TNF) и начинают выделять в окружающую среду молекулы, ускоряющие рост опухоли и прорастание кровеносных сосудов, которые будут обеспечивать ее питание, например фактор роста опухолей (TGFb) и фактор роста сосудов (VGF). Они перестают привлекать и инициировать другие клетки иммунной системы и начинают блокировать местный (противоопухолевый) иммунный ответ (рис. 2).

Рисунок 2. М1- и М2-макрофаги: их взаимодействие с опухолью и другими клетками иммунной системы.
Ключевую роль в этом перепрограммировании играют белки семейства NF-kB . Эти белки являются транскрипционными факторами, контролирующими активность множества генов, необходимых для М1 активации макрофагов. Наиболее важные представители этого семейства - р65 и р50, вместе образующие гетеродимер р65/р50, который в макрофагах активирует множество генов, связанных с острым воспалительным ответом, таких как TNF, многие интерлейкины, хемокины и цитокины. Экспрессия этих генов привлекает все новые и новые иммунные клетки, «подсвечивая» для них район воспаления. В то же время другой гомодимер семейства NF-kB - р50/р50 - обладает противоположной активностью: связываясь с теми же самыми промоторами, он блокирует их экспрессию, снижая градус воспаления.
И та, и другая активность NF-kB транскрипционных факторов очень важна, но еще важнее равновесие между ними. Было показано, что опухоли целенаправленно выделяют вещества, которые нарушают синтез p65 белка в макрофагах и стимулируют накопление ингибиторного комплекса р50/р50 . Таким способом (помимо еще ряда других) опухоль превращает агрессивных М1-макрофагов в невольных пособников своего собственного развития: М2-тип макрофагов, воспринимая опухоль как поврежденный участок ткани, включают программу восстановления, однако секретируемые ими факторы роста только добавляют ресурсы для роста опухоли. На этом цикл замыкается - растущая опухоль привлекает новые макрофаги, которые перепрограммируются и стимулируют ее рост вместо уничтожения.
Реактивация иммунного ответа - актуальное направление антираковой терапии
Таким образом, в ближайшем окружении опухолей присутствует сложная смесь молекул: как активирующих, так и ингибирующих иммунный ответ. Перспективы развития опухоли (а значит, перспективы выживания организма) зависят от баланса ингредиентов этого «коктейля». Если будут преобладать иммуноактиваторы - значит, опухоль не справилась с задачей и будет уничтожена или ее рост сильно затормозится. Если же преобладают иммуносупрессорные молекулы - это значит, что опухоль смогла подобрать ключ и начнет быстро прогрессировать. Понимая механизмы, которые позволяют опухолям подавлять наш иммунитет, мы сможем разработать контрмеры и сдвинуть баланс в сторону уничтожения опухолей .
Как показывают эксперименты, «перепрограммирование» макрофагов (и других клеток иммунной системы) обратимо. Поэтому одним из перспективных направлений онко-иммунологии на сегодняшний день является идея «реактивации» собственных клеток иммунной системы пациента с целью усиления эффективности других методов лечения. Для некоторых разновидностей опухолей (например, меланом) это позволяет добиться впечатляющих результатов. Другой пример, обнаруженный группой Меджитова , - обычный лактат, молекула, которая производится при недостатке кислорода в быстрорастущих опухолях за счет эффекта Варбурга . Эта простая молекула стимулирует перепрограммирование макрофагов, заставляя их поддерживать рост опухоли. Лактат транспортируется внутрь макрофагов через мембранные каналы, и потенциальная терапия заключается в блокировке этих каналов.
МАКРОФАГИ (греч, makros большой + phagos пожирающий) - клетки соединительной ткани, обладающие активной подвижностью, адгезивностью и выраженной способностью к фагоцитозу. М. открыты И. И. Мечниковым; он впервые установил их роль в защитных и других реакциях организма и предложил термин «макрофаги», подчеркивающий отличия этих клеток от клеток меньшего размера - «микрофагов» (т. е. сегментоядерных лейкоцитов, нейтрофилов), фагоцитирующих лишь мелкие чужеродные частицы, напр, микробы. М. описывали под разными названиями: клазматоциты Ранвье, рагиокринные клетки, адвентициальные клетки, блуждающие клетки в покое, пирроловые клетки, полибласты, амебоидные, металлофильные клетки, макрофагоциты, гистиоциты. Большинство этих терминов имеет лишь исторический интерес.
М., как и все клетки соединительной ткани, имеют мезенхимное происхождение, а в постнатальном онтогенезе дифференцируются из стволовой кроветворной клетки (см. Кроветворение), проходя в костном мозге последовательно стадии монобласта, промоноцита и моноцита. Последние циркулируют в крови, и, выселяясь в ткани, превращаются в М. Различают М. свободные (мигрирующие) и фиксированные в тканях. М. также подразделяют на гематогенные, образующиеся из только что выселившихся из крови моноцитов, и гистиогенные, которые ранее присутствовали в тканях. В зависимости от локализации различают М. рыхлой соединительной ткани - гистиоциты (см.), печени - звездчатые ретикулоэндотелиоциты (купферовы клетки), легкого - альвеолярные М., серозных полостей - перитонеальные и плевральные М., М. костного мозга и лимфоидных органов, глиальные макрофаги ц. н. с. (микроглии). Из М. происходят, по-видимому, и остеокласты.
М., являясь последней стадией дифференцировки одноядерных фагоцитов, не делятся митозом. Исключение, возможно, составляют М. в очагах хрон, воспаления. На основе общего происхождения из стволовой кроветворной клетки, строения и функции М. и их клетки-предшественники (моноциты и др.), согласно классификации, опубликованной в Бюллетене ВОЗ (1973), включены в систему мононуклеарных фагоцитов. В отличие от этого ретикулоэндотелиальная система (см.) объединяет клетки, имеющие различное происхождение и обладающие способностью к фагоцитозу: ретикулярные клетки, эндотелиальные клетки (в частности синусоидные капилляры кроветворных органов) и другие элементы.

Строение М. отличается разнообразием, зависящим от фагоцитарной активности, свойств поглощенного материала и пр. (рис. 1). В отличие от своих предшественников моноцитов (см. Лейкоциты) М. имеют большие размеры (20-100 мкм), содержат много плотных цитоплазматических гранул и митохондрий; в слабобазофильной (иногда оксифильной) цитоплазме нередко видны остатки фагоцитированного материала. Ядро сферической, бобовидной или неправильной формы. При наблюдении в фазовом контрастном микроскопе в М. выявляется характерная ундулирующая клеточная мембрана, совершающая волнообразные движения. При электронной микроскопии в М. виден хорошо развитый пластинчатый комплекс (см. Гольджи комплекс), обычно небольшое количество гранулярного эндоплазматического ретикулума. Отражением фагоцитарной активности являются плотные цитоплазматические гранулы - лизосомы (см.), фагосомы, мультивезикулярные остаточные тельца - так наз. миелиновые фигуры (рис. 2). Наблюдаются также микротрубочки и пучки микрофиламент.
Функц, значение М. определяется их высокой способностью к поглощению и переработке плотных частиц - фагоцитоз (см.) и растворимых веществ - Пиноцитоз (см.).
Значение макрофагов в иммунитете
М. являются своеобразным накопителем поступающих в организм антигенов (см.), которые находятся в нем в виде детерминант (участков молекулы антигена, определяющих его специфичность), состоящих не менее чем из 5 пептидов. Антигены подвергают особой переработке: взаимодействуя с рецепторами мембраны М. антигены вызывают активацию их лизосомальных ферментов и увеличение синтеза ДНК.
М. играют весьма существенную роль в индукции антителообразования, для к-рой необходимы все три типа клеток (макрофаги, Т- и В-лимфоциты). Антиген, связанный с различными фракциями М. (мембраны, лизосомы), является значительно более иммуногенным, чем нативный антиген. После обработки в М. антигены поступают к Т- и B-лимфоцитам (см. Иммунокомпетентные клетки). М., содержащие антиген, вначале реагируют с Т-клетками, и только после этого «включаются в работу» В-клетки. Взаимодействие М. с Т-клетками регулируется Н-антигенами или продуктом гена, связанного с системой генов гистосовместимости (см. Иммунитет трансплантационный).
Активированные антигеном В-клетки вырабатывают опсонины (см.), улучшающие контакт М. с антигенным материалом; при этом Fab -фрагменты антитела (см.) взаимодействуют с детерминантами антигена, a Fc -фрагменты прикрепляются к поверхности М. Это стимулирует синтез аденилциклазы и усиливает продукцию 3",5"-АМФ, способствующего пролиферации и дифференцировке В-лимфоцитов.
Макрофаги, Т- и В-лимфоциты взаимодействуют друг с другом при помощи разнообразных растворимых факторов, выделяемых этими клетками после антигенной стимуляции. Высказано предположение, что большинство растворимых факторов выделяется Т-лимфоцитами. Хим. природа этих факторов не изучена. Передача иммунол, информации от М. к лимфоциту происходит при непосредственном контакте этих клеток. Механизм этой передачи заключается в «прилипании» М. к лимфоциту, что сопровождается выбуханием цитоплазмы М., к-рая затем сливается с выростом цитоплазмы лимфоцита. М. синтезируют большое количество неспецифических факторов иммунитета: трансферрин, комплемент, лизоцим, интерферон, пирогены и др., являющиеся антибактериальными факторами.
М. играют большую роль в антимикробном и антивирусном клеточном иммунитете, чему способствует и относительно большая продолжительность жизни этих клеток (примерно от одного до нескольких месяцев), а также в развитии иммунного ответа организма. Они осуществляют важнейшую функцию по освобождению организма от чужеродных антигенов. Переваривание микробов или немикробных агентов, патогенных грибков, простейших, продуктов собственных измененных клеток и тканей осуществляется при помощи лизосомальных ферментов М.
Как показывают многочисленные исследования, идея И. И. Мечникова о значении фагоцитарных клеток в иммунитете (см.) справедлива в отношении не только бактерий, но и вирусов. М., особенно иммунизированных животных, принимают активное участие в разрушении вирионов (см. Вирусы), несмотря на то что вирусы более устойчивы к действию ферментов и процесс их разрушения идет менее энергично, чем процесс разрушения бактерий. М. выполняют защитную функцию на различных этапах инф. процесса: они являются барьером на месте входных ворот инфекции и на стадии виремии, когда ограничению распространения вируса препятствуют М. печени, селезенки и лимф, узлов. С помощью М. ускоряется процесс выведения вируса из организма, точнее, комплекса антиген- антитело (см. Антиген-антитело реакция). М., полученные от неиммунизированных и иммунизированных животных, активно фагоцитируют вирусы гриппа, осповакцины, миксомы, эктромелии. Из иммунных М. вирус гриппа мог быть выделен лишь в течение нескольких часов, в то время как из неиммунных М. он изолировался в течение нескольких суток.
Блокирование в эксперименте М. антимакрофагальной сывороткой, кремнием, каррагинаном (высокомолекулярная полигалактоза) приводит к отягощению течения ряда бактериальных и вирусных инфекций. Однако при некоторых вирусных заболеваниях М. оказались не только неспособными предотвратить инфекцию, но, более того, поддерживали репродукцию вирусов (напр., вирусов лимфоцитарного хориоменингита), которые длительно сохранялись в организме, способствуя развитию аутоиммунных заболеваний.
Проведены исследования, показавшие участие М. в цитотоксическом действии сенсибилизированных лимфоцитов на клетки-мишени. В эксперименте показано, что удаление м. из популяции иммунных лимфоцитов вызывало значительное ослабление цитотоксического действия лейкоцитов на клетки некоторых опухолей и что прогноз заболевания тем благоприятнее, чем больше активных М. содержится в регионарных к опухоли лимф, узлах. Изучение реакций иммунной системы реципиента при трансплантации органов и тканей показало, что М. участвуют в отторжении трансплантата и в элиминации чужеродных клеток из организма (см. Трансплантация).
Библиография: Бернет Ф. М. Клеточная иммунология, пер. с англ., М., 1971; В а н Фюрт Р. и др. Система мононуклеарных фагоцитов, новая классификация макрофагов, моноцитов и их клеток-пред-шественников, Бюлл. ВОЗ, т. 46, № 6, с. 814, 1973, библиогр.; Здродовский П. Ф. Проблемы инфекции, иммунитета и аллергии, М., 1969, библиогр.; Косяков П. Н. и P о в н о в а 3. И. Противовирусный иммунитет, М., 1972; Петров Р. В. Иммунология и иммуногенетика, М., 1976, библиогр.; Учитель И. Я. Макрофаги в иммунитете, М., 1978; А 1 1 i s о и А. С. Interactions of antibodies complement components and various cell types in immunity against viruses and pyogenic bacteria, Transplant. Rev., v. 19, p. 3, 1974, bibliogr.; Carr I. The macrophage, L.- N.Y., 1973; Gordon S. a. С o h n Z. The macrophage, Int. Rev. Cytol., v. 36, p. 171, 1973, bibliogr.; Immunobiology of the macrophage, ed. by D. S. Nelson, N. Y., 1976; Mononuclear phagocytes in immunity, ed. by R. van Furth, Oxford, 1975; Wahl S. M. a. o. The role of macrophages in the production of lymphokines by T and B lymphocytes, J. Immunol., v. 114, p. 1296, 1975.
H. Г. Хрущов; М. С. Бердинских (иммунол.).
Глава 3. Моноциты и макрофаги
Моноциты и макрофаги являются основными клетками системы фагоцитирующих мононуклеаров (ВОЗ) или макрофагальной системы И. И. Мечникова.
Моноциты берут начало от гранулоцитарно-моноцитарной клетки-предшественницы, макрофаги – от моноцитов, переходящих из кровяного русла в ткани. Макрофаги присутствуют во всевозможных тканях человеческого организма: в костном мозге, в соединительной ткани, в легких (альвеолярные макрофаги), в печени (купферовские клетки), в селезенке и лимфатических узлах, в серозных полостях (брюшной полости, полости плевры, полости перикарда), в костной ткани (остеокласты), в нервной ткани (микроглиальные клетки), в коже (клетки Лангерганса). Они могут быть как свободными, так и фиксированными. Кроме того, к макрофагальным элементам относятся и дендритические клетки (имеющие большое количество коротких ветвящихся отростков), присутствующие во всех тканях. При проведении многочисленных операций по трансплантации костного мозга от донора иного пола было доказано кроветворное происхождение альвеолярных макрофагов, купферовских клеток, клеток Лангерганса и остеокластов.
Сформировавшись в костном мозге, моноцит находится там от 30 до 60 ч. После этого он делится и поступает в системный кровоток. Период циркуляции моноцита в крови составляет приблизительно 72 ч, где происходит его созревание. Ядро моноцита трансформируется из круглого сначала в бобовидное, а затем в лапчатое. Помимо этого, отмечается изменение структуры генетического материала клетки. Цвет цитоплазмы моноцита может быть совершенно различным – от базофильного до серо-голубого или даже розоватого. После выхода из кровяного русла моноцит больше не может вернуться в системную циркуляцию.
Макрофаги, расположенные в различных тканях человеческого организма, имеют ряд общих особенностей. При исследовании альвеолярных макрофагов было выявлено, что тканевые макрофаги поддерживают свою популяцию не только за счет образования в костном мозге, но также за счет имеющейся у них способности к делению и самоподдержанию. Данная отличительная черта макрофагов становится очевидной в случае подавления образования данных клеток крови в костном мозге под влиянием облучения или препаратов с цитостатическим действием.
Ядро макрофага имеет овальную форму. Цитоплазма клетки достаточно большая, не имеет четких границ. Диаметр макрофага в норме колеблется в широких пределах: от 15 до 80 мкм.
Специфическими функциональными признаками макрофагов служат способность прилипать к стеклу, поглощение жидкости и более твердых частиц.
Фагоцитоз – «пожирание» чужеродных частиц макрофагами и нейтрофилами. Данное свойство клеток организма открыл И. И. Мечников в 1883 г.; он же предложил указанный термин. Фагоцитоз складывается из захвата клеткой чужеродной частицы и заключения ее в пузырек – фагосому. Образовавшаяся структура продвигается вглубь клетки, где переваривается при помощи ферментов, высвобождающихся из особых органелл – лизосом. Фагоцитоз представляет собой наиболее древнюю и важную функцию макрофагов, благодаря которой они избавляют организм от чужеродных неорганических элементов, разрушенных старых клеток, бактерий, а также иммунных комплексов. Фагоцитоз – одна из основных систем защиты организма, одно из звеньев иммунитета. В макрофагах его ферменты, так же как многие другие структуры, подчинены роли данных кровяных клеток в иммунитете и в первую очередь – фагоцитарной функции.
В настоящее время известно более 40 веществ, продуцируемых микрофагом. Ферментами моноцитов и макрофагов, реализующими переваривание образующихся фагосом, являются пероксидаза и кислая фосфатаза. Пероксидаза содержится только в таких клетках, как монобласты, промоноциты и незрелые моноциты. В клетках последних двух стадий дифференцировки пероксидаза присутствует в очень малом количестве. Зрелые клетки и макрофаги настоящий фермент, как правило, не содержат. Содержание кислой фосфатазы увеличивается в процессе созревания моноцитов. Наибольшее ее количество – в зрелых макрофагах.
Из поверхностных маркеров моноцитов и макрофагов иммунному фагоцитозу способствуют рецепторы к Fc-фрагменту иммуноглобулина G и к компоненту комплемента С 3 . С помощью указанных маркеров на поверхности моноцитарно-макрофагальных клеток закрепляются иммунные комплексы, антитела, различные клетки крови, покрытые антителами или комплексами, состоящими из антитела и комплемента, которые затем втягиваются внутрь клетки, осуществляющей фагоцитоз, и перевариваются ею либо сохраняются в фагосомах.
Кроме фагоцитоза, моноциты и макрофаги обладают способностью к хемотаксису, т. е. способны двигаться в направлении разности содержания определенных веществ в клетках и вне клеток. Также данные кровяные клетки могут переваривать микробы и продуцировать несколько компонентов комплемента, играющих ведущую роль в образовании иммунных комплексов и в активации лизиса антигена, продуцировать интерферон, ингибирующий размножение вирусов, секретировать особый белок лизоцим, обладающий бактерицидным действием. Моноциты и макрофаги продуцируют и секретируют фибронектин. Данное вещество является по своей химической структуре гликопротеидом, связывающим продукты клеточного распада в крови, играющим важную роль во взаимодействии макрофага с иными клетками, в прикреплении (адгезии) на поверхности макрофага элементов, подлежащих фагоцитозу, что связано с наличием на мембране макрофага рецепторов к фибронектину.
С защитной функцией макрофага связана также его способность продуцировать эндогенный пироген, представляющий собой специфический белок, который синтезируется макрофагами и нейтрофилами в ответ на фагоцитоз. Выделяясь из клетки, данный белок оказывает влияние на центр терморегуляции, расположенный в головном мозге. В результате повышается установленная указанным центром температура тела. Обусловленное воздействием эндогенного пирогена повышение температуры тела способствует борьбе организма с инфекционным агентом. Способность к выработке эндогенного пирогена увеличивается по мере созревания макрофагов.
Макрофаг не только организует систему неспецифического иммунитета, заключающуюся в защите организма от любого инородного вещества или клетки, постороннего для данного организма или ткани, но и принимает непосредственное участие в специфическом иммунном ответе, в «представлении» чужеродных антигенов. Данная функция макрофагов связана с существованием на их поверхности особого антигена. HLA-DR-белок играет предопределяющую роль в развитии специфического иммунного ответа. У человека существует 6 вариантов молекулы HLA-DR-подобного белка. Этот белок присутствует практически у всех кроветворных клеток, начиная от уровня полипотентных клеток-предшественниц, но отсутствует на зрелых элементах, имеющих кроветворную природу. HLA-DR-подобный белок определяется и у эндотелиальных клеток, и у сперматозоидов, и у многих других клеток человеческого организма. На поверхности незрелых макрофагов, имеющихся преимущественно в тимусе и селезенке, также присутствует HLA-DR-подобный белок. Самое большое содержание такого белка обнаружено на дендритических клетках и на клетках Лангерганса. Такие макрофагальные клетки являются активными участниками иммунного ответа.
Чужеродный антиген, попадающий в организм человека, адсорбируется поверхностью макрофага, поглощается им, оказываясь на внутренней поверхности мембраны. Затем антиген расщепляется в лизосомах. Фрагменты расщепленного антигена выходят из клетки. Часть этих фрагментов антигена взаимодействует с молекулой HLA-DR-подобного белка, в результате чего образуется комплекс на поверхности макрофага. Такой комплекс выделяет интерлейкин I, поступающий к лимфоцитам. Этот сигнал воспринимается Т-лимфоцитами. У Т-лимфоцита-амплифайера возникает рецептор к HLA-DR-подобному белку, ассоциированному с фрагментом чужеродного антигена. Активированный Т-лимфоцит выделяет второе сигнальное вещество – интерлейкин II и ростовой фактор для лимфоцитов всех типов. Интерлейкин II активирует Т-лимфоциты-хелперы. Два клона лимфоцитов данного типа отвечают на действие чужеродного антигена, продуцируя фактор роста В-лимфоцитов и фактор дифференцировки В-лимфоцитов. Результатом активации В-лимфоцитов является продукция специфических к данному антигену иммуноглобулинов-антител.
Таким образом, несмотря на то что распознавание чужеродного антигена является функцией лимфоцитов без участия макрофага, переваривающего антиген и соединяющего часть его с HLA-DR-подобным белком поверхности, невозможны представление антигена лимфоцитам и иммунный ответ на него.
Макрофаги обладают способностью переваривать не только бактериальные клетки, эритроциты и тромбоциты, на которых фиксированы некоторые компоненты комплемента, в том числе стареющие или патологически измененные, но также и опухолевые клетки. Такой вид активности макрофагов получил название тумороцидной. Из этого нельзя сделать вывод о действительной борьбе макрофагов с опухолью, а именно «признании» ими такого типа клеток как чужеродной ткани, в связи с тем что в любой опухоли присутствует очень много стареющих клеток, подлежащих фагоцитозу аналогично всем неопухолевым стареющим клеткам.
Отдельные факторы, продуцируемые клетками моноцитарно-макрофагальной природы (например, простагландины Е, лизоцим, интерферон), участвуют и в иммунной функции, и в кроветворении. Кроме того, макрофаги помогают развитию эозинофильной реакции.
Доказана макрофагальная природа остеокластов. Макрофаги способны, во-первых, непосредственно растворять костную ткань, во-вторых, стимулировать продукцию остеокластстимулирующего фактора Т-лимфоцитов.
Данная функция макрофагов может оказаться ведущей в патологии, обусловленной опухолевой и реактивной пролиферацией макрофагов.
Весьма существенную роль играют макрофаги в постоянстве внутренней среды. Прежде всего они являются единственными клетками, продуцирующими тканевой тромбопластин, и запускают сложный каскад реакций, обеспечивающих свертывание крови. Однако, по-видимому, повышение тромбогенной активности в связи с жизнедеятельностью макрофагов может быть обусловлено также обилием как секретируемых ими, так и внутриклеточными, выделяемыми при распаде клеток, протеолитических ферментов, продукцией простагландинов. Вместе с тем макрофаги продуцируют активатор плазминогена – антисвертывающий фактор.
Из книги Библия секса автора Пол Джоанидис Из книги Путь к здоровью. Записки голодающего автора Геннадий Петрович МалаховГлава о неприличных словах Глава 3 Вы можете заинтересоваться, почему глава о неприличных словах расположена в самом начале этой замечательной в остальном книги. Наверное, в этой главе есть нечто больше, чем просто неприличные слова. Эта глава, так же как и другие в этой
Из книги Общая и клиническая иммунология автора Н. В. АнохинаГлава 1 Природа не прощает безразличного к ней отношения. Будьте сознательны во всем и не пускайте свою жизнь на самотек, чтобы потом не плакать. Петрович с самого раннего детства ощущал, что окружающий его мир должен быть другим – более интересным, добрым, радостным,
Из книги Прогнозирующая гомеопатия Часть II Теория острых болезней автора Прафулл ВиджейкарГлава 2 Многие опасности подстерегают человека на его жизненном пути, и важно их вовремя распознать. Но наиболее опасна для человека подсознательная агрессия, корни которой уходят глубоко в его прошлые жизни. Агрессию сознательную, вернее, осознанную, человек сразу же
Из книги Живая и мертвая вода против свободных радикалов и старения. Народная медицина, нетрадиционные методы автора Дина Ашбах4. В-лимфоциты. Т-лимфоциты и макрофаги Чтобы функционирование иммунной системы было нормальным, должно соблюдаться определенное соотношение между всеми видами клеток. Любое нарушение этого соотношения ведет к патологии. Это наиболее общие сведения об органах иммунной
Из книги Учимся понимать свои анализы автора Елена В. Погосян8. Нейтрофилы. Базофилы. Эозинофилы. Макрофаги Нейтрофилы, базофилы и эозинофилы – это разновидности лейкоцитов. Названия свои они получили за способность по-разному воспринимать красящие вещества. Эозинофилы реагируют в основном на кислые красители (конго красный,
Из книги Рожденный бежать автора Кристофер Макдугл Из книги автора Из книги автораМакрофаги Макрофаги – это, так сказать, низшее подразделение иммунной армии, обучения они не проходили, и их свойства защищать организм являются врожденными. Они так и называются – врожденный иммунитет. Макрофаги уничтожают своих (и наших) врагов весьма необычным
Из книги автораМоноциты Моноцитозом считается состояние, при котором уровень содержания моноцитов выше1,00 109/л. Он наблюдается при:# тяжело протекающих инфекциях (туберкулезе, сифилисе);# ряде заболеваний системы крови;# росте злокачественных новообразований;# коллагенозах (ревматизме,
Из книги автораГлава 16 Самое смешное в том, что Лохматый смотрел на то же самое, и все, что он видел, - это мужик средних лет с фантастическим коленом.Вначале только слух подсказал Лохматому, что тут что-то не так. Вот уже несколько часов подряд он слышал слабое «тсс… тсс… тсс», исходившее
Из книги автораГлава 17 Ну и что станет с нами, не будь на свете дикарей? Эти люди были чем-то вроде объяснения. Константин Кавафи. В ожидании дикарей - Это было десять лет назад, - завершая свою историю, сообщил мне Кабальо. - И с тех пор я здесь постоянно.Прошло уже несколько часов, как
Из книги автора Из книги автораГлава 19 Я всегда выхожу на эти соревнования с самыми возвышенными целями, словно собираюсь совершить нечто чрезвычайное. Но стоит только моему самочувствию хоть немного ухудшиться, как оценка целей сразу занижается… и лучшее, на что я могу надеяться, - это не опуститься