Изобретение относится к биотехнологии, касается получения продуцентов для пробиотических препаратов - бактерийных препаратов на основе живых культур микроорганизмов-симбионтов, используемых для профилактики и лечения дисбактериозов и других расстройств желудочно-кишечного тракта. В штамм Escherichia coli М17 - продуцент для пробиотического препарата колибактерин - введена неконьюгативная, немобилизуемая плазмида p Сolap, несущая гены продукции колицина Е1 и детерминант устойчивости к ампициллину в дозах до 150 мг/л. Полученный штамм лишен нежелательного адгезивного фенотипа инактивированием гена адгезина fimH пилей 1-го типа интеграцией гена устойчивости к канамицину - неомицину npt. Штамм E.coli М17 fim H::Kan/p Colap депонирован в ВКПМ под номером В-7448, Это позволяет создать пробиотический препарат со сниженной способностью к колонизации отличных от интестинальной ниш, с повышенной антагонистической активностью и резидентный на фоне антибиотикотерапии. Введенные в сконструированный штамм признаки стабильно сохраняются в популяции. Это облегчает получение стандартного препарата на основе штамма и гарантирует, что при приеме препарата пациентом без сопутствующей антибиотикотерапии не произойдет элиминация плазмиды. 4 ил., 1 табл.
Настоящее изобретение относится к биотехнологии и касается создания усовершенствованного штамма Escherichia coli, который может быть использован для получения пробиотиков - бактерийных препаратов на основе живых культур микроорганизмов-симбионтов. Пробиотики (другие названия препаратов данной группы: нормофлоры, эубиотики, микробиотики) являются эффективным средством для профилактики и лечения дисбактериоза кишечника. Дисбактериоз - это выраженное изменение в видовом и количественном соотношении микробов, которое проявляется в бурном развитии условно-патогенных микроорганизмов, в частности бактерий семейства кишечной группы (Enterobacteriaceae), и сопровождается различными болезненными проявлениями. Важной причиной дисбактериозов является применение антибиотиков и других противомикробных препаратов [Красноголовец В. Н. "Клиническое значение дисбактериоза кишечника, развившегося в результате применения антибиотиков". В кн. "Применение колибактерина для профилактики и лечения кишечных заболеваний и технология его производства". М., 1967, с. 223 - 243]. В настоящее время в России известны препараты пробиотиков "Колибактерин" и "Бификол", которые получают на основе штамма Escherichia coli М17, который, по-существу, является производным штамма Е.coli, выделенного А. Ниссле и используемого для получения препарата "Mutaflor" (Германия) [Перетц Л.Г. "Сухой колибактерин. Новые методы диагностики, лечения и профилактики кишечных заболеваний". В кн. "Тезисы докладов Пленуму Уч. мед. сов. МЗ РСФСР". М., 1961, с. 52-54]. Однако, в отличие от исходного штамма штамм Е. coli М17 утратил способность к синтезу колицина B и, следовательно, снизил свою антагонистическую активность в отношении бактерий кишечной группы [Шемчук Л.Ф. "Стандартизация колибактерина", автореф. канд.б.н., М., 1983, с. 16]. Другим недостатком штамма Е.coli М17 и его предшественника является наличие у них высокоадгезивного М н фенотипа фимбрий 1-го типа, необычного и нежелательного для кишечного штамма. Такой фенотип часто обнаруживается у выделяемых из макроорганизма штаммов при инфекции мочевыводящих путей и внутрибольничной пневмонии [Сокуренко Е.В., Чеснокова В.Л. "Способ модификации адгезивного фенотипа диких изолятов Е. coli в применении к штаммам - продуцентам препарата колибактерин". Бюллетень экспериментальной биологии и медицины, 1997, Том 124, N 9, с. 334 - 338]. Недостатком штамма E.coli М17 является также чувствительность его к антибиотикам. Поэтому препараты на его основе не могут быть эффективными на фоне приема антибиотиков. Между тем одновременное применение антибиотиков и пробиотиков может предотвращать развитие дисбактериоза и тем самым повышать эффективность терапевтических мероприятий, сокращать сроки лечения. Задачей изобретения является создание штамма Е.coli - производного E.coli М17, который позволяет устранить упомянутые выше недостатки известного штамма Е. coli М17, а именно: пониженная антагонистическая активность, нежелательный адгезивный фенотип, чувствительность к антибиотикам. Технический результат состоит в конструировании штамма с повышенной антагонистической активностью, сниженной способностью к колонизации отличных от первичной интестинальной ниш в макроорганизме и с резистентностью к умеренным дозам антибиотиков пенициллинового ряда. Указанная цель достигается тем, что с помощью генетических и генно-инженерных методов конструируют штамм Е.coli М17 fimH::kan/pColap, который продуцирует колицин E1, устойчив к умеренным концентрациям ампициллина (до 150 ЕД/мл) и содержит инактивированный ген fimH, кодирующий фимбриальный адгезин. Штамм Е.coli М17 fimH::kan/pColap депонирован во Всероссийской коллекции промышленных микроорганизмов под регистрационным номером В-7448. В основе патентуемой конструкции штамма лежат следующие положения. Нами впервые показано, что инактивирование гена адгезина fimH пилей 1-го типа в геноме Escherichia coli штамма М17 и введение в штамм Escherichia coli М17 неконьюгативной, немобилизуемой плазмиды pColap, несущей гены продукции колицина E1 и детерминант устойчивости к ампициллину в дозах до 150 мг/л позволяет создать пробиотический препарат со сниженной способностью к колонизации отличных от интестинальной ниш, с повышенной антагонистической активностью и резидентный на фоне антибиотикотерапии. Сущность патентуемого генно-инженерного решения поясняется чертежами, где: на фиг. 1 показана схема получения рекомбинантного штамма E. coli M17fimH::kan/pColap с дефектом в гене адгезина fimH пилей 1-го типа, на фиг. 2 - схема конструирования гибридной плазмиды pColap, на фиг. 3 приведены результаты исследования адгезивной активности сконструированного штамма Escherichia coli М17 fimH::kan/pColap, на фиг. 4 - результаты исследования стабильности сконструированного штамма Escherichia coli М17 fimH::kan/pColap. При получении штамма Е.coli М17 fimH::kan/pColap в качестве исходного использовали его ближайший аналог - штамм Е.coli М17. Для элиминации фимбриального адгезина, сообщающего клеткам Е.coli М17 нежелательный высокоадгезивный М н фенотип, получали рекомбинантный штамм, у которого в хромосомный ген fimH, кодирующий адгезин, был интегрирован ген устойчивости к канамицину-неомицину npt. С этой целью использовали плазмиду pCH103, производную плазмиды R6K, которая имеет pir-зависимую систему репликации и может поддерживаться только в штаммах, содержащих ген pir, обеспечивающий ее репликацию [Сокуренко Е.В., Чеснокова В.Л. "Способ модификации адгезивного фенотипа диких изолятов Е.coli в применении к штаммам - продуцентам препарата колибактерин". Бюллетень экспериментальной биологии и медицины, 1997, Том 124, N 9, с. 334 - 338]. Плазмида pCH103 несет ген устойчивости к ампициллину и фрагмент хромосомы, содержащий гены fim-кластера, в котором целостность гена fimH нарушена вставкой гена устойчивости к канамицину (неомицину) npt. После трансформации ее в штамм Е.coli М17 она не может поддерживаться в клетках, и устойчивые к канамицину трансформанты могут возникать или при интеграции ее целиком в хромосому в результате одного кроссинговера или в результате двойного кроссинговера (фиг. 1). Трансформанты второго класса остаются чувствительными к ампициллину. Среди них был отобран штамм, обозначенный Е.coli M17fimH::kan (или М17 fimH::npt). Проведенное исследование подтвердило отсутствие у полученного штамма маннозо-чувствительной адгезии, т.е. FimH - фенотип. Для повышения антагонистической активности штамма Е. coli М17 и придания ему устойчивости к ампициллину на основе плазмиды ColE1 известными методами ["Методы молекулярной генетики и генной инженерии", 1990, Новосибирск, "Наука", Сибирское отделение, с. 7-10, 39-44] была сконструирована гибридная плазмида pColap (фиг. 1). Исходная плазмида ColE1, выделенная из непатогенного штамма Е.coli, детально изучена. Она имеет довольно узкий круг хозяев (в основном - штаммы кишечной палочки) и стабильно поддерживается в бактериальных клетках. Известны ее полная нуклеотидная последовательность, функции всех ее генетических элементов, регуляция их активности. Плазмида детерминирует синтез колицина E1, который губительно действует на клетки родственных бактерий. Недостатком плазмиды ColE1 является ее способность к мобилизации в другие клетки с помощью конъюгативных плазмид, которая обусловлена присутствием в ее структуре mob-области. Используя эндонуклеазу рестрикции BspLu11.1, эту область полностью удалили и при этом практически не затронули другие генетические элементы плазмиды. Затем, используя эндонуклеазу рестрикции BspH1, из известного вектора pUC19 вырезали фрагмент, содержащий ген b1a, кодирующий синтез - лактамазы, и лигировали его с фрагментом плазмиды ColE1, лишенным mob-области. В результате получили плазмиду pColap. Эта плазмида неконъюгативна и немобилизуема и, следовательно, практически не может быть передана в клетки других бактерий. В отличие от вектора pUC19 и других плазмид pColap обеспечивает только умеренный уровень устойчивости к ампициллину трансформированным ею штаммам Е.coli (табл. 1). Такое ухудшение экспрессии гена - лактамазы наблюдается из-за нарушений в промоторной области гена (боксе Гильберта) и 5" - участке, повышающем эффективность экспрессии , произошедших в результате генетических манипуляций в процессе конструирования рекомбинантной плазмиды pColap. Чувствительность штаммов, несущих pColap, к повышенным концентрациям антибиотика следует считать благоприятным фактором. Так, если по каким-либо причинам присутствие штаммов, содержащих эту плазмиду, в кишечнике пациента становится нежелательным или если в результате какого-либо исключительного события плазмида переносится в другой штамм, то все клетки, содержащие ее, можно элиминировать из организма, применив высокие концентрации -лактамных антибиотиков. Плазмидой pColap трансформировали штамм Е. coli М17 fimH::kan и получили штамм Е.coli М17 fimH::kan/pColap. Штамм имеет следующие характеристики. Морфология. Грамотрицательные слабоподвижные тонкие палочки с закругленными концами 1,5 - 2 мкм в длину. Культурально-физиологические признаки. Мясо-пептонный агар и агаризованный бульон Хотингера. Через 36 ч роста при 37 o C образует круглые беловатые полупрозрачные колонии диаметром 1,5 - 2,5 мм, поверхность колоний гладкая, края ровные, структура однородная, консистенция пастообразная, легко эмульгируются. Агаризованная минимальная среда М9 с глюкозой (0,2%). Через 40 ч роста образует колонии 1-2 мм в диаметре, серовато-беловатые, полупрозрачные, круглые, выпуклые, с ровными краями. Мясо-пептонный бульон и бульон Хотингера. Через 18-24 ч роста при 37 o C наблюдается сильное равномерное помутнение, небольшой осадок, характерный запах. Жидкая минимальная среда М9 с глюкозой (0,2 %). Через 20-24 ч роста с аэрацией наблюдается сильное равномерное помутнение, запах слабый или отсутствует. Рост по уколу в мясо-пептонном агаре. Хороший рост по всему уколу. Микроорганизм является факультативным анаэробом. Отношение к температуре и pH среды. Хорошо растет при температуре от 30 до 42 o C и при pH 6,8 - 7,2. Биохимические свойства. Хорошо усваивает глюкозу, сахарозу, лактозу, фруктозу, маннозу, ксилозу, маннит и сорбит с образованием кислоты и газа. Рамнозу, галактозу и арабинозу - со слабым кислотообразованием; салицин - с замедленным кислото- и газообразованием; рафинозу - только с кислотообразованием. Инозит не усваивает. Сероводород не образует; индол вырабатывает. Отношение к антибиотикам. Устойчив к ампициллину при концентрациях в среде до 150 мг/л. Продукция бактериоцинов. Продуцирует колицин E1. Содержание плазмид. Клетки содержат многокопийную неконъюгативную и немобилизуемую плазмиду pColap (5239 п.н.), детерминирующую устойчивость к ампициллину и синтез колицина E1. Штамм имеет антигенную формулу О2:L1:H6 и агглютинируется сывороткой при титре сыворотки не ниже 1:64000. Изобретение иллюстрируется примерами, которые характеризуют устойчивость штаммов, несущих различные плазмиды, к ампициллину, стабильность их признаков в процессе культивирования. Пример 1. Изучение роста штамма Е. coli М17 и его производных, содержащих плазмиды, на средах с разными концентрациями ампициллина (табл. 1). Исследуемые штаммы кишечной палочки (таблица 1) выращивались в течение 18 ч в бульоне Луриа (LB - 10 г триптона, 5 г дрожжевого экстракта, 5 г NaCl на 1 л дистиллированной воды) при 37 o C с аэрацией. Затем готовили последовательные разведения бактериальных культур до 10 -7 в физиологическом растворе и высевали каждую культуру на чашки с LA (LB + 1,6 % агар), содержащие ампициллин в следующих концентрациях (мкг/мл): 5, 50, 75, 100, 125, 150, 200, 250. Оценку роста колоний производили через 18-24 ч. Результаты представлены в таблице 1. Как видно из таблицы 1, исходный штамм кишечной палочки М17 проявляет высокую чувствительность к ампициллину. Плазмида pUC19, содержащаяся в штамме М17/pUC19, которая явилась источником гена - лактамазы для сконструированной нами плазмиды pColap, придает бактериальной клетке устойчивость к концентрациям ампициллина до 2 г/л. В то же время плазмида pColap, содержащаяся в штамме М17 fimH::kan/pColap, обеспечивает устойчивость к концентрациям ампициллина не выше 150 мг/л. Таким образом, полученные штаммы обладают умеренным уровнем устойчивости к ампициллину. Пример 2. Исследование адгезивных свойств и определение адгезивного фенотипа штамма Е. coli М17 и его производных. Адгезивный фенотип определяли стандартным методом "исследования роста" . Из свежей культуры исследуемых штаммов бактерий готовили суспензию бактериальных клеток в физиологическом растворе с оптической плотностью 1.0 при длине волны 540 нм. Параллельно приготовили планшеты для микротитрования с плоскодонными лунками с иммобилизованными в лунках субстратами для адгезии, а именно: МН (дрожжевой маннан), РН (бычья РНКаза В) и БСА (бычий сывороточный альбумин). Затем бактериальную суспензию помещали в лунки и инкубировали в течение 40 мин. Несвязавшиеся бактериальные клетки тщательно отмывали физиологическим раствором. В лунки добавляли богатую питательную среду и инкубировали с постоянным перемешиванием при 37 o C в течение 2,5 - 3 ч до появления помутнения в лунках. Оптическая плотность в каждой лунке учитывалась на автоматическом ридере микропланшет (Molecular Devices, Inc., Menlo Park, Calif., USA). В данном эксперименте исследовались следующие штаммы Е.coli: М17 - исходный штамм; М17 fimH::kan - штамм М17 с инактивированным геном адгезина fimH: М17 fimH: : kan/pPKL91 - штамм fimH::kan, трансформированный плазмидой pPKL91, содержащей регуляторный ген fimB, включающий экспрессию пилей 1-го типа бактериальной клеткой; штамм M17fimH::kan/pColap - штамм М17 fimH::kan, трансформированный сконструированной нами плазмидой pColap, несущей детерминанты устойчивости к ампициллину и продукции колицина Е1. Результаты исследования адгезивной активности штаммов Е.coli М17 и производных штамма Е.coli М17, оцененной с помощью метода "исследования роста", представлены на фиг. 3 (по оси ординат отложены значения оптической плотности при длине волны 540 нм; на оси абсцисс - исследуемые штаммы Е. coli: 1 - М17; 2 - М17 fimH::kan, 3 - M17fimH::kan/pPKL91, 4 - М17 fimH::kan/pColap). Как видно из фиг. 3, исходный штамм Е. coli М17 хорошо связывается и с РНКазой B, и с маннаном, что указывает на МН адгезивный фенотип, нежелательный для интестинального штамма кишечной палочки. Полученный нами рекомбинантный штамм М17 fimH::kan проявляет нулевую адгезивную активность как сам по себе, так и после введения в него плазмиды, включающей экспрессию пилей 1-го типа. Нулевая адгезиная активность сохраняется в этом штамме и после введения в него плазмиды pColap (штамм М17 fimH::kan/pColap). Пример 3. Исследование стабильности признаков штамма Escherichia coli М17 fimH::kan/pColap, детерминируемых плазмидой pColap. Сконструированная нами плазмида pColap обеспечивает продукцию колицина Е1 и устойчивость к ампициллину. Сохранение этих признаков зависит от стабильности поддержания плазмиды в клетках бактерий: утрата плазмиды сопровождается утратой соответствующих признаков. Определяли стабильность сохранения устойчивости к ампициллину и колициногенности полученных штаммов при культивировании их в жидкой питательной среде в отсутствие селективного агента на протяжении 100 генераций. В качестве положительного контроля использовали исходную плазмиду ColE1, а отрицательного - плазмиду pBR322, производную ColE1, не содержащую локуса cer, который влияет на стабильность плазмид. Культуры штаммов М17 fimH::kan/pColap, М17/ColЕ1 и M17/pBR322 выращивались в течение 18 ч с усиленной аэрацией при 37 o C в LB с ампициллином (100 мкг/мл). Штамм М17/ColЕ1 выращивали в тех же условиях, но без ампициллина. Полученные культуры содержали примерно 10 o бактериальных клеток в 1 мл. Затем в пробирки с 10 мл LB (без добавленного антибиотика) вносили 10 мкл (10 6) соответствующей бактериальной культуры. Полученную суспензию выращивали, как описано выше. При таком культивировании бактериальные клетки успевали пройти 10 делений. Повторив эту операцию 10 раз, мы получили бактериальную культуру, прошедшую 100 генераций с момента первого засева в среду без селективного агента. Перед каждым засевом отбирались пробы бактериальной культуры и проверялись на наличие свойств устойчивости к ампициллину и продукции колицина. Для этого суспензии клеток рассевались на чашках с LA до получения отдельных колоний. Затем по 100 колоний каждого штамма проверялись на способность к росту на той же среде в присутствии ампициллина (100 мкг/мл). Кроме того, колонии проверялись на способность продуцировать колицин Е1. Для этого использовался тест с нанесением верхнего агара (Миллер Дж. "Эксперименты в молекулярной генетике", М. , "Мир", 1976, стр. 183-189). Тест заключается в следующем: на чашки с твердой питательной средой, содержащей 1,6 % агар, репликатором или зубочисткой перекалывают исследуемые колонии. Чашки инкубируют при 37 o C в течение 3 - 4 ч, индуцируют продукцию колицина облучением ультрафиолетом в течение 4-5 с и инкубируют в тех же условиях в течение ночи. Затем клетки лизируют парами хлороформа при комнатной температуре в течение 30 - 40 мин. Важно проследить, чтобы на следующем этапе весь хлороформ выветрился из чашки. Наслаивают на нижний слой агара 3 - 5 мл полужидкого (0,7 %) агара, содержащего 10 7 /мл бактериальных клеток тест-штамма Е. coli (чувствительного к колицину Е1). Инкубируют ночь при 37 o C. Регистрируют наличие зон просветления в слое тест-культуры вокруг пятен исследуемых штаммов. Результаты исследования стабильности сконструированного штамма Escherichia coli М17/pColap приведены на фиг. 2 (ColE1 соответствует штамму М17/ColЕ1, pBR322 - штамму M17/pBR322, pColap - штамму М17/pColap). Присутствие плазмиды в бактериальной клетке следует из сохранения ею исходных свойств (колициногенности и/или устойчивости к ампициллину). Результаты эксперимента (фиг. 2) свидетельствуют, что лишенная cer локуса плазмида pBR322 быстро элиминируется из бактериальной популяции при выращивании в среде, лишенной антибиотика, в то время как две другие плазмиды (исходная ColE1 и рекомбинантная pColap) стабильно наследуются клетками в этих условиях. Это свойство является одним из важным преимуществ нашей конструкции, поскольку, с одной стороны, облегчает получение стандартного препарата на основе штамма, содержащего pColap, а с другой стороны, гарантирует, что при приеме препарата пациентом без сопутствующей антибиотикотерапии не произойдет элиминация плазмиды. Промышленная применимость. Приведенное описание способа конструирования патентуемого штамма Escherichia coli М17 rimH::kan/pColap достаточно для повторного получения штамма с использованием стандартных методик, реагентов и оборудования, применяемых в генно-инженерных исследованиях.
Формула изобретения
Штамм бактерий Escherichia coli M 17 fim H::kan/p Colap ВКПМ В-7448, используемый для получения пробиотического препарата.
Похожие патенты:
Изобретение относится к биотехнологии, в частности к генетической инженерии и медицине, конкретно к медицинской вирусологии и иммунологии, и может быть использовано для проведения иммунодиагностики геморрагической лихорадки Марбург, а также для получения специфических антител к вирусу Марбург и генно-инженерных вакцин против вируса Марбург
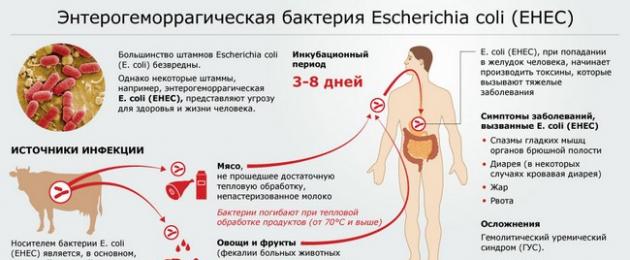
Кишечной палочкой (Escherichia coli) учёные называют палочковидную условно-патогенную бактерию, которая способна нормально функционировать и размножаться только в условиях отсутствия кислорода. Была открыта в восемнадцатом веке Теодором Эшерихом, благодаря которому и получила своё название.
Бактерия имеет довольно много штаммов (разновидностей) и большинство из них считаются безвредными (они живут в кишечнике человека, участвуют в синтезировании витаминоподобных соединений, обладают бактерицидными свойствами по отношению к некоторым патогенным микроорганизмам), но встречаются и такие, которые могут вызывать развитие серьёзных проблем со здоровьем, начиная с нарушений работы ЖКТ и заканчивая развитием , поэтому лечение кишечной палочки должно быть качественным и своевременным.
Общие сведения
Безопасные штаммы этого микроорганизма обитают в кишечнике человека, при этом их количество варьирует от 10 6 до 10 8 КОЕ (микробиологический показатель – колониеобразующая единица) на один грамм содержимого кишечника. Сразу стоит рассказать о том, что бактерии заселяют организм человека в первые дни после рождения, поэтому кишечные палочки у грудничков появляются сразу, и в том случае если их количество не превышает норму, они приносят кишечнику пользу, а значит, лечить такое состояние не нужно.
Однако стоит помнить, что некоторые штаммы этого микроорганизма токсичны, особенно для детей и беременных женщин (кишечная палочка в моче при беременности может свидетельствовать о развитии острого или хронического инфекционного заболевания, угрожающего здоровью плода), так что очень важно вовремя диагностировать это состояние и назначить адекватное лечение.
Кишечные палочки бывают условно-патогенные (к которым относится гемолизирующая кишечная палочка) и патогенные. Учёные смогли выделить больше сотни патогенных штаммов этой бактерии, которые впоследствии были разделены на четыре основных класса, а именно:
- энтероинвазивные;
- энтеротоксигенные;
- энтеропатогенные;
- энтерогеморрагические.
Эти микроорганизмы могут стать причиной развития эшерихиозов – заболеваний инфекционного характера, которые по статистике чаще всего встречаются у детей и женщин (инфекция передаётся фекально-оральным путём в основном через пищу или воду).
Симптомы
Симптомы заражения кишечной палочкой проявляются по-разному, поэтому каждый класс патогенных бактерий необходимо рассматривать в отдельности. Состояние здоровья заражённого человека будет зависеть от того, в какую группу относятся и с какой скоростью размножаются кишечные палочки, симптомы заболеваний описаны ниже.
Энтеропатогенные бактерии
Энтеропатогенные микроорганизмы чаще всего встречаются у детей до одного года жизни и их присутствие, как правило, обнаруживается ещё в роддоме. Сопровождаются водянистой диареей, иногда рвотой, отказом от еды и беспокойным сном.
Энтеротоксигенные бактерии
Энтеротоксигенные кишечные палочки опасны тем, что могут прикрепляться именно к слизистой оболочке кишечника, чем существенно нарушают его работу. Инфекция передаётся через немытые руки или фрукты, поэтому симптомы жизнедеятельности кишечных бактерий в человеческом организме иногда называют «диареей путешественника», которая сопровождается водянистым поносом без крови, тошнотой, приступообразной болью в животе.
Энтерогеморрагические бактерии

Энтерогеморрагические эшерихиозы характеризуется диареей с примесью крови и сопровождаются развитием острой гемолитической анемии. Опасность заболевания состоит в том, что гемолитическая кишечная палочка разрушает кровяные тельца, а это может привести к летальному исходу (чаще всего болезнь поражает женщин). Характерным признаком заболевания является то, что в каловых массах обнаруживается большое количество слизи и примесей зеленоватого оттенка, при этом гемолизирующая кишечная палочка не вызывает повышения температуры тела.
Энтероинвазивные бактерии
Энтероинвазивные патогенные микроорганизмы вызывают боли внизу живота и обильный стул (иногда с примесью крови). Встречаются в основном у детей, временно нарушают работу иммунной системы. Следует сказать о том, что чёткой клинической картины эшерихиозов не существуют, пациенты жалуются на боли в животе (которые могут быть локализованы в любой его части), жидкий стул и рвотные позывы, следовательно, лечение кишечных палочек должно быть комплексным и обязательно проходить под контролем врача. Кстати говоря, лактозонегативная кишечная палочка не должна обнаруживаться в кале в слишком больших количествах (норма – 10 5), а увеличение этого показателя можно заметить даже самостоятельно, об этом свидетельствуют непереваренные кусочки пищи в кале и чередование диареи с запорами.
Кишечная палочка, как возбудитель заболеваний мочеполовой системы
В норме кишечная палочка в моче обнаруживаться не должна, но если при сдаче анализов она была там найдена, врач должен в срочном порядке заняться её лечением. Обычно этот микроорганизм обнаруживается врачами-гинекологами при осмотре беременных женщин, причём для многих наличие этого микроорганизма в микрофлоре влагалища становится сюрпризом. Обнаруженная кишечная палочка в мазке свидетельствует о начале развития воспалительного процесса одного или нескольких органов мочеполовой системы (существует вероятность того, что бактерия передаётся половым путём от одного партнёра к другому).
Нужно сказать о том, что кишечная палочка во влагалище, должна стать поводом к тому, чтоб из лаборатории, сразу же отправиться в кабинет к врачу. Дело в том, что она существенно ослабляет местный иммунитет и делает организм больного человека практически беззащитным перед другими опасными бактериями, например, перед протеусом или стафилококком, что в итоге может стать причиной развития или , следовательно, лечить это состояние должен только специалист.

Гемолизирующая кишечная палочка является причиной развития 80% заболеваний мочеполовой системы, к которым относится:
- острый и хронический (кишечная палочка в мазке при диагностике простатита обнаруживается практически в 65% случаев);
- воспаление яичников и у женщин;
- (если кишечная палочка в мазке на вагинит обнаруживается сразу, то лечение этого недуга проходит максимально быстро, а отсутствие адекватной терапии может стать причиной развития серьёзных проблем со здоровьем);
- (очень часто гемолизирующая кишечная палочка обнаруживается при диагностике пиелонефрита у беременных);
- кольпит и так далее.
На самом деле в гинекологии гемолизирующая кишечная палочка занимает особенное место, потому что при попадании во влагалище она провоцирует развитие ряда таких заболеваний, которые впоследствии приводят к бесплодию и трудно поддаются лечению. По этой причине врачи советуют делать профилактику и диагностику этого возбудителя (определяется кишечная палочка в мазке) хотя бы один раз в год.
Как лечить?
Лечить кишечную палочку должен врач, который вначале делает бактериальный посев и точно определяет штамм возбудителя. Интенсивность и длительность лекарственной терапии зависит от вида бактерии, её локализации и индивидуальных особенностей организма больного человека. В процессе лечения важную роль играет диета и приём пробиотиков – препаратов, нормализующих кишечную микрофлору. После окончания курса лекарственной терапии все анализы сдаются повторно.
Кишечная палочка (E.coli) представляет собой грамотрицательные, палочковидные бактерии, которые обычно находятся в нижней части кишечника теплокровных (эндотермических) организмов. Большинство штаммов кишечной палочки безвредны, но некоторые серотипы являются патогенными и могут вызвать серьезное пищевое отравление у людей, и их наличие в продукции может даже повлечь за собой отзыв продуктов с рынка. Безвредные штаммы являются частью нормальной флоры кишечника, и могут быть полезны для организма, поскольку производят витамин К2 и предотвращают производство патогенных бактерий в кишечнике.
Введение
Кишечная палочка и родственные бактерии составляют около 0,1% от кишечной флоры, и фекально-оральный путь передачи является основным маршрутом, через который патогенные штаммы бактерии вызывают болезни. Клетки способны выживать вне тела в течение ограниченного промежутка времени, что делает их идеальными индикаторными организмами для тестирования проб окружающей среды относительно фекального загрязнения. Бактерия также может быть выращена легко и недорого в лабораторных условиях, и интенсивно исследуется на протяжении более 60 лет. Кишечная палочка является наиболее широко изученной прокариотической моделью организма, а также важным видов в области биотехнологии и микробиологии, где служит в качестве организма-хозяина для большей части работ с рекомбинантной ДНК. Немецкий врач-педиатр и бактериолог Теодор Эшерих обнаружили кишечную палочку в 1885 году, и теперь она классифицируется как часть семейства Enterobacteriaceae гамма-протеобактерий.
Серотипы
Патогенные штаммы E. coli могут быть категоризированы на основании элементов, которые могут вызывать иммунный ответ у животных, а именно: O антиген: часть липополисахаридного слоя K антиген: капсула H антиген: флагеллин Например, штамм Е. coli EDL933 принадлежит к группе O157: H7.
O антиген
Наружная мембрана клетки палочки Е. содержит миллионы молекул липополисахаридов (LPS), которые состоят из:
О антигена, полимера иммуногенных повторяющихся олигосахаридов (1-40 единиц)
Основная область фосфорилированных неповторяющихся олигосахаридов
Липид A (эндотоксин)
Антиген O используется для серотипирования кишечной палочки и эти обозначения группы O идут от O1 до O181, за исключением некоторых групп, которые исторически были удалены, а именно, O31, O47, O72, О67, O93 (ныне K84), O94 и O122; группы 174 до 181 являются предварительными (O174 = OX3 и O175 = OX7) или изучаются (от 176 до 181 – STEC / VTEC). Кроме того, существуют подтипы для многих групп O (например, O128ab и O128ac). Следует отметить, однако, что антитела по отношению к нескольким антигенам O перекрестно реагируют с другими антигенами O и частично с K антигенами не только из E.coli, но и от других видов бактерий Escherichia и вида Enterobacteriaceae. Антиген O кодируется генным кластером rfb. Рол (cld) ген кодирует регулятор длины липополисахаридной O-цепи.
K антиген
Кислый капсульный полисахарид (КПС) представляет собой толстый слизистый слой полисахарида, который окружает некоторые патогены E.coli. Существуют две отдельные группы K-антигеновых групп, называемые группа I и группа II (в то время как небольшая промежуточная группа (K3, K10 и K54 / K96) была классифицирована как группа III). Первая (I) группа состоит из 100 кДа (крупных) капсульных полисахаридов, а вторая (II) связана с внекишечными заболеваниями и имеет размер меньше 50 кДа. Группа IK антигенов обнаруживаются только с определенными О-антигенами (группы О8, O9, O20 и O101), далее они подразделяются на основании отсутствия (IA, аналогично видам Klebsiella в структуре) или присутствия (IB) аминосахаров и некоторые K-антигены группы I прикреплены к липидному А-ядру липополисахарида (KLPS), аналогичным образом, как антигены O (и, будучи структурно идентичны антигенам O, в некоторых случаях рассматриваются только как K антигены при совместной экспрессии с другим подлинным антигеном O). Антигены из группы II K напоминают антигены грам-положительных бактерий и сильно различаются по составу и далее подразделяются в соответствии с их кислотными компонентами. Как правило, 20-50% цепей КПС связаны с фосфолипидами. В общей сложности, насчитывается 60 различных K антигенов, которые были признаны (K1, K2A / переменного тока, К3, К4, К5, К6, К7 (= K56), К8, К9 (= O104), K10, K11, K12 (K82), K13 (= K20 и = K23), K14, K15, K16, K18a, K18ab (= K22), K19, K24, K26, K27, K28, K29, K30, K31, K34, K37, K39, K40, K41, K42 , K43, K44, K45, K46, K47, K49 (o46), K50, K51, K52, K53, K54 (= K96), K55, K74, K84, K85ab / акр (= O141), K87 (= O32), K92, K93, K95, K97, K98, K100, K101, K102, K103, KX104, KX105, и KX106).
H антиген
Антиген Н является основным компонентом жгутиков, участвующим в движении кишечной палочки. Он, как правило, кодируется геном FLIC. Существует 53 идентифицированных антигена H, пронумерованных от H1 до Н56 (Н13 и Н22 не были антигенами E.coli, но входят в группу Citrobacter freundii и было обнаружено, что Н50 – это то же самое, что H10).
Роль в развитии болезней
У людей и у домашних животных, вирулентные штаммы кишечной палочки могут вызывать различные заболевания. В организме человека: гастроэнтерит, инфекции мочевых путей, а также менингит у новорожденных. В более редких случаях, вирулентные штаммы также могут вызывать гемолитико-уремический синдром, перитонит, мастит, септицемию и грамотрицательную пневмонию.
Желудочно-кишечные инфекции
Каждая отдельная бактерия представляет собой округлый цилиндр. Некоторые штаммы кишечной палочки, такие как O157: H7, O104: H4, O121, O26, O103, O111, O145 и O104: H21, производят потенциально смертельные токсины. Пищевое отравление, вызванное кишечной палочкой, может быть вызвано употреблением в пищу немытых овощей или плохо разделанного и плохо приготовленного мяса. O157: H7 также печально известно благодаря тому, что вызывает серьезные и даже угрожающие жизни осложнения, такие как гемолитико-уремический синдром. Этот штамм связан со вспышками кишечной палочки 2006 года в США из-за свежего шпината. O104: H4 штамм является одинаково вирулентным. Против него не так хорошо развиты методы лечения антибиотиками и поддерживающие протоколы лечения (он может быть очень энтерогеморрагическим, как O157: H7, вызывая кровавый понос, но и более энтероагрегативным, то есть, он хорошо адгезируется и прилипает к кишечным мембранам). Этот штамм ответственен за смертельную вспышку кишечной палочки в Европе в июне 2011 года. Степень тяжести заболевания значительно варьирует; это может привести к летальному исходу, особенно у детей младшего возраста, пожилых людей или лиц с ослабленным иммунитетом, но чаще протекает в более мягкой форме. Ранее, в 1996 году, плохая гигиена при приготовлении мяса в Шотландии вызвала гибель семи человек из-за отравления кишечной палочкой, и сотни человек получили заражение. Кишечная палочка может питать как термостойких, так и термолабильных энтеротоксинов. Последние, названные LT, содержат одну А субъединицу и пять В субъединиц, расположенных в одном голотоксине, и в высокой степени сходны по своей структуре и функции с холерными токсинами. В субъединицы способствуют присоединению и вступлению токсина в кишечные клетки-хозяева, в то время как А субъединица расщепляется и предотвращает поглощению воды клетками, вызывая диарею. LT секретируется в ходе типа 2 пути секреции. Если бактерии кишечной палочки избегают желудочно-кишечного тракта через перфорацию (например, от язвы, разорванного аппендикса, или из-за хирургической ошибки) и проникают в живот, они обычно вызывают перитонит, который могут привести к летальному исходу без своевременного лечения. Тем не менее, кишечная палочка чрезвычайно чувствительна к таким антибиотикам, как стрептомицин или гентамицин. Последние исследования показывают, что лечение энтеропатогенной кишечной палочки антибиотиками может не улучшить исход заболевания, поскольку это может значительно увеличить вероятность развития гемолитического-уремического синдрома. E.coli в слизистой оболочке кишечника наблюдаются в повышенных количествах при воспалительных заболеваниях кишечника, болезни Крона и неспецифическом язвенном колите. Высокие количества инвазивных штаммов E.coli существуют в больших количествах в воспаленной ткани, а количество бактерий в воспаленных участках коррелирует с тяжестью воспаления кишечника. Желудочно-кишечные инфекции могут привести к развитию Т-клеток памяти, которые атакуют микробы кишечника в кишечном тракте. Пищевое отравление может вызвать иммунный ответ на микробные бактерии кишечника. Некоторые исследователи предполагают, что это может привести к воспалительным заболеваниям кишечника.
Вирулентность
Кишечная палочка E.coli (ЕС) классифицируется на основе серологических характеристик и свойств вирулентности. Виротипы включают: Энтеротоксигенная кишечная палочка (ETEC) является возбудителем диареи (без лихорадки) у человека, свиньи, овцы, козы, крупного рогатого скота, собак и лошадей. ETEC использует фимбриальные адгезины (проекции из бактериальной клеточной поверхности), чтобы связать клетки энтероцитов в тонком кишечнике. ETEC может производить два протеиновых энтеротоксина: Больший из этих двух белков, LT энтеротоксин, подобен холерному токсину по структуре и функциям. Меньший белок, ST энтеротоксин, вызывает скопление цГМФ в клетках-мишенях и последующую секрецию жидкости и электролитов в просвет кишечника. Штаммы ETEC являются неинвазивным, и они не оставляют просвета кишечника. ETEC является ведущей бактериальной причиной диареи у детей в развивающихся странах, а также наиболее частой причиной диареи путешественников. Каждый год ETEC вызывает более 200 миллионов случаев диареи и 380000 смертей, в основном, у детей в развивающихся странах. Энтеропатогенная кишечная палочка (ЕРЕС) является возбудителем диареи у людей, кроликов, собак, кошек и лошадей. Подобно ETEC, ЕРЕС также вызывает понос, но молекулярные механизмы колонизации и этиология различны. ЕРЕС не имеет ST и LT токсинов, но использует адгезин, известный как интимин, для связывания клеток кишечника хозяина. Этот виротип имеет множество факторов вирулентности, которые подобны Shigella, и может иметь токсин Шига. Связывание со слизистой оболочкой кишечника вызывает перегруппировку актина в клетке-хозяине, приводя к значительным деформациям. ЕРЕС клетки являются умеренно инвазивными (т.е. они проникают в клетки-хозяева) и вызывают воспалительную реакцию. Изменения ультраструктуры кишечных клеток из-за «привязанности и сглаживания», скорее всего, является основной причиной диареи у тех, кто страдает ЕРЕС. Энтероинвазивная кишечная палочка (EIEC) встречается только у людей. EIEC инфекция вызывает синдром, который идентичен дизентерии, с обильной диареей и высокой температурой. Энтерогеморрагическая E. coli (EHEC) содержится в организме человека, крупного рогатого скота и коз. Наиболее печально известным членом этого виротипа является штамм O157: H7, который вызывает кровавый понос без лихорадки. EHEC может вызвать гемолитико-уремический синдром и синдром внезапной почечной недостаточности. Он использует бактериальные фимбрии для прикрепления (общий пилус E.coli, ECP), умеренно инвазивен и обладает фаго-закодированным токсином Шига, который может вызывать интенсивную воспалительную реакцию. Энтероаггегантная E. coli (ЕАЭС) обнаружена только в организме человека называется так потому, что имеет фимбрии, которые агрегируют клетки культуры ткани. ЕАЭС связываются со слизистой оболочкой кишечника, вызывая водянистый понос без лихорадки. EAEC неинвазивны. Они производят гемолизин и энтеротоксин ST, подобно ЕТЕС. Адгезивно-инвазивные E. coli (AIEC) обнаружены в организме человека. AIEC способны вторгаться в эпителиальные клетки кишечника и размножаться внутриклеточно. Вполне вероятно, что AIEC способны более эффективно размножаться в организмах с дефектным врожденным иммунитетом. Они связаны со слизистой оболочкой кишечника при болезни Крона.
Эпидемиология инфекции желудочно-кишечного тракта
Передача патогенной кишечной палочки часто происходит фекально-оральным путем. Общие пути передачи включают в себя:. Негигиеничное приготовление пищи, фермерское загрязнение из-за навоза, орошение посевов загрязненной или грязной водой из неочищенных сточных вод, наличие одичавших свиней на пахотных землях, или прямое потребление сточных загрязненных вод. Молочный и крупный рогатый скот являются основными резервуарами кишечной палочки O157: H7, и они могут переносить его бессимптомно и распространять через свои фекалии. Пищевые продукты, связанные со вспышками E.coli, включают огурец, сырой мясной фарш, сырые ростки семян или шпинат, сырое молоко, непастеризованный сок, непастеризованный сыр и продукты, загрязненные инфицированными работниками пищевой промышленности фекально-оральным путем. В соответствии Управлением по безопасности продуктов питания и лекарственных средств США, фекально-оральный цикл передачи может быть нарушен при правильном приготовлении пищи, предотвращении перекрестного загрязнения, использовании барьеров, таких как перчатки, для пищевых работников, политика здравоохранения, обращение сотрудников пищевой промышленности за медицинской помощью, если они больны, пастеризация сока или молочных продуктов и соответствующие требования для мытья рук. Кишечная палочка, продуцирующая Шига токсин (STEC), в частности, серотип O157: H7, также передавался через мух, а также при непосредственном контакте с сельскохозяйственными животными, животными из мини-зоопарка, и частицами, распространяющимися в воздухе, в среде, где содержатся животные.
Инфекции мочевыводящих путей
Уропатогенные кишечные палочки (UPEC) являются причиной примерно 90% инфекций мочевыводящих путей (ИМП), наблюдаемых у людей с обычной анатомией. При восходящих инфекциях, фекальные бактерии колонизируют уретру и распространяются от мочевого тракта до мочевого пузыря, а также в почки (вызывая пиелонефрит), или простату у мужчин. Поскольку женщины имеют более короткий мочеиспускательный канал, чем мужчины, они в 14 раз чаще страдают от восходящих ИМП. Уропатогенные кишечные палочки используют P фимбрии (пиелонефрит-ассоциированные пили), чтобы связать уротелиальные клетки мочевых путей и колонизировать мочевой пузырь. Эти адгезины специфически связывают фрагменты D-галактоза-D-галактозы на антигене P групп крови эритроцитов и уроэпителиальных клетках. Примерно 1% населения Земли испытывает недостаток этого рецептора, и его присутствие или отсутствие опосредует восприимчивость или не восприимчивость человека к инфекции мочевых путей E.coli, соответственно. Уропатогенные кишечные палочки производят альфа- и бета-гемолизины, которые вызывают лизис клеток мочевых путей. Другим фактором вирулентности, который обычно присутствует в UPEC, является семейство Dr из адгезинов, которые особенно связаны с циститом и ассоциированным с беременностью пиелонефритом. Адгезины Dr связывают антиген Dr группы крови (DRA), который присутствует на распад ускоряющем факторе (DAF) на эритроцитах и других типах клеток. Там, Dr адгезины индуцируют развитие длинных клеточных расширений, которые обертываются вокруг бактерий, сопровождаясь активацией нескольких сигнальных каскадов, включая активацию PI-3-киназы. UPEC может обойти врожденную иммунную защиту организма (например, систему комплемента), вторгаясь в поверхностные клетки с образованием внутриклеточных бактериальных сообществ (ВБС). Кроме того, они обладают способностью к образованию K антигена, капсульных полисахаридов, которые способствуют образованию биопленки. Кишечные палочки, производящие биопленку, являются недостижимыми для иммунных факторов и антибактериальной терапии, и часто влияют на развитие хронических инфекций мочевых путей. Инфекции E.coli, производящие K антиген, обычно встречаются в верхних мочевых путях. Нисходящие инфекции возникают, хотя и сравнительно редко, когда клетки кишечной палочки входят в органы верхних мочевых путей (почки, мочевой пузырь или мочеточники) из потока крови.
Неонатальный менингит (NMEC)
Производится серотипом кишечной палочки, которая содержит капсульный антиген под названием K1. Колонизация кишечника новорожденного этими штаммами, которые присутствуют во влагалище матери, приводит к бактериемии, которая, в свою очередь, приводит к менингиту. И из-за отсутствия антител класса IgM от матери (они не пересекают плаценту, потому что FcRn опосредует только передачу IgG), к тому же, стоит учитывать также тот факт, что организм распознает антиген K1 как часть себя, поскольку он напоминает церебральные гликопептиды, и приводит к развитию серьезной степени менингита у новорожденных.
Роль в развитии рака или клеточном старении
Существуют некоторые штаммы кишечной палочки, которые содержат геномный остров поликетидсинтазы (PKS), чья функция заключается в кодировании мульти-ферментативного механизма, который производит генотоксическое вещество, называемое колибактин. Колибактин может вызывать клеточное старение или рак, повреждая ДНК. Тем не менее, барьер слизистой оболочки препятствует достижению E.coli поверхности энтероцитов. Только тогда, когда совместно с инфекцией E. coli развиваются некоторые воспалительные поражения, бактерия способна вводить колибактин в энтероциты, вызывая развитие опухоли.
Болезни животных
У животных, вирулентные штаммы E.coli вызывают различные заболевания, среди прочих – септицемия и диарея у новорожденных телят, острый мастит у молочных коров, колибактериоз также ассоциируется с хроническими респираторными заболеваниями с микоплазмой, вызывая перигепатит, перикардит, септические легкие, перитонит и т.д. у домашней птицы, и гниль Алабама у собак. Большая часть серотипов, выделенных из птицы, являются патогенными только для птиц. Таким образом, птичьи источники кишечной палочки не кажутся важными источниками инфекций у других животных.
Лабораторная диагностика
В образцах кала, микроскопия покажет грамотрицательные стержни, без особого расположения клеток. Затем, либо агар МакКонки или агар ЕМВ (или оба) высевают с калом. На агаре МакКонки, образуются темно-красные колонии, поскольку организм является лактозоположительным, и ферментация этого сахара приведет к падению среднего уровня рН, что приводит к потемнению среды. Рост на агаре EMB производит черные колонии с зеленовато-черным металлическим блеском. Это служит для диагностики кишечной палочки. Организм также лизин-положителен, и растет на TSI с (А / А / g + / H2S-) профилем. Кроме того, IMViC {+ + - -} для E.coli; поскольку он индол-положительный (красное кольцо) и метил красно-положительный (ярко-красный), но VP-отрицательный (без изменений-бесцветный) и цитрат-отрицательный (без изменений-зеленый цвет). В тестах для токсина могут использоваться клетки млекопитающих в культуре ткани, которые быстро убиваются токсином Шига. Несмотря на то, что этот метод чувствительный и очень специфический, он является медленным и дорогим. Как правило, диагноз делается при культивировании на сорбит МакКонки среде, а затем – с помощью типирования антисыворотки. Тем не менее, в настоящее время анализы латекса и некоторые типирования антисыворотки показали перекрестные реакции с колониями не-E.coli O157. Кроме того, не все штаммы кишечной палочки O157, связанные с HUS, являются несорбитольными ферментёрами. Государственный совет и Территориальные эпидемиологи рекомендуют клиническим лабораториям проводить скрининг, по крайней мере, всего кровавого стула на наличие этого патогена. Центры США по контролю и профилактике заболеваний рекомендуют, «весь стул, представленный для обычного тестирования у пациентов с острой внебольничной диареей (независимо от возраста больного, времени года, или присутствия или отсутствия крови в стуле) одновременно культивировать на E. coli O157:H7 (O157 STEC) и тестировать с помощью анализа, который обнаруживает токсины Шига для обнаружения не-O157 STEC».
Антибактериальная терапия и резистентность
Бактериальные инфекции обычно лечат с помощью антибиотиков. Тем не менее, чувствительности к антибиотикам у различных штаммов E.coli отличается друг от друга. В качестве грамотрицательного микроорганизма, кишечная палочка устойчива ко многим антибиотикам, которые эффективны против грамположительных микроорганизмов. Антибиотики, которые могут быть использованы для лечения инфекции E. coli, включают амоксициллин, а также другие полусинтетические пенициллины, много цефалоспоринов, карбапенемов, азтреонам, триметоприм-сульфаметоксазол, ципрофлоксацин, нитрофурантоин и аминогликозиды. Устойчивость к антибиотикам является растущей проблемой. Частично, это происходит из-за чрезмерного использования антибиотиков, но частично это, вероятно, связано с применением антибиотиков в качестве стимуляторов роста в кормах для животных. В исследовании, опубликованном в журнале Science в августе 2007 года, было установлено, что скорость приспособительных мутаций у E.coli составляет «порядка 10-5 на геном, за поколение, что в 1000 раз выше, чем предыдущие оценки». Это открытие может иметь значение для изучения и управления бактериальной резистентностью к антибиотикам. Устойчивые к антибиотикам кишечные палочки могут также передавать гены, ответственные за устойчивость к антибиотикам, к другим видам бактерий, таким как золотистый стафилококк, посредством процесса, называемого горизонтальный перенос генов. Бактерии E. coli часто несут несколько плазмид с лекарственной резистентностью, и в условиях стресса способны легко передавать эти плазмиды другим видам. В самом деле, E.coli является частым членом биопленки, где существует много видов бактерий в непосредственной близости друг от друга. Это смешение видов позволяет штаммам E.coli принимать и передавать плазмиды из других бактерий и обратно. Таким образом, E.coli и другие энтеробактерии являются важными резервуарами переводимой устойчивости к антибиотикам.
Штаммы бета-лактамазы
Устойчивость к бета-лактамным антибиотикам стала особой проблемой в последние десятилетия, поскольку штаммы бактерий, которые производят бета-лактамазы расширенного спектра, становятся все более распространенными. Эти ферменты бета-лактамазы делают многие, если не все, пенициллины и цефалоспорины неэффективными в качестве терапии. E.coli расширенного спектра, продуцирующие бета-лактамазы (ESBL E.coli), обладают высокой устойчивостью к массе антибиотиков, и инфекции, вызванные этими штаммами, трудно поддаются лечению. Во многих случаях, только два пероральных антибиотика и очень ограниченная группа внутривенных антибиотиков, остаются эффективными. В 2009 году, в Индии и Пакистане на бактерии E.coli был обнаружен ген под названием ген металло-бета-лактамазы Нью-Дели (сокращенно NDM-1), который дает резистентность даже к внутривенному антибиотику карбапенему. Повышенная озабоченность по поводу распространенности этой формы «супербактерии» в Соединенном Королевстве привела к призывам к дальнейшему мониторингу и стратегиям для борьбы с инфекциями и смертями по всей Великобритании. Тестирование к восприимчивости должно определять лечение всех инфекций, при которых организм может быть выделен для культуры.
Фаготерапия
Фаготерапия – использование вирусов, которые направленно воздействуют на патогенных бактерий, была разработана в течение последних 80 лет, в основном, в странах бывшего Советского Союза, где она использовалась для предотвращения диареи, вызванной кишечной палочкой. В настоящее время, фаготерапия для людей доступна только в центре фаготерапии в Республике Грузия и в Польше. Тем не менее, 2 января 2007 года FDA Соединенных Штатов дало одобрение для компании Omnilytics на применение фага, убивающего кишечную палочку O157: H7 для живых животных, которые будут зарезаны для потребления человеком. Фага энтеробактерии Т4, широко изученная фага, направлена на кишечную палочку.
Вакцинация
Исследователи активно работают над разработкой безопасных, эффективных вакцин для снижения случаев инфекции E. coli во всем мире. В марте 2006 года сообщалось, что вакцина, вызывающая иммунный ответ против палочки E. coli O157:H7 О-специфический полисахарид, конъюгированный с рекомбинантным экзотоксином А синегнойной палочки (O157- rEPA), является безопасной у детей от двух до пяти лет. Предыдущая работа уже указала, что она безопасна для взрослых. Планируется III фаза клинических испытаний, чтобы проверить крупномасштабную эффективность лечения. В 2006 году, Fort Dodge Animal Health (Уайет) представил эффективную, живую, ослабленную вакцину для борьбы с аэроциститом и перитонитом у кур. Вакцина представляет собой генетически модифицированную авирулентную вакцину, которая продемонстрировала защиту от O78 и нетипируемых штаммов. В январе 2007 года канадская биофармацевтическая компания Bioniche объявила о разработке вакцины для скота, которая уменьшает количество O157:H7 в навозе, на коэффициент 1000, то есть, убивет около 1000 патогенных бактерий на грамм навоза. В апреле 2009 года исследователь Университета штата Мичиган объявил, что он разработал рабочую вакцину для штамма E.coli. Доктор Махди Саид, профессор эпидемиологии и инфекционных заболеваний в колледжах ветеринарной медицины и медицины человека Университета штата Мичиган, подал патентную заявку на свое открытие и вступил в контакт с фармацевтическими компаниями для её коммерческого производства.
«The Phage Course – Origins». Cold Spring Harbor Laboratory. 2006. Archived from the original on September 16, 2006. Retrieved 2007-12-03Кишечная палочка является довольно распространенным микроорганизмом, вызывающим многочисленные проблемы пищеварительного тракта, мочевыделительной и половой систем у человека, обладающая способностью присутствовать на кожных покровах и слизистых оболочках различных систем организма как вариант нормы.
Кишечная палочка (Escherichia coli или E. coli) – грамотрицательная бактерия (в мазках, окрашенных по Грамму, не окрашивается), относящаяся к Семейству Энтеробактерии, имеющая форму палочки, являющаяся факультативным анаэробом (то есть в основном развивается без наличия кислорода, но в определенных условиях при поступлении кислорода также не теряет своей жизнеспособности). Открыта кишечная палочка была в 1885 году немецким бактериологом Теодором Эшерихом. Палочки имеют закругленные концы, размер от 0,4 до 3 мкм. Некоторые штаммы обладают подвижностью за счет наличия жгутиков, остальные – неподвижны.
Оптимальная температура роста кишечной палочки – 37°. E.coli достаточно устойчива во внешней среде, в таких средах как вода, почва, а также испражнениях сохраняет жизнеспособность длительное время. Имеют способность размножаться в пищевых продуктах (например, молоко). При кипячении погибает практически сразу, при температуре 60º в течение 15 минут, дезинфицирующие вещества (растворы хлорамина, формалина и прочее) губительно действуют на кишечную палочку в течение короткого времени.
Различают многочисленные штаммы (разновидности) кишечной палочки, из которых большинство представителей являются безвредными и в нормальных условиях располагаются на слизистых оболочках пищеварительного тракта, причем преимущественно в нижних его отделах.
Кишечная палочка в норме
В нормальных условиях кишечная палочка заселяет кишечник человека (безопасные ее штаммы), среднее количество варьирует от 10 6 до 10 8 КОЕ/г содержимого дистального отдела кишечника (КОЕ – колониеобразующая единица). Содержание E.coli в составе другой микрофлоры кишечника не более 1%. В обычных условиях кишечная палочка принимают участие в нормальном функционировании кишечника, синтезирует витамины К, В1, В2, В3, В5, В6, В9, B12. Очень важная функция – конкурентное взаимодействие с условно-патогенной флорой кишечника (ограничение размножения условно-патогенных микроорганизмов).
Непатогенный штамм Nissle 1917 (Mutaflor) применяется с лечебной целью у детей в качестве пробиотика при дисбактериозе кишечника. В кишечнике более полезны так называемые лактозопозитивные кишечные палочки, содержание лактозонегативных не должно превышать 10 5 КОЕ/г, а гемолитические E. coli и вовсе должны отсутствовать.
Качественный и количественный состав E.coli толстого кишечника у здоровых людей разных возрастов, как у детей до года, так и старше 60 лет, не имеет различий. Для типичных E.coli это 10 7 -10 8 КОЕ/г фекалий, E.coli лактозонегативные < 10 5 , гемолитические кишечные палочки в норме отсутствуют. Состав остальной флоры кишечника отличается по возрастам по другим параметрам.
Отклонения в содержании непатогенных штаммов кишечной палочки в кишечнике называются дисбактериозом и имеют несколько степеней.
Степени микробиологических нарушений E. coli при дисбактериозе кишечника
1-я степень микробиологических нарушений
: типичных эшерихий до 10 6 -10 5 КОЕ/г, возможно повышение содержания типичных эшерихий до 10 9 - 10 10 КОЕ/г
2-я степень микробиологических нарушений
: повышение содержания гемолитических эшерихий до концентрации 10 5 -10 7 КОЕ/ г
3-я степень микробиологических нарушений
: обнаружение E.coli в ассоциации с другими условнопатоген-ными микроорганизмами в концентрации 10 6 -10 7 КОЕ/г и выше
Патогенные кишечные палочки
Выделяют более 100 штаммов патогенной кишечной палочки, которые объединены в 4 класса:
- энтеропатогенные E. Coli (ETEC);
- энтеротоксигенные E. coli;
- энтероинвазивные E.coli (EIEC);
- энтерогеморрагические E.coli (EHEC).
Морфологически они ничем не отличаются. Особенностью патогенных штаммов является способность при попадании в организм человека продуцировать энтеротоксины (термостабильные или стойкие к высоким температурам и термолабильные или быстроразрушающиеся), за счет которых возникает диарея. Например, E.coli O157:H7, которая продуцирует подобные токсины. Помимо этого для каждой группы характерны свои особенности симптомов заболевания.
Поражение кишечной палочкой желудочно-кишечного тракта
 Эшерихиозы
– заболевания, возникающие в результате попадания в организм патогенных штаммов кишечных палочек, характеризующиеся интоксикацией и поражением преимущественно желудочно-кишечного тракта, но иногда поражающих мочевыводящую систему, желчевыводящие пути и другие органы с возможностью у некоторых пациентов возникновения сепсиса.
Эшерихиозы
– заболевания, возникающие в результате попадания в организм патогенных штаммов кишечных палочек, характеризующиеся интоксикацией и поражением преимущественно желудочно-кишечного тракта, но иногда поражающих мочевыводящую систему, желчевыводящие пути и другие органы с возможностью у некоторых пациентов возникновения сепсиса.
Механизм заражения алиментарный, путь фекально-оральный. Факторами передачи являются загрязненная вода и пищевые продукты. В большинстве своем заболевают дети раннего возраста.
Инкубационный период (с момента заражения до возникновения клинической картины) от 48 до 72 часов чаще всего (реже сокращается до 1 дня или продлевается до 10 суток).
Эшерихиозы, вызванные энтеропатогенной кишечной палочкой : чаще поражаются новорожденные и дети первого года жизни. Являются причиной диареи в роддомах. У маленьких пациентов рвота или срыгивание, частый жидкий стул без патологических примесей (кровь), выраженные боли в животе, беспокойство ребенка, отказ от еды, нарушенный сон.
Эшерихиозы, вызванные энтеротоксигенной кишечной палочкой : данные штаммы обладают способностью прикрепляться к клеткам эпителия кишечника, существенно нарушая их функцию и вызывая сильную водянистую диарею. Также часто проявляются у детей, взрослых и при так называемой «диарее путешественников». У пациентов водянистый стул, без крови, позывы на рвоту, болезненность в животе.
Эшерихиозы, вызванные энтерогеморрагической кишечной палочкой
: вызывает геморрагический колит, в тяжелых случаях проявления гемолитико-уремического синдрома (ГУС). При геморрагическом колите
у пациентов высокая температура до 39-39,5º, симптомы интоксикации, схваткообразные (или спастические) боли в животе, а также появление водянистого стула с примесью крови. Осложнениями могут быть развитие анемии гемолитического характера, острой почечной недостаточности и геморрагического синдрома.
Гемолитико-уремический синдром (ГУС)
– специфический синдром, для которого характерна триада симптомов – гемолитическая анемия, острая почечная недостаточность и критическое падение количества тромбоцитов. Возникает чаще в детской возрастной группе от 6 мес до 4х лет, а также у пожилых пациентов. В 90% случаев встречается при кишечных инфекциях (E.coli, продуцирующая веротоксин, Shigellae и прочие). Причина – поражение клеток эндотелия сосудов. Возникает в среднем через неделю после перенесенной инфекции. Клинически может появиться лимонного цвета желтуха, нарушение оттока мочи, отеки, кровоизлияния на коже и другие тяжелые проявления. Однако при появлений данной симптоматики можно говорить о развернутой клинической картине ГУС. Ранними же его признаками являются лабораторные: появление белка в моче - протеинурия, появление эритроцитов в моче – эритроцитурия, повышение креатинина сыворотки крови, а также снижение эритроцитов и гемоглобина в крови.
Эшерихиозы, вызванные энтероинвазивной кишечной палочкой
: по биохимическим свойствам энтероинвазивные E.coli сходны с шигеллами – возбудителями дизентерии, в частности обладают способностью проникать в клетки эпителия определенного отдела кишечника (ободочной кишки) и там размножаться. Этим объясняется и появление определенной симптоматики при таких эшерихиозах: боли в подвздошной области слева (слева внизу живота), обильный водянистый стул с примесью крови. В отличие от дизентерии, чаще это все-таки водянистый стул, а не скудный со слизью и кровью (как при шигеллезе).
Обобщая вышесказанное, понятно, что нет единой специфической картины эшерихиозов, жалобы пациентов могут быть различными: температура, рвота, водянистый стул без примесей и с кровью, боли в животе разной локализации ноющего характера.
Поражение кишечной палочкой мочевыводящих путей
Механизм заражения чаще связан с непосредственным поступлением кишечной палочки из толстого кишечника при несоблюдении или недостаточном соблюдении личной гигиены, а также при использовании нетрадиционных способов сексуальных контактов (с применением анального секса).
До 80-85% инфекций мочевыводящих путей связано с E. coli. Более 60% острых процессов при воспалении предстательной железы связано именно с этим возбудителем. Подавляющее большинство хронических простатитов связано с кишечной палочкой.
Клинические формы поражения мочевыводящей системы различны. Это могут быть уретриты , циститы , пиелонефриты , простатиты .
Поражение кишечной палочкой половой системы
Большая часть воспалительных процессов в придатке яичка (эпидидимит), воспаление яичка (орхит), а также их сочетанное поражение , воспаление яичников (аднекситы) связано именно с кишечной палочкой.
Диагностика инфекций, вызванных кишечной палочкой
1) Бактериологический метод
– посев биологического материала на специальные питательные среды. Материалом служат при инфекциях кишечника – испражнения и рвотные массы, при инфекциях мочевыделительной системы – моча, при инфекциях половой системы – мазки и соскобы со слизистых половых органов. После идентификации возбудителя проведение антибиотикограммы (определение чувствительности к антибиотикам).
При отклонении содержания кишечной палочки в испражнениях ставят определенную степень микробиологических нарушений (дисбактериоза) или обнаруживают патогенные штаммы кишечной палочки. Наличие E.coli в моче называется бактериурией. При отсутствии симптомов диагноз выставляется при появлении микроорганизмов в количестве 10 5 и выше КОЕ/мл мочи. Если их количество меньше, то считают это признаком контаминации (загрязнение мочи при заборе). Если же симптомы болезни явно выражены, то достаточно 10 2 -10 4 КОЕ/мл мочи.

2) Общеклинические методы исследования
(копрограмма, общий анализ мочи, крови, биохимическое исследование крови и другие) являются дополнительными.
3) Инструментальные методы исследования
(ректороманоскопия, урография, УЗИ и другие).
Общие принципы лечения инфекций, вызванных кишечной палочкой
1. Организационно-режимные мероприятия (госпитализация по клиническим показаниям), диетный режим согласно поражению определенных систем организма (стол № 4 при поражении кишечника, стол № 7 при поражении мочеполовой системы).
2. Медикаментозная терапия включает этиотропную терапию (антибиотики, бактериофаги), патогенетическую терапию (чаще инфузионную), посиндромальную терапию.
Антибактериальная терапия должна проводиться с учетом антибиотикограммы выделенной кишечной палочки. Чаще выявляется чувствительность кишечной палочки к препаратам группы фторхинолона (ципрофлоксацин, левофлоксацин), амоксициллину, нитрофуранам, и другим. И сам препарат, и его дозу, и продолжительность курса лечения назначается только врачом. Самолечение в целях профилактики развития устойчивости кишечной палочки к антибиотикам недопустимо!
Также в отношении E.coli достаточно эффективны бактериофаги (применяются при поражении кишечника) – это бакериофаг коли жидкий, интестибактериофаг, колипротейный бактериофаг, пиобактериофаг комбинированный жидкий, пиобактериофаг поливалентный комбинированный жидкий и другие.
Специально полученные штаммы кишечной палочки входят в состав некоторых лекарственных препаратов, которые используются при дисбактериозе с недостатком E. coli в кишечнике (хелак форте, бификол, колибактерин). Также при дисбактериозе с избыточным ростом кишечной палочки назначаются пробиотики (линнекс, аципол, ацилакт, лактобактерин, бифиформ, бифистим и другие).
Патогенетическая терапия сводится к проведению инфузионной терапии - введения в кровоток различных растворов определённого объёма и концентрации с целью дезинтоксикации и восполнения потерь жидкости при поражении желудочно-кишечного тракта, а также детоксикации организма при поражении почек.
Посиндромальная терапия назначается врачом индивидуально в зависимости от ведущего синдрома заболевания.
Особенности лечения детей и беременных: в данных группах пациентов схемы лечения начинаются с использованием биактериофагов и пробиотиков и только при неэффективности данных препаратов назначаются антибактериальные препараты с учетом возраста, степени поражения.
Профилактика инфекций, вызванных кишечной палочкой
На первом месте при профилактике стоит соблюдение личной гигиены и правил тепловой обработки и хранения пищевых продуктов, мытье овощей и фруктов, а также недопущение употребления в пищу воды из неизвестных источников.
Врач инфекционист Быкова Н.И.
Расшифровка генома EHEC показала, что поразившая Европу кишечная инфекция вызвана ранее не встречавшимся штаммом бактерии - "высокозаразным и токсичным". Число зараженных не снижается, выявлены два случая заболевания в США, все следы ведут на север Германии, источник инфекции пока не найден. Реабилитированные испанские фермеры требуют компенсаций, убытки грозят всему ЕС: Россия запретила импорт овощей из Европы. Москва делает из мухи слона, возмущаются европейцы.
Штамм E. coli, вызвавший беспокойство по всей Европе, - ранее неизвестная "супертоксичная" разновидность этой бактерии, сообщает The New York Times, ссылаясь на заявления чиновников и экспертов в четверг.
"Насколько мы понимаем, этот штамм никогда прежде не выявлялся в условиях вспышки инфекции", - заявил Грегори Хартль, официальный представитель ВОЗ. О случаях этого заболевания сообщили на данный момент 10 стран, но практически все следы ведут на север Германии, пишет издание.
Инфекция вызвана "новым штаммом бактерии - высокозаразным и токсичным", сказано в заявлении Пекинского института геномики, который сотрудничает с немецкими учеными из Университетского медицинского центра Гамбург-Эппендорф. Китайские исследователи заключили, что новый штамм похож на бактерию EAEC 55989, которая встречается в Центрально-Африканской Республике и вызывает сильную диарею.
"Ситуация все еще напряженная. В начале недели мы надеялись, что число зараженных начнет снижаться, но этого не произошло", - сказал директор центра Гамбург-Эппендорф Йорг Дебатин. По словам его коллеги, бактериолога Холгера Роде, китайская лаборатория заключила, что новый штамм является гибридом и дает острое, потенциально летальное осложнение - гемолитико-уремический синдром. "Гены нового штамма примерно на 80% совпадают со штаммом O104, а остальные 20% восходят к другим, более токсичным бактериям", - пересказывает газета слова Роде. Ранее Европейский центр предотвращения и контроля заболеваний ЕС и другие европейские ведомства заявляли, что вспышка вызвана редким штаммом E. coli - O104:H4.
По данным ВОЗ, Швеция сообщила о 28 заболевших, Дания - о 7, Франция - о 6 и т.д. Почти все эти люди недавно побывали на севере Германии, а один имел контакт с приезжим оттуда.
Вспышка инфекции все более сказывается на политической жизни Европы и ее экономических связях, отмечает газета. Так, если Россия будет жестко соблюдать эмбарго на ввоз овощей, европейские фермеры окажутся в еще более тяжелом положении, лишившись одного из крупнейших рынков сбыта.
"В поисках эффективных способов борьбы с опасной кишечной инфекцией врачи сделали важный шаг вперед, - сообщает немецкая Frankfurter Allgemeine Zeitung. - Теперь расшифрован геном EHEC, и специалисты ищут уязвимые места своего врага". В Германии между тем инфекция продолжает бесчинствовать - от ее последствий скончались 17 человек. Всего в Германии зафиксировано около 2 тыс. случаев заболевания кишечной палочкой штамма EHEC. По данным ВОЗ, случаи заболевания зарегистрированы уже в десяти странах Европы.
Эксперты Университетской клиники Гамбург-Эппендорф в сотрудничестве с китайскими коллегами расшифровали геном бактерии, установив, что речь идет о ранее не встречавшемся гибриде энтеробактерий, вызывающих так называемый гемолитико-уремический синдром.
Между тем, говорится в статье, Испания требует миллионной компенсации за ущерб, причиненный ее сельскому хозяйству в результате поспешных заявлений Германии.
Тем временем по меньшей мере два случая инфицирования кишечной палочкой выявлены в США, сообщает The Washington Post. Оба заболевших были госпитализированы в мае с серьезным синдромом, вызываемым микробом, после возвращения из Гамбурга, где, предположительно, они были заражены. Чиновники ожидают результатов лабораторных анализов, чтобы подтвердить диагноз.
"Дональд Крэмер, заместитель руководителя отдела FDA по контролю продуктов питания, заявил, что агентство изучает продукцию, прибывающую из Испании и других стран, где распространилось заболевание", - пишет автор статьи Линдси Лейтон.
Филипп Тарр, специалист по кишечной палочке с кафедры медицины Вашингтонского университета в Сент-Луисе, полагает, что вспышка вряд ли достигнет Соединенных Штатов, потому что бактерия не содержится в продуктах питания, поставляемых на американский рынок. Хотя она может передаваться от человека к человеку, чаще она вызывается зараженной пищей.
Однако если бы бактерия, погубившая 18 человек в Европе, поразила фрукты и овощи, выращиваемые в США, предотвратить вспышку было бы невозможно, потому что от американских производителей не требуют проверки продуктов питания на этот болезнетворный микроорганизм перед их попаданием в супермаркеты. По признанию специалистов, американская нормативно-правовая база в этом вопросе "отстает на пару шагов". При этом регулирующие органы США концентрируются в основном на более известной версии кишечной палочки, E.coli 0157. Штамм, поразивший свыше 1600 человек в Европе, является особо опасной версией микроорганизма, E. Coli 0104, пишет издание.
Из страха перед кишечной палочкой Россия запретила ввоз овощей из ЕС, рассказывает The Financial Times. Глава Роспотребнадзора Геннадий Онищенко заявил, что запрет вступает в силу немедленно и таможенникам приказано заблокировать импорт, особенно из Германии и Испании.
По данным Freshfel, Россия - крупнейший рынок экспорта для европейских производителей овощей. 34% овощей, ввозимых в Россию, - европейские, в основном из Польши и Голландии.
Глава Еврокомиссии по здравоохранению и защите потребителей Паола Тестори Коджи написала в ответ Онищенко "письмо в жестких выражениях", призвав снять "необоснованные ограничения". "Я считаю такие меры диспропорциональными, не обоснованными научно и, следовательно, не соответствующими принципам [международных] соглашений [о торговле]", - цитирует издание ее письмо.
Решение Кремля - признак того, что вспышка инфекции рискует вызвать массовую панику, замечает газета. Европейские эксперты до сих пор не выявили источника E. coli.
Россия не впервые принимает столь жесткие решения, отмечает El Mundo, напоминая о газовом кризисе 2009 года, когда Москва прижала Европу к стенке. На этот раз, по словам профессора Европейского института при Лондонской школе экономики (LSE) Йена Бегга, Россия продемонстрировала "инстинктивную реакцию, носящую скорее популистский, нежели научно обоснованный характер". Возможно, дело в надежде получить дивиденды на предстоящих выборах или в русской привычке делать из мухи слона, но российские аргументы не знают полутонов, пишет издание.
Еврокомиссия осудила чрезмерную реакцию России, предупредив, что потребует объяснений, однако все эти предупреждения могут остаться словами, несмотря на тяжелые экономические последствия такой блокады. "Учитывая, что Россия не входит в ВТО, а нам нужно импортировать ее газ, ответные меры будут затруднены", - приводит газета мнение Бегга.