Гемолитико-уремический синдром (ГУС) представляет собой серьезную терапевтическую проблему в педиатрии и детской нефрологии, являясь одной из ведущих причин острой почечной недостаточности с потенциальной трансформацией в терминальную хроническую почечную недостаточность в различные сроки от начала заболевания.
Несмотря на то, что наиболее распространена типичная форма ГУС с диарейной продромой, ассоциированная с токсином Шига (STEC), требуется тщательное подтверждение инфекционной этиологии, чтобы вовремя исключить атипичный ГУС и ГУС, связанный с пневмококковой инфекцией. В отношении STEC-ГУС рекомендуется адекватная симптоматическая терапия со своевременным подключением диализа при необходимости. Прогноз при этом будет зависеть от продолжительности анурического периода и сопутствующих повреждений центральной нервной системы.
В соответствии с рекомендациями Инициативы по улучшению глобальных исходов заболеваний почек (Kidney Disease: Improving Global Outcomes, KDIGO) их сила указана как уровни «1», «2» или «нет градации», качество доказательной базы - как А, В, С, D.
Типичный гемолитико-уремический синдром (ГУС)
- При развитии острой почечной недостаточности в возрасте от 6 мес до 3 лет велика вероятность ГУС в качестве ее причины.
- Аргументом в пользу ГУС может служить анамнестическое указание на предшествующий эпизод диареи с примесью крови в стуле.
- Клиническими признаками ГУС, помимо симптомов острой почечной недостаточности (олигурия, азотемия, гипергидратация и др.), являются Кумбс-негативная гемолитическая анемия с присутствием в мазке шизоцитов и тромбоцитопения, отражающие активный процесс тромботической микроангиопатии.
- В качестве необходимого диагностического теста рекомендуется исследование Шига-токсина в стуле методом полимеразной цепной реакции или определение IgM-антител к липополисахариду Escherichia coli, продуцирующей Шига- токсин, являющийся основным этиологическим фактором ГУС (1A).
- При развитии острой почечной недостаточности с анурией, а также некорригируемыми гипергидратацией, электролитными расстройствами и артериальной гипертензией рекомендуется незамедлительная инициация заместительной почечной терапии (перитонеальный диализ, гемодиализ, продленная вено-венозная гемодиафильтрация) с учетом возраста и состояния гемодинамики больного (1B).
- Не рекомендуется назначение антибиотиков для лечения диареи при ГУС с учетом возможного усиления циркуляции Шига-токсина из разрушенных микробных клеток (2B).
- Для коррекции выраженной анемии с симптомами гипоксемии рекомендуются трансфузии эритроцитарной массы (1A).
- За исключением выраженного кровотечения, не рекомендуется введение тромбоцитарной массы, так как это может привести к усилению образования микротромбов (2B).
- Дети, перенесшие ГУС, нуждаются в длительном наблюдении с учетом вероятности отдаленных последствий в виде формирования хронической болезни почек.
Атипичный гемолитико-уремический синдром (аГУС).
- Отсутствие предшествующей диареи, негативный результат исследования на Шига-токсин, семейный и рецидивирующий характер заболевания, признаки активации альтернативного пути комплемента, мультиорганность поражения требуют исключения аГУС - комплементопос- редованной тромботической микроангиопатии (ТМА), чаще всего вызванной мутациями генов белков системы комплемента.
- При подозрении на аГУС рекомендуется исследование активности фактора ADAMTS13 для исключения тромботической тромбоцитопенической пурпуры (1A).
- Дифференциальную диагностику аГУС следует проводить с ТМА при системной красной волчанке, применении ряда лекарственных препаратов и метилмалоновой ацидурии (1B).
- Рекомендуется исследование уровня антител к фактору Н комплемента (CFH) для исключения антителоопосредованной формы аГУС (1B).
- В качестве патогенетической терапии аГУС рекомендуется применение экулизумаба - моноклонального антитела к С5 компоненту комплемента, блокирующего дистальную часть альтернативного пути его активации (1B).
- При выявлении высокого уровня антител к фактору Н возможно использование иммуносупрессивной терапии ритуксимабом (2B).
- При невозможности незамедлительного начала лечения экулизумабом рекомендуется плазмотерапия в виде плазмообменов или трансфузий свежезамороженной плазмы (2B).
- Для определения продолжительности терапии экулизумабом рекомендуются оценка его эффекта на протяжении нескольких месяцев и проведение молекулярно-генетического исследования для выявления мутаций генов системы комплемента: CFH, CFI, CFB, C3, THBD, MCP (2B).
Введение
Гемолитико-уремический синдром является одной из наиболее частых причин развития острой почечной недостаточности у детей; характеризуется триадой симптомов: Кумбс-негативной гемолитической анемией с наличием фрагментированных эритроцитов (шизоцитов), тромбоцитопенией и острой почечной недостаточностью.
Указанные признаки являются составляющими тромботической микроангиопатии - генерализованной окклюзии сосудов мелкого калибра тромбами, возникшими вследствие повреждения эндотелия. В результате поражения эндотелиальных клеток происходит механическое повреждение эритроцитов, активация агрегации тромбоцитов с образованием тромбов в микроциркуляторном русле, особенно в почках.
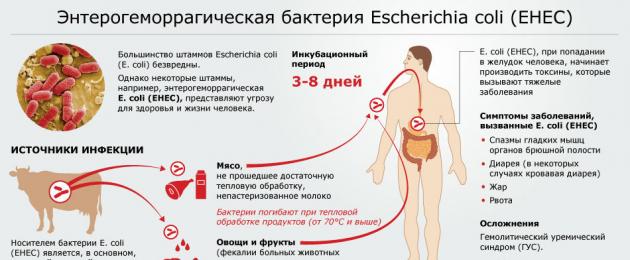
У детей раннего возраста в большинстве случаев (90-95%) развивается так называемый типичный или постдиарейный ГУС (Д + ГУС), который вторичен по отношению к инфекции Escherichia coli, продуцирующей так называемый Шига-токсин (Shigatoxine - Stx, продуцирующий E. coli; STEC). Реже инфекционными стимулами служат шигеллы и пневмококки. Другая форма ГУС, называемая атипичной, встречается гораздо реже (5-10% всех случаев) и является результатом аномалии (чаще генетической) белков, регулирующих процесс активации комплемента.
Типичный постдиарейный гус
Д+ ГУС как следствие STEC-инфекции является наиболее частой формой ГУС у детей. Отмечается в основном в возрасте до 3 лет и редко - до 6 мес. Частота составляет ~2-3 случая на 10 000 детей в возрасте до 3 лет.
Патогенез
STEC-инфекция обнаруживается приблизительно в 85% случаев Д+ ГУС с помощью посева стула или ректального мазка в питательную среду Мак-Конки (Mac Conkey) с сорбитолом. Наиболее часто встречающимся серотипом является 0157:H7 (реже O111, O103, 0121 и др.). Другими вариантами диагностики STEC-инфекции являются обнаружение гена Шига-токсина в стуле методом полимеразной цепной реакции, или, реже, определение IgM-антител к липополисахариду наиболее часто встречающихся серогрупп микроорганизма в сыворотке крови.
Резервуаром инфекции являются кишечник и фекалии крупного рогатого скота. Возможными переносчиками могут быть также овцы, козы, лошади, олени, кошки, собаки, птицы и мухи. Человек заражается при употреблении полусырой рубленой говядины, непастеризованного некипяченого молока, сыра, фруктов, соков, овощей, зараженной воды из колодца и водоемов, а также при неисправности водопровода. Прямой контакт детей с животными или их испражнениями и передача от человека к человеку являются другими серьезными источниками заражения.
Д+ ГУС может быть спорадическим либо, в случае заражения из одного и того же источника, манифестировать с промежутком в несколько дней или недель у сибсов. Часто члены семьи имеют STEC-диарею без развития ГУС.
Эпидемии диареи или геморрагического колита в результате инфицирования STEC из единого источника, охватывавшие сотни людей, отмечены в различных странах, частота ГУС среди них составила 10-20%.
Патогенетическая связь между кишечной контаминацией STEC и ГУС не полностью ясна. Микроорганизм прикрепляется к ворсинкам слизистой оболочки толстой кишки и выделяет Шига-токсин. Остается неясным, каким образом Шига-токсин перемещается из кишечника к своей цели - эндотелиальным клеткам сосудов. Транспортерами Шига-токсина могут быть полинуклеарные нейтрофилы, моноциты или тромбоциты. Токсин прикрепляется к своему рецептору (глоботриаосилцерамиду, Gb3) на сосудистых эндотелиальных клетках почек, центральной нервной системы (ЦНС) и других органов.
После связывания с Gb3 активная часть Шига-токсина проникает в клетку, подавляя синтез белков, что, в свою очередь, приводит к смерти клеток эндотелия. Шига- токсин индуцирует также местную продукцию цитокинов, которые запускают каскад воспалительных и прокоагуляционных событий.
Клиническая картина
В продромальной фазе Д+ ГУС отмечаются диарея (у 90-95%), рвота (у 30-60%) и боли в животе. В 70% случаев через 1-2 дня от начала заболевания в стуле появляется кровь. Манифестация ГУС начинается в среднем через 6 (2-14) дней. Бледность кожных покровов, общее недомогание, слабость, летаргия, изменение поведения, небольшая желтушность, уменьшение количества мочи после «кровавой» диареи должны насторожить врача в отношении ГУС.
ГУС начинается внезапно и характеризуется типичной комбинацией признаков.
- Гемолитическая анемия: уровень гемоглобина, как правило, < 80 г/л, имеются шизоциты (2-10%); 70% пациентов нуждаются в трансфузии крови.
- Тромбоцитопения (~ 50 000-70 000х10*9/л) не является достаточно выраженной, чтобы вызвать кровотечения в отсутствии хирургических вмешательств, хотя у некоторых детей появляется кожный геморрагический синдром.
- Лейкоцитоз более 20,0х10*9/л в тяжелых случаях ГУС является частой находкой.
- Острая почечная недостаточность с повышением уровня сывороточного креатинина и мочевины. Приблизительно половина пациентов имеют тяжелую олигурию или анурию, 50-60% нуждаются в остром диализе.
При наличии мочи постоянно определяются микро- или макрогематурия и протеинурия. Поскольку анурия диагностируется с опозданием, у пациентов прогрессирует гипергидратация, поэтому первыми проявлениями ГУС могут быть гипонатриемия и гиперволемия с артериальной гипертензией. В других случаях отмечается обезвоженность из-за диареи и рвоты. Уровень сывороточного калия, который сначала может быть низким из-за кишечных потерь, быстро повышается. Часто отмечаются ацидоз, гипокальциемия, гиперфосфатемия и гиперурикемия.
Экстраренальные проявления
- Поражение центральной нервной системы, которое является основной причиной смерти, отмечается ~ у 20% детей: частыми симптомами являются фокальные или генерализованные судороги, стридор, нарушение сознания; возможны гемипарестезия или гемиплегия, корковая слепота, кома, иногда децеребрация с вовлечением ствола головного мозга.
Сначала результаты компьютерного или магнитно-резонансного сканирования могут быть нормальными или выявлять участки пониженной плотности. В случае ограниченного и обратимого ишемического поражения возможно полное восстановление нервной системы. Диффузные либо локализованные в стволе мозга некротические изменения могут привести к смерти или тяжелым неврологическим последствиям.
- Серьезное поражение желудочно-кишечного тракта (~ у 10%): тяжелый геморрагический колит с постоянной меленой, боль, рвота, состояние частичной непроходимости; реже токсический мегаколон, инвагинация, перфорация толстой кишки или выраженный некроз, вторичный стеноз толстой кишки.
- Отек поджелудочной железы при ультразвуковом исследовании в сочетании с повышением уровня амилазы и липазы (~10% пациентов). Редко развивается некротизирующий панкреатит. В результате некроза островковых клеток возможно развитие транзиторного или перманентного инсулинзависимого сахарного диабета.
- Поражение печени (у 40%): проявляется гепатомегалией, повышением уровня трансаминаз и имеет относительно доброкачественное течение.
- Сердечно-сосудистые осложнения (за исключением сердечной недостаточности в результате гиперволемии и гипертензии) встречаются редко (2%) и включают ишемию миокарда с сердечной недостаточностью, аритмии, миокардит или тампонаду сердца.
Прогноз
Смертность в 2000-е гг. (в основном в результате поражения ЦНС) составила 1-5%.
В большинстве случаев в течение < 1-2 нед исчезают гемолитическая анемия и тромбоцитопения, нормализуется диурез. Несмотря на это, в среднем в течение 4 мес катамнестического наблюдения ~10% детей достигают терминальной хронической почечной недостаточности (ХПН). ХПН иногда развивается уже в острой стадии после транзиторного частичного улучшения функции почек. В дополнение у 25% детей отмечаются остаточные изменения почек: снижение клубочковой фильтрации (70-80 мл/1,73 м2 в мин), гипертензия или протеинурия.
К факторам риска перманентного поражения почек в острой стадии относятся необходимость в гемодиализе более 5 дней, длительность олигоанурии более 10 дней, количество полинуклеаров > 20,0х10 э/л, поражение ЦНС, тяжелые кишечные осложнения. У большинства пациентов этой группы через 20-30 лет развивается терминальная ХПН.
Ведение ребенка с Д + ГУС
Крайне необходимо своевременное подтверждение факта STEC-инфекции и определение основных признаков тромботической микроангиопатии, показателей азотемии, электролитов и основных витальных параметров. При развитии олигурии следует предусмотреть возможность начала диализа.
Коррекция водно-электролитного обмена
Необходим расчет жидкости с ее ограничением при гипергидратации и, наоборот, компенсацией потерь со стулом, рвотой и сохраненном диурезе, так как дегидратация может усугубить ишемическое повреждение почек и других органов. Признаками гипергидратации могут быть увеличение массы тела, артериальная гипертензия, отеки, гипонатриемия.
Попытки применения высоких доз фуросемида (2-5 мг/кг) редко позволяют достичь эффекта, равно как и гипотензивная терапия периферическими вазодилататорами, поэтому предпочтение отдается диализу, особенно при наличии выраженной гиперкалиемии и метаболического ацидоза, коррекция которых введением растворов бикарбоната и глюкозы может усугубить гипергидратацию.
Питание
Питание так же, как воду и электролиты, лучше обеспечивать перорально, при необходимости - через желудочный зонд. Количество калорий и белка должно составить 100% рекомендованной суточной потребности. Необходимость в парентеральном питании возникает в случае продолжающихся рвоты диареи и симптомов колита.
Переливание крови
Эритроцитарную массу вводят при уровне гемоглобина ниже 70 г/л. С целью предотвращения анти-HLA- иммунизации трансфузию рекомендуется проводить через специальные фильтры (задерживающие лейкоциты и тромбоциты). При отсутствии серьезных кровотечений и показаний к инвазивным мероприятиям (установление центрального или перитонеального катетера, абдоминальные хирургические вмешательства) нет необходимости в введении тромбоцитарной массы. Более того, введение тромбоцитов может усугубить процесс тромбообразования.
Диализ
Необходимость диализа определяется в первую очередь наличием или отсутствием олигурии. Диализ (обычно перитонеальный с помощью катетера Tenckhoff) желательно начать до развития осложнений острой почечной недостаточности.
Терапия осложнений
Дети даже с умеренными неврологическими симптомами нуждаются в пристальном наблюдении и частых исследованиях, нередко в отделении интенсивной терапии: ухудшение может развиться стремительно.
Для обеспечения своевременного оперативного вмешательства при перфорации/некрозе кишечника или вторичном стенозе в ведении пациента должен участвовать хирург. При наличии сахарного диабета необходима инсулинотерапия. У детей с кардиомегалией и сердечной недостаточностью рекомендуется тщательный мониторинг сердечной деятельности.
Специфическая терапия
Нет доказанного варианта терапии, способного повлиять на течение Д+ ГУС. Гепарин, тромболитики и антиагреганты, стероиды и свежезамороженная плазма (СЗП) не имеют существенного эффекта. В тяжелых случаях, особенно при поражении ЦНС, проводят заменное переливание плазмы (ЗПП). Целью является удаление факторов свертывания, тромбообразования и замещение с помощью СЗП потенциально полезных веществ, главным образом антитромбинов.
Трансплантация почки
Риск развития возвратного Д+ ГУС после трансплантации почки отсутствует. Необходимо обсудить возможность трансплантации от живого родственного донора. Циклоспорин не противопоказан. На основании анализа течения заболевания должен быть исключен атипичный ГУС, при необходимости - путем молекулярно-генетического исследования.
Предотвращение инфицирования STEC и профилактика развития ГУС
Следует ознакомить родителей маленьких детей с правилами предотвращения контаминации STEC:
- рубленая говядина должна быть хорошо прожарена до появления серого цвета на разрезе;
- дети до 3 лет не должны употреблять непастеризованные продукты (молоко, сыр, фруктовые соки);
- до приготовления пищи, особенно после манипуляций с рубленой говядиной, необходимо мыть руки;
- дети, которые прикасались к крупному рогатому скоту и другим животным, должны вымыть руки и умыться после этого, а также перед едой;
- для предотвращения контаминации мяса кишечным содержимым необходим контроль убоя скота. Важен надлежащий надзор и уход за системой водоснабжения;
- антибиотики: многочисленными исследованиями показано, что антибиотикотерапия в период диареи увеличивает риск развития ГУС, возможно, в связи с освобождением Шига-токсина в результате лизиса бактерий. Тем не менее этот риск пока не доказан. Необходимо также уточнить, стоит ли назначать антибиотики, не вызывающие бактериальный лизис, такие как макролиды (азитромицин), сибсам пациентов с STEC-позитивным ГУС.
ГУС в результате инфекции Shigella dysenteriae тип 1
S.dysenteriae тип 1, продуцирующий Шига-токсин, является основной причиной ГУС в эндемичных регионах, таких как Бангладеш или Африка. Этот тип ГУС протекает тяжелее, чем STEC-ГУС. В 20% случаев отмечается бактериемия, часто с развитием септического шока и внутрисосудистой коагуляции. Смертность колеблется в пределах 20-40%. У 40% развивается ХПН, которая в течение нескольких лет достигает терминальной стадии. Раннее назначение антибиотиков (цефалоспорины 3-го поколения или хинолоны) снижает риск развития ГУС у детей, инфицированных S. dysenteriae тип 1.
ГУС, вторичный по отношению к Streptococcus pneumoniae
Выделяют особую форму ГУС, которая развивается непосредственно после инфекции S. pneumoniae (пневмония и/или эмпиема и менингит), в основном у детей в возрасте младше 2 лет.
Механизм развития этой формы ГУС особенный. Нейраминидаза S. pneumoniae атакует N-ацетил-нейраминовую кислоту поверхности клеток, обнажая при этом холодовой T-антиген (криптантиген; Thomsen- Friedenreich antigen) - компонент клеточных мембран эритроцитов, тромбоцитов, эндотелиальных клеток клубочков. У человека имеются естественные антитела к Т-антигену, которые приводят к агглютинации эритроцитов и запуску процессов, приводящих в итоге к развитию ГУС. При пневмококковой инфекции положительный тест на Т-активацию свидетельствует о повышенном риске развития ГУС. Прямой тест Кумбса обычно также позитивен. Смертность, в основном обусловленная менингитом, составляет ~10%. Другие 10% пациентов быстро развивают терминальную почечную недостаточность; 20% имеют остаточные явления - нарушение почечной функции, гипертензию.
Введение плазмы и неотмытых эритроцитов противопоказано, поскольку они содержат анти-Т IgM-антитела, которые могут спровоцировать рецидив ГУС. Отдельные работы свидетельствуют об эффективности ЗПП с последующим замещением альбумином.
Атипичный гус
Общепризнанного определения аГУС не существует. Одно из имеющихся гласит, что аГУС - это ГУС без сопутствующей болезни. Под сопутствующей болезнью понимают гемоколит, вызванный STEC-инфекцией, пневмококковую пневмонию, системную красную волчанку, тромботическую тромбоцитопеническую пурпуру, наследственные нарушения обмена кобаламина, патогенное воздействие лекарств и другие патологические состояния, способные вызвать ТМА. В более узком и традиционном понимании аГУС - это ГУС, опосредованный дисфункцией системы регуляции комплемента с неконтролируемой активацией его альтернативного пути.
Атипичный вариант составляет 5-10% всех случаев ГУС у детей и в основном является следствием нарушения регуляции системы комплемента. Отдельные редкие случаи у младенцев (метилмалоновая ацидемия) - это результат наследственной аномалии внутриклеточного метаболизма кобаламина (витамин B12). По данным различных исследований, распространенность аГУС колеблется от 1 до 7 случаев на 1 000 000 населения.
Патогенез
Система комплемента является основным фактором защиты от микроорганизмов. При нормальной регуляции активация комплемента специфически направлена на поверхность микроба, однако подавляется на поверхности клеток хозяина. При активации комплемента образуется конвертаза C3bBb, которая приводит к превращению C3 в C3b.
В результате происходит отложение C3b на поверхности микробов (опсонизация) и формирование мембраноатакующего комплекса (МАК, или C5b9), который приводит к лизису микробной клетки. На поверхности клеток хозяина этот процесс строго контролируется белками-регуляторами, к которым относятся комплементарный фактор H (CFH), фактор I (CFI) и CD46, или мембранный кофакторный протеин, нециркулирующий протеин, закрепленный на поверхности клеток (MCP). Эти три фактора, действуя сообща, предотвращают активацию и депозицию C3b на клетках.
Мутации этих белков приводят к утрате защиты эндотелиальных клеток от повреждения конечными продуктами активации альтернативного пути комплемента. Иными словами, нарушается процесс подавления избыточной активности системы комплемента, что приводит к реализации повреждающего действия конечных продуктов его альтернативного пути на клетки эндотелия с развитием ТМА.
аГУС ассоциируется с мутациями CFH у 20-25% пациентов, MCP — 15% и CFI — 10%. Мутации фактора В (CFB) встречаются крайне редко (1%), в то время как мутации C3 фракции комплемента - у 10% пациентов. Редкими являются мутации гена тромбомодулина (THBD). Приблизительно 10% детей имеют сочетанные мутации. В дополнение 10% детей имеют приобретенный функциональный дефицит CFH в связи с наличием анти- CFH антител. Только 30% заболеваний аГУС не находит сегодня должного объяснения с позиций молекулярной генетики.
Диагностика
Исходя из определения аГУС, для постановки его диагноза у ребенка должны быть исключены прочие причины развития ТМА, в первую очередь Д+ ГУС (постдиарейный). В ряде случаев в дебюте аГУС также отмечается диарея, поэтому необходимо своевременное исключение STEC- инфекции, равно как и инфекции S. pneumoniae.
Помимо этого, следует исключить системную красную волчанку, ВИЧ-инфекцию, инфекцию вирусом H1N1, предшествующую злокачественную гипертонию, HELLP- синдром у рожениц, прием лекарств (циклоспорин А), метилмалоновую ацидурию как возможные причины ТМА.
Особое внимание следует уделить исключению тромботической тромбоцитопенической пурпуры (ТТП). Необходимо исследование уровня фактора ADAMTS13, ответственного за инактивацию фактора Виллебранда у всех больных с картиной ТМА, выраженный дефицит которого (ADAMTS13 < 5% нормы) приводит к определенной форме ТТП. Клинически ТТП и ГУС имеют много сходного. У детей ТТП чаще носит врожденный характер и ассоциируется с наследственным полным дефицитом ADAMTS13. Приобретенные формы в результате наличия анти-ADAMTS антител у детей встречаются исключительно редко. Для ТТП характерно превалирование неврологической симптоматики при умеренном нарушении функции почек.
Поскольку многие мутации скорее ведут к нарушению функции белков системы комплемента, нежели к изменению их плазматической концентрации, уровень CFH, CFI, C3 и CFB может оставаться нормальным даже при наличии мутаций. Сам же молекулярно-генетический анализ требует значительного времени, и получение его результатов в острой фазе заболевания практически нереально. Вместе с тем он крайне желателен в процессе наблюдения за больными для определения стратегии их долгосрочной терапии.
Клинические проявления
Очень ранее начало (даже в период новорожденности) характерно для аГУС, связанного с мутациями CFH и CFI (средний возраст 6 и 2 мес, соответственно).
Наоборот, при мутации MCP заболевание всегда начинается после 1 года жизни. Варианты аГУС с неидентифицированными мутациями могут начаться в любом возрасте. Анти-CFH антитела чаще отмечаются ближе к подростковому периоду.
Некоторые инфекции (верхних дыхательных путей, лихорадка, гастроэнтериты) запускают первый эпизод ГУС и рецидивы, независимо от генетического варианта, у 2/3 пациентов. Диарея провоцирует аГУС у 1/3 пациентов, что иногда затрудняет дифференциацию с Д+ ГУС (типичным).
У 1/4 пациентов аГУС носит семейный характер (сибсы, родители, бабушки и дедушки имеют заболевание). Неотягощенный семейный анамнез не исключает возможности генетической передачи заболевания. Лишь половина носителей мутации в семье в течение жизни имеют манифестацию заболевания.
Прогноз
В целом прогноз аГУС неблагоприятный. Смертность в острой стадии составляет 5-10%. Приблизительно у 50% пациентов развивается терминальная ХПН, чаще в течение 1 года от начала манифестации. Экстраренальные проявления, чаще поражение ЦНС (судороги, кома, ишемические очаги при магнитно-резонансной томографии), отмечаются более чем у 20% пациентов.
Рецидивы аГУС отмечаются при всех вариантах, чаще у пациентов с мутацией MCP. Провоцирующие инфекции при этой мутации сопровождаются острым гемолизом, тромбоцитопенией и острой почечной недостаточностью в результате гемоглобинурии. В большинстве этих случаев функция почек полностью восстанавливается. Промежуток времени между рецидивами колеблется иногда от нескольких недель до многих лет.
Наиболее благоприятный прогноз отмечается при MCP, наиболее неблагоприятный - при CFH и сочетанных мутациях. Во французском исследовании смерть или терминальная ХПН в сроки менее 1 года от начала заболевания отмечены у 60% с мутацией CFH, у 37% с мутацией CFI, у 33% с мутацией С3, у 60% с комбинированными мутациями, у 32% в группе с неизвестной этиологией и 0% с мутацией MCP. У больных с анти-CFH антителами в случае раннего лечения плазмообменом заболевание имеет благоприятное течение.
Лечение
Плазма
Введение СЗП долгое время оставалось первой линией терапии. Тем не менее ее эффективность, по данным ретроспективных исследований, не предотвращает развития терминальной ХПН. СЗП является источником нормальных CFH, CFI, C3 и CFB, а также большого количества других функциональных белков. С помощью плазмообмена удаляются мутантные CFH, CFI, C3, CFB и анти-CFH антитела. Предварительное удаление плазмы при ЗПП предотвращает гиперволемию и риск развития сердечной недостаточности в результате введения большого количества СЗП.
Плазмотерапия эффективна в наибольшей степени при мутациях CFH. При мутациях MCP ее эффективность практически отсутствует, так как кодируемый белок экспрессируется на клеточных мембранах, то есть в твердой фазе, а не в циркуляции.
Предпочтительным является мембранный плазмаферез с объемом замещения 50-60 мл на кг массы тела. Альтернативный вариант - инфузии СЗП в объеме 10-20 мл/кг.
Экулизумаб
Терапевтический подход к аГУС был радикально усовершенствован с открытием и внедрением в клиническую практику экулизумаба - гуманизированного моноклонального антитела к С5-фракции терминальной стадии каскада комплемента. Препарат предотвращает расщепление С5, ведущее к образованию провоспалительного С5а и протромботического С5Ь-9 компонентов, тем самым устраняя их патогенное действие. К настоящему моменту опубликованы результаты лечения экулизумабом более 189 пациентов с аГУС; препарат одобрен во многих странах, в том числе в России.
Дополнительное введение препарата рекомендуется при сочетанном применении плазмафереза, так как последний удаляет часть препарата из циркуляции. С учетом единичных сообщений о риске развития менингококкового менингита на фоне применения экулизумаба рекомендуется предварительная вакцинация и/или профилактическое применение антибиотиков.
В опубликованных результатах контролируемых исследований продемонстрирована быстрая ликвидация активности гемолиза (в среднем за 7-14 дней) и признаков активной ТМА у 88% больных с гематологической ремиссией на протяжении всего курса лечения у большинства пациентов. Отмечено повышение скорости клубочковой фильтрации в среднем на 32 мл/1,73 м2 в мин от исходного с наибольшей выраженностью при раннем начале лечения. У детей повышение скорости клубочковой фильтрации было более выраженным (64 мл/1,73 м2 в мин). В ряде случаев наблюдали медленное улучшение почечной функции (на протяжении 2 лет). Большинство пациентов избавились от потребности в диализе.
При сравнении групп больных, получавших и не получавших экулизумаб, отмечена достоверная разница в количественном отношении достигших терминальной стадии ХПН к 1 году наблюдения (25 и 63%, соответственно).
При патогенетической обоснованности пожизненной терапии у носителей мутаций генов системы комплемента длительность терапии экулизумабом остается дискутабельной. В единичном сообщении об отмене экулизумаба у 10 взрослых больных у троих отмечены рецидивы ТМА с прогрессирующим снижением почечной функции.
Поддерживающая терапия
При вариантах аГУС, опосредованных антителами к CFH, помимо терапии экулизумабом, эффективность которой подтверждена, возможно использование иммуносупрессивной терапии. Описаны положительные результаты в отношении гематологических изменений и показателей функции почек на фоне применения пульсовых введений циклофосфамида в дозе 0,5 г/1,73 м2, кортикостероидов и ритуксимаба. Положительная клиническая динамика сопровождалась снижением титра антител к CFH. Для поддерживающей терапии наряду с кортикостероидами применялся микофенолата мофетил.
Профилактика инфекций
Большинство эпизодов аГУС запускаются с помощью инфекций, что обусловливает необходимость эрадикации хронических очагов аденоидной, тонзиллярной и зубной инфекции. У отдельных больных рецидивы отмечены после вакцинации. Тем не менее польза иммунизации существенно превалирует над риском. Мы рекомендуем проведение всех вакцинаций, включая противогриппозную.
Трансплантация почки при aГУС
Среди детей с потребностью в трансплантации почки, возникшей в исходе перенесенного ГУС, доля больных с атипичным вариантом может достигать половины. Риск возврата аГУС сразу после трансплантации чрезвычайно высок у пациентов с мутациями CFH (~80%), CFI и С3 (> 50%). Трансплантация проведена всего 3 пациентам с мутацией CFB: все потеряли почки в результате возвратного аГУС.
Поскольку трансплантированная почка не содержит мутированного MCP-белка, вероятность возврата аГУС при этих мутациях очень мала. Большинство больных при возврате аГУС теряют почки менее чем через 1 год. Другой причиной потери почки у детей является тромбоз.
Лишь у единичных пациентов удалось предотвратить возвратный аГУС путем проведения сеансов ЗПП до операции и в посттрансплантационном периоде. Более оптимистичные перспективы связаны с использованием экулизумаба в до- и послеоперационном периоде трансплантации. Имеются сообщения о 13 пациентах с потерей предыдущего трансплантата, у которых введение экулизумаба за несколько часов до пересадки и в течение 24 ч после нее с постепенным переходом на стандартный режим лечения способствовало предотвращению отторжения и возврата ТМА.
Поскольку CFH, так же, как и CFI, CFB и C3, синтезируются в печени, комбинированную трансплантацию печени и почки либо изолированную трансплантацию печени в случае сохранной функции почек можно рассматривать как вариант терапии. Однако, предварительные результаты показали, что данный метод уступает по эффективности применению экулизумаба.
Заключение
Гемолитико-уремический синдром представляет собой серьезную терапевтическую проблему в педиатрии и детской нефрологии, являясь одной из ведущих причин острой почечной недостаточности с потенциальной трансформацией в терминальную хроническую почечную недостаточность в различные сроки от начала заболевания.
Несмотря на то, что наиболее распространена STEC-ассоциированная форма ГУС с типичной диарейной продромой, требуется тщательное подтверждение инфекционной этиологии для того, чтобы в максимально ранние сроки исключить атипичный ГУС и ГУС, связанный с пневмококковой инфекцией.
В отношении STEC-ГУС (типичного) рекомендуется адекватная симптоматическая терапия со своевременным подключением диализа при необходимости. Прогноз при этом в основном зависит от продолжительности анурического периода и сопутствующих повреждений ЦНС.
Атипичный ГУС чаще всего имеет в основе генные мутации, приводящие к дисфункции каскада комплемента с неконтролируемой активацией альтернативного пути. При общем неблагоприятном прогнозе этой склонной к рецидивированию формы перспективным является лечение экулизумабом, блокирующим терминальные компоненты каскада комплемента.
А.Н. Цыгин, Т.В. Вашурина, Т.В. Маргиева, П.В. Ананьин,
А.М. Мазо, А.А. Пушков, К.В. Савостьянов
Гемолитико-уремический синдром, который известный многим специалистам как болезнь Гессера, может проявляться в виде острого гемоколита, спровоцированного микроангиопатической анемией, или же почечной дисфункцией. Согласно статистике, этот недуг встречается среди малышей в возрасте от 1 до 4 лет в 2-3 случаях на 100 000 в год. Гемолитико-уремический синдром у детей от 4-х и до 18 лет проявляется в 1-2 случаях на 100 000. Полное или частичное восстановление функции почек наблюдается только в 70% случаях. При наличии наследственной или спорадической болезни Гессера, прогноз, как правило, плачевный: в 25% - летальный исход, в 50%случаев может происходить отек головного мозга.
У маленьких детей грудного возраста этот недуг проявляется как четко приставленное заболевание. Гемолитико-уремический синдром у взрослых может провоцировать различные симптомы.
Характеристика
Сегодня мнения большинства докторов сходятся в том, что болезнь Гессера характеризуется поражением организма в трех направлениях. Как уже выше упоминалось, гемолитико-уремический синдром может проявляться в виде:
- Гемолитической анемии. Начинается распад .
- Тромбоцитопении. Может возникать множество кровотечений.
- Уремии. Проявляется острая почечная недостаточность.
Как правило, гемолитико-уремический синдром у детей выражена уремией, которая со временем проходит. После выздоровления, малышам необходимо регулярно проходить особую поддерживающую терапию, для того, чтобы избежать осложнений.
У детей постарше, ремиссия вряд ли наступит без специального лечения. В некоторых случаях, гемолитико-уремический синдром может провоцировать поражения . В результате этого, болезнь еще больше усугубляется.
Причины
К большому сожалению, на сегодня, специалисты не могут, точно назвать основной причины возникновения недуга Гессера, который поражает множество участков организма.
Мнения многих специалистов сошлось в том, что болезнь Гессера может быть спровоцирована как , так и неинфекционными возбудителями. В первом случаи, внутрь нашего организма попадают специфические бактерии, которые могут провоцировать различные расстройства желудка. Например, диарею. В ответ, реагирует наша иммунная система вследствие чего, и возникают симптомы заболевания Гессера.
Иные случаи, которые не связанные с попаданием этих бактерий внутрь нашего организма относятся к неинфекционным. Как правило, симптомы гемолитико-уремический синдрома могут возникнуть как побочный эффект от некоторых препаратов, иногда при беременности или проявиться как сопутствующий недуг какого-то другого заболевания. Также заболевания может передаваться и наследственно.
В медицине принято выделять две формы прохождения болезни Гессера:
- Типичное развитие. Характеризуется расстройствами желудка. Как правило, такая форма течения спровоцирована кишечной палочкой (Escherichia coli), анабиозом (Shigella dysenteriae), бактерия Френкеля (Streptococcus pneumoniae).
- Атипичное развитие. Диарея для этого случая – не характерна. Развития болезни спровоцировано приемом противоопухолевых лекарств, разных иммунодепрессантов. Также атипическое развитие болезни Гессера, может проявиться во время беременности или же после нее. Симптомы гемолитико-уремического синдрома при атипичной форме проявляются и больных на ВИЧ, склеродермию и других. Как правило, этот недуг свидетельствует об осложнении основного заболевания. Проявляется в виде кровавого поноса, . По статистике атипичная форма болезни встречается достаточно редко, только у 10% от всех случаев.
Патогенетические свойства
Что же происходит после того как внутрь организма попала бактерия? Как иммунная система реагирует на раздражитель? Давайте поэтапно рассмотрим, что и зачем происходит внутрь нашего организма.
После попадания в организм кишечная палочка или бактерия Френкеля может провоцировать образования огромного количества веротоксина. В результате его накопления и размножения в желудке или толстой кишке может возникать диарея. Происходит деформация эндотелиальных клеток. Вследствие чего токсин попадает в печень, где происходит он метаболизируется.
Затем болезнь, словно по мишеням внедряется и в другие органы. Как правило, печень или легкие. В результате патологического процесса происходит свертывания крови в полости сосудов, тромбоциты соединяются в кучки, и происходит агрегация. На этом фоне их количество значительно падает.
Опасность таких процессов заключается в том, что может возникнуть в поврежденных или даже здоровых органах, которая приводит к опасным состояниям больного. В результате свертывание крови в сосудах, капилляры сужаются, и возникает нарушения нормальной работы почек. Под угрозой также могут быть легкие, сердце, печень или даже мозг. Это спровоцировано сбоем прохождения эритроцитов по нитям у поврежденных сосудов.

Прогресс атипичной формы болезни Гессера происходит из-за нарушения работы системы комплимента, которая входит в состав иммунной системы и защищает наше тело от чужеродных бактерий.
Когда недуг поражает наш организм, происходит дисфункция этой системы, проявляется значительное повреждение эндотелия. В результате чего иммунная система начинает уничтожать здоровые органы. Из-за беспрерывной активации тромбоцитов возникает тромбообразование и сбой в работе поврежденных органов.
Симптомы и лечение гемолитико-уремического синдрома у детей и взрослых значительно отличается. Это можно объяснить тем, что у ребятишек 4-10 лет недуг выражается в типичной форме, а у взрослых, как правило, прогрессирует как атипичная.
На начальных стадиях у больных наблюдается острая диарея, которую вызывает кишечная палочка. Не взирая на лечения болезни, самочувствие больного не улучшается. У детей поднимается температура тела, и присутствует чувство . Их кожа приобретает бледноватый оттенок, в некоторых случаях - желтоватый.
У ребенка значительно уменьшается количество мочи. В результате чего возникает сильный отек в районе век или голеней. Появляется сбой в работе центральной нервной системе. Могут . Затем, под воздействия этого патологического процесса, втягиваются и остальные органы. Необходимо, как можно быстрее, провести специальную терапию.
В некоторых случаях, гемолитико-уремический синдром может пройти самостоятельно, без дальнейшего проявления, и полного излечения почек. Как правило, это может, происходит у маленьких детей или младенцев. Но все же не стоит забивать о лечении, ведь запущенная форма болезни может привести к непоправимому исходу.
Как правило, атипическое протекания гемолитико-уремического синдрома проявляется серьезными симптомами и бурным течением. После диареи и общей слабости на протяжении 6 дней наблюдается значительное уменьшение оттока мочи, неврологические осложнение, гипертензия, и т.д.
В некоторых случаях. недуг может поражать сердечно-сосудистую систему или даже желудочно-кишечную, провоцируя аритмии, . Но практически всегда болезнь образовывает дисфункцию почек, и, невзирая на лечения, в большинстве случаев, развивается почечная недостаточность.

Диагностика
Диагностику проводят, опираясь на и мочи, которые сопоставляют из выявленными симптомами.
Опасаться стоит, если у вас выявили:
- или же белок.
- Гемолитическую анемию.
- Уремию.
- Патогенные бактерии в кале.
Параллельно к этому специалисты изучают общее состояния больного. Сложность заключается в дифференциации атипичной формы недуга ввиду того, что может проявляться смешанность симптомом и других болезней.
Лечение
Независимо от формы развития болезни, необходимо провести специальную поддерживающую терапию. С ее помощью происходит сохранения количества эритроцитов в крови, поддерживаются показатели электролитов. После проведенной терапии приходит в норму водный баланс в организме, исчезают судороги и гипертензия.
В тяжелых случаях доктор может назначить гемодиализ, выписать много мочегонных препаратов и прописать специальную высококалорийную диету с минимальным количеством соли.
Профилактика
Профилактика гемолитико-уремический синдрома возможна только для типичной формы. В первую очередь нужно придерживаться правил личной гигиены. Не рекомендуется купаться в сомнительных водоемах. При готовке мясных продуктов необходимо придерживаться технологии их обработки.
Прогноз ГУС
Делать положительный прогноз при гемолитико-уремического синдрома можно только после проведенной терапии. Как правило, для маленьких детей, в которых болезнь спровоцирована кишечной бактерией, - прогноз х, в большинстве случаев, хороший. Но, тем не менее, необходимо контролировать показатели артериального давления и вовремя сдавать анализы мочи, кала и крови.
У многих развитых странах выздоровления у пациентов (старше 18 лет) с типичной формой, можно наблюдать у 90% случаев. Прогноз при атипичных формах все же остается негативным. Если болезнь передалась наследственно, то летальный исход наступает практически у 90% случаев.
К большому сожалению, пациенты, выздоровевшие после гемолитико-уремического синдрома, умирают на протяжении 2-3 лет в 80%случаев из-за проблем с почками.
(ГУС, синдром Гассера)
ГУС – объединяет гетерогенную группу заболеваний и характеризуется приобретенной гемолитической анемией, тромбоцитопенией и острой почечной недостаточностью (ОПН).
В возникновении ГУС участвуют эндогенные и экзогенные факторы. В зимне-весенний период ГУС вызывается респираторными вирусами (А 2 , RS, аденовирусы и др.), в летний период преобладают кишечные инфекции, вызванные Е. coli, стафилококком. У детей раннего возраста имеет значение проведение прививок (АКДС и др.).
У детей старшего возраста ГУС встречается при тяжелых бактериальных инфекциях, коллагеназах, укусах змей и др.
Клиническая диагностика:
1.Анемический синдром – к бледности присоединяется незначительная желтушность.
2. Геморрагический синдром появляется на 2-4 день, от единичных петехиальных кровоизлияний до обширных экхимозов, повторных носовых кровотечений.
3. Почечный синдром: гематурия, протеинурия, олигоанурия, признаки ОПН в начале без отеков (потери жидкости со стулом, рвотой, путем перстерации), артериальная гипертензия чаще преходящая.
4. Неврологические признаки: судорожный синдром, сопор, кома.
5. Сердечно-сосудистые нарушения: тахикардия, приглушенность тонов, систолический шум, экстрасистолия с последующей сердечно-сосудистой недостаточностью.
6. Компенсаторно усиливается функция желудочно-кишечного тракта и потовых желез (холодный пот, гастроэнтеролит).
Лабораторная диагностика:
1. В периферической крови – анемия, шизоциты, микросфероциты, нормобласты, лейкоцитоз со сдвигом влево, тромбоцитопения.
2. Увеличиваются трансаминазы, непрямой билирубин > 20 ммоль/л, ретикулоциты > 15 0 / 00 .
3. В гемостазиограмме в начале гипер-, затем гипокоагуляция.
4. Признаки ОПН – в сыворотке крови нарастают креатинин, мочевина, остаточный азот, внутриклеточные электролиты (К, Mg, P). Снижаются внеклеточные электролиты (Na, Cl). Развивается метаболический ацидоз. В моче – гематурия, протеинурия.
Лечение ГУС
Зависит от тяжести поражения почек и периода заболевания, проводится в отделениях реанимации или интенсивной терапии.
I период генерализованных реакций : имеются большие потери жидкости, солей (гиповолемия), функциональные нарушения почек.
1. Ввести изотонический раствор хлорида натрия (или 5 % раствор альбумина, инфузол) – 20 мл/кг в/в капельно 15-45, затем 5-10 мг/кг (ЦВД – 4-6). При отсутствии рвоты 60 % жидкости назначают внутрь.
2. При резкой артериальной гипотензии ввести 1 % раствор допамина (2-4,5 мкг/кг/мин) в/в капельно.
3. Для воздействия на инфекционный процесс назначить нетоксичные антибиотики.
4. Проводить коррекцию электролитов.
5. При расстройстве периферического кровотока рано назначить сосудорасширяющие препараты (нитропруссид натрия (1-8 мг/кг/мин), перлин ганит 1-2 мг/сут.
6. Точно учитывать почасовой диурез путем катетеризации мочевого пузыря.
II Оигоанурическая фаза
Показания к гемо или перитонеальному диализу являются:
дефицит оснований (В,Е) > 10 ммоль/л;
анурия более суток, олигурия > 36-48 час.;
мочевина в крови > 24 ммоль/л;
креатинин крови > 350 мкмоль/л;
гиперкалиемия > 6,5 ммоль/л;
Продолжить симптоматическую терапию:
Коррекция водно-электролитных расстройств.
При олигурии объем жидкости для инфузии составляет около 1500 мл/м 2 /сут. При анурии с развитием отечного синдрома около 400-500 мл/ м 2 /сут.
2. Метаболический ацидоз компенсируется введением 4 % раствора гидрокорбаната из расчета: мл = ВЕ х масса тела (кг) х 0,33.
3.При отсутствии диуреза и повышении внутричерепного давления ввести в/в капельно 20 % раствор маннитола (1 г/кг), можно сочетать со свежезамороженной плазмой (2 мл/кг), ввести 2 % раствор лазикса (1-4 мг/кг) в/в струйно.
4. При гипертензии вводят ингибиторы АПФ (капотен, каптоприл, анаприл 1-6 мг/кг/сут), апрессин 0,1-0,5 мг/кг или -адреноблокаторы (празозин, кардура) при неэффективности нитропруссид натрия (1-8 мкг/кг/мин) или нитроглицерин (0,5-1 мкг/кг/мин).
При высоком диастолическом давлении (> 100 мм рт. ст.) – нифедипин (0,25-0,5 мк/кг), адреноблокаторы (анаприлин, атенонол, талинолол, лабеталол 1-3 мг/кг/час).
5. Для борьбы с сердечной недостаточностью (допамин, добутамин,допексамин).
6. При отеке легких – ИВЛ, эуфиллин 0,1-0,15 мл/кг, кортикостероидные гормоны 10-30 мг/кг, добутамин.
7. При анемии (Нв<80 г/л) - трансфузия эритромассы или отмытые эритроциты 3-5 мл/кг.
8. При судорогах: оксибутират Na (30-50 мг/кг/час), тиопентал (1,5-3 мг/кг/час).
При энцефалопатии: сибазон, кавинтон, сермион, ноотропы.
9. При гиперкоагуляции гепарин 200-400 ед/кг/сут, фраксипарин, курантил (5 мг/кг/сут), трентал (5-15 мг/кг/сут), СЗП (10-30 мл/кг/сут).
10. Диета 70-100 ккал/кг/сут, при парентеральном питании 50-60 ккал/кг/сут.
В период восстановления диуреза (III стадии) проводить возмещение жидкости и коррекцию электролитов (К, Mg, Na).
В четвертую стадию, период выздоровления , постоянно следить за диурезом, плотностью мочи, весом ребенка.
Проводить лечение основного заболевания.
Гемолитико-уремический синдром в некоторых медицинских справочниках называют синдромом Гассера по имени американского физиолога Герберта Спенсера Гассера, немало лет посветившего изучению этой тяжелой болезни с неблагоприятным прогнозом. В большинстве случаев это заболевание диагностируется у детей в грудничковом возрасте, при тяжелом течении показана ИВЛ и диализ.
Гемолиз - это разрушение эритроцитов с выходом гемоглобина в окружающую эритроциты среду. Гемолиз бывает внутриклеточным, внутрисосудистым, постгепатитным, внутриаппаратным.
Гемолитико-уремический синдром (ГУС, синдром Гассера) - патологическое состояние, включающее триаду симптомов: микро-ангиопатическую гемолитическую анемию, тромбоцитопению и поражение почек с развитием острой почечной недостаточности (ОПН). ГУС - наиболее частая причина ОПН у детей.
Причины и классификация гемолитико-уремического синдрома
В большинстве случаев причиной синдрома является вирусная (Коксаки, Эхо, вирус гриппа) или бактериальная (шигеллы, сальмонеллы, кишечная палочка типа 0157, пневмококк) инфекция. Формирование синдрома может быть обусловлено токсическим воздействием лекарств (циклоспорин А). Чаще всего гемолитико-уремический синдром развивается у детей в возрасте от 2 мес. до 8 лет.
В развитии синдрома участвуют как экзогенные, так и эндогенные факторы. Происходит повреждение бактериальными токсинами и другими экзогенными ядами эндотелия мелких сосудов почек с последующей адгезией тромбоцитов, локальным внутрисосудистым свертыванием и сужением просвета сосудов. Эндогенные факторы вызывают агрегацию тромбоцитов, активацию комплемента или дефицит простациклина.
Следствием тромботической микроангиопатии становятся повышенное потребление тромбоцитов, их деструкция гемолиз острый и ускоренное разрушение в селезенке, деструкция эритроцитов, гемолиз и анемия. Поражение почек проявляется уменьшением клубочковой фильтрации, АГ и развитием кортикального некроза. Хотя главным органом-мишенью при ГУС являются почки, их изолированного поражения практически никогда не бывает.
Тромботическая микроангиопатия поражает кишечник, головной мозг, легкие, печень, сердце. В связи с этим заболевание часто характеризуется полиорганной недостаточностью с нарушением витальных функций организма. К этому присоединяются токсико-метаболические (как следствие уремии) и дистрофические (в результате предшествующих инфекций, например, язвенно-некротический колит, деструктивная пневмония, миоперикардит и др.) изменения. Иногда тяжелая форма гемолитико-уремического синдрома протекает без грубых морфологических нарушений.
Клиническая классификация ГУС основана на определении тяжести заболевания:
- Легкая форма (без анурии).
- Триада симптомов (анемия, тромбоцитопения, азотемия).
- Указанная триада, осложненная судорожным синдромом или артериальной гипертензией.
- Тяжелая форма.
- Триада в сочетании с анурией длительностью более суток.
- Указанная триада на фоне анурии в сочетании с артериальной гипертонией и/или судорожным синдромом.
Симптомы и диагностика гемолитико-уремического синдрома у детей
Клиническая картина в раннем возрасте развивается остро - через 5-8 дней после кишечной, гриппозной или другой вирусной инфекции, а также при приеме некоторых лекарств, после укусов змей. Внезапно ухудшается состояние, возникают выраженная бледность, субиктеричность кожных покровов, гепатомегалия. Также симптомом гемолитико-уремического синдрома является петехиальная сыпь на коже.
К этому времени уже имеется почечная недостаточность с олиго- или анурией, первые признаки которой часто просматриваются. Нередко бывают судороги и помрачение сознания, быстро развивается угрожающая жизни гипергидратация (отек мозга и/или легких, гипертензия, кардиомегалия).
Гемоглобин падает до 50-80 г/л, снижаются гематокрит, число тромбоцитов (до 20,0-50,0 109/л), определяются продукты деградации фибрина, повышаются уровни мочевины и креатинина в крови, возникают гиперкалиемия, гипонатриемия, метаболический ацидоз; проба Кумбса отрицательная. Обычно выявляют небольшую гематурию и протеинурию.
Программа исследований при диагностике гемолитико-уремического синдрома:
- Общий анализ крови с подсчетом числа тромбоцитов, ретикулоцитов и лейкоцитарной формулой (обратить внимание на наличие фрагментоцитов);
- Анализ мочи и контроль за диурезом;
- Контроль КОС;
- Коагулограмма с определением антитромбина III, продуктов деградации фибриногена, растворимого фибрина, тромбинового времени, парциального тромбопластинового времени, протромбинового времени Квика;
- Определение группы крови, реакция Кумбса;
- Биохимический анализ крови (определение уровня мочевины, креатинина, электролитов, комплемента, трансаминаз, лактатдегидрогеназы, билирубина, белка и белковых фракций, иммуноглобулинов);
- Бактериологическое исследование кала, мочи, мазка из зева, многократные исследования гемокультуры;
- УЗИ почек.
Лечение гемолитико-уремического синдрома у детей: показания к ИВЛ и диализу
Перед началом курса лечения гемолитико-уремического синдрома проводят катетеризацию мочевого пузыря с целью точного определения почасового диуреза, в дальнейшем ребенка взвешивают каждые 6 ч.
Выделяют патогенетические и симптоматические лечебные мероприятия. К симптоматическим мероприятиям относят коррекцию анемии, сердечной и легочной недостаточности, проведение антибактериальной и гипотензивной терапии, лечение энцефалопатии.
Последовательный терапевтический подход к тяжелой артериальной гипертонии может быть следующим: если диастолическое давление превышает 95 мм рт. ст. у детей до 1 года или 110 мм рт. ст. у детей в возрасте 1-3 лет, показано немедленное снижение АД.
Показаниями к ИВЛ являются:
- Судорожный синдром, сопровождающийся нарушением вентиляции;
- Мозговая кома;
- ДН как центрального, так и обструктивного генеза.
К патогенетическим лечебным мероприятиям относятся:
- Назначение дезагрегантов;
- Коррекция антиоксидантного статуса;
- Гепаринотерапия;
- Коррекция недостаточности антитромбина III проводят переливание свежезамороженной плазмы (СЗП);
- Плазмаферез с целью удаления одних и восполнения других факторов, усиления фибринолитических свойств крови.
При лечении гемолитико-уремического синдрома у детей назначают внутривенную дезинтоксикационную терапию (Реополиглюкин , 5-10% раствор глюкозы) из расчета 50-60 мл/кг массы тела. С целью улучшения микроциркуляции вводят трентал в дозе 5 мг/кг и допамин - по 3-4 мкг/(кг-мин).
Проводят коррекцию ацидоза и нарушений водно-электролитного баланса. При атипичной форме гемолитико-уремического синдрома обменный плазмаферез делают на ранних сроках, в то время как при типичных формах, для которых характерен благоприятный исход, - только при тяжелых осложнениях со стороны ЦНС, легких.
Однако при легких формах (1-А) клинической рекомендацией по терапии гемолитико-уремического синдрома у детей является проведение дискретного плазмафереза в объеме 1А-3А объема циркулирующей плазмы (ОЦП) для восполнения дефицита плазменных факторов и активации фибринолитической активности плазмы.
При установлении диагноза «органическая почечная недостаточность» необходимо сразу начать диализ, не дожидаясь появления уремических осложнений. Наиболее доступный клинический критерий оценки органической ОПН - это анурия, т. е. отсутствие мочи более суток.
Показания к экстренному диализу:
- Анурия (<0,3 мл/кг/ч), несмотря на терапию Лазиксом ;
- Обеспечение адекватного питания и лечения больного.
- Олигурия, осложненная:
- Тяжелой неврологической симптоматикой;
- Гиперволемией с СН и/или отеком легких;
- Гиперкалиемией (> 7 ммоль/л);
- Некорригируемыми гиперфосфатемией, метаболическим ацидозом;
- Мочевина> 22-25 ммоль/л, уровень креатинина 250-300 (максимально 400) мкмоль/л или его быстрый прирост (на 44 мкмоль/л/сут. и более.
Применение Солириса при атипичном гемолитико-уремическом синдроме у детей
Первым и единственным препаратом, зарегистрированным для лечения атипичного гемолитико-уремического синдрома у детей, является экулизумаб (Солирис) - рекомбинантное гуманизированное моноклональное антитело, препятствующее вызываемому комплементом внутрисосудистому гемолизу.
|
Масса тела, кг |
Индукция |
Поддерживающая доза |
|
По 300 мг 1 раз в неделю |
300 мг на 2-й неделе, затем 300 мг каждые 3 недели |
|
|
По 600 мг 1 раз в неделю |
300 мг на 2-й неделе, затем 300 мг каждые 2 недели |
|
|
По 600 мг 1 раз в неделю в течение 2-х недель |
600 мг на 3-ей неделе, затем 600 мг каждые 2 недели |
|
|
По 600 мг 1 раз в неделю в течение первых двух недель |
900 мг на 3-ей неделе, затем 900 мг каждые 2 недели |
|
|
40 и более |
||
|
Пациентам старше 18 лет |
||
|
По 900 мг 1 раз в неделю в течение первых 4 недель |
1200 мг на 5-й неделе, затем 1200 мг каждые 2 недели |
Препарат Солярис повышает предрасположенность больного к менингококковой инфекции (ТТТ), поэтому минимум за 2 недели лечения Солярисом необходимо проведение вакцинации тетравалентной вакциной против менингококка.
В настоящее время из заместительной почечной терапии (ЗПТ) при лечении детей с ОПН применяют гемодиализ, продолженную вено-венозную гемодиафильтрацию (ПВВГДФ) и перитонеальный диализ. Гемодиализ является золотым стандартом ЗПТ.
 Однако при применении его у детей младшего возраста с ОПН часто встречаются определенные трудности, связанные с прерывистым характером процедуры (что не позволяет контролировать водный обмен ребенка в течение всех суток), сложностью в обеспечении сосудистого доступа для создания адекватного потока крови. Следуя этой рекомендации по лечению гемолитико-уремического синдрома у больных с ОПН, отдается предпочтение продолженным методам очищения, таким как ПВВГДФ.
Однако при применении его у детей младшего возраста с ОПН часто встречаются определенные трудности, связанные с прерывистым характером процедуры (что не позволяет контролировать водный обмен ребенка в течение всех суток), сложностью в обеспечении сосудистого доступа для создания адекватного потока крови. Следуя этой рекомендации по лечению гемолитико-уремического синдрома у больных с ОПН, отдается предпочтение продолженным методам очищения, таким как ПВВГДФ.
Этот метод достаточно эффективный, позволяющий проводить ЗПТ даже новорожденным и больным в крайне тяжелом состоянии, однако он дорог и еще мало распространен в педиатрии. Более доступным и простым методом ЗПТ является перитонеальный диализ.
Его недостаток - относительно низкий клиренс очищения по сравнению с гемодиализом и ПВВГДФ,но доступная цена, простота и непрерывность делают его эффективным методом для лечения детей раннего возраста с ОПН, особенно на ранних этапах заболевания.
Гемолитический криз
Гемолитический криз - синдром, возникающий вследствие острого массивного внутрисосудистого гемолиза эритроцитов.
 Развивается у больных с хронической приобретенной и врожденной гемолитической анемией под влиянием инфекций, травм, охлаждения, приема медикаментов, а также при поступлении в кровь гемолитических субстанций и переливании несовместимой крови.
Развивается у больных с хронической приобретенной и врожденной гемолитической анемией под влиянием инфекций, травм, охлаждения, приема медикаментов, а также при поступлении в кровь гемолитических субстанций и переливании несовместимой крови.
Клиническая картина. Легкая степень криза проявляется небольшой иктеричностью склер и кожных покровов, тяжелая - ознобом, лихорадкой, болью в области спины и живота, ОПН, желтухой, анемией.
Лечение. Противошоковые мероприятия, уменьшение интоксикации и стимуляция диуреза, предупреждение дальнейшего гемолиза, заместительная терапия.
В качестве противошоковых средств используют плазмозаменяющие растворы: полиглюкин, изотонический раствор натрия хлорида или раствор Рингера , производные гидроксиэтилкрахмала - до стабилизации АД. Если АД не стабилизируется, вводят допамин.
Препараты для лечения гемолитико-уремического синдрома
Лекарства, влияющие на свертывание крови, подразделяют на две группы: гемостатические и антитромботические. Препараты этих групп действуют в противоположном направлении на три основных процесса: агрегацию тромбоцитов, образование фибринных тромбов и их лизис. Антитромботические средства делят на три группы: антикоагулянты, фибринолитики и антиагреганты.
 Антикоагулянты - вещества, нарушающие образование фибринных тромбов. Они могут быть прямыми (Гепарин, Гирудин
), непосредственно влияющими на процесс свертывания крови (in vitro и in vivo), и непрямыми (неодикумарин, синкумар, фенилин), дающими эффект только после введения в организм.
Антикоагулянты - вещества, нарушающие образование фибринных тромбов. Они могут быть прямыми (Гепарин, Гирудин
), непосредственно влияющими на процесс свертывания крови (in vitro и in vivo), и непрямыми (неодикумарин, синкумар, фенилин), дающими эффект только после введения в организм.
Фибринолитические средства расщепляют фибрин, приводя к рассасыванию фибринных тромбов. Их подразделяют также на прямые (фибринолизин, профибринолизин) и непрямые (стрептокиназа, урокиназа).
Антиагреганты - вещества, подавляющие процесс агрегации тромбоцитов (пептоксифиллин, ксантинола никотинат, эуфиллин).
Гепарин - естественный противосвертывающий фактор организма. Вместе с фибринолизином входит в состав физиологической антисвертывающей системы. Это антикоагулянт прямого действия, т. е. он влияет непосредственно на факторы свертывания, находящиеся в крови (XII, XI, X, IX, VII, II).
 Блокирует биосинтез тромбина, уменьшает агрегацию тромбоцитов.
Блокирует биосинтез тромбина, уменьшает агрегацию тромбоцитов.
Гепарин действует быстро, но кратковременно. Вводят внутривенно, внутримышечно и подкожно в дозе 100-300 ЕД/(кг сут) для предотвращения или ограничения тромбообразования. Введение производят под контролем свертывания крови, подбирая дозу таким образом, чтобы время свертывания было в 2-2,5 раза выше нормы. За 3-4 дня до отмены гепарина суточную дозу постепенно уменьшают.
Осложнение гепаринотерапии - геморрагический синдром.
- Побочные явления: аллергические реакции.
- Противопоказания: геморрагические диатезы и другие заболевания, сопровождающиеся замедлением свертывания крови; повышенная проницаемость сосудов; кровотечения.
- Форма выпуска: флаконы по 5 мл с активностью 5000; 10 000 и 20 000 ЕД в 1 мл.
Ксантинола никотинат (теоникол, компламин) расширяет периферические сосуды и улучшает периферическое коллатеральное кровообращение, уменьшает агрегацию тромбоцитов. Назначают внутривенно, внутримышечно и внутрь. Внутривенно вводят очень медленно по 0,5-1 мл, внутримышечно по 0,5-1 мл 1-3 раза в день, внутрь - по 0,05-0,075 г 3 раза в день после еды.
- Побочные явления: покраснение кожи лица и шеи, ощущение тепла, давления в голове, слабость, головокружение.
- Противопоказан при сердечной недостаточности ПБ-Ш степени, острых геморрагиях.
- Формы выпуска: таблетки (драже), содержащие 0,15 г препарата; 15 % раствор в ампулах по 2 мл (0,3 г) и 10 мл (по 1,5 г - для капельного введения).
 Пентоксифиллин (трентал)
оказывает сосудорасширяющее действие, способствует улучшению снабжения тканей кислородом, тормозит агрегацию тромбоцитов, уменьшает вязкость крови. Назначают внутривенно, внутриартериально, внутрь. Внутривенно вводят 0,05-0,1 г в 200 мл изотонического раствора натрия хлорида или в 5% растворе глюкозы. Внутрь принимают, начиная с 0,1 г 3 раза в день после еды (не разжевывая). После наступления эффекта дозу уменьшают.
Пентоксифиллин (трентал)
оказывает сосудорасширяющее действие, способствует улучшению снабжения тканей кислородом, тормозит агрегацию тромбоцитов, уменьшает вязкость крови. Назначают внутривенно, внутриартериально, внутрь. Внутривенно вводят 0,05-0,1 г в 200 мл изотонического раствора натрия хлорида или в 5% растворе глюкозы. Внутрь принимают, начиная с 0,1 г 3 раза в день после еды (не разжевывая). После наступления эффекта дозу уменьшают.
Побочное действие при применении внутрь: диспепсические явления, тошнота, головокружение, покраснение лица; при парентеральном введении - понижение АД.
- Противопоказания: массивные кровотечения.
- Формы выпуска: таблетки по 0,1 г; 2% раствор в ампулах по 5 мл (0,1 г в 1 ампуле).
Стрептокиназа - фермент, обладающий тромболитической активностью, что связано со способностью стрептокиназы активировать содержащийся в крови плазминоген и превращать его в расщепляющий фибрин фермент плазмин.
Применяют для восстановления проходимости тромбированных кровеносных сосудов. Вводят внутривенно капельно 30 000-50 000 ЕД, растворив в изотоническом растворе натрия хлорида или 5 % растворе глюкозы.
- Противопоказания , геморрагические диатезы, повышение АД, сахарный диабет, язвенная болезнь желудка и двенадцатиперстной кишки.
- Форма выпуска: ампулы по 250 000 и 500 000 ЕД.
Фибринолизин (плазмин) - фермент, образующийся при активации содержащегося в крови плазминогена; физиологический компонент естественной противосвертывающей системы организма.
 В основе действия фермента лежит его способность растворять нити фибрина. Его применяют для лечения заболеваний, сопровождающихся внутрисосудистым выпадением сгустков фибрина и образованием тромбов. В терапевтических дозах фибринолизин не влияет на процесс свертывания крови, поэтому его следует применять в комбинации с антикоагулянтами (гепарином).
В основе действия фермента лежит его способность растворять нити фибрина. Его применяют для лечения заболеваний, сопровождающихся внутрисосудистым выпадением сгустков фибрина и образованием тромбов. В терапевтических дозах фибринолизин не влияет на процесс свертывания крови, поэтому его следует применять в комбинации с антикоагулянтами (гепарином).
Вводят внутривенно капельно. Фибринолизин, находящийся в сухом виде во флаконе, растворяют в стерильном изотоническом растворе натрия хлорида из расчета 100-160 ЕД препарата в 1 мл. Растворы готовят непосредственно перед употреблением. Суточная доза фибринолизина - 5000-10 000 ЕД. Препарат применяют под контролем показателей свертывающей системы крови.
- Побочные действия: гиперемия лица, боль по ходу вены, озноб, повышение температуры, появление крапивницы, боли в животе и за грудиной.
- Противопоказания: геморрагические диатезы, кровотечения, язвенная болезнь желудка и двенадцатиперстной кишки, нефрит, туберкулез, высокое АД.
- Форма выпуска: флаконы по 10 000, 20 000, 30 000 и 40 000 ЕД.
Эуфиллин оказывает спазмолитическое и диуретическое действие, тормозит агрегацию тромбоцитов, понижает не только сопротивление кровеносных сосудов, но и давление в системе легочной артерии.
Назначают внутривенно (2,4% раствор), внутримышечно (24% раствор), внутрь.
Суточная доза - 3 мг/(кг сут).
- Побочное действие: при внутривенном введении - головокружение, головная боль, сердцебиение, тошнота, рвота, судороги, понижение АД; при приеме внутрь - диспепсические явления.
- Противопоказания: резкое понижение АД, пароксимальная тахикардия, экстрасистолия.
- Формы выпуска: таблетки по 0,15 г; 2,4 и 24% растворы в ампулах.
(Пока оценок нет)
Полезные статьи
Гемолитико-уремический синдром (болезнь Гассера) является одним из немногих приобретенных заболеваний,
встречающихся обычно в детской возрастной группе. Вероятно, данный синдром охватывает целый спектр заболеваний, варьируя от
классической саморазрешающейся формы у детей грудного возраста до более грозной и часто фатальной тромбоцитопенической
тромбо-гемолитической пурпуры (болезнь Мошкович), наблюдаемой у взрослых. Для этих заболеваний характерна общая триада:
острая почечная недостаточность с олигурией, гемолитическая анемия и тромбоцитопения. Однако заболевания, протекающие под
прикрытием болезни Гассера, могут также иметь ту или иную степень артериальной ангиопатии, гипертензии и поражения ЦНС,
кишечника или печени.
Хотя общий знаменатель, который связывал бы различные формы болезни или служил базисом для их классификации или
выбора лечения, еще не найден, некоторые из недавних основных научных достижений помогают проникнуть в суть данной
проблемы.
Этиология и патогенез.
Повреждение эндотелиальных клеток играет центральную роль в патогенезе почечных поражений, гемолиза и
тромбоцитопении. Повреждение эндотелия может ограничиваться капиллярными мембранами, но не исключено и вовлечение
артерии. Такое разграничение может помочь в более детальном классифицировании и прогнозировании, а также объяснении природы
большой группы симптомов. Механизм повреждения эндотелия в настоящее время является объектом споров и научных
исследований. Идентифицировано, по меньшей мере, 5 агентов, способных оказывать повреждающее действие на эндотелиальные
клетки при болезни Гассера: эндотоксин, нейраминидаза, эстроген - содержащие контрацептивы, истинный цитотоксин (веротоксин),
продуцируемый некоторыми штаммами кишечной палочки, и токсин, вырабатываемый бактериями Григорьева - Шиги. Во время
эпидемий Гемолитико - уремического синдрома было выделено несколько видов вирусов, чаще всего Коксаки, ECHO и аденовирус,
но без четкой связи с заболеванием. Более убедительным является развитие данного синдрома у больных с инфекциями,
вызванными шигеллой, сальмонеллой, цитотоксической, кишечной палочкой или пневмококком. В настоящее время внимание
исследователей сосредоточено на веротоксин - продуцирующей E. Coli (VTEC O157:H7) и Shigella disenteriae type1. Болезнь Гассера
может также наблюдаться у женщин, принимающих гормональные контрацептивные средства, содержащие эстроген, или у
беременных. Некоторые исследования отмечают высокую частоту возникновения Гемолитико - уремического синдрома при
использовании ампициллина для лечения дизентерии вызваной Shigella disenteriae type1.
Повреждение эндотелиальных клеток затрагивает и приводит в действие целый ряд вторичных процессов: локальное
внутрисосудистое свертывание крови, слипание тромбоцитов и агрегацию тромбоцитов. У большинства больных отмечаются
появление продуктов распада фибрина в циркулирующей крови и тромбоцитопения. Наличие циркулирующих мономеров фибрина
(указывает на продолжающееся внутрисосудистое свертывание) определяется у меньшинства больных; предполагается, что у
большинства больных к моменту обращения за медицинской помощью внутрисосудистое свертывание прекращается. Фактически
во всех случаях наблюдается отложение фибрина в сосудах почечных клубочков, что приводит к сужению или облитерации
просвета капилляров, снижению скорости клубочковой фильтрации и уменьшению перфузии почечных канальцев с их вторичной
дисфункцией или некрозом. У большинства больных с болезнью Гассера возникает тромбоцитопения, которая обусловлена как
возросшим потреблением тромбоцитов, так и сокращением периода их жизни. Более того, циркулирующие в крови тромбоциты
неполноценны; в них меньше серотонина, аденозиндифосфата, бета-тромбоглобулина и снижена способность к агрегации, что
предполагает их истощение. Значение этих факторов и развитии поражений почек или ЦНС не установлено, однако при
возникновении у больного геморрагических осложнений тромбоцитопении следует помнить о сниженной функции тромбоцитов.
Другим удивительным фактом является очевидное снижение продукции простациклина (PGJ2) эндотелиальными клетками у
некоторых больных с болезнью Гассера и членов их семей. Простациклин является эндогенным ингибитором агрегации
тромбоцитов. Это предполагает, что у некоторых людей имеется генетический дефект, который может привести к болезни Гассера,
если этиологический фактор вызовет повреждение сосудов. Такой механизм может быть причиной заболевания в наблюдавшихся
семейных случаях.
У больных с гемолитико-уремическим синдромом при снижении гематокрита до 10-15 % быстро возникает гемолитическая
анемия. Реакция Кумбса, как правило, бывает отрицательной, а осмотическая резистентность и ферменты эритроцитов находятся в
пределах нормы. Таким образом, анемия у них обусловлена, вероятно, микроангиопатией, приводящей к повреждению эритроцитов
во время их продвижения по измененной капиллярной сети. Выживаемость перелитых с кровью клеток также снижена. Главной
причиной повреждения эритроцитов является механическая травма, чему в ряде случаев способствует измененный
антиоксидантный статус эритроцитов.
Наконец, как показывают проведенные за последнее десятилетие исследования, при болезни Гассера в процесс вовлекаются и
другие органы, особенно печень и мозг, а также сердце и легкие, возможно, вследствие все той же микроангиопатии,
обсуждавшейся выше. Судороги, ступор или кома нередко бывают осложнением гемолитико-уремического синдрома, и их нельзя
объяснить только гипертензией, вызванной почечной недостаточностью, или нарушением электролитного баланса. Тем не менее,
патологические изменения в мозге детей, умерших от болезни Гассера, были неспецифическими (отек, некроз клеток);
микротромбы (предположительно вследствие повреждения сосудов) обнаружены лишь в нескольких случаях.
Диагностические исследования.
Продромальный период чаще всего проявляется диареей и рвотой. Кровавый стул отмечается не всегда, но довольно часто.
Реже заболеванию предшествует инфекция верхних или нижних дыхательных путей или вирусная инфекция. Затем, прежде чем
синдром начнет проявляться, может последовать короткий период относительно хорошего состояния. Наблюдаемые симптомы
варьируют в зависимости от тяжести заболевания и вовлечения в процесс различных органов. Часто при первом обращении к врачу,
связанном с жалобами на бледность или вялость ребенка, обнаруживаются анемия и уремия. Гемолитико-уремический синдром
может также проявляться абдоминальными симптомами, симулирующими острый живот или язвенный колит, с кровавой диареей и
болезненностью брюшной стенки при надавливании.
Симптомы заболевания широко варьируют как при внепочечных, так и при почечных проявлениях. Различия в тяжести
заболевания связаны скорее с экстраренальными проявлениями, нежели с выраженностью и продолжительностью почечной
недостаточности. У нетяжелых больных наблюдаются анемия, тромбоцитопения и азотемия, у более тяжелых - олигурия или анурия
и гипертензия. У самых тяжелых больных могут также отмечаться упорные судороги, кома, легочная недостаточность или
признаки миокардита.
Дифференциальный диагноз болезни Гассера включает септицемию и неотложные абдоминальные хирургические состояния с
сопутствующей преренальной олигурией или острым тубулярным некрозом (заворот кишок с инфарктом, непроходимость
кишечника, перфорация кишечника, дивертикул подвздошной кишки, слизистая колика). Однако в мазках крови при болезни Гассера
обычно определяется гемолиз, а абдоминальные признаки, как правило, обнаруживают доброкачественный характер. Факторы
тяжелого васкулита при почечной недостаточности редко выявляются в детском возрасте (например, люпус-нефрит) и обычно не
вызывают тромбоцитопении.
Лабораторная оценка.
Включает выявление наличия тромбоцитов в мазке и определение числа лейкоцитов, коагуляционного профиля, содержания
электролитов, функции печени, измерение уровня азота мочевины в крови и креатинина, а также культуральные исследования крови
и кала. Особое внимание следует уделить выявлению патогенных штаммов кишечной палочки, в частности 0157:Н7, которому
приписывается ведущая роль: в патогенезе болезни Гассера. У детей со значительными нарушениями психики, судорогами или
патологическими изменениями, обнаруженными при неврологическом исследовании, можно произвести компьютерную томографию
черепа и поясничную пункцию для исключения кровотечения или менингита. Рутинная биопсия почки не показана, она проводится
лишь в атипичных случаях и при необходимости инструментального исследования.
Лечение.
В настоящее время при болезни Гассера осуществляется поддерживающее лечение, направленное на сохранение гематокрита
в приемлемых пределах, на нормализацию содержания электролитов в сыворотке и поддержание водного баланса, а также на борьбу
с гипертензией и судорогами. Раннее проведение перитонеального диализа для коррекции биохимических показателей сыворотки и
восстановления объема крови снижает смертность, тяжелобольных с 77% до менее чем 10%.
Рутинный непрерывный мониторинг в отделении интенсивной терапии включает контроль ЭКГ. Для контроля над
внутрисосудистым объемом и серийного получения проб крови для лабораторных анализов устанавливают центральновенозный
катетер. У больных с лабильной (транзиторной) гипертензией целесообразно использование внутриартериального катетера. Катетер
для выведения мочи позволяет выполнять точное количественное определение диуреза и клиренса креатинина. В случае анурии этот
катетер удаляют ввиду риска инфицирования.
Количество жидкостей, не содержащих натрия или калия, ограничивают объемом, необходимым для возмещения неощутимых
потерь воды (300 мл/м2 в день) плюс ее потеря с мочой и фекалиями. Другие виды поддерживающего лечения, имеют своей целью
контроль за гиперкалимией, гипертензией и судорогами, если они возникают. Гиперкалиемию, если она не является неотложным
состоянием, можно лечить с помощью катионообменных смол; глюкоза, инсулин и хлорид кальция используются при неотложной
терапии. При незначительно выраженной или умеренной гипертензии лечение начинают с диализа для уменьшения
внутрисосудистого объема; если симптомы сохраняются, назначают сосудорасширяющие средства. Для предупреждения
тахикардии и повышения эффективности лечения можно добавить бета - блокаторы, такие как анаприлин. Тяжелая гипертензия
лучше всего лечится с помощью непрерывной инфузии нитропруссида натрия при постоянном АД-мониторинге с использованием
внутриартериального катетера. При сохранении гипертензии после окончания острой фазы болезни можно перевести больного на
пероральный прием гипотензивных средств.
Осуществляется ежедневный контроль за гематокритом и числом тромбоцитов. Если гематокритное число меньше 20 %, больному
переливают эритроцитную массу. Необходимо иметь под рукой запас крови на случай внезапного снижения гематокритного числа в
результате гемолиза или кровотечения. Переливание тромбоцитов производится при определении их числа ниже 20,0*109/л или при
наличии клинических признаков кровотечения.
Сообщалось о применении антикоагулянтной терапии гепарином или противотромбоцитарными средствами, а также
фибринолитической терапии стрептокиназой, однако число проспективных контролируемых исследований их эффективности пока
невелико. Антикоагулянтная терапия, не дает немедленного антитромботического эффекта, но способна оказывать продолжительное
благоприятное влияние на гипертензию и протеинурию в тяжелых случаях при комбинированном назначении гепарина и
стрептокиназы. Однако антикоагулянтная терапия сопряжена со значительным риском геморрагических осложнений; у большинства
детей выздоровление наступает без ее применения.
Немногочисленные литературные данные не позволяют дать окончательную оценку эффективности плазмафереза при лечении
болезни Гассера. Описано лишь два случая такого лечения; в одном из них уровень креатинина в сыворотке крови начал снижаться
еще до проведения плазмафереза на 14-й день болезни. Оценивалась также эффективность повторного переливания плазмы при
лечении болезни Гассера у 10 детей и 7 взрослых. Отсутствие данных о проведении исследований в контрольной группе затрудняет
интерпретацию полученных результатов; в целом же исход болезни был не лучше обычно наблюдаемого при стандартном лечении.
У 2 больных (13 %,) в результате переливания развился сывороточный гепатит. Степень риска по отношению к эффективности
рутинного переливания плазмы, по-видимому, слишком высока, что не позволяет рекомендовать повторные переливания плазмы
больным с неосложненной болезнью Гассера. Более определенно установлена положительная роль плазмафереза или переливания
плазмы в лечении специально отобранных больных с рецидивирующим гемолитико-уремическим синдромом или с явными
признаками нарушения синтеза простациклина.