При ишемической болезни сердца методы консервативного лечения недостаточно эффективны, потому нередко приходится прибегать к хирургии. Оперативное вмешательство проводят по определенным показаниям. Подходящий вариант хирургического лечения выбирают индивидуально, учитывая ряд критериев, особенности течения болезни и состояния организма больного.
Показания к хирургическому лечению
Оперативное вмешательство при ИБС проводят с целью реваскуляризации миокарда. Это означает, что посредством операции восстанавливают сосудистое кровоснабжение сердечной мышцы и кровоток по артериям сердца, включая их ветви, когда просвет сосудов сужен более чем на 50%.
Основная цель оперативного вмешательства – устранение атеросклеротических изменений, приводящих к коронарной недостаточности. Такая патология является частой причиной смерти (10% всего населения).
При необходимости хирургического вмешательства учитывают степень поражения коронарных артерий, наличие сопутствующих заболеваний, технические возможности медицинского учреждения.
Операция необходима при наличии следующих факторов:
- патологии сонной артерии;
- сниженной сократительной функции миокарда;
- острой сердечной недостаточности;
- атеросклероза коронарных артерий;
- множественного поражения коронарных артерий.
Все эти патологии могут сопровождать ишемическую болезнь сердца. Оперативное вмешательство необходимо для повышения качества жизни, снижения рисков осложнений, избавления от некоторых проявлений болезни либо их снижения.
Оперативное вмешательство не проводят на ранних сроках после инфаркта миокарда, а также в случае тяжелой сердечной недостаточности (III стадия, II стадия рассматривается индивидуально).
Все операции при ИБС делятся на 2 большие группы – прямые и непрямые.
Прямые операции при ИБС
Наиболее распространены и эффективны методы прямой реваскуляризации. Такое вмешательство требует длительной реабилитации, последующей медикаментозной терапии, но в большинстве случаев восстанавливает кровоток и улучшает состояние сердечной мышцы.
Аортокоронарное шунтирование
Методика является микрохирургической и подразумевает использование искусственных сосудов – шунтов. Они позволяют восстановить нормальный кровоток от аорты до коронарных артерий. Вместо пораженного участка сосудов кровь будет двигаться по шунту, то есть создается новый обходной путь.
Как проходит операция, можно понять, просмотрев этот анимационный ролик:
Аортокоронарное шунтирование может выполняться на работающем или неработающем сердце. Первая методика сложнее в исполнении, но снижает риск осложнений и ускоряет выздоровление. При операции на неработающем сердце используют аппарат искусственного кровообращения, который временно будет выполнять функции органа.
Операция может проводиться также эндоскопическим методом. В таком случае разрезы делают минимальные.
Аортокоронарное шунтирование может быть маммарно-коронарным, аутоартериальным или аутовенозным. В основе такого разделения тип используемых шунтов.
При успешном проведении операции прогноз благоприятен. Такая методика привлекательна определенными преимуществами:
- восстановлением кровотока;
- возможностью заменить несколько пораженных участков;
- значительным повышением качества жизни;
- увеличением продолжительности жизни;
- прекращением приступов стенокардии;
- снижением риска инфаркта миокарда.
Аортокоронарное шунтирование привлекательно возможностью применения при стенозе сразу нескольких артерий, что большинство других методик не позволяет. Такая техника показана пациентам с высокой группой риска, то есть при сердечной недостаточности, сахарном диабете, возрасте старше 65 лет.
Возможно применение коронарного шунтирования при осложненной форме ишемической болезни сердца. Подразумевается сниженная фракция выброса левого желудочка, аневризма левого желудочка, митральная недостаточность, фибрилляция предсердий.
К недостаткам аортокоронарного шунтирования можно отнести возможные осложнения. Во время операции либо после нее есть риск:
- кровотечения;
- инфаркта;
- тромбоза;
- сужения шунта;
- инфицирования раны;
- медиастенита.
Аортокоронарное шунтирование не обеспечивает постоянного эффекта. Обычно срок службы шунтов составляет 5 лет.
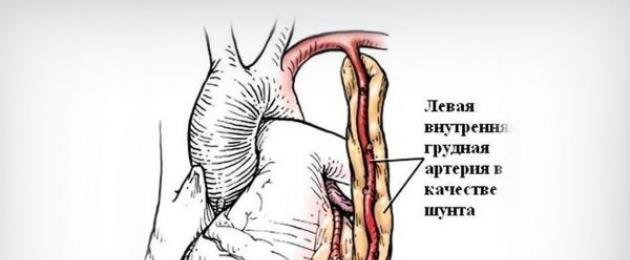
Такую методику называют также операцией Демихова-Колесова и считают золотым стандартом коронарного шунтирования. Ее основное отличие заключается в использовании внутренней грудной артерии, которая служит естественным шунтом. Обходной путь для кровотока в таком случае создается от этой артерии к коронарной. Соединение выполняют ниже участка стеноза.

Доступ к сердцу обеспечивается срединной стернотомией, одновременно с такими манипуляциями выполняют забор аутовенозного трансплантата.
Основные преимущества такой операции следующие:
- устойчивость маммарной артерии к атеросклерозу;
- долговечность маммарной артерии в качестве шунта (в сравнении с веной);
- отсутствие у внутренней грудной артерии варикоза и клапанов;
- снижение риска рецидива стенокардии, инфаркта, сердечной недостаточности, необходимости повторной операции;
- улучшение работы левого желудочка;
- способность маммарной артерии к увеличению в диаметре.
Главный недостаток маммарно-коронарного шунтирования состоит в сложности техники. Выделение внутренней грудной артерии затрудненно, кроме того, она отличается небольшим диаметром и тонкой стенкой.
При маммарно-коронарном шунтировании возможность реваскуляризации нескольких артерий ограничивается, так как есть только 2 внутренние грудные артерии.
Стентирование коронарных артерий
Такую методику называют внутрисосудистым протезированием. В целях операции используют стент, представляющий собой сетчатый каркас из металла.
Операцию выполняют через бедренную артерию. В ней делают прокол и посредством проводникового катетера вводят специальный баллон со стентом. Баллон расправляет стент, а просвет артерии восстанавливается. Устанавливают стент напротив атеросклеротической бляшки.
Как происходит установка стента, наглядно показывает этот анимационный ролик:
Из-за использования в ходе операции баллона такую методику часто называют баллонной ангиопластикой. Применение баллона необязательно. Некоторые виды стентов раскрываются самостоятельно.
Наиболее современный вариант – скаффолды. Такие стенки имеют биорастворимое покрытие. Лекарство выделяется в течение нескольких месяцев. Оно заживляет внутреннюю оболочку сосуда и предотвращает ее патологическое разрастание.
Такая методика привлекательна минимальной травматичностью. К преимуществам стентирования относят также следующие факторы:
- риск повторного стеноза значительно снижается (особенно при использовании стентов с лекарственным покрытием);
- организм восстанавливается намного быстрее;
- восстановление нормального диаметра пораженной артерии;
- не требуется общий наркоз;
- количество возможных осложнений минимально.
Выделяют и некоторые недостатки коронарного стентирования. Они касаются наличия противопоказаний к операции и сложности ее проведения в случае кальциевых отложений в сосудах. Риск повторного стеноза полностью не исключается, поэтому пациенту необходим прием профилактических средств.
Использование стентирования не оправдано при стабильном течении ишемической болезни сердца, но показано при ее прогрессировании либо подозрении на инфаркт миокарда.
Аутопластика коронарных артерий
Такая методика является в медицине относительно молодой. Она подразумевает использование тканей собственного организма. Источником являются вены.
Эту операцию называют также аутовенозным шунтированием. В качестве шунта используют участок поверхностной вены. Источником может быть голень или бедро. Наиболее эффективна для замены коронарного сосуда подкожная вена голени.
Проведение такой операции подразумевает условия искусственного кровообращения. После остановки сердца проводят ревизию коронарного русла и накладывают дистальный анастомоз. Затем сердечную деятельность восстанавливают и накладывают проксимальный анастомоз шунта с аортой, при этом выполняют ее боковое отжатие.
Такая методика привлекательна малой травматичностью относительно сшитых концов сосудов. Стенка используемой вены постепенно перестраивается, что обеспечивает максимальное сходство трансплантата с артерией.
Недостаток метода заключается в том, что при необходимости замены большого участка сосуда просвет концов вставки отличается по диаметру. Особенности техники операции в таком случае могу привести к возникновению турбулентных потоков крови и тромбозу сосудов.
Баллонная дилатация венечных артерий
Этот метод основан на расширении суженной артерии посредством особого баллончика. Его вводят в нужный участок с помощью катетера. Там баллончик раздувается, устраняя стеноз. Такую методику обычно применяют при поражении 1-2 сосудов. Если участков стеноза больше, то уместнее проведение коронарного шунтирования.
Вся процедура проходит под контролем рентгена. Баллончик можно заполнять несколько раз. Для степени остаточного стеноза проводится ангиографический контроль. После операции в обязательном порядке назначают антикоагулянты и антиагреганты, чтобы избежать тромбообразования в расширенном сосуде.
Сначала проводят коронарографию стандартным способом, используя ангиографический катетер. Для последующих манипуляций применяют катетер-проводник, который необходим для проведения дилатационного катетера.
Баллонная ангиопластика является основным методом лечения при запущенной ишемической болезни сердца и эффективна в 8 случаях из 10. Такая операция особенно уместна, когда стеноз наблюдается на небольших участках артерии, а кальциевые отложения незначительны.
Оперативное вмешательство не всегда позволяет избавиться от стеноза полностью. Если сосуд имеет диаметр более 3 мм, то дополнительно к баллонной дилатации может быть проведено коронарное стентирование.
Смотрите анимацию проведения баллонной ангиопластики со стентированием:
В 80% случаев стенокардия исчезает полностью либо ее приступы проявляются значительно реже. Практически у всех пациентов (более 90%) толерантность к физическим нагрузкам повышается. Улучшается перфузия и сократительная способность миокарда.
Основной недостаток методики – риск окклюзии и перфорации сосуда. В таком случае может понадобиться проведение срочного аортокоронарного шунтирования. Существует риск и других осложнений – острого инфаркта миокарда, спазма коронарной артерии, фибрилляции желудочков.
Анастомоз с желудочно-сальниковой артерией
Такая методика означает необходимость вскрытия брюшной полости. Желудочно-сальниковую артерию выделяют в жировой ткани и клипируют ее боковые ветви. Дистальную часть артерии отсекают и проводят в полость перикарды к нужному участку.
Преимущество этой техники заключается в аналогичных биологических особенностях желудочно-сальниковой и внутренней грудной артерии.
Сегодня такая методика менее востребована, так как несет риск осложнений, связанных с дополнительным вскрытием брюшной полости.
В настоящее время такую технику используют нечасто. Основное показание к ней – распространенный атеросклероз.
Операция может проводиться открытым или закрытым методом. В первом случае эндартерэктомию проводят из передней межжелудочковй ветви, что обеспечивает освобождение боковых артерий. Делают максимальный разрез и извлекают атероматозно измененную интиму. Образуется дефект, который закрывают заплатой из аутовены, а в нее вшивают внутреннюю грудную артерию (конец в бок).
Объектом закрытой техники обычно является правая коронарная артерия. Делают разрез, отслаивают бляшку и извлекают ее из просвета сосуда. Затем в этот участок вшивают шунт.
Успешность операции напрямую зависит от диаметра коронарной артерии – чем он больше, тем благоприятнее прогноз.
К недостаткам такой методики относят техническую сложность и высокий риск тромбоза коронарной артерии. Вероятна также повторная окклюзия сосуда.

Непрямые операции при ИБС
Непрямая реваскуляризация увеличивает приток крови к сердечной мышце. Для этого применяют механические средства и химические вещества.
Основная цель оперативного вмешательства – создать дополнительный источник кровоснабжения. С помощью непрямой реваскуляризации восстанавливают кровообращение в небольших артериях.
Такая операция проводится с целью прекратить передачу нервного импульса и снять артериальный спазм. Для этого клипируют или разрушают нервные волокна в симпатическом стволе. При технике клипирования есть возможность возвращения проходимости нервного волокна.
Радикальной техникой является разрушение нервного волокна электрическим воздействием. В таком случае операция высокоэффективна, но ее результаты необратимы.
Современная симпатэктомия является эндоскопической методикой. Она проводится под общей анестезией и полностью безопасна.
Преимущества такого вмешательства заключатся в получаемом эффекте – снятии сосудистого спазма, спадания отека, исчезновении болевых ощущений.
Симпатэктомия неуместна при выраженной сердечной недостаточности. В числе противопоказаний также ряд прочих заболеваний.

Кардиопексия
Такую методику называют также кардиоперикардопексией. В качестве дополнительного источника кровоснабжения используется перикард.
В ходе операции получают внеплевральный доступ к передней поверхности перикарда. Ее вскрывают, отсасывают из полости жидкость и распыляют стерильный тальк. Такой подход называют методом (модификацией) Томпсона.
Операция приводит к развитию асептического воспалительного процесса на поверхности сердца. В результате перикард и эпикард тесно сращиваются, раскрываются интракоронарные и развиваются экстракоронарные анастомозы. Это обеспечивает дополнительную реваскуляризацию миокарда.
Различают также оментокардиопексию. Дополнительный источник кровоснабжения в таком случае создают из лоскута большого сальника.
Источником кровоснабжения могут служить также другие материалы. При пневмокардиопексии это легкое, при кардиомиопексии – грудная мышца, при диафрагмокардиопексии – диафрагма.
Операция Вайнберга
Такая техника является промежуточной между прямыми и непрямыми оперативными вмешательствами при ишемической болезни сердца.
Улучшение кровоснабжения миокарда выполняется за счет имплантации в него внутренней грудной артерии. Используется кровоточащий дистальный конец сосуда. Он имплантируется в толщу миокарда. Сначала формируется внутримиокардиальная гематома, а затем между внутренней грудной артерией и ветвями коронарных артерий развиваются анастомозы.
Сегодня такое оперативное вмешательство нередко проводят двухсторонне. Для этого прибегают к трансстернальному доступу, то есть мобилизации внутренней грудной артерии на всем протяжении.
Основной недостаток такой методики заключается в том, что она не обеспечивает немедленный эффект.
Операция Фиески
Такая техника позволяет усилить коллатеральное кровоснабжение сердца, что необходимо при коронарной недостаточности хронического характера. Заключается методика в двухсторонней перевязке внутренних грудных артерий.
Перевязку выполняют на участке ниже перикардодиафрагмальной ветви. Благодаря такому подходу по всей артерии усиливается кровоток. Этот эффект обеспечивается увеличением сброса крови в венечные артерии, что объясняется увеличением давления в перикардиально-диафрагмальных ветвях.

Лазерная реваскуляризация
Такая методика считается экспериментальной, но довольно распространена. Пациенту выполняют разрез на груди для подведения к сердцу специального проводника.
Лазер используется для выполнения отверстий в миокарде и создания каналов для поступления крови. В течение нескольких месяцев эти каналы закрываются, но эффект сохраняется на годы.
Благодаря созданию временных каналов стимулируется образование новой сети сосудов. Это позволяет компенсировать перфузию миокарда и устранить ишемию.
Лазерная реваскуляризация привлекательна тем, что может быть выполнена пациентам, имеющим противопоказания к аортокоронарному шунтированию. Обычно такой подход требуется при атеросклеротическом поражении мелких сосудов.
Лазерную технику можно применять в комплексе с коронарным шунтированием.
Преимущество лазерной реваскуляризации заключается в проведении на работающем сердце, то есть аппарат искусственного кровоснабжения не требуется. Лазерная методика привлекательна также минимальной травматичностью, невысоким риском осложнений и непродолжительным восстановительным периодом. Использование такой техники устраняет болевой импульс.
Реабилитация после хирургического лечения ИБС
После любого типа оперативного вмешательства необходима коррекция образа жизни. Она направлена на питание, физические нагрузки, режим отдыха и труда, избавление от вредных привычек. Такие меры необходимы для ускорения реабилитации, снижения риска рецидивов болезни и развития сопутствующих патологий.
Операция при ишемической болезни сердца проводится по определенным показаниям. Различают несколько хирургических методик, при выборе подходящего варианта учитывают клиническую картину болезни и анатомию поражения. Оперативное вмешательство не означает отмену медикаментозной терапии – обе методики применяются в комплексе и дополняют друг друга.
Хирургический метод получил повсеместное распространение и прочно вошел в арсенал средств в комплексном лечении больных ИБС. Идею создать обходной шунт между аортой и коронарным сосудом в обход пораженного и суженного атеросклерозом участка клинически реализовал в 1962 г. Дэвид Сабистон, использовав в качестве сосудистого протеза большую подкожную вену, наложив шунт между аортой и коронарной артерией. В 1964 г. ленинградский хирург В. И. Колесов впервые создал анастомоз между внутренней грудной артерией и левой коронарной артерией. Ранее предложенные многочисленные операции, направленные на устранение стенокардии, в настоящее время представляют исторический интерес (удаление симпатических узлов, пересечение задних корешков спинного мозга, периартериальная симпатэктомия коронарных артерий, тиреоидэктомия в сочетании с шейной симпатэктомией, скарификация эпикарда, кардиоперикардиопексия, подшивание к эпикарду лоскута сальника на ножке, перевязка внутренних грудных артерий). В коронарной хирургии на этапе диагностики широко применяют весь арсенал диагностических методов, традиционно используемых в кардиологической практике (ЭКГ, в том числе с пробой физической нагрузкой и медикаментозными пробами; рентгенологические методы: рентгеноскопия органов грудной клетки; радионуклидные методы; эхокардиография, стресс-эхокардиография). Катетеризация левых отделов сердца позволяет измерить конечно-диастолическое давление в левом желудочке, которое имеет важное значение для оценки его функциональной способности, особенно, если это исследование сочетать с измерением сердечного выброса. Левая вентрикулография позволяет изучить движение стенок и их кинетику, а также рассчитать объемы и толщину стенок левого желудочка, оценить сократительную функцию, рассчитать фракцию выброса. Селективная коронарография, разработанная и внедренная в клиническую практику F. Sones в 1959 г., предназначена для объективной визуализации коронарных артерий и основных ветвей, изучения их анатомического и функционального состояния, степени и характера поражения атеросклеротическим процессом, компенсаторного коллатерального кровообращения, дистального русла венечных артерий и т. д. Селективная коронарография в 90—95 % случаев объективно и точно отражает анатомическое состояние венечного русла. Показания к коронарографии и левой вентрикулографии:
- Ишемия миокарда, выявленная с помощью неинвазивных методов диагностики
- Наличие любого типа стенокардии, подтвержденное неинвазивными методами исследования (изменения на ЭКГ в покое, проба с дозированной физической нагрузкой, суточное мониторирование ЭКГ)
- Инфаркт миокарда в анамнезе с последующей постинфарктной стенокардией
- Инфаркт миокарда в любой фазе
- Плановый контроль состояния коронарного русла трансплантированного сердца
- Предоперационная оценка состояния коронарного русла у пациентов старше 40 лет с заболеваниями клапанов.
- Клиническая картина заболевания, т. е. выраженность стенокардии, ее устойчивость к лекарственной терапии.
- Анатомия поражения коронарного русла: степень и локализация поражения коронарных артерий, количество пораженных сосудов, тип коронарного кровоснабжения.
- Состояние сократительной функции миокарда.
- множественное поражение коронарных артерий;
- наличие стволового стеноза левой коронарной артерии;
- наличие устьевых стенозов левой или правой коронарной артерии;
- стеноз передней межжелудочковой артерии при невозможности выполнить ее ангиопластику.
- диффузные множественные поражения периферических коронарных артерий;
- сниженная сократительная функция миокарда (фракция выброса менее 0,3)
- наличие тяжелой сердечной недостаточности (II Б-III стадии)
- ранние сроки после инфаркта миокарда (до 4 мес).
- после подключения аппарата искусственного кровообращения, остановки сердца и ревизии коронарного русла - наложение дистального анастомоза конец-в-бок с коронарной артерией (рис. 1, 2);
- после восстановления сердечной деятельности - наложение проксимального анастомоза шунта с аортой с использованием бокового отжатия стенки аорты.
Для цитирования:
Акчурин Р.С., Ширяев А.А., Власова Э.Е., Васильев В.П., Галяутдинов Д.М. Хирургическое лечение ИБС // РМЖ. 2014. №30. С. 2152
Ишемическая болезнь сердца (ИБС) лидирует среди причин смертности трудоспособного населения развитых стран. Поиск оптимальных методов ее лечения является задачей жизненной важности. Вот уже почти полвека метод прямой реваскуляризации миокарда - коронарное шунтирование (КШ) является основой лечения этой болезни. Впервые примененное в клинической практике в конце 1960-х гг. КШ стало наиболее изучаемым из хирургических вмешательств; в наши дни в мире ежегодно выполняется более полумиллиона операций, и количество их продолжает расти.
Показания
В течение почти 30 лет КШ оставалось единственным методом коронарной реваскуляризации; в этот период показания к КШ формировались исходя из возможностей медикаментозной терапии того времени и сравнения его результатов с результатами КШ в разных клинических группах . Однако с развитием научно-технического прогресса и внедрением в практику чрескожных коронарных вмешательств (ЧКВ) появился выбор среди способов реваскуляризации; эндоваскулярные методы прочно заняли свое место в лечении ИБС и стали альтернативой хирургии. Кроме того, в течение последнего десятилетия медикаментозная терапия ИБС претерпела значительные преобразования и показала улучшение результатов, особенно в случаях стабильного течения болезни. Это привело к переосмыслению показаний к хирургической реваскуляризации (в сторону их сужения), особенно при учете возможных церебральных осложнений. И все-таки, основываясь на последних рандомизированных клинических исследованиях (РКИ), в которых принимали участие наиболее тяжелые больные и изучался более широкий спектр конечных клинических исходов, можно утверждать, что КШ остается «золотым стандартом» ведения больных со стенозом ствола левой коронарной артерии и трехсосудистым поражением венечного русла .
Коронарная реваскуляризация преследует 2 цели: облегчение клинических проявлений, или повышение качества жизни, и улучшение прогноза - как ближайшего, так и отдаленного. Отсюда следует, что показания к реваскуляризации (и ЧКВ, и КШ) могут быть классифицированы на клинические и анатомические (или прогностические).
Клиническими показаниями к коронарной реваскуляризации принято считать:
- наличие тяжелой стенокардии, сохраняющейся несмотря на оптимальную медикаментозную терапию; другими словами - отсутствие эффекта от медикаментозной терапии;
- недостаточность кровообращения на фоне доказанной ишемии;
- острый коронарный синдром.
Анатомические, или прогностические, показания к реваскуляризации определяют приоритет КШ перед ЧКВ в таких случаях, как:
- стеноз ствола левой коронарной артерии (ССЛКА) >50%;
- эквивалент ССЛКА (проксимальные стенозы передней нисходящей артерии и огибающей артерии) >70%;
- трехсосудистое поражение коронарного русла в сочетании с дисфункцией левого желудочка (ЛЖ) сердца (фракция выброса ЛЖ <50%);
- трехсосудистое поражение коронарного русла с доказанным большим объемом ишемизированного миокарда;
- двухсосудистое поражение с обязательным вовлечением проксимального отдела передней нисходящей артерии в сочетании с дисфункцией ЛЖ (фракция выброса ЛЖ <50%).
Формирование показаний к реваскуляризации происходило на основании сравнения результатов медикаментозного, эндоваскулярного и хирургического лечения больных разных клинических групп, отраженных в многочисленных РКИ, метаанализах и крупных наблюдательных регистрах последнего десятилетия . Наиболее убедительное сопоставление ЧКВ и КШ проведено в рандомизированной подгруппе (n=705) исследования SYNTAX: КШ характеризовалось достоверно более высоким риском церебральных осложнений (2,7% против 0,3%), но значительно более редкой частотой повторных реваскуляризаций (6,7% против 12,0%, p<0,02) .
Необходимо подчеркнуть, что в наши дни формулировка показаний к применению того или иного метода реваскуляризации в каждом конкретном случае не основывается на догме, а складывается с учетом анализа эффективности и побочных эффектов проводимой медикаментозной терапии, коронарной анатомии, подтвержденной ишемии, доступных результатов сравнений ЧКВ и КШ в подобных ситуациях , оценки технических возможностей и опыта операторов, а также выбора самого больного. При любом выборе реваскуляризации лечение больного будет комбинированным (реваскуляризация + оптимальная медикаментозная терапия).
Стратификация риска
Шкалы Parsonnet, Society of Thoracic Surgeons (STS), Mayo Clinic Risk Score, ACEF score, Euroscore, Euroscore II разработаны для предсказания риска хирургической смертности; некоторые из них включают в число детерминант не только возраст и фракцию выброса ЛЖ, но и уровень креатинина . Каждый хирург перед операцией осознает, что шкалы имеют лишь рекомендательный характер и окончательное решение относительно тактики принимается командой врачей. КШ становится целесообразным и показанным, если его ожидаемая польза превосходит потенциальные опасности и жизнеугрожающие риски. Сегодня в повседневной клинической практике наиболее используемой системой является Euroscore II.
Подготовка к КШ
Предоперационное обследование больного предполагает детализацию клинической ситуации с целью формулировки показаний к КШ и стратификации риска. Сопутствующие заболевания (сахарный диабет (СД), ожирение, хроническая обструктивная болезнь легких, патология щитовидной железы) должны быть диагностированы и максимально компенсированы на догоспитальном этапе. Вероятным осложнением операции с применением аппарата искусственного кровообращения (ИК) и системной гепаринизации является желудочно-кишечное кровотечение при наличии его потенциальных источников. Мы настаиваем на 100-процентном проведении предоперационной гастроскопии даже при отсутствии клиники язвенной болезни - для выявления «немых» эрозивно-язвенных поражений; при их обнаружении КШ должно быть отложено до достижения эндоскопической ремиссии. Не вызывает сомнений факт повышения риска инфекционных послеоперационных осложнений при наличии не санированных перед операцией очагов инфекции. Поэтому поиск и излечение очагов инфекции при наличии маркеров воспаления обязательны. Санация полости рта даже без видимых признаков воспаления показана всем без исключения кандидатам на КШ.
Важную роль при подготовке к КШ мы отводим диагностике и детализации неврологического дефицита: как у пациентов со стенозами в каротидном бассейне, так и без них . Для оценки и эффективного снижения риска неврологических осложнений пациенты должны быть дообследованы (допплероскопия ветвей дуги аорты, магнитно-резонансная томография головного мозга в ангиографическом режиме), при необходимости - консультированы неврологом с целью дифференцированного назначения предоперационной подготовки и соответствующего лечения начиная с первых суток послеоперационного периода.
Техника операции
Операцию КШ проводят для формирования нового пути кровотока в обход пораженных участков коронарных артерий, обычно в его эпикардиальной части. В качестве шунтов чаще всего используют левую внутреннюю грудную (маммарную) артерию (ЛВГА) и фрагменты большой подкожной вены (БПВ) голени и бедра. Применение правой внутренней грудной (ПВГА), лучевой (ЛА), правой желудочно-сальниковой артерий (ЖСА) и малой подкожной вены считается альтернативным и имеет свои ограничения.
Наиболее часто реваскуляризацию миокарда проводят с использованием ИК. Операцию начинают одновременным выделением сосудистых трансплантатов и выполнением срединной стернотомии. Вены нижних конечностей выделяют из отдельных разрезов преимущественно обеих голеней. ЛА выделяют в комплексе с сопутствующими венами, используя меры профилактики артериального спазма - наружное орошение раствором папаверина.
Артериальные ветви ЛА клипируют.
После выполнения стандартной срединной стернотомии внутренние грудные артерии выделяют до вскрытия перикарда, мобилизируя ножку трансплантата с окружающими тканями.
После разведения краев грудины ранорасширителем Т-образно вскрывают перикард и подшивают его к краям раны. После полной гепаринизации (300-400 Ед./кг веса) аортальную канюлю устанавливают несколько проксимальнее отхождения брахиоцефального ствола, для венозного дренажа чаще используют одну двухпросветную канюлю, проведенную через ушко правого предсердия в нижнюю полую вену. Полное ИК проводят с умеренной гипотермией до 28-32oС. В восходящий отдел аорты устанавливают кардиоплегическую канюлю. После стабилизации параметров гемодинамики в расчетном режиме выполняют поперечное пережатие аорты дистальнее кардиоплегической канюли и производят кардиоплегию введением 400-500 мл холодного калиевого раствора. В полость перикарда помещают замороженный до кашицеобразной консистенции физиологический раствор.
Выбор сосудов для шунтирования и ориентировочной локализации анастомозов обусловлен топографией поражения коронарного русла. Под оптическим увеличением острым скальпелем вскрывают эпикард над внешней поверхностью артерии в зоне анастомоза, затем - просвет артерии. Качественный оптический контроль при этой манипуляции позволяет выбрать место вскрытия артерии вне зоны атеросклеротической бляшки и предотвратить возможное ранение задней стенки артерии. Далее разрез артерии расширяют продольно специализированными изогнутыми по ребру ножницами до 4-8 мм. Формируют соустье аутовенозного или артериального трансплантата, соответствующее по размерам артериотомии. Для сосудистого шва аутовенозно-коронарного анастомоза используют нить 7/0 или 8/0, ayоартериально-коронарного - нить 8/0 (пролен) с атравматическими колющими иглами. Непрерывным швом сшивают только стенки сосудов, окружающие ткани вовлекаются в анастомоз в случаях истончения стенки коронарной артерии и угрозы прорезывания.
При тяжелом диффузном атеросклеротическом процессе в коронарных сосудах, отсутствии адекватного для выполнения анастомоза просвета или выраженном кальцинозе приходится использовать методику энд-артерэктомии. Путем удаления измененной интимы из коронарной артерии добиваются того, чтобы в дистальном направлении были освобождены все русло, а также боковые и септальные ветви. После выполнения эндартерэктомии на всем протяжении артериотомного разреза выполняют шов с коронарным шунтом. Протяженность такого анастомоза может быть более 3 см.
Все более широкое внедрение секвенциальных («бок в бок») анастомозов, множественного аутоартериального КШ, использование бимаммарных Т- и У-образных конструкций, ЖСА настоятельно требуют повышения прецизионности вмешательств и обусловливают перспективность применения методов микрохирургии.
Использование микрохирургической техники и операционного микроскопа в коронарной хирургии существенно улучшают качество выполнения дистальных анастомозов. В своей практике мы используем операционный микроскоп потолочного или напольно-штативного крепления. Оптическое увеличение меняется в диапазоне 4-48 крат, для комфортной работы достаточно 6-12 крат. Преимуществами перед общепринятыми лупами-очками являются:
- единое поле зрения хирурга и ассистента;
- переменное увеличение для исключения технических ошибок;
- хорошая визуализация измененной сосудистой стенки;
- возможность применения микрошовного материала (нити 8-9/0) и микрохирургических инструментов.
Надо отметить, что особенностью данной технологии является непрямое видение операционного поля для хирурга и ассистента и, как следствие, - непривычная мануальная координация выполнения дистальных анастомозов. Ограниченное рабочее поле (поле зрения 4-5 см) требует навыка работы инструментами с минимальными движениями кистей рук.
Опыт выполненных нами более 6500 операций прямой реваскуляризации миокарда с использованием операционного микроскопа позволяет рекомендовать кардиохирургам шире использовать микрохирургическую технику в коронарной хирургии. В таблицах 1 и 2 приведены результаты выполненного нами исследования 10-летнего наблюдения за пациентами, оперированными в 1998-2001 гг.
Для формирования проксимальных анастомозов после снятия поперечного зажима с аорты производят боковое отжатие аорты, формируют овальные перфорационные отверстия несколько больше диаметра аутовенозных шунтов, ориентированные соответственно функционально выгодной позиции шунта. Аутовенозные трансплантаты с аортой анастомозируют непрерывным швом нитью 6/0.
После реваскуляризации миокарда и стабилизации гемодинамики прекращают ИК, деканюлируют аорту и правые отделы сердца, дренируют переднее средостение, полость перикарда и, при необходимости, вскрытые плевральные полости. Остеосинтез грудины выполняют преимущественно проволочными серкляжными швами. Мягкие ткани раны ушивают послойно синтетическим шовным материалом.
Не будет преувеличенным утверждение о том, что внедрение маммарокоронарного шунтирования (МКШ) в 1970-х гг. ознаменовало новую эру коронарной хирургии, когда удалось значительно улучшить как ближайшие, так и отдаленные результаты КШ. Революция в хирургии, произошедшая с приходом МКШ, сравнима по значимости с другой, более поздней революцией, произошедшей в интервенционной кардиологии с появлением стентов с лекарственным покрытием. Отдаленная проходимость (10-15 лет) маммарных шунтов превышает 90%, что дает существенное увеличение выживаемости . В наши дни применение МКШ является «золотым стандартом» коронарной хирургии.
Бимаммарное шунтирование, без сомнения, увеличивает потенциальную пользу операции, однако не всегда может быть использовано у больных с СД и ожирением, т. к. ассоциируется с более высоким риском раневой инфекции из-за деваскуляризации грудины. ПВГА может быть использована на ножке, т. е. с сохранением своего анатомического источника, а может быть и свободным артериальным трансплантатом. К сожалению, достаточного количества РКИ, доказывающих преимущество бимаммарного шунтирования перед использованием только ЛВГА, пока нет. Отдаленные результаты обоих вмешательств в ближайшем будущем будут проанализированы в Arterial Revascularisation Trial .
Первоначальный опыт использования левой ЛА в качестве шунта показал худшие, чем при венозном шунтировании, результаты и вызвал пессимизм. Однако с улучшением техники выделения и применением способов борьбы со спазмом ситуация изменилась, и результаты ряда РКИ это подтвердили . Во многих клиниках изучалась возможность использования ЖСА, перспективы ее рутинного применения пока исследуются.
Клиническая практика показывает, что у молодых пациентов, не страдающих СД и ожирением, выполнение мультиартериального шунтирования является весьма оправданным и дает надежду на хороший отдаленный результат.
С целью минимизации кровопотери используется аутотрансфузия концентрированных отмытых эритроцитов до, во время и после ИК с использованием технологии Cell Saver. Это позволяет сократить потребность в донорской крови, снизить частоту трансфузионных, легочных, почечных и мозговых осложнений, а также уменьшить время пребывания пациентов в стационаре на 25-30%.
КШ без ИК (off-pump)
Вмешательство проводится без применения ИК на работающем сердце, при этом локальная стабилизация участка миокарда в зоне дистального анастомоза достигается с помощью специально разработанных устройств (рис. 1).
Первоначально данная методика была предложена как хирургическое вмешательство с заведомо более низким риском периоперационного инсульта. В нашем исследовании (оно было проведено в 2007-2008 гг.) это нашло подтверждение. Мы провели сравнение частоты церебральных осложнений при КШ с ИК и без ИК среди больных старше 70 лет. В этой группе, где особенно оправдан выбор техники операции без ИК, инсульт развивался в 3, а энцефалопатия - в 2 раза реже, чем при «традиционном» КШ. В некоторых РКИ, однако, не было получено достоверного снижения частоты неврологических осложнений при выполнении КШ на бьющемся сердце. Преимущество этой технологии еще ждет своего убедительного подтверждения или опровержения. Принято, что КШ off-pump является технологически не рутинным, а сложным вмешательством, и рекомендовано для проведения только в высокоспециализированных центрах.
Результаты и осложнения
Летальность в специализированных клиниках составляет <2%. В неосложненной группе пациентов моложе 65 лет, без нарушения функции ЛЖ и клинических признаков недостаточности кровообращения 30-дневная летальность не превышает 1%. Необходимо заметить, что такой уровень летальности сохраняется уже длительное время, несмотря на то, что контингент оперированных стал значительно тяжелее и старше. Это объясняется накоплением опыта и прогрессом в анестезиологии, перфузиологии, хирургической технике, послеоперационном наблюдении и медикаментозном ведении.
Кровотечение после КШ является нечастым, но грозным осложнением и развивается на фоне массивной гепаринизации вследствие нарушений гемостаза и функции тромбоцитов при ИК. Средний объем кровопотери при неосложненном КШ составляет 400-600 мл, что обычно возмещается с помощью кровосохраняющих технологий (аппарат «Сell Saver» и его отечественные аналоги) и трансфузий; рестернотомия и хирургическая остановка кровотечения необходимы в 0,5-2% случаев.
Наиболее частыми клинически значимыми и влияющими на прогноз ранними осложнениями КШ являются церебральные расстройства, раневая инфекция и почечная дисфункция, реже развиваются периоперационный инфаркт и тромбоз глубоких вен.
К неблагоприятным неврологическим исходам КШ относят инсульт, делирий и так называемое нарушение когнитивных функций . Несмотря на прогресс в технологии, частота их, к сожалению, остается довольно высокой и устойчивой. Для иллюстрации мы сравнили результаты нашей годичной деятельности в разные периоды работы - за 1995 и 2010 гг. (табл. 3). Сопоставление только результатов КШ показало, что за 15 лет почти втрое возросло количество операций, и мы сумели достичь заметного снижения госпитальной летальности, частоты периоперационного инфаркта, медиастинита и даже почечной недостаточности. Однако в борьбе с церебральными осложнениями наши успехи оказались гораздо более скромными. Наиболее значимыми причинами церебральных осложнений являются снижение церебральной перфузии и эмболия, а реализуются эти причины в результате 3-х основных моментов: собственно ИК, манипуляций на аорте и нарушений ритма сердца. Сочетанное поражение магистральных артерий головы мы рассматриваем как крайне неблагоприятный фон, на котором реализуется действие указанных механизмов.
Медиастинит развивается в 1-2% случаев, факторами риска являются тяжелый диабет, высокий индекс массы тела, использование стероидов и рестернотомия. Современная антибиотикотерапия и применение препаратов, содержащих иммуноглобулины, часто позволяют справиться с инфекцией при так называемом закрытом ведении.
Почечная дисфункция, требующая заместительной терапии, возникает у 1-5% пациентов и в большинстве случаев может быть предсказана; наиболее частым ее субстратом являются диабетическая нефропатия и гипоперфузия. Развитие острой почечной недостаточности в значительной степени влияет на прогноз, удлиняет пребывание больного в реанимации и отделении, повышает стоимость лечения.
К наиболее частым послеоперационным проблемам мы относим нарушения ритма сердца (фибрилляция предсердий), легочные осложнения (плеврит, ателектазы, пневмония), постперикардиотомный синдром, анемию и нарушение заживления ран.
Послеоперационная реабилитация
Активизация больного начинается с 1-х сут послеоперационного периода (полулежачее и пассивное сидячее положение - в 1-е сут, активное сидячее положение в постели, пересаживание на кресло, переход в вертикальное положение и ходьба по палате - со 2-х сут). Особое внимание уделяется раннему началу дыхательной гимнастики.
С целью профилактики нарушений ритма и проводимости в течение первых 5-7 сут после операции необходим постоянный контроль электролитных нарушений; поддержание сывороточной концентрации электролитов на нормальном уровне в большинстве случаев обеспечивает удержание синусового ритма. Наиболее частым вариантом нарушения ритма в послеоперационном периоде является фибрилляция предсердий.
В стандартном случае медикаментозная терапия в периоде восстановления включает в себя:
а) базисные препараты, использование которых является обязательным и 100-процентным (низкомолекулярный гепарин, ацетилсалициловая кислота, антибиотик, противогрибковый антибиотик, противоязвенный препарат);
б) препараты, которые являются не обязательными, но значительно востребованными в послеоперационном периоде (β-блокаторы и препараты калия);
в) различные препараты для симптоматического лечения (анальгетики, муко- и бронхолитики, антиаритмики, железо, эпоэтин β).
Результаты внедрения нами «программы ускоренной реабилитации» показали, что значительное укорочение госпитального послеоперационного периода - до 7-8 сут - возможно . Однако при современном составе больных только 15-20% пациентов (неосложненные случаи КШ) могут действительно войти в эту программу; остальные требуют более длительного восстановления в отделении и продолжения реабилитации вне отделения хирургии. Наш опыт показывает, что для успеха хирургического лечения сегодняшнего контингента больных необходимо предусмотреть период пребывания в реабилитационном учреждении, желательно специализированном, длительностью не менее 14-20 сут. Цели такого долечивания: окончательное восстановление физической активности и адаптация к жизни, приобретение уверенности в себе и знаний о своем состоянии и окончательный подбор медикаментозной терапии перед выпиской (при необходимости терапии антикоагулянтами, тяжелом диабете и переходе с инсулина на пероральные препараты, для долечивания неврологических осложнений, анемии и др.). Уже на этой стадии реабилитации больной начинает вторичную профилактику заболевания, которая будет продолжаться дальше. В большинстве западных стран эту фазу реабилитации определяют как временной интервал - от 3 до 6 нед. после выписки.
Патогенез изменений в организме при регулярных физических нагрузках изучен, польза их не подвергается сомнению. По нашему мнению и опыту, необходимо соблюдать следующие важнейшие требования к планированию физических тренировок: регулярность, дискретность, т. е. плавное ступенчатое наращивание нагрузки, и обязательный учет состояния миокарда и наличия аритмий при выборе модели физических тренировок (умеренные или интенсивные).
Обычно индивидуальная программа физических тренировок определяется на основании результатов нагрузочной пробы. При исследованиях эффективности КШ еще в 1980-1990-х гг. стало очевидным, что большинство больных способны выполнить нагрузочную пробу на 12-14-е сут послеоперационного периода, причем в подавляющем большинстве случаев - со значительным приростом двойного произведения в сравнении с дооперационным результатом . В подавляющем большинстве случаев критерием прекращения нагрузочной пробы после операции является физическая усталость пациента, реже - достижение субмаксимальной частоты сердечных сокращений. Результаты нагрузочной пробы становятся отправной точкой при наращивании объема двигательной активности и определении необходимости лекарственной поддержки этого процесса. Повторные тесты с физической нагрузкой проводятся как контроль адаптации. Физические тренировки могут проходить в виде индивидуальных и групповых занятий с методистом, пешеходных прогулок (т. е. дозированной ходьбы), велотренировок, плавания в бассейне и занятий на тренажерах. Наиболее приемлемыми видами физических тренировок мы считаем ходьбу, в т. ч. подъем по лестнице, а также велотренажер. Мы придерживаемся классических принципов активизации: сначала наращивать объем нагрузки, а уже потом - ее интенсивность. В применении к ходьбе это означает: сначала наращивать дистанцию, а потом, при уверенном преодолении 4-5 км без отдыха, - и темп ходьбы.
Медикаментозная терапия в фазе реабилитации, вторичная профилактика ИБС после КШ
Грамотно организованный реабилитационный этап у больных, перенесших КШ, становится началом вторичной профилактики атеросклероза. Вторичная профилактика, или кардиопротективная стратегия, или 3-я фаза кардиореабилитации - это не только программа продолжения физического тренинга. Сюда включаются контроль факторов риска атеросклероза (дислипидемия, курение, гипергликемия, артериальная гипертония (АГ), ожирение), адекватный амбулаторный медицинский контроль и психосоциальная поддержка (рис. 2).
Адекватный амбулаторный медицинский контроль предполагает назначение антитромботической терапии, соответствующей ситуации и требованиям времени; эффективной и безопасной гиполипидемической терапии (статины, статины + эзетимиб, фибраты) с обязательным достижением рекомендованных для больных высокого риска целевых уровней холестерина, холестерина липопротеидов низкой плотности и триглицеридов; по показаниям - плазмаферез, раннее выявление стенозирования и/или тромбоза шунтов и прогрессии коронарного атеросклероза на основании регулярного неинвазивного обследования; своевременное решение о проведении повторной ангиографии и ЧКВ.
Организация специализированной медицинской реабилитации больных ИБС после операций КШ - это новое направление в здравоохранении РФ. Важность данной проблемы, имеющей не только медицинское, но и большое социально-экономическое значение, отмечена в приказе Министерства здравоохранения и социального развития РФ № 44 от 2006 г. «О долечивании (реабилитации) больных в условиях санатория». В документе говорится о необходимости формирования концепции реабилитации этой категории больных в условиях специализированных центров восстановительной медицины. К сожалению, на сегодняшний день вопрос взаимодействия между кардиохирургическими центрами и амбулаторными медицинскими учреждениями остается далеким от окончательного разрешения.




Литература
1. Igbal J., Serruys P.W., Taggart D.P. Optimal revascularisation for complex coronary artery disease // Nat Rev Cardiol. 2013. Vol. 10. P. 635-647.
2. Wijns W., Kolh P., Danchin N. et al. Task Force on Myocardial Revascularisation of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Guidelines on myocardial revascularisation // Eur. Heart J. 2010. Vol. 31 P. 2501-2555.
3. Shomig A., Mehilli J., de Waha A., Seyfarth M., Pache J., Kastrati A. A meta-analysis of 17 randomised trials of a percutaneous coronary intervention-based strategy in patients with stable coronary artery disease // J Am Coll Card. 2008. Vol. 52. Р. 894-904.
4. Naik H., White A.J., Chakravarty T., Forrester J., Fontana G., Kar S., Shah P.K., Weiss R.E., Makkar R. A meta-analysis of 3773 patients treated with percutaneous coronary intervention or surgery for unprotected left main coronary artery stenosis // JACC Cardiovasc Interv. 2009. Vol. 2. Р. 739-747.
5. Mohr F.W., Morice M.C., Kappetein P.A. et al. Coronary artery bypass graft surgery versus percutaneous coronary intervention in patients with three vessel disease and left main coronary disease: five-year follow-up of the randomised, clinical SYBTAX Trial // Lancet. Vol. 381 (2013). P. 629-638.
6. Акчурин Р.С., Ширяев А.А., Галяутдинов Д.М., Васильев В.П., Руденко Б.А., Колегаев А.С., Черкашин Д.И., Емельянов А.В., Вдовенко Ю.В. Коронарное шунтирование при рецидиве стенокардии после ангиопластики со стентированием коронарных артерий // Кардиологический вестник. 2013. № 2. С. 12-17.
7. Nashef S.A., Roques F., Michel P., Gauducheau E., Lemeshow S., Salamon R. European system for cardiac operative risk evaluation (EuroSCORE) // Eur J Cardiothorac Surg. 1999. Vol. 16. Р. 9-13.
8. John R., Choudhri A. F., Weinberg A. D., Ting W., Rose E. A., Smith C. R. Multicenter review of preoperative risk factors for stroke after coronary artery bypass grafting // Annals of Thoracic Surgery. 2000. Vol. 69. Р. 30-35.
9. Loop F.D., Lytle B.W., Cosgrove D.M. et al. Influence of the internal mammary-artery graft on 10-year survival and other cardiac evebts // N Engl J Med. 1986. Vol. 314. P. 1-6.
10. Taggart D.P., Lees B., Grey A., Altman D.G., Flather M., Channon K. Protocol for the Arterial Revascularisation Trial (ART) / A randomiset trial to compare survival following bilateral versus single internal mammary grafting in coronary revascularization // Trials. 2006. Vol. 7. P. 7.
11. Achouh P., Isselmou K., Boutekadjirt R. et al. Reappraisal of a 20-year experience with the radial artery as a conduit for coronary bypass grafting // Eur. J. Cardiothorac. Surg. 2012. Vol. 41 (1). P. 87-92.
12. Gottesman R.F., Sherman P.M., Grega M.A. et al. Whatershed strokes after cardiac surgery: diagnosis, ethiology, and outcome // Stroke. 2006. Vol. 37. Р. 2306-2311.
13. Власова Э.Е., Комлев А.Е., Васильев В.П., Ширяев А.А., Лепилин М.Г., Акчурин Р.С. Опыт ранней реабилитации больных после операций коронарного шунтирования // Ангиология и сосудистая хирургия. 2010. № 1. С. 21-34.
14. Акчурин Р.С., Агапов А.А., Власова Э.Е., Покровский С.Н., Павлов Н.А., Творогова М.Г. Аутовенозное коронарное шунтирование: риск ранних и годичных окклюзий шунтов при дислипидемии // Грудная и сердечно-сосудистая хирургия. 1996. № 2. С. 31-34.
При ухудшении симптомов стенокардии прием лекарственных препаратов неэффективен. Возникает необходимость проведения хирургии. Но современное медикаментозное лечение стало намного эффективнее из-за уменьшения потребления миокардом кислорода. Основным показанием к операции при патологическом состоянии являются анатомические показатели больного. К ним относятся расположение и количество пораженных сосудов.
Способы вмешательства
Хирургические методы лечения ибс направлены на восстановление нормального состояния просвета артерий. Он сужается из-за отложений холестерина на стенке кровеносного сосуда. Лекарства в этом случае не всегда помогают устранить проблему. Показания к хирургическому лечению в основном анатомические.
Целями хирургического лечения при ИБС является восстановление просвета артерии (реваскуляризация), суженного атеросклеротической бляшкой
- Стентирование.
- Аорто-коронарное шунтирование.
- Реваскуляризация коронарных сосудов.
- Непрямое шунтирование миокарда.
- Пересадка сердца.
Операция при ишемическом инсульте осуществляется в зависимости от показаний по усмотрению врача.
Стентирование
Является уникальным способом нормализация циркуляции крови к сердцу и от него. В нормальном состоянии оно снабжается кровью из коронарных артерий, отходящих от аорты. Недалеко от каждой артерии располагается коронарная вена, обеспечивающая отток крови от сердца. При ИБС коронарная артерия перекрывается бляшкой. Она препятствует потоку крови, но не поражает вены. Суть вмешательства заключается в создании канала между коронарным кровеносным сосудом и суженным просветом артерии специальным катетером.

Внутриаортальную баллонную контрапульсацию обычно осуществляют через бедренную артерию
Операция продолжается 2 часа без наркоза. Просвет кровеносного сосуда, проводящего кровь от сердечной мышцы ко всем частям тела, восстанавливается введением стента. Это сетчатая трубка из металла. При помощи рентгена выбирается расположение стента напротив бляшки. Надувным баллоном трубка расширяется. Все манипуляции осуществляются через бедренную вену с применением катетера. Используется местный наркоз, поэтому больной осознает, что с ним происходит и выполняет команды доктора. Успех вмешательства связан с качеством материалов трубки. Есть стенты, которые раскрываются самостоятельно, а некоторые после введения даже сами выделяют лекарственные вещества. Операция восстанавливает просвет кровеносного сосуда, нормализует кровоток и устраняет боль. Но полностью вылечить атеросклероз нельзя, поэтому обязательно соблюдение профилактических мер. Распространенным осложнением после вмешательства считается повторное появление бляшки. В таком случае операцию повторяют. При ИБС в стабильном состоянии вместо операции показана медикаментозная терапия.
Аорто-коронарное шунтирование
Ишемическая болезнь сердца – основная причина летального исхода людей в трудоспособном возрасте. Суть вмешательства заключается в полной нормализации процесса кровоснабжения сердца и передвижения крови по артериям с суженным просветом. Коронарные артерии и главная артерия соединяются шунтами.

Это стандартная операция при закупорках коронарных артерий
Если диагностирована ИБС, показания к вмешательству заключаются в следующем:
- неподдающаяся медикаментозной терапии стенокардия;
- осложнения от инфаркта миокарда;
- сердечная недостаточность;
- желудочковые аритмии;
- атеросклероз.
Оперативное вмешательство проводится больным в возрасте от 30 до 55 лет. У людей в пожилом возрасте атеросклероз поражает и другие артерии. Обычно количество шунтов не превышает пяти. Используется устройство «искусственное сердце – легкие».
Для шунтирования применяют большую подкожную вену (БПВ), расположенную в ногах. Её длина составляет от 65 до 75 см. Врач выделяет её и производит перевязывание. Затем аккуратно отрезает. Из-за большого процента закрытия венозных шунтов после окончания манипуляций, для материала чаще используют артерии (лучевые, грудные). Для шунтирования используются артериальные и венозные шунты. Эффективность процедуры увеличивается при применении антериальных шунтов. Но такая операция должна проводиться высококвалифицированным специалистом и является дорогостоящей, а восстановительный период занимает много времени.

Во время хирургической операции, сердце на время останавливают, а ваш организм подключают к машине, которая называется аппаратом искусственного кровообращения
Реваскуляризация коронарных сосудов
Вмешательство проводится на работающей сердечной мышце. При помощи специальных медикаментов происходит замедление ритма сердца. Врач накладывает анастомоз, используя грудные внутренние артерии (а. thoracica interna). Операция проводится, если обнаружено выраженное поражение сердца, в связи с этим состоянием даже небольшая остановка в работе сердца у пациента может спровоцировать усугубление ситуации.
Непрямое шунтирование миокарда
У 9% больных атеросклеротические бляшки локализуются в мелких артериях, при этом наблюдается их множественное поражение. Баллонная ангиопластика не может применяться из-за большого количества сосудов. Другие манипуляции также малоэффективны. Для таких пациентов создано непрямое шунтирование миокарда. Из левого желудочка создаются каналы в сеть капилляров и артерий в толщу сердца. Каналы создаются лазером. С его помощью создается канал диаметром около 1 мм. Из левого желудочка (лат. ventriculus sinister cordis) кровь, переносящая кислород, проникает в сеть сердечных капилляров. По окончании 3–4 месяцев происходит закрытие каналов. Но результат от операции сохраняется больше 2 лет. Такое хирургическое лечение ишемической болезни сердца не очень распространено.
Пересадка сердца
К этому способу прибегают в крайнем случае, если сердце сильно поражено патологическим процессом. А также при выраженной сердечно-сосудистой недостаточности. Но необходимо найти подходящего донора. Поэтому пересадку получают меньше 1% пациентов.
Мини-инвазивное вмешательство
При помощи эндоскопической техники врач соединяет ветви правой (right coronary artery) или левой (left coronary artery) коронарной артерии с кровеносным сосудом, проводящим кровь от сердечной мышцы к молочной железе. При этом травматизация уменьшается, а устройство «искусственное сердце – легкие» не нужно. Восстановительный период занимает меньше времени.