Чистая желтая сера
Минерал из класса самородных элементов. Сера представляет собой пример хорошо выраженного энантиоморфного полиморфизма. В природе образует 2 полиморфные модификации: a-сера ромбическая и b-сера моноклинная. При атмосферном давлении и температуре 95,6°С a-сера переходит в b-серу. Сера жизненно необходима для роста растений и животных, она входит в состав живых организмов и продуктов их разложения, ее много, например, в яйцах, капусте, хрене, чесноке, горчице, луке, волосах, шерсти и т.д. Она присутствует также в углях и нефти.
Смотрите так же:
СТРУКТУРА

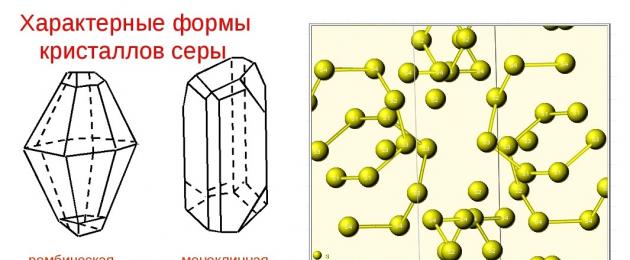
Самородная сера обычно представлена a-серой, которая кристаллизуется в ромбической сингонии, ромбо-дипирамидальный вид симметрии. Кристаллическая сера имеет две модификации; одну из них, ромбическую, получают из раствора серы в сероуглероде (CS 2) испарением растворителя при комнатной температуре. При этом образуются ромбовидные просвечивающие кристаллы светложелтого цвета, легко растворимые в CS 2 . Эта модификация устойчива до 96° С, при более высокой температуре стабильна моноклинная форма. При естественном охлаждении расплавленной серы в цилиндрических тиглях вырастают крупные кристаллы ромбической модификации с искаженной формой (октаэдры, у которых частично «срезаны» углы или грани). Такой материал в промышленности называется комовая сера. Моноклинная модификация серы представляет собой длинные прозрачные темножелтые игольчатые кристаллы, также растворимые в CS 2 . При охлаждении моноклинной серы ниже 96° С образуется более стабильная желтая ромбическая сера.
СВОЙСТВА

Самородная сера жёлтого цвета, при наличии примесей — жёлто-коричневая, оранжевая, бурая до чёрной; содержит включения битумов, карбонатов, сульфатов, глины. Кристаллы чистой серы прозрачны или полупрозрачны, сплошные массы просвечивают в краях. Блеск смолистый до жирного. Твердость 1-2, спайности нет, излом раковистый. Плотность 2,05 -2,08 г/см 3 , хрупкая. Легко растворима в канадском бальзаме, в скипидаре и керосине. В HCl и H 2 SO 4 нерастворима. HNO 3 и царская водка окисляют серу, превращая её в H 2 SO 4 . Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов.
Наиболее стабильны циклические молекулы S 8 , имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера - хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S 4 , S 6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета, которая получается при резком охлаждении расплава серы (пластическая сера уже через несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно превращается в ромбическую). Формулу серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами.
Плавление серы сопровождается заметным увеличением объёма (примерно 15 %). Расплавленная сера представляет собой жёлтую легкоподвижную жидкость, которая выше 160 °C превращается в очень вязкую тёмно-коричневую массу. Наибольшую вязкость расплав серы приобретает при температуре 190 °C; дальнейшее повышение температуры сопровождается уменьшением вязкости и выше 300 °C расплавленная сера снова становится подвижной. Это связано с тем, что при нагревании серы она постепенно полимеризуется, увеличивая длину цепочки с повышением температуры. При нагревании серы свыше 190 °C полимерные звенья начинают рушиться.
Сера может служить простейшим примером электрета. При трении сера приобретает сильный отрицательный заряд.
МОРФОЛОГИЯ

Образует усечённо-дипирамидальные, реже дипирамидальные, пинакоидальные или толстопризматические кристаллы, а также плотные скрытокристаллические, сливные, зернистые, реже тонковолокнистые агрегаты. Главные формы на кристаллах: дипирамиды (111) и (113), призмы (011) и (101), пинакоид (001). Также сростки и друзы кристаллов, скелетные кристаллы, псевдосталактиты, порошковатые и землистые массы, налёты и примазки. Для кристаллов характерны множественные параллельные срастания.
ПРОИСХОЖДЕНИЕ

Сера образуется при вулканических извержениях, при выветривании сульфидов, при разложении гипсоносных осадочных толщ, а также в связи с деятельностью бактерий. Главные типы месторождений самородной серы — вулканогенные и экзогенные (хемогенно-осадочные). Экзогенные месторождения преобладают; они связаны с гипсо-ангидритами, которые под воздействием выделений углеводородов и сероводорода восстанавливаются и замещаются серно-кальцитовыми рудами. Такой инфильтрационно-метасоматический генезис имеют все крупнейшие месторождения. Самородная сера часто образуется (кроме крупных cкоплений) в результате окисления H 2 S. Геохимические процессы её образования существенно активизируются микроорганизмами (сульфатредуцирующими и тионовыми бактериями). Сопутствующие минералы — кальцит, арагонит, гипс, ангидрит, целестин, иногда битумы. Среди вулканогенных месторождений самородной серы главное значение имеют гидротермально-метасоматические (например, в Японии), образованные сероносными кварцитами и опалитами, и вулканогенно-осадочные сероносные илы кратерных озёр. Образуется также при фумарольной деятельности. Образуясь в условиях земной поверхности, самородная сера является всё же не очень устойчивой и, постепенно окисляясь, даёт начало сульфатам, гл. образом гипсу.
Используется в производстве серной кислоты (около 50% добываемого количества). В 1890 г. Герман Фраш предложил плавить серу под землёй и извлекать на поверхность через скважины, и в настоящее время месторождения серы разрабатывают главным образом путём выплавки самородной серы из пластов под землёй непосредственно в местах её залегания. Сера также в больших количествах содержится в природном газе (в виде сероводорода и сернистого ангидрида), при добыче газа она откладывается на стенках труб, выводя их из строя, поэтому её улавливают из газа как можно быстрее после добычи.
ПРИМЕНЕНИЕ

Примерно половина производимой серы используется в производстве серной кислоты. Серу применяют для вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная - лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента - для получения серобетона. Сера находит применение для производства пиротехнических составов, ранее использовалась в производстве пороха, применяется для производства спичек.
Сера (англ. Sulphur) — S
КЛАССИФИКАЦИЯ
| Strunz (8-ое издание) | 1/B.03-10 |
| Nickel-Strunz (10-ое издание) | 1.CC.05 |
| Dana (7-ое издание) | 1.3.4.1 |
| Dana (8-ое издание) | 1.3.5.1 |
| Hey’s CIM Ref. | 1.51 |
Описание и свойства серы
Сера представляет собой вещество, которое находится в в 16 группе, под третьим периодом и имеет атомный номер – 16. Она может встретиться как в самородном, также и в связанном виде. Обозначается сера литерой S. Известна формула серы – (Ne)3s 2 3p 4 . Сера как элемент входит в состав многих белков.
На фото кристаллы серы
Если говорить о строении атома элемента серы , то на внешней его орбите есть электроны, валентное число которых достигает шести.
Это объясняет свойство элемента быть максимально шестивалентным в большинстве объединений. В структуре природного химического элемента есть четыре изотопа, и это – 32S, 33S, 34S и 36S. Говоря о внешней электронной оболочке, атом имеет схему 3s2 3р4. Радиус атома – 0,104 нанометра.
Свойства серы в первую очередь делятся на физического типа. К нему относится то, что элемент имеет твердый кристаллический состав. Два аллотропических видоизменения – основное состояние, в котором устойчив этот элемент серы.
Первое видоизменение ромбическое, имеющее лимонно-желтую окраску. Его устойчивость ниже, чем 95,6 °С. Второй – моноклинный, имеющий медово-желтую окраску. Его устойчивость колеблется от 95,6 °С и 119,3 °С.

На фото минерал сера
Во время плавки химический элемент стает движущейся жидкостью, имеющей желтый цвет. Она буреет, достигая температуры более 160 °С. А при 190 °С цвет серы превращается в темно-коричневый. После достижения отметки 190 °С наблюдается уменьшение вязкости вещества, которое все же после нагревания 300 °С стает жидкотекучим.
Другие свойства серы:
Практически не проводит тепла и электричества.
Не растворяется при погружении в воду.
Растворима в аммиаке, имеющем безводную структуру.
Также растворима в сероуглероде и других растворителях, имеющих органическую природу.
К характеристике элемента серы важно добавить и ее химические особенности. Она является активной в этом отношении. Если серу нагреть, то она может просто объединяться практически с любым химическим элементом.

На фото образец серы, добытый в Узбекистане
За исключением инертных газов. При контакте с металлами, хим. элемент образовывает сульфиды. Комнатная температура способствует тому, что элемент может вступить в реакцию с . Увеличенная температура способствует увеличению активности серы.
Рассмотрим, как поведение серы с отдельными веществами:
С металлами – является окислителем. Образовывает сульфиды.
С водородом – при высоких температурах – до 200 °С происходит активное взаимодействие.
С кислородом. Образовывается объединения оксидов при температурах до 280 °С.
С фосфором, углеродом – является окислителем. Только при отсутствии воздуха во время реакции.
С фтором – проявляет себя как восстановитель.
С веществами, имеющими сложную структуру – также как восстановитель.
Месторождения и добыча серы
Основной источник для получения серы – ее месторождения. В целом во всем мире насчитывается 1,4 млрд т запасов этого вещества. Ее добывают как при открытом и подземном способе выработки, так и с помощью выплавки из-под земли.

На фото добыча серы в вулкане Кава Иджен
Если применим последний случай, то используется вода, которую перегревают и расплавляют ею серу. В бедных рудах элемент содержится примерно в 12 %. Богатых – 25% и больше.
Распространенные типы месторождений:
Стратиформный – до 60%.
Солянокупольный – до 35 %.
Вулканогенный – до 5%.
Первый тип связан с толщами, несущими название сульфатно-карбонатных. При этом рудные тела, которые имеют мощность до нескольких десятков метров и с размером до сотни метров находятся в сульфатных породах.
Также эти пластовые залежи можно найти посреди пород сульфатного и карбонатного происхождения. Второй тип характеризуется залежами серого цвета, которые приурочиваются к соляным куполам.
Последний тип связывают с вулканами, имеющими молодую и современную структуру. При этом рудный элемент имеет пластообразную, линзовидную форму. В нем сера может содержаться в размере 40 %. Этот тип месторождения распространен в Тихоокеанском вулканическом поясе.
Месторождение серы в Евразии находится в Туркмении, в Поволжье и других местах. Породы серы находят возле левых берегов Волги, которые тянутся от Самары. Ширина полосы пород достигает нескольких километров. При этом их можно найти вплоть до Казани.

На фото сера в горной породе
В Техасе и Луизиане в кровлях соляных куполов находят огромное количество серы. Особо красивые Италийские этого элемента находят Романьи и Сицилии. А на острове Вулькано находят моноклинную серу. Элемент, который был окислен пиритом, нашли на Урале в Челябинской области.
Для добычи серы хим элемента используют разные способы. Все зависит от условия его залегания. При этом, конечно же, особое внимание уделяют безопасности.
Так как вместе с серной рудой скопляется сероводород, то необходимо особо серьезно подходить к любому способу добычи, ведь этот газ ядовитый для человека. Также и сера имеет свойство возгораться.
Чаще всего пользуются открытым способом. Так с помощью экскаваторов снимаются значительные части пород. Затем с помощью взрывов дробится рудная часть. Глыбы отправляются на фабрику для обогащения. Затем – на завод по плавке серы, где и получают серу из концентрата.

На фото сера в порту, привезенная морским транспортом
В случае глубокого залегания серы во многих объемах, используют метод Фраша. Сера расплавляется, находясь еще под землей. Затем, как и нефть выкачивается наружу через пробитую скважину. Такой подход основывается на том, что элемент легко плавится и имеет небольшую плотность.
Также известен способ разделения на центрифугах. Только этот способ имеет недостаток: сера получается с примесями. И тогда необходимо проводить ее дополнительную очистку.
В некоторых случаях используют скважный метод. Другие возможности добычи серного элемента:
Пароводяной.
Фильтрационный.
Термический.
Центрифугальный.
Экстракционный.
Применение серы
Большая часть добытой серы уходит, чтоб изготовить серную кислоту. А роль этого вещества очень огромная в химическом производстве. Примечательно, что для получения 1 тонны серного вещества необходимо 300 кг серы.
Бенгальские огни, которые ярко светятся и имеют много красителей, также производятся с помощью серы. Бумажная промышленность – это еще одна область, куда уходит значительная часть добытого вещества.

На фото серная мазь
Чаще всего применение сера находит при удовлетворении производственных нужд. Вот некоторые из них:
Использование в химическом производстве.
Для изготовления сульфитов, сульфатов.
Изготовление веществ для удобрения растений.
Чтоб получить цветные виды металлов.
Для придачи стали дополнительных свойств.
Для изготовления спичек, материалов для взрывов и пиротехники.
Краски, волокна из искусственных материалов – изготовляются при помощи этого элемента.
Для отбеливания ткани.
В некоторых случаях элемент сера входит в мази, которые лечат кожные болезни.
Цена серы
По последним новостям необходимость в сере активно растет. Стоимость на российский продукт равняется 130 долларам. На канадский вариант – 145 долларов. А вот в Ближнем Востоке цены возросли до 8 долларов, что привело к стоимости в 149 долларов.

На фото крупный экземпляр минерала сера
В аптеках можно найти молоту в порошок серу по цене от 10 до 30 рублей. К тому же есть возможность купить ее оптом. Некоторые организации предлагают по невысокой цене приобрести гранулированную техническую газовую серу .
Можно выделить следующие генетические типы: 1) магматические, 2) карбонатитовые, 3) скарновые, 4) гидротермальные и пневматолитовые, 5) вулканогенно-осадочные, 6) подземноводные и газонефтяные, 7) осадочные.
К магматическим месторождениям серы следует относить ликвационные медно-никелевые месторождения, сера в которых формирует сульфиды , , , и других металлов и извлекается попутно при переработке руд цветных металлов. Примеры - Талнахское и другие месторождение в России, Сёдбери в Канаде.
К карбонатитовым месторождениям серы относятся редко встречаемые гипс-барит-флюоритовые, связанные с апикальными частями карбонатитовых комплексов. Сера извлекается из . Пример - месторождение Амба-Донгар в Индии.
К скарновым месторождениям серы относятся медные и полиметаллические месторождения, сера которых также представлена сульфидами различных металлов: железа, меди, , и др. Извлекаются они попутно с получением металлов. Примеры - Турьинские медные рудники Урала, полиметаллические месторождения Кара- Мазара в Средней Азии.
Среди гидротермальных месторождений серы следует выделять плутоногенные и вулканогенные. К плутоногенным относятся медные н полиметаллические месторождения, сера которых формирует сульфиды железа и цветных металлов; извлекается она попутно. Примеры - полиметаллические месторождения Забайкалья. Среди гидротермальных вулканогенных месторождений выделяется ряд формаций. К этому типу следует относить формации самородной серы в вулканических образованиях. Это и метасоматические залежи (точнее, импрегнационно-метасоматические, так как часть серы формируется не путем замещения, а путем выполнения пустот) серы в приповерхностных зонах вулканических построек, преимущественно среди опалитов, и месторождения серных потоков и кратерных расплавов, а также месторождения, формирующиеся из серосодержащих газов и горячих вод непосредственно в поверхностных условиях.
Для импрегнационно-метасоматических месторождений, играющих ведущую роль в вулканогенной группе, характерна определенная метасоматическая зональность, при этом среди характерных пород здесь наблюдаются и сами серные руды - сероносные опалиты, и алунитовые породы, пропилиты и монтмориллонитизированные вулканиты. Примеры - Новое на Курильских островах, Мелитойваямское на Камчатке, ряд месторождений Японии. Этот тип месторождений возникает при воздействии сероносных газов и растворов на вулканические постройки, при этом интенсивно выщелачивается ряд металлов, в том числе железо и , а кремнезем остается и формирует существенно опаловые породы - опалиты.
Нередко наряду с самородной серой и серосодержащим минералом алунитом отмечается и сульфид серы - мельниковит. Месторождения серных потоков возникают при расплавлении ранее возникших серных залежей при активизации вулканов. Например, серный поток, вынесший 200 тыс. т серы, наблюдался в Японии на вулкане Сиеретоко-Иоцан. В некоторых вулканах в кратерах имеются серные расплавы (например, на островах Галапагос). Поверхностные небольшие месторождения серы, в том числе сульфуриты, формируются из серосодержащих вод и газов. Они известны на вулкане Менделеева и ряде вулканов Японии.
К вулканогенно-осадочным месторождениям серы относятся кратерно-озерные месторождения самородной серы, а также месторождения колчеданных руд, формирующиеся при поступлении сероносных вулканогенных гидротерм в морские бассейны. Примером кратерно-озерных месторождений служит одно из крупных месторождений Индонезии Телага Бодае. К колчеданным вулканогенно-осадочным месторождениям принадлежит ряд месторождений Испании и Португалии, играющих заметную роль в получении сульфидной серы. К этому типу можно отнести и некоторые месторождения цветных металлов, из руд которых сера извлекается как попутный компонент.
Существенное значение в добыче серы имеют подземноводные и газонефтяные месторождения серы
. Подземно-водные месторождения возникают при метасоматическом замещении гипсов и ангидритов серокальцитовыми рудами. Процесс этот осуществляется на определенном расстоянии от поверхности земли, т. е. может начаться только после определенного уровня денудации, вызывающего приближение продуктивных горизонтов гипсов и ангидритов к поверхности. При этом существенную роль играют процессы эрозии, в частности деятельность древних долин, приближающих сульфатоносные слои к поверхности, а также наличие разрывных нарушений, облегчающих миграцию вод, в том числе подъем глубинных вод. К этому типу месторождений относятся наиболее крупные месторождения серы России, стран Ближнего Востока и др.
Разновидностью месторождений данного типа являются месторождения серы в кепроках соляных куполов. Кепроки, или остаточные шляпы, возникают при растворении верхних частей растущих: соляных куполов. Строение их зональное: непосредственно выше солей, в области фронта их растворения, представленного «соляным зеркалом», располагаются гипсы и ангидриты, выше - зона карбонатных пород, а над ней нередко отмечаются скопления глин, как наиболее труднорастворимого остатка соляной толщи. Осернению подвергаются породы зоны сульфатов кальция (см. рис. 30). Пример этого подтипа месторождений - месторождения серы Мексиканского залива.
В газовых месторождениях сера входит в состав сероводорода, который попутно извлекается при добыче природных горючих газов. Такие месторождения известны в Канаде, Франции, России (Оренбургские месторождения газа). Месторождения сернистых нефтей известны в ряде стран. Сера извлекается попутно при переработке .
К осадочным месторождениям серы относятся гипсоангидритовые месторождения, из которых получают серу в ряде стран, а также колчедансодержащие каменные и бурые и скопления пирита и марказита в песчаниках и глинистых породах, в том числе в глинистых . Из угля соединения серы извлекают как в процессе обогащения углей, так и при получении кокса. Пример - Подмосковный буроугольный бассейн. Скопления, в том числе желваки железного колчедана, известны в песчано-глинистых отложениях ряда стран, в том числе , Россия и др. Иногда отмечаются сплошные залежи колчеданов (не желваки или караваи), правда в таком случае не исключается эффузивно-осадочный генезис этих пластов и линз сплошных колчеданных руд.
В некоторых случаях отмечается формирование осадочных скоплений самородной серы, однако промышленные скопления этого типа пока не установлены.
Сегодня именно химическая промышленность потребляет наибольшее количество серы. Наиболее важной является серная кислота. Именно поэтому на ее изготовление уходит почти половина серы, которая добывается по всему миру. Из трехсот кг серы при сжигании получается около одной тонны серной кислоты.
Еще одной отраслью промышленности, которая неразрывно связана с добываемой серой и потребляет ее существенную часть, является производство бумаги. Чтобы получить 17 целлюлозы требуется использовать не меньше ста кг серы.
Применение серы в резиновой промышленности
Для того, чтобы превратить каучук в резину чаще всего используется сера. При смешивании с серой и нагревании до нужной температуры каучук приобретает свойства, за которые очень ценится среди потребителей, – упругость и эластичность. Этот процесс еще называют вулканизацией.
Она бывает:
- Горячей. Предложена Гудиром в 1839 году. Смесь каучука и серы нагревается примерно до 150 градусов Цельсия.
- Холодной. Предложена Парксом в 1846 году. Каучук не нагревается, а обрабатывается с раствором хлорида серы S2C12.
Вулканизацию проводят с целью появления в веществе связей между полимерными группами.
Большинство важных физико-механических свойств материала, прошедшего вулканизацию, зависят от того, из чего состоят, как распределены и сколько энергии содержат связи -С-Sn-С-. Например, при разной концентрации добавляемой серы могут получиться абсолютно различные материалы с отличающимися свойствами.
Сера в сельском хозяйстве и медицине
Сера в чистом виде и в соединениях с другими элементами с успехом применяется для сельскохозяйственных целей. Она также значима для растений, как фосфор. Удобрения, имеющие в своем составе серу, положительно влияют и на качество собранного урожая, и на его количество.
Опытным путем ученые выявили влияние серы на устойчивость злаков к морозам. Она провоцирует образование органических веществ, которые содержит сульфгидрильные группы-S-Н. Благодаря этому повышается морозостойкость растения за счет гидрофильности белков и изменения внутренней структуры. Еще одним способом использовать серу для сельскохозяйственных нужд является ее применение в предотвращении болезней, в основном хлопчатника и винограда.
 Для медицинских целей может быть использована и чистая сера, а также ее соединения с другими элементами. Основа для многих мазей, которые используются для лечения разных грибковых заболеваний кожи – это мелкодисперсная сера. Большинство препаратов сульфамидной группы – это ничто иное, как соединения разных веществ с серой: сульфадимезин, норсульфазол, белый стрептоцид.
Для медицинских целей может быть использована и чистая сера, а также ее соединения с другими элементами. Основа для многих мазей, которые используются для лечения разных грибковых заболеваний кожи – это мелкодисперсная сера. Большинство препаратов сульфамидной группы – это ничто иное, как соединения разных веществ с серой: сульфадимезин, норсульфазол, белый стрептоцид.
Сегодня объем добычи серы превышает необходимое количество сырья для промышленности. Ее добывают не только из глубины земли, но и из газов или при очищении топлива. В связи с этим придумываются новые способы применения вещества, например, в строительстве. Так, в Канаде изобрели пенопласт из серы, который планируется использовать при укладке дорог и для прокладывания трубопровода за пределами полярного круга. А в Монреале был построен первый в мире дом из необычных по составу блоков, которые на треть состоят из серы (остальное песок). Для изготовления таких блоков используют металлические формы, в которых нагревают смесь до температуры больше 100 градусов Цельсия. Они такие же прочные и устойчивые к износу, как их цементные аналоги. Избежать окисления поможет простая обработка синтетическим лаком. Из таких блоков можно построить гараж или склад, магазин или дом.
Сегодня все чаще можно встретить информацию о появлении новых стройматериалов, которые содержат серу. Ни для кого уже не секрет, что при использовании серы получается асфальтовое покрытие, обладающее отличными свойствами. Оно может сравниться с покрытием из гравия и даже превзойти его. Достаточно выгодно использовать его при строительстве автострады. Для получения такого состава необходимо смешать одну часть асфальта, две части серы и 13 частей песка.
Потребность в данном сырье растет. Продажи серы в долгосрочной перспективе будут только увеличиваться.
Сера - золотисто-желтое токсическое вещество
и признак активной вулканической деятельности
Токсические и ядовитые камни и минералы
Сера (лат. Sulfur) S, химический элемент VI группы периодической системы Д.И. Менделеева; атомный номер 16, атомная масса 32,06. Природная сера состоит из четырех стабильных изотопов: 32 S (95,02%), 33 S (0,75%), 34 S (4,21%), 36 S (0,02%). Получены искусственные радиоактивные изотопы 31 S (T ½ = 2,4 сек), 35 S (T ½ = 87,1 сут), 37 S (Т ½ = 5,04 мин) и другие.
Историческая справка.
Сера в самородном состоянии, а также в виде сернистых соединений известна с древнейших времен. Она упоминается в Библии и Торе евреев (рукописи Мертвого моря), поэмах Гомера и других. Сера входила в состав "священных" курений при религиозных обрядах (одурманивание пришедших – пьют ртруть и дают красную киноварь в порошке); считалось, что запах горящей серы в сатанинских обрядах ("Все женщины - ведьмы", г. Альмаден, Испания, континент, вместо работы в шахтах на промышленной красной киновари) отгоняет духов (вызывает фрагментированные поражения ствола спинного мозга и головного мозга в основании входащих в него нервов). Серу не применяют в церкви на службах - вместо нее используют более безопасный порошок янтаря (в т.ч. амброид - похож на серу, тоже хрупкий, но более легкий по весу и электризуется при трении, в отличие от серы). Серу в церкви не воскуривают (ересь). Вызывает аборты.
Сера давно стала компонентом зажигательных смесей для военных целей, например "греческого огня" (10 в. н. э.). Около 8 века в Китае стали использовать серу в пиротехнических целях. Издавна серой и ее соединениями лечили кожные заболевания. В период средневековой алхимии (обработка золотисто-желтого и беловатого с серебром и платиной золота жидкой ртутью и красной киноварью с целью получения белой амальгамы, похожей на серебро, т.н. "белое золото") возникла гипотеза, согласно которой сера (начало горючести) и ртуть (начало металличности) считали составными частями всех металлов. Элементарную природу серы установил А. Л. Лавуазье и включил ее в список неметаллических простых тел (1789). В 1822 году Э. Мичерлих доказал аллотропию серы.

Щетка кристаллов серы (60х40 см) с о-ва Сицилия (Италия). Фото: В.И. Дворядкин.

Золото в гальке кварца из битакских конгломератов. Симферополь, Крым (Украина). Фото: А.И. Тищенко.
Страшный имитатор серы, особенно в кристаллах и включениях. Золото - ковкое, сера - хрупкая.
Распространение серы в природе.
Сера относится к весьма распространенным химическим элементам (кларк 4,7 * 10 -2); встречается в свободном состоянии (самородная сера) и в виде соединений - сульфидов, полисульфидов, сульфатов. Вода морей и океанов содержит сульфаты натрия, магния, кальция. Известно более 200 минералов серы, образующихся при эндогенных процессах. В биосфере образуется свыше 150 минералов сера (преимущественно сульфатов); широко распространены процессы окисления сульфидов до сульфатов, которые в свою очередь восстанавливаются до вторичного H 2 S и сульфидов. Очень опасна - проявляется на вулканах, где наблюдается дефицит воды, сухая возгонка от очагов раскаленной магмы по фумаролам, видимым и невидимым трещинам, с вторичной пиритизацией и пр.
Эти реакции происходят при участии микроорганизмов. Многие процессы биосферы приводят к концентрации серы - она накапливается в гумусе почв, углях, нефти, морях и океанах (8,9 * 10 -2 %), подземных водах, в озерах и солончаках. В глинах и сланцах серы в 6 раз больше, чем в земной коре в целом, в гипсе - в 200 раз, в подземных сульфатных водах - в десятки раз. В биосфере происходит круговорот серы: она приносится на материки с атмосферными осадками и возвращается в океан со стоком. Источником сера в геологическом прошлом Земли служили главным образом продукты извержения вулканов, содержащие SO 2 и H 2 S. Хозяйственная деятельность человека ускорила миграцию серы; интенсифицировалось окисление сульфидов.

Сера (желтая). Роздольское м-ние, Прикарпатье, Зап. Украина. Фото: А.А. Евсеев.

Арагонит (белая), сера (желтая). Чианчиана, Сицилия, Италия. Фото: А.А. Евсеев.
Физические свойства серы.
Сера - твердое кристаллическое вещество, устойчивое в виде двух аллотропических модификаций. Ромбическая α-S лимонно-желтого цвета, плотность 2,07 г/см 3 , t пл 112,8 o С, устойчива ниже 95,6 o С; моноклинная β-S медово-желтого цвета, плотность 1,96 г/см 3 , t пл 119,3 o С, устойчива между 95,6 o С и температурой плавления. Обе эти формы образованы восьмичленными циклическими молекулами S 8 с энергией связи S-S 225,7 кдж/моль.
При плавлении сера превращается в подвижную желтую жидкость, которая выше 160 o С буреет, а около 190 o С становится вязкой темно-коричневой массой. Выше 190 o С вязкость уменьшается, а при 300 o С сера вновь становится жидкотекучей. Это обусловлено изменением строения молекул: при 160 o С кольца S 8 начинают разрываться, переходя в открытые цепи; дальнейшее нагревание выше 190 o С уменьшает среднюю длину таких цепей.
Если расплавленную серу, нагретую до 250-300 o С, влить тонкой струей в холодную воду, то получается коричнево-желтая упругая масса (пластическая сера). Она лишь частично растворяется в сероуглероде, в осадке остается рыхлый порошок. Растворимая в CS 2 модификация называется λ-S, а нерастворимая - μ-S. Температура плавления, 113 o С (ромб.), 119 o С (монокл.). Температура кипения 444 o С.
При комнатной температуре обе эти модификации превращаются в устойчивую хрупкую α-S. t кип серы 444,6 o С (одна из стандартных точек международной температурной шкалы). В парах при температуре кипения, кроме молекул S 8 , существуют S 6 , S 4 и S 2 . При дальнейшем нагревании крупные молекулы распадаются, и при 900 o С остаются лишь S 2 , которые приблизительно при 1500 o С заметно диссоциируют на атомы. При замораживании жидким азотом сильно нагретых паров серы получается устойчивая ниже -80 o С пурпурная модификация, образованная молекулами S 2 .
Сера - плохой проводник тепла и электричества. В воде она практически нерастворима, хорошо растворяется в безводном аммиаке, сероуглероде и в ряде органических растворителей (фенол, бензол, дихлорэтан и других).
ДОПОГ 2.1
Легковоспламеняющиеся газы
Риск пожара. Риск взрыва. Могут находиться под давлением. Риск удушья. Могут вызывать ожоги и/или отморожения. Емкости могут взрываться при нагревании (сверхопасны - практически не горят)
ДОПОГ 2.2
Газовый баллон
Невоспламеняющиеся, нетоксичные газы.
Риск удушья. Могут находиться под давлением. Могут вызывать отморожение (похоже на ожог - бледность, пузыри, черная газовая гангрена - скрип). Емкости могут взрываться при нагревании (сверхопасны – взрыв от искры, пламени, спички, практически не горят)
Использовать укрытие. Избегать низких участков поверхности (ям, низин, траншей)
Зеленый ромб, номер ДОПОГ, черный или белый газовый баллон (типа "баллон", "термос")
ДОПОГ 2.3
Токсичные газы
. Череп и скрещенные кости
Опасность отравления. Могут находиться под давлением. Могут вызывать ожоги и/или отморожения. Емкости могут взрываться при нагревании (сверхопасны – мгновенное распространение газов по окрестности)
Использовать маску для аварийного оставления транспортного средства. Использовать укрытие. Избегать низких участков поверхности (ям, низин, траншей)
Белый ромб, номер ДОПОГ, черный череп и скрещенные кости
ДОПОГ 3
Легковоспламеняющиеся жидкости
Риск пожара. Риск взрыва. Емкости могут взрываться при нагревании (сверхопасны – легко горят)
Использовать укрытие. Избегать низких участков поверхности (ям, низин, траншей)
Красный ромб, номер ДОПОГ, черное или белое пламя
ДОПОГ 4.1
Легковоспламеняющиеся твердые вещества
, самореактивные вещества и твердые десенсибилизированные взрывчатые вещества
Риск пожара. Легковоспламеняющиеся или горючие вещества могут загораться от искр или пламени. Могут содержать самореактивные вещества, способные к экзотермическому разложению в случае нагревания, контакта с другими веществами (такими как: кислоты, соединения тяжелых металлов или амины), трению или удару.
Это может привести к выделению вредных или легковоспламеняющихся газов или пары или самовоспламенения. Емкости могут взрываться при нагревании (сверхопасны - практически не горят).
Риск взрыва десенсибилизированных взрывчатых веществ после потери десенсибилизатора
Семь вертикальных красных полос на белом фоне, равновеликие, номер ДОПОГ, черное пламя
ДОПОГ 8
Коррозийные (едкие) вещества
Риск ожогов в результате разъедания кожи. Могут бурно реагировать между собой (компоненты), с водой и другими веществами. Вещество, что разлилось / рассыпалось, может выделять коррозийную пару.
Составляют опасность для водной окружающей среды или канализационной системы
Белая верхняя половина ромба, черная - нижняя, равновеликие, номер ДОПОГ, пробирки, руки
| Наименование особо опасного при транспортировке груза | Номер ООН | Класс ДОПОГ |
| Ангидрид серный, стабилизированный СЕРЫ ТРИОКСИД СТАБИЛИЗИРОВАННЫЙ | 1829 | 8 |
| Ангидрид серист СЕРЫ ДИОКСИД | 1079 | 2 |
| Углероду дисульфид СЕРОУГЛЕРОД | 1131 | 3 |
| Газ СЕРЫ ГЕКСАФТОРИД | 1080 | 2 |
| КИСЛОТА СЕРНАЯ ОТРАБОТАННАЯ | 1832 | 8 |
| КИСЛОТА СЕРНАЯ ДЫМЯЩАЯСЯ | 1831 | 8 |
| КИСЛОТА СЕРНАЯ, что содержит не более 51% кислоты, или ЖИДКОСТЬ АККУМУЛЯТОРНАЯ КИСЛОТНАЯ | 2796 | 8 |
| КИСЛОТА СЕРНАЯ, РЕГЕНЕРИРОВАННАЯ ИЗ КИСЛОГО ГУДРОНА | 1906 | 8 |
| КИСЛОТА СЕРНАЯ, что содержит более 51% кислоты | 1830 | 8 |
| КИСЛОТА СЕРНАЯ | 1833 | 8 |
| СЕРА | 1350 | 4.1 |
| СЕРА РАСПЛАВЛЕНА | 2448 | 4.1 |
| Сера хлористая СЕРЫ ХЛОРИДЫ | 1828 | 8 |
| Сера шестифтористая СЕРЫ ГЕКСАФТОРИД | 1080 | 2 |
| Серы дихлорид | 1828 | 8 |
| СЕРЫ ДИОКСИД | 1079 | 2 |
| СЕРЫ ТЕТРАФТОРИД | 2418 | 2 |
| СЕРЫ ТРИОКСИД СТАБИЛИЗИРОВАННЫЙ | 1829 | 8 |
| СЕРЫ ХЛОРИДЫ | 1828 | 8 |
| СЕРОВОДОРОД | 1053 | 2 |
| СЕРОУГЛЕРОД | 1131 | 3 |
| СПИЧКИ БЕЗОПАСНЫЕ в коробках, книжечках, картонках | 1944 | 4.1 |
| СПИЧКИ ПАРАФИНОВЫЕ „ВЕСТА” | 1945 | 4.1 |
| Спички парафиновые СПИЧКИ ПАРАФИНОВЫЕ „ВЕСТА” | 1945 | 4.1 |
| СПИЧКИ САПЕРНЫЕ | 2254 | 4.1 |