План лекции 1. Конечные продукты азотистого обмена: соли аммония, мочевина и мочевая кислота. 1. Конечные продукты азотистого обмена: соли аммония, мочевина и мочевая кислота. 2. Обезвреживание аммиака: синтез глутамина и карбамилфосфата, восстановительное аминирование 2- оксоглутарата. 2. Обезвреживание аммиака: синтез глутамина и карбамилфосфата, восстановительное аминирование 2- оксоглутарата. 3. Глутамин как донор амидной группы при синтезе ряда соединений. Глутаминаза почек, образование и выведение солей аммония. Адаптивная активация глутаминазы почек при ацидозе. 3. Глутамин как донор амидной группы при синтезе ряда соединений. Глутаминаза почек, образование и выведение солей аммония. Адаптивная активация глутаминазы почек при ацидозе.

План лекции 4. Биосинтез мочевины. 4. Биосинтез мочевины. 5. Связь орнитинового цикла с превращениями фумаровой и аспарагиновой кислот; происхождение атомов азота мочевины. 5. Связь орнитинового цикла с превращениями фумаровой и аспарагиновой кислот; происхождение атомов азота мочевины. 6. Биосинтез мочевины как механизм предотвращения образования аммиака. Уремия. 6. Биосинтез мочевины как механизм предотвращения образования аммиака. Уремия.

КОНЕЧНЫЕ ПРОДУКТЫ: АММИАК КОНЕЧНЫЕ ПРОДУКТЫ: АММИАК Деградация аминокислот происходит преимущественно в печени. При этом непосредственно или косвенно освобождается аммиак. Значительные количества аммиака образуются при распаде пуринов и пирамидинов. Деградация аминокислот происходит преимущественно в печени. При этом непосредственно или косвенно освобождается аммиак. Значительные количества аммиака образуются при распаде пуринов и пирамидинов.


ТОКСИЧНОСТЬ АММИАКА Аммиак - NH 3 является клеточным ядом. При высоких концентрациях он повреждает главным образом нервные клетки (гепатаргическая кома). Аммиак - NH 3 является клеточным ядом. При высоких концентрациях он повреждает главным образом нервные клетки (гепатаргическая кома). В норме распад 70 г АК в сутки ведет к концентрации NH 3 в крови 60 мкмоль/л, что в 100 раз меньше концентрации глюкозы в крови. В норме распад 70 г АК в сутки ведет к концентрации NH 3 в крови 60 мкмоль/л, что в 100 раз меньше концентрации глюкозы в крови.

Токсичность аммиака В опытах на кроликах концентрация В опытах на кроликах концентрация NH 3 3 ммоль/л вызывала смерть! NH 3 3 ммоль/л вызывала смерть! Причины токсичности: Причины токсичности: 1. при рН крови в виде NH 4 +, проникает через плазм. и МХ мембраны с большим трудом. 1. при рН крови в виде NH 4 +, проникает через плазм. и МХ мембраны с большим трудом.

Нейтр. мол. своб. NH 3 легко проходят эти мембраны. При рН 7.4 только 1% NH 3 от общего количества аммиака проникает в клетки мозга и МХ. Нейтр. мол. своб. NH 3 легко проходят эти мембраны. При рН 7.4 только 1% NH 3 от общего количества аммиака проникает в клетки мозга и МХ.

Причины токсичности 2. NH 3 + а-КГ + НАДФН NH 3 + а-КГ + НАДФН 2 - Глу Н 2 О Глу + НАДФ + Н 2 О Отток альфа- КГ из фонда ЦТК и как следствие – снижение скорости окисления глюкозы

Токсичность аммиака Аммиак настолько токсичен, что должен быть немедленно удален посредством того или иного экскреторного механизма, либо путем включения в какое-то другое азотсодержащее соединение, не обладающее подобной токсичностью. Аммиак настолько токсичен, что должен быть немедленно удален посредством того или иного экскреторного механизма, либо путем включения в какое-то другое азотсодержащее соединение, не обладающее подобной токсичностью.

Глу. 3. Аминирование а-КГ --> Глу. 4. Амидирование белков. 4. Амидир" title="Механизмы детоксикации аммиака 1. Синтез глутамина: Глн, аспарагина: Асн. 1. Синтез глутамина: Глн, аспарагина: Асн. 2. Синтез мочевины. 2. Синтез мочевины. 3. Аминирование а-КГ --> Глу. 3. Аминирование а-КГ --> Глу. 4. Амидирование белков. 4. Амидир" class="link_thumb"> 11 Механизмы детоксикации аммиака 1. Синтез глутамина: Глн, аспарагина: Асн. 1. Синтез глутамина: Глн, аспарагина: Асн. 2. Синтез мочевины. 2. Синтез мочевины. 3. Аминирование а-КГ --> Глу. 3. Аминирование а-КГ --> Глу. 4. Амидирование белков. 4. Амидирование белков. Глу. 3. Аминирование а-КГ --> Глу. 4. Амидирование белков. 4. Амидир"> Глу. 3. Аминирование а-КГ --> Глу. 4. Амидирование белков. 4. Амидирование белков."> Глу. 3. Аминирование а-КГ --> Глу. 4. Амидирование белков. 4. Амидир" title="Механизмы детоксикации аммиака 1. Синтез глутамина: Глн, аспарагина: Асн. 1. Синтез глутамина: Глн, аспарагина: Асн. 2. Синтез мочевины. 2. Синтез мочевины. 3. Аминирование а-КГ --> Глу. 3. Аминирование а-КГ --> Глу. 4. Амидирование белков. 4. Амидир"> title="Механизмы детоксикации аммиака 1. Синтез глутамина: Глн, аспарагина: Асн. 1. Синтез глутамина: Глн, аспарагина: Асн. 2. Синтез мочевины. 2. Синтез мочевины. 3. Аминирование а-КГ --> Глу. 3. Аминирование а-КГ --> Глу. 4. Амидирование белков. 4. Амидир">
Механизмы детоксикации аммиака 5. Синтез пурин. и пирамид. структур. 5. Синтез пурин. и пирамид. структур. 6. Нейтрализация в почках кислотами и выделение с мочой аммонийных солей. 6. Нейтрализация в почках кислотами и выделение с мочой аммонийных солей.

Обезвреживание аммиака В организмах автотрофов большая часть образующегося аммиака может вновь использоваться для синтеза новых клеточных структур. Гетеротрофы же обычно получают с пищей значительное количество белка, усвоение которого легко может привести к накоплению большого количества конечных продуктов азотистого обмена. Удаление этих отходов требует создания соответствующего аппарата. В организмах автотрофов большая часть образующегося аммиака может вновь использоваться для синтеза новых клеточных структур. Гетеротрофы же обычно получают с пищей значительное количество белка, усвоение которого легко может привести к накоплению большого количества конечных продуктов азотистого обмена. Удаление этих отходов требует создания соответствующего аппарата.

Обезвреживание аммиака Организм, живущий в водной среде, может выделять аммиак непосредственно, поскольку он будет немедленно разбавлен водой, не оказывая никакого или почти никакого вредного влияния на клетки. Экскреция аммиака у животных, обитающих в засушливых областях, потребовала бы для его разведения использования собственных водных ресурсов. Организм, живущий в водной среде, может выделять аммиак непосредственно, поскольку он будет немедленно разбавлен водой, не оказывая никакого или почти никакого вредного влияния на клетки. Экскреция аммиака у животных, обитающих в засушливых областях, потребовала бы для его разведения использования собственных водных ресурсов. Поэтому у многих видов аммиак превращается в организме в некоторые другие соединения, обладающие меньшей токсичностью. Поэтому у многих видов аммиак превращается в организме в некоторые другие соединения, обладающие меньшей токсичностью.

Восстановительное аминирование Большинство организмов обладает способностью реутилизировать аммиак за счет реакции, катализируемой глутаматдегидрогеназой. Большинство организмов обладает способностью реутилизировать аммиак за счет реакции, катализируемой глутаматдегидрогеназой. А-Кетоглутарат + NH3 + НАДФН.Н+ А-Кетоглутарат + NH3 + НАДФН.Н+ Глутамат + НАДФ+. Глутамат + НАДФ+. Это восстановительное аминирование. Это восстановительное аминирование. Однако все же некоторая часть образовавшегося аммиака остается неиспользованной и в конце концов выводится из организма беспозвоночных и позвоночных либо в свободном виде, либо в форме мочевой кислоты, либо в форме мочевины. Однако все же некоторая часть образовавшегося аммиака остается неиспользованной и в конце концов выводится из организма беспозвоночных и позвоночных либо в свободном виде, либо в форме мочевой кислоты, либо в форме мочевины.







МОЧЕВИНА МОЧЕВИНА У человека инактивация аммиака осуществляется прежде всего за счет синтеза мочевины, часть NH 3 выводится непосредственно почками. У человека инактивация аммиака осуществляется прежде всего за счет синтеза мочевины, часть NH 3 выводится непосредственно почками.

АММОНИОТЕЛИЧЕСКИЕ ОРГАНИЗМЫ У разных видов позвоночных инактивация и выведение аммиака производятся различными способами. Живущие в воде животные выделяют аммиак непосредственно а воду; например, у рыб он выводится через жабры (аммониотелические организмы). У разных видов позвоночных инактивация и выведение аммиака производятся различными способами. Живущие в воде животные выделяют аммиак непосредственно а воду; например, у рыб он выводится через жабры (аммониотелические организмы).

УРЕОТЕЛИЧЕСКИЕ ОРГАНИЗМЫ Наземные позвоночные, в том числе человек, выделяют лишь небольшое количество аммиака, а основная его часть превращается в мочевину (уреотелические организмы). Наземные позвоночные, в том числе человек, выделяют лишь небольшое количество аммиака, а основная его часть превращается в мочевину (уреотелические организмы).

УРИКОТЕЛИЧЕСКИЕ ОРГАНИЗМЫ Птицы и рептилии, напротив, образуют мочевую кислоту, которая в связи с экономией воды выделяется преимущественно в твердом виде (урикотелические организмы). Птицы и рептилии, напротив, образуют мочевую кислоту, которая в связи с экономией воды выделяется преимущественно в твердом виде (урикотелические организмы).

Синтез мочевины Мочевина в противоположность аммиаку это нейтральное и нетоксичное соединение. Небольшая молекула мочевины может проходить через мембраны, а также из-за ее хорошей растворимости в воде мочевина легко переносится кровью и выводится с мочой. Мочевина в противоположность аммиаку это нейтральное и нетоксичное соединение. Небольшая молекула мочевины может проходить через мембраны, а также из-за ее хорошей растворимости в воде мочевина легко переносится кровью и выводится с мочой.

СТАДИИ СИНТЕЗА МОЧЕВИНЫ Мочевина образуется в результате циклической последовательности реакций, протекающих в печени. Мочевина образуется в результате циклической последовательности реакций, протекающих в печени. Оба атома азота берутся из свободного аммиака и за счет дезаминирования аспартата, карбонильная группа из гидрокарбоната. Оба атома азота берутся из свободного аммиака и за счет дезаминирования аспартата, карбонильная группа из гидрокарбоната.

Первая реакция На первой стадии, реакция , из гидрокарбоната (НСО3-) и аммиака с потреблением 2 молекул АТФ образуется карбамилфосфат. На первой стадии, реакция , из гидрокарбоната (НСО3-) и аммиака с потреблением 2 молекул АТФ образуется карбамилфосфат.


Вторая стадия Вторая стадия На следующей стадии, реакция , карбамоильный остаток переносится на орнитин с образованием цитруллина. Для этой реакции вновь необходима энергия в форме АТФ, который при этом расщепляется на АМФ и дифосфат. На следующей стадии, реакция , карбамоильный остаток переносится на орнитин с образованием цитруллина. Для этой реакции вновь необходима энергия в форме АТФ, который при этом расщепляется на АМФ и дифосфат.











ВЕЛОСИПЕД КРЕБСА Фумарат, образующийся в цикле мочевины, может в результате двух стадий цитратного цикла через малат переходить в оксалоацетат, который за счет трансаминирования далее прекращается в аспартат. Последний также вновь вовлекается в цикл мочевины. Фумарат, образующийся в цикле мочевины, может в результате двух стадий цитратного цикла через малат переходить в оксалоацетат, который за счет трансаминирования далее прекращается в аспартат. Последний также вновь вовлекается в цикл мочевины.

ЭНЕРГОЗАВИСИМЫЙ ПРОЦЕСС Биосинтез мочевины требует больших затрат энергии. Энергия поставляется за счет расщепления четырех высокоэнергетических связей: двух при синтезе карбамилфосфата и двух (!) при образовании аргининосукцината (АТФ АМФ + PPi, РРi 2Pi). Биосинтез мочевины требует больших затрат энергии. Энергия поставляется за счет расщепления четырех высокоэнергетических связей: двух при синтезе карбамилфосфата и двух (!) при образовании аргининосукцината (АТФ АМФ + PPi, РРi 2Pi).

КОМПАРТМЕНТАЛИЗАЦИЯ Цикл мочевины протекает исключительно в печени. Он разделен на два компартмента: митохондрии и цитоплазму. Прохождение через мембрану промежуточных соединений цитруллина и орнитина возможно только с помощью переносчиков. Цикл мочевины протекает исключительно в печени. Он разделен на два компартмента: митохондрии и цитоплазму. Прохождение через мембрану промежуточных соединений цитруллина и орнитина возможно только с помощью переносчиков.

АЛЛОСТЕРИЧЕСКАЯ РЕГУЛЯЦИЯ СИНТЕЗА МОЧЕВИНЫ Скорость синтеза мочевины определяется первой реакцией цикла . Карбамоилфосфатсинтаза активна только в присутствии N- ацетилглутамата. Состояние обмена веществ (уровень аргинина, энергоснабжение) сильно зависит от концентрации этого аллостерического эффектора. Скорость синтеза мочевины определяется первой реакцией цикла . Карбамоилфосфатсинтаза активна только в присутствии N- ацетилглутамата. Состояние обмена веществ (уровень аргинина, энергоснабжение) сильно зависит от концентрации этого аллостерического эффектора. Скорость синтеза мочевины определяется первой Скорость синтеза мочевины определяется первой
 Азотистый обмен - совокупность химических превращений азотсодержащих веществ в организме. А. о. включает обмен простых и сложных белков, нуклеиновых кислот, продуктов их распада (пептидов, аминокислот и нуклеотидов), содержащих азот жироподобных веществ (липидов), аминосахаров, гормонов, витаминов и др. Для нормального течения процессов жизнедеятельности организм должен быть обеспечен необходимым количеством усвояемого азота. Главнейшей составной частью и основным источником азота пищи человека являются белковые вещества
Азотистый обмен - совокупность химических превращений азотсодержащих веществ в организме. А. о. включает обмен простых и сложных белков, нуклеиновых кислот, продуктов их распада (пептидов, аминокислот и нуклеотидов), содержащих азот жироподобных веществ (липидов), аминосахаров, гормонов, витаминов и др. Для нормального течения процессов жизнедеятельности организм должен быть обеспечен необходимым количеством усвояемого азота. Главнейшей составной частью и основным источником азота пищи человека являются белковые вещества

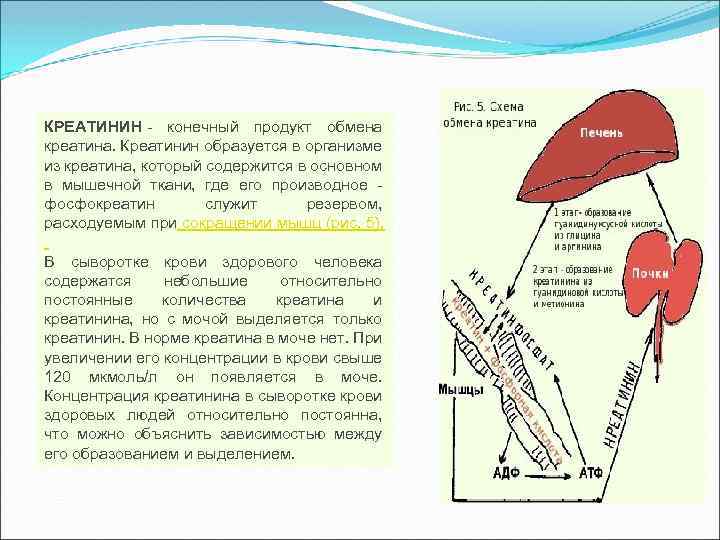 КРЕАТИНИН - конечный продукт обмена креатина. Креатинин образуется в организме из креатина, который содержится в основном в мышечной ткани, где его производное - фосфокреатин служит резервом, расходуемым при сокращении мышц (рис. 5). В сыворотке крови здорового человека содержатся небольшие относительно постоянные количества креатина и креатинина, но с мочой выделяется только креатинин. В норме креатина в моче нет. При увеличении его концентрации в крови свыше 120 мкмоль/л он появляется в моче. Концентрация креатинина в сыворотке крови здоровых людей относительно постоянна, что можно объяснить зависимостью между его образованием и выделением.
КРЕАТИНИН - конечный продукт обмена креатина. Креатинин образуется в организме из креатина, который содержится в основном в мышечной ткани, где его производное - фосфокреатин служит резервом, расходуемым при сокращении мышц (рис. 5). В сыворотке крови здорового человека содержатся небольшие относительно постоянные количества креатина и креатинина, но с мочой выделяется только креатинин. В норме креатина в моче нет. При увеличении его концентрации в крови свыше 120 мкмоль/л он появляется в моче. Концентрация креатинина в сыворотке крови здоровых людей относительно постоянна, что можно объяснить зависимостью между его образованием и выделением.
 Мочевина – конечный продукт распада белка в организме, при выведении которого через почки осуществляется удаление остатков «ненужного» азота. Образуется в печени. Выводится вместе с мочой и частично с потом (что придает поту специфический запах). Мочевина помогает организму сохранять воду и некоторые микроэлементы. Это выполняется посредством повторного всасывания почками в кровоток. Каждый раз, когда происходит процесс всасывания, мочевина «тянет» за собой обратно в кровь молекулы воды и полезных минералов. Однако избыточное ее содержание наносит вред органам и тканям.
Мочевина – конечный продукт распада белка в организме, при выведении которого через почки осуществляется удаление остатков «ненужного» азота. Образуется в печени. Выводится вместе с мочой и частично с потом (что придает поту специфический запах). Мочевина помогает организму сохранять воду и некоторые микроэлементы. Это выполняется посредством повторного всасывания почками в кровоток. Каждый раз, когда происходит процесс всасывания, мочевина «тянет» за собой обратно в кровь молекулы воды и полезных минералов. Однако избыточное ее содержание наносит вред органам и тканям.
 Мочевая кислота Конечный продукт метаболизма пуриновых оснований, входящих в состав нуклеотидов. Благодаря выведению мочевой кислоты из организма удаляется избыток азота. В плазме крови мочевая кислота содержится преимущественно в форме натриевой соли. Концентрация мочевой кислоты в крови обусловлена равновесием процессов синтеза мочевой кислоты и её выведения почками.
Мочевая кислота Конечный продукт метаболизма пуриновых оснований, входящих в состав нуклеотидов. Благодаря выведению мочевой кислоты из организма удаляется избыток азота. В плазме крови мочевая кислота содержится преимущественно в форме натриевой соли. Концентрация мочевой кислоты в крови обусловлена равновесием процессов синтеза мочевой кислоты и её выведения почками.
 ПУТИ ОБРАЗОВАНИЯ АММИАКА глутаминовая кислота -кетоглутаровая кислота + NH 3 -аминокислота -кетокислота + NH 3 цистеин пируват + NH 3 гистидин урокаиновая кислота + NH 3 глицин глиоксалевая кислота + NH 3 глюкозамин-6 -фосфат глюкоза-6 -фосфат + NH 3 глутамин глутаминовая кислота + NH 3 O ║ NH 2 -C O-P +CO 2 + NH 3 карбомоилфосфат глутамин АТФ АДФ мочевина пиримидины фолиевая кислота пурины глюкозамин
ПУТИ ОБРАЗОВАНИЯ АММИАКА глутаминовая кислота -кетоглутаровая кислота + NH 3 -аминокислота -кетокислота + NH 3 цистеин пируват + NH 3 гистидин урокаиновая кислота + NH 3 глицин глиоксалевая кислота + NH 3 глюкозамин-6 -фосфат глюкоза-6 -фосфат + NH 3 глутамин глутаминовая кислота + NH 3 O ║ NH 2 -C O-P +CO 2 + NH 3 карбомоилфосфат глутамин АТФ АДФ мочевина пиримидины фолиевая кислота пурины глюкозамин
Src="http://present5.com/presentation/229073585_437016682/image-8.jpg" alt="ПРИЧИНЫ АММИАЧНОЙ ИНТОКСИКАЦИИ ГИПЕРАММОНИЙЕМИЯ (>25 -40 мкмоль/л) Нарушение мочевинообразующей функции печени Нарушение азотовыделительной функции"> ПРИЧИНЫ АММИАЧНОЙ ИНТОКСИКАЦИИ ГИПЕРАММОНИЙЕМИЯ (>25 -40 мкмоль/л) Нарушение мочевинообразующей функции печени Нарушение азотовыделительной функции почек Острая почечная недостаточность Вирусный гепатит Хроническая почечная недостаточность Токсический гепатит Цирроз печени Портакавальные анастомозы на фоне богатой белками пищи Врожденные гипераммонийемии
 Остаточный азот и его компоненты Показатель Содержание в сыворотке крови в мг/100 мл единицы СИ Остаточный азот 20- 40 мг/100 мл 7, 06- 14, 1 ммоль/л Мочевина 20- 40 мг/100 мл 3, 3- 6, 6 ммоль/л Азот аминокислот 2, 0- 4, 3 мг/100 мл 1, 43- 3, 07 ммоль/л Мочевая кислота 2- 6, 4 мг/100 мл 0, 12- 0, 38 ммоль/л мужчины 0, 2- 0, 7 мг/100 мл 13- 53 мкмоль/л женщины 0, 4- 0, 9 мг/100 мл 27- 71 мкмоль/л мужчины 1- 2 мг/100 мл 0, 088- 0, 177 ммоль/л женщины 0, 5- 1, 6 мг/100 мл 0, 044- 0, 141 ммоль/л Аммиак 0, 03- 0, 06 мг/100 мл 21, 4- 42, 8 Креатин: Креатинин: Остальные небелковые вещества (полипептиды, нуклеотиды и др.) Ксантопротеиновая реакция 20 ед. Креатин: цельной крови 3- 4 мг % 229- 305 мкмоль/л плазмы 1- 1, 5 мг% 76, 3- 114, 5 мкмоль/л Азот мочевины крови (мочевина: 2, 14) 9- 14 мг % 3, 18- 4, 94 ммоль/л
Остаточный азот и его компоненты Показатель Содержание в сыворотке крови в мг/100 мл единицы СИ Остаточный азот 20- 40 мг/100 мл 7, 06- 14, 1 ммоль/л Мочевина 20- 40 мг/100 мл 3, 3- 6, 6 ммоль/л Азот аминокислот 2, 0- 4, 3 мг/100 мл 1, 43- 3, 07 ммоль/л Мочевая кислота 2- 6, 4 мг/100 мл 0, 12- 0, 38 ммоль/л мужчины 0, 2- 0, 7 мг/100 мл 13- 53 мкмоль/л женщины 0, 4- 0, 9 мг/100 мл 27- 71 мкмоль/л мужчины 1- 2 мг/100 мл 0, 088- 0, 177 ммоль/л женщины 0, 5- 1, 6 мг/100 мл 0, 044- 0, 141 ммоль/л Аммиак 0, 03- 0, 06 мг/100 мл 21, 4- 42, 8 Креатин: Креатинин: Остальные небелковые вещества (полипептиды, нуклеотиды и др.) Ксантопротеиновая реакция 20 ед. Креатин: цельной крови 3- 4 мг % 229- 305 мкмоль/л плазмы 1- 1, 5 мг% 76, 3- 114, 5 мкмоль/л Азот мочевины крови (мочевина: 2, 14) 9- 14 мг % 3, 18- 4, 94 ммоль/л
 гиперазотемия продукционная Печено-клеточная недостаточность немочевинных фракций остаточного азота (аммония, азота ам-т, биогенных аминов); ↓фракция мочевины в остаточном азоте Усиленный катаболизм белков (голодание, перекорм) немочевинных фракций остаточного азота (аммония, азота ам-т, биогенных аминов); фракция мочевины в остаточном азоте ретенционная Острая и хроническая почечная нед-ть ОПН: концентрация мочевины в плазме, ↓клиренс мочевины, остаточного азота и азота мочевины ХПН: остаточный азот до 200 -300 мг/100 мл, концентрация мочевины, аммония, мочевой к-ты, пептидов («средних молекул») в плазме
гиперазотемия продукционная Печено-клеточная недостаточность немочевинных фракций остаточного азота (аммония, азота ам-т, биогенных аминов); ↓фракция мочевины в остаточном азоте Усиленный катаболизм белков (голодание, перекорм) немочевинных фракций остаточного азота (аммония, азота ам-т, биогенных аминов); фракция мочевины в остаточном азоте ретенционная Острая и хроническая почечная нед-ть ОПН: концентрация мочевины в плазме, ↓клиренс мочевины, остаточного азота и азота мочевины ХПН: остаточный азот до 200 -300 мг/100 мл, концентрация мочевины, аммония, мочевой к-ты, пептидов («средних молекул») в плазме
 ИСТОЧНИКИ И СПОСОБЫ ОБЕЗВРЕЖИВАНИЯ АММИАКА В РАЗНЫХ ТКАНЯХ Биогенные амины Аминокислоты Нуклеотиды АММИАК Синтез Образование мочевины глутамина аланина глутамата аммонийных (25 г/сут) солей (0, 5 г/сут) печень мозг Мышцы, кишечник мозг почки
ИСТОЧНИКИ И СПОСОБЫ ОБЕЗВРЕЖИВАНИЯ АММИАКА В РАЗНЫХ ТКАНЯХ Биогенные амины Аминокислоты Нуклеотиды АММИАК Синтез Образование мочевины глутамина аланина глутамата аммонийных (25 г/сут) солей (0, 5 г/сут) печень мозг Мышцы, кишечник мозг почки
 РЕАКЦИИ СВЯЗЫВАНИЯ АММИАКА В КЛЕТКЕ 1. Реакция восстановительного аминирования -кетоглутарата в L-глутамат: НАДФН 2 НАДФН NH 3 + -кетоглутаровая глутаминовая + Н 2 О кислота глутаматдегидрогеназа кислота 2. Реакция образования глутамина из глутаминовой кислоты с участием фермента глутаминсинтетазы. Реакция протекает в цитозоле клеток всех тканей, но в большей степени – мозга: COOH CONH 2 │ │ CH 2 АТФ АДФ + Фн CH 2 │ │ CH 2 2 CH │ │ HC-NH 2 глутаминсинтетаза HC-NH 2 │ │ COOH COOH глутаминовая глутамин кислота
РЕАКЦИИ СВЯЗЫВАНИЯ АММИАКА В КЛЕТКЕ 1. Реакция восстановительного аминирования -кетоглутарата в L-глутамат: НАДФН 2 НАДФН NH 3 + -кетоглутаровая глутаминовая + Н 2 О кислота глутаматдегидрогеназа кислота 2. Реакция образования глутамина из глутаминовой кислоты с участием фермента глутаминсинтетазы. Реакция протекает в цитозоле клеток всех тканей, но в большей степени – мозга: COOH CONH 2 │ │ CH 2 АТФ АДФ + Фн CH 2 │ │ CH 2 2 CH │ │ HC-NH 2 глутаминсинтетаза HC-NH 2 │ │ COOH COOH глутаминовая глутамин кислота
 Пути обмена азота аминокислот и аммиака ТКАНИ КРОВЬ ПЕЧЕНЬ Мышцы, кишечник Аминок-ты -КГ Ала -КГ NH 3 Кеток-ты глутамат пируват пируват глутамат СО 2 АМФ NH 3 глюкоза карбомоил фосфат ИМФ глутамат глутамин МОЗГ и другие ткани Аминок-ты -КГ NH 3 Кеток-ты глутамат глутамин -КГ ПОЧКИ NH 3 глутамат NH 3 МОЧА орнитиновый цикл NH 3 глутамат мочевина аммонийные соли глутамат мочевина
Пути обмена азота аминокислот и аммиака ТКАНИ КРОВЬ ПЕЧЕНЬ Мышцы, кишечник Аминок-ты -КГ Ала -КГ NH 3 Кеток-ты глутамат пируват пируват глутамат СО 2 АМФ NH 3 глюкоза карбомоил фосфат ИМФ глутамат глутамин МОЗГ и другие ткани Аминок-ты -КГ NH 3 Кеток-ты глутамат глутамин -КГ ПОЧКИ NH 3 глутамат NH 3 МОЧА орнитиновый цикл NH 3 глутамат мочевина аммонийные соли глутамат мочевина
 ЦИКЛ МОЧЕВИНЫ И ЕГО СВЯЗЬ С ЦТК цитоплазма NH 3 + CO 2 + Н 2 О L-аспартат 2 АТФ карбомоил-фосфат цитруллин аргининосукцинат оксалоацетат митохондрия малат митохондрия орнитин аргинин фумарат мочевина ЦТК
ЦИКЛ МОЧЕВИНЫ И ЕГО СВЯЗЬ С ЦТК цитоплазма NH 3 + CO 2 + Н 2 О L-аспартат 2 АТФ карбомоил-фосфат цитруллин аргининосукцинат оксалоацетат митохондрия малат митохондрия орнитин аргинин фумарат мочевина ЦТК

I. Цель изучения: знать конечные продукты обмена белков в организме, основные источники образования аммиака, пути его обезвреживания из организма.
II. Уметь количественно определять содержание мочевины по цветной реакции с диацетилмонооксимом в сыворотке крови; познакомиться с физико-химическими свойствами мочевины.
III. Исходный уровень знаний: качественные реакции на аммиак (неорганическая химия).
IV. Ответить на вопросы контрольных итоговых билетов по теме: «Распад простых белков. Метаболизм аминокислот, конечные продукты азотистого обмена».
1. Конечными продуктами распада азотсодержащих веществ являются углекислый газ, вода и аммиак, в отличие от углеводов и липидов. Источником аммиака в организме являются аминокислоты, азотистые основания, амины. Аммиак образуется в результате прямого и непрямого дезаминирования аминокислот, (основной источник) гидролитического дезаминирования азотистых оснований, инактивации биогенных аминов.
2. Аммиак токсичен и его действие проявляется в нескольких функциональных системах: а) легко проникая через мембраны (нарушая трансмембранный перенос Na + и К +) в митохондриях связывается с α-кетоглутаратом и другими кетокислотами (ЦТК), образуя аминокислоты; в этих процессах используются и восстановительные эквиваленты (NADH+H +).
б) при высоких концентрациях аммиака глутамат и аспартат образуют амиды, используя и АТФ нарушая все тот же ЦТК, являющийся главным энергетическим источником работы мозга. в) Накопление глутамата в мозге повышает осмотическое давление, что ведет к развитию отека. г) Повышение концентрации аммиака в крови (N – 0.4 – 0.7 мг/л) сдвигает рН в щелочную сторону, повышая сродство О 2 к гемоглобину, что вызывает гипоксию нервной ткани. д) Уменьшение концентрации α-кетоглутарата вызывает угнетение обмена аминокислот (синтеза нейромедиаторов), ускорение синтеза оксалоацетата из пирувата, что связано с повышенным использованием СО 2 .
3. Гипераммониемия прежде всего отрицательно действует на мозг и сопровождается тошнотой, головокружением, потерей сознания, отставанием умственного развития (при хронической форме).
4. Основной реакцией связывания аммиака во всех клетках является синтез глутамина под действием глутаминсинтетазы в митохондриях, где используется для этой цели АТФ. Глутамин облегченной диффузией поступает в кровь и транспортируется в кишечник и почки. В кишечнике под действием глутаминазы образуется глутамат, который трансаминируется с пируватом, превращая его в аланин, поглощаемый печенью; 5% аммиака удаляется через кишечник, остальные 90% выводятся почками.
5. В почках также идет гидролиз глутамина с образованием аммиака под действием глутаминазы, которая активируется ацидозом. В просвете канальцев аммиак нейтрализует кислые продукты обмена образуя аммонийные соли для выведения, одновременно сокращая потери К + и Na + . (N – 0,5г солей аммония в сутки).
6. Высокий уровень глутамина в крови обуславливает его использование во многих анаболических реакциях в качестве донора азота (синтез азотистых оснований и др.)
7. Наиболее значительные количества аммиака обезвреживаются в печени синтезом мочевины (86% азота в моче) в количестве ~25 г/сутки. Биосинтез мочевины – циклический процесс, где ключевым веществом является орнитин, присоединяющий карбомоил, образованный из NH 3 и CO 2 при активации 2АТФ. Образованный цитруллин в митохондриях транспортируется в цитозоль для введения второго атома азота из аспартата с образованием аргинина. Аргинин гидролизуется аргиназой и превращается снова в орнитин, а вторым продуктом гидролиза является мочевина, которая по сути дела в этом цикле образовалась из двух атомов азота (источники –NH 3 и аспартат) и одного атома углерода (из СО 2). Энергией обеспечивают 3АТФ (2-при образовании карбомолфосфата и 1 при образовании аргининосукцината).
8. Орнитиновый цикл тесно связан с ЦТК, т.к. аспартат образуется при трансаминировании ЩУК из ЦТК, а фумарат, оставшийся из аспартата после удаления NH 3 , возвращается в ЦТК и, при превращении его в ЩУК, образуются 3 АТФ, обеспечивающие биосинтез молекулы мочевины.
9. Наследственные нарушения орнитинового цикла (цитруллинемия, аргининосукцинатурия, гипераргининемия) ведут к гиперамминиемии и в тяжелых случаях могут привести к печеночной коме.
10. Норма мочевины в крови 2,5-8,3 ммоль/л. Понижение наблюдается при болезнях печени, повышение – результат почечной недостаточности.
Лабораторная работа
Азотистый обмен - совокупность химических превращений, реакций синтеза и распада азотистых соединений в организме; составная часть обмена веществ и энергии. Понятие «азотистый обмен» включает в себя белковый обмен (совокупность химических превращений в организме белков и продуктов их метаболизма), а также обмен пептидов, аминокислот , нуклеиновых кислот , нуклеотидов, азотистых оснований, аминосахаров (см. Углеводы), азотсодержащих липидов , витаминов , гормонов и других соединений, содержащих азот.
Организм животных и человека усвояемый азот получает с пищей, в которой основным источником азотистых соединений являются белки животного и растительного происхождения. Главным фактором поддержания азотистого равновесия - состояния А. о., при котором количество вводимого и выводимого азота одинаково, - служит адекватное поступление белка с пищей. В СССР суточная норма белка в питании взрослого человека принята равной 100 г , или 16 г азота белка, при расходе энергии 2500 ккал . Азотистый баланс (разность между количеством азота, который попадает в организм с пищей, и количеством азота, выводимого из организма с мочой, калом, потом) является показателем интенсивности А. о. в организме. Голодание или недостаточное по азоту питание приводят к отрицательному азотистому балансу, или азотистому дефициту, при котором количество азота, выводимого из организма, превышает количество азота, поступающего в организм с пищей. Положительный азотистый баланс, при котором вводимое с пищей количество азота превышает количество азота, выводимое из организма, наблюдается в период роста организма, при процессах регенерации тканей и т.д. Состояние А. о. в значительной степени зависит от качества пищевого белка, которое, в свою очередь, определяется его аминокислотным составом и прежде всего наличием незаменимых аминокислот.
Принято считать, что у человека и позвоночных животных А. о. начинается с переваривания азотистых соединений пищи в желудочно-кишечном тракте. В желудке происходит расщепление белков при участии пищеварительных протеолитических ферментов трипсина и гастриксина (см. Протеолиз ) с образованием ептидов, олигопептидов и отдельных аминокислот. Из желудка пищевая масса поступает в двенадцатиперстную кишку и нижележащие отделы тонкой кишки, где пептиды подвергаются дальнейшему расщеплению, катализируемому ферментами сока поджелудочной железы трипсином, химотрипсином и карбоксипептидазой и ферментами кишечного сока аминопептидазами и дипептидазами (см. Ферменты ). Наряду с пептидами. в тонкой кишке расщепляются сложные белки (например, нуклеопротеины) и нуклеиновые кислоты. Существенный вклад в расщепление азотсодержащих биополимеров вносит и микрофлора кишечника. Олигопептиды, аминокислоты, нуклеотиды, нуклеозиды и др. всасываются в тонкой кишке, поступают в кровь и с ней разносятся по всему организму. Белки тканей организма в процессе постоянного обновления также подвергаются протеолизу под действием тканевых протсаз (пептидаз и катепсинов), а продукты распада тканевых белков попадают в кровь. Аминокислоты могут быть использованы для нового синтеза белков и других соединений (пуриновых и пиримидиновых оснований, нуклеотидов, порфиринов и т.д.), для получения энергии (например, посредством включения в цикл трикарбоновых кислот) или могут быть подвергнуты дальнейшей деградации с образованием конечных продуктов А. о., подлежащих выведению из организма.
Аминокислоты, поступающие в составе белков пищи, используются для синтеза белков органов и тканей организма. Они участвуют также в образовании многих других важных биологических соединений: пуриновых нуклеотидов (глутамин, глицин, аспарагиновая кислота) и пиримидиновых нуклеотидов (глутамин, аспарагиновая кислота), серотонина (триптофан), меланина (фенилалпнин, тирозин), гистамина (гистидин), адреналина, норадреналина, тирамина (тирозин), полиаминов (аргинин, метионин), холина (метионин), порфиринов (глицин), креатина (глицин, аргинин, метионин), коферментов, сахаров и полисахаридов, липидов и т.д. Важнейшей для организма химической реакцией, в которой участвуют практически все аминокислоты, является трансаминирование, заключающееся в обратимом ферментативном переносе a -аминогруппы аминокислот на a -углеродный атом кетокислот или альдегидов. Трансаминирование является принципиальной реакцией биосинтеза заменимых аминокислот в организме. Активность ферментов, катализирующих реакции трансаминирования, - аминотрансфераз - имеет большое клинико-диагностическое значение.
Деградация аминокислот может протекать по нескольким различным путям. Большинство аминокислот способно подвергаться декарбоксилированию при участии ферментов декарбоксилаз с образованием первичных аминов, которые затем могут окисляться в реакциях, катализируемых моноаминоксидазой или диаминоксидазой. При окислении биогенных аминов (гистамина, серотонина, тирамина, g -аминомасляной кислоты) оксидазами образуются альдегиды, подвергающиеся дальнейшим превращениям, и аммиак , основным путем дальнейшего метаболизма которого является образование мочевины.
Другим принципиальным путем деградации аминокислот является окислительное дезаминирование с образованием аммиака и кетокислот. Прямое дезаминирование L-аминокислот в организме животных и человека протекает крайне медленно, за исключением глутаминовой кислоты, которая интенсивно дезаминируется при участии специфического фермента глутаматдегидрогеназы. Предварительное трансаминирование почти всех a -аминокислот и дальнейшее дезаминирование образовавшейся глутаминовой кислоты на a -кетоглутаровую кислоту и аммиак является основным механизмом дезаминирования природных аминокислот.
Продуктом разных путей деградации аминокислот является аммиак, который может образовываться и в результате метаболизма других азотсодержащих соединений (например, при дезаминировании аденина, входящего в состав никотинамидадениндинуклеотида - НАД). Основным путем связывания и нейтрализации токсичного аммиака у уреотелических животных (животные, у которых конечным продуктом А. о, является мочевина) служит так называемый цикл мочевины (синоним: орнитиновый цикл, цикл Кребса - Гензелейта), протекающий в печени. Он представляет собой циклическую последовательность ферментативных реакций, в результате которой из молекулы аммиака или амидного азота глутамина, аминогруппы аспарагановой кислоты и диоксида углерода осуществляется синтез мочевины. При ежедневном потреблении 100 г белка суточное выведение мочевины из организма составляет около 30 г . У человека и высших животных существует еще один путь нейтрализации аммиака - синтез амидов дикарбоновых кислот аспарагана и глутамина из соответствующих аминокислот. У урикотелических животных (рептилии, птицы) конечным продуктом А. о. является мочевая кислота.
В результате расщепления нуклеиновых кислот и нуклеопротеинов в желудочно-кишечном тракте образуются нуклеотиды и нуклеозиды. Олиго- и моно-нуклеотиды при участии различных ферментов (эстераз, нуклеотидаз, нуклеозидаз, фосфорилаз) превращаются затем в свободные пуриновые и пиримидиновые основания.
Дальнейший путь деградации пуриновых оснований аденина и гуанина состоит в их гидролитическом дезаминировании под влиянием ферментов аденазы и гуаназы с образованием соответственно гипоксантина (6-оксипурина) и ксантина (2,6-диоксипурина), которые затем превращаются в мочевую кислоту в реакциях, катализируемых ксантиноксидазой. Мочевая кислота - один из конечных продуктов А. о. и конечный продукт обмена пуринов у человека - выводится из организма с мочой. У большинства млекопитающих имеется фермент уриказа, который катализирует превращение мочевой кислоты в экскретируемый аллантоин.
Деградация пиримидиновых оснований (урацила, тимина) состоит в их восстановлении с образованием дигидропроизводных и последующем гидролизе, в результате которого из урацила образуется b -уреидопропионовая кислота, а из нее - аммиак, диоксид углерода и b -аланин, а из тимина - b -аминоизомасляная кислота, диоксид углерода и аммиак. Диоксид углерода и аммиак могут далее включаться в мочевину через цикл мочевины, а b -аланин участвует в синтезе важнейших биологически активных соединений - гистидинсодержащих дипептидов карнозина (b -аланил-L-гистидина) и анзерина (b -аланил-N-метил-L-гистидина), обнаруживаемых в составе экстрактивных веществ скелетных мышц, а также в синтезе пантотеновой кислоты и кофермента А.
Т.о., разнообразные превращения важнейших азотистых соединений организма связаны между собой в единый обмен. Сложный процесс А. о. регулируется на молекулярном, клеточном и тканевом уровнях. Регуляция А. о. в целом организме направлена на приспособление интенсивности А. о. к изменяющимся условиям окружающей и внутренней среды и осуществляется нервной системой как непосредственно, так и путем воздействия на железы внутренней секреции.
У здоровых взрослых людей содержание азотистых соединений в органах, тканях, биологических жидкостях находится на относительно постоянном уровне. Избыток азота, поступившего с пищей, выводится с мочой и калом, а при недостатке азота в пище нужды организма в нем могут покрываться за счет использования азотистых соединений тканей тела. При этом состав мочи изменяется в зависимости от особенностей А. о. и состояния азотистого баланса. В норме при неизменном режиме питания и относительно стабильных условиях окружающей среды из организма выделяется постоянное количество конечных продуктов А. о., а развитие патологических состояний приводит к его резкому изменению. Значительные изменения экскреции азотистых соединений с мочой, в первую очередь экскреции мочевины, могут наблюдаться и при отсутствии патологии в случае существенного изменения режима питания (например, при изменении количества потребляемого белка), причем концентрация остаточного азота (см. Азот остаточный ) в крови меняется незначительно.
При исследовании А. о. необходимо учитывать количественный и качественный состав принимаемой пищи, количественный и качественный состав азотистых соединений, выделяемых с мочой и калом и содержащихся в крови. Для исследования А. о. применяют азотистые вещества, меченные радионуклидами азота, фосфора, углерода, серы, водорода, кислорода, и наблюдают за миграцией метки и включением ее в состав конечных продуктов А. о. Широко используют меченые аминокислоты, например 15 N-глицин, которые вводят в организм с пищей или непосредственно в кровь. Значительная часть меченого азота глицина пищи выводится в составе мочевины с мочой, а другая часть метки попадает в тканевые белки и выводится из организма крайне медленно. Проведение исследования А. о. необходимо для диагностики многих патологических состояний и контроля за эффективностью лечения, а также при разработке рациональных схем питания, в т.ч. лечебного (см. Питание лечебное ).
Патологию А. о. (вплоть до очень значительной) вызывает белковая . Ее причиной может стать общее недоедание, продолжительный дефицит белка или незаменимых аминокислот в рационе, недостаток углеводов и жиров, обеспечивающих энергией процессы биосинтеза белка в организме. Белковая может быть обусловлена преобладанием процессов распада белков над их синтезом не только в результате алиментарного дефицита белка и других важнейших пищевых веществ, но и при тяжелой мышечной работе, травмах, воспалительных и дистрофических процессах, ишемии, инфекции, обширных ах, дефекте трофической функции нервной системы, недостаточности гормонов анаболического действия (гормона роста, половых гормонов, инсулина), избыточном синтезе или избыточном поступлении извне стероидных гормонов и т.п. Нарушение усвоения белка при патологии желудочно-кишечного тракта (ускоренная эвакуация пищи из желудка, гипо- и анацидные состояния, закупорка выводного протока поджелудочной железы, ослабление секреторной функции и усиление моторики тонкой кишки при энтеритах и энтероколитах, нарушение процесса всасывания в тонкой кишке и др.) также может приводить к белковой недостаточности. Белковая ведет к дискоординации А. о. и характеризуется резко выраженным отрицательным азотистым балансом.
Известны случаи нарушения синтеза определенных белков (см. Иммунопатология , Ферментопатии ), а также генетически обусловленного синтеза аномальных белков, например при гемоглобинопатиях , миеломной болезни (см. Парапротеинемические гемобластозы ) и др.
Патология А. о., заключающаяся в нарушении обмена аминокислот, часто связана с аномалиями процесса трансаминирования: уменьшением активности аминотрансфераз при гипо- или авитаминозах В 6 , нарушением синтеза этих ферментов, недостатком кетокислот для трансаминирования в связи с угнетением цикла трикарбоновых кислот при гипоксии и сахарном е и т.д. Снижение интенсивности трансаминирования приводит к угнетению дезаминирования глутаминовой кислоты, а оно, в свою очередь, - к повышению доли азота аминокислот в составе остаточного азота крови (гипераминоацидемии), общей гиперазотемии и аминоацидурии. Гипераминоацидемия, аминоацидурия и общая азотемия характерны для многих видов патологии А. о. При обширных поражениях печени и других состояниях, связанных с массивным распадом белка в организме, нарушаются процессы дезаминирования аминокислот и образования мочевины таким образом, что возрастают концентрация остаточного азота и содержание в нем азота аминокислот на фоне снижения относительного содержания в остаточном азоте азота мочевины (так называемая продукционная азотемия).
Продукционная азотемия, как правило, сопровождается выведением избытка аминокислот с мочой, поскольку даже в случае нормального функционирования почек фильтрация аминокислот в почечных клубочках происходит интенсивнее, чем их реабсорбция в канальцах. Заболевания почек, обтурация мочевых путей, нарушение почечного кровообращения приводят к развитию ретенционной азотемии, сопровождающейся нарастанием концентрации остаточного азота в крови за счет повышения содержания в крови мочевины (см. Почечная недостаточность ). Обширные раны, тяжелые и, инфекции, повреждения трубчатых костей, спинного и головного мозга, болезнь Иценко - Кушинга и многие другие тяжелые заболевания сопровождаются аминоацидурией. Она характерна и для патологических состояний, протекающих с нарушением процессов реабсорбции в почечных канальцах: болезни Вильсона - Коновалова (см. Гепатоцеребральная дистрофия ), нефронофтизе Фанкони (см. Рахитоподобные болезни ) и др. Эти болезни относятся к многочисленным генетически обусловленным нарушениям А. о. Избирательное нарушение реабсорбции цистина и цистинурия с генерализованным нарушением обмена цистина на фоне общей аминоацидурии сопровождает так называемый цистиноз. При этом заболевании кристаллы цистина откладываются в клетках ретикулоэндотелиальной системы. Наследственное заболевание фенилкетонурия характеризуется нарушением превращения фенилаланина в тирозин в результате генетически обусловленной недостаточности фермента фенилаланин - 4-гидроксилазы, что вызывает накопление в крови и моче непревращенного фенилаланина и продуктов его обмена - фенилпировиноградной и фенилуксусной кислот. Нарушение превращений этих соединений характерно и для вирусного гепатита.Тирозинемию, тирозинурию и тирозиноз отмечают при ах, диффузных заболеваниях соединительной ткани (коллагенозах) и других патологических состояниях. Они развиваются вследствие нарушения трансаминирования тирозина. Врожденная аномалия окислительных превращений тирозина лежит в основе алкаптонурии, при которой в моче накапливается непревращенный метаболит этой аминокислоты - гомогентизиновая кислота. Нарушения пигментного обмена при гипокортицизме (см. Надпочечники ) связаны с угнетением превращения тирозина в меланин вследствие ингибирования фермента тирозиназы (полное выпадение синтеза этого пигмента характерно для врожденной аномалии пигментации - а).
При массивном распаде клеточных структур (голодание, тяжелая мышечная работа, инфекции и др.) отмечают патологическое нарастание концентрации остаточного азота за счет увеличения относительного содержания в ней азота мочевой кислоты (в норме концентрация мочевой кислоты в крови не превышает - 0,4 ммоль/л ).
В пожилом возрасте снижаются интенсивность и объем синтеза белка за счет непосредственного угнетения биосинтетической функции организма и ослабления его способности усваивать аминокислоты пищи; развивается отрицательный азотистый баланс. Нарушения обмена пуринов у людей пожилого возраста приводят к накоплению и отложению в мышцах, суставах и хрящах солей мочевой кислоты - уратов. Коррекция нарушений А. о. в пожилом возрасте может быть осуществлена за счет специальных диет, содержащих полноценные животные белки, витамины и микроэлементы, с ограниченным содержанием пуринов.
Азотистый обмен у детей отличается рядом особенностей, в частности положительным азотистым балансом как необходимым условием роста. Интенсивность процессов А. о. на протяжении роста ребенка подвергается изменениям, особенно ярко выраженным у новорожденных и детей раннего возраста. В течение первых 3-х дней жизни азотистый баланс отрицателен, что объясняется недостаточным поступлением белка с пищей. В этот период обнаруживается транзиторное повышение концентрации остаточного азота в крови (так называемая физиологическая азотемия), иногда достигающее 70 ммоль/л ; к концу 2-й нед.
жизни концентрация остаточного азота снижается до уровня, отмечаемого у взрослых. Количество выделяемого почками азота нарастает в течение первых 3-х дней жизни, после чего снижается и вновь начинает увеличиваться со 2-й нед. жизни параллельно возрастающему количеству пищи.Наиболее высокая усвояемость азота в организме ребенка наблюдается у детей первых месяцев жизни. Азотистый баланс заметно приближается к равновесию в первые 3-6 мес. жизни, хотя и остается положительным. Интенсивность белкового обмена у детей достаточно высока - у детей 1-го года жизни обновляется около 0,9 г белка на 1 кг массы тела в сутки, в 1-3 года - 0,8 г/кг/ сут., у детей дошкольного и школьного возраста - 0,7 г/кг/ сут.
Средние величины потребности в незаменимых аминокислотах, по данным ФАО ВОЗ (1985), у детей в 6 раз больше, чем у взрослых (незаменимой аминокислотой для детей в возрасте до 3 мес. является цистин, а до 5 лет - и гистидин). Более активно, чем у взрослых, протекают у детей процессы трансаминирования аминокислот. Однако в первые дни жизни у новорожденных из-за относительно низкой активности некоторых ферментов отмечаются гипераминоацидемия и физиологическая аминоацидурия в результате функциональной незрелости почек. У недоношенных, кроме того, имеет место аминоацидурия перегрузочного типа, т.к. содержание свободных аминокислот в плазме их крови выше, чем у доношенных детей. На первой неделе жизни азот аминокислот составляет 3-4% общего азота мочи (по некоторым данным, до 10%), и лишь к концу 1-го года жизни его относительное содержание снижается до 1%. У детей 1-го года жизни выведение аминокислот в расчете на 1 кг массы тела достигает величин выведения их у взрослого человека, экскреция азота аминокислот, достигающая у новорожденных 10 мг/кг массы тела, на 2-м году жизни редко превышает 2 мг/кг массы тела. В моче новорожденных повышено (по сравнению с мочой взрослого человека) содержание таурина, треонина, серина, глицина, аланина, цистина, лейцина, тирозина, фенилаланина и лизина. В первые месяцы жизни в моче ребенка обнаруживаются также этаноламин и гомоцитруллин. В моче детей 1-го года жизни преобладают аминокислоты пролин и [гидр]оксипролин.
Исследования важнейших азотистых компонентов мочи у детей показали, что соотношение мочевой кислоты, мочевины и аммиака в процессе роста существенно изменяется. Так, первые 3 мес. жизни характеризуются наименьшим содержанием в моче мочевины (в 2-3 раза меньше, чем у взрослых) и наибольшей экскрецией мочевой кислоты. Дети в первые три месяца жизни выделяют 28,3 мг/кг массы тела мочевой кислоты, а взрослые - 8,7 мг/кг . Относительно высокая экскреция у детей первых месяцев жизни мочевой кислоты способствует иногда развитию мочекислого инфаркта почек. Количество мочевины в моче нарастает у детей в возрасте от 3 до 6 месяцев, а содержание мочевой кислоты в это время снижается. Содержание аммиака в моче детей в первые дни жизни невелико, но затем резко возрастает и держится на высоком уровне на протяжении всего 1-го года жизни.
Характерной особенностью А. о. у детей является физиологическая креатинурия. Креатин обнаруживается еще в амниотической жидкости; в моче он определяется в количествах, превышающих содержание креатина в моче взрослых, начиная с периода новорожденности и до периода полового созревания. Суточная экскреция креатинина (дегидроксилированного креатина) с возрастом увеличивается, в то же время по мере нарастания массы тела ребенка относительное содержание азота креатинина мочи снижается. Количество креатинина, выводимого с мочой за сутки, у доношенных новорожденных составляет 10-13 мг/кг , у недоношенных 3 мг/кг , у взрослых не превышает 30 мг/кг.
При выявлении в семье врожденного нарушения А. о. необходимо проведение медико-генетического консультирования .
Библиогр.: Березов Т.Т. и Коровкин Б.Ф. Биологическая химия, с. 431, М., 1982; Вельтищев Ю.Е. и др. Обмен веществ у детей, с. 53, М., 1983; Дудел Дж. и др. Физиология человека, пер. с англ., т. 1-4, М., 1985; Зилва Дж.Ф. и Пэннелл П.Р. Клиническая химия в диагностике и лечении, пер. с англ., с. 298, 398, М., 1988; Кон Р.М. и Рой К.С. Ранняя диагностика болезней обмена веществ, пер. с англ., с. 211, М., 1986; Лабораторные методы исследования в клинике, под ред. В.В. Меньшикова, с. 222, М., 1987; Ленинджер А. Основы биохимии, пер. с англ., т. 2, М., 1985; Мазурин А.В. и Воронцов И.М. Пропедевтика детских болезней, с. 322, М., 1985; Руководство по педиатрии, под. ред. У.Е. Бермана и В.К. Вогана, пер. с англ., кн. 2, с. 337, VI., 1987; Страйер Л. Биохимия, пер. с англ., т. 2, с. 233, М., 1985.
Вопрос полный
Азотистый обмен
Азотистый обмен - совокупность химических превращений, реакций синтеза и распада азотистых соединений в организме; составная часть обмена веществ и энергии. Понятие «азотистый обмен» включает в себя белковый обмен (совокупность химических превращений в организме белков и продуктов их метаболизма), а также обмен пептидов, аминокислот , нуклеиновых кислот , нуклеотидов, азотистых оснований, аминосахаров (см. Углеводы), азотсодержащих липидов , витаминов , гормонов и других соединений, содержащих азот.
Организм животных и человека усвояемый азот получает с пищей, в которой основным источником азотистых соединений являются белки животного и растительного происхождения. Главным фактором поддержания азотистого равновесия - состояния А. о., при котором количество вводимого и выводимого азота одинаково, - служит адекватное поступление белка с пищей. В СССР суточная норма белка в питании взрослого человека принята равной 100 г , или 16 г азота белка, при расходе энергии 2500 ккал . Азотистый баланс (разность между количеством азота, который попадает в организм с пищей, и количеством азота, выводимого из организма с мочой, калом, потом) является показателем интенсивности А. о. в организме. Голодание или недостаточное по азоту питание приводят к отрицательному азотистому балансу, или азотистому дефициту, при котором количество азота, выводимого из организма, превышает количество азота, поступающего в организм с пищей. Положительный азотистый баланс, при котором вводимое с пищей количество азота превышает количество азота, выводимое из организма, наблюдается в период роста организма, при процессах регенерации тканей и т.д. Состояние А. о. в значительной степени зависит от качества пищевого белка, которое, в свою очередь, определяется его аминокислотным составом и прежде всего наличием незаменимых аминокислот.
Принято считать, что у человека и позвоночных животных А. о. начинается с переваривания азотистых соединений пищи в желудочно-кишечном тракте. В желудке происходит расщепление белков при участии пищеварительных протеолитических ферментов трипсина и гастриксина (см. Протеолиз ) с образованием полипептидов, олигопептидов и отдельных аминокислот. Из желудка пищевая масса поступает в двенадцатиперстную кишку и нижележащие отделы тонкой кишки, где пептиды подвергаются дальнейшему расщеплению, катализируемому ферментами сока поджелудочной железы трипсином, химотрипсином и карбоксипептидазой и ферментами кишечного сока аминопептидазами и дипептидазами (см. Ферменты ). Наряду с пептидами. в тонкой кишке расщепляются сложные белки (например, нуклеопротеины) и нуклеиновые кислоты. Существенный вклад в расщепление азотсодержащих биополимеров вносит и микрофлора кишечника. Олигопептиды, аминокислоты, нуклеотиды, нуклеозиды и др. всасываются в тонкой кишке, поступают в кровь и с ней разносятся по всему организму. Белки тканей организма в процессе постоянного обновления также подвергаются протеолизу под действием тканевых протсаз (пептидаз и катепсинов), а продукты распада тканевых белков попадают в кровь. Аминокислоты могут быть использованы для нового синтеза белков и других соединений (пуриновых и пиримидиновых оснований, нуклеотидов, порфиринов и т.д.), для получения энергии (например, посредством включения в цикл трикарбоновых кислот) или могут быть подвергнуты дальнейшей деградации с образованием конечных продуктов А. о., подлежащих выведению из организма.
Аминокислоты, поступающие в составе белков пищи, используются для синтеза белков органов и тканей организма. Они участвуют также в образовании многих других важных биологических соединений: пуриновых нуклеотидов (глутамин, глицин, аспарагиновая кислота) и пиримидиновых нуклеотидов (глутамин, аспарагиновая кислота), серотонина (триптофан), меланина (фенилалпнин, тирозин), гистамина (гистидин), адреналина, норадреналина, тирамина (тирозин), полиаминов (аргинин, метионин), холина (метионин), порфиринов (глицин), креатина (глицин, аргинин, метионин), коферментов, сахаров и полисахаридов, липидов и т.д. Важнейшей для организма химической реакцией, в которой участвуют практически все аминокислоты, является трансаминирование, заключающееся в обратимом ферментативном переносе a-аминогруппы аминокислот на a-углеродный атом кетокислот или альдегидов. Трансаминирование является принципиальной реакцией биосинтеза заменимых аминокислот в организме. Активность ферментов, катализирующих реакции трансаминирования, - аминотрансфераз - имеет большое клинико-диагностическое значение.
Деградация аминокислот может протекать по нескольким различным путям. Большинство аминокислот способно подвергаться декарбоксилированию при участии ферментов декарбоксилаз с образованием первичных аминов, которые затем могут окисляться в реакциях, катализируемых моноаминоксидазой или диаминоксидазой. При окислении биогенных аминов (гистамина, серотонина, тирамина, g-аминомасляной кислоты) оксидазами образуются альдегиды, подвергающиеся дальнейшим превращениям, и аммиак , основным путем дальнейшего метаболизма которого является образование мочевины.
Другим принципиальным путем деградации аминокислот является окислительное дезаминирование с образованием аммиака и кетокислот. Прямое дезаминирование L-аминокислот в организме животных и человека протекает крайне медленно, за исключением глутаминовой кислоты, которая интенсивно дезаминируется при участии специфического фермента глутаматдегидрогеназы. Предварительное трансаминирование почти всех a-аминокислот и дальнейшее дезаминирование образовавшейся глутаминовой кислоты на a-кетоглутаровую кислоту и аммиак является основным механизмом дезаминирования природных аминокислот.
Продуктом разных путей деградации аминокислот является аммиак, который может образовываться и в результате метаболизма других азотсодержащих соединений (например, при дезаминировании аденина, входящего в состав никотинамидадениндинуклеотида - НАД). Основным путем связывания и нейтрализации токсичного аммиака у уреотелических животных (животные, у которых конечным продуктом А. о, является мочевина) служит так называемый цикл мочевины (синоним: орнитиновый цикл, цикл Кребса - Гензелейта), протекающий в печени. Он представляет собой циклическую последовательность ферментативных реакций, в результате которой из молекулы аммиака или амидного азота глутамина, аминогруппы аспарагановой кислоты и диоксида углерода осуществляется синтез мочевины. При ежедневном потреблении 100 г белка суточное выведение мочевины из организма составляет около 30 г . У человека и высших животных существует еще один путь нейтрализации аммиака - синтез амидов дикарбоновых кислот аспарагана и глутамина из соответствующих аминокислот. У урикотелических животных (рептилии, птицы) конечным продуктом А. о. является мочевая кислота.
В результате расщепления нуклеиновых кислот и нуклеопротеинов в желудочно-кишечном тракте образуются нуклеотиды и нуклеозиды. Олиго- и моно-нуклеотиды при участии различных ферментов (эстераз, нуклеотидаз, нуклеозидаз, фосфорилаз) превращаются затем в свободные пуриновые и пиримидиновые основания.
Дальнейший путь деградации пуриновых оснований аденина и гуанина состоит в их гидролитическом дезаминировании под влиянием ферментов аденазы и гуаназы с образованием соответственно гипоксантина (6-оксипурина) и ксантина (2,6-диоксипурина), которые затем превращаются в мочевую кислоту в реакциях, катализируемых ксантиноксидазой. Мочевая кислота - один из конечных продуктов А. о. и конечный продукт обмена пуринов у человека - выводится из организма с мочой. У большинства млекопитающих имеется фермент уриказа, который катализирует превращение мочевой кислоты в экскретируемый аллантоин.
Деградация пиримидиновых оснований (урацила, тимина) состоит в их восстановлении с образованием дигидропроизводных и последующем гидролизе, в результате которого из урацила образуется b-уреидопропионовая кислота, а из нее - аммиак, диоксид углерода и b-аланин, а из тимина - b-аминоизомасляная кислота, диоксид углерода и аммиак. Диоксид углерода и аммиак могут далее включаться в мочевину через цикл мочевины, а b-аланин участвует в синтезе важнейших биологически активных соединений - гистидинсодержащих дипептидов карнозина (b-аланил-L-гистидина) и анзерина (b-аланил-N-метил-L-гистидина), обнаруживаемых в составе экстрактивных веществ скелетных мышц, а также в синтезе пантотеновой кислоты и кофермента А.
Т.о., разнообразные превращения важнейших азотистых соединений организма связаны между собой в единый обмен. Сложный процесс А. о. регулируется на молекулярном, клеточном и тканевом уровнях. Регуляция А. о. в целом организме направлена на приспособление интенсивности А. о. к изменяющимся условиям окружающей и внутренней среды и осуществляется нервной системой как непосредственно, так и путем воздействия на железы внутренней секреции.
У здоровых взрослых людей содержание азотистых соединений в органах, тканях, биологических жидкостях находится на относительно постоянном уровне. Избыток азота, поступившего с пищей, выводится с мочой и калом, а при недостатке азота в пище нужды организма в нем могут покрываться за счет использования азотистых соединений тканей тела. При этом состав мочи изменяется в зависимости от особенностей А. о. и состояния азотистого баланса. В норме при неизменном режиме питания и относительно стабильных условиях окружающей среды из организма выделяется постоянное количество конечных продуктов А. о., а развитие патологических состояний приводит к его резкому изменению. Значительные изменения экскреции азотистых соединений с мочой, в первую очередь экскреции мочевины, могут наблюдаться и при отсутствии патологии в случае существенного изменения режима питания (например, при изменении количества потребляемого белка), причем концентрация остаточного азота (см. Азот остаточный ) в крови меняется незначительно.
При исследовании А. о. необходимо учитывать количественный и качественный состав принимаемой пищи, количественный и качественный состав азотистых соединений, выделяемых с мочой и калом и содержащихся в крови. Для исследования А. о. применяют азотистые вещества, меченные радионуклидами азота, фосфора, углерода, серы, водорода, кислорода, и наблюдают за миграцией метки и включением ее в состав конечных продуктов А. о. Широко используют меченые аминокислоты, например 15 N-глицин, которые вводят в организм с пищей или непосредственно в кровь. Значительная часть меченого азота глицина пищи выводится в составе мочевины с мочой, а другая часть метки попадает в тканевые белки и выводится из организма крайне медленно. Проведение исследования А. о. необходимо для диагностики многих патологических состояний и контроля за эффективностью лечения, а также при разработке рациональных схем питания, в т.ч. лечебного (см. Питание лечебное ).
Патологию А. о. (вплоть до очень значительной) вызывает белковая недостаточность. Ее причиной может стать общее недоедание, продолжительный дефицит белка или незаменимых аминокислот в рационе, недостаток углеводов и жиров, обеспечивающих энергией процессы биосинтеза белка в организме. Белковая недостаточность может быть обусловлена преобладанием процессов распада белков над их синтезом не только в результате алиментарного дефицита белка и других важнейших пищевых веществ, но и при тяжелой мышечной работе, травмах, воспалительных и дистрофических процессах, ишемии, инфекции, обширных ожогах, дефекте трофической функции нервной системы, недостаточности гормонов анаболического действия (гормона роста, половых гормонов, инсулина), избыточном синтезе или избыточном поступлении извне стероидных гормонов и т.п. Нарушение усвоения белка при патологии желудочно-кишечного тракта (ускоренная эвакуация пищи из желудка, гипо- и анацидные состояния, закупорка выводного протока поджелудочной железы, ослабление секреторной функции и усиление моторики тонкой кишки при энтеритах и энтероколитах, нарушение процесса всасывания в тонкой кишке и др.) также может приводить к белковой недостаточности. Белковая недостаточность ведет к дискоординации А. о. и характеризуется резко выраженным отрицательным азотистым балансом.
Известны случаи нарушения синтеза определенных белков (см. Иммунопатология , Ферментопатии ), а также генетически обусловленного синтеза аномальных белков, например при гемоглобинопатиях , миеломной болезни (см. Парапротеинемические гемобластозы ) и др.
Патология А. о., заключающаяся в нарушении обмена аминокислот, часто связана с аномалиями процесса трансаминирования: уменьшением активности аминотрансфераз при гипо- или авитаминозах В 6 , нарушением синтеза этих ферментов, недостатком кетокислот для трансаминирования в связи с угнетением цикла трикарбоновых кислот при гипоксии и сахарном диабете и т.д. Снижение интенсивности трансаминирования приводит к угнетению дезаминирования глутаминовой кислоты, а оно, в свою очередь, - к повышению доли азота аминокислот в составе остаточного азота крови (гипераминоацидемии), общей гиперазотемии и аминоацидурии. Гипераминоацидемия, аминоацидурия и общая азотемия характерны для многих видов патологии А. о. При обширных поражениях печени и других состояниях, связанных с массивным распадом белка в организме, нарушаются процессы дезаминирования аминокислот и образования мочевины таким образом, что возрастают концентрация остаточного азота и содержание в нем азота аминокислот на фоне снижения относительного содержания в остаточном азоте азота мочевины (так называемая продукционная азотемия).
Продукционная азотемия, как правило, сопровождается выведением избытка аминокислот с мочой, поскольку даже в случае нормального функционирования почек фильтрация аминокислот в почечных клубочках происходит интенсивнее, чем их реабсорбция в канальцах. Заболевания почек, обтурация мочевых путей, нарушение почечного кровообращения приводят к развитию ретенционной азотемии, сопровождающейся нарастанием концентрации остаточного азота в крови за счет повышения содержания в крови мочевины (см. Почечная недостаточность ). Обширные раны, тяжелые ожоги, инфекции, повреждения трубчатых костей, спинного и головного мозга, гипотиреоз, болезнь Иценко - Кушинга и многие другие тяжелые заболевания сопровождаются аминоацидурией. Она характерна и для патологических состояний, протекающих с нарушением процессов реабсорбции в почечных канальцах: болезни Вильсона - Коновалова (см. Гепатоцеребральная дистрофия ), нефронофтизе Фанкони (см. Рахитоподобные болезни ) и др. Эти болезни относятся к многочисленным генетически обусловленным нарушениям А. о. Избирательное нарушение реабсорбции цистина и цистинурия с генерализованным нарушением обмена цистина на фоне общей аминоацидурии сопровождает так называемый цистиноз. При этом заболевании кристаллы цистина откладываются в клетках ретикулоэндотелиальной системы. Наследственное заболевание фенилкетонурия характеризуется нарушением превращения фенилаланина в тирозин в результате генетически обусловленной недостаточности фермента фенилаланин - 4-гидроксилазы, что вызывает накопление в крови и моче непревращенного фенилаланина и продуктов его обмена - фенилпировиноградной и фенилуксусной кислот. Нарушение превращений этих соединений характерно и для вирусного гепатита.
Тирозинемию, тирозинурию и тирозиноз отмечают при лейкозах, диффузных заболеваниях соединительной ткани (коллагенозах) и других патологических состояниях. Они развиваются вследствие нарушения трансаминирования тирозина. Врожденная аномалия окислительных превращений тирозина лежит в основе алкаптонурии, при которой в моче накапливается непревращенный метаболит этой аминокислоты - гомогентизиновая кислота. Нарушения пигментного обмена при гипокортицизме (см. Надпочечники ) связаны с угнетением превращения тирозина в меланин вследствие ингибирования фермента тирозиназы (полное выпадение синтеза этого пигмента характерно для врожденной аномалии пигментации - альбинизма).
При хроническом гепатите, сахарном диабете, остром лейкозе, хроническом миело- и лимфолейкозе, лимфогранулематозе, ревматизме и склеродермии нарушается обмен триптофана и его метаболиты 3-оксикинуренин, ксантуреновая и 3-оксиантраниловая кислоты, обладающие токсическими свойствами, накапливаются в крови. К патологии А. о. относятся и состояния, связанные с нарушением выделения почками креатинина и накоплением его в крови. Усиление экскреции креатинина сопровождает гиперфункцию щитовидной железы, а снижение экскреции креатинина при повышенном выведении креатина - гипотиреоз.
При массивном распаде клеточных структур (голодание, тяжелая мышечная работа, инфекции и др.) отмечают патологическое нарастание концентрации остаточного азота за счет увеличения относительного содержания в ней азота мочевой кислоты (в норме концентрация мочевой кислоты в крови не превышает - 0,4 ммоль/л ).
В пожилом возрасте снижаются интенсивность и объем синтеза белка за счет непосредственного угнетения биосинтетической функции организма и ослабления его способности усваивать аминокислоты пищи; развивается отрицательный азотистый баланс. Нарушения обмена пуринов у людей пожилого возраста приводят к накоплению и отложению в мышцах, суставах и хрящах солей мочевой кислоты - уратов. Коррекция нарушений А. о. в пожилом возрасте может быть осуществлена за счет специальных диет, содержащих полноценные животные белки, витамины и микроэлементы, с ограниченным содержанием пуринов.
Азотистый обмен у детей отличается рядом особенностей, в частности положительным азотистым балансом как необходимым условием роста. Интенсивность процессов А. о. на протяжении роста ребенка подвергается изменениям, особенно ярко выраженным у новорожденных и детей раннего возраста. В течение первых 3-х дней жизни азотистый баланс отрицателен, что объясняется недостаточным поступлением белка с пищей. В этот период обнаруживается транзиторное повышение концентрации остаточного азота в крови (так называемая физиологическая азотемия), иногда достигающее 70 ммоль/л ; к концу 2-й нед.
жизни концентрация остаточного азота снижается до уровня, отмечаемого у взрослых. Количество выделяемого почками азота нарастает в течение первых 3-х дней жизни, после чего снижается и вновь начинает увеличиваться со 2-й нед. жизни параллельно возрастающему количеству пищи.
Наиболее высокая усвояемость азота в организме ребенка наблюдается у детей первых месяцев жизни. Азотистый баланс заметно приближается к равновесию в первые 3-6 мес. жизни, хотя и остается положительным. Интенсивность белкового обмена у детей достаточно высока - у детей 1-го года жизни обновляется около 0,9 г белка на 1 кг массы тела в сутки, в 1-3 года - 0,8 г/кг/ сут., у детей дошкольного и школьного возраста - 0,7 г/кг/ сут.
Средние величины потребности в незаменимых аминокислотах, по данным ФАО ВОЗ (1985), у детей в 6 раз больше, чем у взрослых (незаменимой аминокислотой для детей в возрасте до 3 мес. является цистин, а до 5 лет - и гистидин). Более активно, чем у взрослых, протекают у детей процессы трансаминирования аминокислот. Однако в первые дни жизни у новорожденных из-за относительно низкой активности некоторых ферментов отмечаются гипераминоацидемия и физиологическая аминоацидурия в результате функциональной незрелости почек. У недоношенных, кроме того, имеет место аминоацидурия перегрузочного типа, т.к. содержание свободных аминокислот в плазме их крови выше, чем у доношенных детей. На первой неделе жизни азот аминокислот составляет 3-4% общего азота мочи (по некоторым данным, до 10%), и лишь к концу 1-го года жизни его относительное содержание снижается до 1%. У детей 1-го года жизни выведение аминокислот в расчете на 1 кг массы тела достигает величин выведения их у взрослого человека, экскреция азота аминокислот, достигающая у новорожденных 10 мг/кг массы тела, на 2-м году жизни редко превышает 2 мг/кг массы тела. В моче новорожденных повышено (по сравнению с мочой взрослого человека) содержание таурина, треонина, серина, глицина, аланина, цистина, лейцина, тирозина, фенилаланина и лизина. В первые месяцы жизни в моче ребенка обнаруживаются также этаноламин и гомоцитруллин. В моче детей 1-го года жизни преобладают аминокислоты пролин и [гидр]оксипролин.
Исследования важнейших азотистых компонентов мочи у детей показали, что соотношение мочевой кислоты, мочевины и аммиака в процессе роста существенно изменяется. Так, первые 3 мес. жизни характеризуются наименьшим содержанием в моче мочевины (в 2-3 раза меньше, чем у взрослых) и наибольшей экскрецией мочевой кислоты. Дети в первые три месяца жизни выделяют 28,3 мг/кг массы тела мочевой кислоты, а взрослые - 8,7 мг/кг . Относительно высокая экскреция у детей первых месяцев жизни мочевой кислоты способствует иногда развитию мочекислого инфаркта почек. Количество мочевины в моче нарастает у детей в возрасте от 3 до 6 месяцев, а содержание мочевой кислоты в это время снижается. Содержание аммиака в моче детей в первые дни жизни невелико, но затем резко возрастает и держится на высоком уровне на протяжении всего 1-го года жизни.
Характерной особенностью А. о. у детей является физиологическая креатинурия. Креатин обнаруживается еще в амниотической жидкости; в моче он определяется в количествах, превышающих содержание креатина в моче взрослых, начиная с периода новорожденности и до периода полового созревания. Суточная экскреция креатинина (дегидроксилированного креатина) с возрастом увеличивается, в то же время по мере нарастания массы тела ребенка относительное содержание азота креатинина мочи снижается. Количество креатинина, выводимого с мочой за сутки, у доношенных новорожденных составляет 10-13 мг/кг , у недоношенных 3 мг/кг , у взрослых не превышает 30 мг/кг.
При выявлении в семье врожденного нарушения А. о. необходимо проведение
Вопрос короткр
Выделение конечных продуктов азотистого обмена
Мочевая кислота является одним из наиболее важных конечных продуктов азотистого обмена у человека. В норме ее концентрация в сыворотке крови у мужчин составляет 0,27- 0,48 ммоль-л1, у женщин 0,18-0,38 ммоль-л-1; суточная экскреция с мочой колеблется от 2,3 до 4,5 ммоль (400-750 мг). У человека экскретируется мочевая кислота, у многих млекопитающих имеется фермент уриказа, которая окисляет мочевую кислоту до аллантоина. В теле здорового человека в сутки образование и выделение мочевой кислоты составляет от 500 до 700 мг. Большая часть мочевой кислоты (до 80 %) образуется в результате метаболизма эндогенных нуклеиновых кислот, лишь около 20 % связано с пуринами, поступающими с пищей. Почки за сутки экскретируют около 500 мг мочевой кислоты, 200 мг удаляются через желудочно-кишечный тракт.
Функциональные протеинурии. К функциональным протеинуриям, точные процессы возникновения которых не определены, причисляются относящаяся к вертикальному положению тела, идиопатическая непостоянное, выделение белка с мочой натуги, горячечное появление белка в моче, а также выделение белка с мочой приожирении.
Для ортостатической протеинурии свойственно появление полипептида в urina при длительном бездействии или расхаживании с скорым его исчезновением при изменении позы тела на перпендикулярное. Появление белка в моче в большинстве случаев не превосходит один г/сутки, является клубочковой и невыборочной, процедура ее появления неотчётлива. Чаще она отмечается в юношеском возрасте, у половины больных вылечивается через некоторое время. Механизм формирования, пожалуй, объединен с ненормально обострённым ответом почечного кровообращения на изменение размещения туловища.
Определение ортостатической протеинурии ставят при комбинировании ниженазванных условий:
Возраст пациентов 13-двадцать лет;
Закрытый тип появления белка в моче, неимение иных признаков нарушения почек (перестроений уринозного осадка, увеличения давления, которое кровь, находящаяся в артерии, оказывает на ее стенку, видоизменений сосудов внутренней поверхности глазного яблока);
Всего лишь ортостатический ход появления белка в моче, когда в изучениях урины, забранных после нахождения обследуемого в положении лежа (в том числе наутро до вставания с постели), протеин отсутствует.
Для доказательства этого диагноза нужно выполнить относящуюся к вертикальному положению туловища проверку. Для этого урину собирают утром перед вставанием с кровати, затем после некоторого нахождения в перпендикулярном положении (движение с палкой за спиной для развёртывания позвоночного столба). Диагностика передаёт еще более точные итоги, когда утренняя (ночная) доля urina сливается (так как в vesica urinaria возможна остаточная урина), а начальная порция подбирается после недолгого присутствия пациента в лежачем положении.
В молодом возрасте возможна в свою очередь первичное непостоянное появление белка в моче, устанавливаемая у здоровых индивидуумов при врачебном исследовании и пропадающая при следующих анализах мочи.
Протеинурия напряжения выявляется у двадцати процентов лиц в здоровом состоянии (даже спортсменов) после сильной физической нагрузки. Белок выявляетсяв начальной подготовленной порции урины. выделение белка с мочой характером связанным с патологией канальцев. Предполагается, что алгоритм появления белка в моче объединен с рекомбинацией тока крови и относительной ишемией проксимальных участков нефрона.
Лихорадочное появление белка в моче встречается при сильных горячих состояниях, в частности у лиц детского возраста и лиц старческого возраста. Лихорадочное выделение белка с мочой имеет преимущественно гломерулярный ход. Процессы этого вида протеинурии мало изучены, изучается возможная важность увеличения клубочковой фильтрации наравне с недолговечным поражением клубочкового фильтра защитными комплексами.
Выделение белка с мочой при патологической избыточной массе тела. Выделение белка с мочой нередко наблюдается при анормальном отложении жира в теле. (вес тела более 115 килограммов). По данным J.P.Domfeld (1989), среди одной тысячи пациентов с патологическим отложением жира в теле. у 420 диагностировано выделение белка с мочой без перерождений отстоя урины; показаны и прецеденты нефротического синдрома. Предполагается, что в первопричине формирования такой протеинурии располагаются искажения кровообращения скопления сильно фенестрированных капилляров (повышение давления в группе капилляров почечного тельца, повышенная скорость фильтрации), связанные с повышением при патологической избыточной массе тела. концентрации полипептидного гормона, вырабатываемого почкой вследствие понижения кровяного давления и гипертензин, которая при голодании убавляется. При снижении веса, а также при лечении замедлителями АПФ выделение белка с мочой может убавляться, а также утрачиваться.
Вдобавок, протеинурия может иметь внепочечное начало. При присутствии лейкоцитов в анализе мочи и особенно появление крови в моче удостоверяющая реакция на полипептид может быть итогом распада форменных элементов крови при длительном стоянии урины, в данной обстановке ненормальным представляется появление белка в моче превышающее, 0,3 грамма/сут. Осадочные полипептидные проверки способны давать ложноположительные результаты при присутствии в urina йодосодержащих контрастных материалов, немалого числа сходных препаратов Penicillinum а также лекарственного вещества из группы полусинтепнческих беталактамовых антибиотиков, продуктов метаболизма сульфаниламидных препаратов.
Похожая информация.








