Неотложное состояние, тяжелый проявление сепсиса, которой возникает при инфекционных, хирургических, урологических, акушерско-гинекологических болезнях, который проявляется тяжелой гипотонией и нарушениями системной гемодинамики.
Относительно сепсиса в международной клинической практике широко используют терминологию, которая была предложена на согласительном конференции по сепсиса в 1992 году в США (англ. Consensus Conference of the American College of Chest Physicians and the Society of Critical Care Medicine). Главным признаком сепсиса считают таким образом наличие в организме патогенных бактерий, которые вызывают развитие синдрома системного воспалительного ответа, что, в свою очередь, обусловливает появление неконтролируемых патофизиологических изменений на уровне эндотелия капилляров.
Синдром системного воспалительного ответа (ССВО, SIRS) — это термин, который был введен для выделения универсальных клинических проявлений, возникающих в результате развития выраженной воспалительной реакции (но не только инфекционного генеза) или системного ответа тяжелой инфекции. Для установления факта этого синдрома у больного существуют соответствующие диагностические критерии, как группа показателей, изменение которых может отображать воспалительные изменения (инфекционного или другого генеза) на микрососудистых и клеточном уровнях. Наличие по крайней мере двух из следующих 4 критериев указывает на развитие ССВО:
- температура тела выше 38 ° C или ниже 36 ° C;
- частота сердечных сокращений выше 90 в минуту;
- частота дыхания более 20 в минуту;
- количество лейкоцитов больше 12×10 9 / л или менее 4×10 9 / л или наличие более 10% незрелых форм.
Тяжелый сепсис может иметь ход без критериев ССВО, так же и критерии ССВО можно выявить при других заболеваний (травма, отравление, острый панкреатит и т.д.). Данные исследований указывают на большую диагностическую значимость раннего выявления органной дисфункции, чем просто наличия критериев ССВО.
В зависимости от степени тяжести выделяют:
- сепсис (критерии ССВО / SIRS + инфекция),
- тяжелый сепсис (дисфункция органов вследствие гипоперфузии)
- септический шок (присоединение гипотензии, которую корректирует инфузионная терапия).
Термин «бактериемия» означает наличие микроорганизмов в крови (не обязательно ассоциируется с сепсисом). Бактериемия часто является вторичной, как результат наличия внутрисосудистого очага инфекции или очага вне сосудов.
Установлено, что септический шок с бактериологически подтвержденной бактериемией составляет лишь 30-50% случаев.
Причины
В генезисе сепсиса наиболее важным является то обстоятельство, что организм больного теряет способнисть локализации и подавления возбудителей и / или нейтрализации их экзо или эндотоксинов, или обоих сразу. Основой развития септического шока является нарушение гемодинамики, периферической тканевой гемоперфузии. Возбудителями сепсиса чаще является кишечная палочка, протей, синегнойная палочка, клебсиелла, сальмонеллы, стрептококки, стафилококки, Clostridium perfringens и тому подобное. Бактериальные токсины порождают сначала спазм мелких сосудов, а затем их паралич, что приводит к артериальной гипотензии, ацидоза, нарушений кровообращения в мозговых, почечных, печеночных сосудах с развитием ССВО, главными проявлениями которого является токсическая энцефалопатия, сердечная недостаточность, поражение почек и печени.
В акушерстве септический шок возникает часто в результате послеродовой инфекции. Его можно наблюдать также при септических выкидышах, в поздние сроки беременности, как осложнение криминального аборта.
Уровень летальности от тяжелого сепсиса колеблется в пределах 20-50%. Главной причиной летальности при сепсисе является септический шок. Факторы, которые непосредственно связаны с ростом уровня летальности:
- преклонного возраста,
- наличие сопутствующей патологии
- развитие множественной органной недостаточности.
Отмечаются стремительный рост летальности у больных старше 50 лет. Сепсис чаще наблюдают у лиц пожилого возраста, имеющих фоновые заболевания, способствующие возникновению инфекции (сахарный диабет, иммунодефицитные состояния и т.д.). К группе риска относятся:
- онкологические больные во время проведения химиотерапии,
- больные с почечной или печеночной недостаточностью в конечной стадии,
- ВИЧ-инфицированные,
- больные, длительно принимавших кортикостероиды или иммуносупрессивные препараты,
- лица с установленными катетерами и другими внутривенными устройствами, эндопротезами.
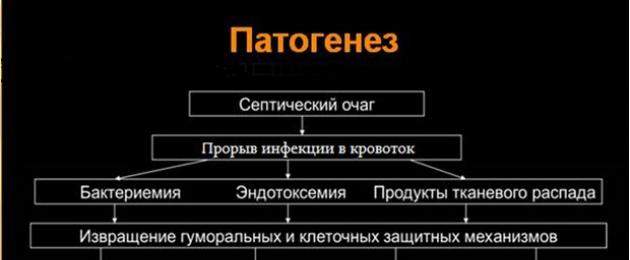
Патогенез
Патофизиологическая ответ на инфекцию заключается в активации ряда механизмов на локальном и системном уровнях, реализуемых в неконтролируемую воспалительную реакцию, которая включает:
- активацию нейтрофилов и моноцитов;
- высвобождение медиаторов воспаления;
- диффузную вазодилатацию и увеличение проницаемости эндотелия;
- активацию факторов свертывания крови.
Считают, что в случае грамотрицательных бактерий инициирующим моментом является взаимодействие иммунокомпетентных клеток с эндотоксинами бактериальной стенки. В случае грамположительной инфекции также имеет место взаимодействие с экзотоксинами, которых освобождают бактерии. В клетках активируется высвобождение цитокиновых и нецитокинових медиаторов
- фактор некроза опухолей-a (TNF-a),
- интерлейкин-1 (IL-1),
- интерлийкин-6 (IL-6).
В кровоток выделяются медиаторы с вазодилатирующим и эндотоксических действием (простагландины, тромбоксан А2 и оксид азота), что приводит к системной гипоперфузии, развития синдрома капиллярного просачивания, микротромбування, ишемии и функциональной недостаточности органов. Следует отметить, что нарушения микроциркуляции могут возникать даже на фоне нормальных показателей гемодинамики.
Клинические проявления
Клиническая симптоматика на ранних стадиях сепсиса может быть неспецифической. Типичные симптомы системного воспаления могут отсутствовать, особенно у лиц пожилого возраста. Локальные проявления часто являются ключевыми для выявления этиологии процесса. Лихорадка является симптомом инфекции, но подъем температуры тела не является высокоспецифичный признаку. Гипотермия (снижение температуры ниже отметки в 37 ° C) является более весомым фактором прогнозирования тяжести процесса. Тахикардия является компенсаторным механизмом для процесса увеличения доставки кислорода к тканям и указывает на потребность в проведении инфузионной терапии, хотя может быть вызвана и собственно лихорадкой. Одышка (тахипноэ) в ранние сроки является результатом воздействия эндотоксинов и медиаторов воспаления на дыхательный центр, в дальнейшем увеличение частоты дыхания является компенсаторной реакцией на возникновение метаболического ацидоза. Больной часто испытывает недостаток воздуха, появляется чувство тревоги. Тахипноэ является одним из самых весомых и неблагоприятных критериев ССВО и признаком легочной недостаточности и острого респираторного дистресс-синдрома (ОРДС). Нарушение функции ЦНС колеблется от незначительной дезориентации во времени и пространстве до комы. Другими проявлениями нарушений ЦНС является немотивированный страх, тревожность или возбуждения. Причинами этого является гипоперфузия (уменьшение кровоснабжения) головного мозга и нарушения обмена аминокислот. Во время объективного обследования определяют общее состояние больного, проходимость дыхательных путей, самостоятельное дыхание и состояние кровообращения, степень сознания. Бледная, серая или мраморная кожа является признаком нарушения кровоснабжения тканей и шока. На ранних стадиях кожа тепла вследствие периферической вазодилатации и увеличение сердечного выброса («теплый шок»). В ходе прогрессирования септического шока гиповолемия, гипоперфузия и уменьшение сердечного выброса проявляются холодными на ощупь конечностями и нарушением капиллярного наполнения. Петехиальная сыпь или пурпура могут быть связаны с синдромом диссеминированного внутрисосудистого свертывания крови (ДВС-синдром).
Диагностика
Клинический анализ крови
Подсчет количества лейкоцитов входит критериям ССВО. Уровень гемоглобина выше 100 г / л и гематокрита выше 30% является достаточным для поддержания адекватной перфузии тканей, поскольку кислородная емкость и транспорт кислорода кровью являются решающими. Повышение уровня тромбоцитов в крови является показателем острой фазы воспаления, однако на фоне ДВС-синдрома их количество значительно снижается.
Биохимический анализ крови
Мониторить и корректировать уровень электролитов особенно важно в случае тяжелой дегидратации. Снижение уровня бикарбонатов указывает на острый ацидоз. Повышение содержания азота в моче и уровня креатинина может указывать на тяжелую дегидратацию и / или почечной недостаточности. Важным является контроль уровня глюкозы в крови, повышение которого связывают с более высоким процентом летальности. Активность аминотрансфераз (АЛТ, АСТ) щелочной фосфатазы, липазы и уровень билирубина могут указать на вероятный источник инфекции или на развитие определенной органной недостаточности. Лактат крови является маркером анаэробного метаболизма, который происходит на фоне кислородного голода. Следствием гипоксемии является снижение перфузии и диффузии кислорода через капилляры в ткани, нарушение утилизации О 2 на клеточном уровне. Повышение уровня лактата более 2,5 ммоль / л ассоциируют с повышением смертности.
Коагулограмма
Нарушение коагуляции диагностируют по уровню ПВ и активированного тромбопластинового времени, которые удлиняются на фоне ДВС-синдрома. Также наблюдают снижение уровня фибриногена и повышение уровня продуктов деградации фибрина.
Бактериологическое исследование
Посев крови выполняют во всех пациентов с подозрением на сепсис для выделения специфического штамма и коррекции антибиотикотерапии. Следует подчеркнуть, что ожидания выделения патогенной культуры при сепсисе составляет лишь 50%. В 10-15% случаев лихорадки без явных локальных симптомов инфекции источником является мочевая система (особенно в пожилом возрасте), поэтому важно провести бактериальное исследование мочи и выделений из мочевыводящих путей. Мокроты при подозрении на пневмонию, гнойный материал из дренажей / абсцессов, ликвор при подозрении на инфекцию ЦНС по Граму.
Инструментальные методы исследования
Проведение диагностических мероприятий для поиска источника инфекции особенно важно в случаях, когда важно и возможно провести хирургическое дренирование (инфекция брюшной полости, мягких тканей и фасции, параректальные абсцессы и т.п.). Во время рентгенографии органов грудной клетки в 5% случаев обнаруживают инфильтраты на фоне лихорадки неизвестного происхождения, в других случаях диагностируют ОРДС. Рентгенография органов брюшной полости выполняется в случаях клиники кишечной непроходимости или перфорации полостного органа. В некоторых случаях рентгенография конечностей может помочь в диагностике инфекции глубоких тканей (скопление газа, признаки остеомиелита). Однако при диагностике некротизирующего фасциита наиболее информативные такие клинические проявления, как сильная боль, крепитация, отек, геморрагии, экссудат с резким запахом. Проведение ультразвукового исследования брюшной полости показано при наличии симптомов острого холецистита или холангита. По показаниям выполняют КТ органов брюшной полости.
Лечение
Общие принципы
Полноценное лечение возможно только в условиях стационара с соответствующим диагностическим и мониторным оборудованием. Однако инсуфляцию (введение в полости) кислорода и восполнения объема циркулирующей крови (ОЦК) изотоническими кристаллоидными растворами медицинский персонал должен проводить даже на достационарный этапе.
Манипуляции и диагностические процедуры в стационаре
Оротрахеальна интубация и искусственная вентиляция легких (ИВЛ)
Необходимость выполнения ранней интубации и ИВЛ должна быть Рассмотрены даже при отсутствии явной гипоксии или ОРДС. Адекватная ИВЛ позволяет сохранить энергетические ресурсы, которые расходуются на работу дыхания, достигает до 30% от общего метаболизма.
Внутривенный доступ
В случае потенциальной необходимости проведения массивной инфузии растворов рекомендуется введение двух широких катетеров в периферийную вену. Центральный катетер (т.е. установлен в подключичную вену) устанавливают пациентам с шоком, рефрактерным к инфузии 20-30 мл / кг кристаллоидных растворов в течение 30-60 минут.
Установка мочевого катетера
Позволяет точно подсчитывать диурез как показатель баланса жидкости и тканевой перфузии. Нормальный диурез у взрослых составляет 0,5 мл / кг в час, или 30-50 мл в час.
Меры для установления очага инфекции
Дренирование абсцесса кожи и мягких тканей выполняют немедленно, поскольку другие терапевтические меры будут малоэффективными. Выполняют все необходимые диагностические процедуры для нахождения очага инфекции. Люмбальную пункция используют при подозрении на менингит или энцефалит. Антибиотики широкого спектра, которые проникают через гематоэнцефалический барьер, назначают перед началом процедуры. При подозрении на инфекцию ЦНС антибиотики назначают как можно быстрее, поскольку они не влияют на результаты бактериологического исследования ликвора в течение нескольких часов после назначения. Если септическое костер возникает в женской репродуктивной системе, то для его устранения осторожно проводят инструментальное исследование матки с помощью кюретки. При отсутствии эффекта от лечения выполняют ампутацию матки.
Общие положения лечения сепсиса и септического шока согласно международным протоколам
Всем пациентам с подозрением на сепсис назначают оксигенотерапию, проводят оценку дыхания и проходимости дыхательных путей. Проведение ИВЛ рекомендуется пациентам с необходимостью в кислороде, наличием одышка и тахипноэ, артериальной гипотонией и периферической гипоперфузией.
Инфузионная Волемический поддержка
Поскольку септический шок относят к дистрибутивных видов шока, при этом состоянии развивается относительная или абсолютная гиповолемия. В большинстве случаев нужно проводить массивные инфузии кристаллоидных и коллоидных растворов, часто до 4-6 литров в первые сутки. Считают, что примерно у 50% больных с септическим шоком базисные гемодинамические показатели можно стабилизировать за счет адекватной инфузионной терапии. Пациентам с вероятным септическим шоком проводят первоначальное Волемический нагрузки (то есть быстрый ввод объема жидкости за определенный период времени с последующей оценкой реакции на это) кристаллоидами объемом 20-30 мл / кг (1-2 л) за период 30-60 минут с последующим введением в 1 л еще за 30 минут. Скорость инфузии мониторують по показателям центрального венозного давления (ЦВД) и признаками перегрузки объемом (одышка, крепитация над легкими или их отек по данным рентгенографии органов грудной клетки).
Есть утверждение, что введение коллоидов (альбумина и гидроксиэтилкрахмалы), не имеет преимуществ перед введением кристаллоидов (изотонический раствор хлорида натрия или растворы Рингера-лактата). Но есть противоположные выводы, что важную роль в современной жидкостной ресусцитации играет смесь гипертонического раствора натрия хлорида (7,5%) с раствором коллоида (гидроксиэтилкрахмал, декстран). Гипертонический раствор / коллоид (4 мл / кг) улучшает микроциркуляцию и перфузию тканей при тяжелой гиповолемии. Считают, что введение растворов гидроксиэтилкрахмала при предоставляют в такой ситуации протекторный эффект эндотелия сосудов, способствуют нормализации проницаемости и сохранению жидкости в сосудистом русле. Предполагают положительное влияние этих растворов на воспалительный ответ и проницаемость эндотелия вследствие уменьшения освобождения адгезивных молекул. Волемический поддержка раствором гидроксиэтилкрахмала 130 / 0,4 существенно улучшает оксигенацию тканей по сравнению с применением только кристаллоидных растворов.
Антибиотикотерапия
Рекомендуется начинать ее в течение часа выявления септического шока, задержку назначения антибиотиков связывают с повышением летальности. Выбор антибиотика основывают на оценке потенциального источника инфекции и вероятных возбудителей.
- Если первоисточник инфекции неизвестно, антибиотик должен быть широкого спектра: действовать как в отношении грамположительных, так и на грамотрицательные бактерии и анаэробы.
- Отмечают общую тенденцию к увеличению частоты выявления метициллин-резистентного золотистого стафилококка (MRSA), поэтому следует применять соответствующие антибактериальные препараты (ванкомицин или линезолид). Особенно это касается пациентов с постоянным введением (в / в) лекарств в анамнезе, с постоянными в / в катетерами / устройства или хронически больных тяжелыми болезнями.
- Антипсевдомонадные антибиотики (цефтазидим, цефепим, тикарцилин, пиперациллин, имипенем, меропенем) должны быть применены в имуноскомпроментованих пациентов, особенно при наличии нейтропении или ожогов.
- Доказано, что у пациентов без иммуносупрессии адекватна монотерапия карбапенемами (имипенем, меропенем), одним из цефалоспоринов третьего или четвертого поколения (цефотаксим, цефоперазон, цефтазидим) или пенициллины широкого спектра действия (тикарцилин, пиперациллин) без применения нефротоксических аминогликозидов.
Вазопрессорная терапия
При недостаточном эффекте объемной ресусцитации, для нормализации параметров гемодинамики и, прежде всего, артериального давления необходимо вазопрессорная поддержка ((препараты, которые вызывают сужение сосудов). Применение этих препаратов теоретически обосновано снижением общего периферического сопротивления сосудов при септическом шоке. Поэтому применение альфа1-адренорецепторов агонистов улучшает прогноз при нем. Вазопрессоры назначают в случае устойчивой гипотензии после достижения адекватного ОЦК. Стойку гипотензии обычно определяют как систолическое артериальное давление (САД) <90 мм рт.ст. или среднего артериального давления (САД) <65 мм рт.ст. с признаками нарушением тканевой перфузии. Главной целью терапии является ликвидация патологической вазодилатации и перераспределения крови, которые породила воспалительный ответ на инфекцию. Вазопрессоры рекомендуют ввести после достижения ЦВД — 80-120 мм вод. ст. на фоне гипоперфузии, доза титруется до достижения САТ более 65 мм рт.ст. В случае выраженного шока (ТВ <70 мм рт. Ст. И признаки тканевой гипоперфузии) вазопрессоры назначают, несмотря на жидкостную ресусцитация (т.е. реанимацию). Следует отметить, что вазопрессоры необходимо применять только после заполнения внутрисосудистого объема, поскольку они могут усиливать глобальную и региональную ишемию тканей, особенно это касается висцерального и почечного кровотока, а также способны провоцировать нарушения ритма сердца.
Вазопрессоры первой линии
Препаратами выбора для септического шока является норадреналин или дофамин. Первый имеет преимущественно альфа-адреномиметическими эффект и сильную сосудосуживающим (такую, что приводит сильный спазм сосудов) действие в отношении периферических артерий без существенного влияния на частоту сокращений сердца (ЧСС) и сердечный выброс. Теоретически норадреналин является идеальным вазопрессоры в случае «теплого» шока, когда отмечают периферическую вазодилатацию на фоне нормального или повышенного сердечного выброса. Типичный пациент с «теплым» шоком имеет теплые конечности при системной гипотензии и тахикардии. Доза норадреналина у взрослых должно быть в пределах 2-20 мкг / мин без учета массы тела. Дофамин, имеет значительно больший ẞ-адреномиметическими эффект, увеличивает САТ за счет повышения сократительной функции миокарда, ударного объема и ЧСС. Однако в больших дозах он оказывает большее альфа-адреномиметическими эффект и периферическое сопротивление. Дофамин может быть более полезным в случае «холодного» шока, когда есть периферическая вазоконстрикция (холодные конечности), и сердечный выброс слишком мал для обеспечения тканевой перфузии. Доза составляет 1-20 мкг / кг в минуту.
Вазопрессоры второй линии
Вазопрессоры второй линии для пациентов с такой стойкой гипотонией, которую корректируют несмотря на максимальные дозы норадреналин или дофамин, является адреналин, фенилэфрин (мезатон) и вазопрессин. Адреналин повышает САД у пациентов, нечувствительных к другим вазопрессоров, в основном за счет сильного инотропного эффекта на миокард. Побочные эффекты включают тахиаритмии, миокардиальную ишемию, повышение общей концентрации лактата. Фенилэфрин — это чистый альфа-адреномиметик, что вызывает сильную вазоконстрикцию, но за счет этого уменьшается сократительная функция миокарда и ЧСС. Этот препарат показан у пациентов со значительной тахикардией. Вазопрессин предлагают как потенциально полезный препарат для лечения септического шока. Он является эндогенным пептидом с сильным вазоактивным эффектом, уровень которого снижается при септического шока. Назначение вазопрессина снижает потребность в норадреналин.
Другие инотропные средства
Поскольку при септическом шоке быстро снижается сократительная функция миокарда, необходима существенная кардиотоническое поддержка. Добутамин — инотропный средство с ẞ-адреномиметическими эффектом, стимулирует сердечный выброс. Он Улучшает доставку кислорода в тех пациентов с септическим шоком, которым проведена адекватная жидкостная ресусцитация и предоставлена вазопрессорная поддержка. Добутамин рекомендуют при наличии признаков тканевой гипоперфузии после достижения целевых показателей ЦВД, САТ и гематокрита. Добутамин является препаратом выбора для инотропной поддержки при снижении сердечного выброса <2,5 л / мин / м 2 при адекватном восполнении жидкостью. Возможно, поэтому одной из наиболее эффективных считают комбинацию добутамина и норадреналина.
Выраженный лактатацидоз, который развивается в результате преобладания анаэробного гликолиза, может сам стать одной из причин неэффективности катехоламинов. В этих случаях, но только при условии рН крови <7,2, рекомендуют переливания раствора соды.
Лечение нарушений почечной функции
Развитие почечной недостаточности при септическом шоке чаще носит Преренальная (донирковий) характер, поэтому основным методом лечения такой недостаточности является скорейшее возобновление кровоснабжения почек. При развитии острой почечной недостаточности показано соответствующее экстракорпоральное (вне организма) лечение, включая гемодиализ.
Глюкокортикостероиды
Проблема применения глюкокортикоидных гормонов при септическом шоке, остается актуальной вот уже несколько десятилетий. При этом очень часто одни рекомендации меняют на совершенно противоположные. Для применения ГКС серьезное основание. Так как в основе прогрессирования септического процесса лежит ССВО, выраженное противовоспалительное действие ГКС имеет это предотвратить. Во второй половине ХХ века при лечении септического шока рекомендовали применение больших доз ГКС (до 30 мг / кг в сутки). Однако в последние два десятилетия положительный эффект такой терапии опровергнуто. На сегодня считают, что большие дозы не только не оказывают положительного эффекта, но и ухудшают результаты лечения больных септический шок. И наоборот данные, что низкие дозы ГКС (200-300 мг гидрокортизона в сутки в течение 5-7 суток) уменьшают летальность и рекомендованы для применения при сепсисе с артериальной гипотонией, которая плохо поддается другой терапии. Особенно эффективно применение ГКС у больных с относительной недостаточностью надпочечников, которая часто возникает у этой категории больных.
Коррекция гемостаза и других факторов
Одной из наиболее важных стратегий лечения септического шока считают активацию фибринолитической системы, в частности применение рекомбинантного активированного протеина С. эндогенный активированный протеин C является важнейшим природным ингибитором факторов гемостаза Va и VIIIa и играет существенную антитромботической роль в бассейне микроциркуляции. Активированный протеин C обладает прямым противовоспалительным действием — снижает продукцию цитокинов, ингибирует адгезию лейкоцитов с эндотелием. Согласно результатам исследования PROWESS, прием активированного дротрекогина альфа в дозе 24 мкг / кг / час в течение 96 часов достоверно уменьшило 28-дневную смертность до 26,5% и позволило быстрее нормализовать функцию сердечно-сосудистой и дыхательной систем.
При достаточной перфузии тканей при наличии ишемической болезни сердца или острого кровотечения гемоглобин следует поддерживать на уровне 70-90 г / л. Для этого можно применить переливания эритромассы.
Осуществляют профилактику тромбоза глубоких вен бинтованием голеней и другими мерами. Проводят профилактику стрессогенных язв и кровотечений из верхних отделов желудочно-кишечного тракта путем использования блокаторов H2-рецепторов или ингибиторов протонной помпы.
Питательная поддержка
У пациентов с септическим шоком увеличена потребность в потреблении белков и большой расход калорий, поэтому адекватное питание улучшает результаты лечения и уменьшает летальность при этой патологии. Даже короткий период отсутствия энтерального (т.е. желудочно-кишечного) питание приводит к тяжелым неблагоприятных последствий. Ранее доминировало мнение о преимуществах исключительно парентерального питания и исключения энтерального приема пищи у больных в критическом состоянии, в том числе при септическом шоке. Однако за последнее время мнения о методах питательной поддержки кардинально изменились. Преимуществами энтерального питания считают
- Протекцию слизистой оболочки и сохранения барьерной функции кишечника;
- Более физиологический путь поступления пищи с более адекватной продукцией некоторых гормонов в пищеварительной системе;
- Отсутствие необходимости в длительной катетеризации вен и массивных инфузий, что также снижает риск инфекционных осложнений;
- Возможность обеспечения более эффективной нутриитивнои поддержки;
- Меньший риск образования язв желудка и кишечника;
- Меньшая стоимость.
Противопоказаниями к раннему энтерального питания является отсутствие гемодинамической стабильности и внутрибрюшные осложнения после абдоминальных операций (например, недостаточность кишечного анастомоза). Однако не все согласны с таким подходом. Есть мнения, что энтеральное питание для пациентов с сепсисом не опасен и показано даже в случаях тяжелого септического шока.
Следует также помнить о нежелательности парентерального введения глюкозы у больных септический шок.
Особенности лечения септического шока на фоне сахарного диабета
Необходимо в такой ситуации является строгий контроль уровня гликемии, поддержание уровня глюкозы в крови <8 ммоль / л после начальной стабилизации. Для этого часто необходимо использование интенсивной инсулинотерапии, при проведении которой следует учитывать риск развития гипогликемии.
Особенности лечения септического шока у детей
Включают:
- более тщательное использование физикальных методов обследования для выбора терапии;
- дофамин является средством выбора при гипотензии;
- глюкортикостероиды применяют только у детей с подозреваемым или доказанной недостаточностью надпочечников;
- использование рекомбинантного активированного протеина C у детей противопоказано.
Септический шок – это самый распространенный вариант осложнения при развитии гнойно-инфекционного процесса, вызываемого преимущественно грамотрицательными бактериями. В результате разрушения всех этих разновидностей бактерий происходит активное выделение эндотоксина, представляющего собой своеобразный провокаторный механизм развития такой патологии как инфекционно-септический шок. При воздействии грамположительных бактерий практически никогда не развивается патогенез септического шока. Кроме вышеперечисленных видов бактериальной флоры провокатором развития септического шока может выступать и анаэробная флора в виде Clostridiaperfringens, риккетсий, вирусов герпеса и цитамегаловируса, а несколько реже — грибов и простейших.
Такая патология как в своем патогенезе во многом зависит от состояния общей индивидуальной резистентности организма человека, а также концентрации возбудителя и степени его патогенности. Учитывая данные особенности патогенеза, самой распространенной клинической формой данной патологии является септический шок в акушерстве.
Такая довольно распространенная патология как септический шок в гинекологии в свою очередь разделяется на этиопатогенетические формы типа септического внебольничного аборта, инфекционного и постартифициального аборта, произведенного в условиях гинекологического стационара. Раннее развитие септического шока в гинекологии и акушерстве обусловлено тем, что беременная матка является своеобразными входными воротами для проникновения инфекционных агентов, сгустки крови выступают в роли питательной среды для размножения микроорганизмов, в этом периоде отмечается изменение гормонального статуса женского организма, а также развитие , усугубляющей течение шока.
Следует учитывать, что клиника септического шока также может осложняться развитием ограниченного или разлитого перитонита, что является крайне неблагоприятным фактором и может стать причиной развития летального исхода.
Причины септического шока
Данное осложнение заражения крови является достаточно изученным, патогенез септического шока представляет собой широкий спектр патологических реакций организма человека, каждая из которых напрямую зависит от индивидуальных особенностей организма пациента. В качестве факторов, оказывающих стимулирующее влияние на развитие септического шока, следует отметить: особенности патогенности возбудителя, локализация первичного воспалительного очага, продолжительность сепсиса, особенности клинического течения фоновой инфекции, концентрация возбудителя, возраст и функция иммунного аппарата пациента, наличие дополнительного травматического воздействия.
Первоначальным звеном патогенеза септического шока является непосредственное поступление токсинов, выделяемых микроорганизмами в общий кровоток, сопровождающееся разрушением клеточных мембран эндотелиальных клеток, а также тромбоцитарных и лейкоцитарных кровяных клеток. В результате данных изменений происходит активное освобождение лизосом, содержащих протеолитические ферменты, активирующие вазоактивные вещества типа кинина, гистамина, серотонина, катехоламина, ренина.
Таким образом, первичные патологические изменения претерпевает периферическое кровообращение, проявляющиеся вазоплегией в капиллярной сети, приводящей к развитию резкого снижения периферического сопротивления. В начальной стадии срабатывают компенсаторные механизмы в виде повышения минутного объема сердца, а также развития регионарного артериовенозного шунтирования. И вместе с тем, уже на этой стадии септического шока отмечается снижение капиллярной перфузии, нарушение усвоения кислорода головным мозгом и другими жизненно-важными структурами человеческого организма.
Для септического шока характерно раннее развитие и молниеносное нарастание интенсивности ДВС-синдрома в результате гиперактивациитромбоцитарного, а также прокоагулянтного звеньев гемостаза. Данные изменения оказывают крайне негативное влияние на протекании обменных процессов, происходящих во всех тканях человеческого организма, что сопровождается избыточным накоплением недоокисленных продуктов.
При продолжающемся повреждающем действии токсических веществ, выделяемых в большой концентрации микроорганизмами, происходит углубление расстройств циркуляции. В результате повышения проницаемости сосудистых стенок капиллярной сети происходит просачивание плазмы крови и отдельных форменных элементов крови в интерстиций, что обусловливает развитие . На этой стадии патогенеза септического шока компенсаторные механизмы в виде перестают быть эффективными и происходит нарастание нарушений периферической гемодинамики.
Развитие при септическом шоке происходит в результате ухудшения коронарного кровообращения, отрицательного воздействия токсинов бактерий, снижения реакции сердечной мышцы на адренергическую стимуляцию. Первым патогенетическим признаком наступления расстройства сердечной деятельности при септическом шоке является резкая и стойкая , что соответствует гиподинамической фазе септического шока.
Тяжелая клиника септического шока во многом обусловлена развитием изменений со стороны структуры и функции дыхательной системы, сопровождающейся развитием, так называемой, патогенетической стадии «шокового легкого». Вышеперечисленные изменения провоцируют развитие механизмов острой дыхательной недостаточности, сопровождающейся глубоким нарушением транспортировки кислорода по организму пациента.
Симптомы и признаки септического шока
Для септического шока характерно развитие патогномоничной клинической симптоматики, зачастую позволяющей уже на ранней стадии развития данного осложнения верифицировать диагноз. Интенсивность того или иного клинического проявления септического шока имеет корреляционную зависимость от патогенетической стадии шока, продолжительности течения патоморфологических изменений, степени влияния патогенности возбудителя и наличия какой-либо тяжелой фоновой соматической патологии, ухудшающей течение септического шока. Крайне тяжелой клинической симптоматикой отличается септический шок в акушерстве. В целом, септический шок в гинекологии и хирургии является самой распространенной причиной развития летального исхода.
Дебют клинической картины септического шока всегда острый, так как развитие его чаще всего связано с наличием обширной инфицированной раневой поверхности. Перед появлением патогномоничных для септического шока клинических симптомов всегда имеет место кратковременная пиретическая реакция организма гектического типа продолжительностью не более трех суток. Также в дебюте клинической картины септического шока может наблюдаться развитие волнообразной лихорадки, характеризующейся быстрым наступлением и купированием гипертермии, сопровождающейся выраженным ознобом и профузным потоотделением.
Вместе с тем, самым характерным клиническим маркером септического шока, появляющимся и при других этиопатогенетических вариантах шока, является резкая без явных признаков кровотечения. На ранних стадиях развития септического шока «срабатывают» компенсаторные механизмы, в связи с чем, в течение часа у пациента отмечается гипердинамическая фаза шока, характеризующаяся умеренным снижением систолического артериального давления.Это так называемая стадия «мнимого благополучия», при которой верификация диагноза несколько затруднительна. При наступлении гиподинамической фазы септического шока отмечается резкая стойкая артериальная гипотония. Особенностью клинического течения септического шока является развитие у пациента артериальной гипотонии, сочетающейся с выраженной тахикардией и шоковым индексом более 1,5, что является косвенным признаком быстрого снижения ОЦК.
Помимо вышеперечисленных клинических проявлений, для септического шока характерно раннее развитие дыхательных расстройств, проявляющихся выраженной одышкой, свидетельствующей в пользу развития нарастающего тканевого . Недостаточное поступление кислорода в структуры центральной нервной системы крайне негативно отображается на состоянии пациента, что проявляется появлением немотивированного возбуждения и дезориентации в личности, времени и месте, быстро сменяющейся вялостью. У части пациентов данные неврологические нарушения могут предшествовать резкой артериальной гипотонии.
К отдаленным клиническим маркерам септического шока следует отнести иктеричность и сухость кожных покровов, нарастающий и петехиальную , что является проявлением полиорганной недостаточности. У части пациентов отмечается развитие неспецифического абдоминального болевого синдрома, а также выраженной головной боли, что обусловлено нарушением кровоснабжения тканей. При наступлении , который развивается в 98% септического шока, отмечается появление рвоты «кофейной гущей» и распространенные кровоизлияния в слизистые оболочки и кожные покровы.
Неотложная помощь при септическом шоке
Начало реанимационных мероприятий при септическом шоке заключается в проведении ИВЛ, в случае, когда имеет место развитие респираторного дистресс-синдрома. При определении дыхательного объема для проведения ИВЛ используется расчетный метод 6 мл на кг веса пациента, для того, чтобы показатель давления в дыхательных путях на выдохе не превышал 30 см вод.ст. При проведении ИВЛ при септическом шоке допускается гиперкапния, однако, следует снизить показатель давления на вдохе, а также поддерживать SaO2 на уровне 88–95%. Кроме того, положительным влиянием на проведении оксигенации обладает положение пациента на животе, а также приподнятие на 45° головного конца койки.
Когда у пациента имеет место умеренно выраженная гипоксемия, реагирующая на низкие уровни ПДКВ, а также стабильная гемодинамика, допускается самостоятельное очищение дыхательных путей от секрета через маску, однако, следует учитывать, что в любой момент пациенту может понадобиться экстренное интубирование трахеи.
В случае, когда у пациента на фоне проведения ИВЛ отмечается стабилизация гемодинамических показателей, безопасный показатель FiO2, прекращение седации и появление спонтанного кашля, а также paO2/FiO2 превышает 200 мм рт.ст. допустимо произведение отлучения от респиратора. В ситуации, когда отлучение от респиратора сопровождается нарастанием частоты дыхательных движений и сердечных сокращений, а также критической артериальной гипотонией, необходимо незамедлительно возобновить ИВЛ.
При тяжелом состоянии пациента, нуждающегося в экстренной ИВЛ, обязательно необходимо проводить неотложную седацию, для чего используется боллюсное или непрерывное парентеральное введение лекарственных средств группы миорелаксантов, позволяющее не только снизить длительность ИВЛ, но и уменьшить вероятность проведения трахеостомии.
В стандартный комплекс неотложных мероприятий при септическом шоке обязательно необходимо включать инфузию инсулина, при имеющейся , до достижения уровня глюкозы в крови не более 8,3 ммоль/л. Одномоментно при введении инсулина необходимо проведение инфузии глюкозы с обязательным контролем показателей глюкозы в крови с периодичностью в 1 час.
При рассмотрении вопроса о применении гидрокарбоната натрия в качестве неотложной помощи септического шока, следует оценивать РН крови. Так, при показателе pH — 7,15 не следует вводить гидрокарбонат натрия, так как в этой ситуации не наблюдается коррекция гемодинамических нарушений и не снижается потребность в использовании вазопрессоров.
В качестве неотложных профилактических мероприятий при септическом шоке, предотвращающих характерное для него развитие следует в раннем периоде назначать пациенту введение низких доз нефракционированного Гепарина. К абсолютным противопоказаниям для применения препаратов этой фармакологической группы следует отнести имеющуюся у пациента тромбоцитопению, тяжелую коагулопатию, продолжающееся кровотечение, внутримозговое кровоизлияние. В этой ситуации следует прибегать к механическим методам неотложной профилактики в виде механической компрессии.
При проведении неотложных медикаментозных мероприятий в отношении пациента, страдающего септическим шоком, задачей лечащего врача является разъяснение членам его семьи о применяемых видах реанимационного лечения, а также возможных исходах данного заболевания.
Диагностика септического шока
В некоторых ситуациях при известных анамнестических данных и имеющихся патогномоничных клинических проявлений у пациента становится возможным установление первичного клинического диагноза уже на долабораторном этапе. И вместе с тем, оценку тяжести течения септического шока диагностически можно определить только после всестороннего обследования человека, включающего не только лабораторные, но и высокоточные инструментальные методики.
Так, в дебюте патогенетических изменений при сепсисе в пользу развития септического шока свидетельствует появление выраженной тромбоцитопении менее 100 109/л, повышенного показателя С-реактивного белка, увеличенного уровня прокальцитонина более 6,0 нг/мл, положительного теста на эндотоксин, а также позитивного результата посева крови идентификацией патогенного возбудителя сепсиса.
Неоспоримыми клиническими диагностическими маркерами развившегося септического шока является появление у пациента резкой и стойкой артериальной гипотензии на фоне тахикардии более 100 уд/мин и тахипноэ более 25 дыхательных движений в минуту. К дополнительным косвенным клиническим критериям септического шока также относятся развитие олигурии, как свидетельства почечной недостаточности, кратковременного или глубокого нарушения сознания, обусловленного выраженной гипоксемией и гиперкапнией, геморрагической распространенной сыпи и повышенного уровня лактата в крови более 1,6 ммоль/л.
С целью динамической оценки тяжести состояния пациента, страдающего септическим шоком, в условиях реанимационного отделения производится круглосуточный мониторинг гемодинамических параметров, частоты дыхательных движений, газового состава крови, почасового и суточного диуреза, пирометрия, показателя кислотно-щелочного баланса крови, количества тромбоцитарных кровяных клеток и показателей свертывания.
К дополнительным диагностическим мероприятиям при септическом шоке относится постоянное электрокардиографическое исследование, ультразвуковое сканирование и стандартная рентгенография органов грудной полости для исключения изменений инфильтративного характера в легочной паренхиме. Большинство лабораторных показателей определяется с целью исключения или подтверждения развития полиорганной недостаточности, которая часто имеет место при септическом шоке. К косвенным лабораторным маркерам септического шока, помимо вышеперечисленных, также относится обнаружение , нейтрофильного лейкоцитоза со сдвигом влево или выраженной лейкопении, морфологических изменений нейтрофилльных лейкоцитов в виде токсичной зернистости, появления телец Доле и вакуолизации.
Так как развитие септического шока чаще всего наблюдается при разнообразных инфекционных патологиях, высокой диагностической ценностью обладает методика определения лейкоцитарного индекса интоксикации, определяемого расчетным способом. Нормальным пороговым значением является 1, а при обнаружении показателя в 4-9 следует подразумевать наличие у пациента выраженной эндогенной интоксикации, значительно усугубляющей течение септического шока. И вместе с тем, крайне неблагоприятным прогностическим диагностическим признаком является обнаружение лейкопении на фоне высокого лейкоцитарного индекса интоксикации, так как в этой ситуации существует значительный риск развития летального исхода септического шока.
Лечение септического шока
Так как такая патология как септический шок представляет собой тяжелое патологическое состояние с высоким уровнем летальности и труднодоступностью лечебных мероприятий, все усилия специалистов международного уровня направлены на разработку алгоритмов и эффективных схем медикаментозной терапии такого рода пациентов. Последние рандомизированные исследования в этом вопросе были произведены в 2008 году, после чего были разработаны современные лечебные способы коррекции септического шока.
Первичные или так называемые неотложные медицинские мероприятия должны оказываться пациенту при подозрении на развитие септического шока уже на догоспитальном этапе. Среди показателей эффективности проводимых неотложных мероприятий при септическом шоке рассматривается достижение ЦВД порога 110–160 мм вод.ст., систолического компонента артериального давления — 65 мм рт.ст., диуреза — 0,5 мл/кг/час и степени сатурации кислорода 65% в смешанной венозной крови. В ситуации, когда проводимые неотложные мероприятия в течение первых 6 часов септического шока не приводят к достижению целевого порога ЦВД ScvO2, то следует отдавать предпочтение введениюэритроцитарной массы и Добутаминав дозе 20 мкг/кг/мин.
В случае бактериального происхождения септического шока, основополагающим этиопатогенетически обоснованным звеном лечения пациента является применение антибактериальных препаратов. Предпочтительно до введения первой дозы эмпирического антибактериального препарата осуществить двухразовый бактериальный посев крови пациента, страдающего септического шока, а также допускается дополнительный посев других биологических выделений пациента. В случае выделения одного и того же возбудителя из различных биологических сред пациента производиться идентификация микроорганизма и определение чувствительности различных антибиотиков к данному типу возбудителя. Задержка в применении антибактериальной терапии ухудшает прогноз в отношении выздоровления пациента, страдающего септическим шоком.
Предпочтительным способом введения препаратов антибактериального действия при септическом шоке является парентеральный через венозный доступ, отдельный от доступа, применяемого для введения инфузионных растворов. Первоначальным этапом антибактериальной терапии является применение эмпирических антибиотиков широкого спектра действия до достоверной идентификации возбудителя. На процесс подбора эмпирического антибактериального препарата влияют такие факторы как индивидуальная непереносимость отдельных компонентов препарата, специфика клинических проявлений, уровень дегидратации, скорость инфузии, функциональное состояние печени и почек, уровень токсичности препарата. Проводить антибактериальную терапию пациенту при септическом шоке необходимо только под постоянным лабораторным контролем концентрации действующего вещества в крови.
В случае, когда в роли возбудителя септического шока выступает Pseudomonas начало антибактериальной терапии подразумевает использовании комбинации антибактериальных препаратов продолжительностью до семи суток. Увеличение продолжительности антибактериальной терапии при септическом шоке, как правило, имеет место при недренированных очагов на фоне выраженной иммунодепрессии.
Основополагающими клиническими критериями положительного фармакологического влияния антибактериального препарата при септическом шоке являются улучшение общего самочувствия пациента, исчезновение неврологической и интоксикационной симптоматики, устранение гемодинамических нарушений.
Препараты при септическом шоке
Проведение каких-либо медикаментозных интенсивных методов коррекции септического шока должно производиться только под совместным контролем врачей различного профиля. Все вводимые в организм пациента лекарственные препараты при септическом шоке могут оказывать как положительное фармакологическое влияние, так и провоцировать развитие негативных патологических реакций, поэтому осуществление медикаментозной терапии данного патологического состояния осуществляется под динамическим контролем различного рода клинических и лабораторных показателей в виде термометрии, оценки состояния кожных покровов, частоты дыхательных движений и пульса, показателей ЦВД и гематокрита, почасового и суточного диуреза, протеинограммы и коагулограммы.
Все применяемые лекарственные препараты при септическом шоке должны быть патогенетически обоснованными, а именно оказывать профилактическое действие в отношении предупреждения развития осложнений в виде острой почечной или дыхательной недостаточности, а также массивных кровотечений. Положительное фармакологическое влияние препаратов при септическом шоке также заключается в улучшении тканевой перфузии и купировании метаболических нарушений.
Ввиду того, что при септическом шоке есть необходимость постоянного введения в организм человека различных групп фармацевтических препаратов, предпочтительным является осуществление центрального венозного доступа с установлением постоянного катетера в подключичную вену.
Первоначальными препаратами в лечении септического шока являются различного рода инфузионные растворы в виде Реополиглюкина в объеме 800 мл или Гемодеза в объеме 400 мл. Действие этой группы лекарственных средств направлено на восстановление и улучшение реологических свойств крови, устранение агрегации тромбоцитарных кровяных клеток и улучшение микроциркуляции.
С целью осуществления обратной транспортировки жидкой части крови из интерстициального пространства в просвет сосуда при септическом шоке необходимо использовать белковые препараты в виде 5-10% раствора Альбумина в объеме 400 мл, предотвращающих критическое снижение уровня белка в крови, что часто имеет место при септическом шоке. Кроме того, в практической деятельности реаниматологи в общую схему медикаментозного лечения вводят переливание сухой плазмы, способствующей быстрому восстановлению объема циркулирующей крови.
Помимо вышеперечисленных лекарственных средств, в состав, так называемой, инфузионной терапии при септическом шоке часто включается введение до 500 мл 10% раствора Глюкозы на фоне введения Инсулина. Концентрированные растворы глюкозы способны быстро восполнять энергетические ресурсы организма.
Учитывая тот факт, что при септическом шоке наблюдается раннее развитие гемодинамических нарушений, в раннем сроке развития данного патологического состояния специалистами рекомендуется назначение вазоактивных лекарственных средств в виде 0,05% раствора Строфантина в дозе 1 мл, 0,06% раствора Коргликона в объеме 0,5 мл. При выраженном снижении систолического компонента артериального давления специалистами используется введение малых доз Дофамина из расчета 1-5 мкг/кг/мин.
Септический шок – какой врач поможет ? При наличии или подозрении на развитие септического шока следует незамедлительно обратиться за консультацией к таким врачам как реаниматолог, инфекционист, гематолог.
Интенсивная терапия септического шока осуществляется совместно реаниматологом и акушером-гинекологом, при необходимости с привлечением нефролога, уролога и гематолога-коагулолога.
Проведение лечебных мероприятий требует постоянного (лучше мониторного) наблюдения. Необходимо осуществлять обязательный контроль за температурой тела, состоянием кожных покровов, частотой дыхания и пульса, показателями и ЦВД и гематокрита, ЭКГ, почасовым диурезом, кислотно-основным и электролитным составом плазмы, протеинограммой, содержанием азотистых шлаков и билирубина крови, коагулограммой. Желательно определять ОЦК и величину сердечного выброса: Лечение проводится комплексно. Оно направлено на борьбу с шоком и инфекцией, на профилактику и терапию осложнений септического шока: острой почечной и дыхательной недостаточности и кровотечений вследствие нарушений свертывающей системы крови.
Мероприятия по борьбе с шоком должны быть сосредоточены на восстановлении тканевого кровотока, коррекции метаболических нарушений и поддержании адекватного газообмена.
Две первые задачи решаются путем проведения инфузионной терапии, которую необходимо начать как можно быстрее и осуществлять длительное время. Для этих целей в крупную вену (чаще подключичную) вводится постоянный катетер.
Так как при септическом шоке довольно рано наступает гиповолемии, являющаяся следствием несоответствия между емкостью сосудистого русла и объемом ОЦК. то борьба с шоком в первую очередь заключается в восполнении ОЦК.
В качестве инфузионных сред на первых этапах лечении предпочтительнее использовать производные декстрана (по 400-800 мл реополиглюкина и/или полиглюкина) и поливинилпирролидона (гемодез в количестве 400 мл). Эти препараты восстанавливают и улучшают реологические свойства крови и тем самым способствуют уменьшению вязкости, устранению стаза и агрегации форменных элементов, улучшению микроциркуляции. Кроме того, указанные кровезаменители значительно повышают ОЦК за счет привлечения межтканевой жидкости. Немаловажным достоинством данных инфузионных сред является их способность адсорбировать токсины и выводить их из организма.
Находят свое место в инфузионной терапии септического шока растворы желатина, особенно декальцинированный желатиноль, который можно вводить до 1000 мл. Этот препарат хорошо переносится больными, может смешиваться с донорской кровью в любых пропорциях, не вызывая агрегации эритроцитов, быстро выводится почками, способствуя детоксикации.
Проводя инфузионную терапию у шоковых больных, необходимо придерживаться средних доз плазмозаменителеи, ибо в случае передозировки могут проявиться нежелательные побочные свойства этих сред. Крупномолекулярные декстраны способны блокировать ретикулоэндотелиальную систему, низкомолекулярные - вызывать осмотический нефроз. Желатиноль может способствовать выбросу гистамина и оказывать агрегационное действие на форменные элементы крови..
Для повышения коллоидно-осмотического давления с целью транспорта жидкости из интерстициального пространства в кровеносное русло применяются белковые препараты: 400 мл 5-10% раствора альбумина, 500 мл протеина. Эти препараты ликвидируют гипопротеинемию, всегда имеющуюся при септическом шоке, а также оказывают выраженное детоксикационное действие. Полезно переливание сухой и нативной плазмы, которая хорошо держит осмотическое давление и тем самым способствует восстановлению ОЦК.
Гемотрансфузии не являются основным средством для ликвидации гиповолемии при септическом шоке. Переливание крови, а лучше эритроцитной массы, необходимо, если гематокритный показатель ниже 30. Обычно вводится небольшое количество крови или эритроцитной массы не позднее 3-го дня хранения (300-500 мл). Гемотрансфузии осуществляются параллельно с вливанием реологически активных плазмозаменителей или кристаллоидных растворов в режиме гемодилюции. Наилучший эффект достигается при использования «теплой» гепаринизированной крови. Если септический шок сочетается с кровотечением, то гемотрансфузии должны соответствовать степени кровопотери.
В состав инфузионной терапии включается 10% или 20% раствор глюкозы в количестве 300-500 мл с адекватными дозами инсулина. Преимущество концентрированных растворов глюкозы состоит в том, что они, восполняя энергетические затраты организма, одновременно обладают осмодиуретическим свойством, что немаловажно при лечении больных с септическим шоком.
Скорость и количество вливаемой жидкости зависят от реакции больной на проводимую терапию. Пульс, артериальное давление, ЦВД, минутный диурез следует оценивать после инфузии каждых 500 мл жидкости. Общее количество жидкости в первые сутки, как правило, составляет 3000-4500 мл, но может достигать 6000 мл. Объем инфузионных сред следует сопоставлять с диурезом, потерей жидкости через кожу и легкие (700 мл - 400 мл на каждый градус повышения температуры тела), рвотными массами и т. д.
Основными клиническими критериями, свидетельствующими о ликвидации гиповолемии и восстановлении ОЦК, являются нормализация окраски кожных покровов, оптимальные цифры ЦВД (5,0-100 мм вод. ст.), достаточный диурез (более 30 мл/ч без применения диуретиков, 60-100 мл/ч - при форсировании диуреза). При соответствующих возможностях желательно определение ОЦК и величины сердечного выброса. Артериальное давление при септическом шоке может длительное время оставаться на относительно низких цифрах - 90 мм рт. ст.. Нет необходимости всеми средствами форсировать его подъем, если налицо признаки улучшения микроциркуляции (цвет кожных покровов, достаточный почасовой диурез).
На фоне восполнения ОЦК и улучшения реологических свойств крови для коррекции гемодинамики и восстановления тканевого кровотока необходимо обязательное применение сердечных и вазоактивных средств. Сердечные гликозиды вводятся внутривенно вместе с 20 мл 40% раствора глюкозы в обычных дозировках: 0,5-1 мл 0,05% раствора строфантина, или 0,5-1 мл 0,06% раствора коргликона, или 1-2 мл 0,02% раствора целанида (изоланида), 1-2 мл 0,025% раствора дигоксина. Целесообразно после ликвидации гиповолемии использовать 0,5% раствор курантила, который из-за возможного понижения системного артериального давления следует вводить медленно в количестве 2-4 мл. Курантил расширяет коронарные сосуды, повышает толерантность миокарда к гипоксии и, кроме того, тормозит агрегацию тромбоцитов.
С успехом используют малые дозы дофамина (допамина). Это средство повышает артериальное давление, усиливает сердечные сокращения и увеличивает сердечный выброс. Кроме того, малые дозы дофамина (1-5 мкг/ (кг мин) уменьшают сопротивление почечных сосудов, увеличивают почечный кровоток и клубочковую фильтрацию, что повышает эффективность действия препарата при септическом шоке. 5 мл 0,5% раствора дофамина разводят в 125 мл изотонического раствора натрия хлорида или 5% раствора глюкозы и вводят внутривенно очень медленно по 2-10 капель в минуту.
После восполнения объема ОЦК при сохраняющемся вазомоторном коллапсе можно воспользоваться (осторожно!) медленным капельным введением ангиотензинамида. Обычно инфузию препарата начинают из расчета 3-5 мкг/мин, при необходимости увеличивая дозу до 10-20 мкг/мин. При достижении необходимого эффекта (повышении артериального давления до 90-100 мм рт. ст.) вводимую дозу можно уменьшить. Для приготовления концентрации 1 мкг/мл 1 флакон (1 мг) препарата растворяют в 1000 мл изотонического раствора натрия хлорида или 5% раствора глюкозы, а для концентрации 2 мкг/мл - в 500 мл растворителя.
В терапии септического шока с целью расширения периферических сосудов находят широкое применение вазодилататоры типа эуфиллина, папаверина, но-шпы или компламина. Эти препараты назначаются после восполнения ОЦК при обязательном контроле за цифрами артериального давления. Дозирование препаратов обычное: 5-10 мл 2,4% раствора эуфиллина, 2 мл 2% раствора папаверина. 2-4 мл 2% раствора но-шпы. Весьма активно расширяет артериолы и венулы компламин. При этом одновременно с уменьшением периферического сопротивления увеличивается минутный объем сердца. 15% раствор препарата в количестве 2 мл вводится внутривенно очень медленно.
Бета-адреноблокаторы типа анаприлина или оксипренолона улучшают кровообращение в легких, в органах брюшной полости, оптимизируют коронарный кровоток, способствуют закрытию артериовенозных шунтов. Эти свойства препаратов пытались использовать при лечении больных с септическим шоком. Однако отрицательное ино- и хронотропное влияние на сердце ограничивает сферу их применения.
Продолжает дискутироваться вопрос об использовании кортикостероидов для лечения септического шока. Данные литературы и наш собственный клинический опыт свидетельствуют в пользу этих препаратов. Кортикостероиды не только способствуют улучшению гемодинамики, но и оказывают положительное действие на многие патогенетические звенья септического шока. Глюкокортикоиды, увеличивая сердечный выброс, оптимизируют деятельность сердца; обладая умеренным сосудорасширяющим свойством, улучшают микроциркуляцию; снижая поступление тканевого тромбопластина и предупреждая нарастание агрегации тромбоцитов, уменьшают выраженность синдрома ДВС. Кроме того, эти препараты ослабляют действие эндотоксина, стимулируют деятельность ферментов, участвующих в окислительных процессах, повышают толерантность клеток к недостатку кислорода, способствуют стабилизации мембран, предупреждают развитие шокового легкого, обладают антигистаминным свойством.
Противошоковое действие кортикостероидов проявляется при введении средних и высоких доз препаратов. Одномоментно вводится 250-500 мг гидрокортизона; или 60-120 мг преднизолона, или 8-16 мг дексаметазона. Через 2-4 ч введение препарата повторяется.
Критерием эффективности включения кортикостероидов в комплекс лечебных мероприятий служат общее состояние больной, окраска и температура кожных покровов, артериальное давление и почасовой диурез.
В сутки вводится 1000-3000 мг гидрокортизона или эквивалентные количества преднизолона и дексаметазона. Такие дозировки применяются в течение 1-2 дней, поэтому не следует опасаться отрицательного влияния экзогенных кортикостероидов на функциональную активность надпочечников и иммунные свойства организма. Отсутствие эффекта на значительные дозы глюкокортикоидов (1000 мг гидрокортизона или соответствующих количеств преднизолона или дексаметазона) свидетельствует о далеко зашедших необратимых изменениях в жизненно важных органах и является плохим прогностическим признаком. В таких случаях нет необходимости продолжать стероидную терапию.
Принимая во внимание изменения в системе гистамин-гистаминаза при септическом шоке, необходимо вводить антигистаминные препараты: 1-2 мл 1% раствора димедрола, 1-2 мл 2,5% раствора пипольфена, 1-2 мл 2% раствора супрастина или 2 мл тавегила.
Наряду с нормализацией гемодинамики, инфузионная терапия при септическом шоке должна иметь своей целью коррекцию кислотно-основного и электролитного гомеостаза.
При септическом шоке довольно быстро развивается метаболический ацидоз, который на первых порах может компенсироваться дыхательным алкалозом. Для коррекции ацидоза Необходимо в состав инфузионной терапии включать 500 мл лактасола, 500 мл рингер-лактата или 150-200 мл 4-5% раствора натрия бикарбоната. Точное количество раствора определяется в зависимости от дефицита оснований (-BE).
Для улучшения окислительно-восстановительных процессов показано применение раствора глюкозы с адекватным количеством инсулина и витаминов: 1-2 мл 6 % раствора витамина B2, 1-2 мл 5 % раствора витамина В6, 400-500 мкг витамина B12, 100-200 мг кокарбоксилазы, 5-10 мл 5% раствора аскорбиновой кислоты. Следует помнить, что витамины группы В нельзя смешивать в одном шприце. Для улучшения функции печени, кроме витаминов и коферментов, желательно использовать холина хлорид в количестве 200 мл в виде 1% раствора, 10-20 мл эссенциале, 2 мл сирепара или других гепатотропных средств.
Септический шок быстро приводит к электролитному дисбалансу. Уже на ранних этапах его развития имеется снижение содержания ионов К, Na, Ca, Mg в плазме. В первые сутки лечения необходимо корригировать недостаток этих ионов путем капельной внутривенной инфузии. С этой целью можно использовать панангин в количестве 10-20 мл или 4% раствор калия хлорида в количестве 10-20 мл, или 4% раствор калия хлорида в количестве 50 мл с 400-500 мл изотонического раствора глюкозы, не следует забывать о введении 10 мл 10% раствора кальция хлорида или 100 мл 1% раствора того же препарата. Сообщают об успешном применении энергетического полиионного раствора следующего состава: на 1 л 25% раствора глюкозы добавляют 3 г калия хлорида, 0,8 г кальция хлорида и 0,4 г магния хлорида. Обязательно введение адекватных доз инсулина. Необходимость в дальнейшем введении электролитных растворов должна подтверждаться лабораторными данными, особую осторожность следует проявлять при наличии признаков острой почечной недостаточности.
Параллельно с восстановлением гемодинамических расстройств и коррекцией метаболических нарушений большое значение имеет обеспечение адекватной оксигенации. Введение кислорода необходимо начинать с первых минут лечения, использовать для этого все имеющиеся способы вплоть до искусственной вентиляции легких (ИВЛ). Абсолютным показанием к ИВЛ является падение Р 02 ниже 8-9,3 кПа (60- 70 мм рт. ст.) при ингаляции 100% кислорода через маску.
Наряду с противошоковыми мероприятиями неотъемлемую часть интенсивной терапии септического шока составляет борьба с инфекцией.
Если известен возбудитель сепсиса, то проводят направленную, например антипсевдомонадную (антисинегнойную), терапию. Однако в подавляющем большинстве случаев из-за отсутствия адекватного бактериологического исследования проводят эмпирическое лечение сепсиса, которое вследствие назначения препаратов с максимально широким спектром действия часто оказывается успешным. Так, начальная эмпирическая антимикробная терапия у больных сепсисом была эффективной в 91% случаев и продлена после того, как результаты бактериологического исследования крови стали известны.
Лечение проводят максимальными разовыми и суточными дозами, продолжительность его - 6-8 дней. Лечение продолжают до нормализации температуры тела в течение как минимум 3-4 дней. В отдельных случаях требуется замена антибиотика и продолжение курса терапии.
Еще раз хочется подчеркнуть, что консервативное лечение эффективно только в случае хирургической санации гнойного очага, а сохранение и тем более нарастание клинических признаков интоксикации и других проявлений инфекционного процесса на фоне адекватной антибактериальной терапии могут свидетельствовать о нерадикальности операции или появлении крупных пиемических очагов, что требует их выявления и санации.
В своей клинической практике для лечения сепсиса успешно применяют следующие препараты или их комбинации:
- монотерапия бета-лактамными антибиотиками с ингибиторами бета-лактамаз - ТИК/КК - тикарциллин/клавулоновая кислота (тиментин) в разовой дозе 3,1, суточной дозе 18,6 г;
- цефалоспорины III генерации в комбинации с нитроимидазолами, например, цефотаксим (клафоран) + клион (метронидазол) или цефтазидим (фортум) + клион (метронидазол); цефотаксим (клафоран) в разовой дозе 2 г, суточной дозе 6 г, курсовой дозе 48 г;
- аминогликозиды, цефалоспорины (III поколение), ампициллин + сульбактам, амоксициллин + клавулановая кислота, пиперациллин + тазобактам, тикарциллин + клавулоновая кислота.
- цефтазидим (фортум) в разовой дозе 2 г, суточной дозе 6 г, курсовой дозе 48 г;
- клион (метронидазол) в разовой дозе 0,5 г, суточной дозе 1,5 г, курсовой дозе 4,5 г;
- комбинации линкозаминов и аминогликозидов, например, линкомицин + гентамицин (нетромицин) или клиндамицин + гентамицин (нетромицин);
- линкомицин в разовой дозе 0,9 г, суточной дозе 2,7 г; клиндамицин в разовой дозе 0,9 г, суточной дозе 2,7 г; гентамицин в суточной дозе 0, 24 г; нетромицин в суточной дозе 0,4 г, курсовой дозе 2,0 г внутривенно;
- монотерапия меропенемами, например: меронем в разовой дозе 1 г, суточной дозе 3 г; гиенам в разовой дозе 1 г, суточной дозе 3 г.
Наряду с антибиотиками в особо тяжелых случаях рекомендуется применение антисептиков: диоксидина до 1,2 г/сут. -120 мл 1 % раствора внутривенно или фурагина до 0,3-0,5 г/сут.
Инфузионная терапия при сепсисе направлена на поддержание объема циркулирующей крови, адекватной тканевой перфузии, коррекцию нарушений гомеостаза и удовлетворение потребностей в энергии.
В связи с преобладанием катаболических процессов у больных с сепсисом, энергетические потребности организма при парентеральном питании составляют 200-300 г глюкозы/сут. с инсулином и не менее 1,5 г/кг белка.
Они восполняются за счет инфузий кристаллоидов (растворы глюкозы с инсулином, глюкастерил, йоностерил), коллоидов (в основном растворов оксиэтилкрахмалаплазмастерила, 6 и 10% HAES-стерила), растворов свежезамороженной плазмы и альбумина. Объем инфузий индивидуален и определяется характером ЦВД и величиной диуреза. В среднем вводится 2-2,5 л инфузионных сред.
Антибактериальная терапия при септическом шоке является экстренной, времени на идентификацию флоры и определение ее чувствительности к антибиотикам нет, поэтому лечение начинается с введения антибиотиков широкого спектра действия. Дозировки обычно значительно превышают средине. Бензилпенициллина натриевая соль вводится до 40 000 000-60 000 000 ЕД в сутки внутривенно в 2-3 приема Бензилпенициллина калиевая соль внутривенно вводится только при лабораторно подтвержденной гипокалиемии. Необходимо учитывать, что 1 000 000 ЕД калиевой соли бензилпенициллина содержит 65,7 мг калия, т. е. 25 000 000 ЕД антибиотика могут обеспечить минимальную суточную потребность организма в калии.
Широкое применение находят полусинтетические пенициллины. Метициллина натриевая соль вводится по 1-2 г каждые 4 ч внутримышечно или внутривенно. Для внутривенного капельного вливания каждый грамм препарата разводится в 100 мл изотонического раствора натрия хлорида. Максимальная суточная доза - 12 г. Оксациллина и диклоксациллииа натриевая соль применяются по 1 г каждые 4 ч внутримышечно или внутривенно (для капельного внутривенного введения препарат разводят в 100 мл изотонического раствора натрия хлорида), максимальная суточная доза - 6 г. Ампициллина натриевая соль (пентрексил) употребляется по 1,5-2 г каждые 4 ч внутримышечно или внутривенно с 20 мл изотонического раствора натрия хлорида; максимальная суточная доза - 12 г. Карбенициллина динатриевая соль (пиопен) вводится по 2 г через 4 ч внутримышечно или внутривенно на 40 мл изотонического раствора натрия хлорида; суточная доза - 12 г.
При выборе препарата следует помнить, что наиболее широким спектром действия обладают ампициллин и карбенициллин. Метициллин, диклоксациллин и оксациллин характеризуются устойчивостью к пенициллиназе, поэтому оказывают выраженное действие на микроорганизмы, продуцирующие пенициллиназу. Карбенициллин оказывает бактерицидное действие на синегнойную палочку, устойчивую к другим антибиотикам пенициллинового ряда.
С успехом используются препараты группы цефалоспоринов. Цефалоридин (цепорин), цефазолин (кефзол), цефалексин назначаются по 1 г каждые 4 ч или по 2 г каждые 6 ч внутримышечно или внутривенно; максимальная доза - 8 г.
Широким спектром антимикробного действия обладают антибиотики группы аминогликозидов. Максимальная суточная доза: канамицина сульфата - 2 г (вводится по 0,5 г каждые 6 ч); гентамицина сульфата - 240 мг (препарат вводится по 80 мг каждые 8 ч); в таких же дозировках применяется тобрамицина сульфат; амикацина (полусинтетического канамицина сульфата) - 2 г (вводится по 0.5 г каждые 6 ч). Аминогликозиды обычно вводятся внутримышечно, но в случаях тяжелого сепсиса в течение 2-3 дней возможно внутривенное капельное введение. Разовая доза препарата разводится в 200 мл изотонического раствора натрия хлорида или 5% раствора глюкозы; скорость введения-60-80 капель в минуту.
Не потерял своего значения в антибактериальной терапии септического шока левомицетина сукцинат натрия (хлорамфеникол), который может употребляться внутривенно или внутримышечно по 1 г через 6-8 ч; максимальная суточная доза - 4 г. Кроме указанных апробированных препаратов возможно использование новейших поколений антибиотиков широкого спектра действия.
Дозировки препаратов во многом определяются выделительной функцией почек. При нормальном, а тем более высоком диурезе употребляются максимальные количества антибиотиков.
Для усиления антимикробного эффекта и расширения спектра действия антибиотики можно комбинировать между собой. При выборе комбинации препаратов необходимо учитывать характер их взаимодействия (индифферентный, аддитивный, сикергидный или антагонистический), вероятную суммацию их побочных действий и возможностей внутривенного введения хотя бы одного из них. Наиболее употребительными сочетаниями антибиотиков являются: ампициллин с оксациллином, природные и полусинтетические пенициллины с аминогликозидами, цефалоспорины с аминогликозидами, левомицетин с гентамицином или линкомицином.
Учитывая широкую распространенность анаэробной инфекции, в комплекс антибактериальных средств следует включать препараты метронидаэола (по 100 мл 0,5% раствора 2-3 раза в сутки).
Как известно, борьба с инфекцией включает в себя ликвидацию очага инфекции. В хирургической практике вопрос о раннем и полном удалении септического очага не вызывает сомнения. Не так просто решить вопрос о ликвидации источника инфекции в гинекологической практике, если этим источником является матка. Поэтому многие весьма авторитетные авторы при шоке, причиной которого является септический аборт, рекомендуют одновременно с проведением массивной противошоковой и антибактериальной терапии производить осторожное инструментальное опорожнение матки. Другие авторы считают, что манипуляции в полости матки неблагоприятно влияют на течение септического шока и ухудшают прогноз. Наш опыт подтверждает опасность подобных вмешательств. Конечно, подкупает мнение о том, что постоянное поступление микроорганизмов или их токсинов в кровеносное русло больной значительно опаснее, чем одномоментный прорыв их при инструментальном опорожнении матки. Однако клиническая практика показывает: при септическом шоке, особенно развившемся на фойе внебольничного аборта, инфекция нечасто ограничивается пределами плодного яйца. Значительно чаще в процесс вовлекаются миомстрий, маточные вены или инфекция выходит за пределы матки. В таких случаях инструментальное удаление плодного яйца не приводит к желаемому эффекту.
Опыт гинекологической практики свидетельствует о том, что подход к ликвидации очага инфекции при септическом шоке должен быть сугубо индивидуальным. В случае инфицированного выкидыша раннего срока при отсутствии признаков воспалительного процесса в миометрии и за пределами матки допустимо опорожнение полости матки путем бережного выскабливания; выскабливание безусловно показано при кровотечении, не являющемся следствием синдрома ДВС. При начавшемся позднем выкидыше ликвидация инфицированного плодного яйца осуществляется проведением родостимулирующей терапии капельным внутривенным введением окситоцина или простагландинов; задержавшийся послед удаляется инструментальным путем.
Наиболее радикальным способом борьбы с очагом инфекции является удаление матки. К этой операции следует прибегать при безуспешности интенсивной терапии шока, проводимой в течение 4-6 ч. Основным отличием септического шока от других видов шока является скорость развития глубоких и необратимых изменений в жизненно важных органах, поэтому фактор времени при лечении подобных больных приобретает решающее значение. Промедление с радикальным удалением септического очага, связанное как с преодолением морального барьера неизбежности удаления матки у молодых женщин, так и с необходимостью оперативного вмешательства у больных, находящихся в крайне тяжелом состояния, может стоить жизни пациентки. Операцией выбора является экстирпация матки с удалением маточных труб, дренированием параметрия и брюшной полости. В отдельных случаях у больных, находящихся в крайне тяжелом состоянии, при отсутствии макроскопически выраженных изменений тканей матки, допустимо производство надвлагалищной ампутации матки. Удаление маточных труб и дренирование брюшной полости обязательны и в этих случаях.
Развитие септического шока на фоне ограниченного или разлитого перитонита, безусловно, требует хирургического вмешательства, удаления очага инфекции (матки, придатков) с широким дренированием брюшной полости.
Коррекция иммунных нарушений у больных с сепсисом
Иммунотерапия при сепсисе чрезвычайно сложна и может эффективно целенаправленно проводиться только при наличии соответствующих иммунологических исследований, причем желательно специалистом-иммунологом, поскольку нарушено может быть любое звено иммунитета или многие его звенья.
В случае дефицита клеточных факторов (Т-система) целесообразно введение лейковзвеси (3-4 дозы по 300 мл), человеческого лейкоцитарного интерферона в дозе 10 000-20 000 ME. При недостаточности факторов гуморального иммунитета (В-система) эффективно применение специфической гипериммунной плазмы 5-7 мл/кг до 10 доз на курс. Для лечения сочетанного иммунодефицита рекомендуется использование лейковзвеси, препаратов тимуса - Т-акгавина, тималина. При сочетанном дефиците субпопуляций Т- и В-лимфоцитов либо повышении в плазме циркулирующих иммунных комплексов, по мнению авторов, целесообразна гемосорбция, оказывающая иммуномодулирующий эффект.
Если известен возбудитель, эффективно использование соответствующих специфических иммунизированных сывороток (антистафилококковой, антисинегнойной).
В последнее время в литературе появились сообщения об эффективности патогенетических способов лечения, что, безусловно, является весьма обнадеживающим фактом. Это применение поликлональных иммуноглобулинов (пентаглобина) при высокой концентрации эндотоксина в плазме у больных грамотрицательными септико-токсическими заболеваниями.
В многочисленных исследованиях сообщается об успешном использовании моноклональных антител к эндотоксину и отдельным цитокинам, способных связывать TNF, ИЛ-1 и ИНФ-гамма при лечении сепсиса и его осложнений.
Симптоматическая терапия применяется у всех больных с сепсисом. Она индивидуальна и включает применение анальгетических, антигистаминных, спазмолитических, седативных препаратов, витаминов, коферментов, средств, улучшающих процессы тканевой васкуляризации и репарации, и по показаниям кардиальных, гепатотропных, нейротропных средств.
Устранение гемокоагуляционных нарушений достигается назначением ингибиторов протеаз крови: гордокса в дозе 300 000-500 000 ЕД, контрикала в дозе 800 000-1 500 000 ЕД или трасилола в дозе 125 000-200 000 ЕД в сутки.
Назначение гепарина целесообразно только под контролем коагулограммы или агрегатограммы при наличии хронического ДВС-синдрома и повышении агрегационных свойств крови. Средняя доза гепарина составляет 10 тыс. единиц в сутки (по 2,5 тыс. ед. х 4 раза подкожно).
В настоящее время более эффективно назначение пролонгированных низкомолекулярных аналогов гепарина - фраксипарина по 0,4 мл 1 раз в сутки или клексана в дозе 20 мг (0,2 мл) 1 раз в сутки, их вводят подкожно в переднюю или заднелатеральную область брюшной стенки на уровне пояса. При введении препаратов необходимо соблюдать ряд условий: при инъекции игла должна располагаться вертикально и проходить всю толщу кожи, зажатой в складку; место инъекции нельзя растирать. Для тучных больных, имеющих вес более 100 кг, дозы гепарина и его аналогов удваиваются.
Все больным показано применение дезагрегантов (антиагрегантов). В состав инфузионной терапии включают реополиглюкин, применяют также курантил (трентал). Последний включают в инфузионные среды в среднем по 100-200 мг/сут., а при необходимости (невозможность применения прямых антикоагулянтов) доза может быть увеличена до 500 мг/сут. с постепенным введением препарата.
Применение свежезамороженной плазмы также способствует устранению нарушений коагуляции, при этом свежезамороженная плазма является универсальным препаратом, устраняющим как гипо-, так и гиперкоагуляцию, и показана всем больным с сепсисом.
Экстракорпоральные методы детоксикации
Показаниями к применению экстракорпоральных методов детоксикации у больных с сепсисом являются:
- прогрессирование острой печеночно-почечной недостаточности;
- токсические проявления со стороны ЦНС (интоксикационный делирий, коматозное состояние);
- неэффективность консервативной терапии.
Экстракорпоральные методы детоксикации применяются у больных с тяжелой полиорганной недостаточностью. Выбор метода детоксикации зависит от тех задач, которые необходимо решить, исходя, как правило, из тяжести состояния больной (тяжелое или очень тяжелое), а главное, из технических возможностей данного стационара. Если метод ультрафиолетового облучения крови (УФО) доступен и должен широко применяться для лечения гнойных больных практически во всех стационарах, то для лечения другими способами приходится использовать соответствующие отделения многопрофильных больниц.
Таким образом, сепсис является наиболее тяжелым осложнением гнойного процесса, лечение которого сложно и не всегда результативно. Поэтому чрезвычайно важно своевременно проводить все меры профилактики этого грозного осложнения, основными из которых являются выявление и санация гнойного очага.
Как указывалось выше, в комплекс терапевтических мероприятий септического шока должны входить средства, предупреждающие развитие острой почечной недостаточности или способствующие ее ликвидации. Профилактике острой почечной недостаточности служит быстрое и достаточное восполнение ОЦК с включением в состав инфузионных сред реологически активных жидкостей и средств (реополиглюкин, полиглюкнн, гемодез, трентал) с последующим внутривенным введением 10 мл 2,4% раствора эуфиллина, 2-3 мл 2% раствора но-шпы и 40 мг лазикса.
При развившейся острой почечной недостаточности первую помощь оказывает гинеколог совместно с реаниматологом. Ход дальнейшего лечения корректирует нефролог, либо больная переводится в соответствующее отделение. Лечение острой почечной недостаточности начинается с восполнения ОЦК, для чего используют растворы, улучшающие микроциркуляцию: реополиглюкин, полиглюкин, гемодез. Затем назначают средства, снимающие сосудистый спазм: каждые 4 ч вводятся 5-10 мл 2,4% раствора эуфиллина и 2-4 мл 2% раствора но-шпы. Можно использовать глюкозо-новокаиновую смесь (250 мл 20% раствора глюкозы, 250 мл 0,25% раствора новокаина и 12 ЕД инсулина). Параллельно с вазоактнвнымн средствами применяют диуретики. Салуретик лазикс вводится по 80-120 мг каждые 3-4 ч. Осмодиуретик быстрого действия - маннитол - вводят в виде 15% раствора в количестве 200 мл. При положительном диуретическом действии инфуэионную терапию продолжают в соответствии с количеством выделяемой мочи В случае отсутствия эффекта на введение маннитола темп вливания жидкости необходимо замедлить и, во избежание межклеточного отека паренхиматозных органов, повторно осмодиуретики не применять. Стойкая анурия при восполненном объеме циркулирующей крови диктует обязательное ограничение вливаемой жидкости до 700- 1000 мл/сут.
При септическом шоке острой почечной недостаточности в стадии олигоанурии характеризуется быстрым развитием азотемии и гиперкалиемии, поэтому в состав инфузионной терапии необходимо включать не менее 500 мл 20% раствора глюкозы с инсулином. Глюкоза тормозит белковый катаболизм, а также способствует снижению гиперкалиемии. В качестве антидота калия используется и 10% раствор кальция глюконата или хлорида и 4-5% раствор гидрокарбоната натрия. Для улучшения выведения азотистых шлаков, наряду с мероприятиями, нормализующими функцию почек, не следует забывать о таких простых способах, как промывание желудка раствором натрия гидрокарбоната с последующим введением алмагеля и сифонные клизмы с раствором натрия гидрокарбоната.
Консервативная лечение острой почечной недостаточности может быть применена только при медленном темпе нарастания азотемии и дизэлектремии. Общепринятыми показаниями к переводу больной для гемодиализа в отделение искусственной почки служат: повышение уровня калия в сыворотке крови до 7 ммоль/л и более. уровня мочевины - до 49,8 ммоль/л и более, уровня креатинина - до 1,7 ммоль/л и более, рН менее 7.28,- BE - 12 ммоль/л, гипергидратация с явлениями отека легких и мозга.
Для профилактики и лечения острой дыхательной недостаточности необходимы следующие мероприятия:
- строгая коррекция водного баланса, которая заключается. с одной стороны, в своевременном восполнении ОЦK и, с другой - в предупреждении или устранении гипергидратации;
- поддержание необходимого уровня онкотического давления крови за счет введения белковых препаратов;
- своевременное применение кортикостероидной терапии;
- обязательное проведение кардиальной терапии и использование вазодилататоров;
- адекватная оксигенация, при нарастании гипоксии - своевременный переход на ИВЛ.
Таким образом, все основные мероприятия, направленные на ликвидацию септического шока, служат устранению явлений острой дыхательной недостаточности.
Синдром ДВС крови является важным звеном в патогенезе септического шока, поэтому профилактика связанных с ним кровотечений, в том числе маточных, по сути дела, состоит в своевременном и адекватном лечении шока, направленном на оптимизацию тканевой перфузии. Включение в комплекс проводимой терапии гепарина, как специфического антикоагулянтного средства, не является бесспорным. Несмотря на все положительные свойства гепарина, в том числе на его способность повышать устойчивость организма к тканевой гипоксии и действию бактериальных токсинов, применение данного антикоагулянта должно осуществляться сугубо индивидуально. Обычно лечение проводится врачом-гематологом под контролем коагулограммы с учетом стадии ДВС и индивидуальной чувствительности больной к гепарину.
Антикоагулянтный и противотромботический эффекты гепарина связаны с содержанием антитромбина III, уровень которого при септическом шоке падает, поэтому гепаринотерапию необходимо сочетать с трансфузией свежей донорской крови в количестве 200-300 мл.
Лечение поздней стадии септического шока с появлением геморрагического синдрома, в том числе маточного кровотечения, также требует дифференцированного.подхода. При сепсисе организм больной даже после санации очага инфекции испытывает тяжелейшую двойную поломку гемостаза: повсеместное внутрисосудистое свертывание крови с нарушением микроциркуляции в органах и последующее истощение механизмов гемостаза с неконтролируемыми кровотечениями.
В зависимости от показателей коагулограммы проводится заместительная терапия («теплая» донорская кровь, лиофилизированная плазма, сухая, нативная и свежезамороженная плазма, фибриноген) и/или вводится антифибринолитические препараты (контрикал, гордокс).
Критериями эффективности комплексной терапии септического шока являются улучшение сознания больной, исчезновение цианоза, потепление и порозовение кожных покровов, уменьшение тахикардии и одышки, нормализация ЦВД и артериального давления, повышение темпа мочеотделения, ликвидация тромбоцитопении. В зависимости от тяжести септического шока, связанной с особенностями микрофлоры и реактивностью микроорганизма, от своевременности начала и адекватности проведения терапии нормализация вышеназванных показателей происходит в течение нескольких часов или нескольких суток. Однако выведение больной из состояния шока не должно служить сигналом к окончанию интенсивной терапии гнойно-септического заболевания, которое явилось причиной развития шока. Целенаправленная антибактериальная, детоксикационная и гемостимулирующая терапия, восполнение энергетических ресурсов и повышение собственных защитных сил организма, нормализация КОС и электролитного гомеостаза должны продолжаться до полной ликвидации инфекционного процесса.
],По мнению ряда отечественных патофизиологов и клиницистов (Костюченко А.Л. с соавт., 2000) развитие септического шока определяютвирулентность возбудителя, реактивность организма больного, факторы пускового механизма шока (входные ворота инфекции и длительность действия этих ворот). Важно, что бактериемия может быть и при сепсисе и без него. То есть, бактериемия перестает являться облигатным признаком сепсиса.
У хирургических больных септический шок наиболее часто возникает при бактериальных инфекциях . По данным литературы, до 50-х годов основным возбудителем сепсиса являлся стрептококк, позже преобладающим возбудителем стал стафилококк, а в последнее время возросла частота грам-отрицательного сепсиса и роль условно-патогенной флоры.
Вид микроба, его патогенность, токсичность и другие биологические свойства в значительной степени определяют клиническое течение сепсиса. Посевы крови стерильны примерно у 50 % больных с септическим синдромом. У определенного процента больных, умерших при типичной клинической картине септического шока при вскрытии гнойные метастазы не обнаруживаются. Таким образом, бактериальный шок служит проявлением общерезорбтивного действия токсинов.
Измененная реактивность организма считается одним из наиболее значимых условий развития септического шока. По образному выражению А.П. Зильбера (), необходимы соответствующие условия, чтобы кишечная палочка - один из наиболее частых возбудителей септического шокового синдрома, жившая в содружестве с человеком, участвовавшая в микробном гидролизе белка, продуцировавшая витамины группы В, воевавшая с тифозными, дизентерийными и гнилостными микробами, вдруг начала убивать своего хозяина.
Возраст больного имеет существенное значение. За исключением послеоперацаонных осложнений в акушерстве и неонатологии, послеоперационый септический шок развивается чаще всего у больных старше 50 лет.
Существенное значение в снижении активности защитных механизмов имеют истощающие заболевания, сопутствующие хирургической патологии (болезни крови, онкопатология, системные заболевания), а также состояние гормонального фона. При оценке состояния больного с предполагаемым септическим шоком следует учитывать, что оно может быть исходно изменено иммунодепресантами, лучевой терапией, авитаминозами, хроническими интоксикациями (наркомания, алкоголизм).
Первичный гнойный очаг (или входные ворота для инфекта) и длительность действия этих ворот являются обязательным фактором, имеющим отношение к пусковому механизму септического шока.
Первичными гнойными очагами при сепсисе чаще всего являются острые гнойные хирургические заболевания (карбункулы, маститы, абсцессы, флегмоны и т. д.) или гнойные раны, как посттравматические, так и послеоперационные. Сепсис, возникающий в результате локальных гнойных процессов и гнойных ран, известен давно. Сепсис как осложнение различных обширных операций, реанимационных мероприятий и инвазивных диагностическвх процедур, то есть нозокомиальный (или ятрогенный) сепсис, растет по мере расширения объема и сложности оперативных вмешательств и современных медицинских манипуляций и в последнее время получил название «болезнь медицинского прогресса».
Существующее мнение о возможности так называемого первичного, или криптогенного, сепсиса является, по-видимому, ошибочным и является следствием несовершенства знаний и диагностики. Диагноз криптогенного сепсиса уводит врача от поиска первичного очага и, следовательно, затрудняет постановку правильного диагноза и проведение полноценного лечения.
Входные ворота для инфекта являются, как правило, детерминантом клинической формы послеоперационного септического шока. В целом одно из первых мест занимает уродинамическая форма септического шока. Очень часто в хирургической клинике встречается перитонеальная форма септического шока, а следующее по частоте место входных ворот для инфекта при послеоперационном септическом шоке занимают желчевыводящие пути (билиарная форма). В качестве кишечного варианта послеоперационного сепсиса может рассматриваться развитие антибиотико-ассоциированного псевдомембранозного колита с появлением на первом этапе диарейного синдрома различной степени выраженности. Входными воротами может стать жировая клетчатка, особенно в тех случаях, когда гнойное воспаление протекает с явлениями прогрессирующего целлюлита паранефральной, ретроперитонеальной, межмышечной клетчатки. Все большее значение в практике интенсивной терапии приобретают необычные пути проникновения инфекта: при длительной интубации трахеи и трахеостомия, при катетеризации центральных сосудов. Поэтому сосудистая, или ангиогенная, форма септического шока может возникать не только как следствие гнойного тромбофлебита, осложняющего течение раненого процесса, но я как самостоятельное осложнение.
Шокогенным фактором может стать одномоментный лизис содержащихся в очаге и циркулирующих в крови микроорганизмов под воздействием эффективного бактерицидного препарата в высокой дозе (реакция Гельцгеймера-Яриша).
Патогенез септического шока
Сепсис характеризуется массивным поражением эндотелия, вызванным персистирующим воспалением, обусловленным инфекционными или неинфекционнымй причинами. Тяжелая бактериальная инфекция или септический шок связаны с появлением в циркуляции как цитокинов (TNF-a, IL-1, IL-6, IL-8, IL-10), так и их антагонистов (IL-1 RA, TNF-RtI и TNF-RtII), а также комплементов (С3а, С5а), метаболитов (лейкотриены, простагландины), кислородных радикалов (супероксиды О и др.), - кининов (брадикинин), протеазы гранулоцитов, коллагеназы и др.
При септическом шоке, как и при сепсисе, наблюдается выделение в кровь гидралаз, причем не только из лизосом тканей печени, селезенки, легких, но и из полиморфноядерных лейкоцитов (ПМЯЛ). Одновременно при септическом процессе происходит снижение активности естественных антипротеаз. В результате общая протеолитическая активность крови повышается соответственно степени тяжести системной воспалительной реакции.
По мере развития септического шока включаются механизмы, компенсирующие эффект системной вазодалятации. Это может быть отнесено к действию катехоламинов, ангиотензина, гормонов коры надпочечников. Но резервы этих компенсаторных реакций не запрограммированы на такую патофизиологическую ситуацию, как септический шок.
По мере прогрессирования септического шока потенциал вазодилятаторов превышает потенциал вазоконстрикторов. В различных сосудистых зонах этот эффект выражен неодинаково, что и определяет, в известной мере, клинико-морфологические проявления органной патологии.
Клиническая картина септического шока
В развитии септического шока (СШ) различают первоначальный (нередко очень кратковременный) «горячий» период (или гипердинамическую фазу) и последующий, более продолжительный, «холодный» период (гиподинамическую фазу).
При СШ всегда выявляются признаки повреждения органов жизнеобеспечения. Поражение 2-х органов и более классифицируется как синдром полиорганной недостаточности.
Степень дисфункции ЦНС может изменяться от умеренного оглушения до глубокой комы. Примерно у 1 из 4 больных с септическим синдромом развивается респираторный дистресс–синдром взрослых (РДСВ) в результате повреждения активированными нейтрофилами эндотелия легочных капилляров. Клинически опасность острого повреждения легких проявляется нарастанием одышки, изменением дыхательных шумов, появлением рассеянных влажных хрипов, нарастанием артериальной гипоксемии. Наиболее ранний и четкий признак типичной для септического шока органной дисфункции - нарушение функции почек, которое устанавливается по нарастанию олигурии, прогрессирования азотемии и других симптомов острой почечной недостаточности. Для печени органное поражение характеризуется быстрым нарастанием билирубинемии, быстрым подъемом активности в крови печеночных трансаминаз и других маркеров клеточно-печеночной недостаточности. В ЖКТ повреждающее действие медиаторного взрыва проявляется в виде динамической кишечной непроходимости и диапедезных желудочных и кишечных кровотечений. Систолическая и диастолическая функции желудочков сердца угнетены и прогрессивно ухудшаются, происходит снижение сердечного выброса, что знаменует начало декомпенсированной фазы септического шока.
Диагностика септического шока.
Предположение о возможности СШ требует немедленного перехода к интенсивной наблюдению за таким больным в условиях ОРИТ. Стандартный мониторинг должен включать:
Динамическое определение АД, ЧСС, УО и МОК, уровня ЦВД; определение почасового диуреза;
Динамику показателей пульсоксиметра; динамическое исследование напряжения газов и КОС артериальной и смешанной венозной крови;
Динамику Т тела (с определением градиента между внутренней и периферической Т тела больного);
Динамику опорных биохимических показателей (белок, мочевина, креатинин, коагуллограмма, глюкоза, печеночные трансаминазы и др.);
Посевы крови на стерильность.
Диагностика СШ должна включать определение этиологического фактора - выделение возбудителей с определением их чувствительности к антибактериальньим препаратам.
Патогенетические критерии дифференциальной диагностики септического шока включают определение суррогатные маркеры септического процесса: С-реактивный белок, фосфолипазу А2, прокальцитонин (ПКТ). Определение уровня ПКТ в плазме важно именно у больных сепсисом с исходом в септический шок, так как его уровень возрастает в десятки раз при СШ по сравнению с определенно значимым повышением при септических процессах. Для коррекции терапии СШ необходимы также надежные лабораторные критерии состояния системы перекисного окисления липидов и антиоксидантной защиты организма.
Лечение септического шока.
Лечебные мероприятия при септическом шоке преследуют следующие главные цели: коррекцию нарушений гемодинамики со стабилизацией кислородного режима организма, искоренение инфекции и купирование органных дисфункций, включая их замещение.
Стабилизация гемодинамики достигается в первую очередь адекватной волемической нагрузкой: быстрое вливание 1-2 л кристаллоидных растворов с закреплением эффекта коллоидными растворами (в соотношении 2:1) под контролем гемодинамического мониторинга (Ад, ЦВд, СВ) и темпа диуреза. Решающее значение в стабклизации гемодинамики имеет инотропная поддержка, обеспечивающая купирование гемодинамических нарушений и поддержание адекватного уровня ткавевой перфузии. Средством первого выбора для инотропной поддержки ка фоне СШ считается допамин, применяемый либо в малых дозах - 1-4 мкг/кг мин (увеличивает кровоток в почках, мезектериалькых, мозговых и коронарных сосудах), либо в средних дозах - 5-10 мкг/кг мин (микокардиальная).
Для снижения повреждающего действия тканевой гипоксии применяют антигипоксанты: кровезаменители на основе фумарата (мафусол) и сукцината (реамберен), регуляторные антигипоксанты (цитохром С, милдронат).
Искоренение инфекции и санация циркулирующей крови от возбудителя - основное патогенетическое направление терапии СШ. И основные лечебные мероприятия в этом направлении - дренирование септического очага и адекватная противомикробная терапия. В соответствии со стандартами лечения больного с хирургическим сепсисом объем оперативного вмешательства должен включать в себя максимально полную некрэктомию, адекватнос дренаж двухпросветными трубками. Санация септического очага должна быть неотложной и основой хирургического участия должно являться не положение - «больной слишком тяжел, чтобы вмешиваться», а наоборот, - «пациент слишком болен, чтобы откладывать вмешательство...». Любая интенсивная терапия СШ может стать неэффективной именно из-за наличия недиагностированных или плохо прооперированных очагов раневой инфекции.
Препаратами первого выбора при бактериальном СШ считают карбапенемы - меронем или тиенам. Учитывая максимально широкий спектр антибактериальной активности этих препаратов и значительную устойчивость к -лактамазам. Начальная доза карбопенема должна быть максимальной (1-2 г) и вводиться внутривенно микроболюсно (для меронема) или капельно в течение 60 мин (для тиенама). Последующие введения определяются сохранностью почечных функций и составляют 5000-1000 мг каждые 8 ч.
Клиническими критериями оптимальной эффективности проводимой терапии СШ следует считать:
Улучшение сознания и общего вида больного;
Исчезновение периферического цианоза и порозовение кожи, потепление ее на кистях и стопах со снижением градиента температур до 4-5 С;
Уменьшение одышки и повышение РаО2 при стабильном уровне;
Снижение ЧСС, нормализация системного Ад и ЦВд с восстановлением МОК и УО;
Возрастание темпа диуреза.
Детерминантой выхода из СШ считаются реакция жизненно важных функций пациента на проводимое лечение.
Септический шок является одним из тяжелейших осложнений сепсиса, и сопровождается высоким риском летального исхода. Данное состояние свидетельствует о полном истощении компенсаторных систем организма, его неспособности самостоятельно поддерживать артериальное давление, а также о присоединении полиорганной недостаточности (состояние, при котором органы не способны выполнять свои функции без медицинского вмешательства).
Для септического шока характерно изменение сосудистого русла, а также развитие паралича сосудов. Возможно нарушение сократительной способности сердечной мышцы, хотя и на поздних сроках, а также возможно сгущение крови. Не исключено, что может развиться дыхательная недостаточность.
Септический шок – это тяжелое течение , характеризующееся развитием артериальной гипотензии, устойчивой к стандартной реанимации жидкостями и сопровождающейся возникновением тканевой гипоперфузии (нарушение микроциркуляции в тканях) и множественной органной дисфункции.
Внимание. Артериальная гипотензия на фоне септического шока всегда требует подключения вазопрессорных лекарственных средств.
Артериальная гипотензия, резистентная к инфузионной терапии, является обязательным и важнейшим критерием выставления диагноза септический шок.
Течение сепсиса, сопровождающееся только дыхательной или сердечно-сосудистой дисфункцией, сочетающимися с двумя и более, другими дисфункциями (неврологическая, гематологическая, почечная, желудочно-кишечная, печеночная и т.д.) определяется как тяжелый сепсис без септического шока.
Важно. Септический шок никогда не бывает первым проявлением сепсиса. Его развитию всегда предшествует клиническая картина прогрессирующего тяжелого сепсиса.

Развитию септического шока предшествует сепсис-индуцированная артериальная гипотония, сопровождающаяся понижением систолического артериального давления ниже 90 мм.рт.ср. для пациентов с исходным нормальным давлением или на 40 мм.рт.ст. ниже привычного рабочего давления для пациентов с гипертонией.
На этой стадии гипотония временно устраняется проведением адекватной инфузионной терапии. О присоединении септического шока будут свидетельствовать падение систолического давления ниже 65 мм.рт.ст., а также отсутствие реакции на проведение инфузионной терапии в возрастной дозировке.
Причины развития септического шока
Септический шок является осложнением тяжелого сепсиса. То есть, вначале развивается синдром системной воспалительной реакции, затем сепсис, далее тяжелый сепсис. Финальным этапом является развитие септического шока. Для его развития требуется наличие предрасполагающих факторов риска, а также тяжелая септицемия, септикопиемия и тяжелейшая интоксикация.
Чаще всего септический шок развивается у:
- ослабленных больных, недавно перенесших длительные инфекционно-воспалительные заболевания, травмы, ожоги и т.д.;
- лиц, с декомпенсированными соматическими заболеваниями (сердечная недостаточность, сахарный диабет, хроническая почечная недостаточность и т.д.);
- лиц, с иммунодефицитами (первичными и вторичными);
- пациентов с выраженными авитаминозами, дефицитом белка (вегетарианцы, лица, придерживающиеся низкобелковых диет);
- новорожденных детей;
- пациентов пожилого возраста;
- больных со злокачественными новообразованиями (в особенности, в период опухолевого распада либо при наличии большого количества метастатических очагов);
- больных, получающих или недавно проходивших курс химиотерапии или лучевой терапии;
- пациентов, принимающих цитостатическую или иммунодепрессивную терапию;
- лиц, с тяжелыми аутоиммунными патологиями;
- пациентов после трансплантации органов.
Справочно. Причиной развития сепсиса и септического шока могут быть бактериальные, вирусные или грибковые инфекции.
Септический шок может развиваться при генерализации инфекции на фоне отитов, синуситов, пневмоний, абсцессов в легких, гнойных поражений кожных покровов и подкожно-жировой клетчатки, септических артритов, остеомиелитов, гнойных бурситов, аппендицита, перитонита, аднекситов, сальпингоофорита, , эндокардитов, кишечных инфекций, менингитов и т.д.
Возбудители сепсиса и септического шока
 Спектр основных возбудителей зависит от возраста больного, состояния его иммунной системы, а также первичного очага инфекции.
Спектр основных возбудителей зависит от возраста больного, состояния его иммунной системы, а также первичного очага инфекции.
Причинами пупочного и кожного сепсиса и септического шока, чаще всего, выступают золотистые и эпидермальные стафилококки, эшерихия коли, пиогенные стрептококки.
Легочной сепсис, как правило, развивается из-за пневмококков, клебсиеллы пневмония, гемофильной инфекции типа В, золотистых и эпидермальных стафилококков. У интубированных больных может развиться сепсис и септический шок, вызванных синегнойной палочкой или ацинетобактером.
Важно. Причинами септического шока у больных с септическим эндокардитом, как правило, бывают стрептококки, пневмококки и стафилококки.
Кишечный сепсис может быть ассоциирован энтеробактериями (сальмонеллы, шигеллы и т.д.), энтеробактером, эшерихией коли. У детей первых трех лет жизни септический шок может развиваться на фоне тяжелого септического течения сальмонеллеза (у взрослых, генерализированный сальмонеллез встречается гораздо реже).
Читайте также по теме
Если палочкоядерные нейтрофилы 0 у взрослого – о чем это говорит
Септический шок, связанный с гнойно-воспалительными заболеваниями мочеполовой системы, как правило, вызывается эшерихией коли, стафилококками, стрептококками, клебсиеллой, протеем, энтерококком. У пациентов с катетеризированным мочевым пузырем, среди основных возбудителей сепсиса и септического шока выделяют золотистый и эпидермальный стафилококк, энтеробактер и псевдомонады.
Внимание. Септический шок на фоне инфекций ротовой полости, заглоточных абсцессов, эпиглоттитов, целюлита, периорбитальной флегмоны и т.д., как правило, связан с:
- фузобактерией некрофорум (палочкой Шморля),
- гемофильной инфекцией типа В,
- стафилококковой, стрептококковой и пневмококковой флорой.
Сепсис у пациентов с менингитом развивается из-за пневмококков, гемофильной инфекции и менингококков (септический шок на фоне менингококковой инфекции, как правило, встречается у детей, для взрослых более характерно здоровое носительство менингококков или менингококковые назофарингиты).
Причиной септического шока у больных с остеомиелитом, гнойным бурситом или септическим артритом, чаще всего, становятся золотистые стафилококки, пневмококки, пиогенные стрептококки, гемофильная палочка, клебсиеллы.
Септический шок – классификация
Септические шоки принято разделять на:
- теплые компенсированные (гипердинамическая фаза шока);
- холодные декомпенсированные (гиподинамическая фаза);
- рефрактерные к введению дофамина;
- рефрактерный к введению катехоламинов;
- абсолютно рефрактерный шок (картина септического шока продолжает нарастать, несмотря на введение вазопрессорных, вазодилататорных и инотропных препаратов).
По длительности течения септический шок может быть молниеносный, прогрессирующий, стертый, рецидивирующий и терминальный.
Септический шок – стадии
В патогенезе развития шока выделяют две основные стадии:
- гипердинамическую, сопровождающуюся снижением периферического сосудистого сопротивления, рефлекторным увеличением работы сердца и компенсаторным повышением сердечного выброса;
- гиподинамическая, характеризующаяся нарушением микроциркуляции в органах и тканях, резким уменьшением периферического кровообращения, гипоксией и ишемией органов и тканей, а также прогрессирующими нарушениями функции органов (сердечная, дыхательная, почечная, печеночная и т.д. недостаточности).
Патогенез развития септического шока
Септический шок – это следствие:
- развития синдрома системной воспалительной реакции;
- массивной септицемии, септикопиемии, токсинемии;
- выброса в кровь большого количества воспалительных медиаторов;
- относительной (развивается за счет расширения сосудов и снижения периферического сопротивления сосудов) и абсолютной (возникающей как результат резко увеличенной сосудистой проницаемости) гиповолемии;
- снижения сократимости миокарда и понижения сердечного выброса (наблюдается при прогрессирующем септическом шоке). При начальных стадиях септического шока при адекватной и ранней инфузионной терапии, характерно компенсаторное повышение сердечного выброса, с целью поддержания периферического кровообращения. При истощении компенсаторных механизмов организма, способность сердечной мышцы к сокращению снижается.

В результате резко выраженной артериальной гипотонии и гипоперфузии в тканях, нарушается кислородный обмен и полноценный метаболизм. Развивается гипоксия, увеличивается процесс анаэробного гликолиза (ферментативные процессы, в результате которых происходит расщепление глюкозы без потребления О2).
Анаэробный гликолиз позволяет некоторое время поддерживать метаболизм в клетках и обеспечивать их энергией, однако прогрессирующая гипоксия приводит к накоплению в клетках молочной кислоты и развитию лактатацидоза.
Лактатацидоз при септическом шоке развивается остро (в течение одного-двух часов). У пациентов появляется:
- сильная мышечная боль,
- боли за грудиной,
- одышка,
- учащенное дыхание,
- боли в животе,
- многократная и не приносящая облегчения рвота,
- заторможенность,
- нарушение сердечного ритма ,
- появление дыхания Куссмауля (шумного, редкого, глубокого дыхания).
Неврологическая симптоматика может проявляться отсутствием рефлексов, либо наоборот гиперкинезами и судорогами. Также характерны симптомы почечной недостаточности (анурия), снижение температуры тела (гипотермия), диссеминированное внутрисосудистое свертывание крови, внутрисосудистый тромбоз. При тяжелом лактатацидозе возможно появление очагов некроза на кончиках пальцев рук и ног.
Кроме симптомов лактатацидоза, септический шок сопровождается развитием острого респираторного дистресс-синдрома, нарушения сознания, ишемией головного мозга, паралитической кишечной непроходимостью, ишемией и некрозом кишечника.
Внимание! На фоне септического шока возможно возникновение стрессовых язв желудка и кишечника, геморрагических гастропатий, ишемических колитов, надпочечниковой недостаточности, массивных кровотечений.
Симптомы и признаки септического шока
 Развитию септического шока всегда предшествуют прогрессирующие симптомы сепсиса. Пациенты бледные, вялые, заторможенные, может отмечаться выраженное беспокойство, страхи. Характерен также озноб и профузная потливость. Первыми признаками сепсиса у детей может быть капризность, плаксивость, отказ от еды, частое шумное дыхание, вздутие живота. Характерно появление рвоты, не приносящей облегчения.
Развитию септического шока всегда предшествуют прогрессирующие симптомы сепсиса. Пациенты бледные, вялые, заторможенные, может отмечаться выраженное беспокойство, страхи. Характерен также озноб и профузная потливость. Первыми признаками сепсиса у детей может быть капризность, плаксивость, отказ от еды, частое шумное дыхание, вздутие живота. Характерно появление рвоты, не приносящей облегчения.
Отмечается также снижение диуреза и парез кишечника (отсутствие стула и перистальтики). При пальпации живота обнаруживается увеличение печени и селезенки. У большинства пациентов печень при пальпации болезненна, живот вздут и напряжен.
Важно. Прогрессирующие септицемия и токсинемия сопровождаются пожелтением кожи и склер, появлением геморрагической и гнойничковой сыпи. Возможны кровотечения (носовые, желудочно-кишечные и т.д.).
Симптомы по стадиям
При развитии компенсированного септического шока (теплый или гипердинамический шок), характерно развитие:
- гипертермии (температура повышается выше 38.5-39 градусов);
- тахикардии, нарушений сердечного ритма;
- ускорения периферического пульса, время наполнения капилляров менее двух секунд (симптом белого пятна оценивается надавливанием пальцем на кисть и подсчетов времени, которое требуется на исчезновение белого пятна);
- олигурии (снижения объема мочеиспускания);
- спутанности сознания, сонливости, заторможенности.