Железодефицитная анемия
Железодефицитная анемия – анемия, вызванная недостатком железа в организме в результате нарушения баланса между его поступлением, использованием и потерей. Это самый распространенный вид анемии (80% всей заболеваемости анемиями).
Этиология.
Наиболее частой причиной развития железодефицитной анемии (ЖДА) являются повторные и длительные, иногда массивные однократные кровотечения, приводящие к потере железа вместе с эритроцитами. Чаще всего это наблюдается при маточных, реже – желудочно-кишечных, почечных, легочных кровотечениях, при геморрагическом синдроме (см. "Постгеморрагическая анемия").
ЖДА может возникать при нарушении поступления железа с пищей (при кормлении детей только коровьим или козьим молоком) и повышенном расходе железа в период роста, созревания организма, при беременности, лактации. Кроме того, причиной развития ЖДА служит снижение всасывания железа при заболеваниях пищевого канала (гипоацидный гастрит, хронический энтерит) или резекции его отделов, а также нарушение транспорта железа (гипотрансферринемия при поражении печени, наследственная атрансферринемия3), его утилизации из резервов4 (при инфекции, интоксикации, глистной инвазии) и депонировании (при гепатитах, циррозе печени).
Патогенез.
Экзогенный или эндогенный дефицит железа в организме характеризуется уменьшением и постепенным истощением резервов железа, что проявляется исчезновением гемосидерина в макрофагоцитах печени и селезенки, снижением до 2-5% в костном мозге количества сидеробластов (клетки, содержащие железо в виде гранул ферритина; их число в норме – 20-40%). В крови понижается концентрация сывороточного железа (гипосидеремия достигает 1,8-2,7 мкм/л вместо 12,5-30,4 мкм/л в норме) и степень насыщения им трансферрина, что приводит к уменьшению транспорта железа в костный мозг. Нарушается включение железа в эритроцитарные клетки, снижается синтез гема в гемоглобине и некоторых железосодержащих и железозависимых ферментов (каталазы, глутатионпероксидазы) в эритроцитах, что повышает их чувствительность к гемолизирующему действию окислителей. Увеличивается неэффективный эритропоэз вследствие возросшего гемолиза эритрокариоцитов в костном мозге и эритроцитов в крови. Продолжительность жизни эритроцитов уменьшается.
В организме при железодефицитной анемии возникают компенсаторные реакции – усиление абсорбции железа в пищевом канале, повышение концентрации трансферрина, гиперплазия эритроцитарного ростка, увеличение интенсивности гликолиза и активности 2,3-дифосфоглицерата в эритроцитах, способствующее лучшей отдаче кислорода тканям. Однако эти реакции оказываются недостаточными, чтобы восполнить дефицит железа в организме и улучшить кислородтранспортную функцию крови при уменьшении общего количества эритроцитов и содержания в них гемоглобина. Возникают морфологические изменения в эритроцитарных клетках костного мозга: гипохромия, связанная с недостаточной гемоглобинизацией, преобладание базофильных нормобластов над ацидофильными в костном мозге, микроцитоз, деструкция ядерных клеток (нарушение митоза, кариорексис, вакуолизация цитоплазмы эритробластов и нормобластов).
Наряду с патологическими изменениями эритропоэза дефицит железа в организме приводит к уменьшению миоглобина и активности железосодержащих ферментов тканевого дыхания. Следствием гемической и тканевой гипоксии при железодефицитной анемии являются атрофические и дистрофические процессы в тканях и органах, особенно выраженные в пищевом канале (глоссит, гингивит, кариес зубов, поражение слизистой оболочки пищевода, атрофический гастрит с ахилией) и сердце (дистрофия миокарда).
Картина крови.
Железодефицитная анемия – это анемия с эритробластическим типом кроветворения, гипохромная с низким цветовым показателем (0,6 и меньше). Количество гемоглобина снижается в большей степени, чем число эритроцитов. Для мазка крови характерны гипохромия, "тени" эритроцитов, анулоциты, микроцитоз, пойкилоцитоз. Количество ретикулоцитов зависит от регенераторной способности эритроцитарного ростка (регенераторная или чаще гипорегенераторная анемия).
Сидеропенический синдром характеризуется рядом трофических нарушений. Отмечаются: сухость и трещины кожи, преждевременные морщины, ломкость ногтей, койлонихия (катлонихия) – ложкообразные ногти, ангулярный стоматит, атрофия слизистых оболочек рта, пищевода, желудка, дыхательных путей. Нарушается иммунитет, что приводит к хронизации инфекций, частым ОРЗ; развивается мышечная слабость, слабость физиологических сфинктеров. Может возникнуть извращение вкуса (поедание несъедобных продуктов – мела, бумаги и др.), пристрастие к необычным запахам (ацетон, бензин, краска). Нарушается память, концентрация внимания. При дефиците железа резко усиливается абсорбция свинца, и у детей на этом фоне развивается необратимая задержка интеллектуального развития. Нарушение проницаемости мелких сосудов ведет к отекам лица. Иногда возникает «сидеропенический субфебрилитет».
Железорефрактерная анемия
Железорефрактерная анемия может возникнуть при нарушении различных этапов биосинтеза гемоглобина, катализируемых теми или иными ферментами: от взаимодействия глицина с янтарной кислотой, через последовательное образование 5-аминолевулиновой кислоты (АЛК), порфобилиногена, уро-, копро-, протопорфириногена, протопорфирина, гема и до формирования молекулы гемоглобина. Этот вид анемии может быть следствием генетического дефекта синтеза АЛК или протопорфирина, который наследуется рецессивно, сцеплено с Х-хромосомой. Однако более частой причиной является дефицит пиридоксальфосфата, образующегося в организме из пиридоксина (витамина В6) и являющегося коферментом синтетазы АЛК. Снижение содержания пиридоксальфосфата происходит не столько при недостатке пиридоксина в пище (при искусственном вскармливании грудных детей), сколько при лечении лекарственными препаратами, повышающими потребление витамина В6 (например, противотуберкулезное средство изониазид). Бытовое и производственное отравление свинцом также вызывает нарушение синтеза порфиринов в связи с тем, что свинец блокирует сульфгидрильные группы в ферментах, участвующих в образовании гема (дегидразы АЛК, декарбоксилазы уропорфириногена, гемсинтегазы).
Патогенез.
Уменьшение активности ферментов, участвующих в образовании порфиринов и гема, приводит к снижению утилизации железа и нарушению синтеза гема гемоглобина, что ведет к развитию гипохромной анемии с низким содержанием гемоглобина в эритроцитах при одновременном повышении содержания сывороточного железа в крови (до 54-80 мкмоль/л). В костном мозге наблюдается раздражение эритроцитарного ростка и увеличение количества базофильных нормобластов и эритрокариоцитов с включением железа ("кольцевых" сидеробластов), в то же время уменьшается число гемоглобинизированных форм, повышается неэффективный эритропоэз и укорачивается продолжительность жизни эритроцитов. Отложение железа во внутренних органах сопровождается вторичным разрастанием соединительной ткани (гемосидероз печени, сердца, поджелудочной железы и других органов).
ЖЕЛЕЗОДЕФИЦИТНАЯ АНЕМИЯ
Железодефицитная анемия - это анемия, обусловленная дефицитом железа в сыворотке крови, костном мозге и депо. Люди, страдающие скрытым дефицитом железа и железодефицитной анемией, составляют 15-20% населения Земли. Наиболее часто железодефицитная анемия встречается среди детей, подростков, женщин детородного возраста, пожилых людей. Общепринято выделять две формы железодефицитных состояний: латентный дефицит железа и железодефицитную анемию. Латентный дефицит железа характеризуется уменьшением количества железа в его депо и снижением уровня транспортного железа крови при нормальных показателях гемоглобина и эритроцитов.
Этиология
Хронические кровопотери
Повышенная потребность в железе
Беременность, роды и лактация
Недостаточное поступление железа с пищей
Алиментарная железодефицитная анемия, обусловленная недостаточным поступлением железа с пищей, развивается у строгих вегетарианцев, у лиц с низким социально-экономическим уровнем жизни, у больных с психической анорексией.
Нарушение всасывания железа
Основными причинами, приводящими к нарушению всасывания железа в кишечнике и развитию вследствие этого железодефицитной анемии, являются: хронические энтериты и энтеропатии с развитием синдрома мальабсорбции; резекция тонкой кишки; резекция желудка по методу Бильрот II («конец в бок»), когда происходит выключение части 12-перстной кишки. При этом железодефицитная анемия часто сочетается в В 12 -(фолиево)-дефицитной анемией в связи с нарушением всасывания витамина В 12 и фолиевой кислоты.
Нарушения транспорта железа
Железодефицитная анемия, обусловленная снижением содержания в крови трансферинаКлиническая картина
Клинические проявления железодефицитной анемии можно сгруппировать в два важнейших синдрома - анемический и сидеропенический.
Анемический синдром
Анемический синдром обусловлен снижением содержания гемоглобина и количества эритроцитов, недостаточным обеспечением тканей кислородом и представлен неспецифическими симптомами. Больные жалуются на общую слабость, повышенную утомляемость, снижение работоспособности, головокружение, шум в ушах, мелькание мушек перед глазами, сердцебиения, одышку при физической нагрузке, появление обморочных состояний. Может появляться снижение умственной работоспособности, памяти, сонливость. Субъективные проявления анемического синдрома вначале беспокоят больных при физической нагрузке, а затем и в покое (по мере роста анемии).
При объективном исследовании обнаруживается бледность кожи и видимых слизистых оболочек. Нередко обнаруживается некоторая пастозность в области голеней, стоп, лица. Характерны утренние отеки - «мешки» вокруг глаз.
Анемия обусловливает развитие синдрома миокардиодистрофии, который проявляется одышкой, тахикардией, часто аритмией, умеренным расширением границ сердца влево, глухостью тонов сердца, негромким систолическим шумом во всех аускультативных точках. При тяжелой и длительной анемии миокардиодистрофия может привести к выраженной недостаточности кровообращения. Железодефицитная анемия развивается постепенно, поэтому организм больного постепенно адаптируется и субъективные проявления анемического синдрома не всегда бывают ярко выражены.
Сидеропенический синдром
Сидеропенический синдром (синдром гипосидероза) обусловлен тканевым дефицитом железа, что приводит к снижению активности многих ферментов (цитохромоксидаза, пероксидаза, сукцинат-дегидрогеназа и др.). Сидеропенический синдром проявляется многочисленными симптомами:
· извращение вкуса (picachlorotica) - непреодолимое желание употреблять в пищу что-либо необычное и малосъедобное (мел, зубной порошок, уголь, глину, песок, лед), а также сырое тесто, фарш, крупу; этот симптом чаще встречается у детей и подростков, но достаточно часто и у взрослых женщин;
· пристрастие к острой, соленой, кислой, пряной пище;
· извращение обоняния - пристрастие к запахам, которые большинством окружающих воспринимаются как неприятные (бензин, ацетон, запах лаков, красок, гуталина и др.);
· выраженная мышечная слабость и утомляемость, атрофия мышц и снижение мышечной силы в связи с дефицитом миоглобина и ферментов тканевого дыхания;
· дистрофические изменения кожи и ее придатков (сухость, шелушение, склонность к быстрому образованию на коже трещин; тусклость, ломкость, выпадение, раннее поседение волос; истончение, ломкость, поперечная исчерченность, тусклость ногтей; симптом койлонихии - ложкообразная вогнутость ногтей);
o ангулярный стоматит - трещины, «заеды» в углах рта (встречаются у 10-15% больных);
o глоссит (у 10% больных) - характеризуется ощущением боли и распирания в области языка, покраснением его кончика, а в дальнейшем атрофией сосочков («лакированный» язык); часто наблюдается склонность к пародонтозу и кариесу;
o атрофические изменения слизистой оболочки желудочно-кишечного тракта - это проявляется сухостью слизистой оболочки пищевода и затруднениями, а иногда болями при глотании пищи, особенно сухой (сидеропеническая дисфагия); развитием атрофического гастрита и энтерита;
o симптом «синих склер» характеризуется синеватой окраской или выраженной голубизной склер. Это объясняется тем, что при дефиците железа нарушается синтез коллагена в склере, она истончается и через нее просвечивает сосудистая оболочка глаза.
o императивные позывы на мочеиспускание, невозможность удержать мочу при смехе, кашле, чихании, возможно даже ночное недержание мочи, что обусловлено слабостью сфинктеров мочевого пузыря;
o «сидеропенический субфебрилитет» - характеризуется длительным повышением температуры до субфебрильных величин;
o выраженная предрасположенность к острым респираторно-вирусным и другим инфекционно-воспалительным процессам, хронизации инфекций, что обусловлено нарушением фагоцитарной функции лейкоцитов и ослаблением системы иммунитета;
o снижение репаративных процессов в коже, слизистых оболочках.
Лабораторные данные
Наиболее часто встречаются железодефицитные анемии, особенно у детей раннего возраста, девочек в период полового созревания и женщин в период беременности и лактации. Данный вид составляет 2/3 случаев от числа всех анемий.
Причиной железодефицитных анемий является превышение потерь железа над его поступлением в организм. Суточная потребность в железе для мужчин составляет 10 мг, для женщин – 18 мг, в период беременности и лактации – 33-38 мг. В норме всасывается только около 10 % (1,5-2 мг в сутки) железа, поступающего с пищей, при его дефиците всасывание железа может возрастать до 40 %. Столько же железа теряется с мочой, калом, слущивающимся эпителием и его производными (ногти, волосы), менструальной кровью, грудным молоком. Общая потеря составляет 1,5-2 мг/сут. В 1 мл крови содержится 0,5 мг железа, запасы железа в организме составляют 3-4 г.
Поступление железа в клетки (для справки): Всасывание железа лучше происходит из мяса, в меньшей степени – из других продуктов. Неорганическое железо овощей и зерновых в основном трехвалентное, до 60% железа находится в трудноусвояемой форме, связанной с фитиновой кислотой. В желудке Fe +3 под действием солянойкислоты желудка превращается в Fe +2 , в таком виде железо всасывается быстрее. Ускоряют его всасывание аскорбиновая кислота, ионы меди. Препятствуют всасыванию железа фосфаты, оксалаты, препараты кальция и содержащие кальций продукты (творог, молоко), а также вегетарианская диета. В сосудистом русле железо соединяется с трансферрином – гликопротеидом, синтезируемым в печени. Основным источником сывороточного пула железа являются макрофаги печени и селезенки, где происходит распад старых эритроцитов.
При абсорбции его в тонком кишечнике в плазму поступает небольшое количество железа. Большинство клеток, в том числе эритробласты и гепатоциты, содержат на мембране рецепторы к трасферрину. В клетке железо включается в состав ферментов, содержащих и несодержащих гем . Основными формами депонированного железа являются ферритин и гемосидерин, которые содержатся практически во всех тканях организма.
Дефицит железа в организме возникает:
E при его недостаточном поступлении с пищей (наиболее богаты железом печень, яйца, овсяная, пшеничная, гречневая крупа, мясо, яблоки, черная смородина),
E при нарушении всасывания (гастриты, энтериты, резекция части желудка и двенадцатиперстной кишки),
E транспорта железа кровью (дефицит трансферрина),
E при повышении потребности в нем (многоплодие, растущий организм, беременность, лактация).
К отрицательному балансу железа в организме также могут привести избыточные ежесуточные в течение месяца потери крови в количестве 25-50 мл из ЖКТ (язвенная болезнь, гастриты, гельминтоз: поражение власоглавом и анкилостомой), гиповитаминоз К (геморрагическая болезнь новорожденных и др.).
Дефицит железа развивается, когда его потеря превышает 2 мг/сут. У женщин частыми причинами дефицита железа могут быть метроррагии, у мужчин – кровотечения из мочеполового тракта. При метроррагиях женщины могут терять до 40 мг железа за цикл.
Повышенный расход железа отмечается в ходе беременности, родов (потеря 150-200 мг железа) и лактации (900 мг).
Потери железа могут происходить при внутрисосудистом гемолизе вследствие гемоглобинурии и гемосидеринурии при хронических гемолитических анемиях.
Недостаток железа в организме приводит кснижению его содержания в плазме крови –сидеропения (в норме 12-30 мкмоль/л), что, в первую очередь, приводит к недостаточному образованию гемоглобина и ведет к гипохромии эритроцитов. В связи с тем, что железо входит в состав железосодержащих ферментов (цитохромов, пероксидаз, каталазы), при железодефицитных анемиях нарушаются окислительно-восстановительные процессы в тканях, снижается антиоксидантная защита, что способствует активации окислительного повреждения клеточных мембран и клеточному повреждению.
Поэтому, кроме общеанемических симптомов при железодефицитной анемии развивается сидеропенический синдром , который проявляется мышечной слабостью, истончением и выпадением волос, ломкостью ногтей, трофическими изменениями кожи и слизистой желудочно-кишечного тракта (глоссит, гингивит, атрофический гастрит), изъязвлением в углах рта, нарушением аппетита, а также извращением вкуса и обоняния (употребление в пищу мела, глины, угля, сырых продуктов), дисфагией, диспепсией и снижением иммунитета. У девушек в период полового созревания (ранняя форма) сидеропенический синдром получил название хлороз (от греч. – зеленый), «бледная немочь», у женщин в климактерическом периоде отмечается поздняя его форма.
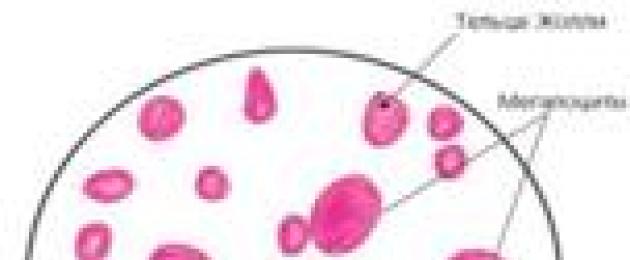
В периферической крови при железодефицитных анемиях отмечается понижение содержания эритроцитов, уменьшение уровня гемоглобина, значительное снижение цветового показателя (гипохромная анемия), вследствие чего эритроциты выглядят в виде колец. Наблюдается пойкилоцитоз и анизоцитоз с преобладанием микроцитоза. Причиной образования микроцитов является дополнительное митотическое деление предшественников эритроцитов при их созревании в красном костном мозге. Известно, что гемоглобин выступает как ингибитор деления нормоцитов, а его недостаточное образование способствует дополнительному делению предшественников эритроцитов. Количество ретикулоцитов снижается (гипорегенераторная анемия).
Картина периферической крови с железодефицитной анемией(гипохромия, микроцитоз, анизоцитоз эритроцитов)
В последние годы для характеристики железодефицитной анемии применяют определение в сыворотке крови концентрации растворимых рецепторов к трансферрину, отражающих адекватное поступление железа в клетки эритропоэза. При железодефицитной анемии происходит повышение синтеза и экспрессии данных рецепторов и увеличение их концентрации в крови.
Патогенез. Выделяют три последовательных этапа железодефицитной анемии – предлатентный и латентный дефицит железа и собственно железодефицитную анемию.
Предлатентный дефицит железа – состояние, предшествующее дефициту железа. Клинические симптомы отсутствуют. Уровень гемоглобина нормальный. Показатели транспортного фонда железа в норме. Снижены показатели запасов железа.
Латентный дефицит железа сопровождается сидеропеническим синдромом, обусловленным дефицитом железа в тканях. Анемия отсутствует, содержание гемоглобина нормальное. Критериями диагностики латентного дефицита железа являются изменение показателей транспортного фонда железа (снижение железа сыворотки, повышение общей и латентной железосвязывающей способности сыворотки, нормальные или сниженные значения коэффициента насыщения трансферрина), снижение уровня ферритина сыворотки.
Диагностикасобственножелезодефицитной анемии основывается на выявлении признаков анемии в общем анализе крови, морфологического исследования мазка периферической крови. Снижение уровня гемоглобина следует считать проявлением железодефицитной анемии только в том числе, если выявляются гипохромия (морфологически и по цветовым индексам), пониженный уровень ретикулоцитов и снижение транспортного фонда железа.
Биохимически отмечается уменьшение содержания железа в сыворотке до 1,8-7,2 мкмоль/л (сидеропения) и увеличение общей железосвязывающей способности (в норме 40,6-62,5 мкм/л) как следствие компенсаторного повышения концентрации трансферрина). Процент насыщения трансферрина снижается до 15 % и ниже.
Железоперераспределительные анемии занимают второе место по распространенности, они сопровождают хронические инфекционные, ревматические, опухолевые заболевания и обусловлены нарушением перемещения железа из депо в плазму.
Для нормального гемопоэза организму в сутки требуется 25 мг железа. В тонком кишечнике всасывается 1,5-2 мг железа. Основная доля железа поступает в клетки гемопоэза путем его реутилизации из разрушающихся эритроцитов. В ряде случаев клетки депо (макрофаги селезенки, печени, костного мозга) прочно удерживают железо, поэтому механизм реутилизации нарушается.Развивается перераспределительный, или функциональный, дефицит железа, сопровождающийся снижением доставки железа к эритробластам костного мозга, нарушению эритропоэза и развитию анемии.
В периферической крови отмечается умеренная гипохромная анемия, умеренное снижение гемоглобина, снижение сывороточного железа, ОЖСС, трансферина, коэффициент «насыщение трансферрина железом» (НТЖ) и повышение содержания сывороточного ферритина.
Порфиринодефицитные (сидероахрестические) анемии , от греч. achrestos – бесполезный, тщетный. Сходны по механизму развития с железодефицитными анемиями. Они развиваются при нарушении включения железа в гемиз-за низкой активности ферментов, участвующих в синтезе порфиринов, которые входят в состав гема . Порфиринодефицитные анемии могут быть наследственными (сцепленные с Х-хромосомой или аутосомой) и приобретенными (интоксикация свинцом, дефицит витамина В 6). Нарушение включения железа в гем приводит к увеличению уровня железа в плазме крови (до 80-100 мкмоль/л) и накоплению его в печени, надпочечниках, поджелудочной железе, яичках, что нарушает их функции. НТЖ достигает 100%.
Лечение железодефицитных анемий должно быть направлено на устранение нарушения поступления и всасывания железа в организм, лечебное питание, восполнение депо железа и проведение противорецидивной (поддерживающей) уровень железа в организме терапии. Среди препаратов железа лучше всего использовать сульфат железа (по 200 мг три раза в сутки перед едой). При железоперераспределительных анемиях препараты железа не назначаются.
8. Этиология и патогенез витамин В 12 -дефицитных (болезнь Адиссона-Бирмера) и фолиеводефицитных анемий. Картина периферической крови. Патогенез основных синдромов.
Витамин В 12 -дефицитная анемия (болезнь Адиссона-Бирмера)
Особое место занимает анемия, связанная с дефицитом витамина В 12 (суточная потребность около 1 мкг, в дневной рацион – 10-15 мкг), относящаяся к анемиям, возникающим вследствие дефицита кровеобразующих факторов.
Поступление витамина В 12 в клетки (для справки ). В продуктах питания цианокобаламин, или «внешний фактор Кастла», связан с белком. В желудке витамин В 12 освобождается от белка и связывается с гликопротеином – «внутренним фактором Кастла», что позволяет образовавшемуся комплексу всасываться в тонкой кишке. В крови витамин соединяется с транспортными белками траскобаламинами.
Большая часть витамина связывается с транскобаламином I, в соединении с которым он неактивен, а также связывается с транскобаламином II, который с током крови транспортирует витамин в печень, костный мозг, головной мозг и другие органы и с транскобаламином III, функция которого неизвестна.
Запасы витамина В 12 в организме находятся в печени, составляют около 2-5 мг. При прекращении экзогенного поступления цианокобаламина их достаточно на 3-6 лет.
Патогенез. Витамин В 12 имеет две коферментные формы: метилкобаламин и 5-дезоксиаденозилкобаламин.
Метилкобаламин участвует в обеспечении нормального (эритробластического) кроветворения в результате образования из фолиевой кислоты тетрагидрофолиевой, необходимой для образования тимидинмонофосфата, синтеза глутаминовой кислоты, пуриновых и пиримидиновых оснований.
Другая коферментная форма 5-дезоксиаденозилкобаламин регулирует синтез жирных кислот, катализируя превращение метилмалоновой кислоты в янтарную (сукциниловую) кислоту, которая необходима для образования миелина.
Недостаток витамина В 12 приводит к нарушению синтеза и структуры ДНК, что уменьшает количество митозов в эритропоэзе. В результате клетки эритроидного ростка увеличиваются в размерах (мегалобласты и мегалоциты), резко уменьшается их количество и продолжительность жизни из-за низкой резистентности .

Одновременно нарушается созревание клеток других ростков гемопоэза, что приводит к тромбоцитопении и лейкопении.
При В 12 -дефицитной анемии в результате тяжелого функционального поражения костного мозга вследствие авитаминоза В 12 регенерация эритроцитов протекает по мегалобластическому типу кроветворения. При этом родоначальником новообразованных эритроцитов является мегалобласт, который при дальнейшем созревании превращается в зрелую безъядерную клетку – мегалоцит. Мегалобласты и мегалоциты обнаруживаются при В 12 -дефицитной анемии не только в костном мозге, но и в крови. Нормоциты, наоборот, встречаются в крови при анемии Бирмера исключительно редко.
Мегалобласты представляют собой крупные клетки в 2-4 раза больше эритробласта. Цитоплазма их нередко гиперхромна, ядро – относительно большое с нежной сетевидной структурой, бедное хроматином. При созревании мегалобласта ядро не выталкивается, в отличие от нормобласта, а распадается на фрагменты, часть которых выталкивается из клетки, а часть лизируется. Поэтому в цитоплазме мегалобластов часто видны тельца Жолли (остатки ядер) и остатки нуклеолеммы (кольца Кебота). Тельца Жолли представляют собой точечные включения в протоплазме эритроцита, окрашивающиеся по Романовскому-Гимза в яркокрасный цвет, обычно их не более 1-2 в эритроците. Кольца Кебота представляют тонкие колечки или фигуры в виде восьмерки и окрашиваются по методу Романовского-Гимза в красный или синий цвет. Характерно ассинхронное созревание ядра и цитоплазмы.
После исчезновения ядра из мегалобласта образуется мегалоцит. Мегалоцит отличается от нормоцита большей величиной (диаметр его равен 12-20 мкм) и более интенсивной окраской (гиперхромия), что соответствует высокому цветовому показателю крови. Гиперхромия отличает мегалоциты от макроцита.
Картина периферической крови. Витамин В 12 -дефицитные анемии отличаются очень низким содержанием эритроцитов (1,0-0,8 × 10 12 /л) и гемоглобина (50-25 г/л). Цветовой показатель превышает норму, достигая 1,4-1,8 (гиперхромная анемия). В периферической крови характерно наличие мегалобластов и мегалоцитов, в эритроцитах телец Жоли и колец Кебота, анизоцитоза и пойкилоцитоза, лейкопении, трмбоцитопении. Отмечается наличие нейтрофилов с пиперсегментированным ядром. Количество ретикулоцитов обычно понижено.
Вследствие нарушения регенераторной способности костного мозга при витамин В 12 -дефицитных анемиях развиваются изменения со стороны желудочно-кишечного тракта (глоссит и формирование «полированного» языка вследствие атрофии его сосочков (атрофический глоссит Гунтера, стоматит, гастроэнтероколит), которые обусловлены нарушением деления и созревания эпителиоцитов слизистой.
Для дефицита витамина В 12 характерно также наличие неврологического синдрома, вызванного нарушением образования миелина дорзальных и латеральных канатиков спинного мозга, включающего признаки фуникулярного миелоза (шаткая походка, парестезии, болевые ощущения); психические расстройства (бред, галлюцинации). Неврологический синдром обусловлен дефицитом 5-дезоксиаденозилкобаламина, накоплением метилмалоновой кислоты и недостатком янтарной кислоты.
Лечение анемий состоит в назначении внутримышечных инъекций этого витамина (по 1 мг, инъекции повторяют каждые 2-3 дня, пока не будет сделано 6 инъекций). Затем проводят по одной инъекции раз в три месяца, пока не будет устранена причина дефицита витамина В 12 .
Фолиеводефицитные анемии
Соединения фолиевой кислоты содержатся в большом количестве в печени, мясе, дрожжах, шпинате. Суточная потребность взрослого человека в фолиевой кислоте составляет 100-400 мкг. При дефиците поступления запасы ее в организме (5-20 мг) исчерпываются в течение 3-4 мес. Всасывается фолиевая кислота в основном в верхнем отделе тонкой кишки.
Коферментная форма фолиевой кислоты необходима для образования тимидинмонофосфата, синтеза глутаминовой кислоты, пуриновых и пиримидиновых оснований, участвует в нейрофизиологии мозга.
Причинами дефицита фолиевой кислоты может быть:
· плохое питание (диета, бедная зеленью, свежими фруктами, овощами), н
· арушение всасывания (кишечная мальабсорбция, алкоголизм, прием барбитуратов, гастрэктомия),
· повышенная потребность в фолиевой кислоте (беременность, кормление грудью, болезни кожи, гемобластозы).
Дефицит фолиевой кислоты приводит к аналогичным изменениям в крови и желудочно-кишечном тракте, которые наблюдаются при витамин В 12 -дефицитной анемии.
Лечение дефицита фолиевой кислоты состоит в назначении фолиевой кислоты (5 мг/день на протяжении 4-х месяцев, затем режим изменяют – либо 5 мг фолиевой ксилоты раз в неделю, либо 400 мкг – ежедневно).
Установлено, что витамины В 12 и фолиевая кислота участвуют в реметилировании гомоцистеина в аминокислоту метионин. Дефицит этих витаминов приводит к увеличению концентрации гомоцистеина в крови. Гипергомоцистеинемия вызывает повреждение и активацию эндотелиальных клеток, что способствует развитию атеросклероза, инфаркта миокарда, тромбоза.
– синдром, обусловленный недостаточностью железа и приводящий к нарушению гемоглобинопоэза и тканевой гипоксии. Клинические проявления представлены общей слабостью, сонливостью, пониженной умственной работоспособностью и физической выносливостью, шумом в ушах, головокружениями, обморочными состояниями, одышкой при нагрузке, сердцебиением, бледностью. Гипохромная анемия подтверждается лабораторными данными: исследованием клинического анализа крови, показателей сывороточного железа, ОЖСС и ферритина. Терапия включает лечебную диету, прием препаратов железа, в некоторых случаях – трансфузию эритроцитарной массы.
МКБ-10
D50
Общие сведения
Железодефицитная (микроцитарная, гипохромная) анемия – анемия, обусловленная нехваткой железа, необходимого для нормального синтеза гемоглобина. Её распространенность в популяции зависит от половозрастных и климатогеографических факторов. По обобщенным сведениям, гипохромной анемией страдает около 50% детей раннего возраста, 15% женщин репродуктивного возраста и около 2% мужчин. Скрытый тканевой железодефицит выявляется практически у каждого третьего жителя планеты. На долю микроцитарной анемии в гематологии приходится 80–90% всех анемий. Поскольку железодефицит может развиваться при самых различных патологических состояниях, данная проблема актуальна для многих клинических дисциплин: педиатрии , гинекологии , гастроэнтерологии и др.
Причины
Ежесуточно с потом, калом, мочой, слущенными клетками кожи теряется около 1 мг железа и примерно столько же (2-2,5 мг) поступает в организм с пищей. Дисбаланс между потребностями организма в железе и его поступлением извне или потерями способствует развитию железодефицитной анемии. Железодефицит может возникать как при физиологических условиях, так и в результате ряда патологических состояний и быть обусловлен как эндогенными механизмами, так и внешними воздействиями:
Кровопотери
Чаще всего анемия вызывается хронической потерей крови: обильными менструациями , дисфункциональными маточными кровотечениями ; желудочно-кишечными кровотечениями из эрозий слизистой желудка и кишечника, гастродуоденальных язв , геморроидальных узлов , анальных трещин и др. Скрытая, но регулярная кровопотеря отмечается при гельминтозах , гемосидерозе легких , экссудативном диатезе у детей и др.
Особую группу составляют лица с болезнями крови - геморрагическими диатезами (гемофилией , болезнью Виллебранда), гемоглобинурией . Возможно развитие постгеморрагической анемии , вызванной одномоментным, но массивным кровотечением при травмах и операциях. Гипохромная анемия может возникать вследствие ятрогенных причин - у доноров, часто сдающих кровь; пациентов с ХПН , находящихся на гемодиализе .
Нарушение поступления, всасывания и транспорта железа
К факторам алиментарного порядка относятся анорексия , вегетарианство и следование диетам с ограничением мясных продуктов, плохое питание; у детей - искусственное вскармливание, позднее введение прикорма. Снижение абсорбции железа характерно для кишечных инфекций, гипоацидного гастрита , хронического энтерита , синдрома мальабсорбции , состояния после резекции желудка или тонкой кишки , гастрэктомии . Значительно реже железодефицитная анемия развивается вследствие нарушения транспортировки железа из депо при недостаточной белково-синтетической функции печени – гипотрансферринемиях и гипопротеинемиях (гепатитах , циррозе печени).
Повышенное расходование железа
Ежедневная потребность в микроэлементе зависит от пола и возраста. Наиболее высока необходимость в железе у недоношенных , детей раннего возраста и подростков (в связи с высокими темпами развития и роста), женщин репродуктивного периода (в связи с ежемесячными менструальными потерями), беременных (в связи с формированием и ростом плода), кормящих мам (в связи с расходом в составе молока). Именно эти категории являются наиболее уязвимыми в отношении развития железодефицитной анемии. Кроме того, повышение потребности и расхода железа в организме наблюдается при инфекционных и опухолевых заболеваниях.
Патогенез
По своей роли в обеспечении нормального функционирования всех биологических систем железо является важнейшим элементом. От уровня железа зависит поступление кислорода к клеткам, протекание окислительно-восстановительных процессов, антиоксидантная защита, функционирование иммунной и нервной систем и пр. В среднем содержание железа в организме находится на уровне 3-4 г. Более 60% железа (>2 г) входит в состав гемоглобина, 9% - в состав миоглобина, 1% - в состав ферментов (гемовых и негемовых). Остальное железо в виде ферритина и гемосидерина находится в тканевом депо – главным образом, в печени, мышцах, костном мозге, селезенке, почках, легких, сердце. Примерно 30 мг железа непрерывно циркулирует в плазме, будучи частично связанным основным железосвязывающим белком плазмы – трансферрином.
При развитии отрицательного баланса железа мобилизуются и расходуются запасы микроэлемента, содержащиеся в тканевых депо. На первых порах этого бывает достаточно для поддержания адекватного уровня Hb, Ht, сывороточного железа. По мере истощения тканевых резервов компенсаторно увеличивается эритроидная активность костного мозга. При полном истощении эндогенного тканевого железа его концентрация начинает снижаться в крови, нарушается морфология эритроцитов, уменьшается синтез гема в гемоглобине и железосодержащих ферментов. Страдает кислородтранспортная функция крови, что сопровождается тканевой гипоксией и дистрофическими процессами во внутренних органах (атрофический гастрит, миокардиодистрофия и др.).
Классификация
Железодефицитная анемия возникает не сразу. Вначале развивается предлатентный железодефицит, характеризующийся истощением только запасов депонированного железа при сохранности транспортного и гемоглобинового пула. На этапе латентного дефицита отмечается уменьшение транспортного железа, содержащегося в плазме крови. Собственно гипохромная анемия развивается при уменьшении всех уровней метаболических запасов железа – депонированного, транспортного и эритроцитарного. В соответствии с этиологией различают анемии: постгеморрагические, алиментарные, связанные с повышенным расходом, исходным дефицитом, недостаточностью резорбции и нарушением транспорта железа. По степени выраженности железодефицитные анемии подразделяются на:
- Легкие (Нb 120-90 г/л). Протекают без клинических проявлений или с их минимальной выраженностью.
- Среднетяжелые (Нb 90-70 г/л). Сопровождаются циркуляторно-гипоксическим, сидеропеническим, гематологическим синдромами умеренной степени выраженности.
- Тяжелые (Нb
Симптомы
Циркуляторно-гипоксический синдром обусловлен нарушением синтеза гемоглобина, транспорта кислорода и развитием гипоксии в тканях. Это находит свое выражение в ощущении постоянной слабости, повышенной утомляемости, сонливости. Пациентов преследует шум в ушах, мелькание «мушек» перед глазами, головокружения, переходящие в обмороки . Характерны жалобы на сердцебиение, одышку, возникающую при физической нагрузке, повышенную чувствительность к низким температурам. Циркуляторно-гипоксические нарушения могут усугублять течение сопутствующей ИБС , хронической сердечной недостаточности .
Развитие сидеропенического синдрома связано с недостаточностью тканевых железосодержащих ферментов (каталазы, пероксидазы, цитохромов и др.). Этим объясняется возникновение трофических изменений кожных покровов и слизистых оболочек. Чаще всего они проявляются сухостью кожи ; исчерченностью, ломкостью и деформацией ногтей ; повышенным выпадением волос . Со стороны слизистых оболочек типичны атрофические изменения, что сопровождается явлениями глоссита , ангулярного стоматита , дисфагии , атрофического гастрита. Может возникать пристрастие к резким запахам (бензина, ацетона), искажение вкуса (желание есть глину, мел, зубной порошок и пр.). Признаками сидеропении также служат парестезии, мышечная слабость, диспепсические и дизурические расстройства. Астеновегетативные нарушения проявляются раздражительностью , эмоциональной неустойчивостью, снижением умственной работоспособности и памяти.
Осложнения
Поскольку в условиях железодефицита IgA теряет свою активность, больные становятся подвержены частой заболеваемости ОРВИ , кишечными инфекциями. Пациентов преследует хроническая усталость, упадок сил, снижение памяти и концентрации внимания. Длительное течение железодефицитной анемии может привести к развитию миокардиодистрофии , распознаваемой по инверсии зубцов Т на ЭКГ . При крайне тяжелом железодефиците развивается анемическая прекома (сонливость, одышка, резкая бледность кожи с цианотичным оттенком, тахикардия, галлюцинации), а затем – кома с потерей сознания и отсутствием рефлексов. При массивной стремительной кровопотере возникает гиповолемический шок.
Диагностика
На наличие железодефицитной анемии может указывать внешний вид больного: бледная, с алебастровым оттенком кожа, пастозность лица, голеней и стоп, отечные «мешки» под глазами. При аускультации сердца обнаруживается тахикардия , глухость тонов, негромкий систолический шум, иногда – аритмия . С целью подтверждения анемии и определения ее причин проводится лабораторное обследование.
- Лабораторные тесты . В пользу железодефицитного характера анемии свидетельствует снижение гемоглобина, гипохромия, микро- и пойкилоцитоз в общем анализе крови. При оценке биохимических показателей отмечается снижение уровня сывороточного железа и концентрации ферритина (60 мкмоль/л), уменьшение насыщения трансферрина железом (
- Инструментальные методики . Для установления причины хронической кровопотери должно быть проведено эндоскопическое обследование ЖКТ (ЭГДС, колоноскопия,), рентгенодиагностика (ирригоскопия , рентгенография желудка). Обследование органов репродуктивной системы у женщин включает УЗИ малого таза , осмотр на кресле , по показаниям - гистероскопию с РДВ .
- Исследование пунктата костного мозга . Микроскопия мазка (миелограмма) показывает значительное снижение количества сидеробластов, характерное для гипохромной анемии. Дифференциальная диагностика направлена на исключение других видов железодефицитных состояний - сидеробластной анемии, талассемии .
Лечение
К основным принципам терапии железодефицитной анемии относятся устранение этиологических факторов, коррекция рациона питания, восполнение железодефицита в организме. Этиотропное лечение назначается и проводится специалистами гастроэнтерологами, гинекологами, проктологами и др.; патогенетическое – гематологами . При железодефицитных состояниях показано полноценное питание с обязательным включением в рацион продуктов, содержащих гемовое железо (телятины, говядины, баранины, мяса кролика, печени, языка). Следует помнить, что усилению ферросорбции в ЖКТ способствуют аскорбиновая, лимонная, янтарная кислота. Ингибируют всасывание железа оксалаты и полифенолы (кофе, чай, соевый протеин, молоко, шоколад), кальций, пищевые волокна и др. вещества.
Вместе с тем, даже сбалансированная диета не в состоянии устранить уже развившийся недостаток железа, поэтому больным с гипохромной анемией показана заместительная терапия ферропрепаратами. Препараты железа назначаются курсом не менее 1,5-2-х месяцев, а после нормализации уровня Hb проводится поддерживающая терапия в течение 4-6 недель половинной дозой препарата. Для фармакологической коррекции анемии используются препараты двухвалентного и трехвалентного железа. При наличии витальных показаний прибегают к гемотрансфузионной терапии.
Прогноз и профилактика
В большинстве случаев гипохромная анемия подается успешной коррекции. Однако при неустраненной причине железодефицит может рецидивировать и прогрессировать. Железодефицитная анемия у детей раннего и младшего возраста может вызывать задержку психомоторного и интеллектуального развития (ЗПР). В целях профилактики железодефицита необходим ежегодный контроль параметров клинического анализа крови, полноценное питание с достаточным содержанием железа, своевременная ликвидация источников кровопотери в организме. Следует учитывать, что лучше всего усваивается железо, содержащееся в мясе и печени в форме гема; негемовое железо из растительной пищи практически не усваивается – в этом случае оно сначала должно восстановиться до гемового при участии аскорбиновой кислоты. Лицам групп риска может быть показан профилактический прием железосодержащих препаратов по назначению специалиста.
Железодефицитная анемия (ЖДА) – самая распространённая анемия, и среди всех случаев занимает 80%. Вместе с ней следует скрытый дефицит железа, и его распространённость – около 30% населения по Европе. Самыми главными причинами развития этой анемии являются повышенная потеря железа организмом, недостаточное поступление железа, или повышенная в нём потребность. Самые частые случаи ЖДА бывают у детей, беременных, и женщин репродуктивного возраста.
Иногда бывает путаница, и думают, что железодефицитная анемия и гемолитическая – это одно и то же, но на самом деле это разные заболевания, и гемолитическая анемия – это групповое название редко встречающихся заболеваний, которые имеют общий признак в виде усиленного разрушения эритроцитов в крови.
Клиническая картина железодефицитной анемии делится на признаки тканевого дефицита железа (это носит название сидеропенический синдром), и на обусловленные гемической гипоксией общие симптомы анемии. Сидеропенический синдром, вызванный дефицитом многих ферментов, куда входит железо, имеет такие симптомы:
- Пристрастие к необычным запахам.
- Извращение вкуса (стремление съесть что-то малосъедобное).
- ЖКТ (дисфагия и т.д.)
- Изменение слизистых (трещины в углах рта etc).
- Изменение кожи и её придатков, изменения ногтей.
- Изменения в мышечной системе (ослабляется сфинктер, и появляются позывы на мочеиспускание, иногда ночное недержание, пропускание мочи при кашле и смехе).
- Изменения в половой системе.
- Склонность к тахикардии, гипотонии, сидеропеническая миокардиодистрофия.
- Изменения со стороны иммунитета.
- Изменения в нервной системе (головные боли, шум в ушах, повышенная утомляемость, головокружение, снижение интеллектуальных способностей. Некоторые исследователи связывают нарушение мышления, появление болезни Паркинсона и Альцгеймера, снижение памяти и когнитивных функций с дефицитом железа, так как нарушается миелинизация нервных стволов, что, скорее всего, носит необратимый характер.
- Функциональная недостаточность печени; на фоне гипоксии возможно появление гипогликемии, гипоальбуминемии, гипопротромбинемии.
- Возможно ухудшение внешнего вида зубов (могут выпадать, желтеть, покрываться налётом). В таком случае, пока причина не будет устранена, лечение у стоматолога не будет эффективным.
Общий симптом при анемии такой: ухудшение аппетита, слабость, головокружение, одышка при физической нагрузке, ощущение сердцебиения, повышенная утомляемость, синкопальные состояния, мелькание «мушек» перед глазами при низком артериальном давлении, раздражительность, головные боли (чаще в вечернее время), часто наблюдается умеренное повышение температуры, нередко сонливость днем и плохое засыпание ночью, нервозность, плаксивость, снижение памяти и внимания.
Очень сильное влияние на детскую центральную нервную систему и её развитие оказывает дефицит железа. Дети с его нехваткой отстают в психомоторном развитии, их познавательные способности снижаются, падает внимание, работоспособность. Гемолитическая также снижает иммунитет и неспецифические факторы защиты, повышается заболеваемость ОРВИ и тонзиллитами, аденоидитами, и другими хроническими очагами инфекций.
Если у беременной женщины анализ крови показал железодефицитную анемию, то это значит, что у неё повышенный риск развития осложнений во время родов и беременности, и ещё это оказывает негативный эффект на развитие плода. У беременной женщины увеличивается возможность появления гестоза, послеродовых септических осложнений, повышенной кровопотери в родах, выкидыша, несвоевременного излития околоплодных вод. Сам же плод может перенести внутриутробную гипоксию, анемию, гипотрофию.
Гемолитическая анемия, которую часто путают с железодефицитной, клинически проявляется лимонного оттенка желтухой, уробилинурией, и повышением содержания в крови непрямого билирубина и сывороточного железа.
Стадии железодефицитной анемии
Самая первая стадия – прелатентный дефицит железа; вторая стадия – латентный дефицит; третья – железодефицитная анемия.
Прелатентный дефицит
Основной формой депонирования железа есть – это содержащийся в макрофагах селезёнки, печени, костного мозга, сыворотке крови и эритроцитах водорастворимый гликопротеиновый комплекс, и на этой стадии ЖДА просиходит истощение депо. Клинических признаков нет, диагноз можно установить, лишь взяв анализ.
Латентный дефицит
В случае отсутствия восполнения дефицита железа на прелатентной стадии наступает латентный дефицит железа, и на этой стадии в ткани появляется снижение активности тканевых ферментов, благодаря чему проявляется сидеропенический синдром. К нему относят извращение вкуса, пристрастие к пряной, солёной, острой пище, мышечную слабость и др. На этой стадии в лабораторных показателях будут более выраженные изменения в организме – анализ покажет и снижение содержания железа в белках-переносчиках и сыворотке.
Важным лабораторным показателем есть сывороточное железо. Но делать выводы лишь по его уровню нельзя, так как его уровень колеблется в зависимости от пола, возраста, в течение суток, кроме того, гипохромные анемии могут быть разной этиологии и патогенетических уровней механизмов развития, и здесь будет совсем другое лечение.
Третья стадия – ЖДА
Выраженные клинические проявления, объединяющие два предыдущие синдрома. Клинические проявления происходят из-за кислородного голодания тканей, и обнаруживаются в виде шума в ушах, тахикардии, обморочных состояний, головокружения, астенического синдрома и т.д. Теперь анализ крови покажет изменения и в общем анализе, и в характеризующих обмен железа показателях.
Анализ крови
Общий анализ крови при ЖДА покажет пониженный уровень эритроцитов и гемоглобина; также, если есть железодефицитная и гемолитическая анемия, будут зарегистрированы изменения морфологических характеристик эритроцитарных индексов и эритроцитов.
Биохимический анализ крови в случае ЖДА покажет повышение ОЖСС, уменьшение концентрации сывороточного ферритина, уменьшение насыщения железом трансферрина, уменьшение концентрации сывороточного железа.
Дифференциальная диагностика при постановке диагноза ЖДА обязательна, нужно проводить дифференциальный диагноз с другими гипохромными анемиями.
Сейчас достаточно частой патологией есть железораспределительные анемии (второе место среди анемий после ЖДА). Она бывает при острых и хронических инфекционно-воспалительных заболеваниях, ревматоидном артрите, сепсисе, болезнях печени, туберкулёзе, онкологических заболеваниях, ИБС и т.д. Основным отличием этой анемии от ЖДА являются: сывороточное железо в пределах нормы или умеренно сниженное, сыворотки (что означает повышенное содержание железа в депо), ОЖСС в пределах нормы или сниженный.
Лечение анемии
Если ваш анализ крови показал именно ЖДА, то вам предстоит длительный приём внутрь в умеренных дозах препаратов двухвалентного железа, и, хоть улучшение самочувствия наступит довольно скоро, существенный прирост гемоглобина начнётся через 4-6 недель.
Доктора назначают какой-либо препарат двухвалентного железа (часто сульфат железа), и лучше всего его принимать в пролонгированной лекарственной форме, несколько месяцев в средней лечебной дозе. Потом доза уменьшается до минимальной, и снова принимается несколько месяцев, и, если причина болезни не будет устранена, многие годы придётся продолжать поддерживающий приём минимальной дозы неделю.