Свёртывание крови - это важнейший этап работы системы гемостаза , отвечающий за остановку кровотечения при повреждении сосудистой системы организма. Совокупность взаимодействующих между собой весьма сложным образом различных факторов свёртывания крови образует систему свёртывания крови .
Свёртыванию крови предшествует стадия первичного сосудисто-тромбоцитарного гемостаза. Этот первичный гемостаз почти целиком обусловлен сужением сосудов и механической закупоркой агрегатами тромбоцитов места повреждения сосудистой стенки. Характерное время для первичного гемостаза у здорового человека составляет 1-3 минуты . Собственно свёртыванием крови (гемокоагуляция, коагуляция, плазменный гемостаз, вторичный гемостаз) называют сложный биологический процесс образования в крови нитей белка фибрина , который полимеризуется и образует тромбы, в результате чего кровь теряет текучесть, приобретая творожистую консистенцию. Свёртывание крови у здорового человека происходит локально, в месте образования первичной тромбоцитарной пробки. Характерное время образования фибринового сгустка - около 10 минут . Свёртывание крови - ферментативный процесс.
Основоположником современной физиологической теории свёртывания крови является Александр Шмидт . В научных исследованиях XXI века , проведённых на базе Гематологического научного центра под руководством Атауллаханова Ф. И. , было убедительно показано , что свёртывание крови представляет собой типичный автоволновой процесс , в котором существенная роль принадлежит эффектам бифуркационной памяти .
Энциклопедичный YouTube
-
1 / 5
Процесс гемостаза сводится к образованию тромбоцитарно-фибринового сгустка. Условно его разделяют на три стадии :
- временный (первичный) спазм сосудов;
- образование тромбоцитарной пробки за счёт адгезии и агрегации тромбоцитов;
- ретракция (сокращение и уплотнение) тромбоцитарной пробки.
Повреждение сосудов сопровождается немедленной активацией тромбоцитов. Адгезия (прилипание) тромбоцитов к волокнам соединительной ткани по краям раны обусловлена гликопротеином фактором Виллебранда . Одновременно с адгезией наступает агрегация тромбоцитов: активированные тромбоциты присоединяются к повреждённым тканям и к друг другу, формируя агрегаты, преграждающие путь потере крови. Появляется тромбоцитарная пробка .
Из тромбоцитов, подвергшихся адгезии и агрегации, усиленно секретируются различные биологически активные вещества (АДФ, адреналин, норадреналин и другие), которые приводят к вторичной, необратимой агрегации. Одновременно с высвобождением тромбоцитарных факторов происходит образование тромбина , который воздействует на фибриноген с образованием сети фибрина, в которой застревают отдельные эритроциты и лейкоциты – образуется так называемый тромбоцитарно-фибриновый сгусток (тромбоцитарная пробка). Благодаря контрактильному белку тромбостенину тромбоциты подтягиваются друг к другу, тромбоцитарная пробка сокращается и уплотняется, наступает её ретракция .
Процесс свёртывания крови
Процесс свёртывания крови представляет собой преимущественно проферментно-ферментный каскад, в котором проферменты, переходя в активное состояние, приобретают способность активировать другие факторы свёртывания крови . В самом простом виде процесс свёртывания крови может быть разделён на три фазы:
- фаза активации включает комплекс последовательных реакций, приводящих к образованию протромбиназы и переходу протромбина в тромбин;
- фаза коагуляции - образование фибрина из фибриногена;
- фаза ретракции - образование плотного фибринового сгустка.
Данная схема была описана ещё в 1905 году Моравицем и до сих пор не утратила своей актуальности .
В области детального понимания процесса свёртывания крови с 1905 года произошёл значительный прогресс. Открыты десятки новых белков и реакций, участвующих в процессе свёртывания крови, который имеет каскадный характер. Сложность этой системы обусловлена необходимостью регуляции данного процесса.
Современное представление с позиций физиологии каскада реакций, сопровождающих свёртывание крови, представлено на рис. 2 и 3. Вследствие разрушения тканевых клеток и активации тромбоцитов высвобождаются белки фосфолипопротеины, которые вместе с факторами плазмы X a и V a , а также ионами Ca 2+ образуют ферментный комплекс, который активирует протромбин. Если процесс свёртывания начинается под действием фосфолипопротеинов, выделяемых из клеток повреждённых сосудов или соединительной ткани , речь идёт о внешней системе свёртывания крови (внешний путь активации свёртывания, или путь тканевого фактора). Основными компонентами этого пути являются 2 белка: фактор VIIа и тканевый фактор, комплекс этих 2 белков называют также комплексом внешней теназы.
Если же инициация происходит под влиянием факторов свёртывания, присутствующих в плазме, используют термин внутренняя система свёртывания . Комплекс факторов IXа и VIIIa, формирующийся на поверхности активированных тромбоцитов, называют внутренней теназой. Таким образом, фактор X может активироваться как комплексом VIIa-TF (внешняя теназа), так и комплексом IXa-VIIIa (внутренняя теназа). Внешняя и внутренняя системы свёртывания крови дополняют друг друга .
В процессе адгезии форма тромбоцитов меняется - они становятся округлыми клетками с шиповидными отростками. Под влиянием АДФ (частично выделяется из повреждённых клеток) и адреналина способность тромбоцитов к агрегации повышается. При этом из них выделяются серотонин , катехоламины и ряд других веществ. Под их влиянием происходит сужение просвета повреждённых сосудов, возникает функциональная ишемия . В конечном итоге сосуды перекрываются массой тромбоцитов, прилипших к краям коллагеновых волокон по краям раны .
На этой стадии гемостаза под действием тканевого тромбопластина образуется тромбин . Именно он инициирует необратимую агрегацию тромбоцитов. Реагируя со специфическими рецепторами в мембране тромбоцитов, тромбин вызывает фосфорилирование внутриклеточных белков и высвобождение ионов Ca 2+ .
При наличии в крови ионов кальция под действием тромбина происходит полимеризация растворимого фибриногена (см. фибрин) и образование бесструктурной сети волокон нерастворимого фибрина. Начиная с этого момента в этих нитях начинают фильтроваться форменные элементы крови, создавая дополнительную жёсткость всей системе, и через некоторое время образуя тромбоцитарно-фибриновый сгусток (физиологический тромб), который закупоривает место разрыва, с одной стороны, предотвращая потерю крови, а с другой - блокируя поступление в кровь внешних веществ и микроорганизмов. На свёртывание крови влияет множество условий. Например, катионы ускоряют процесс, а анионы - замедляют. Кроме того, существуют вещества как полностью блокирующие свёртывание крови (гепарин , гирудин и другие), так и активирующие его (яд гюрзы, феракрил).
Врождённые нарушения системы свёртывания крови называют гемофилией .
Методы диагностики свёртывания крови
Все многообразие клинических тестов свёртывающей системы крови можно разделить на две группы :
- глобальные (интегральные, общие) тесты;
- «локальные» (специфические) тесты.
Глобальные тесты характеризуют результат работы всего каскада свёртывания. Они подходят для диагностики общего состояния свёртывающей системы крови и выраженности патологий, с одновременным учётом всех привходящих факторов влияний. Глобальные методы играют ключевую роль на первой стадии диагностики: они дают интегральную картину происходящих изменений в свёртывающей системе и позволяют предсказывать тенденцию к гипер- или гипокоагуляции в целом. «Локальные» тесты характеризуют результат работы отдельных звеньев каскада свёртывающей системы крови, а также отдельных факторов свёртывания. Они незаменимы для возможного уточнения локализации патологии с точностью до фактора свёртывания. Для получения полной картины работы гемостаза у пациента врач должен иметь возможность выбирать, какой тест ему необходим.
Глобальные тесты :
- определение времени свёртывания цельной крови (метод Мас-Магро или Метод Моравица);
- тест генерации тромбина (тромбиновый потенциал, эндогенный тромбиновый потенциал);
«Локальные» тесты :
- активированное частичное тромбопластиновое время (АЧТВ);
- тест протромбинового времени (или протромбиновый тест, МНО, ПВ);
- узкоспециализированные методы для выявления изменений в концентрации отдельных факторов.
Все методы, измеряющие промежуток времени с момента добавления реагента (активатора, запускающего процесс свёртывания) до формирования фибринового сгустка в исследуемой плазме, относятся к клоттинговым методам (от англ. сlot - сгусток).
Примеры нарушений свёртывания крови:
См. также
Примечания
- Атауллаханов Ф.И. , Зарницына В. И. , Кондратович А. Ю. , Лобанова Е. С. , Сарбаш В. И. Особый класс автоволн - автоволны с остановкой - определяет пространственную динамику свертывания крови (рус.) // УФН: журнал. - 2002. - Т. 172 , № 6 . - С. 671-690 . -
Кровь – это соединительная ткань, которая находится в жидком состоянии. Циркулирует она по замкнутому кругу в системе кровеносных сосудов. Включает форменные клетки (лейкоциты, эритроциты, тромбоциты) и жидкое вещество – плазму.
Что такое гемокоагуляция и ее функции
Свертывание крови – процесс сложный, протекающий поэтапно. Относится гемокоагуляция к числу важных реакций, защищающих организм от кровопотерь в случае повреждения стенки сосуда, а значит, и от гибели. Свертывание – это переход крови из жидкого состояния в желеобразное. В результате происходит образование тромба. При плохой свертываемости есть опасность погибнуть от кровотечения даже при не слишком тяжелых ранениях.
В этом процессе участвуют кровеносные сосуды, ткани, которыми они окружены, активные вещества плазмы, а также форменные клетки крови, при этом безъядерным пластинкам (тромбоцитам) отводится в свертывании крови главная роль.
Как быстро происходит гемокоагуляция?
При нормальной свертываемости процесс начинается практически сразу после повреждения сосуда. Приблизительное время свертывания крови – 5-7 минут. За это время в норме тромб должен полностью сформироваться. Есть заболевание, а именно гемофилия, при которой гемокоагуляции не происходит. Кроме этого, ухудшается она на холоде, а также от воздействия гирудина, гепарина, фибринолизина, лимоннокислого натрия и калия.
Процесс гемостаза защищает организм от кровопотерь при повреждении тканей и сосудов
Система свертывания крови
Система включает активные элементы, или факторы свертывания крови. Вещества, находящиеся в плазме, относятся к группе белков и непосредственно участвуют в процессе гемокоагуляции. Их называют плазменными факторами и обозначают римскими цифрами. Вырабатываются они в организме неактивными, когда активируются, то к римской цифре добавляют букву «a». К нескольким из них добавлено имя больного, у которого впервые была выявлена нехватка этого вещества. Среди них следующие факторы:
- I – фибриноген. Образуется в печени, а также в селезенке, костном мозге, лимфоузлах. Преобразуется в нерастворимый белок фибрин при участии тромбина.
- II – протромбин. Если его содержание составляет менее 40 процентов от нормы, скорость гемостаза понижается.
- III – тканевый тромбопластин. Содержится неактивным в разных тканях организма. Участвует в формировании протромбиназы, с помощью которой протромбин превращается в тромбин.
- IV – ионы кальция. Участвуют во всех трех фазах гемокоагуляции. При отсутствии слипание тромбоцитов и ретракция сгустка нарушаются.
- V – AC-глобулин. Синтезируется в печени, быстро разрушается. Необходимая концентрация для свертывания – не менее 10%.
- VI – исключен из списка.
- VII – проконвертин. Производится в печени с участием витамина K. Активируется в самой первой фазе, во время свертывания не расходуется, остается в сыворотке крови. Уровень для гемостаза должен составлять не менее 5%.
- VIII – антигемофильный глобулин A. Вырабатывается в печени, селезенке, почках, лейкоцитах, клетках эндотелия. Усиливает влияние фактора IX на фактор X. Необходимая концентрация – около 35%.
- IX – фактор Кристмаса. Образуется в печени, при этом необходимо участие витамина K. Долго сохраняется в крови (сыворотке и плазме). Свертывание крови происходит, если его уровень не менее 20%.
- X – Стюарта – Прауэра. Вырабатывается неактивным в печени с участием витамина K. Минимальная концентрация для гемостаза – 10-20 процентов.
- XI – антигемофильный глобулин C. Образуется в печени, становится активным под действием факторов XII, Флетчера, Фитцджеральда и активирует фактор IX.
- XII – Хагемана (фактор контактный). Синтезируется неактивным в печени. Свертывание происходит, даже если его уровень составляет всего 1%.
- XIII – фибриназа, или фибринстабилизирующий фактор. В плазме крови находится в соединении с фибриногеном. Активируется при участии тромбина. Для гемостаза достаточно 5 %.
- XIV – Флетчера, или прокалликреин. Производится в печени, для свертывания достаточно 1%.
- XV – Фитцджеральда – Фложе. Необходимая концентрация – 1%.
Недостаточная активность факторов приводит к плохой свертываемости крови и кровотечениям. Это может произойти при недостатке витамина K, болезнях печени, при нарушении всасывания жиров в кишечнике, сниженном образовании желчи, генетических заболеваниях, таких как гемофилия, при которой кровь не свертывается. Витамин K нужен для выработки II, VII, IX и X факторов. Он содержится в продуктах растительного происхождения, их всасывание происходит в кишечнике.
При свертывании крови необходимы активные вещества, находящиеся в тромбоцитах. Они носят название тромбоцитарных (пластинчатых) факторов и обозначаются арабскими цифрами. К ним относятся следующие:
- акцелератор-глобулин;
- акцелератор тромбина (влияет на скорость превращения фибриногена);
- тромбоцитарный тромбопластин;
- антигепариновый;
- свертываемый;
- тромбостенин;
- котромбопластин тромбоцитарный;
- антифибринолизин;
- фибриностабилизирующий;
- серотонин;
- АДФ (аденозиндифосфат).
Механизм гемокоагуляции
В свертывании крови задействовано два механизма. Если сосуды мелкие, происходит процесс сосудисто-тромбоцитарный. В этом случае идет образование сгустка тромбоцитарного. Время его образования составляет от 1 до 5 минут.

Во время кровотечения в сосуде формируется волокнистое вещество – фибрин. В его нити попадают кровяные элементы, и образуется тромбВ случае, если поврежден сосуд крупный, первый механизм не подходит. Пробка тромбоцитарная не может выдержать повышенного давления, поэтому необходимо образование сгустка более надежного – фибринового. Вот почему в данном случае механизм задействуется другой – коагуляционный.
Запускается процесс свертывания крови, когда повреждается сосуд и начинаются изменения (физико-химические) плазменного белка фибриногена. В ходе этой цепной реакции активация факторов свертывания, а также формирование комплексов с участием ионов кальция осуществляется последовательно. В результате под действием тромбина фибриноген растворимый преобразуется в нерастворимый. Так появляется волокнистое вещество – фибрин, выпадающий в форме нитей. Будучи тонкими и длинными, они образуют сети, в них попадают форменные клетки крови, таким образом появляется тромб.
Было создано несколько теорий о свертывании крови. В наше время признана теория Шмидта, согласно которой процесс проходит в три стадии.
Фаза первая
Она является наиболее длительной и сложной. Время ее продолжения – примерно 5-10 минут. На этой стадии идет формирование протромбиназы, под воздействием которой становится активным плазменный белок протромбин. Задействуются факторы, как кровяные, так и тканевые. Во время повреждения сосудистых стенок и близлежащих тканей начинает формироваться тромбопластин тканевый. Этот процесс проходит при взаимодействии плазменных факторов с выделяющимися при повреждении тканей веществами. При разрушении пластинок крови начинает образовываться протромбиназа (тромбопластин) кровяная. Это обусловлено сложным взаимодействием и тромбоцитарных факторов, и плазменных с выделяющимися в результате разрушения веществами.
Фаза вторая
На этом этапе происходит переход протромбина в активно действующий тромбин.
Фаза третья
Эта стадия завершающая. Растворимый фибриноген преобразуется в нерастворимый. Сначала с помощью тромбина формируется фибрин-мономер, после чего с участием ионов Ca² получается растворимый фибрин-полимер. С помощью фактора XIII образуется стойкий к расщеплению фибрин-полимер нерастворимый. Он имеет вид нитей. На них и оседают кровяные элементы, в том числе и красные клетки. Таким образом формируется сгусток, закрывающий рану.
Тромбостенин – белок в тромбоцитах – и ионы Ca² уплотняют тромб, который закрепляется в сосуде. Благодаря этому процессу (ретракции) за два-три часа сгусток уменьшается почти наполовину и происходит отжатие плазмы, в которой фибриноген отсутствует. Сгусток уплотняется, рана стягивается. Вместе с ретракцией запускается такой процесс, как фибринолиз, или растворение сгустка. После этого происходит закрытие просвета сосуда. Если невозможно расщепление пробки, она замещается соединительной тканью.
Заключение
Процесс гемокоагуляции – очень важная реакция организма на повреждение кровеносных сосудов, помогающая избежать значительных кровопотерь. При нормальной свертываемости крови проходит достаточно быстро и занимает не более 10 минут. Одновременно со свертывающей системой в крови действует и противосвертывающая, которая препятствует тому, чтобы свертывание происходило внутри сосуда.
Свертывание крови - переход из жидкого состояния в желеобразный сгусток - является биологически важной защитной реакцией организма, препятствующей кровопотере.
На месте ранения мелкого кровеносного сосуда создается кровяной сгусток - тромб, являющийся как бы пробкой, которая закупоривает сосуд и прекращает дальнейшее кровотечение. При уменьшении способности крови к свертыванию даже незначительные ранения могут вызвать смертельное кровотечение.
Выпущенная из сосудов кровь человека начинает свертываться через 3-4 минуты, а через 5-6 минут полностью превращается в студенистый сгусток. При повреждении внутренней оболочки (интимы) кровеносных сосудов и при повышенной свертываемости крови может происходить свертывание крови и внутри кровеносных сосудов в целом организме. В этом случае тромб образуется внутри сосуда.
В основе свертывания крови лежит изменение физико-химического состояния содержащегося в плазме белка - фибриногена. Последний переходит из растворимой формы в нерастворимую, превращаясь в фибрин и образуя сгусток.
Фибрин выпадает в виде длинных тонких нитей, образуя сети, в петлях которых задерживаются форменные элементы. Если же выпускаемую из сосуда кровь взбивать метелочкой, то на метелочке остается большая часть образующегося фибрина. Хорошо отмытый от эритроцитов фибрин имеет белый цвет и волокнистое строение.
Кровь, из которой таким образом удален фибрин, называют дефибринированной. Она состоит из форменных элементов и кровяной сыворотки. Следовательно, сыворотка крови отличается по своему составу от плазмы отсутствием фибриногена.
Сыворотку можно отделить от кровяного сгустка, если оставить на некоторое время пробирку со свернувшейся кровью. При этом сгусток крови в пробирке уплотняется, стягивается и из него отжимается некоторое количество сыворотки.
Рис. 2. Схема свертывания крови.
Свертываться способна не только цельная кровь, но и плазма. Если отделить центрифугированием плазму от форменных элементов на холоду, который препятствует свертыванию крови, а затем плазму согреть до 20-35°, то она быстро свернется.
Для объяснения механизма свертывания крови был предложен ряд теорий. В настоящее время общим признанием пользуется ферментативная теория свертывания крови, основы которой заложены почти столетие назад А. Шмидтом.
Согласно этой теории, конечным звеном свертывания является переход растворенного в плазме фибриногена в нерастворимый фибрин под влиянием фермента тромбина (рис. 2, стадия III).
Тромбина в циркулирующей крови нет. Он образуется из белка плазмы крови - протромбина, синтезируемого печенью. Для образования тромбина необходимо взаимодействие протромбина с тромбопластином, которое должно происходить в присутствии ионов кальция (рис. 2, стадия II).
Тромбопластина в циркулирующей крови также нет. Он образуется при разрушении кровяных пластинок (кровяной тромбопластин) или при повреждении тканей (тканевой тромбопластин).
Образование кровяного тромбопластина начинается с разрушения кровяных пластинок и взаимодействия выделяющихся при этом веществ с имеющимся в плазме крови глобулином - фактором V (другое его название глобулин-акцелератор) и с другим глобулином плазмы крови - так называемым антигемофилическим глобулином (другое его название тромбопластиноген), а также еще с одним веществом плазмы крови - так называемым плазменным компонентом тромбопластина (другое его название фактор Кристмаса). Кроме того, для образования кровяного тромбопластина необходимо также присутствие ионов кальция (см. рис. 2, стадия I, слева).
Образование тканевого тромбопластина происходит при взаимодействии веществ, выделяющихся из разрушенных клеток тканей, с уже упомянутым глобулином плазмы крови - фактором V, а также с глобулином плазмы крови - фактором VII (другое его название проконвертин) и тоже обязательно в присутствии ионов кальция (рис. 2, стадия I, справа). После возникновения тромбопластина быстро начинается процесс свертывания крови.
Приведенная схема является далеко не полной, так как в действительности в процессе свертывания крови принимают участие значительно больше разных веществ.
При отсутствии в крови упомянутого выше антигемофилического глобулина, принимающего участие в образовании тромбопластина, возникает заболевание - гемофилия, характеризующееся резко пониженной свертываемостью крови. При гемофилии даже небольшое ранение может привести к опасной кровопотере.
Разработаны химические методы извлечения из плазмы тромбина и получения его в больших количествах (Б. А. Кудряшов). Этот препарат значительно ускоряет свертывание крови. Так, оксалатная кровь, в которой тромбин не образуется вследствие осаждения кальция, после прибавления тромбина свертывается в пробирке в течение 2-3 секунд. Если при ранении органа (например, печени, селезенки, мозга) кровотечение нельзя остановить перевязкой сосудов, то накладывание на их поверхность марли, смоченной раствором тромбина, быстро прекращает кровотечение.
После перехода фибриногена в фибрин образовавшийся сгусток уплотняется, стягивается, иначе говоря, происходит его ретракция. Этот процесс совершается под влиянием вещества, называемого ретрактозимом, освобождающегося при распаде кровяных пластинок. В экспериментах на кроликах показано, что при резком уменьшении количества кровяных пластинок свертывание крови может произойти, но уплотнения сгустка не наступает, и он остается рыхлым, не обеспечивая хорошего закрытия поврежденного кровеносного сосуда.
Свертываемость крови изменяется под влиянием нервной системы. Свертывание ускоряется при болевых раздражениях. Повышение свертываемости крови при этом препятствует кровопотере. При раздражении верхнего шейного симпатического узла время свертывания крови укорачивается, а при удалении его - удлиняется.
Свертывание крови может также изменяться условнорефлекторно. Так, если какой-либо сигнал многократно сочетается с болевым раздражением, то затем при действии только одного сигнала, который прежде не оказывал никакого влияния на свертывание крови, этот процесс ускоряется. Можно думать, что при раздражении нервной системы в организме образуются какие-то вещества, ускоряющие свертывание крови. Известно, например, что адреналин, выделение которого из надпочечников стимулируется нервной системой и увеличивается при болевых раздражениях и эмоциональных состояниях, повышает свертываемость крови. Одновременно с этим адреналин суживает артерии и артериолы и тем способствует также уменьшению кровотечения при ранении кровеносных сосудов. Приспособительное значение этих фактов ясно.
Ряд физических факторов и химических соединений тормозит свертывание крови. В связи с этим следует в первую очередь отметить действие холода, который значительно замедляет процесс свертывания крови.
Свертывание крови замедляется также, если кровь поместить в стеклянный сосуд, стенки которого покрыты парафином или силиконом, после чего они не смачиваются кровью. В таком сосуде кровь может оставаться жидкой в течение нескольких часов. В этих условиях в значительной мере затрудняется разрушение кровяных пластинок и выход в кровь содержащихся в них веществ, участвующих в образовании тромбина.
Свертыванию крови препятствуют щавелевокислые и лимоннокислые соли. При добавлении к крови лимоннокислого натрия происходит связывание ионов кальция; щавелевокислый аммоний вызывает выпадение кальция в осадок. И в том, и в другом случае становится невозможным образование тромбопластина и тромбина. Оксалаты и цитраты применяются только для предотвращения свертывания крови вне организма. Их нельзя в больших количествах вводить в организм, так как связывание кальция крови в организме вызывает тяжелые нарушения жизнедеятельности.
Некоторые вещества, их называют антикоагулянтами, полностью устраняют возможность свертывания крови. К их числу относятся гепарин, выделяемый из ткани легких и печени, и гирудин, выделяемый из слюнных желез пиявки. Гепарин препятствует действию тромбина на фибриноген, а также угнетает активность тромбопластина. Гирудин действует угнетающе на третью стадию процесса свертывания крови, т. е. препятствует образованию фибрина.
Имеются также антикоагулянты так называемого непрямого действия. Не влияя непосредственно на процесс свертывания крови, они угнетают образование веществ, участвующих в этом процессе. Сюда относятся полученные синтетически препараты - дикумарин, пелентан и др., блокирующие синтез в печени протромбина и фактора VII.
В составе белков сыворотки обнаружено еще одно вещество - фибринолизин, растворяющее образовавшийся фибрин. Это вещество представляет собой фермент, находящийся в плазме крови в неактивной форме. Его предшественник профибринолизин активируется фибринокиназой, содержащейся во многих тканях тела.
Из всего изложенного следует, что в крови имеются одновременно две системы: свертывающая и противосвертывающая. В норме они находятся в определенном равновесии, что препятствует процессам внутрисосудистого свертывания крови. Это равновесие нарушается при некоторых заболеваниях и ранениях.
Значение физиологической противосвертывающей системы показано в опытах Б. А. Кудряшова. Если животному быстро ввести в вену достаточное количество тромбина, то наступает смерть вследствие внутрисосудистого свертывания крови. Если такую же смертельную дозу тромбина вводить в организм медленно, то животное не гибнет, но его кровь в значительной мере теряет способность к свертыванию.
Это позволило сделать вывод, что введение тромбина вызывает в организме появление веществ, препятствующих свертыванию крови. Выделение этих веществ регулируется нервной системой. Если денервировать у крысы одну лапу и медленно вводить ей в вену тромбин, то кровь свернется только в сосудах денервированной лапы. Считают, что повышение уровня тромбина в сосудистом русле вызывает рефлекторно выделение стенкой сосуда веществ, препятствующих свертыванию. Перерезка нервов, а также воздействие наркотических веществ подавляют этот рефлекс.
Процесс свертывания крови начинается с кровопотери, но массивная кровопотеря, сопровождающаяся падением артериального давления, ведет к резким изменениям всей системы гемостаза.
Система свертывания крови (гемостаза)
Система свертывания крови — это сложный многокомпонентный комплекс гомеостаза человека, обеспечивающий сохранение целостности организма благодаря постоянному поддержанию жидкого состояния крови и формированию при необходимости различного типа тромбов, а также активации процессов заживления в местах сосудистых и тканевых повреждений.
Функционирование системы свертывания обеспечивается непрерывным взаимодействием сосудистой стенки и циркулирующей крови. Известны определенные компоненты, отвечающие за нормальную деятельность коагулологической системы:
- эндотелиальные клетки сосудистой стенки,
- тромбоциты,
- адгезивные молекулы плазмы,
- плазменные факторы свертывания,
- системы фибринолиза,
- системы физиологических первичных и вторичных антикоагулянтов-антипротеаз,
- плазменная система физиологических первичных репарантов-заживителей.
Любые повреждения сосудистой стенки, «травмирование крови», с одной стороны, приводят к различной тяжести кровотечениям, а с другой - вызывают физиологические, а в последующем патологические изменения в системе гемостаза, которые способны сами по себе привести к гибели организма. К закономерным тяжелым и частым осложнениям массивной кровопотери относится острый синдром диссеминированного внутрисосудистого свертывания (острый ДВС-синдром).
При острой массивной кровопотере, а ее нельзя представить без повреждения сосудов, практически всегда имеет место локальный (в месте повреждения) тромбоз, который в сочетании с падением артериального давления может запустить острый ДВС-синдром, являющийся важнейшим и патогенетически наиболее неблагоприятным механизмом всех бед острой массивной кровопотери.
Эндотелиальные клетки
Эндотелиальные клетки сосудистой стенки обеспечивают поддержание жидкого состояния крови, непосредственно влияя на многие механизмы и звенья тромбообразования, полностью блокируя или эффективно сдерживая их. Сосуды обеспечивают ламинарность тока крови, что препятствует склеиванию клеточных и белковых компонентов.
Эндотелий несет на своей поверхности отрицательный заряд, как и циркулирующие в крови клетки, различные гликопротеины и другие соединения. Одноименно заряженные эндотелий и циркулирующие элементы крови отталкиваются, что препятствует слипанию клеток и белковых структур в циркуляторном русле.
Поддержание жидкого состояния крови
Поддержанию жидкого состояния крови способствуют:
- простациклин (PGI 2),
- NO и АДФаза,
- ингибитор тканевого тромбопластина,
- глюкозаминогликаны и, в частности, гепарин, антитромбин III, кофактор гепарина II, тканевой активатор плазминогена и др.
Простациклин
Блокада агглютинации и агрегации тромбоцитов в кровотоке осуществляется несколькими путями. Эндотелий активно вырабатывает простагландин I 2 (PGI 2), или простациклин, который ингибирует формирование первичных агрегатов тромбоцитов. Простациклин способен «разбивать» ранние агглютинаты и агрегаты тромбоцитов, вместе с тем являясь вазодилататором.
Окись азота (NO) и АДФаза
Дезагрегация тромбоцитов и вазодилатация осуществляются также путем выработки эндотелием окиси азота (NO) и так называемой АДФазы (фермента, расщепляющего аденозиндифосфат — АДФ) — соединения, вырабатываемого различными клетками и являющегося активным агентом, стимулирующим агрегацию тромбоцитов.
Система протеина С
Сдерживающее и ингибирующее влияние на свертывающую систему крови, преимущественно на ее внутренний путь активации, оказывает система протеина С. В комплекс этой системы входят:
- тромбомодулин,
- протеин С,
- протеин S,
- тромбин как активатор протеина С,
- ингибитор протеина С.
Эндотелиальные клетки вырабатывают тромбомодулин, который при участии тромбина активирует протеин С, переводя его соответственно в протеин Ca. Активированный протеин Са при участии протеина S инактивирует факторы Va и VIIIa, подавляя и ингибируя внутренний механизм свертывающей системы крови. Кроме того, активированный протеин Са стимулирует активность системы фибринолиза двумя путями: за счет стимуляции выработки и выброса из эндотелиальных клеток в кровоток тканевого активатора плазминогена, а также благодаря блокаде ингибитора тканевого активатора плазминогена (PAI-1).
Патология системы протеина С
Нередко наблюдаемая наследственная или приобретенная патология системы протеина С приводит к развитию тромботических состояний.
Фульминантная пурпура
Гомозиготный дефицит протеина С (фульминантная пурпура) — крайне тяжелая патология. Дети с фульминантной пурпурой практически нежизнеспособны и погибают в раннем возрасте от тяжелых тромбозов, острого ДВС-синдрома и сепсиса.
Тромбозы
Гетерозиготный наследственный дефицит протеина С или протеина S способствует возникновению тромбозов у молодых. Чаще наблюдаются тромбозы магистральных и периферических вен, тромбоэмболии легочной артерии, ранние инфаркты миокарда, ишемические инсульты. У женщин с дефицитом протеина С или S, принимающих гормональные контрацептивы, риск тромбозов (чаше тромбозов мозговых сосудов) возрастает в 10-25 раз.
Поскольку протеины С и S являются витамин К-зависимыми протеазами, вырабатываемыми в печени, лечение тромбозов непрямыми антикоагулянтами типа синкумара или пелентана у пациентов с наследственным дефицитом протеина С или S может приводить к усугублению тромботического процесса. Кроме того, у ряда больных при проведении лечения непрямыми антикоагулянтами (варфарином) могут развиваться периферические некрозы кожи («варфариновые некрозы »). Их появление практически всегда означает наличие гетерозиготною дефицита протеина С, что ведет к снижению фибринолитической активности крови, локальной ишемии и кожным некрозам.
V фактор Leiden
Еще одна патология, напрямую связанная с функционированием системы протеина С, получила название наследственной резистентности к активированному протеину С, или V фактор Leiden. По сути V фактор Leiden представляет собой мутантный V фактор с точечной заменой аргинина в 506-й позиции фактора V на глутамин. V фактор Leiden обладает повышенной резистентностью к прямому действию активированного протеина С. Если наследственный дефицит протеина С у пациентов преимущественно с венозными тромбозами встречается в 4-7% случаев, то V фактор Leiden, по данным разных авторов, - в 10-25%.
Ингибитор тканевого тромбопластина
Эндотелий сосудов также может ингибировать тромбообразование при активации . Эндотелиальные клетки активно вырабатывают ингибитор тканевого тромбопластина, который инактивирует комплекс тканевый фактор — фактор VIIa (ТФ-VIIa), что приводит к блокаде внешнего механизма свертывания крови, активизирующегося при попадании тканевого тромбопластина в кровоток, тем самым поддерживая текучесть крови в циркуляторном русле.
Глюкозаминогликаны (гепарин, антитромбин III, кофактор гепарина II)
Другой механизм поддержания жидкого состояния крови связан с выработкой эндотелием различных глюкозаминогликанов, среди которых известны гепаран- и дерматан-сульфат. Эти глюкозаминогликаны по строению и функциям близки к гепаринам. Вырабатываемый и выбрасываемый в кровоток гепарин связывается с циркулирующими в крови молекулами антитромбина III (AT III), активируя их. В свою очередь активированный AT III захватывает и инактивирует фактор Ха, тромбин и ряд других факторов свертывающей системы крови. Кроме механизма инактивации свертывания, осуществляющегося через АТ III, гепарины активируют так называемый кофактор гепарина II (КГ II). Активированный КГ II, как и AT III, ингибирует функции фактора Ха и тромбина.
Кроме влияния на активность физиологических антикоагулянтов-антипротеаз (AT III и КГ II), гепарины способны модифицировать функции таких адгезивных молекул плазмы, как фактор Виллебранда и фибронектин. Гепарин снижает функциональные свойства фактора Виллебранда, способствуя уменьшению тромботического потенциала крови. Фибронектин в результате гепариновой активации связывается с различными объектами-мишенями фагоцитоза — клеточными мембранами, тканевым детритом, иммунными комплексами, фрагментами коллагеновых структур, стафилококками и стрептококками. Вследствие стимулированных гепарином опсонических взаимодействий фибронектина активизируется инактивация мишеней фагоцитоза в органах макрофагальной системы. Очистка циркуляторного русла от объектов-мишеней фагоцитоза способствует сохранению жидкого состояния и текучести крови.
Кроме того, гепарины способны стимулировать выработку и выброс в циркуляторное русло ингибитора тканевого тромбопластина, что существенно снижает вероятность тромбоза при внешней активации свертывающей системы крови.
Процесс свертывания крови — тромбообразования
Вместе с описанным выше существуют механизмы, также связанные с состоянием сосудистой стенки, но не способствующие поддержанию жидкого состояния крови, а ответственные за ее свертывание.
Процесс свертывания крови начинается с повреждения целостности сосудистой стенки. При этом различают и внешний механизмы процесса формирования тромба.
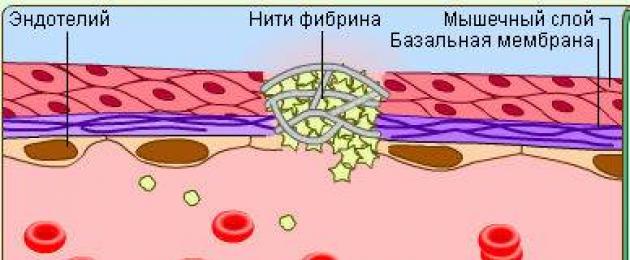
При внутреннем механизме повреждение только эндотелиального слоя сосудистой стенки приводит к тому, что поток крови контактирует со структурами субэндотелия — с базальной мембраной, в которой основными тромбогенными факторами являются коллаген и ламинин. С ними взаимодействуют находящиеся в крови фактор Виллебранда и фибронектин; формируется тромбоцитарный тромб, а затем — фибриновый сгусток.
Необходимо отметить, что тромбы, формирующиеся в условиях быстрого кровотока (в артериальной системе), могут существовать практически только при участии фактора Виллебранда. Напротив, в формировании тромбов при относительно небольших скоростях кровотока (в микроциркуляторном русле, венозной системе) участвуют как фактор Виллебранда, так и фибриноген, фибронектин, тромбоспондин.
Другой механизм тромбообразования осуществляется при непосредственном участии фактора Виллебранда, который при повреждении целостности сосудов существенно увеличивается в количественном отношении вследствие поступления из телец Вейбола-Паллада эндотелия.
Системы и факторы свертывания крови
Тромбопластин
Важнейшую роль во внешнем механизме тромбообразования играет тканевый тромбопластин, поступающий в кровоток из интерстициального пространства после разрыва целостности сосудистой стенки. Он индуцирует тромбообразование, активируя свертывающую систему крови при участии VII фактора. Поскольку тканевый тромбопластин содержит фосфолипидную часть, тромбоциты в этом механизме тромбообразования участвуют мало. Именно появление тканевого тромбопластина в русле крови и его участие в патологическом тромбообразовании и определяют развитие острого ДВС-синдрома.
Цитокины
Следующий механизм тромбообразования реализуется с участием цитокинов — интерлейкина-1 и интерлейкина-6. Образующийся в результате их взаимодействия фактор некроза опухоли стимулирует выработку и выброс из эндотелия и моноцитов тканевого тромбопластина, о значении которого уже говорилось. Этим объясняется развитие локальных тромбов при различных заболеваниях, протекающих с четко выраженными воспалительными реакциями.
Тромбоциты
Специализированными клетками крови, участвующими в процессе ее свертывания, являются тромбоциты - безъядерные клетки крови, представляющие собой фрагменты цитоплазмы мегакариоцитов. Продукция тромбоцитов связана с определенным — тромбопоэтином, регулирующим тромбоцитопоэз.
Количество тромбоцитов в крови составляет 160-385×10 9 /л. Они хорошо видны в световом микроскопе, поэтому при проведении дифференциальной диагностики тромбозов или кровоточивости микроскопия мазков периферической крови необходима. В норме размер тромбоцита не превышает 2-3,5 мкм (около ⅓-¼ диаметра эритроцита). При световой микроскопии неизмененные тромбоциты выглядят как округлые клетки с ровными краями и красно-фиолетовыми гранулами (α-гранулы). Продолжительность жизни тромбоцитов составляет в среднем 8-9 сут. В норме они дискоидной формы, но при активации принимают форму сферы с большим количеством цитоплазматических выпячиваний.
В тромбоцитах имеется 3 типа специфических гранул:
- лизосомы, содержащие в большом количестве кислые гидролазы и другие ферменты;
- α-гранулы, содержащие множество различных белков (фибриноген, фактор Виллебранда, фибронектин, тромбоспондин и др.) и окрашивающиеся по Романовскому-Гимзе в фиолетово-красный цвет;
- δ-гранулы — плотные гранулы, содержащие большое количество серотонина, ионов К + , Ca 2+ , Mg 2+ и др.
В α-гранулах содержатся строго специфичные белки тромбоцитов - такие, как 4-й пластиночный фактор и β-тромбоглобулин, являющиеся маркерами активации тромбоцитов; их определение в плазме крови может помочь в диагностике текущих тромбозов.
Кроме того, в структуре тромбоцитов имеются система плотных трубочек, являющаяся как бы депо для ионов Ca 2+ , а также большое количество митохондрий. При активации тромбоцитов происходит ряд биохимических реакций, которые при участии циклооксигеназы и тромбоксансинтетазы приводят к образованию тромбоксана А 2 (ТХА 2) из арахидоновой кислоты — мощного фактора, отвечающего за необратимую агрегацию тромбоцитов.
Тромбоцит покрыт 3-слойной мембраной, на внешней ее поверхности располагаются различные рецепторы, многие из которых являются гликопротеинами и взаимодействуют с различными белками и соединениями.
Тромбоцитарный гемостаз
Рецептор гликопротеина Iа связывается с коллагеном, рецептор гликопротеина Ib взаимодействует с фактором Виллебранда, гликопротеинами IIb-IIIa — с молекулами фибриногена, хотя может связываться и с фактором Виллебранда, и с фибронектином.
При активации тромбоцитов агонистами — АДФ, коллагеном, тромбином, адреналином и др. - на их внешней мембране появляется 3-й пластиночный фактор (мембранный фосфолипид), активирующий скорость свертывания крови, повышая ее в 500-700 тыс. раз.
Плазменные факторы свертывания крови
Плазма крови содержит несколько специфических систем, участвующих в каскаде свертывания крови. Это системы:
- адгезивных молекул,
- факторов свертывания крови,
- факторов фибринолиза,
- факторов физиологических первичных и вторичных антикоагулянтов-антипротеаз,
- факторов физиологических первичных репарантов-заживителей.
Система адгезивных молекул плазмы
Система адгезивных молекул плазмы представляет собой комплекс гликопротеинов, отвечающих за межклеточные, клеточно-субстратные и клеточно-белковые взаимодействия. К ней относятся:
- фактор Виллебранда,
- фибриноген,
- фибронектин,
- тромбоспондин,
- витронектин.
Фактор Виллебранда
Фактор Виллебранда высокомолекулярный гликопротеин с молекулярной массой 10 3 кД и более. Фактор Виллебранда выполняет множество функций, но основные из них две:
- взаимодействие с VIII фактором, благодаря чему происходит защита антигемофильного глобулина от протеолиза, что увеличивает продолжительность его жизни;
- обеспечение процессов адгезии и агрегации тромбоцитов в циркуляторном русле, особенно при высоких скоростях кровотока в сосудах артериальной системы.
Снижение уровня фактора Виллебранда ниже 50%, наблюдающееся при болезни или синдроме Виллебранда, приводит к выраженной петехиальной кровоточивости, как правило, микроциркуляторного типа, проявляющейся синяковостью при небольших травмах. Однако при тяжелой форме болезни Виллебранда может наблюдаться гематомный тип кровоточивости, подобный гемофилии ().
Напротив, существенное повышение концентрации фактора Виллебранда (более 150%) может приводить к тромбофилическому состоянию, что нередко клинически проявляется различного типа тромбозами периферических вен, инфарктом миокарда, тромбозами системы легочной артерии или мозговых сосудов.
Фибриноген — фактор I
Фибриноген, или фактор I, участвует во многих межклеточных взаимодействиях. Его основными функциями являются участие в формировании фибринового тромба (армирование тромба) и осуществление процесса агрегации тромбоцитов (прикрепление одних тромбоцитов к другим) благодаря специфическим тромбоцитарным рецепторам гликопротеинов IIb-IIIа.
Плазменный фибронектин
Плазменный фибронектин — адгезивный гликопротеин, взаимодействующий с различными факторами свертывания крови.Также одной из функций плазменного фибронектина является репарация дефектов сосудов и тканей. Показано, что нанесение фибронектина на участки тканевых дефектов (трофические язвы роговицы глаза, эрозии и язвы кожных покровов) способствует стимуляции репаративных процессов и более быстрому заживлению.
Нормальная концентрация плазменного фибронектина в крови - около 300 мкг/мл. При тяжелых травмах, массивной кровопотере, ожогах, длительных полостных операциях, сепсисе, остром ДВС-синдроме в результате потребления уровень фибронектина падает, что снижает фагоцитарную активность макрофагальной системы. Именно этим можно объяснить высокую частоту инфекционных осложнений у лиц, перенесших массивную кровопотерю, и целесообразность назначения пациентам переливания криопреципитата или свежезамороженной плазмы, содержащих в большом количестве фибронектин.
Тромбоспондин
Основными функциями тромбоспондина являются обеспечение полноценной агрегации тромбоцитов и связывание их с моноцитами.
Витронектин
Витронектин, или белок, связывающийся со стеклом, участвует в нескольких процессах. В частности, он связывает комплекс АТ III-тромбин и в дальнейшем выводит его из циркуляции через макрофагальную систему. Кроме того, витронектин блокирует клеточно-литическую активность конечного каскада факторов системы комплемента (комплекс С 5 -С 9), тем самым препятствуя реализации цитолитического эффекта активации системы комплемента.
Факторы свертывания крови
Система плазменных факторов свертывания крови — это сложный многофакторный комплекс, активация которого приводит к формированию стойкого фибринового сгустка. Она играет основную роль в остановке кровотечения при всех вариантах повреждения целостности сосудистой стенки.
Система фибринолиза
Система фибринолиза является важнейшей системой, препятствующей бесконтрольному свертыванию крови. Активация системы фибринолиза реализуется по внутреннему либо по внешнему механизму.
Внутренний механизм активации
Внутренний механизм активации фибринолиза начинается с активации плазменного XII фактора (фактора Хагемана) при участии высокомолекулярного кининогена и калликреин-кининовой системы. В результате плазминоген переходит в плазмин, который расщепляет молекулы фибрина на мелкие фрагменты (X, Y, D, Е), опсоннзируюшиеся плазменным фибронектмном.
Внешний механизм активации
Внешний путь активации фибринолитической системы может осуществляться стрептокиназой, урокиназой либо тканевого активатора плазминогена. Внешний путь активации фибринолиза часто используется в клинической практике для лизирования острых тромбозов различной локализации (при тромбоэмболии легочной артерии, остром инфаркте миокарда и др.).
Система первичных и вторичных антикоагулянтов-антипротеаз
Система физиологических первичных и вторичных антикоагулянтов-антипротеаз существует в организме человека для инактивации различных протеаз, плазменных факторов свертывания и многих компонентов фибринолитической системы.
К первичным антикоагулянтам относится система, включающая гепарин, AT III и КГ II. Эта система преимущественно ингибирует тромбин, фактор Ха и ряд других факторов свертывающей системы крови.
Система протеина С, как уже отмечалось, ингибирует Va и VIIIa плазменные факторы свертывания, что в итоге тормозит свертывание крови по внутреннему механизму.
Система ингибитора тканевого тромбопластина и гепарин ингибируют внешний путь активации свертывания крови, а именно комплекс ТФ-VII фактор. Гепарин в этой системе играет роль активатора выработки и выброса в кровоток ингибитора тканевого тромбопластинаиз эндотелия сосудистой стенки.
PAI-1 (ингибитор тканевого активатора плазминогена) является основной антипротеазой, инактивирующей активность тканевого активатора плазминогена.
К физиологическим вторичным антикоагулянтам-антипротеазам относятся компоненты, концентрация которых повышается в процессе свертывания крови. Одним из основных вторичных антикоагулянтов является фибрин (антитромбин I). Он активно сорбирует на своей поверхности и инактивирует циркулирующие в кровотоке свободные молекулы тромбина. Инактивировать тромбин могут также дериваты факторов Va и VIIIa. Кроме того, в крови тромбин инактивируют циркулирующие молекулы растворимого гликокалицина, которые представляют собой остатки рецептора тромбоцитов гликопротеина Ib. В составе гликокалицина имеется определенная последовательность — «ловушка» для тромбина. Участие растворимого гликокалицина в инактивации циркулирующих молекул тромбина позволяет достигать самоограничения тромбообразования.
Система первичных репарантов-заживителей
В плазме крови находятся определенные факторы, которые способствуют процессам заживления и репарации сосудистых и тканевых дефектов, - так называемая физиологическая система первичных репарантов-заживителей. В эту систему входят:
- плазменный фибронектин,
- фибриноген и его производное фибрин,
- трансглутаминаза или XIII фактор свертывающей системы крови,
- тромбин,
- фактор роста тромбоцитов - тромбопоэтин.
О роли и значении каждого из этих факторов в отдельности уже говорилось.
Механизм свертывания крови

Выделяют внутренний и внешний механизм свертывания крови.
Внутренний путь свертывания крови
Во внутреннем механизме свертывания крови участвуют факторы, находящиеся в крови в нормальных условиях.
По внутреннему пути процесс свертывания крови начинается с контактной или протеазной активации XII фактора (или фактора Хагемана) при участии высокомолекулярного кининогена и калликреин-кининовой системы.
XII фактор превращается в XIIа (активированный) фактор, который активирует XI фактор (предшественник плазменного тромбопластина), переводя его в фактор ХIа.
Последний активирует IX фактор (антигемофилический фактор В, или фактор Кристмаса), переводя его при участии фактора VIIIa (антигемофилический фактор А) в фактор IХа. В активации IX фактора участвуют ионы Ca 2+ и 3-й тромбоцитарный фактор.
Комплекс факторов IХа и VIIIa с ионами Ca 2+ и 3-м тромбоцитарным фактором активирует X фактор (фактор Стюарта), переводя его в фактор Ха. В активации X фактора принимает также участие фактор Va (проакцелерин).
Комплекс факторов Ха, Va, ионов Са (IV фактор) и 3-го тромбоцитарного фактора называется протромбиназой; она активирует протромбин (или II фактор), превращая его в тромбин.
Последний расщепляет молекулы фибриногена, переводя его в фибрин.
Фибрин из растворимой формы под влиянием фактора XIIIа (фибринстабилизирующий фактор) превращается в нерастворимый фибрин, который непосредственно и осуществляет армирование (укрепление) тромбоцитарного тромба.
Внешний путь свертывания крови
Внешний механизм свертывания крови осуществляется при попадании в циркуляторное русло из тканей тканевого тромбопластина (или III, тканевого, фактора).
Тканевый тромбопластин связывается с VII фактором (проконвертином), переводя его в фактор VIIa.
Последний активирует X фактор, переводя его в фактор Ха.
Дальнейшие превращения свертывающего каскада такие же, как при активации плазменных факторов свертывания по внутреннему механизму.
Механизм свертывания крови кратко
В целом механизм свертывания крови кратко может быть представлен как ряд последовательных этапов:
- в результате нарушения нормального кровотока и повреждения целостности сосудистой стенки развивается дефект эндотелия;
- к обнажившейся базальной мембране эндотелия (к коллагену, ламинину) прилипают фактор Виллебранда и плазменный фибронектин;
- циркулирующие тромбоциты также прилипают к коллагену и ламинину базальной мембраны, а затем к фактору Виллебранда и фибронектину;
- адгезия тромбоцитов и их агрегация приводят к появлению на их внешней поверхностной мембране 3-го пластиночного фактора;
- при непосредственном участии 3-го пластиночного фактора происходит активация плазменных факторов свертывания, что приводит к образованию в тромбоцитарном тромбе фибрина — начинается армирование тромба;
- активируется система фибринолиза как по внутреннему (через XII фактор, высокомолекулярный кининоген и калликреин-кининовую систему), так и по внешнему (под влиянием ТАП) механизмам, останавливающая дальнейшее тромбообразование; при этом происходит не только лизирование тромбов, но и образование большого количества продуктов деградации фибрина (ПДФ), которые в свою очередь блокируют патологическое тромбообразование, обладая фибринолитической активностью;
- начинаются репарация и заживление сосудистого дефекта под влиянием физиологических факторов репаративно-заживительной системы (плазменного фибронектина, трансглутаминазы, тромбопоэтина и др.).
При острой массивной кровопотере, осложненной шоком, равновесие в системе гемостаза, а именно между механизмами тромбообразования и фибринолиза быстро нарушается, так как потребление существенно превосходит продукцию. Развивающееся истощение механизмов свертывания крови и является одним из звеньев развития острого ДВС-синдрома.
Свёртываемость крови – это процесс, происходящий в человеческом организме и подразумевающий изменение структуры кровяных клеток, то есть преобразование из жидкого состояния в желеобразное. В случае возникновения незначительного пореза или других ран, возникшие повреждения кожи быстро заживают. Этот факт приятен каждому человеку. При этом никто из нас никогда не задумывался над самым важным вопросом. Нужно знать подробности процесса заживления ран, а точнее с чего начинается процесс свертывания крови, в чем его сущность и какое место занимает в жизни каждого человека?
В медицине также существует другое понятие системы коагуляции крови, а именно речь идет о гемостазе. Можно сказать, что гемостаз – это процесс, который отвечает за жидкое состояние крови в сосудах человеческого организма . Также он препятствует развитию обширной кровопотери. Во многих медицинских источниках можно найти информацию о том, что во всех сосудах в организме движется 5 литров кровяных клеток. Следовательно, при повреждении кожи или сосудов кровь может проливаться, и если не система коагуляции, тогда каждый человек мог бы умереть от кровопотери. Таким образом осуществляется регуляция свертывания крови.
Сама система гемостаза крови является уникальной, так как она обеспечивает жидкое состояние крови на протяжении многочисленных артерий и вен в организме человека. Если произошло повреждение даже самого маленького сосуда, сразу же начинается активная работа специальных ферментов, осуществляющих постепенное стягивание отверстия, предотвращая излив клеток крови. Проще можно описать этот процесс как образование тромбов, то есть кровяные клетки начинают склеиваться.
Как правило, сворачивается кровь благодаря существованию в человеческом организме определенной системы, под ней понимается образование ингибиторов сворачиваемости. Фермент же, способствующий процессу коагуляции, образуется в организме всегда. А ингибиторы непрерывно работают. Работу ингибиторов можно разделить на 2 основные фазы:
- начинается действие гепарина и антипротромбиназа;
- начинается работа ингибиторов тромбина (фибрина, фибриногена, претромбина I и II).
Если человек заболевает, то в организме могут образовываться и другие ингибиторы. Так как при высокой температуре начинается интенсивное свертывание.

Помимо системы свертывания крови существует еще и антисвертывающая система. Антисвертывающая система начинает функционировать, когда тромбин начинает раздражать хеморецепторы кровеносных сосудов. Таким образом разрушается фибриноген, который является главным фактором образования тромбов. Антисвертывающая система является очень важной для полноценной жизнедеятельности организма.
Какой фермент способствует коагуляции?
Если механизм свертывания крови понятен, то теперь нужно узнать, какой же фермент способствует свертываемости крови? Основным ферментом, который участвует в процессе коагуляции, является тромбин. В период протекания химических реакций в организме это вещество воздействует на фибриноген, преобразовывая его в фибрин. Это вещество также регулирует фибринолиз и процесс образования тромбов, поддерживает тонус сосудов.
Данный фермент образуется при воспалительных процессах, происходящих в организме, при высокой температуре.
Далее начинается следующий этап свертываемости, образуется тромбин из протромбина. В свою очередь тромбин активирует V, VIII, XIII факторы коагуляции. Гормональные свойства рассматриваемого вещества проявляются при тесном контакте с эндотелием и тромбоцитами. А вот в процессе стыковки с тромбомодулином действие по сворачиванию крови заканчивается.
Роль тромбина в коагуляции
Ключевая функция гемостаза состоит в блокировании разрыва в сосуде. При этом фибриновые нити образуют тромб, после чего кровяные клетки приобретают характерное вяжущее свойство. Итак, какой же фермент участвует в коагуляции? Это тромбин, происходит от слова «тромб». Тромбин находится в постоянной готовности, и как только возникает повреждение стенки сосуда, начинается активная его работа.
Существуют следующие фазы свертывания крови:
- Этап I – начало, появление протромбиназы. На первой стадии происходит образование тканевого и кровяного ферментов, при этом процесс их образования проходит с разной скоростью. Важным здесь является то, что тканевый фермент активирует работу кровяного фермента.
- Этап II — образуется тромбин. Протромбин начинает распадаться на частицы, после распада образуется вещество, которое активирует тромбин.
- Этап III — образование фибрина. На данной стадии фермент, участвующий в коагуляции начинает действовать на фибриноген, при этом отщепляются аминокислоты.
- Этап IV. Является одним из особенных, потому что начинается полимеризация фибрина и образуется сгусток крови.
- Этап V — происходит фибринолиз. Это завершающая стадия гемостаза, так как происходит полное свертывание крови.
Перечисленные этапы системы гемостаза говорят о тесном и взаимосвязанном процессе. Нормой свертываемости считается промежуток от 7до12 минут, анализы оцениваются при комнатной температуре. Все описанные этапы можно изобразить схематично с определенной последовательностью.

Следует отметить, что деление коагуляции по видам, то есть на внешнюю и на внутреннюю, считается условным, при этом может использоваться только в круге ученых для простоты и удобства, так как обе разновидности свертываемости крови взаимосвязаны между собой.
Что влияет на свертывание
Процесс коагуляции происходит благодаря определенным веществам, которые называются факторами. Иначе их можно назвать «плазменные белки». Агентами, которые принимают активное участие в процессе гемостаза, являются:
- фибрин и фибриноген;
- протромбин и тромбин;
- тромбопластин;
- ионизированный кальций (Ca++);
- проакцелерин и акцелерин;
- фактор Коллера;
- фактор Хагеман;
- стабилизатор фибрина Лаки-Лоранда.
Действие всего перечисленного заключается в правильной коагуляции, при том что данный процесс проходит достаточно быстро. Они способствуют предотвращению развития обширной кровопотери при нарушении сосудистой стенки.
Как происходит процесс гемостаза крови
Важно знать, что поврежденный сосуд не восстанавливается каким-либо случайным образом. В процессе коагуляции участвуют многочисленные ферменты, выполняющие каждый свою возложенную функцию. Сама же суть этого процесса заключается в том, что начинается активное сворачивание белков и эритроцитов. При этом тромбы присоединяются к стенке поврежденной артерии и дальнейшее отсоединение их невозможно.

В случае повреждения сосудов из них начинают выделяться вещества, которые тормозят весь процесс коагуляции. Тромбоциты начинают изменяться и разрушаться, а далее происходит попадание в кровь тромбопластина и тромбина. Затем под влиянием тромбина фибриноген превращается в фибрин (представляет собой ниточную сетку). Именно сетка из нитей фибрина располагается в поврежденной зоне и в течение некоторого времени становится более плотной. Следовательно, процесс коагуляции завершен, и кровь из поврежденного сосуда останавливается.
Еще важно знать, в течение которого времени должна проходить коагуляция при нормальной температуре тела. Нормой свертываемости крови, начиная от повреждения сосудистой стенки и до полной остановки крови, является обычно промежуток в 2-4 минуты при нормальной температуре тела. Однако тромбин сворачивает кровь в течение 10 минут. Именно это время считается нормой для коагуляции. Процесс коагуляции может замедлиться или вовсе не закончиться. Кровь может не свернуться, если имеются заболевания: гемофилией или диабетом. Схема свертывания крови является не простой и для правильной коагуляции важно следить за своим здоровьем, регулярно сдавать кровь на анализ, чтобы в экстренных случаях избежать большого кровотечения.