Противовоспалительная терапия
Как известно, воспаление является нормальной реакцией слизистой оболочки околоносовых пазух, направленной на уничтожение вирусов и бактерий. Это сложная комплексная местная сосудисто-тканевая защитно-приспособительная реакция целостного организма на действие патогенного раздражителя.
Основными компонентами воспаления являются:
альтерация с выделением медиаторов
сосудистая реакция с экссудацией
пролиферация
В ответ на это высвобождаются медиаторы воспаления, в свою очередь вызывающие пролиферацию лейкоцитов, активацию Т-лимфоцитов и дальнейшее усиление воспаления.
К основным медиаторам воспаления (а в настоящий момент их известно более 50) относят гистамин, простогландины, лейкотриены и цитокины. И простагландины и лейкотриены являются конечным продуктом метаболизма фосфолипадов клеточной мембраны. На первом этапе под воздействием фосфолипазы А 2 происходит метаболизм фосфолипидов клеточной мембраны до арахидоновой кислоты.
В дальнейшем циклооксигеназный путь метаболизма арахидоновой кислоты приводит к образованию простагландинов и тромбоксана, а липооксигеназный - к образованию лейкотриенов.
К провоспалительным цитокинам воспаления относятся интерлейкины (IL 1 , IL 3 , IL 4 , IL 5 , IL 6), фактор некроза опухолей (TNF α).
Результатом действия медиаторов воспаления становится усиление кровотока, изменение проницаемости сосудов, увеличение выхода клеток крови через сосудистую стенку с развитием отека . Кроме того респираторные агенты способны вызывать возрастание альфа-адренергической активности симпатических нервных окончаний, с чем связано увеличение образования вязкой слизи, и стимуляцию H 1 -гистаминовых рецепторов, приводящую к увеличению объема секрета за счет притока жидкости из-за повышенного поступления ионов натрия и хлора.
Таким образом, именно воспаление лежит в основе развития клинических симптомов и жалоб пациента с отитом.
Противовоспалительная терапия направлена в первую очередь на блокаду каскада медиаторных реакций, усиливающих воспалительную реакцию. Это ведет к купированию таких основных симптомов воспаления при острых синуситах как боль, отек, расширение сосудов слизистой оболочки околоносовых пазух, чрезмерная экссудация. Поэтому противовоспалительная терапия должна являться непременным звеном терапии острых синуситов (???).
В настоящее время различают два основных направления системной противовоспалительной терапии в целом - это противовоспалительные глюкокортикостероиды и нестероидные противовоспалительные средства.
Не отрицая большое значение глюкокортикостероидов в системной противовоспалительной терапии, следует указать на их полную непригодность в терапии острых синуситов (???). Благодаря своей способности к снижению антибактериальной активность фагоцитов и снижению секреции нейтральных протеаз глюкокортикостероиды ведут к снижению противоинфекционной защиты организма. Поэтому они не должны использоваться в комплексном лечении острого бактериального воспаления околоносовых пазух (???). В то же время, как местные, так и системные глюкокортикостероиды показали свою высокую эффективность в лечении аллергического воспаления (аллергические риниты и риносинуситы) и хронического полипозного риносинусита (за исключением полипозно-гнойной его формы) (???).
Нестероидные противовоспалительные средства (НПВС) ингибируют биосинтез простагландинов, угнетают активность циклооксигеназы, угнетают перекисное окисление липидов, влияют на кининовую систему. Все это делает их мощным средством в комплексном лечении острого бактериального воспаления околоносовых пазух (???)..
Нестероидные противовоспалительные средства по механизму своего действия делятся на две группы.
Первая группа - активные ингибиторы синтеза простагладинов (ибупрофен, флурбипрофен, диклофенак). Они наиболее активны при остром воспалении.
Вторая группа - сравнительно слабые ингибиторы синтеза простагландинов (индометацин, пироксикам, фенилбутозан). Эти препараты мало активны при остром воспалении, но весьма эффективны при хроническом.
Естественно, при лечении острых синуситов (???) предпочтение отдается препаратам первой группы.
В качестве противовоспалительной терапии неперфаративных острых отитов некоторые авторы предлагают местные глюкокортикостероидные препараты. Эффект от такого назначения может не всегда оправдать ожидания.
Комбинация местных глюкокортикостероидных препаратов и антибиотиков аминогликозиздного ряда прекрасно проявила себя при лечении острых наружных отитов. Это препараты гаразон (гентамицин + беклометозон), софрадекс (фрамецитина сульфа + дексаметазон), полидекса ушная (неомицин + полимиксин + дексаметазон). Такая комбинация позволяет не только эффективно ликвидировать микробную инфекцию, но и быстро купировать явления воспаления, благодаря эффективному действию местного кортикостероида. При остром среднем неперфоративном отите положительный эффект этих препаратов может быть обусловлен только противовоспалительным воздействием кортикостероидного компонента и, как следствие этого - частичным анальгезирующим эффектом. Потенциал же аминогликозидного антибиотика в данном случае остается неиспользованным. Поэтому при острых средних неперфоративных отитах целесообразнее использовать либо местные противовоспалительные препараты, либо противовоспалительные препараты в комбинации с анальгетиками локального действия.
Особняком от двух перечисленных групп системных противовоспалительных препартов стоит фенспирид (эреспал). Механизм действия фенспирида (эреспал) направлен непосредственно на метаболизм арахидоновой кислоты, путем блокирования транспорта ионов кальция, которые необходимы для активации фасфолипазы А 2 , что в свою очередь позволяет одновременно блокировать как образование простагландинов, так и лейкотриенов. В этом заключается важное преимущество фенспирида (эреспал) по сравнению с НПВП, влияющими только на циклооксигеназный путь метаболизма арахидоновой кислоты. НПВП не препятствуют накоплению таких сильных провоспалительных медиаторов, как лейкотриены, с чем и связаны их многие побочные эффекты. Важно отметить, что фенспирид (эреспал), не являясь стероидным противовоспалительным средством и обладая тропностью к слизистой оболочке дыхательного тракта, лишен неблагоприятных системных побочных эффектов ГКС.
Фенспирид (эреспал) снижает остроту воспалительного процесса не только посредством влияния на каскад арахидоновой кислоты, но также и за счет антагонизма в отношении гистамина посредством блокады Н 1 - рецепторов и ингибиции 1 – адренергических рецепторов, что способствует уменьшению гиперпродукции вязкого секрета в очаге воспаления. Кроме того, фенспирид (эреспал) оказывает ингибирующее действие на синтез и секрецию цитокинов, особенно на фактор некроза опухоли (TNF). Известно, что TNF усиливает цитотоксичность макрофагов, что с одной стороны, ведет к элиминации патогена, но с другой стороны, вызывает деструкцию тканей. Комплексный противовоспалительный механизм действия Эреспала позволяет быстрее нормализовать мукоциллиарный клиренс.
Эффективный контроль над воспалением способствует более быстрому разрешению основных клинических симптомов поражения уха.
Добавление фенспирида (эреспал) в схему лечения ЭСО позволяет быстрее добиться улучшения слуха, уменьшения чувства заложенности, снижения шума. Эффективность фенспирида (эреспала) подтверждена данными аудиометрии и тимпанометрии. Включение фенспирида (эреспал) в схему лечения пациентов с ЭСО сокращает сроки нормализации слуховых порогов по всей тон-шкале, а также сроки нормализации давления в полости среднего уха и восстановления подвижности барабанной перепонки (тимпанограмма типа А).
Таким образом, противовоспалительная терапия должна являться непременным звеном терапии острых отитов. По месту своего приложения фенспирид (эреспал) разработан специально для слизистых оболочек дыхательных путей, и поэтому при выборе средств системной противовоспалительной терапии острых отитов имеет преимущества перед другими противовоспалительными препаратами.
Системная антибиотикотерапия
Основным методом лечения ОСО, РОСО и ЗОСО является антимикробная терапия , причем первоначальный выбор антибиотика, как правило, бывает эмпирическим. Хотя не все формы ОСО требуют назначения антибиотиков, но лечение антибиотиками снижает риск развития мастоидита и других осложнений. Считается обязательным назначение антибиотиков во всех случаях ОСО у детей младше двух лет, а также пациентам с иммунодефицитными состояниями. Назначение антибиотиков необходимо при ЗОСО и РОСО.
Эмпирический выбор антибиотика должен учитывать спектр типичных возбудителей ОСО, ЗОСО и РОСО, каковыми являются пневмококк, гемофильная палочка, а в некоторых регионах – еще и моракселла . Оптимальным был бы выбор с учетом данных о региональной чувствительности предполагаемых возбудителей к антибиотикам, но в России эти данные не всегда достоверны и доступны лишь в отдельных регионах.
Чувствительность возбудителей ОСО к антибиотикам значительно варьирует в различных регионах. Общей тенденцией является нарастание резистентности пневмококков к пенициллину, макролидам и гемофильной палочки к ампициллину и амоксициллину. У пациентов, которые получали недавно курсы ампициллина, амоксициллина или пенициллина, значительно выше вероятность выделения микрофлоры, продуцирующей бета-лактамазы.
В Центральной части России у S.pneumoniae и H.influenzae, выделенных при ОСО, сохраняется высокая чувствительность к аминопенициллинам и цефалоспоринам: 97,0% штаммов S.pneumoniae чувствительны к амоксициллину, 100% - к к амоксициллину/клавуланату и цефуроксиму; 98% штаммов H.influenzae чувствительны к амоксициллину, 100% -к амоксициллину/клавуланату и цефуроксиму .
Основной проблемой является высокая резистентность пневмококка и гемофильной палочки к ко-тримоксазолу: резистентность отмечена у 35% штаммов S.pneumoniae и 18% H.influenzae .
Изложенное выше показывает, что стратегия использования нового фторхинолона левофлоксацина должна основываться на его применении не только в качестве альтернативного средства лечения внебольничных респираторных заболеваний и мочевых инфекций. Врач может предпочитать его в таких конкретных ситуациях как пожилой возраст больного, недавно проведенные курсы антибиотикотерапии, алкоголизм, нарушения иммунитета, недавняя госпитализация, лечение в условиях дневного стационара и некоторых других случаях, когда фармакодинамические и фармакокинетические преимущества левофлоксацина способны сыграть решающую роль в исходе заболевания важно осуществлять реалистичную сравнительную фармакоэкономическую оценку различных противомикробных средств с учетом всех факторов .
Очевидно также, что в перспективе (после детальных исследований) перечень показаний для левофлоксацина может расшириться за счет других нозокомиальных инфекций, требующих применения парентеральных бактерицидных антибактериальных средств широкого спектра. Поэтому в ряде публикаций последних двух лет высказываются предположения по применению левофлоксацина в схеме лечения острых средних гнойных отитов средний тяжести и тяжелых как препарата, альтернативного традиционным бета-лактамным антибиотикам .
Учитывая широкое распространение ятрогенной антибиотиковой тугоухости в России следует строго запретить назначение любых антибиотиков аминогликозидного ряда при острых средних отитах. Воспалительный процесс в барабанной полости способствует проникновению аминогикозидов в жидкости внутреннего уха и токсическому поражению нейросенсорных клеток.
Секретолитическая терапия
Как уже было показано, в этиопатоненезе острых средних отитов ключевую роль играет дисфункция слуховой трубы. Главным образом в терапии отитов внимание обращает на восстановление воздухопроводящей функции слуховой трубы - адренализация устья, катетеризация, вазоконстрикторные препараты.
Но не менее важной является дренажная функция слуховой трубы. Благодаря согласованным колебаниям ресничек мерцательного эпителия, выстилающих просвет слуховой трубы, происходит эвакуация патологического содержимого из барабанной полости. При отеке слизистой оболочки трубы функции эта полностью утрачивается. К тому же, густой вязкий секрет, заполняющий барабанную полость, с трудом поддается эвакуации.
Аналогичные процессы происходят в околоносовых пазухах при острых синуситах и с успехом купируются с помощью муколитической, секретомоторной и секретолитической терапии. В комплексной же терапии недостаточно разработанным.
Важное значение в лечении синуситов имеют расплавление или размягчение и разжижение вязкого, густого секрета. Прием медикаментов с дифференцированным действием на продукцию секрета, уменьшение вязкости слизи и функцию ресничек позволяет реактивировать нарушенное мукоцилиарное очищение. Лекарственные средства, оказывающие подобный терапевтический эффект, объединяют в группы муколитических, секретомоторных и секретолитических препаратов .
Муколитические препараты изменяют физико-химические свойства секрета путем уменьшения его вязкости. С этой целью применяются смачиватели, снижающие поверхностное натяжение, или ферменты, вызывающие разрыв дисульфидных связей.
К секретомоторным препаратам относят лекарственные средства, которые через различные механизмы, в основном путем усиления моторной активности мерцательного эпителия, повышают эффективность мукоцилиарного очищения. Типичными представителями этой группы являются известные как бронхорасширяющие средства стимуляторы b2-адренорецепторов. Секретомоторным действием обладают также теофиллин, бензиламины и прежде всего эфирные масла.
Секретолитические препараты являются лекарственными средствами, улучшающими эвакуацию слизи путем изменения характера секреции. Эфирные масла растительного происхождения, экстракты различных растений, производные креозота (гваякол) и синтетические бензиламины, бромгексин и амброксол оказывают секретолитический эффект через механизм усиления секреции бронхиальных желез. Сложность фармакологической оценки муколитических, секретолитических и секретомоторных препаратов заключается в том, что до сих пор не имеется надежного метода экспериментального подтверждения их эффективности.
Одним из немногих препаратов этой группы, применяющийся в лечении острых средних отитов является сунупрет.
Этиотропный принцип -устранение, прекращение, уменьшение силы и/или длительности действия на ткани и органы флогогенных факторов:
извлечение из тканей травмирующих инородных предметов;
нейтрализация кислот, щелочей и других химических соединений, повреждающих ткани;
Патогенетический принцип -блокирование механизма развития воспаления путем разрыва звеньев патогенеза воспаления, лежащих в основе, главным образом, процессов альтерации и экссудации:
стимуляция развития артериальной гиперемии, процессов резорбции жидкости с помощью физиотерапевтических процедур;
применение антигистаминных препаратов, иммуностимуляторов и иммуномодуляторов, активаторов эмиграции лейкоцитов, фагоцитоза, пролиферации клеток и другие.
Симптоматический принцип - проведение специального лечение, направленного на предупреждение или устранение развившихся симптомов. С этой целью применяют, например, болеутоляющие, анестезирующие ЛС, транквилизаторы, антистрессорные ЛС; вещества, способствующие нормализации функций органов и физиологических систем.
Саногенетический принцип -направлен на активацию общих и местных механизмов компенсации, регенерации, защиты, восстановления и устранения повреждений и изменений в тканях и клетках, вызванных флогогенным агентом, а также последствий его влияния. Например, стимуляция иммунных и пролиферативных реакций, развитие артериальной гиперемии, фагоцитоза и других.
6. Контрольные вопросы
Воспаление как типовой патологический процесс. Общая характеристика компонентов воспаления, виды воспаления.
Назовите механизмы местных и общих проявлений при воспалении?
Альтерация. Изменения реологических свойств крови в очаге воспаления, белкового состава и физико-химических свойств белков плазмы при воспалении.
Клеточные и плазменные медиаторы воспаления. Взаимосвязь различных медиаторов при воспалительном процессе.
Дайте характеристику про- и противовоспалительным медиаторам.
Назовите стадии изменения кровотока при воспалении, раскройте механизмы сосудистых реакций.
Охарактеризуйте изменение реологических свойств крови при воспалении, белкового состава и физико-химических свойств белков плазмы.
Перечислите функции лейкоцитов в очаге воспаления. Дайте характеристику механизмам эмиграции лейкоцитов.
Дайте характеристику фагоцитарного процесса: виды, стадии, механизмы. Объясните причины и механизмы недостаточности фагоцитоза (синдром Чедиака-Хигаси, хронический гранулематоз у детей).
Дайте характеристику стимуляторов и ингибиторов пролиферации.
Укажите связь общих местных и общих проявлений при воспалении.
Роль воспаления для организма человека.
7. Задания для самоподготовки и уирс
Фагоцитоз. Учение И.И. Мечникова о фагоцитозе как защитной реакции организма.
СОЭ. История открытия. Познание сущности процесса.
Л.Л. Силин, А.В. Гаркави, К.С. Терновой
Боль и асептическое воспаление – неизбежные спутники не только переломов костей, но и сколько–нибудь значительных повреждений мягких тканей. Консервативное лечение таких повреждений, нуждающихся в анальгетической и противовоспалительной терапии, занимает ведущее место в практике травматолога как в стационаре, так и особенно в амбулаторных условиях.
Цель исследования Целью настоящего исследования явилось изучение обезболивающего и противовоспалительного эффектов последовательного применения нестероидных противовоспалительных препаратов (НПВП) с преимущественно обезболивающим и преимущественно противовоспалительным действиями в комплексе консервативного лечения в остром периоде повреждений опорно–двигательной системы. По нашему мнению, этой цели в большей степени отвечают такие НПВП разной направленности, как Кеторол и Найз, (производство фармацевтической компании «Доктор Реддис Лабораторис Лтд.», Индия). Оба этих препарата не влияют на опиодные рецепторы, не угнетают дыхание и моторику кишечника, не вызывают лекарственной зависимости. Из трех составляющих эффекта НПВП (жаропонижающий, противовоспалительный и обезболивающий) у Кеторола (кеторолака трометамина) наиболее выражено анальгетическое действие. На биохимическом уровне механизм действия Кеторола – угнетение фермента циглооксигеназы (ЦОГ–1 и ЦОГ–2) главным образом в периферических тканях. Препарат представляет собой рацемическую смесь [–] S и [+] R энантиомеров. Его обезболивающее действие обусловлено [–] S формой. Выпускается Кеторол в форме таблеток по 10 мг кеторолака трометамина и в форме раствора – в ампулах, содержащих по 30 мг препарата. Найз (нимесулид) – препарат нового поколения, обладающий селективным воздействием на ЦОГ–2, что снижает вероятность нежелательных эффектов при его применении.
Из триады эффекта НПВП Найз обладает наиболее выраженным противовоспалительным действием. Применяется Найз в форме таблеток, содержащих по 100 мг нимесулида. Материал и методики В настоящее исследование включено 87 пациентов. 46 из них лечились с последовательным применением Кеторола и Найза (основная группа). В группу сравнения вошел 41 пациент, получавший с целью обезболивания трамадол ретард. Среди наблюдавшихся было 58 мужчин и 29 женщин в возрасте от 18 до 82 лет.
Как следует из приведенных данных, обе группы сравнимы по возрасту, преобладали лица в возрасте от 21 до 60 лет (73,5%). В этом возрасте в основной группе было 71,8% больных, в контрольной – 75,6%. Для анализа в обеих группах подбирались больные со сравнимыми типами повреждений костей и мягких тканей. В обе группы включены пациенты со свежими повреждениями, которым в остром периоде после травмы проводилось консервативное лечение. Как видно из приведенной таблицы, обе группы пациентов сформированы примерно из одинакового количества однотипных повреждений. Наибольшее количество больных в остром посттравматическом периоде (31,1%) лечились на скелетном вытяжении по поводу диафизарных переломов длинных костей голени (18 больных), плеча (6 больных), бедра (3 больных). В дальнейшем эти пациенты либо были оперированы, либо лечились в гипсовой повязке. Около– и внутрисуставные переломы (переломы лучевой кости в типичном месте, переломы лодыжек, внутрисуставные переломы в коленном суставе) без смещения или после удачной репозиции лечились в гипсовой повязке в 20,7% наблюдений. «Растяжение» (частичный разрыв) связок голеностопного сустава констатировано у 19,5% наших больных. Во всех случаях проводилась иммобилизация 8–образной повязкой. Обширные закрытые повреждения мягких тканей бедра и (или) голени по типу ушиба констатированы в 13,8% наблюдений. Во всех этих случаях в остром периоде проводилась иммобилизация на функциональной шине.
Посттравматический гемартроз коленного сустава у 14,9% больных лечили в лангетной гипсовой повязке. По показаниям проводили пункцию сустава. Показаниями для назначения препаратов являлись боли средней, сильной и очень сильной интенсивности с клиническими проявлениями местного асептического воспаления. Интенсивность боли оценивали по визуальной аналоговой шкале (ВАШ) от 0 до 100 баллов и речевой шкале от 0 до 4 баллов: 0 – нет боли (соответственно 0–5 баллов ВАШ); 1 – умеренная боль (6–35 баллов ВАШ); 2 – средняя боль (36–55 баллов ВАШ); 3 – сильная боль (56–75 баллов ВАШ); 4 – очень сильная боль (76–100 баллов ВАШ). Степень выраженности асептического воспаления определяли по выраженности местного отека, локальной гипертермии и гиперемии. Каждый из этих признаков оценивали по пятибалльной речевой шкале: 0 – признак отсутствует; 1 – выражен умеренно; 2 – средней интенсивности; 3 – выражен; 4 – резко выражен. Суммарная оценка всех признаков в баллах оценивалась от 0 баллов (признаки воспаления отсутствуют), до 12 баллов (локальное воспаление резко выражено). Кроме того, оценивали необходимость пункции суставов по поводу травматического синовита, а также наличие и выраженность фликтен, обусловленных отеком мягких тканей и вторичными трофическими нарушениями кожных покровов. В основной группе лечение начинали с назначения Кеторола для уменьшения интенсивности болей. Разовая доза Кеторола для внутримышечного введения составляла 30 мг, суточная – не превышала 90 мг. При болях средней интенсивности и, особенно, у амбулаторных больных препарат назначали в таблетках по 10 мг 2–3 раза в день. Через 1–2 дня, когда боли уменьшались, прекращали лечение Кеторолом и переходили на назначение Найза, обладающего большим противовоспалительным действием. Если к этому времени интенсивность болей не превышала 30–40 баллов по ВАШ, то назначали Найз в форме таблеток по 100 мг 2–3 раза в день (суточная доза 200–300 мг). При более интенсивных болях суточная доза Найза составляла 300–400 мг. Препарат назначали до стихания локального асептического воспаления (обычно в течение 6–12 дней). В группе сравнения (контрольная группа) для купирования болевого синдрома назначали трамадол ретард по 100–200 мг 2–3 раза в день (суточная доза от 200 до 450 мг). После стихания болевого синдрома препарат отменяли. Противовоспалительная терапия ограничивалась физиотерапевтическими процедурами. Оценку эффективности лечения проводили через одни сутки на 1–й, 3–й, 7–й и 12–й день. В конце лечения оценивали (отдельно врачом и пациентом) эффект лечения по бальной системе от 0 до 4: 0 – нет эффекта, 1 – слабый эффект, 2 – удовлетворительный, 3 – хороший, 4 – очень хороший (отличный).
Для оценки общих изменений проводили контроль частоты дыхания и сердечных сокращений (ЧСС), артериального давления (АД), анализа мочи и крови, показателей свертывающей системы крови и еебиохимическое исследование. Побочное действие препаратов – нежелательные явления (НЯ) – тошнота, боли в животе, слабость и т.д. оценивали по речевой шкале от 0 (нет НЯ) до 4 (резко выраженные НЯ). Результаты исследования Основная группа (n=46) Максимальный анальгетический эффект первой дозы Кеторола 30 мг (внутримышечно) наступал в течение первых двух часов и сохранялся в течение 5–7 часов. У подавляющего большинства больных при этом выраженность болевого синдрома была снижена в два и более раза. Лишь у двух больных при очень сильных исходных болях (76–100 баллов) эффект лечения Кеторолом был недостаточным. Им потребовалось дополнительное назначение наркотических анальгетиков в первые сутки лечения. Средний балл по шкале ВАШ через 2 часа после однократной инъекции Кеторола был снижен с 72,1 до 31,4 балла. Через сутки у 32,6% больных боли стали уменьшаться. Им назначали Найз по 200 мг в сутки. У половины больных (23 пациента) боли были средней интенсивности. Они получали Найз по 300 мг в сутки. У 8 пациентов (17,4%) сохранялись сильные боли. Поэтому им суточная доза Найз была увеличена до 400 мг. По мере стихания болевого синдрома суточная доза Найза снижалась до 200 мг. Так, к 3 дню 400 мг получал один больной (2,2%). К пятому дню максимальная суточная доза препарата составила 300 мг у четверых больных (8,7%). С 7 дня после травмы пациенты получали по 100 мг Найза 2 раза в день. На фоне такой терапии болевой синдром по ВАШ был снижен через сутки до 42,3 балла, к третьему дню – до 34,1, к пятому – до 21,7, к седьмому – до 7 баллов. Дальнейшее применение препарата преследовало противовоспалительный эффект.
Из приведенных данных следует, что исходные признаки воспаления у больных основной группы расценены, как средней интенсивности. После применения Найза через 2 суток констатировано снижение суммы баллов до 5,3 за счет примерно одинакового уменьшения всех показателей. Эта тенденция в дальнейшем была более выраженной. Через 4 суток сумма баллов составила 3,1, т.е. признаки воспаления выражены умеренно. К 7–му дню признаки практически отсутствовали – сумма баллов 0,5. Ни кому из наблюдавшихся пациентов не потребовалась повторная пункция сустава из–за травматического синовита. Субэпидермальных пузырей (фликтен) у пациентов основной группы не было. Нежелательные явления констатированы у двух больных основной группы (4,35%) в виде тошноты (по одному баллу), слабости и сонливости (по одному баллу). Эти нежелательные явления (НЯ) прошли через 2–3 дня на фоне лечения без снижения дозы НПВП. Достоверной связи НЯ с назначением препаратов установить не удалось. Переносимость препарата оценивалась врачом и пациентом в среднем в 3,4 балла. Изменений ЧД, ЧСС, АДс, АДд, а также лабораторных показателей, обусловленных приемом препарата, не было. Оценка эффективности лечения в основной группе была хорошей (3 балла) или отличной (4 балла). Средняя оценка эффективности врачом – 3,6, пациентами – 3,8 балла. Оценивались как анальгетический, так и противовоспалительный эффекты. Контрольная группа (n=41) Максимальный анальгетический эффект наступал в течение 1–2–ого часа после введения трамадола ретарда и сохранялся в течение 4–7 часов. Снижение интенсивности болей на половину и более через два часа после разовой дозы препарата достигнуто у всех пациентов, кроме двух с очень сильными болями. В обоих случаях для адекватного обезболивания пришлось прибегнуть к дополнительному назначению промедола в первые сутки.
Средний балл болей по шкале ВАШ через 2 часа после однократного применения 100–200 мг трамадола снизился с 70 до 35,2 балла. На фоне применения препарата при суточной дозе 200–450 мг болевой синдром по ВАШ через сутки снизился до 40,1 балла, через трое суток – до 35,2 балла, пять суток – до 23,1 балла, семь суток – до 6,9 балла. После 7 суток необходимости в проведении анальгетической терапии не было. Из приведенных данных следует, что исходные признаки воспаления в контрольной группе были средней интенсивности (сумма баллов 6). В течение первых трех дней признаки асептического воспаления постепенно нарастали до 8 суммарных баллов (выраженное воспаление), за счет главным образом отека (средний балл до 3) и гипертермии (средний балл до 3,8). Затем признаки воспаления постепенно снижались и к 7 дню были менее чем умеренно выражены: сумма баллов составила 2,1. У 3 пациентов (7,3%) из–за выраженности отека ко 2–3 дню констатировано образование эпидермальных пузырей. Из 10 больных с повреждениями коленного сустава в 2–х случаях потребовалась повторная пункция суставов по поводу посттравматическго синовита. Изменений АДс, АДд, ЧСС, ЧД, а также лабораторных показателей, обусловленных приемом трамадола ретарда не было. Нежелательные явления в виде тошноты, сонливости, головокружения отмечены у 10 больных (24,4%). У 6–ти из них оценены в среднем в 1,8 балла, у 3–х – в 3,1 балла, у 1–ого – в 3,7 балла. Это потребовало в 5–ти случаях снижение дозы препарата, в 1–ом его отмены (2,4%). Эффективность лечения по анальгетическому и противовоспалительному эффектам оценивалась не одинаково. Так анальгетический эффект лечения оценивался врачом на 3,6 балла, пациентом на 3,4 балла. Противовоспалительный эффект применения опиодного анальгетика и физиотерапии оценивался в среднем врачом в 1,8, пациентом – в 2 балла. Переносимость препарата оценена врачом и пациентом в среднем в 2,3 балла. Обсуждение результатов Все больные были разделены на две группы исследований. Сравнение пациентов обеих групп проводилось по полу и возрасту, характеру повреждений опорно–двигательной системы, методикам консервативного лечения в остром периоде травмы, выраженности исходной интенсивности болевого синдрома, локального отека, гипертермии и гипе-ремии. Больные основной группы получали Кеторол внутримышечно по 30 мг с максимальной суточной дозой 90 мг, а в последующем Найз в форме таблеток по 100 мг, с суточной дозой 200–400 мг, до ликвидации симптомов острого воспаления.Пациентам контрольной группы назначали трамадол ретард разовой дозой 100–200 мг, суточная доза 200–450 мг. В обеих группах максимальный обезболивающий эффект наступал в течение первых двух часов после приема препарата и сохранялся в сроки от 4 до 7 часов.
При болях средней и сильной интенсивности анальгетический эффект достигнут в обеих группах уже в первые сутки. В случаях очень сильных болей (76–100 баллов по ВАШ), которые были отмечены в обеих группах (по 2 пациента в каждой), потребовалось дополнительное введение трамадола и промедола в основной и контрольной группах соответственно в первые сутки после травмы. После отмены Кеторола в первые сутки и назначения Найза в суточных дозах: 200 мг при умеренных болях, 300 мг при болях средней интенсивности и 400 мг при сильных болях, получен адекватный обезболивающий эффект, сопоставимый с таковым в контрольной группе. К концу недели у подавляющего большинства пациентов обеих групп болей не было. Средний балл оценки боли по ВАШ у пациентов основной и контрольной групп составил соответственно 7 и 6,9 балла. Достоверной разницы обезболивающего эффекта между группами не было. У пациентов обеих групп исходное локальное воспаление после травмы по усредненным баллам было средней интенсивности (как по сумме баллов, так и по отдельным показателям). Как следует из приведенных данных, у пациентов контрольной группы в первые 2 дня синдром асептического воспаления нарастает, увеличиваясь на 1/3, что отвечает общей тенденции воспаления в остром посттравматическом периоде. В то же время на фоне применения Найза воспалительный синдром не только не нарастает, но снижается на 11,7% от исходного, а в сравнении с контрольной группой уменьшается на 44,7%. Это свидетельствует о том, что, во–первых, противовоспалительный эффект физиотерапевтического лечения у контрольной группы больных меньше, чем противовоспалительный эффект НПВП в основной группе. Во–вторых, НПВП преимущественно противовоспалительного действия следует назначать как можно раньше в остром посттравматическом периоде. К 4–му дню воспалительный синдром снижается в обеих группах. Однако в основной группе эта тенденция выражена больше и составляет почти половину от исходного (51,7%), тогда как в контрольной группе это уменьшение равно всего 10%. Еще в большей степени эта разница отмечена спустя неделю от начала лечения. Если в основной группе воспалительный синдром почти полностью стихает, составляя 8,3% от исходного, то в контрольной группе он выражен в 4,2 раза сильнее (35% от исходного).
Сравнительный анализ компонентов воспаления показал следующее. Через двое суток у больных контрольной группы отек увеличивается более, чем в 1,5 раза (157,9% от исходного), а в основной уменьшается на 10%. При этом отек в контрольной группе выражен на 67,9% больше, чем в основной. С 4–ого дня до конца недели констатировано снижение отека в обеих группах. Однако, спадение отека в основной группе идет быстрее. Через 7 дней в основной группе отек почти полностью спадает и составляет почти 5% от исходного. В контрольной же группе к этому времени отек выражен в 9,5 раз больше, чем в основной. Аналогичная тенденция просматривается при анализе динамики гиперемии и гипертермии, которые в контрольной группе через 2 дня увеличиваются соответственно на 10% и 33%, тогда как в основной группе эти показатели уменьшаются соответственно на 10,5% и 14,3%. При этом в контрольной группе гиперемия на 20,5%, а гипертермия на 40,6% превышают показатели основной группы. К исходу первой недели у пациентов контрольной группы гиперемия выражена в 2,9 раз больше, а гипертермия в 9 раз больше, чем в основной группе (соответственно 10,5% и 9,5%). О противовоспалительном эффекте предложенной схемы лечения свидетельствует и то, что в основной группе не было ни одного случая посттравматического синовита, тогда как в группе сравнения он отмечен у 2 из 10 больных с травмой коленного сустава. Таким образом, предлагаемая схема лечения позволяет добиться не только адекватного анальгетического эффекта, но и обеспечивает выраженное противовоспалительное действие. При этом уже в первые дни лечения удается не только избежать нарастания синдрома воспаления (в отличие от группы сравнения), но и уменьшить его на 44,7% в сравнении с контрольной группой. К концу первой недели воспалительный синдром при лечении по предлагаемой схеме выражен уже в 4,2 раза меньше, чем в группе сравнения. Предложенная схема лечения положительно влияет на компоненты синдрома воспаления, но более всего выражен противоотечный эффект. Так, к концу первой недели в основной группе локальный отек выражен в 9,5 раз меньше, чем в группе сравнения. Фликтен (эпидермальных пузырей) у пациентов основной группы не было, тогда как в контрольной группе они отмечены у 7,3% больных. Это позволяет у пациентов основной группы быстрее справиться с острыми посттравматическими изменениями и на несколько дней раньше провести запланированное лечение (функциональное ведение, иммобилизацию глухой гипсовой повязкой или хирургическое вмешательство).
Изменений АД, ЧСС, ЧД и лабораторных данных, обусловленных приемом препаратов, у пациентов основной и контрольной группы не обнаружено. Нежелательные явления у пациентов основной группы выявлены в двух (4,3%) случаях с выраженностью в один балл. Ни в одном случае не потребовалась отмена препарата. В группе сравнения нежелательные явления отмечены у 10 (24,4%) пациентов. Выраженность их была больше, чем в основной группе – в среднем 2,4 балла (у 6 больных – 1,8 балла, у трех – 3,1 балла, у одного – 3,7 балла), что потребовало в 5 случаях снижения дозы препарата, в 1 – его отмен ы. Сопоставительный анализ нежелательных явлений свидетельствует о лучшей переносимости использованных доз НПВП. Это нашло отражение в оценке переносимости препаратов. В основной группе она оценена врачом и пациентом как хорошая и отличная (в среднем 3,4 балла), в контрольной группе – чаще как удовлетворительная и хорошая (всреднем 2,3 балла). Оценка врачом и пациентами анальгетического и противовоспалительного эффектов лечения в основной группе была примерно одинакова и составила в среднем 3,6 балла врачом и 3,8 балла пациентом, т.е. эффект был хорошим или отличным. Оценка анальгетического эффекта лечения в группе сравнения была примерно такой же, как и в основной группе – 3,6 балла врачом и 3,4 балла пациентами. Иначе выглядит в группе сравнения оценка противовоспалительного эффекта. Он был оценен врачом в 1,8 балла, пациентами в 2 балла, т.е. значительно ниже, чем в основной группе. Это свидетельствует о том, что несмотря на применение физиотерапевтического лечения, на фоне приема трамадола ретарда в контрольной группе не удается добиться противовоспалительного эффекта, сравнимого с результатами последовательного применения Кеторола и Найза.
Catad_tema Бронхиальная астма и ХОБЛ - статьи
Противовоспалительная терапия хронической обструктивной болезни легких: настоящее и будущее
С.Н. Авдеев, ФБГУ «НИИ пульмонологии» ФМБА России
Сегодня хроническая обструктивная болезнь легких представляет собой значительную экономическую и социальную проблему и является единственной болезнью, при которой смертность продолжает увеличиваться . По данным ряда недавно выполненных исследований, распространенность хронической обструктивной болезни легких в мире у людей старше 40 лет составляет 10,1% (11,8% у мужчин и 8,5% у женщин) .
Ключевые слова:
хроническая обструктивная болезнь легких, Т-лимфоциты, мокрота, рофлумиласт
Значение воспаления в патогенезе хобл
Хроническая обструктивная болезнь легких (ХОБЛ) -заболевание, характеризующееся ограничением воздушного потока с развитием не полностью обратимой бронхиальной обструкции; ограничение воздушного потока прогрессирует и связано с усиленным патологическим воспалительным ответом дыхательных путей на повреждающие частицы или газы . Курение и другие ингаляционные ирританты инициируют развитие воспалительного ответа в дыхательных путях и легочной паренхиме. Воспаление у «здоровых» курильщиков по составу клеточных элементов, медиаторов и протеаз очень похоже на воспаление у пациентов с ХОБЛ, но менее выражено . Поэтому полагают, что воспаление в дыхательных путях и паренхиме при ХОБЛ представляет собой усиленный хронический воспалительный ответ на ирританты (такие как табачный дым) . Механизм такого усиления или амплификации пока остается до конца не изученным, он может детерминироваться генетическими факторами , латентными вирусными инфекциями и нарушением активности деацетилазы гистонов .
Основное место локализации характерной для ХОБЛ дыхательной обструкции - это малые дыхательные пути (ЦП) диаметром менее 2 мм . Но картина воспалительного инфильтрата в крупных и малых дыхательных путях, а также в легочной паренхиме и стенке легочных сосудов в целом довольно сходная . Данное воспаление может разрешаться или приводить к фиброзу, протеолизу и ремоделированию. Hogg и колл. показали, что по мере возрастания тяжести ХОБЛ происходит прогрессирующее утолщение стенки бронха, вызванное аккумуляцией клеток воспаления, а также накопление избытка слизи в просвете бронха . Воспалительный инфильтрат состоит из нейтрофилов, макрофагов и Т-лимфоцитов (CD4 + и CD8 +) и других клеток (рис. 1).
Рисунок 1.
Патогенез ХОБЛ (Martin et al. Int J COPD 2013)
Одну из ведущих ролей в воспалении при ХОБЛ играют нейтрофилы. O"Donnell et al. показали, что число нейтрофилов в индуцированной мокроте хорошо коррелирует с тяжестью поражения малых ДП по данным КТВР (отношение средних плотностей легких во время выдоха и вдоха), но не с тяжестью эмфиземы . Нейтрофильное воспаление ДП связано с гиперпродукцией секрета в проводящих ДП .
У пациентов с ХОБЛ обнаруживают повышенное содержание макрофагов в ДП, и эти макрофаги могут демонстрировать различные фенотипические черты . Frankenberger и колл. показали, что среди макрофагов, изолированных из индуцированной мокроты пациентов ХОБЛ, 46% были малыми макрофагами, в то время как у здоровых добровольцев обнаруживали лишь 1% малых макрофагов .
Повышенное содержание Т-лимфоцитов при ХОБЛ обнаруживают в проксимальных ДП, в малых ДП и в альвеолах . Saetta и колл. выявили у пациентов с ХОБЛ в эпителии малых ДП CD8+ Т-лимфоциты, экспрессирующие CXCR3, хемокиновый рецептор и его лиганд-интерферон-индуцированный протеин 10/CXCL10 . Аккумуляция активированных CD8+ Т-лимфоцитов в дистальных ДП у больных ХОБЛ была ассоциирована с различными структурными изменениями, что говорит о важной роли этих клеток в патогенезе ХОБЛ .
Пока недостаточно изучена роль в воспалительной реакции ДП таких клеток, как тучные клетки и эозинофилы. Grashoff et al. показали значительное повышение числа интраэпителиальных тучных клеток у пациентов с ХОБЛ, что не исключает их роль в патогенезе структурных изменений, приводящих к бронхиальной обструкции . Эозинофильную инфильтрацию проксимальных ДП обнаруживают у больных ХОБЛ во время обострений , особенно вызванных вирусной инфекцией , и в т. ч. у больных ХОБЛ с хроническим кашлем и выраженной продукцией мокроты .
Анализ бронхиальных биопсий и индуцированной мокроты у бросивших курить пациентов демонстрирует схожий воспалительный процесс, что предполагает персистенцию воспаления даже после прекращения действия ингаляционных ирритантов (курения) .
С учетом такой важной роли воспаления ДП в патогенезе ХОБЛ неудивительно, что противовоспалительной терапии при данном заболевании сегодня уделяют огромное внимание. К числу противовоспалительных препаратов для терапии ХОБЛ сегодня относятся ингаляционные глюкокортикостероиды (ИГКС), а новые перспективы противовоспалительной терапии ХОБЛ связывают с препаратами из класса ингибиторов фосфодиэстеразы-4 (рофлумиласт) , с новыми макролидами и статинами .
Ингаляционные глюкокортикостероиды
Согласно современным руководствам, терапия ИГКС рекомендована больным с тяжелыми и крайне тяжелыми стадиями ХОБЛ при наличии частых обострений; терапия ИГКС добавляется к терапии длительно действующими (ДД) бронходилататорами . Важное место среди лекарственных средств (ЛС), использующихся для длительной поддерживающей терапии ХОБЛ, занимают комбинированные препараты - ИГКС плюс длительно действующие β2-агонисты (ДДБА) . Так же как и ИГКС, комбинированная терапия ИГКС/ (ДДБА) в настоящее время рекомендована для применения больным с III-IV стадиями (по классификации GOLD) и с частыми обострениями . Научное обоснование комбинации ИГКС/ДДБА вытекает из комплементарных эффектов препаратов: ИГКС повышают экспрессию гена β2-рецептора и уменьшают потенциал для развития десенситизации β2-рецептора, в то время как β2-агонисты активируют неактивные ГКС-рецепторы, делая их более чувствительными для стероидзависимой активации .
Данные об эффективности ИГКС у больных ХОБЛ довольно противоречивы. В некоторых краткосрочных исследованиях терапия ИГКС не приводила к значимой модификации воспалительной реакции у больных ХОБЛ (рис. 2) . Однако в ряде работ показано, что терапия ИГКС в сочетании с ДДБА и без них может не оказать влияния на маркеры воспаления в мокроте, но может повлиять на воспаления в стенке бронха по данным биопсий . Краткосрочная терапия ИГКС (в течение 2-3 месяцев) у больных со среднетяжелой ХОБЛ приводила к уменьшению числа тучных клеток, не влияла на СD8 + -лимфоциты, нейтрофилы и макрофаги . Комбинированная терапия ИГКС/ДДБА в течение 3 месяцев оказалась более эффективной по влиянию на бронхиальное воспаление по сравнению с плацебо и, в сравнении с ИГКС, приводила к снижению числа СD8 + -клеток и макрофагов . По данным исследования GLUCOLD, терапия флутиказоном в течение 30 месяцев приводила к стойкому уменьшению числа Т-лимфоцитов и тучных клеток в слизистой бронхов, однако после прекращения терапии ИГКС в течение 6 месяцев вновь наблюдалось усиление воспалительной реакции , т. е. данные этого исследования указывают на то, что противовоспалительные эффекты терапии ИГКС не «закрепляются» надолго .

Рисунок 2.
Влияние терапии на ИГКС и ИГКС/ДДБА на клетки воспаления в дыхательных путях больных ХОБЛ (по данным бронхобиопсии) (Bourbeau J. et al. Thorax 2007)
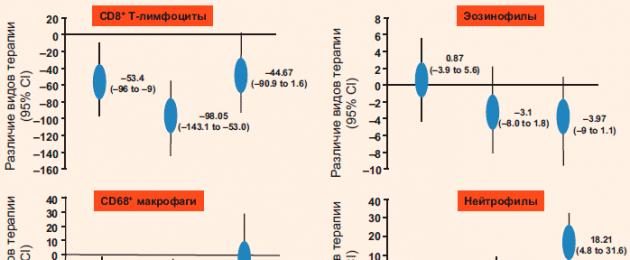
Jen и колл. провели метаанализ на основе 8 рандомизированных исследований, посвященных изучению эффектов ИГКС на маркеры воспаления дыхательных путей по данным бронхоальвеолярного лаважа (БАЛ) (n = 102) и данным эндобронхиальных биопсий (n = 309) . По сравнению с пациентами контрольной группы, у больных, принимавших ИГКС, стандартизованное среднее различие (ССР) по числу нейтрофилов в жидкости БАЛ составило -0,64 ед. (р = 0,003). ИГКС также снижали число лимфоцитов в жидкости БАЛ (ССР -0,64 ед., р = 0,01). Терапия ИГКС не оказывала никакого эффекта на эозинофилы БАЛ, но приводила к повышению числа альвеолярных макрофагов (ССР 0,68 ед., р = 0,002). ИГКС не влияли на число нейтрофилов в бронхиальных биоптатах (ССР 0,61 ед., р = 0,10). Однако терапия ИГКС приводила к достоверному снижению числа CD8-лимфоцитов (ССР -0,66 ед., р = 0,002) и СD4-лимфоцитов (ССР -0,52 ед., р = 0,001) в препаратах эндобронхиальных биопсий. ИГКС не оказывали никакого влияния на число тканевых CD68-макрофагов и эозинофилов. Основные результаты метаанализа схематично представлены в таблице .
Таблица.
Влияние терапии ИГКС на маркеры воспаления дыхательных путей по данным БАЛ (n = 102) и данным эндобронхиальных биопсий (n = 309)
Менее выраженная эффективность ИГКС при ХОБЛ, по сравнению с бронхиальной астмой, может быть объяснена с позиции снижения экспрессии и активности одного из ключевых ядерных ферментов - деацетилазы гистонов-2 (HDAC-2), который необходим для «выключения» активированных воспалительных генов . Снижение активности HDAC-2 и относительная резистентность воспаления при ХОБЛ к ИГКС являются следствием выраженного окислительного и нитративного стресса в дыхательных путях пациентов ХОБЛ .
Согласно ряду исследований регулярная противовоспалительная терапия ИГКС у больных ХОБЛ улучшает симптомы, функциональные показатели, качество жизни и снижает число обострений у пациентов с ХОБЛ . Отмена ИГКС (под прикрытием ДДБА) приводит к снижению ОФВ 1 , нарастанию симптомов, ухудшению качества жизни и повышению числа обострений .
В одном из самых масштабных исследований, проведенных в последнее время (наблюдение за 6 000 больными ХОБЛ на протяжении 3 лет) - TOwards a Revolution in COPD Health (TORCH), было продемонстрировано, что длительная поддерживающая терапия ИГКС (флутиказоном), ДДБА (салметеролом) и ИГКС/ДДБА (салметеролом/флутиказоном) приводит к замедлению скорости снижения OФB1 на 13,13 и 16 мл/год соответственно . Согласно результатам недавно выполненного метаанализа, основанного на 27 исследованиях (30 495 пациентов с ХОБЛ), комбинированная терапия ИГКС/ДЦБА приводит к снижению общей летальности больных на 20% (ОР 0,80; р = 0,005) .
При терапии больных ХОБЛ необходимо помнить о возможных нежелательных реакциях со стороны ИГКС. По данным когортных исследований, применение ИГКС сопровождается определенным риском развития остеопороза и катаракты . Пневмония чаще осложняет терапию ИГКС и ИГКС/ДЦБА по сравнению с ЦЦ бронхолитиками и плацебо , но в то же время на фоне терапии ИГКС/ДЦБА отмечен более низкий уровень летальности и меньшее число обострений ХОБЛ. По данным крупного когортного исследования, терапия ИГКС была ассоциирована с повышением на 34% риска развития сахарного диабета и риском прогрессирования диабета .
Ингибиторы фосфодиэстеразы-4
Ингибиторы фосфодиэстеразы-4 (ФДЭ-4) пока представлены всего одним препаратом - рофлумиластом, который оказывает разнообразное противовоспалительное действие и специфически влияет на основные механизмы воспаления при ХОБЛ. Практически все клетки, участвующие в воспалении дыхательных путей при ХОБЛ, содержат изофермент ФДЭ-4 .
Противовоспалительная активность рофлумиласта в модели астмы на мышах и in vitro в легочных фибробластах эмбриона человека проявлялась в уменьшении ремоделирования дыхательных путей и в антифибротическом эффекте, сравнимом с эффектом дексаметазона при хроническом аллергическом воспалении . В животных моделях ХОБЛ рофлумиласт снижал число нейтрофилов в БАЛ и гиперсекрецию слизи, однако при хроническом воздействии табачного дыма противовоспалительный эффект рофлумиласта проявлялся только при высоких дозах препарата и заключался в уменьшении макрофагального воспаления и уменьшении площади эмфиземы без влияния на гиперплазию бокаловидных клеток . Данные, полученные на различных животных моделях, свидетельствуют о способности рофлумиласта уменьшать содержание нейтрофилов дыхательных путей, но в то же время - о неэффективности таких средств, как метилпреднизолон и дексаметазон .
Grootendorst и колл. в рандомизированном плацебо-контролируемом перекрестном исследовании изучали эффекты рофлумиласта на цитологический профиль индуцированной мокроты у больных ХОБЛ . Терапия рофлумиластом в течение 4 недель привела к улучшению функциональных показателей, а также снижению количества воспалительных клеток в мокроте, таких как нейтрофилы (рис. 3), лимфоциты и эозинофилы . Кроме того, на фоне терапии рофлумиластом отмечено уменьшение концентрации воспалительных маркеров - нейтрофильной эластазы, IL-8, эозинофильного катионного белка и α2-макроглобулина - маркера микроваскулярной проницаемости .

Рисунок 3.
Рофлумиласт уменьшает уровни маркеров воспаления в мокроте больных ХОБЛ (Grootendorst et al. Thorax 2007)
Клиническая эффективность рофлумиласта у пациентов с ХОБЛ среднетяжелого и тяжелого течения была продемонстрирована в серии крупных рандомизированных плацебо-контролируемых исследований. Рофлумиласт не обладает прямым бронхорасширяющим действием, но благодаря своим противовоспалительным эффектам способен улучшить функциональные показатели у пациентов с ХОБЛ . В исследовании Rabe и колл. рофлумиласт улучшил постбронходилатационный OФB1 на 74 мл в минимальной (250 мг/сут) и на 97 мл в максимальной дозировках (500 мг/сут) по сравнению с плацебо .
В двух исследованиях среднее число тяжелых и среднетяжелых обострений ХОБЛ на одного пациента в год значительно снизилось у больных, получавших рофлумиласт, по сравнению с плацебо: отношение риска (ОР; 0,83) независимо от одновременного приема ДДБА .
Rennard и колл. выполнили совокупный post-hoc-анализ исследований, изучавших эффективность рофлумиласта у пациентов с тяжелой и очень тяжелой ХОБЛ (стадии III и IV по классификации GOLD), и показали значительное снижение числа обострений ХОБЛ в подгруппе больных с бронхитическим вариантом ХОБЛ (т. е. с хроническим кашлем и продукцией мокроты) - на 26,2% (р = 0,001), в то время как в целом по группе ХОБЛ снижение числа обострений составило 14,3% (р = 0,026) (рис. 4) . Bateman и колл. на основе двух других исследований проанализировали влияние рофлумиласта на число обострений у пациентов с ХОБЛ с частыми (≥ 2 в год) и нечастыми (< 2 в год) обострениями (рис. 5) . У больных с нечастыми обострениями терапия рофлумиластом приводила к достоверному снижению числа обострений по сравнению с плацебо на 16,5% (р = 0,006). Но у больных с частыми обострениями различие с плацебо оказалось еще более выраженным - 22,3% (р = 0,002).

Рисунок 4.
Терапия рофлумиластом приводит к наибольшему снижению числа обострений у больных с бронхитическим типом ХОБЛ

Рисунок 5.
Терапия рофлумиластом приводит к наибольшему снижению числа обострений у больных ХОБЛ с частыми обострениями
В соответствии с современными рекомендациями GOLD рофлумиласт рассматривается как терапия, назначаемая дополнительно к приему комбинации ИГКС и ДДБА или к приему ДД антихолинергических препаратов у пациентов с выраженными симптомами, тяжелой или очень тяжелой бронхиальной обструкцией и высоким риском обострений .
Из наиболее частых нежелательных явлений можно отметить диарею, тошноту, снижение аппетита, снижение массы тела и головную боль . Большинство нежелательных явлений носили легкий и умеренный характер. Нежелательные явления при приеме рофлумиласта появлялись чаще всего в первые недели приема препарата и разрешались в ходе его дальнейшего приема . У пациентов ХОБЛ, получавших терапию рофлумиластом, было отмечено более частое, по сравнению с плацебо, снижение массы тела. После отмены рофлумиласта масса тела большинства пациентов восстановилась в течение 3 месяцев.
Длительная терапия макролидами
В настоящее время накапливается все больше и больше данных (причем не только в экспериментальных, но и в клинических исследованиях) о том, что макролидные антибиотики обладают важными иммуномодулирующими и противовоспалительными свойствами, которые могут быть использованы для контроля воспаления при хронических заболеваниях дыхательных путей .
Противовоспалительные свойства макролидов тесно связаны с их структурным строением - иммуномодулирующая активность была выявлена только у 14-членных (эритромицин, кларитромицин и ротроксимицин) и 15-членных макролидов (азитромицин), но не у 16-членных макролидов (спирамицин, джозамицин). Сегодня в клинической практике для терапии хронических воспалительных бронхолегочных заболевании используются преимущественно макролиды нового поколения - азитромицин или кларитромицин .
Потенциальными механизмами действия макролидов при хронических воспалительных бронхолегочных заболеваниях могут быть ингибиторные эффекты на секрецию в дыхательных путях , на аккумуляцию нейтрофилов и лимфоцитов в дыхательных путях и антипролиферативное воздействие на активноделящиеся клетки (рис. 6) .

Рисунок 6.
Потенциальные механизмы действия макролидов при хронических воспалительных бронхолегочных заболеваниях
Эффективность терапии макролидами воспалительных заболеваний малых дыхательных путей, уже продемонстрированная во многих исследованиях, может быть связана со способностью макролидов подавлять нейтрофильное воспаление . Принципиальным различием между терапией ГКС/иммуносупрессантами и макролидами является ингибирование различных митоген-активированных протеинкиназ, таких как р38-МАРК, экстрацеллюлярно регулируемой киназы и Janus-N-концевой киназы, а также уменьшение окислительного стресса макролидами, но не ГКС/иммуносупрессантами .
Возможным механизмом положительного влияния макролидов на воспалительный процесс при патологии дыхательных путей является их способность модулировать бактериальную вирулентность. Кроме того, макролиды способны уменьшить формирование биопленок .
Относительно недавно было опубликовано самое масштабное на сегодня исследование, посвященное изучению влияния длительной терапии азитромицином на развитие обострений ХОБЛ . В исследование было включено 1 142 больных ХОБЛ (средний OФB1 40 ± 16%), которые в течение 1-го года принимали либо азитромицин в дозе 250 мг/сут ежедневно (570 пациентов), либо плацебо (572 пациента). Число обострений ХОБЛ оказалось существенно ниже у больных, принимавших азитромицин: 741 против 900 в группе плацебо, т. е. риск развития обострений составил 0,73 (р < 0,001). Частота обострений на одного человека в год составила 1,48 и 1,83, а среднее время до следующего обострения - 266 против 174 дней (р < 0,001) соответственно в группах азитромицина и плацебо (рис.7). Не было отмечено различий между группами пациентов по числу госпитализаций в стационар, однако число незапланированных визитов оказалось меньше среди больных, принимавших азитромицин: 2,46 против 2,57 на одного пациента в год (р = 0,048).

Рисунок 7.
Развитие обострений ХОБЛ при терапии азитромицином и плацебо (Alberts et al. N Engl J Med, 2011) обострений ХОБЛ . В исследование было включено
Несмотря на полученные обнадеживающие данные о возможности использования макролидов у больных с хроническими воспалительными заболеваниями легких, нельзя не обсудить проблему безопасности длительной терапии данными препаратами. Продолжительная терапия макролидами может привести к селекции штаммов микроорганизмов, резистентных к данному классу антибиотиков, что особенно актуально для S. pneumoniae . Кроме того, известны случаи, когда терапия макролидами приводила к развитию побочных явлений со стороны желудочно-кишечного тракта , кардиотоксичным (нарушение внутрисердечной проводимости) и ототоксичным эффектам .
Статины
Довольно неожиданно хорошо изученные «нереспираторные» препараты - статины (ингибиторы ГМГ-КоА-редуктазы) недавно привлекли внимание и с точки зрения терапии ХОБЛ. Статины обладают универсальными противовоспалительными эффектами, в т. ч. они способны уменьшить выраженность воспаления дыхательных путей, индуцированного табачным дымом . Статины уменьшают экспрессию поверхностных молекул адгезии на эндотелиальных клетках, макрофагах и эозинофилах, а также хемокиновых рецепторов, что приводит к снижению рекрутирования и миграции таких клеток воспаления, как нейтрофилы . Кроме того, статины подавляют продукцию провоспалительных цитокинов.
Согласно результатам когортных исследований статины могут уменьшить число обострений и летальность больных ХОБЛ . Также на фоне приема статинов отмечено уменьшение выраженности тяжести обострений, числа интубаций трахеи и потребности использования респираторной поддержки во время обострений . По данным двух исследований, статины способны замедлить прогрессирование ХОБЛ . Lee и колл. показали, что у пациентов с ХОБЛ на фоне приема статинов наблюдается снижение сывороточного уровня СРБ и повышение физической выносливости .
Антагонисты медиаторов
В формировании воспалительного ответа при ХОБЛ участвуют многие медиаторы , и антагонисты некоторых из них теоретически могут быть использованы для контроля воспаления у пациентов с ХОБЛ. Уже сегодня можно привести несколько примеров использования таких препаратов в пилотных исследованиях.
Фактор некроза опухоли (TNF-α) является универсальным цитокином, принимающим участие в хемотаксисе и активации макрофагов и нейтрофилов. Повышенные уровни TNF-a способствуют развитию апоптоза миоцитов поперечно-полосатых мышц и их атрофии . Rennard и колл. провели многоцентровое РКП, в котором изучали эффективность терапии инфликсимабом - человеческим моноклональным антителом к TNF-a - у пациентов с ХОБЛ . Препарат хорошо переносился пациентами, однако не снижал число обострений и не улучшал качество жизни больных. В данном исследовании была отмечена недостоверная тенденция к повышению числа опухолей и пневмоний на фоне приема инфликсимаба .
Цитокин IL-8 также играет большую роль в воспалительном каскаде, приводя к повышенной миграции и активации нейтрофилов . В единственном на сегодня РКП человеческий моноклональный IgG2 к IL-8 (ABX-IL8) назначали пациентам с ХОБЛ в виде 3 инфузий в течение 3 месяцев . По сравнению с плацебо терапия ABX-IL8 привела к статистически значимому улучшению одышки (по шкале Transitional Dyspnea Index), но не было различий по другим показателям эффективности (функциональные параметры, качество жизни и 6-минутный тест). Была отмечена хорошая переносимость препарата.
Лейкотриен В4 (LTB4), дериват арахидоновой кислоты, является хемоаттрактантом и активатором нейтрофилов . Эффективность ингибитора синтеза лейкотриенов BAYx1005 была изучена в небольшом исследовании II фазы у больных ХОБЛ . Терапия препаратом в течение 14 дней приводила к значительному снижению концентрации LTB4 в мокроте по сравнению с плацебо . Так как подавление синтеза лейкотриенов может быть важным методом влияния на нейтрофильное воспаление, обсуждается вопрос о проведении дальнейших исследований с подобными препаратами при ХОБЛ .
Заключение
Воспаление у «здоровых» курильщиков по составу клеточных элементов, медиаторов и протеаз очень похоже на воспаление у пациентов с ХОБЛ, но менее выражено. Поэтому полагают, что воспаление в дыхательных путях и паренхиме при ХОБЛ представляет собой усиленный хронический воспалительный ответ на ирританты (такие как табачный дым). К числу широко используемых противовоспалительных препаратов при ХОБЛ относятся ИГКС, как правило, в виде комбинаций с ДДБА. Новые перспективы противовоспалительной терапии ХОБЛ связывают с препаратами из класса ингибиторов фосфодиэстеразы-4 (рофлумиласт), с макролидами, статинами и новыми антагонистами медиаторов.
ЛИТЕРАТУРА
1. Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for diagnosis, management, and prevention of chronic obstructive pulmonary disease. NHLBI/WHO workshop report. Last updated 2011.
2. Celli B.R., MacNee W. ATS/ERS Task Force. Standards for the diagnosis and treatment of patients with COPD: a summary of the ATS/ERS position paper. Eur Respir J 2004; 23: 932-946.
3. Buist A.S., McBurnie M.A., Vollmer W.M. et al. International variation in the prevalence of COPD (the BOLD Study): a population-based prevalence study. Lancet 2007; 370: 741-50.
4. Mannino D.M., Ноmа D.M., Akinbami L. et al. Chronic obstructive pulmonary disease surveillance - United States, 1971-2000. MMWR Surveill Summ 2002; 51: 1-16.
5. Murray C.J., Lopez A.D. Alternative projections of mortality and disability by cause 1990-2020: Global Burden of Disease Study. Lancet 1997; 349: 1498-504.
6. Barnes P.J., Shapiro S.D., Pauwels R.A. Chronic obstructive pulmonary disease: molecular and cellular mechanisms. Eur Respir J 2003; 22: 672-88.
7. HoggJ.C. Pathophysiology of airflow limitation in chronic obstructive pulmonary disease. Lancet 2004; 364: 709-21.
8. Barnes P.J. Chronic obstructive pulmonary disease. N Engl J Med 2000; 343: 269-80.
9. Barnes P.J. Molecular genetics of chronic obstructive pulmonary disease. Thorax 1999; 54: 245-52.
10. Meshi B., Vitalis T.Z., Ionescu D., Elliott W.M., Liu С., Wang X.D. et al. Emphysematous lung destruction by cigarette smoke. The effects of latent adenoviral infection on the lung inflammatory response. Am J Respir Cell Mol Biol 2002; 26: 52-7.
11. Ito K., Barnes PJ., Adcock I.M. Glucocorticoid receptor recruitment of histone deacetylase 2 inhibits interleukin- lb-induced histone H4 acetylation on lysines 8 and 12. Mol Cell Biol 2000; 20: 6891-903.
12. Hogg J.C., Macklem P.T., Thurlbeck W.M. Site and nature of airway obstruction in chronic obstructive lung disease. N Engl J Med 1968; 278: 1355-1360.
13. O’Donnell R.A., Peebles С., Ward J.A. et al. Relationship between peripheral airway dysfunction, airway obstruction, and neutrophilic inflammation in COPD. Thorax 2004; 59: 837-842.
14. Nadel J.A. Role of neutrophil elastase in hypersecretion during COPD exacerbations, and proposed therapies. Chest 2000; 117: Suppl. 2, 386S-389S.
15. Finkelstein R, Ma H.D., Ghezzo H. et al. Morphometry of small airways in smokers and its relationship to emphysema type and hyperresponsiveness. Am J Respir Crit Care Med 1995; 152: 267-276.
16. Frankenberger М., Menzel М., Betz R. et al. Characterization of a population of small macrophages in induced sputum of patients with chronic obstructive pulmonary disease and healthy volunteers. Clin Exp Immunol 2004; 138: 507-516.
17. Saetta М., Mariani М., Panina-Bordignon P. et al. Increased expression of the chemokine receptor CXCR3 and its ligand CXCL10 in peripheral airways of smokers with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2002; 165: 1404-1409.
18. Fairclough L„ Urbanowicz R.A., Corne J., et al. Killer cells in chronic obstructive pulmonary disease. Clin Sci (Lond) 2008; 114: 533-541.
19. Grashoff W.F., Sont J.K., Sterk P.J., et al. Chronic obstructive pulmonary disease: role of bronchiolar mast cells and macrophages. Am J Pathol 1997; 151: 1785-1790.
20. Saetta М., Di Stefano A., Maestrelli P., et al. Airway eosinophilia in chronic bronchitis during exacerbations. Am J Respir Crit Care Med 1994; 150: 1646-1652.
21. Papi A., Bellettato C.M., Braccioni F., et al. Infections and airway inflammation in chronic obstructive pulmonary disease severe exacerbations. Am J Respir Crit Care Med 2006; 173: 1114-1121.
22. Snoeck-Stroband JB, Lapperre TS, Gosman MM, et al. Chronic bronchitis sub-phenotype within COPD: inflammation in sputum and biopsies. Eur Respir J 2008; 31: 70-77.
23. Rutgers SR, Postma DS, ten Hacken NH, Kauffman HF, Der Mark TW, ter GH, et al. Ongoing airway inflammation in patients with COPD who do not currently smoke. Thorax 2000; 55: 12-18.
24. Antoniu S.A. New therapeutic options in the management of COPD - focus on roflumilast. Int J Chron Obstruct Pulmon Dis 2011; 6: 147-155.
25. Yamaya M, Azuma A, Takizawa H. Macrolide effects on the prevention of COPD exacerbations. Eur Respir J 2012; 40:485-494.
26. Young RP, Hopkins R, Eaton ТЕ. Pharmacological actions of statins: potential utility in COPD. Eur Respir Rev 2009; 18: 1-11.
27. Cazzola M, Dahl R. Inhaled combination therapy with long-acting β 2-agonists and corticosteroids in stable COPD. Chest 2004; 126: 220-237.
Острые респираторные заболе-ва-ния (ОРЗ) остаются самой частой причиной обращений населения за медицинской помощью. Дети болеют чаще, в среднем 4-6 раз в год, а иногда до 8-12 . Однако во многих случаях подростки и взрослые лечатся при легких и даже среднетяжелых формах самостоятельно, вызывая врача только уже при развитии осложнений. В результате этого истинную заболеваемость оценить достаточно сложно. Безусловно, значительное число эпизодов ОРЗ с нетяжелым течением могут быть успешно купированы с помощью средств безрецептурной продажи и остаться нигде не учтенными.
Помимо ОРЗ, пациентам при сочетании симптомов интоксикации с ринитом и фарингитом врачами часто ставится диагноз острой респираторной вирусной инфекции (ОРВИ). Однако дифференцировать в отсутствие результатов лабораторной диагностики вирусную и бактериальную этиологию непросто, а в некоторых случаях невозможно, особенно в первые сутки от начала заболевания или при атипичной этиологии (микоплазменной, хламидийной). Нередко имеется то или иное сочетание вирусов и бактерий. Поэтому для практики термин ОРЗ остается наиболее удобным.
Во многих исследованиях последних десятилетий было показано, что в большинстве случаев этиологическим фактором ОРЗ оказываются вирусы . Среди них часто обнаруживают вирусы парагриппа, гриппа А и В, риновирусы, аденовирусы, респираторно-синцитиальные вирусы и вирусы группы герпеса. Реже выявляют метапневмовирус, бокавирус, коронавирусы, реовирусы, энтеровирусы, что во многом связано с невысокой распространенностью их лабораторной диагностики и неосведомленностью об их значимости врачей. Недавно было показано, что ротавирусы также могут быть причиной развития симптомов ОРЗ даже в отсутствие рвоты и диареи . Бактериальная флора (Streptocoсcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus, Moraxella catarrhalis и другие) обнаруживается существенно реже. В проведенных исследованиях было показано, что они могут быть выявлены и у здоровых лиц, а становятся причиной заболевания при ослабленном иммунитете, чаще у детей раннего и дошкольного возраста, пожилых и страдающих тяжелой хронической патологией. Практически столько же, сколько и типичные бактериальные возбудители (около 10-15%), в этиологической структуре ОРЗ составляет атипичная флора — Mycoplasma pneumoniae и Chlamydophila pneumoniae . Безусловно, вклад того или другого микроорганизма будет различаться год от года в зависимости от территории, сезона и от обследуемого контингента. Во многих случаях комплексное лабораторное обследование не позволяет определить этиологический фактор. Это может быть связано с нарушением техники забора материала для анализа, несоблюдением условий транспортировки, отсутствием соответствующих диагностических реагентов, неизвестным вариантом или мутацией возбудителя.
Основные клинические симптомы ОРЗ, вызываемых различными инфекционными агентами, одинаковы: повышение температуры тела, ринит, фарингит, иногда присоединяются тонзиллит, ларингит и трахеит . Синуситы, отиты, стоматиты, эпиглоттит, бронхиты, пневмонии относят к осложнениям. Частота и выраженность того или другого проявления заболевания зависит и от возбудителя, и от особенностей организма заболевшего.
Терапию врач должен назначить непосредственно после первого осмотра пациента, не дожидаясь результатов лабораторного обследования. В большинстве случаев амбулаторной практики оно не представляется абсолютно необходимым, за исключением диагностики гриппа и стрептококковой инфекции, поскольку целенаправленно действующих против одного возбудителя лекарственных средств, кроме противогриппозных препаратов, в настоящее время не существует. При стационарном лечении осложнений, тяжелых и жизнеугрожающих форм этиологическая диагностика необходима с целью оценки прогноза и подбора наиболее эффективной схемы терапии с учетом свойств патогена.
Невозможность назначения надежной этиотропной терапии в первую очередь диктует необходимость подбора активной патогенетической терапии. Безусловно, она снижает выраженность симптомов и ускоряет сроки выздоровления и при лечении препаратами против гриппа, и при назначении антибактериальных средств. Ключевым звеном патогенеза ОРЗ является воспалительный синдром. За счет него развивается отечность структур, вовлеченных в инфекционный процесс, избыточная продукция слизи, нарушение мукоцилиарного клиренса, сужение просвета дыхательных путей. Воспаление представляет собой выработанную в ходе эволюции защитную реакцию, направленную на локализацию и последующую ликвидацию возбудителя. Однако избыток воспалительных компонентов может приводить к выраженному ухудшению состояния, увеличению продолжительности заболевания, а иногда — к грубому нарушению функции дыхательной системы и других органов. Это может происходить за счет индивидуальной гиперреактивности самого организма, стимуляции α-адренорецепторов респираторными вирусами, что сопровождается интенсификацией выделения вязкой слизи, и воздействия возбудителя на Н1-рецепторы, что вызывает увеличение проницаемости сосудистой стенки с накоплением секрета и отечностью тканей . Высвобождение провоспалительных медиаторов способствует миграции в очаг новых клеток, при разрушении которых выделяются новые активные вещества, усиливающие отек и накопление слизи.
В современных условиях проживания населения загрязненность воздуха в сочетании с высокой концентрацией микроорганизмов в общественных местах формирует практически постоянную реакцию слизистых дыхательных путей, выраженность которой зависит от индивидуальных особенностей организма. Закономерные реакции на контакт с патогеном суммируются с ранее сформировавшимися, что ведет к резкому отеку, сужению просвета, интенсивному выделению вязкой слизи. Затрудненный отток способствует развитию осложнений: синусита, отита, бронхита, пневмонии. На таком фоне растет риск развития жизнеугрожающих состояний: обструктивного ларингита и астматического статуса.
В многочисленных исследованиях было показано, что снижение активности воспалительного процесса благоприятно влияет на течение ОРЗ: снижает выраженность симптомов, облегчая состояние пациента, сокращает продолжительность заболевания, препятствует развитию осложнений . Много лет в качестве активных противовоспалительных средств использовались глюкокортикостероиды. Однако их побочные действия проявляются довольно часто: повышение артериального давления, усиление симптоматики сердечной недостаточности, гипокалиемия с сопутствующими нарушениями ритма сердца и судорогами, гипергликемия, затяжные или рецидивирующие инфекционные заболевания, поражения желудочно-кишечного тракта, ожирение и многие другие. Многочисленные нежелательные явления резко ограничили их частоту применения. Нестероидные противовоспалительные препараты рекомендуются чаще, при ОРЗ — в основном в качестве жаропонижающих и обезболивающих. Известно их купирующее влияние на воспаление. Однако увеличение количества лейкотриенов из-за перераспределения путей метаболизма арахидоновой кислоты нередко приводит к поражению органов желудочно-кишечного тракта, бронхоспазмам и другим побочным эффектам.
Поиск препаратов с противовоспалительным эффектом, безопасных для приема больными любого возраста, привел к появлению в конце прошлого века новой группы лекарств — ингибиторов метаболизма арахидоновой кислоты, не относящихся ни к глюкокортикостероидам, ни к нестероидным противовоспалительным средствам. Первым таким веществом стал фенспирид. Механизм его действия заключается в снижении поступления внутрь лейкоцитов кальция, который активизирует фосфолипазу А2. В результате снижается количество вырабатываемой арахидоновой кислоты и ее метаболитов: простагландинов, тромбоксана, лейкотриенов, что приводит к снижению выраженности отека на всех уровнях респираторного тракта. Его эффективность была подтверждена в ходе эксперимента на животных .
С момента появления на фармацевтическом рынке в конце прошлого столетия фенспирида было проведено большое количество исследований его действия на течение ОРЗ у детей и взрослых. Общее количество участников составило более 6 тысяч . Результаты в основном были сходными. Они показали, что препарат действует практически на все симптомы ОРЗ, сокращает продолжительность заболевания на 2-3 дня, обеспечивает выздоровление 71% детей к 7-му дню, а остальных — к 10-му. В то же время в группе сравнения купирование симптоматики к концу первой недели отмечалось у 50% пациентов, а у другой половины — в течение 2-й недели . Препарат оказывает действие и при ринофарингитах, и при ларингитах, трахеитах, бронхитах, синуситах, а также отитах . Назначение такого лекарственного средства оказывается наиболее выгодным в условиях, когда невозможно предугадать динамику развития инфекционно-воспалительного процесса. Вначале, как правило, беспокоят заложенность носа с теми или иными выделениями (проявления ринита), першение или боли в горле, покашливание. Визуально определяется гиперемия, иногда — зернистость и/или отечность задней стенки глотки, что характеризует фарингит. Практикующим врачам хорошо известно, что при некоторых инфекциях (например, при парагриппе) из носоглотки симптомы довольно быстро распространяются на гортань, трахею и бронхи. Развиваются ларингит с кашлем и осиплостью голоса, трахеит с частым преимущественно сухим кашлем, а затем бронхит. У часто болеющих пациентов или имеющих хроническую патологию того или другого отдела респираторного тракта риск распространения инфекционного процесса резко возрастает. Назначенный при симптомах ринофарингита фенспирид будет оказывать противовоспалительное, противоотечное и подавляющее гиперсекрецию действие и при ларингите, и при трахеите, и при бронхите, и при бронхиолите, и при пневмонии .
Под нашим наблюдением находилось 140 пациентов, больных ОРЗ, в возрасте от рождения до 90 лет (из них детей и подростков — 64, взрослых — 76), получавших фенспирид в рекомендуемых возрастных дозировках. Основным показанием для назначения этого препарата был кашель, развивавшийся из-за воспалительного процесса в носоглотке (у всех 140 пациентов диагностирован острый ринофарингит). У многих больных диагностировали и изменения нижележащих отделов дыхательных путей: гортани (у 25 отмечен острый ларингит), трахее и бронхах (острый трахеит — у 8, острый бронхит — у 29, бронхиолит — у 6). При этом у 54 пациентов на момент назначения фенспирида отмечалось сочетание двух или трех клинических форм. Базисная терапия в большинстве случаев состояла из орошения носоглотки солевыми растворами или антисептиками (118 пациентов), жаропонижающих средств — по мере необходимости. Противовирусная терапия применялась у 43 больных, антибактериальная — у 38.
На 3-и сутки после начала лечения фенспиридом у 132 пациентов (94%) отмечалось улучшение: существенно снижалась частота приступов кашля и покашливаний, особенно в период ночного сна, уменьшалась интенсивность першения в горле, выделений из носа. К 7-му дню выздоровление отмечалось у 103 больных (74%), к 10-му — еще у 21. У 13 пациентов в возрасте от 36 до 90 лет к этому времени отмечалось улучшение, но сохранялся кашель, который был связан с обострением хронического бронхита на фоне отсутствия симптомов ОРЗ. К 21-м суткам на фоне пролонгации терапии фенспиридом обострение в этой группе пациентов было купировано. У троих находившихся под нашим наблюдением препарат был заменен из-за развития нежелательных явлений, возможно связанных с назначенным лечением.
Следует отметить, что хороший результат терапии был отмечен и пациентами, и их родителями в случаях наблюдения за детьми раннего и дошкольного возраста. Это подтверждается тем, что при последующих эпизодах ОРЗ они настаивали на назначении фенспирида или начинали самостоятельно его прием до осмотра врачом.
Полученные нами результаты наблюдения за пациентами подтверждают опубликованные ранее данные об эффективности фенспирида при различных проявлениях ОРЗ, в том числе и на фоне хронической обструктивной болезни легких . При своевременном назначении он обеспечивает профилактику осложнений: бронхита, бронхиолита, пневмонии, синусита, отита. В случаях начала лечения при уже имеющихся симптомах развития инфекционного процесса за пределами носоглотки, что нередко встречается при инфицировании парагриппом, респираторно-синцитиальными вирусами, аденовирусами, метапневмовирусом (частое развитие ларингита, бронхиолита, бронхита, особенно у детей), препарат способствует купированию симптоматики и сокращению периода выздоровления. При развитии ОРЗ на фоне хронических изменений того или другого отдела респираторного тракта фенспирид также оказывает лечебное воздействие.
В проведенных исследованиях было показано, что препарат существенно снижает интенсивность сухого навязчивого кашля, способствует переходу его во влажный, а затем — ускоряет его купирование . Вместе с этим фенспирид, в отличие от глюкокортикостероидов и нестероидных противовоспалительных средств, гораздо реже проявляет побочные действия. Препарат обычно хорошо переносится: не оказывает отрицательного действия на органы желудочно-кишечного тракта, цифры артериального давления, уровень глюкозы и калия.
Из 140 пациентов, находящихся под нашим наблюдением, на фоне лечения ОРЗ фенспиридом нежелательные явления были отмечены только у троих (2%): у двух (женщины 38 и 54 лет) были зарегистрированы жалобы на тахикардию, а у одного (ребенок 11 лет) — на тошноту. Следует отметить, что учащенное сердцебиение появилось на фоне изменений, по данным электрокардиограмм (полная блокады левой ножки пучка Гиса у одной пациентки и синдром Вольфа-Паркинсона-Уайта — у второй), и при наличии диагноза хронического гастродуоденита у ребенка. Это свидетельствует о возможном обострении имеющейся хронической патологии в связи с ОРЗ, а связь с приемом препарата представляется сомнительной. В других исследованиях также было показано, что частота нежелательных явлений при приеме фенспирида незначительна: 2,4%, по данным Н. А. Геппе и соавт. .
Таким образом, фенспирид рекомендуется для лечения ОРЗ у пациентов любого возраста. Его противовоспалительное действие способствует купированию основных симптомов, сокращению периода заболевания и профилактике осложнений, в том числе и у пациентов с фоновой хронической патологией дыхательной системы.
Литература
- Педиатрия. Национальное руководство. Краткое издание / Под ред. Баранова А. А. М.: ГЭОТАР-Медиа 2015. 768 с.
- Трухан Д. И., Мазурова А. Л., Речапова Л. А. Острые респираторные вирусные инфекции: актуальные вопросы диагностики, профилактики и лечения в практике врача терапевта // Терапевтический архив. 2016; 11: 76-82.
- Усенко Д. В., Горелова Е. А., Каннер Е. В. Рациональный подход к терапии ОРВИ и гриппа в клинической практике врача-педиатра // Русский медицинский журнал. 2015; 3: 174-177.
- Плоскирева А. А., Горелов А. В. Возможна ли респираторная форма ротавирусной инфекции? // Инфекционные болезни. 2016; 14 (3): 22-31.
- Львов Н. И., Лихопоенко В. П. Острые респираторные заболевания. Руководство по инфекционным болезням: в 2 кн. 4-е изд., СПб: Фолиант, 2011; 2 (III): 7-122.
- Blasi F. Atypical pathogens and respiratory tract infections // Eur. Respir. J. 2004; 24: 171-181.
- Pricipi N., Esposito S., Blasi F., Allegra L. Role of Mycoplasma pneumoniae and Chlamydia pneumoniae in children with community-acquired lower respiratory tract infections // Clin. Infect. Dis. 2001; 32: 1281-1289.
- Савенкова М. С. Хламидийная и микоплазменная инфекции в практике педиатра // Consilium Medicum (прил. 1). Педиатрия. 2005; 1: 10-17.
- Купченко А. Н., Понежева Ж. Б. Современные принципы диагностики и лечения ОРВИ // Архивъ внутренней медицины. 2016; 1 (27): 6-12.
- Козлов В. С. Роль воспаления в патогенезе респираторных заболеваний // Consilium medicum. 2003; 5 (10): 213-225.
- Спичак Т. В. Место противовоспалительной терапии при острых респираторных заболеваниях у детей // Педиатрия. 2012, 91 (5): 67-73.
- Evrard Y., Kato G., Bodinier M. C., Chapelean B. Fenspiridide and inflammation in experimental pharmacology // Eur. Respir. Rev. 1991; 1 (2): 93-100.
- Геппе Н. А. Программа «Эльф»: эффективность и безопасность использования Эреспала при острых респираторных заболеваниях у детей // Consilium Medicum (прил. 1). Педиатрия. 2005; 1: 29-32.
- Коровина Н. А., Овсянникова Е. М., Далилова И. Е. Комплексная терапия обструктивного бронхита с применением Эреспала (фенспирида) у детей раннего возраста // Клин. фармакология и терапия. 2001; 5: 1-4.
- Самсыгина Г. А., Фитилев С. Б., Левин А. М. Результаты многоцентрового исследования эффективности фенспирида гидрохлорида (Эреспала) при лечении острой респираторной инфекции у детей раннего возраста // Педиатрии. 2002; 2: 81-85.
- Сорока Н. Д., Коршунова Е. В., Гомозова С. П., Власова Т., Котельникова В. Н. Опыт применения фенспирида в раннем реабилитационном периоде при пневмонии у детей // Пульмонология. 2010; 1: 93-98.
- Григорьева Н. Ю., Майорова М. В. Противовоспалительная терапия респираторных заболеваний фенспиридом // Русский медицинский журнал. 2015; 4: 216-219.
Т. А. Руженцова, доктор медицинских наук
ФБУН ЦНИИЭ Роспотребнадзора, Москва