Эти средства профилактического действия, предназначенные для лечения основы болезни - хронического персистирующего воспаления в дыхательных путях. Терапевтический эффект их регулярного применения развивается спустя 2 недели или даже месяц и больше. Это диктует необходимость их длительного приема при персистирующих формах астмы, что и должно быть объяснено пациентам. К средствам базисной терапии БА относят негормональные (стабилизаторы мембран тучных клеток и антилейкотриеновые) и гормональные (ГКС) препараты. Последние, в свою очередь, подразделяют на ингаляционные (ИГКС) и системные ГКС (для перорального и парентерального введения).
Стабилизаторы мембран тучных клеток представлены кромогликатом натрия и недокромилом натрия. Механизм действия препаратов связан с блокадой дегрануляции тучных клеток. Из тучных клеток происходит высвобождение определенных биологически активных веществ, которые участвуют в воспалительной реакции бронхов. Стабилизаторы мембран тучных клеток ингибируют высвобождение данных биологически активных веществ. При длительном, локальном применении на уровне бронхиального дерева данные препараты оказывают специфическое противовоспалительное действие, что приводит к уменьшению гиперреактивности бронхов и клинических проявлений БА. Важным преимуществом кромонов является безопасность при их длительном применении, а недостатком - не всегда достаточная противовоспалительная эффективность в сравнении с ингаляционными глюкокортикостероидами. Также кромоны неэффективны при лечении обострений бронхиальной астмы. Данные препараты применяются при легком эпизодическом течении бронхиальной астмы, перед физической нагрузкой или предстоящем воздействием аллергена. Одной из загадок применения этих препаратов является отсутствие достаточной предсказуемости в результатах. При наличии очевидных показаний к применению, препарат может оказаться неэффективным, а в других случаях оказывает существенное действие, несмотря на менее убедительные предпосылки к использованию. В связи с этим целесообразно проведение 4-6-недельного курса лечения с оценкой эффективности через 2-3 недели. В случае недостаточной эффективности возможна либо взаимозамена этих препаратов, либо подключение ИГКС.
Антигистаминный препарат кетотифен также является стабилизатором мембран тучных клеток. Кетотифен обладает двояким механизмом действия: является Н1-гистаминоблокатором и блокатором дегрануляции тучных клеток. С последним связано его применение для профилактики приступов БА, особенно аллергической природы. Показанием для преимущественного применения является сочетание БА с внелегочными признаками аллергии. Терапевтический эффект препарата развивается медленно, в течение 1-2 мес., и является сравнительно слабым. В связи с этим кетотифен применяется обычно в составе комплексной терапии БА, т.к. позволяет снизить потребность в бронхолитиках и, в ряде случаев, дозировку базисных препаратов. Основным побочным действием, ограничивающим его применение, является седативный эффект (сонливость, легкое головокружение, замедление психических реакций), который обычно исчезает или уменьшается через 5-6 дней начала лечения. Седативный эффект может оказаться полезным у пациентов с нервно-психическим компонентом БА.
Антилейкотриеновые препараты
представлены зафирлукастом и монтерлукастом, сходными по клинической эффективности. Показанием для их преимущественного применения является аспириновая БА. Эффективны также при астме физического усилия. Являются важным дополнением к доступной в настоящее время базисной антиастматической терапии. По механизму действия являются конкурентными, высокоселективными и высокоактивными антагонистами пептидных медиаторов воспаления - лейкотриенов. Применяются для профилактики приступов и в качестве поддерживающей терапии при БА а также как препараты первой линии при неэффективности бета -2-агонистов. Преимуществом препаратов этой группы является их пероральный прием (для пациентов, испытывающих трудности с применением ингаляторов), хорошая переносимость, редкие побочные эффекты, в т.ч. отсутствие седативного эффекта. Монотерапия антилейкотриеновыми препаратами возможна только при БА легкого течения. При более тяжелом течении - только в составе комплексной противовоспалительной терапии. При этом в ряде случаев возможно постепенное снижение дозировок ингаляционных и/или системных ГКС.
В последние годы отмечен значительный прогресс в лечении бронхиальной астмы (БА) . По–видимому, это связано с определением БА, как хронического воспалительного заболевания дыхательных путей, и вследствие этого – с широким применением ингаляционных глюкокортикостероидов (ГКС) в качестве базисных противовоспалительных препаратов. Однако несмотря на достигнутые успехи, уровень контроля над течением заболевания нельзя считать удовлетворительным. Так, например, почти каждый третий больной БА, как минимум, 1 раз в месяц просыпается ночью в связи с симптомами болезни. Более половины больных имеют ограничения физической активности, более трети вынуждены пропускать занятия в школе или отсутствовать на работе. Более 40% больных вынуждены обращаться за неотложной помощью вследствие обострения заболевания. Причины подобной ситуации многообразны, и не последнюю роль в этом играет недостаточная осведомленность врача в патогенезе БА и, соответственно, выбор неправильной тактики лечения.
Определение и классификация БА
Бронхиальная астма хроническое заболевание дыхательных путей, в котором принимают участие многие клетки: тучные клетки, эозинофилы и Тлимфоциты. У предрасположенных лиц это воспаление приводит к повторным эпизодам хрипов, одышки, тяжести в грудной клетке и кашлю, особенно ночью и/или ранним утром. Эти симптомы сопровождаются распространенной, но вариабельной обструкцией бронхиального дерева, которая, по крайней мере, частично обратима, спонтанно или под влиянием лечения. Воспаление также вызывает увеличение ответа дыхательных путей на различные стимулы (гиперреактивность).
Ключевыми положениями определения следует считать следующие:
1. БА хроническое персистирующее воспалительное заболевание дыхательных путей вне зависимости от тяжести течения.
2. Воспалительный процесс приводит к гиперреактивности бронхов, обструкции и появлению респираторных симптомов.
3. Обструкция дыхательных путей обратима, по крайней мере, частично.
4. Атопия генетическая предрасположенность к продукции иммуноглобулинов класса Е (может присутствовать не всегда).
Бронхиальную астму можно классифицировать на основе этиологии, тяжести течения и особенностей проявления бронхиальной обструкции.
Однако в настоящее время бронхиальную астму в первую очередь следует классифицировать по степени тяжести, т.
к. именно это отражает степень выраженности воспалительного процесса в дыхательных путях и определяет тактику противовоспалительной терапии.
Степень тяжести определяется по следующим показателям:
Количество ночных симптомов в неделю. Количество дневных симптомов в день и в неделю. Кратность применения b2–агонистов короткого действия. Выраженность нарушений физической активности и сна. Значения пиковой скорости выдоха (ПСВ) и ее процентное соотношение с должным или наилучшим значением. Суточные колебания ПСВ. Объем проводимой терапии.
Существует 5 степеней тяжести течения БА: легкая интермиттирующая; легкая персистирующая; средней тяжести персистирующая; тяжелая персистирующая; тяжелая персистирующая стероидозависимая (табл. 1).
БА интермиттирующего течения: симптомы астмы реже 1 раза в неделю; короткие обострения (от нескольких часов до нескольких дней). Ночные симптомы 2 раза в месяц или реже; отсутствие симптомов и нормальная функция легких между обострениями: пиковая скорость выдоха (ПСВ) > 80% от должного и колебания ПСВ менее 20%.
БА легкого персистирующего течения. Симптомы 1 раз в неделю или чаще, но реже 1 раза в день. Обострения заболевания могут нарушать активность и сон. Ночные симптомы возникают чаще 2 раз в месяц. ПСВ более 80% от должного; колебания ПСВ 2030%.
БА средней тяжести. Ежедневные симптомы. Обострения нарушают активность и сон. Ночные симптомы возникают более 1 раза в неделю. Ежедневный прием b2агонистов короткого действия. ПСВ 6080% от должного. Колебания ПСВ более 30%.
БА тяжелого течения: постоянные симптомы, частые обострения, частые ночные симптомы, физическая активность ограничена проявлениями астмы. ПСВ менее 60% от должного; колебания более 30%.
Необходимо отметить, что определение степени тяжести астмы по этим показателям возможно только перед началом лечения. Если больной уже получает необходимую терапию, то ее объем также должен учитываться. Таким образом, если у пациента по клинической картине определяется легкая персистирующая астма, но при этом он получает медикаментозное лечение, соответствующее тяжелой персистирующей астме, то у данного пациента диагностируется БА тяжелого течения.
БА тяжелого течения стероидозависимая: независимо от клинической картины пациент, получающий длительное лечение системными кортикостероидами, должен быть расценен, как страдающий БА тяжелого течения.
Ингаляционные ГКС
Рекомендован ступенчатый подход к терапии БА в зависимости от тяжести ее течения (табл. 1). Все препараты для лечения БА разделены на две основные группы: для длительного контроля воспалительного процесса и средства для купирования острых симптомов астмы. Основой терапии для длительного контроля воспалительного процесса являются ингаляционные глюкокортикостероиды (ИГКС), которые следует применять, начиная со второй ступени (легкое персистирующее течение) до пятой (тяжелое стероидозависимое течение). Поэтому в настоящее время ИГКС рассматриваются в качестве средств первой линии для терапии БА. Чем выше степень тяжести течения БА, тем большие дозы ИГКС следует применять. По данным ряда исследований, у пациентов, начавших лечение ИГКС не позже двух лет от начала заболевания, отмечены существенные преимущества в улучшении контроля над симптомами астмы по сравнению с группой, начавшей лечение ИГКС по прошествии более чем 5 лет от дебюта заболевания.
Механизмы действия и фармакокинетика
ИГКС способны связываться со специфическими рецепторами в цитоплазме, активируют их и образуют с ними комплекс, который затем димеризуется и перемещается в ядро клетки, где связывается с ДНК и взаимодействует с механизмами транскрипции ключевых ферментов, рецепторов и других сложных белков. Это приводит к проявлению фармакологического и терапевтического действия.
Противовоспалительный эффект ИГКС связан с их ингибирующим действием на клетки воспаления и их медиаторы, включая продукцию цитокинов, вмешательство в метаболизм арахидоновой кислоты и синтез лейкотриенов и простагландинов, предотвращение миграции и активации клеток воспаления. ИГКС увеличивают синтез противовоспалительных белков (липокортина1), увеличивают апоптоз и снижают количество эозинофилов путем ингибирования интерлейкина5. Таким образом, ИГКС приводят к стабилизации клеточных мембран, уменьшают проницаемость сосудов, улучшают функцию bрецепторов как путем синтеза новых, так и повышая их чувствительность, стимулируют эпителиальные клетки.
ИГКС отличаются от системных глюкокортикостероидов своими фармакологическими свойствами: липофильностью, быстротой инактивации, коротким периодом полувыведения из плазмы крови. Важно учитывать, что лечение ИГКС является местным (топическим), что обеспечивает выраженные противовоспалительные эффекты непосредственно в бронхиальном дереве при минимальных системных проявлениях.
Количество ИГКС, доставляемое в дыхательные пути, зависит от номинальной дозы препарата, типа ингалятора, наличия или отсутствия пропеллента, а также техники выполнения ингаляции. До 80% пациентов испытывают сложности при использовании дозированных аэрозолей.
Наиболее важной характеристикой для проявления селективности и времени задержки препарата в тканях является липофильность . Благодаря липофильности ИГКС накапливаются в дыхательных путях, замедляется их высвобождение из тканей и увеличивается их сродство к глюкокортикоидному рецептору. Высоколипофильные ИГКС быстрее и лучше захватываются из просвета бронхов и длительно задерживаются в тканях дыхательных путей. ИГКС отличает от системных препаратов их топическое (местное) действие. Поэтому бесполезно назначать ингаляции системных ГКС (гидрокортизона, преднизолона и дексаметазона): эти препараты вне зависимости от способа применения обладают только системным действием.
В многочисленных рандомизированных плацебо-контролируемых исследованиях у больных БА показана эффективность всех доз ИГКС в сравнении с плацебо.
Системная биодоступность складывается из пероральной и ингаляционной. От 20 до 40% от ингалируемой дозы препарата попадает в дыхательные пути (это величина значительно варьирует в зависимости от средства доставки и от ингаляционной техники пациента). Легочная биодоступность зависит от процента попадания препарата в легкие, наличия или отсутствия носителя (лучшие показатели имеют ингаляторы, не содержащие фреон) и от абсорбции препарата в дыхательных путях. 6080% ингаляционной дозы оседает в ротоглотке и проглатывается, подвергаясь затем полному или частичному метаболизму в желудочнокишечном тракте и печени. Пероральная доступность зависит от абсорбции в желудочнокишечном тракте и от выраженности эффекта ォпервого прохожденияサ через печень, благодаря чему в системный кровоток поступают уже неактивные метаболиты (за исключением беклометазона 17монопропионата активного метаболита беклометазона дипропионата). Дозы ИГКС до 1000 мкг/сутки (для флютиказона до 500 мкг/сут) обладают незначительным системным действием.
Все ИГКС имеют быстрый системный клиренс , сравнимый с величиной печеночного кровотока. Это один из факторов, снижающих системное действие ИГКС.
Характеристика наиболее часто используемых препаратов
К ИГКС относятся беклометазона дипропионат, будесонид, флютиказона пропионат, флунизолид, триамсинолона ацетонид, мометазона фуроат.
Они выпускаются в виде дозированных аэрозолей, порошковых ингаляторов, а также в виде растворов для ингаляции через небулайзер (будесонид).
Беклометазона дипропионат. Применяется в клинической практике более 20 лет и остается одним из самых эффективных и часто используемых препаратов. Разрешено применение препарата у беременных. Выпускается в виде дозированного аэрозольного ингалятора (Бекотид 50 мкг, Беклофорте 250 мкг, Альдецин 50 мкг, Беклокорт 50 и 250 мкг, Бекломет 50 и 250 мкг/доза), дозированного ингалятора, активируемого вдохом (Беклазон Легкое Дыхание 100 и 250 мкг/доза), порошкового ингалятора (Бекодиск 100 и 250 мкг/доза ингалятор Дискхалер; мультидозовый ингалятор Изихейлер, Бекломет 200 мкг/доза). Для ингаляторов Бекотид и Беклофорте производятся специальные спейсеры ォВолюматикサ (клапанный спейсер большого объема для взрослых) и ォБэбихалерサ (2клапанный спейсер малого объема с силиконовой лицевой маской для детей раннего возраста).
Будесонид. Современный высокоактивный препарат. Используется в виде дозированного аэрозольного ингалятора (Будесонид-мите 50 мкг/доза; Будесонидфорте 200 мкг/доза), порошкового ингалятора (Пульмикорт Турбухалер 200 мкг/доза; Бенакорт Циклохалер 200 мкг/доза) и суспензии для небулайзера (Пульмикорт 0,5 и 0,25 мг/доза). Пульмикорт Турбухалер единственная лекарственная форма ИГКС, не содержащая носителя. Для дозированных ингаляторов Будесонид мите и Будесонид форте производится спейсер. Будесонид является составной частью комбинированного препарата Симбикорт.
Будесонид имеет наиболее благоприятный терапевтический индекс, что связано с его высоким сродством к глюкокортикоидным рецепторам, и ускоренным метаболизмом после системной абсорбции в легких и кишечнике. Будесонид является единственным ИГКС, для которого доказана возможность однократного применения. Фактор, обеспечивающий эффективность применения будесонида один раз в день, ретенция будесонида в дыхательных путях в виде внутриклеточного депо благодаря обратимой эстерификации (образованию эфиров жирных кислот). При снижении концентрации свободного будесонида в клетке активируются внутриклеточные липазы, высвобождающийся из эфиров будесонид вновь связывается с рецептором. Подобный механизм не свойственен другим ГКС и позволяет пролонгировать противовоспалительный эффект. В ряде исследований показано, что внутриклеточное депонирование может оказаться более важным в плане активности препарата, чем сродство к рецептору.
Исследования последних лет по препарату Пульмикорт Турбухалер доказали, что он не влияет на конечный рост при длительном применении у детей, на минерализацию кости, не вызывает ангиопатию и катаракту. Пульмикорт также рекомендован к применению у беременных: установлено, что его применение не вызывает увеличения числа аномалий плода. Пульмикорт Турбухалер является первым и единственным ИГКС, которому FDA (организация по контролю за лекарственными средствами в США) присвоила категорию ォВサ в рейтинге лекарств, назначаемых при беременности. В эту категорию включаются лекарства, прием которых в период беременности является безопасным. Остальные ИГКС относятся к категории ォСサ (прием их во время беременности не рекомендуется).
Флютиказона пропионат. Самый высокоактивный препарат на сегодняшний день. Обладает минимальной пероральной биодоступностью (
В статье рассмотрены факторы, влияющие на степень эффективности и безопасности, особенности фармакодинамики и фармакокинетики современных ингаляционных глюкокортикостероидов, в том числе нового для российского рынка ингаляционного глюкокортикостероида - циклесонида.
Бронхиальная астма (БА) является хроническим воспалительным заболеванием дыхательных путей, характеризующимся обратимой бронхиальной обструкцией и гиперреактивностью бронхов. Наряду с воспалением, а возможно, и в результате восстановительных процессов в дыхательных путях формируются структурные изменения, которые рассматриваются как процесс ремоделирования бронхов (необратимая трансформация), что включает гиперплазию бокаловидных клеток и бокаловидных желез подслизистого слоя, гиперплазию и гипертрофию гладкой мускулатуры, увеличение васкуляризации подслизистого слоя, накопление коллагена в зонах, расположенных ниже базальной мембраны, и субэпителиальный фиброз.
Согласно международным (Global Initiative for Asthma - "Глобальная стратегия по лечению и профилактике бронхиальной астмы", пересмотр 2011 г.) и национальным согласительным документам ингаляционные глюкокортикостероиды (ИГКС), обладающие противовоспалительным эффектом, являются средствами первой линии в лечении среднетяжелой и тяжелой бронхиальной астмы.
Ингаляционные глюкокортикостероиды при длительном их применении улучшают или нормализуют функцию легких, уменьшаются дневные колебания пиковой скорости выдоха, а также снижается потребность в системных глюкокортикостероидах (ГКС) вплоть до полной их отмены. При длительном применении препаратов предотвращается антиген-индуцированный бронхоспазм и развитие необратимой обструкции дыхательных путей, снижаются частота обострений заболевания, число госпитализаций и смертность больных.
Механизм действия ингаляционных глюкокортикостероидов нацелен на противоаллергический и противовоспалительный эффект, в основе данного эффекта лежат молекулярные механизмы двухэтапной модели действия ГКС (геномный и внегеномный эффекты). Терапевтический эффект глюкокортикостероидов (ГКС) связан с их способностью ингибировать образование в клетках провоспалительных белков (цитокинов, оксида азота, фосфолипазы А2, молекул адгезии лейкоцитов и др.) и активировать образование белков, обладающих противовоспалительным эффектом (липокортина-1, нейтральной эндопептидазы и др.).
Местное воздействие ингаляционных глюкокортикостероидов (ИГКС) проявляется повышением количества бета-2-адренергических рецепторов на клетках гладкой мускулатуры бронхов; снижением сосудистой проницаемости, уменьшением отека и секреции слизи в бронхах, снижением числа тучных клеток в слизистой бронхов и усилением апоптоза эозинофилов; уменьшением выброса воспалительных цитокинов Т-лимфоцитами, макрофагами и эпителиальными клетками; уменьшением гипертрофии субэпителиальной мембраны и подавлением тканевой специфической и неспецифической гиперреактивности. Ингаляционные ГКС угнетают пролиферацию фибробластов и уменьшают синтез коллагена, что замедляет темпы развития склеротического процесса в стенках бронхов.
Ингаляционные глюкокортикостероиды (ИГКС) в отличие от системных обладают высокой селективностью, выраженной противовоспалительной и минимальной минералокортикоидной активностью. При ингаляционном пути введения препаратов в легких откладывается приблизительно 10-50% номинальной дозы. Процент отложения зависит от свойств молекулы ИГКС, от системы доставки препарата в дыхательные пути (тип ингалятора) и от техники ингаляции. Большая часть дозы ИГКС проглатывается, абсорбируется из желудочно-кишечного тракта (ЖКТ) и быстро метаболизируется в печени, что обеспечивает высокий терапевтический индекс ИГКС.
Ингаляционные глюкокортикостероиды (ИГКС) различаются по активности и биодоступности, что обеспечивает некоторую вариабельность клинической эффективности и выраженности побочных эффектов у разных лекарственных средств этой группы. Современные ингаляционные глюкокортикостероиды (ИГКС) обладают высокой липофильностью (для лучшего преодоления мембраны клетки), высокой степенью сродства к глюкокортикоидному рецептору (ГКР), что обеспечивает оптимальную местную противовоспалительную активность, и низкой системной биодоступностью, а следовательно, небольшой вероятностью развития системных эффектов.
При использовании разных типов ингаляторов эффективность некоторых препаратов изменяется. С увеличением дозы ИГКС противовоспалительный эффект возрастает, однако начиная с определенной дозы кривая доза-эффект приобретает вид плато, т.е. эффект от лечения не увеличивается, а вероятность развития побочных эффектов, характерных для системных глюкокортикостероидов (ГКС), возрастает. Основными нежелательными метаболическими эффектами ГКС являются:
- стимулирующее действие на глюконеогенез (в результате - гипергликемия и глюкозурия);
- снижение синтеза белка и повышение его распада, что проявляется отрицательным азотистым балансом (похудение, мышечная слабость, атрофия кожи и мышц, стрии, кровоизлияния, замедление роста у детей);
- перераспределение жира, повышение синтеза жирных кислот и триглицеридов (гиперхолестеринемия);
- минералокортикоидная активность (приводит к увеличению объема циркулирующей крови и повышению артериального давления);
- отрицательный баланс кальция (остеопороз);
- угнетение гипоталамо-гипофизарной системы, в результате чего уменьшается продукция адренокортико-тропного гормона и кортизола (надпочечниковая недостаточность).
В связи с тем, что лечение ингаляционными глюкокортикостероидами (ИГКС), как правило, носит длительный (а в некоторых случаях постоянный) характер, то закономерно увеличивается озабоченность врачей и больных относительно способности ингаляционных глюкокортикостероидов вызывать системные побочные эффекты.
Препараты содержащие ингаляционные глюкокортикостероиды
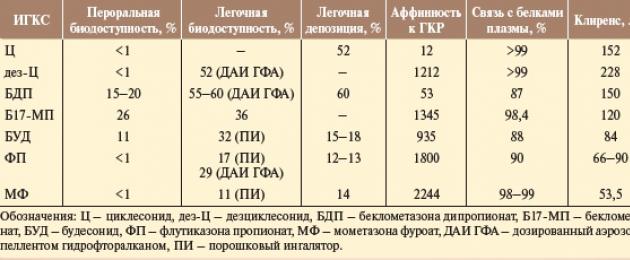
На территории Российской Федерации зарегистрированы и разрешены к применению следующие ингаляционные глюкокортикостероиды: препарат будесонид (суспензию для небулайзера применяют с 6 мес, в виде порошкового ингалятора - с 6 лет), флутиказона пропионат (применяют с 1 года), беклометазона дипропионат (применяют с 6 лет), мометазона фуроат (на территории РФ разрешен у детей с 12 лет) и циклесонид (разрешен у детей с 6 лет). Все препараты обладают доказанной эффективностью, однако различия в химической структуре отражаются на фармакодинамических и фармакокинетических свойствах ИГКС и, следовательно, на степени эффективности и безопасности препарата.Эффективность ингаляционных глюкокортикостероидов (ИГКС) зависит прежде всего от местной активности, что определяется высокой аффинностью (сродство к глюкокортикоидному рецептору (ГКР), высокой селективностью и продолжительностью персистирования в тканях. Все известные современные ИГКС обладают высокой местной глюкокортикоидной активностью, которую определяют по сродству ИГКС к ГКР (обычно в сравнении с дексаметазоном, активность которого принимают за 100) и модифицированными фармакокинетическими свойствами.
Циклесонид (аффинность 12) и беклометазона дипропионат (аффинность 53) не обладают исходной фармакологической активностью, и только после ингаляции, попадая в органы-мишени и подвергаясь действию эстераз, они превращаются в свои активные метаболиты - дезциклесонид и беклометазона 17-монопропионат - и становятся фармакологически активными. Сродство к глюкокортикоидному рецептору (ГКР) у активных метаболитов выше (1200 и 1345 соответственно).

Высокая липофильность и активное связывание с дыхательным эпителием, а также длительность ассоциации с ГКР обусловливают продолжительность действия препарата. Липофильность увеличивает концентрацию ингаляционных глюкокортикостероидов (ИГКС) в дыхательных путях, замедляет их высвобождение из тканей, увеличивает сродство и удлиняет связь с ГКР, хотя до сих пор не определена грань оптимальной липофильности ИГКС.
В наибольшей степени липофильность проявляется у циклесонида, мометазона фуроата и флутиказона пропионата. Для циклесонида и будесонида характерна эстерификация, происходящая внутриклеточно в тканях легких, и образование обратимых конъюгатов дезциклесонида и будесонида с жирными кислотами. Липофильность конъюгатов во много десятков раз превышает липофильность интактных дезциклесонида и будесонида, что обусловливает длительность пребывания последних в тканях дыхательных путей.
Воздействие ингаляционных глюкокортикостероидов на дыхательные пути и их системное действие зависят в большей степени от используемого ингаляционного устройства. Учитывая то, что процессы воспаления и ремоделирования происходят во всех отделах дыхательных путей, включая дистальные отделы и периферические бронхиолы, встает вопрос об оптимальном способе доставки лекарственного препарата в легкие вне зависимости от состояния бронхиальной проходимости и соблюдения техники ингаляции. Предпочтительный размер частиц ингаляционного препарата, обеспечивающий равномерное распределение его в крупных и дистальных бронхах, составляет для взрослых 1,0-5,0 мкм, а для детей - 1,1-3,0 мкм.
Для уменьшения количества связанных с техникой ингаляции ошибок, влекущих за собой снижение эффективности лечения и повышение частоты и выраженности побочных эффектов, способы доставки лекарственных средств постоянно усовершенствуются. Дозированный аэрозольный ингалятор (ДАИ) можно использовать вместе со спейсером. Использование небулайзера позволяет эффективно купировать обострение бронхиальной астмы (БА) в амбулаторных условиях, снижая или отменяя необходимость в инфузионной терапии.
Согласно международному соглашению о сохранении озонового слоя земли (Монреаль, 1987), все производители ингаляционных лекарственных препаратов перешли на бесфреоновые формы дозированных аэрозольных ингаляторов (ДАИ). Новый пропеллент норфлуран (гидрофторалкан, ГФА 134а) значительно повлиял на размер частиц некоторых ингаляционных глюкокортикостероидов (ИГКС), в частности циклесонида: существенная доля частиц препарата имеет размер от 1,1 до 2,1 мкм (экстрамелкодисперсные частицы). В связи с этим ИГКС в виде ДАИ с ГФА 134а имеют самый высокий процент легочной депозиции, например, 52% для циклесонида, а его депозиция в периферических отделах легких составляет 55%.
Безопасность ингаляционных глюкокортикостероидов и вероятность развития системных эффектов определяются их системной биодоступностью (абсорбция со слизистой ЖКТ и легочная абсорбция), уровнем свободной фракции препарата в плазме крови (связь с белками плазмы) и уровнем инактивации ГКС при первичном прохождении через печень (наличие/отсутствие активных метаболитов).
Ингаляционные глюкокортикостероиды быстро всасываются в ЖКТ и дыхательных путях. На абсорбцию глюкокортикостероидов (ГКС) из легких могут оказывать влияние размеры ингалируемых частиц, так как частицы размером менее 0,3 мкм откладываются в альвеолах и всасываются в легочный кровоток.
При использовании дозированного аэрозольного ингалятора (ДАИ) только 10-20% ингалированной дозы доставляется в дыхательные пути, при этом до 90% дозы откладывается в ротоглоточной области и проглатывается. Далее эта часть ингаляционных глюкокортикостероидов (ИГКС), абсорбируясь из ЖКТ, попадает в печеночный кровоток, где большая часть препарата (до 80% и более) инактивируется. В системный кровоток ИГКС поступают преимущественно в виде неактивных метаболитов. Поэтому системная пероральная биодоступность для большинства ингаляционных глюкокортикостероидов (циклесонида, мометазона фуроата, флутиказона пропионата) очень низка, практически равна нулю.

Следует учитывать, что часть дозы ИГКС (примерно 20% номинально принятой, а в случае беклометазона дипропионата (беклометазона 17-монопропионата) - до 36%), поступая в дыхательные пути и быстро абсорбируясь, попадает в системный кровоток. Более того, эта часть дозы может вызывать внелегочные системные нежелательные эффекты, особенно при назначении высоких доз ИГКС. Немаловажное значение в этом аспекте придается типу используемого ингалятора с ИГКС, так как при вдыхании сухой пудры будесонида через Турбухалер легочное отложение препарата увеличивается в 2 раза и более по сравнению с показателем при ингаляции из ДАИ.
Для ингаляционных глюкокортикостероидов (ИГКС) с высокой фракцией ингаляционной биодоступности (будесонид, флутиказона пропионат, беклометазона 17-монопропионат) системная биодоступность может возрастать при наличии воспалительных процессов в слизистой бронхиального дерева. Это было установлено при сравнительном исследовании системных эффектов по уровню снижения кортизола в плазме крови после однократного использования будесонида и беклометазона пропионата в дозе 2 мг в 22 ч здоровыми курящими и некурящими лицами. Следует отметить, что после ингаляции будесонида уровень кортизола у курящих был на 28% ниже, чем у некурящих.
Ингаляционные глюкокортикостероиды (ИГКС) имеют довольно высокую связь с белками плазмы крови; у циклесонида и мометазона фуроата эта связь несколько выше (98-99%), чем у флутиказона пропионата, будесонида и беклометазона дипропионата (90, 88 и 87% соответственно). Ингаляционные глюкокортикостероиды (ИГКС) имеют быстрый клиренс, его величина примерно одинакова с величиной печеночного кровотока, и это является одной из причин минимальных проявлений системных нежелательных эффектов. С другой стороны, быстрый клиренс обеспечивает ИГКС высокий терапевтический индекс. Наиболее быстрый клиренс, превышающий скорость печеночного кровотока, обнаружен у дезциклесонида, что обусловливает высокий профиль безопасности препарата.
Таким образом, можно выделить основные свойства ингаляционных глюкокортикостероидов (ИГКС), от которых преимущественным образом зависят их эффективность и безопасность, особенно при длительной терапии:
- большая доля мелкодисперсных частиц, обеспечивающая высокую депозицию препарата в дистальных отделах легких;
- высокая местная активность;
- высокая липофильность или способность образовывать жировые конъюгаты;
- низкая степень абсорбции в системный кровоток, высокая связь с белками плазмы и высокий печеночный клиренс, чтобы препятствовать взаимодействию ГКС с ГКР;
- низкая минералокортикоидная активность;
- высокая комплаентность и удобство дозирования.
Циклесонид (Альвеско)
Циклесонид (Альвеско) - негалогенизированный ингаляционный глюкокортикостероид (ИГКС), является пролекарством и под действием эстераз в ткани легких превращается в фармакологически активную форму - дезциклесонид. Дезциклесонид имеет в 100 раз большее сродство к глюкокортикоидному рецептору (ГКР), чем циклесонид.Обратимая конъюгация дезциклесонида с высоколипофильными жирными кислотами обеспечивает формирование депо препарата в легочной ткани и поддержание эффективной концентрации на протяжении 24 ч, что позволяет применять Альвеско однократно в сутки. Молекула активного метаболита характеризуется высокой аффинностью, быстрой ассоциацией и медленной диссоциацией с глюкокортикоидным рецептором (ГКР).
Наличие в качестве пропеллента норфлурана (ГФА 134а) обеспечивает существенную долю экстрамелкодисперсных частиц препарата (размер от 1,1 до 2,1 мкм) и высокую депозицию действующего вещества в мелких дыхательных путях. Учитывая то, что процессы воспаления и ремоделирования происходят во всех отделах дыхательных путей, включая дистальные отделы и периферические бронхиолы, встает вопрос об оптимальном способе доставки лекарственного препарата в легкие вне зависимости от состояния бронхиальной проходимости.
В исследовании T.W. de Vries et al. с помощью лазерного дифракционного анализа и метода разных инспираторных потоков было проведено сравнение доставленной дозы и размера частиц различных ингаляционных глюкокортикостероидов ИГКС: флутиказона пропионата 125 мкг, будесонида 200 мкг, беклометазона (ГФА) 100 мкг и циклесонида 160 мкг.
Средний аэродинамический размер частиц будесонида составил 3,5 мкм, флутиказона пропионата - 2,8 мкм, беклометазона и циклесонида - 1,9 мкм. Влажность окружающего воздуха и скорость инспираторного потока не оказывали значимого влияния на размер частиц. Циклесонид и беклометазон (ГФА) имели самую большую фракцию мелкодисперсных частиц размером от 1,1 до 3,1 мкм.
За счет того, что циклесонид является неактивным метаболитом, его пероральная биодоступность стремится к нулю, а также это позволяет избегать таких местных нежелательных эффектов, как орофарингеальный кандидоз и дисфония, что было продемонстрировано в ряде исследований.
Циклесонид и его активный метаболит дезциклесонид при попадании в системный кровоток практически полностью связываются с белками плазмы крови (98-99%). В печени дезциклесонид инактивируется ферментом СУР3А4 системы цитохрома Р450 до гидроксилированных неактивных метаболитов. Циклесонид и дезциклесонид имеют самый быстрый среди ингаляционных глюкокортикостероидов (ИГКС) клиренс (152 и 228 л/ч соответственно), его величина существенно превышает скорость печеночного кровотока и обеспечивает высокий профиль безопасности.
Вопросы безопасности ингаляционных глюкокортикостероидов (ИГКС) наиболее актуальны в педиатрической практике. В ряде международных исследований была установлена высокая клиническая эффективность и хороший профиль безопасности циклесонида. В двух идентичных многоцентровых двойных слепых плацебоконтролируемых исследованиях по изучению безопасности и эффективности Альвеско (циклесонид) принял участие 1031 ребенок в возрасте 4-11 лет. Применение циклесонида 40, 80 или 160 мкг однократно в сутки в течение 12 недель не приводило к подавлению функции гипоталамо-гипофизарно-надпочечниковой системы и изменению уровня кортизола в суточной моче (в сравнении с плацебо). В другом исследовании терапия циклесонидом в течение 6 месяцев не привела к статистически значимым различиям в скорости линейного роста у детей в активной группе лечения и группе плацебо.
Экстрадисперсный размер частиц, высокая легочная депозиция циклесонида и поддержание эффективной концентрации на протяжении 24 ч, с одной стороны, низкая пероральная биодоступность, низкий уровень свободной фракции препарата в плазме крови и быстрый клиренс - с другой, обеспечивают высокий терапевтический индекс и хороший профиль безопасности Альвеско. Длительность персистирования циклесонида в тканях обусловливает его высокую продолжительность действия и возможность однократного применения в сутки, что существенно повышает комплайнс пациента к данному препарату.
© Оксана Курбачева, Ксения Павлова
Глюкокортикостероиды (ГК) широко применяются практически во всех отраслях медицины, в том числе и в пульмонологии. Они являются базисными, т.е. основными, в лечении всех патогенетических вариантов бронхиальной астмы персистирующего течения, начиная с легкой степени тяжести. Тем не менее, как показывает опыт, назначение ГК вызывает опасения не только у пациентов, но даже у врачей. Несвоевременная и неадекватная стероидная терапия может привести не только к неконтролируемому течению бронхиальной астмы, но и к развитию жизнеугрожающих состояний, требующих назначения гораздо более серьезной системной стероидной терапии. В свою очередь длительная системная стероидная терапия даже небольшими дозами может сформировать ятрогенные болезни и синдромы (васкулит, остеопороз, синдром Иценко–Кушинга, ожирение, артериальную гипертензию, сахарный диабет, миодистрофию и т.д.). Мы попытаемся ответить на вопрос, как можно контролировать бронхиальную астму безопасными и эффективными стероидами и как избежать возможных осложнений.
Итак, целями лечения больных бронхиальной астмой являются:
Достижение и поддержание контроля над симптомами.
Предотвращение обострений.
Поддержание показателей функции внешнего дыхания, максимально приближенных к нормальному уровню.
Отсутствие ограничений физической активности, включая занятия физкультурой и спортом.
Отсутствие побочных эффектов и нежелательных явлений от лекарственных препаратов.
Предотвращение формирования необратимой бронхиальной обструкции.
Предотвращение смертности от астмы.
Эти цели отражают понимание бронхиальной астмы, как хронического заболевания с прогрессирующим развитием воспалительного процесса в дыхательных путях, ведущего к проявлению различных симптомов болезни (от незначительных до ярко выраженных) в зависимости от степени этого воспаления. В связи с этим целесообразно напомнить читателям современное определение бронхиальной астмы, приведенное в "Глобальной стратегии лечения и профилактики бронхиальной астмы"; (GINA-2002):
Бронхиальная астма – хроническое воспалительное заболевание дыхательных путей, в котором играют роль многие клетки и клеточные элементы. Хроническое воспаление вызывает сопутствующее повышение гиперреактивности дыхательных путей, приводящее к повторяющимся эпизодам свистящих хрипов, одышки, чувства стеснения в груди и кашля, особенно ночью или ранним утром. Эти эпизоды обычно связаны с распространенной, но изменяющейся по своей выраженности бронхиальной обструкцией, которая часто является обратимой либо спонтанно, либо под влиянием лечения.
В настоящее время бронхиальную астму следует классифицировать в первую очередь по степени тяжести, так как именно это отражает степень выраженности воспалительного процесса в дыхательных путях и определяет тактику противовоспалительной терапии.
Степень тяжести
определяется по следующим показателям:
1. Количество ночных симптомов в неделю.
2. Количество дневных симптомов в день и в неделю.
3. Кратность применения beta2-агонистов короткого действия.
4. Выраженность нарушений физической активности и сна.
5. Значения пиковой скорости выдоха (ПСВ) и ее процентное соотношение с должным или наилучшим значением.
6. Суточные колебания ПСВ.
7. Объем проводимой терапии.
Наиболее важными, как нам кажется, в определении степени тяжести являются не только и не столько симптомы и показатели функции внешнего дыхания (ФВД), сколько объем базисной терапии, необходимый для поддержания нормальной жизнедеятельности человека.
Ступенчатый подход
к терапии бронхиальной астмы отражает объем проводимой терапии в зависимости от тяжести ее течения. Как видно из представленных таблиц, все препараты для лечения бронхиальной астмы разделены на две основные группы: для длительного контроля воспалительного процесса (основные и альтернативные) и для купирования острых симптомов астмы. Основой терапии для длительного контроля воспалительного процесса являются ингаляционные глюкокортикоиды (ИГКС), которые следует применять при персистирующей бронхиальной астме любой степени тяжести. В настоящее время ИГКС рассматриваются в качестве средств первой линии в терапии бронхиальной астмы.
Чем выше степень тяжести течения бронхиальной астмы, тем большие дозы ингаляционных стероидов следует применять. По данным ряда исследований, у пациентов, начавших лечение ИГКС не позже 2 лет от начала заболевания, отмечены существенные преимущества в улучшении контроля над симптомами астмы, по сравнению с начавшими такую терапию по прошествии 5 лет и более.
Противовоспалительный эффект ИГКС связан с их ингибирующим действием на клетки воспаления и их медиаторы, включая продукцию цитокинов, вмешательство в метаболизм арахидоновой кислоты и синтез лейкотриенов и простагландинов, снижение проницаемости микрососудов, предотвращение прямой миграции и активации клеток воспаления, повышение чувствительности beta-рецепторов гладкой мускулатуры. ИГКС увеличивают синтез противовоспалительных белков (липокортина-1), увеличивают апоптоз и снижают количество эозинофилов путем ингибирования интерлейкина-5. Таким образом, ИГКС приводят к стабилизации клеточных мембран, уменьшают проницаемость сосудов, улучшают функцию beta-рецепторов как путем синтеза новых, так и повышая их чувствительность, стимулируют эпителиальные клетки.
ИГКС отличаются от системных глюкокортикостероидов своими фармакологическими свойствами: липофильностью, быстротой инактивации, коротким периодом полувыведения из плазмы крови. Важно учитывать, что лечение ИГКС является местным (топическим), что обеспечивает выраженные противовоспалительные эффекты непосредственно в бронхиальном дереве при минимальных системных проявлениях. Количество ИГКС, доставляемое в дыхательные пути, зависит от номинальной дозы препарата, типа ингалятора, наличия или отсутствия пропеллента, а также техники выполнения ингаляции. Следует учитывать, что около 80% пациентов испытывают сложности при использовании дозированных аэрозолей.
Наиболее важной характеристикой для проявления селективности и времени задержки препарата в тканях является липофильность. Благодаря липофильности ИГКС накапливаются в дыхательных путях, замедляется их высвобождение из тканей и увеличивается их сродство к глюкокортикоидному рецептору. Высоколипофильные ИГКС быстрее и лучше захватываются из просвета бронхов и длительно задерживаются в тканях дыхательных путей. Наиболее высокой липофильностью и противовоспалительной активностью обладает флутиказон пропионат (фликсотид), что позволяет применять его в меньших дозах. Будесонид (пульмикорт), как показали исследования, образует внутриклеточные конъюгаты, также обладающие выраженной липофильностью. Именно липофильность ИГКС отличает их от системных препаратов, поэтому бесполезно назначать ингаляции системных ГКС (гидрокортизона, преднизолона и дексаметазона) – эти препараты вне зависимости от способа применения обладают только системным действием.
К ИГКС относятся беклометазон дипропионат (БДП), будесонид (БУД), флутиказон пропионат (ФП), флунизолид (ФЛУ) и триамцинолона ацетонид (ТА), мометазона фуроат. Они выпускаются в виде дозированных аэрозолей, сухой пудры, а также в виде растворов для использования в небулайзерах.
В многочисленных рандомизированных плацебо-контролируемых исследованиях у больных бронхиальной астмой показана эффективность всех доз ИГКС в сравнении с плацебо (уровень доказательности А). Все ИГКС в эквипотентных дозах обладают противовоспалительным действием (уровень доказательности А). Итак, в GINA-2002 введено понятие эквипотентных, или эквивалентных, доз, указывающее на то, что различные ИГКС отличаются друг от друга по степени противовоспалительного действия. Приблизительные эквипотентные дозы указаны.
Сведения относительно системного эффекта ИГКС весьма разноречивы. Системная биодоступность складывается из пероральной и легочной. Пероральная доступность зависит от абсорбции в желудочно-кишечном тракте и от выраженности эффекта "первого прохождения" через печень, благодаря чему в системный кровоток поступают уже неактивные метаболиты (за исключением беклометазона 17-монопропионата – активного метаболита беклометазона дипропионата). Легочная биодоступность зависит от процента попадания препарата в легкие (что зависит от типа используемого ингалятора), наличия или отсутствия носителя (лучшие показатели имеют ингаляторы, не содержащие фреон) и от абсорбции препарата в дыхательных путях. Так, например, беклометазон дипропионат с фреоновым носителем (CFC, ХФУ или ХФК – хлорфлюорокарбон) используется в дозах, вдвое больших, чем при использовании бесфреонового носителя (HFA или ГФА – гидрофторалкан). Следует отметить, что дозы ИГКС до 1000 мкг/сут обладают минимальным системным действием, несравнимым с использованием любых системных стероидов.
ИГКС отличаются друг от друга не только показателями системной биодоступности, но и рядом других показателей, определяющих их эффективность и безопасность, в том числе и системное действие.
Таким образом, из представленных выше данных видно, что флутиказон пропионат, обладающий высокой тропностью к ГКР, имеет наиболее выраженное противовоспалительное действие и должен использоваться в дозах, вдвое меньших, чем беклометазон дипропионат и будесонид в сравнимых средствах доставки. Флунизолид для достижения сравнимого противовоспалительного эффекта должен использоваться в более высоких дозах, чем беклометазон и будесонид.
Нежелательные эффекты ИГКС
. Особо следует подчеркнуть, что ИГКС обладают минимальными побочными эффектами при правильном подборе и технике ингаляции. Наиболее часто наблюдаются местные нежелательные проявления: кандидоз полости рта и ротоглотки, дисфония, иногда кашель, возникающий вследствие раздражения верхних дыхательных путей. Однако их зачастую можно предотвратить, если пользоваться устройством со спейсером. Полоскание рта водой (с последующим сплевыванием) после ингаляции и использование спейсера может предотвратить развитие кандидоза полости рта и ротоглотки. Все существующие в настоящее время ИГКС всасываются в легких, и, таким образом, неизбежно некоторая их часть попадает в системный кровоток. Риск системных нежелательных эффектов ингаляционных ГКС зависит от дозы и активности ГКС, а также от биодоступности, всасывания в кишечнике, метаболизма при первом прохождении через печень и периода полувыведения той их части, которая всосалась в легких, и, вероятно, в кишечнике. Поэтому системные эффекты будут различны у разных ингаляционных ГКС. Несколько сравнительных исследований продемонстрировали, что будесонид и флутиказон пропионат обладают меньшим системным действием, чем БДП и триамцинолон. Риск системных эффектов также зависит от типа ингалятора: применение спейсеров уменьшает системную биодоступность и риск системных нежелательных действий большинства ГКС. При использовании турбухалер эффективность будесонида возрастает вдвое.
Комбинированная терапия
Хотя ИГКС являются основой терапии бронхиальной астмы, они не всегда позволяют полностью контролировать проявления астмы. В связи с этим возникала необходимость в назначении ингаляционных beta2-агонистов не только по потребности, но и регулярно. Таким образом, возникла необходимость в препаратах нового класса, свободных от недостатков, которые присущи beta2-агонистам короткого действия, и обладающих доказанным длительным протективным и противовоспалительным действием на дыхательные пути. Были созданы и в настоящее время широко применяются beta2-агонисты длительного действия, которые на фармацевтическом рынке представлены двумя препаратами: сальметеролом ксинафоатом и формотеролом фумаратом. В современных руководствах по терапии астмы рекомендовано добавление beta2-агонистов длительного действия при недостаточном контроле бронхиальной астмы монотерапией ингаляционными глюкокортикоидами (начиная со 2-й ступени). В ряде исследований показано, что комбинация (ИГКС+beta2-агонист длительного действия) более эффективна, чем удвоение дозы ингаляционных глюкокортикоидов, и приводит к более значимому улучшению функции легких и лучшему контролю над симптомами астмы. Было отмечено также снижение количества обострений у пациентов, получающих комбинированную терапию, и значимое улучшение качества их жизни. Таким образом, появление комбинированных препаратов, составными компонентами которых являются ингаляционный кортикостероид и beta2-агонист длительного действия, является отражением эволюции взглядов на терапию бронхиальной астмы.
Главным преимуществом комбинированной терапии является повышение эффективности лечения при использовании более низких доз ИГКС. Кроме того, соединение двух препаратов в одном ингаляторе облегчает пациенту выполнение назначений врача и потенциально улучшает комплайнс.
Следует рассматривать данные классы препаратов (ИГКС и beta2-агонисты длительного действия) как синергисты, что обусловлено их комплементарным воздействием на молекулярном и рецепторном уровнях.
ИГКС увеличивают количество beta-рецепторов и повышают их активность. beta-Рецепторы в свою очередь запускают каскад внутриклеточных биохимических реакций, что приводит к активированию глюкокортикоидного рецептора и образованию активного комплекса ГКС + ГКР под действием меньших доз ИГКС, увеличивают транслокацию активного стероидрецепторного комплекса в ядро, где он взаимодействует со специфичной областью гена-мишени (глюкокортикоидчувствительный элемент, ГЧЭ). Это приводит к усилению противовоспалительной активности и вновь к повышению синтеза beta-рецепторов (см. рисунок).
Контролируемые исследования также показали, что введение ИГКС и beta2-агонистов длительного действия в виде комбинированного препарата столь же эффективно, как и раздельное введение каждого из них (уровень доказательности В). Ингаляторы с фиксированными комбинациями препаратов более удобны для пациентов, повышают комплайнс, обеспечивают одновременное введение beta2-агониста и ИГКС. В настоящее время существуют два препарата с фиксированными комбинациями: флутиказон пропионат плюс сальметерол (серетид) и будесонид плюс формотерол (симбикорт).
Серетид мультидиск.
Составными компонентами являются сальметерол ксинафоат и флутиказон пропионат. Обеспечивает высокий контроль над симптомами бронхиальной астмы. Используется только в качестве базисной терапии. Можно назначать, начиная со второй ступени. Препарат представлен в дозировках 50/100 мкг, 50/250 мкг, 50/500 мкг/доза.
Компоненты, входящие в состав серетида, применяются достаточно давно: флутиказон пропионат – с 1993 года, сальметерол ксинафоат – с 1990 года.
Флутиказон пропионат
– один из самых высокоактивных противовоспалительных препаратов на сегодняшний день. Эквивалентные терапевтические (эквипотентные) дозы флутиказон почти в 2 раза меньше, чем у беклометазона дипропионата. Препарат имеет низкую системную биодоступность (~1%), а абсолютная биодоступность составляет 10–30% в зависимости от типа ингалятора. Флутиказон обладает высоким сродством к глюкокортикоидным рецепторам и имеет длительную связь с рецептором. Для предотвращения осиплости голоса и развития кандидоза при приеме флутиказон следует соблюдать те же правила, что и при приеме других ИГКС, т.е. полоскать рот и горло водой после ингаляции. В связи с высоким противовоспалительным действием флутиказон также показан больным с тяжелым течением бронхиальной астмы и зависимостью от системных ГКС. Дозы флутиказон должны подбираться строго индивидуально в зависимости от тяжести течения, ответа на противовоспалительную терапию и индивидуальной чувствительности пациента.
Сальметерол ксинафоат
относится к ингаляционным beta2-агонистам длительного действия с медленным началом действия. Исследования конца 90-х годов показали, что применение beta2-агонистов длительного действия, к которым относятся сальметерол и формотерол, позволяет не только предупредить ночные симптомы и астму физического усилия, но и уменьшить почти вдвое дозу ИГКС, необходимую для достижения адекватного контроля над бронхиальной астмой. Проведенные клинические исследования показали, что beta2-агонисты длительного действия оказывают стабилизирующее влияние на тучные клетки, ингибируют IgE-опосредованное высвобождение ими гистамина, что приводит к уменьшению системной и местной концентрации гистамина. Они также уменьшают проницаемость легочных капилляров, причем в большей степени, чем ИГКС. Важно отметить, что противовоспалительные эффекты beta2-агонистов длительного действия не могут играть определяющей роли у больных бронхиальной астмой, так как снижение чувствительности beta2-адренорецепторов (десенситизация) и "down"-регуляция (уменьшение количества рецепторов) в клетках воспаления возникает быстрее, чем в миоцитах бронхов. Поэтому при систематическом приеме стимуляторов beta2-адренорецепторов толерантность к их противовоспалительным эффектам развивается достаточно быстро. Однако благодаря способности ИГКС увеличивать число и функцию beta2-адренорецепторов, снижая их десенситизацию и "down"-регуляцию, при совместном назначении ИГКС и beta2-агонистов противовоспалительная активность beta2-агонистов длительного действия может проявляться клинически. Сальметерол назначается только в качестве препарата для базисной терапии и не применяется по потребности. Следует использовать только рекомендованные дозы, а для купирования симптомов использовать beta2-агонисты короткого действия. Следует отметить, что сальметерол обладает и рядом неожиданных свойств, в частности вызывает снижение патогенности P.aeruginosa
и протективный эффект в отношении H.influenzae
в культурах эпителия респираторного тракта.
Клинические исследования, проведенные с препаратом "Серетид", доказали его высокую эффективность. Более того, его эффективность при бронхиальной астме была выше, чем у его компонентов, назначаемых по отдельности.
Серетид выпускается в порошковых ингаляторах мультидиск. Данное ингаляционное устройство позволяет не только точно дозировать препарат, но и подсчитывать дозы. В России серетид доступен в следующих дозировках: 50 мкг сальметерола и 100 мкг флутиказон пропионата; 50 мкг сальметерола и 250 мкг флутиказон пропионата.
Следует помнить, что серетид не назначают для купирования симптомов бронхиальной астмы, для этого предпочтительно назначать beta2-агонисты короткого действия.
В нашей стране проведено исследование качестваа жизни больных бронхиальной астмой, принимающих серетид (ИКАР), подтвердившие, что прием серетида улучшает показатели качества жизни пациентов, способствует сотрудничеству пациента с врачом, он более удобен в применении. Изучение предпочтений пациентов также показало преимущество комбинированного препарата.
Симбикорт турбухалер.
Составными компонентами являются будесонид и формотерол фумарат. На российском рынке представлен в дозировке 160/4,5 мкг/доза (дозы препаратов указаны как доза на выходе).
Препарат обладает быстрым началом действия (в течение 1–3 мин) благодаря быстрому действию формотерола. Можно применять однократно, так как доказано 24-часовое действие будесонида. Все это вместе создает возможность гибкого дозирования препарата.
Системные глюкокортикостероиды
Системные стероиды при бронхиальной астме обычно применяются перорально и значительно реже – внутривенно высокими дозами (пульс-терапия) при обострении заболевания.
Предполагаемые механизмы действия такие же, как у ИГКС. Однако системные ГКС могут достигать других клеток-мишеней, чем ингаляционные ГКС, и формировать при длительном приеме системные осложнения.
Следует отличать назначение системных ГКС при признаках обострения бронхиальной астмы и в качестве препаратов для длительного контроля при персистирующей бронхиальной астме. Назначение системных стероидов для длительного контроля астмы сразу определяет больного как тяжелого и требует назначения высоких доз ИГКС и ингаляционных beta2-агонистов длительного действия (табл. 3–5, ступень 4). Недопустимо контролировать бронхиальную астму только системными стероидами. Неназначение ИГКС при этом является грубой врачебной ошибкой, приводящей к развитию тяжелых системных осложнений при недостаточном контроле воспалительного процесса в легких. Осложнения длительного применения системных ГКС известны: остеопороз, артериальная гипертензия, сахарный диабет, подавление функциональной активности гипоталамо-гипофизарно-надпочечниковой системы, катаракта, глаукома, ожирение, истончение кожи с образованием стрий и повышенной капиллярной проницаемостью, мышечная слабость. Если же необходимость в длительном применении системных ГКС все же возникает, несмотря на максимальный объем ингаляционной терапии, то с момента назначения системной стероидной терапии в любой форме пациент должен получать превентивную терапию по поводу остеопороза.
Следует отметить, что терапевтический индекс (соотношение эффект/нежелательный эффект) при длительном лечении бронхиальной астмы ингаляционными ГКС всегда выше, чем при любой длительной пероральной или парентеральной терапии ГКС. Ингаляционные ГКС более эффективны, чем пероральные, принимаемые через день. Если предстоит длительная терапия пероральными ГКС, необходимо обратить внимание на мероприятия, которые уменьшают системные нежелательные эффекты. Для длительного лечения пероральные препараты предпочтительнее парентеральных. Лучше назначать такие пероральные ГКС, как преднизон, преднизолон или метилпреднизолон, поскольку они обладают минимальным минералокортикоидным эффектом, относительно коротким периодом полувыведения и нерезко выраженным действием на поперечнополосатую мускулатуру. Если это возможно, то их следует назначать через день. Длительный прием триамцинолона нежелателен из-за частого развития мышечной дистрофии, похудания, слабости, поражения желудочно-кишечного тракта; препараты триамцинолона категорически противопоказаны беременным женщинам и детям. Дексаметазон при бронхиальной астме не показан для длительного приема в связи с выраженным подавлением функции коры надпочечников, способностью задерживать жидкости и низкой эффективностью в отношении ГКР в легких.
По возможности, при длительной терапии пероральные ГКС следует назначать 1 раз в сутки, утром, ежедневно или через день. Следует еще раз особо подчеркнуть, что выбор системных ГКС для поддерживающей терапии в настоящее время за короткодействующими препаратами. Применение депонированных форм длительного действия в терапии бронхиальной астмы категорически не рекомендуется.
Любой пациент, которому назначены системные ГКС для контроля бронхиальной астмой, в обязательном порядке подлежит тщательному обследованию с целью установления причин, приведших к необходимости данного вида лечения. Наиболее важными факторами являются: врачебные ошибки при терапии бронхиальной астмы (неназначение ИГКС, недооценка степени тяжести бронхиальной астмы на предшествующих этапах, попытка контроля воспаления в период обострения низкими дозами ГКС, что приводит к назначению системных ГКС на длительный срок, применение beta-блокаторов, неправильный подбор системы доставки для ИГКС), низкий комплайнс, продолжающаяся экспозиция аллергенов. В отдельных случаях имеет место неправильный диагноз бронхиальной астмы, где респираторные симптомы являются следствием другой патологии (системные васкулиты, системная склеродермия, дерматомиозит, бронхолегочный аспергиллез, гастроэзофагеальная рефлюксная болезнь, истерия и т.д.). В 5% случаев встречается стероидорезистентность, для которой характерна резистентность стероидных рецепторов к стероидным препаратам. В настоящее время различают две подгруппы: больные с истинной стероидной резистентностью (тип II), не имеющие побочных эффектов при длительном приеме высоких доз системных глюкокортикоидов, и пациенты с приобретенной резистентностью (тип I), имеющие побочные эффекты от приема системных стероидов. В последней подгруппе резистентность скорее всего можно преодолеть повышением дозы глюкокортикоидов и назначением препаратов, имеющих аддитивный эффект.
Необходима разработка диагностических и лечебных программ для пациентов, получающих системную стероидную терапию. Следует провести тщательную дифференциальную диагностику для исключения других заболеваний, имитирующих клиническую картину бронхиальной астмы.
Перед врачом стоит задача контролировать воспалительный процесс при бронхиальной астме наименьшими поддерживающими дозами как системных, так и ингаляционных ИГКС. Внедрение в клиническую практику высоколипофильных ИГКС, в частности флутиказон пропионата, позволяет значительно снизить или даже полностью отменить системные ГКС. К сожалению, в настоящее время не существует фиксированных схем снижения системных ГКС. Поэтому врач должен правильно оценить клиническую картину заболевания, предположить возможные причины стероидозависимости и назначить максимальные дозы высокоэффективных ИГКС, например флутиказон пропионата. Обязательно в качестве контроля за ФВД рекомендовать применение ежедневной пикфлоумстрии и учет приема beta2-агонистов по потребности. Следует снижать системные ГКС постепенно на фоне постоянного приема высоких доз ИГКС. Нам представляется целесообразным снижать системные ГКС медленно, уменьшая дозу не ранее чем каждые 3–4 нед, во избежание развития осложнений. Целесообразно при каждом уменьшении дозы проводить анализ крови. Возможное нарастание СОЭ и эозинофилии может свидетельствовать о проявлении системного заболевания, в том числе васкулита. Желательно также исследовать базальный уровень кортизола, так как после прекращения длительной терапии супрессивными дозами системных ГКС возможно развитие надпочечниковой недостаточности. На фоне снижения системных ГКС нельзя уменьшать поддерживающие дозы ИГКС. После отмены системных стероидов титрование дозы ИГКС должно проводиться с учетом рекомендаций ступенчатого подхода. Представляется целесообразным назначение комбинированной терапии пациентам с тяжелой стероидозависимой бронхиальной астмой.
Центральным звеном в патогенезе бронхиальной астмы (БА) является хроническое аллергическое воспаление нижних дыхательных путей . Это обстоятельство определяет выбор глюкокортикостероидов (ГКС) в качестве основных и наиболее эффективных лекарственных средств (ЛС), применяемых для базовой (ежедневной) терапии БА и лечения обострений этого заболевания .
ГКС в настоящее время рассматриваются как наиболее эффективные препараты для базовой терапии БА. Согласно принятой в доказательной медицине шкале оценки, применение ГКС относится к рекомендациям высшего уровня (уровень рекомендаций А). В большом числе исследований применение этих ЛС сопровождалось значительным улучшением функции дыхания, ростом показателей спирометрии, уменьшением выраженности симптомов бронхиальной астмы, снижением бронхиальной гиперреактивности и улучшением качества жизни (уровень доказательности А). Таким образом, ГКС положительно воздействуют практически на все проявления БА и должны постоянно применяться у всех больных, за исключением пациентов с легким интермиттирующим течением заболевания .
Широкое внедрение ГКС в практику лечения БА стало возможно лишь с появлением форм, использующихся для ингаляций. Применение ингаляций ГКС позволило, во-первых, усилить местные (по отношению к дыхательным путям) эффекты кортикостероидной терапии, а во-вторых, уменьшить выраженность и частоту нежелательных лекарственных реакций (НЛР), связанных с системным действием этих препаратов.
Использование ГКС в виде ингаляций позволяет полностью избежать у больных развития таких грозных осложнений ГКС-терапии, как язва верхних отделов желудочно-кишечного тракта, стероидный диабет и гипертензия. С другой стороны, при применении ГКС в форме ингаляций реже возникают такие НЛР, как синдром Кушинга, вторичная надпочечниковая недостаточность, глаукома и т. д. .
Вместе с тем при всех достоинствах этого метода ингаляционные ГКС в ряде случаев оказываются недостаточно эффективными.
- У больных с обострением БА или очень тяжелым течением заболевания, сопровождающимся значительным снижением бронхиальной проходимости, применение ингаляционных ГКС неэффективно, так как выраженная бронхообструкция существенно снижает поступление этих ЛС в средние и нижние отделы дыхательных путей. Считается, что при бронхообструкции, при которой величина пиковой скорости выдоха снижается до уровня менее 200 мл/с, применение ингаляционных ГКС малоэффективно .
- У ряда пациентов (пожилой возраст, заболевания протекающие с нарушением памяти и интеллекта) при использовании ингаляторов возникают значительные проблемы, которые часто оказывается невозможно устранить, что в свою очередь не позволяет проводить полноценную ингаляционную терапию.
- При очень тяжелом течении астмы или наличии относительной резистентности больного к действию ГКС может отмечаться полная или частичная неэффективность ингаляционных ГКС при их использовании в больших дозах .
- Ингаляционные ГКС практически неэффективны у ряда больных, страдающих особыми клиническими формами БА, например БА с лабильным течением1 .
Таким образом, вопрос о применении системных ГКС (ГКС для приема внутрь, внутривенно или внутримышечно в виде препаратов пролонгированного действия — депо-форм) остается достаточно актуальным, несмотря на высокий риск НЛР и наличие менее «опасных» ингаляционных форм.
Выбор препарата для системного применения
Современные руководства по клинической практике рекомендуют применять для лечения БА средства, обеспечивающие сочетание высокой противовоспалительной и минимальной минералокортикоидной активности. Из таблицы видно, что в наибольшей степени этим требованиям отвечают такие ЛС, как преднизолон и метилпреднизолон.
Фармакокинетика системных ГКС, применяемых для терапии БА
С точки зрения фармакокинетики эти ЛС отличает высокая (около 100%) биодоступность при приеме внутрь. У преднизолона и метилпреднизолона максимальная концентрация в крови отмечается уже через 0,5—1,5 ч после приема. На скорость их всасывания может оказывать влияние одновременный прием пищи — при этом скорость всасывания уменьшается, но биодоступность остается на прежнем уровне. Эти ЛС быстро метаболизируются в печени (период полувыведения составляет соответственно 60 и 200 мин) и выделяются с мочой в виде конъюгатов серной и глюкуроновой кислот.
Вместе с тем благодаря высокой липофильности преднизолон и метилпреднизолон активно распределяются в тканях организма, а период полувыведения из тканей составляет у них 0,5—1,5 сут. .
Эффективность ГКС усиливается при одновременном назначении эритромицина (замедляет метаболизм глюкокортикоидов в печени), салицилатов (увеличение не связанной с белками фракции глюкокортикоидов), эстрогенов. Индукторы микросомальных ферментов печени — фенобарбитал, фенитоин, рифампицин — снижают эффективность этих ЛС.
ГКС ослабляют действие антикоагулянтов, антидиабетических и антигипертензивных препаратов и усиливают действие теофиллина, симпатомиметиков, иммуносупрессоров, нестероидных противовоспалительных средств.
Важным для терапии БА является взаимодействие ГКС с b2-адреностимуляторами. При систематическом приеме стимуляторов b2-адренорецепторов достаточно быстро развивается толерантность к их бронхолитическому действию (происходит снижение чувствительности рецепторов — десенситизация и уменьшение их числа — down-регуляция) . ГКС способны увеличивать число b-адренорецепторов, повышая их транскрипцию, и препятствуют развитию десенситизации и down-регуляции .
Фармакодинамика и НЛР системных ГКС, применяемых для терапии БА
По своим фармакодинамическим особенностям преднизолон и метилпреднизолон практически не отличаются друг от друга. Оба препарата обладают выраженным противовоспалительным действием (преимущественно при аллергической и иммунной формах воспалительного процесса), подавляют синтез простагландинов, лейкотриенов и цитокинов, вызывают уменьшение проницаемости капилляров, снижают хемотаксис иммунокомпетентных клеток и подавляют активность фибробластов, Т-лимфоцитов, макрофагов и эозинофилов .
С другой стороны, применение этих ЛС приводит к задержке в организме натрия и воды (благодаря увеличению реабсорбции в дистальных почечных канальцах) и увеличению массы тела.
Уменьшение под воздействием ГКС всасывания кальция с пищей, снижение его накопления в костной ткани и усиленная экскреция кальция с мочой создают предпосылки для развития другой НЛР ГКС — остеопороза. При длительном применении преднизолона и метилпреднизолона отмечается развитие синдрома Кушинга, стероидного диабета, стимуляция катаболических процессов в коже, костной ткани и мышцах (вплоть до развития мышечной дистрофии и поражений кожных покровов). Эти препараты могут вызывать повышение уровня артериального давления (стероидная гипертензия), лимфоцитопению, моноцитопению и эозинопению.
Длительное применение системных ГКС (особенно в сочетании с хронической гипоксией) вызывает образование стероидных язв желудка и повышает риск кровотечения из верхних отделов ЖКТ.
Одним из самых неприятных последствий длительного использования ГКС является развитие вторичной надпочечниковой недостаточности при отмене ГКС. Риск возникновения вторичной надпочечниковой недостаточности существенно повышается:
- при использовании доз > 2,5-5 мг/сут. (в пересчете на преднизолон2);
- при продолжительности лечения > 10-14 дней;
- при приеме препаратов в вечерние часы.
Особенности фармакодинамики системных ГКС у больных БА
При приеме 40 мг преднизолона внутрь препарат начинает действовать (показатель, оцениваемый у больных БА по величине прироста объема форсированного выдоха за 1-ю секунду — ОФВ1) уже через 3 ч после приема препарата . Максимальный эффект (по влиянию на бронхиальную проходимость) отмечается через 9 ч после приема препарата и сохраняется даже спустя 24 ч после однократного приема. Уровень ОФВ1 достигает исходной величины через 36 ч . Эти данные относятся к больным БА в стабильном состоянии. Метаанализ применения ГКС у больных с тяжелым (уровень ОФВ1 <50% от должной величины) обострением БА показал, что значимое увеличение ОФВ1 у больных с обострением наблюдается не ранее чем через 12—24 ч после начала лечения3 .
При многократном назначении ГКС внутрь у пациентов со стабильным течением БА (преднизолон по 20 мг в день в течение 3 недель) в первую неделю лечения у 70% больных наблюдалось улучшение бронхиальной проходимости (прирост уровня ОФВ1 >10% от исходного). При этом максимальный ответ на лечение преднизолоном был отмечен уже спустя 5,1 сут. .
В целом эффективность системных ГКС у больных БА носит дозозависимый характер и повышается при постоянном приеме этих ЛС по сравнению с альтернирующим . Эффективность системных ГКС при купировании обострений БА (оценивается по числу больных, которые благодаря использованию системных ГКС избежали госпитализации в стационар) значительно выше, если они применяются в течение первого часа после появления симптомов обострения .
ПРИМЕНЕНИЕ СИСТЕМНЫХ ГКС НА ПРАКТИКЕ С ТОЧКИ ЗРЕНИЯ ДОКАЗАТЕЛЬНОЙ МЕДИЦИНЫ
С точки зрения доказательной медицины для назначения системных ГКС можно выделить несколько показаний .
Терапия обострения БА
Согласно глобальной стратегии по бронхиальной астме, системные ГКС должны применяться при всех обострениях БА4 (уровень рекомендаций A), кроме самых легких, особенно в тех случаях, когда :
- после первого введения b2-агонистов не отмечается длительного улучшения состояния больного;
- обострение БА развилось несмотря на то, что больной уже принимает ГКС внутрь;
- предшествующие обострения требовали приема системных ГКС;
- необходимо увеличение доз ингаляционных ГКС при обострениях БА (уровень рекомендаций D).
- Подобного мнения придерживаются эксперты Британского торакального общества, которое также выработало свои критерии назначения системных ГКС при обострениях астмы (уровень рекомендаций D) :
- ухудшение состояния и усиление симптомов "день ото дня";
- падение пиковой скорости выдоха ниже 60% от индивидуального лучшего показателя;
- нарушение сна из-за симптомов БА;
- постоянное наличие симптомов астмы в утренние часы (до полудня);
- уменьшение ответа на ингаляционные бронхолитические средства;
- появление/увеличение потребности в ингаляциях бронхолитических средств.
Исходя из этих рекомендаций для купирования обострений ГКС следует принимать перорально, так как назначение этих ЛС внутривенно не обеспечивает дополнительных преимуществ. Внутривенно ГКС должны применяться только у тех больных, которые по ряду причин не могут принимать таблетированные ЛС (уровень рекомендаций А).
Лучшие результаты отмечаются при назначении ГКС в течение первого часа после появления симптомов обострения (уровень рекомендаций В) .
Лечение обострения начинают с применения преднизолона внутрь в дозах от 60 до 80 мг или гидрокортизона — от 300 до 400 мг в день. Эти дозы являются адекватными для большинства госпитализированных пациентов (уровень рекомендаций В) .
Продолжать терапию ГКС следует в течение 10-14 дней у взрослых и 3—5 дней у детей (уровень рекомендаций D), хотя в ряде случаев, например при длительном сохранении симптомов обострения, курс лечения может быть продлен до трех недель (уровень рекомендаций С) .
Доказательств преимуществ постепенного снижения доз пероральных ГКС не существует (уровень рекомендаций B) , поэтому отмену ГКС следует проводить одномоментно. Разумеется, в этом случае больной должен заранее (за несколько дней до отмены преднизолона) начать прием ингаляционных ГКС.
Постепенное снижение дозы показано в тех случаях, когда больной принимал системные ГКС более 2—3 недель. В этом случае дозу уменьшают постепенно (в течение нескольких недель). Аналогичная ситуация может возникнуть и в том случае, когда больному не были заблаговременно назначены ингаляционные ГКС, так как нельзя отменять прием ГКС внутрь до присоединения к терапии ингаляционных ГКС.
Обычно после выписки из стационара пациенты продолжают прием системных ГКС (30—60 мг/сут.), по крайней мере, в течение 7—10 дней5 (уровень рекомендаций А) , особенно если в условиях стационара не были назначены ингаляционные ГКС.
Тяжелое течение БА
Больные с очень тяжелым течением БА, у которых симптомы заболевания сохраняются несмотря на применение максимальных доз ингаляционных ГКС, являются кандидатами для терапии системными ГКС. При этом назначению ГКС внутрь должно предшествовать применение всех имеющихся в распоряжении врача дополнительных средств для контроля за течением БА (пролонгированные b2-агонисты, пролонгированные теофиллины и т. д.) (уровень рекомендаций А) . Больные, требующие постоянного приема ГКС внутрь, должны наряду с этим получать ингаляционные ГКС (уровень рекомендаций А) , для того чтобы уровень поддерживающей дозы был минимальным. Для длительной терапии пероральными ГКС прием препаратов следует назначать однократно утром каждый день или через день .
«Трудная» астма
«Трудная» астма — термин, который ввел в медицинский обиход Barnes в середине 90-х годов . Это понятие объединяет несколько форм бронхиальной астмы, представляющих особые трудности для терапии: лабильная астма (см. выше), БА, связанная с менструальным циклом, ГКС-резистентная астма, БА у больных с гиперчувствительностью к грибковым и профессиональным аллергенам и т. д. Отличительной чертой большинства форм «трудной» астмы является необходимость ежедневного приема ГКС внутрь (в ряде случаев в высоких дозах).
Безопасность лечения
Применение ГКС внутрь требует постоянного контроля со стороны врача за безопасностью лечения и коррекции неизбежных осложнений. Больной должен быть информирован о возможных НЛР, а также использовать простейшие правила их профилактики (например, прием препарата только в утренние часы).
Наиболее актуальными в этом плане представляются следующие меры:
- тщательный сбор и анализ жалоб, связанных с верхними отделами ЖКТ, при подозрении на развитие стероидной язвы - проведение ЭГДС; профилактическое назначение противоязвенных средств у больных с заболеваниями желудка в анамнезе (ранитидин или омепрозол по 1 таблетке на ночь);
- контроль уровня АД и его медикаментозная коррекция;
- регулярное исследование уровня сахара крови;
- регулярное обследование у окулиста;
- ежегодное проведение денситометрии6, профилактическое назначение препаратов кальция, витамина D3;
- исследования, направленные на выявление грибковых инвазий и туберкулеза.
У больных герпесом, а также у лиц, контактировавших с больными ветряной оспой, применение ГКС необходимо немедленно прекратить.
Заключение
Системные ГКС продолжают занимать важное место в терапии БА благодаря своей высокой эффективности, однако их применение неизбежно сопровождается развитием НЛР. Цель врача — правильно определить показания к использованию системных ГКС, максимально уменьшить объем их использования за счет комбинирования с ингаляционными ГКС и другими ЛС (пролонгированные b2-агонисты, пролонгированные теофиллины и т. д.) или применения альтернирующих курсов лечения.
С другой стороны, не следует пренебрегать назначением коротких (и относительно безопасных) курсов ГКС у больных с обострением БА или оттягивать их назначение до последнего. Применение ГКС внутрь представляет собой общепризнанную терапевтическую тактику лечения БА и служит в первую очередь интересам самого больного.
Однако во всех случаях применения ГКС необходим целенаправленный контроль и последующая коррекция неизбежно возникающих НЛР.
А. Н. Цой
, доктор медицинских наук, профессор
В. В. Архипов
ММА им. И. М. Сеченова, Москва
Литература
- Barnes P. J., Chung K. F., Page C. P. Inflammatory Mediators of Asthma: An Update // PHARM. REV. 1998. Vol. 50. № 4. 515-596.
- NHLBI/WHO Workshop Report: Global Strategy for Asthma Management and Prevention // NIH Publication. № 02-3659. February 2002. P. 1-177 (рус. перевод М.: Атмосфера, 2002).
- Доказательная медицина // Клиническая фармакология. 1999. 6. с. 3-9.
- Barnes P. J., Pedersen S., Busse W. W. Efficacy and safety of inhaled corticosteroids // Am. J. Respi. Crit. Care Med. 1998. 157. s 51-s 53.
- Lipworth B. J. Treatment of acute asthma // Lancet. 1997. 350 (suppl. II). P. 18-23.
- Barnes P. J., Woolcock A .J. Difficult asthma // Eur. Respir. J. 1998. 12: 1209-1218.
- Ayres J. G. Classification and management of brittle asthma // Br. J. Hosp. Med. 1997. 57: 387-389.
- Mosby"s Drug Consult. Mosby"s GenRx(r), 2002, 12th ed. Версия для Internet. Web site: www.mdconsult.com
- Barnes P. J., Chung K. F., Page C. P. Inflammatory Mediators of Asthma: An Update // PHARM. REV. 1998. Vol. 50. №. 4. 515-596.
- Barnes P. J. Effects of b2-agonists and steroids on b2-adrenoreceptor // Eur. Respir. Rev. 1998. 8: 55; 210-215.
- Kia Soong Tan, McFarlane L. C., Lipworth B. J. Concomitant Administration of Low-Dose Prednisolone Protects Against In Vivo beta2-Adrenoceptor Subsensitivity Induced by Regular Formoterol. Chest 1998; Vol. 113: № 1; 34-41.
- Mak J. C. W., Nishikawa M., Barnes P. J. Glucocorticosteroids increase b2-adrenergic receptor transcription in human lung // Am. J. Physiol. 1995. 268: L41-46.
- Ellul-Micallef R., Borthwick R. C., McHardy G. J. R. The time course of response to prednisolone in chronic bronchial asthma // Clinical Science and Molecular Medicine Clin. Sci. Mod. Med. 1974. 47 105-117.
- Ellul-Micallef R., Borthwick R. C., McHardy G. J.R. The effect of oral prednisolone on gas exchange in chronic bronchial asthma // Br. J. Clin. Pharmacol. 1980. 9: 479-482.
- Ellul-Micallef R., Johansson S. A. Acute dose response studies in bronchial asthma with a new corticosteroid, budesonide // Br. J. Clin. Pharmacol. 1983. 15: 419-422.
- Rodrigo G, Rodrigo C. Corticosteroids in the emergency department therapy of acute adult asthma // Chest. 1999. 116: 285-295.
- Webb J., Clark T. J. H., Chilvers C. Time course of response to prednisolone in chronic airflow obstruction. Thorax. 1981. 36: 18-21.
- Lin R. Y., Persola G. R., Westfal R. E. Early Parenteral Corticosteroid Administration in Acute Asthma // American Journal of Emergency Medicine. Volume 15. № 7. November 1997. P. 621-625.
- Canаdian asthma consensus report, 1999 // CMAJ. 1999; 161 .
- The British Guidelines on Asthma Management: 1995 review and position statement. Thorax, 1997; 52 (suppl I): 1-21.
2 Преднизолон в дозе 5 мг по своей ГКС-активности эквивалентен 4 мг метилпреднизолона.
3 При этом трудно дефференцировать прирост ОФВ1 вследствие противовоспалительного действия ГКС от увеличения ОФВ1 под влиянием бронхолитиков, которые получали все больные с тяжелым обострением БА.
4 Под обострением БА понимают:
- обращение за скорой медицинской помощью и/или госпитализацию в стационар в связи с ухудшением течения БА;
- необходимость в приеме ГКС внутрь;
- значительное (>2 раз) увеличение потребности в ингаляциях b2-агонистов по сравнению с исходным периодом на протяжении двух или более дней подряд;
- снижение уровня пиковой скорости выдоха или объема форсированного выдоха за 1-ю секунду <50% от должного значения.
5 Pекомендация западных специалистов, где, как правило, продолжительность госпитализации невелика.
6 Особенно важно контролировать показатели минерального обмена костной ткани у женщин менопаузального возраста, у лиц с неблагоприятной наследственностью, у больных с переломами конечностей в анамнезе и т. д.