«Антибиотики и химиотерапия», 2003, 48 (10): 32-39.
Статья размещена с любезного разрешения Ефременковой Ольги
Владимировны, зав. сектором поиска природных соединений
НИИ по изысканию новых антибиотиков им. Г.Ф. Гаузе РАМН
Коммуникативные сигналы бактерий
В.Д. Грузина
Научно-исследовательский институт по изысканию новых антибиотиков им. Г. Ф. Гаузе РАМН, Москва
V.D. Gruzina. Bacteria Communicative Signals
G.F. Gause Institute of New Antibiotics, Russian Academy of Medical Sciences, Moscow
В настоящее время наблюдается переход от традиционного представления о бактериях как строго одноклеточных организмах к представлению о микробных сообществах как целостных структурах, регулирующих свои поведенческие реакции в зависимости от изменения условий обитания.
Колонии практически всех видов бактерий демонстрируют способность к клеточной дифференцировке и многоклеточной организации. Эта способность наиболее очевидно проявляется при росте бактерий в их природных местах обитания, где они формируют различные многоклеточные структуры: биоплёнки, бактериальные маты, плодовые тела и др.
Понятие «ощущение кворума» (Quorum Sensing) было предложено в 1994 году. Оно означает восприятие клетками изменений среды, которые наступают при достижении бактериальной культурой некоторой пороговой численности, и реакцию на эти изменения.
К числу описанных процессов, протекающих лишь при достаточно высокой плотности популяции, относятся следующие явления:
- биолюминесценция у морских бактерий Vibrio fisheri и V.harveyi ;
- агрегация клеток миксобактерий и последующее формирование плодовых тел со спорами;
- споруляция у бацилл и актиномицетов;
- стимуляция роста у стрептококков и ряда других микроорганизмов;
- конъюгация с переносом плазмид у Enterococcus faecalis и родственных видов, а также у бактерий рода Agrobacterium ;
- синтез экзоферментов и других факторов вирулентности у патогенов растений (Erwinia carotovora , E.hyacinthii и др.) и животных (Pseudomonas aeruginosa , Staphylococcus aureus );
- образование антибиотиков у представителей рода Streptomyces и у E.carotovora ;
- формирование биоплёнок у Р.aeruginosa и других микроорганизмов.
Раскрыты механизмы многих из указанных процессов, определены факторы межклеточной коммуникации, отвечающие за процессы, зависящие от плотности популяции.
Серьёзной проблемой клинической практики является широкое распространение устойчивых форм микроорганизмов, снижающее эффективность применения антибактериальных препаратов. Особенную трудность представляет повышенная лекарственная устойчивость бактерий в биоплёнках. Для синтеза факторов вирулентности, антибиотиков и формирования биоплёнок бактерии часто используют реакции кворум-сенсинга. Поэтому изучение механизмов таких реакций открывает новые возможности для предупреждения и лечения болезней, вызванных микробными агентами, а также позволяет по-иному взглянуть на сложный комплекс межвидовых бактериальных взаимодействий в природных местах обитания микроорганизмов.
Механизмы реакций кворум-сенсинга различаются у грамположительных и грамотрицательных бактерий, поэтому целесообразно их рассмотрение в отдельности.
Реакции кворум-сенсинга у грамположительных микроорганизмов
Грамположительные бактерии обычно осуществляют коммуникации, используя олигопептидные сигнальные молекулы. Передача сигналов в большинстве случаев включает двухкомпонентный механизм фосфорилирования. Как правило, состояние кворума достигается при переходе популяции бактериальных клеток в стационарную фазу роста. Именно в это время обнаруживаются сигнальные молекулы, при помощи которых клетки контактируют друг с другом. Общую схему коммуникаций грамположительных бактерий можно представить следующим образом: сначала в клетке синтезируется предшественник, который, модифицируясь, превращается в зрелый олигопептид. Последний экскретируется наружу клетки экспортером. Молекулы олигопептида накапливаются в межклеточном пространстве по мере того, как растёт плотность бактериальных клеток. Двухкомпонентная сенсорная киназа, пронизывающая мембрану, распознает сигнал и осуществляет его передачу в клетку в процессе каскадного фосфорилирования. В клетке олигопептидная молекула взаимодействует с целевым геном (генами).
Классической пептидной кворум-зависимой системой можно считать систему, отвечающую за конъюгативный перенос плазмид у Enterococcus faecalis и родственных бактериальных видов. Эта система стимулирует распространение в микробной популяции признаков, важных для взаимодействия микроорганизма и животного-хозяина, а также для устранения конкуренции. Переносимая пептидной кворум-зависимой системой плазмида pPDl отвечает за синтез гемолизинов, плазмида pCDl - за образование бактериоцина, плазмида pCFlO - за устойчивость E.faecalis к тетрациклину. Каждый гекса- или октапептид индуцирует слипание бактериальных клеток и их конъюгацию с переносом от донора к реципиенту определенной плазмиды. Например, октапептид cPDl стимулирует конъюгативный перенос плазмиды pPDl. Плазмида кодирует рецептор, находящийся на белке-репрессоре соответствующего оперона. Взаимодействие олигопептида с рецептором вызывает диссоциацию репрессора от ДНК, тем самым запуская синтез соответствующего продукта. Плазмида pPDl включает также ген traC, продуктом которого является белок, облегчающий проникновение пептида через клеточную стенку. Олигопептидные сигналы интенсивно синтезируются клетками, не несущими соответствующие плазмиды (реципиентами), в то время как у клеток-доноров синтез таких сигналов подавлен, более того, плазмида кодирует ингибирующий пептид.
Продуктом плазмиды pPDl является пептид iPDl, HHaKTHBHpyiounmcPDl.
Другим кворум-зависимым процессом, обнаруженным у E.faecalis , является выработка двух вирулентных факторов: желатиназы (GelE) и сериновой протеазы (SprE).
Примером использования пептидного сигнала для осуществления межклеточных взаимодействий может служить система кворум-сенсинга, осуществляющая контроль над синтезом экзотоксинов в поздней логарифмической фазе роста у Staphylococcus aureus . В этой системе белок AgrD синтезируется в виде предшественника, состоящего из 46 аминокислот, который в процессе экспорта белком AgrB превращается в зрелый пептид AIP (autoinducing peptide), состоящий из 8 аминокислот. AIP распознается двухкомпонентной сенсорной киназой AgrC, которая передает сигнал внутрь клетки в процессе фосфорилирования регулятора ответа - AgrA. AgrA~P активирует транскрипцию целевых генов, стимулирует транскрипцию оперона agrB, D, С, А (положительная ауторегуляторная петля), а также «запрещает» транскрипцию генов, кодирующих другие экзотоксины. На основании различий в AIP и его рецепторе штаммы S.aureus могут быть отнесены к четырём или более группам. Олигопептиды, синтезируемые одной из групп, индуцируют патогенность в этой группе и специфически подавляют системы Agr-вирулентности в других группах.
От плотности популяции зависит появление компетентности в поздней логарифмической фазе роста у Streptococcus pneumoniae . Ген соmС кодирует предшественник, состоящий из 41 аминокислотного остатка. Последний преобразуется в зрелый пептид, состоящий из 17 аминокислотных остатков в процессе взаимодействия с системой экспорта пептидов (АВС-система), которую образуют продукты генов соmАВ. Пептид контактирует со своим рецептором на поверхности клетки - гистидинкиназой, продуктом гена comD. Активированная гистидинкиназа фосфорилирует продукт гена соmЕ. По мере накопления клеток количество пептидных сигналов растёт и достигает в среде критического уровня. Соответственно увеличивается и количество фосфорилированного белка cоmЕ, который, начиная с определенной концентрации, связывается с промотором оперона comCDE, стимулируя его работу (положительная ауторегуляторная петля), активирует промотор оперона соmАВ (система экспорта белка из клетки), активирует оперон сотХ, который включает целую цепочку поздних генов компетентности; отвечающих за связывание и поглощение трансформирующей ДНК и все остальные, поздние стадии трансформации.
В добавление к приведённым примерам реакций кворум-сенсинга у грамположительных бактерий нужно отметить, что в качестве сигнальных молекул помимо олигопептидов грамположительными бактериями также используются вещества другой химической природы. Так, у представителей порядка Actinomycetales наряду с пептидными сигнальными молекулами были обнаружены вещества низкомолекулярной природы, большинство из которых содержит лактонную группировку.
У стрептомицетов в системы кворум-сенсинга вовлечены бутиролактоны и соответствующие им белковые рецепторы, которые совместно регулируют морфологическое развитие и образование антибиотиков у их продуцентов. Наиболее хорошо изученным актиномицетным регулятором является А-фактор, представляющий собой 2-изо-каприлоил-3-оксиметил-у-бутиролактон.
Влияние А-фактора на морфологическую дифференцировку и антибиотикообразование подчиняется общей схеме работы стрептомицетных регуляторов, содержащих лактонную группировку. На ранних стадиях роста, когда концентрация А-фактора низка, рецептор А-фактора (АгрА) связывается и репрессирует экспрессию общего гипотетического активатора биосинтеза стрептомицина и спорообразования. При выделении АгрА из клеточного лизата S.griseus IFO 13350 было показано, что этот белок состоит из 276 аминокислот и имеет молекулярную массу 29,1 кДа.
Когда плотность культуры возрастает, концентрация А-фактора достигает критического уровня, при котором он связывает АгрА, вызывая диссоциацию последнего от ДНК и, таким образом включая транскрипцию ключевого гена adpA, кодирующего AdpA (белок, состоящий из 405 аминокислот, содержащий в центральном участке сайт связывания с ДНК, схожий с регуляторами транскрипции из семейства белков AraC/XylS). AdpA, в свою очередь, является позитивным регулятором обнаруженного цитоплазматического активатора кластера генов биосинтеза стрептомицина и активаторов процесса спорообразования. Цитоплазматический активатор, связываясь с ДНК в районе промотора гена специфической регуляции кластера биосинтеза стрептомицина strR, индуцирует транскрипцию данного гена, расположенного вслед за ним гена устойчивости к собственному антибиотику - aphD, гена adsA, кодирующего экстрацитоплазматический а-фактор РНК-полимеразы, необходимой для формирования воздушного мицелия, а также гена sgmA, кодирующего белок-пептидазу, участвующую наряду с другими гидролитическими ферментами в деградации белков субстратного мицелия в результате формирования воздушного мицелия. Регуляторный продукт гена strR обусловливает начало транскрипции структурных генов биосинтеза в составе кластера с StrR-зависимых промоторов. Начало экспрессии с промотора strR гена под влиянием цитоплазматического активатора обеспечивает также наработку продукта гена aphD - аминогликозидфосфотрансферазы, и тем самым создание базового уровня устойчивости штамма к собственному антибиотику.
Показано, что у разных видов стрептомицетов наблюдается гомология между структурными элементами регуляторов. Нуклеотидные последовательности, гомологичные гену агрА у S.griseus , обнаружены также у других стрептомицетов. Например, у S.coelicolor A3 (2) было обнаружено два гена сргА и сргВ, кодирующих АгрА-подобные белки СргА и СргВ, которые на 90,7% сходны между собой и на 35% - с АгрА.
Реакции кворум-сенсинга у грамотрицательных микроорганизмов
Более чем у 450 видов грамотрицательных бактерий обнаружены кворум-зависимые системы, в которых сигнальными молекулами служат различные ацилгомосеринлактоны. Общую схему коммуникаций грамотрицательных бактерий можно представить следующим образом: в системе кворум-сенсинга грамотрицательных бактерий белки семейства Luxl являются аутоиндукторными синтазами и катализируют формирование специфических ацилгомосеринлактонных аутоиндукторных молекул. Аутоиндукторы свободно диффундируют через мембрану и аккумулируются по мере увеличения плотности клеток. Белки семейства LuxR связывают родственные им аутоиндукторы при достижении достаточно высокой концентрации сигнальных молекул. Комплекс LuxR - аутоиндуктор связывается с промотором целевых генов, запуская их транскрипцию.
Бактерии рода Erwinia (E.carotovora , E.chrysanthemii ) - патогены для растений. Они расщепляют растительные клеточные стенки с помощью пектиназ и целлюлаз. Образование этих ферментов является важным фактором вирулентности и зависит от плотности популяции. У Erwinia функционирует генная система expI-expR, аналогичная системе luxI-luxR у V.fisheri . В реакциях кворум-сенсинга также задействована регуляторная система, обеспечиваемая транскрипцией генов rsmA-rsmB. От плотности популяции у E.carotovora зависит также синтез антибиотика карбапенема. Продукция этого антибиотика находится под контролем кластера генов сагА-сагН, и, возможно, необходима для устранения конкурирующих микроорганизмов в локусе заражения растения.
Другой пример использования в качестве сигнальных молекул гомосеринлактонов показан для Pseudomonas aeruginosa - патогена для животных. Патогенность у Р.aeruginosa обусловлена широким арсеналом факторов вирулентности. Одни из них ассоциированы с клеткой (пили, адгезины, липополисахариды), другие секретируются (протеазы, рамнолипиды, экзофермент S, экзотоксин А, антибиотик пиоцианин и т. д.). Образование многих из внеклеточных факторов вирулентности контролируется системами межклеточного взаимодействия. Центральными компонентами таких взаимодействий служат las- и rhl-системы кворум-сенсинга, активирующие экспрессию генов в зависимости от величины плотности клеток микроорганизма. Каждая система представлена двумя генами: один кодирует фермент, при помощи которого синтезируется специфический аутоиндуктор - ацилированный гомосеринлактон (lasl/rhll); другой кодирует активатор транскрипции, с которым связывается соответствующий аутоиндуктор (lasR/rhIR). Аутоиндуктором систем las и rhi является N-(3-оксододеканоил)-L-гомосеринлактон (З-оксо-С12-HSL), для экспорта которого из клетки служит специальная система, получившая название MexEF-OprN-помпа и N-бутирил-L-гомосеринлактон (C4-HSL) соответственно.
Система las контролирует экспрессию генов, кодирующих такие факторы вирулентности, как эластазы А, В, а также щелочную протеазу; система rhi - ферменты биосинтеза рамнолипидов, пиоцианина. Недавно была обнаружена третья сигнальная молекула, принимающая участие в реакциях кворум-сенсинга у P.aeruginosa - 2-гептил-З-гидрокси-4-хинолон (PQS). Эта сигнальная молекула может контролировать уровень экспрессии las В, кодирующего эластазу Las В, а также уровень экспрессии rhil, кодирующего синтазу C4-HSL.
Бактерия Agrobacterium tumefaciens вызывает образование корончатых галлов у многих видов растений. Галлы представляют собой растительный аналог злокачественной опухоли и образуются в результате переноса онкогенных фрагментов ДНК от бактерии в ядро растительной клетки посредством Ti-плазмид. Некоторые из генов Ti-плазмид обусловливают синтез растительными клетками опинов, которые служат питательным субстратом для A.tumefaciens . Гомологичная luxI-luxR генная система traI-traR стимулирует распространение Ti-плазмид в бактериальной популяции. Плазмидная ДНК стремится распространиться в популяции бактерий и, как только создается достаточный «кворум», побуждает несущие плазмиду клетки конъюгировать с другими бактериальными клетками. В то же время конъюгативный перенос Ti-плазмид зависит от опинов. В частности, транскрипция traR стимулируется фактором OccR, активируемым октопином.
Кворум-сенсинг в многоклеточных образованиях
Способность бактерий образовывать биоплёнки интересна ввиду того, что представители патогенных для человека и животных возбудителей проявляют устойчивость к действию антимикробных веществ при их росте в биоплёнках. Биоплёнки - высокоупорядоченные бактериальные сообщества, которые позволяют бактериям жить в прикреплённом состоянии. Биоплёнки могут состоять из одного или нескольких видов бактерий. Их пронизывает сеть водных каналов, обеспечивающих доставку питательных веществ членам сообщества и удаляющих продукты метаболизма. В одной биоплёнке можно наблюдать различные образцы генной экспрессии, что говорит о том, что индивидуальные члены сообщества имеют «специфические обязанности», которые, комбинируясь с другими, усиливают жизнеспособность всего консорциума.
Биоплёнки формируются в лёгких патогенным микроорганизмом P.aeruginosa . Толщина такой биоплёнки составляет несколько сотен микрометров. Микроколонии в зрелой биоплёнке расположены во внеклеточном полисахаридном матриксе. Внутри биоплёнки обнаруживается неоднородность: в ней существует кислородный градиент - уменьшение концентрации кислорода от периферии вглубь. Предполагается, что сходные градиенты будут обнаружены для рН и питательных веществ. Эти градиенты обеспечивают физиологическую вариабельность среди индивидуальных клеток биоплёнки: так, в глубине клетки растут гораздо медленнее, чем на периферии. Бактерия в такой зрелой биоплёнке фенотипически устойчива к бактерицидным агентам. Таким образом, биоплёнки вызывают различные типы хронических бактериальных инфекций. Формирование биоплёнки у P.aeruginosa находится под контролем реакций кворум-сенсинга. Мутации гена lasI нарушает созревание биоплёнки, так как белок LasI не синтезирует 3-oкco-C12-HSL, и после стадии микроколонии формирование микропленки не продолжается. Роль C4-HSL в процессах формирования остаётся неизвестной. Биоплёнки, образуемые мутантами по LasI-белку, восприимчивы к детергентам, в то время как нормальные биоплёнки устойчивы. Это дает повод думать, что терапия, нацеленная на нарушение регуляции механизма кворум-сенсинга у P.aeruginosa , может привести к остановке формирования биоплёнки, что повысит чувствительность этой бактерии к антимикробным агентам.
Формирование биоплёнки у патогенной бактерии Burkholderia cepacia также определяется «чувством кворума». При росте в биоплёнках данный микроорганизм подобно P.aeruginosa обнаруживает значительную устойчивость к антимикробным агентам.
Межвидовые взаимодействия микроорганизмов
Межвидовые коммуникации у бактерий могут служить для синхронизации специализированных функций видов в группе. Разнообразие, присутствующее в каждой данной популяции, может повышать выживаемость для всего сообщества. Более того, продуктивные взаимодействия на основе кворум-сенсинга могут способствовать развитию многовидовых бактериальных организаций, таких, как биоплёнки, а также установлению специфических симбиотических ассоциаций с хозяевами - эукариотами.
Межвидовые взаимодействия микроорганизмов наиболее полно изучены на примере микробного сообщества ротовой полости и поверхности зубов человека. В биоплёнках на поверхности зубов выявлено около 500 видов бактерий, которые функционируют как координированное сообщество, имеющее внутри- и межвидовые коммуникации. Стрептококки составляют от 60 до 90% бактерий, которые колонизируют поверхность зубов в течение первых четырёх часов после ее очистки стоматологом. Среди других видов «ранних колонизаторов» обнаруживаются представители Actinomyces , Capnocytophaga , Eikenella , Haemophilus , Prevotella , Propionibacterium и Veillonella .
Способы коммуникаций среди генетически идентичных клеток, по всей вероятности, отличаются от сигналов при межвидовых коммуникациях. Нет доказательств наличия среди сигнальных молекул бактерий ротовой полости типичных представителей семейства ацилгомосеринлактонов, которые регулируют внутривидовую генную экспрессию у грамотрицательных бактерий.
Главной сигнальной молекулой при межвидовых коммуникациях является AI-2. Подтверждением этому является факт обнаружения гена luxS, кодирующего фермент, необходимый для синтеза молекулы AI-2, у нескольких родов бактерий ротовой полости.
AI-2 впервые был обнаружен у морской светящейся бактерии Vibrio harveyi , для которой он является сигнальной молекулой, регулирующей процесс биолюминесценции. Позже наличие AI-2 было показано более чем у 30 видов бактерий, включающих грамположительные и грамотрицательные микроорганизмы.
Иногда для одной группы бактерий может быть полезным негативно влиять на цикл реакций кворум-сенсинга конкурирующей группы бактерий. Исследования в этой области выявляют несколько примеров стратегий антикворум-сенсинга, которые используют сосуществующие популяции бактерий. Так, Staphylococcus epidermidis использует пептид для контроля уровня своей agr вирулентности, а также для подавления вирулентности у Staphylococcus aureus .
Штамм Bacillus sp. 240B1 демонстрирует способность к энзиматической инактивации ацилгомосеринлактонов - сигнальных молекул грамотрицательных бактерий. Было показано, что в присутствии АИА, гомосеринлактоназы, состоящей из 250 аминокислот, разрушаются молекулы гомосеринлактонов, продуцируемых патогеном у растений Erwinia сагоtovora . Гены, гомологичные гену аiiА, обнаружены и у 16 подвидов Bacillus thuringiensis , следовательно, данные микроорганизмы также способны осуществлять деградацию гомосеринлактонов.
Почвенная бактерия Variovorax paradoxus может использовать ацилгомосеринлактоны в качестве единственного источника углерода и азота. Этот факт указывает на то, что в своих природных местах обитания V.paradoxus может расти на ацилгомосеринлактонах, извлекая выгоду из конкурентного обострения в окружающей среде. В данном случае фермент, разрушающий ацилгомосеринлактоны, отличен от AiiA-лактоназы: это - аминоацилаза, отщепляющая лактонное кольцо от ацильной группы.
По причине того, что у многих патогенов животных и растений системы кворум-сенсинга контролируют вирулентность, эти системы можно рассматривать как потенциальные мишени для действия антимикробных агентов. Во-первых, одна из стратегий состоит в ингибировании синтеза молекул - предшественников ацилгомосеринлактонов или самих ацилгомосеринлактонов. Во-вторых, мишенью лекарственных препаратов могут служить системы, контролирующие выброс и диффузию ацилгомосеринлактонов. В-третьих, ацилгомосеринлактон-подобные антагонисты могут конкурировать с ацилгомосеринлактонами за связывание с гомологами LuxR. В-четвертых, возможно применение ферментов, расщепляющих ацилгомосеринлактоны, а также антител к этим молекулам. И, наконец, как было показано недавно, гены аiiА, кодирующие лактоназы, осуществляющие деградацию ацилгомосеринлактонов, могут быть внедрены в геном растений, экспрессируясь в котором, они могли бы обеспечивать защиту растению-хозяину от патогенных микроорганизмов. Так, трансгенные растения табака с включенным аiiА-геном успешно противостояли заражению E.carotovora .
Бактериальные цитокины
Обнаружено, что прокариотические микроорганизмы синтезируют вещества, похожие на гормоны позвоночных (включая стероиды и полипептидные гормоны, такие, как инсулин). Увеличивается количество данных, подчеркивающих важность химически опосредованных межклеточных взаимодействий в бактериальных культурах для таких событий, как споруляция, конъюгация, вирулентность и биолюминесценция. Таким образом, в настоящее время многие исследования в области микробиологии посвящены взаимодействиям между микроорганизмами, основанными на использовании бактериальных цитокинов.
Известно, что микроорганизмы способны гибко адаптироваться к изменяющимся условиям окружающей среды (в частности, к недостатку питательных компонентов). При этом некоторые из них обладают генетически закреплённой специфической организацией метаболизма, позволяющей существовать при очень низких концентрациях питательных веществ (олиготрофы). Клетки другой категории (копиотрофы) при истощении среды обитания способны включать специальные программы переживания неблагоприятных условий. Часть из них образуют специализированные структуры (споры и цисты), которые чрезвычайно устойчивы к различным стрессам, неспорулирующие же бактерии способны переживать неблагоприятные условия, оставаясь вегетативными клетками с пониженной метаболической активностью, т.е. переходя в особое VBNC (viable but nonculturable - жизнеспособные, но некультивируемые) состояние. Естественно, что некультивируемые бактерии остаются за рамками общепринятых методов исследований (высевы на плотные или жидкие среды не позволяют их обнаруживать). Например, возбудители таких опасных заболеваний, как холера и кампилобактериоз, склонны образовывать некультивируемые формы. При микроскопическом исследовании образцов, выделенных из окружающей среды (почва, речные и морские воды и т.д.) обнаружено множество клеток, которые, обладая метаболической активностью, не могут образовывать полноценную культуру (т.е. некультивируемые). В настоящее время известно всего несколько примеров превращения таких бактерий в нормальные культивируемые клетки. Концепция цитокин-зависимого роста микроорганизмов позволяет по-новому рассматривать проблему подбора сред для восстановления некультивируемых форм.
Некультивируемые формы патогенных бактерий обнаружены не только в окружающей среде, но и в тканях, органах человека и животных. Чаще всего они сильно отличаются морфологически и биохимически. Например, возбудитель туберкулёза в тканях образует нетипичные кокковидные формы. Возможно, такие клетки являются особыми переживающими формами, способными к активации и размножению. Существование таких покоящихся форм может объяснить периодически возникающие рецидивы болезни у, казалось бы, вылеченных больных. Показано, что клетки Mycobacterium tuberculosis могут переходить в нереплицируемое кокковидное состояние в микроаэрофильных условиях in vitro , которые часто возникают in vivo (например, в гранулемах). Кокковидные формы также обнаружены для Campylobacter jejuni и Helicobacter pylori . Предполагается, что они образуются в тканях в ответ на воздействие лекарств и, возможно, являются покоящимися клетками, устойчивыми к действию антибиотиков. Однако данные о культивировании таких форм весьма противоречивы. Возможно, такие бактерии могут быть активированы какими-то специфическими ростовыми факторами, роль которых, вероятно, исполняют цитокины хозяина. Например, рост туберкулёзных бацилл внутри моноцитов существенно стимулировался трансформирующим ростовым фактором (TGF-1), тогда как рост клеток М.tuberculosis и M.avium внутри макрофагов значительно ускорялся в присутствии эпидермадьного ростового фактора. Очевидно, цитокинные факторы хозяина могут играть важную роль и в активации покоящихся бактерий, и в размножении активных возбудителей. Снижение уровня инсулина в крови больных сахарным диабетом приводит к значительному размножению клеток Pseudomonas pseudomallei , являющихся возбудителями мелиоидоза, а трансферрин имеет большое значение для роста и переживания внутри мышиных макрофагов клеток Francisella tularensis .
Возможно, что специфические бактериальные цитокины также играют существенную роль в образовании покоящихся форм и их восстановлении в активные делящиеся клетки. Тогда, принимая во внимание проблемы возникновения устойчивости к антибиотикам, сложно переоценить важность отыскания автокринных ростовых факторов, необходимых для роста патогенных бактерий, и, следовательно, являющихся мишенью для воздействия принципиально новых антибиотиков, нетоксичных для больного.
Применение специфических бактериальных цитокинов также может существенно улучшить ситуацию с выращиванием некультивируемых бактерий в средах, не вполне подходящих для их размножения. Например, обычно не растущие на минимальной сукцинатной среде микрококки начинают нормально в ней размножаться в присутствии автокринного фактора Rpf (resuscitation-promoting factor), а отмытые клетки Mycobacterium smegmatis , которые растут на минимальной среде только при добавлении Rpf, выделенного из Micrococcus luteus , можно рассматривать в качестве модели популяции «голодающих» бактерий в почве, вероятно, требующей для начала деления присутствия специфического цитокина. Применение специфических бактериальных цитокинов также может существенно улучшить ситуацию с выращиванием некультивируемых бактерий в средах, не вполне подходящих для их размножения. Гены, имеющие сходство с геном, кодирующим белок Rpf у М.luteus , широко распространены среди грамположительных бактерий с высоким содержанием G+C, к которым относятся стрептомицеты, коринебактерии и микобактерии. Этот факт открывает новые возможности для предупреждения и лечения болезней, вызванных микробными агентами, а также позволяет по-иному взглянуть на сложный комплекс межвидовых бактериальных взаимодействий в природных местах обитания микроорганизмов.
Последнее обновление: 20.02.2004
ЛИТЕРАТУРА
- Олескин А.В., Ботвинко И.В., Цавкелова Е.А. Колониальная организация и межклеточная коммуникация у микроорганизмов. Микробиология 2000; 69: 3: 309-327.
- Fuqua W.С., Winans S., Greenberg Е. Quorum sensing in bacteria: the Lux R-Lux I family of cell density-responsive transcriptional regulators. J Bacteriol 1994; 176: 2: 269-275.
- Meighen E. Molecular biology of bacterial bioluminescence. Microbiol Rev 1991; 55:1:123-142.
- Winans S.С., Bassler В.L. Mob psychology. J Bacteriol 2002; 184: 4: 873-883.
- Writh R., Muscholl A., Wanner G. The role of pheromones in bacterial interactions. Trends Microbiol 1996; 4: 3: 96-103.
- Хохлов А.С. Низкомолекулярные микробные ауторегуляторы. М.: 1988;270.
- Waldburger С., Gonzalez D., Chambliss G.H. Characterization of a new sporulation factor in Bacillus subtilis. J Bacteriol 1993; 175: 6321-6327.
- Pestova E., Havarstein L., Morrison D. Regulation of competence for genetic transformation in Streptococcus pneumoniae by an auto-induced peptide pheromones and a two-component regulatory systems. Mol Microbiol 1996; 21:4: 853-862.
- Alloing G., Martin В., Granadel G., Claveris J. Development of competence in Streptococcus pneumoniae : pheromone autoinduction and control of quorum-sensing by the oligopeptide permease. Ibid 1998; 9:1: 75-83.
- Прозоров А.А. Феромоны компетентности у бактерий. Микробиология 2001; 70: 1:5-14.
- Salmond G., Bycroft В., Stewart С., Williams P. The bacterial «enigma»: cracking the code of cell-cell communication. Mol Microbiol 1995; 16:4:615-624.
- Greenberg E., Winans S., Fuqua C. Quorum-sensing by bacteria. Ann Rev Microbiol 1996; 50: 727-751.
- Otto M., Sussmuth R., Vuong C. et al. Inhibition of virulence factor expression in Staphylococcus aureus by the Staphylococcus epidermidis agr pheromone and derivatives. FEBS Lett. 1999; 450: 257-262.
- Dong Y., Xu J., Li X., Zhang L. AiiA, an enzyme that inactivates the acyl-homoserine lactone quorum-sensing signal and attenuates the virulence of Erwinia carotovoru . Proc Natl Acad Sci 2000; 97:7: 3526-3531.
- Byers J., Lucas C., Salmond G., Welch М. Nonenzymatic turnover of an Erwinia carotovora quorum-sensing signaling molecule. J Bacteriol 2002; 184:4: 1163-1171.
- Calfee М., Coleman J., Pesci E. Interference with Pseudomonas quinolone signal synthesis inhibits virulence factor expression by Pseudomonas aeruginosa . Proc Natl Acad Sci 2001; 98: 20:11633-11637.
- Nakayama J., Takanami Y., Horii T. et al. Molecular mechanism of pep-tide-specific pheromone signaling in Enterococcus faecalis : functions of pheromone receptor TraA and pheromone-binding protein TraC encoded by plasmid pPDI. J Bacteriol 1998: 180: 3: 449-456.
- Mylonakis E., Engelbert М., Qin X. et al. The Enterococcus faecalis fsrB gene, a key component of the fsr quorum-sensing system, is associated with virulence in the rabbit endophthalmitis model. Infect Immun 2002; 70: 8: 4678-4681.
- Sifri C., Mylonakis E., Singh V. et al. Virulence effect of Enterococcus faecalis protease genes and the quorum-sensing locust in Caenorhabditis elegans and mice. Ibid 2002; 70:10: 5647-5650.
- Matson М., Armitage J., Hoch J., Macnab R. Bacterial locomotion and signal transduction. J Bacteriol 1998; 180: 5: 1009-1022.
- Onaka H., Horinouchi S. DNA-binding activity of the A-factor receptor protein and its recognition DNA sequences. Mol Microbiol 1997; 24: 991-1000.
- Onaka H., Ando N., Nihira Т., Yamada Y. et al. Cloning and characterisation of the A-factor receptor gene from Streptomyces griseus . J Bacteriol 1995; 177: 21: 6083-6092.
- Ohnishi Y., Kameyama S., Onaka H., Horinouchi S. The A-factor regulatory cascade leading to streptomycin biosynthesis in Streptomyces griseus : identification of a target gene of the A-factor receptor. Mol Microbiol 1999; 34: 102-111.
- Yamazaki H., Ohnishi Y., Horinouchi S. An A-factor-dependent extracytoplasmatic function sigma factor (OAdsA) that is essential for morphological development in Streptomyces griseus . J Bacteriol 2000; 182:16:4596- 4605.
- Kato J., Suzuki A., Yamazaki H. et al. Control by A-factor of a metalloendopeptidase gene involved in aerial mycelium formation in Streptomyces griseus . Ibid 2002; 184: 21: 6016-6025.
- Onaka H., Nikagawa Т., Horinouchi S. Involvement of two A-factor receptor homologues in Streptomyces coelicolor A3(2) in the regulation of secondary metabolism and morphogenesis. Mol. Microbiol. 1998; 28:4: 743-753.
- Revenchon S., Bouillant М., Salmond G., Nasser W. Integration of the quorum-sensing system in the regulatory networks controlling virulence factor synthesis in Erwinia chrysanthemii . Mol Microbiol 1998; 29: 1407-1418.
- Chatterjee A., Cui Y., Chatterjee A.K. RsmA and the quorum-sensing signal, N--L-homoserine lactone, control the levels of rsmB RNA in Erwinia carotovora subsp. carotovora by affecting its stability. J Bacteriol 2002; 184:15: 4089-4095.
- Kohler Т., Van Delden C., Curty L. et al. Overexpression of the MexEF-OprN multidrug efflux system affects cell-to-cell signaling in Pseudomonas aeruginosa . Ibid 2001; 183: 18: 5213-5222.
- Gallagher L., McKnight S., Kuznetsova М. el al. Functions required for extracellular quinolone signaling by Pseudomonas aeruginosa . Ibid 2002; 184:23:6472-6480.
- Parsek М., Greenberg P. Acyl-homoserine lactone quorum sensing in gram-negative bacteria: a signaling mechanism involved in associations with higher organisms. Proc Natl Acad Sci 2000; 97: 16: 8789-8793.
- Conway В.А., Уепи V., Speert D. Biofilm formation and acyl-homoserine lactone production in the Burkholderia cepacia complex. J Bacteriol 2002; 184:20:5678-5685.
- Kolenbrander P., Andersen R., Blehert D. et al. Communication among oral bacteria. Microb. Molecular Biology Rev 2002; 66: 3: 486-505.
- Miller M., Bassler B. Quorum sensing in bacteria. Annu Rev Microbiol 2001; 55: 165-199.
- Frias J., Olle E., Alsina M. Periodontal pathogens produce quorum sensing signal molecules. Infect Immun 2001; 69: 3431-3434.
- McNab R., Ford S., EI-Sabaeny A. et al. LuxS-based signaling in Streptococcus gordonii : Autoinducer 2 controls carbohydrate metabolism and biofilm formation with Porphyromonas gingivalis . J Bacteriol 2003; 185: 1:274-284.
- Bassler В., Wright M., Silverman M. Multiple signalling systems controlling expression of luminescence in Vibrio harveyi : sequence and function of genes encoding a second sensory pathway. Mol Microbiol 1994; 13: 273-286.
- Ji G., Beavis R., Novick R. Bacterial interference caused by autoinducing peptide variants. Science 1997; 276: 2027-2030.
- Lee S., Park S., Lee J., et al. Genes encoding the N-acyi homoserine lactone-degrading enzyme are widespread in many subspecies of Bacillus thuringiensis . Appl Environ Microbiol 2002; 68: 8: 3919-3924.
- Leadbetter J., Greenberg E. Metabolism of acylhomoserine lactone quorum-sensing signals by Variovorax paradoxus . J Bacteriol 2000; 182:6921-6926.
- Hoang Т., Schweizer H. Characterization of Pseudomonas aeruginosa enoyl-acyl carrier protein reductase (Fabl): a target for the antimicrobial triclosan and its role in acylated homoserine lactone synthesis. Ibid 1999; 181:. 5489-5497.
- Pearson J., Delden C., Iglewski B. Active efflux and diffusion are involved in transport of Pseudomonas aeruginosa cell-to-cell signals. J. Bacteriol. 1999; 181: 1203-1210.
- Manefield M., Welch M., Givskov G. et al. Halogenated furanoses from the red alga, Delisea pulchra, inhibit carbapenem antibiotic synthesis and exoenzyme virulence factor production in the phytopatoge Erwinia carotovora . FEMS Microbiol Lett 2001; 205: 131-138.
- Dong Y., Wang L., Xu J. et al. Quenching quorum-sensing-dependent bacterial infection by an N-acyl homoserine lactonase. Nature. 2001; 411:813-817.
- Романова Ю.М., Гинцбург А.Л. Цитокины - возможные активаторы роста патогенных бактерий. Вести РАМН 2000; 1: 13-17.
- Barcina I., Lebaron P., Vives-Rego J. Survival of allochthonous bacteria in aquatic systems: a biological approach. FEMS Microbiol Ecol 1997; 23:1-9.
- Heim S., Lleo M., Bonato B. et al. The viable but nonculturable state and starvation are different stress responses of Enterococcus faecalis , as determined by proteome analysis. J Bacteriol 2002; 184:23: 6739-6745.
- Xu H., Roberts N., Singleton F. el al. Survival and viability of nonculturable Escherichia coli and Vibrio cholerae in the estuarine and marine environment. Microb Ecol 1982; 8: 313-323.
- Kell D., Kaprelyants A., Grafen A. Pheromones, social-behavior and the functions of secondary metabolism in bacteria. Trends In Ecology & Evolution 1995; 10: 126-129.
- Domingue G., Woody H. Bacterial persistence and expression of disease. Clin Microbiol Rev 1997; 10: 320-328.
- Khomenko A. The variability of Mycobacterium tuberculosis in patients with cavitary pulmonary tuberculosis in the course of chemotherapy. Tubercle Lung Disease 1987; 68: 243-253.
- Gangadharam P. Mycobacterial dormancy. Tub Lung Dis 1995; 76: 477-479.
- Wayne L. Dormancy of Mycobacterium tuberculosis and latency of disease. European J Clin Microbiol Infect Dis 1994; 13: 908-914.
- Wayne L., Hayes L. An in vitro model for sequential study of shiftdown of Mycobacterium tuberculosis through 2 stages of nonreplicating persistence. Infect Immun 1996; 64: 2062-2069.
- Beumer R., Devries J., Rombouts F. Campylobacter jejuni nonculturable coccoid cells. Intern J Food Microbiol 1992; 15: 153-163.
- Kusters J., Gerrits M., Van Strijp J. el at. Coccoid forms of Helicobacter pylori are the morphologic manifestation of cell death. Infect Immun 1997; 65: 3672-3679.
- Cellini L., Hui P., Leung K. el at. Coccoid Helicobacter pylori not culturable in vitro reverts in mice. Microbiol Immun 1994; 38: 843-850.
- Hirsch С., Yoneda T., Averill L. et al. Enhancement of intracellular growth of Mycobacterium tuberculosis in human monocytes by transforming growth-factor-b-l. J. Infect Dis 1994; 170: 1229-1237.
- Bermudez. L., Pelrofsky M. Regulation of the expression of Mycobacterium avium complex proteins differs according to the environment within host cells. Immunol Cell Biol 1997; 75: 35-40.
- Woods D., Jones A., Hill P. Interaction of insulin with Pseudomonas pseudomallei . Infect Immun 1993; 61: 4045-4050.
- FortierA., Leiby D., Narayanan R. et al. Growth of Francisella tularensis LVS in macrophages - the acidic intracellular compartment provides essential iron required for growth. Ibid 1995; 65:1478-1483.
- Duncan S., Glover L., Killham K., Prosser J. Luminescence-based detection of activity of starved and viable but nonculturable bacteria. Appl Environ Microbiol 1994; 60: 1308-1316.
- Young D., Duncan K. Prospects for new interventions in the treatment and prevention of mycobacterial disease. Ann. Rev. Microbiol. 1995; 49: 641-673.
- Mukamolova G., Kapreilyants A., Young D. et al. A bacterial cytokine. Proc Nat! Acad Sci USA. 1998; 95: 8916-8921.
- Шлеева M.О., Мукамолова Г.В., Телков M.В. и др. Образование «некультивируемых» клеток Mycobacterium tuberculosis и их оживление. Микробиология 2003; 72: 76-83.
) общаться и координировать своё поведение за счёт секреции молекулярных сигналов.
Назначение чувства кворума
Назначение чувство кворума - координировать определённое поведение или действия между бактериями того же вида или подвида в зависимости от плотности их населения. Например, оппортунистические патогенные бактерии Pseudomonas aeruginosa могут размножаться в пределах хозяина без ущерба, пока они не достигают определённой концентрации. Но они становятся агрессивными, когда их число становится достаточным, чтобы преодолеть иммунную систему хозяина, приводя к развитию болезни. Для того чтобы сделать это, бактериям необходимо сформировать биоплёнки на поверхности тела хозяина. Возможно, что терапевтическая ферментативная деградация сигнальных молекул предотвращает образование таких биоплёнок. Разрушение сигнального процесса таким образом - подавление чувства кворума.
Роль чувства кворума у некоторых организмов
Чувство кворума впервые наблюдалось у бактерии Vibrio fischeri , биолюминецсентной бактерии, живущей как симбионт в световых органах одного из видов гавайских кальмаров. Когда клетки Vibrio fischeri живут свободно, автоиндукторы находятся в низкой концентрации, и поэтому клетки не люминесцирующие. В световом органе кальмара (фотофоры) они чрезвычайно сконцентрированы (около 10 11 клеток/мл), и поэтому индуцируется транскрипция люциферазы, приводя к биолюминесценции.
Процессы, которые регулируются или частично регулируются чувством кворума на основе AI-2 у кишечной палочки , включают деление клетки. У других видов, например - Pseudomonas aeruginosa (синегнойная палочка), связанные с чувством кворума процессы включают развитие биоплёнок, производство экзополисахаридов и агрегацию клеток. Обнаружено, что AI-2 увеличивает экспрессию гена sdiA, регулятора транскрипции промотора, регулирующего ген ftsQ, часть оперона ftsQAZ, важного для деления клетки.
Streptococcus pneumoniae (пневмококк) использует чувство кворума, чтобы сделать клетки компетентными. Это может быть важным для увеличения количества мутаций в условиях перенаселения, когда возникает необходимость колонизации новых окружений.
Напишите отзыв о статье "Чувство кворума"
Отрывок, характеризующий Чувство кворума
В ту же ночь, откланявшись военному министру, Болконский ехал в армию, сам не зная, где он найдет ее, и опасаясь по дороге к Кремсу быть перехваченным французами.В Брюнне всё придворное население укладывалось, и уже отправлялись тяжести в Ольмюц. Около Эцельсдорфа князь Андрей выехал на дорогу, по которой с величайшею поспешностью и в величайшем беспорядке двигалась русская армия. Дорога была так запружена повозками, что невозможно было ехать в экипаже. Взяв у казачьего начальника лошадь и казака, князь Андрей, голодный и усталый, обгоняя обозы, ехал отыскивать главнокомандующего и свою повозку. Самые зловещие слухи о положении армии доходили до него дорогой, и вид беспорядочно бегущей армии подтверждал эти слухи.
«Cette armee russe que l"or de l"Angleterre a transportee, des extremites de l"univers, nous allons lui faire eprouver le meme sort (le sort de l"armee d"Ulm)», [«Эта русская армия, которую английское золото перенесло сюда с конца света, испытает ту же участь (участь ульмской армии)».] вспоминал он слова приказа Бонапарта своей армии перед началом кампании, и слова эти одинаково возбуждали в нем удивление к гениальному герою, чувство оскорбленной гордости и надежду славы. «А ежели ничего не остается, кроме как умереть? думал он. Что же, коли нужно! Я сделаю это не хуже других».
Князь Андрей с презрением смотрел на эти бесконечные, мешавшиеся команды, повозки, парки, артиллерию и опять повозки, повозки и повозки всех возможных видов, обгонявшие одна другую и в три, в четыре ряда запружавшие грязную дорогу. Со всех сторон, назади и впереди, покуда хватал слух, слышались звуки колес, громыхание кузовов, телег и лафетов, лошадиный топот, удары кнутом, крики понуканий, ругательства солдат, денщиков и офицеров. По краям дороги видны были беспрестанно то павшие ободранные и неободранные лошади, то сломанные повозки, у которых, дожидаясь чего то, сидели одинокие солдаты, то отделившиеся от команд солдаты, которые толпами направлялись в соседние деревни или тащили из деревень кур, баранов, сено или мешки, чем то наполненные.
На спусках и подъемах толпы делались гуще, и стоял непрерывный стон криков. Солдаты, утопая по колена в грязи, на руках подхватывали орудия и фуры; бились кнуты, скользили копыта, лопались постромки и надрывались криками груди. Офицеры, заведывавшие движением, то вперед, то назад проезжали между обозами. Голоса их были слабо слышны посреди общего гула, и по лицам их видно было, что они отчаивались в возможности остановить этот беспорядок. «Voila le cher [„Вот дорогое] православное воинство“, подумал Болконский, вспоминая слова Билибина.
Владельцы патента RU 2534617:
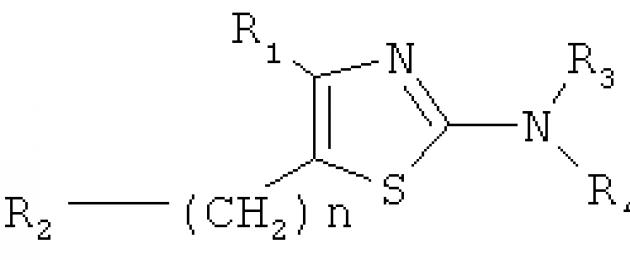
Изобретение относится к области микробиологии, биотехнологии и фармацевтики, а именно к малым регуляторным молекулам, способным направленно изменять плотностно-зависимую коммуникацию и регулируемое ей коллективное поведение («чувство кворума») у бактерий. В частности, изобретение относится к применению производного тиазола формулы 1 в качестве регулятора (активатора или ингибитора) коллективного поведения («чувства кворума») у бактерий. Технический результат - производное тиазола, предназначенное для регуляции опосредуемого гомосеринлактонами «чувства кворума» у виолацеин-продуцирующих биотехнологически полезных, гнилостных и патогенных бактерий. 2 ил., 1 табл., 2 пр.
Изобретение относится к микробиологии, биотехнологии и фармацевтике и касается малых регуляторных молекул, способных направленно изменять (ослаблять или усиливать) плотностно-зависимую коммуникацию и регулируемое ей коллективное поведение («чувство кворума») у бактерий. Изобретение может найти применение при контроле биотехнологических процессов, производстве средств для предупреждения порчи сельскохозяйственной продукции, а также создании новых лекарственных препаратов, предназначенных для контроля и управления бактериальными инфекциями растений, животных и человека.
Обнаружение плотностно-зависимой коммуникации у бактерий с характеристикой лежащих в ее основе молекулярно-генетических механизмов стало одним из наиболее ярких открытий в микробиологии конца XX века . При этом данный феномен коллективного поведения бактерий, обозначенный понятием «чувство кворума» (англ. - quorum sensing), позволил принципиально по-новому оценить целый ряд примеров функциональной и морфологической дифференцировки прокариот, включая развитие биолюминесценции, синтез пигментов и антибиотиков, образование экзоферментов и факторов вирулентности, формирование биопленок, конъюгацию и спорообразование .
Первым из описанных и наиболее распространенным среди микроорганизмов вариантом «чувства кворума» являются luxI/luxR-подобные системы, в которых синтезируемая под контролем гена luxI сигнальная молекула-автоиндуктор диффундирует во внешнюю среду, а при достижении критической плотности популяции и определяемой этим собственной пороговой концентрации совершает обратное движение внутрь бактериальной клетки, где, связываясь с регуляторным белком LuxR, запускает транскрипцию целевых генов . При этом анализ химической природы подобных автоиндукторов позволил охарактеризовать их как разнообразные варианты ацилированных гомосеринлактонов (ГСЛ) .
Расшифровка молекулярно-генетических механизмов коллективного поведения, а также выявление важной биологической роли систем плотностно-зависимой коммуникации, определили актуальность поиска подходов к управлению чувством кворума. Предложенными решениями стали: 1) подавление синтеза автоиндуктора; 2) его деградация специфическими ферментами (лактоназами или ацилазами); 3) использование агонистов и антагонистов ГСЛ, способных прямо интерферировать с естественным сигналом за связывание с luxR-подобными белками . Именно последний подход, наиболее интенсивно разрабатываемый во многих лабораториях по всему миру и к настоящему моменту приведший созданию уже нескольких сотен активных соединений , составляет теоретическую основу для настоящего изобретения.
Анализ открытых патентных источников позволяет констатировать, что наиболее близким аналогом заявляемого изобретения является патент , формула и описание которого содержат сведения о ряде соединений, в зависимости от объекта воздействия способных вызывать либо активационные (агонистические), либо ингибирующие (антагонистические) эффекты в отношении опосредуемого гомосеринлактонами «чувства кворума» у определенных видов бактерий. При этом в основу подобных веществ заявителями положено аналогичное природным ГСЛ лактонное кольцо, для придания которому дополнительных модулирующих активностей осуществлена ковалентная модификация ацильными группами различного строения и состава. Однако значительное структурное сходство предложенной группы молекул с естественными сигналами не только обеспечивает обозначенную заявителями возможность интерференции между ними, но потенциально сохраняет возможность развития неучтенных эффектов в отношении других микроорганизмов, плотностно-зависимая коммуникация между которыми опосредуется структурно схожими ГСЛ.
В свою очередь относительно химической структуры заявляемого соединения наиболее близким известным техническим решением является патент , формула и описание которого содержат сведения о ряде соединений, в основу которых положено пятичленное кольцо тиазола, ковалентно связанное с замещенными или незамещенными циклоалкильными, арильными и др. группировками. Однако в данном патенте отсутствуют указания о возможности использования данных соединений для регуляции коллективного поведения («чувства кворума») у бактерий, а основным назначением заявленных соединений является их применение в качестве антагонистов аденозиновых рецепторов.
Таким образом, заявляемое изобретение не известно из уровня техники, что определяет его соответствие требованию новизны.
Задачей данного изобретения является разработка структурно отличного от гомосеринлактнов соединения, обладающего избирательной и выраженной способностью к регуляции (как усилению, так и ослаблению) опосредуемого ГСЛ коллективного поведения («чувства кворума») у определенного круга биотехнологически полезных, гнилостных и патогенных бактерий.
В настоящем изобретении эта задача решается применением соединения на основе тиазола, полностью описываемого формулой 1:
В данном изобретении раскрывается структурная формула соединения формулы 1 и способы его практического применения для регуляции коллективного поведения («чувства кворума») у бактерий.
В соответствии с настоящим изобретением регуляторный препарат (композиция) на основе производного тиазола содержит по весу от 0.0001 до 100% соединений формулы 1, остальное - нейтральные компоненты или вещества, позитивно модифицирующие (повышающие биодоступность, увеличивающие сроки действия и т.д.) свойства данной композиции.
По сравнению с соединениями, составляющими сущность известных патентов , заявляемое соединение формулы 1 имеет ряд существенных отличий, а именно:
во-первых, в отличие от известных соединений, созданных на основе лактонного кольца и, в этой связи, являющихся близкими структурными аналогами природных авторегуляторных молекул - гомосеринлактонов , заявляемое соединение представляет собой структурно отличный от них синтетический лиганд. Из доступной научной и патентной литературы регуляторы «чувства кворума» на основе тиазола не известны;
во-вторых, в отличие от известных производных тиазола общей формулы 2

заявляемое соединение имеет только один вариант ковалентно присоединяемого радикала, по своему положению соответствующего R 4 и полностью описываемого аналогичным имеющемуся в молекуле естественного сигнала (гексаноил-гомосеринлактона) остатком гексановой кислоты, при отсутствии иных изменений по радикалам R 1 , R 2 и R 3 =Н. Кроме того, в отличие от известного патента , оговаривающего использование соединений общей формулы 2 в качестве антагонистов аденозиновых рецепторов, заявляемое соединение формулы 1 предназначено для регуляции опосредуемого ГСЛ коллективного поведения («чувства кворума») у бактерий;
в-третьих, благодаря структурным отличиям от природных авторегуляторных молекул, проявляющих активность во многих luxI/luxR-подобных системах, заявляемое соединение формулы 1 обладает избирательной (селективной) регуляторной активностью, реализуемой в отношении cviI/cviR-регулируемой системы биосинтеза виолацеина Chromobacterium violaceum, а также других биотехнологически полезных, гнилостных и патогенных виолацеин-продуцирующих, бактерий (см. пример 1). При этом вероятной причиной селективного действия соединения формулы 1 в названных системах «чувства кворума» лежит избирательное взаимодействие с регуляторным белком CviR и его близкими гомологами, но не другими LuxR-подобными белками. В свою очередь природное разнообразие CviR-подобных белков определяет возможность их как позитивного, так негативного регулирования заявляемым соединением, что у различного круга биотехнологически полезных, гнилостных и патогенных виолацеин-продуцирующих бактерий будет проявляться либо как усиление (см. пример 1), либо как ослабление (см. пример 2) коллективного поведения.
Для понимания сути изобретения также необходимо указать, что достигаемая применением соединения формулы 1 регуляция «чувства кворума» включает, но не исчерпывается только воздействием на продукцию виолацеина, т.к. под контролем регуляторного белка CviR и его гомологов находится ряд целевых генов (оперонов), в том числе ответственных за продукцию экзоферментов и образование биопленок. Использование же теста индукции или ингибирования биосинтеза виолацеина в настоящем изобретении определяется простотой и информативностью регистрируемого проявления регуляторной активности соединения формулы 1.
Таким образом, результатом действия соединения формулы 1 является специфическая регуляция определенной системы «чувства кворума», направленность которой (усиление или ослабление) определяется рецепторными особенностями воспринимающих его CviR-подобных белков. Таким образом, с использованием одного и того же соединения оказывается возможным разнонаправленное воздействие на коллективное поведение различных микроорганизмов, в том числе изолированно или в их смешанной культуре.
Защищаемое применение соединения формулы 1 подразумевает, в том числе, его использование для управления биотехнологическими процессами, реализуемыми с помощью виолацеин-продуцирующих микроорганизмов (справочное: виолацеин-производное индола, образующееся при окислении триптофана, сине-фиолетовый пигмент с антибактериальной, протистоцидной, противовирусной и другими биотехнологически и фармакологически полезными активностями). В этом случае соединение формулы 1 может вводиться в плотные или жидкие питательные среды в виде растворов, а также применяться в виде чистого вещества или иммобилизованным на различных носителях.
В состав патентуемого изобретения входит также применение соединения формулы 1 для регуляции активности других целевых генов (оперонов), в том числе вовлеченных в процессы порчи сельскохозяйственной продукции, а также развитие инфекционных заболеваний растений, животных и человека. С этой целью данное соединение может вводиться в организм для обеспечения системного эффекта, а также применяться местно для воздействия на определенные области (например, в составе перевязочных материалов для обработки ран, при обработке операционного поля и т.д.). Соединение может использоваться в виде твердых веществ, растворов или суспензий в воде или других растворителях, а также нанесенным на различные носители. Возможно также использование соединения формулы 1 в составе композиций с другими веществами, в том числе позитивно модифицирующими (увеличивающими биодоступность, сроки действия) его биологическую активности.
Заявляемое изобретение иллюстрируется, но никак не ограничивается следующими примерами.
Пример 1. Стимуляция коллективного поведения («чувства кворума») у бактерий.
Определение способности соединения формулы 1 к регуляции «чувства кворума» проводилось с использованием двух бактериальных тест-систем, в присутствии гексаноил-гомосеринлактона (С 6 -ГСЛ)? отвечающих синтезом пигмента виолацеина {Chromobacterium violaceum NCTC 13274) или развитием биолюминесценции {Escherichia coli pAL103). При этом особенностью первого являлась инсерция транспозона Тn5 в ген cvil, ответственного за синтез собственного С 6 -ГСЛ, с сохранением функционально активного гена cviR и кодируемого им регуляторного белка, ответственного за восприятие автоиндуктора .
Quomm sensing and Chrornobacteriurn violaceum: exploitation of violacein production and inhibition for the detection of N-acyl homoserine lactones. Microbiology, 1997, V.143, P.3703-3711]. В свою очередь особенностью второго штамма являлось наличие генетической конструкции luxR+luxI_luxCDABE, кодирующей рецепторный белок LuxR Vibrio fischeri и в присутствии экзогенно вносимого С 6 -ГСЛ или С 6 -оксо-ГСЛ отвечающей развитием свечения (биолюминесценции) .
При проведении тестирования С. violaceum NCTC13274 и Escherichia coli pAL103 выращивались на жидких питательных средах в отсутствие (контроль) и в присутствии С 6 -ГСЛ или соединения формулы 1 (опыт), использованных в диапазоне концентраций от 2 до 1000 мкМ. Характеристикой регуляторного действия служила величина ЕС50 - концентрация сравниваемых соединений, вызывающая индукцию образования пигмента виолацеина или биолюминесценции на 50% от максимально выраженного эффекта в присутствии естественного сигнала. Результаты подобного тестирования иллюстрируются Фиг.1, а в обобщенном виде приведены в таблице 1.
Таблица 1. Оценка влияния соединения формулы 1 на коллективное поведение («чувство кворума») у бактерий в тестах на С. violaceum NCTC13274 и E.coli pAL103.
Из приведенных данных видно, что оба использованных микроорганизма интенсивно реагируют кворум-зависимым синтезом виолацеина (С. violaceum NCTC) или развитием биолюминесценции (Е. coli рAL103) в присутствии естественного авторегулятора С 6 -ГСЛ. В свою очередь тестируемое соединение формулы 1 действует менее активно, но более специфично, вызывая индукцию синтеза виолацеина, но не развитие биолюминесценции. При этом в основе подобных различий предположительно лежит избирательное сродство соединения 1 к воспринимающему регуляторный сигнал белку CviR при отсутствии такового к LuxR.
Положительным результатом подобного использования заявляемого изобретения является возможность избирательной индукции «чувства кворума» определенных видов бактерий, входящих в состав полимикробных ассоциаций.
Пример 2. Подавление коллективного поведения («чувства кворума») у бактерий.
Определение способности соединения формулы 1 к регуляции «чувства кворума» проводилось с использованием штамма Jantinobacterium lividum, депонированного во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) под №В-10136. Данный штамм представляет собой природный изолят, характеризующийся способностью к синтезу пигмента виолацеина под контролем автоиндуктора неидентифицированной природы.
При проведении тестирования J. lividum В-10136 выращивался на жидких питательных средах в отсутствие (контроль) и в присутствии соединения формулы 1 (опыт), использованных в диапазоне концентраций от 2 до 1000 мкМ. Характеристикой регуляторного действия служила величина ЕС50 - концентрация соединения формулы 1, вызывающая подавление продукции виолацеина на 50% от максимально выраженного эффекта в контроле.
Результаты подобного тестирования иллюстрируются Фиг.2. Из приведенных данных следует, что тестируемое соединения формулы 1 подавляет продукцию виолацеина (ЕС50=87,5 мкМ), что характеризует его как ингибитор коллективного поведения («чувства кворума») J. lividum B-10136.
Положительным результатом подобного использования заявляемого изобретения является возможность подавления «чувства кворума» определенных видов бактерий, в частности J. lividum, для предупреждения вызываемой ими порчи сельскохозяйственной продукции. Та же активность может быть использована при лечении и профилактике инфекционных заболеваний растений, животных и человека, вызываемых J. lividum и другими виолацеин-продуцирующими микроорганизмами.
Применение производного тиазола формулы 1 в качестве регулятора (активатора или ингибитора) коллективного поведения («чувства кворума») у бактерий:
Похожие патенты:
Изобретение относится к области органической химии, а именно к новым биологически активным веществам класса 4-арил-2-гидрокси-4-оксо-2-бутеноатов гетериламмония, а именно к 2-гидрокси-4-метилфенил-4-оксо-2-бутеноат тиазолиниламмония формулы (1).
Изобретение относится к области органической химии, к новым биологически активным веществам класса 4-арил-2-гидрокси-4-оксо-2-бутеноатов гетериламмония, а именно к 2-гидрокси-4-оксо-4-(4-хлорфенил)-2-бутеноату тиазолинаммония (1) формулы обладающему антикоагулянтной активностью, что позволяет предположить его использование в медицине в качестве антикоагулянтного средства.
Изобретение относится к новым производным 2-(имино-замещенных)тиазолидинов, способу их получения, фармацевтическим средствам, содержащим эти вещества, применения указанных производных 2-(имино-замещенных) тиазолидинов для лечения различных заболеваний, а также получения фармацевтических составов на их основе, применяемых для лечения.
Изобретение относится к способу получения новых биологически активных химических соединений, конкретно к способу получения новых производных иминотиазолидина или их гидрохлоридов, обладающих антидепрессивной, антиэпилептической, антипаркинсоновой и анальгетической активностью.
Изобретение относится к соединению, представленному формулой (I), где представляет собой α-конфигурацию; представляет собой β-конфигурацию; и представляет собой α-конфигурацию, β-конфигурацию или их произвольную смесь, его соль, или его смесь с диастереомером в произвольном соотношении, или его циклодекстриновый клатрат.
Изобретение относится к способу получения кристаллов А-формы 2-(3-циано-4-изобутилоксифенил)-4-метил-5-тиазолкарбоновой кислоты. Способ включает: стадию растворения при нагревании 2-(3-циано-4-изобутилоксифенил)-4-метил-5-тиазолкарбоновой кислоты в 1-пропаноле или 2-пропаноле, стадию охлаждения полученного раствора и стадию добавления к этому раствору гептана.
Изобретение относится к применению соединений общей формулы (I), обладающих свойствами ингибитора моноаминоксидаз (МАО), и/или липидного перокисления, и/или свойствами модуляторов натриевых каналов, а также к лекарственному средству на их основе, обладающему теми же свойствами, более конкретно соединения и лекарственное средство могут быть использованы для лечения болезни Паркинсона, старческого слабоумия, болезни Альцгеймера, хореи Гентингтона, бокового амиотрофического склероза, шизофрении, депрессий, психозов, боли и эпилепсии.
Изобретение относится к соединению, представленное формулой (I), в которой A1 обозначает бензол или гетероцикл, выбранный из группы, состоящей из пиридина, пиразина, имидазола, тиазола, пиримидина, тиофена, пиридазина, бензоксазина и оксобензоксазина; A2 обозначает бензол, в случае необходимости замещенный фтором, или тиофен; B1 обозначает водород, низший алкил, в случае необходимости замещенный пиперазинилом или морфолино, галогензамещенный низший алкил, низший алкокси, замещенный карбамоилом, ациламино, карбамоил или низший алкилкарбонилокси (при условии, что, когда A1 обозначает тиазол, B1 не обозначает ациламино); B2 обозначает водород или функциональную группу, содержащую по меньшей мере один атом азота, выбранную из группы, состоящей из ациламино, пирролидинила, морфолино, пиперидинила, в случае необходимости замещенного ацилом, пиперазинила, в случае необходимости замещенного низшим алкилом или ацилом, пиразолила, диазабициклогептила, в случае необходимости замещенного ацилом, и ди-(низший алкил)амино, в случае необходимости замещенного амино или ациламино (при условии, что, когда A1 обозначает тиазол, B2 не обозначает ациламино); Y обозначает группу, представленную формулой (II), в которой J обозначает этилен или низший алкинилен; L обозначает связь; M обозначает связь; X обозначает -(CH2)m-, -(CH2)m-O- или -(CH2)m-NR2- (где m означает целое число от 0 до 3, и R2 обозначает водород); D обозначает -NR3-, где R3 обозначает водород; и E обозначает амино, или его фармацевтически приемлемой соли.
Изобретение относится к соединениям формулы 1.0: где Q представляет собой тетрагидропиридинильное кольцо замещенное. R5, R1 выбирают из группы, состоящей из: (1) пиридила, замещенного заместителем, выбираемым из группы, состоящей из: -O-СН3, -O-C2H5, -O-СН(СН3)2, и -О-(СН2)2-O-СН3, R2 выбирают из группы, состоящей из: -ОСН3 и -SCH3; и R5 выбирают из группы, состоящей из: (a) замещенного триазолилфенила-, где триазолил замещен одной или двумя алкильными группами, выбранными из группы, состоящей из: -С1-С4алкила, (b) замещенного триазолилфенила-, где триазолил замещен на атоме азота -С1-С4алкилом, (c) замещенного триазолилфенила-, где триазолил замещен на атоме азота -С2алкилен-O-С1-С2алкилом, (d) замещенного триазолилфенила-, где триазолил замещен на атоме азота -С2-С4алкилен-O-СН3, и (e) замещенного триазолилфенила-, где триазолил замещен на атоме азота гидрокси-замещенным -С1-С4алкилом, и где фенил необязательно замещен от 1 до 3 заместителями, независимо выбранными из группы, состоящей из галогена; и их фармацевтически приемлемым солям и сольватам, которые заявлены в качестве ингибиторов ERK.
Изобретение относится к новому средству, представляющему собой производные роданина формулы (I), для лечения опухолевых заболеваний различной локализации. Технический результат - средство антипролиферативного и антиметастатического действия для лечения опухолевых заболеваний.
Предложены применение (R)-5--2-(-пропилимино)-3-орто-толилтиазолидин-4-она (Соединение 1) или его соли для получения лекарственного препарата для предупреждения и/или лечения болезни или расстройства, связанного с активацией иммунной системы, где лекарственный препарат представляет собой набор доз Соединения 1, причем в течение начальной фазы лечения доза индуцирует десенсибилизацию сердца и она ниже конечной дозы, и при указанной начальной фазе лечения доза вводится с частотой, которая обеспечивает поддерживание десенсибилизации сердца до тех пор, пока не произойдет следующее острое снижение частоты сердечных сокращений, а затем дозу титруют с повышением до конечной дозы Соединения 1; соответствующие способ лечения и набор доз.
Изобретение относится к соединению формулы I или его терапевтически приемлемым солям, где А1 представляет собой фурил, имидазолил, изотиазолил, изоксазолил, пиразолил, пирролил, тиазолил, тиадиазолил, тиенил, триазолил, пиперидинил, морфолинил, дигидро-1,3,4-тиадиазол-2-ил, бензотиен-2-ил, бензотиазол-2-ил, тетрагидротиен-3-ил, триазолопиримидин-2-ил или имидазо-тиазол-5-ил; где А1 незамещен или замещен одним, или двумя, или тремя, или четырьмя или пятью заместителями, независимо выбранными из R1, OR1, C(O)OR1, NHR1, N(R1)2, C(N)C(O)R1, C(O)NHR1, NHC(O)R1, NR1C(O)R1, (O), NO2, F, Cl, Br и CF3; R1 представляет собой R2, R3, R4 или R5; R2 представляет собой фенил; R3 представляет собой пиразолил или изоксазолил; R4 представляет собой пиперидинил; R5 представляет собой C1-C10алкил или C2-C10алкенил, каждый из которых не замещен или замещен заместителями, выбранными из R7, SR7, N(R7)2, NHC(O)R7, F и Cl; R7 представляет собой R8, R9, R10 или R11; R8 представляет собой фенил; R9 представляет собой оксадиазолил; R10 представляет собой морфолинил, пирролидинил или тетрагидропиранил; R11 представляет собой C1-C10алкил; Z1 представляет собой фенилен; Z2 представляет собой пиперидин, не замещенный или замещенный OCH3, или пиперазин; Z1A и Z2A оба отсутствуют; L1 представляет собой C1-C10алкил или C2-C10алкенил, каждый из которых не замещен или замещен R37B; R37B представляет собой фенил; Z3 представляет собой R38 или R40; R38 представляет собой фенил; R40 представляет собой циклогексил или циклогексенил; где фенилен, представленный Z1 не замещен или замещен группой OR41; R41 представляет собой R42 или R43; R42 представляет собой фенил, который не конденсирован или конденсирован с пирролилом, имидазолилом или пиразолом; R43 представляет собой пиридинил, который не конденсирован или конденсирован с пирролилом; где каждый вышеуказанный циклический фрагмент, представленный R2, R3, R4, R8, R9, R10, R38, R40, R42 и R43, независимо не замещен или замещен одним или несколькими заместителями, независимо выбранными из R57, OR57, С(О)OR57, F, Cl CF3 и Br; R57 представляет собой R58 или R61; R58 представляет собой фенил; R61 представляет собой C1-C10алкил; и где фенил, представленный группой R58, не замещен или замещен одним или несколькими заместителями, независимо выбранными из F и Cl. Также изобретение относится к фармацевтической композиции, содержащей указанные соединения, и к способу лечения заболеваний, при которых экспрессируются антиапоптотические белки Bcl-2. 4 н. и 3 з.п. ф-лы, 2 табл., 48 пр.
Изобретение относится к области микробиологии, биотехнологии и фармацевтики, а именно к малым регуляторным молекулам, способным направленно изменять плотностно-зависимую коммуникацию и регулируемое ей коллективное поведение у бактерий. В частности, изобретение относится к применению производного тиазола формулы 1 в качестве регулятора коллективного поведения у бактерий. Технический результат - производное тиазола, предназначенное для регуляции опосредуемого гомосеринлактонами «чувства кворума» у виолацеин-продуцирующих биотехнологически полезных, гнилостных и патогенных бактерий. 2 ил., 1 табл., 2 пр.
Формирование, рост, миграция планктонных форм клеток для колонизации в биопленках регулируются на уровне популяции посредством механизмов межклеточной коммуникации. «Quorum sensing» (QS) - это процесс коллективной координации экспрессии генов в популяции бактерий, опосредующий специфическое поведение клеток. Механизм работы QS основан на сложной иерархической регуляции целевых локусов генома бактериальной клетки. При этом регуляция осуществляется на разных уровнях воздействия: транскрипционном, трансляционном, посттрансляционном.
На конкретный клеточный сигнал клетки в популяции отвечают специфическим ответом. На сегодняшний день установлено, что клеточно-клеточные взаимосвязи влияют на внутрипопуляционную дифференцировку клеток, на экспрессию генов вирулентности, регулируют ростовые процессы, характер и направление подвижности (таксис), а также бактериальный апоптоз и токсинообразование.
Работу QS можно сравнить с гормональной регуляцией функциональной активности различных органов и тканей в многоклеточном организме.
Грамположительные и грамотрицательные микроорганизмы используют различные сигнальные системы и разные химические передатчики сигналов. Первые синтезируют 7-8-членные пептиды (Enterococcus spp.), циклопептиды (Staphylococcus spp.); вторые: разнообразные ацил-гомосерин лактоны (AHL).
Рассмотрим работу QS на примере синегнойной палочки. У данного микроорганизма функционируют, по меньшей мере, три регуляторные системы. Наиболее изученная из них LasI - LasR система (в качестве химического сигнала выступают AHL с длинной ацильной цепью); RhlI - RhlR система (мессенджер - AHL c короткой ацильной цепью, C4-HSL); и хинолоновая PQS система. Взаимодействие этих трех систем позволяет регулировать экспрессию порядка 6-10% генома. В LasI - LasR системе за биосинтез сигнальных молекул отвечает AHL-синтаза, продукт гена lasI. Его экспрессия находится на базальном уровне, поэтому накопление сигнальных молекул происходит достаточно длительно, и биологический эффект начинает проявляться только в стационарной фазе роста популяции. В клетках AHL взаимодействует с LasR-белком (продукт lasR-гена, экспрессия которого также находится на базальном уровне), образуя при этом гомодимер - регулятор транскрипции. Этот регулятор активирует множество генов, участвующих в формировании вирулентности, и в процессах образования биопленок, он также активирует хромосомный регулон las Box, который отвечает за экспрессию различных факторов патогенности (протеазы, эластаза, и прочее). Комплекс LasR + AHL активирует вторую сигнальную систему. Это происходит после взаимодействия с промотором Rhl-генов. Экспрессия RhlI обусловливает образование протеина для синтеза AHL с короткими ацильными остатками (C4-HSL). Ген rhlR кодирует белок (RhlR), который взаимодействует с сигнальными молекулами C4-HSL. Образующийся протеиновый тандем RhlR + C4-HSL регулирует транскрипцию генов, кодирующих различные структурные соединения матрикса биопленок (альгината, рамнолипида и др.), а также липазы, пиоцианина. Также этот транскрипционный регулятор активирует экспрессию другого регулятора - RpoS (сигма-фактор стационарной фазы роста P.aeruginosa), который инициирует образование стрессовых белков клетки и участвует в адаптационных реакциях. Среди клинических изолятов P.aeruginosa обнаружено, что помимо функционирования AHL-сигнальных систем, параллельно вступает хинолоновая система (генный локус - pqsABCDE), мессенджерами являются гидроксиалкилхинолоны и гидроксигептилхинолоны. Эта система функционирует так же, как и вышеописанные механизмы регуляции, и опосредует увеличение экспрессии факторов вирулентности, в частности, синтез эластазы, лектинов. Взаимодействие трех сигнальных систем затрагивает большое количество генов, в связи с чем происходит глобальная регуляция транскрипции, что приводит к очень гибкой лабильности физиологических процессов клетки, и является следствием огромного адаптационного потенциала бактерий в популяции.
Сигнальные системы работают по принципу аутоиндукции, синтезированные сигнальные молекулы действуют на свою же клетку, и по мере их накопления во внеклеточной среде происходит все большая активация зависимых промоторов, регулонов генома клеток. QS на основе AHL обнаружен у многих грамотрицательных бактерий: Acinetobacter, Aeromonas, Brucella, Burkholderia, Erwinia, Enterobacter, Chromobacterium, Hafnia, Serratia, Vibrio, Yersinia и др.. AHL-коммуникация осуществляется внутри вида, специфичность и сила биологического ответа зависит от химической структуры самой сигнальной молекулы.
Но среди клинических изолятов грамотрицательных бактерий часто наблюдается и перекрестная коммуникация (cross - talk communication), обеспечивающая взаимодействие популяций разных видов в инфекционном очаге. Перекрестный QS способен как активировать, так и ингибировать работу зависимых целевых генов в бактериальных ассоциациях. Например, P. aeruginosa, Serratia liquefaciens, Aeromonas hydrophila синтезируют один тип сигнальных молекул. QS C.violaceum и A.hydrophila ингибируется AHL-молекулами с длинными ацильными остатками, которые синтезируются различными грамотрицательными микроорганизмами. Синегнойная палочка образует сигнальные молекулы с длинными и короткими ацильными остатками, и они взаимно не ингибируются, однако, мессенджеры E.coli такой же молекулярной структуры с длинными ацильными остатками способны ингибировать rhl-сигнальную систему P.aeruginosa. В смешанных биопленках P.aeruginosa и Burkholderia cepacia, буркхолдерии реагируют на сигналы синегнойной палочки (которая в свою очередь не чувствительна к сигналам B.cepacia), следовательно, популяция P.aeruginosa регулирует многие физиологические процессы своего ассоцианта. Имеются данные, что некоторые штаммы P.aeruginosa, выделенные от больных исцидозом, не способны сами синтезировать аутоиндукторы rhl-сигнальной системы, следствием чего является снижение вирулентности, и неполноценное формирование биопленок в опытах in vitro. Но, однако, in vivo, эти же штаммы синегнойной палочки формируют полноценные биопленки. Выяснено, что микрофлора, выделенная из слизи от тех же больных, синтезирует rhl-аутоиндукторы, регулируя таким образом вирулентность и формирование биопленок P.aeruginosa и инициируя инфекционный процесс. Сами AHL-молекулы неодинаково влияют на другие группы бактерий, установлено например, что аутоиндукторы синегнойной палочки блокируют работу QS у S.aureus. Сигнальные молекулы прокариот способны влиять и на поведение клеток грибов, растений, и даже животных клеток. Так, AHL P.aeruginosa подавляет процесс филаментации Candida albicans.
В организме человека AHL-молекулы ингибируют пролиферацию лейкоцитов и процесс образования фактора некроза опухолей б. В высоких концентрациях AHL инициируют апоптоз разных типов иммунокомпетентных клеток. В целом, бактериальные аутоиндукторы оказывают иммуносупрессирующее действие. Именно за счет реакций QS осуществляются «социальные» отношения внутри популяции, образуется «химическая коммуникационная сеть» биопленки, которая может охватывать мультиводовое сообщество.
Не менее интересна работа сигнальных систем среди грамположительных микроорганизмов. Например, у Enterococcus spp. QS регулирует процесс переноса плазмид (от донорной к реципиентной клетке) через механизм конъюгации. Клетка-реципиент синтезирует специфический пептидный сигнал («половой» бактериальный феромон) который накапливается в среде и специфически связывается с рецепторами клеток-доноров, несущими плазмиду, которая соответствует этому феромону. Запускаемая при этом регуляторная система обеспечивает экспрессию факторов, опосредующих клеточное взаимодействие и перенос плазмиды (компоненты конъюгации). Как отмечалось выше, определенной плазмиде соответствует конкретный феромон. За счет такого строгого механизма взаимодействия осуществляется бактериальная селекция клеток внутри биопленки. Посредством такой коммуникации траслоцируются плазмиды, несущие гены устойчивости к антибиотикам, гены гемолизинов, бактериоцинов. Обычно биологически активные сигнальные пептиды закодированы в хромосоме, а рецепторные белки, обеспечивающие аффинитет к феромонам закодированы в самих плазмидах. После транслокации плазмиды в клетку реципиента, она начинает синтез ингибиторов феромонов, для каждого типа феромона соответствует свой ингибитор. Это свойство позволяет выключать сигнал для уже имеющейся плазмиды, и усиливать накопление молекул феромонов для другого типа плазмид. биоплёнка микроорганизм клетка
За счет работы подобной системы в популяции биопленки постоянно происходит положительная селекция штаммов с выгодными свойствами и отрицательная селекция - элиминация штаммов, с «ненужными» фенотипами. При инфекционных поражениях такие коммуникативные механизмы передачи мобильных генетических элементов позволяют с максимальной скоростью распространять гены антибиотикорезистентности, вирулентности, дополнительные физиологические возможности.
Наибольший интерес представляет QS, участвующий в регуляции экспрессии факторов вирулентности у стафилококков. Генетической основой работы этой системы является agrABCD - хромосомный локус. В качестве передатчиков сигналов выступают циклопептиды - аутоиндукторы (AIP, auto-inducing peptide), которые классифицированы по строению и биологическому эффекту на группы и субгруппы, например, 1 и 4 субгруппы у S.aureus увеличивают экспрессию факторов вирулентности. Эти молекулы крайне специфичны, замена хоты бы одной аминокислоты в структуре соединения, ведет к потере биологической функции. Как и с примерами сигнальной - ингибиторной системы у энтерококков, стафилококковая система реагирует только на один тип аутоиндукторов, как только клетка получила специфический сигнал, активируются гены-ингибиторы, и клетка уже не способна воспринимать другие сигналы. Такой механизм обеспечивает жесткую популяционную селекцию. Синтезированные сигнальные молекулы взаимодействуют с гистидинкиназной мембранной системой (agrC), которая через каскад реакций активирует регулятор транскрипции (agrA). Этот белок осуществляет бифункциональную регуляцию двух промоторов P2 и P3. Соответственно, транскриптами этих зависимых генов является РНК II и РНК III, первая содержит основные agr-гены, таким образом проявляется аутоиндуктивный ответ системы. В свою очередь РНК III обеспечивает регуляцию синтеза факторов вирулентности (ДНКазы, фибринолизина, энтеротоксина, б-, в-, д-токсинов и др.). Интересной особенностью на данном этапе регуляции является то, что транскрипт РНК III размером в 500 пар нуклеотидов не несет кодируемой информации, за исключением одной открытой рамки считывания для д-токсина. Подавляющая часть молекулы транскрипта сама выступает как рибосомальный ингибитор. РНК III блокирует процесс трансляции фактора репрессии вирулентности Rot (repressor of toxins), регулирующий синтез стафилококковых токсинов, следствием чего является неконтролируемое образование экзотоксинов. Таким образом, agr-система обеспечивает популяционную регуляцию экспрессии факторов вирулентности стафилококков. Используя различные варианты ПЦР-исследований, установлено, что экспрессия agr-локуса в клетках наблюдается при многих стафилококковых поражениях: инфекции кожи, эндокардиты, артриты, сепсис. В популяции биопленок накапливаются сигнальные молекулы, синтезируемые подавляющим большинством клеток, являющихся метаболическим и генетическим «ядром, кворумом» популяции, они задают метаболическое поведение, фенотипические изменения для всех клеток. Это осуществляется за счет аккумуляции сигналов через свойство аутоиндукции, и ингибирование других сигналов, синтезируемыми меньшинством, либо вообще иными штаммами в биопленке за счет параллельного механизма ингибирования. 1.5.Клиническое значение биоплёнок.
Представления о биопленках, подтвержденные с помощью современных методов визуализации, изменили взгляды на инфекционные заболевания. Все новые данные свидетельствуют о том, что хронические инфекции принципиально отличаются от острых образованием биопленок, а фагоциты макроорганизма неспособны поглощать биопленки в отличие от отдельных бактериальных клеток.
Существование биопленок при хронических инфекциях требует совершенно новых подходов к их диагностике и лечению. Кроме того, традиционные бактериологические методы не выявляют большинство бактерий, участвующих в инфекционном процессе. Новейшие молекулярные, геномные, транскрипционные и протеомные методы позволили определить, что при выделении чистой культуры определяется лишь около 1% клеток патогенного микробиоценоза. В результате лечение нацелено лишь на 1-2 вида бактерий из множества штаммов, присутствующих в составе биопленки (в том числе, возможно, и грибов).
К настоящему времени достоверно доказана роль микробных биопленок в возникновении и развитии таких распространенных заболеваний, как инфекции, связанные с катетеризацией сосудов, вызванные Staphylococcus aureus и другими грамположительными микроорганизмами; инфекции сердечных клапанов и суставных протезов, вызываемые стафилококками; пародонтит, обусловленный рядом микроорганизмов полости рта; инфекции мочевых путей, определяемые Е. coli и др. патогенами; инфекции среднего уха -- причина, например, Haemophilus influenzae, муковисцидоз, вызываемый P. Aeruginosa и др.
Все эти заболевания трудны для лечения, имеют высокую частоту рецидивов и некоторые из них могут явиться причиной летальных исходов. Далеко не до конца ясны механизмы, по которым микроорганизмы, образующие биопленки, вызывают патологические процессы в макроорганизме.
Кроме тканей организма хозяина, микробные биопленки колонизируют различные медицинские устройства небиологической природы, внедряемые в организм человека (катетеры, водители ритма, сердечные клапаны, ортопедические устройства). Исследования имплантированных медицинских устройств с применением электронной микроскопии показали присутствие бактериальных биопленок.
Возрастающая антибиотикорезистентность и развитие бактериальных биопленок являются основными проблемами в лечении инфекций мочевых путей.
Установлено, что в основе повышенной устойчивости лежат свойства клеток и внеклеточного матрикса. Матрикс биопленки может связывать или не пропускать, и/или инактивировать антибиотики. Устойчивость, обусловленную свойствами клеток биопленки, объясняют уменьшением их свободной поверхности за счет контактов друг с другом и формированием особых бактерий, получивших название персистеров.
Персистеры это альтруистические клетки, которые образуются в стационарной фазе роста, они метаболически не активны и обеспечивают выживание материнской популяции в присутствии летальных, для всех клеток, факторов. В биопленках эта субпопуляция составляет 1-5% от всей клеточной массы. Формирование таких клеток зависит от степени роста популяции, в лог-фазе культура не образует или образует очень небольшую долю персистеров, их количество увеличивается к стационарной фазе. Образование субпопуляции обратно зависимо от уровня метаболической активности всех клеток биопленки, а также от действия экзогенных неблагоприятных факторов. Фенотип персистеров характеризуется интересной биологией, они замедляют все физиологические процессы и становятся толерантными к действию разных факторов, в том числе и к воздействию антимикробных препаратов.
Свойство антибиотикотолерантности отличается от механизмов резистентности. Действиевсех механизмов устойчивости бактерий, по существу, можно свести к одному явлению - это предотвращение взаимодействия антибиотика с его мишенью (за счет изменений самих мишеней, или с помощью синтеза ферментов, нейтрализующих антибиотики). Толерантность же опосредуется способностью микробной клетки выживать в присутствии антибиотика за счет замедления метаболизма и «выключения» основных биологических процессов клетки.
Основными же механизмами повышения устойчивости бактерий к антибиотикам в биопленках являются:
1. ограничение проникновения антибиотиков через биопленки;
2. ограничение питания и измененная микросреда в биопленке приводят к уменьшению скорости деления бактерий, вследствие чего остается меньше мишеней для действия антибиотиков;
3. адаптивные реакции;
4. генная изменчивость у персистирующих в биопленке бактерий.
Исходя из накопившихся данных, следует, что антибиотики по действию набактерии биопленок разделяются на два типа. К первому относят антибиотики, проникающие в биопленки и угнетающие или убивающие образующие их микроорганизмы. Второй тип -- антибиотики, практически не проникающие в биопленки, но эффективно препятствующие их расселению за счет мигрирующих бактерий. Таким образом, некоторые антибиотики не проникают в биопленки и не уничтожают существующие сообщества, а только препятствуют увеличению их числа и распространению в организме человека. В связи с этим в последние годы началось изучение способности антибиотиков проникать в биопленки различных микробов.
Установлено, что в биопленки Klebsiella pneumoniae плохо проникает ампициллин, а в сообщества Enterococcus faecalis -- ампициллин, ко-тримаксозол и ванкомицин. В биопленки ряда микробов плохо проникает широко используемый амоксициллин.
К числу антибиотиков, хорошо проникающих через липиды клеток, относятся фторхинолоны. Эта группа антимикробных препаратов способна действовать на основные возбудители урологических заболеваний, в достаточной концентрации проникает в очаг инфекции. Имеющийся опыт использования антибиотиков свидетельствует, что с инфекционным процессом, прежде всего с его клиническими проявлениями, можно справиться с помощью антибиотиков, как проникающих, так и не проникающих в биопленки. Однако разница между ними существует, и она достаточно существенна. Показано, что различия антибиотиков, проникающих и непроникающих в биопленки, могут проявляться в отдаленных результатах лечения. Использование антибиотиков, плохо проникающих в биопленку, очень быстро приводит к формированию и отбору устойчивых штаммов. Кроме того, при этом чаще возникают рецидивы и формируются очаги хронических процессов.
Терапевтическое воздействие на биопленки может быть направлено на механизмы первоначальной адгезии бактерий к поверхности, блокирование синтеза или разрушение полимерного матрикса, нарушение межклеточного обмена информацией, а также оно может сочетаться с собственно бактерицидными агентами. Подобное лечение, действующее на структуру или функции биопленок, может оказаться более эффективным, чем стандартная антибактериальная терапия.