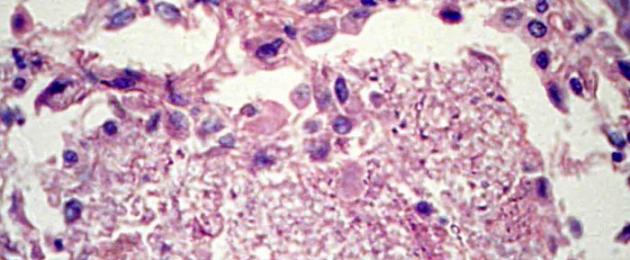
Пневмония пневмоцистная (ПЦП, пневмоцистоз) — это заболевание дыхательной системы, проявляющееся как инфекционно-токсический синдром, поражающий легкие и мелкие бронхи. Пневмоцистоз входит в группу антропонозных инфекций, которым подвержены только люди. ПЦП — оппортунистическое инфекционное заболевание, т. е. возникает у людей с сильно ослабленным иммунитетом (ВИЧ-инфицированные), способное привести к летальному исходу. Поэтому ПЦП считается главным СПИД-индикаторным заболеванием. Оппортунистические инфекции не опасны для людей с хорошим иммунитетом.
Инфицируют организм возбудители — пневмоцисты Pneumocystis carinii, описанные в 1909 г. и выделенные из организма животного в 1912 г. Из-за этого вначале считали, что данный возбудитель не опасен для человека.
1942 г. была выделена пневмоциста Pneumocystis jiroveci, ставшая причиной вспышки пневмонии у грудных детей и детей с низким иммунитетом. Pneumocystis jiroveci названа в честь ученого Отто Йировица, который первым описал данный возбудитель, вызывающий легочную форму заболевания у людей. С тех пор название Pneumocystis carinii стало считаться устаревшим. Только в 1980 г. было установлено, что пневмоциста ошибочно отнесена к типу простейших, и на самом деле занимает промежуточное место между грибами и простейшими.
 Как и представители царства грибов, пневмоциста в составе своей оболочки имеет хитиноподобное вещество глюкан, схожие по строению рибосомальную РНК, митохондриальные белки, ферменты. В то же время, как и простейшие, пневмоциста не содержит эргостерол (гормоноподобное вещество), что обеспечивает ее устойчивость к действию противогрибковых препаратов.
Как и представители царства грибов, пневмоциста в составе своей оболочки имеет хитиноподобное вещество глюкан, схожие по строению рибосомальную РНК, митохондриальные белки, ферменты. В то же время, как и простейшие, пневмоциста не содержит эргостерол (гормоноподобное вещество), что обеспечивает ее устойчивость к действию противогрибковых препаратов.
 Заражение происходит воздушно-капельным путем от больного человека, выделяющего пневмоцисты во время кашля или чихания. Были установлены и вертикальные способы передачи инфекции, т. е. от болеющей матери к плоду. Такие случаи, как правило, приводили к мертворождению. Проявление клинической картины у новорожденных также является подтверждением внутриутробной передачи инфекции. Пневмоцистоз у детей с пороками развития, цитомегаловирусной инфекцией, недоношенностью — частое явление.
Заражение происходит воздушно-капельным путем от больного человека, выделяющего пневмоцисты во время кашля или чихания. Были установлены и вертикальные способы передачи инфекции, т. е. от болеющей матери к плоду. Такие случаи, как правило, приводили к мертворождению. Проявление клинической картины у новорожденных также является подтверждением внутриутробной передачи инфекции. Пневмоцистоз у детей с пороками развития, цитомегаловирусной инфекцией, недоношенностью — частое явление.
Заболевание возникает у лиц с низким иммунитетом:
- имеющие ВИЧ-положительный анализ;
- с патологиями соединительной ткани и крови;
- больные с злокачественными опухолями;
- пациенты, перенесшие трансплантацию органов;
- больные, находящиеся на лечении, приводящим к иммуносупрессии (подавление иммунитета), например, облучение, сильнодействующие препараты;
- диабетики, пожилые люди;
- курящие на протяжении многих лет;
- работающие с токсическими веществами.
Пневмоцистная пневмония у ВИЧ-инфицированных встречается в 80% случаев. Если лечение не будет проведено, то почти всегда ПЦП влечет за собой причины смерти при ВИЧ-инфекции. У больных с низким иммунитетом по другим причинам ПЦП возникает в 40% случаев.
Клиническая картина
 У детей старшего возраста и взрослых, заболевание, как правило, характеризуется острым началом напоминающим, воспаление легких. Проявляются все симптомы интоксикации: озноб, повышение температуры тела, боль в груди, кашель надсадного характера. Постепенно наступают признаки дыхательной недостаточности:
У детей старшего возраста и взрослых, заболевание, как правило, характеризуется острым началом напоминающим, воспаление легких. Проявляются все симптомы интоксикации: озноб, повышение температуры тела, боль в груди, кашель надсадного характера. Постепенно наступают признаки дыхательной недостаточности:
- Тахипноэ — учащенное дыхание.
- Цианоз — синюшность кожных покровов, акроцианоз — более распространенная синюшность.
- Одышка — чувство нехватки воздуха.
Течение пневмоцистной пневмонии у детей начинается скрыто, первые симптомы появляются после поражения легких:
- Кашель коклюшеобразный, т. е. лающий, не дающий облегчения.
- Затрудненное дыхание, удушающего характера. Обычно возникает по ночам.
- Мокрота серого цвета, пенистая.
 У детей недоношенных и с ослабленным иммунитетом (особенно в возрасте до 6 месяцев) ПЦП протекает в несколько стадий:
У детей недоношенных и с ослабленным иммунитетом (особенно в возрасте до 6 месяцев) ПЦП протекает в несколько стадий:
- Отечная — стадия нарастания симптомов пневмонии (воспаления легких), продолжающаяся от 7 до 10 дней. Характерна нарастающая одышка (может прогрессировать до затруднения дыхания в покое) с сухим кашлем. Признаки интоксикации выражены слабо.
- Ателектатическая стадия длительностью до 4 недель. Одышка выраженного характера, до 30-50 дыханий в минуту, кашель с вязкой мокротой, вздутая грудная клетка. Симптомы интоксикации более выражены.
- Эмфизематозная стадия — возникают эмфизематозные вздутия, могут разрушиться альвеолярные перегородки с проникновением воздуха в плевральную полость (пневмоторакс).
У взрослых и старших детей заболевание протекает без четкой стадийности. По этой причине нередко ПЦП воспринимают как хронический воспалительный процесс бронхиального древа. У больных СПИДом наблюдается еще менее выраженная клиническая картина. Симптоматика развивается в течение более продолжительного времени. Такие симптомы как одышка, кашель могут вначале отсутствовать. Наступает медленное прогрессирование дыхательных расстройств.
Диагностические мероприятия
Диагностика затруднена из-за отсутствия специфических поражений легочной ткани.
 Специалисты делаю вывод на основании анамнеза, выявления причин, повлекших за собой ослабление иммунной системы, и нетипичного течения пневмонии. Должна настораживать скудная клиническая картина на фоне сильной одышки. Рентгенография не дает точной картины, понадобится проведение МРТ или КТ.
Специалисты делаю вывод на основании анамнеза, выявления причин, повлекших за собой ослабление иммунной системы, и нетипичного течения пневмонии. Должна настораживать скудная клиническая картина на фоне сильной одышки. Рентгенография не дает точной картины, понадобится проведение МРТ или КТ.
В первую очередь показана госпитализация больных с ярко выраженной клинической картиной. Следует назначить диету, согласно состояния больного. Консервативное (медикаментозное) лечение пневмоцистной пневмонии может включать несколько схем.
Этиотропная терапия. При этом способе лечения идет воздействие возбудителя заболевания. Например, дают эффект следующие препараты:
- Пентамидин (назначается строго врачом, в силу высокой токсичности);
- Фуразолидон (антибиотик, производный нитрофуранов);
- Трихопол (комбинированный препарат с антибактериальный и противопротозойным действиями);
- Бисептол (комбинированный препарат из группы сульфаниламидов).
При СПИДе в схему лечения пневмоцистной пневмонии включают антиретровирусную терапию (ВААРТ) — это терапия, направленная на подавление действия вируса у ВИЧ-инфицированных, включающая прием 3-4 препаратов: Ламивудин, Ставудин, Зидовудин и др.
Своевременное и компетентное лечение приводит к выздоровлению. В случае сильного иммунодефицита (ВИЧ-инфекции, при СПИДе) смерть наступает в среднем в 50% случаев. Смерть от пневмонии при ВИЧ наступает по причине дыхательной недостаточности из-за нарушения газообмена.
Если отсутствует лечение и ранняя диагностика, могут возникнуть следующие осложнения: абсцесс легкого (некроз легочной ткани с образованием полости), неожиданный пневмоторакс (скопление воздуха в плевральной полости), эксудативный плеврит (воспаление плевральных листков, скопление жидкости в плевральной полости).
Эпидуральная и спинальная анестезия
Compilated by Virus
Глава I. ПОНЯТИЕ О НЕЙРОФИЗИОЛОГИЧЕСКИХ МЕХАНИЗМАХ БОЛИ
В представлении об общих физиологических механизмах боли существуют две точки зрения.
Теория специфических болевых рецепторов (М.Фрей,1894) - имеются специфические болевые рецепторы, представленные свободными неинкапсулированными нервными окончаниями, имеющими множество концевых разветвлений с мелкими аксоноплазматическими отростками. Отличительной особенностью этих окончаний является их высокая хемочувствительность. Любое повреждение тканей сопровождается высвобождением аллогенных химических веществ, которые подразделяются на три типа - тканевые (серотонин, гистамин, ацетилхолин и др.), плазменные (брадикинин, каллидин) и выделяющиеся из нервных окончаний (субстанция Р). Кроме того, к активации свободных нервных окончаний приводят продукты разрушения тканей, образующиеся при воспалении, травме, гипоксии.
Теория интенсивности А.Гольдшейдера (1894) - боль возникает вследствие избыточной активации всех типов рецепторов (главенствующим является интенсивность воздействия).
Основными проводниками кожной и висцеральной болевой чувствительности являются гонкие миелиновые А-5 и безмиелиновые С-волокна. (табл.1)
Таблица 1 Типы и функции нервных волокон
А- ?
Диаметр (мкм) 12-20
Скорость импульса (м/с) 70-120
Функция волокна Иннервация скелетной мускулатуры. Проприоцепция
А- ?
Диаметр (мкм) 5-15
Скорость импульса (м/с) 30-70
Функция волокна Прикосновение Давление
A
-
?
Диаметр (мкм) 3-6
Скорость импульса (м/с) 15-30
Функция волокна Поддержание тонуса скелетной мускулатуры
А- ?
Диаметр (мкм) 2-5
Скорость импульса (м/с) 12-30
Функция волокна Проведение быстрой боли Прикосновения Температурная чувствительность
B
Диаметр (мкм) 3
Скорость импульса (м/с) 3-15
Функция волокна Преганглнонарные волокна вегетативной нервной системы
С
Диаметр (мкм) 0,4-1,2
Скорость импульса (м/с) 0,5-2,0
Функция волокна Проведение медленной боли Прикосновения Температурная чувствительность Постганглпонарные симпатические волокна
Кратковременная активация С- волокон вызывает ощущение умеренной и плохо локализуемой боли. При длительном.ноцицептивном воздействии в С - афферентах наблюдается феномен утомления с одновременным уменьшением боли, но через непродолжительное время возникает сенситизация, проявляющаяся резким снижением порога раздражения С- волокон и возрастанием интенсивности болевого ощущения.
С импульсной активностью в А- ? - волокнах связано ощущение острой колющей боли, которую испытывает человек сразу после сильного термического повреждения кожи (локальный ожог, прикосновение к горячему предмету).
Следует подчеркнуть, что А- ? и С- волокна не являются проводниками исключительно болевых сигналов. Эти волокна активируются повреждающими термическими (холодовы-ми и тепловыми) и механическими (прикосновение, небольшое сдавливание) воздействиями.
После входа в спиной мозг А- с и С- волокна в составе "факта Лиссауэра идут в каудальном и ростральном направлениях и оканчиваются в дррзальной части заднего рога, где имеются три группы нейронов. Первая группа (I слой серого вещества спинного мозга) активируется исключительно ноци цептивными стимулами или раздражениями А- ? и С- волокон. Вторая группа (IV, V и, частично, VI слои) отвечают на ноцицептивные и неноцицептивные воздействия. Третья группа, представленная нейронами желатинозной субстанции, образует систему контроля афферентного входа в спинной мозг и формирования восходящего ноцицептивного потока импульсов. Аксоны желатинозных нейронов оканчиваются в I, II, IV и V слоях серого вещества спинного мозга.
Желатинозная субстанция функционирует не только как релейная инстанция, но и модулирует эффективность синаптического воздействия афферентных входов на нейроны дорсального рога спинного мозга. Ей отводится ключевая роль в теории "входных ворот" Р. Мельзака и П. Уолла (1965), которая объясняет формирование ноцицептивного потока на сегментарном уровне на основе центрального взаимодействия быстропроводящей миелиновой (неноцицептивной) и медлен-нопроводящей безмиелиновой систем на первых релейных нейронах спинного мозга.
В желатинозной субстанции обнаружено большое количество опиатных рецепторов, которые расположены как на наружной, так и на внутренней поверхностях клеточной мембраны. Типы опиатных рецепторов и их характеристики представлены в таблице 2.
Таблица 2 Характеристика опиатных рецепторов
? (мю)
Супраспинальная аналгезня, угнетение дыхания, миоз. гипотермия, орадикардия. эйфория, каталепсия, снижение активности барорецепторов дуги аорты, парез кишечника, запоры
?
(дельта)
Тахикардия, тахипноэ, дисфория, галлюцинации, мидриаз, тошнота, аналгезия отсутствует
к
(каппа)
Спинальная аналгезия, дистрофия, седатация, миоз. уменьшение аппетита. Рецепторы активируются при геморрагическом шоке.
? (сигма)
Спинальная аналгезия. стресс-индуцированная аналгезия, угнетение дыхания, гипертермия, гипотензия. Рецепторы активируются при септическом и геморрагическом шоке
В зонах задних рогов спинного мозга (преимущественно в желатинозной субстанции), через которые передаются ноцицептивные сигналы, выявлено наличие значительного количества адренорецепторов, причём?
2-адренорецепторы преобладают в поверхностных участках. Экспериментально, с использованием интратекальных микроинъекций адренолитиков, имеющих разное сродство к?
1- и?
2-адренорецепторам, установлено, что болевые реакции на сегментарном уровне контролируются адренергической системой через?
2-адренорецепторы.
Оценивая действие адренопозитивных соединений (прежде всего "эталонного" препарата - клофелина) на сегментарные нейроны и ноцицептивные рефлексы установлено, что болеутоляющий эффект клофелина не блокируется налоксо-ном и устраняется адреноблокаторами?
2-рецепторов. Клофелин не вызывал существенных изменений моторных функций и неноцицептивных рефлексов. Всё это позволило опробировать введение клофелина в онкологической клинике, где был получен хороший обезболивающий эффект, причём на фоне толерантности к морфину (D. Coombs et al.,1986).
Выявление аналгетического эффекта адренопозитивных соединений ознаменовало собой новый этап в развитии неопиатной лекарственной анестезии. В настоящий момент имеются все основания полагать, что адренергическая система является самостоятельной системой регуляции боли, независимой от опиоидергической и других нейромедиаторных механизмов (Ю.Д. Игнатов и др., 1994).
Изучение эффектов совместного применения адренопозитивных соединений с наркотическими аналгетиками свидетельствует о достаточно выраженном синергизме агонистов адрено- и опиатных рецепторов. Взаимодействие адренергического и опиоидергического болеутоляющего механизмов имеет не метаболическую основу, а осуществляется либо на общем рецепторном субстрате, либо через разные рецепторы, но с последующим запуском общего аналгетического механизма. (А.А.Зайцев, Ю.Д.Игнатов, 1990, Ю.Д. Игнатов и др., 1994).
Следует отметить, что в ЦНС не существует специализированных путей проведения болевой чувствительности. Интеграция боли осуществляется на различных уровнях ЦНС на основе сложных взаимодействий лемнисковых и экстралемнисковых проекций.
Путь проведения так называемой первичной боли (быстрой, хорошо локализуемой) представляется следующим образом. Боль активирует быстро проводящие миелинизированные волокна. Ноцицептивная информация передаётся по неоспиноталамическому тракту и, частично, по системе дорсолатеральных и дорсальных лемнисковых проекций, через вентролатеральный отдел таламуса достигает соматосепсорной коры. Быстрая передача информации через эту систему обеспечивает точную локализацию боли, оценку ее длительности и интенсивности.
Вторичная боль обусловлена проведением ноцицептивной информации по медленным немиелинизированным С-волокнам, которая затем передаётся по спиноретикулоталамическому, спиномезенцефалоталамическому тракту, по проприоцептивной системе. По мере прохождения ноцицептивных сигналов происходит активация ретикулярной формации, гипоталамуса, лимбической и стриопалидарной систем. Через медиальные, интраламинарные и задние ядра таламуса ноцицептивный поток достигает различных областей коры головного мозга. Вся эта система восходящих проекций и структур головного мозга обусловливает труднодифференциированную по качеству и локализации боль и её висцеромоторные и эмоционально-аффектные проявления.
Глава II. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ СРЕДСТВ, ИСПОЛЬЗУЕМЫХ ДЛЯ РЕГИОНАЛЬНОЙ АНЕСТЕЗИИ И АНАЛГЕЗИИ
Краткая характеристика местных анестетиков
Большинство местных анестетиков состоит из ароматического кольца, соединённого при помощи углеродного мостика с аминогруппой. В зависимости от вида углеродной группы различают местные анестетики эфирного (новокаин, хлорпрокаин и др.) и амидного (лидокаин, мепивакаин, маркаин и др.) типов. Эфирные анестетики относительно нестабильны в растворе, быстро гидролизируются в организме псевдохолинэстеразой крови. Одним из продуктов их распада является парааминобензоат, с которым связывают аллергические реакции. Амидные анестетики относительно стабильны в растворе, их биотрансформация происходит в печени путём диэтилирования с последующим расщеплением амидной группы. При повторном введении амидов следует строго соблюдать максимально допустимую дозу.
В тканях организма местные анестетики приобретают либо ионизированную, либо неионизированную форму, причём соотношение форм будет зависеть от рН раствора и рК конкретного препарата. Неионизированное основание затем диффундирует через периневральные ткани, оболочку нерва и ней-рональную мембрану, достигая аксоплазмы, где частично ионизируется вновь. В ионизированной форме местные анестетики проходят (изнутри нервного волокна) через натриевые каналы, образованные макромолекулами белка, встроенными в жидкую фазу мембраны, и либо блокируют их, либо соединяются с рецепторами, расположенными во внутреннем устье натриевого канала.
Учитывая, что для соединения с рецептором местному анестетику необходимо проникнуть в липидную фазу мембраны, то наиболее эффективным будет тот анестетик, который лучше растворим в липидах мембраны. При одинаковой растворимости в липидах сила и продолжительность действия анестетика будет зависеть от сродства анестетика к рецептору (Б.И.Ходоров, 1976). Анестетики уменьшают скорость и степень деполяризации синаптической мембраны до такого уровня, что не достигается пороговый потенциал нервной передачи и возбуждение не распространяется по нервному волокну.
Местные анестетики представляют собой основания почти не растворимые в воде. Их растворимость увеличивается путём соединения с соляной кислотой и образованием гидрохлоридов. Растворы местных анестетиков имеют кислую реакцию (рН 4,0-5,5) и содержат стабилизаторы (метабисульфит натрия, пиросульфит натрия и др.) и фунгицид.
В связи с тем, что анестетики вызывают вазодилятацию и быстро абсорбируются, для увеличения силы и продолжительности действия к ним часто добавляют вазоконстрикторы. Последние уменьшают системную токсичности, увеличивают безопасность, снижая скорость абсорбции, которая зависит от местного кровотока в тканях.
Одним из наиболее часто используемых вазоконстрикторов является адреналин, применяемый в концентрации 1:200000 (5 мкг/мл). Для достижения необходимой концентрации 0,1 мл (0,1 мг) адреналина добавляют к 20 мл раствора местного анестетика или одна капля из иглы для подкожного введения на 5 мл раствора местного анестетика.
Точность соблюдения дозировки адреналина должна быть обязательной, так как при увеличении его концентрации возможны гипертензивные реакции (вплоть до гипертонических кризов), нарушения сердечного ритма, а также неврологические последствия, связанные с локальной ишемизацией нервных тканей (А.Ю. Пащук, 1987, М.И.Кузин, С.Ш.Харнас, 1993).
Адреналин увеличивает продолжительность действия эпи-дуральной анестезии при добавлении его к мепивакаину, лидокаину, тримекаину, но практически не изменяет продолжительность действия прилокаина, бупивакаина и этидокаина.
Удлинение аналитического эффекта местных анестетиков при эпидуральной анестезии симпатомиметиком адреналином происходит не только за счёт уменьшения резорбции из эпидурального пространства путём локального спазма сосудов, но реализуется через активацию?
2-адренорецепторов спинного мозга.
Применение в качестве вазоконстриктора мезатона или эфедрина значительно менее эффективно, а норадреналин вызывает слишком интенсивное и генерализованное сужение сосудов (Ж.Адриани, 1978).
Другой вазоконстриктор - фелипрессин (октапрессин) добавляется к местным анестетикам (в частности, к прилокаину) в концентрации 0,003 ЕД\мл. Он химически сходен с гормоном задней доли гипофиза, но не является катехоламином. Растворы местных анестетиков с фелипрессином выпускаются официнально.
Увеличить продолжительность обезболивающего эффекта тримекаина при эпидуральной анестезии можно за счёт использования тримекаин-альбуминового комплекса, который состоит из равного количества 5% раствора тримекаина и 10% раствора донорского альбумина. Длительность действия 8-10мл указанной смеси составляет от 4 до 13,5 часов (В.А.Корячкин, 1994).
Применение пломбированных аутокровыо растворов местных анестетиков, ранее широко используемых в практике, в настоящее время признано нецелесообразным ввиду возможности развития спаечных процессов в эпидуральном пространстве (P.G.Tarkkila et al., 1988).
Современное состояние фармакологии местных анестетиков открывает широкие возможности для дифференцированного подхода к достижению анестезии и аналгезии. При минимальных концентрациях местных анестетиков развивается блокада симпатических волокон, увеличение концентрации препарата приводит к развитию сенсорного блока, а затем к блокаде моторной и проприоцептивной иннервации (табл. 3).
Таблица 3 Фармакологические основы и препараты выбора для дифференцированною проводникового блока (В. А. Светлов, С. П. Козлов, 1996)
Лидокаин
симпатическая +++
сенсорная +++
моторная +++
Тримекаин
симпатическая +++
сенсорная +++
моторная +
Бупивакаин
симпатическая +++
сенсорная +++
моторная +
Этидокаин
симпатическая ++
сенсорная ++
моторная +++
Ультракаин
симпатическая +++
сенсорная +++
моторная +++
Для получения симпатической блокады с лечебно-диагностической целью используется раствор лидокаина в концентрации менее 0,75%, для достижения аналгезии при острой и хронической боли применяют 1,0-0,75% раствора лидокаина, для анестезии во время оперативного вмешательства используются растворы лидокаина в концентрации 2-4%.
Местные анестетики эфирного типа.
Незакаин (хлорпрокаин).
а. Очень быстрое начало действия, короткий обезболивающий эффект, низкая токсичность.
б. Быстрая гидролизация холинстеразой обусловливает непродолжительность действия препарата и его низкую токсичность.
в. Применяется для инфильтрационной анестезии, блокады нервных стволов и для эпидуральной анестезии.
г. Субарахноидальное введение препарата не показано, т.к. незакаин имеет низкий рН раствора, а в качестве стабилизатора используется метабисульфит натрия.
д. Незакаин является препаратом выбора, когда региональная анестезия показана больному со склонностью к злокачественной гипертермии.
Тетракаин (дикаин, понтокаин).
а. Длительный эффект, высокие силы действия и токсичность.
б. Используется в основном для спинномозговой анестезии.
в. По длительности и глубине моторный блок превышает сенсорный.
Местные анестетики амидного типа.
Лидокаин (лигнокаин, ксилокаин).
а. Быстрое начало и относительно непродолжительный обезболивающий эффект, средние сила действия и токсичность.
б. Используется для всех видов местной анестезии.
Мепивакаин (карбокаин, скандикаин).
а. Средние сила действия и токсичность, обезболивающий эффект более длительный, чем у лидокаина.
б. Применяется для инфильтрационной анестезии, блокады нервных стволов, для эпидуральной анестезии.
Бупивакаин (маркаин, карбостезин, анекаин).
а. Медленное начало и длительное обезболивающее действие, высокие силы действия и токсичность.
б. Используется для всех видов местной и региональной анестезии.
в. Сенсорная блокада более интенсивная и длительная, чем моторная.
г. Случайное внутривенное введение препарата может вызвать резистентную к терапии остановку сердечной деятельности. Особенно чувствительны к препарату беременные.
Этидокаин (дуранест).
а. Быстрое начало и длительный обезболивающий эффект, высокие сила действия и токсичность.
б. Применяется доя блокады нервных стволов и ятя эпидуральной анестезии.
в. Моторная блокада более интенсивна, чем сенсорная.
В связи со слишком быстрым метаболизмом хлорпрокапна определить степень его связывания с белками не представляется возможным.
Ропивакаин (наропин).
а. Медленное начало и длительное обезболивающее действие. Сила действия высокая. Кардиотоксичность менее выражена, чем у бупивакаина.
б. Используется для эпидуральной, спинномозговой анестезии, для проводниковых блокад.
в. Сенсорная блокада менее интенсивна и длительна, чем моторная.
Наркотические аналгетики
Первое сообщение об эпидуральном введении морфина с целью обезболивания принадлежит M.Behar и соавт. (1979).
Наркотические аналгетики, введённые эпидурально, быстро абсорбируются венозными сплетениями, оставшаяся часть (2,0-3,6% введённой дозы) через твёрдую мозговую оболочку достаточно медленно проникает в спинномозговую жидкость. Пик концентрации морфина в ликворе достигается через 20-120 минут, причём его концентрация в спинномозговой жидкости в 25 раз превышает концентрацию в плазме. Через 4 часа после введения в ликворе присутствует 80% введённой дозы, через 12 часов - около 50%.
Наркотические аналгетики путём диффузии проникают в желатинозную субстанцию задних рогов спинного мозга, где связываются с опиатными рецепторами и вызывают блокаду болевой чувствительности. Время наступления и продолжительность аналгезии зависят от сродства наркотического аналгетика к опиатным рецепторам спинного мозга и дозы используемого препарата.
Для эпидурального обезболивания могут применяться любые наркотические аналгетики кроме пиритрамида (дипидоло-ра), при случайном попадании которого в ликвор вследствие низкого рН препарата (рН пиритрамида равен 3,96) происходит выпадение белков. У других опиатов рН более 4-6.
Важное значение для достижения эффективной послеоперационной аналгезии имеет подведение наркотического анал-етика к заинтересованному сегменту спинного мозга. Эффективность такого вида обезболивания составляет 85-97%. Однако, у больных, оперированных па органах грудной клетки и верхнего этажа брюшной полости, возможно введение аналгетика на поясничном уровне без учёта сегментарности. В этом случае доза аналгетика должна быть увеличенной (максимальная доза морфина 8 - 10 мг).
Фармакологической основой данного метода является возможность продолжительной циркуляции опиатов (в виде морфинглюкоронида) в субарахноидальном пространстве и связывание их с опиатными рецепторами на уровне грудного отдела спинного мозга. Основным преимуществом этого метода является то, что пункция и катетеризация эпидурального пространства на поясничном уровне технически проще, чем на грудном.
Первое сообщение о спинальном введении наркотических аналгетиков сделано J.Wang в 1977 году.*
Интратекальное применение опиатов имеет ряд преимуществ: простота, надёжность, низкие дозы, возможность введения через катетер. Дозозависимые побочные эффекты наркотических аналгетиков при интратекальном введении снижены до минимума, т.к. аналгезия достигается использованием доз в 10-16 раз меньших, чем при эпидуральной анестезии (при эпиду-ральном введении на количество препарата, достигающего рецепторов спинного мозга через твёрдую мозговую оболочку, влияют системная абсорбция и секвестрация опиатов в жировой ткани эпидурального пространства).
Следует отметить, что комбинация местных анестетиков и наркотических аналгетиков (лидокаин + морфин, лидокаин + фентанил) при эпидуральной и спинномозговой анестезии значительно повышают качество анестезии во время операции и эффективность аналгезии в послеоперационном периоде.
Адренергические средства
Работами Ю.Д. Игнатова и А.А.Зайцева (1984-1996) убедительно показано, что адренергическая система является самостоятельной системой регуляции боли. Аналгетический эффект центральных адренопозитивных средств получил полное подтверждение в клинике при лечении болевого синдрома различной этиологии (В.И.Страшное с сотрудниками, 1987-1999, В.А.Михайлович с сотрудниками, 1991-1996).
Среди различных химических соединений, обладающих центральным адренопозитивным эффектом, наибольшее применение получил клофелин (клонидин, катапрессан, гемитон). Эпидуральное введение клофелина вызывает достаточно качественную и длительную аналгезию, нормализует показатели кровообращения и дыхания при боли. Достоинства и преимущества клофелиновой анестезии наглядно подчёркивает её сопоставление с болеутоляющим эффектом эпидурально введённого морфина (табл.5).
Таблица 5 Сравнительная характеристика эпидуральной аналгезии морфином и клофелином
Морфин
Оптимальная аналгетическая доза 5мг
Латентный период аналгезии 30 - 60 минут
Максимальная выраженность 60 - 90 минут
Максимум аналгезии снижение проявлений боли на 70%
Продолжительность аналгезии 13,5 часов
Изменения гемодинамики отсутствуют
Брадипноэ без нарушения газообмена
Изменение гормонов «стресса» в крови отсутствуют
Побочные эффекты задержка, мочеотделения, тошнота, рвота, кожный зуд
Толерантность быстро развивается
Клофелин
Оптимальная аналгетическая доза 100мг
Латентный период аналгезии 15 минут
Максимальная выраженность 30 минут
Максимум аналгезии снижение проявлений боли на 90%
Продолжительность аналгезии 5 часов
Выражена индивидуальная вариабельность
Нормализация гипердинамических сдвигов
Изменения дыхания отсутствуют
Снижение гормонов «стресса» в крови отсутствуют
Побочные эффекты сухость во рту
Толерантность отсутствует или медленно развивается
Следует подчеркнуть два важных обстоятельства. Первое, опасения развития гипотонии при клофелиновой аналгезии необоснованны, т.к. клофелину присуще не столько гипотензивное, сколько антигипертензивное действие. Опасения снижения артериального давления могут возникнуть при использовании клофелиновой аналгезии только у больных с предрасположенностью к этому (гиповолемия, кахексия). И второе, у клофелина отсутствует наркогенный потенциал.
Использование клофелина для спинномозговой анестезии позволяет значительно улучшить качество обезболивания. Так, спинномозговая анестезия с применением комбинации 75 мкг клофелина, 100 мг лидокаина и 50 мкг фентанила позволяет проводить оперативные вмешательства длительностью до 2,5-3,0 часов с сохранением послеоперационного обезболивания в течение 5,0-6,5 часов.
Глава III. СПИННОМОЗГОВАЯ АНЕСТЕЗИЯ
Показаниями к проведению спинномозговой анестезии являются оперативные вмешательства на органах, расположенных ниже диафрагмы, особенно в ситуациях, когда по тем или иным причинам нежелательно проведение других методов анестезии.
Относительными противопоказаниями могут быть сердечная недостаточность, гиповолсмия, септические состояния, кахексия, повышенная возбудимость нервной системы, частые головные боли в анамнезе, ишемическая болезнь сердца.
Абсолютными противопоказаниями к спинномозговой анестезии являются воспалительные процессы в поясничной области, гнойничковые заболевания кожи спины, некоррегированная гиповолемия, тяжёлая анемия, психические заболевания, искривления позвоночника (выраженные сколиоз, кифоз и др.), аллергия к местным анестетикам, увеличенное внутричерепное давление, нежелание пациента подвергаться этому методу обезболивания.
Больные, которым предлагается проведение спинномозговой анестезии, должны иметь достаточные компенсаторные возможности сердечно-сосудистой системы, т.к. гемодинами-ческие эффекты являются неотъемлемыми компонентами течения данного вида обезболивания и глубина их проявлений находится в прямой зависимости от адаптационных возможностей организма. Выраженный атеросклероз, сахарный диабет, гипертоническая болезнь, хроническая ишемическая болезнь сердца, сердечная недостаточность,пожилой возраст считаются неблагоприятными факторами при выполнении спинномозговой анестезии.
Премедикация перед спинномозговой анестезией должна обеспечивать оптимальный эмоциональный фон без грубого влияния на адаптационные возможности организма. Обязательным являются психогенная подготовка больных, назначение наркотических и седативных средств накануне операции и внутримышечное введение за 30-40 минут до операции стандартных доз наркотических и антигистаминных препаратов. Вопрос о включении в состав премедикации атропина решается индивидуально.
За 30 минут до спинномозговой пункции подкожно вводят 2 мл 20% раствора кофеина. Достаточно эффективно превентивное назначение дигидроэрготамина в два приёма по 0,25 мг (0,5 мл 0,05% раствора), который повышает тонус венозных сосудов и увеличивает венозный возврат.
Обычной мерой профилактики артериальной гипотензии является инфузия 800-1200 мл коллоидных и кристаллоидных растворов в соотношении 1:1, проводимая непосредственно перед спинномозговой анестезией.
Техника спинномозговой анестезии
Пункцию спинномозгового пространства производят в положении больного сидя или лёжа на боку с хорошо согнутым позвоночником, прижатыми к животу бёдрами и пригнутой к груди головой. Помощнику необходимо удерживать больного в этом положении. Кожу спины обрабатывают антисептиком или спиртом дважды. Растворы йода не рекомендуется использовать, поскольку даже его следы, занесённые в подпаутинное пространство, могут вызвать асептический арахноидит (спинальная и эпидуральная анестезия требуют тщательной ассептики и антисептики. Непременным условием является работа в перчатках, а при длительной (с катетером) анестезии - использование бактериальных фильтров).
Анестезию области пункции осуществляют либо с использованием за два часа до манипуляции крема ЭМЛА, либо, непосредственно перед манипуляцией, местного обезболивания.
Толстой иглой (15G) прокалывают кожу. Игла для спинномозговой анестезии (рис.1) проводится строго по средней линии между остистыми отростками под небольшим углом (не более 15-20 градусов) в соответствии с наклоном остистых отростков. Глубина, на которую необходимо вкалывать иглу, колеблется от 4,5 до 6,0 см, в среднем 5,5 см, размеры игл для спинномозговой анестезии представлены в таблице 6.
Таблица 6 Наружный диаметры и цветовой код игл для эпидуральной и спинномозговой анестезии
Оливково-коричневый 10G; 3,4мм.
Желто-зеленый 11G;3,0 мм.
Бледно-голубой 12G;2,7 мм.
Фиолетовый 13G;2,4 мм.
Светло-зеленый 14G;2,1 мм.
Серо- голубой 15G; 1,8 мм.
Белый 16G; 1,6 мм.
Красно-фиолетовый 17G; 1,4 мм.
Розовый 18G; 1,2 мм.
Кремовый 19G; 1,1 мм.
Желтый 20G;0,9 мм.
Темно-зеленый 21G; 0,8 мм.
Черный 22G; 0,7 мм.
Темно-синий 23G; 0,6 мм.
Сиреневый 24G; 0,55 мм.
Оранжевый 25G; 0,5 мм.
Коричневый 26G; 0,45 мм.
Серый 27G; 0,4 мм.
Бирюзовый 28G; 0,36 мм.
Красный 29G; 0,33 мм.
Желтый 30G; 0,3 мм.
При медленном проведении иглы через связочный аппарат ощущается сопротивление плотных тканей, которое внезапно исчезает после прокола жёлтой связки. После этого извлекают мандрен и продвигают иглу на 2-3 мм, прокалывая твёрдую мозговую оболочку.
К моменту прокола твёрдой мозговой оболочки плоскость среза иглы должна быть направлена продольно волокнам оболочки. Игла должна раздвигать волокна, а не перерезать их. Истечение ликвора из павильона иглы - абсолютный признак её точной локализации в субарахноидальном пространстве.
Пункция субарахноидального пространства тонкими (25-26G) иглами представляет определенные технические трудности, связанные с высокой вероятностью изгибания иглы, вплоть до ее перелома, при прохождении через плотные оссифицированные связки или при попадании в костные образования позвоночника.
Для облегчения субарахноидальной пункции были предложены интродьюсеры (проводники), представляющие собой коротки толстые иглы размером 18-20G) с заточкой Crawford, впервые описанные J.L.Corning (1894). Позднее свои варианты интродьюсеров предложили L.S.Sise (1928), J.S.Lundy (1942). В настоящее время интродьюсеры входят в наборы для спинальной, спинально-эпидуральной, длительной спинальной анестезии, выпускаемые фирмами "Sims Portex", "Braun". При отсутствии штатного интродьюсера допускается использование игл для вливаний размером 18 - 20G и длиной 40 мм.
Интродьюсер вводится строго по средней линии в межостистом промежутке на глубину 3 - 4 см проходя кожу, подкожную клетчатку, надостистую связку и останавливается в толще межостистой связки. Затем через просвет интродьюсера иглой для спинномозговой анестезии пунктируется субарахноидальное пространство. В случае, если игла упирается в костное образование, необходимо ее удалить, изменить направление интродьюсера и повторить пункцию.
В другом варианте с использованием более длинного интродьюсера к последнему присоединяется шприц с изотоническим раствором хлорида натрия и пузырьком воздуха и пунктируется эпидуральное пространство, попадание в которое определяется методами "утраты сопротивления" и "воздушного пузырька". После этого шприц отсоединяют и через просвет интродьюсера выполняют пункцию субарахноидального пространства.
Для спинномозговой анестезии можно использовать парамедианный доступ. На уровне межостистого промежутка, отступая на 1,5-2,0 см от линии остистых отростков, вводят иглу под углом 25 градусов к сагитальной плоскости. При необходимости движение конца иглы может меняться как в краниальном, так и каудальном направлениях. Вариантом парамедианного доступа является люмбосакральный, описанный T.A.Taylor в 1940 году. Пункцию выполняют на уровне L5 -S1. Вкол иглы осуществляется на 1 см медиальнее и 1 см каудальнее точки проекции на кожу задневерхней ости гребня подвздошной кости (рис.3).
Рис. 3. Люмбосакральный доступ по Т.А. Taylor
Достоинствами парамедианного доступа является отсутствие на пути плотных связок, более чёткое ощущение прокола твёрдой мозговой оболочки и снижение риска ранения венозного plexus spinalis posterioris, наиболее крупная ветвь которого заложена в клетчатке между костной стенкой позвоночника и твёрдой мозговой оболочкой, как раз по средней линии. Главный недостаток - возможность попадания иглы в брюшную полость при отклонении от необходимой траектории движения.
Недостаточное поступление ликвора из иглы может быть обусловлено следующими причинами. Во-первых, возможно не весь срез иглы прошёл через твёрдую мозговую оболочку спинного мозга. В этом случае иглу следует продвинуть на 1-2 мм вперёд. Во-вторых, возможно, что острие иглы насквозь прошло подпаутинное пространство и, проколов твёрдую мозговую оболочку, прошло до тела позвонка. При этом обычно ранится венозная сеть, и ликвор окрашивается кровью. В этом случае иглу оттягивают на 1-2 мм назад и выпускают 1-2 мл спинномозговой жидкости до очищения её от примесей крови. Возможно, срез иглы, находящейся в подпаутинном пространстве, прикрывается нервным корешком. В этих случаях иглу необходимо повернуть вокруг собственной оси.
При отсутствии ликвора рекомендуется прочистить иглу мандреном, попросить больного покашлять или попробовать аспирировать ликвор шприцем.
Если, несмотря на принятые меры, ликвор из павильона иглы не появился, следует либо изменить доступ и направление, либо произвести пункцию спинномозгового пространства в соседнем межпозвонковом промежутке.
Пункцию спинномозгового пространства необходимо проводить анатомично ввиду опасности травматических повреждений спинного мозга и его корешков, проявляющихся парестезиями, острой болью, мышечными подёргиваниями или резкими движениями нижних конечностей. Правильно проведённая спинальная пункция не должна сопровождаться какими-либо неприятными ощущениями для больного.
Перед удалением спинномозговой иглы в ее просвет необходимо ввести мандрен. Выполнение этого простого приема способствует уменьшению частоты возникновения постпункционного синдрома (Vilming, 1988).
Следует отметить, что в последнее время высокая и средняя спинномозговая анестезия (в смысле пункции) практически не используются из-за опасности травмы спинного мозга. Для блокады сегментов спинного мозга выше уровня Тh12 пункцию субарахноидального пространства производят на уровне ниже L1, вводят гипербарический раствор местного анестетика (Баричность - соотношение массы 1 мл раствора местного анестетика к массе 1 мл ликвора при температуре 4° С.), больного укладывают на спину и головной конец операционного стола опускают на 10 градусов. После достижения желаемого уровня анестезии больного возвращают в горизонтальное положение.
Традиционно растворы местных анестетиков для спинномозговой анестезии в зависимости от удельного веса подразделяются на гипербарические, изобарические и гипобарические (табл.6).
Таблица 6 Характеристика местных анестетиков, используемых для спинномозговой анестезии
Гипербарические растворы
Лидокаин
Концентрация 5% на 7,5% растворе глюкозы
Дозировка 60 мг (1,2 мл)
Длительность действия (ч) 0,75 - 1,5
Бупивакаин
Концентрация 0,75% на 8,25% растворе глюкозы
Дозировка 9 мг (1,2 мл)
Тетракаин
Концентрация 0,5% на 5% растворе глюкозы
Дозировка 12 мг (2,4 мл)
Длительность действия (ч) 2,0 - 3,0
Изобарические растворы
Лидокаин
Концентрация 2% водный раствор
Дозировка 60 мг (3,0 мл)
Длительность действия (ч) 1,0 - 2,0
Бупивакаин
Дозировка 15 мг (3,0 мл)
Длительность действия (ч) 2,0 - 4,0
Тетракаин
Концентрация 0,5% водный раствор
Дозировка 15 мг (3,0 мл)
Гипобарические растворы
Тетракаин
Концентрация 0,1% водный раствор
Дозировка 10 мг (10 мл)
Длительность действия (ч) 3,0 - 5,0
При введении растворов с различным удельным весом обязательно следует учитывать их гидродинамические свойства
в субарахноидальном пространстве. Так, в положении Трен-деленбурга гипобарический раствор будет распространяться каудально, а гипербарический раствор - краниально, при поднятом головном конце операционного стола гипобарический раствор будет распространяться краниально, гипербарический раствор - каудально (рис.4)

В последние годы всё шире применяется комбинированная спинномозговая анестезия, включающая введение наряду с местными анестетиками наркотических аналгетиков и центральных адреномиметиков. (табл.7).
Таблица 7 Дозировки наркотических аналгетиков и клофелина для спинномозговой анестезии
Морфин 1 - 2мг
Фентанил 50 - 100 мкг
Петидин 1,0 мг/кг
Клофелин 50 - 100 мкг
Наиболее рациональные их сочетания представлены в таблице 8.
Таблица 8 рациональные комбинации препарапов для спинномозговой анестезии
2 мл 5% раствор лидокаина + 50 мкг фентанила
длительность операции до 90 мин
длительность послеоперационной аналгезии 60 - 70 мин
2 мл 5% раствор лидокаина + 75 мкг клофелина
длительность операции до 120 мин
длительность послеоперационной аналгезии 4 - 5 часов
2 мл 5% раствор лидокаина + 50 мкг фентанила + 75 мкг клофелина
длительность операции до 180 мин
длительность послеоперационной аналгезии 6,0 - 6,5 часов
Особенностью спинномозговой анестезии является блокада преганглионарных симпатических волокон, проходящих в составе передних корешков. При этом расширяются артериолы и венулы, снижается общее периферическое сопротивление (на 5-20%), венозный возврат и сердечный выброс (на 10-30%). Снижение сердечного выброса может быть обусловлено также снижением частоты сердечных сокращений и сократимости миокарда.
Обычно это имеет место при высоком уровне спинального блока (выше Th IV. Артериальное давление снижается на 15-30%. У больных с гипертонической болезнью или гиповолемией снижение артериального давления более выражено, чем у больных с нормальным артериальным давлением или нормоволемией.
Спинномозговая анестезия не оказывает клинически значимого влияния на дыхательный объём, частоту дыхания, минутную вентиляцию, парциальное давление СО
2в альвеолярном воздухе, РаСО
2и РаО
2Потребность в кислороде сокращается на 10%, продукция СО
2также уменьшается за счёт снижения активности метаболических процессов в мышцах.
В качестве анестетика целесообразно использовать бупивакаин (маркаин, анекаин) в виде 0,5% раствора. Начальная доза составляет 15-20 мг. Сенсорный блок развивается через 7-8 минут, моторный - несколько позже. Повторную дозу препарата приходится вводить, как правило, через 3-3,5 часа, она составляет 0,5-0,75 от первоначальной. За время операции, продолжающейся 7-8 часов, расходуется не более 40 мг бупивакаина.
Стабилизация гемодинамики осуществляется по общим дія спинальной анестезии правилам: инфузионная поддержка в сочетании с клиническим титрованием эфедрина.
Эмоциональный комфорт, весьма необходимый при длительных и травматичных вмешательствах, следует обеспечить мидазоламом (дормикумом) - водорастворимым бензодиазепином с коротким периодом полувыведения, обладающим прекрасным седативным, анксиолитическим, амнестическим эффектами.
Обезболивание в послеоперационном периоде.
Пациенты с катетером в субарахноидальном пространстве должны находиться только в отделении интенсивной терапии под наблюдением анестезиолога.
С целью аналгезии применяются три типа препаратов: местные анестетики, наркотические аналгетики и клофелин.
Местные анестетики применяются в концентрации вдвое меньшей, нежели для операционного обезболивания. Маркаин в виде 0,25% или даже 0,125% раствора, лидокаин в виде 1% раствора. Более целесообразно применение бупивакаина, как длительно действующего и обладающего менее выраженным, чем у лидокаина, свойством создавать моторный блок, необходимость в котором в послеоперационном периоде отсутствует. Начальная доза бупивакаина - 3,0 - 4,0 мл, повторные дозы аналогичного объёма вводятся через 3,5 - 4 часа. В течение суток расходуется 50 - 60 мг анестетика, в течение двух суток - не более 110 мг. Подобные дозы практически исключают возможность развития интоксикации. При использовании 0,25% бупивакаина аналгезия полная, но возможно некоторое ограничение движений в ногах, при работе с 0,125% раствором двигательных нарушений нет. Применение растворов местных анестетиков с пониженной концентрацией в послеоперационном периоде не вызывает заметных сдвигов гемодинамики, однако доступ в вену должен быть постоянным ввиду возможности усиления симпатического блока и развития гипотензии.
Из опиоидов предпочтительно использование фентанила в дозе 50 мкг, создающего адекватную аналгезию в течение 3-5 часов. Аналгезия не сопровождается дыхательными и двигательными расстройствами. Не характерно развитие задержки мочеиспускания, тошноты и рвоты, кожного зуда, свойственных применению морфина.
Клофелин в дозе 50-75 мкг создаёт достаточную аналгезию, продолжающуюся 5-6 часов, которая не сопровождается расстройствами гемодинамики и дыхания.
На фоне продлённой спинальной аналгезии рано восстанавливается перистальтика кишечника, начинают отходить газы. Кашель и эвакуация мокроты эффективны, что является профилактикой осложнений в бронхо-лёгочной системе. Этот вариант послеоперационного обезболивания позволяет избежать применения больших доз опиатов, обладающих известными негативными эффектами.
Представляется, что продлённая спинальная анестезия имеет некоторые преимущества перед широко распространённой продлённой эпидуральной анестезией ввиду:
– использования тонкого и мало травматичного инструмента,
– значительно меньших доз препаратов, следовательно, более низкой токсичности и стоимости,
– высокой интенсивности анестезии и аналгезии,
– редко встречающейся "мозаичности" анестезии.
Глава IV. ДЛИТЕЛЬНАЯ СПИННОМОЗГОВАЯ АНЕСТЕЗИЯ
Впервые длительную спинномозговую анестезию описал лондонский хирург Н.P.Dean (1907), затем ее применяли Aburel Е. (1931), Lemman W.T. (11940), Tuochy Е. (1944), Мо-стовый М.И.(1949).
Техника анестезии заключалась во введении иглы в субарахноидальное пространство и присоединении к ней гибкой трубки для инъекции местного анестетика. Больного укладывали на операционный стол, имеющий специальную вырезку для спинномозговой иглы.
Использование такого метода анестезии ограничивали не только технические сложности (специальный операционный стол), но и высокая, до 20%, частота развития постпункционных головных болей.
В 1944 году Е.Tuochy описал технику катетеризации субарахноидального пространства с использованием мочеточникового катетера. С появлением катетеров из пластмасс интерес к длительной спинномозговой анестезии возродился. Через иглы размером 22-23G в субарахноидальное пространство вводили катетер размером 28G (Harley R.J., Lambert D.H., 1990). Однако в связи с развитием тяжелых осложнений в виде синдрома "конского хвоста" (Rigler et al., 1991) в США комитетом по контролю за качеством продуктов питания и лекарственных средств с 1992 года использование микрокатетеров для длительной спинномозговой анестезии было запрещено. Примеру США последовали и другие страны, что привело к значительному уменьшению числа исследований по длительной спинномозговой анестезии. В дальнейшем было установлено, что не микрокатетер был причиной данного осложнения, а использовавшийся 5% гипербарический раствор лидокаина.
В настоящее время длительную спинномозговую анестезию в клинике вытесняет метод спинально-эпидуральной анестезии.
Показаниями к проведению продлённых спинальных анестезий являются оперативные вмешательства любой продолжительности и травматичности, выполняемые в зоне иннервации Th
10- S
5: на толстой кишке, мочевом пузыре, женских половых органах, промежности, аорте и подвздошных сосудах, нижних конечностях, при трансплантации почек. Необходимость качественного послеоперационного обезболивания также является показанием к этой методике региональной анестезии.
Противопоказания не отличаются от таковых при рутинной спинальной анестезии.
Техника катетеризации субарахноидального пространства
В положении сидя или на боку на уровне ниже L, в межостистую связку вводится интродьюсер. Через интродьюсер иглой Крауфорда пунктируется субарахноидальное пространство, которое верифицируется по появлению ликвора в павильоне иглы. Учитывая малый её диаметр, следует проявить некоторое терпение. Микрокатетер вводится на 3 см дистальнеє конца иглы, после чего удаляется игла и мандрен из катетера. Проксимальный конец катетера соединяется с адаптером и фильтром. Следует иметь в виду, что для свободного введения микрокатетера необходимо расположить конец иглы Крауфорда как можно ближе к дорсальной стенке дурального мешка, ибо в противном случае катетер будет упираться в вентральную стенку. Категорически запрещено извлекать уже введённый катетер через иглу ввиду опасности его срезания.
Анестезию начинают при наличии доступа в венозное русло и создании объёмной нагрузки в размере 1000,0-1500,0 мл кристаллоидов. Исключение составляет контингент пациентов с ХПН при трансплантации почек, находящихся в состоянии гипергидратации.

Двухсегментный метод
Спинальная и эпидуральная анестезия осуществляются в разных межостистых промежутках. Сначала выполняется пункция и катетеризация эпидурального пространства, оценивается эффект тест-дозы, затем ниже на соответствующем уровне выполняется спинномозговая анестезия.
Для обеспечения спинального компонента спинально-эпидуральной анестезии используются 2% водные растворы лидокаина, 1% гипербарические растворы лидокаина, 0,5% растворы бупивакаина, сочетание растворов лидокаина с фентанилом (100мкг) и/или клофелином (100мкг).
В случае необходимости расширения зоны анестезии эпидурально дробными дозами вводят растворы местного анестетика (5-8мл 2% раствора лидокаина). Характерно, что расширение зоны анестезии на один сегмент требует меньшей
дозы анестетика, чем при обычной эпидуральной анестезии (Э. Ю. Галлингер, 1995).
Существенной особенностью спинально-эпидуральной анестезии является уменьшение частоты развития постпункционных головных болей до 1,3% (L.E.S.Carrie, 1990). Связано это, с одной стороны, с тем, что эпидуральный катетер "шинирует" твёрдую мозговую оболочку к паутинной, с другой - введение раствора местного анестетика в эпидуральное пространство препятствует истечению ликвора из субарахноидального пространства.
Таким образом, спинально-эпидуральная анестезия позволяет получить надёжный спинальный блок, быстро начать оперативное вмешательство, продлить при необходимости анестезию, как во время операции, так и в послеоперационном периоде.
Клиническое применение спинально-эпидуральной анестезии. Сочетанная комбинированная спинально-эпидуральная анестезия при абдоминальных операциях
Показаниями для спинально-эпидуральной анестезии в абдоминальной хирургии являются оперативные вмешательства на желудке, поджелудочной железе, желчевыводящих путях, кишечнике, при больших вентральных грыжах.
Вначале катетеризируется эпидуральное пространство на уровне Тh
7-8и катетер фиксируется лейкопластырем, затем однократно интратекально на уровне L
2-3вводится 8-12 мл 2% раствора лидокаина в сочетании со 100 мкг фентанила и 100 мкг клофелина. Через 5-7 минут развивается сенсорная блокада, достигающая уровня Тh
2-4. Операция выполняется на фоне 70-100 мг/кг ГОМКа в условиях ИВЛ (МОД-70-75 мл/ кг, FiO,»0,3). Поддержание показателей центральной гемодинамики на адекватном, стабильном уровне осуществляется инфузионно-трансфузионной терапией, приданием больному положения Тренделенбурга (10-15°), введением холинолитиков и по показаниям (брадикардия, снижение артериального давления) - адреноми.метиков (В. И. Страшнов и др., 1997).
Длительность комбинированной спинномозговой анестезии составляет 3,5-4,5 часа. В качестве препаратов для эпидуральной анестезии используют l - 2% растворы лидокаина или его сочетание с 50 мкг клофелина и 50 мкг фентанила. Возможно использование комбинации 0,25% - 0,125% раствора бупивакаина с фентанилом (50 мкг фентанила на 50мл раствора местного анестетика), вводимая постоянно шприцом-дозатором со скоростью 6-8мл/час.
Глава V. ЭПИДУРАЛЬНАЯ АНЕСТЕЗИЯ И АНАЛГЕЗИЯ
Показания к эпидуральной анестезии и аналгезии
1. Оперативные вмешательства на органах грудной клетки, брюшной полости, урологические, проктологические, акушерско-гинекологические, операции на нижних конечностях.
2. Оперативные вмешательства у больных с тяжёлой сопутствующей патологией (ожирение, сердечно-сосудистые и лёгочные заболевания, нарушение функций печени и почек, деформация верхних дыхательных путей), у лиц пожилого и старческого возраста, у больных с "полным" желудком.
3. Компонент сочетанного обезболивания.
4. Тяжёлые комбинированные скелетные травмы (множественные переломы рёбер, костей таза, нижних конечностей).
5. Послеоперационное обезболивание.
6. Компонент терапии панкреатита, перитонита, кишечной непроходимости, астматического статуса.
7. Борьба с хроническим болевым синдромом.
Относительные противопоказания к эпидуральной анестезии и аналгезии
1. Деформация позвоночника (кифоз, сколиоз и др.), затрудняющая пункцию эпидурального пространства.
2. Заболевания нервной системы.
3. Гиповолемия.
4. Артериальная гипотензия.
5. Не показано эпидуральное введение наркотических аналгетиков у больных в послеоперационном периоде с высоким риском развития несостоятельности анастомозов (резекция желудка по поводу рака).
Абсолютные противопоказания к эпидуральной анестезии и аналгезии
1. Воспалительные поражения кожи в области предполагаемой эпидуральной пункции.
2. Тяжёлый шок.
3. Нежелание больного подвергаться эпидуральной анестезии.
4. Сепсис и септические состояния.
5. Нарушение свёртывающей системы крови (опасность эпидуральной гематомы).
6. Повышенное внутричерепное давление.
7. Повышенная чувствительность к местным анестетикам или наркотическим аналгетикам.
Психологическая подготовка больного к эпидуральной анестезии включает обязательную доверительную беседу с пациентом перед операцией, в которой анестезиолог должен в простой и тактичной форме объяснить ему, почему именно этот метод выбран для обезболивания, как анестезия будет выполняться, какие могут возникнуть ощущения и как больной должен будет себя вести. Недостаточная информированность больного о возможностях и преимуществах эпидуральной анестезии, личный негативный опыт, отрицательное отношение людей, окружающих больного, часто приводят к настороженному отношению пациента к этому виду обезболивания. Однако, опыт показывает, что, как правило, негативное отношение к эпидуральной анестезии после доверительной беседы удаётся преодолеть, особенно у пожилых, уравновешенных больных, у лиц с высоким интеллектом, у длительно болеющих. В целом, установление доверительного контакта между анестезиологом и больным представляется крайне важным.
Медикаментозная подготовка включает назначение на ночь снотворных, антигистаминных препаратов и малых транквилизаторов. За 30 минут до транспортировки больного в операционную внутримышечно вводится дормикум в дозах 0.1 мг/кг, что создаёт хороший фон для выполнения анестезии, так как препарат обладает прекрасным анксиолитическим, амнестическим и седативным эффектами. Наркотические аналгетики (промедол) использовать не рекомендуется из-за выраженного седативного действия. Атропин, при возникновении соответствующих показаний, лучше использовать на операционном столе.
Наиболее целесообразным мы считаем выполнение пункции и катетеризации эпидурального пространства не в день операции, а накануне. В этом случае создаётся спокойная обстановка, анестезиолог не лимитирован во времени, что позволяет тщательно, без спешки выполнить все необходимые манипуляции. Дефицит времени в день операции, торопливость, ожидающие начала оперативного вмешательства хирурги и риск снижения личного "рейтинга" в глазах операционного персонала при неэффективной эпидуральной анестезии не способствуют выполнению качественного анестезиологического пособия.
Техника эпидуральной анестезии
Пункция эпидурального пространства выполняется в положении больного сидя или лёжа на боку.
Положение сидя: больной сидит на операционном столе, нижние конечности согнуты под прямым углом в тазобедренном и коленном суставах, туловище максимально согнуто кпереди, голова опущена вниз, подбородок касается груди, кисти рук лежат на коленях.
Положение лёжа на боку: нижние конечности максимально согнуты в тазобедренных суставах, колени приведены к животу, голова согнута, подбородок прижат к груди, нижние углы лопаток располагаются на одной вертикальной оси. Помощник должен удерживать больного в таком положении и одновременно наблюдать за его состоянием.
Кожа в области предполагаемой пункции и руки анестезиолога должны быть обработаны более тщательно, чем это делают хирурги (для хирурга важно избежать инфицирования раны, для анестезиолога - эпидурита или менингита!).
Уровень эпидуральной пункции избирает в зависимости от области оперативного вмешательства (табл.9) и соотвествующей сегментарной иннервации органов (рис.8).
Таблица 9 Уровень эпидуральной анестезии в зависимости от области оперативного вмешательства
Th
2- Th
4Грудная клетка (сердце, легкие)
Th
5- Th
7Желудок, двенадцатиперстная кишка, желчный пузырь, поджелудочная железа
Th
7- Th
9Тощая и подвздошная кишка
Th
8- Th
10Слепая и восходящий отдел толстой кишки
Th
10- Th
12Нисходящий отдел толстой кишки, сигмовидная кишка
L
2- L
5Прямая кишка, промежность
Th
10- L
1Матка, почки, мочеточники
L
2- L
4Предстательная железа, мочевой пузырь
L
2- L
5Нижние конечности

Рис. 8. Схема сегментарной иннервации кожи.
Анатомо-топографические ориентиры при выборе уровня пункции представлены в таблице 10.
Таблица 10. Анатомические ориентиры при пункции
С
7остистый отросток VII шейного позвонка
Th
2соединение тела и рукоятки грудины
Th
4сосок молочной железы
Th
7 - 8линия, соединяющая нижние углы лопаток, мечевидный отросток
Th
10пупок
Тh
12XII пара ребер
L
1лонное сочленение
L
4 - 5линия, соединяющая гребни крыльев подвздошной кости
После обработки места пункции раствором антисептика производится анестезия кожи и подлежащих тканей 0,5% о раствором новокаина. Анестезируется только кожа, подкожная клетчатка и надостистая связка. Далее по ходу почти нет болевых рецепторов, а введение новокаина в межостистую связку может создать видимость потери сопротивления при выполнении теста Dogliotti по мере продвижения иглы Туохи к эпидуральному пространству. Толстой иглой пунктируется кожа. Иглу для эпидуральной анестезии вводят строго по средней линии, придерживаясь сагитальной плоскости. В зависимости от уровня пункции направление иглы должно соответствовать направлению остистых отростков. Если в поясничном отделе угол, образуемый иглой и поверхностью кожи, составляет около 90°, то в нижнегрудном - до 50°, а в верхнегрудном достигает 30°-40°. Для достижения эпидурального пространства игла проходит кожу, подкожную клетчатку, надо-стистую, межостистую и жёлтую связки.
Расстояние между поверхностью кожи и эпидуральным пространством в среднем 5см. У тучных больных оно увеличивается, иногда, до 7-8см.
Размеры эпидурального пространства в разных отделах позвоночника различны (табл. 11).
Таблица 11 Размеры эпидуралыюго пространства в различных отделах позвоночника, мм
Шейный 1,0 - 1,5
Верхнегрудной 2,5 - 3,0
Нижнегрудной 4,0 - 5,0
Поясничный 5,0 - 6,0
Идентификация эпидурального пространства
1.Признак потери сопротивления. При осторожном продвижении иглы с присоединённым наполненным физиологическим раствором или воздухом шприцем через жёлтую связку ощущается лёгкий щелчок или провал. Свободное движение поршня шприца вперёд свидетельствует о попадании иглы в эпидуральное пространство.
2. Воздушный пузырёк. В шприце с физиологическим раствором, присоединённом к пункционной игле, находится небольшой пузырёк воздуха. Во время пункции при периодическом надавливании на поршень пузырёк сжимается. При попадании в эпидуральное пространство пружинящий эффект пузырька исчезает, т.к. раствор без сопротивления проходит через иглу.
3. Индикатор эпидурального пространства. Индикатор представляет собой отрезок стандартного внутривенного катетера длиной около 15 см. Индикатор заполняют 1 мл анестетика или изотонического раствора хлорида натрия, затем осторожно встряживают с тем, чтобы столбик жидкости превратился в капли, смешанные с пузырьками воздуха. После этого индикатор соединяется с пункционной иглой, введенной в межостистую связку, и игла проводится дальше через желтую связку в эпидуральное пространство. Попадание кончика иглы в эпидуральное пространство сопровождается резким движением пузырьков воздуха в сторону иглы. Столбик жидкости и воздуха в индикаторе начинает колебаться синхронно с сердечными сокращениями. Иногда наблюдаются колебания большей амплитуды в такт дыханию больного.
4. Признак подвешенной капли. При прохождении иглы в толще жёлтой связки на павильон иглы навешивается капля раствора местного анестетика. При попадании в эпидуральное пространство, благодаря отрицательному давлению в нём, капля втягивается в просвет иглы, особенно на вдохе.
5. Если во время пункции эпидурального пространства из иглы начинает выделяться ликвор, иглу следует оттянуть на 2-3 мм назад до прекращения выделения ликвора, что указывает на нахождение кончика иглы в эпидуральном пространстве. При катетеризации вероятность того, что катетер попадает в субарахноидальное пространство, невелика, т.к. направление движения катетера определяется скосом иглы.
У больных пожилого и старческого возраста в связи с дегенеративными изменениями в межостистых связках, образуются полости, попадание в которые иглой ощущается как потеря сопротивления, симулирующее пункцию эпидуралыюго пространства. В этом случае полезна проба с "обратным заполнением шприца": 1мл физиологического раствора и 1,0 -1,5мл воздуха быстро вводят через пункционную иглу, сразу после этого снимая палец с поршня. При правильном расположении иглы обратного поступления жидкости не будет или её количество не превышает 0,2мл. Возможно также выполнение пробной катетеризации, т.к. прохождение катетера в эпидуральное пространство характеризуется специфическими тактильными ощущениями в виде лёгкого упругого сопротивления.
Использование для идентификации эпидурального пространства различных приспособлений (индикаторы, капиллярные трубки и т.п.) широкого применения в практике не получили.
Убедившись в правильном расположении пункционной иглы, через её просвет вводят катетер. При выходе кончика катетера в эпидуральное пространство ощущается лёгкое сопротивление. Катетер продвигают на глубину 3-5 см (рис.9), после чего пункционную иглу осторожно удаляют, а катетер располагают вдоль позвоночника и выводят в подключичную область, фиксируя лейкопластырем на всём протяжении.
К концу катетера присоединяется специальный адаптер, или в его просвет вводится тонкая игла для соединения со шприцем. Введение растворов местных анестетиков должно осуществляться через бактериальный микрофильтр.
Для уточнения характера расположения катетера в эпидуральном пространстве используют рентгенографию, вводя в катетер водорастворимые рентгеноконтрастные препараты (урографин) в объёме 0,6-0,9мл. Рентгенограмма позволяет отчётливо проследить наружную часть катетера, место прохождения катетера через ткани, внутреннюю часть, располагающуюся в эпидуральном пространстве. В некоторых наборах для эпидуральной анестезии имеются рентгеноконтрастные катетеры, что значительно облегчает определение места нахождения катетера. При сомнении в том, что катетер расположен в эпидуральном пространстве, извлекать его следует обратно только вместе с иглой. В противном случае кончик катетера может срезаться и остаться в тканях, в том числе и в эпидуральном пространстве, что потребует оперативного его извлечения.

Рис.9. Определение длины катетера в эпидуральном пространстве.
Пример №1. Полная длина эпидуральной иглы - 11,5см. Катетер проведён через просвет иглы до тронной метки (на 15см). Длина катетера в эпидуральном пространстве: 15-11,5 = 3,5см.
1 - эппдуральный катетер. 2- пункционная игла. 3- кожа. 4- подкожная клетчатка. 5- надостистая связка, 6- остистый отросток, 7- жёлтая связка. 8 -эпндуральное пространство, 9 - наружный листок твёрдой мозговой оболочки. 10 - субарахноидальное пространство.
После катетеризации эпидурального пространства вводят "тест-дозу" местного анестетика в объёме 2,0-3,0 мл. Тщательное наблюдение за больным в течение 5 минут позволяет выявить признаки развивающегося спинального блока (см. гл. IV). При отсутствии данных за развитие спинномозговой анестезии вводят основную дозу местного анестетика.
Дозировка местных анестетиков для эпидуральной анестезии
I. Расчёт по номограмме Доза /мл/сегм./

Пример расчёта: Больной 55 лет, рост 180см.
Операция - устранение паховой грыжи. Иннервация: Th
8
-
122 - 5 дерматомов
L
I
- 5- 5 дерматомов
S
I
- 5- 5 дерматомов
Всего: 15 дерматомов
Объём анестетика (мл) = 15 х 1,1 = 16,5
II Расчёт по формуле
V на 1 сегмент = 3,113 - 0,0252 х возраст (лет)
III Расчётна массу тела
V= 15 - 17 мг/кг/час
Таблица 11 Сегментарная дозировка 2% раствора лидокаина
V= мл/сегмент х число сегментов
20 - 30 лет 1,75 - 1,6 мл/сегм
40 - 50 лет 1,50 - 1,4 мл/сегм
60 - 70 лет 1,25 - 1, 1мл/сегм
80 лет 1,0 мл/сегм
IV. Дозировка местных анестетиков у детей
Таблица 13 Дозировка тримекаина для эпидуральной анестезии у детей
Новорожденные
0,5 %; 5 - 7 мл; 10 - 15 мг/кг
Менее
1
года
1,0 %; 4 - 9 мл; 8 - 15 мг/кг
1
- 4
года
2,0%; возраст + 2 мл; 4 - 6 мг/кг
5 - 9
лет
2,0%; возраст + 1 мл; 4 - 6 мг/кг
9 - 13
лет
2,0%; до 10 мл; 4 - 6 мг/кг
Особенности применения некоторых местных анестетиков для эпидуральной анестезии
Максимальная разовая доза лидокаина без адреналина для эпидуральной анестезии составляет 400мг (4,5 мг/кг), с адреналином - 500мг (7мг/кг). Для анестезии в грудном отделе позвоночника используют 10-15мл 2% раствора лидокаина (200-300 мг). В поясничном отделе 2% раствор лидокаина используется в объёме 15-20мл (300-400мг), 1,5° о раствор лидокаина - 20-25мл (300-375мг).
Максимальная разовая доза бупивакаина составляет 150мг, а в сочетании с адреналином - 200мг. Максимальная суточная доза - 400мг. При использовании 0,75% раствора бупивакаина первое введение препарата осуществляется в объёме 10-20мл (75-150мг), повторные введения - по 3-5мл. Длительность анестезии достигает 6-9 часов. При использовании 0,25-0,5% раствора бупивакаина начало действия отмечается на 10-12 минуте, длительность анестезии достигает 4-6 часов. В послеоперационном периоде интервал между введениями должен быть не менее 3 часов.
Мепивакаин для эпидуральной анестезии используется в 1%, 1,5% и 2% растворах. Максимальная разовая доза препарата 400мг, суточная - 1000мг. Начало действия 2% раствора мепивакаина отмечается на 7-15 минуте, длительность анестезии составляет до 3-5 часов. Интервал между введениями не должен быть менее 1,5 часов.
Однократная доза незакаина - 800мг, а в сочетании с адреналином - 1000мг. Для эпидуральной анестезии в грудном отделе применяют 1,5-2,0 мл/сегм. (30-60мг), в поясничном отделе - 2,0-2,5 мл/сегм. (40-75мг) 2-3% раствора незакаина. Повторное введение препарата в дозе на 3-6мл меньшей, чем первоначальная, выполняется через 40-50 минут после первой инъекции. Общий объём раствора составляет 15-25мл (300-750мг). Длительность действия анестезии незакаином составляет 30-60 минут, а при сочетании с адреналином 60-90 минут.
Разовая доза 1% раствора этидокаина составляет 300мг (4,0мг/кг), при использовании адреналина - 450мг (5,5 мг/кг).
Обычно используемая дозировка - 0,7-1,7 мл/сегм. Повторное введение препарата выполняется через 2-3 часа после первой инъекции.
Общая характеристика местных анестетиков представлены в таблице 14.
Таблица 14 Характеристика местных анестетиков, используемых для эпидуральной анестезии
Лидокаин 2%
Макс. разовая доза (мг) 400
Сила 1,0
Токсичность 1,0
Начало (мин) 8 - 12
Длительность (часы) до 1,3
Тримекаин 2,5%
Макс. разовая доза (мг) 400
Сила 0,45
Токсичность 1,0
Начало (мин) 7 - 10
Длительность (часы) 1,0 - 1,5
Бупивакаин 0,5%
Макс. разовая доза (мг) 150
Сила 4,0
Токсичность 2,0
Начало (мин) 10 - 12
Прилокаин 2%
Макс. разовая доза (мг) 900
Сила 0,65
Токсичность 0,77
Начало (мин) 10 - 13
Длительность (часы) 2,0 - 3,0
Мепивакаин 2%
Макс. разовая доза (мг) 400
Сила 1,0
Токсичность 1,8
Начало (мин) 7 - 15
Длительность (часы) 3,0 - 5,0
Этидокаин 1%
Макс. разовая доза (мг) 300
Сила 4,0
Токсичность 5,5
Начало (мин) 10 - 12
Длительность (часы) 4,0 - 6,0
Азакаин 0,75%
Макс. разовая доза (мг) 420
Сила 3,5
Токсичность 3,6
Начало (мин) 25 - 30
Длительность (часы) 5,0 - 10,0
Незакаин 2%
Макс. разовая доза (мг) 800
Сила 0,5
Токсичность 0,3
Начало (мин) 1 - 2
Длительность (часы) 0,5 - 1,0
Ропивакаин
Макс. разовая доза (мг) 150
Сила 4,0
Токсичность 2,0
Начало (мин) 10 - 12
Длительность (часы) 3,0 - 3,5
Однако, местные анестетики не лишены недостатков. Длительность действия наиболее распространённых из них (тримекаин, лидокаин) достаточно невелика, что увеличивает нагрузку на медперсонал, а также вероятность инфицирования эпидурального пространства при частых введениях в послеоперационном периоде. Первоначальное введение больших доз препаратов, увеличение количества больных с множественными сопутствующими заболеваниями приводит к тому, что развиваются тяжёлые осложнения, преимущественно глубокая артериальная гипотензия.
Клинический опыт последних лет показал, что применение для эпидуральной аналгезии наркотических аналгетиков даёт мощный и продолжительный болеутоляющий эффект. Максимальную длительность аналгезии обеспечивает морфин (до 24 и более часов), минимальную - фентанил (до 4 часов). Эффективность послеоперационной эпидуральной аналгезии зависит от точной идентификации эпидурального пространства и подведения аналгетика к заинтересованным сегментам спинного мозга. Большое значение имеет и выбор дозы препарата (табл.15).
Таблица 15 Дозировка наркотических аналгетиков, используемых для эпидуральной аналгезии
Морфин 2мг - 0,1 мг/кг
Фентанил 100 - 200мкг
Петидин 25 - 100мг
Альфентанил 15 - 30мкг
Лофентанил 5 мкг
Метадон 4 - 6 мг
Бупренорфин 60 - 300 мкг
Буторфанол 1 - 4мг
Фенопиридин 2 мг
Налбуфин 5 мг
Омнопон 10мг
Пентазоцин 0,2 - 0,4 мг/кг
Просидел 5 - 10 мг
Промедол 20мг
У больных с хроническим болевым синдромом достаточно введения 2-Змг морфина, у больных с острой болью в послеоперационном периоде 4-5мг.
Примечательно, что осложнения, возникающие в период проведения эпидуральной аналгезии наркотическими аналгетиками, носят дозозависимый характер. При использовании морфина в дозе 5 мг у 60% больных отмечается задержка мочеиспускания, а при использовании 7мг - у 100%.
Следует отметить, что разрешёнными фармакопеей России к эпидуральному применению являются морфин и фентанил.
Было отмечено и снижение болеутоляющей активности эпидурально введённого морфина, который на 6-7 сутки был практически не эффективен.
Подобного рода недостатков лишена эпидуральная аналгезия клофелином, который используется в дозе 100-200 мкг.
Начало действия клофелина отмечается на 5-6 минуте, достаточная аналгезия развивается через 15-30 минут. Болеутоляющий эффект клофелина длится от 3,5 до 24 часов, в среднем - 8,5 часов. Причём, длительность аналгезии и её качество оставались такими же и на 5-6 сутки введения. Хорошие результаты эпидуральной аналгезии клофелином достигнуты в 83-90% случаев.
Эпидурально введённый клофелин через 15 минут снижал систолическое артериальное давление на 10-15%, максимум снижения приходится на 60 минуту - на 15-18%. Снижаются на 6,1% среднединамическое давление, на 8,6% частота сердечных сокращений, на 8,9% общее периферическое сопротивление. Минутный объём сердца, ударный объём и сердечный индекс не меняются. Частота дыханий уменьшается на 19%,возрастают дыхательный объём на 31% и жизненная ёмкость лёгких на 50%. РаО
2возрастает на 8%, РаСО2 уменьшается на 9,5%.
Таким образом, изменения показателей гемодинамики и дыхания при эпидуральной аналгезии клофелином носят нормализующий характер и способствуют гладкому течению послеоперационного периода.
Глава VI. ЛЕЧЕБНОЕ ПРИМЕНЕНИЕ ЭПИДУРАЛЬНОЙ АНАЛГЕЗИИ
Эффекты эпидуральной аналгезии не ограничиваются только выключением проводимости в спинальных корешках в результате введения местноанестезирующего препарата или наркотика. Под влиянием эпидуральной блокады в организме происходят разнообразные и сложные физиологические реакции многих органов и систем, лечебные эффекты которых значительно шире и глубже, чем обезболивающие свойства.
Использование эпидуральной аналгезии в терапии - это относительно новый подход к лечению тяжёлых заболеваний и состояний, в основе которых лежит спазм гладкой мускулатуры (бронхиолоспазм, спазм сфинктеров, артериоспазм и др.), основанный на сегментарной десимпагизации органов и систем в комплексе с другими специфическими методами воздействия на основные звенья патогенеза страдания. Блокада ноцицептивной афферентации оказывает как общее воздействие, нормализующее соотношение адренергических и холинергических систем организма, так и местное влияние в виде вазодилятации и увеличения кровотока, релаксации гладкой мускулатуры и бронходилятации, расслаблении сфинктеров и протоков желёз.
Эпидуральная аналгезия при астматическом статусе
Симпатическая блокада, вызываемая эпидуральной аналгезией у больных, находящихся в астматическом статусе, увеличивает внутрилёгочный кровоток, улучшает газообмен в лёгких, уменьшает артериальную гипоксемию. Бронходилятирующий эффект аналгезии основан на законе Кеннона-Розенблютта: "в результате денервации органа его чувствительные структуры делаются во много раз чувствительнее к своему медиатору" (Кеннон У., Розенблют А., 1951).
Пункция и катетеризация эпидурального пространства производится на уровне Тh
З
-
4. Объём вводимого местного анестетика (2% раствор лидокаина) определяется необходимостью блокады 7-8 верхнегрудных сегментов (от С
7до Тh
6
-8) из расчёта 1мл/сегм., т.е. 6-8мл. Через 30-40 минут после введения местного анестетика дыхание больных становится свободнее, уменьшается одышка, выдох делается более полным, облегчается отхождение мокроты, уменьшается сопротивление дыхательных путей, уменьшаются явления гипоксии, работа дыхание резко снижается. На фоне эпидуральной аналгезии у больных увеличиваются дыхательный объём на 50%, минутный объём дыхания на 45%, жизненная ёмкость лёгких на 126%. Увеличиваются рН и РаО
2, снижается РаСО
2. Происходит нормализация показателей гемодинамики: артериальное давление снижается на 22,5%, частота сердечных сокращений урежается на 25%, ударный объём, минутный объём сердца и сердечный индекс увеличиваются соответственно на 22,3%, 13% и 37%. Общее периферическое сопротивление снижается на 13,7%.
Эпидуральная аналгезия у больных с острым инфарктом миокарда
Выполнять катетеризацию эпидурального пространства у больных с острым инфарктом миокарда следует до начала терапии антикоагулянтами и фибринолитиками. В противном случае - абсолютно противопоказано. Эпидуральная аналгезия у больных с острым инфарктом миокарда вызывает прерывание афферентной патологической импульсации, сопровождается дилятацией артерий и артериол, уменьшением общего периферического сопротивления, давления в правом предсердии и крупных венах, работы миокарда, частоты аритмий и фибрилляций.
Показанием для применения эпидуральной аналгезии у больных с острым инфарктом миокарда является стойкий, некупирующийся наркотическими аналгетиками, болевой синдром.
Пункцию и катетеризацию эпидурального пространства производят на уровне Th
З
-
4. В качестве препарата для аналгезии применяют 2% раствор лидокаина в дозе 0,5-1,0 мл/ сегм. Для блокады 8 сегментов (С
5-Th
5) обычно используют 5-8мл раствора местного анестетика. Длительность болеутоляющего эффекта составляет 4 - 5 часов. При сочетанном применении раствора местного анестетика с 3 - 4мг морфина длительность аналгезии возрастает до 8-12 часов.
Эпидуральная аналгезия у больных с панкреатитом
У больных с панкреатитом эпидуральная аналгезия полностью купирует болевой синдром, снимает висцеральный вазоспазм, спазм сфинктера Одди, панкреатических и желчных протоков, за счёт чего увеличивается отток панкреатического секрета и желчи, увеличивается перфузия поджелудочной железы, ускоряется нормализация амилазы крови и мочи.
Больным с панкреатитом, которым предполагается выполнение эпидуральной аналгезии, в первую очередь необходимо возместить дефицит ОЦК инфузией коллоидных и кристаллоидных растворов до нормализации ЦВД и гематокрита.
Пункция и катетеризация эпидурального пространства производится на уровне Th
7-8. Доза вводимого анестетика определяется необходимостью блокады 7-8 сегментов спинного мозга (Th
5
- 12) из расчёта 1,2-2,0 мл/сегм. Обычно используют 6-10мл 2% раствора лидокаина. Для увеличения длительности эффекта в раствор местного анестетика добавляют 50-100 мг фентанила.
Эпидуральная аналгезия корешкового болевого синдрома
Показанием для применения эпидуральной аналгезии является упорный, жестокий корешковый болевой синдром, не поддающийся обычным методам консервативного лечения.
Под местной анестезией на уровне L
1
-2пунктируется эпидуральное пространство и вводится сначала смесь, состоящая из 5-6 мл 2% раствора лидокаина или 0,5% раствора маркаина, 50-100 мкг фентанила и 100-200 мкг клофелина, а затем глюкокорортикоид. В качестве последнего используются метилпреднизолон (60-120 мг), гидрокортизон (100-150 мг)
или триамцинолон (75-50 мг). Кортикостероид перед введением разводится в 5-10 мл изотонического раствора хлорида натрия.
Перед извлечением из эпидурального пространства иглу необходимо промыть во избежание образования свищей, т.к. даже следовые концентрации кортикостероидов способствуют их образованию.
Болевой синдром купируется через 15-20 минут после эпидуральной инъекции. При необходимости повторное введение вышеуказанной смеси препаратов выполняют через 24-48 часов. Обычно достаточно 1-2 инъекций.
Эпидуральная анестезия и аналгезия у больных с облитерирующим эндартериитом и ишемическими нарушениями в нижних конечностях
Эпидуральная блокада у больных с облитерирующим эндартериитом выключает патологическую импульсацию из области поражения, улучшает местный кровоток, снимает спазм артериол и гладкой мускулатуры, что приводит к разрыву порочного круга: спазм - ишемия -боль - спазм.
Показания к проведению эпидуральной анестезии и аналгезии у больных с облитерирующим эндартериитом:
1. С лечебной целью - в спастической стадии заболевания.
2. С прогностической целью - при определении показаний к выполнению симпатэктомии. В случае, если имеется положительный эффект (потепление конечности, исчезновение болей, улучшение цвета кожных покровов и др.) симпатэктомия показана, если же эпидуральная анестезия не эффективна -симпатэктомия не показана.
3. Подготовка больных к операции на сосудах нижних конечностей (эпидуральная блокада эффективно купирует тяжёлый болевой синдром, улучшает кровоток в нижних конечностях, трофические процессы, снимает психоэмоциональное напряжение, нормализует сон).
4. Анестезия во время оперативного вмешательства.
5. Послеоперационная аналгезия.
Пункция и катетеризация эпидурального пространства производится на уровне L1-2. В спастической стадии заболевания эпидурально вводят по 15мл 2% раствора лидокаина, причём, в первые 2-3 суток интервал введения составляет 4 часа, затем Р течение 7-10 дней через 6 часов. Для предоперационной подготовки используют эпидурально 3-7 мг морфина в суточной дозе не менее 10мг, клофелина 100-200 мкг в суточной дозе не менее 400 мкг или сочетание 4мг морфина с 50-100 мкг клофелина. Во время операции используются растворы местных анестетиков совместно с клофелином.
В послеоперационном периоде хороший обезболивающий эффект получен после введения 5-7мг морфина, 100-200 мкг клофелина или комбинации 4мг морфина и 50-100 мкг клофелина. Примечательно, что клофелин как после первого эпидурального введения, так и на 5-6 сутки непрерывного применения не изменял выраженности и длительности аналгетического эффекта. В среднем болеутоляющий эффект клофелина продолжается 5 часов.
Эпидуральная анестезия у больных сахарным диабетом
Эпидуральная анестезия, не вызывая стрессорной продукции контринсулярных гормонов, выраженного гликогенолиза и угнетения инсулинопродуцирующей функции поджелудочной железы, предупреждает избыточную катаболическую реакцию в ответ на хирургическую агрессию и сохраняет рациональные адаптационные механизмы углеводного обмена. Все выше указанное является основанием для применения эпидуральной анестезии при хирургических вмешательствах у больных сахарным диабетом.
Показанием для использования эпидуральной анестезии у этой категории больных являются длительные травматические операции на нижнем этаже брюшной полости и нижних конечностях.
После установки на соответствующем уровне в эпидуральном пространстве катетера и проведения тест-дозы, основная доза местного анестетика вводится дробно в два этапа. На первом этапе объем 2% раствора лидокаина составляет 7-10 мл, на втором, через 10-15 минут - 5-7 мл.
Двухэтапность введения основной дозы местного анестетика позволяет своевременно восполнить ОЦК, подобрать оптимальную дозу местного анестетика и избежать артериальной гипотензии.
Поддержание анестезии в интраоперационном периоде осуществляется введением 5-7 мл 2° о раствора лидокаина с интервалом 1,0-1,5 часа. Для аналгезии в послеоперационном периоде целесообразно использовать комбинацию наркотических аналгетиков с центральными адреномиметиками.
Эпидуральная аналгезия в послеоперационном периоде
Болевой синдром поддерживается четырьмя источниками болевой импульсации - кожным, глубоким соматическим, висцеральным и гуморальным, а они, в свою очередь, вызывают рефлекторный сосудистый спазм, образуя порочный круг, ведущий в конечном итоге к общей и органной гиподинамии и развитию разного рода осложнений.
По своему механизму действия Эпидуральная аналгезия способна полностью предотвратить влияние первых Ірех компонентов, что существенно сказывается на течении послеоперационного периода. В условиях эффективной эпидуральной аналгезии полностью купируется болевой синдром, увеличивается двигательная активность больных, они могут свободно дышать и откашливать мокроту, самостоятельно себя обслуживать. Облегчается проведение дыхательной гимнастики.
Симпатолитические эффекты эпидуральной аналгезии способствуют снятию рефлекторного вазоспазма, усилению кишечной перистальтики, увеличению перфузии органов и тканей.
Уровень пункции и катетеризации эпидурального пространства производится в зависимости от области оперативного вмешательства. В качестве препаратов для аналгезии используют растворы местных анестетиков, наркотические аналгетики, центральные адренопозитивные препараты.
Примечательно, что предоперационное эпидуральное введение наркотических аналгетиков, вызывающих блокаду модуляции ноцицептивных импульсов в нейронах задних рогов спинного мозга, сопровождается более длительной послеоперационной аналгезией, чем при введении опиатов после операции. Так, при эпидуральном введении 4 мг морфина за 45-60 мин. до операции длительность послеоперационной анальгезии составляет 15-20 и более часов, тогда как та же доза морфина введенная непосредственно по окончанию операции вызывает обезболивание около 10-12 часов.
Эпидуральная анальгезия является наиболее физиологическим методом п/о обезболиванияпо своей эффективности значительно превосходящим рутинное введение парентеральное введение наркотических анальгетиков и обладающее нормализующим влиянием на показатели дыхания и кровообращения, уменьшающим количество послеоперационных осложнений облегчающим проведение послеоперационною периода.
Эпидуральная аналгезия для обезболивания родов
Показаниями для применения эпидуральной аналгезии служат любые роды при отсутствии противопоказаний к этому виду обезболивания, особенно роды с дискоординированными сокращениями матки, роды двойней, родоразрешение при помощи наложения акушерских щипцов, при позднем токсикозе беременных, а также при наличии тяжёлой сопутствующей эк-страгенитальной патологии (сахарный диабет, болезни печени, почек, пороки сердца, гипертоническая болезнь). Используется эпидуральная анестезия и при операции кесарева сечения.
Трансплацентарная проницаемость местных анестетиков представлена в таблице 16.
Таблица 16 Трансплацентарная проницаемость местных анестетиков
Лидокаин 0,45 - 0,7
Тримекаин 0,46 - 0,67
Бупнвакаин 0,26 - 0,45
Мепивакаин 0,7
Прилокаин 1,0 - 1,2
Этидокаин 0,14 - 0,35
Для обезболивания родов пункция и катетеризация эпидурального пространства выполняется на уровне L
3-4. Аналгезию начинают при раскрытии маточного зева на 5-6 см. В первом периоде родов вводят 10-12 мл 1% раствора лидокаина. По окончании сгибания и внутреннего поворота головки плода дополнительно вводят 10-12 мл 2% раствора лидокаина.
При операции кесарева сечения объём вводимого местного анестетика должен быть достаточен для блокады сегментов с Th5 до L5.
Эпидуральная аналгезия при хроническом болевом синдроме у онкологических больных
Для борьбы с болевым синдромом при инкурабельных онкологических заболеваниях, помимо наркотических аналгетиков, используют эпидуральную химическую денервацию.
Методика эпидуральной химической денервации.
– Катетеризация эпидурального пространства
– После введения пробной дозы местного анестетика определяют границы кожной анестезии.
– Через 30 минут после введения обычной дозы местного анестетика эпидурально вводят (медленно!) 1-2 мл 96 спирта.
Исчезновение или значительное уменьшение болей происходит на 5-7 сутки. Если болевой синдром сохраняется, инъекцию спирта повторяют. Обычно достаточно 2-3 введений спирта.
Глава VII. ОСЛОЖНЕНИЯ ЭПИДУРАЛЬНОЙ И СПИННОМОЗГОВОЙ АНЕСТЕЗИИ И АНАЛГЕЗИИ
При грамотном выполнении эпидуральная и спинномозговая анестезия являются простыми и безопасными методами обезболивания. Основной причиной развития осложнений при их проведении является низкая квалификация врача-анестезиолога, который, помимо желания овладеть этими методами, должен иметь глубокие теоретические знания по вопросам эпидуральной и спинномозговой анестезии, а также в совершенстве владеть методикой проведения реанимационных мероприятий. Практика показывает, что с накоплением опыта частота неудач и осложнений при выполнении регионарной анестезии значительно снижается.
Осложнения эпидуральной анестезии
Перфорация твёрдой мозговой оболочки встречается в 0,4 - 0,8% случаев и диагностируется по вытеканию тёплой спинномозговой жидкости из павильона иглы. Опасность этого осложнения минимальная, если оно вовремя установлено. В этом случае возможен либо отказ от выполнения эпидуральной анестезии, либо проведение длительной спинномозговой анестезии, либо выполнение пункции эпидурального пространства на сегмент выше, либо, оттянув иглу на 2-Змм назад до прекращения истечения ликвора, катетеризируют эпидуральное пространство и относятся к анестезии как к спинномозговой (тест-доза вводится в объёме 2-Змл и, если в течение 10-15 минут спинномозговая анестезия не развивается, вводят основную расчётную дозу местного анестетика). Перфорация твёрдой мозговой оболочки в любом случае диктует необходимость отказа от эпидурального применения морфина. Допустимо использование фентанила в дозе не более 50 мкг.
Осложнения со стороны катетера. Оптимальная глубина проведения катетера при катетеризации эпидурального пространства составляет 3-5 см. При глубокой катетеризации возрастает вероятность смещения катетера в переднебоковые отделы эпидурального пространства, выход его через межпозвоночные отверстия за пределы эпидурального пространства, повреждение венозных сплетений. Во многих случаях это определяет развитие мозаичности, неадекватности анестезии, односторонность обезболивания. Глубокая катетеризация эпидурального пространства чревата опасностью перегиба и узлообразования катетера. При проведении катетера на расстояние менее 2 см возможен выход его из эпидурального пространства, особенно, при изменении положения тела больного.
Артериальная гипотензия. Снижение артериального давления более чем на 30% от исходного расценивается как осложнение, которое встречается у 9% больных, оперированных в условиях эпидуральной анестезии. Артериальная гипотензия чаще возникает у больных со сниженными компенсаторными возможностями сердечно-сосудистой системы (больные в преклонном возрасте, ослабленные, истощенные, с исходной гиповолемией).
Непосредственными причинами гипотонии являются:
– Введение относительно большой дозы местного анестетика, блокирующего более 10 сегментов спинного мозга.
– Введение раствора местного анестетика на фоне не замеченной перфорации твёрдой мозговой оболочки и проникновение анестетика в субарахноидальное пространство.
В результате широкой симпатической блокады снижается тонус сосудов и общее периферическое сопротивление, увеличивается ёмкость сосудистого русла, что ведёт к развитию тяжёлой гипотензии.
Субарахноидальное попадание местного анестетика в дозе значительно превышающей используемую для спинномозговой анестезии, приводит к развитию в течение 2-5 минут тяжёлой гипотензии, резко выраженному "ладьевидному животу", диафрагмальному дыханию с последующим апноэ, потерей сознания, параличу нижних конечностей. Такое состояние называется тотальный спинальный блок.
Сущность изменений, происходящих в организме больного при развитии тотального спинного блока, объясняется тем, что анестетик, распространяясь в краниальном направлении, последовательно блокирует корешки спинномозговых нервов, в составе которых проходят преганглионарные симпатические волокна и волокна, иннервирующие межрёберную дыхательную мускулатуру. В результате развивается гипогензия, выраженность которой зависит от степени вазодилятации. При достижении анестетиком уровня Тh
1выключается иннервация всех межрёберных мышщ и дыхание поддерживается одной диафрагмой. Выключается также симпатическая иннервация сердца, что приводит к брадикардии, снижению сократимости миокарда и сердечного выброса.
Профилактические мероприятия по борьбе с отрицательными проявлениями эпидуральной анестезии заключаются в тщательном отборе больных, точной дозировке местных анестетиков (блокада не более 10 сегментов), проведении инфузионной терапии в режиме гиперволемической гемодилюции в пред- и интраоперационном периодах. С позиций патогенеза гипотензии, являющейся следствием десимпатизации сердца и обширных сосудистых регионов брюшной полости и нижних конечностей, наиболее целесообразно использовать смешанный адреномиметик эфедрин, который ликвидирует дефицит венозного возврата, устраняет брадикардию и оказывает положительное инотропное влияние.
Значительно менее эффективен при развитии артериальной гипотензи "чистый" ?-адреномиметик мезатон, который не увеличивает ни венозного возврата, ни ударного объёма и, кроме того, способствует развитию брадикардии.
В критических ситуациях препаратом выбора является адреналин, который способен восстановить кровообращение даже при остановке сердечной деятельности.
Использование вазопрессоров обеспечивает анестезиологу время для первичного диагноза, позволяет начать массивную инфузионную терапию, а в случае развития тотального спинного блока - ИВЛ. Если лечебные мероприятия начаты своевременно, то прогноз, как правило, благоприятен.
Специфическим осложнением проведения эпидуральной анестезии в родах является развитие синдрома Бернара-Горнера, который проявляется миозом, сужением глазной щели, энофтальмом, а также нарушением слезоотделения, анизокорией, инъекцией сосудов склер, гиперемией кожи, потоотделением с одновременной анестезией отдельных участков кожи верхних конечностей и двигательными нарушениями в них на стороне блокады. Это осложнение связано с широким распространением анестетика по уменьшенному в объёме эпидуральному пространству и блокадой симпатической иннервации зоны шейных сегментов. Уменьшение объёма эпидурального пространства обусловлено сдавливанием маткой сосудов нижней полой вены, расширением венозных сплетений эпидурального пространства, препятствующих оттоку анестетика через межпозвоночные отверстия, использованием окситоцина для усиления схваток.
В положении на спине у беременных может развиться синдром аортокавальной компрессии, при котором нарушается венозный возврат к сердцу. Синергизм синдрома нижней полой вены и эпидуральной анестезии приводит к тяжёлым гемодинамическим нарушениям, в связи с чем, в период родоразрешения рекомендуется роженицу повернуть на левый бок или подложить под правую ягодицу валик.
Во время пункции возможно повреждение иглой вен эпидурального пространства, что может привести к кровоизлиянию и развитию гематомы. Хотя кровь, как правило, свободно покидает эпидуральное пространство через межпозвоночные отверстия, существует опасность сдавливания гематомой спинного мозга с тяжёлыми неврологическими последствиями в виде стойких параличей и парезов.
Аллергические реакции на местноанестезирующие средства встречаются относительно редко и в основном носят характер кожных высыпаний (крапивница, волдыри). Преимущественно эти реакции возникают после введения анестетиков эфирного типа. Редкие аллергические реакции, возникающие в ответ на введение амидных анестетиков, связаны чаще всего не с самим анестетиком, а со стабилизатором, находящимся в растворе (метабисульфит натрия), концентрация которого может достигать до 2 мг/мл (Дж. Леви, 1990).
Больным, имеющим в анамнезе аллергические реакции на местные анестетики или больным с полиаллергией, рекомендуется выполнение кожных тестов для определения лекарственных средств, которые являются для них безопасными.
Тест проводится по истечению месяца после аллергической реакции. Больной не должен принимать антигистаминные и симпатомиметические средства, метилксантины, средства от кашля и простуды. Местные анестетики разводят непосредственно перед использованием в изотоническом растворе хлористого натрия. Кожу предплечья обрабатывают спиртом и с помощью шариковой ручки или фломастера наносят клеточки размером 2,5x2,5см.
Лекарственные средства вводят внутрикожно в центр квадрата до появления волдыря размером 1-2мм (0,01-0,02мл раствора). При отрицательных результатах готовят и вводят растворы местных анестетиков, имеющих в 10 раз большую концентрацию (табл.17).
Таблица 17 Дозы местноанестезирующнх средств, вводимых при кожных тестах
Внутрикожный 0,02 мл 1:100
Подкожный 0,1 мл 1:100
Подкожный 0,1 мл 1:10
Подкожный 0,1 мл не разведенный
Подкожный 0,5 мл не разведенный
Подкожный 1,0 мл не разведенный
Реакция считается положительной при появлении в течение первых 10 минут инфильтрата диаметром не менее 7мм и существование его не менее 30 минут, при возникновении и сохранении в течение 30 минут очагов гиперемии кожи, при генерализованных кожных реакциях (кожный зуд).
Наиболее грозным осложнением эпидуральной аналгезии опиатами является депрессия дыхания (до 0,4% случаев). Она может развиться впервые 30-60 минут (ранняя депрессия) и спустя 6-48 часов (отсроченная депрессия). Большинство авторов отмечают, что самый опасный период это 6-12 часов после эпидуральной микроинъекции.
Причиной развития дыхательной депрессии является незамеченная перфорация твёрдой мозговой оболочки во время пункции эпидурального пространства, эпидуральное введение завышенных доз опиатов, применение опиатов на фоне эпидуральной аналгезии наркотическими аналгетиками.
Механизм развития дыхательной депрессии заключается в том, что эпидурально введенный наркотический аналгетик проникает в задние отделы субарахноидального пространства, с током ликвора поднимается в ростральном направлении и связывается с опиатными рецепторами в области дыхательного центра.
Клинически депрессия дыхания проявляется состоянием сомнолентности больного, наличием точечных "морфиновых" зрачков и постепенным урежением дыхания до 4-6 в минуту, вплоть до апноэ.
Угнетение дыхания, вызванное эпидурально введенным морфином, устраняется инфузией налоксона в дозе 5 мкг/кг.ч, причем ослабление аналгезии наступает только при увеличении дозы налоксона до 10 мкг/кг.ч. Примечательно, что на-локсон в дозе 5-10 мкг/кг.ч не только устраняет нарушения дыхания, но и значительно снижает глубину аналгезии при эпидуральном введенном фентаниле.
Острое нарушение дыхания купируется болюсным введением 0,4 мг налоксона. При необходимости 0,4 мг налоксона вводят повторно через 2-3 минуты. В крайнем случае после кратковременной масочной вентиляции больного интубируют и переводят на ИВЛ.
При проведении эпидуральной аналгезии опиатами целесообразно соблюдать следующие правила:
1. При подозрении на повреждение твёрдой мозговой оболочки от введения морфина следует отказаться. При необходимости можно использовать 25-50 мкг фентанила.
2. Не следует предпринимать попыток к усилению эпидуральной аналгезии опиатами путём парентерального введения наркотических аналгетиков.
3. Не превышать расчётные дозы эпидурально вводимых наркотических аналгетиков.
К числу "малых" осложнений эпидуральной аналгезии наркотическими аналгетиками относятся кожный зуд (до 8% случаев), тошнота и рвота (до 12% случаев).
Кожный зуд может ограничиваться зоной сегментарной аналгезии, однако, чаще он отмечается на лице, шее, туловище, иногда бывает генерализованным. Частота зуда резко возрастает при использовании морфина в дозе 5мг и более. Продолжительность и интенсивность кожного зуда варьируется от нескольких десятков минут до многих часов.
Тошнота и рвота, как правило, возникают после появления кожного зуда, причём тошнота отмечается через 4, а рвота - через 6 часов после эпидуральной микроинъекции.
Кожный зуд, тошнота и рвота специального лечения не требуют.
Транзиторное расстройство мочеиспускания при эпидуральной аналгезии морфином в дозе 5мг и более отмечаются у 60% больных, однако, это не является сложной проблемой, так как в отделениях реанимации и интенсивной терапии большинству больных с тяжёлой патологией для учёта диуреза выполняется катетеризация мочевого пузыря.
Частота проявлений общетоксического действия препаратов, используемых для регионарного обезболивания, составляет 1-5% и связана либо с передозировкой местного анестетика, либо с его внутрисосудистым введением при случайной катетеризации вен эпидурального пространства. Особенно опасно внутрисосудистое введение бупивакаина, вызывающего остановку сердца, резистентную к терапии.
Клинические проявления токсичности местных анестетиков.
Лёгкая степень тяжести. Больные жалуются на головокружение, шум в ушах, онемение вокруг рта. Отмечается спутанность сознания, расширение зрачков, тошнота, гипертензия, тахикардия, угнетение дыхания.
Средняя степень тяжести. У больного возникают подёргивания мышц лица, гримасы, затем развиваются генерализованные тонико-клонические судороги, рвота, тахикардия снижение артериального давления до 60-80 мм рт.ст., нарушение дыхания (до апноэ).
Тяжёлая степень. Сознание больного утрачено до комы мидриаз, остановка дыхания, глубокая гипотензия, синусовая брадикардия, нарушение проводимости миокарда, развитие желудочковых экстрасистол с последующей остановкой сердечной деятельности.
Лечение токсических проявлений местных анестетиков заключается в первую очередь в использовании противосудорожных препаратов (барбитураты), осуществлении интубации трахеи и проведении ИВЛ при FiO2=l,0, массивной инфузии кровезаменителей, введении гормонов (преднизолоц до 30 мг/кг). При развитии брадикардии используется атропин (0,5 - 1,0 - 1,5 мг). В случае остановки сердечной деятельности проводятся реанимационные мероприятия. Следует помнить, что при остановке сердечной деятельности, вызванной токсическими проявлениями бупивакаина, сердечно-лёгочно-церебральная реанимация должна проводиться не менее 60 минут.
Не рекомендуется оставлять катетер у больного более 4-7 суток, так как пропорционально увеличению этого срока возрастает опасность инфицирования эпидурального пространства.
Одним из наиболее грозных осложнений эпидуральной и спинномозговой анестезии является развитие гнойного эпидурита. Первые признаки этого осложнения возникают на 3-7 сутки после начала анестезии и проявляются слабостью, головной болью, гипертермией, болями в области местонахождения катетера или пункции при движениях, при поколачивании по остистым отросткам, при введении местного анестетика или наркотика. В более поздний период боли носят разлитой характер, и отмечается появление кожной гипертезии. По мере прогрессирования процесса кожная чувствительность уменьшается, в связи со сдавливанием корешков снижаются рефлексы, иногда возникает симптом Кернига. В некоторых случаях отмечается развитие парапареза со снижением чувствительности и нарушением функций тазовых органов.
При подозрении на возникновение гнойного эпидурита катетер необходимо удалить и произвести его микробиологическое исследование. Диагноз и локализация эпидурита уточняется эпидуральной пункцией, для чего используется методика трёх игл (В.И. Костюнин, 1977). Одна игла вкалывается в место предыдущего вкола, вторая - выше на один позвонок, третья ниже на позвонок. Введение игл должно быть очень осторожным, шаг иглы не более 1,5-2,0 мм. Для идентификации эпидурального пространства следует использовать шприц, наполненный воздухом (изотонический раствор хлорида натрия, расширяя эпидуральное пространство, разрушает воспалительный барьер, который, как правило, ограничивает распространение гнойного процесса). Наличие густого гноя указывает на развитие эпидурального абсцесса, мутноватой жидкости - гнойного эпидурита.
После эвакуации отделяемого в эпидуральное пространство вводятся антибиотики группы аминогликозидов (1г канамицина или 80мг гентамицина или 3 мг/кг нетилмицина). Введение антибиотиков повторяют 2-3 раза через 2-3 дня. Помимо этого, проводится курс массивной антибактериальной терапии, включающий назначение цефалоспоринов II - III поколения в сочетании с аминогликозидами 2-3 поколения, в максимальных дозах.
В начальный период заболевания такие больные должны быть осмотрены нейрохирургом, поскольку оптимальным сроком для оперативного вмешательства является период локальной болезненности и корешковых болей до развития симптомов спинальной дисфункции (И.М.Иргер, 1988).
Осложнения спинномозговой анестезии
Гипотензия является неотъемлемым компонентом течения спинномозговой анестезии. Степень его выраженности определяется уровнем анестезии и выполнением соответствующих профилактических мероприятий. Проведение предоперационной инфузионной "подпорки" (М.Добсон, 1989), интраоперационной инфузионной терапии в режиме гиперволемической гемодилюции, использование эфедрина, медленное введение анестетика в субарахноидальное пространство исключают развитие тяжёлых гемодинамических нарушений.
В случае развития тяжелой гипотензии и отсутствии возможности значительно увеличить темп и объем инфузионной терапии показано внутривенное струйное введение 3,0-3,5 мл/ кг массы тела больного 7,5% раствора хлорида натрия в течение 3-5 минут. Быстрое повышение уровня натрия в плазме создает высокий трансмембранный градиент и, мобилизируя жидкость из интерстициального пространства, увеличивает внутрисосудистый объем, эффективно коррегируя гипотензию.
Если профилактические меры не предпринимались, то в 80% случаев при спинномозговой анестезии внезапно развивается глубокая гипотензия, требующая коррекции путём немедленного введения коллоидных растворов и адреномиметических средств.
При использовании для спинномозговой анестезии наркотических аналгетиков возможно развитие угнетения дыхания. Дыхательно-депрессивный эффект морфина пропорционален его введённой дозе и резко выражен после интратекальной инъекции более 1-2мг.
Для профилактики дыхательной депрессии следует строго соблюдать дозировку наркотических аналгетиков, помещать больного в полусидячее положение. В качестве антагониста морфина используется налоксон (0,4 мг), который устраняет нежелательные эффекты опиатов. По показаниям больного переводят на ИВЛ до восстановления самостоятельного дыхания.
Одним из основных факторов, обусловливающих развитие неврологических осложнений при спинномозговой анестезии, является травма спинного мозга или его корешков во время пункции. Травмирование иглой корешка спинного мозга сопровождается появлением резких болей по ходу нервных стволов в виде "прострелов" в нижние конечности, что должно всегда настораживать, так как это может привести к серьёзным неврологическим последствиям типа радикулита с парестезиями, остаточными параличами или синдрома "конского хвоста".
Межостистый лигаментоз проявляется сильными болями в спине (не только в области пункции, но и на протяжении всего позвоночного столба). Развитие этого осложнения связано с травматическими манипуляциями, повторными пункциями, асептическим воспалением. Как правило, боли в спине специального лечения не требуют и самостоятельно исчезают к 5-7 дню. При стойком болевом синдроме эффективно применение дарсанвализации места пункции или электрофореза магния.
Во избежание подобных осложнений следует строго соблюдать максимальную осторожность и анатомичность при пункции субарахноидального пространства.
Головная боль после спинномозговой анестезии встречается от 1,5% до 14% случаев. Патофизиологической основой головной боли принято считать грубый прокол твёрдой мозговой оболочки и связанную с ним ликворею (С.С.Юдин,1925, Б.А.Петров, P.C.Lund, 1969). Причинами головной боли в постпункционном периоде могут быть понижение ликворного давления и раздражение мозговых оболочек.
Постпункционная головная боль в три раза чаще встречается у больных, страдающих головныи болями до спинномозговой анестезии. Частота цефалгий заметно возрастает у женщин в возрасте от 18 до 30 лет, особенно имеющих низкий индекс массы тела (отношение вес/рост), эндокринные заболевания. В случае направления среза иглы перпендикулярно продольным волокнам твердой мозговой оболочки частота постпункционных головных болей достигает 16,1%, тогда как при направлении среза иглы в продольном направлении относительно волокон твердой мозговой оболочки только в 0,24% (Morris M.C. et al, 1989). При выполнении пункций иглами калибра 22G и более головная боль возникает в 10-15%. В развитии цефалгий имеет значение и используемый анестетик: лидокаин » бупивакаин » тетракаин (Naulty J.S. et al, 1985). Наш опыт показывает, что использование комбинаций местных анестетиков с наркотическими аналге-тиками и клофелином частота головных болей и их интенсивность значительно снижаются.
Для профилактики постпункционной головной боли следует использовать пункционные иглы небольшого диаметра (25 G и менее), типа "pencil point". После введения местного анестетика игла извлекается на 0,5-0,6 см до прекращения поступления ликвора из павильона и эпидурально вводится 10-15 мл изотонического раствора хлорида натрия (изотонический раствор хлорида натрия коррегирует отрицательное давление в эпидуральном пространстве и тем самым препятствует истечению спинномозговой жидкости).
Головные боли могут возникнуть на 2-3 сутки после операционного периода и длиться не более 1-2 дней. Обычно они хорошо купируются обильным питьём. В случае стойких головных болей, усиливающихся в вертикальном положении, помимо обильного питья, назначается инфузионная терапия в объёме 1,5-2,0 л в сутки, аналгетики, спазмолитики, витамины группы В, внутривенное введение 40% раствора глюкозы, 20% раствора кофеина, 25% раствора сернокислой магнезии, 20% раствора пирацетама.
Хороший эффект показан при внутривенном введении 500-1000 мг кофеина в 1000 мл раствора Рингера, приводящий в 80% случаев к уменьшению интенсивности головных болей (Cammann W.R. et al, 1990).
При тяжелых цефалгиях, не поддающихся консервативным методам лечения, с целью уменьшения ликвореи показано эпидуральное введение "пломбировочных" растворов, в качестве которых используется аутокровь. Иглой Туохи пунктируется эпидуральное пространство на уровне предшествующей люмбальной пункции и эпидурально вводится 15-20 мл аутокрови (Gormley J.B., 1960). Эффективность " пломбировки" аутокровью достигает 90% (Choi A. et al, 1996).
При стойких головных болях хороший эффект получен от применения физиотерапевтических процедур: эндоназального электрофореза глютаминовой кислоты, электрофореза магния в область шейного отдела позвоночника, применение синусоидального модулированного тока на область шейных симпатических узлов (Л.А.Рыбаков, 1996).
Ведущим в профилактике головной боли в постпункционном периоде является использование для спинномозговой анестезии игл наименьшего диаметра (22-28G) и недопущение излишнего истечения ликвора из иглы.
Примечательно, что при парамедианном доступе пункциопные отверстия в твёрдой мозговой оболочке и паутинной оболочке не совпадают, что препятствует ликвореи.
Иногда, головная боль, носящая характер цефалгии, сопровождается нарушениями зрения и слуха. Это связано с тем, что при снижении давления ликвора несколько смещается мозжечок и мост мозга, что обусловливает натяжение отводящего нерва, который фиксирован в каменистой части височной кости. Парез отводящего нерва приводит к развитию сходящегося косоглазия и диплопии.
После спинномозговой анестезии возможно развитие глухоты, сопровождающейся вестибулярными расстройствами, в том числе и односторонней. Это объясняется снижением ликворного давления и соответственно, снижением давления во внутреннем ухе.
Методом лечения этих осложнений является "пломбирование" аутокровью эпидурального пространства и инфузионная терапия.
Асептический менингит проявляется гипертермией, головной болью, ригидностью шейных мышц, фотофобией. Симптомы асептического менингита возникают в течение 24 часов после спинномозговой анестезии и сохраняются не более недели.
Синдром "конского хвоста". В 90% случаев развитию этого осложнения предшествует возникновение парестезии во время спинномозговой пункции. Клинически синдром проявляется потерей чувствительности в области промежности, различной степенью пареза нижних конечностей, недержанием мочи и кала. Синдром возникает по окончании действия анестезии и постепенно регрессирует за период от нескольких недель до нескольких месяцев.
Адгезивный арахноидит более серьёзное осложнение спинномозговой анестезии, которое развивается постепенно, через несколько недель после анестезии. Отмечается слабость, потеря чувствительности в нижних конечностях и, в конечном итоге, развивается полная параплегия.
Неврологические нарушения обычно проходят в течение нескольких дней, но если симптомы сохраняются 6-12 месяцев, то полное восстановление функций нервной системы представляются сомнительными.
К достаточно редким осложнениям спинномозговой анестезии относят выпадение волос, нарушение зрения с развитием скотомы, внезапная отсроченная остановка сердечной деятельности.
Brett B. Gutshe,M.D
профессор анестезиологии, профессор акушерства и гинекологии. The University of Pennsylvania Medical Center, Филадельфия, штат Пенсильвания
Эпидуральная анестезия и, в особенности, продленная эпидуральная анестезия (ПЭА)- одна из наиболее эффективных методик борьбы с болью из числа тех, которые имеются в распоряжении анестезиолога. Данный способ обезболивания можно модифицировать разнообразными путями, что дает возможность применять его в самых разных клинических случаях. В последнее десятилетие широко практиковалась методика введения в эпидуральное пространство наркотических анальгетиков в виде монорастворов или в сочетании с местными анестетиками (МА), что расширило возможности метода. Непосредственно сама эпидуральная блокада может обеспечить тотальную анальгезию и удовлетворительные условия для проведения оперативного вмешательства при самых разнообразных операциях ниже уровня диафрагмы. В случаях, когда необходимо провести операцию с отключением сознания пациента, обычно сначала проводят эпидуральную блокаду, дополняя ее в дальнейшем поверхностной общей анестезией; больной при этом находится в состоянии “социального сна”. Когда проведение одной лишь эпидуральной анестезии не обеспечивает удовлетворительных условий для выполнения оперативного вмешательства, как это бывает в торакальной хирургии и при операциях на желудке, ее проводят на фоне общей анестезии, что позволяет осуществлять хирургическую интервенцию в условиях поверхностной общей анестезии и уменьшить стрессорное влияние хирургической травмы. Выполнение одной лишь эпидуральной анестезии может обеспечить анальгезию без утраты сознания и с минимально выраженным моторным блоком, давая тем самым возможность пациету помогать проведению операции, что является идеальным способом анальгезии при родах и влагалищном родоразрешении. Эпидуральная блокада позволяет успешно бороться с острой послеоперационной или посттравматической болью, хронической болью и болевым синдромом у больных со злокачественными новообразованиями. В этой главе будет рассматриваться вопрос о применении метода эпидуральной анестезии в хирургии и для борьбы с болью во время родов.
Эпидуральная блокада может привести к возникновению определенных побочных эффектов, которые могут представлять значительный риск для пациента, когда своевременно не распознаются и не лечатся. Применение этого метода, как, впрочем, и других методов анестезии, подразумевает выполнение определенных требований безопасности. В предоперационном периоде больной должен быть осмотрен анестезиологом, во время которого последний собирает полные данные об истории болезни, изучает данные лабораторных исследований и производит полное физикальное обследование пациента. Если анестезия проводится без непосредственного участия анестезиолога (например, при родоразрешении), постоянное пристальное наблюдение над больным должно осуществляться опытным средним медицинским персоналом. Ни в каких других случаях, за редким исключением, анестезиолог так не поступает, передавая своего пациента вскоре после начала обезболивания под наблюдение неанестезиологического персонала. Всем пациентам, которым будет проводиться продленная эпидуральная блокада, необходимо обеспечить доступ к венам, используя при этом катетеры 18G или большего размера, подключив их к инфузионным помпам или закрыв их с использованием “гепаринового замка”. В акушерской практике пациенткам после 15 недели гестации в обязательном порядке проводится смещение матки с целью предупреждения компрессии нижней полой вены и брюшной аорты. Помимо рутинного наблюдения за показателями кровяного давления, частотой пульса и сатурацией, необходимо проводить постоянный мониторинг частоты пульса плода и следить за сокращениями матки, используя при этом либо электронные системы слежения, либо хорошо подготовленную акушерку. Пациенты, которые идут на операцию, требуют проведения мониторинга в том объеме, который диктует характер того или иного оперативного вмешательства. Все мониторирующиеся параметры необходимо документировать в письменном виде с последующим занесением в историю болезни.
По сложившейся практике всем пациентам перед началом продленной эпидуральной блокады проводят в течение 15-30 минут внутривенную инфузию 1-2 литров сбалансированного многокомпонентного солевого раствора (ССР) или 0.9% физиологического раствора с целью предупреждения гипотензии. Совсем недавно эта доктрина была пересмотрена, поскольку было показано, что такая быстрая инфузия не особенно эффективна у больных, которые не имеют дефицита жидкости. Такое внутривенное введение 1 литра ССР рожающим пациенткам перед началом низкой “эпидуральной блокады при родах” (сенсорный уровень Т10) не влияет на частоту возникновения гипотонии и приводит к непродолжительному снижению сократительной способности матки у самостоятельно рожающих женщин. Тем не менее мы по-прежнему проводим быструю предварительную гидратацию с использованием 1-2 литров ССР пациентам, которым будет проводиться высокая эпидуральная блокада. Применяющиеся для такой предварительной гидратации растворы не содержат глюкозы, так как она вызывает значительное увеличение концентрации сахара в крови, что может привести не только к повышению диуреза, но и к развитию метаболического ацидоза. Было показано, что быстрая инфузия раствора 5% глюкозы рожающим пациенткам приводит к развитию у новорожденного ребенка метаболического ацидоза и реактивной гипогликемии через 2 часа после рождения, а также повышает вероятность возникновения желтухи. Вообще говоря, скорость введения глюкозы беременным пациенткам не должна превышать 5 г/час и менее. При состояниях, сопровождающихся снижением осмоляльности плазмы, которые, например, наблюдаются у пациенток, получающих окситоцин для стимуляции родовой деятельности или токолитические (снижающие родовую деятельность) препараты (ritodrine, terbutaline), а также при преэклампсии, проведение быстрой прегидратации противопоказано, так как это может привести к отеку легких.
Выполнение эпидуральной блокады
Положение, в котором находится пациент при выполнении продленной эпидуральной блокады, мало влияет на уровень анестезии. В сложных случаях- например, у пациентов с ожирением, сколиозом, неясными анатомическими ориетирами,- целесообразно выполнять эпидуральную блокаду в положении больного сидя с наклоненным вперед туловищем и выгнутой спиной, что позволяет более легко определить межпозвоночные промежутки. Когда не удается отчетливо пропальпировать межпозвоночные промежутки, проводят линию, которая соединяет верхние задние ости подвздошных костей. Эта линия обычно пересекает проекцию позвоночного столба на уровне остистого отростка четвертого поясничного позвонка, сверху находится L3-L4 межпозвоночный промежуток, снизу- промежуток L4-L5. Несмотря на то, что попасть в эпидуральное пространство можно через любой межостистый промежуток и через hiatus sacralis (каудальный эпидуральный доступ), обычно проще всего выполнить пункцию через промежутки L3-4 или L4-5, поскольку эти промежутки являются самыми широкими, а эпидуральное пространство на этом уровне максимально по ширине (до 5 мм). Когда это возможно, старайтесь проводить пункцию эпидурального пространства по средней линии, так как, опять-таки, в этой проекции оно максимально широкое, а связки наиболее плотные, что позволяет лучше почувствовать утрату сопротивления при продвижении иглы. По мере распространения по бокам от срединной линии эпидуральное пространство быстро суживается, а количество эпидуральных вен резко возрастает. Обычно сначала находят тот межпозвоночный промежуток, в котором желают осуществить пункцию, и прокалывают кожу и подкожную клетчатку при помощи тонкой, 2-2.5- дюймовой иглы размером 20 или 22 G. Для уменьшения болевых ощущений используют разведенный алкалинизированный раствор местного анестетика (МА), например 0.5-1 % раствор лидокаина. Осторожно выполненная обильная инфильтрация позволяет провести эпидуральную блокаду безболезненно и с минимальным дискомфортом для пациента, даже при плохо определяющихся анатомических ориентирах. Нет никакой необходимости проводить выраженную седацию пациента, более того, она нежелательна, так как может маскировать симптомы непреднамеренного субарахноидального введения и другие проблемы.
Размещение эпидурального катетера на торакальном уровне может потребоваться при проведении торакальных операций, выполнение которых во всех случаях требует общей анестезии. Тем не менее разумнее не пунктировать эпидуральное пространство на торакальном уровне тем специалистам, которые не имеют достаточного опыта по проведению пункций в поясничных отделах. Несмотря на то, что достижение анальгезии на торакальном уровне при люмбарном стоянии катетера требует введения больших количеств местного анестетика, размещенный таким образом на поясничном уровне катетер может обеспечить эффективную сенсорную блокаду всех торакальных дерматомов.
Если эпидуральный катетер провести не удается, следует подумать о следующих возможных причинах. Кончик иглы может находиться не в эпидуральном пространстве; он может упираться в твердую мозговую оболочку, вену или в нервный корешок. Попробуйте немного потянуть иглу на себя (она может упираться в твердую мозговую оболочку), а уже потом продвигайте катетер вперед. Продвижение катетера осуществляйте во время глубокого вдоха пациента, так как при этом спадаются эпидуральные вены и происходит коллабирование твердой мозговой оболочки. Вы также можете попробовать направить иглу немного краниальнее, что позволяет продвигать катетер в эпидуральное пространство под более острым углом. Болюсное введение 3-5 мл физиологического раствора или раствора местного анестетика мало помогает продвижению катетера. Никогда не применяйте катетер со стилетом, так как его использование часто приводит к перфорации твердой мозговой оболочки, попаданию в сосуд и вообще к неправильному положению катетера. Никогда насильственно не удаляйте катетер из иглы для пункции перидурального пространства, и вообще не пытайтесь вынуть его в случае, когда кончик катетера вышел за пределы кончика иглы, так как может произойти отрыв части катетера.
После установки катетера необходимо убедиться в том, что он действительно находится в эпидуральном пространстве, а не расположен субарахноидально или внутри сосуда. Это лучше всего проверить, когда пациент находится в состоянии бодрствования. Хотя существует много способов проведения “тест-дозы”, почти любой местный анестетик может служить прекрасным маркером. позволяющим достоверно определить месторасположение катетера. Чтобы быть уверенным в том, что МА поступает не в подпаутинное пространство, сначала следует ввести небольшую дозу местного анестетика, которая тем не менее при условии субарахноидального расположения катетера быстро вызывает блокаду большого количества сегментов, и которая составляет для лидокаина 40-60 мг, для бупивакаина 8-10 мг, для 2-хлорпрокаина 60-100 мг. При этом важна доза в милиграммах, а не объем вводимого МА. Подождите 3-5 минут, только потом продолжайте инъекцию, наблюдая при этом, не появились ли признаки, характерные для субарахноидального введения. Такие меры предосторожности малоинформативны, если уже имеет место высокая и массивная блокада. В этом случае следует несколько раз подряд с интервалом 2-3 минуты ввести небольшие дозы МА, наблюдая при этом, не расширилась ли зона анестезии в краниальном направлении и не затронула ли она верхние конечности.
Кроме того, необходимо быть уверенным, что МА через катетер не вводится внутрисосудисто. Можно добавить к раствору МА 15 мкг адреналина в качестве “маркера”, обычно при внутрисосудистом введении это приводит к увеличению частоты сердечных сокращений более чем на 30 ударов в минуту уже через 15 секунд. Однако такое увеличение частоты пульса является быстропреходящим и требует постоянного мониторирования частоты сокращений сердца пациента при помощи ЭКГ или пульсоксиметрии. Указанный метод не всегда является достоверным в акушерской практике, особенно во время родов, так как может способствовать быстрому изменению частоты сокращений сердца матери. Внутривенное введение 15 мкг адреналина приводит к развитию и других признаков и симптомов, таких как нервное возбуждение, бледный цвет лица, головная боль, парастезии, боль в груди, которые существенно увеличивают достоверность проводимого теста. Еще один способ, позволяющий исключить внутрисосудистое расположение катетера, состоит в быстром болюсном введении 100 мг лидокаина или 2-хлорпрокаина. Признаки и симптомы при внутрисосудистом введении подобных нетоксических доз МА проявляются появлением звона в ушах, металлического привкуса во рту, ощущением онемения и покалывания вокруг рта, нервным возбуждением и чувством общего недомогания. К сожалению, использование 2-хлорпрокаина для проведения подобного теста, как это было показано, снижает эффективность последующих введений в эпидуральное пространство амидных МА и морфина, даже если последние вводятся в больших дозировках (таблица 1). Другие способы проведения “тест-дозы” для исключения внутрисосудистого расположения катетера состоят в использовании изопротеренола или 1 мл воздуха, с последующим мониторингом тонов сердца по методу Допплера.
Другие методы, позволяющие удостовериться в том, что введение осуществляется не в субарахноидальное пространство и не внутрь сосуда, включают в себя: 1) проведение аспирационной пробы до, во время и после каждой инъекции; 2) медленное введение МА со скоростью, не превышающей 1 мл за 3 секунды; 3) фракционное введение МА, которое подразумевает первоначальную инъекцию нетоксической дозы (например, 0.3 мг/кг бупивакаина, 1 мг/кг лидокаина или 1.5 мг/кг 2-хлорпрокаина) с последующим 3-минутным периодом ожидания перед последующим введением раствора. Указанные меры предосторожности следует соблюдать при любом способе введения МА в эпидуральное пространство, будь то через иглу или через катетер, а также как при первом, так и при всех последующих введениях. Некоторые данные указывают на возможность миграции правильно установленного в эпидуральном пространстве катетера в субарахноидальное пространство, внутрь сосуда или в другие структуры в процессе проведения продленной перидуральной блокады, особенно у бодрствующих и активных пациентов.
Чтобы добиться достаточно интенсивной блокады на наиболее подходящем для данного оперативного вмешательства уровне, следует использовать достаточный объем и концентрацию МА. Лучше немного превысить дозировку в сторону ее увеличения, особенно при первом введении МА, так как это обеспечивает достаточный сенсорный анатомический уровень анальгезии. Немного более интенсивная по силе блокада на несколько более высоком, чем требуется, уровне является намного предпочтительней блокады, выполненной “точь-в-точь”. Такая стратегия впоследствии позволяет снизить общее количество используемого МА. Чтобы уменьшить латентный период и увеличить продолжительность блока, следует проводить алкалинизацию (ощелачивание) растворов местного анестетика, особенно бупивакаина. Это позволяет снизить латентный период у бупивакаина более чем на 40%. Мы рекомендуем добавлять следующие объемы 7.5% или 8.4%-ных растворов NaHCO3 на каждые 10 мл раствора МА: для лидокаина и хлорпрокаина- 0.3-0.5 мл NaHCO3 на каждые 10 мл анестетика; для бупивакаина- 0.05 мл NaHCO3 на каждые 10 мл. Не превышайте указанных количеств гидрокарбоната натрия, иначе произойдет преципитация бупивакаина (таблица 2). Полученный в результате такого смешивания раствор бупивакаина можно вводить в течение лишь нескольких минут после ощелачивания, иначе, опять-таки, произойдет преципитация МА. Помимо этого к растворам МА следует добавлять ex tempore адреналин в концентрациях 1:200,000-1:400,000, когда это не противопоказано. Использование адреналина в концентрациях 1:300,000 и ниже значительно увеличивает продолжительность блокады и ее качество, при этом также снижается латентный период действия МА (таблица 3). Не применяйте коммерческих готовых растворов, в которых адреналин смешивается с МА в заводских условиях, так как они имеют более низкий рН (менее 4. 5 по сравнению с несодержащими адреналин растворами МА, рН которых превышает 6.0), содержат антиоксидант и метабисульфит натрия для стабилизации адреналина. Желаемое разведение адреналина в растворе МА (по выбору 1:200,000, 1:300,000 или 1:400,000) достигается при добавлении к каждым 10 мл местного анестетика следующего количества адреналина в концентрации 1:1000 (1 мг/мл): для разведения 1:200,000- 0.05 мл адреналина, для разведения 1:300,000- 0.033 мл адреналина и для разведения 1:400,000- 0.025 мл адреналина. В случае, когда используется метод продленной катетеризации, сначала необходимо ввести через катетер рассчитанную дозу МА полностью или по крайней мере подавляющую ее часть, чтобы быть уверенным в правильной установке катетера в эпидуральном пространстве и в эффективности проводимой блокады. Далее следует провести дополнительную инъекцию раствора МА в дозе, составляющей 25-30% от первоначальной, но не ранее, чем через 10-15 минут после первого введения местного анестетика. Это пролонгирует блокаду во времени и делает ее более интенсивной, значительного повышения анатомического уровня анальгезии вместе с тем не происходит. Если при выполнении блокады на первоначальном этапе необходимо ввести большое количество МА, то сначала следует инъецировать лишь часть рассчитанной дозы и выждать определенное время, чтобы быть уверенным в наступлении хорошего билатерального блока, и только потом вводить остальную дозу МА. Если после введения части рассчитанной дозы не наступает удовлетворительной блокады, катетер следует установить вновь. Такая тактика позволяет при повторной установке катетера вводить через него достаточную дозу МА без риска передозировки.Если при выполнении блокады она получается неполной, односторонней или по каким-либо другим критериям неадекватной, не теряйте времени и не расходуйте лекарство, пытаясь изменить положение катетера или пациента с целью улучшить качество блокады. Удалите катетер и затем установите его заново, не теряя времени и не расходуя дополнительное количество местного анестетика.
Количество местного анестетика, которое потребуется для проведения блокады, зависит от нескольких вполне определенных факторов. Возраст является одним из самых основных факторов, определяющих распространение МА. Пациенты в возрасте примерно 19-20 лет требуют введения максимальных дозировок МА, при этом распространение местного анестетика в эпидуральном пространстве у такой категории больных минимальное по сравнению с другими возрастными группами. В возрастной группе 20-40 лет для блокирования одного дерматома достаточно ввести на люмбарном уровне примерно 1.2-1.5 мл 2% раствора лидокаина. С возрастом доза МА уменьшается, поэтому дозировка МА у пациентов 70-80 лет жизни на 33-50% меньше той, которая требуется для пациентов в возрасте 20-40 лет. Для получения одинаковой по всем параметрам блокады мужчинам необходимо вводить большее количество МА, чем женщинам того же возраста и роста. Примерно на 30% снижают дозировку МА женщинам, начиная с 10-12 недели беременности и до ее конца. Рост также имеет значение для распространения МА. Bromage предлагает увеличивать дозу МА на 0.1 мл на сегмент на каждые 2 дюйма (5 см) сверх 5-футовой (152 см) отметки роста пациента. Место введения МА в эпидуральное пространство играет главную роль в распространении раствора анестетика и определяет его количество. Для блокады одного сегмента при введении МА на каудальном, поясничном и торакальном уровнях необходимо инъецировать соответственно 2, 1.2-1.5 и 1 мл 2% раствора лидокаина. Bromage показал также, что при использовании лидокаина для получения моторного блока анатомический уровень развившейся блокады зависит от дозировки препарата, а не от его объема, то есть например при введении 20 мл 2% лидокаина (400 мг) происходит блокада на том же уровне, что и при введении 8 мл 5% лидокаина (400 мг). Тем не менее, вводя методом постоянной инфузии растворы МА с меньшей процентной концентрацией (бупивакаин, 2-хлорпрокаин) пациенткам в родах для получения одной лишь сенсорной блокады, мы обнаружили, что больший объем менее концентрированного раствора МА позволяет обеспечить блокаду большего количества дерматомов (вводимый со скоростью 16 мл/час 0.125% раствор бупивакаина (20 мг) распространяется в эпидуральном пространстве шире, чем вводимый со скоростью 8 мл/час 0.25% раствор бупивакаина (20 мг)). Добавление ex tempore к растворам МА адреналина в концентрациях 1:300,000-1:400,000 расширяет зону распространения местного анестетика в перидуральном пространстве и увеличивает время блокады. Положение пациента (сидя, лежа на спине) мало влияет на эпидуральное распространение МА и последующий уровень анальгезии. Однако при введении МА в положении пациента на боку блокада наступает несколько быстрее и немного более интенсивна с нижележащей стороны тела. При ожирении может отмечаться сниженная потребность в местном анестетике. Общие рекомендации по дозированию МА у пациентов среднего роста, 20-40 лет жизни при выполнении эпидуральной пункции на уровне L3-4 с использованием 2% раствора лидокаина или 0.5% раствора бупивакаина с адреналином 1:200,000 выглядят следующим образом: для получения моторной блокады на уровне Т10 необходимо ввести 10-12 мл такого раствора; для достижения моторной блокады на уровне Т4 следует ввести 20-25 мл такого раствора.
Гипотония обычно возникает при выполнении высокой эпидуральной блокады, которая необходима, например, при операциях на органах живота. Возникновение гипотонии констатируют в случае, когда систолическое кровяное давление снижается более чем на 25% от исходного уровня, или когда этот показатель снижается ниже отметки в 100 мм рт. ст. Если пациент при этом бодрствует, чувствует себя хорошо, у него не отмечается никаких симптомов, мочеотделение происходит в достаточном объеме, то в этом случае проводить какую-либо терапию нет необходимости. Исключение составляют лишь беременные пациентки, так как подобные показатели кровяного давления матери приводят к таким изменениям частоты сердечных сокращений плода, которые свидетельствуют о неадкватном маточно-плацентарном кровообращении и о гипоксии плода. Хотя гипотония чаще встречается при выполнении субарахноидальной блокады, возникновение гипотонии в сочетании с брадикардией после эпидуральной блокады является угрожающим признаком, поскольку может указывать не только на развитие системной вазодилатации, но и на блокаду ускоряющих нервов сердца. Такое состояние требует немедленной лекарственной терапии, например эфедрином (10-15 мг внутривенно); в тяжелых случаях может потребоваться введение адреналина или методом повторных внутривенных болюсных инъекций, или методом постоянной внутривенной инфузии. Предупредить развитие гипотонии после эпидуральной блокады можно следующими способами:
- Проведением быстрой предварительной внутривенной гидратации при помощи не содержащего глюкозы физиологического раствора или сбалансированного солевого раствора. Как было отмечено ранее, целесообразность проведения такого рода терапии у пациентов, не имеющих предоперационного дефицита жидкости, представляется сомнительной.
- В настоящее время вазопрессоры перед выполнением эпидуральной блокады с профилактической целью назначают крайне редко. У беременных пациенток со сроком гестации 18-20 недель и более в обязательном порядке необходимо проводить боковое смещение матки вбенка.
- Пациента с акушерской патологией, с ожирением или асцитом после проведения эпидуральной блокады необходимо повернуть на левый бок, это также позволяет избежать гипотонии.
Лечение гипотонии, возникшей после выполнения эпидуральной блокады, включает в себя:
- Быструю внутривенную инфузию растворов.
- У беременных пациенток необходимо продолжать проводить постоянное боковое смещение матки в левую сторону, увеличив при этом свои усилия.
- Использование внутривенных вазопрессоров. Обычно из всей группы вазопессоров препаратом выбора является эфедрин в дозе 5-15 мг. Однако при тахикардиях, или в случаях, когда назначение эфедрина приводит к возникновению тахикардии без заметного увеличения кровяного давления, показано внутривенное введение агониста a -адренорецепторов phenylephrine в дозировке 25-50 мкг. В противоположность публиковавшимся ранее данным,проведенные недавно исследования, которые затронули как пациенток с неосложенным течением беременности, так и пациенток высокого риска с нарушением маточно-плацентарного кровообращения, позволили нам констатировать, что назначение таких доз препарата phen ylephrine не оказывает каких-либо побочных эффектов на плод.
Высокая эпидуральная блокада, а также любые пролонгированные во времени блокады, часто приводят к возникновению “озноба” у пациентов в состоянии бодрствования. Это может вызвать у пациента ощущение дискомфорта и затруднить точное измерение кровяного давления. Предупреждение и лечение озноба заключается в: 1) согревании внутривенно вводимых растворов, 2) согревании раствора местного анестетика до 37° С непосредственно перед его введением, 3) добавлении к вводимому раствору МА 25-50 мг меперидина (он вытесняет фентанил из связей со спинальными структурами, фентанил же вводят в эпидуральное пространство для улучшения качества блокады), и 4) внутривенном введении 12.5-25 мг меперидина.
Продленная эпидуральная блокада в хирургии
Метод продленной эпидуральной блокады (ПЭБ) сам по себе или в сочетании с общей анестезией имеет большое количество значительных преимуществ, которые представлены ниже.
- ПЭБ снижает стрессорный компонент в ответ на хирургическую агрессию.
- ПЭБ обеспечивает большую стабильность сердечно-сосудистой системы, снижает риск возникновения выраженной гипертензии и сердечных аритмий.
- Метод способствует восстановлению пассажа по желудочно-кишечному тракту в полном объеме в более ранние сроки, особенно когда для блокады используются только одни МА.
- ПЭБ уменьшает кровопотерю во время операции, что было показано при операциях по поводу полного протезирования бедренной кости, тотальной резекции предстательной железы и кесаревом сечении.
- Метод позволяет не допустить выраженных сдвигов водного баланса в организме и снижает риск перегрузки жидкостью, изменений, которые сопутствуют проведению обширных хирургических вмешательств.
- ПЭБ снижает частоту возникновения тромбоэмболических осложнений, особенно при операциях на сосудах и нижних конечностях.
- Длительность хирургического обезболивания не ограничена во времени.
- ПЭБ в сочетании с “поверхностной общей анестезией” приводит к более раннему восстановлению сознания и защитных рефлексов.
- ПЭБ может проводиться в послеоперационном периоде, обеспечивая прекрасную анальгезию при повторных болюсных инъекциях или непрерывном введении разбавленных растворов местного анестетика, наркотических анальгетиков или комбинации и тех, и других.
- Использование данного метода в послеоперационном периоде с целью обезболивания после операции часто снижает необходимость в проведении респираторной поддержки, уменьшает количество осложнений со стороны дыхательной системы, и укорачивает время пребывания пациента в отделении интенсивной терапии.
Перед выполнением эпидуральной анестезии необходимо определиться, блокада каких сегментов обеспечит для данной операции адекватный сенсорный уровень обезболивания и насколько выраженной должна быть при этом релаксация мышц. Операции на промежности требуют проведения блокады до сенсорного уровня L5. Для операций на шейке матки, яичках или при цистоскопиях, когда осуществляются тракции мочевого пузыря, необходимо провести блокаду до сенсорного уровня Т10. При влагалищной экстирпации матки блокаду необходимо выполнить минимум до сенсорного уровня Т4, что позволяет избежать стрессорных реакций в ответ на тракцию органов промежности и малого таза. Операции на нижних конечностях подразумевают выполнение блокады по крайней мере до сенсорного уровня Т10. Наложение турникета диктует необходимость в выполнении насыщенной блокады до сенсорного уровня Т8-6, что позволяет избежать “турникетной боли”. Операции на органах брюшной полости, в том числе и грыжесечение, требуют проведения блокады минимум до сенсорного уровня Т4, а сенсорный уровень Т2 является еще более предпочтительным. Более низкий уровень блокады приведет к возникновению у пациента значительных висцеральных болевых ощущений после того, как брюшная полость будет вскрыта и начнет осуществляться тракция за брюшину и висцеральные органы. Такого рода ощущения воспринимаются пациентом как сильная боль в груди без какой-либо определенной локализации, сопровождаются рвотой, что значительно ухудшает условия для проведения операции. Фентанил позволяет предупредить висцеральную боль и связанные с ней реакции, когда его вводят в эпидуральное пространство с раствором МА в дозировке 50-100 мкг вначале и повторяют введения в дозе 50 мкг каждые 3-4 часа.
В недалеком прошлом считалось, что блокада на сенсорном уровне Т8-6 обеспечивает удовлетворительные условия для проведения кесарева сечения, так как: 1) кесарево сечение редко длилось более 30 минут, 2) применялся вертикальный разрез кожи, при котором тракция за брюшину осуществляется с меньшей силой, 3) матка рассекалась “классическими” вертикальными разрезами, 4) не требовалось выводить матку в рану.
В настоящее время кесарево сечение требует выполнения высокой блокады (до уровня Т4 и выше), так как: 1) эта операция обычно длится 60 минут и более; 2) применяется низкий поперечный разрез кожи по типу “бикини”, при котором проводится существенная тракция органов таза и брюшины; и 3) матка выводится в рану при ее ушивании.
Блокада, выполненная ниже сенсорного уровня Т4, приводит к развитию болевых ощущений, тошноты, рвоты и ощущению дискомфорта со стороны матери и акушера. Проводимые с целью поддержания блокады повторные введения МА, по объему и дозе составляющие 50-67% от первоначального введенного количества, следует выполнять с учетом времени действия конкретного местного анестетика и до того, как произойдет регрессия анатомического уровня блокады. Если перед выполнением повторной инъекции МА произошла регрессия уровня блокады более чем на два дерматома, то для восстановления первоначального уровня анестезии потребуется ввести значительно большие дозы местного анестетика, а подобная ситуация приводит к развитию состояния тахифилакии в более ранние сроки. Восстановить первоначальный уровень блокады при ее регрессии более чем на два дерматома обычно удается при введении такого количества МА, которое используется при самом первом выполнении блокады. В случаях, когда пациенту планируется провести общую анестезию в дополнение к эпидуральной, и когда последняя является основным компонентом планируемого обезболивания, вначале обычно выполняют эпидуральную блокаду и верифицируют ее уровень, а уже затем переходят к проведению общей анестезии. Такая тактика позволяет оценить реакцию пациента на проведенную блокаду. Это позволяет также осуществить индукцию при более поверхностном уровне общей анестезии, при котором гипотония менее выражена по сравнению со случаями, когда эпидуральная блокада выполняется вслед за индукцией в общую анестезию. В таблице 4 указано время проведения повторных инъекций МА и время, в течение которого происходит регрессия уровня эпидуральной блокады на два сегмента, при использовании различных местных анестетиков с адреналином 1:200,000.
Если пациентка готовится к родам через естественные родовые пути и ей проводится продленная эпидуральная блокада через заблаговременно установленный катетер, а акушер принимает решение произвести родоразрешение оперативным путем (кесарево сечение), то анестезиолог, несмотря на проведение продленной блокады, вводит вначале обезболивания в эпидуральное пространство полную дозу МА, которая требуется при стартовой одномоментной инъекции при операции кесарева сечения. Если в подобной ситуации будет использована меньшая доза МА, то блокада по анатомическому уровню и интенсивности получится неадекватной. Введение 3% хлорпрокаина , 1.5-2% лидокаина или 0.5% бупивакаина в количестве от двадцати до двадцати пяти миллилитров обеспечивает удовлетворительный уровень аналгезии. В неотложных ситуациях, когда необходимо быстро повысить анатомический уровень блокады (кесарево сечение в экстренном порядке), выполнение следующих мероприятий позволяет уменьшить латентный период действия МА: 1) добавление свежего раствора адреналина 1:200,000-1:300,000, 2) добавление 75-100 мкг фентанила, и 3) добавление бикарбоната натрия для повышения рН раствора МА. В случаях, когда время не позволяет провести полное “тестирование” эпидурального катетера, 1.5% раствор лидокаина вводят медленно со скоростью, не превышающей 1 мл за 5 секунд. Если у пациента развиваются клинические признаки внутрисосудистого или субарахноидального введения МА, то инъекцию раствора немедленно прекращают. Это обычно позволяет предупредить наступление судорог как следствие внутрисосудистого введения. а также неврологическое повреждение спинного мозга и конского хвоста вследствие субарахноидального введения больших объемов МА. Использование 3% хлорпрокаина позволяет более быстро инициировать блокаду, однако длительность действия и эффективность вводимых в эпидуральное пространство амидных местных анестетиков и морфина при этом уменьшаются.
Продленная эпидуральная блокада при влагалищном родоразрешении
Существуют следующие показания для проведения эпидуральной блокады в родах: 1) боль во время родов (блокада может быть выполнена при любом типе предлежания плода, степень раскрытия шейки матки при этом не имеет никакого значения) и 2) беременность высокой степени риска (выполнение блокады в более ранние сроки с последующим ее поддержанием на сенсорном уровне Т8 и выше защищает мать и плод от болевого стресса в родах и позволяет, когда это необходимо, немедленно приступить к проведению оперативного родоразрешения абдоминальным или вагинальным путем). Понятие “беременность высокой степени риска” подразумевает следующую патологию: хроническая внутриутробная гипоксия плода, появление аномальных типов сердечной деятельности плода, гипертония во время беременности, преждевременные роды, диабет, большое количество беременностей в анамнезе и аномальное предлежание плода. Хотя на ранних этапах родовой деятельности блокада сегментов Т10-L1 позволяет уменьшить ощущения дискомфорта при сокращениях матки, тем не менее по мере продвижения плода вниз по родовым путям женщина начинает испытывать болезненные ощущения даже до наступления второй стадии родов. Блокирование указанных сегментов требует проведения пункции эпидурального пространства на уровне Т10-Т11 или Т11-Т12. Однако в большинстве случаев при родах эпидуральную пункцию выполняют ниже, в поясничных отделах, вводя при этом такое количество МА, которое обеспечивает тотальную блокаду сегментов Т10-S5.
Адекватная анальгезия наступает при введении на начальном этапе в эпидуральное пространство 12-15 мл (включая “тест-дозу”) растворов таких МА, как бупивакаин 0.25% или 0.125%, лидокаин 1%, или хлорпрокаин 1%, с добавлением ex tempore свежего раствора адреналина в концентрациях 1:200,000-1:400,000. Добавление к вводимому раствору фентанила снижает латентный период и удлиняет время действия МА. Кроме того, это позволяет пользоваться менее концентрированными растворами МА, поэтому моторный блок выражен в меньшей степени; при таком блоке на второй стадии родов пациентка во время сокращений матки не испытывает болезненных ощущений и в состоянии более эффективно управлять продвижением плода по родовым путям. Никаких нежелательных влияний на плод и новорожденного ребенка фентанил не оказывает, если его общее количество не превышает 150 мкг или 50 мкг/час. Блокаду начинают, вводя 10-12 мл 0.125% бупивакаина с 50 мкг фентанила. Поддержание эпидуральной блокады осуществляют, вводя каждые 2-2.5 часа по 10-14 мл 0.125% бупивакаина с добавлением 25 мкг фентанила. Вводимые в перидуральное пространство опиоиды малоэффективны, когда в качестве местного анестетика используется хлорпрокаин. Ко всем растворам добавляют адреналин 1:300,000-1:400,000. Если хотят добиться удовлетворительной, но неполной анальгезии (особенно на ранних стадиях родов), то эпидуральную блокаду начинают с введения 3 мл 0.25% бупивакаина с адреналином. Вслед за этим в эпидуральное пространство вводят 50 мкг фентанила, разведенных в 10-15 мл не содержащего консервантов физиологического раствора. Такой “фентаниловый эпидуральный блок” при необходимости может быть повторен. Бупивакаин в данном случае необходим для достижения удовлетворительной анальгезии. Указанный метод не приводит к возникновению моторного блока, выраженность симпатической блокады минимальна, и, как следствие, гипотонические реакции у рожающей женщины наблюдаются редко. Однако использование подобной схемы на поздних стадиях родов может не обеспечить адекватную анальгезию, а повторные введения фентанила снижают эффективность метода. “Фентаниловый эпидуральный блок” бывает полезен на ранних этапах родовой деятельности для тех пациенток, которые хотят ощущать сокращения своей матки и не хотят чувствовать себя “парализованными”.
Эпидуральная блокада в родах не должна прерываться и осуществляется до момента окончания родов и завершения эпизиотомии. Нельзя допускать снижения анатомического уровня блокады , по крайней мере это показано в крайне редких случаях. Снижение анатомического уровня блокады во время родов приводит к возникновению у пациентки сильных болей и ощущений дискомфорта. В связи с этим необходимо проводить эпидуральную блокаду повторно через заранее определенные промежутки времени, не дожидаясь, когда возникнут болевые ощущения или произойдет снижение сенсорного уровня блокады. При повторных инъекциях в эпидуральное пространство вводят 75-100% первоначальной дозы в зависимости от уровня блокады, полученного при первом введении МА. Если перед повторным введением МА анатомический уровень блокады успел опуститься на два дерматома и более, то для восстановления первоначального уровня блокады потребуется ввести такую же дозу МА, которая вводилась изначально. В общем, при повторных блокадах необходимо использовать дозу МА, равную первоначальной.
Эпидуральная блокада методом постоянной инфузии (ЭБПИ) успешно применяется как при родовспоможении, так и для послеоперационного обезболивания. Проведение такой блокады начинают обычным способом: сначала устанавливают катетер в эпидуральном пространстве и затем одномоментно вводят расчитанное количество МА. Блокаду поддерживают путем постоянной инфузии разведенного раствора местного анестетика (8-12 мл/час 0.125% бупивакаина, 15-20 мл/час 0.5-0.75% лидокаина, или 30-40 мл/час 0.5-0.75% хлорпрокаина, с адреналином 1:400,000). Преимущества метода ЭБПИ состоят в следующем: 1) обезболивание не прерывается; 2) анатомический уровень блокады не снижается; 3) безопасность повышается, так как при миграции катетера внутрь сосуда или в подпаутинное пространство больших проблем не возникнет, как это было бы при введении МА через катетер болюсами (я никогда не сталкивался со случаями миграции катетера при выполнении ЭБПИ); 4) витальные функции организма более стабильны; 5) моторная блокада менее выражена, особенно на ранних этапах; и 6) метод удобен для анестезиолога. Тем не менее использование метода ЭБПИ требует проведения постоянного наблюдения за пациентом.
Применение фентанила при ЭБПИ обеспечивает прекрасную анальгезию с минимальной моторной блокадой. Выполнение блокады начинают с введения 10-14 мл 0.125% бупивакаина с 50 мкг фентанила. Поддержание осуществляют путем постоянной инфузии 0.0625% (1/16%) раствора бупивакаина с 1-2 мкг/мл фентанила со скоростью 10-12 мл/час. К вводимому раствору следует добавить адреналин 1:300,000-1:400,000 для улучшения качества блокады и удлинения времени ее действия.
Вообще говоря, метод ЭБПИ применяют только для поддержания блокады, а не для повышения ее анатомического уровня или увеличения ее интенсивности. При использовании ЭБПИ могут возникнуть определенные характерные для этого метода клинические ситуации. Во-первых, если происходит регрессия анатомического уровня блокады, необходимо проверить, не мигрировал ли катетер внутрь сосуда, затем ввести болюс МА и увеличить скорость инфузии. Во-вторых, иногда пациентка начинает чувствовать боль несмотря на адекватный сенсорный уровень блокады, особенно часто это происходит при аномальных видах затылочного предлежания плода. В такой ситуации проведите повторное болюсное введение МА в первоначальной или немного более высокой дозе и увеличьте концентрацию инфузируемого МА на 50%, или проведите повторное болюсное введение МА в первоначальной дозе вместе с 50 мкг фентанила и добавьте 1-2 мкг фентанила на каждый миллилитр инфузируемого раствора. В-третьих, если сенсорный уровень блокады начинает повышаться, необходимо проверить, не мигрировал ли катетер в субарахноидальное пространство, затем уменьшить скорость инфузии на 25-50%, ни в коем случае не прерывая инфузию полностью. В-четвертых, если ЭБПИ в родах не прерывалась, то в большинстве случаев аналгезия в области промежности будет адекватной и позволит провести вакуум-экстракцию, эпизиотомию или наложить щипцы при родах. Если аналгезия будет неадекватной, прервите постоянную инфузию и введите достаточную дозу быстродействующего МА, например 12-14 мл 1.5% лидокаина или такое же количество 2-3% 2-хлорпрокаина. В-пятых, если состояние пациентки требует проведения кесарева сечения, прервите постоянную инфузию и введите достаточное по объему и дозе количество МА, как в случае, если бы никакой блокады не проводилось вообще. При проведении ЭБПИ обычно нет никакой необходимости в дополнительных болюсных инъекциях МА для усиления блокады или повышения ее анатомического уровня.
Проверку адекватности анальгезии в области промежности осуществляют незадолого перед родами. Если поддержание блокады проводилось путем описанных выше повторных болюсных инъекций МА или методом ЭБПИ, то анальгезия обычно бывает достаточной для проведения родов, эпизиотомии и, вероятно, позволит наложить щипцы в родах и осуществить вакуум-экстракцию. Если анальгезия неадекватна, то блокаду проводят заново, используя при этом 12-14 мл 1.5-2% лидокаина или 2-3% 2-хлорпрокаина. При этом нет никакой необходимости вводить МА в положении пациентки сидя, так как это положение не ускорит время наступления и качество анальгезии в области промежности.
Нижеследующие пункты содержат указания по эффективности и безопасности метода продленной эпидуральной блокады.
- Старайтесь добиться блокады на несколько более высоком, чем это необходимо, уровне, при этом она должна быть немного более интенсивной, чем требуется, по силе; такая техника имеет преимущества перед блокадой, выполненной “точь-в-точь”. Используйте дозы МА, ненамного превышающие минимально необходимые для осуществления блокады на заданном уровне.
- Перед введением полной рассчитанной дозы МА проверьте правильность расположения и функционирования катетера, введя через него тест-дозу местного анестетика.
- Дополнительное введение МА через 10-15 мин после первоначальной инъекции в дозе 20-30% от исходной позволяет пролонгировать блокаду во времени и увеличить ее интенсивность.
- Повторные введения МА осуществляйте с учетом фактора времени. Не дожидайтесь, когда произойдет регрессия уровня блокады и пациент начнет ощущать боль.
- К раствору МА добавляйте адреналин ex tempore в количестве 1:200,000-1:400,000, когда это не противопоказано (что бывает редко).
- Непосредственно перед самим введением необходимо провести ощелачивание раствора МА при помощи бикарбоната натрия.
- К растворам МА добавляйте фентанил.
- Не спешите проводить разнообразные тесты. Дождитесь наступления объективных признаков наступившей блокады, а уже потом проверяйте ее уровень.
- Избегайте проводить проверку анатомического уровня блокады при помощи иглы; вместо нее используйте пропитанный спиртом тампон или кусочек льда.
- Проведение эпидуральной блокады и введение тест-дозы МА осуществляйте перед индукцией в общую анестезию. У рожающей пациентки с беременностью высокого риска эпидуральную блокаду необходимо начать в более ранние сроки, поддерживать ее на более высоком, чем это требуется, уровне, стараясь сделать блокаду немного более интенсивной, чем это необходимо.
- Не теряйте времени и препарата, стараясь понять, почему блокада получилась неравномерной, односторонней или по каким-либо другим признакам неэффективной. Быстро проведите блокаду заново в другом межпозвоночном промежутке.
- БУДЬТЕ САМОУВЕРЕННЫМ.
Please enable JavaScript to view the
Горакотомического обезболивания инфузиями жирорастворимых опиоидов, однако анатомические особенности этой области создают значительные технические трудности. Во-первых, остистые отростки, особенно с Th -4 по Th-10 являются более длинными и более выражено отклонены книзу, что делает срединный доступ более трудным.
Многообразные нарушения, вызываемые хирургическим вмешательством, могут быть относительно компенсированы анестезией . Анестезия (греч. an - отрицание, aistesis - чувство, ощущение), главной задачей которой как раз и является предупреждение последствий...- Пациент помешается в положение лежа на боку или сидя с максимальным сгибанием шеи и верхнего отдела спины. Определяются и маркируются остистые отростки. Остистый отросток VII шейного позвонка обычно больше других выступает над поверхностью шеи, что помогает определить этот уровень. Нижний угол лопатки определяется на уровне Th-9. Маркер «X» наносится на кожу на 1-1.5 см латеральнее остистого отростка на выбранном уровне, обычно на 1 дерматомный уровень ниже центральной части области хирургического вмешательства. В грудном отделе остистые отростки располагаются над телами и дугами позвонков нижележащего сегмента. Катетер должен вводиться на один или два уровня ниже намеченного центра блокируемой области, поскольку при введении он будет подниматься вверх по каналу.
- Обезболивание места проведения иглы раствором анестетика проводится иглой диаметром 22 G и длиной 1.5 дюйма. Кончик этой иглы может быть использован для обнаружения пластины тела позвонка. У тучных пациентов для идентификации кости и проведения адекватного обезболивания может понадобиться спинальная игла длиной 3.5 дюйма. Также необходимо выполнить инфильтрационную анестезию периостальной зоны. Поисковая игла продвигается до верхнего края дуги позвонка и, затем, проводится через желтую связку.
Эта методика кажется наиболее простой, однако она предполагает прерывистое продвижение иглы и, соответственно, прерывистую оценку уровня сопротивления, в отличие от его постоянного восприятия при использовании сжатого пузырька воздуха. Кроме этого, беспокойство по поводу введения воздуха в эпидуральное пространство может сделать этот метод нежелательным. Другим способом является использование солевого раствора, однако использование не сжимаемой среды повышает риск искаженного восприятия сопротивления поршня. Ни один из этих способов не дает такого плавного или отчетливого ощущения потери сопротивления как сочетание воздуха и жидкости.
В грудной области эпидуральное пространство испытывает влияние отрицательного давления грудной полости. В этой зоне капля раствора на канюле продвинутой иглы будет резко всасываться в эпидуральное пространство в связи с наличием там отрицательного давления, как только игла пройдет желтую связку. Метод «висячей капли », использующийся в грудной зоне, не подходит для поясничной области, где давление может быть равным атмосферному давлению.
Другие положения пациента
Эпидуральная анестезия может быть также выполнена, если пациент находится в положении сидя или лицом вниз, как было описано ранее для спинномозговой анестезии. Как и при спинномозговой анестезии, положение сидя оказывается полезным у тучных пациентов. Это положение позволяет легче идентифицировать костные анатомические ориентиры и срединную линию.
Эпидуральная анестезия в положении лицом вниз также используется на практике, но не имеет широкого распространения. Методика и доступ в этом случае такие же, как и описанные ранее. Показанием для анестезии в положении лицом вниз может являться необходимость избежать изменения положения тела пациента после проведения блокады, однако при эпидуральной блокаде в течение 5-10 минут, сохраняется адекватная резидуальная чувствительность и двигательная функция, позволяющая безопасно придать нужное положение после инъекции анестетика. Положение лицом вниз может позволить лучше развести остистые отростки и больше отодвинуть твердую мозговую оболочку от связки , однако эти второстепенные преимущества не стоят требуемых в этом случае дополнительных усилий.
Комбинированная спинномозговая эпидуральная анестезия
Преимущества спинномозговой или эпидуральной анестезии могут быть объединены при комбинированной методике — быстрое начало действия и распространение инъекции в крестцовую область, в сочетании с возможностью продолженной анестезии или анальгезии через эпидуральный катетер. Это особенно полезно в акушерской практике, но также применимо в хирургии при таких вмешательствах, как брюшно-промежностная резекция и протезирование коленного сустава, при которых необходимо быстрое начало крестцовой анестезии, а также при обезболивании в послеоперационном периоде. Эта методика обычно ограничена поясничной областью, где субарахноидальная инъекция является более безопасной.
При свободном истечении спинномозговой жидкости спинальная игла фиксируется или закрепляется на канюле эпидуральной иглы (в некоторых наборах). Выбранная доза для субарахноидального введения местного анестетика или опиоида вводится по стандартной для спинномозговой анестезии или акушерской анастезии методике. Затем, спинальная игла извлекается и также по стандартной методике через эпидуральную иглу проводится эпидуральный катетер.
Эпидуральная анестезия в настоящее время набирает всё большую популярность среди врачей и пациентов. И не зря: такая процедура даёт хорошую эффективность и имеет достаточно мало противопоказаний.
Эпидуральная анестезия считается современным методом в медицинской практике, однако о ней было известно уже давно. Ещё в начале двадцатого столетия специалистами было обнаружено, что если кокаин ввести в эпидуральное пространство, то наблюдается прекрасный обезболивающий эффект. Но, не смотря на такое важное научное открытие, анестезию по многим причинам не стали широко применять в медицине. Около века на постсоветском пространстве многие врачи так и продолжали использовать «общий наркоз», игнорируя при этом долгое время более щадящий и лёгкий метод обезболивания.
На данный момент мы можем смело рассчитывать на эпидуральное (синоним – перидуральное) обезболивание, которое обширно применяется в абдоминальной хирургии, онкологии, травматологии и ортопедии, акушерстве, гинекологии, урологии и довольно часто — в педиатрии. Итак, давайте узнаем и рассмотрим, что такое эпидуральная анестезия, как выполняют данную процедуру, какие у неё имеются побочные эффекты, болит ли она и почему именно этот наркоз, а не общий?
Сегодня этот метод считается самым распространённым в анестезиологии. Сколько же пациентов выбирают такой современный вид обезболивания, как эпидуральная анестезия?
Если верить статистике, то в развитых странах Европы и США им пользуются в 75-80% случаев.
Техника выполнения
Самая главная задача для анестезиолога – это правильно поставить катетер в эпидуральное (перидуральное) пространство. Под эпидуральным пространством расположен спинной мозг, который также окружён оболочкой (именно в это место необходимо попасть иглой для получения такого наркоза, как спинальная анестезия).
Перидуральная анестезия осуществляется с помощью специальной иглы (игла Туохи), которая имеет определённый диаметр (1-2 мм) и длину (9 см). Местный анестетик, попадая в эпидуральное пространство, блокирует проводящие нервные волокна, которые напрямую связаны со спинным мозгом. Таким образом, происходит перидуральная анестезия того или иного, в зависимости от уровня анестезии, участка тела.
Игла Туохи
Чтобы выполнить обезболивающую процедуру, необходимо иметь набор для эпидуральной анестезии, в который входит следующее (возможны дополнительные компоненты):
- игла Туохи (эпидуральная игла);
- эпидуральный катетер;
- шприц низкого сопротивления;
- коннектор
- бактериальный фильтр;

1-игла Туохи. 2-коннектор с катетером. 3-бактериальный фильтр. 4-шприц низкого сопротивления
Как делают эпидуральную анестезию?
Манипуляция совершается врачом анестезиологом и медицинской сестрой. Перед началом проведения процедуры набор для эпидуральной анестезии выкладывается в стерильный лоток или на стерильную пеленку.
Пациент находится в положение сидя, хотя допускается и положение на боку с согнутыми к груди ногами. Пациента просят выгнуть спину дугой, либо «кошечкой» для того, чтобы удобнее было нащупать нужные ориентиры и попасть иглой в необходимую область. При этом врач рекомендует больному не совершать никаких движений, чтобы правильно и быстро выполнить свою работу.
Место установки катетера зависит от хирургического пособия (операции). Это чаще всего поясничный, нижний грудной или высокий грудной уровни. Задача врача на этом этапе – пальпационным методом (потрогать руками) выбрать необходимое место, куда будет вводиться игла.
Место инъекции обкладывается стерильным материалом (пелёнки, простыни, одноразовые фартуки), оставляется лишь небольшое окошко в области позвоночника, которое потом обрабатывается антисептиком. Либо просто спина широко обрабатывается антисептическим раствором. Все зависит от материальных возможностей медицинского учреждения. Так как процедура может доставить болевые ощущения пациенту, то место сначала «замораживают»-нужное место обкалывают местным анестетиком (чаще всего это лидокаин). Пациент при этом может сказать о том, что немного распирает в зоне укола, может ощущать лёгкое жжение, которое длится недолго. Затем врач начинает «поиск» нужного пространства посредством иглы Туохи и шприца низкого давления, и установки в это пространство эпидурального катетера
Этот этап манипуляции считается самым важным и безболезненным для пациента: под действием предыдущей анестезии прокол иглой, как правило, практически не чувствуется или не ощущается вообще. Правильная техника выполнения требует большого врачебного мастерства, чтобы удачно провести такую процедуру,как эпидуральная анестезия.
Когда игла попала в необходимую область, через неё производится введение катетера. Через эту тоненькую трубочку будет подаваться препарат для выполнения анестезирующего действия. Пациент на данном этапе также не ощущает никакого дискомфорта.
После установки катетера в позвоночник, игла извлекается. Далее к нему подсоединяется коннектор (переходник), чтобы можно было шприцом ввести необходимый препарат.
Прежде чем ввести полную дозу анестетика, врач вводит «тест-дозу». Это один из дополнительных методов для подтверждения правильного расположения эпидурального катетера. Для этого вводится несколько миллилитров препарата и производится оценка его воздействия. В это время врач будет задавать вопросы, просить выполнить те или иные действия. Очень важно, чтобы пациент давал четкие ответы и в точности выполнял все действия врача. От этого будет зависеть качество анестезии. Катетер надёжно фиксируют с помощью стерильной повязки и лейкопластыря. Многие пациенты спрашивают: «Сколько времени проходит, прежде чем я почувствую действие лекарства и наркоз?». Действие анестезии проявляется через 15-25 минут.
Показания к эпидуральной анестезии:
- выполнения оперативных вмешательств на грудной полости, брюшной полости, на нижних конечностях;
- в комплексной терапии некоторых заболеваний (например, панкреатит)
- лечение хронических и затяжных болей;
- обезболивание родов;
- акушерские показания;
Противопоказания к перидуральной (эпидуральной) анестезии.
Итак, противопоказания могут быть абсолютными (не допускают пациента к анестезии в 100% случаях) и относительные (на усмотрение врача).
Абсолютные противопоказания:
- отказ больного;
- кожные заболевания спины с выраженными гнойничковыми нарывами и образованиями в месте пункции (укола);
- аллергическая реакция на местный анестетик;
- выраженная деформация позвоночного столба (например, болезнь Бехтерова);
- нарушение свертывающей функции крови (коагулопатии);
- Клинически значимая гиповолемия (обезвоживание, потеря крови);
- Нарушение проводимости сердца (АВ-блокады, синдром слабости синусового узла);
Относительные противопоказания:
- аномалии развития и лёгкая деформация позвоночника;
- психиатрические заболевания;
- Низкий уровень интелекта у больного;
- Лечение дезагрегантами и антикоагулянтами – препараты «разжижающие кровь» (клопидогрель и его производные, варфарин и т.д.);
- Перенесенные раннее операции на позвоночнике;
- Наличие татуировки в месте пункции (укола);
Плюсы и минусы анестезии
Как уже было сказано выше, перидуральная анестезия имеет на сегодняшний день высокую актуальность. Данный вид анестезии имеет гораздо меньше побочных явлений на организм, в отличие от общей анестезии (наркоза)
Однако у каждой медали есть обратная сторона. Речь пойдет об осложнениях
Осложнения эпидуральной анестезии:
- эпидуральная анестезия не приносит желаемого эффекта, поэтому может наблюдаться частичная блокада либо её не будет вовсе (не произойдёт обезболивание);
- образование гематомы в эпидуральном пространстве-довольно редкое осложнение;
- попадание инфекции в перидуральное пространство-встречается редко;
- токсическое действие препаратов из-за непреднамеренного в\в введения местного анестетика либо передозировкой препарата из-за превышенной дозы препарата;
- Головные боли разной интенсивности. Это может произойти при непреднамеренном прокол проколе спиномозгового пространства иглой Туохи (самое частое осложнение)
- Различные неврологические нарушения – от легких (частичный паралич/онемение, боли в ногах) до грубых (повреждение спинного мозга) — встречаются очень редко;
- Отрыв катетера (так как катетер-это пластиковая трубочка, то и поломаться гипотетически может! В зависимости от уровня, на котором обломился катетер, может потребоваться хирургическая операция по его «поимки». Например, если это случилось на уровне кожи. В остальных случаях катетер оставляется, так как абсолютно совместим с окружающими тканями);
- Боль в спине (связано чаще всего с тем, что анестезия вызывает расслабление мышц и натяжение связок, встречается примерно у 40% пациентов, проходит через 1-2 дня, описаны случаи более длительного присутствия боли, что связано с обострением уже имеющихся проблем с позвоночником);
- Ошибочное введение не предназначенного для эпидурального введения лекарственного средства (как бы странно это не звучало, но это имеет место быть, хотя и довольно редко)