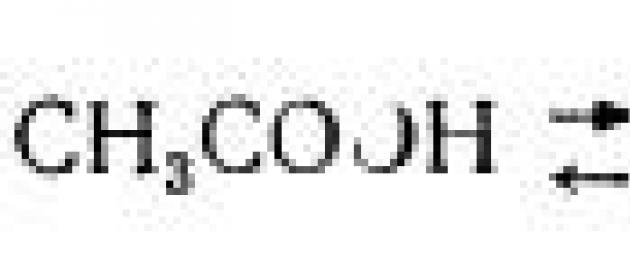بالنسبة للتفاعلات التي تحدث في الجسم، فإن التفاعل النشط للبيئة له أهمية كبيرة.
يُفهم التفاعل النشط للوسط على أنه تركيز أيونات الهيدروجين أو أيونات الهيدروكسيل في المحلول.
تتحلل العديد من المواد (الشوارد) الموجودة في محلول مائي إلى أيونات. اعتمادًا على طبيعة المنحل بالكهرباء، تختلف درجة التحلل (التفكك). الماء النقي عبارة عن إلكتروليت ضعيف جدًا، ويتفكك إلى أيونات هيدروجين وهيدروكسيل:
كمية أيونات الهيدروجين والهيدروكسيل في الماء النقي لا تذكر وتبلغ 0.0000001 جم.
تنفصل الأحماض في المحاليل المائية إلى أيون الهيدروجين والأيون المقابل:
![]()
والقواعد - إلى أيون الهيدروكسيل والكاتيون المقابل:
![]()
إذا كان تركيز أيونات الهيدروجين في المحلول يساوي تركيز أيونات الهيدروكسيل ([H+]=[OH-])، فإن التفاعل يكون متعادلًا؛ إذا كان تركيز أيونات الهيدروجين أقل من تركيز أيونات الهيدروكسيل ((OH])، يكون التفاعل حمضيًا.
مع نفس الوضع الطبيعي لمحاليل حمض الخليك والهيدروكلوريك، يكون التفاعل النشط في محلول حمض الأسيتيك أقل منه في محلول حمض الهيدروكلوريك، حيث أن حمض الأسيتيك يتفكك بقوة أقل من حمض الهيدروكلوريك، ونتيجة لذلك يوجد عدد أقل من الهيدروجين الأيونات في محلول حمض الخليك عنها في محلول حمض الهيدروكلوريك.
وهكذا، فإن التفاعل المحايد للوسط يتميز بالمساواة في تركيزات H+ و OH- الأيونات في المحلول، الحمضية - بغلبة أيونات الهيدروجين على أيونات الهيدروكسيل، القلوية - بغلبة أيونات الهيدروكسيل على أيونات الهيدروجين. كلما زاد تركيز أيونات الهيدروجين في المحلول، انخفض تركيز أيونات الهيدروكسيل، والعكس صحيح. حتى في المحاليل الحمضية جدًا توجد دائمًا كمية ضئيلة من أيونات الهيدروكسيل وفي المحاليل القلوية جدًا - أيونات الهيدروجين. لذلك، يمكن وصف التفاعل النشط للوسط بمحتوى أيونات الهيدروجين أو محتوى أيونات الهيدروكسيل. من المعتاد التعبير عن التفاعل النشط للوسط من خلال تركيز أيونات الهيدروجين، والتي تساوي 1 * 10v-7 بالنسبة للماء. من أجل عدم العمل في العمل العملي مع مثل هذه القيم العددية غير المريحة، يتم التعبير عن التفاعل النشط للوسيط في الغالب من حيث قيمة الرقم الهيدروجيني.
مؤشر الهيدروجين هو لوغاريتم تركيز أيونات الهيدروجين، مأخوذ بالإشارة المعاكسة:
![]()
التغيرات في الرقم الهيدروجيني في النطاق من 0 إلى 7 تميز التفاعل الحمضي، عند الرقم الهيدروجيني 7 المحايد ودرجة الحموضة من 7 إلى 14 القلوية.
تتم العمليات الكيميائية المختلفة بشكل مختلف، اعتمادًا على ما إذا كان تفاعل الوسط حمضيًا أو متعادلًا أو قلويًا. وينطبق الشيء نفسه على العمليات التي تحدث في خلايا الكائن الحي، وهنا يلعب رد فعل البيئة دورا كبيرا. وهذا ما تؤكده حقيقة أن ثبات تفاعل الدم وسوائل الأنسجة، مثل اللمف، يتم الحفاظ عليه بدقة كبيرة، على الرغم من أن المواد التي تتشكل في الأنسجة أثناء عملية التمثيل الغذائي تميل إلى تعطيلها.
تتجلى خصائص البروتينات في الاعتماد الصارم على طبيعة رد فعل البيئة. أهمية التفاعل النشط للبيئة للعمليات الأنزيمية لها أهمية خاصة.
رد فعل بيئة الدم والأنسجة والأعضاء الأخرى قلوي قليلاً، قريب من المحايد. يتم الحفاظ على ثبات الرقم الهيدروجيني في الدم ضمن حدود ضيقة جدًا (7.3-7.4). إن تحول درجة الحموضة إلى الجانب الحمضي أو القلوي هو نتيجة لأي اضطرابات تحدث في الجسم.
يتم الحفاظ على ثبات درجة الحموضة في الدم من خلال التنظيم الكيميائي عن طريق الأنظمة العازلة الموجودة في الدم وإزالة النفايات عن طريق الرئتين والكليتين. تزيل الرئتان المنتجات الحمضية - ثاني أكسيد الكربون، وتزيل الكلى - الفوسفات والأمونيا، والأخيرة بشكل رئيسي بعد تحويلها إلى اليوريا.
يشير الإجراء المنظم إلى قدرة المحلول على مقاومة التغيرات في الرقم الهيدروجيني التي قد تحدث بسبب إضافة حمض أو قلوي.
يمكن للأنظمة العازلة في الدم وسوائل الأنسجة أن تحافظ على درجة حموضة ثابتة أثناء تكوين الأحماض والقواعد التي يتم إطلاقها أثناء عملية التمثيل الغذائي.
من بين الأنظمة العازلة، تعتبر البروتينات ذات أهمية كبيرة في الجسم، وكذلك المركبات المعدنية - بيكربونات وفوسفات الصوديوم والبوتاسيوم. أنظمة عازلة الدم هي: الكارونات - H2CO3/NaHCO3، الفوسفات NaH2PO4/NaHPO4 وبروتين بروتين-حمض/بروتين-ملح.
في الجسم، عندما يتفاعل بيكربونات الصوديوم NaHCO3 مع حمض الفوسفوريك المنطلق أثناء عملية التبادل، يتكون حمض الكربونيك:
حمض الكربونيك، كونه غير مستقر للغاية، يتفكك بسرعة ويخرج من الجسم مع هواء الزفير على شكل ماء وثاني أكسيد الكربون. وهذا يضمن درجة حموضة الدم ثابتة. تعمل أملاح حمض الفوسفوريك أيضًا على مقاومة التغيرات في الرقم الهيدروجيني. على سبيل المثال، عندما يتفاعل حمض اللاكتيك مع فوسفات الصوديوم ثنائي الاستبدال، يتكون ملح الصوديوم لحمض اللاكتيك وفوسفات الصوديوم أحادي الاستبدال:

تتحد الأمونيا، التي تتشكل أثناء عملية تبادل القواعد، مع حمض الكربونيك الحر، مما يؤدي إلى تكوين بيكربونات الأمونيوم:
إن المادة العازلة الأكثر أهمية في الدم كله هي بروتين الهيموجلوبين، والذي، بسبب خصائصه الحمضية، يمكنه ربط القواعد وتكوين الأملاح، على سبيل المثال هيموجلوبين الصوديوم.
يمكن إظهار قدرة الدم على التخزين المؤقت باستخدام المثال التالي: لتحويل الرقم الهيدروجيني لمصل الدم إلى الجانب القلوي إلى الرقم الهيدروجيني 8.2، تحتاج إلى إضافة قلويات أكثر بـ 70 مرة من الماء، ولتحويل الرقم الهيدروجيني للدم إلى 4.4، تحتاج إلى إضافة حمض الهيدروكلوريك إلى الدم بمقدار 327 مرة أكثر من الماء.
يتذكر كل واحد منا صيغ عدة جزيئات على الأقل من دورة الكيمياء لدينا. حتى لو كنت لا تعرف مبادئ الكيمياء نفسها، فمن المحتمل أن يكون لديك إدخال رمزي واحد في ذاكرتك - H2O، مما يعني أن جزيء الماء يتكون من ذرتين هيدروجين متصلتين بذرة أكسجين. لكن مثل هذا الجزيء غير نشط كيميائيا، أي أنه لا يمكن أن يتفاعل مع مواد أخرى. هذه العملية ممكنة فقط عندما تتفكك الجزيئات إلى أيونات.
ليس كل جزيئات الماء، ولكن جزءًا معينًا منها، تنفصل إلى كاتيون موجب الشحنة H+ وأنيون بشحنة سالبة OH-. يحدث هذا الانفصال والجمع في جزيء كامل باستمرار، حيث ينقسم جزء من الجزيئات إلى أيونات، والآخر في هذا الوقت ينضم معًا. في الماء النقي كيميائيًا عند درجة حرارة الغرفة، يكون 1/10.000.000 من إجمالي عدد الجزيئات في حالة تفكك مستمرة.
قد تزيد أو تنقص نسبة الجزيئات المنفصلة. ولا تؤثر تقلبات درجات الحرارة على هذه الظاهرة، وعلى الأقل داخل درجة حرارة الغرفة، يبقى عدد الجزيئات كما هو. لكن إضافة مواد أخرى مذابة في الماء يؤثر بشكل كبير على عدد الجزيئات.
يمكن أن يكون التأثير على درجة التفكك ثلاثة أضعاف:
- المذاب لا يغير نسبة الجزيئات المنفصلة. على سبيل المثال، يمكنك إذابة ملح الطعام (NaCl) في الماء، والذي سوف يتفكك إلى أيونات Na+ وC1-. لن تتغير نسبة أيونات H+ و OH- التي يتكون منها الماء.
- يزيد المذاب من تركيز أيونات H+. على سبيل المثال، تتفكك جزيئات حمض الفوسفوريك H2PO3 أيضًا إلى أيونين H+ وأيون PO3-. وهذا يعني أن عدد أيونات H+ في محلول الماء وحمض الفوسفوريك سيصبح أكبر، في حين أن عدد أيونات OH- لن يتغير.
- يزيد المذاب من تركيز أيونات OH-. على سبيل المثال، تشكل جزيئات هيدروكسيد الصوديوم (NaOH) أيونات Na+ وOH-. في هذه الحالة، لن يتغير تركيز أيونات H+، ولكن سيكون هناك المزيد من أيونات OH- في المحلول.
بهذا يمكننا إنهاء المقدمة المليئة بالمصطلحات المعقدة واستخلاص النتائج الرئيسية. فائض H+ يعطي الماء حمضيةالخصائص والفائض OH- - قلوية.عندما لا تتغير نسبة الجزيئات المنفصلة، يكون للماء خصائص محايدة. بشكل عام، تسمى هذه الخاصية للمياه رد فعل نشط.
لتقييم التفاعل النشط بالأرقام، استخدم ما يسمى مؤشر الرقم الهيدروجيني.إنه يساوي اللوغاريتم المضاد لأيونات H + في المحلول، أي بالنسبة للماء النقي كيميائيًا (1/10.000.000) = 7. بالنسبة لأولئك الذين لا يجيدون الرياضيات ولا يعرفون ما هو اللوغاريتم المضاد، ألفت الانتباه إلى عدد الأصفار في جزء جزيئات الماء المنفصلة - يتزامن مع قيمة مؤشر الهيدروجين. يتم اختصار قيمة الرقم الهيدروجيني للمياه المحايدة بالرقم الهيدروجيني 7. ويعني اختصار الرقم الهيدروجيني "بوندوس هيدروجيني"، والذي يُترجم من اللاتينية إلى "قيمة الهيدروجين".
بالمعنى الأكثر عمومية، عند درجة حموضة 7، يكون للماء خصائص محايدة، وعند درجة حموضة 7، يكون قلويًا. وللدلالة بشكل أكثر دقة على خصائصه يسمى الماء:
- الرقم الهيدروجيني 1-3 - حمضي بقوة.
- الرقم الهيدروجيني 3-5 - حمضية.
- الرقم الهيدروجيني 5-7 - حمضية قليلاً.
- الرقم الهيدروجيني 7 - محايد.
- الرقم الهيدروجيني 7-9 - قلوية قليلاً؛
- الرقم الهيدروجيني 9-11 - القلوية.
- الرقم الهيدروجيني 11-14 - قلوي للغاية.
في المثال أعلاه، قائمة المواد المختلفة التي تغير مؤشر الهيدروجين لم تستنفد بعد. كل منهم، بغض النظر عن التركيب الكيميائي، يؤثر على هذه القيمة. يتم تخفيضه (أو بمعنى آخر، تحمض الماء) بواسطة الأحماض وأملاحها. يساهم وجود القلويات أو الأملاح القلوية في الماء في زيادة قيمة الرقم الهيدروجيني. بعض المواد لا تغير قيمة الرقم الهيدروجيني - وهي مواد محايدة.
في ممارسة حوض السمك، تم استخدام العديد من المواد التي يمكن أن تؤثر على التفاعل النشط منذ فترة طويلة. على سبيل المثال، يتم تقليل قيمة الرقم الهيدروجيني باستخدام مغلي الخث الحمضي. ثاني أكسيد الكربون المذاب في الماء له نفس التأثير. عند تربية أسماك الزينة، غالبا ما يستخدم حمض الفوسفوريك. يتم زيادة قيمة الرقم الهيدروجيني باستخدام محلول صودا الخبز (Na2HCO3). كما تفهم، يمكنك تحمض أو قلوية الماء بأي مادة لها الخصائص المناسبة، ولكن للاستخدام في حوض السمك، لا ينبغي أن تكون سامة. ولذلك، يمكن اعتبار قائمة المواد المستخدمة في تربية الأحياء المائية شاملة.
في كثير من الأحيان، عند الحديث عن قيمة الرقم الهيدروجيني للمياه، يستخدم علماء الأحياء المائية مصطلحات "الحموضة" أو "القلوية". علاوة على ذلك، فإنهم يستخدمونها كما لو أن زيادة الحموضة تساوي انخفاضًا في الرقم الهيدروجيني، والعكس صحيح. في الواقع، هذا خطأ. الحموضة هي عدد البقايا الحمضية في الماء ويتم قياسها بالملجم / لتر، مما يعني أن نفس الحموضة يمكن أن تتوافق مع قيم الأس الهيدروجيني المختلفة، اعتمادًا على قوة هذه البقايا الحمضية. على سبيل المثال، في عينة واحدة يذوب حمض الكربونيك بنفس التركيز، وفي أخرى - حمض الهيدروكلوريك. نظرًا لأن الخواص الحمضية لحمض الهيدروكلوريك أقوى بمئات المرات من حمض الكربونيك، فإن قيمة الرقم الهيدروجيني في محلول حمض الهيدروكلوريك ستكون أقل بكثير، وستكون حموضة المحاليل هي نفسها. ويمكن قول الشيء نفسه عن القلوية. من الأفضل عدم استخدام هذه المصطلحات في ممارسة أحواض السمك على الإطلاق.
آي شيريميتيف