text_fields
text_fields
arrow_upward
В арсенале современной иммунопрофилактики насчитывается несколько десятков иммунопрофилактических средств.
В настоящее время выделяют два вида вакцин:
- традиционные (первого и второго поколения) и
- вакцины третьего поколения, сконструированные на основе методов биотехнологии.
Вакцины первого и второго поколения
text_fields
text_fields
arrow_upward
Среди вакцин первого и второго поколения различают:
- живые,
- инактивированные (убитые) и
- химические вакцины.
Живые вакцины
text_fields
text_fields
arrow_upward
Для создания живых вакцин используют микроорганизмы (бактерии, вирусы, риккетсии) с ослабленной вирулентностью, возникшей в естественных условиях или искусственно в процессе селекционирования штаммов. Эффективность живой вакцины впервые была показана английским ученым Э.Дженнером (1798), предложившим для иммунизации против натуральной оспы вакцину, содержащую маловирулентный для людей возбудитель коровьей оспы, от латинского слова vасса – корова и произошло название «вакцина». В 1885 г. Л.Пастер предложил против бешенства живую вакцину из ослабленного (аттенуированного) вакцинного штамма. Французские исследователи А.Кальметт и Ш.Герен для ослабления вирулентности длительно культивировали на неблагоприятной для микроба среде туберкулезные микобактерии бычьего типа, которые и применяются для получения живой вакцины БЦЖ.
В России используются как отечественные, так и зарубежные живые аттенуированные вакцины. К ним относятся вакцины против полиомиелита, кори, эпидемического паротита, краснухи, туберкулеза, вошедшие в календарь профилактических прививок.
Применяются также вакцины против туляремии, бруцеллеза, сибирской язвы, чумы, желтой лихорадки, гриппа. Живые вакцины создают напряженный и длительный иммунитет.
Инактивированные вакцины
text_fields
text_fields
arrow_upward
Инактивированные (убитые) вакцины представляют собой препараты, приготовленные с использованием производственных штаммов возбудителей соответствующих инфекций и сохранением корпускулярной структуры микроорганизма. (Штаммы обладают полноценными антигенными свойствами.) Существуют различные методы инактивации, основными требованиями к которым являются надежность инактивации и минимальное повреждающее действие на антигены бактерий и вирусов.
Исторически первым методом инактивации считают нагревание («гретые вакцины»).
Идея «гретых вакцин» принадлежит В.Колле и Р.Пфейфферу. Инактивация микроорганизмов также достигается под действием формалина, формальдегида, фенола, феноксиэтанола, спирта и др.
В календарь прививок России включена вакцинация убитой вакциной против коклюша. В настоящее время в стране применяют (наряду с живой) инактивированную вакцину против полиомиелита.
В практике здравоохранения наряду с живыми также используют убитые вакцины против гриппа, клещевого энцефалита, брюшного тифа, паратифов, бруцеллеза, бешенства, гепатита А, менингококковой инфекции, герпетической инфекции, Ку‑лихорадки, холеры и других инфекций.
Химические вакцины
text_fields
text_fields
arrow_upward
Химические вакцины содержат специфические антигенные компоненты, извлеченные из бактериальных клеток или токсинов различными способами (экстрагирование трихлоруксусной кислотой, гидролиз, ферментативное переваривание).
Наиболее высокий иммуногенный эффект наблюдается при введении антигенных комплексов, полученных из оболочечных структур бактерий, например Vi‑антигена возбудителей брюшного тифа и паратифов, капсульного антигена чумного микроорганизма, антигенов из оболочек возбудителей коклюша, туляремии и др.
Химические вакцины оказывают менее выраженное побочное действие, они ареактогенны, длительно сохраняют свою активность. Среди препаратов этой группы в медицинской практике используют холероген – анатоксин, высокоочищенные антигены менингококков и пневмококков.
Анатоксины
text_fields
text_fields
arrow_upward
Для создания искусственного активного иммунитета против инфекционных болезней, которые вызываются микроорганизмами, продуцирующими экзотоксин, применяют анатоксины.
Анатоксины представляют собой обезвреженные токсины, сохранившие антигенные и иммуногенные свойства. Обезвреживание токсина достигается путем воздействия формалина и длительного выдерживания в термостате при температуре 39–40 °С. Идея обезвреживания токсина формалином принадлежит Г.Рамону (1923), предложившему для иммунизации дифтерийный анатоксин. В настоящее время применяют дифтерийный, столбнячный, ботулинический и стафилококковый анатоксины.
В Японии создана и изучается бесклеточная преципитированная очищенная коклюшная вакцина. Она содержит лимфоцитозстимулирующий фактор и гемагглютинин в виде анатоксинов и обладает существенно более низкой реактогенностью и как минимум такой же эффективностью, как и корпускулярная убитая вакцина против коклюша (которая представляет собой наиболее реактогенную часть широко используемой АКДС‑вакцины).
Вакцины третьего поколения
text_fields
text_fields
arrow_upward
В настоящее время продолжается совершенствование традиционных технологий изготовления вакцин и успешно разрабатываются вакцины с учетом достижений молекулярной биологии и генной инженерии.
Стимулом к разработке и созданию вакцин третьего поколения послужили причины, обусловленные ограниченностью использования традиционных вакцин для профилактики ряда инфекционных заболеваний. Прежде всего это связано с возбудителями, которые плохо культивируются в системах in vitro и in vivo (вирусы гепатита,ВИЧ, возбудители малярии) или обладают выраженной антигенной изменчивостью (грипп).
К вакцинам третьего поколения относятся:
- синтетические вакцины ,
- генно‑инженерные и
- антиидиотипические вакцины .
Искусственные (синтетические) вакцины
text_fields
text_fields
arrow_upward
Искусственные (синтетические) вакцины представляют собой комплекс макромолекул, несущих несколько антигенных детерминант различных микроорганизмов и способных иммунизировать против нескольких инфекций, и полимерный носитель – иммуностимулятор.
Применение синтетических полиэлектролитов в качестве иммуностимулятора позволяет существенно повысить иммуногенный эффект вакцины, в том числе и у лиц, несущих Ir‑гены низкого ответа и Is‑гены сильной супрессии, т.е. в случаях, когда традиционные вакцины неэффективны.
Генно‑инженерные вакцины
text_fields
text_fields
arrow_upward
Генно‑инженерные вакцины разрабатываются на основе антигенов, синтезированных в рекомбинантных бактериальных системах (Е. соli), дрожжах (Саndida) или вирусах (вирус осповакцины). Такого типа вакцины могут оказаться эффективными при иммунопрофилактике вирусного гепатита В, гриппа, герпетической инфекции, малярии, холеры, менингококковой инфекции, оппортунистических инфекций.
Антиидиотипические вакцины
text_fields
text_fields
arrow_upward
Среди инфекций, для борьбы с которыми уже существуют вакцины или планируется применение вакцин нового поколения, прежде всего следует отметить гепатит В (вакцинация введена в соответствии с приказом МЗРФ № 226 от 08.06.96 г. в календарь прививок).
К перспективным вакцинам следует отнести вакцины против пневмококковой инфекции, малярии, ВИЧ‑инфекции, геморрагических лихорадок, острых респираторных вирусных инфекций (аденовирусная, респираторно‑синцитиальная вирусная инфекция), кишечных инфекций (ротавирусная, хеликобактериоз) и др.
Моновакцины и комбинированные вакцины
text_fields
text_fields
arrow_upward
Вакцины могут содержать антигены одного или нескольких возбудителей.
Вакцины, содержащие антигены возбудителя одной инфекции, называются моновакцинами
(холерная, коревая моновакцина).
Широкое применение получили ассоциированные вакцины, состоящие из нескольких антигенов и позволяющие вакцинировать одновременно против нескольких инфекций, ди‑ и тривакцины. К ним относятся адсорбированная коклюшно‑дифтерийно‑столбнячная (АКДС) вакцина, тифо‑паратифозно‑столбнячная вакцина. Используется адсорбированная дифтерийностолбнячная (АДС) дивакцина, которой прививают детей после 6 лет жизни и взрослых (вместо прививки АКДС).
К живым ассоциированным вакцинам относится вакцина против кори, краснухи и паротита (ТТК). Готовится к регистрации комбинированная вакцина ТТК и против ветряной оспы.
Идеология создания комбинированных вакцин заложена в программу Всемирной вакцинной инициативы, конечная цель которой – создание вакцины, которая могла бы защитить от 25–30 инфекций, вводилась бы однократно внутрь в самом раннем возрасте и не вызывала бы побочных явлений.
1. По характеру антигена.
Бактериальные вакцины
Вирусные вакцины
2.По способам приготовления.
Живые вакцины
Инактивированные вакцины (убитые, неживые)
Молекулярные (анатоксины)
Генно-инженерные
Химические
3. По наличию полного или неполного набора антигенов.
Корпускулярные
Компонентные
4. По способности вырабатывать невосприимчивость к одному или нескольким возбудителям.
Моновакцины
Ассоциированные вакцины.
Живые вакцины – препараты в которых в качестве действующего начала используются:
Аттенуированные, т.е. ослабленные (потерявшие свою патогенность) штаммы микроорганизмов;
Так называемые дивергентные штаммы непатогенных микроорганизмов, имеющих родственные антигены с антигенами патогенных микроорганизмов;
Рекомбинантные штаммы микроорганизмов, полученные генно-инженерным способом (векторные вакцины).
Иммунизация живой вакциной приводит к развитию вакцинального процесса, протекающего у большинства привитых без видимых клинических проявлений. Основное достоинство этого типа вакцин – полностью сохраненный набор антигенов возбудителя, что обеспечивает развитие длительной невосприимчивости даже после однократной иммунизации. Однако есть и ряд недостатков. Главный – риск развития манифестной инфекции в результате снижения аттенуации вакцинного штамма (напр., живая полиомиелитная вакцина в редких случаях может вызвать полиомиелит вплоть до развития поражения спинного мозга и паралича).
Аттенуированные вакцины изготавливают из микроорганизмов с пониженной патогенностью, но выраженной иммуногенностью. Введение их в организм имитирует инфекционный процесс.
Дивергентные вакцины – в качестве вакцинных штаммов используются микроорганизмы, находящиеся в близком родстве с возбудителями инфекционных заболеваний. Антигены таких микроорганизмов индуцируют иммунный ответ, перекрестно направленный против антигенов возбудителя.
Рекомбинантные (векторные) вакцины – создаются на основе использования непатогенных микроорганизмов со встроенными в них генами специфических антигенов патогенных микроорганизмов. В результате этого введенный в организм живой непатогенный рекомбинантный штамм вырабатывает антиген патогенного микроорганизма, обеспечивающий формирование специфического иммунитета. Т.о. рекомбинантный штамм выполняет роль вектора (проводника) специфического антигена. В качестве векторов используют, например, ДНК-содержащий вирус осповакцины, непатогенные сальмонеллы, в геном которых введены гены HBs – антигена вируса гепатита В, антигены вируса клещевого энцефалита и др.
|
Бактериальные вакцины |
Наименование вакцины |
Штамм | |
|
Туберкулезная, БЦЖ (из микобактерий бычьего типа) |
Атт., Див. |
А.Кальмет, К.Герен |
|
|
Чумная, EV |
Г.Жирар, Ж.Робик |
||
|
Туляремийная |
Б.Я.Эльберт, Н.А.Гайский |
||
|
Сибиреязвенная, СТИ |
Л.А.Тамарин, Р.А.Салтыков |
||
|
Бруцеллезная |
П.А.Вершилова |
||
|
Ку-лихорадки, М-44 |
В.А.Гениг, П.Ф.Здродовский |
||
|
Вирусные вакцины |
Оспенная (вирус оспы коров) |
Э.Дженнер |
|
|
А.А.Смородинцев, М.П.Чумаков |
|||
|
Желтой лихорадки | |||
|
Гриппозная |
В.М.Жданов |
||
|
Паротитная |
А.А.Смородинцев, Н.С.Клячко |
||
|
Венесуэльского энцефаломиелита |
В.А.Андреев, А.А.Воробьев |
||
|
Полиомиелитная |
А.Сэбин, М.П.Чумаков, А.А.Смородинцев |
Примечание: Атт. – аттенуированная, Див. – дивергентная.
Инактивированные вакцины – приготовлены из убитых микробных тел либо метаболитов, а также отдельных антигенов, полученных биосинтетическим или химическим путем. Эти вакцины проявляют меньшую (по сравнению с живыми) иммуногенность, что ведет к необходимости многократной иммунизации, однако они лишены балластных веществ, что уменьшает частоту побочных эффектов.
Корпускулярные (цельноклеточные, цельновирионные) вакцины – содержат полный набор антигенов, приготовлены из убитых вирулентных микроорганизмов (бактерий или вирусов) путем термической обработки, либо воздействием химических агентов (формалин, ацетон). Напр., противочумная (бактериальная), антирабическая (вирусная).
Компонентные (субъединичные)вакцины – состоят из отдельных антигенных компонентов, способных обеспечить развитие иммунного ответа. Для выделения таких иммуногенных компонентов используют различные физико-химические методы, поэтому их ещё называют химические вакцины. Напр., субъединичные вакцины против пневмококков (на основе полисахаридов капсул), брюшного тифа (на основе О-, Н-, Vi - антигенов), сибирской язвы (полисахариды и полипептиды капсул), гриппа (вирусные нейраминидаза и гемагглютинин). Для придания этим вакцинам более высокой иммуногенности их сочетают с адъювантами (сорбируют на гидроксиде аллюминия).
Генно-инженерные вакцины содержат антигены возбудителей, полученные с использованием методов генной инженерии, и включают только высокоиммуногенные компоненты, способствующие формированию иммунного ответа.
Пути создания генно-инженерных вакцин:
1. Внесение генов вирулентности в авирулентные или слабовирулентные микроорганизмы (см. векторные вакцины).
2. Внесение генов вирулентности в неродственные микроорганизмы с последующим выделением антигенов и их использованием в качестве иммуногена. Напр., для иммунопрофилактики гепатита В предложена вакцина, представляющая собой HBsAg вируса. Его получают из дрожжевых клеток, в которые введен вирусный ген (в форме плазмиды), кодирующий синтез HBsAg. Препарат очищают от дрожжевых белков и используют для иммунизации.
3. Искусственное удаление генов вирулентности и использование модифицированных организмов в виде корпускулярных вакцин. Селективное удаление генов вирулентности открывает широкие перспективы для получения стойко аттенуированных штаммов шигелл, токсигенных кишечных палочек, возбудителей брюшного тифа, холеры и др. бактерий. Возникает возможность для создания поливалентных вакцин для профилактики кишечных инфекций.
Молекулярные вакцины – это препараты в которых антиген представлен метаболитами патогенных микроорганизмов, чаще всего молекулярных бактериальных экзотоксинов – анатоксинов.
Анатоксины – токсины обезвреженные формальдегидом (0,4%) при 37-40 ºС в течение 4 нед., полностью утратившие токсичность, но сохранившие антигенность и иммуногенность токсинов и используемые для профилактики токсинемических инфекций (дифтерии, столбняка, ботулизма, газовой гангрены, стафилококковых инфекций и др.). Обычный источник токсинов –промышленно култивируемые естественные штаммы-продуценты. Анатоксины выпускаю в форме моно- (дифтерийный, столбнячный, стафилококковый) и ассоциированных (дифтерийно-столбнячный, ботулинический трианатоксин) препаратов.
Конъюгированные вакцины – комплексы бактериальных полисахаридов и токсинов (напр., сочетание антигенов Haemophilus influenzae и дифтерийного анатоксина). Принимаются попытки создать смешанные бесклеточные вакцины, включающие анатоксины и некоторые другие факторы патогенности, напр., адгезины (напр., ацеллюлярная коклюшно-дифтерийно-столбнячная вакцина).
Моновакцины – вакцины применяемые для создания невосприимчивости к одному возбудителю (моновалентные препараты).
Ассоциированные препараты – для одномоментного создания множественной невосприимчивости, в этих препаратах совмещаются антигены нескольких микроорганизмов (как правило убитых). Наиболее часто применяются: адсорбированная коклюшно-дифтерийно-столбнячная вакцина (АКДС-вакцина), тетравакцина (вакцина против брюшного тифа, паратифов А и В, столбнячный анатоксин), АДС-вакцина (дифтерийно-столбнячный анатоксин).
Методы введения вакцин.
Вакцинные препараты вводят внутрь, подкожно, внутрикожно, парентерально, интраназально и ингаляционно. Способ введения определяют свойства препарата. Живые вакцины можно вводить накожно (скарификацией), интраназально или перорально; анатоксины вводят подкожно, а неживые корпускулярные вакцины – парентерально.
Внутримышечно вводят (после тщательного перемешивания) сорбированные вакцины (АКДС, АДС, АДС-М, ВГВ, ИПВ). Верхний наружный квадрант ягодичной мышцы использоваться не должен, так как у 5% детей там проходит нервный ствол, а ягодицы грудничка бедны мышцами, так что вакцина может попасть в жировую клетчатку (риск медленно рассасывающейся гранулемы). Место инъекции - передненаружная область бедра (латеральная часть четырехглавой мышцы) или, у детей старше 5-7 лет, дельтовидная мышца. Игла вводится отвесно (под углом 90°). После укола следует оттянуть поршень шприца и вводить вакцину только при отсутствии крови, в противном случае следует повторить укол. Перед инъекцией собирают мышцу двумя пальцами в складку, увеличив расстояние до надкостницы. На бедре толщина подкожного слоя у ребёнка до возраста 18 месяцев - 8 мм (макс. 12 мм), а толщина мышцы - 9 мм (макс. 12 мм), так что достаточно иглы длиной 22-25 мм. Другой метод - у детей с толстой жировой прослойкой - растянуть кожу над местом инъекции, сократив толщину подкожного слоя; при этом глубина введения иглы меньше (до 16 мм). На руке толщина жирового слоя всего 5-7 мм, а толщина мышцы - 6-7 мм. У больных гемофилией внутримышечное введение осуществляют в мышцы предплечья, подкожное - в тыл кисти или стопы, где легко прижать инъекционный канал. Подкожно вводят несорбированные - живые и полисахаридные - вакцины: в подлопаточную область, в наружную поверхность плеча (на границе верхней и средней трети) или в передненаружную область бедра. Внутрикожное введение (БЦЖ) проводят в наружную поверхность плеча, реакция Манту - в сгибательную поверхность предплечья. ОПВ вводят в рот, в случае срыгивания ребенком дозы вакцины ему дают повторную дозу, если он срыгнет и ее, - вакцинацию откладывают.
Наблюдение за привитыми длится 30 минут, когда теоретически возможна анафилактическая реакция. Следует информировать родителей о возможных реакциях, требующих обращения к врачу. Ребенок наблюдается патронажной сестрой первые 3 дня после введения инактивированной вакцины, на 5-6-й и 10-11-й день - после введения живых вакцин. Сведения о проведенной вакцинации заносят в учетные формы, прививочные журналы и в Сертификат профилактических прививок.
По степени необходимости выделяют: плановую (обязательную) вакцинацию, которая проводится в соответствии с календарем прививок и вакцинацию по эпидемиологическим показаниям, которая проводится для срочного создания иммунитета у лиц, подвергшихся риску развития инфекции.
КАЛЕНДАРЬ ПРОФИЛАКТИЧЕСКИХ ПРИВИВОК В УКРАИНЕ
(Приказ МЗ Украины №48 от 03.02.2006)
Прививки по возрасту
|
Возраст |
Вакцинация от: |
Примечания |
|
Гепатит В | ||
|
Туберкулеза | ||
|
Гепатит В | ||
|
Дифтерии, Коклюша, Столбняка Полиомиелита (ИПВ) Гемофильной инфекции |
Детям с высоким риском развития поствакцинальных осложнений вакциной АаКДС |
|
|
Дифтерии, Коклюша, Столбняка Полиомиелита (ОПВ) Гемофильной инфекции |
Детям с высоким риском развития поствакцинальных осложнений вакциной АаКДС |
|
|
Гепатит В | ||
|
Кори, Краснухи,Паротита | ||
|
Дифтерии, Коклюша, Столбняка вакциной АаКДС Полиомиелита (ОПВ) Гемофильной инфекции | ||
|
Дифтерии, Столбняка Полиомиелита (ОПВ) Кори, Краснухи, Паротита | ||
|
Туберкулеза | ||
|
Дифтерии, Столбняка Полиомиелита (ОПВ) Туберкулеза | ||
|
Краснухи (девочки), Паротита (мальчики) | ||
|
Дифтерии, Столбняка | ||
|
Взрослые |
Дифтерии, Столбняка |
Прививки для профилактики туберкулеза не проводят в один день с другими прививками. Недопустимо комбинировать в один день прививки для профилактики туберкулеза с другими парентеральными манипуляциями. Ревакцинации против туберкулеза подлежат дети в возрасте 7 и 14 лет с негативным результатом пробы Манту. Ревакцинация проводится вакциной БЦЖ.
Вакцинации для профилактики гепатита В подлежат все новорожденные, вакцинация проводится моновалентной вакциной (Энжерикс В). Если мать новорожденного HBsAg «–» (негативна), что документально подтверждено, можно начать вакцинацию ребенка в течение первых месяцев жизни или объединить с прививками против коклюша, дифтерии, столбняка, полиомиелита (Инфанрикс ИПВ, Инфанрикс пента). В случае комбинации иммунизации с прививками против коклюша, дифтерии, столбняка и полиомиелита, рекомендуются схемы: 3-4-5-18 мес жизни или 3-4-9 мес. жизни. Если мать новорожденного HBsAg «+» (позитивна), ребенка прививают по схеме (первые сутки жизни) - 1-6 мес. Первая доза вводится в первые 12 часов жизни ребенка независимо от массы тела. Вместе с вакцинацией, но не позже 1-ой недели жизни, в другую часть тела необходимо ввести специфичный иммуноглобулин против гепатита В из расчета 40 МЕ/кг массы тела, но не менее 100 МЕ. Если у матери новорожденного с HBsAg неопределен HBsAg статус, прививки ребенку проводят обязательно в первые 12 часов жизни с одновременным исследованием статуса матери по HBsAg. В случае получения позитивного результата у матери, профилактику гепатита В проводят также как в случае прививки новорожденного ребенка от HBsAg «+» матери.
Интервал между первой и второй, второй и третьей вакцинацией АКДС вакциной составляет 30 дней. Интервал между третьей и четвертой вакцинацией должен составлять не менее 12 мес. Первая ревакцинация в 18 месяцев проводится вакциной с ацеллюлярным коклюшным компонентом (далее - АаКДС) (Инфанрикс). АаКДС используется для дальнейшей вакцинации детей, которые имели поствакцинальные осложнения на предыдущие прививки АКДС, а также для проведения всех вакцинаций детям с высоким риском возникновения поствакцинальных осложнений по итогам вакцинальной комисии или детского иммунолога. Для профилактики дифтерии, столбняка, коклюша, полиомиелита, гепатита В и инфекций вызванных бактериями Haemophilus influenze типа b (далее - Hib) можно использовать комбинированные вакцины (с разными вариантами комбинаций антигенов), которые зарегистрированы в Украине (Инфанрикс гекса).
Инактивированная вакцина для профилактики полиомиелита (далее ИПВ) применяется для первых двух вакцинаций, а в случае противопоказаний к введению оральной полиомиелитной вакцины (далее - ОПВ) - для всех последующих вакцинаций согласно календаря вакцинаций (Полиорикс, Инфанрикс ИПВ, Инфанрикс пента, Инфанрикс гекса). После вакцинации ОПВ предлагается ограничить инъекции, парентеральные вмешательства, плановые операции в течение 40 дней, исключить контакт с больными и ВИЧ-инфицированными.
Вакцинация для профилактики Hib-инфекции, может проводиться моновакцинами и комбинированными вакцинами которые содержат Hib-компонент (Хиберикс). В случае использования Hib-вакцины и АКДС разных производителей, вакцины вводятся в различные части тела. Желательно использовать комбинированные вакцины с Hib-компонентом для первичной вакцинации (Инфанрикс гекса).
Вакцинация для профилактики кори, эпидемического паротита и краснухи проводится комбинированной вакциной (далее - КПК) в возрасте 12 мес (Приорикс). Повторную вакцинацию для профилактики кори, паротита и краснухи проводят детям в возрасте 6 лет. Детям, которые не были вакцинированы против кори, паротита и краснухи в возрасте 12 мес и в 6 лет, вакцинацию можно провести в любом возрасте до 18 лет. В таком случае ребенок должен получить 2 дозы с минимальным интервалом. Детям в возрасте 15 лет, которые получили 1 или 2 вакцинацию против кори, но не были вакцинированы против эпидемического паротита и краснухи и не болели этими инфекциями, проводится плановая вакцинация против эпидемического паротита (мальчики) или против краснухи (девочки). Лица старше 18 лет, которые не были ранее вакцинированы против этих инфекций, могут быть вакцинированы одной дозой согласно эпидемическим показаниям в любом возрасте до 30 лет. Перенесенные заболевания корью, эпидемическим паротитом или краснухой не является противопоказанием к вакцинации тривакциной.
Открытие метода вакцинации дало старт новой эре борьбы с болезнями.
В состав прививочного материала входят убитые или сильно ослабленные микроорганизмы либо их компоненты (части). Они служат своеобразным муляжом, обучающим иммунную систему давать правильный ответ инфекционным атакам. Вещества, входящие в состав вакцины (прививки), не способны вызвать полноценное заболевание, но могут дать возможность иммунитету запомнить характерные признаки микробов и при встрече с настоящим возбудителем быстро его определить и уничтожить.
Производство вакцин получило массовые масштабы в начале ХХ века, после того как фармацевты научились обезвреживать токсины бактерий. Процесс ослабления потенциальных возбудителей инфекций получил название аттенуации.
Сегодня медицина располагает более, чем 100 видами вакцин от десятков инфекций.
Препараты для иммунизации по основным характеристикам делятся на три основных класса.
- Живые вакцины. Защищают от полиомиелита, кори, краснухи, гриппа, эпидемического паротита, ветряной оспы, туберкулеза, ротавирусной инфекции. Основу препарата составляют ослабленные микроорганизмы - возбудители болезней. Их сил недостаточно для развития значительного недомогания у пациента, но хватает, чтобы выработать адекватный иммунный ответ.
- Инактивированные вакцины. Прививки против гриппа, брюшного тифа, клещевого энцефалита, бешенства, гепатита А, менингококковой инфекции и др. В составе мертвые (убитые) бактерии или их фрагменты.
- Анатоксины (токсоиды). Особым образом обработанные токсины бактерий. На их основе делают прививочный материал от коклюша, столбняка, дифтерии.
В последние годы появился еще один вид вакцин - молекулярные. Материалом для них становятся рекомбинантные белки или их фрагменты, синтезированные в лабораториях путем применения методов генной инженерии (рекомбининтная вакцина против вирусного гепатита В).
Схемы изготовления некоторых видов вакцин
Живые бактериальные
Схема подходит для вакцины БЦЖ, БЦЖ-М.
Живые противовирусные

Схема подходит для производства вакцин от гриппа, ротавируса, герпеса I и II степеней, краснухи, ветряной оспы.
Субстратами для выращивания вирусных штаммов при производстве вакцин могут становиться:
- куриные эмбрионы;
- перепелиные эмбриональные фибробласты;
- первичные клеточные культуры (куриные эмбриональные фибробласты, клетки почек сирийских хомячков);
- перевиваемые клеточные культуры (MDCK, Vero, MRC-5, BHK, 293).
Первичный сырьевой материал очищают от клеточного дебриса в центрифугах и с помощью сложных фильтров.
Инактивированные антибактериальные вакцины

- Культивация и очистка штаммов бактерий.
- Инактивация биомассы.
- Для расщепленных вакцин клетки микробов дезинтегрируют и осаждают антигены с последующим их хроматографическим выделением.
- Для конъюгированных вакцин полученные при предыдущей обработке антигены (как правило, полисахаридные) сближают с белком-носителем (конъюгация).
Инактивированные противовирусные вакцины

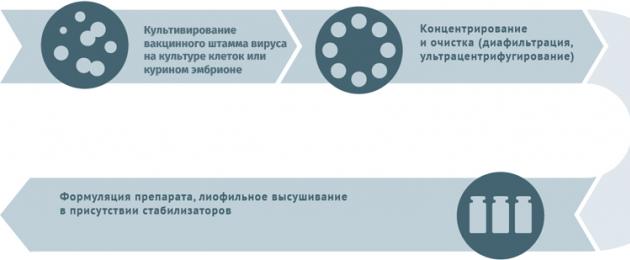
- Субстратами для выращивания вирусных штаммов при производстве вакцин могут становиться куриные эмбрионы, перепелиные эмбриональные фибробласты, первичные клеточные культуры (куриные эмбриональные фибробласты, клетки почек сирийских хомячков), перевиваемые клеточные культуры (MDCK, Vero, MRC-5, BHK, 293). Первичная очистка для удаления клеточного дебриса проводится методами ультрацентрифугирования и диафильтрации.
- Для инактивации используются ультрафиолет, формалин, бета-пропиолактон.
- В случае приготовления расщепленных или субъединичных вакцин полупродукт подвергают действию детергента с целью разрушить вирусные частицы, а затем выделяют специфические антигены тонкой хроматографией.
- Человеческий сывороточный альбумин применяется для стабилизации полученного вещества.
- Криопротекторы (в лиофилизатах): сахароза, поливинилпирролидон, желатин.
Схема подходит для производства прививочного материала против гепатита А, желтой лихорадки, бешенства, гриппа, полиомиелита, клещевого и японского энцефалитов.
Анатоксины

Для дезактивации вредного воздействия токсинов используют методы:
- химический (обработка спиртом, ацетоном или формальдегидом);
- физический (подогрев).
Схема подходит для производства вакцин против столбняка и дифтерии.
По данным Всемирной Организации Здравоохранения (ВОЗ), на долю инфекционных заболеваний приходится 25 % от общего количества смертей на планете ежегодно. То есть инфекции до сих пор остаются в списке главных причин, обрывающих жизнь человека.
Одним из факторов, способствующих распространению инфекционных и вирусных заболеваний, являются миграция потоков населения и туризм. Перемещение человеческих масс по планете влияет на уровень здоровья нации даже в таких высокоразвитых странах, как США, ОАЭ и государства Евросоюза.
По материалам: «Наука и жизнь» № 3, 2006, «Вакцины: от Дженнера и Пастера до наших дней», академик РАМН В. В. Зверев, директор НИИ вакцин и сывороток им. И. И. Мечникова РАМН.
Задать вопрос специалисту
Вопрос экспертам вакцинопрофилактики
Вопросы и ответы
Вакцина "Менюгейт" зарегистрирована в России? С какого возраста разрешена к применению?
Да, зарегистрирована, вакцина – от менингококка С, сейчас также есть вакцина конъюгированная, но уже против 4 типов менингококков – А, С, Y, W135 – Менактра. Прививки проводят с 9 мес.жизни.
Муж транспортировал вакцину РотаТек в другой город.Покупая ее в аптеке мужу посоветовали купить охлаждающий контейнер,и перед поездкой его заморозить в морозильной камере,потом привязать вакцину и так ее транспортировать. Время в пути заняло 5 часов. Можно ли вводить такую вакцину ребенку? Мне кажется,что если привязать вакцину к замороженному контейнеру, то вакцина замерзнет!
Отвечает Харит Сусанна Михайловна
Вы абсолютно правы, если в контейнере был лед. Но если там была смесь воды и льда- вакцина не должна замерзать. Однако живые вакцины, к которым относится ротавирусная, не увеличивают реактогенность при температуре менее 0, в отличие от неживых, а, например, для живой полиомиелитной допускается замораживание до -20 град С.
Моему сыну сейчас 7 месяцев.
В 3 месяца у него случился отек Квинке на молочную смесь Малютка.
Прививку от гепатита сделали в роддоме, вторую в два месяца и третью вчера в семь месяцев. Реакция нормальная, даже без температуры.
Но вот на прививку АКДС нам устно дали медотвод.
Я за прививки!! И хочу сделать прививку АКДС. Но хочу сделать ИНФАНРИКС ГЕКСА. Живем в Крыму!!! В крыму ее нигде нет. Посоветуйте как поступить в такой ситуации. Может есть зарубежный аналог? Бесплатную делать категорически не хочу. Хочу качественную очищеную, что бы как монжно меньше риска!!!
В Инфанрикс Гекса содержится компонент против гепатита В. Ребенок полностью привит против гепатита. Поэтому в качестве зарубежного аналога АКДС можно сделать вакцину Пентаксим. Кроме того, следует сказать, что отек Квинке на молочную смесь не является противопоказанием к вакцине АКДС.
Подскажите, пожалуйста, на ком и как тестируют вакцины?
Отвечает Полибин Роман Владимирович
Как и все лекарственные препараты вакцины проходят доклинические исследования (в лаборатории, на животных), а затем клинические на добровольцах (на взрослых, а далее на подростках, детях с разрешения и согласия их родителей). Прежде чем разрешить применение в национальном календаре прививок исследования проводят на большом числе добровольцев, например вакцина против ротавирусной инфекции испытывалась почти на 70 000 в разных странах мира.
Почему на сайте не представлен состав вакцин? Почему до сих пор проводится ежегодная реакция Манту (зачастую не информативна), а не делается анализ по крови, например, квантифероновый тест? Как можно утверждать реакции иммунитета на введенную вакцину, если еще ни кому не известно в принципе, что такое иммунитет и как он работает, особенно если рассматривать каждого отдельно взятого человека?
Отвечает Полибин Роман Владимирович
Состав вакцин изложен в инструкциях к препаратам.
Реакция Манту. По Приказу № 109 «О совершенствовании противотуберкулезных мероприятий в Российской Федерациии» и Санитарным правилам СП 3.1.2.3114-13 "Профилактика туберкулеза", несмотря на наличие новых тестов, детям необходимо ежегодно делать реакцию Манту, но так как этот тест может давать ложноположительные результаты, то при подозрении на тубинфицирование и активную туберкулезную инфекцию проводят Диаскин-тест. Диаскин-тест является высоко чувствительным (эффективным) для выявления активной туберкулезной инфекции (когда идет размножение микобактерий). Однако полностью перейти на Диаскин-тест и не делать реакцию Манту фтизиатры не рекомендуют, так как, он не "улавливает" раннее инфицирование, а это важно, особенно для детей, поскольку профилактика развития локальных форм туберкулеза эффективна именно в раннем периоде инфицирования. Кроме того, инфицирование микобактерией туберкулеза необходимо определять для решения вопроса о ревакцинации БЦЖ. К сожалению, нет ни одного теста, который бы со 100% точностью ответил на вопрос, есть инфицирование микобактерией или заболевание. Квантифероновый тест также выявляет только активные формы туберкулеза. Поэтому при подозрении на инфицирование или заболевание (положительная реакция Манту, контакт с больным, наличие жалоб и пр.) используются комплексные методы (диаскин-тест, квантифероновый тест, рентгенография и др.).
Что касается «иммунитета и как он работает», в настоящее время иммунология - это высокоразвитая наука и многое, в частности, что касается процессов на фоне вакцинации – открыто и хорошо изучено.
Ребёнку 1 год и 8 месяцев, все прививки ставились в соответствии с календарем прививок. В том числе 3 пентаксима и ревакцинация в полтора года тоже пентаксим. В 20 месяцев надо ставить от полиомиелита. Очень всегда переживаю и отношусь тщательно к выбору нужных прививок, вот и сейчас перерыла весь интернет, но так и не могу решить. Мы ставили всегда инъекцию (в пентаксиме). А теперь говорят капли. Но капли-живая вакцина, я боюсь различных побочек и считаю, что лучше перестраховаться. Но вот читала, что капли от полиомиелита вырабатывают больше антител, в том числе и в желудке, то есть более эффективные, чем инъекция. Я запуталась. Поясните, инъекция менее эффективна (имовакс-полио, например)? Отчего ведутся такие разговоры? У каплей боюсь хоть и минимальный, но риск осложнения в виде болезни.
Отвечает Полибин Роман Владимирович
В настоящее время Национальный календарь прививок России предполагает комбинированную схему вакцинации против полиомиелита, т.е. только 2 первых введения инактивированной вакциной и остальные – оральной полиовакциной. Это связано с тем, чтобы полностью исключить риск развития вакциноассоциированного полиомиелита, который возможен только на первое и в минимальном проценте случаев на второе введение. Соответственно, при наличии 2-х и более прививок от полиомиелита инактивированной вакциной, осложнения на живую полиовакцину исключены. Действительно, считалось и признается некоторыми специалистами, что оральная вакцина имеет преимущества, так как формирует местный иммунитет на слизистых кишечника в отличие от ИПВ. Однако сейчас стало известно, что инактивированная вакцина в меньшей степени, но также формирует местный иммунитет. Кроме того, 5 введений вакцины против полиомиелита как оральной живой, так и инактивированной вне зависимости от уровня местного иммунитета на слизистых оболочках кишечника, полностью защищают ребенка от паралитических форм полиомиелита. В связи с вышесказанным вашему ребенку необходимо сделать пятую прививку ОПВ или ИПВ.
Следует также сказать, что на сегодняшний день идет реализация глобального плана Всемирной организации здравоохранения по ликвидации полиомиелита в мире, которая предполагает полный переход всех стран к 2019 году на инактивированную вакцину.
В нашей стране уже очень долгая история использования многих вакцин – ведутся ли долгосрочные исследования их безопасности и можно ли ознакомиться с результатами воздействия вакцин на поколения людей?
Отвечает Шамшева Ольга Васильевна
За прошлый век продолжительность жизни людей возросла на 30 лет, из них 25 дополнительных лет жизни люди получили за счет вакцинации. Больше людей выживают, они живут дольше и качественнее за счет того, что снизилось инвалидность из-за инфекционных заболеваний. Это общий ответ на то, как влияют вакцины на поколения людей.
На сайте Всемирной Организации Здравоохранения (ВОЗ) есть обширный фактический материал о благотворном влиянии вакцинации на здоровье отдельных людей и человечества в целом. Отмечу, что вакцинация –это не система верований, это - область деятельности, опирающаяся на систему научных фактов и данных.
На основании чего мы можем судить о безопасности вакцинации? Во-первых, ведется учет и регистрация побочных действий и нежелательных явлений и выяснение их причинно-следственной связи с применением вакцин (фармаконадзор). Во-вторых, важную роль в отслеживании нежелательных реакций играют постмаркетинговые исследования (возможного отсроченного неблагоприятного действия вакцин на организм), которые проводят компании - владельцы регистрационных свидетельств. И, наконец, проводится оценка эпидемиологической, клинической и социально-экономической эффективности вакцинации в ходе эпидемиологических исследований.
Что качается фармаконадзора, то у нас в России система фармаконадзора только формируется, но демонстрирует очень высокие темпы развития. Только за 5 лет число зарегистрированных сообщений о нежелательных реакциях на лекарственные средства в подсистему «Фармаконадзор» АИС Росздравнадзора выросло в 159 раз. 17 033 жалобы в 2013 году против 107 в 2008. Для сравнения – в США в год обрабатываются данные около 1 млн случаев. Система фармаконадзора позволяет отслеживать безопасность препаратов, накапливаются статистические данные, на основании которых может измениться инструкция по медицинскому применению препарата, препарат может быть отозван с рынка и т.п. Таким образом, обеспечивается безопасность пациентов.
И по закону «Об обращении лекарственных средств» от 2010 года врачи обязаны сообщать федеральным органам контроля обо всех случаях побочного действия лекарственных средств.
Оглавление темы "Иммунодефициты. Вакцины. Сыворотки. Иммуноглобулины.":Вакцины. Виды антигенов вакцин. Классификация вакцин. Виды вакцин. Живые вакцины. Ослабленные (аттенуированные) вакцины. Дивергентные вакцины.
Вакцины - иммунобиологические препараты, предназначенные для активной иммунопрофилактики, то есть для создания активной специфической невосприимчивости организма к конкретному возбудителю. Вакцинация признана ВОЗ идеальным методом профилактики инфекционных заболеваний человека. Высокая эффективность, простота, возможность широкого охвата вакцинируемых лиц с целью массового предупреждения заболевания вывели активную иммунопрофилактику в большинстве стран мира в разряд государственных приоритетов. Комплекс мероприятий по вакцинации включает отбор лиц, подлежащих вакцинации, выбор вакцинного препарата и определение схемы его использования, а также (при необходимости) контроль эффективности, купирование возможных патологических реакций и осложнений. В качестве Аг в вакцинных препаратах выступают:
Цельные микробные тела (живые или убитые);
отдельные Аг микроорганизмов (наиболее часто протективные Аг);
токсины микроорганизмов;
искусственно созданные Аг микроорганизмов;
Аг, полученные методами генной инженерии.
Большинство вакцин разделяют на живые, инактивированные (убитые, неживые), молекулярные (анатоксины) генно инженерные и химические; по наличию полного или неполного набора Аг - на корпускулярные и компонентные, а по способности вырабатывать невосприимчивость к одному или нескольким возбудителям - на моно- и ассоциированные.
Живые вакцины
Живые вакцины - препараты из аттенуированных (ослабленных) либо генетически изменённых патогенных микроорганизмов, а также близкородственных микробов, способных индуцировать невосприимчивость к патогенному виду (в последнем случае речь идёт о так называемых дивергентных вакцинах). Поскольку все живые вакцины содержат микробные тела, то их относят к группе корпускулярных вакцинных препаратов.
Иммунизация живой вакциной приводит к развитию вакцинального процесса, протекающего у большинства привитых без видимых клинических проявлений. Основное достоинство живых вакцин- полностью сохранённый набор Аг возбудителя, что обеспечивает развитие длительной невосприимчивости даже после однократной иммунизации. Живые вакцины обладают и рядом недостатков. Наиболее характерный - риск развития манифестной инфекции в результате снижения аттенуации вакцинного штамма. Подобные явления более типичны для противовирусных вакцин (например, живая полиомиелитная вакцина в редких случаях может вызвать полиомиелит вплоть до развития поражения спинного мозга и паралича).
Ослабленные (аттенуированные) вакцины
Ослабленные (аттенуированные ) вакцины изготавливают из микроорганизмов с пониженной патогенностью, но выраженной иммуногенностью. Введение вакцинного штамма в организм имитирует инфекционный процесс: микроорганизм размножается, вызывая развитие иммунных реакций. Наиболее известны вакцины для профилактики сибирской язвы, бруцеллёза, Ку-лихорадки, брюшного тифа. Однако большая часть живых вакцин - противовирусные. Наиболее известны вакцина против возбудителя жёлтой лихорадки, противополи-омиелитная вакцина Сэйбина, вакцины против гриппа, кори, краснухи, паротита и аденовирусных инфекций.
Дивергентные вакцины
В качестве вакцинных штаммов используют микроорганизмы, находящиеся в близком родстве с возбудителями инфекционных болезней. Аг таких микроорганизмов индуцируют иммунный ответ, перекрёстно направленный на Аг возбудителя. Наиболее известны и длительно применяются вакцина против натуральной оспы (из вируса коровьей оспы) и БЦЖ для профилактики туберкулёза (из микобактерий бычьего туберкулёза).