يظل النظام خارج الهرمي واحدًا من أقل أنظمة الدماغ التي تمت دراستها من وجهة نظر علم الأعصاب الأساسي والسريري. نشأ هذا الوضع بسبب عدد من العوامل الموضوعية: تعقيد البنية التشريحية، والاتصالات العصبية العديدة مع أجزاء مختلفة من الجهاز العصبي ووجود عدد كبير من الخلايا العصبية البينية، وهو نظام وظيفي متعدد المستويات يوجد فيه عدد كبير من الخلايا العصبية. تشارك الناقلات العصبية المختلفة، والصعوبات في المختبر والتشخيص الآلي للمتلازمات السريرية.
نظام خارج الهرميهو نظام تشريحي ووظيفي يشمل العقد القاعدية (حسب بعض الباحثين، تصنف العقد القاعدية على أنها أعلى مراكز الجهاز خارج الهرمي)، وجزء من المادة الرمادية للدماغ المتوسط والدماغ البيني، والعديد من الوصلات لهذه الهياكل مع أجزاء مختلفة من الدماغ والحبل الشوكي. تم اقتراح مصطلح "الجهاز خارج الهرمي" لأول مرة من قبل ويلسون (1912) بعد وصفه للتنكس الكبدي العدي.
تشمل العقد القاعدية مجموعة من النوى الموجودة في قاعدة نصفي الكرة المخية والدماغ المتوسط والدماغ البيني (الشكل 1):
I. النواة المذنبة (النواة المذنبة).
ثانيا. نواة عدسية الشكل (nucleus lentiformis)، تتكون من:
- من القشرة (بوتامين)؛
- الكرة الشاحبة (الكرة الشاحبة).
ثالثا. المادة السوداء (المادة السوداء).
رابعا. النواة تحت المهاد (النواة تحت المهاد).
الوصف التفصيلي للعقد القاعدية ينتمي إلى V.M. Bekhterev، الذي قام بدمج النواة المذنبة والبطامة في الجسم المخطط الحديث، أو الجسم المخطط (التكوينات الأحدث من حيث التطور الوراثي)، عرّف الكرة الشاحبة بأنها باليوسترياتوم، أو الشاحبة. لقد ثبت الآن أن وظيفة الجسم المخطط تتحدد إلى حد كبير من خلال تركيبه الخلوي. تشير التقديرات إلى أن الجسم المخطط للإنسان يحتوي على حوالي 110 مليون خلية عصبية صغيرة لا لونية وحوالي 670 ألف خلية عصبية كبيرة متعددة الأقطاب. يتم تمثيل 95% من الخلايا الجسمية بواسطة خلايا عصبية شوكية متوسطة الحجم، وهي عبارة عن خلايا عصبية إسقاطية. يتم تصنيف الخلايا العصبية المتبقية على أنها عصبونات داخلية (interneurons).
ينتهي التدفق الكامل للمعلومات الواردة التي تدخل المجمع الستريوباليدال في الجسم المخطط. يتلقى نبضات من الهياكل التالية:
1) معظم مناطق القشرة الدماغية.
2) النوى داخل الصفائح المركزية للمهاد.
3) الجزء المضغوط من المادة السوداء ونواة أخرى من المنطقة السقيفية البطنية للدماغ المتوسط.
4) نواة رافي الدماغ المتوسط.
5) البقعة الزرقاء.
من الجسم المخطط، تتدفق المعلومات إلى الكرة الشاحبة والجزء الشبكي من المادة السوداء، والتي تبدأ منها المسارات الرئيسية الصادرة للعقد القاعدية إلى المناطق الحركية للمهاد، وهي نواة التكوين الشبكي للدماغ المتوسط، بشكل رئيسي إلى نواة pedunculopontine، وهي رابط النقل لتأثير العقد القاعدية على الآليات الحركية في العمود الفقري.
من الأهمية بمكان في فهم عمل العقد القاعدية، أن دورها في تنظيم الوظائف الحركية وتطور اضطرابات الحركة يرتبط بدراسة تنظيم الناقلات العصبية الخاصة بها. لقد ثبت أن النشاط الوظيفي للنظام الستريوباليدال يتم تحديده من خلال التفاعل المعقد بين أنظمة الناقلات العصبية المختلفة. حاليًا، تمت دراسة وظيفة الناقلات العصبية التالية بشكل كامل: الغلوتامات، الأسبارتات، حمض غاما أمينوبوتيريك، النورإبينفرين، السيروتونين، الأدرينالين، الدوبامين، المادة P.
يتم تبادل المعلومات بين القشرة والعقد القاعدية من خلال الدوائر القشرية تحت القشرية. حاليًا، هناك خمس دوائر معروفة، اثنتان منها تشارك في تنظيم الحركات (الحركية الحسية والحركية للعين)، وثلاثة تشارك في تنظيم الوظائف المعرفية وردود الفعل السلوكية (الفص الجبهي الظهري الجانبي، المداري الأمامي الجانبي، الحزامي الأمامي). في مرض باركنسون، تلعب أمراض هذه المسارات غير الحركية دورًا في تكوين الاضطرابات العقلية.
لعبت الدور الرئيسي في تشكيل الاضطرابات الحركية في أمراض الجهاز خارج الهرمي عن طريق أمراض مسار الدوبامين nigrostriatal. يؤدي انحطاط هذا المسار في مرض باركنسون إلى انخفاض حاد في تخليق وإطلاق الدوبامين من أطرافه في الجسم المخطط. يعتمد عمل مسار الدوبامين nigrostriatal على نشاط مستقبلات الدوبامين. حاليًا، هناك مجموعتان كبيرتان منها: مستقبلات D1 وD2.
هناك نوعان آخران من أنظمة الدوبامين الصاعدة: المسارات المتوسطة والقشرية المتوسطة. يربط المسار الوسطي الحوفي الدماغ المتوسط بتكوينات الدماغ الأمامي الأقدم من الناحية التطورية وينتهي في المنطقة البطنية من الجسم المخطط والقشرة الأمامية. ويعتقد أن الوظيفة الأساسية لهذا المسار هي المشاركة في التحكم في المزاج والسلوك. لوحظ نقص الدوبامين في المسار الوسطي الحوفي في مرض باركنسون، وهو ما قد يفسر الاضطرابات العاطفية (الاكتئاب في المقام الأول) وغيرها من الاضطرابات العقلية الشائعة في هذا المرض. بالإضافة إلى ذلك، هناك معلومات حول مشاركة المسار الوسطي الطرفي في التحكم في بداية الفعل الحركي وردود الفعل العاطفية الحركية. لذلك، قد يكون خللها الوظيفي مهمًا في تطور تعذر الحركة الأولي.
يمتد مسار الدوبامين القشري المتوسط من الدماغ المتوسط إلى مناطق الفص الجبهي والحزامية والشمية في القشرة الدماغية. من المفترض أن تنشيطه قد يرتبط بتأثير مثبط على النشاط السلوكي. يُعتقد أن أمراض هذا المسار، جنبًا إلى جنب مع أمراض المسار القشري المتوسط، قد تكون مهمة في تكوين الاضطرابات العقلية في مرض باركنسون.
من الضروري الخوض في مزيد من التفاصيل حول العلاقة بين الجسم المخطط والكرة الشاحبة. يتم تنفيذه من خلال مسارين عصبيين. أحدهما مستقيم، ويربط البطامة والنواة المذنبة بالجزء الداخلي من الكرة الشاحبة والجزء الشبكي من المادة السوداء. يتم تنظيم وظيفتها في الغالب بواسطة مستقبلات D1. أما المسار الآخر فهو غير مباشر: يصل إلى الجزء الداخلي من الكرة الشاحبة والجزء الشبكي من المادة السوداء، ويتجه أولاً إلى الجزء الخارجي من الكرة الشاحبة، ومن ثم إلى النواة تحت المهاد، ولا يصل إلى هدفه الأصلي إلا بعد ذلك. . يتم تنظيم المسار غير المباشر بشكل أساسي بواسطة مستقبلات D2.
يؤدي تنشيط المسار المباشر إلى تحفيز المناطق الحركية في القشرة الدماغية وتسهيل تكوين الحركات، بينما يضعف المسار غير المباشر التأثيرات المهادية القشرية المثيرة ويسبب نقص الحركة والصلابة. يسهل الدوبامين توصيل النبضات على طول المسار المباشر وله تأثير مثبط على المسار غير المباشر. في ظل ظروف نقص الدوبامين (مرض باركنسون)، ينخفض النشاط الوظيفي للمسار المباشر ويزداد نشاط المسار غير المباشر. ويصاحب ذلك تثبيط التوصيل على طول المسار المهادي القشري وتعطيل النشاط الوظيفي للقشرة الحركية الإضافية.
مرض الشلل الرعاش(PD) هو مرض دماغي مزمن وتقدمي مع انحطاط الخلايا العصبية السوداوية المخططية وخلل في العقد القاعدية. تم وصف المرض لأول مرة من قبل طبيب الأعصاب الإنجليزي جيمس باركنسون في عام 1817 وأسماه “الشلل الرعاش”. في عام 1877، وصف طبيب الأعصاب شاركو المظاهر السريرية للمرض بمزيد من التفصيل واقترح تسميته بمرض باركنسون. يعد مرض باركنسون أحد أكثر أشكال أمراض التنكس العصبي المزمنة الأولية شيوعًا. وفقًا للمفاهيم الحديثة، يعد PD، أو الباركنسونية الأولية مجهولة السبب، اضطرابًا تنكسًا عصبيًا متعدد الأنظمة متقطعًا وعائليًا مع تعدد الأشكال السريري وتقلب المسار، وعدم التجانس المسبب للأمراض والمورفولوجية، مع تأثير جيد للعلاج الدوبامين فيما يتعلق باضطرابات الحركة الباركنسونية الكلاسيكية.
معدل انتشار مرض باركنسون مرتفع جدًا ويتراوح من 67 إلى 350 حالة لكل 100 ألف نسمة. وتم تسجيل أعلى معدل انتشار في الولايات المتحدة الأمريكية – 107-329 حالة لكل 100 ألف نسمة، والأدنى بين الدول الأوروبية – في السويد – 76 حالة. وفي أوكرانيا، يبلغ معدل الانتشار حوالي 133 حالة لكل 100 ألف نسمة، على الرغم من أن الأرقام الفعلية تبدو أعلى من ذلك بكثير. للمرض بنية واضحة تعتمد على العمر: كلما زاد عمر السكان، زاد انتشار المرض. وهكذا، بعد سن 65 عاما، يعاني 1٪ من السكان؛ وبعد سن 80 عاما، يحدث المرض في 3-4٪ من السكان. في أغلب الأحيان، يتم تسجيل الأعراض الأولى للمرض في سن 42-52 سنة. يجب التأكيد على أنه على الرغم من الأفكار التقليدية حول طبيعة مرض باركنسون التي تعتمد على العمر، فإن حالات الإصابة في سن أصغر لم تكن شائعة منذ فترة طويلة: يُعتقد أن كل عشر مريض تقريبًا يصاب بمرض باركنسون قبل سن الخمسين، و كل عشرين - قبل 40 سنة . في هذا الصدد، هناك حتى مجموعة فرعية منفصلة - بداية مرض باركنسون المبكر، والتي تتميز بعدد من ميزات آليات تطور المرض، فضلا عن الصورة السريرية والدورة، والاستجابة للأدوية المضادة للباركنسون، والتشخيص . حاليًا، هناك حوالي 5-6 مليون شخص مصاب بداء باركنسون في العالم. كما أن معدل الإصابة لكل 100 ألف نسمة له اتجاه مختلف اعتمادًا على البلد الذي أجريت فيه الدراسة. وسجلت أعلى نسبة إصابة في جزر فارو – 21.1، والأدنى – في ليبيا – 4.5 لكل 100 ألف نسمة. يصاب الرجال والنساء بالمرض بنفس التردد تقريبًا، مع غلبة طفيفة لدى الرجال، على الرغم من أن النساء في اليابان يمرضن بمعدل 1.5 مرة أكثر.
فقط في بداية القرن الحادي والعشرين، أتاح التقدم في تطوير علم الوراثة الجزيئية والبيولوجيا الجزيئية إلقاء الضوء على الأساس الجيني لمسببات مرض باركنسون. تم تحديد عدد من الجينات المسببة للأشكال الوراثية من مرض باركنسون الأولي في الحالات العائلية. وفقًا للمفاهيم الحديثة، فإن ما بين 5 إلى 10% من جميع حالات مرض باركنسون لها أساس أحادي المنشأ مباشر. أما الحالات المتبقية فهي متفرقة ولها طبيعة متعددة البؤر. في تطور الشكل المتقطع لمرض باركنسون، يلعب تفاعل العوامل الوراثية والبيئية دورًا حاسمًا، والذي يحدد في النهاية خصائص إزالة السموم الخلوية والتمثيل الغذائي للأجانب الحيوية، والحماية من مضادات الأكسدة، ومعالجة عدد من البروتينات العصبية، وطبيعة الدوبامين. الاسْتِقْلاب. لقد أتاح اكتشاف الروابط الجزيئية الرئيسية للتنكس الأسود المخططي التوصل إلى فهم للتسلسل الكيميائي الحيوي المرضي في مرض باركنسون.
حاليًا، تم تحديد أكثر من 15 جينًا من الأشكال الوراثية لمرض باركنسون الأولي. الأكثر دراسة وذات أهمية رائدة هي 6 متغيرات وراثية:
1. PARK1 (سينوكلين). يلعب بروتين ألفا سينوكلين دورًا مهمًا في النقل الحويصلي المتشابك وتخزين الناقلات العصبية. تؤدي الطفرات (الوراثية أو الناتجة عن التعرض لعوامل سمية عصبية خارجية) في جين ألفا سينوكلين إلى تغيرات في بنية البروتين وتراكمه في الخلية العصبية وتجمعه مع تكوين أجسام ليوي. حاليًا، يعتبر السينوكلين بمثابة علامة جزيئية رئيسية لعلم الأمراض العصبية وتعديل عمليات التنكس العصبي من النوع الشلل الرعاش.
2. باركن 2 (باركن). تعد الطفرات في جين باركن سببًا شائعًا لمرض باركنسون المبكر، بما في ذلك الأحداث، (ما يصل إلى 50٪ من الأشكال العائلية وحوالي 15٪ من الحالات المتفرقة). باركين هو إنزيم بروتين يوبيكويتين E3، وتتمثل مهمته في توصيل بروتينات غير طبيعية إلى المركب البروتيني من أجل التحلل اللاحق.
3. بارك 6 (بينكي). شكل من أشكال الباركنسونية المتنحية يمثل تطور ما يصل إلى 9٪ من حالات البداية المبكرة للمرض. بروتين PINKI هو بروتين كيناز الميتوكوندريا ويلعب دورًا مهمًا في التكاثر الحيوي للميتوكوندريا.
4. PARK7 (DJ-I). شكل نادر من الباركنسونية الجسدية المتنحية - 1-2% من الحالات المبكرة لمرض باركنسون. يلعب بروتين DJ-I دورًا مهمًا في الحفاظ على سلامة وبقاء الخلايا العصبية الدوبامينية.
5. بارك 8 (LRRK2). يرتبط الجين بشكل جسمي سائد من مرض باركنسون مع نفاذية تصل إلى 40٪. يتمتع جين LRRK2 بأهمية كبيرة في تطور الحالات المتفرقة من مرض باركنسون الأولي: بدءًا من مرض باركنسون المتأخر النموذجي مع أجسام ليوي إلى المتغيرات غير النمطية من أمراض السينوكلين وتاو. المنتج البروتيني للجين هو الداردارين، وهو تنشيطه المرضي هو نتيجة طفرة سائدة في جين LRRK2 ويؤدي إلى تطور التغيرات التنكسية العصبية.
6. جين GBA. يشفر إنزيم الجلوكوزيربروسيداز الليزوزومي. يمكن أن تكون الطفرات في هذا الجين مصحوبة بتطور أنواع مختلفة من اعتلالات Synucleinopathy - PD الكلاسيكي والخرف مع أجسام ليوي.
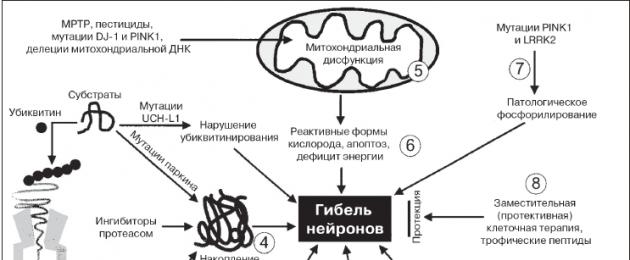
في العديد من النواحي، تظل الآلية المرضية لمرض باركنسون غير معروفة ولا تزال بحاجة إلى الدراسة. ومن الجدير بالذكر الاكتشافات الهامة التي غيرت أفكارنا حول طبيعة مرض باركنسون. من بينها وصف لتدهور الخلايا الكبيرة المحتوية على الميلاتونين في المادة السوداء، التي ينتمي إليها العالم الروسي ك.ب. تريتياكوف (1919)، تحديد نقص الدوبامين في العقد القاعدية (H. Ehringer، O. Hornykiewicz، 1960). بعد تلخيص مواد المؤلفين المختلفين حول دراسة انحطاط الخلايا العصبية الزنجية المخططية، ج.ن. كريزانوفسكي وآخرون. (1995) اضطرابات التمثيل الغذائي داخل الخلايا التي تساهم في حدوث التنكس العصبي:
— اضطراب التنفس الميتوكوندريا والأضرار التي لحقت الميتوكوندريا.
— نقص الطاقة في الخلايا العصبية.
- زيادة أكسدة الجذور الحرة مع تكوين بيروكسيدات عدوانية.
— التراكم المفرط لأيونات الكالسيوم الحرة.
- انتهاك لعملية التمثيل الغذائي للأجانب الحيوية.
كانت أهم مرحلة في فهم الآلية المرضية لمرض باركنسون هي التقدم الهائل الذي تم تحقيقه في دراسة العوامل الوراثية في تطور المرض، مما أدى إلى تطور عملية التنكس العصبي (الشكل 2). لقد ثبت أن الآليات الجزيئية لـ PD تعتمد على انتهاك نظام التحكم في التولد الحيوي والتنظيم المكاني والتنكس الحيوي للبروتينات العصبية. يلعب السينوكلين دورًا رئيسيًا، حيث يمثل تجمعه المرضي على شكل هياكل ليفية المرحلة الأولى من تكوين أجسام ليوي. في الوقت نفسه، فإن الأشكال قليلة القسيم المتوسطة من السينوكلين لها أكبر سمية عصبية، في حين أن تكوين الألياف الناضجة، وخاصة أجسام ليوي، هو رد فعل وقائي للخلية يهدف إلى تحييد قليلات السينوكلين السامة. يتم تحقيق السمية العصبية من خلال آليات مختلفة: تحفيز تفاعلات الجذور الحرة، وتعطيل التدفق الإندوبلازمي، وتنشيط كينازات بروتين الإجهاد وعمليات موت الخلايا المبرمج، وتنشيط الخلايا الدبقية الصغيرة، وتعطيل تفاعل ألفا سينوكلين مع البروتينات الشريكة الطبيعية. والنتيجة النهائية لهذه العمليات هي تطور وتطور عمليات التنكس العصبي مع انخفاض إنتاج الدوبامين. كما ذكر أعلاه، يؤدي هذا إلى خلل في الخلايا العصبية للعقد القاعدية، وفي المقام الأول التثبيط والنشاط المفرط للخلايا العصبية في الجزء الداخلي من الكرة الشاحبة، الجزء الشبكي من المادة السوداء، ويؤدي إلى تثبيط الخلايا العصبية القشرية المهادية وعجز في تنشيط الخلايا العصبية. الخلايا العصبية في القشرة الحركية الإضافية، والتي ترتبط بتطور المظاهر الحركية الرئيسية لمرض باركنسون. بالإضافة إلى الخلايا العصبية الدوبامينية في المادة السوداء، تتعرض مجموعات أخرى من الخلايا العصبية إلى انحطاط في مرض باركنسون، بما في ذلك الخلايا العصبية في النواة الظهرية للعصب المبهم، والخلايا العصبية في البصلة الشمية، والخلايا العصبية النورأدرينالية في الموضع الأزرق، والخلايا العصبية السيروتونينية في نواة الرفاء، الخلايا العصبية الكولينية في نواة ماينرت، وكذلك الخلايا العصبية في القشرة الدماغية وبعض الضفائر اللاإرادية. ولهذا السبب، بالإضافة إلى نقص الدوبامين، يحدث خلل في أنظمة هرمون السيروتونين والنورأدرينالين والكولين. ترتبط المظاهر غير الحركية للمرض بأضرار في الهياكل الخارجية.

المظاهر السريرية لـ PD
أساس الصورة السريرية لمرض باركنسون هو الثالوث الكلاسيكي: تعذر الحركة (نقص الحركة)، وصلابة العضلات، ورعاش الراحة. في مرحلة لاحقة من المرض، يظهر العرض الرابع - عدم الاستقرار الوضعي. يمكن أن يبدأ المرض بكل عرض من الأعراض الثلاثة المشار إليها، ثم تضاف إليها الأعراض الأخرى فيما بعد. في بعض الحالات، قد تتكون بداية مرض باركنسون من عرضين أو حتى ثلاثة أعراض في وقت واحد.
تكينسيا (نقص الحركة)يمثل انخفاضًا في النشاط الحركي التلقائي. يعد تعذر الحركة الحقيقي (الافتقار التام للحركة) نادرًا جدًا، خاصة في المراحل النهائية من مرض باركنسون. في المراحل الأولية، لوحظ البطء (بطء الحركة) وفقر الحركات التطوعية (قلة الحركة).
هناك أربعة مكونات لحالة تعذر الحركة (A. Barbeau, 1984):
1) انتهاك المبادرة الحركية؛
2) انتهاك "اللحن" الحركي.
3) انتهاك استراتيجية التعلم الحركي.
4) الإرهاق السريع عند أداء المهام المتكررة مع التوهين التدريجي للنشاط الحركي.
سريريًا، يتم اكتشاف نقص الحركة من خلال عدد من الحركات الإرادية:
- يتجمد المريض في أوضاع مختلفة، يشبه في بعض الأحيان عارضة أزياء؛
- تنشأ صعوبات عند بدء الحركة وتغيير وضع الجسم (إذا كان نقص الحركة واضحًا بدرجة كافية، فقد يقوم المريض بعدة محاولات قبل القيام بالحركة)؛
- يتطور نقص التمثيل الغذائي، ولا يوجد تلوين عاطفي على الوجه، ونادرا ما يومض المريض (أعراض ماري)؛
- يصبح الكلام هادئا، رتيبا، معدلا بشكل سيء، يتلاشى تدريجيا بسبب هزات الحبال الصوتية، يمكن أن يكتسب الكلام شخصية "مرتجفة"؛
- تطور اضطرابات النطق (خلل النطق) هو سمة في الحالات الشديدة، ويصبح الكلام همسًا. يقوم بعض المرضى، بناءً على وجود أو عدم وجود اضطرابات النطق، بتنظيم جرعة الأدوية التي تحتوي على الليفادو بشكل مستقل؛
- أثناء المشي لا توجد حركات مترافقة (حركية عصبية)، مع الباركنسونية النصفية - من جانب واحد.
وفقا لآلية التطور، يميز بعض الباحثين تعذر الحركة الأولي والثانوي. يحدث تعذر الحركة الثانوي بسبب الصلابة ويرتبط بالتدهور الأولي للخلايا العصبية في الجزء البطني من المادة السوداء بارس كومباكتا. يتطور تعذر الحركة الأولي لاحقًا، في المتوسط بعد 5 سنوات من ظهور المرض، ويرتبط بموت الخلايا العصبية في الطبقة الظهرية والنواة الوسطى للمادة السوداء (إمداد الدوبامين بمسار الدوبامين الميزوليمبي). ويرافقه تعذر الحركة الحركية النفسية والاكتئاب وتشكيل الضعف الإدراكي. مع تطور تعذر الحركة الأولي، تنخفض فعالية أدوية ليفودوبا.
للكشف المبكر عن نقص الحركة، يمكن استخدام الاختبارات التالية:
— اختبار فورنييه: يُطلب من المريض أداء سلسلة من الحركات في أسرع وقت ممكن: الوقوف، والجلوس، والالتفاف، والانحناء، وما إلى ذلك. بالفعل في المراحل المبكرة من نقص الحركة، عند إجراء الاختبار، يمكنك ملاحظة بطء الحركات؛
- اختبار النقر بالإبهام والسبابة: يقوم المريض، بأقصى سرعة ممكنة وبأقصى سعة، بالنقر على الطاولة بالإبهام والسبابة بالتناوب بكلتا يديه. الاختبار مفيد بشكل خاص في تطوير مرض الشلل الرعاش - في هذه الحالة، تتخلف يد واحدة عن الوتيرة والسعة؛
- اختبار الضغط على اليد وفتحها: يُطلب من المريض قبض اليد وفتحها في أسرع وقت ممكن (تتأخر اليد الموجودة على الجانب المصاب بقصور الحركة).
الأعراض التالية هي صلابة (ارتفاع ضغط الدم العضلي)- يمثل زيادة بلاستيكية في قوة العضلات وله الميزات التالية:
- تتميز بزيادة في قوة العضلات بالفعل في المرحلة الأولية للحركة وتستمر حتى نهاية الحركة، بسبب التقلص المتزامن للعضلات المناهضة والناهضة. وتزداد درجة الصلابة من حركة إلى أخرى. يتم تعريف صلابة العضلات الموصوفة على أنها فرط توتر العضلات البلاستيكية، أو صلابة خارج الهرمية؛
- ظاهرة الزنجي - أحد أعراض "العجلة المسننة": الشعور بالتقطع، ومقاومة العضلات خطوة بخطوة على خلفية فرط التوتر البلاستيكي؛
- أعراض "وسادة الهواء": بعد رفع رأس المريض فوق الوسادة يبقى على هذا الوضع لبعض الوقت؛
- وضعية "الطالب": بسبب زيادة قوة العضلات، يتم خفض الرأس، وثني الذراعين والساقين عند مفاصل الكوع والركبة؛
- أعراض ديليف: قوة المقاومة السلبية أكبر بكثير من قوة الحركات النشطة؛
- عند إجراء اختبار تأرجح الساق على شكل البندول - توقف عن التأرجح فورًا بعد الانتهاء من الاختبار.
للتعرف على التيبس في المراحل الأولى من المرض، عندما يكون خفيفاً، يمكن استخدام الاختبارات التالية:
— مناورة نويك جانيف: عندما يقوم الطبيب بإجراء حركات ثني وتمديد سلبية في مفصل الرسغ لمريض مستلقي، يُطلب منه رفع الساق ببطء على جانب الدراسة - في ظل وجود نغمة بلاستيكية مخفية، يشعر الباحث زيادة في مقاومة الطرف الذي يتم اختباره؛
- أعراض فورمان: زيادة في قوة العضلات المتزايدة بشكل بلاستيكي عند فحصها في يدي مريض في وضع رومبيرج مع إغلاق عينيه.
— زيادة بلاستيكية في قوة العضلات بعد الحركات المتكررة في الطرف قيد الدراسة؛
- اختبار "هز الكتفين": يتخذ المريض وضعية عمودية، ويطلب منه الاسترخاء، ثم يضع الطبيب راحتيه على أكتاف المريض ويقوم بدورات نصف دائرية سريعة متناوبة لجسمه حول المحور الرأسي. الاختبار حساس بدرجة كافية لتقييم درجة صلابة العضلات وانخفاض ضغط الدم ويسمح للشخص بتحديد تناسق التغيرات في منشط العضلات.
الهزة (الهز).يتم تعريف طبيعتها على أنها رعشة أثناء الراحة:
— تردد الهزة هو 4-6 هرتز.
- يبدأ عادة على جانب واحد من الأجزاء البعيدة من الذراع؛
- في اليد، تخلق الحركات متعددة الاتجاهات للإبهام وأصابع اليد الأخرى صورة غريبة لـ "حبوب اللف" أو "عد العملات المعدنية"؛
- في الحالات النموذجية، يختفي رعاش الراحة أثناء الحركات الإرادية ويختفي أثناء النوم؛
— مع تقدم المرض، ينتشر الارتعاش تباعًا من اليد إلى الساعد والكتف (الرسغ والكوع ومفاصل الكتف)، وبعد ذلك قد تشارك الساق التي تحمل الاسم نفسه في هذه العملية. يمكن ملاحظة حدوث ارتعاش في الساق عندما يجلس المريض في وضعية غير مريحة؛ وتختفي الرعشة أثناء المشي؛
- في بعض الحالات، عندما تكون الرعشة معممة، تشترك عضلات الرقبة والوجه في الارتعاش، والذي يصاحبه ارتعاش الرأس والفك السفلي والشفتين واللسان.
اضطرابات الوضعية.وهي تتألف من انتهاكات الموقف والثبات والمشية. وهي ناجمة عن نقص الحركة وتصلب العضلات وخلل في نغمة الوضع وردود الفعل. يتجلى سريرياً في ما يلي:
- يواجه المريض صعوبة في الحفاظ على مركز ثقل الجسم في منطقة الدعم؛
- تحدث ظاهرة الدفع، الدفع الرجعي، الدفع اللاحق: عفوي مفاجئ أو ناتج عن دفع خارجي للانتقال إلى المشي السريع للأمام أو للخلف أو للجانب. وفي هذه الحالة يكون جسم المريض مائلاً في اتجاه الحركة وقد تتفوق على حركة الساقين، مما يصاحب سقوط المريض؛
- من أعراض "الدوس": لا يستطيع المريض، بعد أن قام من الكرسي أو السرير، أن يبدأ على الفور في التحرك، ولكنه يدوس في مكان واحد لبعض الوقت. بعد أن بدأ في التحرك، يمشي بخطوات صغيرة (ميكروباسيا)، ويجر قدميه على طول الأرض. من أجل تغيير اتجاه الحركة، يضطر المريض إلى التوقف، ويحدد الوقت لبعض الوقت ويغير الاتجاه تدريجيًا فقط ويبدأ في التحرك. عند الدوران قد يسقط المريض.
الحركية المتناقضة.في بعض الأحيان، على خلفية نقص الحركة، تحدث الحلقات عندما يتمكن المريض فجأة من أداء سلسلة من الحركات المعقدة السريعة (الركض بعد الترولي باص، والرقص). يحدث هذا عادة في حالة من العاطفة أو على خلفية التجارب العاطفية، وفي كثير من الأحيان على خلفية المشاعر الإيجابية. يتم بعد ذلك استبدال فترة الحركة المتناقضة مرة أخرى بمتلازمة اللاحركية الصلبة، والتي تأخذ طابعًا أكثر وضوحًا لبعض الوقت.
من المقبول عمومًا الآن أن داء باركنسون لا يظهر سريريًا من خلال الاضطرابات الحركية فحسب، بل له نطاق كامل أيضًا المظاهر غير الحركيةوالتي تحدث لدى جميع المرضى بغض النظر عن عمر ظهور المرض ومرحلة المرض:
1) الاضطرابات العصبية النفسية:
- عاطفي؛
- ذهني؛
- مريض نفسي؛
— السلوكية.
2) اضطرابات النوم واليقظة.
3) الاضطرابات اللاإرادية.
4) الاضطرابات الحسية والألم.
5) زيادة التعب.
وتظهر معظم المظاهر غير الحركية وتزداد مع تقدم المرض، بالتوازي مع تفاقم الاضطرابات الحركية. لكن بعض المظاهر غير الحركية، مثل ضعف حاسة الشم، والإمساك، واضطرابات النوم، ومتلازمات الألم، تحدث قبل ظهور الأعراض الحركية الكلاسيكية لمرض باركنسون. في هذا الصدد، يتحدثون حاليًا عن المرحلة ما قبل السريرية، والمرحلة ما قبل الحركية لمرض باركنسون.
إن فهم آليات التطور ودور المظاهر غير الحركية في بنية PD ينعكس في مفهوم H. Braak et al. (2002)، والتي بموجبها لا تقتصر العملية التنكسية على الجزء المضغوط من المادة السوداء، ولكنها تشمل على التوالي عددًا كبيرًا من الهياكل الحركية المختلفة للدماغ. حاء براك وآخرون. حددت 6 مراحل من تطور العملية المرضية في PD (الشكل 3). تتميز المرحلة الأولى بانحطاط البصلة الشمية والنواة الشمية الأمامية، والتي يمكن أن تظهر سريريا على أنها انتهاك لحاسة الشم. تتميز المرحلة الثانية بمشاركة نوى جذع الدماغ التي تتحكم في الوظائف العاطفية اللاإرادية، ودورة النوم والاستيقاظ، وقد تظهر على شكل اضطراب سلوك النوم مع حركات العين السريعة، والاكتئاب، والإمساك. تظهر المظاهر الحركية الكلاسيكية للمرض فقط في المرحلتين الثالثة والرابعة وفقًا لـ H. Braak، والتي ترتبط بانتشار العملية التنكسية إلى المادة السوداء. في المرحلتين الخامسة والسادسة الأخيرتين، تظهر أجسام ليوي في الهياكل الحوفية والقشرة الدماغية، مما يؤدي إلى تطور الاضطرابات المعرفية والسلوكية والحركية النفسية.

جزء كبير من المظاهر غير الحركية تقاوم أدوية ليفودوبا، مما يدل على ارتباطها بخلل في الأنظمة غير الدوبامينية: النورأدرينالية، السيروتونينية، الكولينية وغيرها.
تصنيف مرض باركنسون
يعتمد التصنيف على حقيقة أن مرض باركنسون هو متلازمة متعددة الأسباب. هناك مرض باركنسون مجهول السبب (أولي)، يتضمن هيكله مرض باركنسون، ومرض باركنسون مجهول السبب النادر، الذي له أساس وراثي، ومرض باركنسون ثانوي - بسبب أي آفات أو أمراض في الجهاز العصبي المركزي (الأوعية الدموية، والصدمات النفسية، والتهاب ما بعد الدماغ، وما إلى ذلك). . مع "الباركنسونية زائد" يتم تضمين متلازمة باركنسون في بنية أمراض التنكس العصبي الأخرى وعدد من أمراض الجهاز العصبي ذات الطبيعة الوراثية (الجدول 1).

الأشكال السريرية لـ PDفي الشكل الكلاسيكي، تتوافق مع ثلاثة أعراض رئيسية: يمكن ملاحظة الأشكال المرتعشة والقاسية والحركية فقط في المرحلة الأولى من المرض. مع تقدم المرض، يتم ملاحظة مجموعة من هذه الأعراض في الصورة السريرية. اعتمادا على غلبة أعراض معينة، يتم تمييز الأشكال التالية: مختلط (رجال حركي جامد)، حركي جامد ورعاش. تم اكتشاف الشكل المختلط في 60-70٪ من حالات مرض باركنسون، والصلابة الحركية - في 15-20٪، والارتعاش - في 5-10٪ من الحالات. مع تقدم المرض، قد يتغير شكله السريري.
خلال مسار التطوير المهني، يتم تمييز مراحل التطوير. التصنيف المقبول عمومًا هو الذي اقترحه Hoehn and Yarh (1967):
— المرحلة 1. المظاهر الأحادية للمرض (الأطراف فقط)؛
- المرحلة 1.5. عملية أحادية الجانب (الأطراف ونفس الجانب من الجسم)؛
— المرحلة 2. مرض ثنائي دون عدم استقرار الوضع.
- المرحلة 2.5. المظاهر الأولية للعملية الثنائية مع العودة إلى الوضع الطبيعي عند الفحص؛
- المرحلة 3. عدم الاستقرار الوضعي المعبر عنه بشكل معتدل، والحركة المستقلة ممكنة؛
— المرحلة 4. فقدان كبير للنشاط الحركي، حيث يصبح المريض غير قادر على التحرك دون مساعدة؛
— المرحلة الخامسة. في غياب المساعدة الخارجية، يبقى المريض طريح الفراش أو مقيدًا بالكرسي المتحرك.
بالنظر إلى شدة تطور أعراض مرض باركنسون، هناك ثلاثة خيارات لمعدل تطور المرض (تخضع للعلاج المناسب):
- معدل التقدم السريع، حيث يحدث تغيير في مراحل المرض (الأولى - الثانية أو الثانية - الثالثة) خلال سنتين أو أقل؛
- معدل معتدل للتقدم، حيث يحدث تغيير في المراحل بعد أكثر من عامين، ولكن ليس أكثر من 5 سنوات؛
- بطء معدل التقدم مع تغيرات في المراحل بعد أكثر من 5 سنوات.
يتضمن التشخيص السريري لمرض باركنسون ثلاث مراحل:
1. التعرف على متلازمة خارج الهرمية.
2. توضيح بيانات المراقبة، وتحديد المتلازمات المصاحبة، والاختبارات المعملية، والتصوير العصبي (SCT، MRI، PET)، تشخيصات ليفودوبا، تشخيصات ENMG.
3. إنشاء تشخيص تصنيفي (للشلل الرعاش - تحديد درجة الخطورة باستخدام مقاييس التصنيف).
حاليًا، من أجل التشخيص السريري لمرض باركنسون، يتم استخدام معايير الاشتمال التي اقترحها بنك الدماغ التابع لجمعية مرض باركنسون في المملكة المتحدة (A. Hughes et al., 1992).
تشخيص متلازمة الباركنسونية
معايير الاشتمال لمرض باركنسون:نقص الحركة مع واحد على الأقل من الأعراض التالية:
- تصلب العضلات.
- رعشة أثناء الراحة 4-6 هرتز؛
- عدم الاستقرار الوضعي غير المرتبط بالاضطرابات البصرية أو الدهليزية أو المخيخية أو التحفيزية الأولية.
معايير الاستبعاد لمرض باركنسون:
- تاريخ من السكتات الدماغية المتكررة مع تطور تدريجي لأعراض مرض باركنسون.
- تاريخ إصابات الدماغ المؤلمة المتكررة.
- تاريخ التهاب الدماغ.
- أزمات العين.
- العلاج بمضادات الذهان في وقت ظهور الأعراض؛
- الطبيعة العائلية للمرض (أكثر من قريب مصاب بمرض مماثل)؛
- وجود مغفرة طويلة الأمد.
- أعراض أحادية الجانب بشكل صارم لأكثر من 3 سنوات؛
- شلل النظرة إلى الأسفل؛
— الفشل اللاإرادي المبكر سريع التقدم؛
- علامات المخيخ.
— الخرف المبكر مع ضعف الذاكرة، والكلام، والتطبيق العملي؛
- أعراض بابنسكي.
- وجود ضمور المخيخ أو استسقاء الرأس التواصلي على التصوير المقطعي.
- عدم الاستجابة لجرعات عالية من ليفودوبا (باستثناء سوء الامتصاص)؛
- ملامسة المواد السامة التي تسبب مرض باركنسون.
المعايير التي تؤكد تشخيص مرض باركنسون (ثلاثة على الأقل):
- بداية من جانب واحد؛
- رعاش الراحة.
- دورة تقدمية؛
- استمرار عدم تناسق الأعراض مع غلبة الجانب المصاب في البداية؛
- فعالية عالية لأدوية الليفودوبا (تقليل الأعراض بنسبة 70-100%).
- خلل الحركة المشيمية الشديد الناجم عن ليفودوبا.
- الحفاظ على الاستجابة لليفودوبا لمدة 5 سنوات أو أكثر.
- مدة المرض 10 سنوات أو أكثر.
مرض باركنسون الناجم عن المخدراتهو أحد أكثر أشكال مرض باركنسون الثانوي شيوعًا ويمثل 4 إلى 10٪ من جميع حالات المرض. غالبًا ما يرتبط هذا المرض باستخدام الأدوية المضادة للذهان (الشلل الرعاش المضاد للذهان)، لذلك يكون معدل انتشاره أعلى بين المرضى في عيادات الطب النفسي ومؤسسات الطب النفسي الخارجية.
وفي حالات أقل شيوعًا، يحدث تطور مرض باركنسون الناجم عن الأدوية بسبب أدوية أخرى:
- منبهات مستقبلات الدوبامين الأخرى (ميتوكلوبراميد، ديبرازين، فلوناريزين، سيناريزين).
- الأدوية التي تقلل من دوران الدوبامين في المشابك العصبية (ميثيل دوبا).
- الحالة الودية المركزية، مما يؤدي إلى استنفاد إمدادات الدوبامين في النهايات العصبية (ريسيربين، تيترابينازين)؛
- عوامل هرمون السيروتونين التي تمنع نشاط الخلايا العصبية الدوبامينية في المادة السوداء.
يحدث مرض باركنسون المضاد للذهان في 10-15% من المرضى الذين يتناولون مضادات الذهان. تعتمد احتمالية الإصابة بالشلل الرعاش على قدرة الدواء على التسبب في انسداد مستقبلات D2. لوحظ التأثير الجانبي الأكثر شيوعًا عند تناول مضادات الذهان غير الانتقائية (هالوبيريدول، أمينازين، تريفتازين). وفقا للتصوير المقطعي بالإصدار البوزيتروني، تظهر أعراض مرض باركنسون عندما يتم حظر ما لا يقل عن 80٪ من مستقبلات D2. غالبًا ما تحدث عند الأشخاص الذين تزيد أعمارهم عن 40 عامًا، عند النساء - مرتين أكثر. يزيد وجود تلف عضوي في الدماغ من احتمالية الإصابة بمرض باركنسون المضاد للذهان. تظهر أعراض مرض باركنسون بعد عدة أيام أو أسابيع من بدء تناول الدواء. جرعات كبيرة من مضادات الذهان، زيادة حادة في الجرعة أو الانسحاب من مصحح مضادات الكولين تثير تطور مرض الشلل الرعاش. تتضمن الصورة السريرية لمرض باركنسون المضاد للذهان أعراضًا ليست مميزة لمرض باركنسون: أزمات عينية، فرط الحركة الفموية، ضزز، صعر، أزمات opisthotonus. في كثير من الأحيان، تتطور الأعراض على كلا الجانبين. بعد التوقف عن تناول الدواء، تتراجع الأعراض، عادة خلال بضعة أسابيع. في بعض الحالات، وخاصة في المرضى الأكبر سنا، قد تستمر الأعراض لسنوات.
باركنسونية الأوعية الدموية.شكل من أشكال الباركنسونية الثانوية، والذي يتميز بأعلى نسبة من الإفراط في التشخيص. وفقا للدراسات المورفولوجية التي أجريت في المراكز المتخصصة، فإن معدل الإصابة بالباركنسونية الوعائية لا تتجاوز 6-8% من جميع حالات الباركنسونية.
الأسباب التي تسبب تطور مرض باركنسون الأوعية الدموية هي ما يلي:
1. تلف الشرايين الدماغية الصغيرة:
- اعتلال الأوعية الدقيقة الناتج عن ارتفاع ضغط الدم (داء الهيالين الشحمي) ؛
- اعتلال الأوعية الدقيقة الشيخوخي (تصلب الشرايين الشيخوخي، تعرج الشرايين الشيخوخي)؛
- التهاب الأوعية الدموية واعتلال الأوعية الدموية (التهاب الشرايين العقدي، التهاب الأوعية الدموية في الجهاز العصبي المركزي، مرض الذئبة الحمراء).
- اعتلال الشرايين الوراثي.
2. تلف الشرايين الدماغية الكبيرة:
- تصلب الشرايين في الشرايين الكبيرة (خارج وداخل الجمجمة)؛
- الزهري السحائي الوعائي.
3. آفات الدماغ القلبية:
- الانسداد القلبي.
- اعتلال الدماغ بنقص التأكسج (نخر العقد القاعدية).
4. أمراض أخرى:
— التشوهات الشريانية الوريدية.
- متلازمة الفوسفوليبيد؛
- اعتلال التخثر.
التغيرات المورفولوجية في مادة الدماغ المكتشفة في مرض باركنسونية الأوعية الدموية أثناء تصوير الأعصاب هي كما يلي:
1) احتشاءات جوبية متعددة في العقد القاعدية وجذع الدماغ والأجزاء العميقة من المادة البيضاء.
2) آفات منتشرة في المادة البيضاء:
- داء الكريات البيضاء المتكدسة تحت القشرية أو المتكدسة جزئيا.
- انتشار داء الكريات البيض حول البطينات على نطاق واسع مع ملامح غير متساوية، وينتشر إلى المنطقة تحت القشرية.
3) احتشاءات تحت القشرية الإقليمية في العقد القاعدية والمادة البيضاء المجاورة؛
4) الاحتشاءات الإقليمية الثنائية (في كثير من الأحيان من جانب واحد) للفص الجبهي.
5) احتشاءات أحادية وثنائية في منطقة المهاد.
6) البؤر النزفية في العقد القاعدية، الدماغ المتوسط، المهاد.
7) ضمور الدماغ مع توسع الجهاز البطيني والأخاديد القشرية.
يتميز هذا النوع من الشلل الرعاش الثانوي بوجود صلابة بلاستيكية، والتي يتم دمجها مع عناصر التشنج الهرمي والآفة السائدة في الأطراف السفلية. تشمل السمات المميزة متلازمة عدم الحركة الصلبة المتناظرة، واضطرابات المشية غير المنتظمة، والبداية المبكرة لعدم الاستقرار الوضعي. الرعاش نادر للغاية وليس له طابع باركنسوني نموذجي. غالبًا ما يتطور الشلل البصلي الكاذب مع أعراض عسر التلفظ وعسر البلع والعواطف العنيفة. الاختلافات المميزة في ردود الفعل الوترية، ووجود ردود الفعل المرضية، واضطرابات المخيخ. تتطور الاضطرابات المعرفية بسرعة كبيرة. لا يوجد أي تأثير من مستحضرات L-dopa. ومع ذلك، تجدر الإشارة إلى أن الجرعات الصغيرة من هذه الأدوية في بعض الأحيان تجلب الراحة للمرضى، وهو ما قد يكون بسبب قصور خارج الهرمي الذي يتطور مع تقدم العمر.
يمكن اختزال جميع المظاهر السريرية المتنوعة لمرض باركنسونية الأوعية الدموية في ثلاثة خيارات مميزة:
1. مع بداية متناظرة على شكل متلازمة جامدة حركية، أكثر وضوحًا في الأطراف السفلية، تظهر لأول مرة مع ضعف المشي. لا يوجد أي ارتعاش ولا تأثير لأدوية L-dopa. تتميز بالتطور التدريجي على خلفية القصور الوعائي الدماغي التدريجي.
2. تتميز بمزيج من الشلل الرعاش مع الاضطرابات الهرمية والمخيخية والبصلية الكاذبة والضعف الإدراكي والاضطرابات الحركية للعين.
3. الباركنسونية الوعائية المصحوبة بمتلازمة الجامد الحركي الأحادي، ورعاش الراحة، وأحيانًا مع الاستجابة الإيجابية لأدوية L-dopa. يحدث البديل عندما تحدث آفة الأوعية الدموية في الدماغ المتوسط، في منطقة المادة السوداء.
للتمييز بين مرض باركنسون الوعائي ومرض باركنسون، من الضروري استخدام طرق التصوير العصبي (التصوير بالرنين المغناطيسي، PET).
باركنسونية ما بعد الصدمة.غالبًا ما يتطور مع إصابات الدماغ المؤلمة الشديدة (TBI) أو بعد تكرار الإصابة الدماغية المؤلمة الخفيفة. بعد الإصابة الدماغية الرضية الشديدة، تتطور متلازمة باركنسون في حالة حدوث ضرر مؤلم مباشر للعقد تحت القشرية أو تلف منتشر للمحاور العصبية في الأجزاء العميقة من نصفي الكرة المخية بسبب تسارع الدوران في وقت الإصابة. في هذه الحالة، يتطور مرض باركنسون في حوالي 1٪ من الحالات ويتميز بنقص الحركة، ونقص الصوت، وعدم استقرار الوضع، وهو ليس تقدميًا. يكشف التصوير العصبي غالبًا عن تغيرات هيكلية في العقد تحت القشرية.
يمكن أن تؤدي إصابات الدماغ الرضية الخفيفة المتكررة والمتكررة، خاصة عند الأشخاص المشاركين في الرياضات التي تتطلب الاحتكاك الجسدي (الملاكمة وفنون الدفاع عن النفس)، إلى تطور اعتلال دماغ الملاكم. ويشمل أعراض الاضطرابات خارج الهرمية، والتي عادة ما تكون متناظرة، وكذلك الاضطرابات الهرمية، والمخيخية، والاضطرابات البصلية الكاذبة، وتطور الاضطرابات المعرفية. ويعتقد أن سبب هذا النوع من الشلل الرعاش الثانوي هو ضرر طفيف في منطقة السويقات الدماغية، مما يؤدي إلى اضطرابات محور عصبي في الجهاز nigrostriatal.
مرض باركنسون ما بعد العدوى.تم وصفه لأول مرة في عام 1918 من قبل ك. فون إيكونومو بعد إصابته بالتهاب الدماغ الخامل. واعتبرت العدوى الفيروسية (فيروس orthomyxovirus، فيروس الأنفلونزا) كعامل مسبب للمرض. ومع ذلك، لم تجد الدراسات الحمض النووي الريبوزي لفيروس الأنفلونزا في المادة الدماغية للأشخاص الذين ماتوا بسبب التهاب الدماغ الخامل. يشير هذا إلى طبيعة المناعة الذاتية للمرض، وهو ما أكده باحثون من المملكة المتحدة في عام 2003، حيث وجدوا أجسامًا مضادة لمستضدات العقد القاعدية في دم 95٪ من المرضى الذين يعانون من حالات متفرقة من التهاب الدماغ الخمول.
تتطور الصورة السريرية للمرض بشكل حاد، بدءًا من ارتفاع درجة حرارة الجسم، وألم عضلي، وأعراض دماغية. بالإضافة إلى ظاهرة الشلل الرعاش، هناك أعراض محددة: فرط النوم الشديد، أزمات العين، الاضطرابات الحركية للعين، هجمات الذهول أو الحركة المتناقضة، خلل التوتر العضلي، الرمع العضلي، العلامات الهرمية. تسود ظاهرة الرعشة على الصلابة. الاضطرابات اللاإرادية مميزة: زيادة دهون الجلد والشعر، فرط اللعاب، فرط التعرق، واضطرابات حركية مختلفة. يمكن أن يكون مسار المرض ثابتًا أو مع تقدم بطيء مع زيادة بطء الحركة والصلابة واضطرابات الوضع. في بعض الأحيان يتطور الخرف.
في الوقت الحالي، يتم ملاحظة مرض باركنسون بعد التهاب الدماغ نتيجة للعدوى التالية:
- الفيروس المعوي (كوكساكي من النوع ب، الفيروس المتعدد)؛
- الفيروسات المفصلية (التهاب الدماغ الياباني الذي ينقله القراد) ؛
— فيروسات النكاف.
- فيروس الحصبة؛
— فيروسات الأنفلونزا من النوع أ؛
— فيروسات الهربس البسيط.
— فيروس الحماق النطاقي.
- الزهري العصبي.
- داء اللولبيات ( بوريليا برغدورفيرية).
الباركنسونية السامة.يمكن أن يتطور بسبب التعرض للسموم الخارجية المختلفة: المنغنيز وأول أكسيد الكربون وثاني كبريتيد الكربون والثاليوم والسيانيد وكبريتيد الهيدروجين ورباعي إيثيل الرصاص وFOS والميثانول. في العقود الأخيرة، تم وصف حالات الشلل الرعاش لدى مدمني المخدرات باستخدام بدائل الهيروين التي تحتوي على 1-ميثيل-4-فينيل-1،2،3،6-رباعي هيدروبيريدين (MPTP)، والذي له قابلية عالية للخلايا العصبية في المادة السوداء. التوطين الأكثر شيوعًا للآفات في مرض باركنسون السام هو الكرة الشاحبة والمادة السوداء.
غالبًا ما يتم ملاحظة مرض باركنسون مع التسمم بالمنجنيز. يدخل المنغنيز إلى الجسم عن طريق استنشاق الغبار الذي يحتوي على تركيزات عالية منه، مع الطعام، أو عن طريق الحقن (عند استخدام برمنجنات البوتاسيوم في تحضير الأدوية المخدرة). يتطور المرض تدريجياً، وهناك مراحل مبكرة ومتأخرة. في المرحلة المبكرة، على خلفية أعراض غير محددة (الصداع، والوهن، اعتلال الأعصاب)، تم الكشف عن علامات متلازمة جامدة الحركية: زيادة قوة العضلات، خلل التوتر العضلي، ورعاش الأصابع والجفون، نقص التمثيل الغذائي، فرط النوم، اللامبالاة. الاضطرابات اللاإرادية مميزة: عدم انتظام دقات القلب، انخفاض ضغط الدم الشرياني، فرط التعرق، زراق الأطراف.
في المرحلة المتأخرة من المرض، تتطور الاضطرابات الحركية الصلبة، والتي يتم دمجها مع الاضطرابات الهرمية والمخيخية (فرط المنعكسات، وردود الفعل المرضية، والهزات المتعمدة، والتحريك العضلي، وما إلى ذلك). تتفاقم اضطرابات عديد الأعصاب مع زيادة أعراض الرنح الحساس، وتتشكل تفاعلات الوهن الاكتئابي. عكس المرض ممكن فقط في مرحلة مبكرة.
في الجدول ويبين الشكل 2 تواتر أشكال مختلفة من مرض باركنسون. تجدر الإشارة إلى أن مرض باركنسون الأولي يحدث في الغالبية العظمى من الحالات ويمثل حوالي 80% من جميع حالات مرض باركنسون.

المبادئ الأساسية لعلاج PD
كما ذكر أعلاه، وفقًا لمفهوم براك وآخرين، يتميز مرض باركنسون بنوع تصاعدي من عملية التنكس العصبي: من الأجزاء الذيلية من جذع الدماغ إلى القشرة الدماغية. في الوقت نفسه، تستمر المراحل المبكرة والكامنة (السابقة للحركية) للمرض حوالي 5-8 سنوات، وبحلول الوقت الذي تظهر فيه المظاهر الكلاسيكية لمرض باركنسون، تموت معظم الخلايا العصبية في المادة السوداء. ولذلك، فإن محاولات الحماية العصبية في مرحلة لاحقة لا يمكن أن تكون ناجحة، ومهمة الطبيب هي التدخل في أقرب المراحل الممكنة من العملية المرضية.
الأهداف الرئيسية لعلاج مرضى الشلل الرعاش هي تعويض نقص الدوبامين وعواقبه (تصحيح العلاقات المضطربة بين الناقلات العصبية)، وإبطاء تطور المرض (الحفاظ على الخلايا العصبية الدوبامين وحمايتها)، وتنشيط عمليات التعافي وتحفيز الدوبامين. توليف.
لتحقيق هذه الأهداف، من الضروري الالتزام بالمبادئ التالية لعلاج PD:
- يوصف العلاج في موعد لا يتجاوز 6 أشهر من طلب المريض (فترة تحديد التشخيص الصحيح بدقة)؛
— بمجرد تشخيص مرض باركنسون، يجب على المريض تناول الأدوية المضادة للباركنسون (APDs) بشكل مستمر لبقية حياته؛
- يبدأ العلاج على شكل علاج وحيد بأحد الـ PPS؛
— الدواء المفضل يمكن أن يكون أي PPS (في حالة عدم وجود موانع)، بما في ذلك مضادات الكولين.
- يبدأ العلاج الأحادي بجرعات أقل من الحد الأدنى (يتم اختيار الجرعة المثالية تدريجيًا، على مدى 3-4 أسابيع على الأقل) ويتم تنفيذها ضمن نافذة العلاج الدوائي، مع تحديد الجرعة المفردة المثالية وتكرار الإعطاء؛
- يوصف العلاج المركب إذا كان العلاج الأحادي غير فعال بما فيه الكفاية مع إضافة جرعة ثانية من PPS بجرعة دون الحد الأدنى، تليها زيادة تدريجية في الجرعة؛
- حدوث آثار جانبية يتطلب تخفيض الجرعة أو وقف الدواء المسؤول عن التأثير الجانبي، ويتم تعويض الخسارة المحتملة لفعالية العلاج عن طريق مراجعة الجرعات وتكرار تناول أدوية أخرى؛
— يؤدي العلاج طويل الأمد لمرض باركنسون بأدوية الليفودوبا في النهاية إلى ظهور مرض مرضي سريري يتطلب تصحيحًا خاصًا.
ومن الناحية العملية اليوم، يتم استخدام 6 مجموعات رئيسية من أعضاء هيئة التدريس:
- الاستعدادات ليفودوبا.
- منبهات مستقبلات الدوبامين.
- مثبطات إنزيمات استقلاب الدوبامين - COMT وMAO-B؛
- الأمانتادين.
- مضادات الكولين المركزية.
مستحضرات ليفودوبا (L-dopa).ظهرت في الممارسة السريرية في الستينيات والسبعينيات من القرن العشرين. وقد أتاح استخدامها إمكانية تأخير فترة العجز بشكل كبير لدى المرضى الذين يعانون من مرض باركنسون. L-dopa هو السلف البيولوجي للدوبامين. تبين أن استخدام الدوبامين نفسه كعامل علاجي أمر مستحيل، لأنه لا يخترق حاجز الدم في الدماغ. ومع ذلك، هناك مشاكل في تناول L-dopa، حيث يتم تدمير معظم الدواء في الجهاز الهضمي والدم تحت تأثير DOPA decarboxylase، والذي يسبب آثارًا جانبية مثل الغثيان والقيء وانخفاض ضغط الدم الانتصابي. فقط 1% من الجرعة المُتناولة من الليفودوبا تصل إلى الخلايا العصبية السوداوية المخططية وتشارك في تخليق الدوبامين. من أجل تحييد تأثير دوبا ديكاربوكسيلاز المحيطي وتسهيل دخول ليفودوبا إلى أنسجة المخ، وتقليل شدة الآثار الجانبية المحيطية وتقليل الجرعة الإجمالية لليفودوبا المأخوذة، يتم دمجه عادةً مع مثبط دوبا ديكاربوكسيلاز محيطي (كاربيدوبا أو بنسيرازيد). ). حاليًا، لا يتم استخدام مستحضرات ليفودوبا النقية عمليًا في الممارسة السريرية. يعتبر استخدام أدوية L-dopa هو المعيار الذهبي لعلاج مرض باركنسون.
يجب أن يكون توقيت بدء العلاج بأدوية الليفودوبا فرديًا ويعتمد على معدل تطور المرض ونوع النشاط المهني وفعالية الأدوية الأخرى وعائلة المريض وحالته المعيشية. من المعتقد أنه من الأنسب وصف أدوية L-dopa عندما يؤدي مرض باركنسون إلى إعاقات حركية كبيرة لا يمكن علاجها بواسطة PPS الأخرى.
يعتمد اختيار الجرعة المثلى وتكرار تناول الدواء على الحساسية الفردية. تعتبر الجرعة الفردية المثلى هي جرعة الدواء التي يحدث فيها أقصى تصحيح ممكن لأعراض مرض باركنسون، ولكن لا تحدث أي آثار جانبية. يبدأ وصف الأدوية المحتوية على دوبا مع مثبطات دوبا ديكاربوكسيلاز بجرعات دون العتبة (الجدول 3). في بداية العلاج، يتم وصف ربع قرص 3 مرات في اليوم، ثم يتم زيادة الجرعة بمقدار ربع قرص مرة واحدة في الأسبوع. بعد كل زيادة في الجرعة، يتم تقييم فعاليتها. عادة، عند وصف دواء ليفودوبا لأول مرة، يكفي تناول نصف قرص 3 مرات في اليوم. إذا لزم الأمر، يتم زيادة الجرعة إلى قرص واحد 3 مرات في اليوم. إذا لم تنتج جرعة يومية مكونة من 4 أقراص أي تأثير، فإن الزيادات الإضافية في الجرعة تعتبر غير فعالة.

يمكنك تقييم فعالية الدواء باستخدام اختبارات بسيطة:
- اختبار كب-استلقاء اليد؛
- اختبار حركة اليد بين نقطتين تقعان على مسافة 30 سم عن بعضهما البعض؛
- اختبار الحركات السريعة للأصابع (على سبيل المثال، النقر بأصابعك على الطاولة واحدة تلو الأخرى)؛
- اختبار المشي لمسافة 7 أمتار والظهر مع دوران الجذع.
وتجدر الإشارة إلى أن الزيادة التدريجية في جرعة الدواء مع زيادة شدة المرض أمر لا مفر منه. بالإضافة إلى ذلك، مع تقدم المرض، تقل مدة تأثير الجرعة الواحدة، مما يستلزم زيادة عدد الجرعات. ومع ذلك، مع زيادة تواتر الإعطاء، تنخفض الجرعة المفردة من الدواء، مما قد يؤدي إلى حقيقة أن الجرعة المفردة قد تصبح دون العتبة وليس لها تأثير سريري. وفي هذا الصدد، يجب ألا يتجاوز تكرار تناول الدواء 4-5 مرات في اليوم.
أدى استخدام مثبطات DOPA decarboxylase إلى القضاء على الآثار الجانبية الطرفية لليفودوبا في معظم الحالات. ومع ذلك، في 60-80٪ من المرضى، بعد 3-5 سنوات من تناول الأدوية، تتطور الآثار الجانبية المركزية، مثل المكافئات الذهانية، وخلل الحركة، والتقلبات الحادة في النشاط الحركي، والتي سنناقشها أدناه.
لتحقيق مستوى أكثر استقرارًا من الأدوية التي تحتوي على دوبا في الدم من أجل القضاء على التحفيز النابض غير الفسيولوجي لمستقبلات الدوبامين، وتقليل شدة خلل الحركة الدوائي ووقت ظهورها، يتم استخدام مستحضرات ليفودوبا طويلة المفعول. أنها توفر إطلاقًا بطيئًا للمادة الفعالة في الجهاز الهضمي، مما يساهم في تأثير الدواء طويل الأمد (حتى 8 ساعات)، ومع ذلك، فإن التوافر البيولوجي المنخفض نسبيًا لليفودوبا في أشكال الجرعات هذه يتطلب زيادة في إجمالي الجرعة. جرعة المادة الفعالة بمعدل 30%.
في أوائل العقد الأول من القرن الحادي والعشرين، تم اقتراح شكل من أشكال ليفودوبا مع كاربيدوبا للإعطاء المستمر للاثني عشر بعد فغر المعدة المجهري. بفضل مضخة الجرعات المحمولة، يضمن المرضى الذين يعانون من المراحل الشديدة من المرض تركيزًا ثابتًا للليفودوبا في الأمعاء والدم.
ومن بين الـ PPS التي تحتوي على الدوبا، فإن عقار Carbidopa وLevodopa-Teva المسجل في أوكرانيا (الذي تصنعه شركة TEVA، إسرائيل) يجذب الانتباه. يحتوي على نسبة ليفودوبا/كاربيدوبا 10:1. الدواء عبارة عن أقراص قابلة للقسمة، مما يسمح بتناول الجرعات المثالية للدواء، بدءًا من 1/4 أقراص 3 مرات يوميا، مع زيادة الجرعة1/4 أقراص مرة واحدة في الأسبوع. يمثل الدواء المزيج المثالي بين السعر والجودة في سوق الأدوية.
منبهات مستقبلات DA.في البداية، تم استخدام منبهات مستقبلات DA (ADARs) في العلاج المركب مع أدوية ليفودوبا لتقليل جرعاتها. وفي وقت لاحق، اتضح أن ADARs فعالة في المراحل الأولى من المرض كعلاج وحيد. وقد زاد الاهتمام بأدوية هذه المجموعة بشكل خاص بعد أن أظهرت عدد من الدراسات التأثير الوقائي للأعصاب لـ ADAR، مما أدى إلى تباطؤ معدل تطور المرض.
تعمل ADARs مباشرة على مستقبلات DA في العقد تحت القشرية، متجاوزة الجزء قبل المشبكي من الخلايا العصبية السوداوية المخططية. يتم توجيه عملهم إلى مستقبلات D2، والتي يتم توزيعها على نطاق واسع في المسارات السوداوية المخططية والميزوليمبية والقشرية المتوسطة. مع تحفيز مستقبلات D2 يرتبط التأثير العرضي لـ ADAR فيما يتعلق بالصلابة ونقص الحركة والرعشة. حاليًا، هناك مجموعتان من التأثيرات الضارة: الإرغولين (بروموكريبتين) وغير الإرغولين (بيريبيديل وبراميبكسول) (الجدول 3).
تشمل مزايا ADAR ما يلي:
— فعالية ضد الرعاش، الذي يصعب الاستجابة للعلاج التقليدي بالليفودوبا (يظهر التأثير “المضاد للرعاش” بشكل مقنع بشكل خاص في بيريبيديل وبراميبكسول)؛
— لا منافسة مع الأحماض الأمينية الغذائية.
- لا حاجة لمزيد من الأيض في الجهاز العصبي المركزي، بما في ذلك بمشاركة التفاعلات المؤكسدة.
- عمر نصف أطول (مقارنة بالليفودوبا) وتحفيز منشط أطول لمستقبلات ما بعد المشبكي.
- انخفاض خطر الإصابة بخلل الحركة.
- التأثير المضاد للاكتئاب لعدد من الأدوية (خاصة براميبيكسول) ؛
- تأثير وقائي للأعصاب.
تشمل الآثار الجانبية لـ ADAR ما يلي:
- غثيان؛
- عدم انتظام ضربات القلب؛
— تليف صمامات القلب.
- انخفاض ضغط الدم الوضعي.
- الهلوسة.
- اضطراب النوم.
- وذمة محيطية؛
- ظاهرة رينود وغيرها.
إلى حد كبير، ترتبط هذه الآثار الجانبية بـ ergoline ADARs.
بالإضافة إلى تأثيره على مستقبلات D2، يعزز البيريبيديل انتقال النورأدرينالين المركزي بسبب خواص النورأدرينالية A2 الإضافية (حصار المستقبلات الأدرينالية A2 قبل المشبكي، التعزيز المتبادل لإطلاق الأسيتيل كولين في القشرة الأمامية والحصين الظهري). ونتيجة لهذا التأثير، بيريبيديل فعال في علاج مضاعفات مرض باركنسون مثل الضعف الإدراكي وعدم الاستقرار الوضعي.
مع الاختيار الفردي المناسب والزيادة التدريجية في الجرعة، تظهر ADARs قدرة تحمل جيدة وفعالية عالية إلى حد ما. في المراحل المبكرة من مرض باركنسون، باستخدام ADARs غير الإرغولين كعلاج وحيد، من الممكن تقليل شدة الأعراض الرئيسية للمرض (بطء الحركة، والرجفة، وتصلب العضلات) بنسبة 20-40٪، وفي المرضى في المراحل المتقدمة من مرض باركنسون. المرض، فإن إضافة الـ ADARs إلى الليفودوبا يساعد على تقليل شدة الأعراض في المتوسط بنسبة 15-20٪. حوالي 60٪ من المرضى الذين يتلقون ADAR كعلاج وحيد لا يحتاجون إلى ليفودوبا بحلول نهاية السنة الثالثة من العلاج. العلاج الأحادي الأولي باستخدام العقاقير المضادة للحساسية غير الإرغولية الحديثة (مع أو بدون إضافة ليفودوبا) يصاحبه انخفاض معدل الإصابة بخلل الحركة بعد 3-5 سنوات من بدء العلاج، ونوعية الحياة أثناء العلاج الأحادي الأولي باستخدام الليفودوبا والعقاقير المضادة للحساسية هي تقريبًا الأقل. نفس. في المراحل المتأخرة من المرض، عند استخدام ADAR مع ليفودوبا، هناك انخفاض يصل إلى الثلث في المدة الإجمالية لفترات التوقف، ويتم "تلطيف" التقلبات الحركية، ومن الممكن أيضًا تقليل إجمالي مدة فترات الراحة. الجرعة اليومية من ليفودوبا بنسبة 25-30%.
مثبطات مونوامين أوكسيديز من النوع ب (MAO-B).ويشارك إنزيم MAO من النوع B في عملية التمثيل الغذائي للأمينات الأحادية الدماغية، بما في ذلك الدوبامين، وتقسيمها إلى المنتج النهائي - حمض الهوموفانيليك. بالإضافة إلى ذلك، فإن مثبطات MAO-B هي مضادات أكسدة، وقد ظهر تأثيرها الوقائي بشكل متكرر في نماذج تجريبية مختلفة لمرض الشلل الرعاش. يرتبط التأثير العلاجي الدوائي لمثبطات MAO-B بما يلي:
- مع زيادة مستوى الدوبامين في الجسم المخطط.
- زيادة في محتوى فينيل إيثيل أمين في الجسم المخطط، مما يحفز إطلاق الدوبامين ويمنع إعادة امتصاصه، فضلاً عن قدرته على تحفيز مستقبلات الدوبامين بشكل مباشر؛
- عمل مستقلبات السيليجيلين - الميثامفيتامين والأمفيتامين، التي تعزز إطلاق الدوبامين وتمنع إعادة امتصاصه؛
- قدرة السيليجيلين على تغيير نشاط الخلايا العصبية الدوبامين بشكل مباشر أو غير مباشر مما يؤدي إلى زيادة إفراز الدوبامين.
يجب أن تكون الجرعة اليومية من السيليجيلين 10-15 مجم يوميًا مقسمة على جرعتين (الجدول 3).
في الآونة الأخيرة نسبيًا ، بدأ استخدام دواء من الجيل الجديد - مثبط MAO-B الذي لا رجعة فيه راساجيلين. أظهرت الدراسات قدرة راساجيلين على التأثير بشكل إيجابي على مسار العملية المرضية في مرض باركنسون، مما يجعل من الممكن تصنيف الدواء على أنه واعد جدًا.
مثبطات الكاتيكول-O- ميثيل ترانسفيراز (COMT).يقوم إنزيم COMT بميثيل كل من سلائف الدوبامين L-dopa والدوبامين نفسه، اللذين يتوقفان عن المشاركة في وظائف الخلايا العصبية الدوبامينية. مثبطات COMT قادرة على زيادة مستوى الدوبامين الداخلي وتخليق الدوبامين من الليفودوبا. هناك مثبطات COMT ذات التأثير المحيطي والتي لا تخترق حاجز الدم في الدماغ (إنتاكابون) وتلك التي تعبره (تولكابون). بسبب السمية الكبدية العالية، لا يستخدم تولكابون كعامل علاجي. الجرعة المفردة الفعالة من الانتاكابون هي 200 ملغ، ومتوسط الجرعة اليومية من 600 إلى 1200 ملغ. الدواء له تأثير إيجابي على التقلبات الحركية، وخاصة عندما "تنتهي" نهاية الجرعة. يوجد دواء مركب ليفودوبا + كاربيدوبا + إنتاكابون. فهو يجعل من الأسهل مكافحة التقلبات الناجمة عن ليفودوبا. هناك أدلة على أن الإدارة المبكرة لهذا المزيج يمكن أن تمنع أو تؤخر ظهور مضاعفات العلاج بالليفودوبا (الجدول 3).
أمانتادين.لقد تم استخدام أدوية مجموعة الأمانتادين لعلاج مرض باركنسون لفترة طويلة. هناك مجموعتان فرعيتان معروفتان من الأمانتادين: أمانتادين هيدروكلوريد وكبريتات أمانتادين. ترتبط الفعالية في علاج مرض باركنسون بالآليات التالية:
— زيادة في تخليق الدوبامين في محطات ما قبل المشبكي.
- زيادة إطلاق الدوبامين في الشق التشابكي؛
- تثبيط إعادة امتصاص الدوبامين من الشق التشابكي؛
- حجب مستقبلات الغلوتامات NMDA.
في المراحل المبكرة والمعتدلة من المرض، يكون للأمانتادين تأثير مضاد للباركنسون معتدل؛ وفي المراحل المتقدمة، يمكن أن يقلل أيضًا من شدة المضاعفات الحركية للعلاج بالليفودوبا. إن خاصية الأمانتادين لقمع شدة خلل الحركة الناجم عن ليفودوبا مهمة. مع الأخذ في الاعتبار تأثير الأمانتادين المانع للغلوتامات، تمت مناقشة جدوى استخدامها بغرض تصحيح الضعف الإدراكي لدى المرضى. الجرعة المثالية هي 100-200 ملغ من الأمانتادين يوميًا مقسمة على 3 جرعات (الجدول 3).
مضادات مفعول الكولين.تم استخدام الأدوية المضادة للكولين لعلاج مرض باركنسون منذ منتصف القرن التاسع عشر. ترتبط آلية العمل باستعادة التوازن بين النشاط الكوليني السائد نسبيًا وانخفاض وظيفة الدوبامين في الجسم المخطط. في الوقت الحالي، يتناقص استخدام الأدوية من مجموعة مضادات الكولين، وذلك بسبب عدد كبير إلى حد ما من الآثار الجانبية. من الآثار الجانبية الطرفية للدواء يجب ملاحظة ما يلي:
- انتهاك الإقامة؛
- توسع الحدقة.
- فم جاف؛
- إمساك؛
- احتباس البول.
من بين الآثار الجانبية المركزية من الضروري الإشارة إلى:
- الهلوسة.
- ضعف الوظائف المعرفية.
موانع الاستعمال المباشرة لوصف مضادات الكولين هي الورم الحميد في البروستاتا، والزرق، وعدد من أشكال عدم انتظام ضربات القلب، واضطرابات الذاكرة والتغيرات الضامرة في الدماغ وفقًا للتصوير العصبي.
من الممكن وصف مضادات الكولين في المرحلة المبكرة من المرض لدى المرضى الصغار نسبيًا (حتى 65 عامًا) كعلاج وحيد، خاصة في الشكل المرتجف من مرض باركنسون. الجمع مع الأدوية التي تحتوي على ليفودوبا يمكن أن يقلل من شدة التقلبات الحركية خلال النهار ويطيل تأثير ليفودوبا. متوسط الجرعة اليومية لمعظم الأدوية في هذه المجموعة هو 4-8 ملغ يوميا (الجدول 3).
جراحة.في المراحل المتأخرة من المرض، عندما يتم استنفاد جميع إمكانيات العلاج المحافظ وتطور الاضطرابات الحركية المستعصية، ينبغي إثارة مسألة طرق العلاج الجراحية العصبية.
حاليًا، يتم استخدام طريقتين للتدخل الجراحي العصبي في المراحل المتأخرة من مرض باركنسون:
- التدمير المجسم لمجموعات معينة من نوى المهاد، الكرة الشاحبة، وما إلى ذلك؛
— التحفيز الكهربائي المزمن عالي التردد لهياكل الدماغ العميقة باستخدام الأقطاب الكهربائية المزروعة (جراحة الأعصاب الوظيفية). وتتمثل مهمتها في مقاطعة "الدوائر" العصبية القشرية الشاحبة التي تعمل بشكل مرضي.
يتمتع التحفيز الكهربائي العميق بمزايا مقارنة بالعمليات التدميرية: حيث يمكن إجراؤه على كلا الجانبين ويتميز بمضاعفات أقل وتأثير أكثر وضوحًا على جميع المظاهر السريرية الرئيسية لمرض باركنسون.
خلل الحركة الناجم عن المخدرات في PD
كما ذكرنا من قبل، تعتبر أدوية الليفودوبا هي المعيار الذهبي في علاج مرض باركنسون. ومع ذلك، مع العلاج طويل الأمد بالليفودوبا، يحدث تغيير في الصورة النموذجية للمرض، والمظهر الرئيسي له هو خلل الحركة الناجم عن الأدوية، مما يؤدي إلى تفاقم نوعية حياة المرضى.
ترتبط آلية تطور خلل الحركة بالعوامل التالية:
- موت الخلايا المستمر للمادة السوداء.
- التحفيز النابض غير الفسيولوجي لمستقبلات الدوبامين ؛
- انخفاض نشاط الجزء الإنسي من الكرة الشاحبة والجزء الشبكي من المادة السوداء.
تم اقتراح التصنيف التالي لخلل الحركة (J.A. Obeso، 1989):
1. خلل الحركة (خلل التوتر العضلي) في الحركة - يتجلى في شكل فرط الحركة الرقصية أثناء عمل حركي معين.
2. خلل الحركة "التشغيلي" - يحدث على خلفية تأثير جرعة واحدة وينقسم إلى خلل الحركة بجرعة الذروة، والذي يتجلى مع أقصى تأثير لعقار ليفودوبا، بالإضافة إلى خلل الحركة في فترة هضبة العلاج، والتي يمكن تتبعها طوال فترة "التشغيل" بأكملها.
3. يظهر خلل الحركة ثنائي الطور في بداية فترة "التشغيل" ويختفي ليظهر في نهاية فترة "التشغيل". هذا النوع من خلل الحركة يتجلى في أغلب الأحيان على أنه خلل الحركة البطيء، وعادة ما يحدث في عضلات الساق. في بعض المرضى، يتجلى خلل الحركة ثنائي الطور من خلال خلل التوتر الوضعي.
4. يظهر خلل التوتر العضلي في فترة "التوقف" خلال الفترة التي ينتهي فيها تأثير جرعة واحدة من الأدوية المحتوية على ليفودوبا. يتجلى بشكل رئيسي في الصباح في شكل خلل التوتر الصباحي بعد استراحة ليلية في تناول الأدوية. يظهر عادة على شكل خلل التوتر في الوضعية وعضلات الوجه والرقبة، ولكن يمكن تعميمه.
5. يتجلى خلل الحركة - الشلل الرعاش في حدوث فرط الحركة في نصف الجسم مع تأثير مضاد للباركنسونية، في النصف الآخر من الجسم - مع أعراض الشلل الرعاش. يعتمد هذا على الحساسية المختلفة للخلايا العصبية الدوبامينية في الأجزاء المختلفة جسديًا من الجسم المخطط.
6. يحدث خلل الحركة دون تحسن حركي بعد تناول الأدوية دون أي تأثير مضاد للباركنسونية.
7. يظهر خلل الحركة الانتيابي غير المتوقع في أي وقت، بغض النظر عن وقت تناول الدواء.
في المراحل المبكرة، يمكن تصحيح خلل الحركة عن طريق تقليل جرعة ليفودوبا أو تغيير وتيرة تناوله. مع العلاج طويل الأمد لمرض باركنسون، يصبح التصحيح أكثر تعقيدًا. عندما يتم تقليل جرعة الأدوية أو تكرار تناولها، قد يتفاقم النشاط الحركي للمرضى: الظهور المبكر لأعراض "التوقف" أو زيادة شدة هذه الفترة.
هناك عدد من مجموعات الأدوية التي يمكن أن تقلل من شدة ومدة خلل الحركة، ويتم استخدام الأساليب التالية:
— تحسين العلاج بمنبهات مستقبلات الدوبامين مع تقليل جرعة الليفودوبا في نفس الوقت.
- استخدام مستحضرات ليفودوبا طويلة المفعول.
— استخدام مثبطات COMT في العلاج.
- زيادة وتيرة تناول أدوية ليفودوبا.
- استخدام جرعات كبيرة من الأمانتادين في العلاج.
هناك طرق للعلاج اعتمادًا على نوع خلل الحركة.
في حالة وجود خلل الحركة المشيمي بجرعة الذروة، يمكن استخدام الطرق التالية:
- استبدال أشكال ليفودوبا سريعة المفعول بأشكال طويلة المفعول.
- انسحاب مثبطات MAO-B.
- تقليل جرعة واحدة من ليفودوبا و/أو زيادة جرعة مضادات مستقبلات الدوبامين.
- وصف أو زيادة جرعة الأدوية من مجموعة الأمانتادين.
- العلاج الجراحي العصبي.
في حالة وجود خلل الحركة ثنائي الطور، يتم استخدام طرق التصحيح التالية:
- استبدال دواء ليفودوبا طويل المفعول بدواء سريع المفعول.
- زيادة جرعة الأدوية الدوبامينية.
— إضافة مثبط COMT؛
- تقليل جرعة الصباح من ليفودوبا و/أو الجرعة اليومية دون تغيير الفاصل الزمني بين الجرعات؛
- طريقة جراحة الأعصاب.
في حالة وجود خلل التوتر في الصباح الباكر، يتم استخدام نهج العلاج التالي:
- تناول ليفودوبا ليلا.
- تناول منبهات مستقبلات الدوبامين ليلا.
— إضافة مثبطات COMT.
- تناول أدوية ليفودوبا في الصباح.
طرق واعدة لعلاج PD.حاليًا، تنتمي معظم PPS المستخدمة اليوم إلى مجموعة الأعراض. ومع ذلك، فهي لا تمنع أو تبطئ العملية المرضية للتنكس العصبي أو تسبب تطورها العكسي. في هذا الصدد، يتم حاليًا تطوير وإدخال عدد من الأدوية المضادة للباركنسونية الجديدة، مع التركيز ليس كثيرًا على تأثير الأعراض، ولكن على الأساس المرضي للمرض (الشكل 2).
مع الأخذ في الاعتبار التأثير على الآليات المسببة للأمراض لـ PD، فإن استخدام مضادات الأكسدة الجديدة (الإيدبينون، وما إلى ذلك) ومضادات مستقبلات الغلوتامات ذات الخصائص المضادة للإثارة (ريلوزول، ريماسميد) يعتبر واعدًا. هناك اتجاه متعلق بالعلاج الجيني لمرض PD يتطور بشكل نشط - الإدخال المجسم في المنطقة القاتلة لمختلف الجسيمات النانوية الفيروسية الكاذبة التي تحمل جينات عوامل نمو الببتيد، وإنزيمات تخليق الدوبامين، وما إلى ذلك. تعتمد آفاق العلاج التجديدي للخلايا لمرض باركنسون على مدى نجاح المحاولات لتحويل النمط الظاهري للخلايا المستخدمة (الخلايا الجذعية الوسيطة لنخاع العظم والأنسجة الدهنية، والخلايا الجدارية للظهارة الشمية، وما إلى ذلك) على طول مسار محدد. الخلايا العصبية المنتجة لـ DA.
يتم وضع آمال خاصة على التطوير والتنفيذ السريري لأساليب جزيئية جديدة للعلاج الوقائي العصبي للتنكس العصبي في مرض باركنسون:
- استخدام عوامل نمو الببتيد - GDNF، وما إلى ذلك عن طريق الإدارة داخل البطينات؛
— طرق العلاج الجيني لزيادة التعبير عن باركين، بينكي، دي جي-1 والبروتينات الأخرى في الدماغ؛
— استخدام الأدوية التي تزيد من التعبير عن الكوبرونات الجزيئية، ونشاط مركب البروتيزوم وتكثيف عمليات الالتهام الذاتي الليزوزومي؛
- استخدام مثبطات تجميع ومعالجة السينوكلين، ومثبطات نشاط كيناز LRRK2؛
— إدخال الأدوية ذات السيتوكينات والخصائص المضادة للالتهابات (الإريثروبويتين، وما إلى ذلك)، بما في ذلك تلك التي تثبط تفاعلات تنشيط الخلايا الدبقية الصغيرة.
ومع ذلك، لكي تكون الطرق الجديدة لعلاج داء باركنسون فعالة، يجب تنفيذها في مرحلة مبكرة أو حتى كامنة من عملية التنكس العصبي، حيث أن الأشكال الواضحة سريريًا من داء باركنسون ترتبط بموت 60-80% من الخلايا العصبية الدوبامينية. وهذا يطرح مهمة تطوير المؤشرات الحيوية الكافية لمرض باركنسون - التصوير العصبي، والفيزيولوجية العصبية، والكيمياء الحيوية، والوراثة الجزيئية، وما إلى ذلك، والتي ستكون مفيدة في المراحل المبكرة الممكنة من المرض.
الأدب
1. مرض باركنسون واضطرابات الحركة: دليل الأطباء / إد. س.ن. إلاريوشكينا، ن. ياخنو. - م، 2008. - 405 ص.
2. اضطرابات خارج الهرمية: دليل التشخيص والعلاج / إد. ف.ن. شتوكا، أ. إيفانوفا-سمولينسكايا، أو إس. ليفينا. - م: MEDpress-inform، 2002. - 608 ص.
3. جولوبيف ف. علاج مرض باركنسون: القضايا التي تم حلها والتي لم يتم حلها // محاضرات مختارة في علم الأعصاب / إد. في إل. جولوبيفا. - م: إيدوس ميديا، 2006. - ص395-420.
4. Zalyalova Z.A.، Yakovleva L.A.، Bogdanov E.I. المظاهر غير الحركية لمرض باركنسون: دليل للتعليم العالي. - قازان، 2009. - 34 ص.
5. التشخيص السريري في علم الأعصاب: دليل الأطباء / م.م. أوديناك، د. ديسكين. - سانت بطرسبرغ: سبيتسيت، 2007. - 528 ص.
6. مرض باركنسون (المسببات المرضية، العيادة، التشخيص، العلاج، الوقاية) / Karaban I.N., Karaban N.V., Kryzhanovsky G.N., Kucheryanu V.G., Magaeva S.V. - م: الطب، 2002. - 336 ص.
كيف تعرف إذا كنت مصاباً بمرض باركنسون؟ كل ما عليك فعله هو تسجيل 30 ثانية من محادثتك وتزويد البرنامج بالصوت لتحليله. دقة الاختبار 99%.
0:11
أنا أدرس الرياضيات التطبيقية، والمشكلة بالنسبة لكل من يمارس الرياضيات التطبيقية هي أنه كمستشارين إداريين، لا أحد يعرف ما نقوم به بالفعل. والآن سأحاول أن أشرح لك ما أفعله.
0:25
الرقص هو نشاط مميز لعدد قليل من الأنواع، وخاصة البشر. نحن معجبون ببراعة راقصي الباليه وراقصي النقر، وسوف ترونهم الآن. يتطلب الباليه مهارة استثنائية، ومستوى عالٍ من الكفاءة، وربما مستوى معينًا من اللياقة البدنية المتأصلة، والتي قد يتم تحديدها وراثيًا. لسوء الحظ، فإن الأمراض العصبية، مثل مرض باركنسون، تدمر هذه القدرة المذهلة تدريجيًا، كما يحدث مع صديقي إيان ستريبلينج، الذي كان في السابق راقص باليه موهوبًا. على مر السنين، تم إحراز تقدم كبير في علاج هذا المرض. ومع ذلك، فإنه يؤثر اليوم على 6.3 مليون شخص في العالم. جميعهم يضطرون للعيش مع ضعف غير قابل للشفاء، ورعشة، وتصلب، وغيرها من الأعراض المصاحبة لمرض باركنسون. ولذلك، هناك حاجة إلى أدوات موضوعية للكشف عن هذا المرض في أقرب وقت ممكن. ويتعين علينا أن نكون قادرين على إجراء تقييم موضوعي لمسار المرض، لأن هذه هي الطريقة الوحيدة التي يمكننا بها أن نعرف أن العلاج يساعد حقاً - عندما يكون لدينا مؤشر موضوعي يعطي إجابة دقيقة.
1:25
ومن المزعج أنه لا توجد مؤشرات حيوية لمرض باركنسون وغيره من اضطرابات الحركة، مما يعني أنه لا يمكنك إجراء فحص الدم فقط، وأفضل طريقة متاحة هي الفحص العصبي لمدة 20 دقيقة. للقيام بذلك، عليك الحضور إلى العيادة، بالإضافة إلى أنها مكلفة للغاية، لذا فهي غير ممكنة خارج نطاق المشاركة في التجارب السريرية. إنه ببساطة غير ممكن.
1:44
ماذا لو تمكن المرضى من إجراء هذا الاختبار في المنزل؟ لن يحتاجوا للسفر إلى العيادة. إذا تمكن المرضى من إجراء هذا الاختبار بأنفسهم، فلن تكون هناك حاجة لإشراك متخصصين يتقاضون رواتب عالية. وبالمناسبة، فإن الفحص العصبي يكلف حوالي 300 دولار.
1:59
أريد أن أقدم نهجا غير تقليدي لحل هذه المشكلة. الحقيقة هي أننا جميعًا موهوبون بمعنى ما، مثل صديقي إيان ستريبلينج.
2:08
الآن ترى كيف تهتز الحبال الصوتية عندما يتحدث الشخص، وهذا الشخص يتمتع بصحة جيدة. يمكننا جميعا أن نعتبر أنفسنا موهوبين صوتيا، لأنه من أجل نطق الأصوات، يجب علينا تنسيق عمل جميع أعضاء الكلام، وهناك جينات خاصة لهذا، على سبيل المثال، FoxP2. تماما مثل الباليه، فهو يتطلب أعلى مستوى من التدريب. تذكر كم من الوقت يستغرق الطفل لتعلم الكلام. ومن خلال الصوت، يمكننا تحديد موضع الحبال الصوتية أثناء اهتزازها. في مرض باركنسون، لا تتأثر الأطراف فحسب، بل تتأثر أيضًا أعضاء النطق. خلاصة القول هي مثال على اهتزاز الحبل الصوتي غير الطبيعي. نرى نفس الأعراض - الارتعاش والضعف والصلابة. يصبح الكلام أكثر هدوءًا وتنفسًا وتأخرًا، وهذا أحد الأعراض النموذجية للمرض.
2:53
قد تكون علامات تغيرات الحبال الصوتية خفية، ولكن إذا استخدمنا ميكروفونًا رقميًا عاديًا وبرنامجًا حساسًا لتحليل الصوت بالكمبيوتر، وأحدث التطورات في التعلم الذاتي بالكمبيوتر، والتي تحسنت الآن بشكل كبير، فيمكننا تحديد مرحلة المرض بدقة. الإنسان موجود من خلال صوته فقط.
3:14
كيف يمكن مقارنة هذا الاختبار المعتمد على تحليل الصوت مع الاختبار السريري الذي يجريه أحد المتخصصين؟ كلا الاختبارين غير جراحيين ويستخدمان البنية التحتية الحالية. ليست هناك حاجة لبناء عيادات جديدة لتنفيذها. وكلاهما موثوق. ومع ذلك، يمكن إجراء اختبار يعتمد على تحليل الصوت من قبل شخص غير متخصص. وهذا يعني أنه يمكن تنفيذها بشكل مستقل. هذا الاختبار سريع جدًا ويستغرق 30 ثانية كحد أقصى. إنها غير مكلفة للغاية ونحن نعرف ما سيؤدي إليه. عندما يصبح شيء ما رخيصًا، يصبح منتجًا بكميات كبيرة. فيما يلي بعض الأهداف الرائعة التي يمكننا الآن تحديدها. يمكننا تقليل عدد زيارات العيادة للمرضى. لن يحتاجوا إلى الحضور لإجراء فحص روتيني. يمكننا إجراء مراقبة متكررة والحصول على نتائج موضوعية. يمكننا إجراء تجارب سريرية منخفضة التكلفة مع أعداد كبيرة من المشاركين، ولأول مرة في التاريخ يمكننا دراسة السكان بالكامل. لدينا الفرصة لبدء البحث عن المؤشرات الحيوية المبكرة للمرض حتى نتمكن من بدء العلاج في البداية.
4:07
واليوم نخطو الخطوات الأولى في هذا الاتجاه ونطلق برنامج “صوت مرض باركنسون”. بالتعاون مع Aculab وPatientsLikeMe، نريد تسجيل أصوات عدد كبير من الأشخاص حول العالم من أجل جمع بيانات كافية للبدء في تحقيق هذه الأهداف الأربعة. لدينا أرقام هواتف محلية متاحة لـ 750 مليون شخص. يمكن لكل شخص، سواء كان يتمتع بصحة جيدة أو يعاني من مرض باركنسون، الاتصال وترك تسجيل لصوته. المكالمة لا تكلف سوى بضعة سنتات. ويسعدني جدًا أن أبلغكم أننا وصلنا بالفعل إلى 6% من هدفنا خلال 8 ساعات فقط. شكرًا لك. (تصفيق). (تصفيق).
4:43
توم رايلي: ماكس، لذا عندما تقوم بتسجيل عينات صوتك، لنفترض 10000 شخص، هل ستتمكن من معرفة من هو السليم ومن هو المريض؟ ما الذي ستحصل عليه؟
4:54
ماكس ليتل: نعم، نعم. الحقيقة هي أنه خلال المكالمة سيتعين عليك الإشارة إلى ما إذا كنت مصابًا بمرض باركنسون.
ر: حسنًا. م.ل: كما ترون، قد لا يتمكن شخص ما من التعامل مع هذا الأمر، وقد لا يتمكن شخص ما من تجاوزه. ولكن سيكون لدينا عينة ضخمة من العينات المسجلة في مجموعة واسعة من الحالات، وهذا مهم للغاية لأنه سيسمح لنا بالتخلص من جميع العوامل المربكة وتحديد العلامات الحقيقية للمرض.
5:15
TR: الآن دقة الطريقة 86%؟
5:18
م.ل: لا، إنه أكبر بكثير الآن. لقد تحقق طالبي ثاناسيس - يجب أن أسميه لأنه قام بعمل رائع - من أن كل شيء يعمل عبر شبكات الهاتف المحمول التي جعلت هذا المشروع ممكنًا، وحققنا دقة بنسبة 99%.
نادراً ما يكون تشخيص مرض باركنسون صعباً اليوم. ومع ذلك، في بعض الحالات تكون هناك حاجة إلى نهج تفاضلي لدراسة المشكلة، لذلك من المهم دائمًا أن يكون المتخصص في شخص الطبيب المعالج مختصًا تمامًا في هذا الشأن. المعرفة الإضافية عند تشخيص مرض باركنسون لن تؤذي أبدًا، لأن... المرض نفسه غالبا ما يكون غامضا.
يعيش العديد من المرضى اليوم دون أن يدركوا أنهم يصابون بمرض باركنسون. والحقيقة هي أنه في الأشكال الأولية يكون المرض بدون أعراض عمليًا ويتم تشخيصه إما أثناء الفحص العشوائي أو في حالة اتباع المريض نهجًا دقيقًا بشكل خاص تجاه صحته. في بعض الأحيان يلاحظ الأقارب أدنى التغييرات ويرسلون المريض إلى الطبيب.
بطريقة أو بأخرى، المجتمع الحديث يدرك جيدا هذه المشكلة، لذلك يهتم الكثيرون بما إذا كان هناك اختبار واحد لمرض باركنسون أم لا. الجواب بسيط: لا، لسوء الحظ، مثل هذه الاختبارات غير موجودة، على الرغم من أن الأطباء في جميع أنحاء العالم يعملون على ذلك، وقد تمكن العلماء الأمريكيون من تطوير نوع من نظام البطاقات الذي يسمح لك بمعرفة الوقت المناسب عن وجود المرض. ما مدى فعاليتها هو تخمين أي شخص، لأنه لا يستخدم في بلدنا. وإذا استخدم أي من الأطباء مثل هذه الخبرة في ممارستهم، فإنهم يفعلون ذلك فقط لأغراض البحث، ولكن ليس كجانب أساسي في تشخيص مرض باركنسون.
اختبار باركنسون: أسطورة أم حقيقة؟
وفي الواقع، فإن اختبار باركنسون موجود بالفعل، وهو ليس وحده. نحن ندعوك للنظر في كل واحد منهم.
اختبار ليفودوبا
يتم إجراء هذه الدراسة في الحالات التي لم يتم فيها تأكيد التشخيص بشكل نهائي. وكما هو معروف، فإن انخفاض إنتاج الدوبامين يلعب دورًا رئيسيًا في تطور مرض باركنسون.
ليفودوبا هو الدواء الرئيسي لمرضى باركنسون، ويهدف عمله إلى استعادة مستويات الدوبامين. ولهذا السبب، عندما يتم التشكيك في التشخيص لسبب أو لآخر، يخضع المرضى لاختبار ليفودوبا.
يكمن جوهرها في إعطاء جرعات معينة من الدواء ومراقبة حالة المريض. إذا انخفضت الأعراض السريرية وتحسنت حالة المريض بعد ذلك، فهناك كل الأسباب للحديث عن تشخيص مرض باركنسون.
الفحوصات الطبية للتوازن

لا ترتبط مثل هذه الاختبارات بشكل مباشر بمرض باركنسون، ولكن يمكن استخدامها في التشخيص التفريقي للمرض. يختار الطبيب المعالج هذه التقنية بشكل مستقل، مع الأخذ في الاعتبار الخصائص الفردية للمريض.
تشمل هذه الاختبارات لمرض باركنسون تلك التي تحدد مستوى القدرة عند كتابة النص على الورق، عند صب الماء من الزجاج إلى الزجاج. وبهذه الطريقة يمكن تقييم خصائص الرعاش أثناء الراحة وأثناء الحركة، مما يوفر معلومات معينة للمتخصصين أثناء التشخيص.
المراقبة الذاتية لقدراتك الخاصة لا تقل أهمية عن الفحص الطبي. إذا لاحظت أنك تفقد سعة الاطلاع السابقة أو أن هذا يحدث مع قريبك، أو أنك لا تتحكم في عملية المحادثة، أو لاحظت شعورًا بالنسيان في نفسك أو في أحد أفراد أسرتك، فيمكنك إجراء مثل هذه الاختبارات في المنزل. إذا تغير خط يدك، ولا توجد فجوات بين الحروف، أو علامات أخرى لنشاط حيوي غير معهود في حياتك السابقة، فيجب عليك الاتصال بأخصائي للحصول على المساعدة.
مرحبا عزيزي قراء موقع البوابة. مع التقدم في السن، تحدث تغيرات معينة في جسم الإنسان، والتي غالباً ما تؤدي إلى ظهور الأمراض، وتسمى تلك المرتبطة بالعمر.
الشيء الأكثر حزنا هو أن هذه التغييرات بدأت تحدث في وقت سابق بكثير ولا يمكن أن يسمى الشخص كبار السن، لكنه بالفعل. ومن الغريب أن هذا المرض يمكن العثور عليه عند شخص يبلغ من العمر أربعين عامًا.
الدراسات الحديثة التي شملت المرضى الذين تم تشخيصهم بـ: مرض الشلل الرعاشفي المراحل المبكرة، يظهر أن الإنزيم المساعد Q10 يمنع انخفاض وظائف المخ، على عكس الدواء الوهمي، لأنه يتمتع بخصائص قوية مضادة للأكسدة ضرورية لإنتاج الطاقة الخلوية. لا تزال الأبحاث جارية، ولكن من المعروف بالفعل أن الإنزيم المساعد Q10 يستخدم في العلاج المعقد في علاج مرض الزهايمر والعديد من أمراض القلب والسكري وضمور العضلات.
وفقًا لمنظمة الصحة العالمية، يؤثر مرض باركنسون على 1.5% أو 4 ملايين شخص على هذا الكوكب.
ماذا يحدث في مرض باركنسون؟
أثناء المرض، تتأثر مادة في الدماغ تسمى المادة السوداء، والتي تطلق الدوبامين. وتتمثل مهمتها في محاكاة النبضات العصبية التي تضمن الحركات الطبيعية.
ومع تقدم الإصابة، تتعطل هذه الوظيفة ويعاني نقل النبضات، وهو ما يتجلى في أعراض مثل: علامات البطء، والتيبس، وضعف التحكم في التوازن، والارتعاش.
ما الذي يسبب الضرر للمادة السوداء؟
لا يزال العلماء ليس لديهم إجماع حول سبب حدوث ذلك. يتم إجراء الأبحاث في هذا الاتجاه بنشاط كبير، لأن هذه المشكلة ذات صلة للغاية حاليا، ولكن حتى الآن دون أي نتائج. العوامل المؤثرة على المظهر مرض بركينسون:
الاستعداد الحركي
عمليات الأكسدة الجذرية الحرة.
الأضرار الناجمة عن المواد السامة المختلفة.
هناك نوعان من المرض: الابتدائي والثانوي.
أساسي - يحدث لأسباب غير واضحة مذكورة أعلاه.
الثانوي هو نتيجة تناول الأدوية المضادة للذهان والأدوية والإصابات والتسممات المختلفة.
لكن كل هذه الأنواع تعبر عن نفسها بنفس الطريقة. الطرق التي تسمح لك بتقييم حالة المادة السوداء هي التصوير المقطعي بالإصدار البوزيتروني و.
اختبار مرض باركنسون:
1. مد ذراعيك أمامك وابدأ في قبض أصابعك وفتحها بأقصى سرعة. إذا كان لديك عدم تناسق، أي اختلاف في سرعات حركة الأطراف، فقد يكون ذلك علامة على المرض.
2. اجلس على كرسي، ضع قدميك على كعبيك واضغط بقدمك على الأرض، بأقصى سرعة أيضًا. إذا تحركت إحدى القدمين بشكل جيد بما فيه الكفاية، ولكن الأخرى تباطأت، فيجب عليك الانتباه إلى ذلك.
3. ضع ذراعيك على صدرك وقم بالوقوف دون مساعدتهم، فهذا لا يجدي نفعاً، فكر في الأمر.
4. قف واطلب من شخص ما أن يدفعك للخلف قليلًا بينما تحاول الوقوف وعدم التحرك للخلف. إذا لم ينجح الأمر ولم تتمكن من التحكم في مركز الجاذبية. يمكن أن يكون هذا أيضًا بمثابة دعوة للاستيقاظ.
وفي كل الأحوال إذا ظهرت هذه العلامات فلا تتأخري بزيارة الطبيب. حتى لو تم تأكيد هذا المرض، لا تستسلموا تحت أي ظرف من الظروف، قاتلوا وتلقوا العلاج. اعتني بنفسك وبصحتك، سوف تنجح!
الصحة لك ولأحبائك!
نراكم قريبا على الصفحات يا علاء
بالرغم من مرض باركنسون غير قابل للشفاءيمكن للأطباء الآن التأثير بشكل إيجابي على مسار المرض حتى يتمكن المرضى من الاستمتاع بنوعية حياة عالية لسنوات عديدة. لمكافحة تدمير خلايا الدماغ في مرض باركنسون، يحتاج الأطباء إلى اكتشاف المرض مبكرًا، ولكن لسوء الحظ، هناك عدد قليل جدًا من طرق الاكتشاف المبكر المناسبة.
وقد اكتشف الباحثون ذلك الآن حاسة الشميعطي نصائح قيمة. نقص الشم، وهو فقدان القدرة على الشم لسبب غير معروف، قد يكون علامة على أعراض غير حركية. صرح الدكتور أولريش ليبيتراو، كبير الأطباء لاستشارات مرض باركنسون في قسم الأمراض العصبية في مستشفى كولونيا دير شتات، في الاجتماع الثاني والعشرين للجمعية العصبية الأوروبية (ENS) في براغ: "إن اختبارات الرائحة في عيادات الأطباء مناسبة للكشف من نقص السكر في الدم، فضلا عن إجراء الاختبارات في المناطق العامة مثل مناطق المشاة.
مرض باركنسون هو مرض عصبي شائع جدًا يتطور ببطء ويصيب عادةً الأشخاص الذين تتراوح أعمارهم بين 50 و60 عامًا. في ألمانيا وحدها هناك ما يقرب من 300000 شخص تم تشخيص إصابتهم بمرض باركنسون. لا يزال العلماء غير متأكدين من أسباب موت الخلايا الذي يحدث في المادة السوداء للعقد القاعدية لأدمغة مرضى باركنسون، ولكن قد تكون هناك عوامل وراثية مشتبه بها. ويتسبب موت الخلايا في نقص الدوبامين، وهو ناقل عصبي، مما يؤدي إلى فقدان السيطرة على الحركات الإرادية وغير الإرادية. اختبر أطباء الأعصاب الألمان من كولونيا الآن طريقة جديدة للكشف المبكر عن العلامات الدقيقة لمرض باركنسون، مع التركيز على الفقدان الجزئي لحاسة الشم، والتي استندوا إليها في أبحاث سابقة تظهر أن واحدًا من كل عشرة أشخاص يعانون من نقص حاسة الشم سيصاب بمرض باركنسون في سنوات لاحقة.
وأوضح الدكتور ليبيترو: "كان هدفنا هو الوصول إلى أكبر عدد ممكن من الأشخاص الذين يعانون من نقص السكر في الدم."
استخدم الفريق طريقة غير عادية للاختبار. وأجروا اختبار حاسة الشم أمام الجمهور يوم السبت في قاعة احتفالات بمنطقة مشاة معروفة في كولونيا. وصف Liebetrau المتطلبات التي يجب استيفاؤها للتنفيذ:
“لكي يتمكن الأشخاص من إجراء الاختبار الذي نقدمه، يجب أن يكون الموقع مركزيًا ومألوفًا للجميع. وكان العامل المهم الآخر هو وجود مناطق مغلقة للتحليل، ولكن الخيام يمكن أن تقلل من خطورة الحدث.
وطلبوا من 187 مشاركًا شم رائحة الفانيليا والليمون والقرنفل والخزامى. تم تحديد ما مجموعه 46 مشاركًا على أنهم يعانون من نقص السكر في الدم وتم تقديم مزيد من التقييم لهم في عيادات مدينة كولونيا (Kliniken der Stadt Köln). وأوضح الدكتور ليبيترو: “بعد الاختبار، كان من الضروري إجراء فحص احترافي من قبل أطباء الأعصاب وأخصائيي الأنف والأذن والحنجرة في وقت ومكان منفصلين. ففي نهاية المطاف، يمكن أن يكون نقص حاسة الشم أحد أعراض مجموعة واسعة من الحالات الطبية.
وكشفت النتائج أنه تم تشخيص إصابة ثلاثة من أصل 46 شخصًا مصابًا بنقص سكر الدم بمرض باركنسون، على الرغم من أنهم لم يعرفوا قبل الاختبار أنهم مصابون بالمرض.
إحدى الفوائد الرئيسية للاختبارات ذات العتبة المنخفضة هي أن الأمراض التي قد لا يتم اكتشافها يتم اكتشافها في مرحلة مبكرة، مما يمنع أيضًا الأمراض المزمنة. التشخيص المبكر مفيد، حتى لو كان مرتبطًا باضطرابات عصبية حادة مثل مرض باركنسون.
وقال الدكتور ليبيترو: "لا يوجد علاج لمرض باركنسون، لكن الأدوية الجديدة مثل راساجيلين قد يكون لها تأثير إيجابي واضح على المرض، خاصة إذا بدأ العلاج مبكرا". هناك حاجة إلى مزيد من البحث لتحديد ما إذا كان هذا ينطبق أيضًا على المراحل المبكرة من المرض."
وخلص الباحثون إلى أن الخلل في حاسة الشم ليس مزعجا فحسب؛ كما أنها توفر فرصة لاكتشاف مرض باركنسون في المراحل المبكرة من المرض والتوصية باستخدام نقص حاسة الشم كمؤشر مبكر لمرض باركنسون. ويخلص ليبيترو إلى أنه "يجب على الأطباء أن يسألوا في كثير من الأحيان عن الخلل في حاسة الشم وأن يقوموا بإجراء اختبارات بسيطة، مثل القهوة أو التوابل. في حالة الاشتباه في نقص السكر في الدم، يجب إجراء تأكيد المرض. وأضاف أن اختبارات الشم العامة مناسبة بشكل خاص لزيادة الوعي بنقص الشم.