مرض يسمى الأورام الليفية الرحمية شائع جدا. يتم تسهيل ظهور علم الأمراض من خلال العديد من العوامل غير المواتية التي يتعين على المرأة مواجهتها في الحياة الحديثة. يمكن أن يكون العقم من المضاعفات الخطيرة. الأورام الليفية الرحمية، والأورام الليفية، والأورام العضلية الملساء هي أنواع من نفس الورم تختلف عن بعضها البعض في البنية، ولكنها يمكن أن تؤدي إلى عواقب وخيمة بنفس القدر. من المهم اكتشاف الأمراض والقضاء عليها في الوقت المناسب.
محتوى:
ملامح الورم العضلي الأملس
تتشكل أورام الرحم الحميدة (الأورام الليفية) في جدار الرحم. بالإضافة إلى الألياف العضلية، هناك أيضًا قاعدة نسيج ضام، بالإضافة إلى شبكة من الأوعية الدموية. اعتمادا على هيكل الأورام، يتم تمييز عدة أنواع من هذه الأمراض. على سبيل المثال، يتكون الورم الليفي من نسيج ليفي (ضام)، والورم العضلي الليفي عبارة عن مزيج من الأنسجة الليفية والعضلية مع غلبة الأول. الورم العضلي الأملس هو ورم يتكون بالكامل تقريبًا من ألياف عضلية ملساء مع مزيج صغير من الأنسجة الليفية، وله نظام وعائي.
وهي عبارة عن كرة تتشكل في سمك الجدار، ثم تنمو باتجاه تجويف الرحم أو تمتد إلى خارج حدوده. يحدث الورم العضلي الأملس بشكل رئيسي عند النساء في سن الإنجاب (20-40 سنة)، لأنه ورم يعتمد على هرمون الاستروجين. تكمن الخصوصية في أنه في بعض الحالات يمكن أن تختفي من تلقاء نفسها.
مراحل التطور وأشكال الوجود
يحدث تطور الورم العضلي الأملس على مراحل.
في المرحلة الأولى، يتم تشكيل بدايتها. يؤدي انقسام الخلايا اللاحق إلى التكوين التدريجي لعقدة الورم.
في المرحلة الثانية، يستمر الورم العضلي الأملس في النمو بسبب تحسن التغذية، كما تنمو شبكة الأوعية الدموية.
المرحلة الثالثة هي الانحدار، والتطور العكسي للورم العضلي الأملس الرحمي، والذي يحدث إذا انخفض محتوى هرمون الاستروجين في الجسم بشكل حاد. يحدث هذا، على سبيل المثال، أثناء انقطاع الطمث، عندما يتم حل الورم العضلي الأملس الصغير الذي تشكل في وقت سابق من تلقاء نفسه بعد توقف المبيضين عن العمل. العلاج في الوقت المناسب لتشكيل الورم لدى امرأة شابة يؤدي إلى نفس النتيجة. في هذه الحالة، تختفي الأورام العضلية الملساء الصغيرة بعد خفض مستويات هرمون الاستروجين بشكل مصطنع بمساعدة أدوية خاصة.
يمكن أن يوجد الورم في شكل عقدي (الأكثر شيوعًا) ومنتشر. يتميز الشكل العقدي بتكوين عقد مدورة واحدة (نوع واحد) أو عدة (نوع متعدد) ذات حدود واضحة. مع الشكل المنتشر، تظهر سماكات عديدة عديمة الشكل، منتشرة في كامل حجم العضو. هذا النموذج نادر للغاية.

لا تتشكل عقد الأورام المتعددة في وقت واحد ولها أحجام مختلفة. جنبا إلى جنب مع عقد الورم العضلي الأملس، قد تكون هناك أورام مماثلة من نوع آخر (الأورام العضلية الليفية، على سبيل المثال).
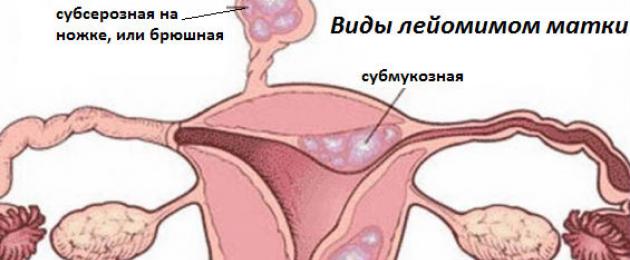
أنواع الورم العضلي الأملس
يتكون جدار الرحم من ثلاث طبقات: بطانة الرحم (الغشاء المخاطي الداخلي المتجدد شهريًا)، عضل الرحم (الطبقة العضلية) والمحيط (الغشاء المصلي الخارجي). اعتمادا على الاتجاه الذي تنمو فيه العقدة، يتم تقسيم الأورام العضلية الملساء إلى الأنواع التالية:
- الورم داخل العضل لا يمتد إلى ما بعد عضل الرحم.
- يبرز الورم العضلي الأملس تحت المخاطي (تحت المخاطية) داخل التجويف، ويحتل حجمًا متزايدًا أثناء نموه.
- ينمو الجزء السفلي (تحت الصفاق) من الخارج، ويدخل إلى تجويف البطن وغالبًا ما يتصل بجسم الرحم بمساعدة ساق رفيع.
إذا كان الورم يقع بالقرب من الصفاق وله حجم كبير، فيمكن اكتشافه عن طريق ملامسة البطن.
أسباب تشكيل الورم العضلي الأملس
السبب الرئيسي لتطور الأورام العضلية الملساء في الرحم هو عدم التوازن الهرموني. تحدث الزيادة المرضية في تركيز هرمون الاستروجين في الدم في الحالات التالية:
- يتم تعطيل إنتاج هرمونات الغدة النخامية FSH و LH، التي تنظم تكوين هرمون الاستروجين والبروجستيرون في المبيضين (البديل "المركزي" لحدوث علم الأمراض). قد يكون سبب الاضطرابات أمراض الغدد الصماء وإصابات الرأس والدورة الدماغية غير السليمة والاضطرابات العقلية والعصبية.
- هناك فشل في وظيفة إنتاج الهرمونات في المبيضين بسبب حدوث أمراض التهابية أو ورم فيها، وتلف هذه الأعضاء ("متغير المبيض"). يتم تسهيل ظهور الورم العضلي الأملس في هذه الحالة عن طريق الإجهاض والعمليات الجراحية التناسلية، فضلا عن عدم الامتثال لقواعد النظافة والحماية من الأمراض المنقولة جنسيا.
- في تجويف الرحم، تتضرر المستقبلات التي تستجيب لتأثيرات هرمون الاستروجين (النسخة "الرحمية"). يحدث هذا أثناء الكشط أو صدمة البطن.
أحد العوامل التي تثير التراكم المفرط لهرمون الاستروجين في الدم هو استخدام الأدوية الهرمونية التي تحتوي على نسبة عالية من هرمون الاستروجين، واضطرابات التمثيل الغذائي التي تؤدي إلى السمنة، والتغيرات في تكوين الدم. يمكن أن يكون سبب التمثيل الغذائي غير السليم هو انخفاض النشاط البدني للمرأة والإفراط في تناول الطعام بشكل منهجي.
ويلعب الاستعداد الوراثي لحدوث مثل هذه الأورام دورا هاما، فضلا عن وجود الأمراض الخلقية لتطور الأعضاء التناسلية. يتم تعزيز حدوث الورم العضلي الأملس من خلال وجود أمراض الأوعية الدموية، حيث يتم انتهاك تدفق الدم إلى مختلف الأعضاء.
فيديو: أسباب الأورام الليفية وكيفية الوقاية من تطورها
أعراض الورم العضلي الأملس
يمكن أن يتطور الورم العضلي الأملس بدون أعراض حتى يصل حجمه إلى 2-3 سم. ويؤدي نمو الأورام إلى أحاسيس مؤلمة بسبب تمدد الأنسجة وضعف انقباض الرحم.
ظهور اضطرابات في الدورة الشهرية. تصبح الدورة الشهرية طويلة وثقيلة. دون معرفة السبب، تبدأ المرأة بتناول المرقئ والمسكنات. وهذا يساعد على تقليل الأعراض غير السارة، وتأجيل زيارة الطبيب. يتم انتهاك انتظام الدورة تدريجيا، ويزيد فقدان الدم.
تظهر علامات خلل في المثانة (تشنجات، كثرة التبول) واضطرابات في الجهاز الهضمي. يحدث هذا بسبب التأثير الضاغط للورم على أعضاء الحوض الأخرى.
وبسبب زيادة حجم العقد، يبدأ بطن المرأة بالنمو، مثل المرأة الحامل. من المعتاد تقدير حجم الورم العضلي الأملس بالسنتيمتر وفي "أسابيع الولادة". يتناسب حجم البطن مع تضخم الورم مع حجمه في أسبوع معين من الحمل.
ملحوظة:في بعض الأحيان يتم الخلط بين تضخم البطن الناتج عن نمو الورم الليفي كعلامة على الحمل. حتى وجود الحيض لا يزعجك، لأن بقع الدم تحدث أيضًا خلال هذه الفترة.

ما هي المضاعفات المحتملة؟
تعتمد شدة المضاعفات على حجم وموقع الورم العضلي الأملس. يتم اكتشاف الأورام في أغلب الأحيان بعد زيادة حجم العقد إلى 5-6 سم أو أكثر.
اعتمادا على نوع الورم
تحت المخاطيةالورم العضلي الأملس الرحمي هو السبب الأكثر شيوعًا والأكثر أهمية للمضاعفات، مثل:
- اضطرابات الدورة الشهرية، والتي تتجلى في حدوث نزيف حاد لفترة طويلة ليس فقط أثناء الحيض، ولكن أيضًا بينهما.
- العقم. يتداخل الورم مع التكوين الطبيعي لبطانة الرحم، مما يجعل من المستحيل الاحتفاظ بالجنين في الرحم، وكذلك تكوين المشيمة الطبيعية. قد يسد عنق الرحم أو قناتي فالوب.
- ولادة الورم العضلي الأملس. تحت تأثير تقلصات عضلات الرحم، يمكن للأورام الليفية الكبيرة، الموجودة بالقرب من عنق الرحم ولها قاعدة رقيقة، أن تتدلى إلى منطقة المهبل.
- تلف الأوعية الدموية مما يؤدي إلى نزيف رحمي خطير وحدوث "بطن حاد" وفقر الدم.
غزير.لا تظهر اضطرابات وظيفة الدورة الشهرية. لكن المضاعفات لا يمكن أن تكون أقل خطورة. يؤدي التواء الساق الرقيقة لمثل هذا الورم إلى نخر أنسجته. يؤدي تحلل الورم الميت في تجويف البطن إلى التهاب الصفاق.
يؤدي ضغط العقد على أعضاء الحوض المجاورة إلى تعطيل عملها وضغط الأوعية الدموية والالتهاب وآلام شديدة في البطن والغثيان والقيء. يصعب اكتشاف مثل هذه الأورام، وغالبًا ما يتم اكتشافها فقط عند حدوث مضاعفات.
داخلي.مع تضخم الورم، تتعطل حالة شبكة الأوعية الدموية وبنية طبقة العضلات. وهذا يؤدي إلى انخفاض في انقباض الرحم، ونتيجة لذلك يستغرق إفراز دم الحيض وقتًا أطول من المعتاد. قد يحدث ركود الدم في تجويف العضو والتهاب بطانة الرحم وبطانة الرحم.
يعد الألم الخفيف والمستمر في البطن علامة مميزة لوجود مثل هذا الورم.

الورم العضلي الأملس أثناء الحمل
عندما تتشكل العقد تحت المخاطية الكبيرة لدى المرأة، يصبح الحمل صعباً بسبب خلل في بنية الغشاء المخاطي للرحم. يؤدي هرمون الاستروجين الزائد، الذي يثير تكوين الورم، إلى ظهور دورات الإباضة، حيث لا تنضج البويضة ويكون الحمل مستحيلاً. لا يتم إعاقة عملية زرع الجنين في جدار الرحم فقط بسبب عدم نضج بطانة الرحم، ولكن أيضًا بسبب زيادة انقباض الرحم أثناء تكوين الأورام الليفية تحت المخاطية.
إذا كانت العقد صغيرة، فمن الممكن الحمل، ولكن الورم المتضخم يتداخل مع نمو الجنين ويضعف إمدادات الدم والتغذية. قد يبدأ المخاض قبل عدة أسابيع من الموعد المتوقع، وقد يحدث نزيف حاد.
بعد اكتشاف ورم مثل الورم العضلي الأملس الرحمي لدى المرأة الحامل، تتم مراقبة تطوره بعناية. إذا زاد كثيرا بحيث يتعارض مع نمو الجنين، تتم إزالته (في أغلب الأحيان بعد الأسبوع السادس عشر من الحمل). تتم الولادة قبل الأوان باستخدام عملية قيصرية.
الورم العضلي الأملس أثناء انقطاع الطمث
في النساء فوق سن 50 عامًا، لا يمكن أن يتشكل مثل هذا الورم بشكل طبيعي. وحتى العكس، غالبًا ما يتم حل العقدة الموجودة مسبقًا من تلقاء نفسها. ومع ذلك، عندما تحدث أمراض الغدد الصماء، لا تزال أورام الرحم تظهر، ويزداد خطر تحولها إلى سرطان بشكل كبير، خاصة في وجود ورم من النوع المنتشر.
تحذير:يجب على المرأة الاتصال على الفور بطبيب أمراض النساء إذا تعرضت لنزيف من الأعضاء التناسلية أثناء فترة ما بعد انقطاع الطمث. في بعض الأحيان يكون هذا أمرًا حيويًا.
التشخيص والعلاج
عند وصف العلاج، يتم تحديد حميدة الورم وعدد وحجم وموقع العقد، وكذلك شدة الأعراض.
استطلاع
إذا تم الكشف عن سماكة الجدار وزيادة في حجم الرحم، يتم وصف الفحص بالموجات فوق الصوتية (عبر المهبل والبطن)، والأشعة السينية للرحم باستخدام محلول التباين (تصوير الرحم والبوق). يتم أيضًا فحص تجويف العضو باستخدام جهاز بصري (يتم إجراء تنظير الرحم). إذا لزم الأمر، يتم أخذ عينة من الأنسجة من الورم (خزعة باستخدام طريقة تنظير البطن)، مما يسمح باستبعاد الأورام وتوضيح بنية الأورام الليفية. بالإضافة إلى ذلك، يمكن وصف التصوير بالرنين المغناطيسي والأشعة المقطعية واختبارات الدم لمستويات الهرمون.

علاج
يستخدم العلاج الطرق المحافظة والجراحية. عند اختيار التقنية، يتم أخذ حجم وموقع العقد العضلية الملساء في الرحم بعين الاعتبار، بالإضافة إلى عمر المريضة ورغبتها في الحفاظ على وظائف الأعضاء التناسلية.
العلاج المحافظيتم استخدامه عندما لا يزيد حجم الورم عن 12 أسبوعًا ولادة ولا توجد أعراض خطيرة للمضاعفات. والدليل على هذا العلاج هو نية المرأة في إنجاب الأطفال فيما بعد.
ينخفض مستوى هرمون الاستروجين في الجسم. في هذه الحالة، يتم استخدام وسائل منع الحمل عن طريق الفم (COC)، مما يساعد على تنظيم الدورة، وتطبيع نسبة الهرمونات الجنسية الأنثوية.
للقضاء على عواقب فرط الاستروجين، توصف أدوية البروجستين (دوفاستون، أوتروجستان، بريجنين)، والتي تمنع تأثير هرمون الاستروجين على أنسجة الرحم. يتم أيضًا تقليل إنتاج هرمون الاستروجين بمساعدة الأدوية التي تثبط إنتاج هرمونات الغدة النخامية التي تحفز تكوين هرمون الاستروجين في المبيضين (Zoladex).
لتسريع عملية تراجع الورم، يتم وصف إجراءات العلاج الطبيعي (الحمامات العلاجية، الكهربائي وغيرها).
جراحة.مؤشرات تنفيذه هي الحجم الكبير للعقد (قطرها أكثر من 3 سم)، وجود ساق طويل، زيادة ملحوظة في الورم، انخفاض في الحجم الحر للرحم، وجود نزيف حاد و فقر دم. موانع الاستعمال ستكون وجود أمراض التهابية ومعدية لدى المرأة، وكذلك أمراض الأوعية الدموية وأمراض الدم.
لإزالة الورم، الطريقة الأكثر استخدامًا هي تنظير البطن - وهي عملية لإزالة الورم من خلال ثقوب في البطن. الطريقة الأكثر صدمة هي فتح البطن - إزالة الورم من خلال شق فوق العانة. يتم استخدامه في وجود الأورام الليفية الكبيرة. في بعض الحالات، تتم إزالة الورم (استئصال الورم العضلي) من خلال المهبل.
أكثر الطرق لطفاً هي الإمارات العربية المتحدة (سد الأوعية الدموية للورم) والاستئصال بالموجات فوق الصوتية. في حالة حدوث أضرار جسيمة في الرحم، يتم إجراء الإزالة الجزئية أو الكاملة.
فيديو: علاج الأورام الليفية الرحمية بالإمارات العربية المتحدة
ورم عضلي أملس في الرحمويعتبر ورمًا حميدًا في عضل الرحم (الطبقة العضلية) في الرحم. هذا المرض هو المرض الأكثر شيوعًا للأعضاء التناسلية الأنثوية ويمثل 25٪ من جميع الآفات النسائية. يتم تشخيصه بشكل رئيسي عند النساء المسنات وقبل انقطاع الطمث.
ورم عضلي أملس عقيدي في الرحمتتميز بتكوين ضغطات فوضوية من ألياف العضلات الملساء. يتراوح حجم هذه العقد من بضعة ملليمترات إلى 1-5 كجم.
مسببات المرض
لم يتم تحديد الأسباب الموثوقة لتطور الورم العضلي الأملس الرحمي. وفقا للعلماء، تلعب عوامل الخطر التالية دورا هاما في حدوث الأورام الحميدة في جدار الرحم:
- عدم التوازن الهرموني. اليوم، مسألة الأولوية أو الطبيعة الثانوية للخلل الهرموني مفتوحة.
- تأخر بداية الدورة الشهرية.
- تاريخ من عمليتي إجهاض أو أكثر.
- الأمراض الالتهابية المزمنة في الأعضاء التناسلية الأنثوية.
- السمنة ونمط الحياة المستقرة.
تصنيف الأورام العضلية الملساء الرحمية
عادةً ما يتم تقسيم الأورام العضلية الملساء الرحمية وفقًا لعدة معايير:
- عدد الآفات العقيدية:
الفردي.
عديد.
- توطين الأورام في أنسجة الرحم:
أمراض تحت المخاطية:
يقع الورم العضلي في الغشاء المخاطي ويتميز بتكوين ورم على ساق رفيع ينزل إلى تجويف الرحم. هذا النوع من الأورام الليفية نادر نسبيًا.
علم الأمراض داخل العضل:
تنبؤ بالمناخ
تشخيص المرض مواتية في معظم الحالات. في بعض الحالات، تعاني النساء بعد انقطاع الطمث من تراجع تلقائي للورم.
يوفر الانصمام والاستئصال للأورام الليفية من أنسجة الرحم علاجًا كاملاً في 50٪ من الحالات السريرية.
كم من الوقت يعيش الناس مع هذا المرض؟
بعد العلاج المحافظ لآفات الورم الليفي، يجب فحص المرضى من قبل طبيب أمراض النساء سنويا. تسمح الفحوصات الوقائية المجدولة بالكشف في الوقت المناسب عن تكرار المرض والعلاج المناسب. الورم العضلي الأملس الرحمي، الذي يبلغ معدل البقاء على قيد الحياة حوالي 100٪، عند إجراء العملية الجراحية، لا يتطلب مراقبة خاصة للأورام.
ورم عضلي أملس في الرحميتم تشخيصه بشكل رئيسي أثناء الفحص الروتيني لأمراض النساء وبعد إجراء التشخيص النهائي، سيتم تقديم العلاج المناسب للمريضة. يجب أن نتذكر أن الأورام الحميدة لديها قدرة عالية على التنكس السرطاني.
MGMSU، NTSAGiP RAM
الورم العضلي الأملس الرحمي هو ورم الحوض الأكثر شيوعًا عند النساء، ويحدث في حوالي 30٪ من المرضى الذين تزيد أعمارهم عن 35 عامًا، ومع ذلك، يشير تحليل المواد المقطعية إلى أن حدوث هذا المرض أعلى بكثير.
نزيف الرحم، وآلام البطن، واحتباس البول، والإمساك، والعقم، والإجهاض، والولادة المبكرة - كل هذه الأعراض للورم العضلي الأملس الرحمي تؤدي إلى تفاقم نوعية حياة المرأة بشكل كبير. المؤشر الأكثر شيوعًا (في 30-40٪ من الحالات) لاستئصال الرحم هو الورم العضلي الأملس الرحمي - وهي عملية تزيل الألم ونزيف فقر الدم، ولكنها لا تحل مشاكل الإنجاب، على العكس من ذلك، تجعل المرأة عقيمة بشكل لا رجعة فيه.
حتى الآن، لا توجد أفكار واضحة حول المسببات المرضية للورم العضلي الأملس الرحمي، ولكن تم تجميع مواد بحثية كافية للسماح لنا بإعادة النظر في وجهات النظر السابقة.
I. الحقائق التي يمكن أن تقلل بشكل كبير من اليقظة السرطانية لدى المرضى الذين يعانون من الورم العضلي الأملس الرحمي.
1. وفقا لعدد من المؤلفين، فإن وتيرة الأورام الخبيثة في الورم العضلي الأملس الرحمي تتراوح من 0.18 إلى 3.1٪ من الحالات. يمكن اعتبار احتمالية الإصابة بعملية خبيثة منخفضة للغاية، مع الأخذ في الاعتبار حقيقة أن الساركوما العضلية الأملس الرحمية نفسها هي ورم نادر جدًا، ويحدث بمعدل 30 مرة أقل من أي ورم خبيث آخر.
2. فقط 30-50% من الأورام العضلية الملساء لديها انحرافات صبغية. كما يتبين من الأرقام، فإن هذه الخاصية للورم العضلي الأملس متناقضة، على الأرجح، ويرجع ذلك إلى بروتوكولات البحث المختلفة. تم تحديد أكثر دقة أن انحرافات الكروموسومات تحدث غالبًا في الكروموسومات 7 و12 و14، بما في ذلك عمليات الحذف والانتقال. هناك أيضًا انحرافات في الكروموسومات الأخرى، بما في ذلك الكروموسوم X، لكنها معزولة وعلى الأرجح عشوائية. إن محاولات تحديد العلاقة بين الانحرافات الصبغية المذكورة أعلاه والعيوب في الجينات التي تشفرها في الورم العضلي الأملس مثيرة للجدل للغاية ولم تتم دراستها بشكل كامل. من المهم أيضًا ملاحظة أن هناك دراسة تشير إلى الطبيعة الثانوية للانحرافات الوراثية الخلوية في تطور الورم العضلي الأملس، بناءً على تحليل العقد العضلية التي تحتوي على خلايا ذات أنماط نووية طبيعية ومتغيرة.
3. كشفت الدراسات التي أجريت على أورام العضلات الملساء الرحمية الحدية، مثل الورم العضلي الأملس الخلوي، والورم العضلي الأملس الغريب، والورم العضلي الأملس النشط الانقسامي، والورم العضلي الأملس غير النمطي، والورم العضلي الأملس مع احتمالية خبيثة غير واضحة، أن عرضها السريري والتشخيص يشبه الورم العضلي الأملس النموذجي. ومع ذلك، من الضروري إجراء تشخيص نسيجي شامل، بناءً على ثلاث سمات رئيسية: كثافة الخلية، وعدم النمطية الخلوية، ووجود أشكال انقسامية في نواة الخلية. بالإضافة إلى العلامات المذكورة أعلاه، يمكن أن يكون عدد الخلايا البدينة في مجال رؤية تمثيلي كبير مؤشرًا مهمًا في التشخيص التفريقي. وبالتالي، فإن 16 خلية بدينة في مجال رؤية كبير واحد تفرق الساركوما العضلية الأملس عن الورم العضلي الأملس الخلوي والورم العضلي الأملس الغريب، وهذه الميزة لها حساسية بنسبة 100% ونوعية بنسبة 96%.
4. يقوم عدد من الأورام الخبيثة بإفراط في تصنيع IGF-II (عامل النمو الشبيه بالأنسولين)، وهو عامل نمو له آلية عمل autocrine-paracrine التي تدعم وتعزز نمو الورم. عادة، يحدث نسخ الجين الذي يشفر IGF-II فقط من الأليل الأبوي، أحادي الأليلة، أي أن هناك ما يسمى ببصمة جين IGF-I. في الساركوما العضلية الأملس، على عكس الورم العضلي الأملس، يتم التعبير عن IGF-II بكميات أعلى بكثير، والذي ثبت أنه ناتج عن فقدان بصمة جين IGF-II، أي تعبيره الثنائي، والذي لم يتم ملاحظته في الورم العضلي الأملس .
5. كشفت دراسة للتعبير عن الجينات الورمية البروتينية المختلفة في أنسجة عضل الرحم الطبيعية وفي الورم العضلي الأملس أن مستوى الجين الورمي البروتيني c-fos في الورم العضلي الأملس أقل بكثير مما هو عليه في عضل الرحم المحيط. هناك أدلة على أن c-fos يلعب دورًا مهمًا في الأورام الخبيثة الحميدة. وبالتالي، فإن المستوى المنخفض لـ c-fos الموجود في الورم العضلي الأملس قد يحميه من التحول الخبيث. تم أيضًا اكتشاف مستوى منخفض من الجين الورمي البروتيني c-myc في الورم العضلي الأملس، وترتبط الزيادة في التعبير عنه بالأورام الخبيثة. بالإضافة إلى ذلك، فقد ثبت أن التعبير عن الجينات الورمية الأولية في الورم العضلي الأملس وعضل الرحم الطبيعي مستقل عن الهرمونات الجنسية.
6. نمط التعبير عن الإنتغرين والكادهيرين (جزيئات التصاق الخلايا) في الورم العضلي الأملس يتوافق مع ذلك الموجود في الأنسجة العضلية الملساء الطبيعية، بينما في الساركومة العضلية الملساء تم اكتشاف تلف في التعبير عن جزيئات التصاق الخلايا المختلفة. وبالتالي، على النقيض من العمليات التي يرتبط فيها التكاثر والتمايز ارتباطًا وثيقًا بالتغيرات في التعبير عن جزيئات التصاق الخلايا (الأورام الخبيثة)، فإن نمو وتطور الورم العضلي الأملس الرحمي لا يصاحبه مثل هذه التغييرات ويشبه في هذه الخاصية عضل الرحم الطبيعي. . من ناحية أخرى، يمكن الافتراض أن الحفاظ على النمط الظاهري الحميد بواسطة الورم العضلي الأملس هو نتيجة للنمط الطبيعي للتعبير عن جزيئات التصاق الخلايا على خلايا العضلات الملساء للورم العضلي الأملس
أظهرت الدراسات الكيميائية المناعية والكيميائية المناعية والكيميائية المناعية والمورفولوجية التي أجريت لمقارنة الورم العضلي الأملس والساركوما العضلية الأملس وجود فرق كبير بين هذه الأورام.
الورم العضلي يفتقر إلى p53 المتحول
مؤشر الوسم لـ PCNA و Ki-67 في ساركومة عضلية أملس أعلى بكثير منه في الورم العضلي
يرتبط مستوى PCNA/Ki-67 بمستوى موت الخلايا المبرمج في عضل الرحم الطبيعي وفي الأورام الليفية، ولكن ليس في الساركومة العضلية الملساء
تتوافق نسبة الأشكال الإسوية للميوسين SM1/SM2 مع مراحل مختلفة من تطور الورم الليفي وترتبط بديناميكيات الانتشار/موت الخلايا المبرمج، بينما في الساركوما العضلية الأملس في الرحم والمعدة والأمعاء هناك نسبة محددة من SM1/SM2 و/أو غير عضلية. الميوسين، وهو لا يوازي الانتشار وموت الخلايا المبرمج في هذه الأورام
وبالتالي، فإن الورم العضلي الأملس الرحمي هو تكوين ذو احتمالية منخفضة للغاية للإصابة بالأورام الخبيثة. وهذا أمر مهم، حيث لا يزال يتم تقديم العلاج الجراحي للنساء على أساس الاحتمال الكبير للإصابة بورم خبيث.
ثانيا. الفيزيولوجيا المرضية
لقد ثبت مؤخرًا أن الورم العضلي الأملس الرحمي أحادي النسيلة، أي أن تطوره يحدث من خلية واحدة. في الوقت الحالي، يمكن التمييز بين نظريتين حول أصل الخلية السليفة. الأول هو وراثي، والثاني يعتمد على حقيقة أن طفرة جسدية ثانوية تحدث في خلية عضل الرحم الطبيعية تحت تأثير عوامل غير محددة. أود أن أتناول النظرية الأولى بمزيد من التفصيل.
يستمر التطور الجيني لخلايا العضلات الملساء ذات الأصل الباطني (الجهاز الهضمي والإفرازي) بشكل أسرع من خلايا العضلات الملساء ذات الأصل المتوسط (الجهاز التناسلي) ؛ 12 و 30 أسبوعا على التوالي. تتمتع الخلايا غير المتمايزة التي تتمايز بشكل أكبر إلى خلايا العضلات الملساء الرحمية بفترة أطول غير مستقرة تتعرض خلالها لعوامل أمومية مختلفة مثل الهرمونات الجنسية و/أو عوامل النمو والفيروسات والسموم وغيرها. من المحتمل أن تصبح بعض هذه الخلايا معيبة، وبالتالي تصبح خلايا مقدمة للورم العضلي الأملس. قبل بدء الحيض، لا تظهر هذه الخلايا نفسها بأي شكل من الأشكال. بعد بدء الحيض، يمكن أن تبدأ هذه الخلايا في النمو، ولكن على الأرجح يكون هناك حاجة إلى عامل محفز لذلك.
بغض النظر عن كيفية ووقت تكوين الخلية السلفية، تؤدي الطفرات في هذه الخلية إلى حقيقة أنها تصبح شديدة الحساسية للعوامل المختلفة التي تحفز تكاثرها، في حين أن خلايا عضل الرحم الطبيعية لا تظهر نشاطًا تكاثريًا. ومن المهم أن نلاحظ أن هذه عملية محلية، وكما سيتم وصفه أدناه، يتم تصنيع معظم المشاركين فيها في الرحم نفسه. التأثير الجهازي، على سبيل المثال، حالة فرط الإستروجين، لا يمكن أن يسبب عملية محلية في العضو المستهدف دون التأثير على العضو بأكمله.
التسبب في الورم العضلي الأملس الرحمي، مثل معظم الأمراض، ينطوي على العديد من العوامل التي تتفاعل مع بعضها البعض، وتنفيذ آلية معقدة لتطوير العملية المرضية. في التسبب في الورم العضلي الأملس الرحمي، يمكن تمييز العوامل التالية: الهرمونات الجنسية، وعوامل النمو ومجموعة من العوامل التي تم تحديد ارتباطها بتطور الورم العضلي الأملس، ولكن بالمقارنة مع العوامل الأخرى، لم يتم دراستها بشكل كاف.
الهرمونات الجنسية
تشير الزيادة في حدوث الورم العضلي الأملس بعد الحيض، وزيادة حجم الورم العضلي الأملس أثناء الحمل، وكذلك تراجعه بعد انقطاع الطمث إلى اعتماد نمو الورم العضلي الأملس على الهرمونات الجنسية.
تقليديا، يعتبر هرمون الاستروجين هو المحفز الرئيسي لنمو الورم العضلي الأملس. تثبت هذه الحقيقة وجود عدد كبير من الدراسات التي كشفت عن زيادة في الورم العضلي الأملس مقارنة مع عضل الرحم الطبيعي من هرمون الاستروجين ومستقبلاته، وانخفاض كبير في حجم العقدة العضلية مع نقص هرمون الاستروجين في الدم المصطنع (العلاج ناهض GHRH)، وكذلك كما انخفاض كبير في تحويل استراديول إلى استرون في الورم العضلي الأملس. على الرغم من أن هذه الملاحظات تشير إلى وجود بيئة مفرطة الاستروجين داخل العقدة العضلية، إلا أنها في الوقت نفسه لا تثبت التحفيز المباشر لنمو الورم العضلي الأملس بواسطة هرمون الاستروجين.
ومن المثير للاهتمام أيضًا أن نلاحظ أنه في عضل الرحم وبطانة الرحم المحيطة بالعقدة العضلية الملساء يوجد إنتاج محلي لهرمون الاستروجين بسبب تحويل كبريتات الاسترون بواسطة سلفاتاز الاسترون إلى استرون. في المقابل، في العقدة العضلية هناك زيادة في نشاط إنزيم ناقلة الكبريت الإستروني، الذي يحول الإسترون إلى الشكل الأقل نشاطًا - كبريتات الإسترون. بالإضافة إلى ذلك، في العقدة العضلية، يمكن تحويل الأندروستينيديون إلى إسترون. في 91% من حالات الورم العضلي الأملس وفي 75% من الحالات في عضل الرحم المجاور، تم اكتشاف نشاط السيتوكروم P450، المسؤول عن تحويل المنشطات C19، بينما في عضل الرحم الذي لا يحتوي على عقد عضلية، تم اكتشاف نشاط ولم يتم الكشف عن هذا الانزيم.
لقد تم الآن الكشف عن أن هرمون الاستروجين يحفز التعبير عن مستقبلات البروجسترون وEGF، وتوليف IGF-I وIGF-II، ويزيد من محتوى النوع الأول والثالث من الكولاجين mRNA في الخلية، ويحفز الإنتاج المحلي لهرمون الغدة الدرقية. مثل الببتيد. يكون التعبير عن هذه الجينات التي تنظمها هرمون الاستروجين أكبر بكثير في الورم العضلي الأملس مقارنةً بالورم العضلي الرحمي المجاور. استنادا إلى هذه الملاحظات، فقد اقترح أن زيادة الحساسية لهرمون الاستروجين هو عامل مهم في التسبب في الورم العضلي الأملس الرحمي.
ومع ذلك، كما هو الحال مع هرمون الاستروجين، ترتفع مستويات البروجسترون بشكل دوري طوال فترة الإنجاب، وتزيد بشكل ملحوظ أثناء الحمل، وتنخفض أيضًا أثناء انقطاع الطمث والعلاج بمحفزات GnrH. ولذلك، كان من الصعب للغاية تحديد الدور القيادي لأي شخص في التسبب في الورم العضلي الأملس، مع الأخذ بعين الاعتبار هذه الملاحظات فقط.
في عام 1949، سيغالوف وآخرون. نشرت بيانات عن زيادة في الخلوية والنشاط الانقسامي للأورام الليفية في 6 مرضى عولجوا بالبروجستيرون. وفي وقت لاحق، ظهرت المزيد من الأدلة التي تشير إلى الدور المركزي للبروجستيرون في نمو الأورام العضلية الملساء الرحمية. وهكذا، أظهر Tiltmam زيادة كبيرة في عدد الانقسامات في مجال رؤية واحد في الاستعدادات النسيجية للعقدة العضلية في المرضى الذين يتلقون خلات الميدروكسي بروجستيرون مقارنة بالمجموعة الضابطة. كاواجوتشي وآخرون. عند دراسة دور تأثير مراحل الدورة الشهرية على مستوى الانقسامات في الورم العضلي الأملس، تبين أنه في المرحلة الإفرازية كان عدد الانقسامات أكبر بكثير من المرحلة التكاثرية أو أثناء الحيض، على التوالي 12.7/3.8/ 8.3 لكل 100 مجال رؤية.
نفس المجموعة من المؤلفين، عند دراسة خصائص البنية التحتية لخلايا الورم العضلي الأملس المزروعة وخلايا عضل الرحم الطبيعية، وجدت أن خلايا الورم العضلي وخلايا عضل الرحم في وسط يحتوي على هرمون الاستروجين والبروجستيرون كانت أكثر نشاطًا تحت المجهر الإلكتروني منها في وسط تحكم ووسط يحتوي على هرمون الاستروجين فقط. . في خلايا الورم العضلي الأملس، تحت تأثير هرمون الاستروجين والبروجستيرون، زاد عدد الخيوط العضلية والأجسام الكثيفة.
برانون وآخرون. كشفت عن زيادة في مستقبلات هرمون البروجسترون في الورم العضلي الأملس مقارنة مع عضل الرحم الطبيعي. في عضل الرحم، يتم التعبير عن النوعين A وB من مستقبلات البروجسترون بكميات متساوية. يرتبط البروجسترون في الغالب بمستقبلات النوع B، والنوع A بدوره يمنع التعبير عن النوع B. في 40%، يتم التعبير بشكل مفرط عن مستقبلات النوع B على سطح العقد العضلية.
وقد لوحظ أيضًا أن هرمون البروجسترون يمنع التعبير عن مستقبلات هرمون الاستروجين، في حين يزيد هرمون الاستروجين من التعبير عن مستقبلات هرمون البروجسترون في كل من عضل الرحم والورم العضلي الأملس. وبالتالي، فإن البروجسترون قادر على أن يكون له تأثير مزدوج على الورم العضلي الأملس: أولاً، عن طريق منع عمل هرمون الاستروجين، وتثبيط التعبير عن مستقبلاته، وثانيًا، ممارسة تأثيره مباشرة من خلال مستقبلاته.
ومن المهم أيضًا تسليط الضوء على الملاحظات السريرية التي تثبت الدور الرئيسي للبروجستيرون في نمو الأورام العضلية الملساء الرحمية.
في عام 1961، وصف ميكسون وهاموند 16 مريضة مصابة بالورم العضلي الأملس في الرحم، تناولن البروجستين نوريثينودريل الاصطناعي بجرعة كافية للحفاظ على انقطاع الطمث. في 15 من هؤلاء المرضى كانت هناك زيادة كبيرة في حجم الرحم. بعد 12 أسبوع من التوقف عن تناول الدواء، انخفض حجم الرحم لدى جميع المرضى، وفي 70٪ من المرضى، عاد الرحم إلى حجمه الأصلي. وخلص الباحثون إلى أن النوريثينودريل يسبب تضخمًا سريعًا ولكن قابلاً للعكس للورم العضلي الأملس.
المزيد من الدراسات الحديثة التي أجراها فريدمان وآخرون. أظهر أن الجمع بين منبهات GnrH وخلات الميدروكسي بروجستيرون لا يؤدي إلى انخفاض في حجم العقدة العضلية، كما لوحظ عند تناول منبهات GnrH وحدها.
أدى استخدام عقار مضاد البروجسترون RU-486 في المرضى الذين يعانون من الورم العضلي الأملس الرحمي إلى انخفاض في حجم الورم العضلي الأملس بنسبة 49٪ بعد 12 أسبوعًا من بدء العلاج. لم تتغير مستويات مصل الاستراديول والإسترون والبروجستيرون في المرحلة الجرابية المبكرة. كشفت الدراسات الكيميائية المناعية عن انخفاض كبير في عدد مستقبلات هرمون البروجسترون في الورم العضلي الأملس، في حين لم يتغير مستوى مستقبلات هرمون الاستروجين، مما يشير إلى إمكانية تراجع العقدة العضلية من خلال تأثير مضاد البروجسترون المباشر.
في واحدة من أحدث الدراسات، باستخدام علامة تكاثر الخلايا PCNA، تبين أن الاستراديول والبروجستيرون يحفزان تكاثر خلايا الورم العضلي الأملس، وأن خلايا عضل الرحم الطبيعية تتكاثر فقط استجابةً لإضافة الاستراديول. بالإضافة إلى ذلك، وجد أن القيم القصوى لمؤشر تسمية PCNA يتم ملاحظتها في المرحلة الإفرازية من الدورة الشهرية، والتي يهيمن عليها هرمون البروجسترون. وقد وجد أيضًا أن البروجسترون قادر على زيادة التعبير عن EGF بشكل ملحوظ في الورم العضلي الأملس، وهو الميتوجين الرئيسي، في حين أن الاستراديول ليس له أي تأثير على التعبير عن عامل النمو هذا. ومع ذلك، على عكس هرمون البروجسترون، استراديول يزيد بشكل كبير من التعبير عن مستقبلات EGF وكذلك مستقبلات هرمون البروجسترون.
ولذلك، هرمون البروجسترون والبروجستينات تعزز نمو الأورام العضلية الملساء. الأدلة البيوكيميائية والمورفولوجية والسريرية المذكورة أعلاه تدعم بقوة هذه الفرضية.
يقوم هرمون الاستروجين والبروجستيرون، معًا أو بشكل منفصل، بقمع إنتاج عامل الانجذاب الكيميائي الوحيدات 1 (MCF-1)، وهو المسؤول عن الانجذاب الكيميائي وتنشيط الوحيدات، التي تنتجها الأورام المختلفة وله تأثير مضاد للأورام، أي. E2 وP قادران على تحفيز نمو العقدة العضلية من خلال قمع إنتاج PCM-1
عوامل النمو
كما هو موضح في العديد من الدراسات، فإن عمل عضل الرحم كنسيج يعتمد على الهرمونات يتوسط عوامل النمو التي تنظم تكاثر وموت الخلايا العضلية الملساء، وتتوسط عمل هرمون الاستروجين والبروجستيرون وتنظم الحالة الوظيفية للعضلات الملساء الخلايا (إفراز مكونات المصفوفة خارج الخلية، والتعبير عن المستقبلات المختلفة، والنشاط المقلص، والاتصالات بين الخلايا، وما إلى ذلك). بناءً على هذه البيانات، تمت صياغة نظرية الاستروميدين، والتي تنص على أن هرمون الاستروجين الذي يعمل على أنسجة العضلات والورم العضلي الأملس يسبب إنتاجًا موضعيًا لعوامل النمو، والتي بدورها تظهر جميع تأثيرات هرمون الاستروجين في هذه الأنسجة.
الآلية الرئيسية لعمل عوامل النمو هي الأوتوقراطي/النظير الصماوي، وبالتالي، في العملية المرضية المحلية، تلعب هذه العوامل أيضًا دورًا رئيسيًا.
تلعب عوامل النمو التالية دورًا رئيسيًا في التسبب في الورم العضلي الأملس الرحمي: EGF (عامل نمو البشرة)، IGF-I (عامل النمو الشبيه بالأنسولين وبروتيناته المرتبطة، والتي تؤدي دورًا تنظيميًا)، TGF beta (عامل النمو المتحول) . هناك عاملان آخران للنمو - bFGF (عامل نمو الخلايا الليفية الأساسية) وPDGF (عامل النمو المشتق من الصفائح الدموية) يشاركان أيضًا في التسبب في الأورام العضلية الملساء الرحمية، ولكن، على ما يبدو، دورهما ثانوي أو غير مفهوم تمامًا. يرتبط EGF وIGF-I ارتباطًا وثيقًا بالهرمونات الجنسية وهم وسطاء لعملهم في الرحم والأعضاء الأخرى.
عوامل النمو الشبيهة بالأنسولين هي بروتينات منخفضة الوزن الجزيئي تشبه من الناحية الهيكلية البرونسولينلين، والتي تحفز تكاثر وتمايز الخلايا في الأنسجة المختلفة. يتم تعديل نشاط عوامل النمو هذه بواسطة 6 بروتينات ربط (IGFBP1-6)، والتي لها ألفة أكبر من مستقبلات IGF. البروتينات الملزمة المنتشرة في الدم تحمي IGF من التدمير وترك الدورة الدموية. في الفضاء خارج الأوعية الدموية، تنقل البروتينات الرابطة IGF إلى الخلايا المستهدفة وتكون أيضًا قادرة على تحفيز أو تثبيط ارتباط IGF بمستقبلاتها المحددة. ويرجع ذلك إلى وجود البروتياز الخاص القادر على تحطيم عامل النمو + مركب البروتين المرتبط إلى أجزاء ذات تأثيرات مختلفة.
في الورم العضلي الأملس الرحمي والعضلي الطبيعي، تم العثور على IGF I و II، وكذلك بروتينات الارتباط IGFBP 2،3،4 و 5، وبدرجة أقل، يتوسط IGF-II عمل هرمون الاستروجين على عضل الرحم. والورم العضلي الأملس، مما يسبب تكاثر هذه الأنسجة. بالإضافة إلى ذلك، فإن عوامل النمو هذه قادرة على تحفيز الانقسام الفتيلي لخلايا الورم العضلي الأملس في غياب الهرمونات الجنسية.
البيانات المتعلقة بتركيزات IGF-I وIGF-II في أنسجة الورم العضلي الأملس وعضل الرحم المحيط بها متناقضة تمامًا. يدعي بعض المؤلفين أنه في الورم العضلي الأملس يزداد تركيز IGF-I و II مقارنة بعضل الرحم الطبيعي، ويكشف آخرون عن النسبة المعاكسة، ويحصل عدد من المؤلفين على بيانات حول نسبة متساوية من تركيزات هذه البروتينات. ويرجع ذلك على الأرجح إلى الأساليب المختلفة المستخدمة من قبل هؤلاء الباحثين، فضلا عن الاختلافات في نوعية وعدد المرضى المختارين. ومع ذلك، فإن نتائج معظم المؤلفين تتفق على التعبير بشكل أكبر بكثير عن مستقبلات IGF-I في الورم العضلي الأملس وعضل الرحم. على الرغم من حقيقة أن تركيز IGF-I في الورم العضلي الأملس قد لا يتغير، فإن حقيقة زيادة حساسية الورم العضلي الأملس تجاه IGF-I تلعب دورًا مهمًا، حيث يتم تصنيع IGF-I بواسطة عضل الرحم أو بطانة الرحم المحيطة (هذا تحتوي الأنسجة أيضًا على محتوى كبير من عامل النمو هذا)، وهي قادرة على تحفيز أنسجة الورم العضلي الأملس الحساسة للغاية، مما يؤدي إلى نموها. في الدراسات المختبرية، كانت الاستجابة الانقسامية لخلايا الورم العضلي الأملس لإضافة IGF-I دائمًا أكبر بكثير من استجابة خلايا عضل الرحم الطبيعية.
البروتين الملزم 3 (IGFBP-3)، وهو المعدل الرئيسي لنشاط عوامل IGF. من خلال تكوين مركب IGF+IGFBP-3، فإنه يمنع أو يحفز ارتباط عوامل IGF بمستقبلاتها، وبالتالي تثبيط أو تحفيز تأثيرها على الخلية المستهدفة. بالإضافة إلى ذلك، IGFBP-3 قادر أيضًا على تثبيط تكاثر الخلايا بشكل مستقل عن طريق الارتباط بمستقبلاته المحددة على سطح الخلية.
ميزة أخرى لـ IGF-I هي قدرته على تغيير إفراز البرولاكتين بواسطة الأورام العضلية الملساء. البرولاكتين قادر أيضًا على تحفيز تكاثر خلايا الورم العضلي الأملس. لقد سبق أن تبين أن عضل الرحم والورم العضلي الأملس الطبيعي يفرزان البرولاكتين، ومع ذلك، فإن IGF-I قادر على زيادة إنتاج البرولاكتين بشكل يعتمد على الجرعة عن طريق الورم العضلي الأملس مقارنة بالورم العضلي الأملس المحيط.
EGF، على عكس عوامل IGF، لا يحتوي على نظام بروتيني ملزم، ومع ذلك، فهو ميتوجين أقوى للورم العضلي الأملس وعضل الرحم الطبيعي من عوامل IGF. كما ذكر أعلاه، يتم تحفيز إنتاجه في الورم العضلي الأملس وعضل الرحم بواسطة هرمون البروجسترون، ويزداد التعبير عن المستقبلات تحت تأثير هرمون الاستروجين.
عامل نمو آخر يشارك في التسبب في الأورام العضلية الملساء في الرحم هو bFGF. يلعب عامل النمو هذا دورًا رئيسيًا في تنظيم تكاثر وحركة وتمايز خلايا الأنسجة ذات الأصل المتوسط. تم التعرف على bFGF في الأورام الحميدة والخبيثة في الجهاز العصبي المركزي، وكذلك في سرطان غدي بطانة الرحم، حيث يتم تنظيم إنتاجه عن طريق هرمون الاستروجين. كعامل وعائي، يلعب bFGF دورًا مهمًا في نمو الورم عن طريق الحفاظ على إمدادات الدم.
bFGF هو أيضًا ميتوجين للورم العضلي الأملس والأورام العضلية الملساء. تم اكتشاف محتوى أعلى من عامل النمو هذا في الورم العضلي الأملس مقارنةً بالعضل العضلي المحيط به. على الأرجح، ويرجع ذلك إلى المحتوى الزائد من المصفوفة خارج الخلية (ECM) في العقدة العضلية، في حين يتم ترجمة bFGF في المقام الأول في ECM. ينظم bFGF إنتاج الإنزيمات المسؤولة عن إعادة هيكلة ECM، مثل الكولاجيناز ومنشط البلازمينوجين، ويؤثر أيضًا على التعبير عن الإنتغرينات وجزيئات التصاق الخلايا الأخرى. ركزت الأبحاث الحديثة حول عامل النمو هذا على الخصائص الفريدة لأحد أشكال مستقبلاته. اتضح أن النوع الأول من هذا المستقبل قادر على الإفراز، أي أنه موجود بدون مجال عبر الغشاء. لقد ثبت أن هذا النوع من المستقبل متورط في نزيف الرحم المرتبط بالورم العضلي الأملس عن طريق إضعاف تكوين الأوعية الدموية في بطانة الرحم. لوحظ انخفاض في محتوى هذا المستقبل في سدى بطانة الرحم لدى النساء الأصحاء في المرحلة الأصفرية من الدورة، بينما لم يتم اكتشاف مثل هذه التغييرات في النساء المصابات بالورم العضلي الأملس الرحمي وظل مستوى مستقبلات bFGF كما هو. من المحتمل أن تكون هذه الظاهرة مرتبطة بطريقة ما بالبروجستيرون، الذي يهيمن في هذه المرحلة من الدورة.
تم اكتشاف عامل النمو المحول بيتا (TGFbeta)، كما هو موضح أعلاه، أيضًا في عضل الرحم والورم العضلي الأملس، ومع ذلك، فإن خصوصيته هي أنه في عضل الرحم، على عكس الورم العضلي الأملس، يُظهر عامل النمو هذا تأثيرًا على مرحلتين. أي أنه بتركيزات منخفضة، يحفز TGFbeta تكاثر خلايا عضل الرحم، وبتراكيز عالية يثبط. وكان هناك تأثير مماثل غائبا في الورم العضلي الأملس. من المحتمل أن يلعب TGF beta دورًا تنظيميًا في التنظيم الاستبدادي للنمو، كونه مكونًا مثبطًا على عكس التأثير المحفز للانتشار لعوامل النمو الأخرى. من هذا يمكننا أن نستنتج أنه من الممكن أن يتم تعطيل هذا التنظيم السلبي للنمو في الورم العضلي الأملس، وهو رابط آخر في التسبب في المرض.
أما بالنسبة لعامل النمو المشتق من الصفائح الدموية (PDGF)، فمن المعروف أنه قادر على تحفيز تكاثر الورم العضلي الأملس والخلايا العضلية الرحمية. هناك حاجة إلى مزيد من البحث لتحديد مكانها في التسبب في الورم العضلي الأملس، في حين يتم تعيين دور ثانوي لها.
عوامل اخرى
وتشمل العوامل الأخرى هرمون النمو النخامي.
في عام 1963، وجد العلماء الفرنسيون أن نسبة الإصابة بالورم العضلي الأملس الرحمي أعلى لدى النساء المصابات بتضخم الأطراف مقارنة ببقية السكان، وكما هو معروف، مع هذا المرض يرتفع مستوى هرمون النمو (GH) في الدم. ينظم هرمون النمو نمو وتمايز مختلف الأعضاء المستهدفة من خلال الارتباط بمستقبله المحدد. يوجد أكبر عدد من مستقبلات هرمون النمو في الكبد. ومن المعروف أيضًا أن هرمون النمو يحفز الكبد على إنتاج هرمون IGF-I، والذي بدوره يتوسط تأثير هرمون النمو على الأعضاء المستهدفة.
تم تحديد مستقبلات هرمون النمو في عضل الرحم والورم العضلي الأملس، ولم يكن هناك اختلاف في التعبير عن هذا المستقبل بين الأنسجة. العلاج بمنبهات GnRH لا يغير التعبير عن مستقبلات هرمون النمو في الورم العضلي الأملس وعضل الرحم، مما يشير إلى أن مستقبلات هرمون النمو لا يتم تنظيمها بواسطة هرمون الاستروجين. ولوحظ أيضًا أنه عند النساء المصابات بالورم العضلي الأملس، يكون المستوى المحفز لهرمون النمو في الدم أعلى مقارنةً بالضوابط المرتبطة بالعمر.
موت الخلايا المبرمج في الورم العضلي الأملس
يتكون نمو الورم من توازن ديناميكي بين تكاثر الخلايا وموت الخلايا. وبالتالي، قد يرتبط النمو بكل من تكاثر الخلايا المفرط وانخفاض مؤشر موت الخلايا. في الآونة الأخيرة نسبيًا، تم الحصول على بيانات تفيد بأن الخلية قادرة على استقبال إشارات لكل من الانقسام والموت، مما يؤدي إلى سلسلة من العمليات المعقدة التي تؤدي إلى تكثيف الكروماتين، والتغيرات في نفاذية الغشاء، والتجاعيد، وفي النهاية إلى تجزئة الخلية مع تكوين غشاء محاط. ، ما يسمى بالأجسام الأبوطوزية. تسمى هذه العملية موت الخلايا المبرمج - موت الخلايا المبرمج، وقد وجد أن الجين الورمي البروتيني Bcl-2، الذي تم اكتشافه لأول مرة في الأورام اللمفاوية في الخلايا البائية، يلعب دورًا مهمًا في تنظيم هذه الظاهرة. تؤدي زيادة التعبير عن Bcl-2 في الخلية إلى تغيير المسار الطبيعي لموت الخلايا المبرمج وبالتالي زيادة عمر خلية معينة. وبالتالي، يلعب Bcl-2 دورًا مهمًا في نمو الورم، حيث يعمل كأحد منظمات التوازن بين التكاثر وموت الخلايا، لذلك يتم تحليل التعبير عن هذا الجين الورمي البروتيني واعتماد تعبيره على عوامل مختلفة في أي ورم. هي خاصية فيزيولوجية مرضية مهمة.
كشفت الدراسات الكيميائية المناعية عن وجود محتوى أعلى من Bcl-2 في الورم العضلي الأملس مقارنةً بعضل الرحم المحيط، مع أعلى تعبير لوحظ في المرحلة الإفرازية، البروجسترون، من الدورة الشهرية. لم يتم اكتشاف أي تغييرات دورية في تعبير Bcl-2 في عضل الرحم المحيط.
في دراسة مختبرية، تسبب علاج زراعة خلايا الورم العضلي الأملس بالبروجستيرون في زيادة سريعة في التعبير عن Bcl-2، بينما أدت إضافة الاستراديول إلى زيادة طفيفة في التعبير عن هذا الجين الورمي الأولي. بناءً على ذلك، يمكن الافتراض أن البروجسترون يشارك أيضًا في نمو الورم العضلي الأملس عن طريق تحفيز التعبير عن Bcl-2، الذي يمنع موت الخلايا المبرمج وبالتالي يزيد من العمر الافتراضي للخلية.
لذلك، يمكن تمثيل التسبب في الورم العضلي الأملس الرحمي على النحو التالي: من المحتمل أن تتشكل الخلية السليفة، والتي ستؤدي لاحقًا إلى استنساخ خلايا الورم العضلي الأملس، بطريقتين. الأول يرتبط بالاضطرابات الجينية، والثاني يعني حدوث طفرة جسدية في خلية عضلية ناضجة بالفعل. ونتيجة لذلك، تتعرض الخلية العضلية الطافرة لسلسلة معقدة من العوامل التي تحفز الانقسام الفتيلي للخلية الطافرة، والتي بدورها تساهم على الأرجح في انتشار الطفرات الجسدية.
العوامل الرئيسية المشاركة في بدء والحفاظ على نمو الورم العضلي الأملس تشمل هرمون الاستروجين والبروجستيرون وعوامل النمو. هناك تآزر بين هرمون الاستروجين والبروجستيرون. يمكن وصف دور هرمون الاستروجين بشكل فضفاض بأنه "مساعد"، في حين من المرجح أن يكون هرمون البروجسترون هو المخفف الرئيسي للورم العضلي الأملس. بالإضافة إلى ذلك، يبدو أن البروجسترون يعزز نمو الأورام العضلية الملساء، مما يطيل عمر الخلية عن طريق حمايتها من موت الخلايا المبرمج.
عوامل النمو هي وسطاء لعمل الهرمونات الجنسية، وتحفز تكاثر خلايا الورم العضلي الأملس، وتتسبب أيضًا في إنتاج وإعادة هيكلة المصفوفة خارج الخلية. عوامل النمو الرئيسية في التسبب في الأورام العضلية الملساء الرحمية هي EGF وIGF-I. آلية عملهم هي الاستبداد / باراكرين. عوامل النمو قادرة على ممارسة تأثيرها بغض النظر عن الهرمونات الجنسية، والتي في مراحل معينة من تطور الورم العضلي الأملس قد تشير إلى إمكانية استقلالية هذا التكوين.
تعد إمكانية الإنتاج المحلي لهرمون الاستروجين في الورم العضلي الأملس وفي عضل الرحم المحيط بها عاملاً مهمًا أيضًا في الحفاظ على نمو الورم العضلي الأملس.
وبالتالي، على الرغم من عدم وجود فهم دقيق لمسببات وتسبب الورم العضلي الأملس الرحمي، فقد تم بالفعل تجميع مواد كافية لتغيير النهج السريري والتشخيصي لهذا المرض. في الوقت الحالي، يوجد عقار (بيرفينيدون) في مرحلة التجارب السريرية، وهو قادر على العمل بشكل مباشر على عوامل النمو في الورم العضلي الأملس الرحمي، مما يؤدي إلى تراجع العقدة العضلية، وهذا الدواء ليس دواء هرمونيًا. الهدف الأكثر أهمية هو تحديد الأدلة التي تربط تطور الأورام العضلية الملساء الرحمية بالحالات المرتبطة غالبًا بهذا المرض، مثل الصدمات التوليدية وأمراض النساء، والعدوى، والتهاب بطانة الرحم.
أرز. 1. مخطط افتراضي للتسبب في الورم العضلي الأملس الرحمي. (بحسب ميتشل س. رين مع التغييرات والإضافات)؛ ER - مستقبلات هرمون الاستروجين. مستقبلات هرمون البروجسترون
فهرس
- جون أ. روك الفصل 276 - ورم عضلي أملس الرحم. راكيل: علاج كون الحالي 1998؛\
- Bonatz G.، Frahm O.S.، Andreas S.، Heidorn K.، Jonat W.، Parwaresch R. Telomere Shorting in الرحم الأملس الورم؛ المجلة الأمريكية لأمراض النساء والتوليد: المجلد 179؛ ن 3؛ سبتمبر 1998
- Orii A، Mori A، Zhai YL، Toki T، Nikaido T، Fujii S Mast cell في أورام العضلات الملساء في الرحم؛ إنت J جينكول باثول 1998 أكتوبر؛ 17 (4):336-42
- Valenti MT، Azzarello G، Vinante O، Manconi R، Balducci E، Guidolin D، Chiavegato A، Sartore S مستويات التمايز والانتشار وموت الخلايا المبرمج في الورم العضلي الأملس البشري والساركوما العضلية الأملس. J السرطان الدقة كلين أونكول 1998 124:2 93-105
- أندرادي LA، توريسان RZ، مبيعات JF الابن، R فيسينتيني، دي سوزا GA ورم عضلي أملس عن طريق الوريد من الرحم. تقرير لثلاث حالات. باثول أونكول ريس 1998؛ 4(1:44-7)
- Adesanya OO، Zhou J، Bondy CA تنظيم الستيرويد الجنسي للتعبير الجيني لنظام عامل النمو الشبيه بالأنسولين وانتشاره في عضل الرحم الرئيسيات. J كلين إندوكرينول ميتاب المجلد 81، العدد 5، مايو 1996
- Sozen I، Olive DL، Arici A Expression والتنظيم الهرموني للبروتين الكيميائي الوحيد الخلية -1 في عضل الرحم والورم العضلي الأملس. معقم فيرتيل 1998 يونيو؛ 69(6):1095-102
- فان دير فين ليو TM، فان بول-عروض SC، جلوديمانز T، بلومين RJ، روهول PJ، سوسينباخ JS، أوتر دبليو دي. تعديل عوامل النمو الشبيهة بالأنسولين التي تعمل بواسطة البروتينات المرتبطة بـ IGF في أنسجة العضلات الملساء الطبيعية والحميدة والخبيثة J Clin Endocrinol Metab Vol 81، N 10، أكتوبر 1996
- Shimomura Y، Matsuo H، Samotto T، Maruo T Up-Regulation بواسطة المستضد النووي لخلية البروجسترون وتعبير عامل نمو البشرة في الورم العضلي الأملس الرحمي البشري J Clin Endocrin Metab Vol.83 N 6 يونيو 1998
- Lee Byung-Seok، Margolin SB، Nowak RA Pirfenidone: عامل بارماكولوجي جديد يمنع تكاثر خلايا الورم العضلي الأملس وإنتاج الكولاجين J Clin Endocrin Metab Vol. 83 ن. 1 يونيو 1998
وهذا الورم الحميد غالباً ما يكون سبباً للعقم. ما هو الورم العضلي الأملس الرحم؟
 الورم العضلي الأملس الرحمي (الورم العضلي، الورم العضلي الليفي) هو مرض نسائي شائع يحدث غالبًا عند النساء الذين تتراوح أعمارهم بين 35 و 40 عامًا، ولكن يمكن أن يظهر في سن مبكرة.
الورم العضلي الأملس الرحمي (الورم العضلي، الورم العضلي الليفي) هو مرض نسائي شائع يحدث غالبًا عند النساء الذين تتراوح أعمارهم بين 35 و 40 عامًا، ولكن يمكن أن يظهر في سن مبكرة.
تجد النساء المصابات بهذا التشخيص صعوبة أكبر في الحمل وحمل الطفل حتى نهاية فترة الحمل. بالإضافة إلى ذلك، هناك خطر طفيف لتحول الورم الحميد إلى ورم خبيث. لذلك، من المهم اكتشاف المرض وعلاجه في الوقت المناسب.
ما هو الورم العضلي الأملس الرحمي
الورم العضلي الأملس هو ورم حميد يعتمد على الهرمونات في تجويف الرحم. هذه عقدة مستديرة يمكن أن يتراوح حجمها من عدة ملليمترات إلى عدة سنتيمترات أو أكثر.
يتشكل الورم عن طريق انقسام خلايا الأنسجة الضامة والعضلية في تجويف الرحم.
في معظم الحالات، لا يظهر الورم أي أعراض ويتم اكتشافه بالصدفة أثناء الفحص من قبل طبيب أمراض النساء.
وفي بعض الحالات يصاحب المرض الأعراض التالية:
- الحيض الثقيل
- ألم وثقل في أسفل البطن. إذا كانت العقدة ملتوية، يحدث ألم حاد في أسفل الظهر والبطن، وترتفع درجة حرارة الجسم.
- اضطراب الأعضاء المجاورة (على سبيل المثال، كثرة التبول، والإمساك).
- ضعف عام.
- تورم، .
- الاضطرابات الهرمونية.
أسباب ورم عضلي أملس الرحم
قد يرتبط ظهور الأورام الليفية باستعداد فردي أو بتأثير عوامل معينة:
- الأمراض الالتهابية للأعضاء التناسلية وغيرها من الأمراض النسائية.
- متكرر.
- تأخر الحيض، ونزيف الحيض الشديد.
- اضطرابات الغدد الكظرية والغدة الدرقية وأمراض القلب والأوعية الدموية.
- فقر دم.
- بداية متأخرة للنشاط الجنسي و/أو نشاط جنسي غير منتظم.
- الإجهاد العاطفي المفرط.
- نمط حياة سيئ (العمل المستقر، سوء التغذية).
تشخيص وعلاج الورم العضلي الأملس الرحمي
يبدأ تشخيص المرض بمقابلة المريض. يوضح الطبيب مدى غزارة الدورة الشهرية، ويكتشف وجود وعدد الولادات، والإجهاض ومضاعفاته، والأمراض المعدية السابقة والتدخلات داخل الرحم.
قد يشك الطبيب في وجود العقد العضلية أثناء الفحص المهبلي اليدوي. ويمكن الإشارة إلى ذلك من خلال زيادة حجم الرحم وعدم التجانس وعدم استواء سطح الرحم.
في المرحلة التالية، يتم استخدام المسح بالموجات فوق الصوتية لأعضاء الحوض. وفي بعض الحالات يتم استخدام التصوير بالرنين المغناطيسي، والأشعة المقطعية، وتنظير الرحم، وخزعة بطانة الرحم (في حالة نزيف الرحم).
تعتمد طريقة علاج الورم العضلي الأملس على الأعراض وحجم وموقع العقد الورمية وعمر المريضة وصحتها، فضلاً عن رغبتها في الحفاظ على الوظيفة الإنجابية. في معظم الحالات، يفضل الأطباء العلاج المحافظ لهذا المرض، ولكن في الحالات القصوى تكون الجراحة ضرورية.
مؤشرات العلاج المحافظ هي:
- رغبة المرأة في الإنجاب في المستقبل.
- مسار بدون أعراض للمرض.
- بطء نمو العقد.
- الأورام الليفية، حيث لا يتجاوز حجم الرحم حجم الرحم خلال فترة الحمل قبل 12 أسبوعًا.
- يكون موقع العقدة في جدار الرحم أو على قاعدة عريضة (داخلية أو تحتية).
- وجود أمراض يشكل فيها التخدير أو إجراء الجراحة خطورة.
- العلاج المحافظ كتحضير للجراحة أو إعادة التأهيل بعد استئصال الورم العضلي.
يشمل العلاج تناول الأدوية أو الأدوية الهرمونية التي توقف نمو الورم وتكاثره، وتقلل من الأعراض غير السارة. بعد العلاج المحافظ، تحتاج المرأة إلى فحصها مرة واحدة على الأقل كل 6 أشهر.
إذا كان الورم ينمو بسرعة، فإن حجم الرحم يتجاوز حجم الرحم أثناء الحمل في الأسبوع 12، وإذا تعطل عمل الأعضاء المجاورة، فينصح بإزالة جزء من الرحم أو العضو بأكمله جراحياً.
هناك الأنواع التالية من العلاج الجراحي للورم العضلي الأملس الرحمي:
استئصال الورم العضلي بالمنظار.مؤشرات: عدم وجود تأثير من العلاج المحافظ، العقد الموجودة تحت المصلية وداخل الجدار التي يبلغ قطرها أكثر من 2 سم، العقد المعنقة. بعد هذه العملية تبقى ندوب على الرحم، الأمر الذي يتطلب مراقبة خاصة إذا كانت المريضة حاملاً.
استئصال الورم العضلي بالمنظار.مؤشرات: ورم عضلي أملس معنق، موقع العقدة تحت المخاطية، المرضى الذين يعانون من الإجهاض المتكرر.
فتح البطن مع استئصال الورم العضلييستخدم كبديل للتقنية التنظيرية، في حالة عدم وجود معدات في العيادة أو مع الحجم المناسب وعدد العقد العضلية.
انصمام شرايين الرحم.يتم وصف هذه الطريقة لأي حجم وموقع للعقد، باستثناء الأورام العضلية الملساء المعنقة وفي حالة الاشتباه في وجود عملية خبيثة.
استئصال الرحم. تتم الإشارة إلى هذه العملية إذا كانت جميع الطرق المذكورة موانع أو غير فعالة.
إن تشخيص علاج الورم العضلي الأملس مواتٍ.
الأورام الليفية الرحمية (الورم العضلي الأملس، الورم العضلي الليفي - مرادفات) هي ورم حميد يعتمد على الهرمونات يتكون من الأنسجة العضلية للرحم. الورم العضلي الأملس هو مرض شائع جدًا، وتصل نسبة حدوثه إلى 30% عند النساء تحت سن 50 عامًا (متوسط عمر التشخيص هو 33 عامًا). في أغلب الأحيان، يتم الكشف عن أعراض الأورام الليفية في فترة ما قبل انقطاع الطمث، ولكن في السنوات الأخيرة أصبح الورم أصغر سنا بكثير. العقدة العضلية هي ألياف متشابكة بشكل عشوائي من العضلات الملساء للرحم، ولها أحجام مختلفة. في أغلب الأحيان، يبلغ قطر الأورام الليفية 1-10 سم (ورم صغير الحجم)، ولكنه يمكن أن ينمو إلى أحجام هائلة.
تصنيف أنواع الأورام الليفية الرحمية
يمكن أن تكون الأورام الليفية موضعية في عنق الرحم (تصل إلى 5٪)، ولكن الأورام العضلية الملساء في جسم الرحم أكثر شيوعًا (تصل إلى 95٪). اعتمادًا على عدد العقد العضلية، يمكن أن يكون الورم مفردًا أو متعددًا، والأعراض هي نفسها تمامًا. ويعتمد تصنيف آخر على المنطقة التي توجد بها الأورام الليفية:
- توجد الأورام الليفية تحت المخاطية (تحت المخاطية) بجوار تجويف الرحم، وتخترق أحيانًا عنق الرحم أو المهبل (عقدة الولادة). عادة ما تكون أعراض هذا النوع من الأورام الليفية الرحمية شديدة.
- تتوضع الأورام الليفية الجوفية (تحت الصفاق) بالقرب من الصفاق على السطح الخارجي للرحم. غالبًا ما يكون لها ساق رفيع في القاعدة، وفي التشخيص يتم تصنيفها على أنها "عقدة عضلية كثيفة".
- الأورام الليفية داخل الجدار والخلالي. تقع هذه الأنواع من الأورام في عمق الطبقة العضلية للرحم.
- الأورام الليفية الرحمية الغائرة الخلالية. ينمو هذا الورم عبر جدار العضلات ثم ينمو باتجاه تجويف البطن.
- الورم العضلي الأملس داخل الرحم. تقع في منطقة أربطة الرحم.
- الورم العضلي الأملس في عنق الرحم.
الأورام الليفية الخلالية هي الأكثر شيوعًا (أكثر من 50٪). تظهر أعراض الأورام الليفية تحت المخاطية في 10% فقط من الحالات. يقوم الأطباء بقياس الأورام الليفية الصغيرة في المراحل المبكرة بالسنتيمتر، والأورام الأكبر حجمًا في أسابيع الحمل (على غرار تضخم الرحم أثناء تطور الجنين فيه).
ما هي أسباب تطور الأورام الليفية؟
ترتبط الأسباب الرئيسية للأورام الليفية الرحمية دائمًا باختلال التوازن الهرموني في الجسم، نظرًا لأن هذا الورم يعتمد على الهرمونات. تبدأ العقدة العضلية في النمو إذا بدأ الانقسام غير السليم لخلايا العضلات الملساء تحت تأثير الهرمونات.
الأسباب المهمة لتطور الأورام الليفية هي الاضطرابات في الغدة النخامية وتحت المهاد والمبيض والغدة الدرقية والغدد الكظرية، أي الأعضاء الرئيسية المنتجة للهرمونات. لدى العديد من النساء اللاتي لديهن علامات الأورام الليفية مستويات مرتفعة من هرمون الاستروجين في الدم، وبالتالي فإن الأسباب الرئيسية لتطور الورم هي الاضطرابات الأيضية المختلفة لهذه الهرمونات. وقد لوحظ أنه خلال انقطاع الطمث، عندما ينخفض إنتاج هرمون الاستروجين، قد يتوقف نمو الأورام الليفية.
هناك بعض عوامل الخطر التي تزيد من خطر انتشار العقد العضلية:
- بداية متأخرة من الحيض.
- اضطرابات الدورة الشهرية، فترات ثقيلة.
- الأمراض الالتهابية المزمنة في الرحم.
- الإجهاض والولادات المؤلمة.
- غياب الولادة
- أمراض الأوعية الدموية والدم.
- أي أمراض الغدة الدرقية والغدد الكظرية.
- حياة جنسية غير منتظمة
- الإجهاد لفترات طويلة.
- زيادة الوزن.
ووفقا للعلماء، فإن أسباب الأورام الليفية قد ترتبط باستعداد وراثي، لذا فإن أعراض الورم لدى الأم أو الجدة تستلزم الاهتمام الشديد بصحتها منذ الصغر.
كيف يظهر الورم الليفي الرحمي نفسه؟
غالبًا لا تظهر أعراض الورم العضلي الأملس الرحمي على الإطلاق، خاصة إذا كان الورم صغيرًا. في معظم الحالات، يتم اكتشاف العلامات المرضية أثناء الفحص النسائي. وفي بعض الأحيان تكون أعراض المرض غير واضحة، فتتعرف المرأة على الأمر كأمر طبيعي. في أغلب الأحيان، تكون الأعراض الأكثر وضوحًا للأورام الليفية ناتجة عن ورم ذو توطين تحت المخاطية والغائرة.
العلامات الأكثر شيوعًا للورم الحميد:
- الحيض الغزير (في بعض الأحيان تكون أعراض الأورام الليفية الرحمية بحيث يتعين على المرأة تغيير 2-3 فوط في الساعة) ؛
- اضطرابات الدورة الشهرية (الحيض غير الدوري) ؛
- ظهور نزيف الرحم أو بقع الدم بين فترات الحيض.
تدريجيا، تؤدي أعراض الأورام الليفية إلى تطور فقر الدم لدى المرأة، عندما تصبح بشرتها شاحبة، وغالبا ما تلاحظ الضعف والدوخة. من الأعراض التشخيصية المهمة لفقر الدم انخفاض مستوى الهيموجلوبين وخلايا الدم الحمراء في الدم.
وبما أن الورم ينمو ببطء شديد، فقد تظهر جميع العلامات الأخرى على مراحل:
- ألم مؤلم في أسفل البطن، وتكثيف أثناء الحيض أو الجماع.
- الشعور بالضغط في البطن (في أغلب الأحيان يصاحب الأورام الليفية العميقة) ؛
- آلام أسفل الظهر؛
- ضغط الجهاز الهضمي والمثانة والمستقيم (في حالة الأورام الصغيرة تكون هذه الأعراض غائبة) وتطور الصعوبات في التبول وحركات الأمعاء.
- زيادة في محيط البطن (مع الأورام العضلية الملساء الكبيرة).
إذا تم انتهاك الدورة الدموية في العقدة العضلية، فقد تتطور أعراض البطن الحادة (ألم تشنجي، زيادة في درجة حرارة الجسم). هناك عواقب أخرى غير سارة للأورام الليفية، وبعضها شديد الخطورة.
العواقب والمضاعفات المحتملة للأورام الليفية الرحمية
الورم العضلي هو ورم حميد لا يتحول أبدًا إلى ورم خبيث (يصل إلى 0.3٪). ومع ذلك، فإن عواقب المرض يمكن أن تكون خطيرة. ومن بينها فقر الدم الناجم عن نقص الحديد بسبب النزيف الشديد، وصعوبات الحمل والإنجاب، وحتى العقم.
ترتبط العواقب المحتملة الأخرى للورم العضلي الأملس (عادة ما تكون غائرة مع ساق) بالتواء قاعدته، ويمكن أن يحدث هذا حتى مع وجود ورم صغير. في هذه الحالة، يكون خطر نخر العقدة والمضاعفات الإنتانية مرتفعًا. في المراحل اللاحقة، يمكن أن تسبب الأورام الليفية الكبيرة نزيفًا، مما قد يؤدي إلى فقدان الدم بشكل حاد. ولهذا السبب تتم إزالة الأورام الليفية التي لا يمكن علاجها بالطرق المحافظة.
كيفية التعرف على الأورام الليفية الرحمية

عادة ما يتم تشخيص الورم العضلي الأملس بسهولة من خلال فحص بسيط لأمراض النساء: إذا كان حجمه كبيرًا، فسيتم تكبير الرحم. يمكن رؤية الأورام الصغيرة من خلال الموجات فوق الصوتية للحوض التي يتم إجراؤها باستخدام مسبار مهبلي. تظهر علامات الأورام الليفية (الموضعية والقطر) بشكل أفضل عندما تكون المثانة ممتلئة ويتم الإشارة إليها على أنها آفات مستديرة ذات صدى منخفض.
لتشخيص الأورام الليفية تحت المخاطية أو الخلالية، ستكون هناك حاجة إلى تنظير الرحم أو فحص الرحم. أثناء الإجراء، يتم أخذ خزعة لفحص الخلايا السرطانية. يصعب تمييز بعض الأورام الليفية عن الأورام السرطانية، لذلك يتم إجراء تنظير البطن لإجراء تشخيص دقيق (غالبًا ما تتم إزالة الأورام الليفية أثناء الجراحة). إذا كان ذلك ممكنًا تقنيًا، يمكن توضيح التشخيص باستخدام التصوير بالرنين المغناطيسي أو التصوير المقطعي المحوسب. يجدر التمييز بين المرض ورم كيسي المبيض والورم الليفي وساركوما الرحم.
علاج الأورام الليفية الرحمية
تختلف أساليب التعامل مع المرضى الذين يعانون من الأورام الليفية اعتمادًا على الموقع والحجم: مع وجود معلمات صغيرة، غالبًا ما يمكن علاج الورم بالطرق المحافظة. بالإضافة إلى ذلك، يجب على المرأة الحفاظ على نمط حياة صحي والالتزام بنظام غذائي خاص.
النظام الغذائي للورم العضلي الأملس
إذا تم تنظيم التغذية بشكل صحيح، فإن المستويات الهرمونية في الجسم تعود إلى طبيعتها، ويبطئ الورم نموه. يمكن استخدام النظام الغذائي للأورام الليفية الرحمية لجميع الأمراض النسائية، وكذلك لعلاج الأورام في هذا المجال.
يجب أن يزود النظام الغذائي المرأة بالعناصر النزرة والفيتامينات اللازمة، وبالتالي فإن النظام الغذائي للأورام الليفية الرحمية يشمل:
- الألياف النباتية من خبز الحبوب الكاملة والحبوب؛
- البقوليات.
- أرز بني؛
- المكسرات (خاصة الصنوبر والجوز)؛
- الخضروات (الملفوف، الطماطم، اليقطين، الفلفل الحلو)؛
- الفواكه (الحمضيات والتفاح)؛
- التوت (العنب البري، التوت، الفراولة)؛
- منتجات الصويا (4 مرات في الأسبوع)؛
- الأسماك والمأكولات البحرية (3 مرات في الأسبوع)؛
- بذور الكتان والثوم (يوميا).
بالإضافة إلى ذلك، قد يشمل النظام الغذائي لعلاج الأورام الليفية الرحمية تناول شاي الأعشاب (البابونج، الخلود، نبتة سانت جون، توت الزعرور)، بالإضافة إلى شرب 4-5 أكواب من الشاي الأخضر يوميًا.
هل من الممكن علاج الأورام الليفية بدون جراحة؟
غالبًا ما يتم علاج الأورام العضلية الملساء الرحمية بالعلاج الدوائي. تعتبر إزالة الورم أثناء الجراحة هي المرحلة الثانية من العلاج إذا كانت المرحلة الأولى غير فعالة. علاج المرض غير مطلوب على الإطلاق إذا:
- ورم صغير بدون أعراض.
- لا يوجد ميل لنموها.
تتم مراقبة النساء عن كثب من قبل طبيب أمراض النساء (قم بزيارة الطبيب كل 4-6 أشهر). يُنصح بإجراء تشخيص متعمق لتحديد السبب الدقيق للأورام الليفية وتصحيحه.
مؤشرات للعلاج المحافظ للأورام الليفية:
- ظهور أعراض خاصة بالورم.
- نمو الورم.
- موقع تحتي أو داخل الجدار للعقدة العضلية.
- ارتفاع خطر حدوث مضاعفات أثناء الجراحة.
- من أجل تقليل حجم الورم العضلي الأملس قبل الجراحة.
يمكن علاج الأورام الليفية التي يقل حجمها عن 12 أسبوعًا من الحمل بالأدوية فقط. وبحسب المؤشرات، تتم إزالة الورم دون إضاعة الوقت في العلاج المحافظ، لأن العديد من الأورام الليفية، حتى بعد العلاج الهرموني، تبدأ في النمو مرة أخرى بعد 6-12 شهرًا.
الطرق غير الهرمونية الرئيسية لعلاج الأورام الليفية:
- أقراص أو حقن عوامل مرقئ لوقف النزيف.
- مضادات التشنج ومضادات الالتهاب غير الستيروئيدية للقضاء على الألم.
- أدوية لفقر الدم بسبب نقص الحديد.
- أدوية لانقباضات الرحم.
- مضادات الأكسدة والفيتامينات لتحسين الحالة العامة للجسم.
- الأدوية العشبية لتحسين تغذية الأنسجة (مستحضرات ذيل الحصان ونبتة الرئة).
إذا كان حجم الأورام الليفية صغيرًا، فإن العلاج الهرموني يعطي نتائج جيدة. وهكذا، في سن مبكرة، توصف النساء هرمون الاستروجين-جستاجين مجتمعة (أوتروجستان) أو الاستعدادات البروجسترون (دوفاستون). في فترة ما قبل انقطاع الطمث، يوصى بالعلاج بالأندروجينات (جيسترينون، دانازول) على مدار 30 يومًا (حتى 6 دورات). بالنسبة للأورام الليفية الصغيرة، يتم أيضًا استخدام العلاج بالأدوية التي تثبط إنتاج هرمون الاستروجين (منبهات هرمون الغدة النخامية Zoladex، Buserelin)، ولكن يتم ملاحظة تأثيرها فقط أثناء تناولها. نوع آخر من العلاج لأحجام الورم الصغيرة (يصل إلى 2 سم) هو تناول وسائل منع الحمل عن طريق الفم (يارينا، جانين)، والتي يمكن أن توقف تطور المرض.
الاستئصال الجراحي للأورام الليفية
في كثير من الأحيان، يكون للورم العضلي الأملس مباشرة بعد اكتشافه مؤشرات لإجراء عملية جراحية. وبالتالي فإن علاج الأورام الليفية الرحمية تحت المخاطية بسبب خطر النزيف الشديد يكون جراحيًا فقط. بالإضافة إلى ذلك، ستكون إزالة الورم مطلوبة إذا:
- فقر الدم بسبب الدورة الشهرية الشديدة والنزيف بين فترات الحيض.
- متلازمة الألم الشديد.
- ضغط المثانة أو المستقيم أو الأعضاء الأخرى.
- حجم الأورام الليفية لأكثر من 13 أسبوعًا من الحمل.
- الشك في ضعف الدورة الدموية في العقدة أو التواء ساق الورم (حتى لو كان صغيرا)؛
- النمو السريع للأورام الليفية أو توطينها غير النمطي.
- إذا تم دمج الورم العضلي الأملس مع أي سرطان أو مرض سرطاني في المنطقة التناسلية.
- عند التخطيط للحمل والعقم.
تتم إزالة الأورام الليفية بطرق مختلفة. وبالتالي، قد يشمل العلاج الجراحي استئصال الورم العضلي (استئصال الأورام الليفية) أو استئصال الرحم (إزالة الرحم). كما تختلف طرق إجراء هذه العمليات حسب نوع وإمكانيات العيادة وموقع وحجم التكوين. لذلك، يمكن أن يكون العلاج الجراحي على النحو التالي:
- إزالة الأورام الليفية بالمنظار. من خلال ثقوب صغيرة في البطن، يقوم المتخصصون بإزالة التكوين الذي لا يزيد حجمه عن 8 سم. إذا كان قطر العقدة العضلية أكبر، يتم إجراء عملية فتح البطن (استئصال الورم الليفي من خلال شق).
- الانصمام الورمي. يتم إدخال قسطرة عبر الشريان الفخذي إلى الورم الليفي ومن خلاله، وباستخدام مستحضرات خاصة، يتم "إغلاق" الأوعية التي تغذي الورم.
- استئصال FUS للورم، أو العلاج بالموجات فوق الصوتية. بمساعدة الموجات فوق الصوتية، يتم تدمير أنسجة الورم الليفي. مساوئ هذه التقنية: غالبًا ما تظهر علامات الأورام الليفية مرة أخرى.
- تنظير الرحم العلاجي. يمكن إزالة الأورام الليفية تحت المخاطية ذات الأحجام الصغيرة، أو التكوينات الموضعية على عنق الرحم، أثناء الفحص.
- إذا كانت المرأة لا تخطط لإنجاب طفل (على سبيل المثال، إذا تم اكتشاف الورم العضلي الأملس أثناء انقطاع الطمث)، فقد تتضمن العملية الإزالة الكاملة للرحم المصاب بالأورام الليفية.
في كثير من الأحيان، بعد العلاج الجراحي، يتم وصف العلاج الهرموني للمرأة، مما سيساعد على منع تكرار الأورام الليفية، خاصة عندما لا يتم استئصالها بالكامل.
العلاج التقليدي للأورام الليفية الرحمية
ساعدت العلاجات الشعبية للأورام الليفية العديد من النساء على إبطاء العملية المرضية، والقضاء على النزيف، وحتى في بعض الأحيان منع الجراحة. من الأفضل علاج الأورام العضلية الملساء الصغيرة التي لا تهدد بعواقب وخيمة بالعلاجات الشعبية:
- دنج. لتقليل حجم الأورام الليفية، يتم عمل كرات صغيرة من البروبوليس. قبل الذهاب إلى السرير، يتم إدخالها في المهبل، ملفوفة بطبقة رقيقة من الشاش. يتم تنفيذ مسار العلاج لمدة 10 أيام، ثم ينقطع العلاج لمدة أسبوع، وبعد ذلك يتكرر هذا العلاج بالعلاجات الشعبية ثلاث مرات أخرى.
- جذر مارين. لتقليل شدة الأعراض وعلاج الأورام الليفية، قم بإعداد صبغة جذر المارينا بمعدل 50 جرام. المواد الخام لكل 0.5 لتر. فودكا. احتفظ بالمنتج في الظلام لمدة 14 يومًا، ثم اشرب ملعقة ثلاث مرات يوميًا قبل الوجبات، مع تخفيفها بالماء. مسار العلاج بالعلاجات الشعبية في هذه الحالة هو شهر واحد، وبعد استراحة لمدة أسبوع يتكرر.
- الرحم بوروفايا. بالنسبة للأورام الليفية، يعطي هذا النبات نتائج ممتازة إذا كان حجم الورم أقل من 2 سم، ويمكن أن تحل هذه الأورام العضلية الملساء تمامًا، وفي حالات أخرى، يخفف الرحم الخنزيري الأعراض غير السارة للمرض. يتم تخمير ملعقة من النبات مع كوب من الماء ويترك لمدة ساعة. بعد التصفية، يتم استخدام التسريب للغسل. مسار العلاج هو شهر واحد، وبعد استراحة لمدة 14 يوما، يتم إعطاء 3 دورات أخرى.
الأورام الليفية الرحمية والحمل
غالبًا ما يكون إنجاب طفل مصاب بالأورام الليفية أمرًا صعبًا للغاية، لأن الورم يضغط على قناة فالوب ويعطل الإباضة. كما أن التعليم سوف يتعارض مع التطور الطبيعي للجنين. خطر آخر على الأمهات الحوامل هو تدمير الأورام الليفية المصحوبة بنخر الأنسجة وظهور علامات المضاعفات الإنتانية. ولذلك فإن الأورام الليفية والحمل أمران غير متوافقين، خاصة إذا كان حجم الورم يتجاوز 12 أسبوعا. إن استئصال الأورام الليفية ذات المعلمات الأكثر أهمية محفوف بالإزالة الكاملة للرحم، حيث قد يحدث نزيف حاد أثناء العملية.
ومع ذلك، إذا تم اكتشاف المرض أثناء الحمل، فهذا ليس مؤشرا على إنهائه. تنجح العديد من النساء في حمل طفل مصاب بهذا الورم، ولكن فقط إذا لم يكن حجمه كبيرًا. يتم التخطيط للولادة مع الأورام الليفية عن طريق العملية القيصرية، لأن الولادة الطبيعية قد تتأخر أو تؤدي إلى نزيف من الورم.
الورم العضلي وانقطاع الطمث
أثناء انقطاع الطمث، يكون التطور الأولي للأورام الليفية نادرًا. في أغلب الأحيان، يتشكل الورم خلال سن الإنجاب أو خلال فترة ما قبل انقطاع الطمث. في كثير من الأحيان، أثناء انقطاع الطمث، لا توجد علامات على الأورام الليفية، ولكن في بعض الأحيان تتجلى في شكل ألم وإمساك واستئناف نزيف الرحم. بالإضافة إلى ما ذكر أعلاه، يعتبر داء السكري عامل خطر لتطور الأورام الليفية في هذا العمر.
يكون علاج الورم العضلي الأملس أثناء انقطاع الطمث جراحيًا دائمًا، لأن المرأة لا تحتاج إلى الحفاظ على قدرتها على الإنجاب. ولكن هناك العديد من الحالات التي يتم فيها شفاء الأورام الصغيرة، وهذا على ما يبدو بسبب نقص هرمون الاستروجين في جسم المرأة. لذلك، فإن اختيار طريقة علاج الأورام الليفية أثناء انقطاع الطمث هو مهمة الطبيب المعالج، الذي سيأخذ في الاعتبار جميع المؤشرات وموانع الاستعمال.
الوقاية من الأورام الليفية الرحمية عند النساء
أفضل الوقاية من المرض هي منع الإجهاض، والولادة الأولى قبل سن 25 عاما، والعلاج الكامل لجميع الأمراض النسائية (الالتهابات، والأمراض المنقولة جنسيا). يجب على المرأة فحص مستوياتها الهرمونية بشكل دوري، ومن الأفضل زيارة طبيب أمراض النساء بانتظام - 1-2 مرات في السنة.