اللون: في البيئة الحمضية يكون لونه أحمر، وفي البيئة القلوية يكون لونه أزرق.
اليوم، هناك عدة مئات من المؤشرات الحمضية والقاعدية المعروفة، والتي تم تصنيعها بشكل مصطنع منذ منتصف القرن التاسع عشر. يمكنك التعرف على بعضهم في مختبر الكيمياء بالمدرسة. يكون مؤشر الميثيل البرتقالي (برتقالي الميثيل) أحمر في البيئة الحمضية، وبرتقالي في بيئة محايدة، وأصفر في بيئة قلوية. يتميز مؤشر أزرق الثيمول بمجموعة ألوان أكثر إشراقًا: في البيئة الحمضية يكون أحمر قرمزي، وفي بيئة محايدة يكون أصفر، وفي بيئة قلوية يكون أزرق. مؤشر الفينول فثالين (يباع في الصيدليات تحت اسم “purgen”) عديم اللون في البيئات الحمضية والمحايدة، وله لون قرمزي في البيئات القلوية. ولذلك، يستخدم الفينول فثالين فقط لتحديد البيئة القلوية. اعتمادًا على حموضة الوسط، يتغير أيضًا لون الصبغة الخضراء الرائعة (يتم استخدام محلول كحول مائة كمطهر - "مادة خضراء"). من أجل التحقق من ذلك، تحتاج إلى تحضير محلول مخفف من اللون الأخضر اللامع: صب بضعة ملليلتر من الماء في أنبوب اختبار وأضف إليه قطرة أو قطرتين من المستحضر الصيدلاني. سوف يكتسب الحل لونًا أخضر-أزرق جميلًا. في بيئة حمضية قوية، يتغير لونه إلى اللون الأصفر، وفي محلول قلوي قوي يتغير لونه.
ومع ذلك، في أغلب الأحيان في الممارسة المخبرية، يتم استخدام مؤشر عالمي - مزيج من عدة مؤشرات حمضية وقاعدية. يجعل من السهل تحديد ليس فقط
يكون مؤشر الثيمول الأزرق باللون الأحمر التوتي في البيئة الحمضية، والأصفر في البيئة المحايدة، والأزرق في البيئة القلوية.
طبيعة البيئة (الحمضية، المحايدة، القلوية)، ولكن أيضًا قيمة الحموضة (pH) للمحلول.
ويسمى الخليط الناتج بالحمض السحري.
يعود اسم هذا المركب إلى الكيميائي الألماني الشاب آي. لوكاس، الذي عمل في مجموعة الكيميائي الشهير جورج أول،
الحائز على جائزة نوبل عام 1994، خلال عطلة عيد الميلاد، قام أحد أعضاء المجموعة، على سبيل المزاح، بإلقاء شمعة من الشمع في هذا "الخليط الجهنمي"، الذي ذاب على الفور. "نعم، هذا هو الحمض السحري!" - صاح لوكاس المندهش. منذ ذلك الحين، لم يصبح هذا المصطلح مقبولًا بشكل عام بين الكيميائيين فحسب، بل تم تسجيله رسميًا كعلامة تجارية. الحمض السحري أكثر "حمضية" بـ 10-15 مرة من حمض الكبريتيك المركز.
حموضة البيئة. مؤشر الهيدروجين
لتوصيف حموضة الوسط، يتم تقديم مؤشر الرقم الهيدروجيني، وهو ما يساوي اللوغاريتم العشري للتركيز المولي لأيونات الهيدروجين المأخوذة بالعلامة المعاكسة: pH = -lg.
اعتمادًا على تركيز أيونات H + في المحلول، قد تكون هناك بيئة حمضية أو محايدة أو قلوية. يعتبر الماء المقطر المأخوذ عند درجة حرارة 22 درجة مئوية محايدا. كونه إلكتروليتًا ضعيفًا، يتفكك الماء جزئيًا إلى أيونات H + (في المحاليل المائية يكون دائمًا رطبًا ويوجد على شكل H 3 O +) وOH -. تركيزاتها هي نفسها وتبلغ 10 -7 مول/لتر في درجة حرارة الغرفة.
من السهل حساب ذلك بالنسبة للمحلول المتعادل (الماء المقطر) pH=-log(10 -7)=7. إذا كانت قيمة الرقم الهيدروجيني أقل من 7، فإن المحلول حمضي، لأن تركيز أيونات الهيدروجين فيه أعلى من تركيز أيونات الهيدروكسيد. على سبيل المثال، محلول حمض الهيدروكلوريك بتركيز 1 مول/لتر يحتوي على pH=-log(1)=0.
وعند درجة حموضة أكبر من 7، يكون تركيز أيونات الهيدروجين في المحلول أقل من تركيز أيونات الهيدروكسيد. تسمى هذه الحلول القلوية. على وجه الخصوص، الرقم الهيدروجيني لمحلول مركز من هيدروكسيد الصوديوم (10 مول / لتر) هو 15. عادة ما يكون لمياه الأمطار تفاعل حمضي طفيف (الرقم الهيدروجيني = 6) بسبب ذوبان ثاني أكسيد الكربون فيه؛ يعتبر المطر حمضيا إذا كان الرقم الهيدروجيني له<5. Желудочный сок - это сильнокислая среда (рН=1,7), а рН крови (7,4), слюны (6,9) и слезы (7) близок к нейтральному.
لتحديد حموضة الوسط، غالبا ما تستخدم المؤشرات الحمضية القاعدية - مواد خاصة لها ألوان مختلفة في بيئات مختلفة. كقاعدة عامة، الأحماض العضوية الضعيفة أو القواعد التي تحتوي على الكروموفورات (من اليونانيةمجموعات "chroma" - "color" و"foro" - "carry") التي تعطي هذه المواد لونًا ساطعًا. في مختبر الكيمياء المدرسية، يتم استخدام عباد الشمس وبرتقال الميثيل والفينول فثالين بشكل شائع كمؤشرات.
الفينول فثالين(إنجليزي) الفينول فثالين) - مؤشر الحموضة، صبغة، في الماضي - ملين منتشر على نطاق واسع، معروف على نطاق واسع في العهد السوفيتي باسم عاصفة. يشير إلى ما يسمى "الملينات المنشطة".
في الوقت الحالي، لا يستخدم الفينول فثالين كملين بسبب العدد الكبير من الآثار الجانبية التي تم تحديدها، بما في ذلك قدرته على السرطان.
الفينول فثالين - مركب كيميائي
كيميائيا، الفينول فثالين هو 4،4 "-ديوكسي فثالوفينون. الصيغة التجريبية للفينول فثالين هي C 20 H 14 O 4. الوزن الجزيئي هو 318.31 جم / مول. يظهر كمسحوق عديم اللون. الفينول فثالين قابل للذوبان بدرجة عالية في الإيثانول وثنائي إيثيل الأثير. ضعيف الذوبان في الماء.الفينول فثالين - دواء
الفينول فثالين هو الاسم الدولي غير المملوك للدواء. وفقا للمؤشر الدوائي، ينتمي الفينول فثالين إلى مجموعة "المسهلات". وفقًا لـ ATC - لمجموعة "A06 Laxatives" ولها الرمز A06AB04. إشارة لاستخدام الفينول فثالين هو الإمساك المزمن.في الصورة على اليسار: "الحلوى الملينة" Cascarets - دواء ملين لا يستلزم وصفة طبية، محظور الآن. مُجَمَّع:كاسكارا، ساغرادا ، الفينول فثالين، مستخلص السنا.
الفينول فثالين كوسيلة لإنقاص الوزن
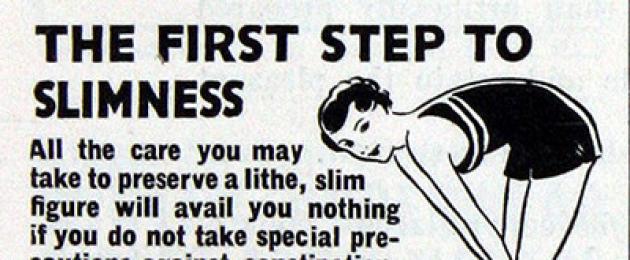
 وفي النصف الأول من القرن الماضي، استخدم الفينول فثالين "لتطهير الأمعاء" وكوسيلة لإنقاص الوزن. في إعلان عام 1935 على اليمين: “ الخطوة الأولى نحو النحافة هي كبسولات Medilax الملينة... بالنسبة للنساء اللواتي يرغبن في تحسين قوامهن، ليس هناك ملين مفضل. يقوم مديلاكس بتنظيف الأمعاء الدقيقة والغليظة بلطف وبدون ألم، وهو أمر مهم للغاية لتحقيق النحافة».
وفي النصف الأول من القرن الماضي، استخدم الفينول فثالين "لتطهير الأمعاء" وكوسيلة لإنقاص الوزن. في إعلان عام 1935 على اليمين: “ الخطوة الأولى نحو النحافة هي كبسولات Medilax الملينة... بالنسبة للنساء اللواتي يرغبن في تحسين قوامهن، ليس هناك ملين مفضل. يقوم مديلاكس بتنظيف الأمعاء الدقيقة والغليظة بلطف وبدون ألم، وهو أمر مهم للغاية لتحقيق النحافة». وفي دراسة للمكملات الغذائية “لإنقاص الوزن” التي تباع في السوق الأمريكية، وجدت إدارة الغذاء والدواء الأمريكية أن بعضها (8 Factor Diet، 24 Hours Diet، Fatloss Slimming، Imelda Perfect Slim، Perfect Slim 5x، Royal Slimming Formula، Superslim، Zhen) دي شو) يحتوي، رغم الحظر، على الفينول فثالين ("أسئلة وأجوبة حول مبادرة إدارة الغذاء والدواء ضد منتجات إنقاص الوزن الملوثة"، تم التحديث في 27/01/2011).
الأدوية التي تحتوي على المادة الفعالة الفينول فثالين
الأسماء التجارية للأدوية التي تحتوي على المادة الفعالة الفينول فثالين، والتي كانت تستخدم سابقًا في الاتحاد السوفييتي: Laxatol، Laxigen، Laksoin، Purgen، Purgil، Phenaloin.في الولايات المتحدة الأمريكية - بروليت، ميديلاكس، فينولاكس، تشوكولاكسد.
الفينول فثالين (purgen) له موانع، آثار جانبية وميزات التطبيق؛ من الضروري التشاور مع أخصائي.
الفينول فثالين - مؤشر الحموضة
الفينول فثالين، اعتمادا على حموضة الوسط، يربط أو يفصل الأيونات، ونتيجة لذلك يتغير لونه. وبسبب هذه القدرة، يتم استخدامه (في أغلب الأحيان في شكل محلول في الإيثانول) كمؤشر للحمض القاعدي.| حموضة الوسط، pH | < 0 | 0–8,2 | 8,2-12,0 | >12,0 |
| لون الفينول فثالين | البرتقالي | عديم اللون | الوردي أو الأرجواني | عديم اللون |
| نوع محلول الفينول فثالين |
 |
- |
 |
- |
| جزيء الفينول فثالين عند حموضة مختلفة للبيئة |
 |
 |
 |
 |
المواد التي يتغير لونها عندما يتغير رد فعل البيئة هي مؤشرات - في أغلب الأحيان مركبات عضوية معقدة - أحماض ضعيفة أو قواعد ضعيفة. من الناحية التخطيطية، يمكن التعبير عن تكوين المؤشرات من خلال الصيغ HInd أو IndOH، حيث Ind عبارة عن أنيون عضوي معقد أو كاتيون مؤشر.
في الممارسة العملية، تم استخدام المؤشرات لفترة طويلة، ولكن المحاولة الأولى لشرح عملها كانت في عام 1894 من قبل أوستفالد، الذي ابتكر ما يسمى بالنظرية الأيونية. وفقًا لهذه النظرية، فإن جزيئات المؤشر غير المنفصلة وأيوناتها الهندية لها ألوان مختلفة في المحلول، ويتغير لون المحلول اعتمادًا على موضع توازن التفكك للمؤشر. على سبيل المثال، يحتوي الفينول فثالين (مؤشر الحمض) على جزيئات عديمة اللون وأنيونات قرمزية؛ برتقال الميثيل (المؤشر الرئيسي) – جزيئات صفراء وكاتيونات حمراء.
الفينول فثالين ميثيل برتقالي
هيندH + + إند – إندوه  إنديانا + + أوه –
إنديانا + + أوه –
عديم اللون مالينوف. أصفر أحمر
يؤدي التغيير وفقًا لمبدأ لو شاتيليه إلى تحول التوازن إلى اليمين أو اليسار.
وفقا لنظرية الكروموفور (هانش)، التي ظهرت لاحقا، يرتبط التغير في لون المؤشرات بإعادة ترتيب عكسية للذرات في جزيء مركب عضوي. يُطلق على إعادة الترتيب العكسي هذا اسم "tautomerism" في الكيمياء العضوية. إذا ظهرت مجموعات خاصة تسمى الكروموفورات في جزيء مركب عضوي، نتيجة للتغير في البنية، فإن المادة العضوية تكتسب اللون. Chromophores عبارة عن مجموعات من الذرات التي تحتوي على واحد أو أكثر من الروابط المتعددة التي تسبب امتصاصًا انتقائيًا للاهتزازات الكهرومغناطيسية في منطقة الأشعة فوق البنفسجية. يمكن لمجموعات الذرات والروابط، مثل −N=N−، =C=S، −N=O، والهياكل الكينويدية، وما إلى ذلك، أن تعمل كمجموعات كروموفور.
عندما يؤدي التحول التوتوميري إلى تغيير في بنية حامل اللون، يتغير اللون؛ إذا، بعد إعادة الترتيب، لم يعد الجزيء يحتوي على كروموفور، فإن اللون سوف يختفي.
تعتمد الأفكار الحديثة على النظرية الأيونية الكروموفورية، والتي بموجبها يحدث التغيير في لون المؤشرات بسبب الانتقال من الشكل الأيوني إلى الشكل الجزيئي، والعكس صحيح، مصحوبًا بتغيير في بنية المؤشرات. وبالتالي فإن نفس المؤشر يمكن أن يوجد في شكلين مختلفين في التركيب الجزيئي، ويمكن أن يتحول هذان الشكلان إلى بعضهما البعض، ويحدث التوازن بينهما في المحلول.
كمثال، يمكننا أن نفكر في التغيرات الهيكلية في جزيئات المؤشرات الحمضية القاعدية النموذجية - الفينول فثالين وبرتقال الميثيل تحت تأثير محاليل القلويات والأحماض (عند قيم أس هيدروجينية مختلفة).
رد الفعل، ونتيجة لذلك، بسبب إعادة ترتيب هيكل جزيء الفينول فثالين، تظهر مجموعة كروموفور فيه، مما تسبب في ظهور اللون، وفقا للمعادلة التالية:

عديم اللون عديم اللون عديم اللون

قرمزي
المؤشرات، مثل الشوارد الضعيفة، لها ثوابت تفكك صغيرة. على سبيل المثال، K d للفينول فثالين هو 2∙10 -10 ويوجد في الغالب في الوسائط المحايدة في شكل جزيئاته بسبب تركيز الأيونات المنخفض جدًا، ولهذا السبب يظل عديم اللون. عند إضافة القلويات، ترتبط أيونات الفينول فثالين H +، "تتحد" مع أيونات OH القلوية، وتشكل جزيئات الماء، ويتحول موضع توازن التفكك للمؤشر إلى اليمين - نحو زيادة تركيز القلويات. إنديانا - الأيونات. في بيئة قلوية، يتكون ملح ثنائي الصوديوم، الذي له بنية كينويد، وهو ما يسبب لون المؤشر. يحدث التحول في التوازن بين الأشكال التوتومرية بشكل تدريجي. ولذلك فإن لون المؤشر لا يتغير على الفور، بل يمر عبر لون مختلط إلى لون الأنيونات. عند إضافة حمض إلى نفس المحلول في وقت واحد مع تحييد القلويات - عند تركيز كافٍ من أيونات H + - يتحول موضع توازن التفكك للمؤشر إلى اليسار، نحو المولية، ويصبح المحلول متغير اللون مرة أخرى.
يتغير لون الميثيل البرتقالي بطريقة مماثلة: جزيئات الميثيل البرتقالية المحايدة تعطي المحلول لونًا أصفر، والذي يتحول نتيجة البروتون إلى اللون الأحمر، مما يتوافق مع البنية الكينويدية. لوحظ هذا التحول في نطاق الأس الهيدروجيني 4.4-3.1:

اصفر احمر
وبالتالي، فإن لون المؤشرات يعتمد على بيئة الرقم الهيدروجيني. تكون كثافة اللون لهذه المؤشرات عالية جدًا ومرئية بوضوح حتى مع إدخال كمية صغيرة من المؤشر الذي لا يمكن أن يؤثر بشكل كبير على الرقم الهيدروجيني للمحلول.
يتغير لون المحلول الذي يحتوي على المؤشر بشكل مستمر مع تغير الرقم الهيدروجيني. لكن العين البشرية ليست حساسة للغاية لمثل هذه التغييرات. يتم تحديد النطاق الذي يتم من خلاله ملاحظة تغير في لون المؤشر من خلال الحدود الفسيولوجية لإدراك اللون بالعين البشرية. مع الرؤية الطبيعية، تكون العين قادرة على تمييز وجود لون واحد في خليطها مع لون آخر فقط إذا كان هناك على الأقل كثافة عتبة معينة للون الأول: لا يُلاحظ تغير في لون المؤشر إلا في المنطقة حيث يوجد 5-10 أضعاف فائض أحد الأشكال بالنسبة إلى الآخر. أخذ HInd كمثال وتوصيف حالة التوازن
هند  ح + + إند –
ح + + إند –
الثابت المقابل
 ,
,
يمكننا أن نكتب أن المؤشر يظهر لونه الحمضي البحت، والذي عادة ما يكتشفه المراقب عندما
 ,
,
ولون قلوي بحت مع
ضمن الفاصل الزمني المحدد بهذه القيم، يظهر لون مختلط للمؤشر.
وبالتالي، فإن عين الراصد لا تميز تغيرًا في اللون إلا عندما يتغير تفاعل الوسط في نطاق حوالي 2 وحدة هيدروجينية. على سبيل المثال، بالنسبة للفينول فثالين، يتراوح نطاق الأس الهيدروجيني هذا من 8.2 إلى 10.5: عند الرقم الهيدروجيني = 8.2 تلاحظ العين بداية ظهور اللون الوردي، والذي يتكثف بشكل متزايد إلى الرقم الهيدروجيني = 10.5، وعند الرقم الهيدروجيني = 10.5 تكثيف اللون الأحمر. لم تعد ملحوظة. ويسمى هذا النطاق من قيم الرقم الهيدروجيني، الذي تميز فيه العين تغيرًا في لون المؤشر، بفاصل انتقال لون المؤشر. بالنسبة للميثيل البرتقالي، KD = 1.65·10 -4 وpK = 3.8. وهذا يعني أنه عند الرقم الهيدروجيني = 3.8، تكون الأشكال المحايدة والمنفصلة في حالة توازن بتركيزات متساوية تقريبًا.
لا يقع نطاق الأس الهيدروجيني المشار إليه والذي يبلغ حوالي وحدتين لمؤشرات مختلفة في نفس المنطقة من مقياس الأس الهيدروجيني، نظرًا لأن موضعه يعتمد على القيمة المحددة لثابت التفكك لكل مؤشر: كلما كان الحمض HInd أقوى، كلما كان الانتقال أكثر حمضية الفاصل الزمني للمؤشر في المنطقة. في الجدول يوضح الشكل 18 فترات الانتقال وألوان المؤشرات الحمضية القاعدية الأكثر شيوعًا.
لتحديد قيمة الرقم الهيدروجيني للمحاليل بشكل أكثر دقة، استخدم مزيجًا معقدًا من عدة مؤشرات مطبقة على ورق الترشيح (ما يسمى "مؤشر Colthoff العالمي"). يتم غمس شريط من ورق المؤشر في محلول الاختبار، ووضعه على ركيزة بيضاء مقاومة للماء، ويتم مقارنة لون الشريط بسرعة بمقياس الرقم الهيدروجيني المرجعي.
الجدول 18.
الفترات الانتقالية والتلوين في الوسائط المختلفة
المؤشرات الحمضية القاعدية الأكثر شيوعًا
|
اسم |
لون المؤشر في بيئات مختلفة |
||
|
الفينول فثالين |
عديم اللون |
قرمزي 8.0 < pH < 9.8 |
قرمزي |
|
البنفسجي 5 < рН < 8 | |||
|
الميثيل البرتقالي |
البرتقالي | ||
|
3.1< рН < 4.4 | |||
|
الميثيل البنفسجي |
البنفسجي | ||
|
بروموكريسول | |||
|
بروموثيمول | |||
|
الثيمول |
2,5 < pH < 7,9 | ||
الفينول فثالين هو أحد أبسط ممثلي فئة الفثالين. ويتكون من تكثيف أنهيدريد الفثاليك والفينول العادي. إذا انتبهت إلى الصيغة الكيميائية للفينول فثالين، فستكون مشتق ديوكسي من ثنائي فينيل فثاليد. يبدو الفينول فثالين وكأنه مادة بلورية بيضاء (ربما ذات لون مصفر طفيف) ذات رائحة مميزة. البلورات على شكل الماس. يستخدم الفينول فثالين على نطاق واسع في الطب والكيمياء. وهو أحد المؤشرات الأكثر استخدامًا للأحماض الضعيفة. فوائد الفينول فثالين واضحة.

لا يتفاعل مع درجات الحرارة المرتفعة. كما أنه يستخدم للتفاعلات مع محاليل الكحول، ولكن قد يختلف لون المحلول القلوي قليلاً عن اللون الأرجواني. إذا كانت المحاليل الكحولية مركزة، فقد يكون اللون بنفسجيًا مزرقًا. يستخدم الفينول فثالين لمعايرة الأحماض العضوية، لتحديد مستوى حموضة الكحوليات، وكذلك الاسترات. نظرًا لخصائصه الكيميائية، يعد الفينول فثالين أحد مكونات العديد من المؤشرات المختلطة. تم استخدام الفينول فثالين بنجاح لتحديد مستويات الحموضة باستخدام المحاليل المخزنة وغير المخزنة (وفقًا لطريقة ميكايليس). وللتحليل النوعي، يمكن أيضًا استخدام هذه المادة الكيميائية؛ وعادةً ما يتم استخدام الفينول فثالين عند رش الرصاص والزنك والكادميوم والمغنيسيوم، مما يؤدي إلى تغير اللون في الطب، وقد استخدم الفينول فثالين منذ ما يقرب من قرن ونصف كملين الإمساك المزمن (الاسم الأوسع هو بورجن). ومع ذلك، فقد أظهرت الدراسات مؤخرًا إمكانية وجود خصائص مسرطنة للفينول فثالين، لذلك في معظم دول العالم لا يتم بيعه في الصيدليات للبيع مجانًا، بل يستخدم فقط ككاشف كيميائي. يستخدم الفينول فثالين بحذر شديد في المؤسسات الطبية نظرا لقدرته على التراكم في الجسم، لذلك لا يستخدم الفينول فثالين إطلاقا للحوامل وكبار السن والأشخاص الذين يعانون من أمراض الجهاز البولي. يحتوي الفينول فثالين على فئة خطورة ثانية ويتطلب الالتزام بقواعد السلامة القياسية عند إجراء تفاعلات كيميائية يمكن أن يسبب الفينول فثالين تفاعلات جلدية، والتي عادة ما تختفي من تلقاء نفسها بعد بضعة أيام. يعتمد التأثير الدوائي للفينول فثالين على تهيج الأمعاء، مما يؤدي إلى تأثير ملين. يتحول البول القلوي إلى اللون الأحمر. عندما يتم تسخين أنهيدريد الفثاليك مع الفينولات في وجود حمض الكبريتيك أو كلوريد الزنك (عوامل إزالة الماء)، يحدث التكثيف (مع إزالة جزيء الماء)، مما يؤدي إلى تكوين ما يسمى الفثالين، وهي مشتقات ثلاثي فينيل الميثان (C6H5)3CH. يتكون جزيء الماء من ذرة الأكسجين لإحدى مجموعات الكربونيل في جزيء أنهيدريد الفثاليك وذرات الهيدروجين لجزيئين من الفينول الموجودة في الموضع الفقرة بالنسبة لمجموعات الهيدروكسيل:

يتم استخدام العديد من الفثالين كمؤشرات نظرًا لقدرتها على تغيير اللون اعتمادًا على تركيز أيونات الهيدروجين (pH) في المحلول. وهكذا، فإن الفينول فثالين عديم اللون، الذي له بنية اللاكتون، عند عمل القلويات يشكل ملحًا (مع تمزق حلقة اللاكتون)، وتأخذ إحدى حلقات البنزين البنية الكينويدية وبالتالي تصبح كروموفور:

|
الكواشف:أنهيدريد الفثاليك ............... 2.5 جم (حوالي 0.02 مول) فينول ........... ............. ...................5 جم (حوالي 0.05 مول)
حامض الكبريتيك. هيدروكسيد الصوديوم حمض الاسيتيك؛ حامض الهيدروكلوريك؛ الكحول. كربون مفعل يوضع خليط من أنهيدريد الفثاليك والفينول مع 1 مل من حمض الكبريتيك المركز في أنبوب اختبار واسع ويسخن لمدة 3 ساعات. في حمام زيت بدرجة حرارة 125-130 درجة (يجب ألا ترتفع درجة الحرارة فوق 130 درجة!). يتم تحريك السائل الموجود في أنبوب الاختبار بشكل دوري باستخدام مقياس حرارة مغمور فيه. في نهاية التفاعل، يُسكب الخليط الذي لا يزال ساخنًا في كوب مع 50 مل من الماء ويُغلى حتى تختفي رائحة الفينول. يُترك المحلول ليبرد ، وبعد ذلك يتم ترشيحه على قمع Buchner ، مع محاولة عدم نقل الرواسب إلى المرشح إن أمكن. يتم غسل الراسب الموجود في الزجاج (وجزئيًا على المرشح) مرتين بأجزاء صغيرة من الماء البارد، ويذوب في كمية صغيرة من محلول هيدروكسيد الصوديوم الدافئ بنسبة 5٪، ثم يتم ترشيحه. يتم تحميض الراشح ذو اللون الأحمر الداكن بحمض الأسيتيك، وتضاف إليه 1-2 قطرة من حمض الهيدروكلوريك ويترك ليقف طوال الليل. يتم ترشيح الراسب الناتج وتجفيفه. يبلغ ناتج المنتج الخام حوالي 2 جرام للحصول على الفينول فثالين النقي، يذاب المنتج الناتج عن طريق التسخين في حوالي 10 مل من الكحول، ويغلى مع الكربون النشط، ويمتص المحلول الساخن ويغسل الكربون بالكحول الساخن. بعد التبريد، يتم تخفيف المحلول مع التحريك بثمانية أضعاف كمية الماء، وتصفيته، ويتم تسخين المرشح في كوب خزفي (في حمام مائي) لإزالة جزء كبير من الكحول ويترك لمدة نصف ساعة. يتم ترشيح البلورات المترسبة وتجفيفها في الهواء. العائد حوالي 1 غرام. رر. 250-253 درجة. |
الفينول فثالينهو مركب عضوي - مؤشر للبيئات الحمضية والقلوية. يمكن استخدامه كصبغة تقنية صناعية. حتى وقت قريب، كان يستخدم على نطاق واسع في علم الصيدلة بسبب خصائصه الملينة الواضحة وكان يباع تحت الاسم التجاري "purgen".
الإنتاج والخصائص الكيميائية للفينول فثالين
يحدث تخليق الفينول فثالين من خلال عملية مشتركة لتكثيف أنهيدريد الفثاليك والفينول. درجة حرارة التفاعل الأولية هي 100 - 110 درجة. يمكن أن يكون محفز العملية عبارة عن حمض الكبريتيك عالي التركيز أو كلوريد الزنك التقني (كلوريد الزنك). الفينول فثالين، يتم تسخينه بحمض الكبريتيك، ويسمح بالتفاعل العكسي لإنتاج الفينول.
المظهر والخصائص الفيزيائية للفينول فثالين
يمتلك الفينول فثالين بنية بلورية بصرية تكون في الغالب على شكل الماس. يذوب بشكل سيء في الماء ويحتوي على رواسب زائدة. قابل للذوبان في ثنائي إيثيل الأثير والكحول. للإشارة إلى الوسيلة، يتم استخدامه في معظم الحالات كمحلول كحولي. يبلغ متوسط كثافة المادة الصلبة الأولية 1.3 جم لكل 1 سم3.
تطبيقات الفينول فثالين
اليوم، يرتبط الاستخدام الرئيسي للفينول فثالين بالإشارة إلى وجود بيئة قلوية على المنتجات المتخصصة، على وجه الخصوص، للأغراض الطبية. في الصناعة والكيمياء التحليلية، يتم استخدام الدواء لتحديد الحموضة الكلية للكحوليات ومحاليل الكحول، وتحليل السعرات الحرارية لمستويات الحموضة، وما إلى ذلك. يستخدم الفينول فثالين عادة كصبغة للرصاص والمغنيسيوم والزنك وما إلى ذلك. في الطب، ليس لاستخدام الدواء أي أهمية، لأنه يرجع إلى تأثير تراكمي قوي وإمكانية تلف أنسجة الكلى البشرية مع الاستخدام على المدى الطويل. بالإضافة إلى ذلك، عند تناوله عن طريق الفم، لوحظت خصائص مشابهة للمواد المسرطنة. ومع ذلك، لم يكن هناك التخلي الكامل عن الدواء في الممارسة الطبية، ولكن يجب أن يتم استخدامه بحذر شديد.
تحضير الحل للإشارة
محلول الفينول فثالينبالنسبة لمعظم الأسطح الخاضعة للرقابة يتم تحضيره بتركيز 1%. للقيام بذلك، يتم إذابة 1 جرام من المادة البلورية الأولية في 100 مل من الكحول الإيثيلي. العمر الافتراضي لحل العمل هو شهر واحد. تخزين الحل في الثلاجة.
طرق استخدام حل العمل
- ضع 2-3 قطرات من المحلول على السطح المراد اختباره.
- يتم ترطيب المسحة بالمحلول ويتم تشحيم السطح الذي يتم اختباره.
- يتم غمر الأداة المراد اختبارها للتأكد من وجود بيئة قلوية في المحلول.
- تتم إضافة 2 - 3 قطرات من المحلول إلى بيئة سائلة خاضعة للرقابة.
يعتمد اختيار طريقة الاختبار على تفاصيل وحجم البيئة الخاضعة للرقابة.
تفاعل محلول العمل مع البيئات الحمضية والقلوية
- بيئة حمضية بقوة. لون المؤشر: برتقالي.
- بيئة حمضية قليلاً. لون المؤشر: عديم اللون.
- بيئة محايدة. لون المؤشر: عديم اللون.
- البيئة القلوية. لون المؤشر: وردي.
- بيئة قلوية للغاية. لون المؤشر: عديم اللون.
شراء الفينول فثالينمعنا يمكنك دائمًا الشراء بأسعار أقل من متوسط السوق وبجودة عالية باستمرار. نحن نتعامل فقط مع الشركات المصنعة الجديرة بالثقة.