التبادل الحراري.
1. التبادل الحراري.
التبادل الحراري أو نقل الحرارةهي عملية نقل الطاقة الداخلية من جسم إلى جسم آخر دون بذل شغل.
هناك ثلاثة أنواع من نقل الحرارة.
1) توصيل حراري- هذا هو التبادل الحراري بين الأجسام أثناء اتصالها المباشر.
2) الحمل الحراري- هذا هو التبادل الحراري الذي يتم فيه نقل الحرارة عن طريق تدفقات الغاز أو السائل.
3) إشعاع- هذا هو التبادل الحراري من خلال الإشعاع الكهرومغناطيسي.
2. كمية الحرارة.
كمية الحرارة هي مقياس للتغير في الطاقة الداخلية للجسم أثناء التبادل الحراري. تمت الإشارة إليه بالحرف س.
وحدة قياس كمية الحرارة = 1 جول.
يمكن إنفاق كمية الحرارة التي يتلقاها جسم من جسم آخر نتيجة للتبادل الحراري على زيادة درجة الحرارة (زيادة الطاقة الحركية للجزيئات) أو تغيير حالة التجميع (زيادة الطاقة الكامنة).
3. السعة الحرارية النوعية للمادة.
تظهر التجربة أن كمية الحرارة اللازمة لتسخين جسم كتلته m من درجة الحرارة T 1 إلى درجة الحرارة T 2 تتناسب مع كتلة الجسم m والفرق في درجة الحرارة (T 2 - T 1) أي.
س = سم(ت 2 - ت 1 ) = سمΔ تي،
معتسمى السعة الحرارية النوعية للمادة الموجودة في الجسم الساخن.
![]()
السعة الحرارية النوعية للمادة تساوي كمية الحرارة التي يجب نقلها إلى 1 كجم من المادة لتسخينها بمقدار 1 ك.
وحدة قياس السعة الحرارية النوعية =.
يمكن العثور على قيم السعة الحرارية للمواد المختلفة في الجداول الفيزيائية.
بالضبط سيتم إطلاق نفس الكمية من الحرارة Q عندما يتم تبريد الجسم بمقدار ΔT.
4. حرارة التبخر النوعية.
تظهر التجربة أن كمية الحرارة اللازمة لتحويل السائل إلى بخار تتناسب طرديا مع كتلة السائل، أي.
س = م,
أين هو معامل التناسب لتسمى الحرارة النوعية للتبخر .
الحرارة النوعية للتبخير تساوي كمية الحرارة اللازمة لتحويل 1 كجم من السائل عند نقطة الغليان إلى بخار.
وحدة قياس الحرارة النوعية للتبخر.
أثناء العملية العكسية، تكثيف البخار، يتم إطلاق الحرارة بنفس الكمية التي تم إنفاقها على تكوين البخار.
5. حرارة الانصهار النوعية.
تظهر التجربة أن كمية الحرارة اللازمة لتحويل المادة الصلبة إلى سائل تتناسب مع كتلة الجسم، أي.
س = λ م,
حيث يسمى معامل التناسب α بالحرارة النوعية للانصهار.
الحرارة النوعية للانصهار تساوي كمية الحرارة اللازمة لتحويل جسم صلب يزن 1 كجم إلى سائل عند نقطة الانصهار.
وحدة قياس الحرارة النوعية للانصهار.
أثناء العملية العكسية، تبلور السائل، يتم إطلاق الحرارة بنفس الكمية التي تم إنفاقها على الذوبان.
6. الحرارة النوعية للاحتراق.
تظهر التجربة أن كمية الحرارة المنبعثة أثناء الاحتراق الكامل للوقود تتناسب مع كتلة الوقود، أي.
س = سم,
حيث يسمى معامل التناسب q بالحرارة النوعية للاحتراق.
الحرارة النوعية للاحتراق تساوي كمية الحرارة المنبعثة أثناء الاحتراق الكامل لـ 1 كجم من الوقود.
وحدة قياس الحرارة النوعية للاحتراق.
7. معادلة التوازن الحراري.
يشمل التبادل الحراري جثتين أو أكثر. بعض الأجسام تبعث الحرارة، والبعض الآخر يستقبلها. ويحدث التبادل الحراري حتى تصبح درجات حرارة الأجسام متساوية. وفقًا لقانون حفظ الطاقة، فإن كمية الحرارة المنبعثة تساوي الكمية التي يتم تلقيها. وعلى هذا الأساس تتم كتابة معادلة التوازن الحراري.
لنلقي نظرة على مثال.
جسم كتلته m 1 ، سعته الحرارية c 1 ، له درجة حرارة T 1 ، وجسم كتلته m 2 ، سعته الحرارية c 2 ، له درجة حرارة T 2. علاوة على ذلك، T 1 أكبر من T 2. يتم الاتصال بهذه الهيئات. تظهر التجربة أن الجسم البارد (م2) يبدأ في التسخين، والجسم الساخن (م1) يبدأ في التبريد. وهذا يشير إلى أن جزءًا من الطاقة الداخلية للجسم الساخن ينتقل إلى الجسم البارد، وتتعادل درجات الحرارة. دعونا نشير إلى درجة الحرارة الإجمالية النهائية بـ θ. 
كمية الحرارة التي تنتقل من الجسم الساخن إلى الجسم البارد
س نقل. = ج 1 م 1 (ت 1 – θ )
كمية الحرارة التي يستقبلها الجسم البارد من الجسم الساخن
س تلقى. = ج 2 م 2 (θ – ت 2 )
وفقا لقانون الحفاظ على الطاقة س نقل. = س تلقى.، أي.
ج 1 م 1 (ت 1 – θ )= ج 2 م 2 (θ – ت 2 )
دعونا نفتح الأقواس ونعبر عن قيمة درجة الحرارة الإجمالية للحالة المستقرة θ.
![]()
في هذه الحالة، نحصل على قيمة درجة الحرارة θ بالكلفن.
ومع ذلك، منذ تم تمرير Q في التعبيرات. ويتم استلام س. هو الفرق بين درجتين من الحرارة، وهو نفسه سواء بالكلفن أو بالدرجات المئوية، ومن ثم يمكن إجراء الحساب بالدرجات المئوية. ثم
![]()
في هذه الحالة، نحصل على قيمة درجة الحرارة θ بالدرجات المئوية.
يمكن تفسير تعادل درجات الحرارة نتيجة التوصيل الحراري على أساس نظرية الحركية الجزيئية كتبادل الطاقة الحركية بين الجزيئات عند الاصطدام في عملية الحركة الفوضوية الحرارية.
يمكن توضيح هذا المثال بالرسم البياني. 
تسمى عملية نقل الطاقة من جسم إلى آخر دون بذل شغل التبادل الحراريأو انتقال الحرارة. يحدث التبادل الحراري بين الأجسام التي لها درجات حرارة مختلفة. عند حدوث اتصال بين الأجسام ذات درجات الحرارة المختلفة، يتم نقل جزء من الطاقة الداخلية من الجسم الذي درجة حرارته أعلى إلى الجسم الذي تكون درجة حرارته أقل. تسمى الطاقة التي تنتقل إلى الجسم نتيجة التبادل الحراري كمية من الحرارة.
السعة الحرارية النوعية للمادة:
إذا لم تكن عملية انتقال الحرارة مصحوبة بشغل، فبناء على القانون الأول للديناميكا الحرارية فإن كمية الحرارة تساوي التغير في الطاقة الداخلية للجسم: .
يتناسب متوسط طاقة الحركة الانتقالية العشوائية للجزيئات مع درجة الحرارة المطلقة. إن التغير في الطاقة الداخلية لجسم ما يساوي المجموع الجبري للتغيرات في طاقة جميع الذرات أو الجزيئات التي يتناسب عددها مع كتلة الجسم، وبالتالي التغير في الطاقة الداخلية، وبالتالي، تتناسب كمية الحرارة مع الكتلة والتغير في درجة الحرارة:


ويسمى عامل التناسب في هذه المعادلة السعة الحرارية النوعية للمادة. توضح السعة الحرارية النوعية مقدار الحرارة اللازمة لتسخين 1 كجم من المادة بمقدار 1 ك.
العمل في الديناميكا الحرارية:
في الميكانيكا، يتم تعريف الشغل على أنه حاصل ضرب معاملي القوة والإزاحة وجيب تمام الزاوية بينهما. يتم الشغل عندما تؤثر قوة على جسم متحرك وتكون مساوية للتغير في طاقته الحركية.
في الديناميكا الحرارية، لا تؤخذ في الاعتبار حركة الجسم ككل؛ فنحن نتحدث عن حركة أجزاء الجسم العياني بالنسبة لبعضها البعض. ونتيجة لذلك يتغير حجم الجسم، لكن سرعته تظل مساوية للصفر. يتم تعريف العمل في الديناميكا الحرارية بنفس الطريقة كما هو الحال في الميكانيكا، ولكنه يساوي التغيير ليس في الطاقة الحركية للجسم، ولكن في طاقته الداخلية.
عند تنفيذ شغل (ضغط أو تمدد)، تتغير الطاقة الداخلية للغاز. السبب في ذلك هو: أثناء التصادمات المرنة لجزيئات الغاز مع مكبس متحرك، تتغير طاقتها الحركية.
دعونا نحسب الشغل الذي يبذله الغاز أثناء التمدد. يؤثر الغاز بقوة على المكبس  ، أين
، أين  - ضغط الغاز، و
- ضغط الغاز، و  - مساحة السطح
- مساحة السطح  مكبس عندما يتمدد الغاز، يتحرك المكبس في اتجاه القوة
مكبس عندما يتمدد الغاز، يتحرك المكبس في اتجاه القوة  مسافة قصيرة
مسافة قصيرة  . إذا كانت المسافة صغيرة، فيمكن اعتبار ضغط الغاز ثابتا. الشغل الذي يبذله الغاز هو:
. إذا كانت المسافة صغيرة، فيمكن اعتبار ضغط الغاز ثابتا. الشغل الذي يبذله الغاز هو:
أين  - التغير في حجم الغاز.
- التغير في حجم الغاز.
وفي عملية تمدد الغاز، فإنه يقوم بعمل إيجابي، لأن اتجاه القوة والإزاحة يتطابقان. أثناء عملية التمدد، يطلق الغاز الطاقة إلى الأجسام المحيطة.
يختلف الشغل الذي تبذله الأجسام الخارجية على الغاز عن الشغل الذي يبذله الغاز فقط بالإشارة  ، منذ القوة
، منذ القوة  التأثير على الغاز معاكس للقوة
التأثير على الغاز معاكس للقوة  ، الذي يعمل به الغاز على المكبس، ويساويه في المعامل (قانون نيوتن الثالث)؛ وتبقى الحركة على حالها. وبالتالي فإن عمل القوى الخارجية يساوي:
، الذي يعمل به الغاز على المكبس، ويساويه في المعامل (قانون نيوتن الثالث)؛ وتبقى الحركة على حالها. وبالتالي فإن عمل القوى الخارجية يساوي:
 .
.
القانون الأول للديناميكا الحرارية:
القانون الأول للديناميكا الحرارية هو قانون حفظ الطاقة، ويمتد ليشمل الظواهر الحرارية. قانون حفظ الطاقة: الطاقة في الطبيعة لا تنشأ من لا شيء ولا تختفي: كمية الطاقة لا تتغير، إنها فقط تنتقل من شكل إلى آخر.
تدرس الديناميكا الحرارية الأجسام التي يظل مركز ثقلها دون تغيير تقريبًا. وتظل الطاقة الميكانيكية لمثل هذه الأجسام ثابتة، ولا يمكن أن تتغير إلا الطاقة الداخلية.
يمكن أن تتغير الطاقة الداخلية بطريقتين: نقل الحرارة والشغل. في الحالة العامة، تتغير الطاقة الداخلية بسبب انتقال الحرارة وبسبب الشغل المبذول. تمت صياغة القانون الأول للديناميكا الحرارية خصيصًا لمثل هذه الحالات العامة:
إن التغير في الطاقة الداخلية للنظام أثناء انتقاله من حالة إلى أخرى يساوي مجموع عمل القوى الخارجية وكمية الحرارة المنقولة إلى النظام:

وإذا كان النظام معزولاً فلا يتم بذل أي شغل عليه ولا يتبادل الحرارة مع الأجسام المحيطة به. وفقا للقانون الأول للديناميكا الحرارية تظل الطاقة الداخلية لنظام معزول دون تغيير.
معتبرا أن  ، يمكن كتابة القانون الأول للديناميكا الحرارية على النحو التالي:
، يمكن كتابة القانون الأول للديناميكا الحرارية على النحو التالي:

تذهب كمية الحرارة المنقولة إلى النظام لتغيير طاقته الداخلية ولأداء العمل على الأجسام الخارجية بواسطة النظام.
القانون الثاني للديناميكا الحرارية: من المستحيل نقل الحرارة من نظام أكثر برودة إلى نظام أكثر سخونة في غياب تغييرات أخرى متزامنة في كلا النظامين أو في الأجسام المحيطة.
730. لماذا يستخدم الماء لتبريد بعض الآليات؟
يتمتع الماء بسعة حرارية نوعية عالية، مما يسهل إزالة الحرارة بشكل جيد من الآلية.
731. في أي حالة يكون من الضروري إنفاق المزيد من الطاقة: لتسخين لتر واحد من الماء بمقدار 1 درجة مئوية أو تسخين مائة جرام من الماء بمقدار 1 درجة مئوية؟
لتسخين لتر من الماء، كلما زادت الكتلة، كلما زاد استهلاك الطاقة.
732. تم إنزال شوكات الفضة والفضة ذات الكتلة المتساوية في الماء الساخن. هل سيحصلون على نفس كمية الحرارة من الماء؟
ستتلقى شوكة النيكل النحاسي المزيد من الحرارة لأن الحرارة النوعية للنيكل أكبر من حرارة الفضة.
733. ضربت قطعة من الرصاص وقطعة من الحديد الزهر من نفس الكتلة ثلاث مرات بمطرقة ثقيلة. أي قطعة أصبحت أكثر سخونة؟
سوف يسخن الرصاص أكثر لأن سعته الحرارية المحددة أقل من الحديد الزهر ويستهلك طاقة أقل لتسخين الرصاص.
734. قارورة واحدة تحتوي على الماء، والآخر يحتوي على الكيروسين من نفس الكتلة ودرجة الحرارة. تم إسقاط مكعب حديدي متساوي التسخين في كل دورق. ما الذي سيسخن إلى درجة حرارة أعلى - الماء أم الكيروسين؟
الكيروسين.
735. لماذا تكون تقلبات درجات الحرارة في الشتاء والصيف أقل حدة في المدن الواقعة على شاطئ البحر عنها في المدن الواقعة في الداخل؟
يسخن الماء ويبرد بشكل أبطأ من الهواء. وفي الشتاء، يبرد وينقل كتل الهواء الدافئة إلى الأرض، مما يجعل المناخ على الساحل أكثر دفئًا.
736. تبلغ السعة الحرارية النوعية للألمنيوم 920 جول/كجم درجة مئوية. ماذا يعني هذا؟
وهذا يعني أنه لتسخين 1 كجم من الألومنيوم بمقدار 1 درجة مئوية، من الضروري إنفاق 920 ج.
737. يتم تبريد قضبان الألومنيوم والنحاس التي لها نفس الكتلة 1 كجم بمقدار 1 درجة مئوية. ما مقدار التغير في الطاقة الداخلية لكل كتلة؟ لأي شريط سيتغير أكثر وبكم؟
738. ما هي كمية الحرارة اللازمة لتسخين كيلوغرام من قطع الحديد بمقدار 45 درجة مئوية؟

739. ما كمية الحرارة اللازمة لتسخين 0.25 كجم من الماء من 30 درجة مئوية إلى 50 درجة مئوية؟

740. كيف ستتغير الطاقة الداخلية لترين من الماء عند تسخينها بمقدار 5 درجات مئوية؟

741. ما كمية الحرارة اللازمة لتسخين 5 جم من الماء من 20 درجة مئوية إلى 30 درجة مئوية؟
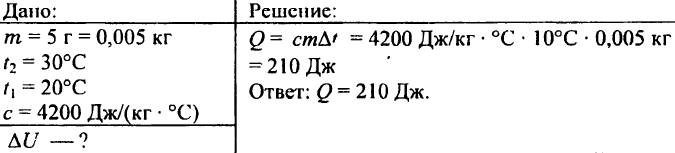
742. ما كمية الحرارة اللازمة لتسخين كرة ألومنيوم وزنها 0.03 كجم إلى 72 درجة مئوية؟
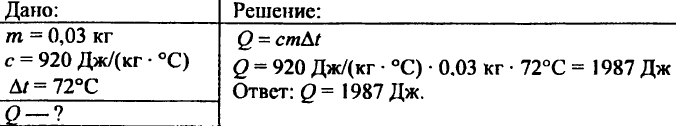
743. احسب كمية الحرارة اللازمة لتسخين 15 كجم من النحاس بمقدار 80 درجة مئوية.

744. احسب كمية الحرارة اللازمة لتسخين 5 كجم من النحاس من 10 درجات مئوية إلى 200 درجة مئوية.

745. ما كمية الحرارة اللازمة لتسخين 0.2 كجم من الماء من 15 درجة مئوية إلى 20 درجة مئوية؟

746. ماء وزنه 0.3 كجم تم تبريده بمقدار 20 درجة مئوية. ما مقدار انخفاض الطاقة الداخلية للماء؟

747. ما كمية الحرارة اللازمة لتسخين 0.4 كجم من الماء عند درجة حرارة 20 درجة مئوية إلى درجة حرارة 30 درجة مئوية؟

748. ما كمية الحرارة التي يتم إنفاقها لتسخين 2.5 كجم من الماء بمقدار 20 درجة مئوية؟

749. ما كمية الحرارة المنبعثة عند تبريد 250 g من الماء من 90 درجة مئوية إلى 40 درجة مئوية؟

750. ما كمية الحرارة اللازمة لتسخين 0.015 لتر من الماء بمقدار 1 درجة مئوية؟
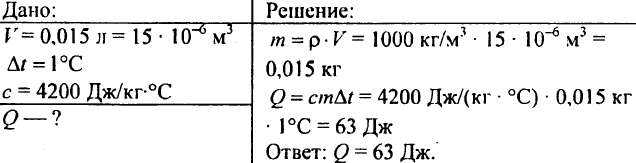
751. احسب كمية الحرارة اللازمة لتسخين بركة حجمها 300 م3 عند درجة حرارة 10 درجات مئوية؟
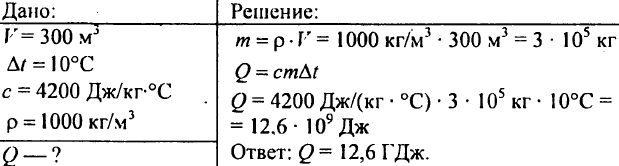
752. ما هي كمية الحرارة التي يجب إضافتها إلى 1 كجم من الماء لترتفع درجة حرارته من 30 درجة مئوية إلى 40 درجة مئوية؟
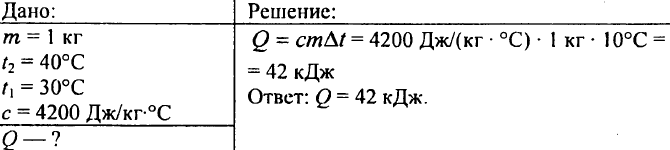
753. تم تبريد الماء الذي يبلغ حجمه 10 لترات من درجة حرارة 100 درجة مئوية إلى درجة حرارة 40 درجة مئوية. ما مقدار الحرارة التي تم إطلاقها خلال هذا؟

754. احسب كمية الحرارة اللازمة لتسخين 1 م3 من الرمال عند درجة حرارة 60 درجة مئوية.

755. حجم الهواء 60 م3، السعة الحرارية النوعية 1000 جول/كجم درجة مئوية، كثافة الهواء 1.29 كجم/م3. ما مقدار الحرارة اللازمة لرفعه إلى 22 درجة مئوية؟

756. تم تسخين الماء بمقدار 10 درجات مئوية، مما أدى إلى إنفاق 4.20103 جول من الحرارة. تحديد كمية الماء.

757. تم نقل 20.95 kJ من الحرارة إلى ماء وزنه 0.5 كجم. ماذا تصبح درجة حرارة الماء إذا كانت درجة حرارة الماء الأولية 20 درجة مئوية؟

758. وعاء نحاسي وزنه 2.5 كجم مملوء بـ 8 كجم من الماء عند درجة حرارة 10 درجة مئوية. ما مقدار الحرارة اللازمة لتسخين الماء في المقلاة حتى الغليان؟

759. تم صب لتر من الماء عند درجة حرارة 15 درجة مئوية في مغرفة من النحاس وزنها 300 جم. ما كمية الحرارة اللازمة لتسخين الماء في المغرفة إلى 85 درجة مئوية؟

760. تم وضع قطعة من الجرانيت المسخن وزنها 3 كجم في الماء. ينقل الجرانيت 12.6 كيلوجول من الحرارة إلى الماء، ويبرد بمقدار 10 درجات مئوية. ما هي السعة الحرارية المحددة للحجر؟

761. تمت إضافة الماء الساخن عند 50 درجة مئوية إلى 5 كجم من الماء عند 12 درجة مئوية، للحصول على خليط بدرجة حرارة 30 درجة مئوية. ما كمية الماء التي أضفتها؟

762. تمت إضافة الماء عند 20 درجة مئوية إلى 3 لترات من الماء عند 60 درجة مئوية، للحصول على ماء عند 40 درجة مئوية. ما كمية الماء التي أضفتها؟

763. ما هي درجة حرارة الخليط إذا قمت بخلط 600 جرام من الماء عند 80 درجة مئوية مع 200 جرام من الماء عند 20 درجة مئوية؟

764. تم سكب لتر من الماء عند درجة حرارة 90 درجة مئوية في ماء عند درجة حرارة 10 درجة مئوية، وأصبحت درجة حرارة الماء 60 درجة مئوية. كم كان الماء البارد هناك؟
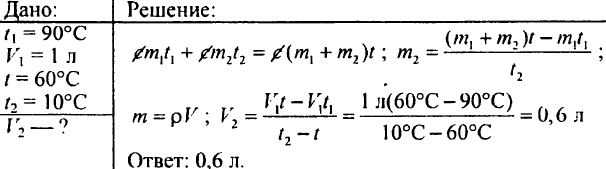
765. تحديد مقدار الماء الساخن الذي يجب سكبه في الوعاء الذي تم تسخينه إلى 60 درجة مئوية إذا كان الوعاء يحتوي بالفعل على 20 لترًا من الماء البارد عند درجة حرارة 15 درجة مئوية؛ يجب أن تكون درجة حرارة الخليط 40 درجة مئوية.

766. تحديد مقدار الحرارة اللازمة لتسخين 425 جم من الماء بمقدار 20 درجة مئوية.

767. كم درجة سيسخن 5 كجم من الماء إذا استقبل الماء 167.2 كيلوجول؟

768. ما مقدار الحرارة المطلوبة لتسخين m جرام من الماء عند درجة الحرارة t1 إلى درجة الحرارة t2؟
769. تم صب 2 كجم من الماء في المسعر عند درجة حرارة 15 درجة مئوية. ما درجة الحرارة التي ستسخن بها المياه في المسعر إذا تم إنزال وزن نحاس كتلته 500 جرام تم تسخينه إلى 100 درجة مئوية؟ السعة الحرارية النوعية للنحاس هي 0.37 كيلوجول/(كجم درجة مئوية).

770. يوجد قطع من النحاس والقصدير والألومنيوم بنفس الحجم. أي من هذه القطع له أكبر سعة حرارية وأيها له أصغر سعة حرارية؟

771. تم صب 450 جم من الماء، درجة حرارته 20 درجة مئوية، في المسعر. عندما تم غمر 200 جم من برادة الحديد المسخنة إلى 100 درجة مئوية في هذا الماء، أصبحت درجة حرارة الماء 24 درجة مئوية. تحديد السعة الحرارية النوعية لنشارة الخشب.

772. يحتوي المسعر النحاسي الذي يزن 100 جم على 738 جم من الماء، ودرجة حرارته 15 درجة مئوية. تم إنزال 200 جم من النحاس في هذا المسعر عند درجة حرارة 100 درجة مئوية، وبعد ذلك ارتفعت درجة حرارة المسعر إلى 17 درجة مئوية. ما هي السعة الحرارية المحددة للنحاس؟

773. أُخرجت كرة فولاذية وزنها 10 جم من الفرن ووضعتها في ماء عند درجة حرارة 10 درجات مئوية. ارتفعت درجة حرارة الماء إلى 25 درجة مئوية. ما درجة حرارة الكرة في الفرن إذا كانت كتلة الماء 50 جم؟ السعة الحرارية النوعية للفولاذ هي 0.5 كيلوجول/(كجم درجة مئوية).

777. تم صب 50 جم من الماء عند 19 درجة مئوية في ماء يزن 150 جم عند درجة حرارة 35 درجة مئوية. ما هي درجة حرارة الخليط؟

778. تم سكب ماء وزنه 5 كجم عند 90 درجة مئوية في وعاء من الحديد الزهر يزن 2 كجم عند درجة حرارة 10 درجات مئوية. كم كانت درجة حرارة الماء؟

779- تم تسخين قاطعة فولاذية تزن 2 كجم إلى درجة حرارة 800 درجة مئوية ثم إنزالها في وعاء يحتوي على 15 لترًا من الماء عند درجة حرارة 10 درجات مئوية. إلى أي درجة حرارة سوف يسخن الماء في الوعاء؟

(إشارة: لحل هذه المشكلة، من الضروري إنشاء معادلة تعتبر فيها درجة حرارة الماء غير المعروفة في الوعاء بعد خفض القاطع غير معروفة.)
780. ما درجة حرارة الماء إذا قمت بخلط 0.02 كجم من الماء عند 15 درجة مئوية، و0.03 كجم من الماء عند 25 درجة مئوية، و0.01 كجم من الماء عند 60 درجة مئوية؟

781. لتدفئة فصل جيد التهوية، فإن كمية الحرارة المطلوبة هي 4.19 ميجا جول في الساعة. يدخل الماء إلى مشعات التدفئة عند درجة حرارة 80 درجة مئوية ويتركها عند درجة حرارة 72 درجة مئوية. ما هي كمية المياه التي يجب توفيرها للمشعات كل ساعة؟

782- تم غمر الرصاص الذي يبلغ وزنه 0.1 كجم عند درجة حرارة 100 درجة مئوية في مسعر من الألومنيوم يزن 0.04 كجم ويحتوي على 0.24 كجم من الماء عند درجة حرارة 15 درجة مئوية. وبعد ذلك وصلت درجة الحرارة في المسعر إلى 16 درجة مئوية. ما هي الحرارة النوعية للرصاص؟

كما نعلم بالفعل، يمكن أن تتغير الطاقة الداخلية للجسم عند بذل شغل ومن خلال نقل الحرارة (دون بذل شغل). والفرق الرئيسي بين الشغل وكمية الحرارة هو أن الشغل يحدد عملية تحويل الطاقة الداخلية للنظام، والتي يصاحبها تحول الطاقة من نوع إلى آخر.
في حالة حدوث تغيير في الطاقة الداخلية بمساعدة انتقال الحرارةيتم نقل الطاقة من جسم إلى آخر بسبب توصيل حراريأو الإشعاع أو الحمل الحراري.
تسمى الطاقة التي يفقدها الجسم أو يكتسبها أثناء انتقال الحرارة كمية من الحرارة.
عند حساب كمية الحرارة، عليك أن تعرف ما هي الكميات التي تؤثر عليها.
سنقوم بتسخين وعاءين باستخدام شعلتين متماثلتين. وعاء واحد يحتوي على 1 كجم من الماء، والآخر يحتوي على 2 كجم. درجة حرارة الماء في الوعاءين هي نفسها في البداية. يمكننا أن نرى أنه خلال نفس الوقت، يسخن الماء في أحد الأوعية بشكل أسرع، على الرغم من أن كلا الوعاءين يتلقىان كمية متساوية من الحرارة.
وهكذا نستنتج: كلما زادت كتلة جسم معين، زادت كمية الحرارة التي يجب إنفاقها لخفض أو زيادة درجة حرارته بنفس عدد الدرجات.
عندما يبرد الجسم، فإنه يطلق كمية أكبر من الحرارة إلى الأجسام المجاورة، وكلما زادت كتلته.
نعلم جميعًا أننا إذا أردنا تسخين غلاية كاملة من الماء إلى درجة حرارة 50 درجة مئوية، فسنقضي وقتًا أقل في هذا الإجراء مقارنة بتسخين غلاية بنفس الحجم من الماء، ولكن إلى 100 درجة مئوية فقط. في الحالة الأولى، سيتم إعطاء حرارة أقل للمياه مقارنة بالحالة الثانية.
وبالتالي، فإن كمية الحرارة اللازمة للتدفئة تعتمد بشكل مباشر على ما إذا كان كم درجهيمكن للجسم الاحماء. بإمكاننا أن نستنتج: تعتمد كمية الحرارة بشكل مباشر على الفرق في درجة حرارة الجسم.
ولكن هل من الممكن تحديد كمية الحرارة المطلوبة ليس لتسخين الماء، ولكن بعض المواد الأخرى، على سبيل المثال، النفط أو الرصاص أو الحديد؟
 املأ وعاء واحد بالماء واملأ الآخر بالزيت النباتي. كتلتا الماء والزيت متساويتان. سنقوم بتسخين كلا الوعاءين بالتساوي على شعلات متطابقة. لنبدأ التجربة عند درجات حرارة أولية متساوية للزيت النباتي والماء. وبعد خمس دقائق، وبعد قياس درجتي حرارة الزيت والماء الساخنين، سنلاحظ أن درجة حرارة الزيت أعلى بكثير من درجة حرارة الماء، على الرغم من أن كلا السائلين تلقى نفس كمية الحرارة.
املأ وعاء واحد بالماء واملأ الآخر بالزيت النباتي. كتلتا الماء والزيت متساويتان. سنقوم بتسخين كلا الوعاءين بالتساوي على شعلات متطابقة. لنبدأ التجربة عند درجات حرارة أولية متساوية للزيت النباتي والماء. وبعد خمس دقائق، وبعد قياس درجتي حرارة الزيت والماء الساخنين، سنلاحظ أن درجة حرارة الزيت أعلى بكثير من درجة حرارة الماء، على الرغم من أن كلا السائلين تلقى نفس كمية الحرارة.
الاستنتاج الواضح هو: عند تسخين كتلتين متساويتين من الزيت والماء عند نفس درجة الحرارة، يلزم وجود كميات مختلفة من الحرارة.
ونخلص على الفور إلى نتيجة أخرى: كمية الحرارة اللازمة لتسخين الجسم تعتمد بشكل مباشر على المادة التي يتكون منها الجسم نفسه (نوع المادة).
وبالتالي، فإن كمية الحرارة اللازمة لتسخين الجسم (أو إطلاقها عند التبريد) تعتمد بشكل مباشر على كتلة الجسم، وتغير درجة حرارته، ونوع المادة.
يُشار إلى كمية الحرارة بالرمز Q. مثل أنواع الطاقة المختلفة الأخرى، يتم قياس كمية الحرارة بالجول (J) أو الكيلوجول (kJ).
1 كيلوجول = 1000 جول
ومع ذلك، يظهر التاريخ أن العلماء بدأوا في قياس كمية الحرارة قبل وقت طويل من ظهور مفهوم الطاقة في الفيزياء. في ذلك الوقت، تم تطوير وحدة خاصة لقياس كمية الحرارة - السعرات الحرارية (كال) أو كيلو كالوري (كيلو كالوري). الكلمة لها جذور لاتينية، كالور - الحرارة.
1 سعرة حرارية = 1000 سعرة حرارية
السعرات الحرارية– هذه هي كمية الحرارة اللازمة لتسخين 1 جم من الماء بمقدار 1 درجة مئوية
1 كال = 4.19 ي ≈ 4.2 ي
1 سعر حراري = 4190 جول ≈ 4200 جول ≈ 4.2 كيلو جول
لا تزال لديك أسئلة؟ لا تعرف كيف تقوم بواجبك المنزلي؟
للحصول على مساعدة من المعلم، قم بالتسجيل.
الدرس الأول مجاني!
موقع الويب، عند نسخ المادة كليًا أو جزئيًا، يلزم وجود رابط للمصدر.
كما هو معروف، خلال العمليات الميكانيكية المختلفة يحدث تغيير في الطاقة الميكانيكية. مقياس التغير في الطاقة الميكانيكية هو عمل القوى المطبقة على النظام:
أثناء التبادل الحراري، يحدث تغيير في الطاقة الداخلية للجسم. مقياس التغير في الطاقة الداخلية أثناء انتقال الحرارة هو كمية الحرارة.
كمية الحرارةهو مقياس للتغير في الطاقة الداخلية التي يتلقاها الجسم (أو يتخلى عنها) أثناء عملية التبادل الحراري.
وبالتالي، فإن كلا من الشغل وكمية الحرارة يميزان التغير في الطاقة، لكنهما ليسا متطابقين مع الطاقة. وهي لا تصف حالة النظام نفسه، ولكنها تحدد عملية انتقال الطاقة من نوع إلى آخر (من جسم إلى آخر) عندما تتغير الحالة وتعتمد بشكل كبير على طبيعة العملية.
الفرق الرئيسي بين الشغل وكمية الحرارة هو أن الشغل يميز عملية تغيير الطاقة الداخلية للنظام، مصحوبة بتحول الطاقة من نوع إلى آخر (من ميكانيكية إلى داخلية). تتميز كمية الحرارة بعملية نقل الطاقة الداخلية من جسم إلى آخر (من الأكثر تسخينًا إلى الأقل تسخينًا)، دون أن يصاحبها تحولات في الطاقة.
تظهر التجربة أن كمية الحرارة اللازمة لتسخين جسم كتلته m من درجة حرارة إلى أخرى يتم حسابها بواسطة الصيغة
حيث c هي السعة الحرارية النوعية للمادة؛
![]()
وحدة SI للسعة الحرارية المحددة هي جول لكل كيلوغرام كلفن (J/(kg K)).
حرارة نوعيةج يساوي عدديًا كمية الحرارة التي يجب نقلها إلى جسم يزن 1 كجم لتسخينه بمقدار 1 ك.
السعة الحراريةالجسم يساوي عددياً كمية الحرارة اللازمة لتغيير درجة حرارة الجسم بمقدار 1 كلفن:
![]()
وحدة SI لقياس السعة الحرارية لجسم ما هي جول لكل كلفن (J/K).
لتحويل السائل إلى بخار عند درجة حرارة ثابتة، من الضروري إنفاق كمية من الحرارة
حيث L هي الحرارة النوعية للتبخر. عندما يتكثف البخار، يتم إطلاق نفس الكمية من الحرارة.







