5. أثناء الصيام والعمل البدني، يتم تنشيط تحلل الدهون في الأنسجة الدهنية ويزداد تدفق الأحماض الدهنية إلى الأنسجة. تصبح الأحماض الدهنية مصدرًا مهمًا للطاقة للأنسجة مثل العضلات الهيكلية وعضلة القلب والكبد. ومع ذلك، لا يستطيع الدماغ استخدام الأحماض الدهنية كمصدر للطاقة لأنها لا تعبر حاجز الدم في الدماغ، كونها جزيئات كارهة للماء. لذلك، في مثل هذه الحالات، وخاصة أثناء الصيام لفترات طويلة، يقوم الكبد بمعالجة ما يقرب من 50٪ من الأحماض الدهنية التي تدخله إلى مصادر أخرى للطاقة. أجسام خلونية،والتي يمكن الاستفادة منها عن طريق الأنسجة العصبية.
الموضوع 8.9. أجسام الكيتون: التوليف والتقويض.
الحماض الكيتوني
1. تشتمل الأجسام الكيتونية على ثلاث مواد: بيتا هيدروكسي بوتيرات، أسيتو أسيتاتو الأسيتون.
الأولين فقط هما مصدران للطاقة ويمكن أكسدتهما في الأنسجة. عادة، يكون تركيز أجسام الكيتون في الدم منخفضًا ويصل إلى 1-3 ملجم/ديسيلتر. يزداد تركيب الأجسام الكيتونية مع:
صيام؛
النشاط البدني المكثف لفترات طويلة.
تناول الأطعمة الغنية بالدهون وقليلة الكربوهيدرات (حمية أتكينز، حمية “الكرملين”)؛
السكرى.
أجسام الكيتون هي أحماض قابلة للذوبان في الماء، لذلك، على عكس الأحماض الدهنية، يمكنها المرور عبر حاجز الدم في الدماغ وتكون بمثابة مصدر للطاقة للأنسجة العصبية، إلى جانب الجلوكوز، خاصة بعد 3-5 أيام من الصيام، عندما يزداد تركيز أجسام الكيتون في الدم بشكل ملحوظ (الشكل 8.20).
تستخدم العضلات الهيكلية والكلى أجسام الكيتون حتى بتركيزات منخفضة في الدم.
أرز. 8.20. تغيرات في تركيز الجلوكوز والأحماض الدهنية والأجسام الكيتونية في بلازما الدم أثناء الصيام
2. يتم تصنيع أجسام الكيتون في الميتوكوندريا الكبدية وبكميات صغيرة في قشرة الكلى. الركيزة الأولية للتوليف هي أسيتيل CoA، الذي يتشكل نتيجة أكسدة الأحماض الدهنية. تتطور الحالة التي يزداد فيها تخليق أجسام الكيتون على النحو التالي. أثناء الصيام، يقوم هرمون الجلوكاجون (أو الأدرينالين أثناء العمل البدني) بتنشيط تحلل الدهون من خلال نظام محلقة الأدينيلات في الأنسجة الدهنية. يتم إطلاق الأحماض الدهنية في الدم ونقلها مع الألبومين إلى الكبد. في الكبد، يزداد معدل أكسدة بيتا وتتشكل كمية كبيرة من أسيتيل مرافق الإنزيم أ. يتم تقليل معدل تفاعلات دورة كريبس في ظل هذه الظروف نتيجة تثبيط الإنزيمات التنظيمية لدورة السترات بواسطة مثبطات التفارغ لـ ATP و NADH، والتي يزداد تركيزها نتيجة للأكسدة النشطة. بالإضافة إلى ذلك، عند التركيزات العالية من NADH، يتم اختزال أوكسالوسيتات إلى مالات وفي هذا الشكل يتم نقله إلى العصارة الخلوية، حيث يستمر التفاعل في الاتجاه المعاكس. يصبح أوكسالوسيتات ركيزة لتكوين الجلوكوز وهو أقل توفرًا للتفاعل مع أسيتيل CoA. ونتيجة لذلك، يتراكم أسيتيل CoA في الميتوكوندريا، والذي يستخدم لتخليق أجسام الكيتون (الشكل 8.21، 8.22).
تتضمن الآلية الكلاسيكية لتكوين السمنة زيادة القدرة على تكوين الدهون وترسبها في الأنسجة الدهنية، خاصة في "مستودعات الدهون"، وصعوبة تعبئة الدهون من الأنسجة. لا يتم زيادة تراكم الدهون في الجسم عن طريق الدهون المدخلة والمتكونة داخليًا بقدر ما يتم عن طريق الكربوهيدرات. يتم التعبير عن تنشيط الدورات الأيضية التي تعزز تكوين الدهون من الكربوهيدرات في السمنة في الغالب في الأنسجة الدهنية. وبطبيعة الحال، ينبغي أن تأخذ مكانا مركزيا بين الآليات المسببة للسمنة.
تمثل الأنسجة الدهنية في الشخص السليم ما يصل إلى 20٪ من وزن الجسم، ولكن في الشخص الذي يعاني من السمنة المفرطة يمكن أن تصل إلى 40-50٪، وفي بعض الحالات تزيد إلى 70٪. تتكون غالبية الأنسجة الدهنية من الدهون الثلاثية (70-90٪). الأنسجة الدهنية ليست عادة مستودعًا بسيطًا للدهون. لديها نشاط استقلابي عالي. يخضع باستمرار لعمليات استقلابية مكثفة، مثل تخليق الدهون والتحلل المائي: تخليق الأحماض الدهنية، بما في ذلك من الكربوهيدرات، وأسترةها إلى دهون ثلاثية أو دهون محايدة، وترسبها وتحللها لتكوين أحماض دهنية، واستخدام الأخيرة في عملية التمثيل الغذائي. أغراض الطاقة. في الشخص السليم، تكون عمليات تكوين الدهون وتحلل الدهون متوازنة. يتم ضمان تخليق الدهون من خلال دورتين استقلابيتين - حال السكر والبنتوز.
يقوم مسار تحلل السكر بتصنيع الجلسرين من الجلوكوز خلال مرحلة تكوين α-glycerophosphate. يستخدم الجلسرين الحر الموجود في الأنسجة الدهنية لتخليق الدهون الثلاثية. تتضمن خطوات دورة البنتوز تكوين حمض البيروفيك من السكريات الأحادية والأحماض الأمينية الجلوكوجينية، ونزع الكربوكسيل، يليها تكوين أسيتيل CoA. يتم تكثيف أسيتيل CoA، بمشاركة أدينوسين ثلاثي الفوسفات (ATP) وNADP-H2، عبر سلسلة من المراحل إلى أحماض دهنية أعلى. إذا كانت دورة البنتوز غير نشطة، فإن NADP غير المخفض هو السائد في البيئة وعمليات تخليق الدهون ليست مكثفة. عندما يهيمن انخفاض NADP، أو NADP-H2، في البيئة، يتم تنشيط عملية التمثيل الغذائي للدهون.
من المعروف أن ترسب الدهون في الأنسجة الدهنية يحدث بشكل رئيسي نتيجة لتكوينها الجديد من الكربوهيدرات الغذائية. تحدد شدة تفاعلات دورة البنتوز معدل تكوين الأحماض الدهنية من الجلوكوز. في الأنسجة الدهنية، مقارنة بأنسجة الجسم الأخرى، فإن دورة فوسفات البنتوز لديها أعلى نشاط. تبلغ نسبة هذا إلى دورة تحلل السكر في الأنسجة الدهنية حوالي 1:1، وفي الكبد 1:12، وفي الأنسجة المعوية، لا يحدث التبادل خلال دورة البنتوز على الإطلاق [Leites S. M., 1967]. أظهرت الحسابات المستندة إلى نتائج الدراسات التي أجريت على الكربون المسمى أن الأنسجة الدهنية تستخدم حوالي 50% من الجلوكوز المتوفر لها في تفاعلات تحلل السكر و50% منها تتأكسد من خلال فوسفات البنتوز ومسارات التمثيل الغذائي البديلة الأخرى.
لقد ثبت أن عمليات تخليق الدهون في السمنة تتعزز بشكل كبير من خلال زيادة نشاط ليس تحلل السكر، ولكن دورة فوسفات البنتوز [Shonka G., Ermolenko R.I., 1960]. يعتبر الإفراط في التغذية، وخاصة الإفراط في تناول الكربوهيدرات من الطعام، أحد العوامل الخطيرة التي تساهم في تنشيط دورة فوسفات البنتوز.
حتى وقت قريب، تمت دراسة نسبة الإنزيمات في الأنسجة الدهنية فقط في التجارب على الحيوانات [Leites S. M., Davtyan N. K., 1965; Pokrovsky A. A.، Pilenitsyna R. A.، 1966؛ كوغب، 1955، 1959؛ كورن وآخرون، 1957]. أظهرت العديد من الدراسات الدور الهام للليباز (هيدرولاز استرات الجلسرين والأحماض الدهنية؛ EC 3.1.1.3) في عمليات التمثيل الغذائي في الأنسجة الدهنية.
هناك عدة أنواع من الليباز، ويتم تنظيم نشاطها من خلال عوامل مختلفة: الليباز الذي ينشطه الأدرينالين؛ الليباز يعمل في الأنسجة غير المحفزة. الليباز البروتين الدهني الذي يزداد نشاطه عند تحضينه بالهيبارين. يعمل الليباز المعبأ للدهون على تحلل الدهون الثلاثية، ويضمن دخول NEFA إلى الدم مع استخدامها لاحقًا كمواد طاقة. يتم تنشيط الليباز الدهني في الأنسجة الدهنية، بالإضافة إلى الأدرينالين، بواسطة النورإبينفرين والهرمون الجسدي والهرمون الموجه لقشر الكظر (ACTH). يحتوي ليباز البروتين الدهني على تأثيرات تحلل الدهون وتخليق الدهون على الدهون الثلاثية في الأنسجة الدهنية. بالإضافة إلى الهيبارين، يتم زيادة نشاط الليباز البروتين الدهني بإضافة الأنسولين والجلوكوز إلى وسط الحضانة. يقوم الليباز البروتين الدهني الموجود في الأنسجة الدهنية بإعداد البروتينات الدهنية في الدم لاستيعاب وتخليق الدهون الثلاثية.
في الشخص الذي يتمتع بعملية استقلاب طبيعية ولا يعاني من السمنة، يكون كل من الليباز نشطًا تمامًا، إلى حد ما يوازن بين عمليات تكوين الدهون وتخليق الدهون [Davtyan N.K., 1962; لييتس إس إم دافتيان إن كيه، 1963، 1965؛ دافتيان إن كيه، بيرتمان آر إن، 1964؛ نيستل، هافيل، 1962؛ ستيرن وآخرون، 1962؛ كلوفيراكيس، 1963، 1979، الخ.].
في الحيوانات السمينة، يتم تقليل نشاط التحلل الدهني للأنسجة الدهنية. العديد من المؤلفين [Leites S.M.، 1962، 1967؛ كيكويك، باوان، 1963، 1964، وما إلى ذلك] أفاد أنه في حالة السمنة، يتم تفسير تأثير تحلل الدهون للأنظمة الغذائية المختارة خصيصًا، بما في ذلك الأنظمة الغذائية منخفضة الطاقة التي تحتوي على نسبة عالية من الدهون، من خلال تنشيط الإنزيمات المحللة للدهون.
أصبح هذا شرطًا أساسيًا لتحديد نشاط الليباز في الأنسجة الدهنية تحت الجلد لدى المرضى الذين يعانون من السمنة المفرطة في معهد التغذية التابع لأكاديمية العلوم الطبية في اتحاد الجمهوريات الاشتراكية السوفياتية [Pokrovsky A. A., Oleneva V. A., Pilenitsina R. A., 1964]. أظهرت الملاحظات أن جميع الأشخاص الذين يعانون من السمنة المفرطة لديهم انخفاض حاد في نشاط كلا الليباز. يتم تقليل نشاط الليباز المعبأ للدهون لدى المرضى الذين يعانون من السمنة المفرطة بنسبة 5 مرات، والليباز البروتين الدهني بنسبة 2.6 مرة. تم الحفاظ على نفس النسب عند استخدام المنشطات - الأدرينالين والهيبارين.
سمح لنا الانخفاض المتزامن في نشاط إنزيمين لهما عمل معاكس بطرح فرضية حول القصور الذاتي الأيضي العميق للأنسجة الدهنية لدى المرضى الذين يعانون من السمنة المفرطة. ومع ذلك، مع انخفاض نشاط الإنزيم بشكل عام، ينخفض نشاط الإنزيم المسؤول عن تحلل الدهون بشكل خاص.
تُظهر نسبة البروتين الدهني والليباز المعبأ للدهون في الأنسجة الدهنية تحت الجلد بشكل واضح غلبة تخليق الدهون على تحلل الدهون لدى المرضى الذين يعانون من السمنة المفرطة والذين يعانون من الجمود الأيضي العام للأنسجة الدهنية. لقد تبين أن التحول في نشاط الإنزيم نحو تخليق الدهون يمكن رؤيته بوضوح عند التحفيز باستخدام المنشطات الفسيولوجية. وفي ظل هذه الظروف، تجاوزت نسبة نشاط البروتين الدهني والليباز المعبأ للدهون في الأنسجة الدهنية لدى الأشخاص الذين يعانون من السمنة المفرطة الرقم المقابل في الأشخاص الأصحاء بأكثر من عامل. من الضروري ليس فقط تقييم هذه الظاهرة من وجهة نظر الحد من عمليات الأكسدة البيولوجية، وتعطيل التوازن الديناميكي بين تعبئة NEFA بواسطة الأنسجة الدهنية أثناء السمنة وعدم كفاية استخدامها لأغراض الطاقة من قبل الأنسجة الأخرى في الجسم. الجسم، ولكن أيضًا يفترض نوعًا من منع الإزالة الدائمة لـ NEFA من مستودعات الدهون، والتي ترتبط ارتباطًا مباشرًا بتثبيط تحلل الدهون بسبب انخفاض نشاط الإنزيم.
في السنوات الأخيرة، زاد الاهتمام بإنزيم آخر للأنسجة الدهنية، وهو إنزيم هيدروجيناز الجلوكوز 6 فوسفات (G-6-PDH). هذا الإنزيم هو المفتاح في دورة فوسفات البنتوز، وفي الأنسجة الدهنية، يعمل مسار البنتوز لتحويل الجلوكوز 6 فوسفات بشكل مكثف للغاية. يتأكسد الجلوكوز 6 فوسفات بواسطة نازع الهيدروجين إلى 6 فوسفوجلوكونات، والذي يتأكسد بعد ذلك بواسطة نازعة هيدروجين أخرى. تظل الأنسجة الدهنية أغنى مصدر لإنزيمات الهيدروجين التي تعمل على إزالة الهيدروجين من الأحماض الدهنية العالية. في هذا الصدد، يكون نشاط الأنسجة الدهنية أعلى بمقدار 2-3 مرات من نشاط الكبد والعضلات والكلى - 30 مرة [Leites S. M., 1948, 1954]. يشير النشاط العالي لمسار البنتوز G-6-FDG مرة أخرى إلى القدرة الكبيرة للأنسجة الدهنية على توليد NADPH2، وهو أمر ضروري للتخليق الحيوي للأحماض الدهنية. ويزداد نشاط G-6-FDG مع التسمين المكثف للحيوانات الطبيعية، وكذلك عند تغذية الفئران بأطعمة غنية بالكربوهيدرات. يبدو أن كلا الأمرين يمكن تفسيرهما من خلال زيادة تكوين الدهون في ظل الظروف التجريبية.
تم تحديد نشاط G-6-FDG في الأنسجة الدهنية في مقطع مجهري من الأنسجة الدهنية تحت الجلد التي تم الحصول عليها عن طريق الاستئصال من جدار البطن الأمامي [Mokina M.N.، 1971]. تم استخدام الطريقة الطيفية لكورنبرج وهوريكر التي تم تعديلها بواسطة يو. زاخارين (1967). يتم التعبير عن النشاط بالميكرومولات من NADP المخفضة في دقيقة واحدة لكل 1 جرام من البروتين المذاب. تم تحديد البروتين في الأنسجة الدهنية بطريقة لوري (1967). ضمت المجموعة الضابطة 23 شخصًا (13 رجلاً تتراوح أعمارهم بين 18-54 عامًا و10 نساء تتراوح أعمارهم بين 16-50 عامًا) يتمتعون بوزن طبيعي. في المجموعة الضابطة، تم الحصول على عينة خزعة أثناء عملية جراحية لالتهاب الزائدة الدودية.
كان متوسط قيم نشاط G-6-FDG لدى الأشخاص ذوي الوزن الطبيعي 20.42+3.28 ميكرومتر/(دقيقة · جرام) من البروتين.
في دراساتنا، في السمنة، انخفض نشاط G-6-FDG بشكل ملحوظ مقارنة بالمعدل الطبيعي بمقدار 3.7 مرة. ولم تؤثر شدة السمنة على نشاط الإنزيم.
تم العثور على أدنى نشاط للإنزيم لدى الأشخاص الذين يعانون من السمنة المفرطة لفترة طويلة. وبالتالي، إذا نشأت السمنة منذ الطفولة أو استمرت 15-20 سنة، فإن نشاط G-6-FDG كان في حدود 4.46±0.76-4.92±1.45 وحدة، وإذا كان المرض لا يزيد عن 3- لمدة 5 سنوات كان 12.69 ± 1.75 وحدة. وفي مرضى المجموعة الأخيرة، الذين وصلوا مؤخرًا إلى درجات مختلفة من السمنة، كان نشاط الإنزيم أعلى بنحو 3 مرات.
ونتيجة لذلك، في المرضى الذين يعانون من السمنة المفرطة، إلى جانب النشاط المنخفض للإنزيمات المحللة للدهون في الأنسجة الدهنية، فإن نشاط هيدروجيناز الجلوكوز 6 فوسفات، أحد الإنزيمات التي توفر الكمية اللازمة من NADP للتخليق الحيوي للأحماض الدهنية، وهو الإنزيم الرئيسي للدهون. يتم تقليل دورة البنتوز بشكل ملحوظ. ونتيجة لذلك، يتم تثبيط عملية التمثيل الغذائي للدهون إلى حد ما. تؤكد البيانات المقدمة مرة أخرى الفرضية المتعلقة بالقصور الذاتي الغريب للعمليات الأيضية وتثبيط التفاعلات الأنزيمية لدى المرضى الذين يعانون من السمنة المفرطة.
40. عمل استريز الكولسترول ينتج:
حمض دهني. الجلسرين. الكولسترول. الكوليسترول والأحماض الدهنية
41. البروتينات الدهنية "المضادة للتصلب" تشمل:
الكيلومكرونات. البروتينات الدهنية عالية الكثافة . البروتينات الدهنية منخفضة الكثافة. بنية خيطية.
42. تتغير التغيرات في محتوى البروتينات الدهنية في الدم لدى الأطفال مع تقدم العمر على النحو التالي:
يزيد محتوى VLDL. ينخفض محتوى HDL.
43. تشمل السمات المرتبطة بالعمر لمستويات الدهون في الدم لدى الأطفال ما يلي:
يتم تقليل محتوى الدهون الكلية. تقليل محتوى العلامة.انخفاض محتوى الأحماض الدهنية الحرة. زيادة محتوى الأحماض الدهنية الحرة.
44. تشمل خصائص امتصاص الدهون لدى الأطفال ما يلي:
كيف هم عند الرضع؟
يبدأ هضم الدهون في المعدة.زيادة نشاط الليباز البنكرياسي. يتم تقليل نشاط الليباز البنكرياس. الأحماض الصفراوية لا تلعب دورا حاسما.
45. الدور الرئيسي للأنسجة الدهنية البنية عند الرضع هو:
إنه احتياطي للدهون. يشارك في التنظيم الحراري للجسم. يلعب دورا هاما في الحماية الميكانيكية.
46. مميزات الاستفادة من الأجسام الكيتونية عند الأطفال هي كما يلي:
الأكسدة أبطأ.أكسدة أسرع. لا فرق.
المهام الظرفية
1. تم تشخيص إصابة الطفل بالتهاب البنكرياس المزمن. تتعطل العمليات الهضمية وعسر الهضم المتكرر.
كيف يتم تفسير اضطرابات الجهاز الهضمي في هذا المرض؟ ما هي الاستعدادات الانزيمية المشار إليها؟
2. تم إدخال طفل ذو وزن منخفض غير مناسب لعمره إلى العيادة. كشف الفحص عن خلل الحركة الصفراوية واضطرابات إفراز الصفراء.
هل يمكن تفسير فقدان وزن الجسم بانخفاض كمية الصفراء، حيث يمكن تصنيع الدهون في الجسم من الجلوكوز؟ كيفية استعادة حالة استقلاب الدهون بشكل صحيح؟
3. بعد مرض طويل فقد الطفل الكثير من الوزن. ما هي الفيتامينات التي يجب وصفها لتسريع تخليق الدهون في الجسم؟ ما هو التبادل الذي يحتاج إلى تفعيل إضافي؟
4. يعاني طفل يبلغ من العمر 6 سنوات من التعب السريع وعدم القدرة على أداء العمل البدني. كشفت دراسة خزعة العضلات عن زيادة إدراج ثلاثي الجلسريد وانخفاض تركيز الكارنيتين. اشرح الاضطرابات البيوكيميائية التي تؤدي إلى انخفاض قوة العضلات.
6. يعاني الطفل الصغير من خلل في وظائف الرئتين والدماغ والعضلات. تفتقر خزعة الكبد والخلايا الليفية الجلدية إلى كربوكسيلاز أسيتيل CoA.
ما هو المسار الأيضي الذي تعطل؟ ما هي الأسباب المحتملة لخلل في الأنسجة المختلفة؟
7. شاب يبلغ من العمر 20 عامًا يبلغ إجمالي تركيز الكوليسترول في الدم 15 مليمول / لتر، ومحتوى LDL أعلى مرتين. وتبين خلال المحادثات مع المريض أن والده توفي عن عمر يناهز 45 عامًا بسبب احتشاء عضلة القلب. اقترح سبب ارتفاع الكولسترول في الدم لدى هذا المريض. ما هي التوصيات التي يمكن تقديمها له؟
8. بعد سباق 10 كم يزداد محتوى أجسام الكيتون في دم الرياضي. اشرح سبب هذه الظاهرة.
التمثيل الغذائي للدهون
الاختبارات
1. يقوم الكولسترول بوظائف بيولوجية في جسم الإنسان والحيوان:
يشارك في بناء أغشية الخلايا.مصدر للطاقة. الركيزة الأولية في التخليق الحيوي للأحماض الصفراوية الركيزة الأولية في التخليق الحيوي للهرمونات الستيرويدية.
2. مكونات السفينغوميلين هي:
الجلسرين. سفينجوزين. قليل السكاريد. السكريات الأحادية. حمض دهني . حمض الفوسفوريك.
2. يتم نقل الكوليسترول من الأنسجة المحيطية إلى الكبد كجزء من البروتينات الدهنية في الدم:
الكيلومكرونات. LDL. فلدل. HDL.
4. تشمل الإيكوسانويدات مشتقات حمض الأراكيدونيك:
البروستاجلاندين . الكاتيكولامينات. الليكوترينات .
5. الإنزيم الرئيسي لتحلل الدهون هو
تاج الليباز.داغ الليباز. ماج الليباز.
6. ركائز البداية في عملية تكوين الأجسام الكيتونية هي:
البيروفات. أسيتيل مرافق الإنزيم أ، بيتا هيدروكسي، بيتا ميثيل جلوتاريل مرافق الإنزيم أ. اللاكتات. فوسفوجلسرين.
7. المنتجات الوسيطة لتخليق الكوليسترول هي المواد التالية:.
حمض الميفالونيك، بيتا هيدروكسي، بيتا ميثيل جلوتاريل-CoA.حمض بيتا هيدروكسي بيوتيريك. كارنيتين. حمض الأراكيدونيك.
8. يتم تنشيط إنزيم تحلل الدهون TAG lipase بواسطة الهرمونات:
الأنسولين. الجلوكاجون. هرمون الغدة الدرقية. الأدرينالين. الألدوستيرون.
9. الحد الأقصى لمحتوى الكوليسترول في دم الشخص السليم البالغ يتوافق عادةً مع القيمة التالية:
5.2 مليمول/لتر . 8.2 مليمول/لتر. 2.0 مليمول/لتر. 10.0 مليمول/لتر.
10. المواد اللازمة لتخليق الشحميات السفنغولية السكرية:
مشتقات UDP من السكريات الأحادية.حمض الفسفوريك. الأحماض الدهنية. الجلسرين.
11. المنتجات الوسيطة لأكسدة بيتا للأحماض الدهنية هي المواد التالية:
حمض الميفالونيك. بيتا هيدروكسي أسيل-CoA. بيتا هيدروكسي، بيتا ميثيل جلوتاريل CoA. إنويل-CoA.
12. الإنزيم الرئيسي لتخليق الكوليسترول هو:
أسيتيل-CoA أسيتيل ترانسفيراز. بيتا هيدروكسي، بيتا ميثيل غلوتاريل-CoA سينثيتيز (HMG-CoA Synthetase). بيتا هيدروكسي، بيتا ميثيل جلوتاريل CoA اختزال (HMG-CoA اختزال).
13. تحتوي الجليسروفوسفوليبيدات على مواد:
الجلسرين.سفينجوزين. أحماض دهنية غير مشبعة. حمض الفوسفوريك . اينوزيتول. الكولين.
14. المواد ذات الطبيعة الستيرويدية هي:
سيريبروزيد. استرات الكولسترول. هرمونات قشرة الغدة الكظرية. فيتامين د. جانجليوسيدات. الكولسترول. الليسيثين.
15. مكونات الجانجليوسيدات الموجودة في المادة الرمادية للدماغ هي:
الجلسرين. السفينجوزين. حمض الفسفوريك.
16. يتم نقل الكولسترول في الدم إلى الأنسجة المختلفة كجزء من البروتينات الدهنية:
الكيلومكرونات. فلدل. LDL. HDL.
17. تشمل الأجسام الكيتونية المركبات التالية:
حمض الأسيتو أسيتيك . حمض الأكسالوسيتيك. حمض السكسينيك. حمض بيتا هيدروكسي بيوتيريك. حمض البيروفيك.
177. تكوين الدهون ينشط الهرمون :
الأنسولين.السوماتوتروبين. الكاتيكولامينات. الجلوكاجون. هرمون الغدة الدرقية.
18. إن إنزيم الفسفوليباز A2 - أحد الإنزيمات الرئيسية في تكوين الإيكوسانويدات النشطة بيولوجيًا، ويشارك في انقسام الروابط في جزيئات الجليسروفوسفوليبيد:
بين الجلسرين والحمض الدهني في موضع ألفا. بين الجلسرين والحمض الدهني في موضع بيتا. بين الجلسرين وحمض الفوسفوريك. بين حمض الفوسفوريك والكولين.
19. قيمة معامل تصلب الشرايين (الكوليسترول الكلي - كوليسترول HDL) / الكولسترول HDL) في شخص بالغ يساوي عادة:
1,0-2,0. 3,0-3,5. 2,0-3,0. 4,0-4,5. 1,3-2,5. 4,5-5,5
20. الكورتيكوستيرويدات هي مثبطات لإنزيم تخليق الإيكوسانويد:
فسفوليباز أ2.ليبوكسيجيناز. انزيمات الأكسدة الحلقية.
21. الأسبرين له تأثير مضاد للالتهابات، وهو مثبط للإنزيم المشارك في تخليق الإيكوسانويدات:
فسفوليباز أ2. انزيمات الأكسدة الحلقية. إنزيمات الأكسجين الشحمية. أكاسيداز السيتوكروم.
22. تشمل الشحميات السفينغولية ما يلي:
داء العقدية. الداء الدماغي. تصلب الشرايين. داء النخاعين
10. يتم استخدام أجسام الأسيتون بشكل فعال كمصادر للطاقة أثناء الصيام طويل الأمد:
مخ. العضلات الهيكلية. عضلة القلب . النسيج الضام
11. NADPH 2 لتركيب الكوليسترول والأحماض الدهنية:
دورة حمض ثلاثي الكربوكسيل. سبيل فسفات البنتوز . β- أكسدة الأحماض الدهنية.
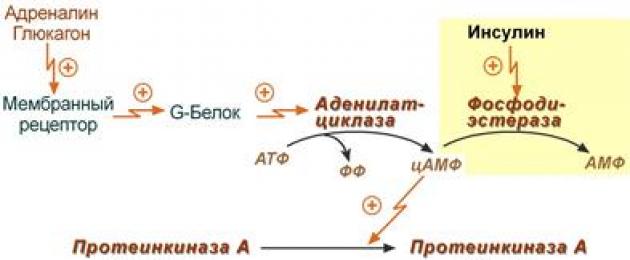
أول ما يحدث عند استخدام الدهون المحايدة أثناء الصيام وممارسة الرياضة هو تنشيط الإنزيمات المسؤولة عن انقسام الأحماض الدهنية من ثلاثي الجلسرين. يسمى الإنزيم الأول المنشط ثلاثي الجلسرين الليبازأو علامة الليباز.
يوجد حاليًا مفهوم حديث ومختلف لتنظيم الإنزيمات المسؤولة عن تعبئة ثلاثي الجلسرين في الخلايا. وفقا لهذه النظرية، حساسة للهرمونات في الواقع الليباز HSL (الليباز الحساس للهرمونات، هنا DAG الليباز)، وليس TAG الليباز.
توضح هذه الصفحة المخطط الذي لا يزال مقبولاً، ولكنه قديم، لتنظيم تحلل الدهون.
بالإضافة إلى TAG الليباز، تحتوي أيضًا على الخلايا الشحمية دياسيل جلسرين ليباز(داج الليباز) و الليباز أحادي الجلسرين(MAG lipase)، والتي تكون نشطة باستمرار، ولكن في حالة الراحة لا يظهر نشاطها بسبب عدم وجود الركيزة. بمجرد ظهور ثنائي أسيل الجلسرين في الخلية بعد عمل الليباز TAG، يبدأ الليباز DAG النشط باستمرار في العمل؛ وتترك الأحماض الدهنية والجلسرين الناتجة الخلية.
التحلل المائي للثلاثي الجلسرين بواسطة الليباز في الخلايا الدهنية
لتنظيم نشاط TAG Lipase، يلزم وجود تأثير هرموني (الأدرينالين، الجلوكاجون، السوماتوتروبين، الأنسولين وعدد من الهرمونات الأخرى).
تفعيل الليباز ثلاثي الجلسرين
يحدث تنشيط تحلل الدهون المعتمد على الهرمونات في الخلايا الشحمية بواسطة الأدرينالين والجلوكاجون عندما يكون الجسم متوترًا ( مجاعة، طويل عمل العضلات, تبريد). يعتمد نشاط TAG lipase بشكل أساسي على النسبة الأنسولين / الجلوكاجون.
بشكل عام، تسلسل أحداث تنشيط تحلل الدهون وفقًا للمخطط الكلاسيكي، ولكن القديم، هو كما يلي:
- مركب هرمون(الأدرينالين، الجلوكاجون، ACTH) يتفاعل مع مستقبله.
- يعمل مجمع مستقبلات الهرمونات النشط على الغشاء بروتين جي.
- بروتين G ينشط الانزيم محلقة الأدينيلات.
- يقوم محلقة الأدينيلات بتحويل ATP إلى أمبير دوري(cAMP) – رسول ثانوي (رسول).
- يقوم cAMP بتنشيط الإنزيم بشكل خافت بروتين كيناز أ.
- بروتين كيناز أ فسفوريلات تاج الليبازوينشطه.
- تاج الليباز ينفصلمن الأحماض الدهنية ثلاثية الجلسرين في الموضع 1 أو 3 لتكوينها ثنائي الجلسرين(داج).

آلية تتالي لتفعيل TAG الليباز
بالإضافة إلى الهرمونات التي تؤثر على نشاط محلقة الأدينيلات من خلال بروتينات G، هناك آليات تنشيط أخرى. على سبيل المثال، هرمون النمويزيد من كمية محلقة الأدينيلات ، الجلايكورتيكويداتتعزيز تخليق TAG الليباز.
حساب توازن الطاقة للأكسدة β:عند حساب كمية ATP المتكونة أثناء أكسدة الأحماض الدهنية، من الضروري مراعاة ما يلي:
* يتم تحديد كمية الأسيتيل SCoA المتكونة من خلال التقسيم المعتاد لعدد ذرات الكربون في الحمض الدهني على 2؛
* عدد دورات الأكسدة β. من السهل تحديد عدد دورات الأكسدة، بناءً على مفهوم الأحماض الدهنية كسلسلة من وحدات ثنائية الكربون. عدد الفواصل بين الوحدات يتوافق مع عدد دورات الأكسدة. ويمكن حساب نفس القيمة باستخدام الصيغة (n/2 -1)، حيث n هو عدد ذرات الكربون في الحمض،
* عدد الروابط الثنائية في الحمض الدهني . في تفاعل الأكسدة بيتا الأول، يتم تشكيل رابطة مزدوجة بمشاركة FAD. إذا كانت الرابطة المزدوجة موجودة بالفعل في الحمض الدهني، فلن تكون هناك حاجة لهذا التفاعل ولن يتشكل FADH2. يتوافق عدد FADN2 غير المشكل مع عدد الروابط المزدوجة. وتستمر التفاعلات المتبقية من الدورة دون أي تغييرات؛
*كمية طاقة ATP المستهلكة في التنشيط (تتوافق دائمًا مع رابطتين عاليتي الطاقة).
أكسدة الأحماض الدهنية بعدد فردي من ذرات الكربون. تدخل الدهون التي تحتوي على عدد فردي من الكربونات إلى الجسم مع الأطعمة النباتية والمأكولات البحرية. تحدث أكسدتها على طول المسار المعتاد حتى التفاعل الأخير، حيث يتم تشكيل بروبيونيل-SCoA. يتلخص جوهر تحولات البروبيونيل-SCoA في عملية الكربوكسيل والأيزومرة وتكوين السكسينيل-SCoA. ويشارك البيوتين وB12 في هذه التفاعلات.
أكسدة الأحماض الدهنية غير المشبعة.عندما تتأكسد الأحماض الدهنية غير المشبعة، تحتاج الخلية إلى إنزيمات إيزوميراز إضافية. تعمل هذه الأيزوميرات على تحريك الروابط المزدوجة في بقايا الأحماض الدهنية من الموضع γ- إلى الموضع وتحويل الروابط المزدوجة الطبيعية من cis- إلى transposition. وبالتالي، يتم تحضير الرابطة المزدوجة الموجودة بالفعل لأكسدة β ويتم تخطي التفاعل الأول للدورة، الذي يشارك فيه FAD.
الجلسرين- كحول ثلاثي الهيدريك قابل للذوبان في الماء ويمتص بسهولة من الأمعاء ويدخل الكبد عن طريق الوريد البابي. أكسدة الجلسرين
يتم أولاً فسفرة الجلسرين بواسطة ATP إلى جلسرين فوسفات (3-فوسفوجليسرول). بعد ذلك، تحت تأثير هيدروجيناز الجلسرين فوسفات المعتمد على NAD، يتم أكسدته إلى 3-فوسفوجليسرالديهيد. يمكن أكسدة الفوسفوجليسرالديهيد إلى حمض البيروفيك وحمض اللاكتيك.
العلاقة بين الأكسدة β و CC و DC: وهكذا، يتم تقسيم جزيء الأحماض الدهنية في النهاية إلى منتجات تحتوي على ذرتي كربون فقط، والتي يتم تحويلها إلى دورة حمض ثلاثي الكربوكسيل. يتم بعد ذلك إعادة أكسدة الإنزيمات المساعدة المخفضة في السلسلة التنفسية مع التكوين المتزامن للفوسفات عالي الطاقة. من وجهة نظر تكوين ATP، تشكل أكسدة الأحماض الدهنية احتياطي الطاقة الرئيسي للجسم.
تنظيم الأكسدة β:الإنزيم الرئيسي هو كارنيتين أسيل ترانسفيراز 1، وهو إنزيم تفارغي في الكبد، ومثبطه التفارغي هو malonylCoA. تنشيط: الكاتيكولامينات، هرمون النمو، الجلوكاجون. المانع: الأنسولين.
قيمة E - الأكسدة للعضلات الهيكلية (50٪ E)، لعضلة القلب (70٪)، والدماغ والأنسجة العصبية الأخرى، وكذلك خلايا الدم الحمراء لا تستخدم الأحماض الدهنية للأكسدة؛ فهي لا تدخل الدماغ، لأنها لا تمر عبر حاجز الدم في الدماغ.
23. تحلل الدهون وتولد الدهون. معنى. اعتماد تكوين الدهون على إيقاع التغذية وتكوين الغذاء. تنظيم تحلل الدهون وتولد الدهون. نقل واستخدام الأحماض الدهنية المتكونة أثناء تعبئة الدهون.
يتم تصنيع ثلاثي الجلسرين أثناء تناول الطعام وبعده مباشرة (تكوين الدهون) وتخزينه في الأنسجة الدهنية، وهو شكل من أشكال تخزين الأحماض الدهنية المشبعة والأحادية غير المشبعة. يسمى انهيار ثلاثي الجلسرين (الدهون الثلاثية) بشكل مختلف تحلل الدهونأو تعبئة الدهون. يحدث في الخلايا الدهنية باستمرار وعادة ما يكون هناك توازن بين تخليق TAG وتكسيره.
حتى عندما يكون الجسم في حالة راحة، يتلقى الكبد والقلب والعضلات الهيكلية والأنسجة الأخرى (باستثناء خلايا الدم الحمراء والخلايا العصبية) أكثر من 50% من طاقتها من أكسدة الأحماض الدهنية القادمة من الأنسجة الدهنية بسبب تحلل الدهون الخلفية. مع انخفاض احتياطي الجلوكوز، تحصل الخلايا على المزيد والمزيد من الطاقة من أكسدة الأحماض الدهنية. وبالتالي، تعمل الأحماض الدهنية المشبعة كنوع من عازلة الطاقة في الجسم. يتم تنشيط تعبئة ثلاثي الجلسرين وأكسدة الأحماض الدهنية في حالات الإجهاد الفسيولوجي العادية - الإجهاد العاطفي، وعمل العضلات، والصيام، وفي ظل الظروف المرضية - داء السكري من النوع الأول، والأمراض الهرمونية الأخرى (فرط الكورتيزول، فرط نشاط الغدة الدرقية). نتيجة لتحلل الدهون، يتم تشكيل الجلسرين الحر والأحماض الدهنية في الخلايا الشحمية. يصل الجلسرين في الدم إلى الكبد والكلى، حيث تتم فسفرته وتأكسده إلى مستقلب تحلل السكر ثنائي هيدروكسي أسيتون فوسفات. اعتمادًا على الظروف، يمكن أن يشارك DAP في تفاعلات تكوين السكر (أثناء الصيام، تمرين العضلات) أو يتأكسد في تحلل السكر إلى حمض البيروفيك. حمض دهني نقلفي الدم بالاشتراك مع ألبومين البلازما:
أثناء النشاط البدني - في العضلات،
في الظروف الطبيعية وأثناء الصيام - إلى العضلات ومعظم الأنسجة، يتم التقاط حوالي 30٪ من الأحماض الدهنية عن طريق الكبد.
أثناء الصيام وممارسة الرياضة، بعد دخول الخلايا، تدخل الأحماض الدهنية إلى مسار الأكسدة.
بشكل عام، يمكن تمثيل عملية تعبئة الدهون كسلسلة من الأحداث التالية:
1. تحلل الدهون هو تحلل TAG المعتمد على الهرمونات في الأنسجة الدهنية أو TAG الاحتياطي في الخلية نفسها.
2. نقل الأحماض الدهنية من الأنسجة الدهنية عبر الدم مع الزلال.
3. اختراق الأحماض الدهنية إلى العصارة الخلوية للخلية المستهدفة.
4. تفعيل الأحماض الدهنية من خلال إضافة HS-CoA.
5. حركة الأحماض الدهنية المعتمدة على الكارنيتين إلى الميتوكوندريا.
6. أكسدة الأحماض الدهنية بتكوين مجموعات الأسيتيل (على شكل أسيتيل-S-CoA).
7. احتراق الأسيتيل-S-CoA في دورة حمض الستريك أو تخليق أجسام الكيتون (فقط في الكبد).
يمكن استخدام المصادر المجانية فقط كمصدر للطاقة، أي. الأحماض الدهنية غير الأسترة. لذلك، يتم أولاً تحلل الدهون الثلاثية بواسطة إنزيمات أنسجة معينة - الليباز - إلى الجلسرين والأحماض الدهنية الحرة. يمكن لآخر مستودعات الدهون أن تنتقل إلى بلازما الدم (تعبئة الأحماض الدهنية العالية)، وبعد ذلك تستخدمها أنسجة وأعضاء الجسم كمواد طاقة. تحتوي الأنسجة الدهنية على العديد من الليباز، وأهمها الليباز ثلاثي الجليسريد (ما يسمى الليباز الحساس للهرمونات)، وليباز ثنائي الجليسريد، وليباز أحادي الجليسريد. نشاط الإنزيمين الأخيرين أعلى بـ 10-100 مرة من نشاط الأول. يتم تنشيط الليباز ثلاثي الجليسريد بواسطة عدد من الهرمونات (على سبيل المثال، الأدرينالين والنورإبينفرين والجلوكاجون، وما إلى ذلك)، في حين أن الليباز ثنائي الجليسريد والليباز أحادي الجليسريد ليسا حساسين لعملهما. الليباز ثلاثي الجليسريد هو إنزيم تنظيمي. أول ما يحدث عند استخدام الدهون المحايدة أثناء الصيام وممارسة الرياضة هو تنشيط الإنزيم المسؤول عن انقسام الحمض الدهني الأول من ثلاثي الجلسرين. يُسمى هذا الإنزيم ليباز ثلاثي الجلسرين الحساس للهرمونات أو ليباز TAG. بالإضافة إلى الليباز TAG، تحتوي الخلايا الشحمية أيضًا على ليباز ثنائي الجلسرين (DAG lipase) وليباز أحادي الجلسرين (MAG lipase)، والذي يكون نشاطه مرتفعًا وثابتًا، لكن هذا النشاط لا يظهر في حالة الراحة بسبب نقص الركيزة. بمجرد ظهور ثنائي الجلسرين في الخلية بعد عمل الليباز TAG، يبدأ الليباز DAG النشط باستمرار في العمل، وناتج تفاعله، أحادي الجلسرين (MAG)، هو ركيزة للليباز MAG. وتترك الأحماض الدهنية والجلسرين الناتجة الخلية. لتنظيم نشاط TAG Lipase، يلزم وجود تأثير هرموني (الأدرينالين، الجلوكاجون، السوماتوتروبين، الأنسولين، إلخ).
بشكل عام، تسلسل الأحداث لتنشيط تحلل الدهون هو كما يلي:
1. يتفاعل جزيء هرمون (الأدرينالين، الجلوكاجون، ACTH) مع مستقبله.
2. يعمل مجمع مستقبلات الهرمونات النشط على بروتين G الغشائي.
3. بروتين G ينشط إنزيم أدينيلات سيكلاز.
4. يقوم Adenylate cyclase بتحويل ATP إلى cAMP - وهو رسول ثانوي (رسول).
5. يقوم cAMP بتنشيط إنزيم بروتين كيناز أ.
6. بروتين كيناز A يفسفر الليباز TAG وينشطه.
7. يشق الليباز TAG الأحماض الدهنية في الموضع 1 أو 3 من ثلاثي الجلسرين لتكوين ثنائي الجلسرين (DAG). يقوم ليباز الدهون الثلاثية النشط بتكسير الدهون الثلاثية إلى ثنائي الجليسريد والأحماض الدهنية. بعد ذلك، تحت تأثير الليباز ثنائي وأحادي الجليسريد، يتم تشكيل المنتجات النهائية لتحلل الدهون - الجلسرين والأحماض الدهنية الحرة التي تدخل مجرى الدم.
معدل تحلل الدهون الثلاثية ليس ثابتًا، فهو يخضع للتأثير التنظيمي لعوامل مختلفة، من بينها العوامل الهرمونية العصبية ذات أهمية خاصة.
تدخل الأحماض الدهنية الحرة المرتبطة بألبومين بلازما الدم على شكل مركب إلى الأعضاء والأنسجة عبر مجرى الدم، حيث يتفكك المركب، وتخضع الأحماض الدهنية إما للأكسدة β أو تستخدم جزئيًا لتخليق الدهون الثلاثية، والجليسيروفوسفوليبيدات، والشحميات الفوسفورية وغيرها. المركبات، وكذلك استرة الكولسترول. أثناء العمل البدني وحالات الجسم الأخرى التي تتطلب زيادة استهلاك الطاقة، يزداد استهلاك الدهون الثلاثية من الأنسجة الدهنية كاحتياطي للطاقة.
تنشيط: الكاتيكولامينات (الأدرينالين)، الجلوكاجون، هرمون الغدة الدرقية، الكورتيزول، cAMP. المانع: الأنسولين.
تكوين الدهون هو تخليق الدهون من الجلسرين والأحماض الدهنية. يحدث في الكبد والأنسجة الدهنية. يجب أن يكون الجلسرين والأحماض الدهنية في شكل نشط. لا يوجد جليسيرول كيناز في الأنسجة الدهنية، وبالتالي فإن الشكل النشط مشتق من DOAP، وهو مستقلب تحلل السكر (من الجلوكوز). يحدث تخليق الدهون خلال فترة الامتزاز (بعد الأكل). يتم دمج جزيئات الدهون في الخلايا الشحمية في قطرة كبيرة وهي شكل مضغوط لتخزين احتياطيات E. يكون التمثيل الغذائي للدهون في الأنسجة الدهنية نشطًا للغاية: فهو يتجدد بالكامل في غضون أيام قليلة. ينتج الكبد 20-50 جرامًا من الدهون يوميًا، والتي تدخل الدم كجزء من البروتين الدهني منخفض الكثافة (VLDL). الإنزيم الرئيسي: أسيل ترانسفيراز. ينشط بواسطة: الأنسولين والإستروجين وATP. تثبيط: الكاتيكولامينات، هرمون النمو، يودوثيرونين، ACTH، ADP. تخليق الدهون المحايدةيحدث بسبب استرة الجليسيرو 1 فوسفات مع اثنين من الأحماض الدهنية النشطة. يتم تقسيم مجموعة الفوسفات من حمض الفوسفاتيديك الناتج عن طريق الفوسفاتيز، مما يؤدي إلى تكوين ثنائي الجلسرين، والذي يتفاعل أيضًا مع حمض دهني منشط آخر لتكوين ثلاثي الجلسرين. تشكل الدهون الثلاثية مستودع الطاقة في الجسم. لديهم حرارة أكسدة عالية جدًا تساوي 37.6 كيلو جول / مول. تتمركز الدهون في الخلايا الدهنية (الخلايا الشحمية) وتتميز بمعدل استقلاب مرتفع. ويتم تنظيم تحولها بشكل مباشر عن طريق الهرمونات، وخاصة الأنسولين والأدرينالين. تفاعلات التخليق الحيوي للدهونيمكن أن تدخل في الشبكة الإندوبلازمية الملساء لخلايا جميع الأعضاء. الركيزة اللازمة لتخليق الدهون دي نوفو هي الجلوكوز. وكما هو معروف، عندما يدخل الجلوكوز إلى الخلية، فإنه يتحول إلى جليكوجين وبنتوسيز ويتأكسد إلى حمض البيروفيك. عندما يكون الإمداد مرتفعًا، يتم استخدام الجلوكوز لتخليق الجليكوجين، ولكن هذا الخيار محدود بحجم الخلية. لذلك، "يسقط" الجلوكوز في تحلل السكر ويتحول إلى البيروفات إما مباشرة أو من خلال تحويلة فوسفات البنتوز. في الحالة الثانية، يتم تشكيل NADPH، والتي ستكون هناك حاجة إليها لاحقا لتوليف الأحماض الدهنية. يمر البيروفات إلى الميتوكوندريا ويتم نزع الكربوكسيل منه إلى أسيتيل SCoA ويدخل في دورة TCA. ومع ذلك، أثناء الراحة، وأثناء الراحة، وفي وجود طاقة زائدة في الخلية، يتم حظر تفاعلات دورة TCA (على وجه الخصوص، تفاعل هيدروجيناز الإيزوسيترات) عن طريق زيادة ATP وNADH. ونتيجة لذلك، يتراكم المستقلب الأول لدورة TCA، وهو السيترات. على طول تدرج التركيز، ينتقل إلى العصارة الخلوية وينقسم لتكوين أسيتيل SCoA، والذي يستخدم أيضًا في التخليق الحيوي للكوليسترول والأحماض الدهنية وثلاثي الجلسرين. يتم اختزال أوكسالوسيتات، المتكون أيضًا من السيترات، إلى حمض الماليك وإعادته إلى الميتوكوندريا * عبر مكوك الأسبارتات المالات (غير موضح)، * بعد نزع الكربوكسيل من المالات إلى البيروفات بواسطة إنزيم الماليك المعتمد على NADP. سيتم استخدام NADPH الناتج في تركيب الأحماض الدهنية.
الصيام وعمل العضلات والراحة في فترة ما بعد الامتصاص.خلال فترة ما بعد الامتصاص وأثناء الصيام، لا توجد الكيلومكرونات و VLDL في الدم. وبما أن هذه الحالة عادة ما تكون مصحوبة بنقص السكر في الدم، يتم إفراز الجلوكاجون من البنكرياس لتعويضه. تحت تأثير الجلوكاجون والهرمونات الأخرى في مستودعات الدهون، يتم تنشيط تحلل TAG إلى أحماض دهنية وجلسرين (تحلل الدهون). يتم نقل الأحماض الدهنية المنطلقة إلى الدم عن طريق الألبومين. أثناء العمل البدني، تسبب هرمونات الأدرينالين والسوماتروبين والسكريات القشرية، التي تؤثر على الخلايا الشحمية، أيضًا تحلل الدهون فيها وإطلاق الأحماض الدهنية في الدم. بالاشتراك مع الألبومين، يتم توصيل هذه الأحماض بشكل أساسي إلى العضلات لضمان تقلص العضلات. في حالة الراحة، عندما تنتهي العمليات الهضمية بالفعل، أثناء الصيام قصير وطويل الأمد، أثناء النشاط البدني في معظم الخلايا، باستثناء الخلايا العصبية وكريات الدم الحمراء، يتم حرق الأحماض الدهنية في عمليات أكسدة بيتا ودورة TCA، مما يوفر 50% أو أكثر من الطاقة الكلية للخلية. في الكبد، أثناء الصيام لفترات طويلة (أكثر من 20 ساعة)، يتم إرسال الأحماض الدهنية إلى عملية تكوين الكيتون لتكوين أجسام الكيتون. يتم توزيع أجسام الكيتون بشكل أكبر في جميع أنحاء الجسم، ويتم تحويلها إلى أسيتيل-SCoA وتستخدم لتوفير الطاقة للخلايا.
24. التخليق الحيوي للأحماض الدهنية: تسلسل التفاعلات، الأهمية الفسيولوجية، التنظيم.
يحدث التخليق الحيوي للأحماض الدهنية بشكل أكثر نشاطًا في العصارة الخلوية لخلايا الكبد والأمعاء والأنسجة الدهنية أثناء الراحة أو بعد تناول الطعام.
تقليديا، يمكن التمييز بين 4 مراحل من التخليق الحيوي:
1. تشكيل الأسيتيل-SCoAمن الجلوكوز أو السكريات الأحادية الأخرى أو الأحماض الأمينية الكيتونية.
2. نقل الأسيتيل-SCoAمن الميتوكوندريا إلى العصارة الخلوية: *قد يكون معقدًا مع الكارنيتين، تمامًا كما يتم نقل الأحماض الدهنية الأعلى إلى الميتوكوندريا، ولكن هنا يحدث النقل في اتجاه مختلف، *عادةً كجزء من حمض الستريك المتكون في التفاعل الأول لـ TCA دورة.
يتم تفكيك السيترات القادمة من الميتوكوندريا في العصارة الخلوية بواسطة لياز سيترات ATP إلى أوكسالوسيتات وأسيتيل-SCoA. يتم اختزال أوكسالوسيتات أيضًا إلى مالات، ويمر هذا الأخير إما إلى الميتوكوندريا (مكوك أسبارتات المالات) أو يتم نزع كربوكسيلته إلى إنزيم مالات البيروفات (إنزيم الماليك).
3. تشكيل malonyl-SCoAمن الأسيتيل-SCoA. يتم تحفيز كربوكسيل الأسيتيل-SCoA بواسطة كربوكسيلاز الأسيتيل-SCoA، وهو مركب متعدد الإنزيمات يتكون من ثلاثة إنزيمات.
4. تخليق حمض البالمتيك.يتم تنفيذه بواسطة مركب متعدد الإنزيمات "سينثاس الأحماض الدهنية" (مرادف سينثاس بالميتات)، والذي يتضمن 6 إنزيمات وبروتين نقل الأسيل (ATP). يشتمل بروتين نقل الأسيل على مشتق حمض البانتوثنيك، 6-فوسفوبانثيين (PP)، الذي يحتوي على مجموعة HS، مثل HS-CoA. أحد إنزيمات المركب، 3-كيتواسيل سينسيز، يحتوي أيضًا على مجموعة HS في السيستين. ويحدد تفاعل هذه المجموعات بداية واستمرار التخليق الحيوي للأحماض الدهنية، وتحديدا حمض البالمتيك. تتطلب التفاعلات التوليفية NADPH. في التفاعلين الأولين، تتم إضافة malonyl-SCoA بالتتابع إلى فسفوبانتيثين بروتين نقل الأسيل وأسيتيل-SCoA إلى السيستين من سينسيز 3-كيتواسيل. 3-سينثاز كيتواسيل يحفز التفاعل الثالث - نقل مجموعة الأسيتيل إلى C2 من المالونيل مع إزالة مجموعة الكربوكسيل. بعد ذلك، يتم تحويل مجموعة الكيتو في تفاعلات الاختزال (3-كيتواسيل اختزال)، والجفاف (ديهيدراتاز) والاختزال مرة أخرى (إنويل اختزال) إلى مجموعة ميثيلين مع تكوين أسيل مشبع مرتبط بالفوسفوبانثيين. ينقل إنزيم الأسيل ترانسفيراز الأسيل الناتج إلى سيستين سينسيز 3-كيتواسيل، ويضاف المالونيل-SCoA إلى فسفوبانتيثين وتتكرر الدورة 7 مرات حتى تتشكل بقايا حمض البالمتيك. بعد ذلك، يتم فصل حمض البالمتيك بواسطة الإنزيم السادس للمركب، وهو الثيوستيراز. استطالة سلسلة الأحماض الدهنية
يدخل حمض البالمتيك المركب، إذا لزم الأمر، إلى الشبكة الإندوبلازمية أو الميتوكوندريا. هنا، بمشاركة malonyl-S-CoA وNADPH، يتم تمديد السلسلة إلى C18 أو C20. يمكن أيضًا إطالة الأحماض الدهنية غير المشبعة (الأوليك واللينوليك واللينولينيك) لتكوين مشتقات حمض الإيكوسانويك (C20). لكن الرابطة المزدوجة يتم تقديمها بواسطة الخلايا الحيوانية ليس أبعد من ذرة الكربون التاسعة، وبالتالي يتم تصنيع الأحماض الدهنية المتعددة غير المشبعة ω3 وω6 فقط من السلائف المقابلة.
يتم تصنيعه في الجسم بشكل رئيسي عن طريق حمض البالمتيك. إذا لزم الأمر، المنتجات التي تحتوي على عدد كبير من ذرات الكربون. تتشكل السوائل غير المشبعة على أغشية EPS بمشاركة O2 وNADH وB5. تحت تأثير إنزيمات desaturase، يتم تشكيل أحماض البالمتيك والأوليك. يجب توفير الأحماض الدهنية المتعددة غير المشبعة (حمض اللينوليك، وحمض الأراكيدونيك، وحمض اللينولينيك) مع الطعام. مصدر الكربوهيدرات لتخليق الأحماض الدهنية هو أسيتيل CoA، الذي يتم إنتاجه أثناء تحلل الكربوهيدرات. تتحول الكربوهيدرات الزائدة التي تدخل الجسم إلى أحماض دهنية ثم إلى دهون.
الإنزيم الذي يحد من المعدل هو أسيتيل-كواكاربوكسيلاز. المنشطات التفارغية هي ATP والسيترات، والمثبطات هي أحماض دهنية طويلة السلسلة. ينشط الأنسولين والإستروجين، وتمنع الكاتيكولامينات والإجهاد تخليق الأحماض الدهنية. الأهمية: أثناء تحلل الهيدروكربونات، يتم استخدام الأسيتيل-Coa، والذي يستخدم في تركيب FA، أي. يتم تخزين الهيدروكربونات الزائدة على شكل دهون.
25. مسارات تكوين واستخدام الأسيتيل مرافق الإنزيم أ. التخليق الحيوي وأهمية الأجسام الكيتونية. حدود التغيرات في تركيز الأجسام الكيتونية في الدم طبيعية أثناء الصيام ومرض السكري.
أسيتيل كو أهو المستقلب المركزي لاستقلاب الدهون.
المصادر: 1) الجلوكوز 2) الجلسرين 3) AA) (أثناء العمل العضلي المكثف قصير المدى) 4) الأحماض الدهنية (الأكسدة أثناء العمل العضلي لفترات طويلة، والصيام، في البرد، والحمل والسكري). تعتمد طرق استخدام الأسيتيل CoA الناتج على الحالة الوظيفية للخلية (شحنة الطاقة) وخصائصها. إذا كان هناك ما يكفي من ATP في الخلية، فسيتم استخدامه لتخليق الأحماض الدهنية، لأنه يقوم ATP بتنشيط الإنزيم الرئيسي لتخليق الدهون، وتراكمها يحفز تخليق الدهون. يتم منع تحلل الدهون ويتم أيضًا منع أكسدة β. العمل العضلي المكثف، والإجهاد، وزيادة إفراز الكاتيكولامينات ينشط تحلل الدهون، وأكسدة الأحماض الدهنية. وفي هذه الحالة يتم تنشيط تخليق أجسام الكيتون ودورة TCA.
طرق الاستخدام: 1. يتأكسد في دورة كريبس (90%)؛ 2. يستخدم في تركيب FA (9%) 3. تكوين B-hydroxy-β-methylglutaryl CoA (ومنه إما أجسام الكوليسترول أو الكيتون -1%)
في الظروف المصحوبة بانخفاض نسبة الجلوكوز في الدم، تعاني خلايا الأعضاء والأنسجة من جوع الطاقة. وبما أن أكسدة الأحماض الدهنية هي عملية "تتطلب جهدا مكثفا"، والأنسجة العصبية عموما غير قادرة على أكسدة الأحماض الدهنية، فإن الكبد يسهل استخدام هذه الأحماض من قبل الأنسجة عن طريق أكسدتها مسبقا إلى حمض الأسيتيك وتحويل الأخير إلى حمض الأسيتيك. استمارة النقل - أجسام خلونية.تشتمل أجسام الكيتون على ثلاثة مركبات ذات بنية مماثلة - أسيتواسيتات، 3-هيدروكسي بويترات وأسيتون. المحفز لتكوين الأجسام الكيتونية هو دخول كميات كبيرة من الأحماض الدهنية إلى الكبد. كما سبقت الإشارة، في ظل الظروف التي تنشط تحلل الدهون في الأنسجة الدهنية، يحتفظ الكبد بما لا يقل عن 30% من الأحماض الدهنية المتكونة. وتشمل هذه الحالات الصيام، ومرض السكري من النوع الأول، والنشاط البدني لفترات طويلة. نظرًا لأن تخليق TAG مستحيل في ظل هذه الظروف، فإن الأحماض الدهنية من العصارة الخلوية تدخل الميتوكوندريا وتتأكسد لتشكل الكيتونات. بالإضافة إلى الحالات المذكورة، تزداد كمية الأجسام الكيتونية في الدم مع التسمم بالكحول واستهلاك الأطعمة الدهنية. مع اتباع نظام غذائي غني بالدهون، خاصة عند الأطفال، لا يتوفر للأحماض الدهنية الوقت الكافي لإدراجها في TAG وVLDL ويتم نقلها جزئيًا إلى الميتوكوندريا، مما يزيد من تخليق أجسام الكيتون. في التسمم الكحولي، الركيزة لتخليق الكيتونات هي الأسيتيل-SCoA، الذي يتم تصنيعه أثناء تحييد الإيثانول. في ظل الظروف العادية، يحدث أيضًا تخليق أجسام الكيتون، وإن كان بكميات أقل بكثير. لهذا الغرض، يتم استخدام كل من الأحماض الدهنية والمخلفات الخالية من النيتروجين من الأحماض الأمينية الكيتونية والمختلطة. . تخليق الأسيتوسيتاتيحدث فقط في الميتوكوندريا الكبدية، ثم يتم اختزاله إلى 3-هيدروكسي بويترات أو نزع الكربوكسيل تلقائيًا إلى الأسيتون. بعد ذلك، تدخل المركبات الثلاثة إلى الدم ويتم توزيعها في جميع أنحاء الأنسجة. الأسيتون، باعتباره مادة متطايرة، تتم إزالته بسهولة عن طريق هواء الزفير والعرق. يمكن أن تفرز جميع أجسام الكيتون في البول. يتم استخدام أجسام الكيتون بواسطة خلايا جميع الأنسجة باستثناء الكبد وخلايا الدم الحمراء. يتم استهلاكها بشكل خاص، وحتى بشكل طبيعي، من قبل عضلة القلب وقشرة الغدة الكظرية. تتزامن تفاعلات الاستفادة من أجسام الكيتون تقريبًا مع الاتجاه العكسي لتفاعلات التخليق. في العصارة الخلوية، يتأكسد 3-هيدروكسي بويترات، ويدخل الأسيتو أسيتات الناتج إلى الميتوكوندريا، ويتم تنشيطه بواسطة succinyl-SCoA ويتم تحويله إلى أسيتيل-SCoA، الذي يتم حرقه في دورة TCA.
تنظيم تخليق الجسم الكيتوني. الإنزيم المنظم لتخليق أجسام الكيتون هو سينسيز HMG-CoA.
* سينسيز HMG-CoA هو إنزيم محفز؛ ويزداد تركيبه مع زيادة تركيزات الأحماض الدهنية في الدم. يزداد تركيز الأحماض الدهنية في الدم عندما يتم تعبئة الدهون من الأنسجة الدهنية تحت تأثير الجلوكاجون والأدرينالين، أي. أثناء الصيام أو العمل البدني.
*يتم تثبيط إنزيم HMG-CoA بواسطة تركيزات عالية من الإنزيم المساعد الحر A.
*عندما يزداد إمداد خلايا الكبد بالأحماض الدهنية، يرتبط CoA بها، وينخفض تركيز CoA الحر، ويصبح الإنزيم نشطًا.
*إذا انخفض إمداد خلايا الكبد بالأحماض الدهنية، فإن تركيز CoA الحر، الذي يثبط الإنزيم، يزداد وفقًا لذلك. وبالتالي، فإن معدل تخليق الأجسام الكيتونية في الكبد يعتمد على كمية الأحماض الدهنية.
تتشكل أجسام الكيتون في الكبد وتقوم بما يلي: سمات: 1. طاقة.توفر العضلات الهيكلية والقلبية والدماغ والأنسجة الأخرى خارج الكبد احتياجات الطاقة من خلال تقويض أجسام الكيتون. لا يستطيع الكبد أكسدة الأجسام الكيتونية. 2. ضروري لتكوين أغلفة المايلين للأعصاب والمادة البيضاء للدماغ.
يحدث استخدام أجسام الكيتون في الميتوكوندريا. يتم تحويل بيتا هيدروكسي بوتيرات إلى أسيتو أسيتات، ويتفاعل الأسيتو أسيتات مع دورة TCA الوسيطة السكسينيل- CoA. مع الصيام لفترات طويلة، تصبح أجسام الكيتون المصدر الرئيسي للطاقة للعضلات الهيكلية والقلب والكلى. وبهذه الطريقة، يتم تخزين الجلوكوز للأكسدة في الدماغ وخلايا الدم الحمراء. بالفعل بعد 2-3 أيام من بدء الصيام، يكون تركيز أجسام الكيتون في الدم كافيا لتمريرها إلى خلايا الدماغ وتتأكسد، مما يقلل من حاجتها إلى الجلوكوز. يتم نزع هيدروجين β-Hydroxybutyrate (الشكل 8-34)، الذي يدخل الخلايا، بواسطة هيدروجيناز المعتمد على NAD وتحويله إلى أسيتو أسيتات. يتم تنشيط Acetoacetate من خلال التفاعل مع succinyl-CoA، الجهة المانحة لـ CoA: Acetoacetate + Succinyl-CoA → Acetoacetyl-CoA + Succinate
يتم تحفيز التفاعل بواسطة ترانسفيراز succinyl-CoA-aceto-acetate-CoA. ولا يتم تصنيع هذا الإنزيم في الكبد، لذلك لا يستخدم الكبد الأجسام الكيتونية كمصادر للطاقة، بل ينتجها “للتصدير”. تعتبر أجسام الكيتون جزيئات وقود جيدة؛ توفر أكسدة جزيء واحد من β-hydroxybutyrate إلى ثاني أكسيد الكربون وH2O تخليق 27 جزيء ATP. يتم استخدام ما يعادل رابطة ATP عالية الطاقة (في جزيء succinyl-CoA) لتنشيط الأسيتوسيتات، وبالتالي فإن إجمالي إنتاج ATP من أكسدة جزيء β-hydroxybutyrate واحد هو 26 جزيء.
عادةً ما تكون عمليات تصنيع واستخدام الأجسام الكيتونية متوازنة، لذا فإن تركيز الأجسام الكيتونية في الدم والأنسجة عادة ما يكون منخفضًا جدًا، ويصل إلى 0.12-0.30 ملي مول/لتر، وهي عادة كمية الأجسام الكيتونية في الدم 1-3 ملغ، في البول 40 ملغ. لمرض السكري 10-50 ملغ في البول. ويسمى تراكم الأجسام الكيتونية في الجسم بالكيتوزية، ويصاحبه كيتون الدم والبيلة الكيتونية. الكيتوزية الفسيولوجية – أثناء الصيام، والعمل العضلي الثقيل، عند الأطفال حديثي الولادة. المرضية – مع مرض السكري. ومع ذلك، أثناء التجويع العام أو التجويع الكربوهيدراتي، قد يتعطل التوازن بين تكوين واستخدام أجسام الكيتون. ويرجع ذلك إلى حقيقة أن معدل تكوين أجسام الكيتون يعتمد على معدل أكسدة الأحماض الدهنية في الكبد، وتتسارع عملية الأكسدة مع زيادة تحلل الدهون (انهيار الدهون) في الأنسجة الدهنية. يمكن أن تحدث زيادة تحلل الدهون تحت تأثير هرمون الأدرينالين، أثناء عمل العضلات، وأثناء الصيام. مع نقص الأنسولين (مرض السكري)، يزداد تحلل الدهون أيضًا. ومع زيادة تحلل الدهون، يزداد معدل الاستفادة من الأجسام الكيتونية، التي تعتبر مصادر مهمة للطاقة أثناء عمل العضلات والصيام.
يؤدي الاستنزاف التدريجي لاحتياطيات الكربوهيدرات في مرض السكري إلى تأخر نسبي في استخدام أجسام الكيتون من عملية تكوين الكيتون. سبب التأخر: لا يوجد ما يكفي من succinyl-CoA وPIKE، وهما في الأساس نتاج استقلاب الكربوهيدرات. ولذلك فإن التعبير صحيح: “الدهون تحترق في لهيب الكربوهيدرات”. وهذا يعني أنه من أجل الاستخدام الفعال لمنتجات تكسير الدهون، فإن منتجات استقلاب الكربوهيدرات ضرورية: succinyl-CoA وPIKE.
وهكذا، أثناء المجاعة الكربوهيدرات، يزيد تركيز أجسام الكيتون في الدم. في اليوم الثالث من الصيام، سيكون تركيز أجسام الكيتون في الدم حوالي 2-3 مليمول / لتر، ومع المزيد من الصيام سيكون أعلى من ذلك بكثير. وتسمى هذه الحالة فرط كيتون الدم. في الأشخاص الأصحاء، يلاحظ فرط كيتون الدم أثناء العمل العضلي وأثناء الصيام، لكنه غير مهم.
حالة مماثلة نموذجية لمرض السكري. في مرض السكري، يتم تجويع الخلايا باستمرار من الكربوهيدرات، لأن الجلوكوز لا يخترق الخلايا بشكل جيد. ويلاحظ تنشيط تحلل الدهون ويزداد تكوين أجسام الكيتون. في الأشكال الشديدة من مرض السكري، يمكن أن يكون تركيز أجسام الكيتون في الدم أعلى ويصل إلى قيم تهدد الحياة: ما يصل إلى 20 مليمول / لتر أو أكثر. جميع أجسام الكيتون هي أحماض عضوية. يؤدي تراكمها إلى تحول الرقم الهيدروجيني إلى الجانب الحمضي. في العيادة، تسمى الزيادة في تركيز أجسام الكيتون في الدم بفرط كيتون الدم، ويسمى التحول في الرقم الهيدروجيني إلى الجانب الحمضي بالحماض الكيتوني. يتم تعطيل عمل العديد من الأنظمة الأنزيمية. زيادة تركيز الأسيتوسيتات يؤدي إلى تسارع تكوين الأسيتون. الأسيتون مادة سامة (مذيب عضوي). يذوب في المكونات الدهنية لأغشية الخلايا ويؤدي إلى عدم تنظيمها. تعاني جميع أنسجة الجسم، والأهم من ذلك، خلايا الأنسجة العصبية. وقد يؤدي ذلك إلى فقدان الوعي (غيبوبة ارتفاع السكر في الدم). وفي الحالات الشديدة جدًا، قد يحدث موت الجسم. يحاول الجسم حماية نفسه، لذلك تتم إزالة بعض أجسام الكيتون في البول. ظهور أجسام الكيتون في البول هو بيلة كيتونية. للتعرف على غيبوبة فرط سكر الدم وغيبوبة سكر الدم، يتم استخدام التشخيص السريع لأجسام الكيتون. يعتمد ذلك على حقيقة أن فرط كيتون الدم يؤدي إلى إفراز أجسام الكيتون في البول (بيلة كيتونية). ولذلك يتم إجراء تفاعل لوني لوجود أجسام كيتونية في البول. في السابق، كان التشخيص يتم عن طريق رائحة الأسيتون المنبعثة من فم مريض يعاني من غيبوبة ارتفاع السكر في الدم (رائحة التفاح الفاسد).
26. تخليق الكولسترول وتنظيمه. الأهمية البيولوجية للكولسترول. تصلب الشرايين. عوامل الخطر لتطوير تصلب الشرايين.
الكولسترول- خاصية الستيرويد خاصة بالكائنات الحيوانية فقط. يتم تصنيعه في العديد من الأنسجة البشرية، ولكن الموقع الرئيسي للتخليق هو الكبد. يتم تصنيع أكثر من 50% من الكوليسترول في الكبد، و15-20% يتم تصنيعه في الأمعاء الدقيقة، ويتم تصنيع باقي الكوليسترول في الجلد وقشرة الغدة الكظرية والغدد التناسلية. يتم تصنيع حوالي 1 جرام من الكوليسترول في الجسم يوميًا؛ 300-500 ملغ تأتي مع الطعام. الكوليسترول (الكولسترول) هو كحول أحادي الهيدريك. يشتمل على حلقات سيكلوبنتان بيرهيدروفينانثرين وسلسلة جانبية مكونة من 8 كربون. التخليق الحيوي للكولستروليحدث في الشبكة الإندوبلازمية. مصدر جميع ذرات الكربون في الجزيء هو أسيتيل SCoA، والذي يأتي هنا من الميتوكوندريا كجزء من السيترات، تمامًا كما يحدث أثناء تخليق الأحماض الدهنية. يتطلب التخليق الحيوي للكوليسترول 18 جزيء من ATP و13 جزيء من NADPH. يحدث تكوين الكوليسترول في أكثر من 30 تفاعلًا، والتي يمكن تجميعها في عدة مراحل: 1. تخليق حمض الميفالونيك.يتزامن أول تفاعلين تخليقيين مع تفاعلات تكوين الكيتون، ولكن بعد تخليق 3-هيدروكسي-3-ميثيلجلوتاريل-SCoA، يبدأ إنزيم اختزال هيدروكسي ميثيل-جلوتاريل-SCoA (اختزال HMG-SCoA) في العمل، مكونًا حمض الميفالونيك.
2. تخليق ثنائي فوسفات الأيزوبنتينيل.في هذه المرحلة، تتم إضافة ثلاثة بقايا فوسفات إلى حمض الميفالونيك، ثم يتم نزع الكربوكسيل منه ونزع الهيدروجين منه.