1. ماذا يفعل علم المناعة؟
2. كيف ظهرت اللقاحات والأمصال العلاجية؟
3. من الاصطناعي حصانةمختلفة عن الطبيعية؟
4. ما الذي يسبب الحساسية؟
5. ما هو توافق الأنسجة ولماذا أثناء نقل الدم؟ دمهل يجب أن نأخذ بعين الاعتبار فصيلة دم المتبرع والمريض؟
وحاليا يدرس علم المناعة المناعة.
إن مساهمتها في الطب وتربية الحيوانات وقطاعات أخرى من الاقتصاد الوطني هائلة، وقد بدأت من حلقة متواضعة إلى حد ما.
أول لقاح اخترعه العالم الإنجليزي إدوارد جينر (1749-1823). ولاحظ أن النساء اللاتي يحلبن أبقارًا مصابة بالجدري وكانت بها بثور الجدري على ضرعهن كن أقل عرضة للإصابة بالجدري. أخذ جينر السائل من بثور الجدري لامرأة مصابة بجدري البقر ونقله إلى جلد الصبي المخدوش. وبعد مرور بعض الوقت، أصيب هذا الصبي بالجدري، لكن الصبي لم يمرض. والحقيقة أن فيروس جدري البقر، الذي لا يشكل خطورة على الإنسان، تسبب في ظهور أجسام مضادة في جسم المريض تعمل على تحييد فيروس الجدري الأسود.
واصل عالم الأحياء الدقيقة الفرنسي لويس باستور (1822-1895) عمل إي. جينر. لقد كان أول من فهم أن العوامل المسببة للأمراض المعدية هي الميكروبات، ولفت الانتباه إلى حقيقة أنه بعد المعاناة من المرض، كقاعدة عامة، لا يمرض الشخص. اقترح باستير أنه إذا كان من الممكن إضعاف الكائنات الحية الدقيقة لدرجة أنها لا يمكن أن تسبب سوى شكل خفيف من المرض البشري، فإن الشخص الذي يعاني من مثل هذا المرض سيكون محميًا من الميكروبات التي تسبب نفس المرض الطبيعي. وقد أكدت التجارب هذه الفكرة.
بدأت الاستعدادات من الميكروبات الضعيفة التي قام بها لويس باستور (أو سمومها) تسمى اللقاحات، (1822-1895) والتي تعني "البقرة"، تخليداً لذكرى اللقاح الأول الذي ابتكره إي.جينر. تسمى عملية إعطاء اللقاح بالتطعيم. بعد التطعيم، تتطور المناعة في المتوسط خلال شهر واحد.
الأمصال العلاجية. عندما يتم إعطاء اللقاح، ينتج الجسم أجسامًا مضادة من تلقاء نفسه. عند إعطاء المصل، يتلقى الجسم الأجسام المضادة في شكلها النهائي. وهذا مهم بشكل خاص إذا حدثت العدوى بالفعل.
يتم أخذ الدم للمصل العلاجي إما من شخص عانى من هذا المرض، أو من الحيوانات التي تم تحصينها مسبقًا (الشكل 48)، عن طريق إدخال العامل المسبب لمرض معدي أو سمه (السم). واستجابة لذلك، ينتج جسم الحيوان أجسامًا مضادة وقائية - إما مضادة للميكروبات أو مضادة للسموم. على سبيل المثال، المصل المضاد للدفتيريا هو مضاد للسموم. يتم الحصول عليه عن طريق إدخال سم الخناق إلى جسم الحيوان.
جميع اللقاحات والأمصال محددة، أي أن لها اتجاهًا صارمًا للعمل (على سبيل المثال، لن يحمي المصل المضاد للدفتيريا من الأمراض المعدية الأخرى).
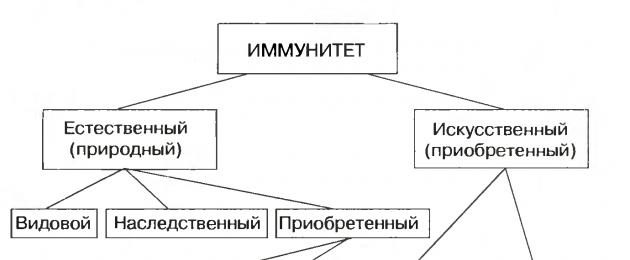
المناعة الطبيعية والاصطناعية.
يمكن أن تكون المناعة طبيعية - طبيعية ومصطنعة. يمكن تقسيم المناعة الطبيعية إلى محددة، وراثية ومكتسبة. على سبيل المثال، لا يصاب الشخص أبدًا بمرض حمى الكلاب، لأنه لا توجد شروط لحياة العامل المسبب لهذا المرض في جسم الإنسان. هذه هي مناعة الأنواع. بعض الناس لديهم مناعة ضد الأمراض التي تصيب الآخرين. هذه مناعة وراثية. وأخيرًا، هناك المناعة المكتسبة نتيجة مرض سابق أو يتلقاها الرضيع عن طريق حليب الأم.
لا يمكن اكتساب المناعة الاصطناعية إلا.
وهو نشط عندما يتم إعطاء لقاح وينتج الجسم نفسه أجسامًا مضادة، أو سلبيًا عندما يُعطى الشخص مصلًا علاجيًا يحتوي على أجسام مضادة جاهزة (انظر الرسم البياني).

حساسية.
تسمى حساسية الجسم المتزايدة لبعض العوامل البيئية، مثل الطعام والمواد ذات الرائحة والأدوية والمواد الكيميائية المنزلية، بالحساسية.
المادة التي تسبب الحساسية تسمى مسببات الحساسية. مسببات الحساسية التي تدخل الجسم تسبب رد فعل مناعي. تلتصق الأجسام المضادة بجدران الأوعية الدموية، وبخلايا مختلفة الأقمشةوالأعضاء. عندما يدخل مسبب الحساسية الجسم مرة ثانية، تشكل هذه الأجسام المضادة مجمعات من الأجسام المضادة للمستضد معه. يؤدي ذلك إلى إطلاق مواد تلحق الضرر بالخلايا التي ترتبط بها هذه الأجسام المضادة. يحدث احمرار وحكة وعلامات تهيج أخرى. على سبيل المثال، يؤدي تهيج الغشاء المخاطي للأنف إلى سيلان الأنف والعطس، ويؤدي تهيج الغشاء المخاطي للقصبات الهوائية إلى السعال وزيادة إنتاج البلغم.
يمكن أن تكون مسببات الحساسية هي حبوب اللقاح وغبار الغرفة ومساحيق الغسيل وأطعمة الأسماك وشعر الكلاب أو القطط والمضادات الحيوية والانبعاثات من المؤسسات الحضرية والريفية.
توافق الأنسجة.
جرت محاولات زرع الأنسجة من شخص إلى آخر منذ فترة طويلة. ومع ذلك، حتى مع نجاح العملية، يتم رفض الأنسجة المزروعة بعد مرور بعض الوقت. كان السبب منيعرد فعل. كان التركيب الكيميائي الحيوي للأنسجة الأجنبية مختلفًا بعض الشيء عن أنسجة المريض الذي تم زرعها فيه. وكان هذا كافياً لكي يُنظر إلى بعض المركبات الكيميائية في الأنسجة على أنها مستضدات في الجسم.
كلما قل عدد الأنسجة المزروعة التي تحتوي على مستضدات، زادت فرصة تجذرها. ولذلك، فإن المهمة الأولى للجراحين هي العثور على الأشخاص الذين تتوافق أنسجتهم. هناك طريقة أخرى لزراعة الأنسجة وهي قمع الاستجابة المناعية باستخدام أدوية خاصة.
نقل الدم.
واجه الأطباء أيضًا مشكلة توافق الأنسجة أثناء عمليات نقل الدم، حيث يتم تدمير المستضدات الموجودة في خلايا الدم الحمراء لدم شخص آخر بواسطة الأجسام المضادة لبلازما المريض إذا كان دمه غير متوافق.
يُطلق على الأشخاص الذين يتبرعون بالدم اسم المتبرعين، ويطلق على أولئك الذين يتلقونه اسم المتلقين. عندما لا تتطابق المناعة الوراثية للمتلقي والمتبرع، يتم تدمير خلايا الدم الحمراء من دم المتبرع الذي تم إدخاله إلى جسم المريض، مما أدى إلى وفاة المريض. أدت دراسة نقل الدم إلى اكتشاف أربع فصائل دم. تم تحديدهم بالأرقام الرومانية I، II، III، IV. إن دم الأشخاص المختلفين من نفس فصيلة الدم يكون دائمًا متوافقًا. بالإضافة إلى ذلك، يمكن نقل دم المجموعة الأولى إلى جميع المجموعات الأخرى دون عواقب سلبية. الأشخاص الذين لديهم فصيلة الدم I هم متبرعون عالميون، لكنهم هم أنفسهم لا يمكنهم تلقي سوى عمليات نقل الدم من فصيلتهم. فإلى جانب المانحين العالميين، هناك أيضًا متلقون عالميون. هؤلاء هم الأشخاص الذين ينتمي دمهم إلى المجموعة الرابعة. يمكنهم تلقي عمليات نقل الدم من أي نوع. يمكن نقل الأشخاص الذين لديهم دماء من المجموعتين الثانية والثالثة بدم من المجموعة الأولى ودمهم.
طوال حياة الشخص، لا تتغير فصيلة دمه: المستضدات الموجودة في خلايا الدم الحمراء والأجسام المضادة الموجودة في البلازما ثابتة طوال الحياة.
عامل ر.س.
لدى العديد من الأشخاص بروتين في خلايا الدم الحمراء يسمى عامل Rh. ويشار إليه بالرمز Rh+. تم اكتشاف هذا البروتين لأول مرة في قرود الريسوس. ويسمى دم الأشخاص الذين لديهم العامل الريسوسي إيجابيًا، ويسمى دم الأشخاص الذين لا تحتوي خلايا الدم الحمراء فيه على العامل الريسوسي سلبيًا.
إذا تم نقل دم لشخص لديه عامل Rh سلبي، فسيبدأ جسمه في إنتاج أجسام مضادة ضد عامل Rh. مع النقل الثانوي للدم الموجب لعامل الريسس إلى شخص مصاب بالدم الموجب للعامل الريسوسي، يحدث صراع مناعي وتحدث تفاعلات عدم التوافق.
يمكن أن يحدث تعارض العامل الريسوسي أيضًا عندما يكون العامل الريسوسي للأم سلبيًا والأب موجبًا. إذا كان الجنين إيجابيًا، فسيبدأ جسم الأم في إنتاج أجسام مضادة تدمر بروتين Rh+. خلال فترة الحمل الأول، قد يتراكم القليل من هذه الأجسام المضادة، ومن ثم يولد طفل طبيعي. لكن خلال الحمل الثاني، عندما تتراكم الكثير من الأجسام المضادة، يحدث تعارض في عامل Rh، مصحوبًا بتدمير خلايا الدم الحمراء لدى الطفل. يتطور مرض انحلالي يهدد حياة الوليد. من أجل الوقاية منه، يتم إجراء اختبار لجميع النساء الحوامل ذوات الدم السلبي لعامل Rh للكشف عن الأجسام المضادة لعامل Rh. إذا كانت موجودة، مباشرة بعد الولادة يتم إعطاء الطفل نقل دم متبادل.
علم المناعة، الأمصال العلاجية، التطعيمات الوقائية (اللقاحات)، الأجسام المضادة، مضادات السموم، المناعة الطبيعية: الأنواع، الوراثية، المكتسبة؛ المناعة الاصطناعية: سلبية، نشطة؛ الحساسية، مسببات الحساسية، توافق الأنسجة، فصائل الدم 1، II، III و IV، عامل Rh، المتبرع، المتلقي.
1. ما هو فضل إ. جينر و إل. باستور في اختراع اللقاح؟
2. لماذا لا يوفر لقاح الحصبة مناعة ضد الكزاز؟
3. ما هي الحساسية وكيف تحدث؟
4. لماذا يعتبر عدم توافق الأنسجة عائقا أمام زراعة الأعضاء؟
5. ما هي فصائل الدم لدى البشر؟
كيف يمكن تفسير الصراع بين الجنين ذو العامل الريسوسي الإيجابي والأم ذات العامل الريسوسي السلبي؟
1. يوضح الشكل 48 عملية تحضير مضاد سم الخناق، المكون من أجسام مضادة تعمل على تحييد سم الخناق.
أنظر إلى الصورة وأجب عن الأسئلة:
ما هو الموجود في الدورق الذي يتم إعطاء محتوياته للحصان عدة مرات مع زيادة الجرعة تدريجياً؟
ماذا يحدث في جسم الحصان استجابة لاعطاء هذه المادة؟
كيف يتم معالجة دم الحصان لإنتاج مضاد سم الخناق؟
في أي الحالات يتم استخدام مضاد سموم الخناق؟
ما هو نوع المناعة التي تم تطويرها لدى المريض الذي تم إعطاؤه مضاد سم الدفتيريا؟
انسخ الرسم التخطيطي في دفتر ملاحظاتك.
ضع علامة بالسهام على من يمكن نقله بدم المجموعات الأولى والثانية والثالثة والرابعة.
Kolosov D. V. Mash R. D.، Belyaev I. N. علم الأحياء الصف الثامن
مقدمة من القراء من الموقع
لقد كانت الأمراض المعدية دائما الأعداء الرئيسيين للإنسان. يعرف التاريخ العديد من الأمثلة على العواقب المدمرة للجدري، والطاعون، والكوليرا، والتيفوئيد، والدوسنتاريا، والحصبة، والأنفلونزا. ويكفي أن نتذكر أن تراجع اليونان القديمة وروما لا يرتبط كثيرًا بالحروب التي شنتها، بل بأوبئة الطاعون الوحشية التي دمرت ياغالبية السكان. وفي القرن الرابع عشر، قتل الطاعون ثلث سكان أوروبا. بسبب وباء الجدري بعد 15 عامًا من غزو كورتيز، بقي أقل من 3 ملايين شخص من إمبراطورية الإنكا التي يبلغ عدد سكانها 30 مليونًا. وأدى جائحة الأنفلونزا (ما يسمى بـ “الأنفلونزا الإسبانية”) في 1918-1920 إلى مقتل نحو 40 مليون شخص، وبلغ عدد الحالات حوالي 500 مليون شخص. وهذا أكثر من الخسائر في ساحات القتال في الحرب العالمية الأولى، حيث قُتل 8 ملايين و400 ألف وجرح 17 مليون شخص.
بحثًا عن علاجات ضد الأمراض المعدية، حاول الناس كثيرًا - من التعويذات والمؤامرات إلى المطهرات وإجراءات الحجر الصحي. ومع ذلك، لم يبدأ عصر جديد من مكافحة العدوى إلا مع ظهور اللقاحات. تحتوي اللقاحات على كائنات دقيقة كاملة (ضعيفة أو مقتولة) أو مكوناتها الفردية. إنهم غير قادرين على التسبب في المرض ويعملون كنوع من "الدمية" التعليمية. بفضل اللقاح، يتذكر الجهاز المناعي العلامات المميزة للعدو، وعندما يواجه مسببات الأمراض الحية، يتعرف عليه على الفور ويدمره.
مصطلح "اللقاح" يأتي من الكلمة اللاتينية لقاح- بقرة. وقد قدمها لويس باستور تكريما للطبيب الإنجليزي إدوارد جينر، الذي يمكن بلا شك اعتباره رائدا في مجال الوقاية من اللقاحات. وفي عام 1796، أثناء ممارسته المهنة في القرية، لاحظ جينر أن المزارعين الذين يعملون مع الأبقار المصابة بجدري البقر لم يصابوا بالجدري. قام بتطعيم صبي بمرض جدري البقر وأثبت أنه أصبح محصنًا ضد مرض الجدري. تم اختراع هذه الطريقة في وقت لم يتم فيه اكتشاف البكتيريا ولا الفيروسات بعد، وانتشرت على نطاق واسع في أوروبا، وشكلت فيما بعد الأساس للقضاء على الجدري في جميع أنحاء العالم. ومع ذلك، بعد مرور قرن فقط، تم اقتراح نهج علمي للتطعيم. كان مؤلفها لويس باستور، الذي طبق مفهومه عن مسببات الأمراض المعدية لإنشاء لقاح ضد داء الكلب.
بدأ تطوير لقاحات جديدة على قدم وساق في بداية القرن العشرين، عندما ظهرت طرق التوهين المستقر (الإضعاف) للكائنات الحية الدقيقة، مما يلغي خطر الإصابة بالمرض، وتم فتح إمكانية استخدام السموم البكتيرية المحايدة للتطعيم.
ومنذ ذلك الحين، ظهر أكثر من 100 لقاح مختلف يحمي من أكثر من أربعين عدوى تسببها البكتيريا والفيروسات والأوالي.

يمكن تقسيم مستحضرات اللقاح الكلاسيكية إلى ثلاث مجموعات:
- اللقاحات الحية. المبدأ النشط فيها هو الكائنات الحية الدقيقة الضعيفة التي فقدت القدرة على التسبب في المرض، ولكنها تحفز الاستجابة المناعية. وتشمل هذه المجموعة لقاحات ضد الحصبة والحصبة الألمانية وشلل الأطفال والنكاف والأنفلونزا.
- اللقاحات المعطلة. أنها تحتوي على الكائنات الحية الدقيقة المسببة للأمراض المقتولة أو شظاياها. ومن الأمثلة على ذلك اللقاحات ضد الأنفلونزا، والتهاب الدماغ الذي ينقله القراد، وداء الكلب، وحمى التيفوئيد.
- الأناتوكسينات (التوكسويدات) هي سموم بكتيرية في شكل معدل وغير ضار. وتشمل هذه اللقاحات المعروفة والمستخدمة على نطاق واسع ضد الخناق والكزاز والسعال الديكي.
مع بداية التطور السريع للبيولوجيا الجزيئية وعلم الوراثة وطرق الهندسة الوراثية، ظهرت فئة جديدة من اللقاحات - اللقاحات الجزيئية. يستخدمون البروتينات المؤتلفة أو أجزاء البروتين من الميكروبات المسببة للأمراض، والتي يتم تصنيعها في خلايا سلالات البكتيريا والفيروسات والخميرة المختبرية. وحتى الآن، لم تدخل حيز التنفيذ سوى ثلاثة من هذه الأدوية: لقاح مؤتلف ضد التهاب الكبد B، ولقاح ضد مرض لايم، ولقاح السعال الديكي المزيل للسموم، والذي تم تضمينه في لقاح DTP المستخدم في إيطاليا.
لقد مكنت اللقاحات البشرية من تحقيق نتائج مذهلة في مكافحة العدوى. لقد تم القضاء تماما على الجدري، وهو المرض الذي يقتل الملايين من الناس كل عام، من العالم. يعد هذا أحد أبرز الأحداث في القرن العشرين، والذي من حيث الأهمية يتساوى مع رحلة الإنسان إلى الفضاء. لقد اختفى شلل الأطفال فعليا، ويستمر القضاء على مرض الحصبة على مستوى العالم. لقد انخفض معدل الإصابة بالدفتيريا والحصبة الألمانية والسعال الديكي والنكاف والتهاب الكبد الفيروسي ب والعديد من الأمراض المعدية الخطيرة الأخرى مئات بل آلاف المرات.
أكاديمي الأكاديمية الروسية للعلوم الطبية V. ZVEREV، مدير معهد أبحاث اللقاحات والأمصال الذي يحمل اسمه. I. I. Mechnikova RAMS.
لقد كانت الأمراض المعدية دائما الأعداء الرئيسيين للإنسان. يعرف التاريخ أمثلة عديدة على العواقب المدمرة للجدري، والطاعون، والكوليرا، والتيفوئيد، والدوسنتاريا، والحصبة، والأنفلونزا. ويكفي أن نتذكر أن تراجع اليونان القديمة وروما لا يرتبط كثيرًا بالحروب التي شنتها، بل بأوبئة الطاعون الوحشية التي دمرت معظم السكان. في القرن الرابع عشر، قتل الطاعون ثلث سكان العالم أوروبا بسبب وباء الجدري بعد 15 عامًا، بعد غزو كورتيز، بقي أقل من 3 ملايين شخص من إمبراطورية الإنكا التي يبلغ عدد سكانها 30 مليونًا، وتسبب وباء الأنفلونزا (ما يسمى بـ "الأنفلونزا الإسبانية") في 1918-1920. حياة حوالي 40 مليون شخص، وكان عدد المرضى حوالي 500 مليون شخص، وهذا أكثر من الخسائر في ساحات القتال في الحرب العالمية الأولى، حيث قتل 8 ملايين و400 ألف وجرح 17 مليون شخص.
كان من الممكن أن تبدو الكاتدرائية المهيبة التي تزين ساحة مدينة سيينا الإيطالية أكبر لولا وباء الطاعون.
إحدى الطرق التقليدية لإضعاف الفيروسات هي إنمائها في الخلايا الحيوانية.
تتيح التقنيات المؤتلفة الحصول على فيروس ضعيف في وقت أقصر.
الجدول الزمني لإنشاء اللقاح
عودة إصابات الأطفال بعد توقف التطعيم الشامل.
يتضمن تطعيم الحمض النووي حقن جزء من الحمض النووي الذي يشفر المستضدات الواقية والسيتوكينات مباشرة في الأنسجة العضلية.
بحثًا عن علاجات ضد الأمراض المعدية، حاول الناس كثيرًا - من التعويذات والمؤامرات إلى المطهرات وإجراءات الحجر الصحي. ومع ذلك، لم يبدأ عصر جديد من مكافحة العدوى إلا مع ظهور اللقاحات. تحتوي اللقاحات على كائنات دقيقة كاملة (ضعيفة أو مقتولة) أو مكوناتها الفردية. إنهم غير قادرين على التسبب في المرض ويعملون كنوع من "الدمية" التعليمية. بفضل اللقاح، يتذكر الجهاز المناعي العلامات المميزة للعدو، وعندما يواجه مسببات الأمراض الحية، يتعرف عليه على الفور ويدمره.
مصطلح "اللقاح" يأتي من الكلمة الفرنسية لقاح- بقرة. وقد قدمها لويس باستور تكريما للطبيب الإنجليزي إدوارد جينر، الذي يمكن بلا شك اعتباره رائدا في مجال الوقاية من اللقاحات. وفي عام 1796، أثناء ممارسته المهنة في القرية، لاحظ جينر أن المزارعين الذين يعملون مع الأبقار المصابة بجدري البقر لم يصابوا بالجدري. قام بتطعيم صبي بمرض جدري البقر وأثبت أنه أصبح محصنًا ضد مرض الجدري. تم اختراع هذه الطريقة في وقت لم يتم فيه اكتشاف البكتيريا ولا الفيروسات بعد، وانتشرت على نطاق واسع في أوروبا، وشكلت فيما بعد الأساس للقضاء على الجدري في جميع أنحاء العالم. ومع ذلك، بعد مرور قرن فقط، تم اقتراح نهج علمي للتطعيم. كان مؤلفها لويس باستور، الذي طبق مفهومه عن مسببات الأمراض المعدية لإنشاء لقاح ضد داء الكلب.
بدأ تطوير لقاحات جديدة على قدم وساق في بداية القرن العشرين، عندما ظهرت طرق التوهين المستقر (الإضعاف) للكائنات الحية الدقيقة، مما يلغي خطر الإصابة بالمرض، وتم فتح إمكانية استخدام السموم البكتيرية المحايدة للتطعيم.
ومنذ ذلك الحين، ظهر أكثر من 100 لقاح مختلف يحمي من أكثر من أربعين عدوى تسببها البكتيريا والفيروسات والأوالي.
يمكن تقسيم مستحضرات اللقاح الكلاسيكية إلى ثلاث مجموعات:
1. اللقاحات الحية. المبدأ النشط فيها هو الكائنات الحية الدقيقة الضعيفة التي فقدت القدرة على التسبب في المرض، ولكنها تحفز الاستجابة المناعية. وتشمل هذه المجموعة لقاحات ضد الحصبة والحصبة الألمانية وشلل الأطفال والنكاف والأنفلونزا.
2. اللقاحات المعطلة. أنها تحتوي على الكائنات الحية الدقيقة المسببة للأمراض المقتولة أو شظاياها. ومن الأمثلة على ذلك اللقاحات ضد الأنفلونزا، والتهاب الدماغ الذي ينقله القراد، وداء الكلب، وحمى التيفوئيد.
3. الأناتوكسينات (السموم) - سموم بكتيرية في شكل غير ضار معدل. وتشمل هذه اللقاحات المعروفة والمستخدمة على نطاق واسع ضد الخناق والكزاز والسعال الديكي.
مع بداية التطور السريع للبيولوجيا الجزيئية وعلم الوراثة وطرق الهندسة الوراثية، ظهرت فئة جديدة من اللقاحات - اللقاحات الجزيئية. يستخدمون البروتينات المؤتلفة أو أجزاء البروتين من الميكروبات المسببة للأمراض، والتي يتم تصنيعها في خلايا سلالات البكتيريا والفيروسات والخميرة المختبرية. وحتى الآن، لم تدخل حيز التنفيذ سوى ثلاثة من هذه الأدوية: لقاح مؤتلف ضد التهاب الكبد B، ولقاح ضد مرض لايم، ولقاح السعال الديكي المزيل للسموم، والذي تم تضمينه في لقاح DTP المستخدم في إيطاليا.
لقد مكنت اللقاحات البشرية من تحقيق نتائج مذهلة في مكافحة العدوى. لقد تم القضاء تماما على الجدري الطبيعي، وهو المرض الذي يقتل ملايين الأشخاص كل عام، من العالم. يعد هذا أحد أبرز الأحداث في القرن العشرين، والذي من حيث الأهمية يتساوى مع رحلة الإنسان إلى الفضاء. لقد اختفى شلل الأطفال فعليا، ويستمر القضاء على مرض الحصبة على مستوى العالم. لقد انخفض معدل الإصابة بالدفتيريا والحصبة الألمانية والسعال الديكي والنكاف والتهاب الكبد الفيروسي ب والعديد من الأمراض المعدية الخطيرة الأخرى مئات بل وآلاف المرات.
لا يزال بعيدًا عن النصر الكامل
على الرغم من التقدم المذهل، لا تزال الأمراض المعدية واحدة من الأسباب الرئيسية للوفاة: وفقا لمنظمة الصحة العالمية، فإنها تمثل ما يصل إلى 30٪ من الوفيات المسجلة سنويا على هذا الكوكب. وأخطرها هي التهابات الجهاز التنفسي الحادة، وفي المقام الأول الأنفلونزا والالتهاب الرئوي، والعدوى بفيروس نقص المناعة البشرية، والالتهابات المعوية، والسل، والتهاب الكبد الفيروسي ب، والملاريا.
ووفقا لتوقعات خبراء منظمة الصحة العالمية وروسيا والولايات المتحدة، فإن تفشي حالات عدوى جديدة أو عائدة يمكن أن يحدث في أي وقت وفي أي مكان على هذا الكوكب. يتم إدخال كائنات دقيقة غير معروفة إلى البشر كل عام تقريبًا من مصادر طبيعية. على مدار الثلاثين عامًا الماضية، واجهنا 40 كائنًا دقيقًا خطيرًا جديدًا، والتي شكلت في كثير من الحالات تهديدًا حقيقيًا لحياة وصحة مئات الآلاف من الأشخاص. ومن بينها فيروس الإيبولا، العامل المسبب لمرض الفيالقة، وفيروس نقص المناعة البشرية، والفيروسات التاجية ومسببات الأمراض الأخرى.
في كثير من الأحيان، على خلفية الصحة الوبائية، يتوقف الناس عن تناول اللقاحات التي توفرها أنظمة الرعاية الصحية الوطنية، ثم تعود العدوى التي كانت تعتبر منذ فترة طويلة مهزومة. وفي العقود الأخيرة، تم تسجيل أوبئة السعال الديكي والدفتيريا وشلل الأطفال والحصبة في اليابان وروسيا وأذربيجان وجورجيا وطاجيكستان وأوكرانيا وهايتي وفنزويلا وكولومبيا. ومن الأمثلة التوضيحية على ذلك عودة مرض الدفتيريا إلى الأراضي الروسية في منتصف التسعينيات، والذي لم يكن يُرى حتى ذلك الوقت إلا من حين لآخر. ونتيجة للحملة ضد التطعيمات التي أطلقها متخصصون زائفون، أصيب أكثر من 100 ألف شخص بالدفتيريا، وتوفي عدة آلاف منهم. وفقط التطعيم الجماعي للأطفال هو الذي سمح بوقف الوباء.
تؤدي هجرة الناس والحيوانات إلى انتشار الكائنات الحية الدقيقة إلى مناطق جديدة. تحدث حالات تفشي واسعة النطاق للأمراض المعدية حتى في البلدان التي تتمتع بأنظمة رعاية صحية متطورة، مثل الولايات المتحدة. في عام 1999، تم الإبلاغ عن حالات حمى غرب النيل، وهو فيروس تنقله الطيور، في نيويورك. وبحلول عام 2002، لوحظ هذا المرض في 44 ولاية. ومرض أكثر من أربعة آلاف شخص، مات منهم نحو ثلاثمائة.
في مايو 2003، ظهرت تقارير عن مرض ناجم عن فيروس جدري القرود. وفي الولايات المتحدة، كانت حاملاته هي القوارض، التي تم جلبها من أفريقيا كحيوانات أليفة غريبة. ولم ينتشر المرض على نطاق واسع فقط بسبب اتخاذ تدابير مكافحة الوباء في الوقت المناسب.
ومن بين الإصابات الجديدة التي تغلغلت بين البشر، يكفي أن نذكر تفشي ما يسمى بالالتهاب الرئوي اللانمطي (المتلازمة التنفسية الحادة الوخيمة) في الصين ووقائع إصابة الإنسان بفيروس أنفلونزا الطيور (H5N1). في الحالة الأولى، كان السبب هو فيروس كورونا المعدل الذي تحمله الخفافيش. استغرق القضاء على المرض حوالي عام. وفي الحالة الثانية، أدت الأمراض الجماعية للدواجن إلى إصابة أكثر من مائة شخص بفيروس أنفلونزا الطيور خلال السنوات الثلاث الماضية، وتوفي نصفهم. ولحسن الحظ فإن هذا الفيروس لم ينتقل بعد من شخص لآخر وبالتالي لا يسبب أوبئة بين الناس. لكن عددًا من العلماء يعتقدون أن التبادل الجيني بين متغيرات فيروس الطيور والمتغيرات البشرية أمر محتمل جدًا، ونتيجة لذلك قد تظهر متغيرات جديدة شديدة الإمراض للبشر (انظر العلوم والحياة رقم 9، 2003 - إد.).
اللقاحات ضد الأمراض "غير المعدية".
ويشير علماء الأوبئة من مختلف البلدان إلى أنه خلال الارتفاع الموسمي في حالات الإصابة بالأنفلونزا، يزداد عدد الأشخاص الذين يدخلون المستشفى بسبب مشاكل في القلب والأوعية الدموية والحوادث الوعائية الدماغية. وفي الوقت نفسه، تتزايد الوفيات الناجمة عن احتشاء عضلة القلب والسكتات الدماغية، وأحياناً بمقدار عشرة أضعاف. في كثير من الأحيان تؤدي العدوى الفيروسية إلى التهاب عضلة القلب والتهاب الشغاف - وهي الأمراض التي تؤثر على أنسجة القلب. عندما بدأ تطعيم الأطفال في الولايات المتحدة ضد النكاف، ظهر تأثير "جانبي" غير متوقع: انخفض معدل الإصابة بالتهاب الشغاف بشكل حاد. وأكد الفحص أن غالبية المرضى الذين يعانون من هذا المرض الخطير المؤدي إلى أمراض القلب كانوا يعانون من مرض النكاف في مرحلة الطفولة المبكرة. من الممكن أن يكون تصلب الشرايين ذو طبيعة معدية، حيث تم اكتشاف وجود الكلاميديا وبعض الكائنات الحية الدقيقة الأخرى في لويحات تصلب الشرايين في الأوعية التاجية والشريان الأورطي البشري.
لقد ثبت بالفعل أن قرحة المعدة والاثني عشر، وكذلك التهاب المعدة، ترتبط بالعدوى هيليكوباكتر بيلوريوالذي حصل اكتشافه على جائزة نوبل عام 2005 (انظر "العلم والحياة" رقم - إد.) ، توجد في 50٪ من مرضى التهاب المعدة، وفي 70-90٪ من المرضى الذين يعانون من قرحة المعدة، وفي 95٪ من الأشخاص الذين يعانون من قرحة الاثني عشر.
عندما يصاب الشخص بالفيروسات القهقرية والفيروسات الرجعية والفيروس المضخم للخلايا وفيروس إبشتاين بار، تتشكل الأجسام المضادة التي تهاجم خلايا البنكرياس، مما قد يؤدي إلى تطور مرض السكري المعتمد على الأنسولين. في 10-20٪ من المرضى الذين يعانون من متلازمة الحصبة الألمانية الخلقية، أي عند الأطفال الذين أصيبت أمهاتهم بالحصبة الألمانية في الأشهر الثلاثة الأخيرة من الحمل، تتطور أيضًا اضطرابات التمثيل الغذائي للكربوهيدرات. كما ترتبط أورام المعدة والأعضاء التناسلية الخارجية والكبد بالبكتيريا أو الفيروسات في كثير من الحالات.
كيف تؤثر الكائنات الحية الدقيقة على تطور الأمراض التي لا تعتبر معدية؟ بادئ ذي بدء، يبدأ العضو في أداء وظيفته بشكل أسوأ بسبب حقيقة أن الميكروبات تدمر الخلايا المصابة. تشير التجارب التي أجريت على مزارع الخلايا إلى أن فيروسات النكاف والحصبة الألمانية وكوكساكي بي تعمل بهذه الآلية.
من الممكن أنه في بعض الحالات، يبدأ الفيروس فقط العملية المرضية، ويحدث المزيد من نمو الورم دون مشاركة الكائنات الحية الدقيقة. تم اقتراح هذه الفرضية من قبل عالم المناعة الروسي L. A. Zilber عند بناء النظرية الفيروسية لأصل الأورام. في بعض الأحيان، تعمل الكائنات الحية الدقيقة على تعزيز تأثير العوامل الضارة الأخرى، وفي بعض الحالات، يؤدي العامل الممرض المعدي إلى تحفيز عملية المناعة الذاتية الموجهة ضد خلايا العضو المستهدف.
وبما أن العديد من الأمراض غير المعدية ترتبط بالميكروبات، فهناك أمل في استخدام اللقاحات الموجودة للوقاية. تم الحصول على أول دليل على أن اللقاحات ضد فيروس التهاب الكبد B لديها القدرة على منع تطور أورام الكبد - سرطان الكبد. وبعد أن بدأت تايوان بتحصين الأطفال ضد التهاب الكبد B، انخفض معدل الإصابة بسرطان الكبد بنسبة 50%، كما انخفض معدل الوفيات بسببه بنسبة 70%.
تم بالفعل اختبار العديد من اللقاحات المحتملة ضد فيروس الورم الحليمي لمنع تطور الأورام الخبيثة في الأعضاء التناسلية. تم الانتهاء من الدراسة ما قبل السريرية للقاح الخلية الكاملة بكتيريا الملوية البوابيةللوقاية من قرحة المعدة والاثني عشر.
الحمض النووي يذهب إلى المعركة
ليس من الممكن دائمًا إنشاء لقاحات ضد الإصابات الجديدة باستخدام تقنيات قديمة أثبتت جدواها. يكاد يكون من المستحيل أن تنمو بعض الكائنات الحية الدقيقة، مثل فيروس التهاب الكبد B، في مزرعة الخلايا لإنتاج لقاح معطل. في كثير من الحالات، تكون اللقاحات المعتمدة على الميكروبات الميتة غير فعالة، وتكون اللقاحات الحية خطيرة للغاية. تم تعليق آمال كبيرة على اللقاحات القائمة على بروتينات المستضد المؤتلف (هذه هي الطريقة التي تم بها إنشاء لقاح للحماية من التهاب الكبد B في الثمانينيات). ولكن أصبح من الواضح الآن أن العديد من اللقاحات المؤتلفة تنتج استجابة مناعية ضعيفة. ويرجع ذلك على الأرجح إلى أن هذه الأدوية تحتوي على بروتين مجرد وتفتقر إلى الهياكل الجزيئية الأخرى التي غالبًا ما تكون ضرورية لتحفيز الاستجابة المناعية. لكي تدخل اللقاحات المؤتلفة حيز التنفيذ، هناك حاجة إلى معززات (مواد مساعدة) تحفز نشاط المستضدات.
على مدى السنوات العشر الماضية، ظهر اتجاه جديد - التحصين الجيني. ويسمى أيضًا بتطعيم الحمض النووي، لأنه ليس بروتين المستضد الذي يتم إدخاله إلى الجسم، ولكن الحمض النووي (DNA أو RNA)، هو الذي يشفر المعلومات حول البروتين. ظهرت الفرصة الحقيقية لاستخدام هذه التكنولوجيا في الطب والطب البيطري في منتصف التسعينيات من القرن الماضي. النهج الجديد بسيط للغاية، ورخيص، والأهم من ذلك أنه عالمي. لقد تم الآن تطوير أنظمة آمنة نسبيًا توفر التوصيل الفعال للأحماض النووية إلى الأنسجة. يتم إدخال الجين المطلوب في البلازميد (حلقة من الحمض النووي) أو في فيروس آمن. يخترق هذا الناقل المتجه الخلية ويصنع البروتينات الضرورية. وتتحول الخلية المتحولة إلى «مصنع» لإنتاج اللقاح داخل الجسم مباشرة. "مصنع" اللقاح قادر على العمل لفترة طويلة تصل إلى عام. يؤدي تطعيم الحمض النووي إلى استجابة مناعية كاملة ويوفر مستوى عالٍ من الحماية ضد العدوى الفيروسية.
باستخدام نفس الناقل البلازميدي أو الفيروسي، من الممكن إنشاء لقاحات ضد الأمراض المعدية المختلفة عن طريق تغيير التسلسل الذي يشفر بروتينات المستضد الضرورية فقط. وفي الوقت نفسه، ليست هناك حاجة للعمل مع الفيروسات والبكتيريا الخطيرة، ويصبح الإجراء المعقد والمكلف لتنقية البروتينات غير ضروري. لا تتطلب مستحضرات لقاح الحمض النووي ظروف تخزين وتسليم خاصة؛ فهي مستقرة لفترة طويلة في درجة حرارة الغرفة.
يعد تطعيم الحمض النووي أحد أكثر المجالات الواعدة في مكافحة السرطان. يمكن إدخال جينات مختلفة إلى الورم: تلك التي تشفر مستضدات السرطان، وجينات السيتوكينات والمعدلات المناعية، وجينات "تدمير" الخلية. كل هذه الجينات يمكن استخدامها في وقت واحد، لتنظيم هجوم واسع النطاق بأسلحة من أنواع مختلفة.
ومع ذلك، قبل أن يدخل تطعيم الحمض النووي في الممارسة الطبية، من الضروري التأكد من سلامة هذه الأدوية، ودراسة مدة المناعة التي تسببها والعواقب على الجهاز المناعي.
اللقاحات "بالحساب"
أدى التطور السريع في علم الجينوم والمعلوماتية الحيوية والبروتينات في العقد الماضي إلى نهج جديد تمامًا لإنشاء اللقاحات، يسمى "علم اللقاحات العكسي". يعبر هذا المصطلح بوضوح عن جوهر التقنية التكنولوجية الجديدة. إذا كان العلماء في وقت سابق، عند إنشاء اللقاحات، يتبعون خطًا تنازليًا، من الكائنات الحية الدقيقة بأكملها إلى مكوناتها، يُقترح الآن المسار المعاكس: من الجينوم إلى منتجاته. يعتمد هذا النهج على حقيقة أن معظم المستضدات الواقية هي جزيئات بروتينية. من خلال المعرفة الكاملة بجميع مكونات البروتين لأي مسبب للمرض، من الممكن تحديد أي منها مناسب كمرشح محتمل لإدراجه في تحضير اللقاح وأي منها ليس مناسبًا.
لتحديد تسلسل النوكليوتيدات للجينوم بأكمله للكائنات الحية الدقيقة المعدية، إن لم يكن عدة أيام، فستكون عدة أسابيع كافية. علاوة على ذلك، فإن العمل الأولي للحصول على "مكتبات" لاستنساخ الحمض النووي الممرض تم تنفيذه منذ فترة طويلة باستخدام مجموعات قياسية من الإنزيمات. تتيح الأجهزة الحديثة لتحديد تسلسل النوكليوتيدات في جزيئات الحمض النووي تلقائيًا إجراء ما يصل إلى 14 مليون تفاعل سنويًا. يستغرق فك تشفير الجينوم بالكامل ووصفه بقائمة البروتينات المشفرة عدة أشهر.
بعد إجراء تحليل حاسوبي (سيليكو) للجينوم، لا يتلقى الباحث قائمة البروتينات المشفرة فحسب، بل يتلقى أيضًا بعض خصائصها، على سبيل المثال، الانتماء إلى مجموعات معينة، والتوطين المحتمل داخل الخلية البكتيرية، والاتصال بالغشاء ، والخصائص المستضدية.
هناك طريقة أخرى لاختيار اللقاحات المرشحة وهي تحديد نشاط الجينات الفردية للكائنات الحية الدقيقة. وللقيام بذلك، يتم قياس مستوى تخليق الحمض النووي الريبي المرسال لجميع منتجات الجينات المنتجة في الخلية في وقت واحد. تتيح هذه التقنية "حساب" الجينات المشاركة في انتشار العدوى.
ويعتمد النهج الثالث على التكنولوجيا البروتينية. وتتيح أساليبها تفصيل الخصائص الكمية والنوعية للبروتينات في مكونات الخلية. هناك برامج كمبيوتر يمكنها، بناءً على تسلسل الأحماض الأمينية، التنبؤ ليس فقط بالبنية ثلاثية الأبعاد للبروتين قيد الدراسة، ولكن أيضًا خصائصه ووظائفه.
باستخدام هذه الطرق الثلاث، من الممكن اختيار مجموعة من البروتينات والجينات المقابلة لها والتي لها أهمية في صنع اللقاح. وكقاعدة عامة، تضم هذه المجموعة حوالي 20-30٪ من جميع الجينات الموجودة في الجينوم البكتيري. لمزيد من التحقق، من الضروري تصنيع وتنقية المستضد المحدد بالكميات اللازمة لتحصين الحيوانات. تتم تنقية البروتين باستخدام أدوات آلية بالكامل. وباستخدام التكنولوجيا الحديثة يستطيع مختبر مكون من ثلاثة باحثين عزل وتنقية أكثر من 100 بروتين خلال شهر واحد.
ولأول مرة، تم استخدام مبدأ "اللقاح العكسي" للحصول على لقاح ضد المكورات السحائية من المجموعة ب. وفي السنوات الأخيرة، تم تطوير مستحضرات اللقاح ضد المكورات العقدية بهذه الطريقة العقدية القاطعة للدرو S. الرئوية، المكورات العنقودية الذهبية، البكتيريا بورفيروموناس اللثة، يسبب التهاب اللثة، ويثير ميكروبات الربو الكلاميديا الرئويةوالعامل المسبب للملاريا الحادة المتصورة المنجلية.
من المهم ليس فقط إنشاء لقاح، ولكن أيضًا العثور على أفضل طريقة لإيصاله إلى الجسم. يوجد الآن ما يسمى باللقاحات المخاطية، والتي يتم إعطاؤها من خلال الأغشية المخاطية للفم أو الأنف أو من خلال الجلد. وتتمثل ميزة هذه الأدوية في أن اللقاح يدخل عبر بوابة دخول العدوى وبالتالي يحفز المناعة المحلية في تلك الأعضاء التي تكون أول من يتعرض للهجوم من قبل الكائنات الحية الدقيقة.
اللقاحات العلاجية
تم تصميم اللقاحات التقليدية للوقاية من المرض: يتم إعطاء اللقاح لشخص سليم من أجل "تسليح" الجسم مسبقًا بوسائل مكافحة العدوى (الاستثناء هو لقاح داء الكلب الذي طوره باستير، والذي يستخدم بعد عضته من قبل حيوان مسعور تفسر فعاليته بفترة الحضانة الطويلة لهذا المرض الفيروسي). لكن في الآونة الأخيرة، تغير الموقف تجاه اللقاحات فقط كإجراء وقائي. ظهرت اللقاحات العلاجية - الأدوية التي تحفز الاستجابة المناعية لدى المرضى وبالتالي تساهم في الشفاء أو تحسين الحالة. تستهدف هذه اللقاحات الأمراض المزمنة التي تسببها البكتيريا أو الفيروسات (وخاصة فيروسات التهاب الكبد B وC، وفيروس الورم الحليمي، وفيروس نقص المناعة البشرية)، والأورام (في المقام الأول سرطان الجلد، وسرطان الثدي أو سرطان القولون والمستقيم)، وأمراض الحساسية أو المناعة الذاتية (التصلب المتعدد، والسكري من النوع الأول، والتهاب المفاصل الروماتويدي).
يتم الحصول على اللقاحات العلاجية الموجودة لعلاج الأمراض الالتهابية المزمنة التي تسببها البكتيريا أو الفيروسات باستخدام الطرق الكلاسيكية. تعمل مثل هذه اللقاحات على تعزيز تطور المناعة ضد الكائنات الحية الدقيقة التي تحتوي عليها وتنشيط المناعة الفطرية.
واحدة من أهم الأهداف لمطوري اللقاحات العلاجية هي الإصابة بفيروس نقص المناعة البشرية. وقد تم بالفعل إجراء سلسلة من التجارب السريرية وما قبل السريرية للعديد من الأدوية. إن قدرتها على تحفيز تطور المناعة الخلوية لدى الأشخاص الأصحاء أمر لا شك فيه. ومع ذلك، لا يوجد دليل مقنع على أن اللقاحات تمنع تكاثر الفيروس لدى المرضى.
ترتبط الآمال الكبيرة في علاج الاضطرابات المناعية في السرطان باللقاحات الجذعية. وهي مصنوعة على أساس الخلايا الجذعية - وهو نوع خاص من خلايا الدم البيضاء التي تبحث عن الكائنات الحية الدقيقة التي يحتمل أن تكون خطرة. الخلايا الجذعية "تقوم بدورية"، في المقام الأول، الأغشية المخاطية والجلد، أي الأعضاء التي تتلامس مع البيئة الخارجية. بعد مواجهة بكتيريا أو فيروس ممرض، تمتص الخلايا الجذعية الجسم الغريب وتستخدم بروتينات المستضد الخاصة به لتنشيط جهاز المناعة لمحاربة العدو.
إجراءات إنتاج لقاح شجيري هي كما يلي: يتم عزل الخلايا التي تؤدي إلى ظهور الخلايا الجذعية من دم المريض ومضاعفتها في المختبر. وفي الوقت نفسه، يتم عزل بروتينات المستضد من ورم المريض. يتم الاحتفاظ بالخلايا الجذعية لبعض الوقت مع مستضدات الورم حتى تتذكر صورة العدو، ثم يتم حقنها في المريض. هذا التحفيز لجهاز المناعة يجبر الجسم على محاربة الورم بشكل فعال.
يمكن استخدام اللقاحات التغصنية لعلاج الأورام العفوية والأورام المرتبطة بالفيروسات. أظهرت النتائج الأولى لاختبار لقاحات السرطان التغصنية على البشر (في مجموعات صغيرة من مرضى المرحلة الرابعة) عدم ضرر هذه اللقاحات، وفي بعض الحالات تم تسجيل تأثير سريري إيجابي.
في الفئران، تساعد اللقاحات التغصنية على منع تكرار الإصابة بالسرطان بعد إزالة الورم. وهذا يتيح لنا أن نأمل أن تكون فعالة في إطالة فترة خلو مرضى السرطان من الأمراض بعد الجراحة.
في القرن العشرين، تم تحديد نجاحات علم اللقاحات، في المقام الأول، من خلال الانتصارات على عدوى خطيرة أخرى. ومع تطور فهمنا لعمل الجهاز المناعي، يتوسع نطاق اللقاحات باستمرار. ومن المأمول أن تساعد اللقاحات في القرن الحادي والعشرين في تقليل حالات الإصابة بمرض السكري والتهاب عضلة القلب وتصلب الشرايين وغيرها من الأمراض "غير المعدية". يجري تطوير أدوية الوقاية المناعية والعلاج المناعي للسرطان على قدم وساق. في المستقبل - إنشاء وسائل الحماية المناعية ضد إدمان المخدرات والتدخين، وتصميم لقاحات لعلاج والوقاية من الحساسية وأمراض المناعة الذاتية.
راجع الموضوع في نفس الموضوع
السؤال 1. ما هو فضل إ. جينر و إل. باستور في اختراع اللقاح؟
اخترع إدوارد جينر (1749-1823) أول لقاح. ولاحظ وجود مناعة ضد الجدري لدى النساء المصابات بجدري البقر. قام جينر بتطعيم (14 مايو 1769) جيمس فيبس البالغ من العمر 8 سنوات بمرض جدري البقر، وبعد شهر ونصف أصابه بالجدري البشري الطبيعي: الصبي لم يمرض. ومن خلال تكرار الإصابة بالفايبس بعد عدة أشهر وسنوات، أثبت جينر إمكانية وفعالية عالية للتطعيم ضد الجدري.
كان عالم الأحياء الدقيقة الفرنسي لويس باستور (1822-1895) أول من اقترح أنه إذا كان من الممكن إضعاف الكائنات الحية الدقيقة لدرجة أنها لا يمكن أن تسبب سوى شكل خفيف من المرض، فإن الشخص الذي عانى من مثل هذا المرض سيكون محميًا من الميكروبات الكاملة. التي تسبب نفس المرض. وقد أكدت التجارب هذه الفكرة.
السؤال 2: لماذا لا يوفر لقاح الحصبة مناعة ضد الكزاز؟
التطعيم ضد الحصبة لا يوفر مناعة ضد الكزاز، لأن جميع اللقاحات والأمصال محددة، أي. لديك اتجاه صارم للعمل.
السؤال 3. ما هي الحساسية وكيف تحدث؟
حساسية- هذه زيادة حساسية الجسم للمواد المختلفة - مسببات الحساسية، والتي تتجلى في أعراض مرض الحساسية. يعاني ما يصل إلى 25% من سكان المناطق الصناعية من نوع ما من أمراض الحساسية. تتزايد حالات الحساسية وشدتها بشكل مطرد في جميع أنحاء العالم. لا يتأثر جسم الإنسان وجهازه المناعي بالكائنات الحية الدقيقة ومنتجاتها الأيضية فحسب، بل يتأثر أيضًا بالمنتجات الغذائية، وإلى حد كبير، بالمواد الكيميائية. في عصرنا من التقدم العلمي والتكنولوجي، يتم تصنيع عدد كبير من المواد الكيميائية: المنظفات والأدوية والمضافات الغذائية والأصباغ وما إلى ذلك. عند دخول جسم الإنسان، حتى بكميات صغيرة جدا، يمكن أن تسبب ردود فعل قوية. قد تكون هناك حساسية تجاه الروائح المختلفة والغبار وشعر الحيوانات الأليفة والأطعمة الطبيعية (الفراولة والبرتقال والبيض والشوكولاتة وما إلى ذلك). يتجلى في شكل العطس وسيلان الأنف الشديد والسعال والقيء (ردود الفعل الوقائية) وتهيج الجلد والدموع. تحاول دفاعات الجسم وجهازه المناعي التخلص من المواد الغريبة عن طريق الجلد والأغشية المخاطية وما إلى ذلك.
الوقاية من الحساسية تتكون من الحفاظ على نظام غذائي سليم ومتوازن. إن تغذية الأطفال بلبن الأم يقوي المناعة الفطرية الطبيعية بشكل كبير. يعد أسلوب الحياة الصحي وجدول العمل والراحة المناسبين مفيدًا أيضًا.
السؤال 4. لماذا يعتبر عدم توافق الأنسجة عائقا أمام زراعة الأعضاء؟
السبب الذي يشكل عائقًا أمام زراعة الأعضاء هو عدم توافق الأنسجة. بدوره، سبب عدم توافق الأنسجة هو رد فعل مناعي. تختلف الأنسجة الأجنبية في التركيب الكيميائي الحيوي عن أنسجة المريض الذي تم زرعها فيه. ونتيجة لذلك، يُنظر إلى بعض المركبات الكيميائية في الأنسجة على أنها مستضدات في الجسم.
السؤال 5. ما هي فصائل الدم لدى البشر؟
لدى الإنسان أربع فصائل دم: الأولى (I)، والثانية (II)، والثالثة (III)، والرابعة (IV). الأشخاص الذين يعانون من فصيلة الدم I ليس لديهم راصات (مواد لاصقة) في كريات الدم الحمراء لديهم، وتحتوي بلازماهم على كلا النوعين من الراصات (يتم تحديدها بأحرف الأبجدية اليونانية - ألفا وبيتا؛ الراصات هي مواد لاصقة). وفي هذا الصدد، تم تعيين هذه المجموعة أيضًا على أنها صفر (0). الأشخاص الذين لديهم فصيلة الدم 0 (حوالي 40٪ من هؤلاء الأشخاص) هم متبرعون عالميون، لكن لا يمكن نقلهم هم إلا بدم من المجموعة 0. يتم تفسير ذلك من خلال حقيقة أن مجموعة الدم O لا يمكن أن "تلتصق ببعضها البعض" (يسمى هذا التفاعل التراص): فهو لا يحتوي على مواد لزجة - مواد راصة. تحتوي خلايا الدم الحمراء من المجموعة الثانية (المجموعة أ) على الراصات A، وتحتوي البلازما على الراصات بيتا. في كريات الدم الحمراء من المجموعة الثالثة (المجموعة ب) يوجد aglutinogen B، وفي البلازما - aglutinin alpha. لا يمكن نقل دم الأشخاص من المجموعتين الثانية والثالثة إلا إلى الأشخاص الذين لديهم نفس فصيلة الدم، أو إلى الأشخاص الذين لديهم فصيلة الدم الرابعة. تحتوي خلايا الدم الحمراء من المجموعة الرابعة (المجموعة AB) على الراصات A وB؛ لا توجد راصات في بلازما فصيلة الدم هذه. الأشخاص الذين لديهم فصيلة الدم IV (حوالي 6٪) هم متلقون عالميون، حيث يمكن نقلهم بالدم من جميع المجموعات الأربع.
بالإضافة إلى ذلك، عند نقل الدم، من الضروري أن تأخذ في الاعتبار عامل Rh (عامل Rh). ويوجد هذا العامل في خلايا الدم الحمراء لدى 86% من الأشخاص. يسمى دم هؤلاء الأشخاص بـ Rh إيجابي. إذا تم نقل هذا الدم إلى الأشخاص الذين يكون دمهم سلبيًا (لا يحتوي على عامل Rh)، فسيتم تشكيل راصات خاصة ومواد تدمر خلايا الدم الحمراء في دمائهم. سيؤدي نقل الدم المتكرر للدم الإيجابي إلى تكتل خلايا الدم الحمراء وتحللها (انحلال الدم) وقد يؤدي إلى الوفاة. لهذا السبب يجب على كل شخص أن يعرف فصيلة دمه ونوع الدم - Rh إيجابي أم سلبي.
السؤال 6. كيف يمكن تفسير الصراع بين الجنين ذو العامل الريسوسي الإيجابي والكائن الأم ذو العامل الريسوسي السلبي؟
إذا كان دم الجنين موجباً، فهذا يعني أن خلايا الدم الحمراء لديه تحتوي على بروتين خاص يسمى "عامل Rh" (كما تم اكتشافه لأول مرة في خلايا الدم الحمراء لدى قرود الريسوس). بالنسبة للمرأة التي لديها عامل Rh سلبي ولا يوجد لديها مثل هذا البروتين، يكون بروتين Rh الخاص بالجنين غريبًا. ويبدأ جسدها في إنتاج الأجسام المضادة له. عندما تتراكم، يحدث صراع Rh، مصحوبا بتدمير خلايا الدم الحمراء الجنينية.
الأسئلة في بداية الفقرة.
السؤال 1. ماذا يفعل علم المناعة؟
علم المناعة هو العلم الذي يهتم بدراسة المناعة.
السؤال 2. كيف ظهرت اللقاحات والأمصال العلاجية؟
السؤال 3. كيف تختلف المناعة الاصطناعية عن المناعة الطبيعية؟
وتشمل المناعة الاصطناعية المناعة النشطة المكتسبة بعد التطعيم (إعطاء اللقاح) والمناعة السلبية المكتسبة (حقن المصل). وتشمل المناعة الطبيعية المناعة الفطرية والمناعة النشطة المكتسبة (بعد المرض). وأيضا سلبي في نقل الأجسام المضادة للطفل من الأم.
السؤال 4. لماذا تحدث الحساسية؟
يمكن أن يكون سبب حدوث رد فعل تحسسي أسباب عديدة، أهمها: استنشاق المواد المسببة للحساسية، في أغلب الأحيان الغبار، حبوب اللقاح النباتية؛ الاتصال مع فراء الحيوانات. المنتجات الغذائية (البيض، المياه العذبة، الفواكه، الخضروات، الأسماك، الحليب، المواد الكيميائية، إلخ)؛ الأدوية (الأدوية المضادة للبكتيريا بشكل رئيسي من سلسلة البنسلين والسيفترياكسون) ؛ زغب الحور تعتبر الحساسية تجاه الشمس شائعة جدًا، والتي تتجلى في شكل طفح جلدي واسع النطاق أو فردي أو متعدد، يشبه خلايا النحل ذات لون أحمر ساطع؛ اضطراب نفسي عاطفي أو إجهاد شديد. لدغات الحشرات (البراغيش، البعوض، القراد، الذباب، إلخ)؛ زهور.
السؤال 5. ما هو توافق الأنسجة ولماذا يجب مراعاة فصيلة دم المتبرع والمريض أثناء نقل الدم؟
جرت محاولات زرع الأنسجة من شخص إلى آخر منذ فترة طويلة. ومع ذلك، حتى مع نجاح العملية، يتم رفض الأنسجة المزروعة بعد مرور بعض الوقت. وكان السبب رد فعل مناعي. كان التركيب الكيميائي الحيوي للأنسجة الأجنبية مختلفًا بعض الشيء عن أنسجة المريض الذي تم زرعها فيه. وكان هذا كافياً لكي يُنظر إلى بعض المركبات الكيميائية في الأنسجة على أنها مستضدات في الجسم.
كلما قل عدد الأنسجة المزروعة التي تحتوي على مستضدات، زادت فرصة تجذرها. ولذلك، فإن المهمة الأولى للجراحين هي العثور على الأشخاص الذين تتوافق أنسجتهم. هناك طريقة أخرى لزراعة الأنسجة وهي قمع الاستجابة المناعية باستخدام أدوية خاصة.
الأسئلة في نهاية الفقرة.
السؤال 1. ما هو فضل إ. جينر و إل. باستور في اختراع اللقاح؟
اخترع إدوارد جينر (1749-1823) أول لقاح. ولاحظ وجود مناعة ضد الجدري لدى النساء المصابات بجدري البقر. قام جينر بتطعيم (14 مايو 1769) جيمس فيبس البالغ من العمر 8 سنوات بمرض جدري البقر، وبعد شهر ونصف أصابه بالجدري البشري الطبيعي: الصبي لم يمرض. ومن خلال تكرار الإصابة بفايبس بعد عدة أشهر وسنوات، أثبت جينر إمكانية وفعالية عالية للتطعيم ضد الجدري.
كان عالم الأحياء الدقيقة الفرنسي لويس باستور (1822-1895) أول من اقترح أنه إذا كان من الممكن إضعاف الكائنات الحية الدقيقة لدرجة أنها لا يمكن أن تسبب سوى شكل خفيف من المرض، فإن الشخص الذي عانى من مثل هذا المرض سيكون محميًا من الميكروبات الكاملة. التي تسبب نفس المرض. وقد أكدت التجارب هذه الفكرة.
السؤال 2: لماذا لا يوفر لقاح الحصبة مناعة ضد الكزاز؟
التطعيم ضد الحصبة لا يوفر مناعة ضد الكزاز، لأن جميع اللقاحات والأمصال محددة، أي أن لها اتجاه صارم للعمل.
السؤال 3. ما هي الحساسية وكيف تحدث؟
الحساسية هي زيادة حساسية الجسم لمختلف المواد - مسببات الحساسية، والتي تتجلى في أعراض مرض الحساسية. يعاني ما يصل إلى 25% من سكان المناطق الصناعية من نوع ما من أمراض الحساسية. تتزايد حالات الحساسية وشدتها بشكل مطرد في جميع أنحاء العالم. عندما يدخل مسبب للحساسية إلى الجسم، فإنه يسبب رد فعل مناعي. ترتبط الأجسام المضادة بجدران الأوعية الدموية وخلايا الأنسجة والأعضاء المختلفة. عندما يدخل مسبب الحساسية الجسم مرة ثانية، تشكل هذه الأجسام المضادة مجمعات من الأجسام المضادة للمستضد معه. يؤدي ذلك إلى إطلاق مواد تلحق الضرر بالخلايا التي ترتبط بها هذه الأجسام المضادة. يحدث احمرار وحكة وعلامات تهيج أخرى. على سبيل المثال، يؤدي تهيج الغشاء المخاطي للأنف إلى سيلان الأنف والعطس، ويؤدي تهيج الغشاء المخاطي للقصبات الهوائية إلى السعال وزيادة إنتاج البلغم. المواد المثيرة للحساسية هي: المنزلية (غبار المنزل، برغوث الماء)، البشرة (وبر وشعر الحيوانات، الريش، قشور السمك)، المواد المسببة للحساسية من سم الحشرات، المواد الغذائية، الطبية، المعدية، الصناعية، حبوب اللقاح.
السؤال 4. لماذا يعتبر عدم توافق الأنسجة عائقا أمام زراعة الأعضاء؟
السبب الذي يشكل عائقًا أمام زراعة الأعضاء هو عدم توافق الأنسجة. بدوره، سبب عدم توافق الأنسجة هو رد فعل مناعي. تختلف الأنسجة الأجنبية في التركيب الكيميائي الحيوي عن أنسجة المريض الذي تم زرعها فيه. ونتيجة لذلك، يُنظر إلى بعض المركبات الكيميائية في الأنسجة على أنها مستضدات في الجسم.
السؤال 5. ما هي فصائل الدم لدى البشر؟
لدى الإنسان أربع فصائل دم: الأولى (I)، والثانية (II)، والثالثة (III)، والرابعة (IV).
السؤال 6. كيف يمكن تفسير الصراع بين الجنين ذو العامل الريسوسي الإيجابي والكائن الأم ذو العامل الريسوسي السلبي؟
إذا كان دم الجنين موجباً، فهذا يعني أن خلايا الدم الحمراء لديه تحتوي على بروتين خاص يسمى "عامل Rh" (كما تم اكتشافه لأول مرة في خلايا الدم الحمراء لدى قرود الريسوس). بالنسبة للمرأة التي لديها عامل Rh سلبي ولا يوجد لديها مثل هذا البروتين، يكون بروتين Rh الخاص بالجنين غريبًا. ويبدأ جسدها في إنتاج الأجسام المضادة له. عندما تتراكم، يحدث صراع Rh، مصحوبا بتدمير خلايا الدم الحمراء الجنينية.
ويبين الشكل 48 عملية تحضير مضاد سموم الخناق، والذي يتكون من أجسام مضادة تعمل على تحييد سم الخناق.
أنظر إلى الصورة وأجب عن الأسئلة:
ما هو الموجود في الدورق الذي يتم إعطاء محتوياته للحصان عدة مرات مع زيادة الجرعة تدريجياً؟
يحتوي الدورق على سم الخناق، الذي يتم حقنه في الحصان، مع زيادة الجرعة تدريجياً.
ماذا يحدث في جسم الحصان استجابة لاعطاء هذه المادة؟
تتشكل مضادات السموم في جسم الحصان - مواد مضادة لسم الدفتيريا.
كيف يتم معالجة دم الحصان لإنتاج مضاد سم الخناق؟
يتم تحرير الدم من العناصر المشكلة، ويتم الحصول على بلازما الدم، وإزالة الفيبرينوجين.
في أي الحالات يتم استخدام مضاد سموم الخناق؟
يستخدم مضاد ذيفان الخناق للسيطرة على الخناق لدى البشر.
ما هو نوع المناعة التي تم تطويرها لدى المريض الذي تم إعطاؤه مضاد سم الدفتيريا؟
تم تطوير مناعة سلبية اصطناعية.