يعرض المقال نتائج الدراسات التجريبية حول اختيار الطريقة وتطوير تقنية التحديد الكمي للفيلوكوينون (فيتامين K1) في النباتات. تم إثبات ميزة الطريقة الكروماتوغرافية (HPLC ذات الطور العكسي) على الطريقة الطيفية في تحديد الفيلوكوينون في تركيبة المواد النشطة بيولوجيًا النباتية. ووفقاً لتوصيات المؤتمر الدولي لمواءمة المتطلبات الفنية لتسجيل المستحضرات الصيدلانية للاستخدام البشري، تم التحقق من صحة المنهجية المطورة من حيث الخصوصية والخطية والاستنساخ والدقة. وقد وجد أن الطريقة المقترحة محددة وخطية وقابلة للتكرار ودقيقة. باستخدام مثال المواد الخام الدوائية التي تحتوي على فيتامين K1، تم إثبات عالمية تطبيق الطريقة في تحليل الكائنات النباتية.
فيلوكينون
فيتامين ك1
أوراق نبات القراص
لحاء الويبرنوم
أعمدة الذرة مع الوصمات
عشب محفظة الراعي
تصديق
1. Abyshev A.Z. تخليق وخصائص ومراقبة جودة مستحضرات الفيتامينات والمواد الشبيهة بالفيتامينات: دليل تعليمي / A.Z. تروسوف، ن. كوتوفا، M. P. بلينوفا. - سان بطرسبرج. : دار النشر SPFKhA، 2010. – 136 ص.
2. GOST R ISO 5725-2002 "دقة (صحة ودقة) طرق القياس والنتائج" في 6 ساعات - مقدمة. 23/04/02. - م.: Gosstandart من روسيا؛ دار نشر المواصفات، 2002.
3. دستور الأدوية الحكومي لاتحاد الجمهوريات الاشتراكية السوفياتية. المجلد. 2 الطرق العامة للتحليل. المواد الخام النباتية الطبية / وزارة الصحة في اتحاد الجمهوريات الاشتراكية السوفياتية. - الطبعة الحادية عشرة، إضافة. – م.، 1989. – 400 ص.
4. معايير الاحتياجات الفسيولوجية للطاقة والمواد الغذائية لمختلف مجموعات سكان الاتحاد الروسي. التوصيات المنهجية MP 2.3.1.2432 -08
5. نوسوف أ.م. نباتات طبية. – م: مطبعة EKSMO، 1999. – 350 ص.
6. بوجودين إ.س.، لوكشا إ.أ. تطوير طريقة للتقدير الكمي لاكتونات السيسكويتيربين في عشبة سوسوريا المر // المشكلات الحديثة للعلوم والتعليم. - 2013. - رقم 1؛ عنوان URL: www.site/107-8426
مقدمة
ينتمي فيتامين K إلى فئة الفيتامينات القابلة للذوبان في الدهون والتي تؤثر على نظام مرقئ. تشتمل الفيتامينات الطبيعية من المجموعة K على نوعين من مركبات الكينويد الميثلية مع سلاسل جانبية تمثلها وحدات الأيزوبرنويد: الفيتامينات K1 و K2. يعتمد هيكل هذه الفيتامينات على نظام 1،4-نفثوكوينون. يتم تصنيع فيتامين K1 (فيلوكينون) بواسطة جميع الكائنات الحية التي تقوم بعملية التمثيل الضوئي. يتم تصنيع فيتامين ك 2 (ميناكينون) بواسطة البكتيريا الموجودة في الأمعاء الغليظة. الدور البيولوجي للفيتامينات K هو تنشيط عوامل التخثر وأنظمة منع التخثر في الثدييات.
حاليًا، تبلغ الحاجة الفسيولوجية لفيتامين K للبالغين 120 ميكروجرامًا في اليوم وللأطفال من 30 إلى 75 ميكروجرامًا في اليوم.
في الممارسة الطبية، يتم استخدام المستحضرات العشبية التي تحتوي على فيلوكينون لتصحيح المضاعفات النزفية. يتضمن دستور الأدوية الحكومي للإصدار الحادي عشر الأنواع التالية من المواد الخام النباتية الطبية التي لها تأثير مرقئ يعتمد على فيتامين K: لحاء الويبرنوم (Cortex Viburni)، والأعمدة التي تحتوي على حرير الذرة (Styli cum stigmatis Zeae maydis)، وأوراق نبات القراص (Folia Urticae) )، عشبة كيس الراعي ( Herba Bursae Pastoris ). لقد ثبت أن فيتامين ك 1 موجود أيضًا في أعشاب اليارو والنعناع والأعشاب العقدية والأعشاب العقدية، مما يحدد إمكانية استخدام هذه المواد الخام لنزيف المعدة والرحم والبواسير. لا يوجد لدى دستور الأدوية الحكومي حاليًا طرق لتحديد مادة الفيلوكينون في المواد النباتية. لتقييم جدوى استخدام المواد النباتية الطبية كمصادر لفيتامين K1، هناك مشكلة ملحة تتمثل في حل قضايا توحيد وتطوير الأساليب التي تهدف إلى تحديد محتوى فيلوكينون في الكائنات النباتية.
الهدف من العمل: تطوير طريقة لتحديد فيتامين K1 في المواد النباتية الطبية.
المواد وطرق البحث
كانت أهداف الدراسة هي الأنواع الرسمية من المواد النباتية الطبية: لحاء الويبرنوم، والأعمدة التي تحتوي على حرير الذرة، وأوراق نبات القراص، وعشب الراعي. تم شراء جميع أنواع المواد الخام من خلال سلاسل الصيدليات. استند اختيار الطريقة العقلانية لتحديد فيتامين K1 إلى تقييم خصائص التحقق التي تم الحصول عليها باستخدام طرق التحليل الكروماتوغرافي والطيفي. لتطوير طريقة للتقدير الكمي للفيلوكينون في المواد الخام النباتية، استخدمنا طريقة تحليل كروماتوجرافيا عالي الضغط عالي الأداء ذو المرحلة العكسية (HPLC) مع كاشف مصفوفة الصمام الثنائي على جهاز Shimadzu LC-20 Prominence في الوضع الإيزوقراطي. في ظل الشروط التالية: عمود تحليلي مملوء بمادة ماصة PerfectSil 300 ODS C18، مقاس 4.6 × 250 مم، بحجم جسيم يبلغ 5 ميكرون؛ تكوين الطور المتحرك: أسيتونتريل-أيزوبروبانول-ماء بنسبة 75:20:5؛ الكشف عند طول موجة 254 نانومتر؛ درجة حرارة العمود - درجة حرارة الغرفة؛ سرعة الطور المتحرك 1 مل/دقيقة؛ حجم العينة المحقونة هو 20 ميكرولتر. تم تقييم النتائج من خلال وقت الاحتفاظ (t r) للفيلوكينون ، والذي تزامن مع مؤشر t r PSO (20.00 ± 1.00 دقيقة) وبمنطقة الذروة للفيلوكينون. تمت معالجة النتائج باستخدام برنامج LC Solutions.
تم إجراء القياس الطيفي لمحتوى فيتامين K 1 على جهاز UNICO 2802S في كفيت كوارتز بطبقة سمكها 1 سم.
تمت معالجة النتائج باستخدام برنامج STATISTICA 8.0. لوصف النتائج التي تم الحصول عليها، بعد التحقق من طبيعية التوزيع، قيم المتوسط (X avg)، الانحراف المعياري (S)، الانحراف المعياري النسبي (RSD)، التشتت (S 2)، فاصل الثقة للمتوسط تم إعطاء (Δx avg) عند مستوى الأهمية α = 0.05.
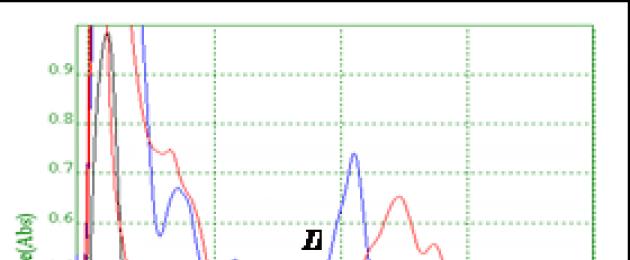
تم استخدام عينة قياسية عاملة (RSS) من فيتامين K1، المعزولة بواسطة كروماتوجرافيا العمود التحضيري من مستخلص الهكسان من أوراق نبات القراص اللاذع، كعينة قياسية. عينة العمل القياسية عبارة عن سائل زيتي أصفر لزج وغير جاف، وغير قابل للذوبان عمليًا في الماء، وقابل للذوبان في المذيبات العضوية والزيوت النباتية، ونقطة الانصهار -20 درجة مئوية. يتم عرض الخصائص الطيفية لمحلول الكحول لعينة قياسية عاملة (بعد إزالة الهكسان) في الشكل. 1.
أرز. 1. الطيف المرئي للأشعة فوق البنفسجية لمحلول RSO phylloquinone (فيتامين K1).
لتعظيم استخلاص فيتامين K1 من العينات المدروسة، تم اختيار معايير تحضير العينة التالية: درجة طحن المواد الخام، نوع المستخلص، النسب الكمية للمواد الخام والمستخلص، وقت وتكرار الاستخلاص، درجة الحرارة وظروف الإضاءة. اِستِخلاص.
النتائج والمناقشة. ومن أجل تطوير طريقة عقلانية لتحديد محتوى فيتامين ك1، تم اختيار شروط استخلاصه من المواد الخام. كانت أوراق نبات القراص بمثابة كائن لتطوير المنهجية. مع الأخذ بعين الاعتبار عدم ثبات مادة الفيلوكينون لتأثيرات الطاقة الضوئية، فقد أجريت جميع مراحل الدراسة تحت ظروف شملت حماية المستخلصات من الضوء. تم تحديد اكتمال الاستخراج بواسطة HPLC بواسطة منطقة الذروة مع t r 20.00 ± 2.00 دقيقة. نتيجة لتقييم تأثير عوامل تحضير العينة على اكتمال استخلاص الفيلوكوينون، تم اختيار المعلمات والشروط التالية: طحن المواد الخام - مرور الجزيئات عبر منخل بقطر ثقب يبلغ 0.5 مم؛ مستخرج - الهكسان. النسبة الكمية "المواد الخام: المستخلص" - 1:25؛ التعرض مرة واحدة لمدة 60 دقيقة؛ نظام درجة الحرارة - درجة حرارة الغرفة (20-22 درجة مئوية).
لتطوير طريقة لتحديد فيتامين K 1 في النباتات باستخدام الطريقة الطيفية، تم إجراء تحليل مقارن لأطياف الامتصاص للمستخلصات من المواد الخام الدوائية (الشكل 2) ومحلول RSO phylloquinone (الشكل 1) سابقًا. ونتيجة لذلك وجد أنه من غير الممكن إثبات وجود فيتامين K1 في المادة الخام باستخدام الحد الأقصى المرجعي (249 نانومتر)، وذلك بسبب عدم وجود هذا الحد الأقصى في طيف جميع الكائنات المدروسة. وبالتالي، فإن طريقة تحديد فيتامين K1 في المجمع الكلي للمواد النشطة بيولوجيًا للمواد الخام النباتية بواسطة الطريقة الطيفية المباشرة لا يمكن في البداية التحقق من صحتها بشكل إيجابي من حيث "الخصوصية". من الممكن زيادة خصوصية الطريقة عند استخدام القياس الطيفي إذا تم استخراج فيلوكينون منقى من المادة الخام، الأمر الذي يتطلب إدخال معالجات تحضيرية إضافية في مرحلة إعداد عينة كائن البحث. التنقية الإضافية للاستخلاص قد تؤثر سلباً على سرعة ودقة التقنية في النتيجة النهائية.

الشكل 2 - أطياف الامتصاص للمستخلصات من المواد النباتية الطبية التي تحتوي على فيلوكينون (Kr - أوراق نبات القراص، K - لحاء الويبرنوم، Ku - أعمدة مع حرير الذرة، P - عشب محفظة الراعي)
الخيار الأكثر قبولًا لتحديد فيتامين K1 في المواد النباتية هو استخدام طريقة تحليل كروماتوجرافيا عالي الضغط عالي الأداء عالي الطور (HPLC) مع كاشف مصفوفة الصمام الثنائي. بناءً على المعلمات المطورة لإعداد عينات المواد الخام للتحليل، تم تطوير التقنية التالية: يتم سحق العينة التحليلية للمواد الخام إلى حجم جسيم يمر عبر منخل به فتحات يبلغ قطرها 0.5 مم. يتم وضع حوالي 1.0 جرام (وزن دقيق) من المادة الخام المسحوقة في دورق مخروطي بسعة 50 مل، مملوء بـ 25 مل من الهكسان، ومغطى ويقلب على شاكر ميكانيكي لمدة 60 دقيقة. يتم ترشيح المستخلص من خلال مرشح ورقي في دورق دائري القاع ويتم تقطير الهكسان على المبخر الدوار. يتم نقل المادة المتبقية كميًا إلى دورق حجمي سعة 5 مل (مقياس البيكنومتر) باستخدام 4 مل من الإيثانول. أحضر حجم المحلول إلى العلامة بنفس المذيب واخلطه. يتم إدخال 0.02 مل من المحلول في الكروماتوجراف.
إعداد عينة قياسية: أضف 4 مل من الإيثانول إلى 0.0005 جم (وزنه بالضبط) من فيلوكينون RSO ونقله إلى دورق حجمي سعة 5 مل. أحضر حجم المحلول إلى العلامة باستخدام المذيب واخلطه. يتم إدخال 0.02 مل من المحلول في الكروماتوجراف.
![]() يتم حساب محتوى فيلوكينون (X) في المواد الخام الجافة تمامًا كنسبة مئوية باستخدام الصيغة:
يتم حساب محتوى فيلوكينون (X) في المواد الخام الجافة تمامًا كنسبة مئوية باستخدام الصيغة:
حيث S o هي منطقة الذروة في الرسم اللوني لمحلول RSO phylloquinone؛ S هي مساحة ذروة الفيلوكينون في اللوني لمحلول الاختبار؛ m o - الجزء الموزون من RSO phylloquinone، بالجرام؛ م - وزن المواد الخام بالجرام ؛ ث - فقدان الوزن أثناء تجفيف المواد الخام، في المائة؛ P هو محتوى فيلوكينون في RSO phylloquinone، في٪.
استناداً إلى نتائج التحديد الكمي للفيلوكينون بواسطة HPLC عكسي الطور، تم تحديد محتوى فيتامين K1 في أوراق نبات القراص (الجدول 1).
الجدول 1 - الخصائص المترولوجية لطريقة التحديد الكمي للفيلوكينون في أوراق نبات القراص (٪) (العدد = 6)
|
Xsr ± Δxsr |
||||||
|
0.00425 ± 0.00021 |
نظرًا لانخفاض محتوى فيتامين K1 في المواد الخام، نقترح إجراء الحسابات بـ mg%، لذلك من الضروري إجراء تغييرات على صيغة الحساب لتحويل وحدات القياس (g إلى mg):
![]()
تم إجراء تقييم التحقق من صحة الطريقة وفقًا للمؤشرات التالية: الخصوصية والخطية والدقة (الاستنساخ) والدقة.
النوعية. تم تأكيد تحديد فيلوكينون من خلال مصادفة وقت الاحتفاظ بالمكون الذي تم تحليله في المادة الخام و RSD للفيلوكينون (الشكل 3). يتم فصل قمم المركبات المرتبطة المتضمنة في مستخلصات المواد النباتية بشكل جيد عن قمة الفيلوكوينون ولا تؤثر على التحديد التحليلي.

أرز. 3. اللوني لمستخلص أوراق نبات القراص (A - الذروة 17، tr = 20.37 دقيقة يتوافق مع فيلوكينون) وعينة قياسية من فيلوكينون (B - الذروة 22، tr = 20.71 دقيقة)
تم التأكد من الخطية والمدى التحليلي للطريقة من خلال تحليل 7 عينات بتراكيز مختلفة تتراوح بين 13 إلى 417% من التركيز (0.12 ملجم/مل)، مأخوذة على أنها 100%. أظهرت مقارنة العلاقة بين محتوى الفيلوكينون (مجم/مل) في محاليل الاختبار ومناطق الذروة الكروماتوغرافية أنها خطية ويتم وصفها بالمعادلة y = 5104417.9 x + 10944.88. معامل الارتباط (rxy) هو 0.999، مما يسمح باستخدام هذه التقنية للتقدير الكمي للفيلوكينون في الكائنات النباتية في نطاق التركيز من 0.016 إلى 0.5 ملغم / مل.
تم تحديد التكاثر (الدقة) من خلال إجراء تحليل بواسطة محللين مختلفين (اثنين) على نفس الدفعة من المواد الخام في أوقات مختلفة. عدد التكرارات لكل محلل هو 3، إجمالي عدد التكرارات هو 6. يجب ألا يتجاوز الانحراف المعياري النسبي، معبرًا عنه كنسبة مئوية (RSD، %)، 5%. ووفقا لنتائج الدراسات، كان تحديد وضع اللاجئ 1.21٪، وهو ما يميز موثوقية التحليل في ظل الظروف المختارة (الجدول 2).
الجدول 2 - نتائج تحديد دقة الطريقة
|
تكرار |
المحلل |
محدد في العينة، mg% |
الخصائص المترولوجية |
|
|
زاف = 4.00525 ملغ% S = 0.04850 ملغ% |
||||
لتحديد دقة هذه التقنية، تم تحليل عينات من أوراق نبات القراص من دفعة واحدة من المواد الخام في 3 مستويات من العينات (0.5، 1.0 و 1.5 جم)، وأخذ العينات ثلاث مرات لكل مستوى. تم تحديد محتوى فيتامين K1 بالملغ في عينة من المواد الخام. تم حساب القيمة المتوقعة (النظرية) مبدئيًا بناءً على متوسط محتوى فيتامين K1 الموجود في أوراق نبات القراص، وهو ما يعادل 4.1 ملجم٪. وتمت مقارنة القيمة النظرية بالقيمة الفعلية. ولتقييم النتائج التي تم الحصول عليها، استخدمنا مؤشر "المعدل المفتوح" (R)، والذي تم قبول معيار القبول له في حدود 98-102% من القيمة المحسوبة.
الجدول 3 - نتائج تحديد دقة التقنية
|
وزن المواد الخام, |
فِعلي |
مُقدَّر |
قابلية الانفتاح |
المترولوجية صفات |
||||
أظهرت نتائج تحديد دقة التقنية، الموضحة في الجدول 3، أن معدل الفتح R هو 98.73%، والانحراف المعياري النسبي (RSD) لا يتجاوز 5%، مما يميز دقة التقنية بأنها مرضية.
وهكذا، فقد ثبت أن الطريقة المقترحة للتقدير الكمي لفيتامين K1 بواسطة HPLC في أوراق نبات القراص هي طريقة محددة وقابلة للتكرار ودقيقة. تم استنساخ هذه التقنية لتحديد فيتامين K1 في أنواع أخرى من المواد النباتية الطبية (الجدول 4).
الجدول 4 - محتوى فيتامين K1 (ملجم%) في المواد النباتية الطبية
|
كائن (ن = 6) |
Xsr ± Δxsr |
||||
|
أعمدة مع حرير الذرة |
|||||
|
عشب محفظة الراعي |
|||||
|
لحاء الويبرنوم |
أظهرت الدراسات التي أجريت جدوى استخدام طريقة HPLC عكسية الطور لتقدير مادة الفيلوكوينون في المواد النباتية. وتتمثل ميزة طريقة HPLC في القدرة على تقييم المحتوى النوعي والكمي للفيلوكينون في عينة واحدة من المواد الخام، مما يوفر بشكل كبير الوقت الذي يقضيه في التحليل. يمكن استخدام الطريقة المطورة لتحديد محتوى فيتامين K1 في الكائنات النباتية.
المراجعون:
جريشين إيه في. دكتوراه في العلوم الصيدلانية، أستاذ، رئيسا. قسم الصيدلة، مؤسسة الموازنة الحكومية التعليمية للتعليم المهني العالي أكاديمية أومسك الطبية الحكومية التابعة لوزارة الصحة الروسية، أومسك.
بينيفسكايا ن. دكتوراه في العلوم الطبية، أستاذ مشارك، رئيس. قسم التكنولوجيا الصيدلانية مع دورة في التكنولوجيا الحيوية، المؤسسة التعليمية لميزانية الدولة للتعليم المهني العالي أكاديمية أومسك الطبية الحكومية التابعة لوزارة الصحة الروسية، أومسك.
الرابط الببليوغرافي
Luksha E.A.، Pogodin I.S.، Kalinkina G.I.، Kolomiets N.E.، Velichko G.N. تطوير طريقة للتحديد الكمي للفيلوكوينون (فيتامين K1) في الكائنات النباتية // المشاكل الحديثة للعلوم والتعليم. – 2014. – رقم 3.;عنوان URL: http://science-education.ru/ru/article/view?id=13736 (تاريخ الوصول: 02/09/2019). نلفت انتباهكم إلى المجلات التي تصدرها دار النشر "أكاديمية العلوم الطبيعية"
الخبرة 1.التحديد الكمي لفيتامين C.
مبدأ الطريقة. تعتمد الطريقة على قدرة فيتامين C على اختزال 2,6-ثنائي كلورو فينوليندوفينول، الذي يكون له لون أحمر في البيئة الحمضية ويتغير لونه عند الاختزال؛ في بيئة قلوية اللون أزرق. ولحماية فيتامين C من التدمير، يعاير محلول الاختبار في وسط حمضي بمحلول قلوي مكون من 2،6-ثنائي كلوروفينوليندوفينول حتى يظهر اللون الوردي.
لحساب محتوى حمض الأسكوربيك في منتجات مثل الملفوف والبطاطس وإبر الصنوبر ووركين الورد وما إلى ذلك، استخدم الصيغة:
أين X– محتوى حمض الاسكوربيك بالملليجرام لكل 100 جرام من المنتج; 0.088 – محتوى حمض الاسكوربيك، ملغ؛ أ– نتيجة المعايرة بمحلول 0.001 ن من 2,6-ثنائي كلورو فينوليندوفينول، مل؛ ب -حجم المستخلص المأخوذ للمعايرة، مل؛ في -كمية المنتج المأخوذ للتحليل، ز؛ ز- المبلغ الإجمالي للمستخلص، مل؛ 100 – تحويل لكل 100 جرام من المنتج.
الخلاصة: اكتب نتائج التجربة والبيانات المحسوبة.
تجربة 1.1. تحديد محتوى فيتامين C في الملفوف.
ترتيب العمل.
وزن 1 جرام من الملفوف، وطحنه في الهاون مع 2 مل من محلول حمض الهيدروكلوريك 10٪ (حمض الهيدروكلوريك - حمض الهيدروكلوريك، حمض الهيدروكلوريك، حمض الهيدروكلوريك)، أضف 8 مل من الماء وقم بالتصفية. قم بقياس 2 مل من الراشح للمعايرة، وأضف 10 قطرات من محلول حمض الهيدروكلوريك 10٪ وقم بالمعايرة باستخدام 2،6-ثنائي كلورو فينوليندوفينول حتى يستمر اللون الوردي لمدة 30 ثانية، بناءً على ذلك مبدأ الطريقةتفاعلات. احسب محتوى حمض الأسكوربيك في 100 جرام من الملفوف باستخدام الصيغة المذكورة أعلاه. يحتوي 100 جرام من الملفوف على 25-60 ملجم من حمض الأسكوربيك، و100 جرام من ثمر الورد 500-1500 ملجم، وإبر الصنوبر 200-400 ملجم.
تجربة 1.2. تحديد محتوى فيتامين C في البطاطس.
ترتيب العمل.
زن 5 جرام من البطاطس، واطحنها في الهاون مع 20 قطرة من محلول حمض الهيدروكلوريك 10٪ (حتى لا تصبح البطاطس داكنة). أضف الماء المقطر تدريجياً - 15 مل. تُسكب الكتلة الناتجة في كوب، ويُشطف الملاط بالماء، ويُسكب فوق قضيب زجاجي في كوب ويُعاير بـ 0.001 N. محلول 2،6-ثنائي كلوروفينوليندوفينول إلى اللون الوردي، بناءً على ذلك مبدأ الطريقةتفاعلات. يحتوي 100 جرام من البطاطس على 1-5 ملجم من فيتامين سي.
الخلاصة: أكتب نتائج التجربة.
تجربة 1.3. تحديد محتوى فيتامين C في البول.
تحديد محتوى فيتامين C في البول يعطي فكرة عن مخزون هذا الفيتامين في الجسم، حيث أن هناك توافقاً بين تركيز فيتامين C في الدم وكمية هذا الفيتامين التي تفرز في البول. ومع ذلك، مع نقص فيتامين C، لا يتم تقليل محتوى حمض الأسكوربيك في البول دائمًا. وهو غالبا ما يكون طبيعيا، على الرغم من النقص الكبير في هذا الفيتامين في الأنسجة والأعضاء.
في الأشخاص الأصحاء، يؤدي تناول 100 ملغ من فيتامين C عن طريق الفم بسرعة إلى زيادة تركيزه في الدم والبول. في حالة نقص فيتامين C، تحتفظ الأنسجة التي تفتقر إلى فيتامين C بفيتامين C المبتلع ولا يزيد تركيزه في البول. يحتوي بول الشخص السليم على 20-30 ملغ من فيتامين C أو 113.55-170.33 ميكرومول/اليوم. عند الأطفال، ينخفض \u200b\u200bمستوى هذا الفيتامين مع مرض الإسقربوط، وكذلك الأمراض المعدية الحادة والمزمنة.
تعتمد طرق التحديد الكمي للفيتامينات على خواصها الفيزيائية والكيميائية، مثل خصائص الأكسدة والاختزال والقدرة على التألق في ضوء الأشعة فوق البنفسجية. يتم استخدام طرق تحديد مختلفة: قياس المعايرة، قياس الألوان الضوئية، قياس الطيف الضوئي، قياس الفلور، إلخ.
التحديد الكمي لفيتامين ك
يتم تحديد فيتامين K الموجود في أوراق نبات القراص بطريقة SFM (الجدول 3).
الجدول 3. التقدير الكمي لفيتامين K في أوراق نبات القراص (طريقة المؤلف)
التحديد الكمي للمواد النشطة بيولوجيا في الوركين الوردية.
حمض الاسكوربيكيمكن تحديده بطريقة المعايرة، التي تعتمد على اختزال 2،6-ثنائي كلوروفينوليندوفينول. يمكن استخدام نفس الكاشف لتقدير اللونية الضوئية لحمض الأسكوربيك. للقيام بذلك، قم باستخراج المادة الخام بحمض الميتافوسفوريك 2٪ وأضف محلول 2،6-ثنائي كلوروفينوليندوفينول. بعد 35 ثانية. إجراء قياس الألوان الضوئية. بالتوازي، يتم قياس لون محلول تحكم مكون من 2% من حمض الميتافوسفوريك مع 2،6-ثنائي كلورو فينوليندوفينول. تتناسب كثافة اللون مع كمية حمض الأسكوربيك.
يمكن إجراء التحديد الكمي لحمض الأسكوربيك بواسطة طريقة قياس الألوان الضوئية باستخدام سداسي سيانوفيريت البوتاسيوم. في البيئة الحمضية، يقوم حمض الأسكوربيك باختزال هيكسسيانوفيريت البوتاسيوم إلى هيكسسيانوفيرات البوتاسيوم، والذي، في وجود أيونات الحديد (III)، يشكل اللون الأزرق البروسي، يليه قياس الألوان الضوئية.
تعتمد طريقة التقدير الكمي لحمض الأسكوربيك (وفقًا لـ SP XI، الإصدار 2، ص 294) على قابليته للأكسدة إلى شكل ديهيدرو بواسطة محلول 2،6-ثنائي كلورو فينوليندوفينولات واختزال الأخير إلى الليوكو. استمارة. يتم تحديد نقطة التكافؤ من خلال ظهور اللون الوردي، مما يشير إلى عدم وجود عامل اختزال، أي حمض الأسكوربيك (2،6-ثنائي كلوروفينوليندوفينول له لون أزرق في بيئة قلوية، أحمر في بيئة حمضية، ويصبح متغير اللون عند تخفيض):


1. تحديد محتوى حمض الاسكوربيك. (الجدول 4). من عينة تحليلية من الفاكهة مسحوقة تقريبًا، خذ عينة تزن 20 جرامًا، وضعها في ملاط خزفي، حيث يتم طحنها جيدًا بمسحوق زجاجي (حوالي 5 جرام)، ثم أضف 300 مل من الماء تدريجيًا، واتركها لمدة 10 دقائق. ثم يتم تقليب الخليط وتصفية المستخلص. أضف 1 مل من الراشح الناتج، 1 مل من محلول حمض الهيدروكلوريك 2٪، 13 مل من الماء في دورق مخروطي بسعة 100 مل، قم بالخلط والمعايرة من السحاحة الدقيقة بمحلول الصوديوم 2،6-ثنائي كلورو فينوليندوفينولات ( 0.001 مول/لتر) حتى يظهر اللون الوردي الذي لا يختفي لمدة 30-60 ثانية. يستمر المعايرة لمدة لا تزيد عن دقيقتين. في حالة التلوين المكثف للمرشح أو المحتوى العالي من حمض الأسكوربيك [استهلاك محلول الصوديوم 2،6-ثنائي كلوروفينوليندوفينولات (0.001 مول/لتر) أكثر من 2 مل]، الذي تم الكشف عنه عن طريق المعايرة الاختبارية، يتم تخفيف المستخلص الأصلي بالماء. 2 مرات أو أكثر.

حيث 0.000088 هي كمية حمض الأسكوربيك المقابلة لـ 1 مل من محلول 2,6-ثنائي كلوروفينوليندوفينولات الصوديوم (0.001 مول/لتر)، بالجرام؛ V هو حجم محلول 2,6-ثنائي كلورو فينوليندوفينولات الصوديوم (0.001 مول/لتر) المستخدم في المعايرة، بالملليلتر؛ م هي كتلة المواد الخام بالجرام. ث- فقدان الوزن عند تجفيف المواد الخام كنسبة مئوية.
ملحوظات. تحضير محلول 2,6-ثنائي كلوروفينوليندوفينولات الصوديوم (0.001 مول/لتر): يتم إذابة 0.22 جم من 2,6-ثنائي كلوروفينوليندوفينولات الصوديوم في 500 مل من الماء المغلي والمبرد حديثًا مع الرج بقوة (لإذابة العينة، يتم طحن المحلول غادر بين عشية وضحاها). يتم ترشيح المحلول في دورق حجمي سعة 1 لتر ويتم ضبط حجم المحلول حسب العلامة مع الماء. لا تزيد مدة صلاحية المحلول عن 7 أيام إذا تم تخزينه في مكان بارد ومظلم.
تحديد العنوان. يتم إذابة عدة بلورات (3-5) من حمض الأسكوربيك في 50 مل من محلول حمض الكبريتيك 2٪؛ تتم معايرة 5 مل من المحلول الناتج من السحاحة الدقيقة بمحلول الصوديوم 2،6-ثنائي كلوروفينوليندوفينولات حتى يظهر اللون الوردي الذي يختفي خلال 1-2 أسبوع. تتم معايرة 5 مل أخرى من نفس محلول حمض الأسكوربيك بمحلول يودات البوتاسيوم (0.001 مول/لتر) في وجود عدة بلورات (حوالي 2 مجم) من يوديد البوتاسيوم و2-3 قطرات من محلول النشا حتى يظهر اللون الأزرق. . يتم حساب عامل التصحيح باستخدام الصيغة:

حيث V هو حجم محلول يودات البوتاسيوم (0.001 مول/لتر) المستخدم للمعايرة، بالملليلتر؛ V1 هو حجم محلول 2،6-ثنائي كلوروفينوليندوفينولات الصوديوم المستخدم في المعايرة، بالملليلتر.
2. تحديد محتوى الأحماض العضوية الحرة. يتم سحق عينة تحليلية من المواد الخام إلى حجم جسيم يمر عبر منخل ذو فتحات يبلغ قطرها 2 مم. يوضع 25 جرام من ثمر الورد المسحوق في دورق بسعة 250 مل، ويسكب مع 200 مل من الماء ويحفظ لمدة ساعتين في حمام مائي مغلي، ثم يبرد، وينقل كمياً إلى دورق حجمي بسعة 250 مل. ، يتم ضبط حجم الاستخلاص حسب العلامة مع الماء وخلطه. خذ 10 مل من المستخلص، ضعه في دورق بسعة 500 مل، أضف 200-300 مل من الماء المغلي الطازج، 1 مل من محلول كحول 1٪ من الفينول فثالين، 2 مل من محلول 0.1٪ من الميثيلين الأزرق ثم عاير بمحلول هيدروكسيد الصوديوم (0.1 مول/لتر) حتى يظهر اللون الأرجواني المحمر في الرغوة.

حيث 0.0067 هي كمية حمض الماليك المقابلة لـ 1 مل من محلول هيدروكسيد الصوديوم (0.1 مول/لتر)، بالجرام؛ V هو حجم محلول هيدروكسيد الصوديوم (0.1 مول/لتر) المستخدم في المعايرة، بالملليلتر؛ م هي كتلة المواد الخام بالجرام. ث- فقدان الوزن عند تجفيف المواد الخام كنسبة مئوية.
الجدول 4. التحديد الكمي لحمض الأسكوربيك في الوركين الوردية (طريقة دستور الأدوية)
التقدير الكمي للمواد الكيميائية في زهور القطيفة.
الكاروتينات يتم تحديدها في المواد الخام الطبية بطريقة القياس اللوني الضوئي التي تعتمد على قياس شدة لونها الطبيعي. تم تطوير طريقة طيفية لتقدير الكاروتينات. يتم استخلاص الكاروتينات من المادة الخام مع الأثير البترولي، ثم كروماتوجرافيا على صفيحة سيلوفول في نظام الإيثر والبنزين والميثانول البترولي (60:15:4)، ويتم التصفية باستخدام الكلوروفورم وقياس الطيف الضوئي عند طول موجي 464 نانومتر (- كاروتين) عند 456 نانومتر (بيتا كاروتين).
- 1. يتم وضع حوالي 1 جرام (وزن دقيق) من زهور القطيفة المسحوقة، المنخلة من خلال منخل بفتحات 1 مم، في دورق مخروطي بسعة 250 مل، ويضاف 50 مل من الكحول بنسبة 70٪، ويغطى الدورق، يتم وزنه (بخطأ ± 0.01 جم) ويترك لمدة ساعة واحدة، ثم يتم توصيل الدورق بمكثف راجع، يتم تسخينه، مع الحفاظ على غليان منخفض لمدة ساعتين. بعد التبريد، يتم إغلاق الدورق بالمحتويات مرة أخرى يتم وزن السدادة ويتم تعويض الخسارة في الكتلة بمذيب. يتم رج محتويات الدورق جيدًا وتصفيتها من خلال مرشح ورقي جاف، مع التخلص من أول 20 مل في دورق جاف سعة 200 مل (المحلول أ).
- يوضع 1 مل من محلول A في دورق حجمي سعة 25 مل، ويضاف 5 مل من محلول كلوريد الألومنيوم، ويضاف 0.1 مل من حمض الأسيتيك ويضبط حجم المحلول إلى العلامة مع كحول 96% ويترك لمدة 40 دقيقة (المحلول). ب).
بعد 40 دقيقة، قم بقياس الكثافة البصرية لمحلول الاختبار B ومحلول العينة القياسي B 1 على مقياس الطيف الضوئي عند الحد الأقصى للامتصاص عند طول موجة (408 + 2) نانومتر في كفيت بسمك طبقة 10 مم، باستخدام المحاليل المرجعية لـ حل الاختبار والعينات القياسية.
حيث: A هي الكثافة البصرية لمحلول الاختبار؛
A o هي الكثافة البصرية لمحلول عينة قياسية من الروتين؛
أ - عينة من المواد الخام، ز؛
أ - الجزء الموزون من العينة القياسية للروتين، ز؛
ث - رطوبة المواد الخام،٪؛
يُسمح بتحديد محتوى إجمالي مركبات الفلافونويد باستخدام معدل الامتصاص المحدد للروتين.
الخصائص التحفيزية للموضوع
تتطلب التغذية البشرية العقلانية التوازن ليس فقط في محتوى البروتينات والدهون والكربوهيدرات، ولكن أيضًا في محتوى المغذيات الدقيقة. تشير نتائج دراسة التغذية الفعلية لمختلف المجموعات السكانية إلى انتشار كبير لنقص الفيتامينات ونقص المعادن الأساسية والألياف الغذائية. لا يمكن القضاء على نقص المغذيات الدقيقة بمجرد زيادة تناول الطعام. تؤدي ظروف المعيشة والعمل الحديثة لغالبية السكان إلى انخفاض في تكاليف الطاقة، مما يستلزم تقليل كمية الطعام المستهلكة ويستلزم استهلاكًا غير كافٍ للمغذيات الدقيقة الموجودة فيه. إن معرفة المظاهر السريرية لنقص المغذيات الدقيقة، ومصادر الفيتامينات والمعادن والألياف الغذائية في النظام الغذائي، وطرق الحفاظ على قيمة الفيتامينات في الأطعمة، وطرق التحصين الوقائي، تسمح للطبيب بتحسين الحالة التغذوية للمرضى.
هدف الدرس: التعرف على الدور البيولوجي والتقنين ومصادر المغذيات الدقيقة والألياف الغذائية في التغذية؛ تعليم كيفية تحديد التركيب الكيميائي للنظام الغذائي بناءً على محتوى الفيتامينات والمعادن والألياف الغذائية باستخدام طريقة الحساب (باستخدام مثال تحليل تخطيط القائمة للنظام الغذائي اليومي لطالب الطب)، وطرق تخزين الفيتامينات وطهيها الغذاء والتحصين الوقائي.
العمل المستقل للطلاب في الفصول الدراسية
1. تحديد التركيب النوعي للنظام الغذائي اليومي للطالب بناءً على محتوى الفيتامينات والمعادن والألياف الغذائية عن طريق طريقة الحساب (وفقًا لتخطيط القائمة الذي تم تجميعه للموضوع 3.2.) باستخدام "جداول التركيب الكيميائي وقيمة الطاقة للأغذية منتجات."
2. حل المشكلات الظرفية الموجهة بشكل احترافي من نوعين، وتوثيق الحل في البروتوكول.
3. العمل المعملي لتحديد محتوى فيتامين C في الخضار. 3.1. تحديد محتوى فيتامين C في البطاطس النيئة والمسلوقة؛ حساب نسبة فقدان فيتامين C أثناء الطهي.
3.2. تحديد محتوى فيتامين C في الملفوف. حساب نسبة فقدان فيتامين C أثناء التخزين.
4. الاستماع ومناقشة الملخصات التي أعدها الطلاب
حسب التعليمات الفردية للمعلم.
مهمة التحضير الذاتي
1. الدور البيولوجي، التقنين، مصادر الفيتامينات القابلة للذوبان في الماء في التغذية.
2. الدور البيولوجي والتقنين ومصادر الفيتامينات التي تذوب في الدهون في التغذية.
3. أنواع نقص الفيتامينات.
4. أسباب نقص الفيتامين ومظاهره.
5. تقنيات الحفاظ على قيمة الفيتامينات في الوجبات الغذائية وزيادتها والوقاية من نقص الفيتامين.
6. الدور البيولوجي، التقنين، مصادر المعادن في التغذية.
7. الدور البيولوجي والتقنين ومصادر الألياف الغذائية في التغذية.
بروتوكول العمل المستقل
"______"____________20___
الجدول 46
التكوين النوعي للنظام الغذائي اليومي للطالب
| أسماء أطباق القائمة ومجموعة المنتجات لكل وجبة | الوزن (جرام | الفيتامينات | المعادن | الألياف الغذائية، ز | ||||||||
| مع ملغ | في ملغ | في ملغ | ميكروغرام | د ميكروغرام | كاليفورنيا ملغ | ف ملغ | ك ملغ | الحديد ملغ | ي ميكروجرام | |||
| إفطار: | ||||||||||||
| الفطور الثاني: | ||||||||||||
| عشاء: | ||||||||||||
| عشاء: | ||||||||||||
| في اليوم الإجمالي: |
2. حل مشكلة ظرفية (النوع 1) رقم____
__________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________
__________________________________________________________________
حل مشكلة ظرفية (النوع 2) رقم ___
__________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________
__________________________________________________________________
3. تحديد محتوى فيتامين C في الخضار:
نوع المنتج _____________، وزن المنتج ____________ جم،
الكمية 0.0001ن. محلول حمض اليوديك البوتاسيوم المستخدم للتيتانيوم
تحضير العينة _____مل؛
صيغة الحساب:
أ) البطاطس النيئة _______ م، البطاطس المسلوقة _______ مجم،
فقدان فيتامين سي أثناء الطهي _________%
ب) الملفوف ______ ملغ، متوسط محتوى الملفوف _____ ملغ،
فقدان فيتامين C أثناء التخزين _____٪.
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
لقد أنجزت العمل __________________
توقيع المعلم _____________
المواد المرجعية
تعريفات الموضوع
الفيتامينات - الاستنزاف الكامل لموارد الفيتامينات في الجسم.
مضادات الفيتامينات - مركبات تستبعد الفيتامينات جزئيًا أو كليًا من تفاعلات التمثيل الغذائي في الجسم عن طريق تدميرها أو تعطيلها أو منع استيعابها. تنقسم مضادات الفيتامينات إلى مجموعتين:
أ) مركبات شبيهة بالبنية (مثبطات تنافسية؛ تدخل في علاقات تنافسية مع الفيتامينات أو مشتقاتها في التفاعلات الأيضية البيوكيميائية المقابلة)، وتشمل هذه السلفوناميدات، والديكومارين، والميغافين، والأيزونيازيد، وما إلى ذلك.
ب) مركبات مختلفة هيكليا (الفيتامينات الطبيعية؛ المواد
والتي، عن طريق تغيير الجزيء أو المركب المعقد مع المستقلبات، تحرم الفيتامين جزئيًا أو كليًا من عمله)، وتشمل هذه الثياميناز، الأسكوربيناز، الأفيدين، إلخ.
الفيتامينات عبارة عن مركبات عضوية منخفضة الجزيئات ذات نشاط بيولوجي مرتفع ضروري للحياة الطبيعية، والتي لا يتم تصنيعها (أو يتم تصنيعها بكميات غير كافية) في الجسم وتدخل الجسم مع الطعام. الدور البيولوجي الفيتامينات القابلة للذوبان في الماءيتم تحديدها من خلال مشاركتها في بناء الإنزيمات المساعدة المختلفة ، الفيتامينات القابلة للذوبان في الدهون- في السيطرة على الحالة الوظيفية لأغشية الخلايا والهياكل التحت خلوية.
الفيتامينات المضادة: ب1 وب2؛ أ و د؛ حمض النيكوتينيك والكولين. الثيامين والكولين (مع تناول أحد الفيتامينات على المدى الطويل للأغراض الطبية، يتم اكتشاف أعراض نقص الآخر).
الفيتامينات التآزرية: C وP؛ ص، ق، ك؛ ب12 وحمض الفوليك؛ ق، ك، ب 2؛ أ و ه. E والإينوزيتول (عند استخدامهما معًا في مستحضرات الفيتامينات المتعددة، يمكن أن يعزز كل منهما التأثير البيولوجي للآخر). نقص الفيتامين - انخفاض حاد في إمداد الجسم بفيتامين أو آخر.
ليس للشكل الخفي (الكامن) لنقص الفيتامينات أي مظاهر أو أعراض خارجية، إلا أنه يؤثر سلبًا على الأداء، ومقاومة الجسم لمختلف العوامل الضارة، ويطيل فترة التعافي بعد المرض.
الألياف الغذائية - الكربوهيدرات ذات الوزن الجزيئي العالي (السليلوز، الهيمسيلولوز، البكتين، اللجنين، الكيتين، وما إلى ذلك) من أصل نباتي بشكل رئيسي، مقاومة للهضم والامتصاص في الأمعاء الدقيقة، ولكنها تخضع للتخمر الكامل أو الجزئي في الأمعاء الغليظة.
أهم أسباب نقص الفيتامينات والفيتامينات
1. عدم تناول كمية كافية من الفيتامينات من الطعام.
1.1. انخفاض محتوى الفيتامينات في النظام الغذائي.
1.2. تقليل الكمية الإجمالية للأغذية المستهلكة بسبب انخفاض استهلاك الطاقة.
1.3. فقدان وتدمير الفيتامينات أثناء المعالجة التكنولوجية للمنتجات الغذائية وتخزينها وطهيها غير العقلاني
يعالج.
1.4. الانحرافات عن الصيغة الغذائية المتوازنة (في الغالب تتطلب التغذية بالكربوهيدرات كميات إضافية من الثيامين؛
مع عدم كفاية إدخال البروتينات الكاملة، تفرز الفيتامينات C، PP، B1 بسرعة في البول، ولا تشارك في عمليات التمثيل الغذائي، ويتأخر تحويل الكاروتين إلى فيتامين أ).
1.5. فقدان الشهية.
1.6. وجود الفيتامينات في بعض المنتجات بشكل غير قابل لإعادة التدوير (الإينوزيتول على شكل فيتين الموجود في منتجات الحبوب).
2. تثبيط البكتيريا المعوية التي تنتج بعض الفيتامينات (ب 6، ك).
2.1. أمراض الجهاز الهضمي.
2.2. عواقب العلاج الكيميائي (dysbiosis).
3. انتهاك استيعاب الفيتامينات.
3.1. ضعف امتصاص الفيتامينات في الجهاز الهضمي
لأمراض المعدة والأمعاء وآفات الجهاز الكبدي الصفراوي وكذلك في الشيخوخة (ضعف إفراز الصفراء الضروري لامتصاص الفيتامينات التي تذوب في الدهون).
3.3. انتهاك عملية التمثيل الغذائي للفيتامينات وتشكيل أشكالها النشطة بيولوجيا (الإنزيم المساعد) في الأمراض المختلفة، وعمل العوامل السامة والمعدية، والعلاج الكيميائي، وفي الشيخوخة.
4. زيادة الحاجة للفيتامينات.
4.1. الظروف الفسيولوجية الخاصة للجسم (النمو المكثف، الحمل، الرضاعة).
4.2. الظروف المناخية الخاصة (تزداد الحاجة إلى الفيتامينات بنسبة 30-60٪ بسبب زيادة استهلاك الطاقة عند درجات حرارة الهواء المنخفضة في المنطقة المناخية بالشمال).
4.4. حمولة نفسية عصبية كبيرة، والظروف العصيبة.
4.5. التعرض لعوامل الإنتاج الضارة (العمال في المحلات الساخنة الذين يتعرضون لدرجات حرارة عالية /32 درجة/ مع ممارسة نشاط بدني متزامن يحتاجون إلى ضعف كمية فيتامينات C، B1، B6، وحمض البانتوثنيك مقارنة بـ 18 درجة).
4.6. الأمراض المعدية والتسممات (في حالات الإنتان الشديدة تصل حاجة الجسم لفيتامين سي إلى 300-500 ملغم يومياً).
4.7. أمراض الأعضاء الداخلية والغدد الصماء.
4.8. زيادة إفراز الفيتامينات.
5. الاضطرابات الخلقية المحددة وراثيا في عملية التمثيل الغذائي ووظائف الفيتامينات.
5.1. الاضطرابات الخلقية في امتصاص الفيتامينات.
5.2. الاضطرابات الخلقية في نقل الفيتامينات في الدم وعبر أغشية الخلايا.
5.3. الاضطرابات الخلقية في التركيب الحيوي للفيتامينات (حمض النيكوتينيك من التربتوفان).
5.4. الاضطرابات الخلقية في تحويل الفيتامينات إلى إنزيمات مساعدة
الأشكال والمجموعات الاصطناعية والأيضات النشطة.
5.5. انتهاك إدراج الفيتامينات في المركز النشط للإنزيم.
5.6. انتهاك بنية الإنزيم المساعد ، مما يعقد تفاعله مع الإنزيم المساعد.
5.7. انتهاك بنية الإنزيم المساعد، مما يؤدي إلى فقدان كامل أو جزئي للنشاط الأنزيمي، بغض النظر عن التفاعل مع الإنزيم المساعد.
5.8. زيادة تقويض الفيتامينات.
5.9. الاضطرابات الخلقية في إعادة امتصاص الفيتامينات في الكلى.
الجدول 47
(لكل 100 جرام جزء صالح للأكل)
| منتجات | في 1 | في 2 | ر.ر | في 6 | مع | ه | أ | في-كا-رو-تين | د | في 12 | حمض فو لي. | ||||
| ملغ/100 جرام | ميكروجرام/100 جم | ||||||||||||||
| خبز الجاودار | 0,18 | 0,11 | 0,67 | 0,17 | - | 2,2 | - | - | - | - | |||||
| خبز حنطة | 0,21 | 0,12 | 2,81 | 0,3 | - | 3,8 | - | - | - | - | |||||
| دقيق الشوفان. | 0,49 | 0,11 | 1,1 | 0,27 | - | 3,4 | - | - | - | - | |||||
| سميد | 0,14 | 0,07 | 1,0 | 0,17 | - | 2,5 | - | - | - | - | |||||
| جريش الأرز | 0,08 | 0,04 | 1,6 | 0,18 | - | 0,4 | - | - | - | - | |||||
| جريش الحنطة السوداء. | 0,53 | 0,2 | 4,19 | 0,4 | - | 6,6 | - | - | - | - | |||||
| الدخن | 0,62 | 0,04 | 1,55 | 0,52 | - | 2,6 | - | 0,15 | - | - | |||||
| معكرونة | 0,17 | 0,08 | 1,21 | 0,16 | - | 2,1 | - | - | - | - | |||||
| لحم | 0,07 | 0,18 | 3,0 | 0,39 | س | - | - | - | - | 2,8 | 8,9 | ||||
| لحم خنزير | 0,52 | 0,14 | 2,4 | 0,33 | س | - | - | - | - | - | 5,5 | ||||
| لحم كبد البقر | 0,3 | 2,19 | 6,8 | 0,7 | 1,3 | 3,8 | 1,0 | - | |||||||
| النقانق مسلوقة. | 0,25 | 0,18 | 2,47 | 0,19 | - | - | - | - | - | - | |||||
| دجاج | 0,07 | 0,15 | 3,6 | 0,61 | - | - | 0,1 | - | - | - | 5,8 | ||||
| بيض الدجاج | 0,07 | 0,44 | 0,2 | 0,14 | - | 0,3 | - | 4,7 | 0,1 | 7,5 | |||||
| سمك القد | 0,09 | 0,16 | 2,3 | 0,17 | س. | 0,9 | س. | - | - | 1,6 | 11,3 | ||||
| الكافيار سمك الحفش. | 0,3 | 0,36 | 1,5 | 0,29 | 7,8 | - | 0,2 | - | - | ||||||
| باستور الحليب . | 0,03 | 0,13 | 0,1 | - | 1,0 | - | س. | 0,01 | - | - | - | ||||
| الكفير | 0,03 | 0,17 | 0,14 | 0,06 | 0,7 | 0,1 | س. | 0,01 | - | 0,4 | 7,8 | ||||
| الكريمة الحامضة | 0,02 | 0,1 | 0,07 | 0,07 | 0,2 | 0,5 | 0,2 | 0,1 | 0,1 | 0,36 | 8,5 | ||||
| جبن | 0,04 | 0,27 | 0,4 | 0,11 | 0,5 | 0,4 | 0,1 | 0,03 | - | 1,0 | 35,0 | ||||
| أجبان صلبة | 0,02 | 0,3 | 0,3 | 0,1 | 1,6 | 0,5 | 0,2 | 0,1 | - | 2,5 | 10-45 | ||||
| سمنة | س | 0,01 | 0,1 | - | - | - | 0,5 | 0,34 | - | - | - | ||||
| يتم تكرير زيت عباد الشمس. | _ | - | - | - | - | - | - | - | - | - | |||||
| بازيلاء | 0,81 | 0,15 | 2,2 | 0,27 | - | 9,1 | - | 0,07 | - | - | |||||
| البطاطس | 0,12 | 0,05 | 0,9 | 0,3 | 0,1 | - | 0,02 | - | - | ||||||
| الملفوف الأبيض | 0,06 | 0,05 | 0,4 | 0,14 | 0,1 | - | 0,02 | - | - | ||||||
| بصل أخضر | 0,02 | 0,1 | 0,3 | 0,15 | - | - | - | ||||||||
| طماطم | 0,06 | 0,04 | 0,53 | 0,1 | 0,4 | - | 1,2 | - | - | ||||||
| خيار | 0,03 | 0,04 | 0,2 | 0,04 | 0,1 | - | 0,06 | - | - | ||||||
| الشمندر | 0,02 | 0,04 | 0,2 | 0,07 | 0,1 | - | 0,01 | - | - | ||||||
| جزرة | 0,06 | 0,07 | 0,13 | 0,6 | - | - | - | ||||||||
| الفطر بورسيني | 0,02 | 0,3 | 4,6 | 0,07 | 0,6 | - | - | - | - | ||||||
| تفاح | 0,01 | 0,03 | 0,3 | 0,08 | 0,6 | - | 0,03 | - | - | 1,6 | |||||
| المشمش | 0,03 | 0,06 | 0,07 | 0,05 | 0,9 | - | 1,6 | - | - | ||||||
| الكرز | 0,03 | 0,3 | 0,4 | 0,05 | 0,3 | - | 0,1 | - | - | ||||||
| توت العليق | 0,02 | 0,05 | 0,6 | 0,07 | 0,6 | - | 0,2 | - | - | ||||||
| فراولة | 0,03 | 0,05 | 0,3 | 0,06 | 0,5 | - | 0,03 | - | - | ||||||
| شجرة عنب الثعلب | 0,02 | 0,02 | 0,3 | 0,13 | 0,7 | - | 0,1 | - | - | ||||||
| النبق البحر | 0,1 | 0,05 | 0,6 | 0,11 | - | - | - | ||||||||
| ثمر الورد جاف. | 0,15 | 0,84 | 1,5 | - | - | - | 6,7 | - | - | - | |||||
| عنب | 0,05 | 0,02 | 0,3 | 0,09 | - | - | س. | - | - | ||||||
| ليمون | 0,04 | 0,02 | 0,1 | 0,06 | - | - | 0,01 | - | - | ||||||
| البرتقال | 0,04 | 0,03 | 0,2 | 0,06 | 0,2 | - | 0,05 | - | - | ||||||
| المعجنات والكعك | 0,75 | 0,1 | 0,7 | - | - | - | 0,1 | 0,14 | - | - | - | ||||
| يتم ضغط الخميرة. | 0,6 | 0,68 | 11,4 | 0,58 | - | - | - | - | - | - | |||||
غالبًا ما يتم إجراء التحديد الكمي لحمض الأسكوربيك في مادة الاختبار باستخدام محلول الصوديوم 2،6-ثنائي كلورفينوليندوفينول، وهو أزرق اللون في بيئة قلوية ووردي في بيئة حمضية. يمكن التعبير عن كيمياء التفاعل بالمعادلة التالية.
يعتمد مبدأ الطريقة على قدرة حمض الأسكوربيك على تقليل كاشف الإندوفينول. عندما تتم معايرة مستخلص مادة الاختبار بمحلول 2،6-ثنائي كلوروفينوليندوفينول، يتأكسد حمض الأسكوربيك إلى حمض ديهيدروأسكوربيك ويتم تقليل كاشف الإندوفينول. يمكن تحديد نهاية المعايرة عن طريق تغيير اللون. الشكل المؤكسد لـ 2,6-ثنائي كلوروفينوليندوفينول له لون أزرق في البيئات المحايدة والقلوية، بينما يكتسب الشكل المخفض لونًا ورديًا في البيئات الحمضية.
يتم استخلاص حمض الأسكوربيك من مادة الاختبار بمحلول 1% من حمض الهيدروكلوريك ومعايرته بمحلول كاشف الإندوفينول. بناءً على كمية الطلاء التي يتم إنفاقها عند المعايرة، يتم حساب محتوى حمض الأسكوربيك.
تجدر الإشارة إلى أن التحديد الدقيق لمحتوى حمض الأسكوربيك في الكائنات البيولوجية تعوقه مواد أخرى تتأكسد بسهولة: الجلوتاثيون والسيستين وما إلى ذلك.
7.7.1. تحديد محتوى فيتامين سي ب
المواد النباتية
خذ عينة من المادة قيد الدراسة، 5-20 جم (حسب المحتوى المتوقع لحمض الأسكوربيك)، مقطعة إلى قطع صغيرة (البطاطس، الجزر، الثوم البري، التفاح، إلخ)، طحنها جيدًا في الهاون مع قليل من الزجاج أو رمل الكوارتز، مع إضافة أجزاء من 4-5 مل من المحلول مع جزء كتلي من حمض الميتافوسفوريك أو حمض الهيدروكلوريك بنسبة 2٪ حتى يتم الحصول على ملاط سائل متجانس. يتم نقل الخليط من المونة كميا، باستخدام محلول الحمض المستخدم في الطحن، إلى دورق حجمي سعة 100 مل ويتم ضبط الحجم الإجمالي للمستخلص إلى العلامة باستخدام نفس المحلول الحمضي. يتم خلط المحتويات جيدًا، وتترك لمدة 5-7 دقائق ثم يتم ترشيحها من خلال مرشح ورقي. يجب أن يكون الترشيح الناتج شفافًا تمامًا.
الأحماض المستخدمة في الاستخلاص (الهيدروكلوريك، الميتافوسفوريك، الأكساليك) تستخرج كلا من حمض الأسكوربيك الحر والمقيد من المادة قيد الدراسة، كما تساهم في استقرار حمض الأسكوربيك في المستخلصات.
خذ دورقين مخروطيين بسعة 100-150 مل، وقم بوضع 20 مل من الراشح الناتج في أحدهما، و20 مل من المحلول الحمضي المستخدم لطحن مادة الاختبار في الآخر. تتم معايرة محتويات المخاريط باستخدام كاشف الإندوفينول حتى يستمر اللون الوردي الباهت لمدة 30 ثانية. يتم تسجيل النتائج وتكرار المعايرة بأجزاء جديدة من نفس الراشح. بناءً على متوسط القيمة التي تم الحصول عليها من 2-3 تقديرات، يتم حساب محتوى حمض الأسكوربيك باستخدام الصيغة:
![]() ,
,
(أ-ب)- الفرق بين أحجام كاشف الإندوفينول المستخدم لمعايرة العينات التجريبية (أ) والعينات الضابطة (ب)، مل؛
u هو الحجم الكلي للمستخلص، مل؛
u 1 - حجم الراشح المأخوذ للمعايرة، مل؛
م - كتلة المادة قيد الدراسة، ز،
100 - التحويل لكل 100 جرام من المادة.
تحتوي الأنسجة النباتية أيضًا في بعض الكميات على مواد مختزلة أخرى تقلل من 2،6-ثنائي كلورو فينوليندوفينول، لذلك إذا كان من الضروري إجراء تحليل دقيق بشكل خاص، فيجب أخذ ذلك في الاعتبار. للقيام بذلك، أضف 0.1 أو 0.2 مل من محلول كبريتات النحاس 10٪ إلى جزأين آخرين 10-20 مل من المستخلص قيد الدراسة وقم بتسخينه في منظم الحرارة أو الفرن لمدة 10 دقائق عند درجة حرارة 110 درجة مئوية. بارد وعاير مع كاشف الإندوفينول. في وجود أملاح النحاس وعند التسخين، يتم تدمير حمض الأسكوربيك بالكامل. يتم طرح التصحيح الناتج من بيانات المعايرة للعينات التجريبية.
عند تحليل العديد من الفواكه والتوت، يتم الحصول على بعض الخضروات، مقتطفات ملونة، مما يجعل تحديد حمض الاسكوربيك صعبا. لتحديد حمض الأسكوربيك، ينقل المستخلص الملون إلى أنبوب اختبار واسع، ويضاف 2-5 مل من ثنائي كلورو إيثان أو كلوروفورم ويعاير مع الرج بمحلول كاشف الإندوفينول حتى يظهر لون وردي في طبقة ثنائي كلورو إيثان أو الكلوروفورم، والذي لا يختفي. لمدة 30 ثانية.
عند التحديد، من الضروري مراعاة القدرة المخفضة للأحماض المستخدمة في الاستخلاص (خليط من 20 مل من حمض الهيدروكلوريك 1٪ و 80 مل من 2٪ حمض الميتافوسفوريك أو 1٪ حمض الأكساليك). للقيام بذلك، يتم معايرة جزأين سعة 10 مل من خليط الأحماض باستخدام كاشف الإندوفينول حتى يتحول إلى اللون الوردي. يتم طرح التصحيح الناتج (عادة لا يتجاوز 0.08-0.10 مل من محلول الطلاء) من بيانات معايرة المحاليل التجريبية.
|
الصوديوم 2،6-ديكلوروفينولينيندولفينول (حمض الأسكوربيك)
|
|
يتم حساب كتلة حمض الأسكوربيك (بالملجم) المقابلة لـ 1 مل من كاشف الإندوفينول (محلول الصوديوم 2،6-ثنائي كلوروفينوليندوفينول) باستخدام الصيغة:
حيث M هي كتلة حمض الأسكوربيك بالملغ، أي ما يعادل 1 مل من كاشف الإندوفينول؛
(u-u 1) - الفرق بين أحجام كاشف الإندوفينول المستخدم لمعايرة العينة بحمض الأسكوربيك (u) والعينة بدون حمض الأسكوربيك (u 1)، مل؛
2- كتلة حامض الاسكوربيك بالملغ الموجودة في العينة التجريبية (التجربة الرئيسية).
7.7.3. تحديد محتوى فيتامين ج في الحليب
لتحديد حمض الاسكوربيك في الحليب، يتم ترسيب البروتينات.
يُسكب 50 مل من الحليب في دورق ويُضاف 4 مل من محلول مشبع بحمض الأكساليك ويُرج ويُضاف 10 مل من محلول كلوريد الصوديوم المشبع ويُرج ويُترك في درجة حرارة الغرفة لمدة 5 دقائق. بعد ذلك يتم ترشيح محتويات الدورق من خلال مرشح ورقي مطوي، ويتم سحب 20 مل من المرشح ومعايرته باستخدام كاشف الإندوفينول حتى يستمر اللون الوردي الباهت لمدة 30 ثانية. خذ 20 مل أخرى من الراشح وكرر المعايرة. يتم استخدام النتيجة المتوسطة للحساب.
في الوقت نفسه، يتم إجراء تحديد التحكم، حيث يتم خلط 50 مل من الماء، 4 مل من محلول مشبع من حمض الأكساليك و 10 مل من محلول مشبع من كلوريد الصوديوم في قارورة. ثم تابع كما في التجربة الرئيسية.
![]() ,
,
أين (أ-ب)– الفرق بين أحجام كاشف الإندوفينول المستخدم لمعايرة العينات التجريبية والضابطة، مل؛
64 – الحجم الإجمالي للحليب بعد إضافة مرسبات البروتين والدهون؛
M - كتلة حمض الأسكوربيك المقابلة لـ 1 مل من كاشف الإندوفينول (انظر الفقرة 2.7.7)، ملغ؛
u هو حجم الراشح المأخوذ للمعايرة، مل؛
ش 1 - حجم الحليب المأخوذ للتحليل مل .
الكواشف. ماء مقطرة؛ حليب طازج؛ البطاطس (الليمون، الجزر، التفاح، الملفوف، الثوم البري، إلخ)؛ محلول بجزء كبير من حمض الميتافوسفوريك أو حمض الهيدروكلوريك 2٪؛ محلول حمض الأكساليك المشبع؛ محلول كلوريد الصوديوم المشبع؛ محلول قياسي طازج من حمض الأسكوربيك (يضاف 100 ملغ من حمض الأسكوربيك الطبي إلى دورق حجمي سعة 100 مل، وبعد الذوبان، يتم ضبط الحجم حسب العلامة بمحلول يحتوي على جزء كبير من حمض الميتافوسفوريك أو حمض الهيدروكلوريك بنسبة 2٪؛ كاشف الإندوفينول (يضاف إلى دورق حجمي سعة 500 مل 140-150 ملغ من الصوديوم 2,6-ثنائي كلوروفينوليندوفينول و200-300 مل من الماء، ويرج بقوة حتى يذوب الطلاء، ويضبط الحجم حسب العلامة مع الماء، ويخلط ويصفى من خلال مرشح الورق في قنينة زجاجية داكنة جافة، قم بتخزين المحلول في الثلاجة لمدة لا تزيد عن ثلاثة أيام.