L’importanza delle proteine per quasi ogni aspetto della vita è stata a lungo fuori dubbio. Tuttavia, i loro "fratellini" - i peptidi - hanno ricevuto immeritatamente poca attenzione, essendo solitamente considerati non così biologicamente importanti. No, nessuno dimentica il ruolo eccezionale dei peptidi nel sistema endocrino e nella protezione antibatterica. Tuttavia, anche vent’anni fa sarebbe stato impossibile sospettare che anche il “fondo” peptidico, presente in tutti i tessuti e tradizionalmente percepito come “frammenti” di proteine funzionali, svolga la sua funzione. I peptidi “ombra” formano un sistema globale di bioregolazione e omeostasi, forse più antico del sistema endocrino e nervoso.
All'inizio del 2010, con decreto del Presidium dell'Accademia russa delle scienze, il direttore dell'Istituto di chimica bioorganica prende il nome. Gli accademici M.M. Shemyakin e Yu.A. Ovchinnikova - Vadim Tikhonovich Ivanov - ha ricevuto la Grande Medaglia d'Oro dell'Accademia Russa delle Scienze intitolata a M.V. Lomonosov - "per il suo eccezionale contributo allo sviluppo della chimica bioorganica". All'assemblea generale dell'Accademia delle scienze russa nel maggio di quest'anno, V.T. Ivanov ha tenuto una conferenza sul ruolo dei peptidi come bioregolatori universali. Questo articolo è stato scritto sulla base della conferenza di Ivanov.
Le proteine, come postulato dai classici del materialismo dialettico, sono il principale “corpo lavoratore” della vita. Non per niente anche il libro di testo di biologia scolastica elenca le funzioni delle proteine in un elenco separato: catalitica, strutturale, protettiva, regolatoria, di segnalazione, di trasporto, di immagazzinamento, di recettore e motoria. Le prime proteine furono descritte nel XVIII secolo: erano l'albumina (albume d'uovo), la fibrina (una delle proteine del sangue) e il glutine (una proteina di deposito nel grano). Il ruolo centrale delle proteine in tutta la biologia fu compreso alla fine del primo quarto del XX secolo, e da allora nessuno ha più dubitato che assolutamente tutti i processi vitali avvengano con la partecipazione di queste universali “molecole della vita”.
Le proteine hanno anche "fratelli minori": i peptidi. La differenza tra queste due classi di molecole è abbastanza arbitraria: identiche nella natura chimica, differiscono solo per le dimensioni (la lunghezza della catena polipeptidica): se la molecola è composta da più di 50 residui amminoacidici, è una proteina, mentre se meno, è un peptide. Le funzioni “classiche” sopra elencate riguardano principalmente le proteine, mentre i peptidi hanno tradizionalmente avuto un ruolo nella regolazione endocrina: i peptidi biologici più conosciuti (e non ce ne sono molti) sono neuroormoni e neuroregolatori. I principali peptidi con una funzione nota nel corpo umano sono i peptidi della tachichinina, i peptidi intestinali vasoattivi, i peptidi pancreatici, gli oppioidi endogeni, la calcitonina e alcuni altri neuroormoni.
Inoltre, un importante ruolo biologico è svolto dai peptidi antimicrobici secreti sia dagli animali che dalle piante (presenti, ad esempio, nei semi o nel muco delle rane), nonché dagli antibiotici di natura peptidica, di cui parleremo poco dopo .
E non molto tempo fa (non più di trent'anni fa) si è scoperto che oltre a questi peptidi, che hanno funzioni molto specifiche, i tessuti degli organismi viventi contengono un "fondo" peptidico abbastanza potente, costituito principalmente da frammenti di strutture funzionali più grandi proteine. Per molto tempo si è creduto che questo non fosse di fondamentale importanza e che tali peptidi fossero solo “frammenti” di molecole funzionanti che il corpo non aveva ancora avuto il tempo di “ripulire”. Tuttavia, recentemente è diventato chiaro che questo "fondo" gioca un ruolo importante nel mantenimento dell'omeostasi (equilibrio biochimico dei tessuti) e nella regolazione di molti processi vitali di natura molto generale, come la crescita, la differenziazione e il ripristino cellulare. È anche possibile che il sistema di bioregolazione basato sui peptidi sia un “predecessore” evolutivo dei più moderni sistemi endocrini e nervosi.
Andiamo però con ordine e, per non perdere la prospettiva storica, iniziamo con una breve escursione nella storia dello studio delle sostanze peptidiche nel nostro Paese.
Contesto storico: scuola di peptidi in URSS
Divenne per molti anni il “biglietto da visita” dell'Istituto valinomicina- antibiotico ciclico depsipeptide da batteri Streptomyces fulvissimus, - la cui sintesi è stata effettuata da un team guidato da Ovchinnikov, dimostrando allo stesso tempo l'errore delle idee precedentemente esistenti sulla struttura di questa sostanza (Fig. 1). Si è scoperto che la valinomicina lo era ionoforo, cioè una sostanza che aumenta selettivamente la permeabilità di una membrana lipidica biologica per un certo tipo di ioni. Uno studio conformazionale della valinomicina e dei suoi complessi con gli ioni potassio (cioè li trasporta attraverso la membrana) ha permesso di formulare il meccanismo d'azione dell'antibiotico. Lo ione metallico, come in un braccialetto, viene posto al centro della cavità presente nella molecola ciclica e viene trasferito attraverso la membrana cellulare senza dispendio energetico, il che porta all’“azzeramento” del potenziale transmembrana del potassio e, in definitiva, alla la morte del microrganismo.
Figura 1. Ad un colloquio di laboratorio presso l'Istituto di Chimica dei Composti Naturali (1965). La struttura dell'antibiotico ciclico valinomicina è disegnata alla lavagna da V.T. Ivanov. I depsipeptidi, che comprendono la valinomicina, contengono, oltre ai legami peptidici “classici”, anche uno o più gruppi esterei.
Un brillante esempio di valinomicina e altri ionofori, oltre a una ricerca parallela negli Stati Uniti eteri della corona, capace anche di formare forti complessi con ioni metallici, diede origine a una serie di lavori in tutto il mondo che portarono alla creazione chimica dei contenitori basato sul concetto ospitante-ospite. Per il loro lavoro in questo campo, Donald Cram, Jean-Marie Lehn e Charles Pedersen furono insigniti del Premio Nobel per la Chimica nel 1987. A proposito, la struttura spaziale del canale transmembrana del potassio, ottenuta già nel 21° secolo, ha mostrato che il meccanismo di trasferimento e selettività allo ione K + in questa proteina è fondamentalmente lo stesso del caso della valinomicina - solo nel canale la sfera di coordinazione dello ione è formata da residui amminoacidici delle subunità canale-tetramero e in un antibiotico costituisce la spina dorsale della stessa molecola di depsipeptide ciclico.
Per il loro enorme lavoro sullo studio della valinomicina e di altri ionofori, i cui risultati sono riassunti nella monografia “Complessi attivi sulla membrana”, Yu. A. Ovchinnikov e V. T. Ivanov - l'attuale direttore dell'Accademia russa delle scienze (IBCh - questo è il nome oggi dell'istituto creato da Shemyakin) - furono insigniti nel 1987 del Premio Lenin. E in ricordo di quel periodo romantico nella chimica bioorganica, vicino all'ingresso dell'IBCh c'è una statua raffigurante un complesso di valinomicina con uno ione potassio.
“Latte cagliato bulgaro”, ovvero come i peptidi stimolano l’immunità innata
Gli antibiotici peptidici sono senza dubbio una cosa interessante, ma sono per lo più prodotti da microrganismi e agiscono sui microrganismi, il che significa che la ricerca ha dovuto andare oltre, verso lo studio dei peptidi animali e umani. Per rendere più agevole il passaggio al discorso sui peptidi umani, parliamone prima brevemente peptidi muramil- componenti della parete cellulare dei batteri che possono stimolare l'immunità innata nell'uomo.
Negli anni '70 il medico bulgaro Ivan Bogdanov si rivolse all'IBH con la richiesta di aiuto nell'analisi di un farmaco ottenuto dai prodotti di fermentazione dei batteri lattici Lactobacillus bulgaricus. Il fatto è che voleva trovare il principio attivo dei “miracolosi” prodotti lattiero-caseari fermentati bulgari (principalmente latte cagliato), che presumibilmente svolgono un ruolo nella famosa longevità bulgara. Il ruolo della dieta nella longevità di intere nazioni non è ancora del tutto dimostrato, ma il farmaco di Bogdanov suscitò vivo interesse perché aveva una significativa attività antitumorale. La composizione di questo estratto era una miscela complessa di sostanze di origine batterica.
Come risultato della ricerca, si è scoperto che il principio attivo del farmaco di Bogdanov è un'unità elementare della parete cellulare batterica - glucosaminil-muramil dipeptide (GMDP), che ha un effetto immunostimolante e antitumorale sul corpo umano. Questo elemento del batterio, infatti, rappresenta per il sistema immunitario una sorta di “immagine del nemico”, innescando istantaneamente una cascata di ricerca e rimozione dell’agente patogeno dall’organismo. A proposito, una risposta rapida è una proprietà integrante dell'immunità innata, in contrasto con la risposta adattativa, che richiede fino a diverse settimane per “dispiegarsi” completamente. È stato creato un farmaco basato su GMDP licopide, che ora viene utilizzato per una vasta gamma di indicazioni, principalmente associate a immunodeficienze e infezioni infettive - sepsi, peritonite, sinusite, endometrite, tubercolosi, nonché a vari tipi di radiazioni e chemioterapia.
Nuove “-omiche”: la peptidomica – una nuova direzione della ricerca post-genomica
La ricerca "dalla vita dei peptidi" non è finita qui - infatti, la storia dello "yogurt" e di molti altri lavori sulle sostanze di natura peptidica ha dato slancio alla nascita di una nuova industria che si occupa di sistematico studiando i peptidi contenuti nelle cellule viventi e nei fluidi tissutali.
All'inizio degli anni '80 divenne chiaro che il ruolo dei peptidi in biologia era ampiamente sottovalutato: le loro funzioni sono molto più ampie di quelle dei noti neurormoni. Innanzitutto si è scoperto che nel citoplasma, nei fluidi intercellulari e negli estratti tissutali sono presenti molti più peptidi di quanto si pensasse in precedenza, sia in massa che in numero di varietà. Inoltre, la composizione del “pool” (o “fondo”) di peptidi differisce significativamente nei diversi tessuti e organi, e queste differenze persistono tra gli individui. Il numero di peptidi “appena scoperti” nei tessuti umani e animali era decine di volte maggiore del numero di peptidi “classici” con funzioni ben studiate. Per un po 'di tempo peptidi "ombra". erano considerati semplicemente “rifiuti” biochimici residui della degradazione di proteine funzionali più grandi e non ancora “riordinati” dall’organismo, e solo a partire dall’inizio degli anni ’90 il velo di segretezza cominciò ad essere sollevato.
Una nuova disciplina ha iniziato a studiare il ruolo dei “pool” di peptidi - peptidomica,- la cui formazione è avvenuta anche nell'IBH. Tutti sanno che inizia l'attuazione del programma genetico incorporato nel DNA degli organismi - un insieme di cromosomi e geni. L'organizzazione e il funzionamento del genoma vengono studiati in un'area speciale all'intersezione tra biologia molecolare e biotecnologia - genomica. Il nucleo cellulare, come un centro di comando, invia messaggi nel citoplasma: RNA messaggero (mRNA), che sono "calchi" di geni. Questo processo si chiama trascrizione, e l'insieme di tutti gli mRNA attualmente presenti nel citoplasma e che riflettono l'attività del genoma, per analogia, è stato chiamato trascrittoma, le cui caratteristiche sono studiate trascrittomica. La somma di tutte le molecole proteiche che sono state sintetizzate dai ribosomi “leggendo” l’mRNA che codifica per le proteine è chiamata proteoma, e studia questa “sfera proteica” proteomica .
Questi tre "-omici" sono classici, ma se ricordi che le proteine hanno una "durata di conservazione" limitata, dopo di che vengono scomposte dalle proteasi in frammenti, cioè in peptidi! - quindi appare un altro "-omics": peptidomica. Per analogia, il suo ruolo è studiare la composizione e le funzioni dei “pool” di proteine esistenti in diversi tessuti e organi, nonché spiegare i meccanismi della loro formazione e distruzione. Il peptidema si trova all'estremità della catena informativa: Genoma → Trascrittoma → Proteoma → Peptideoma. La peptidomica è la disciplina più giovane tra queste: la sua età non supera i 30 anni, e il nome è stato proposto solo intorno al 2000. Ad oggi, la peptidomica sperimentale ha permesso di formulare i tre modelli più importanti che descrivono il comportamento di un insieme di “peptidi ombra” negli organismi viventi.
Innanzitutto, i tessuti, i fluidi e gli organi biologici contengono un gran numero di peptidi che formano “pool di peptidi” e il loro ruolo non è solo di zavorra. Questi pool sono formati sia da proteine precursori specializzate, sia da proteine con altre funzioni proprie (enzimi, proteine strutturali e di trasporto, ecc.).
In secondo luogo, la composizione dei pool peptidici viene riprodotta stabilmente in condizioni normali e non rivela differenze individuali. Ciò significa che in individui diversi i peptidomi del cervello, del cuore, dei polmoni, della milza e di altri organi coincideranno approssimativamente, ma questi pool differiranno significativamente l'uno dall'altro. In diverse specie (almeno tra i mammiferi), anche la composizione di bacini simili è molto simile.
E infine, in terzo luogo, con lo sviluppo di processi patologici, nonché a seguito dello stress (compresa la prolungata privazione del sonno) o dell'uso di farmaci, la composizione dei pool peptidici cambia, e talvolta in modo abbastanza drammatico. Questo può essere utilizzato per diagnosticare varie condizioni patologiche - in particolare, tali dati sono disponibili per le malattie di Hodgkin e di Alzheimer.
L’esatta composizione dei pool peptidici è difficile da determinare, soprattutto perché il numero di “partecipanti” dipenderà in modo significativo dalla concentrazione considerata significativa. Quando si lavora a livello di unità e decimi di nanomole (10−9 M), si tratta di diverse centinaia di peptidi, ma quando la sensibilità dei metodi aumenta a picomoli (10−12 M), il numero va fuori scala a decine di migliaia. Se considerare tali componenti “minori” come “attori” indipendenti o accettare che non abbiano un proprio ruolo biologico e rappresentino solo “rumore” biochimico è una questione aperta.
I pool di peptidi sono una caratteristica comune degli organismi viventi?
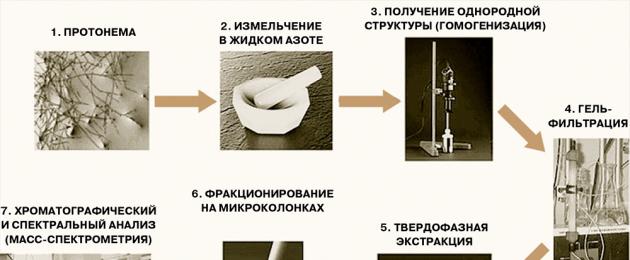
La maggior parte del lavoro pionieristico sulla peptidomica è stato condotto su tessuti animali e in tutti i casi sono stati identificati pool di peptidi con una composizione certa e caratteristica: negli esseri umani, nei bovini, nei ratti, nei topi, nei maiali, negli scoiattoli di terra, nell'idra, nella Drosophila e nelle locuste. Ma il fenomeno della presenza di pool peptidici è comune, ad esempio, alle piante e ai procarioti? Nel caso dei protozoi o dei batteri la situazione è ancora da chiarire, ma per le piante, a quanto pare, una risposta positiva può già essere data. In particolare, per una pianta modello: muschio Patene di Physcomitrella, il cui genoma è stato recentemente decifrato, è stato dimostrato che in ogni fase di sviluppo (nella forma filamentosa, protonema e nella fase matura, gametofori) nella pianta è presente un gran numero di peptidi endogeni - frammenti di proteine cellulari, il cui insieme è individuale per ciascuna forma vegetale. (Lo schema dell'analisi sperimentale dei peptidi del muschio è mostrato nella Figura 2.)

Figura 2. Schema di analisi dei peptidi di muschio.
Anche se non si trova nulla di simile nei procarioti, possiamo già concludere che un gran numero di organismi multicellulari coltivano al loro interno “pool” di peptidi. Ma a cosa servono e come si formano?
Peptidi: sistema di bioregolazione “ombra”.
Il meccanismo di formazione dei pool peptidici è più semplice da determinare nelle colture cellulari, perché, a differenza di interi tessuti e organi, in questo caso c'è la certezza che i peptidi siano generati da questo particolare tipo di cellula e non da qualche altro (o non lo sono affatto un artefatto di isolamento dai tessuti). Gli eritrociti umani sono stati studiati in modo più dettagliato in questo senso: le cellule sono tanto più interessanti perché mancano di nucleo e, quindi, la maggior parte dei processi biochimici in essi contenuti sono fortemente inibiti.
È stato accertato che all’interno degli eritrociti le catene α e β dell’emoglobina vengono “tagliate” in una serie di grandi frammenti (sono stati isolati complessivamente 37 frammenti peptidici di globina α e 15 di globina β) e, inoltre, , gli eritrociti rilasciano molti peptidi più brevi nell'ambiente (Figura 3). I pool peptidici sono formati anche da altre colture cellulari (mielomonociti trasformati, cellule eritroleucemiche umane, ecc.), cioè la produzione di peptidi da colture cellulari è un fenomeno molto diffuso. Nella maggior parte dei tessuti, il 30-90% di tutti i peptidi identificati sono frammenti di emoglobina, ma sono state identificate anche altre proteine che generano "cascate" di peptidi endogeni: albumina, mielina, immunoglobuline, ecc. Per alcuni dei peptidi "ombra", i precursori non sono stati ancora trovati.
Anche uno sguardo superficiale all'elenco dei frammenti peptidici dell'emoglobina (Fig. 3) porta alla conclusione che la diversità dei peptidi endogeni supera significativamente l'insieme tradizionale di ormoni peptidici, neuromodulatori e antibiotici. Nonostante molti dati sparsi sull’attività dei singoli componenti dei pool peptidici, la questione chiave sul ruolo biologico dei pool peptidici nel loro insieme è rimasta irrisolta. La maggior parte dei peptidi nei pool rappresentano semplicemente prodotti intermedi neutri della distruzione dei substrati proteici nel percorso verso gli amminoacidi che vengono nuovamente utilizzati per la risintesi proteica, oppure questi peptidi svolgono un ruolo biologico indipendente?

Figura 3. Formazione di peptidi in eritrociti umani in coltura. Le sequenze di aminoacidi della α- e β-globina sono mostrate su sfondo nero, mentre le sequenze di peptidi identificati come frammenti di queste proteine sono mostrate su sfondo grigio.
Per rispondere a questa domanda, è stato studiato l'effetto di oltre 300 peptidi - componenti dei pool peptidici dei tessuti dei mammiferi - su una serie di colture di cellule tumorali e normali. Di conseguenza, si è scoperto che oltre il 75% di questi peptidi hanno un pronunciato effetto proliferativo o antiproliferativo su almeno una coltura (cioè accelerano o rallentano la divisione cellulare). Sono stati scoperti altri tipi di attività biologiche che si sovrappongono più o meno alle attività di ormoni, paraormoni e neurotrasmettitori. Come risultato di una serie di tali lavori, sono state tratte diverse conclusioni:
- i componenti del peptidoma sono coinvolti nella regolazione del sistema nervoso, immunitario, endocrino e di altro tipo del corpo, e la loro azione può essere considerata complessa, cioè svolta simultaneamente dall'intero insieme di peptidi;
- il pool peptidico nel suo insieme regola i processi a lungo termine (“lungo” per la biochimica significa ore, giorni e settimane), è responsabile del mantenimento dell’omeostasi e regola la proliferazione, la morte e la differenziazione delle cellule che compongono il tessuto.
Apparentemente, uno dei principali meccanismi d'azione dei peptidi biologici corti avviene attraverso i recettori dei noti neurormoni peptidici. L'affinità dei peptidi "ombra" per i recettori è molto bassa - decine o addirittura migliaia di volte inferiore a quella dei loro ligandi "principali", ma bisogna anche tenere conto del fatto che la concentrazione dei peptidi "ombra" è approssimativamente la stessa numero di volte superiore. Di conseguenza, l’effetto che esercitano può avere la stessa entità e, tenendo conto dell’ampio “spettro biologico” del pool peptidico, possiamo concludere che sono importanti nei processi regolatori.
Un esempio di azione attraverso i recettori “non sé” è emorfine- frammenti di emoglobina che agiscono sui recettori degli oppioidi, simili agli “oppiacei endogeni” - encefalina E endorfine. Ciò è dimostrato in un modo standard per la biochimica: aggiungendo naloxone- un antagonista dei recettori degli oppioidi, usato come antidoto in caso di overdose di morfina, eroina o altri analgesici narcotici, blocca l'azione delle emorfine, il che conferma la loro interazione con i recettori degli oppioidi.
Allo stesso tempo, gli obiettivi d’azione della maggior parte dei peptidi “ombra” sono sconosciuti. Secondo i dati preliminari, alcuni di essi possono influenzare il funzionamento delle cascate di recettori e persino partecipare alla “morte controllata” della cellula - apoptosi.
A proposito, i frammenti di proteine più grandi che hanno una propria funzione, che non è in alcun modo correlata alla funzione del "genitore", sono chiamati cripteine(proteine “nascoste”). Le cripteine vengono ora studiate e identificate in modo piuttosto attivo nelle sequenze di proteine "non segrete" nella speranza di scoprire in esse speciali proprietà biologiche (ad esempio medicinali).
Il “tampone biochimico” polifunzionale e polispecifico che forma il pool peptidico, “mitigando” le fluttuazioni metaboliche, ci permette di parlare di un nuovo sistema regolatorio basato sui peptidi, precedentemente sconosciuto (vedi Tabella 1). Questo meccanismo integra i ben noti sistemi nervoso ed endocrino, mantenendo una sorta di omeostasi nel corpo e stabilendo un equilibrio tra crescita, differenziazione, ripristino e morte cellulare. Un cambiamento nel “fondo” peptidico attirerà quasi sicuramente l'attenzione sul processo patologico in corso, e l'effetto riparatore e stimolante di molte sostanze peptidiche può apparentemente essere spiegato proprio con il ripristino dell'equilibrio disturbato.
Considerando quanto sopra, si può anche suggerire che il sistema di bioregolazione dei peptidi sia un predecessore evolutivo dei sistemi nervoso ed endocrino più avanzati e moderni. Gli effetti esercitati dal “fondo” peptidico possono manifestarsi a livello di una singola cellula, mentre è impossibile immaginare il lavoro del sistema nervoso o endocrino in un organismo unicellulare.
| Proprietà | Sistema normativo | ||
|---|---|---|---|
| Nervoso | Endocrino/paracrino | Pool di peptidi tessuto-specifici | |
| "Corpo di lavoro" | Neurotrasmettitori | Ormoni | Peptidi - frammenti di proteine funzionali |
| Predecessore | Precursore proteico specifico | Proteine funzionali | |
| Processo "generativo". | Scissione sito-specifica | Azione di un insieme di proteasi cellulari | |
| Concentrazione (nM/g tessuto) | 0,001–1.0 | 0,001–1.0 | 0,1–100 |
| Tipo di regolamentazione | Secrezione sinaptica | Secrezione extracellulare | Cambiamento nella concentrazione tissutale |
| Meccanismo di azione | Legame ai recettori della membrana sinaptica | Legame con i recettori della membrana cellulare | Legame ai recettori degli ormoni “correlati”. |
| Costante di legame del recettore ( K d, nM) | 1–1000 | 0,1–10 | 100–10000 |
| Periodo di attività | Secondi-minuti | Minuti-ore | Ore–giorni |
| Ruolo biologico | Trasmissione dell'impulso nervoso | Regolazione dei processi fisiologici nei tessuti o nell'intero corpo | Mantenimento dell'omeostasi dei tessuti |
Applicazioni future della peptidomica
I farmaci che sono essenzialmente variazioni sul tema dei pool peptidici di vari tessuti animali sono già ampiamente rappresentati sul mercato (tabella 2), sebbene non siano tra i “blockbuster” che portano i massimi profitti alle aziende. Il loro principale campo di applicazione sono le condizioni associate alla degenerazione o trasformazione di cellule e tessuti, nonché la necessità di rigenerazione (guarigione delle ferite). Tuttavia, tali farmaci non sono sostanze chimiche pure e, pertanto, non soddisfano i requisiti della moderna medicina molecolare basata sull’evidenza. (Il fatto è che i moderni standard farmacologici - come Buona pratica clinica- implicare la conduzione di studi clinici in cui l'effetto di un particolare componente medicinale sarebbe dimostrato in modo assolutamente chiaro.)
| Una droga | Fonte | Indicazione |
|---|---|---|
| Solcoseryl (Svizzera) | Emoderivato deproteinizzato da sangue di vitello | |
| Actovegin (Danimarca) | Peptidi del plasma sanguigno | Guarigione delle ferite, trapianto, ischemia |
| Virulizina (Canada) | Estratto di cistifellea bovina | Immunodeficienze, oncologia |
| Timulina (Russia) | Estratto di timo bovino | Immunodeficienze |
| Cerebrolysin (Austria), Cortexin (Russia) | Estratto di cervello bovino/maiale | Ictus, morbo di Alzheimer |
| Raveron (Svizzera) Prostatilen (Russia) | Estratto di prostata bovina | Prostatite, adenoma prostatico |
Una delle direzioni promettenti qui è l'uso della già menzionata attività antiproliferativa dei peptidi. Pertanto, negli esperimenti sul carcinoma mammario del topo, uno dei frammenti di emoglobina (il cosiddetto VV-emorfina-5) ha raddoppiato la sopravvivenza degli animali quando combinato con l'epirubicina citostatica standard rispetto all'uso della sola epirubicina (Fig. 4). Questo esperimento dà motivo di credere che sulla base dei pool peptidici naturali sia possibile creare farmaci ausiliari e di supporto per la terapia oncologica.

Figura 4. Aspettativa di vita media dei topi con carcinoma mammario dopo somministrazione intraperitoneale di epirubicina e terapia di combinazione di epirubicina con VV-emorfina-5. Nel secondo caso il tasso di sopravvivenza era doppio.
Tuttavia, lo sviluppo e la sperimentazione di nuovi farmaci è un processo estremamente lungo e costoso, complicato dalla concorrenza dei giganti farmaceutici. Una prospettiva più immediata per l’uso dei pool peptidici è la diagnosi di malattie e altre condizioni patologiche. È già stato detto più di una volta che la composizione peptidica del campione dipende fortemente dallo stato in cui si trovava l'organismo donatore di tessuti. Esistono già esempi di utilizzo dell’approccio peptidomico per identificare i marcatori di alcune malattie, compreso il cancro.
L'Istituto di Chimica Bioorganica ha sviluppato un metodo per l'analisi spettrometrica di massa del profilo peptidico dei campioni di sangue e ha identificato differenze statisticamente significative che possono essere utilizzate per diagnosticare il cancro ovarico, il cancro del colon-retto o la sifilide (Fig. 5). Lo spettro di massa, che riflette la composizione del pool peptidico di un campione di tessuto, nel caso di una persona malata presenterà differenze caratteristiche, in base alle quali i ricercatori - e, in futuro, i medici - saranno in grado di fare una diagnosi accurata.

Breve descrizione:
La regolazione dei peptidi nel corpo viene effettuata utilizzando peptidi regolatori (RP), costituiti da soli 2-70 residui di aminoacidi, a differenza delle catene proteiche più lunghe. Esiste una disciplina scientifica speciale, la peptidomica, che studia i pool di peptidi nei tessuti.
La regolazione dei peptidi nel corpo viene effettuata utilizzando peptidi regolatori (RP), costituiti da soli 2-70 residui di aminoacidi, a differenza delle catene proteiche più lunghe.
Lo “fondo” peptidico, presente in tutti i tessuti, era tradizionalmente percepito in precedenza come semplici “frammenti” di proteine funzionali, ma si è scoperto che svolge un'importante funzione regolatrice nel corpo. I peptidi “ombra” formano un sistema globale di bioregolazione (sotto forma di chemioregolazione) e omeostasi, forse più antico del sistema endocrino e nervoso.
In particolare, gli effetti esercitati dal “fondo” peptidico possono manifestarsi già a livello di una singola cellula, mentre è impossibile immaginare il lavoro del sistema nervoso o endocrino in un organismo unicellulare.
Definizione del concetto
Peptidi - questi sono eteropolimeri, il cui monomero è costituito da residui di amminoacidi collegati tra loro da legami peptidici.
I peptidi possono essere figurativamente chiamati i “fratelli minori” delle proteine, perché. sono costituiti dagli stessi monomeri delle proteine: gli amminoacidi. Ma se una tale molecola polimerica è composta da più di 50 residui di amminoacidi, allora è una proteina e, se meno, è un peptide.
La maggior parte dei peptidi biologici conosciuti (e non ce ne sono molti) sono neuroormoni e neuroregolatori. I principali peptidi con una funzione nota nel corpo umano sono i peptidi della tachichinina, i peptidi intestinali vasoattivi, i peptidi pancreatici, gli oppioidi endogeni, la calcitonina e alcuni altri neuroormoni. Inoltre, i peptidi antimicrobici secreti sia dagli animali che dalle piante (presenti, ad esempio, nei semi o nel muco delle rane), così come gli antibiotici peptidici, svolgono un importante ruolo biologico.
Ma si è scoperto che oltre a questi peptidi, che hanno funzioni molto specifiche, i tessuti degli organismi viventi contengono un “fondo” peptidico piuttosto potente, costituito principalmente da frammenti di proteine funzionali più grandi presenti nel corpo. Per molto tempo si è quindi creduto che tali peptidi fossero solo “frammenti” di molecole funzionanti che il corpo non ha ancora avuto il tempo di “ripulire”. Tuttavia, recentemente è diventato chiaro che questo "fondo" gioca un ruolo importante nel mantenimento dell'omeostasi (equilibrio biochimico dei tessuti) e nella regolazione di molti processi vitali di natura molto generale, come la crescita, la differenziazione e il ripristino cellulare. È anche possibile che il sistema di bioregolazione basato sui peptidi sia un “predecessore” evolutivo dei più moderni sistemi endocrini e nervosi.
Una speciale disciplina scientifica ha iniziato a studiare il ruolo dei "pool" di peptidi - peptidomica .
I pool molecolari di biomolecole sono disposti in ordine regolare.
Pool molecolari di biomolecole
Genoma (insieme di geni) →
Trascrittoma (un insieme di trascrizioni ottenute dai geni mediante trascrizione) →
proteoma (un insieme di proteine ottenute da trascritti mediante traduzione) →
Peptide (un insieme di peptidi ottenuti dalla scomposizione delle proteine).
Pertanto, i peptidi si trovano all'estremità della catena molecolare di biomolecole interconnesse a livello informativo.
Uno dei primi peptidi attivi è stato ottenuto dal latte cagliato bulgaro, che un tempo era molto apprezzato da I.I. Mechnikov. Componente della parete cellulare dei batteri del latte cagliato - glucosaminil-muramil-dipeptide (GMDP) - ha un effetto immunostimolante e antitumorale sul corpo umano. La scoperta è stata effettuata studiando il batterio del latte fermentato Lactobacillus bulgaricus (bacillo bulgaro). Questo elemento del batterio, infatti, rappresenta per il sistema immunitario una sorta di “immagine del nemico”, innescando istantaneamente una cascata di ricerca e rimozione dell’agente patogeno dall’organismo. A proposito, una risposta rapida è una proprietà integrante dell'immunità innata, in contrasto con la risposta adattativa, che richiede fino a diverse settimane per “dispiegarsi” completamente. Sulla base del GMDP è stato creato il farmaco licopid, che ora viene utilizzato per una vasta gamma di indicazioni, principalmente associate a immunodeficienze e infezioni infettive: sepsi, peritonite, sinusite, endometrite, tubercolosi, nonché vari tipi di radiazioni e chemioterapia.
All'inizio degli anni '80 divenne chiaro che il ruolo dei peptidi in biologia era ampiamente sottovalutato: le loro funzioni sono molto più ampie di quelle dei noti neurormoni. Innanzitutto si è scoperto che nel citoplasma, nei fluidi intercellulari e negli estratti tissutali sono presenti molti più peptidi di quanto si pensasse in precedenza, sia in massa che in numero di varietà. Inoltre, la composizione del “pool” (o “fondo”) di peptidi differisce significativamente nei diversi tessuti e organi, e queste differenze persistono tra gli individui. Il numero di peptidi “appena scoperti” nei tessuti umani e animali era decine di volte maggiore del numero di peptidi “classici” con funzioni ben studiate. Pertanto, la diversità dei peptidi endogeni supera significativamente l'insieme tradizionale precedentemente noto di ormoni peptidici, neuromodulatori e antibiotici.
L’esatta composizione dei pool peptidici è difficile da determinare, soprattutto perché il numero di “partecipanti” dipenderà in modo significativo dalla concentrazione considerata significativa. Quando si lavora a livello di unità e decimi di nanomole (10−9 M), si tratta di diverse centinaia di peptidi, ma quando la sensibilità dei metodi aumenta a picomoli (10−12 M), il numero va fuori scala a decine di migliaia. Se considerare tali componenti “minori” come “attori” indipendenti o accettare che non abbiano un proprio ruolo biologico e rappresentino solo “rumore” biochimico è una questione aperta.
Il pool peptidico degli eritrociti è stato studiato abbastanza bene. È stato accertato che all’interno degli eritrociti le catene α e β dell’emoglobina vengono “tagliate” in una serie di grandi frammenti (sono stati isolati complessivamente 37 frammenti peptidici di globina α e 15 di globina β) e, inoltre, , gli eritrociti rilasciano nell'ambiente molti peptidi più brevi . I pool peptidici sono formati anche da altre colture cellulari (mielomonociti trasformati, cellule di eritroleucemia umana, ecc.), ad es. La produzione di peptidi da colture cellulari è un fenomeno diffuso. Nella maggior parte dei tessuti, il 30-90% di tutti i peptidi identificati lo sono frammenti di emoglobina , tuttavia, sono state identificate anche altre proteine che generano “cascate” di peptidi endogeni: albumina, mielina, immunoglobuline, ecc. Per alcuni dei peptidi “ombra” non sono stati ancora trovati i precursori.
Proprietà del peptidomo
1. I tessuti biologici, i fluidi e gli organi contengono un gran numero di peptidi che formano “pool di peptidi”. Questi pool sono formati sia da proteine precursori specializzate, sia da proteine con altre funzioni proprie (enzimi, proteine strutturali e di trasporto, ecc.).
2. La composizione dei pool peptidici è riprodotta stabilmente in condizioni normali e non rivela differenze individuali. Ciò significa che in individui diversi i peptidomi del cervello, del cuore, dei polmoni, della milza e di altri organi coincideranno approssimativamente, ma questi pool differiranno significativamente l'uno dall'altro. In diverse specie (almeno tra i mammiferi), anche la composizione di bacini simili è molto simile.
3. Con lo sviluppo di processi patologici, nonché a seguito dello stress (compresa la privazione prolungata del sonno) o dell'uso di farmaci, la composizione dei pool peptidici cambia, e talvolta in modo abbastanza drammatico. Questo può essere utilizzato per diagnosticare varie condizioni patologiche, in particolare tali dati sono disponibili per le malattie di Hodgkin e di Alzheimer.
Funzioni del peptidomo
1. I componenti del peptidoma sono coinvolti nella regolazione del sistema nervoso, immunitario, endocrino e di altri sistemi del corpo, e la loro azione può essere considerata complessa, cioè svolta simultaneamente dall'intero insieme di peptidi.
Pertanto, i pool peptidici svolgono una bioregolazione generale in collaborazione con altri sistemi a livello dell'intero organismo.
2. Il pool peptidico nel suo insieme regola i processi a lungo termine (“lungo” in biochimica significa ore, giorni e settimane), è responsabile del mantenimento dell'omeostasi e regola la proliferazione, la morte e la differenziazione delle cellule che compongono il tessuto.
3. Il pool peptidico forma un “tampone biochimico” tissutale polifunzionale e polispecifico che attenua le fluttuazioni metaboliche, il che ci permette di parlare di un nuovo sistema regolatorio basato sui peptidi precedentemente sconosciuto. Questo meccanismo integra i noti sistemi di regolazione nervosa ed endocrina, mantenendo una sorta di “omeostasi dei tessuti” nel corpo e stabilendo un equilibrio tra crescita, differenziazione, ripristino e morte cellulare.
Pertanto, i pool peptidici effettuano la regolazione tissutale locale a livello del singolo tessuto.
Meccanismo d'azione dei peptidi tissutali
Uno dei principali meccanismi d'azione dei peptidi biologici corti avviene attraverso i recettori dei neurormoni peptidici già noti. L'affinità dei peptidi tissutali “ombra” per questi recettori è molto bassa, decine o addirittura migliaia di volte inferiore a quella dei bioligandi specifici “principali”. Ma bisogna tenere conto del fatto che la concentrazione dei peptidi “ombra” è approssimativamente altrettante volte superiore. Di conseguenza, l'effetto che hanno può essere della stessa entità di quello degli ormoni peptidici e, tenendo conto dell'ampio “spettro biologico” del pool peptidico, possiamo concludere sulla loro importanza nei processi regolatori.
Un esempio di azione attraverso i recettori “non sé” è emorfine- frammenti di emoglobina che agiscono sui recettori degli oppioidi, simili agli “oppioidi endogeni” - encefalina ed endorfina. Ciò è dimostrato in modo standard in biochimica: l'aggiunta di naloxone, un antagonista dei recettori degli oppioidi utilizzato come antidoto in caso di overdose di morfina, eroina o altri analgesici narcotici. Il naloxone blocca l'azione delle emorfine, il che conferma la loro interazione con i recettori degli oppioidi.
Allo stesso tempo, gli obiettivi d’azione della maggior parte dei peptidi “ombra” sono sconosciuti. Secondo i dati preliminari, alcuni di essi possono influenzare il funzionamento delle cascate di recettori e persino partecipare alla “morte cellulare controllata” - l'apoptosi.
Il concetto di regolazione peptidica postula la partecipazione dei peptidi endogeni come bioregolatori nel mantenimento dell'omeostasi strutturale e funzionale delle popolazioni cellulari che contengono e producono questi fattori.
Funzioni dei peptidi regolatori
- Regolazione dell'espressione genica.
- Regolazione della sintesi proteica.
- Mantenere la resistenza ai fattori destabilizzanti dell'ambiente esterno ed interno.
- Contrasto ai cambiamenti patologici.
- Prevenire i cambiamenti legati all’età.
I peptidi corti isolati da vari organi e tessuti, così come i loro analoghi sintetizzati (di-, tri_, tetrapeptidi) hanno un'attività tessuto-specifica pronunciata nella coltura tissutale organotipica. L'esposizione ai peptidi ha portato alla stimolazione tessuto-specifica della sintesi proteica nelle cellule di quegli organi da cui sono stati isolati questi peptidi.
Fonte:
Khavinson V.Kh., Ryzhak G.A. Regolazione peptidica delle principali funzioni del corpo // Bollettino di Roszdravnadzor, n. 6, 2010. P. 58-62.
I peptidi regolatori sono catene corte, comprendenti da 2 a 50-70 residui di aminoacidi, e le molecole peptidiche più grandi sono solitamente classificate come proteine regolatrici. Gli RP sono sintetizzati in tutti gli organi e tessuti del corpo, ma quasi tutti in un modo o nell'altro influenzano l'attività del sistema nervoso centrale. Molti RP sono prodotti sia dai neuroni che dalle cellule dei tessuti periferici. Ad oggi sono state scoperte e descritte almeno quaranta famiglie di RP, ciascuna delle quali comprende da due a dieci rappresentanti di peptidi.
L'RP non può essere attribuito esclusivamente agli ormoni. Alcuni di essi sono mediatori o coesistono nelle terminazioni sinaptiche con mediatori classici di natura non peptidica, essendo rilasciati sia congiuntamente che separatamente. Altri RP agiscono su gruppi di cellule situati vicino al sito di secrezione, cioè sono modulatori. I terzi RP si diffondono su lunghe distanze, regolando le funzioni di vari sistemi corporei: questi sono gli ormoni classici. Esempi di tali ormoni includono ossitocina, vasopressina, ACTH, liberine e statine dell'ipotalamo, ma l'RP è caratterizzato da un effetto non su un organo bersaglio, ma contemporaneamente su molti sistemi corporei. Ricordate che lo stimolatore della contrazione della muscolatura liscia, l'ossitocina, è allo stesso tempo un bloccante della memoria, e il regolatore delle funzioni della corteccia surrenale, l'ACTH, migliora l'attenzione, stimola l'apprendimento, sopprime l'assunzione di cibo e
comportamento sessuale. La proprietà della RP di influenzare contemporaneamente una serie di processi fisiologici è chiamata multimodalità. Tutti gli RP hanno effetti multimodali in un modo o nell'altro. C’è un significato profondo nel fatto che i neuropeptidi hanno molteplici effetti sul corpo. In qualsiasi situazione di vita che richieda una risposta complessa da parte dell'organismo, l'RP, agendo su tutti i sistemi, consente di rispondere in modo ottimale all'impatto. Ad esempio, la piccola tuftsina RP viene costantemente prodotta nel flusso sanguigno. La tuftsina è un potente stimolante del sistema immunitario, ma allo stesso tempo agisce anche su numerose strutture cerebrali, fornendo un effetto psicostimolante. Pertanto, in una situazione pericolosa, una maggiore produzione di tuftsina porta ad un miglioramento della funzione cerebrale e ad un rafforzamento dell'immunità. La prima esposizione al tuftsin consentirà di reagire meglio al pericolo e cercare di evitarlo o resistervi con successo, ed è necessario rafforzare il sistema immunitario per ridurre le conseguenze delle ferite ricevute durante il contatto con un nemico o una vittima.
Il ruolo dell’RP nella risposta del corpo agli effetti avversi è eccezionale. Sopra, abbiamo già presentato informazioni sui peptidi dell'ipotalamo e dell'ipofisi e sulla loro importanza nella formazione di una risposta agli effetti stressanti. Inoltre, gli oppioidi peptidici endogeni, che comprendono peptidi di diversi gruppi: endorfine, encefaline, dinorfine, ecc., hanno un effetto protettivo durante lo stress.
Gli oppioidi peptidici sono tali da poter interagire con i recettori steroidei di varie classi situati sulla membrana esterna delle cellule in quasi tutti gli organi, compresi i recettori neuronali. Questi peptidi promuovono la creazione di emozioni positive, sebbene a grandi dosi possano sopprimere l’attività motoria e il comportamento esplorativo.
Legandosi ai recettori degli oppiacei, i peptidi oppioidi portano ad una riduzione del dolore, il che è molto importante quando il corpo è esposto a fattori avversi.
Tuttavia, possiamo fornire esempi di altri peptidi regolatori che sono mediatori delle informazioni dai recettori del dolore al cervello. L'aumento della produzione di tali peptidi nel corpo o la loro introduzione nell'organismo dall'esterno porta ad un aumento del dolore.
Si è scoperto che alcuni RP agiscono come fattori di regolazione del ciclo sonno-veglia, alcuni peptidi favoriscono il sonno e ne aumentano la durata, mentre altri, al contrario, mantengono il cervello in uno stato attivo.
Sia un aumento che una diminuzione del rilascio di peptidi regolatori possono essere alla base di una serie di condizioni patologiche, comprese quelle associate a compromissione della funzione cerebrale. È già stato menzionato sopra che l'ormone di rilascio dell'ormone tiroideo è un antidepressivo efficace, ma in grandi quantità può portare a stati maniacali. La melatonina, al contrario, è un fattore che contribuisce all'emergenza
depressione.
Non vi è dubbio che i disturbi nel metabolismo di alcuni RP siano alla base della malattia schizofrenia. Pertanto, nei pazienti, il livello di alcuni peptidi oppioidi nel sangue aumenta notevolmente e i peptidi di altre classi (colecistochinina, des-tirosil-gamma-endorfina) hanno un chiaro effetto antipsicotico.
Esistono prove che l'eccesso di alcuni RP può provocare condizioni convulsive, mentre altri RP hanno effetti anticonvulsivanti.
Il ruolo degli RP e dei loro recettori nella genesi di condizioni patologiche comuni come l'alcolismo e la tossicodipendenza è molto importante. Dopotutto, la morfina e i suoi derivati introdotti nell'organismo dai tossicodipendenti interagiscono proprio con quei recettori che in una persona sana sono necessari per il normale funzionamento del sistema oppioide peptidico endogeno. Pertanto, i bloccanti dei recettori degli oppiacei vengono utilizzati, in particolare, per trattare i tossicodipendenti.
È importante capire che tutte le funzioni cerebrali sono sotto il costante controllo del sistema di regolamentazione dei peptidi, la cui complessità stiamo solo iniziando a comprendere.
Dolgov G.V., Kulikov S.V., Legeza V.I., Malinin V.V., Morozov V.G., Smirnov V.S., Sosyukin A.E.
UDC 61.438.1:577.115.05
A cura del prof. V.S. Smirnova .
Team degli autori:
- Dolgov G.V.- Dottore in Scienze Mediche, Professore del Dipartimento di Ostetricia e Ginecologia dell'Accademia Medica Militare
- Kulikov S.V.- Candidato di Scienze Mediche, Ricercatore Senior, Dipartimento di Neurofarmacologia, Istituto di Medicina Sperimentale, Accademia Russa delle Scienze Mediche
- Legeza V.I..- Dottore in Scienze Mediche, Professore, Ricercatore capo, Dipartimento di Terapia sul Campo Militare, Accademia Medica Militare
- Malinin V.V.- Dottore in Scienze Mediche, Capo del Dipartimento dell'Istituto di Bioregolazione e Gerontologia del Ramo Nordoccidentale dell'Accademia Russa delle Scienze Mediche
- Morozov V.G.- Dottore in Scienze Mediche, Professore Vicedirettore dell'Istituto di Bioregolazione e Gerontologia del Ramo Nordoccidentale dell'Accademia Russa delle Scienze Mediche
- Smirnov V.S.- Dottore in Scienze Mediche, Professore, Ricercatore principale, Dipartimento di Terapia sul Campo Militare, Accademia Medica Militare
- Sosyukin A.E.- Dottore in Scienze Mediche, Professore, Capo del Dipartimento di Terapia sul Campo Militare, Accademia Medica Militare
introduzione
La metà del secolo scorso è stata segnata da una serie di scoperte fondamentali, tra cui una delle più importanti è stata l'istituzione del ruolo dei peptidi nella regolazione delle funzioni fisiologiche del corpo. È stato dimostrato che le varie proprietà inerenti a molti ormoni non dipendono dall'intera molecola proteica, ma sono concentrate in piccole catene oligopeptidiche. Di conseguenza, è stato formulato il concetto di peptidi regolatori e sono stati stabiliti i meccanismi della loro azione. È stato dimostrato in modo convincente che questi peptidi, che hanno una lunghezza e un peso molecolare relativamente piccoli, svolgono un ruolo di primo piano nella regolazione della maggior parte delle reazioni fisiologiche del corpo e nel mantenimento dell'omeostasi. La ricerca del gruppo di accademici dell'Accademia russa delle scienze mediche I.P. Ashmarin ha dimostrato che questi composti trasferiscono determinate informazioni codificate sotto forma di una sequenza di aminoacidi da cellula a cellula.
I primi ad essere scoperti furono i neuropeptidi isolati, come suggerisce il nome, dal sistema nervoso. Successivamente, i peptidi regolatori sono stati isolati dal tratto gastrointestinale, dal sistema cardiovascolare, dal sistema respiratorio, dalla milza, dal timo e da altri organi. È diventato chiaro che il sistema dei peptidi regolatori è distribuito in tutto il corpo. Questa idea ci ha permesso di formulare il concetto del sistema APUD (inglese: Amine Precursor Uptake and Decarboxilation), spesso chiamato anche sistema neuroendocrino diffuso. L'ultimo termine indica che questo sistema funziona in modo autonomo e controlla l'attività di tutti gli organi interni senza eccezioni.
La formazione del concetto di regolazione peptidica delle funzioni biologiche dell'organismo è stata, fin dall'inizio, accompagnata da tentativi di applicare le informazioni ottenute per sviluppare nuovi farmaci altamente efficaci basati su peptidi regolatori. Di per sé, questa direzione non può essere definita particolarmente nuova. I primi tentativi di utilizzare estratti di vari organi, che sono essenzialmente una miscela di proteine e oligopeptidi, furono fatti nel XIX secolo dal famoso fisiologo francese Brown-Séquard, che propose emulsioni provenienti dalle ghiandole seminali di cani e porcellini d'India come soluzione rimedio antietà. Successivamente furono utilizzati per lo stesso scopo estratti di testicoli, ovaie, milza, prostata e tiroide di varie specie animali. Si tratta essenzialmente dei primi tentativi di utilizzare miscele di peptidi regolatori per scopi di terapia bioregolatoria o di prevenzione di condizioni patologiche, tra cui I.I. Mechnikov attribuisce anche una vecchiaia prematura.
La ricerca nel campo dei prodotti biologici organotipici è stata ripresa negli anni '70 del secolo scorso V.G. Morozov e V.Kh. Khavinson, che sviluppò una tecnologia originale per ottenere estratti di organi mediante idrolisi acida seguita da isolamento con acetone. In questo modo abbiamo ottenuto estratti di timo, midollo osseo, milza, corteccia e sostanza bianca del cervello, ghiandola pineale, ecc., costituiti da complessi di peptidi di varie dimensioni, e la composizione oligopeptidica di tale complesso può variare ampiamente. In altre parole, ogni campione di tale estratto è unico. Una nuova tappa in questa direzione è stata la creazione di farmaci a base di monopeptidi. I primi di questa serie erano farmaci a base di timosina (un frammento dell'ormone del timo). Successivamente sono stati registrati i farmaci Semax, che è un frammento della molecola dell'ormone adrenocorticotropo, Dalargin e Deltaran (frammenti di neuropeptidi), ecc.. I peptidi sopra elencati sono costituiti da 5-10 residui di aminoacidi e quindi avere sufficiente specificità. Il più piccolo dei peptidi studiati è costituito da soli due residui aminoacidici. Come risultato di molti anni di ricerca, è stato dimostrato dipeptidi, senza alcuna specificità specifica in grado di ripristinare i disturbi del sistema immunitario. Questo è il motivo per cui questi fondi sono stati classificati come timomimetici.
Uno dei primi farmaci di questa classe è stato Thymogen® - dipeptide costituito da acido glutammico e residui di triptofano. Creato alla fine degli anni '80 del secolo scorso, Thymogen® ha rapidamente guadagnato ampia popolarità tra medici e pazienti. Una vasta esperienza è stata accumulata nel suo utilizzo nella terapia complessa di varie malattie e lesioni. Una vasta gamma di risultati ottenuti in tempi diversi e da autori diversi richiede una comprensione e una generalizzazione fondamentali. Sfortunatamente, non sono stati ancora creati lavori generali su questo problema. La monografia di V.S., pubblicata nel 2003. Smirnova e A.E. Sosyukina “Uso di Thymogen® nella pratica clinica”,è una breve guida pratica all'uso di Thymogen® in clinica. La tiratura del libro è stata di 2.000 copie ed è stato completamente esaurito in meno di sei mesi. La monografia presentata all'attenzione del lettore non è una semplice riedizione, ma un libro appena scritto, nel lavoro del quale eminenti scienziati dell'Accademia medica militare e dell'Istituto di bioregolazione e gerontologia del ramo nordoccidentale dell'Accademia russa di medicina Hanno preso parte le scienze. Mi piacerebbe credere che le informazioni presentate nella monografia saranno utili sia per il ricercatore che per il medico praticante. Gli autori accettano con gratitudine tutti i commenti critici, poiché riconoscono che nessun lavoro può essere esaustivo, così come è impossibile raggiungere una conoscenza completa.
Grazie
Il sito fornisce informazioni di riferimento solo a scopo informativo. La diagnosi e il trattamento delle malattie devono essere effettuati sotto la supervisione di uno specialista. Tutti i farmaci hanno controindicazioni. È necessaria la consultazione con uno specialista!
informazioni generali
Oggi, i residenti delle grandi città, di regola, non possono vantarsi di buona salute. Deterioramento dei fattori ambientali, stress, dieta malsana, inattività fisica: tutto ciò riduce gradualmente le riserve sanitarie e provoca un invecchiamento precoce. Le persone si sono già abituate al fatto che la giovinezza è un dono fugace della vita che scompare irrevocabilmente. Ma ora, grazie ai risultati dei ricercatori russi, sul mercato dei farmaci è apparso un nuovo tipo di farmaci, la cui azione mira non solo a migliorare la salute, ma anche a prevenire l'invecchiamento precoce. Questi farmaci sono chiamati bioregolatori peptidici.Peptidi- Queste sono proteine molto corte. Le proteine, come sappiamo, sono una catena di aminoacidi collegati. Sono disponibili in diverse lunghezze: quelli lunghi contengono dozzine di aminoacidi, mentre quelli corti contengono solo pochi collegamenti. Le proteine corte erano chiamate peptidi.
Le cellule del corpo umano devono creare regolarmente e ininterrottamente proteine di una certa struttura. Se una cellula svolge efficacemente le sue funzioni, l’intero organo funziona bene. Se per qualche motivo le cellule di un organo iniziano a funzionare in modo errato, l'intero organo ne soffre, il che, a sua volta, porta alla malattia. Certo, è possibile combattere le malattie attraverso la terapia sostitutiva: introducendo artificialmente sostanze di cui l'organismo è carente. Ma questo metodo ha uno svantaggio: gradualmente la cellula cessa di svolgere le sue funzioni. E se si introducono nel corpo le molecole informative necessarie, la cellula riprende la normale attività e il corpo si ripristina.
Gli oligopeptidi regolatori (peptidi corti) sono molecole organiche costituite da residui di amminoacidi uniti da speciali legami peptidici.
Un amminoacido è il composto organico più semplice in termini di complessità della sua struttura. Gli amminoacidi sono sia acidi che basi, grazie ai quali sono in grado di legarsi tra loro, creando composti abbastanza stabili e allo stesso tempo funzionalmente mobili. Ad oggi, gli scienziati hanno scoperto circa 250 aminoacidi. Solo 20 di essi sono utilizzati negli organismi viventi. Sembra incredibile che solo 20 varietà di aminoacidi formino una così vasta diversità di organismi viventi. Costituiscono tutte le proteine, che sono gli elementi costitutivi di tutti gli esseri viventi.
Ogni tessuto del corpo umano corrisponde a determinati peptidi: per il tessuto cerebrale - peptidi cerebrali, per i reni - renali, per i muscoli - muscoli, ecc.
Le molecole peptidiche sono identiche in tutti i mammiferi. Pertanto, se un peptide vaccino viene introdotto nel corpo umano, verrà percepito come proprio.
Essere nella natura
La maggior parte dei principi della struttura e del funzionamento dei sistemi viventi sono gli stessi dagli organismi viventi più semplici (unicellulari) a quelli superiori (vertebrati, mammiferi). Pertanto, non sorprende che i composti organici che funzionano come portatori di informazioni e regolatori di varie funzioni si siano rivelati per lo più identici per gli organismi dell'intera serie evolutiva.I peptidi corti di base si trovano nei crostacei, insetti, pesci, rettili, ecc. Inoltre, svolgono le stesse funzioni fisiologiche, perché Gli organismi animali funzionano secondo gli stessi principi. Tutte le specie di cui sopra hanno un sistema nervoso, un cuore, un sistema respiratorio ed escretore. E i meccanismi biochimici di base sono generalmente identici.
Storia della scoperta
 Le persone hanno cercato di creare un elisir di giovinezza fin dai tempi antichi. Gli alchimisti continuarono senza successo a tentare di creare una sostanza che potesse riportare indietro il tempo, restituendo la giovinezza agli anziani. Passarono i secoli e la scienza non si fermò. Oggi la nanotecnologia è considerata uno dei settori scientifici più promettenti, compresa la medicina. Più recentemente sono stati creati farmaci a base di peptidi corti in grado di prevenire l'invecchiamento precoce del corpo umano, prolungando la giovinezza per molti anni.
Le persone hanno cercato di creare un elisir di giovinezza fin dai tempi antichi. Gli alchimisti continuarono senza successo a tentare di creare una sostanza che potesse riportare indietro il tempo, restituendo la giovinezza agli anziani. Passarono i secoli e la scienza non si fermò. Oggi la nanotecnologia è considerata uno dei settori scientifici più promettenti, compresa la medicina. Più recentemente sono stati creati farmaci a base di peptidi corti in grado di prevenire l'invecchiamento precoce del corpo umano, prolungando la giovinezza per molti anni. Fino a poco tempo fa, le persone non erano in grado di estrarre peptidi dagli organi animali. Tuttavia, tale tecnologia fu scoperta nel 1971 presso l'Accademia medica militare di Leningrado da due eminenti scienziati sovietici: Vladimir Khavinson e Vyacheslav Morozov.
Agli scienziati è stato affidato il compito di produrre un farmaco in grado di aumentare la resistenza dei soldati in condizioni estreme.
Khavinson e Morozov partivano dal fatto che l'invecchiamento è un processo continuo che si estende per decenni, durante i quali si verifica un lento collasso di tutti gli organi e sistemi del corpo umano.
Uno degli aspetti principali del processo di invecchiamento è una diminuzione del tasso di produzione di proteine. I ricercatori credevano che questi tassi potessero essere ripristinati influenzando il corpo con regolatori peptidici.
Gli scienziati hanno scoperto il modo più ottimale per ripristinare la sintesi naturale dei peptidi nel corpo in quantità ottimali scoprendo una tecnologia per l'estrazione di bioregolatori endogeni (peptidi) dai tessuti animali, identici nella struttura ai tessuti del corpo umano.
Alcuni anni dopo, il duro lavoro dei ricercatori ha dato i suoi frutti. È stato creato un nuovo tipo di farmaci in grado di aumentare l'aspettativa di vita: i bioregolatori peptidici. La ricerca ha dimostrato la possibilità di prevenire l’invecchiamento precoce, nonché di prevenire e curare le malattie associate al processo di invecchiamento.
Sono stati sviluppati prodotti farmaceutici e poi basati su di essi, poiché gli integratori alimentari sono più naturali per il corpo.
Studiando il processo di invecchiamento e i metodi per prevenirlo, gli scienziati dell'Istituto di bioregolazione e gerontologia della filiale nordoccidentale dell'Accademia russa delle scienze mediche (San Pietroburgo) sono giunti alla conclusione che quando ai topi sperimentali vengono somministrati i farmaci sviluppati nel loro cibo , la loro aspettativa di vita aumenta del 30-40%.
Successivamente, le proprietà dei peptidi sono state studiate negli anziani e nei senili presso gli Istituti di gerontologia di Kiev e San Pietroburgo. Di conseguenza, la mortalità è stata ridotta del 50%, il che ha dimostrato le elevate proprietà geroprotettive dei peptidi.
La pratica clinica a lungo termine dell'uso di peptidi bioregolatori ha dimostrato l'elevata efficacia di questo tipo di medicinali per varie malattie e condizioni dolorose, incl. per patologie che non possono essere trattate con altri farmaci.
Omeostasi e omeocinesi
Più recentemente, gli scienziati hanno identificato una classe di cosiddetti peptidi regolatori universali in grado di normalizzare l'attività sia di singoli tipi cellulari che di interi organi e sistemi. Test effettuati da scienziati e medici di tutto il mondo dimostrano che i peptidi corti regolatori sono responsabili di un’ampia gamma di diversi fenomeni fisiologici nel corpo. Di conseguenza, sono applicabili nel trattamento di una serie di malattie di varia origine e gravità.Non sono i singoli peptidi regolatori a partecipare alla comparsa e allo sviluppo di alcune malattie (comprese quelle sistemiche), ma il loro intero sistema.
I peptidi regolatori garantiscono l'armonia nel funzionamento delle singole cellule, organi e sistemi del corpo. Da questo punto di vista, la malattia si sviluppa quando si verifica uno squilibrio nel loro sistema integrale, il rapporto naturale delle loro quantità viene interrotto.
Gli oligopeptidi regolatori sono una delle particelle più importanti responsabili della funzione di autoregolazione del corpo (omeostasi). L'omeostasi è un delicato equilibrio nel funzionamento di tutte le cellule, organi e sistemi di un organismo vivente. Quando gli scienziati si resero conto della complessità della struttura e del funzionamento del corpo umano, in medicina apparve un altro concetto: l'omeocinesi. L'omeocinesi è il processo di modifica del funzionamento del corpo, volto a stabilire l'omeostasi (il cosiddetto equilibrio mobile). Milioni di omeocinesi si verificano simultaneamente nel corpo umano. E i peptidi corti, a loro volta, sono i principali rappresentanti di questi processi.
In tutte le cellule viene effettuata una serie di trasformazioni chimiche sequenziali, attivate da speciali enzimi (peptidasi), a seguito delle quali si formano brevi peptidi. Sono caratterizzati da una maggiore attività biologica e sono considerati regolatori di un'ampia gamma di reazioni microbiologiche. Tutte le cellule del corpo creano e mantengono continuamente un certo livello richiesto di peptidi regolatori. Ma se l'omeostasi viene interrotta, la velocità con cui si formano (in tutto il corpo o in alcuni tessuti) aumenta o diminuisce. Tali fluttuazioni si verificano in determinate situazioni:
- il corpo deve adattarsi alle nuove condizioni (adattamento);
- viene svolto lavoro fisico, mentale o psico-emotivo;
- l'insorgenza e lo sviluppo di qualsiasi malattia - quando il corpo cerca di proteggersi da una violazione dell'omeostasi.
Un caso illustrativo per garantire l'equilibrio è la regolazione della pressione sanguigna. Esistono gruppi di peptidi bioregolatori che sono in costante "competizione": alcuni riducono, altri aumentano la pressione sanguigna. Per correre, camminare velocemente in salita, fare un bagno di vapore o impegnarsi in un'attività mentale o emotiva, è necessario un aumento della pressione sanguigna fino a un certo livello, a seconda del carico. Ma non appena il carico finisce e il corpo ha bisogno di rilassarsi, i peptidi vengono attivati, garantendo che il cuore rallenti a un ritmo normale e la pressione sanguigna si normalizzi. I peptidi vasoattivi regolatori competono continuamente per garantire che la pressione aumenti al livello richiesto (non superiore, altrimenti sono possibili conseguenze negative, incluso l'ictus), e per garantire una normale frequenza di contrazione cardiaca e un normale diametro dei vasi sanguigni alla fine del lavoro.
Meccanismo di azione
 I peptidi sono veri rappresentanti del nanomondo, poiché la loro lunghezza non supera 1 nanometro.
I peptidi sono veri rappresentanti del nanomondo, poiché la loro lunghezza non supera 1 nanometro. Nel corpo umano, il peptide funge da molecola informativa, trasmettendo informazioni da una cellula all'altra. Una volta all'interno della cellula vivente, il peptide provoca la sintesi dei principi attivi, normalizza il metabolismo e attiva il processo di recupero. Pertanto, i peptidi provocano un massiccio ringiovanimento dei tessuti, ovvero agiscono effettivamente come un elisir di giovinezza.
Queste molecole sono le stesse per tutti i mammiferi. Ad esempio, un peptide estratto dal fegato di agnello o di vitello verrà accettato dal fegato umano come proprio. Ogni organo e sistema del corpo umano corrisponde a un tipo specifico di oligopeptidi regolatori: per le arterie e il cuore, il tessuto osseo, il sistema nervoso, il sistema immunitario, il pancreas, la tiroide, ecc. I progressi della medicina moderna rendono possibile estrarre peptidi dai tessuti dei mammiferi e introdurli nel corpo umano, attivando i processi di riparazione dei tessuti.
I bioregolatori peptidici influenzano il corpo nelle seguenti aree:
- ringiovanire le cellule del corpo;
- aumentare la resistenza cellulare alla carenza di ossigeno;
- aumentare la resistenza cellulare alle tossine e ad altre sostanze nocive;
- ottimizzare il metabolismo dei tessuti;
- ottimizzare l'assorbimento dei nutrienti da parte dei tessuti e il rilascio dei prodotti di degradazione;
- ottimizzare l'attività funzionale delle cellule e del metabolismo cellulare;
- ottimizzare i processi di rigenerazione di tutti i tessuti del corpo.
Oggi i meccanismi di questo sistema normativo sono già noti con certezza. La principale specificità dell'effetto dei peptidi regolatori è la mitosi e la maturazione delle cellule di alcuni tessuti. I peptidi regolatori regolano direttamente il rapporto tra cellule che si moltiplicano, maturano, lavorano e utilizzano, cioè fornire un tasso ottimale di sostituzione delle vecchie cellule con quelle nuove. Inoltre, aumentano la stabilità cellulare e riducono il tasso di morte cellulare programmata, sia nello stato normale dell'organismo che durante le malattie; ciò avviene per l'attivazione di meccanismi intracellulari protettivi e rigeneranti aspecifici.
È grazie alla loro azione a livello fondamentale che i peptidi regolatori corrispondenti a tessuti specifici sono efficaci in una gamma così ampia di malattie. I peptidi regolatori corti differiscono da tutti i farmaci moderni e dagli integratori bioattivi così popolari oggi. Tutto ciò che offre oggi il mercato dei farmaci è chimica e biochimica. I peptidi, a loro volta, non agiscono chimicamente. Portano informazioni contenute negli amminoacidi che li compongono.
Un'altra proprietà positiva dei bioregolatori è che esibiscono attività antiossidante. Inoltre, i peptidi corti sono in grado di determinare la direzione della differenziazione delle cellule staminali. In questo modo attivano il potenziale di riserva di ciascun tessuto e lo ripristinano anche in caso di danni molto gravi.
Forme di dosaggio
I preparati contenenti peptidi bioregolatori sono disponibili in una varietà di forme di dosaggio. Una delle ultime forme di questo tipo, che oggi si sta diffondendo, sono gli integratori alimentari. Oltre agli oligopeptidi, la loro composizione comprende una serie di componenti utili: vitamine, microelementi, ecc.Oggi stanno diventando molto popolari i nanocosmetici: creme, soluzioni e maschere antietà, il cui effetto è ottenuto grazie alla dimensione microscopica dei peptidi: minuscole proteine penetrano facilmente negli strati profondi della pelle, attivando le funzioni delle cellule epiteliali, aumentando la loro resistenza all’influenza negativa di fattori esterni.
I risultati della moderna nanomedicina consentono di creare dentifrici e soluzioni per l'igiene orale: mezzi efficaci per la prevenzione della carie e delle malattie gengivali. Una forma di dosaggio come i peptidi liquidi viene applicata all'interno dell'avambraccio. Assorbite dalla pelle, le nanoparticelle entrano nel flusso sanguigno e linfatico, quindi nelle cellule, negli organi e nei sistemi a cui sono destinate.
Indicazioni
Gli esperti di nanomedicina affermano che l'uso regolare di farmaci a base di peptidi corti non solo può prevenire l'invecchiamento precoce, ma anche aumentare significativamente l'aspettativa di vita, del 20-30%. Gli oligopeptidi non hanno praticamente controindicazioni, quindi sono consigliati a tutte le persone che vogliono mantenere la propria salute e il proprio benessere. I medici consigliano di utilizzare bioregolatori oligopeptidici a partire dai 25-30 anni. Ciò rallenterà significativamente l'invecchiamento del corpo nel suo insieme.Esistono anche indicazioni specifiche per l'uso di farmaci a base di oligopeptidi: presenza di disturbi nel funzionamento di qualsiasi organo o sistema del corpo. Un fattore essenziale per prolungare la giovinezza è il ripristino e il rafforzamento del sistema immunitario, il cui funzionamento è in gran parte determinato dallo stato e dal funzionamento del timo. È grazie a questa ghiandola che il nostro organismo si protegge efficacemente dagli agenti patogeni. Pertanto, si raccomanda di includere nel corso della terapia antietà farmaci volti a ripristinare e rigenerare le cellule del timo.
Di seguito un breve elenco di malattie per le quali sono indicati gli oligopeptidi bioregolatori:
- malattie del sistema circolatorio;
- patologie delle ghiandole endocrine;
- patologie dell'apparato urinario e riproduttivo;
- malattie del sistema muscolo-scheletrico;
- malattie del sistema nervoso centrale e del sistema nervoso periferico;
- deterioramento delle condizioni della pelle, rughe;
- calo di vitalità.
Controindicazioni
- ipersensibilità ai componenti del farmaco;
Ringiovanimento
 La scienza moderna sa per certo che il processo di invecchiamento è anche un fenomeno informativo. Può essere immaginato in questo modo: come se alle cellule venissero date istruzioni di rallentare e poi smettere del tutto di dividersi. Forse in futuro, tra 1-2 decenni, la terapia dell'informazione prevarrà in medicina. Seguendo le istruzioni dall'esterno, il corpo stesso eliminerà le placche aterosclerotiche dai vasi sanguigni, rimuoverà le tossine, distruggerà le cellule maligne, ecc.
La scienza moderna sa per certo che il processo di invecchiamento è anche un fenomeno informativo. Può essere immaginato in questo modo: come se alle cellule venissero date istruzioni di rallentare e poi smettere del tutto di dividersi. Forse in futuro, tra 1-2 decenni, la terapia dell'informazione prevarrà in medicina. Seguendo le istruzioni dall'esterno, il corpo stesso eliminerà le placche aterosclerotiche dai vasi sanguigni, rimuoverà le tossine, distruggerà le cellule maligne, ecc. L'influenza sul corpo con l'aiuto di brevi peptidi regolatori è uno dei primi metodi per influenzare il corpo attraverso l'informazione. Per influenzare queste sostanze su determinati tessuti e sistemi del corpo, gli specialisti del Centro nazionale di ricerca e produzione per le tecnologie di ringiovanimento (San Pietroburgo) hanno sviluppato un metodo transepidermico per la loro somministrazione (attraverso la pelle). Grazie a sostanze speciali, i regolatori peptidici vengono trasportati attraverso gli strati cutanei.
La comodità e la versatilità dell'uso di questi farmaci ne consente l'uso a casa. È sufficiente applicare 12-15 gocce del preparato peptidico una volta al giorno sulla pelle intatta e massaggiare leggermente fino a completo assorbimento. Entro 10-15 minuti. gli oligopeptidi, attraverso il torrente sanguigno, raggiungono le cellule a cui corrispondono.
Molte persone in tutto il mondo hanno già risolto i loro problemi legati all’età attraverso l’uso di oligopeptidi bioregolatori. Molti di loro, avendo già più di 70 anni, sembrano 10-15 anni più giovani.
I risultati dell’utilizzo di questi farmaci sono sorprendenti. Inoltre, il loro importante vantaggio è che i peptidi corti sono completamente sicuri e non hanno controindicazioni o effetti collaterali. Gli effetti del trattamento hanno un effetto positivo su quasi tutto il corpo. Ciò ci consente di parlare dell'effetto sistemico di questi farmaci, fornendo protezione all'apparato genetico delle cellule, ottimizzando i processi energetici, metabolici, fisiologici e informativi nel corpo; contemporaneamente si attivano processi rigenerativi e di ripristino.
I peptidi bioregolatori aiutano a ripristinare la salute e prolungare la giovinezza senza interventi chirurgici o effetti collaterali. Al momento, si tratta principalmente di farmaci per il ringiovanimento e la prevenzione delle malattie. Ripristinando ogni organo, le cui funzioni svaniscono nel tempo, si può godere dell'elevata vitalità e dell'ottima salute che le cellule giovani donano al nostro corpo per molti anni. Tuttavia, non dobbiamo dimenticare che, oltre a utilizzare i farmaci peptidici, dobbiamo condurre uno stile di vita sano.
Peptidi sintetici
Oggi, i preparati peptidici prodotti da organi di animali giovani e materiali vegetali non hanno ancora ricevuto una distribuzione di massa. Il fatto è che l'uso di tali farmaci è associato ad alcuni rischi, in particolare allergie e infezioni virali. Per questi motivi il Parlamento Europeo ha adottato una serie di gravi restrizioni alla loro vendita.Gli scienziati hanno sviluppato metodi per creare peptidi artificiali. Consiste in una connessione sequenziale di aminoacidi. Di conseguenza, è stato creato un nuovo tipo di medicinale: i regolatori peptidici, costituiti da tre aminoacidi collegati consecutivamente. Tali farmaci sono riconosciuti come analoghi dei bioregolatori naturali estratti da organi animali, ma, a differenza di questi ultimi, sono completamente sicuri. Tuttavia, hanno un’efficacia inferiore ai peptidi naturali.
Revisione dei farmaci
Oggi sul mercato farmaceutico esiste solo una grande azienda che produce bioregolatori peptidici medicinali. Questo è il Centro di ricerca e produzione per la rivitalizzazione e la salute. Tutti i farmaci sono prodotti utilizzando tecnologie brevettate.Citomax
I complessi peptidici naturali di Cytomax includono oligopeptidi estratti dai tessuti di animali giovani come principali principi attivi.
Elenco dei citomax:
- Ventfort – bioregolatore vascolare;
- Vladonix è un bioregolatore del sistema immunitario;
- Svetinorm – bioregolatore del fegato;
- Sigumir è un bioregolatore della cartilagine e del tessuto osseo;
- Suprefort – bioregolatore del pancreas;
- Thyrogen – bioregolatore della tiroide;
- Cerluten è un bioregolatore del cervello e del sistema nervoso;
- Pielotax è un bioregolatore dei reni e del sistema urinario;
- Stamacort è un bioregolatore dello stomaco;
- Visoluten è un bioregolatore dell'analizzatore visivo (occhio);
- Endoluten è un complesso bioregolatore ottenuto dalla ghiandola pineale di animali giovani; Ha un effetto curativo generale, ottimizzante e ringiovanente sul corpo.
I citogeni sono analoghi sintetici dei peptidi regolatori naturali. Sono considerati meno efficaci rispetto ai peptidi naturali, pertanto sono raccomandati nelle fasi iniziali della terapia peptidica, nonché per brevi cicli di trattamento e per la prevenzione dell'invecchiamento.
Elenco dei citogeni:
- Vezugen – regolatore vascolare;
- Kartalax – regolatore della cartilagine e del tessuto osseo;
- Christagen – regolatore del sistema immunitario;
- Ovageno – regolatore del fegato e del tratto digestivo;
- Pinealon è un regolatore del cervello e del sistema nervoso nel suo complesso;
- Honluten è un regolatore dei polmoni e della mucosa dell'albero bronchiale.
Questi complessi sono basati su peptidi ottenuti da organi e tessuti di animali giovani. La soluzione viene applicata all'interno dell'avambraccio e massaggiata con leggeri movimenti massaggianti. L'effetto di un corso di 2-4 mesi dura fino a sei mesi. Quindi si consiglia di ripetere il corso.
Elenco dei complessi peptidici liquidi:
- PC1 – per i vasi sanguigni e il muscolo cardiaco;
- PC2 – per il sistema nervoso nel suo insieme;
- PC3 – per il sistema immunitario;
- PC4 – per il tessuto cartilagineo (articolazioni);
- PC5 – per il tessuto osseo;
- PC6 – per la tiroide;
- PC7 – per il pancreas;
- PC8 – per il fegato;
- PC9 – per il sistema riproduttivo maschile;
- PC10 – per il sistema riproduttivo femminile;
- PC11 – per i reni e il sistema urinario.
Peptidi e ammine, prodotti dalle cellule endocrine del tratto digestivo stesso, partecipano alla gestione delle funzioni digestive. Queste cellule sono sparse nella mucosa e nelle ghiandole digestive e insieme costituiscono il sistema endocrino diffuso. I prodotti della loro attività sono chiamati ormoni gastrointestinali, enterine e peptidi regolatori del tratto digestivo. Questi non sono solo peptidi, ma anche ammine. Alcuni di essi sono prodotti anche dalle cellule nervose. Nel primo caso, queste sostanze biologicamente attive agiscono come ormoni (forniti agli organi bersaglio dal flusso sanguigno generale e regionale) e paraormoni (diffusi attraverso il tessuto interstiziale in una cellula vicina o vicina). Nel secondo caso, queste sostanze svolgono il ruolo di neurotrasmettitori.
Sono stati scoperti più di 30 peptidi regolatori del tratto digestivo, alcuni di essi esistono in diverse isoforme, che differiscono per numero di gruppi amminici e attività fisiologica. Sono state identificate cellule che producono questi peptidi e ammine (Tabella 9.1), così come cellule in cui si formano non uno, ma diversi peptidi. È stato stabilito che lo stesso peptide può formarsi in cellule diverse.
Gli ormoni gastrointestinali svolgono un'ampia gamma di attività fisiologiche, influenzando le funzioni digestive e causando effetti generali. Nel tratto digestivo, peptidi e ammine stimolano, inibiscono, modulano la secrezione, la motilità, l'assorbimento, hanno effetti trofici, compreso l'influenza sui processi proliferativi, ad esempio, modificando il numero del glande
dulociti nella mucosa gastrica e nel pancreas, riducendo o aumentando la loro massa. Ciascuno dei peptidi regolatori provoca diversi effetti, uno dei quali è spesso il principale (Tabella 9.2). Un certo numero di peptidi agiscono come fattori di rilascio per altri peptidi, che causano cambiamenti nelle funzioni digestive in questa cascata regolatrice. Gli effetti dei peptidi regolatori dipendono dalla loro dose e dai meccanismi con cui la funzione è stata stimolata.
Le influenze combinate di diversi peptidi regolatori, così come dei peptidi con le influenze del sistema nervoso autonomo (autonomo), sono complesse.
I peptidi regolatori rientrano tra le sostanze “di breve durata” (emivita di diversi minuti); gli effetti che provocano, di regola, sono molto più lunghi. Concentrazione
Tabella 9.1. Tipi e localizzazione delle cellule endocrine del tubo digerente e dei prodotti che formano
|
Tipi |
Educato |
|
Posizione della cella |
|
|||
|
cellule |
prodotti |
dare fuoco a |
stomaco |
intestini |
|||
|
|
|
No |
divertimento- |
formica- |
magro |
intestino |
spesso |
|
|
|
|
lontano- No Parte |
No Parte |
procura piccolo Dipartimento |
dis Alto Dipartimento |
|
|
Unione Europea |
Serotonina, sostanza P, encefalina |
Pochi |
+ |
+ |
+ |
+ |
+ |
|
D |
Somatostatina |
+ |
+ |
+ |
+ |
Pochi |
Pochi |
|
IN RR |
Insulina Pancreatico |
+ |
- |
|
- |
- |
- |
|
|
peptide (PP) |
+ |
- |
- |
- |
- |
- |
|
UN |
Glucagone |
+ |
- |
- |
- |
- |
- |
|
X |
Sconosciuto |
- |
+ |
- |
- |
- |
- |
|
ECL |
Sconosciuto (serotonina? istamina?) |
- |
+ |
- |
- |
- |
- |
|
G |
Gastrina |
- |
- |
+ |
+ |
- |
- |
|
SSK |
Colecistochinina (HCC) |
- |
- |
- |
+ |
Pochi |
- |
|
S GIP |
Secretina Gastroinibitorio |
|
- |
- |
+ |
Pochi |
- |
|
|
peptide (GIP) |
- |
- |
- |
+ |
Pochi |
- |
|
M |
Motilin |
- |
- |
- |
+ |
Pochi |
- |
|
N |
Neurotensina |
- |
- |
- |
Pochi |
+ |
Raramente |
|
l |
Peptide immunologicamente simile al glucagone, glicentina |
|
|
|
Pochi |
+ |
+ |
|
GRP VIP |
Peptide rilasciante la gastrina Peptide intestinale vasoattivo (VIP) |
|
Pochi |
+ |
+ |
|
|
Tabella 9.2. I principali effetti degli ormoni gastrointestinali sulle funzioni digestive
|
Ormoni |
Effetti (i più pronunciati sono evidenziati) |
|
Gastrina |
Aumento della secrezione dello stomaco (acido cloridrico e pepsinogeno) e del pancreas, ipertrofia della mucosa gastrica, aumento della motilità dello stomaco, dell'intestino tenue e crasso e della cistifellea |
|
Secretina |
Aumento della secrezione di bicarbonati da parte del pancreas, potenziamento dell'azione della colecistochinina (CCK) sul pancreas, inibizione della secrezione di acido cloridrico nello stomaco e della sua motilità, aumento della formazione della bile, secrezione dell'intestino tenue |
|
Colecistochinina (CCK) |
Aumento della motilità della cistifellea e secrezione di enzimi da parte del pancreas, inibizione della secrezione |
|
Peptide gastrointestinale (stomaco, inibitorio). (GIP o GIP) Motilin |
reazione dell'acido cloridrico nello stomaco e sua motilità, aumento della secrezione di pepsinogeno in esso, motilità dell'intestino tenue e crasso, rilassamento dello sfintere epatico-pancreatico (fiale di Oddi). Soppressione dell'appetito, ipertrofia pancreatica Aumento glucosio-dipendente del rilascio di insulina pancreatica, inibizione della secrezione gastrica e della motilità riducendo il rilascio di gastrina, aumento della secrezione intestinale e inibizione dell'assorbimento di elettroliti nell'intestino tenue Aumento della motilità dello stomaco e dell'intestino tenue, secrezione di pepsinogeno da parte dello stomaco, secrezione dell'intestino tenue |
|
Neurotensina |
Inibizione della secrezione di acido cloridrico da parte dello stomaco, aumento della secrezione del pancreas, potenziamento degli effetti della secretina e della CCK |
|
Peptide pancreatico (PP) |
Antagonista del CCK. Inibizione della secrezione di enzimi e bicarbonati da parte del pancreas, aumento della proliferazione della mucosa dell'intestino tenue, del pancreas e del fegato, rilassamento della bile |
|
Enteroglucagone |
vescica, aumento della motilità dello stomaco e dell'intestino tenue Mobilizzazione dei carboidrati, inibizione della secrezione dello stomaco e del pancreas, motilità dello stomaco e dell'intestino, proliferazione della mucosa dell'intestino tenue (induzione della glicogenolisi, lipolisi, gluconeogenesi e chetogenesi) |
|
Peptide UU |
Inibizione delle secrezioni gastriche e pancreatiche |
|
Peptide intestinale vasoattivo (VIP) |
ghiandole (differenze negli effetti a seconda della dose e dell'oggetto di studio) Rilassamento della muscolatura liscia dei vasi sanguigni, cistifellea, sfinteri, inibizione della secrezione gastrica, aumento della secrezione di idrocarbonati. |
|
Fattore di rilascio della gastrina |
ghiandola gastrica, secrezione intestinale Effetti della gastrina e aumento del rilascio di CCK (e i suoi effetti) |
|
Chimodenina |
Stimolazione della secrezione pancreatica del chimotripsinogeno |
|
Sostanza P |
Aumento della motilità intestinale, salivazione, secrezione pancreatica, inibizione dell'assorbimento |
|
Encefalina |
sodio Inibizione della secrezione enzimatica da parte del pancreas e dello stomaco |
i peptidi nel sangue a stomaco vuoto fluttuano entro piccoli limiti; l'assunzione di cibo provoca un aumento della concentrazione di un numero di peptidi in tempi diversi. La relativa costanza del contenuto di peptidi nel sangue è assicurata dall'equilibrio dell'ingresso dei peptidi nel flusso sanguigno con la loro degradazione enzimatica; una piccola quantità di essi viene rimossa dal sangue come parte delle secrezioni e degli escrementi e viene legata dalle proteine del sangue . La degradazione dei polipeptidi porta alla formazione di oligopeptidi più semplici, che hanno attività maggiore o minore, talvolta qualitativamente modificata. Un'ulteriore idrolisi dei peptidi porta alla perdita della loro attività. La degradazione dei peptidi avviene principalmente nei reni e nel fegato. I peptidi regolatori del tratto digestivo, insieme ai meccanismi centrali e periferici, assicurano la natura adattiva e l'integrazione delle funzioni digestive.
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0