Il sistema extrapiramidale rimane uno dei sistemi cerebrali meno studiati dal punto di vista sia delle neuroscienze fondamentali che cliniche. Questa situazione è dovuta a una serie di fattori oggettivi: la complessità della struttura anatomica, numerose connessioni neuronali con varie parti del sistema nervoso e la presenza di un numero significativo di interneuroni, un sistema di funzionamento a più livelli in cui un numero significativo di sono coinvolti diversi neurotrasmettitori, difficoltà nell'oggettivazione laboratoristica e strumentale delle sindromi cliniche.
Sistema extrapiramidaleè un sistema anatomico e funzionale che comprende i gangli della base (secondo alcuni ricercatori i gangli della base sono classificati come i centri più alti del sistema extrapiramidale), parte della materia grigia del mesencefalo e del diencefalo, e numerose connessioni di queste strutture con varie parti del cervello e del midollo spinale. Il termine “sistema extrapiramidale” fu proposto per la prima volta da Wilson (1912) dopo la sua descrizione della degenerazione epatolenticolare.
I gangli della base comprendono un gruppo di nuclei situati alla base degli emisferi cerebrale, mesencefalo e diencefalo (Fig. 1):
I. Nucleo caudato (nucleo caudatus).
II. Nucleo lentiforme (nucleus lentiformis), costituito da:
- dal guscio (putamen);
- globo pallido (globus pallidum).
III. Sostanza nera (substancia nigra).
IV. Nucleo subtalamico (nucleo subthalamicus).
Una descrizione dettagliata dei gangli della base appartiene a V.M. Bekhterev, che unì il nucleo caudato e il putamen nel neostriato, o striato (formazioni filogeneticamente più giovani), definì il globo pallido paleostriato, o palidum. È ormai accertato che la funzione dello striato è in gran parte determinata dalla sua composizione cellulare. Si stima che lo striato umano contenga circa 110 milioni di piccoli neuroni acromatici e circa 670mila grandi neuroni multipolari. Il 95% delle cellule striatali è rappresentato da neuroni spinosi di medie dimensioni, che sono neuroni di proiezione. I restanti neuroni sono classificati come interneuroni (interneuroni).
L'intero flusso di informazioni afferenti che entrano nel complesso striopallidale termina nello striato. Riceve impulsi dalle seguenti strutture:
1) la maggior parte delle aree della corteccia cerebrale;
2) nuclei intralaminari centrali del talamo;
3) parte compatta della substantia nigra e altri nuclei dell'area tegmentale ventrale del mesencefalo;
4) nuclei del rafe mesencefalo;
5) punto blu.
Dallo striato le informazioni fluiscono al globo pallido e alla parte reticolare della substantia nigra, da cui partono le principali vie efferenti dei gangli della base verso le aree motorie del talamo, i nuclei della formazione reticolare del mesencefalo, principalmente per il nucleo peduncolopontino, che costituisce l'anello di trasmissione per l'influenza dei gangli della base sui meccanismi motori spinali.
Di grande importanza per comprendere il funzionamento dei gangli della base, il loro ruolo nella regolazione delle funzioni motorie e nello sviluppo dei disturbi del movimento è associato allo studio della loro organizzazione dei neurotrasmettitori. È stato stabilito che l'attività funzionale del sistema striopallidale è determinata dalla complessa interazione di vari sistemi neurotrasmettitori. Attualmente, la funzione dei seguenti neurotrasmettitori è stata studiata in modo più approfondito: glutammato, aspartato, acido gamma-aminobutirrico, norepinefrina, serotonina, adrenalina, dopamina, sostanza P.
Lo scambio di informazioni tra la corteccia e i gangli della base avviene attraverso circoli cortico-sottocorticali. Attualmente sono noti cinque di questi circoli, due dei quali sono coinvolti nella regolazione dei movimenti (sensomotorio e oculomotore) e tre sono coinvolti nella regolazione delle funzioni cognitive e delle reazioni comportamentali (prefrontale dorsolaterale, orbitofrontale laterale, cingolato anteriore). Nella malattia di Parkinson, la patologia di queste vie non motorie gioca un ruolo nella formazione dei disturbi mentali.
Il ruolo principale nella formazione dei disturbi motori nella patologia del sistema extrapiramidale è giocato dalla patologia della via dopaminergica nigrostriatale. La degenerazione di questo percorso nella malattia di Parkinson porta ad una forte diminuzione della sintesi e del rilascio di dopamina dai suoi terminali nello striato. Il funzionamento della via dopaminergica nigrostriatale dipende dall'attività dei recettori della dopamina. Attualmente ne esistono due grandi gruppi: i recettori D1 e D2.
Esistono altri due sistemi dopaminergici ascendenti: la via mesolimbica e quella mesocorticale. La via mesolimbica collega il mesencefalo con le formazioni filogeneticamente più antiche del prosencefalo e termina nella regione ventrale dello striato e nella corteccia frontale. Si ritiene che la funzione primaria di questo percorso sia coinvolta nel controllo dell'umore e del comportamento. Nella malattia di Parkinson si osserva una carenza di dopamina nella via mesolimbica, che può spiegare i disturbi emotivi (principalmente depressione) e altri disturbi mentali che sono comuni in questa malattia. Inoltre, ci sono informazioni sulla partecipazione della via mesolimbica nel controllo dell'inizio di un atto motorio e delle reazioni affettive motorie. Pertanto, la sua disfunzione può essere importante nello sviluppo dell’acinesia primaria.
La via dopaminergica mesocorticale va dal mesencefalo alle aree prefrontale, cingolata e olfattiva della corteccia cerebrale. Si presume che la sua attivazione possa essere associata ad un effetto inibitorio sull'attività comportamentale. Si ritiene che la patologia di questa via, insieme alla patologia della via mesocorticale, possa essere importante nella formazione dei disturbi mentali nella malattia di Parkinson.
È necessario soffermarsi più in dettaglio sulla connessione tra lo striato e il globo pallido. Viene effettuato attraverso due vie neuronali. Uno di essi è diritto e collega il putamen e il nucleo caudato con il segmento interno del globo pallido e la parte reticolare della substantia nigra. La sua funzione è regolata prevalentemente dai recettori D1. L'altro percorso è indiretto: raggiunge il segmento interno del globo pallido e la parte reticolare della substantia nigra, dirigendosi prima al segmento esterno del globo pallido, quindi al nucleo subtalamico, e solo dopo raggiunge la meta originaria . La via indiretta è regolata principalmente dai recettori D2.
L'attivazione della via diretta stimola le aree motorie della corteccia e facilita la formazione dei movimenti, mentre la via indiretta indebolisce le influenze eccitatorie talamocorticali e provoca ipocinesia e rigidità. La dopamina facilita la conduzione degli impulsi lungo la via diretta e ha un effetto inibitorio sulla via indiretta. In condizioni di carenza di dopamina (morbo di Parkinson), l'attività funzionale della via diretta diminuisce e aumenta l'attività della via indiretta. Ciò è accompagnato dall'inibizione della conduzione lungo la via eccitatoria talamocorticale e dall'interruzione dell'attività funzionale della corteccia motoria aggiuntiva.
morbo di Parkinson(PD) è una malattia cerebrale cronica e progressiva con degenerazione dei neuroni nigrostriatali e disfunzione dei gangli della base. La malattia fu descritta per la prima volta dal neurologo inglese James Parkinson nel 1817 e la chiamò “paralisi tremante”. Nel 1877, il neurologo Charcot descrisse più dettagliatamente le manifestazioni cliniche della malattia e propose di chiamarla malattia di Parkinson. La malattia di Parkinson è una delle forme più comuni di malattie neurodegenerative croniche primarie. Secondo i concetti moderni, la malattia di Parkinson, o parkinsonismo idiopatico primario, è una malattia multisistemica neurodegenerativa sporadica e familiare con significativo polimorfismo clinico e variabilità del decorso, eterogeneità eziopatogenetica e morfologica, con un buon effetto della terapia dopaminergica in relazione ai classici disturbi del movimento parkinsoniani.
La prevalenza della malattia di Parkinson è piuttosto elevata e varia da 67 a 350 casi ogni 100mila abitanti. La prevalenza più alta è stata registrata negli Stati Uniti - 107-329 casi ogni 100mila abitanti, la più bassa tra i paesi europei - in Svezia - 76 casi. In Ucraina la prevalenza è di circa 133 casi ogni 100mila abitanti, anche se le cifre reali sembrano essere molto più elevate. La malattia ha una chiara struttura dipendente dall’età: quanto più anziana è la popolazione, tanto più comune è la malattia. Pertanto, dopo i 65 anni ne soffre l'1% della popolazione; dopo gli 80 anni la malattia colpisce il 3-4% della popolazione. Molto spesso, i primi sintomi della malattia vengono registrati all'età di 42-52 anni. Va sottolineato che, nonostante le idee tradizionali sulla natura della malattia di Parkinson dipendente dall'età, i casi di incidenza in giovane età non sono da tempo rari: si ritiene che circa un paziente su dieci sviluppi la malattia di Parkinson prima dei 50 anni, e ogni ventesimo - prima dei 40 anni. A questo proposito, esiste anche un sottogruppo separato: la malattia di Parkinson a esordio precoce, che si distingue per una serie di caratteristiche dei meccanismi di sviluppo della malattia, nonché per il quadro clinico e il decorso, la risposta ai farmaci antiparkinsoniani e la prognosi. . Attualmente nel mondo ci sono circa 5-6 milioni di persone affette da Parkinson. Anche il tasso di incidenza per 100mila abitanti presenta un andamento diverso a seconda del Paese in cui è stato condotto lo studio. L'incidenza più alta è stata registrata nelle Isole Faroe - 21,1, la più bassa - in Libia - 4,5 ogni 100mila abitanti. Uomini e donne si ammalano all'incirca con la stessa frequenza, con una leggera predominanza degli uomini, anche se in Giappone le donne si ammalano 1,5 volte più spesso.
Solo all’inizio del 21° secolo, i progressi nello sviluppo della genetica molecolare e della biologia molecolare hanno permesso di far luce sulle basi genetiche dell’eziologia della malattia di Parkinson. Sono stati identificati numerosi geni responsabili di forme ereditarie di parkinsonismo primario in casi familiari. Secondo i concetti moderni, dal 5 al 10% di tutti i casi di Parkinson hanno una base monogenica diretta. I restanti casi sono sporadici e hanno natura multifocale. Nello sviluppo della forma sporadica della malattia di Parkinson, l'interazione di fattori genetici e ambientali gioca un ruolo decisivo, che in definitiva determina le caratteristiche della disintossicazione cellulare e del metabolismo xenobiotico, della protezione antiossidante, dell'elaborazione di un certo numero di proteine neuronali e della natura della dopamina metabolismo. La scoperta dei principali legami molecolari della degenerazione nigrostriatale ha permesso di comprendere la cascata patobiochimica della malattia di Parkinson.
Attualmente sono stati identificati più di 15 geni di forme ereditarie di parkinsonismo primario. Le più studiate e di primaria importanza sono 6 varianti genetiche:
1. PARK1 (a-sinucleina). La proteina alfa-sinucleina svolge un ruolo importante nel trasporto vescicolare sinaptico e nella conservazione dei neurotrasmettitori. Le mutazioni (ereditarie o dovute all'esposizione a fattori neurotossici esogeni) nel gene dell'a-sinucleina portano a cambiamenti nella struttura della proteina, al suo accumulo nel neurone e all'aggregazione con la formazione di corpi di Lewy. Attualmente, l’a-sinucleina è considerata un marcatore molecolare chiave della patologia neuronale e della modulazione dei processi neurodegenerativi di tipo parkinsoniano.
2. PARK2 (parcheggio). Le mutazioni nel gene parkin sono una causa comune di parkinsonismo precoce, anche giovanile (fino al 50% delle forme familiari e circa il 15% dei casi sporadici). Parkin è una ubiquitina-proteina ligasi E3 la cui funzione è quella di fornire proteine conformate in modo anomalo al complesso del proteasoma per la successiva degradazione.
3. PARCO6 (ROSA). Una forma di parkinsonismo autosomico recessivo rappresenta fino al 9% dei casi di esordio precoce della malattia. La proteina PINKI è una proteina chinasi mitocondriale e svolge un ruolo importante nella biogenesi mitocondriale.
4. PARCO7 (DJ-I). Una forma rara di parkinsonismo autosomico recessivo: 1-2% dei casi precoci di Parkinson. La proteina DJ-I svolge un ruolo importante nel mantenimento dell'integrità e della sopravvivenza dei neuroni dopaminergici.
5. PARCO8 (LRRK2). Il gene è associato ad una forma autosomica dominante di parkinsonismo con una penetranza fino al 40%. Il gene LRRK2 è di grande importanza nello sviluppo di casi sporadici di parkinsonismo primario: dalla tipica PD tardiva a corpi di Lewy alle varianti atipiche della patologia sinucleina e tau. Il prodotto proteico del gene è il dardarina; la sua attivazione patologica è una conseguenza di una mutazione dominante nel gene LRRK2 e porta allo sviluppo di cambiamenti neurodegenerativi.
6. Gene GBA. Codifica per l'enzima lisosomiale glucocerebrosidasi. Le mutazioni in questo gene possono essere accompagnate dallo sviluppo di varie varianti di sinucleinopatie: la classica malattia di Parkinson e la demenza con corpi di Lewy.
In molti modi, la patogenesi della malattia di Parkinson rimane sconosciuta e deve essere studiata. Vale la pena menzionare le scoperte fondamentali che hanno cambiato le nostre idee sulla natura del PD. Tra questi c'è una descrizione della degenerazione di grandi cellule contenenti melatonina della substantia nigra, che appartiene allo scienziato russo K.P. Tretyakov (1919), identificazione della carenza di dopamina nei gangli della base (H. Ehringer, O. Hornykiewicz, 1960). Dopo aver riassunto i materiali di vari autori sullo studio della degenerazione dei neuroni nigrostriatali, G.N. Kryzhanovsky et al. (1995) hanno elencato i disturbi del metabolismo intracellulare che contribuiscono al verificarsi della neurodegenerazione:
— interruzione della respirazione mitocondriale e danno ai mitocondri;
— deficit energetico del neurone;
— aumento dell'ossidazione dei radicali liberi con formazione di perossidi aggressivi;
— eccessivo accumulo di ioni calcio liberi;
— violazione del metabolismo degli xenobiotici.
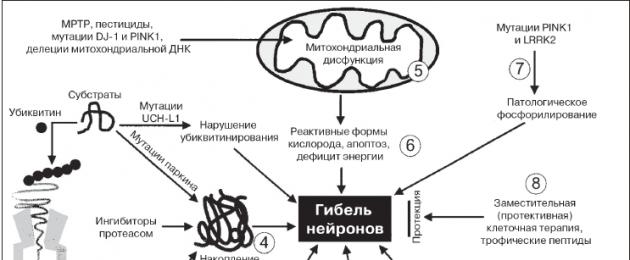
La tappa più importante nella comprensione della patogenesi della malattia di Parkinson è stata l'enorme progresso raggiunto nello studio dei fattori genetici nello sviluppo della malattia, che portano allo sviluppo del processo neurodegenerativo (Fig. 2). È stato stabilito che i meccanismi molecolari della malattia di Parkinson si basano su una violazione del sistema di controllo sulla biogenesi, sull'organizzazione spaziale e sulla biodegenerazione delle proteine neuronali. Un ruolo chiave è svolto dall'a-sinucleina, la cui aggregazione patologica sotto forma di strutture fibrillare costituisce il primo stadio della formazione dei corpi di Lewy. Allo stesso tempo, le forme oligomeriche intermedie di a-sinucleina hanno la maggiore neurotossicità, mentre la formazione di fibrille mature, e in particolare di corpi di Lewy, è una reazione protettiva della cellula volta a neutralizzare gli oligomeri di a-sinucleina tossici. La neurotossicità si realizza attraverso vari meccanismi: induzione di reazioni dei radicali liberi, interruzione del flusso endoplasmatico, attivazione delle proteine chinasi dello stress e processi di apoptosi, attivazione della microglia, interruzione dell'interazione dell'alfa-sinucleina con le sue proteine partner naturali. Il risultato finale di questi processi è lo sviluppo e la progressione dei processi neurodegenerativi con una diminuzione della produzione di dopamina. Come accennato in precedenza, ciò provoca la disfunzione dei neuroni dei gangli della base, principalmente la disinibizione e l'eccessiva attività dei neuroni nel segmento interno del globo pallido, la parte reticolare della substantia nigra, e porta all'inibizione dei neuroni talamocorticali e ad un deficit nell'attivazione di neuroni nella corteccia motoria aggiuntiva, che sono associati allo sviluppo delle principali manifestazioni motorie della malattia di Parkinson. Oltre ai neuroni dopaminergici della substantia nigra, altri gruppi di neuroni vanno incontro a degenerazione nella malattia di Parkinson, inclusi i neuroni del nucleo dorsale del nervo vago, i neuroni del bulbo olfattivo, i neuroni noradrenergici del locus coeruleus, i neuroni serotoninergici dei nuclei del rafe, neuroni colinergici del nucleo di Meynert, nonché neuroni della corteccia cerebrale e alcuni plessi autonomi. Per questo motivo, oltre alla carenza di dopamina, si verifica la disfunzione dei sistemi serotoninergico, noradrenergico e colinergico. Le manifestazioni non motorie della malattia sono associate a danni alle strutture extranigrali.

Manifestazioni cliniche del PD
La base del quadro clinico della malattia di Parkinson è la classica triade: acinesia (ipocinesia), rigidità muscolare e tremore a riposo. In una fase successiva della malattia appare un quarto sintomo: l'instabilità posturale. La malattia può iniziare con ciascuno dei tre sintomi indicati, ai quali si aggiungono successivamente altri sintomi. In alcuni casi, l’esordio della malattia di Parkinson può consistere in due o anche tre sintomi contemporaneamente.
Acinesia (ipocinesia) rappresenta una diminuzione dell’attività motoria spontanea. La vera acinesia (completa mancanza di movimento) è piuttosto rara, soprattutto nelle fasi finali della malattia di Parkinson. Nelle fasi iniziali si osserva lentezza (bradicinesia) e povertà dei movimenti volontari (oligocinesia).
Le componenti dell'acinesia sono quattro (A. Barbeau, 1984):
1) violazione dell'iniziativa motoria;
2) violazione della “melodia” cinetica;
3) violazione della strategia di apprendimento motorio;
4) rapido esaurimento durante l'esecuzione di compiti ripetuti con graduale attenuazione dell'attività motoria.
Clinicamente, l'ipocinesia viene rilevata con una serie di movimenti volontari:
- il paziente si blocca in varie posizioni, a volte assomiglia a un manichino;
- sorgono difficoltà nell'iniziare il movimento e nel cambiare la posizione del corpo (se l'ipocinesia è sufficientemente pronunciata, il paziente può fare diversi tentativi prima di effettuare un movimento);
— si sviluppa ipomimia, non vi è colorazione emotiva sul viso, il paziente sbatte le palpebre raramente (sintomo di Marie);
- la parola diventa tranquilla, monotona, poco modulata, gradualmente svanendo; a causa dei tremori delle corde vocali, la parola può acquisire un carattere “tremante”;
- è caratteristico lo sviluppo di disturbi della fonazione (disfonia); nei casi più gravi, il parlato diventa sussurrato. Alcuni pazienti, in base alla presenza o all'assenza di disturbi della fonazione, regolano autonomamente la dose dei farmaci contenenti levado;
- durante la deambulazione non ci sono movimenti coniugati (acheirocinesi), con emiparkinsonismo - da un lato.
Secondo il meccanismo di sviluppo, alcuni ricercatori distinguono l'acinesia primaria e secondaria. L'acinesia secondaria è causata dalla rigidità ed è associata alla degenerazione primaria dei neuroni nella parte ventrale della substantia nigra pars compacta. L'acinesia primaria si sviluppa più tardi, in media 5 anni dopo l'esordio della malattia, ed è associata alla morte dei neuroni nello strato dorsale e nel nucleo mediale della substantia nigra pars compacta (fornitura di dopamina della via dopaminergica mesolimbica). È accompagnato da acinesia psicomotoria, depressione e formazione di deterioramento cognitivo. Con lo sviluppo dell'acinesia primaria, l'efficacia dei farmaci levodopa diminuisce.
Per la diagnosi precoce dell'ipocinesia possono essere utilizzati i seguenti test:
— Test di Fournier: al paziente viene chiesto di eseguire una serie di movimenti il più velocemente possibile: alzarsi, sedersi, girarsi, piegarsi, ecc. Già nelle fasi iniziali dell'ipocinesia, durante l'esecuzione del test, si può notare lentezza dei movimenti;
— test di tocco con il pollice e l'indice: il paziente, alla massima velocità possibile e con la massima ampiezza, batte sul tavolo con il pollice e l'indice alternativamente con entrambe le mani. Il test è particolarmente informativo nello sviluppo dell'emiparkinsonismo: in questo caso, una mano resta indietro rispetto al ritmo e all'ampiezza;
- test di compressione e apertura della mano: al paziente viene chiesto di stringere e aprire la mano il più rapidamente possibile (la mano dal lato in cui si sviluppa l'ipocinesia resta indietro).
Il sintomo successivo è rigidità (ipertensione muscolare)- rappresenta un aumento plastico del tono muscolare e presenta le seguenti caratteristiche:
- caratterizzato da un aumento del tono muscolare già nella fase iniziale del movimento e persiste fino alla fine del movimento, causato dalla contrazione simultanea dei muscoli antagonisti e agonisti. Il grado di rigidità aumenta da movimento a movimento. La rigidità muscolare descritta è definita ipertonicità muscolare plastica, o rigidità extrapiramidale;
- Fenomeno negro - un sintomo di una "ruota dentata": una sensazione di intermittenza, resistenza muscolare passo dopo passo sullo sfondo dell'ipertono plastico;
- sintomo del “cuscino d'aria”: dopo aver sollevato la testa del paziente sopra il cuscino, rimane in questa posizione per qualche tempo;
— posa del “chiedente”: a causa dell'aumento del tono muscolare, la testa è abbassata, le braccia e le gambe sono piegate alle articolazioni del gomito e del ginocchio;
— Sintomo di Dylev: la forza della resistenza passiva è molto maggiore della forza dei movimenti attivi;
- quando si esegue il test dell'oscillazione della gamba a forma di pendolo, interrompere l'oscillazione immediatamente dopo aver completato il test.
Per individuare la rigidità nelle fasi iniziali della malattia, quando è lieve, si possono utilizzare i seguenti esami:
— Manovra di Noyk-Ganev: quando il medico esegue movimenti passivi di flesso-estensione nell'articolazione del polso di un paziente sdraiato, gli viene chiesto di sollevare lentamente la gamba sul lato dello studio - in presenza di tono plastico nascosto, il ricercatore si sente un aumento della resistenza nell'arto sottoposto a prova;
- Sintomo di Formann: aumento del tono muscolare plasticamente aumentato quando esaminato nelle mani di un paziente nella posizione di Romberg con gli occhi chiusi;
— un aumento plastico del tono muscolare aumenta dopo movimenti ripetuti nell'arto in studio;
- test “scuotere le spalle”: il paziente assume una posizione verticale, gli viene chiesto di rilassarsi, quindi il medico posiziona i palmi delle mani sulle spalle del paziente ed esegue rapidi mezzi giri rotatori alternati del suo corpo attorno all'asse verticale. Il test è sufficientemente sensibile per valutare il grado di rigidità muscolare e di ipotensione e consente di determinare la simmetria dei cambiamenti tonico-muscolari.
Tremore (tremore). La sua natura è definita tremore a riposo:
— la frequenza del tremore è 4-6 Hz;
- inizia solitamente da un lato dalle parti distali del braccio;
- nella mano, i movimenti multidirezionali del pollice e delle altre dita della mano creano un'immagine peculiare di "rotolare pillole" o "contare monete";
- nei casi tipici, il tremore a riposo scompare durante i movimenti volontari e scompare durante il sonno;
— man mano che la malattia progredisce, il tremore si diffonde successivamente dalla mano all'avambraccio, alla spalla (polso, gomito, articolazioni della spalla) e successivamente può essere coinvolta in questo processo la gamba con lo stesso nome. Si possono osservare tremori alla gamba quando il paziente è seduto in una posizione scomoda; il tremore scompare mentre cammina;
- in alcuni casi, quando il tremore è generalizzato, i muscoli del collo e del viso sono coinvolti nel tremore, che è accompagnato da tremore della testa, della mascella inferiore, delle labbra e della lingua.
Disturbi posturali. Consistono in violazioni della postura, della statica e dell'andatura. Sono causate da ipocinesia, rigidità muscolare, disfunzione del tono posturale e dei riflessi; Clinicamente si manifesta come segue:
- il paziente ha difficoltà a mantenere il baricentro del corpo nella zona di appoggio;
- si verifica il fenomeno della propulsione, retropulsione, lateropulsione: una transizione improvvisa, spontanea o causata da una spinta esterna, alla camminata veloce in avanti, all'indietro o di lato. In questo caso, il corpo del paziente è inclinato nella direzione del movimento e può superare il movimento delle gambe, che è accompagnato dalla caduta del paziente;
- un sintomo di “calpestio”: il paziente, alzandosi da una sedia o da un letto, non può iniziare immediatamente a muoversi, ma cammina per qualche tempo in un posto. Dopo aver iniziato a muoversi, cammina a piccoli passi (microbasia), trascinando i piedi sul pavimento. Per cambiare la direzione del movimento, il paziente è costretto a fermarsi, segna il tempo per un po 'e solo gradualmente cambia direzione e inizia a muoversi. Quando si gira, il paziente potrebbe cadere.
Cinesia paradossale. A volte, sullo sfondo dell'ipocinesia, si verificano episodi in cui il paziente può improvvisamente eseguire una serie di movimenti rapidi e complessi (correre dietro a un filobus, ballare). Ciò di solito accade in uno stato di passione o sullo sfondo di esperienze emotive, più spesso sullo sfondo di emozioni positive. Il periodo di cinesia paradossa viene poi nuovamente sostituito dalla sindrome acinetico-rigida, che per qualche tempo assume un carattere più pronunciato.
È ormai generalmente accettato che la malattia di Parkinson si manifesti clinicamente non solo con disturbi motori, ma abbia anche un intero spettro manifestazioni non motorie, che si verificano in tutti i pazienti indipendentemente dall'età di esordio della malattia e dallo stadio della malattia:
1) disturbi neuropsichici:
- emotivo;
— cognitivo;
- psicotico;
- comportamentale;
2) disturbi del sonno e della veglia;
3) disturbi autonomici;
4) disturbi sensoriali e dolore;
5) aumento della fatica.
La maggior parte delle manifestazioni non motorie compaiono e aumentano con il progredire della malattia, parallelamente al peggioramento dei disturbi del movimento. Ma alcune manifestazioni non motorie, come l’alterazione del senso dell’olfatto, la stitichezza, i disturbi del sonno e le sindromi dolorose, si verificano prima dello sviluppo dei classici sintomi motori della malattia di Parkinson. A questo proposito, attualmente si parla dello stadio preclinico e premotorio della malattia di Parkinson.
La comprensione dei meccanismi di sviluppo e del ruolo delle manifestazioni non motorie nella struttura del PD si riflette nel concetto di H. Braak et al. (2002), secondo cui il processo degenerativo non si limita alla parte compatta della substantia nigra, ma coinvolge successivamente un gran numero di diverse strutture motorie del cervello. H. Braak et al. identificato 6 fasi di sviluppo del processo patologico nel PD (Fig. 3). Il primo stadio è caratterizzato dalla degenerazione del bulbo olfattivo e del nucleo olfattivo anteriore, che può manifestarsi clinicamente come una violazione dell'olfatto. Il secondo stadio è caratterizzato dal coinvolgimento dei nuclei del tronco cerebrale che controllano le funzioni affettive, autonome, il ciclo sonno-veglia e può manifestarsi come disturbo del comportamento del sonno con movimenti oculari rapidi, depressione e stitichezza. Le classiche manifestazioni motorie della malattia compaiono secondo H. Braak solo al terzo e quarto stadio, che è associato all'estensione del processo degenerativo alla substantia nigra. Nel quinto e nel sesto stadio finale, i corpi di Lewy compaiono nelle strutture limbiche e nella corteccia cerebrale, il che porta allo sviluppo di disturbi cognitivi, comportamentali e psicomotori.

Una parte significativa delle manifestazioni non motorie è resistente ai farmaci levodopa, il che indica la loro connessione con la disfunzione dei sistemi non dopaminergici: noradrenergici, serotoninergici, colinergici e altri.
Classificazione del parkinsonismo
La classificazione si basa sul fatto che il parkinsonismo è una sindrome polietiologica. Esistono il parkinsonismo idiopatico (primario), la cui struttura comprende la malattia di Parkinson e il più raro parkinsonismo idiopatico, che ha una base genetica, il parkinsonismo secondario - dovuto a qualsiasi lesione o malattia del sistema nervoso centrale (vascolare, traumatico, postencefalitico, ecc.) . Con il "parkinsonismo plus", la sindrome parkinsoniana è inclusa nella struttura di altre malattie neurodegenerative e in una serie di malattie del sistema nervoso di natura ereditaria (Tabella 1).

Forme cliniche della malattia di Parkinson nella forma classica corrispondono a tre sintomi principali: le forme tremante, rigida e acinetica si possono osservare solo nella fase iniziale della malattia. Man mano che la malattia progredisce, nel quadro clinico si osserva una combinazione di questi sintomi. A seconda della predominanza di un particolare sintomo, si distinguono le seguenti forme: mista (tremore acinetico-rigido), acinetico-rigido e tremulo. La forma mista viene rilevata nel 60-70% dei casi di malattia di Parkinson, acinetica-rigida - nel 15-20%, tremante - nel 5-10% dei casi. Con il progredire della malattia, la sua forma clinica può cambiare.
Nel corso della PD si distinguono le fasi di sviluppo. La classificazione generalmente accettata è quella proposta da Hoehn e Yarh (1967):
— stadio 1. Manifestazioni unilaterali della malattia (solo estremità);
— fase 1.5. Processo unilaterale (arti e stesso lato del corpo);
— stadio 2. Malattia bilaterale senza instabilità posturale;
— fase 2.5. Manifestazioni iniziali di un processo bilaterale con ritorno alla normalità all'esame;
— stadio 3. Instabilità posturale moderatamente espressa, il movimento indipendente è possibile;
— stadio 4. Perdita significativa dell'attività motoria, il paziente non è in grado di muoversi senza assistenza;
— stadio 5. In assenza di aiuto esterno, il paziente è costretto a letto o su una sedia a rotelle.
Considerando l’intensità dello sviluppo dei sintomi della malattia di Parkinson, ci sono tre opzioni per la velocità di progressione della malattia (soggetto a un trattamento adeguato):
- rapida velocità di progressione, in cui il cambiamento degli stadi della malattia (primo - secondo o secondo - terzo) avviene entro 2 anni o meno;
- tasso moderato di progressione, al quale si verifica un cambiamento di stadio dopo più di 2 anni, ma non più di 5 anni;
- lento tasso di progressione con cambiamenti nelle fasi dopo più di 5 anni.
La diagnosi clinica della malattia di Parkinson comprende tre fasi:
1. Riconoscimento della sindrome extrapiramidale.
2. Chiarimento dei dati anamnestici, identificazione di sindromi concomitanti, esami di laboratorio, neuroimaging (SCT, MRI, PET), diagnostica con levodopa, diagnostica ENMG.
3. Stabilire una diagnosi nosologica (per il parkinsonismo - determinare il grado di gravità utilizzando scale di valutazione).
Attualmente, per la diagnosi clinica della malattia di Parkinson, vengono utilizzati i criteri di inclusione proposti dalla banca del cervello della UK Parkinson's Disease Society (A. Hughes et al., 1992).
Diagnosi della sindrome di parkinsonismo
Criteri di inclusione per la malattia di Parkinson: ipocinesia in combinazione con almeno uno dei seguenti sintomi:
- rigidità muscolare;
- tremore a riposo 4-6 Hz;
- instabilità posturale non associata a disturbi primari visivi, vestibolari, cerebellari o propriocettivi.
Criteri di esclusione per la malattia di Parkinson:
- storia di ictus ripetuti con progressione graduale dei sintomi del parkinsonismo;
- storia di ripetute lesioni cerebrali traumatiche;
- storia di encefalite;
- crisi oculogire;
- trattamento con antipsicotici al momento della comparsa dei sintomi;
- natura familiare della malattia (più di 1 parente affetto da malattia simile);
- presenza di remissione a lungo termine;
- sintomi strettamente unilaterali da più di 3 anni;
- paralisi dello sguardo verso il basso;
— fallimento autonomo precoce e rapidamente progressivo;
- segni cerebellari;
— demenza ad esordio precoce con disturbi della memoria, della parola e della prassi;
- Il sintomo di Babinsky;
- presenza di atrofia cerebellare o idrocefalo comunicante alla tomografia computerizzata;
- mancanza di risposta ad alte dosi di levodopa (ad eccezione del malassorbimento);
- contatto con sostanze tossiche che causano parkinsonismo.
Criteri che confermano la diagnosi di malattia di Parkinson (almeno tre):
- esordio unilaterale;
- tremore a riposo;
- decorso progressivo;
- persistenza dell'asimmetria dei sintomi con predominanza del lato inizialmente interessato;
— elevata efficacia dei farmaci a base di levodopa (riduzione dei sintomi del 70-100%);
- gravi discinesie coreiformi indotte da levodopa;
- mantenimento della risposta alla levodopa per 5 anni o più;
- durata della malattia per 10 anni o più.
Parkinsonismo indotto da farmaciè una delle forme più comuni di parkinsonismo secondario e rappresenta dal 4 al 10% di tutti i casi della malattia. È più spesso associato all'uso di farmaci antipsicotici (parkinsonismo neurolettico), quindi la sua prevalenza è più alta tra i pazienti nelle cliniche psichiatriche e negli istituti psichiatrici ambulatoriali.
Meno comunemente, lo sviluppo del parkinsonismo indotto da farmaci è causato da altri farmaci:
- altri agonisti dei recettori della dopamina (metoclopramide, diprazina, flunarizina, cinnarizina);
- farmaci che riducono la circolazione della dopamina nelle sinapsi (metildopa);
- simpaticolitici centrali, che riducono l'apporto di dopamina nei terminali nervosi (reserpina, tetrabenazina);
- agenti serotoninergici che inibiscono l'attività dei neuroni dopaminergici della substantia nigra.
Il parkinsonismo neurolettico si verifica nel 10-15% dei pazienti che assumono antipsicotici. La probabilità di sviluppare parkinsonismo dipende dalla capacità del farmaco di causare il blocco dei recettori D2. L'effetto collaterale più comune si osserva durante l'assunzione di antipsicotici non selettivi (aloperidolo, aminazina, triftazina). Secondo la tomografia ad emissione di positroni, i sintomi del parkinsonismo si verificano quando almeno l'80% dei recettori D2 sono bloccati. Si verificano più spesso nelle persone di età superiore ai 40 anni, nelle donne - 2 volte più spesso. La presenza di danno cerebrale organico aumenta la probabilità di sviluppare parkinsonismo neurolettico. I sintomi del parkinsonismo si sviluppano diversi giorni o settimane dopo l’inizio del trattamento con il farmaco. Grandi dosi di antipsicotici, un forte aumento della dose o la sospensione di un correttore anticolinergico provocano lo sviluppo del parkinsonismo. Il quadro clinico del parkinsonismo neurolettico comprende sintomi non caratteristici della malattia di Parkinson: crisi oculogire, ipercinesi orale, trisma, torcicollo, crisi di opistotono. Più spesso, i sintomi si sviluppano su entrambi i lati. Dopo la sospensione del farmaco, i sintomi regrediscono, solitamente entro poche settimane. In alcuni casi, soprattutto nei pazienti anziani, i sintomi possono persistere per anni.
Parkinsonismo vascolare. Una forma di parkinsonismo secondario, caratterizzata dalla più alta frequenza di sovradiagnosi. Secondo studi morfologici condotti in centri specializzati, la frequenza del parkinsonismo vascolare non supera il 6-8% di tutti i casi di parkinsonismo.
Le ragioni che causano lo sviluppo del parkinsonismo vascolare sono le seguenti:
1. Danni alle piccole arterie cerebrali:
— microangiopatia ipertensiva (lipoialinosi);
- microangiopatia senile (arteriolosclerosi senile, tortuosità senile delle arterie);
- vasculiti e vasculopatie (poliarterite nodosa, angioite del sistema nervoso centrale, LES);
- arteriopatia ereditaria.
2. Danno alle grandi arterie cerebrali:
- aterosclerosi delle grandi arterie (extra e intracraniche);
-sifilide meningovascolare.
3. Lesioni cerebrali cardiogene:
- embolia cardiogena;
- encefalopatia ipossica (necrosi dei gangli della base).
4. Altre malattie:
— malformazioni artero-venose;
- sindrome da antifosfolipidi;
- coagulopatia.
I cambiamenti morfologici nella sostanza cerebrale rilevati nel parkinsonismo vascolare durante il neuroimaging sono i seguenti:
1) infarti lacunari multipli nei gangli della base, nel tronco cerebrale e nelle parti profonde della sostanza bianca;
2) lesioni diffuse della sostanza bianca:
- leucoaraiosi sottocorticale confluente o parzialmente confluente;
- leucoaraiosi periventricolare diffusa con contorni irregolari, che si estende alla regione sottocorticale;
3) infarti sottocorticali territoriali nei gangli della base e nella sostanza bianca adiacente;
4) infarti territoriali bilaterali (meno spesso unilaterali) dei lobi frontali;
5) infarti unilaterali e bilaterali nella regione talamica;
6) focolai emorragici nei gangli della base, mesencefalo, talamo;
7) atrofia cerebrale con espansione del sistema ventricolare e dei solchi corticali.
Questa forma di parkinsonismo secondario è caratterizzata dalla presenza di rigidità plastica, che si combina con elementi di spasticità piramidale e con una lesione predominante degli arti inferiori. Le caratteristiche caratteristiche comprendono la sindrome acinetico-rigida simmetrica, i disturbi dell'andatura disbasica e l'esordio precoce dell'instabilità posturale. Il tremore è estremamente raro e non ha il tipico carattere parkinsoniano. La paralisi pseudobulbare si sviluppa spesso con sintomi di disartria, disfagia ed emozioni violente. Differenze caratteristiche nei riflessi tendinei, presenza di riflessi patologici e disturbi cerebellari. I disturbi cognitivi si sviluppano abbastanza rapidamente. Non vi è alcun effetto dai preparati a base di L-dopa. Tuttavia, va notato che a volte piccole dosi di questi farmaci apportano sollievo ai pazienti, il che può essere dovuto all’insufficienza extrapiramidale che si sviluppa con l’età.
Tutta la varietà delle manifestazioni cliniche del parkinsonismo vascolare può essere ridotta a tre opzioni più caratteristiche:
1. Con esordio simmetrico sotto forma di sindrome acinetico-rigida, più pronunciata negli arti inferiori, che esordisce con disturbi della deambulazione. Non c'è tremore e nessun effetto con i farmaci L-dopa. Caratterizzato da uno sviluppo graduale sullo sfondo di una progressiva insufficienza cerebrovascolare.
2. Caratterizzato da una combinazione di parkinsonismo con disturbi piramidali, cerebellari, pseudobulbari, deterioramento cognitivo e oculomotori.
3. Parkinsonismo vascolare con sindrome acinetico-rigida unilaterale, tremore a riposo, talvolta con risposta positiva ai farmaci L-dopa. La variante si verifica quando si verifica una lesione vascolare nel mesencefalo, nella zona della substantia nigra.
Per differenziare il parkinsonismo vascolare dalla malattia di Parkinson è necessario utilizzare metodi di neuroimaging (MRI, PET).
Parkinsonismo post-traumatico. Il più delle volte si sviluppa con una grave lesione cerebrale traumatica (TBI) o dopo ripetuti trauma cranico lieve. Dopo un grave trauma cranico, la sindrome parkinsoniana si sviluppa in caso di danno traumatico diretto ai gangli sottocorticali o danno diffuso agli assoni nelle parti profonde degli emisferi cerebrali a causa dell'accelerazione rotazionale al momento della lesione. In questo caso il parkinsonismo si sviluppa in circa l'1% dei casi ed è caratterizzato da ipocinesia, ipofonia, instabilità posturale e non è progressivo. Il neuroimaging rivela spesso cambiamenti strutturali nei gangli sottocorticali.
Il trauma cranico lieve e ripetuto, soprattutto nelle persone coinvolte negli sport di contatto (boxe, arti marziali), può portare allo sviluppo dell'encefalopatia del pugile. Comprende sintomi di disturbi extrapiramidali, solitamente localizzati simmetricamente, nonché disturbi piramidali, cerebellari, pseudobulbari e lo sviluppo di disturbi cognitivi. Si ritiene che la causa di questa forma di parkinsonismo secondario sia un danno minore nell'area dei peduncoli cerebrali, che porta a disturbi assonali del tratto nigrostriatale.
Parkinsonismo post-infettivo. Fu descritta per la prima volta nel 1918 da K. von Economo dopo aver sofferto di encefalite letargica. Come fattore eziologico è stata considerata un'infezione virale (ortomixovirus, virus dell'influenza). Tuttavia, gli studi non hanno trovato l’RNA del virus dell’influenza nella materia cerebrale di persone morte di encefalite letargica. Ciò ha suggerito la natura autoimmune della malattia, confermata nel 2003 da ricercatori britannici che hanno trovato autoanticorpi contro gli antigeni dei gangli della base nel sangue del 95% dei pazienti con casi sporadici di encefalite letargica.
Il quadro clinico della malattia si sviluppa in modo acuto, iniziando con un aumento della temperatura corporea, mialgia e sintomi cerebrali. Oltre ai fenomeni di parkinsonismo si osservano sintomi specifici: ipersonnia grave, crisi oculogire, disturbi oculomotori, attacchi di stupore o cinesia paradossa, distonia, mioclono, segni piramidali. I fenomeni di tremore prevalgono sulla rigidità. Sono caratteristici i disturbi autonomici: aumento dell'untuosità della pelle e dei capelli, ipersalivazione, iperidrosi, vari disturbi vasomotori. Il decorso della malattia può essere stazionario o con lenta progressione con aumento della bradicinesia, della rigidità e dei disturbi posturali. A volte si sviluppa la demenza.
Attualmente, il parkinsonismo postencefalitico si osserva come conseguenza delle seguenti infezioni:
— enterovirus (Coxsackie tipo B, polivirus);
— arbovirali (encefalite trasmessa dalle zecche e giapponese);
— virus della parotite;
- virus del morbillo;
— virus influenzali di tipo A;
— virus dell'herpes simplex;
— virus varicella-zoster;
- neurosifilide;
- spirochetosi ( Borrelia burgdorferi).
Parkinsonismo tossico. Può svilupparsi a causa dell'esposizione a varie tossine esogene: manganese, monossido di carbonio, disolfuro di carbonio, tallio, cianuro, idrogeno solforato, piombo tetraetile, FOS, metanolo. Negli ultimi decenni sono stati descritti casi di parkinsonismo in tossicodipendenti che utilizzavano surrogati dell'eroina contenenti 1-metil-4-fenil-1,2,3,6-tetraidroperidina (MPTP), che ha un'elevata affinità per i neuroni della substantia nigra. La localizzazione più comune delle lesioni nel parkinsonismo tossico è il globo pallido e la substantia nigra.
Il parkinsonismo si osserva più spesso con l'intossicazione da manganese. Il manganese entra nel corpo inalando polvere contenente alte concentrazioni di esso, con il cibo o per via parenterale (quando si utilizza il permanganato di potassio per la preparazione di stupefacenti). La malattia si sviluppa gradualmente e ci sono fasi iniziali e tardive. Nella fase iniziale, sullo sfondo di sintomi aspecifici (mal di testa, astenia, polineuropatia), vengono rilevati segni di sindrome acinetico-rigida: aumento del tono muscolare, distonia muscolare, tremore delle dita e delle palpebre, ipomimia, ipersonnia, apatia. I disturbi autonomici sono caratteristici: tachicardia, ipotensione arteriosa, iperidrosi, acrocianosi.
Nella fase tardiva della malattia progrediscono disturbi acinetici-rigidi, che si combinano con disturbi piramidali e cerebellari (iperreflessia, riflessi patologici, tremori intenzionali, adaidococinesi, ecc.). I disturbi polineuritici si intensificano con un aumento dei sintomi di atassia sensibile e si formano reazioni astenodepressive. La regressione della malattia è possibile solo in una fase precoce.
Nella tabella La Figura 2 mostra la frequenza di varie forme di parkinsonismo. Va notato che il parkinsonismo primario si verifica nella stragrande maggioranza dei casi e rappresenta circa l'80% di tutti i casi di parkinsonismo.

Principi di base della terapia della malattia di Parkinson
Come accennato in precedenza, secondo il concetto di Braak et al., la malattia di Parkinson è caratterizzata da un processo neurodegenerativo di tipo ascendente: dalle parti caudali del tronco cerebrale alla corteccia cerebrale. Allo stesso tempo, gli stadi prodromici (premotori) latenti e precoci della malattia durano circa 5-8 anni e quando si manifestano le manifestazioni classiche della malattia di Parkinson, la maggior parte dei neuroni della substantia nigra muore. Pertanto, i tentativi di neuroprotezione in una fase successiva non possono avere successo e il compito del medico è quello di intervenire nelle fasi più precoci del processo patologico.
Gli obiettivi principali del trattamento per i pazienti affetti da parkinsonismo sono la compensazione della carenza di dopamina e delle sue conseguenze (correzione delle relazioni interrotte tra neurotrasmettitori), il rallentamento della progressione della malattia (conservazione e protezione dei neuroni della dopamina), l'attivazione dei processi di recupero e la stimolazione della dopamina. sintesi.
Per raggiungere questi obiettivi, è necessario aderire ai seguenti principi della terapia della PD:
- il trattamento è prescritto entro e non oltre 6 mesi dalla richiesta del paziente (periodo necessario per stabilire con precisione la corretta diagnosi);
— una volta posta la diagnosi di PD, il paziente dovrà assumere continuativamente farmaci antiparkinsoniani (APD) per il resto della sua vita;
- il trattamento inizia sotto forma di monoterapia con uno dei PPS;
— il farmaco di scelta può essere qualsiasi PPS (in assenza di controindicazioni), compreso un anticolinergico;
- la monoterapia inizia con dosi sottosoglia (la dose ottimale viene scelta gradualmente, nell'arco di almeno 3-4 settimane) e viene effettuata all'interno della finestra farmacoterapeutica, con la definizione della dose singola ottimale e della frequenza di somministrazione;
- se la monoterapia non è sufficientemente efficace viene prescritta una terapia di associazione con l'aggiunta di un secondo PPS a dose sottosoglia, seguita da un aumento graduale della dose;
- la comparsa di effetti collaterali richiede una riduzione della dose o la sospensione del farmaco responsabile dell'effetto collaterale; un'eventuale perdita di efficacia della terapia viene compensata rivedendo le dosi e la frequenza di somministrazione di altri farmaci;
— il trattamento a lungo termine della malattia di Parkinson con farmaci a base di levodopa porta alla fine alla comparsa di una patomorfosi clinica che richiede una correzione speciale.
In pratica oggi vengono utilizzati 6 gruppi principali di personale docente:
- preparati a base di levodopa;
- agonisti dei recettori della dopamina;
- inibitori degli enzimi del metabolismo della dopamina - COMT e MAO-B;
- amantadine;
- anticolinergici centrali.
Preparati a base di levodopa (L-dopa). Apparso nella pratica clinica negli anni '60 e '70 del XX secolo. Il loro utilizzo ha permesso di ritardare significativamente il periodo di disabilità nei pazienti affetti da PD. La L-dopa è il precursore biologico della dopamina. L'uso della dopamina stessa come agente terapeutico si è rivelato impossibile, poiché non penetra nella barriera ematoencefalica. Tuttavia, ci sono problemi con l'assunzione di L-dopa, poiché la maggior parte del farmaco viene distrutta nel tratto gastrointestinale e nel sangue sotto l'influenza della DOPA decarbossilasi, che provoca effetti collaterali come nausea, vomito e ipotensione ortostatica. Solo l'1% della dose somministrata di levodopa raggiunge i neuroni nigrostriatali e partecipa alla sintesi della dopamina. Per neutralizzare l'effetto della DOPA decarbossilasi periferica e facilitare l'ingresso della levodopa nel tessuto cerebrale, ridurre la gravità degli effetti collaterali periferici e ridurre la dose totale di levodopa assunta, di solito viene combinata con un inibitore periferico della DOPA decarbossilasi (carbidopa o benserazide ). Attualmente, i preparati puri di levodopa non sono praticamente utilizzati nella pratica clinica. L’uso dei farmaci L-dopa è considerato il gold standard per il trattamento della malattia di Parkinson.
Il momento di inizio della terapia con farmaci a base di levodopa dovrebbe essere individuale e dipendere dalla velocità di progressione della malattia, dal tipo di attività professionale, dall’efficacia di altri farmaci, dalla famiglia e dallo stato di vita del paziente. Si ritiene che sia più appropriato prescrivere farmaci L-dopa quando il parkinsonismo porta a disturbi motori significativi che non sono alleviati da altri PPS.
La scelta della dose ottimale e della frequenza di somministrazione del farmaco dipende dalla sensibilità individuale. La dose individuale ottimale è considerata la dose del farmaco alla quale si verifica la massima correzione possibile dei sintomi del parkinsonismo, ma non si verificano effetti collaterali. La prescrizione di farmaci contenenti dopa con inibitori della DOPA decarbossilasi inizia con dosi sottosoglia (Tabella 3). All'inizio del trattamento, viene prescritta 1/4 compressa 3 volte al giorno, quindi la dose viene aumentata di 1/4 compressa 1 volta a settimana. Dopo ogni aumento della dose, viene valutata la sua efficacia. Di solito, quando si prescrive la levodopa per la prima volta, è sufficiente assumere 1/2 compressa 3 volte al giorno. Se necessario, la dose viene aumentata a 1 compressa 3 volte al giorno. Se una dose giornaliera di 4 compresse non produce alcun effetto, ulteriori aumenti della dose sono considerati inefficaci.

Puoi valutare l'efficacia del farmaco utilizzando semplici test:
- test di pronazione-supinazione della mano;
- prova di movimento della mano tra due punti posti a una distanza di 30 cm l'uno dall'altro;
- prova di movimenti rapidi delle dita (ad esempio, picchiettando le dita sul tavolo una dopo l'altra);
- prova di camminata per una distanza di 7 metri e ritorno con rotazione del busto.
Va notato che è inevitabile un aumento graduale della dose del farmaco con l'aumentare della gravità della malattia. Inoltre, con il progredire della malattia, la durata d’azione di una singola dose diminuisce, rendendo necessario un aumento della frequenza di dosaggio. Tuttavia, all’aumentare della frequenza di somministrazione, la dose singola del farmaco diminuisce, il che può portare al fatto che una singola dose può diventare sottosoglia e non avere un effetto clinico. A questo proposito, la frequenza di assunzione del farmaco non deve superare le 4-5 volte al giorno.
L’uso degli inibitori della DOPA decarbossilasi ha eliminato nella maggior parte dei casi gli effetti collaterali periferici della levodopa. Tuttavia, nel 60-80% dei pazienti, dopo 3-5 anni di assunzione dei farmaci, si sviluppano effetti collaterali centrali, come equivalenti psicotici, discinesie, forti fluttuazioni dell'attività motoria, di cui parleremo di seguito.
Per raggiungere un livello più stabile di farmaci contenenti dopa nel sangue al fine di eliminare la stimolazione pulsante non fisiologica dei recettori della dopamina, ridurre la gravità delle discinesie da farmaci e il tempo della loro insorgenza, vengono utilizzati preparati di levodopa a lunga durata d'azione. Forniscono un rilascio lento del principio attivo nel tratto gastrointestinale, che contribuisce ad un effetto più duraturo del farmaco (fino a 8 ore), tuttavia, la biodisponibilità relativamente bassa della levodopa in queste forme di dosaggio richiede un aumento della concentrazione totale dosaggio del principio attivo in media del 30%.
All’inizio degli anni 2000, è stata proposta una forma di levodopa in combinazione con carbidopa per la somministrazione duodenale continua dopo microgastrostomia. Grazie ad una pompa dosatrice portatile, i pazienti negli stadi gravi della malattia assicurano una concentrazione costante di levodopa nell'intestino e nel sangue.
Tra i PPS contenenti dopa, attira l'attenzione il farmaco Carbidopa e Levodopa-Teva registrato in Ucraina (prodotto da TEVA, Israele). Contiene un rapporto levodopa/carbidopa pari a 10:1. Il farmaco è una compressa divisibile, che consente un dosaggio ottimale del farmaco, a partire da 1/4 compresse 3 volte al giorno, aumentando la dose di1/4 compresse una volta alla settimana. Il farmaco rappresenta la combinazione ideale di prezzo e qualità sul mercato farmaceutico.
Agonisti dei recettori DA. Inizialmente, gli agonisti del recettore DA (ADAR) venivano usati in terapia di combinazione con farmaci a base di levodopa per ridurne la dose. Successivamente si è scoperto che gli ADAR sono efficaci nelle fasi iniziali della malattia come monoterapia. L'interesse per i farmaci di questo gruppo è aumentato soprattutto dopo che numerosi studi hanno dimostrato l'effetto neuroprotettivo dell'ADAR, che ha rallentato il tasso di progressione della malattia.
Gli ADAR agiscono direttamente sui recettori DA nei gangli sottocorticali, bypassando la parte presinaptica dei neuroni nigrostriatali. La loro azione è diretta sui recettori D2, ampiamente distribuiti nelle vie nigrostriatale, mesolimbica e mesocorticale. È alla stimolazione dei recettori D2 che si associa l'effetto sintomatico dell'ADAR in relazione alla rigidità, all'ipocinesia e al tremore. Attualmente esistono due gruppi di ADAR: ergolina (bromocriptina) e non ergolina (piribedil e pramipexolo) (Tabella 3).
I vantaggi di ADAR includono:
— efficacia contro il tremore, a cui è difficile rispondere alla terapia tradizionale con levodopa (l'effetto “antitremore” è dimostrato in modo particolarmente convincente per piribedil e pramipexolo);
— nessuna competizione con gli aminoacidi alimentari;
- nessuna necessità di ulteriore metabolizzazione nel sistema nervoso centrale, anche con la partecipazione di reazioni ossidative;
- emivita più lunga (rispetto alla levodopa) e stimolazione tonica dei recettori postsinaptici più lunga;
- minor rischio di sviluppare discinesie;
- effetto antidepressivo di numerosi farmaci (in particolare pramipexolo);
- effetto neuroprotettivo.
Gli effetti collaterali di ADAR includono:
-nausea;
- aritmia cardiaca;
— fibrosi delle valvole cardiache;
- ipotensione posturale;
- allucinazioni;
- disturbi del sonno;
- edema periferico;
- Fenomeno di Raynaud, ecc.
In misura maggiore, questi effetti collaterali riguardano gli ADAR dell’ergolina.
Oltre al suo effetto sui recettori D2, piribedil potenzia la trasmissione noradrenergica centrale grazie ad ulteriori proprietà a2-noradrenergiche (blocco dei recettori a2-adrenergici presinaptici, potenziamento reciproco del rilascio di acetilcolina nella corteccia frontale e nell'ippocampo dorsale). Grazie a questo effetto, il piribedil è efficace nel trattamento delle complicanze della malattia di Parkinson come il deterioramento cognitivo e l'instabilità posturale.
Con un'adeguata selezione individuale e un aumento graduale della dose, gli ADAR mostrano una buona tollerabilità e un'efficacia piuttosto elevata. Negli stadi iniziali della malattia di Parkinson, utilizzando gli ADAR non ergolinistici in monoterapia, è possibile ridurre la gravità dei principali sintomi della malattia (bradicinesia, tremore e rigidità muscolare) del 20-40%, e nei pazienti in stadio avanzato di malattia malattia, l’aggiunta di ADAR alla levodopa aiuta a ridurre la gravità dei sintomi in media del 15-20%. Circa il 60% dei pazienti trattati con ADAR in monoterapia non necessita di levodopa entro la fine del terzo anno di trattamento. La monoterapia iniziale con i moderni ADAR non ergolinici (con o senza ulteriore aggiunta di levodopa) è accompagnata da una minore incidenza di discinesia 3-5 anni dopo l'inizio del trattamento, e la qualità della vita durante la monoterapia iniziale con levodopa e ADAR è quasi la stessa Stesso. Negli stadi successivi della malattia, quando si utilizza ADAR in combinazione con levodopa, si osserva una riduzione fino a un terzo della durata totale dei periodi off, le fluttuazioni motorie vengono “attenuate” ed è anche possibile ridurre la durata totale dei periodi off. dose giornaliera di levodopa del 25-30%.
Inibitori della monoaminossidasi di tipo B (MAO-B). L'enzima MAO di tipo B è coinvolto nel metabolismo delle monoammine cerebrali, inclusa la dopamina, scomponendola nel prodotto finale: l'acido omovanillico. Inoltre, gli inibitori MAO-B sono antiossidanti, il cui effetto protettivo è stato ripetutamente dimostrato in vari modelli sperimentali di parkinsonismo. L’effetto farmacoterapeutico degli inibitori delle MAO-B è associato a:
- con un aumento del livello di dopamina nello striato;
- un aumento del contenuto di feniletilamina nello striato, che stimola il rilascio e inibisce la ricaptazione della dopamina, nonché la sua capacità di stimolare direttamente i recettori della dopamina;
- l'azione dei metaboliti della selegilina - metanfetamine e anfetamine, che migliorano il rilascio e inibiscono la ricaptazione della dopamina;
- la capacità della selegilina di modificare direttamente o indirettamente l'attività dei neuroni della dopamina, con conseguente aumento del rilascio di dopamina.
La dose giornaliera di selegilina deve essere di 10-15 mg al giorno suddivisa in 2 dosi (Tabella 3).
Relativamente recentemente, ha iniziato a essere utilizzato un farmaco di nuova generazione: l'inibitore irreversibile delle MAO-B rasagilina. Gli studi hanno dimostrato la capacità della rasagilina di influenzare positivamente il decorso del processo patologico nella malattia di Parkinson, il che rende possibile classificare il farmaco come piuttosto promettente.
Inibitori della catecol-O-metiltransferasi (COMT). L'enzima COMT metila sia il precursore della dopamina L-dopa che la dopamina stessa, che cessano di partecipare alle funzioni dei neuroni dopaminergici. Gli inibitori COMT sono in grado di aumentare sia il livello di dopamina endogena che la sintesi di dopamina dalla levodopa. Esistono inibitori delle COMT ad azione periferica che non penetrano la barriera ematoencefalica (entacapone) e quelli che la attraversano (tolcapone). A causa della sua elevata epatotossicità, il tolcapone non viene utilizzato come agente terapeutico. La dose singola efficace di entacapone è di 200 mg, la dose media giornaliera va da 600 a 1200 mg. Il farmaco ha un effetto positivo sulle fluttuazioni motorie, soprattutto quando la fine della dose “si consuma”. Esiste una combinazione di farmaci levodopa + carbidopa + entacapone. Rende più facile combattere le fluttuazioni indotte dalla levodopa. Esistono prove che la somministrazione precoce di questa combinazione può prevenire o ritardare l'insorgenza di complicanze della terapia con levodopa (Tabella 3).
Amantadine. I farmaci del gruppo dell’amantadina vengono utilizzati da molto tempo per il trattamento della malattia di Parkinson. Sono noti due sottogruppi di amantadine: amantadina cloridrato e amantadina solfato. L’efficacia nel trattamento della malattia di Parkinson è associata ai seguenti meccanismi:
- aumento della sintesi della dopamina nei terminali presinaptici;
- aumento del rilascio di dopamina nella fessura sinaptica;
- inibizione della ricaptazione della dopamina dalla fessura sinaptica;
- bloccando i recettori del glutammato NMDA.
Nelle fasi iniziali e moderate della malattia, le amantadine hanno un effetto antiparkinsoniano moderato; nelle fasi avanzate possono anche ridurre la gravità delle complicanze motorie della terapia con levodopa. È importante la proprietà delle amantadine di sopprimere la gravità delle discinesie indotte dalla levodopa. Tenendo conto dell’effetto di blocco del glutammato delle amantadine, viene discussa la fattibilità del loro utilizzo allo scopo di correggere il deterioramento cognitivo nei pazienti. La dose ottimale è 100-200 mg di amantadina al giorno suddivisa in 3 dosi (Tabella 3).
Anticolinergici. I farmaci anticolinergici sono stati utilizzati per trattare la malattia di Parkinson sin dalla metà del XIX secolo. Il meccanismo d'azione è associato al ripristino dell'equilibrio tra l'attività colinergica relativamente predominante e la ridotta funzione dopaminergica nello striato. Attualmente, l'uso di farmaci del gruppo degli anticolinergici sta diminuendo, a causa di un numero piuttosto elevato di effetti collaterali. Tra gli effetti collaterali periferici del farmaco, va notato quanto segue:
— violazione dell'alloggio;
- midriasi;
- bocca asciutta;
- stipsi;
- ritenzione urinaria.
Tra gli effetti collaterali centrali è necessario indicare:
- allucinazioni;
- compromissione delle funzioni cognitive.
Controindicazioni dirette alla prescrizione di anticolinergici sono l'adenoma prostatico, il glaucoma, una serie di forme di aritmie cardiache, disturbi della memoria e alterazioni atrofiche nel cervello secondo il neuroimaging.
La prescrizione di anticolinergici è possibile nella fase iniziale della malattia in pazienti relativamente giovani (fino a 65 anni) come monoterapia, principalmente nella forma tremante della malattia di Parkinson. La combinazione con farmaci contenenti levodopa può ridurre la gravità delle fluttuazioni motorie durante il giorno e prolungare l'effetto della levodopa. La dose media giornaliera per la maggior parte dei farmaci di questo gruppo è di 4-8 mg al giorno (Tabella 3).
Chirurgia. Nelle fasi successive della malattia, quando tutte le possibilità di terapia conservativa sono state esaurite e si sviluppano disturbi motori intrattabili, dovrebbe essere sollevata la questione dei metodi di trattamento neurochirurgico.
Attualmente, negli stadi avanzati della malattia di Parkinson vengono utilizzati due metodi di intervento neurochirurgico:
- distruzione stereotassica di alcuni gruppi di nuclei del talamo, del globo pallido, ecc.;
— stimolazione elettrica cronica ad alta frequenza delle strutture profonde del cervello mediante elettrodi impiantati (neurochirurgia funzionale). Il suo compito è quello di interrompere i “circuiti” neuronali pallidotalamocorticali patologicamente funzionanti.
La stimolazione elettrica profonda presenta vantaggi rispetto agli interventi distruttivi: può essere eseguita su entrambi i lati ed è caratterizzata da minori complicanze e da un effetto più netto su tutte le principali manifestazioni cliniche del parkinsonismo.
Discinesie indotte da farmaci nel PD
Come già osservato, i farmaci a base di levodopa rappresentano il gold standard nel trattamento della malattia di Parkinson. Tuttavia, con la terapia a lungo termine con levodopa, si verifica un cambiamento nel quadro tipico della malattia, la cui manifestazione principale è la discinesia indotta da farmaci, che peggiora la qualità della vita dei pazienti.
Il meccanismo di sviluppo della discinesia è associato ai seguenti fattori:
- morte cellulare in corso della substantia nigra;
- stimolazione non fisiologica e pulsante dei recettori della dopamina;
- diminuzione dell'attività del segmento mediale del globo pallido e della parte reticolare della substantia nigra.
È stata proposta la seguente classificazione delle discinesie (J.A. Obeso, 1989):
1. Discinesia (distonia) d'azione - si manifesta sotto forma di ipercinesia coreoforme durante un determinato atto motorio.
2. Discinesia "attiva" - si verifica sullo sfondo dell'effetto di una singola dose ed è divisa in discinesia della dose di picco, che si manifesta con l'effetto massimo del farmaco levodopa, nonché nella discinesia del periodo di plateau del trattamento, che può essere rintracciata durante tutto il periodo “on”.
3. La discinesia bifasica appare all'inizio del periodo “on” e scompare per apparire proprio alla fine del periodo “on”. Questa forma di discinesia si manifesta molto spesso come discinesia distonica lenta, solitamente nei muscoli delle gambe. In alcuni pazienti, la discinesia bifasica si manifesta con distonia posturale.
4. La distonia del periodo "off" appare durante il periodo in cui termina l'effetto di una singola dose di farmaci contenenti levodopa. Si manifesta principalmente al mattino sotto forma di distonia mattutina dopo una pausa notturna nell'assunzione di farmaci. Tipicamente si manifesta come distonia della postura, dei muscoli facciali e del collo, ma può essere generalizzata.
5. La discinesia-parkinsonismo si manifesta con la comparsa di ipercinesia in una metà del corpo con effetto antiparkinson, nell'altra metà del corpo - con sintomi di parkinsonismo. Ciò si basa sulla diversa sensibilità dei neuroni dopaminergici in parti somatotopicamente diverse dello striato.
6. La discinesia senza miglioramento motorio si verifica dopo l'assunzione di farmaci senza alcun effetto antiparkinsoniano.
7. La discinesia parossistica imprevedibile appare in qualsiasi momento, indipendentemente dal momento di assunzione del farmaco.
Nelle fasi iniziali, la discinesia può essere corretta riducendo la dose di levodopa o modificando la frequenza della sua somministrazione. Con la terapia a lungo termine per la malattia di Parkinson, la correzione diventa più complicata. Quando si riduce il dosaggio dei farmaci o la frequenza di somministrazione, l'attività motoria dei pazienti può peggiorare: comparsa precoce di sintomi “off” o maggiore gravità di questo periodo.
Esistono numerosi gruppi di farmaci che possono ridurre la gravità e la durata della discinesia e vengono utilizzati i seguenti approcci:
— ottimizzazione della terapia con agonisti dei recettori della dopamina riducendo contemporaneamente la dose di levodopa;
- uso di preparati a base di levodopa ad azione prolungata;
— uso degli inibitori delle COMT in terapia;
- aumentare la frequenza di assunzione di farmaci a base di levodopa;
- uso di grandi dosi di amantadine in terapia.
Esistono approcci alla terapia a seconda del tipo di discinesia.
In presenza di discinesia coreiforme da dose di picco, possono essere utilizzati i seguenti metodi:
- sostituzione delle forme di levodopa ad azione rapida con una forma ad azione prolungata;
- sospensione degli inibitori MAO-B;
- ridurre la dose singola di levodopa e/o aumentare la dose di antagonisti dei recettori della dopamina;
- prescrivere o aumentare la dose di farmaci del gruppo amantadina;
— trattamento neurochirurgico.
In presenza di discinesia bifasica, vengono utilizzati i seguenti metodi di correzione:
- sostituzione del farmaco levodopa ad azione prolungata con un farmaco ad azione rapida;
- aumentare la dose di farmaci dopaminergici;
— aggiunta di un inibitore COMT;
- ridurre la dose mattutina di levodopa e/o la dose giornaliera senza modificare l'intervallo tra le dosi;
- metodo neurochirurgico.
Se è presente distonia mattutina, viene utilizzato il seguente approccio terapeutico:
- assunzione notturna di levodopa;
- assunzione notturna di agonisti dei recettori della dopamina;
— aggiunta di inibitori COMT;
- assunzione mattutina di farmaci a base di levodopa.
Metodi promettenti per il trattamento della malattia di Parkinson. Attualmente, la maggior parte dei PPS utilizzati oggi appartengono al gruppo di quelli sintomatici. Tuttavia, non impediscono né rallentano il processo patologico di neurodegenerazione né ne provocano lo sviluppo inverso. A questo proposito, sono attualmente in fase di sviluppo e introduzione numerosi nuovi farmaci antiparkinsoniani, concentrandosi non tanto sull'effetto sintomatico, ma sulla base patogenetica della malattia (Fig. 2).
Tenendo conto dell'impatto sui meccanismi patogenetici della PD, l'uso di nuovi antiossidanti (idebenone, ecc.) e di antagonisti dei recettori del glutammato con proprietà antieccitotossiche (riluzolo, remasemide) è considerato promettente. Si sta sviluppando attivamente una direzione relativa alla terapia genica per la malattia di Parkinson: l'introduzione stereotassica nell'area striatale di varie nanoparticelle pseudovirali che trasportano geni per fattori di crescita peptidici, enzimi di sintesi della dopamina, ecc. Le prospettive della terapia rigenerativa cellulare per la malattia di Parkinson dipendono dal successo dei tentativi di trasformare il fenotipo delle cellule utilizzate (cellule staminali mesenchimali del midollo osseo e del tessuto adiposo, cellule parietali dell'epitelio olfattivo, ecc.) lungo la via specifica Neuroni che producono DA.
Particolari speranze sono riposte nello sviluppo e nell’implementazione clinica di nuovi approcci molecolari alla terapia neuroprotettiva per la neurodegenerazione nella malattia di Parkinson:
- uso di fattori di crescita peptidici - GDNF, ecc. mediante somministrazione intraventricolare;
— approcci di terapia genica per aumentare l'espressione di parkin, PINKI, DJ-1 e altre proteine nel cervello;
— l'uso di farmaci che aumentano l'espressione dei cpereroni molecolari, l'attività del complesso proteasoma e l'intensificazione dei processi di autofagia lisosomiale;
— uso di inibitori dell'aggregazione e della lavorazione dell'a-sinucleina, inibitori dell'attività della chinasi LRRK2;
— introduzione di farmaci con proprietà citochine e antinfiammatorie (eritropoietina, ecc.), compresi quelli che sopprimono le reazioni di attivazione microgliale.
Tuttavia, affinché i nuovi metodi di terapia per la malattia di Parkinson siano efficaci, devono essere implementati in una fase precoce o addirittura latente del processo neurodegenerativo, poiché le forme clinicamente manifeste della malattia di Parkinson sono associate alla morte del 60-80% dei neuroni dopaminergici. Ciò pone il compito di sviluppare adeguati biomarcatori della malattia di Parkinson - neuroimaging, neurofisiologici, biochimici, genetici molecolari, ecc., che potrebbero fornire informazioni nelle prime fasi possibili della malattia.
Letteratura
1. Morbo di Parkinson e disturbi del movimento: una guida per i medici / Ed. S.N. Ilarioshkina, N.N. Yakhno. - M., 2008. - 405 pag.
2. Disturbi extrapiramidali: guida alla diagnosi e al trattamento / Ed. V.N. Shtoka, I.A. Ivanova-Smolenskaya, O.S. Levina. - M.: MEDpress-inform, 2002. - 608 p.
3. Golubev V.L. Trattamento della malattia di Parkinson: questioni risolte e irrisolte // Lezioni selezionate di neurologia / Ed. V.L. Golubeva. - M.: Eidos Media, 2006. - P. 395-420.
4. Zalyalova Z.A., Yakovleva L.A., Bogdanov E.I. Manifestazioni non motorie della malattia di Parkinson: un manuale per la formazione post-laurea. - Kazan, 2009. - 34 p.
5. La diagnostica clinica in neurologia: una guida per i medici / M.M. Odinak, D.E. Dyskin. - San Pietroburgo: SpetsLit, 2007. - 528 p.
6. Malattia di Parkinson (eziologia, patogenesi, quadro clinico, diagnosi, trattamento, prevenzione) / Karaban I.N., Karaban N.V., Kryzhanovsky G.N., Kucheryanu V.G., Magaeva S.V. - M.: Medicina, 2002. - 336 p.
Come fai a sapere se hai la malattia di Parkinson? Devi solo registrare 30 secondi della tua conversazione e fornire al programma l'audio per l'analisi. La precisione del test è del 99%.
0:11
Mi occupo di matematica applicata, e il problema per tutti coloro che si occupano di matematica applicata è che, come consulenti gestionali, nessuno sa cosa facciamo effettivamente. Quindi ora cercherò di spiegarvi cosa faccio.
0:25
La danza è un'attività caratteristica di poche specie e, in particolare, dell'uomo. Ammiriamo il virtuosismo dei ballerini classici e dei ballerini di tip tap, li vedrai ora. Il balletto richiede abilità eccezionali, un alto livello di competenza e forse un certo livello di forma fisica intrinseca, che potrebbe essere determinato geneticamente. Sfortunatamente, le malattie neurologiche, come il morbo di Parkinson, distruggono gradualmente questa straordinaria capacità, come accade al mio amico Ian Stripling, che una volta era un virtuoso ballerino. Nel corso degli anni sono stati fatti notevoli progressi nella cura di questa malattia. Tuttavia oggi colpisce 6,3 milioni di persone nel mondo. Tutti loro sono costretti a convivere con debolezza incurabile, tremori, rigidità e altri sintomi che accompagnano la malattia di Parkinson. Pertanto, sono necessari strumenti oggettivi per individuare questa malattia il prima possibile. Dobbiamo essere in grado di valutare obiettivamente il decorso della malattia, perché solo così possiamo sapere se il trattamento è davvero d'aiuto, quando disponiamo di un indicatore oggettivo che dia una risposta accurata.
1:25
Sfortunatamente, non esistono biomarcatori per la malattia di Parkinson e altri disturbi del movimento, il che significa che non puoi semplicemente fare un esame del sangue e il miglior metodo disponibile è un esame neurologico di 20 minuti. Per fare questo è necessario venire in clinica, inoltre è molto costoso, quindi non è fattibile al di fuori della partecipazione a studi clinici. Semplicemente non è fattibile.
1:44
E se i pazienti potessero eseguire questo test a casa? Non avranno bisogno di recarsi in clinica. Se i pazienti possono eseguire questo test da soli, non ci sarà bisogno di coinvolgere specialisti ben pagati. A proposito, un esame neurologico costa circa 300 dollari.
1:59
Voglio offrire un approccio non convenzionale per risolvere questo problema. Il fatto è che siamo tutti dei virtuosi in un certo senso, come il mio amico Ian Stripling.
2:08
Ora vedi come vibrano le corde vocali quando una persona parla, e quella persona è sana. Possiamo tutti considerarci dei virtuosi vocali, perché per pronunciare i suoni dobbiamo coordinare il lavoro di tutti gli organi vocali, e per questo esistono anche geni speciali, ad esempio FoxP2. Proprio come il balletto, richiede il massimo livello di allenamento. Ricorda quanto tempo impiega un bambino per imparare a parlare. Dal suono possiamo determinare la posizione delle corde vocali mentre vibrano. Nella malattia di Parkinson non sono colpiti solo gli arti, ma anche gli organi della parola. La conclusione è un esempio di vibrazione anomala delle corde vocali. Vediamo gli stessi sintomi: tremore, debolezza e rigidità. Il linguaggio diventa più silenzioso, ansimante e ritardato, e questo è uno dei sintomi tipici della malattia.
2:53
I segni di alterazioni delle corde vocali possono essere impercettibili, ma se usiamo un normale microfono digitale e un programma sensibile di analisi vocale computerizzata, e gli ultimi progressi nell’autoapprendimento computerizzato, che ora sono notevolmente migliorati, possiamo determinare con precisione quale stadio della malattia una persona è colpita solo dalla sua voce.
3:14
Come si confronta un test di questo tipo basato sull'analisi vocale con un test clinico eseguito da uno specialista? Entrambi questi test non sono invasivi e utilizzano l’infrastruttura esistente. Non è necessario costruire nuove cliniche per realizzarli. Ed entrambi sono affidabili. Tuttavia, un test basato sull'analisi vocale può essere eseguito da un non specialista. Ciò significa che può essere effettuato in modo indipendente. Questo test è molto veloce e richiede un massimo di 30 secondi. È molto economico e sappiamo a cosa porterà. Quando qualcosa diventa economico, diventa prodotto in serie. Ecco alcuni obiettivi straordinari che ora possiamo prefiggerci. Possiamo ridurre il numero di visite cliniche per i pazienti. Non avranno bisogno di venire per un esame di routine. Possiamo effettuare monitoraggi frequenti e ottenere risultati oggettivi. Possiamo condurre studi clinici a basso costo con un gran numero di partecipanti e, per la prima volta nella storia, possiamo studiare l’intera popolazione. Abbiamo l’opportunità di iniziare la ricerca dei biomarcatori precoci della malattia in modo da poter iniziare il trattamento fin dall’inizio.
4:07
Oggi stiamo muovendo i primi passi in questa direzione e lanciando il programma “La Voce della Malattia di Parkinson”. Insieme ad Aculab e PatientsLikeMe, vogliamo registrare le voci di un gran numero di persone in tutto il mondo per raccogliere dati sufficienti per iniziare a raggiungere questi quattro obiettivi. Abbiamo numeri di telefono locali disponibili per 750 milioni di persone. Ogni persona, sana o affetta dal morbo di Parkinson, può chiamare e lasciare una registrazione della propria voce. La chiamata costa solo pochi centesimi. E sono molto felice di annunciare che abbiamo già raggiunto il 6% del nostro obiettivo in sole 8 ore. Grazie. (Applausi). (Applausi).
4:43
Tom Riley: Max, quindi quando registri i tuoi campioni vocali, diciamo su 10.000 persone, sarai in grado di dire chi è sano e chi è malato? Cosa otterrai?
4:54
Max Piccolo: Sì, sì. Il fatto è che durante la chiamata dovrai indicare se hai la malattia di Parkinson.
TR: Va bene. ML: Vedi, qualcuno potrebbe non essere in grado di farcela, qualcuno potrebbe non farcela. Ma avremo un vasto campione di campioni registrati in un’ampia varietà di condizioni, e questo è molto importante perché è ciò che ci permetterà di scartare tutti i fattori confondenti e identificare i veri marcatori della malattia.
5:15
TR: Ora la precisione del metodo è dell'86%?
5:18
ML: No, ora è molto più grande. Il mio studente Thanasis - devo nominarlo perché ha fatto un ottimo lavoro - ha verificato che tutto funzionasse sulle reti di telefonia mobile che hanno reso possibile questo progetto e abbiamo raggiunto una precisione del 99%.
Oggi la diagnosi della malattia di Parkinson è raramente difficile. Tuttavia, in alcuni casi è necessario un approccio differenziale allo studio del problema, quindi è sempre importante che uno specialista rappresentato dal medico curante sia assolutamente competente in materia. Ulteriori conoscenze nella diagnosi della malattia di Parkinson non faranno mai male, perché... La malattia stessa è spesso misteriosa.
Molti pazienti oggi vivono senza nemmeno rendersi conto che stanno sviluppando il parkinsonismo. Il fatto è che nelle forme iniziali la malattia è praticamente asintomatica e viene diagnosticata durante un esame casuale o nel caso di un approccio particolarmente attento del paziente alla propria salute. A volte i parenti notano i minimi cambiamenti e mandano il paziente dal medico.
In un modo o nell'altro, la società moderna è ben consapevole di questo problema, quindi molti sono interessati a sapere se esiste o meno un unico test per la malattia di Parkinson. La risposta è semplice: no, sfortunatamente tali test non esistono, anche se i medici di tutto il mondo ci stanno lavorando e gli scienziati americani sono persino riusciti a sviluppare una sorta di sistema di carte che consente di scoprire rapidamente la presenza del malattia. Nessuno sa quanto sia efficace, perché nel nostro paese non viene utilizzato. E se qualcuno dei medici utilizza tale esperienza nella propria pratica, lo fa esclusivamente a fini di ricerca, ma non come aspetto fondamentale nella diagnosi della malattia di Parkinson.
Test di Parkinson: mito o realtà?
In realtà il test del Parkinson esiste e non è l'unico. Ti invitiamo a considerare ciascuno di essi.
Test della levodopa
Questo studio viene effettuato nei casi in cui la diagnosi non è stata definitivamente confermata. Come è noto, la diminuzione della produzione di dopamina gioca un ruolo importante nello sviluppo della malattia di Parkinson.
La levodopa è il farmaco principale per i malati di Parkinson, la sua azione è mirata al ripristino dei livelli di dopamina. Ecco perché, quando la diagnosi viene messa in dubbio per un motivo o per l'altro, i pazienti si sottopongono al test della levodopa.
La sua essenza sta nella somministrazione di determinate dosi del farmaco e nel monitoraggio delle condizioni del paziente. Se i sintomi clinici si riducono e le condizioni del paziente migliorano, allora ci sono tutte le ragioni per parlare di una diagnosi di malattia di Parkinson.
Test medici per l'equilibrio

Tali test non sono direttamente correlati alla malattia di Parkinson, ma possono essere utilizzati nella diagnosi differenziale della malattia. Il medico curante sceglie la tecnica in modo indipendente, tenendo conto delle caratteristiche individuali del paziente.
Tali test per la malattia di Parkinson includono quelli che determinano il livello di abilità quando si scrive testo su carta, quando si versa l'acqua da un bicchiere all'altro. In questo modo è possibile valutare le caratteristiche del tremore a riposo e in movimento, che fornisce alcune informazioni agli specialisti in fase di diagnosi.
L’automonitoraggio delle proprie capacità è importante quanto una visita medica. Se noti che stai perdendo la tua precedente erudizione o che questo sta accadendo a un tuo parente, non controlli il processo di conversazione o noti una sensazione di dimenticanza in te stesso o in una persona cara, puoi condurre tali test a casa. Se la tua calligrafia cambia, non ci sono spazi tra le lettere o altri segni di attività vitale che non sono caratteristici della tua vita precedente, dovresti contattare uno specialista per chiedere aiuto.
Ciao cari lettori del sito portale. Con l'età, si verificano alcuni cambiamenti nel corpo umano, che spesso portano alla comparsa di malattie, chiamate legate all'età.
La cosa più triste è che questi cambiamenti hanno cominciato a verificarsi molto prima e una persona non può ancora essere definita anziana, ma lo è già. Stranamente, questa malattia può essere trovata in una persona di quarant'anni.
Studi moderni che includevano pazienti con diagnosi di: morbo di Parkinson, nelle fasi iniziali, mostra che il coenzima Q10 inibisce il declino delle funzioni cerebrali, a differenza del placebo, poiché possiede potenti proprietà antiossidanti necessarie per la produzione di energia cellulare. La ricerca è ancora in corso, ma è già noto con certezza che il coenzima Q10 in terapia complessa viene utilizzato nel trattamento del morbo di Alzheimer, di molte malattie cardiache, del diabete e della distrofia muscolare.
Secondo l'OMS, la malattia di Parkinson colpisce l'1,5% ovvero 4 milioni di persone sul pianeta.
Cosa succede nella malattia di Parkinson?
Durante la malattia viene colpita una sostanza nel cervello chiamata substantia nigra, che rilascia dopamina. La sua funzione è quella di simulare gli impulsi nervosi che assicurano i normali movimenti.
Con il progredire della lesione, questa funzione viene interrotta e ne risente la trasmissione degli impulsi, che si manifesta con sintomi quali: segni di lentezza, rigidità, compromissione del controllo dell'equilibrio, tremore.
Cosa provoca il danno alla substantia nigra?
Gli scienziati non hanno ancora un consenso sul motivo per cui ciò sta accadendo. La ricerca in questa direzione viene condotta molto attivamente, poiché questo problema è attualmente molto rilevante, ma finora senza risultati. Fattori che influenzano l'aspetto La malattia di Pkinson:
Predisposizione cinetica;
Processi di ossidazione dei radicali liberi;
Danni a varie sostanze tossiche.
Esistono due tipi di malattie: primarie e secondarie.
Primario: si verifica a causa dei motivi poco chiari sopra elencati.
Secondario è il risultato dell'assunzione di farmaci antipsicotici, farmaci, lesioni e varie intossicazioni.
Ma tutti questi tipi si manifestano allo stesso modo. I metodi che consentono di valutare le condizioni della substantia nigra sono la tomografia a emissione di positroni e.
Test della malattia di Parkinson:
1. Estendi le braccia davanti a te e inizia a stringere e aprire le dita alla massima velocità. Se avverti asimmetria, cioè diverse velocità di movimento degli arti, questo potrebbe essere un segno di malattia.
2. Siediti su una sedia, metti i piedi sui talloni e batti il piede sul pavimento, sempre alla massima velocità. Se un piede si muove abbastanza bene, ma l’altro rallenta, vale la pena prestare attenzione a questo.
3. Incrocia le braccia sul petto e alzati senza il loro aiuto, non funziona, pensaci.
4. Alzati e chiedi a qualcuno di spingerti leggermente indietro mentre cerchi di alzarti e di non muoverti all'indietro. Se non avesse funzionato e non potessi controllare il centro di gravità. Questo potrebbe anche essere un campanello d'allarme.
In ogni caso, se vengono rilevati questi segni, non ritardare la visita dal medico. Anche se questa malattia viene confermata, non arrenderti in nessun caso, combatti e fatti curare. Prenditi cura di te e della tua salute, avrai successo!
Salute a te e ai tuoi cari!
A presto sulle pagine, Alla
Sebbene La malattia di Parkinson è incurabile, i medici possono ora influenzare favorevolmente il decorso della malattia in modo che i pazienti possano godere di un'elevata qualità di vita per molti anni. Per combattere la distruzione delle cellule cerebrali nel Parkinson, i medici devono individuare precocemente la malattia, ma purtroppo esistono pochissimi metodi idonei per la diagnosi precoce.
I ricercatori lo hanno ora scoperto senso dell'olfatto dà preziosi consigli. L’iposmia, che è la perdita della capacità di annusare per un motivo sconosciuto, può essere un indicatore di sintomi non motori. Il Dr. Ulrich Liebetrau, primario delle consultazioni per la malattia di Parkinson presso il Dipartimento di Neurologia della Kliniken der Stadt di Colonia, ha dichiarato al 22° incontro della Società Europea di Neurologia (ENS) a Praga: “Gli esami dell'olfatto negli studi medici sono adatti per il rilevamento di iposmia, oltre a condurre test in aree pubbliche come le aree pedonali”.
La malattia di Parkinson è una malattia neurologica molto comune che progredisce lentamente e colpisce solitamente persone di età compresa tra i 50 e i 60 anni. Solo in Germania sono circa 300.000 le persone a cui è stato diagnosticato il Parkinson. Gli scienziati rimangono incerti sulle cause della morte cellulare che si verifica nella substantia nigra dei gangli della base del cervello dei pazienti affetti da Parkinson, ma sospettano che possano essere coinvolti fattori genetici. La morte cellulare provoca una mancanza di dopamina, un neurotrasmettitore, che porta alla perdita di controllo sui movimenti volontari e involontari. Neurologi tedeschi di Colonia hanno ora testato un nuovo metodo per la diagnosi precoce dei segni sottili della malattia di Parkinson, concentrandosi sulla perdita parziale dell'olfatto, sulla base di ricerche precedenti che mostravano che una persona su dieci con iposmia svilupperà la malattia di Parkinson negli anni successivi.
Il dottor Liebetrau ha spiegato: "Il nostro obiettivo era raggiungere il maggior numero possibile di persone affette da iposmia".
Il team ha utilizzato un metodo insolito per il test. Sabato hanno effettuato un test olfattivo pubblico in una sala banchetti in una nota zona pedonale di Colonia. Liebetrau ha descritto i requisiti che devono essere soddisfatti per eseguire:
“Affinché le persone potessero sostenere il test che proponevamo, la location doveva essere centrale e familiare a tutti. Un altro fattore importante era disporre di aree chiuse per le analisi, ma le tende potevano sminuire la gravità dell’evento”.
Hanno chiesto a 187 partecipanti di annusare vaniglia, limone, chiodi di garofano e lavanda. Un totale di 46 partecipanti sono stati identificati come affetti da iposmia e gli è stata offerta un'ulteriore valutazione presso le cliniche della città di Colonia (Kliniken der Stadt Köln). Il Dr. Liebetrau spiega: “Dopo il test è stato richiesto un esame professionale da parte di neurologi e specialisti otorinolaringoiatri in tempi e luoghi separati. Dopotutto, l’iposmia può essere un sintomo di un’ampia varietà di condizioni mediche”.
I risultati hanno rivelato che a tre delle 46 persone con iposmia era stata diagnosticata la malattia di Parkinson, sebbene prima del test non sapessero di essere affetti dalla malattia.
Uno dei principali vantaggi dei test a bassa soglia è che le malattie che altrimenti passerebbero inosservate vengono rilevate in una fase precoce, il che previene anche le malattie croniche. La diagnosi precoce è utile, anche se è associata a gravi disturbi neurologici come il morbo di Parkinson.
Il dottor Liebetrau ha affermato: “Non esiste una cura per la malattia di Parkinson, ma nuovi farmaci come la Rasagilina potrebbero avere un chiaro effetto positivo sulla malattia, soprattutto se il trattamento viene iniziato precocemente. Sono necessarie ulteriori ricerche per determinare se ciò si applica anche alle fasi iniziali della malattia”.
I ricercatori concludono che le disfunzioni olfattive non sono solo fastidiose; forniscono inoltre l'opportunità di rilevare la malattia di Parkinson nelle fasi iniziali della malattia e raccomandano l'uso dell'iposmia come indicatore precoce della malattia di Parkinson. Liebetrau conclude: “I medici dovrebbero chiedere più spesso informazioni sulle disfunzioni olfattive ed eseguire test semplici, come caffè o spezie. Se si sospetta un’iposmia, è necessario eseguire la conferma della malattia”. Ha aggiunto che i test dell’olfatto pubblici sono particolarmente adatti per aumentare la consapevolezza dell’iposmia.
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0