Una malattia chiamata "fibromi uterini" è molto comune. L'emergere della patologia contribuisce a molti fattori avversi che le donne devono affrontare nella vita moderna. L’infertilità può essere una complicanza seria. Fibromi uterini, fibromi, leiomiomi sono varietà dello stesso tumore che differiscono tra loro nella struttura, ma possono portare a conseguenze altrettanto gravi. È importante rilevare ed eliminare la patologia in modo tempestivo.
Contenuto:
Caratteristiche del leiomioma
Nella sua parete si formano tumori benigni dell'utero (fibromi). Oltre alle fibre muscolari, c'è anche una base di tessuto connettivo e una rete di vasi sanguigni. A seconda della struttura dei tumori, si distinguono diversi tipi di tale patologia. Ad esempio, il fibroma è costituito da tessuto fibroso (connettivo), il fibromioma - da una miscela di tessuto fibroso e muscolare, con la predominanza del primo. Il leiomioma è un tumore, quasi interamente costituito da fibre muscolari lisce con una piccola aggiunta di tessuto fibroso, che ha un sistema vascolare.
È un groviglio che si forma nello spessore della parete, per poi crescere verso la cavità uterina o oltrepassarla. Il leiomioma si verifica principalmente nelle donne in età riproduttiva (20-40 anni), poiché è un tumore estrogeno-dipendente. La particolarità è che in alcuni casi è in grado di scomparire da sola.
Fasi di sviluppo e forme di esistenza
Lo sviluppo del leiomioma avviene per fasi.
Nella prima fase si forma il suo germe. La successiva divisione cellulare porta alla formazione graduale di un nodo tumorale.
Nella seconda fase, l'aumento del leiomioma continua grazie al miglioramento della nutrizione, man mano che la rete dei vasi sanguigni cresce.
Il terzo stadio è la regressione, lo sviluppo inverso del leiomioma uterino, che si verifica se il contenuto di estrogeni nel corpo diminuisce drasticamente. Ciò accade, ad esempio, con la menopausa, quando un piccolo leiomioma, formatosi in precedenza, si risolve da solo dopo la cessazione del funzionamento delle ovaie. Lo stesso risultato porta a un trattamento tempestivo nella formazione di un tumore in una giovane donna. In questo caso, un piccolo leiomioma scompare dopo una diminuzione artificiale dei livelli di estrogeni con l'aiuto di preparati speciali.
Il tumore può esistere in forma nodulare (la più comune) e diffusa. La forma nodale è caratterizzata dalla formazione di uno (tipo singolo) o più nodi arrotondati (tipo multiplo) con confini chiari. Con forma diffusa compaiono numerosi ispessimenti informi, sparsi in tutto il volume dell'organo. Questa forma è estremamente rara.

I nodi di un tumore multiplo si formano non contemporaneamente, hanno dimensioni diverse. Insieme ai nodi di leiomioma possono essere presenti tumori simili di diverso tipo (fibromiomi, per esempio).
Tipi di leiomiomi
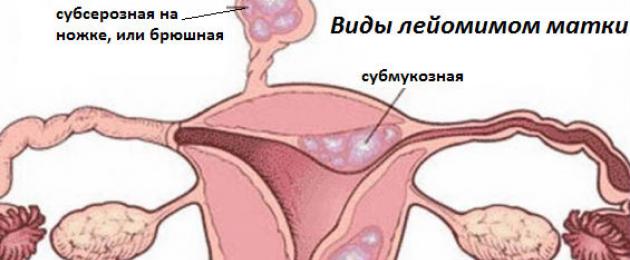
La parete dell'utero è composta da 3 strati: endometrio (membrana mucosa interna, che si rinnova mensilmente), miometrio (strato muscolare) e perimetria (membrana sierosa esterna). A seconda della direzione in cui cresce il nodo, i leiomiomi si dividono nei seguenti tipi:
- Il tumore intramurale non si estende oltre il miometrio.
- Il leiomioma sottomucoso (sottomucoso) si gonfia nella cavità, assumendone un volume crescente con un aumento.
- Il subseroso (sottoperitoneale) cresce all'esterno, entra nella cavità addominale e molto spesso si collega al corpo dell'utero con uno stelo sottile.
Se il tumore è situato vicino al peritoneo e ha dimensioni significative, può essere rilevato mediante palpazione dell'addome.
Ragioni per la formazione del leiomioma
La ragione principale per lo sviluppo del leiomioma uterino è l'insufficienza ormonale. Un aumento patologico della concentrazione di estrogeni nel sangue si verifica nei seguenti casi:
- La produzione degli ormoni ipofisari FSH e LH, che regolano la formazione di estrogeni e progesterone nelle ovaie, viene interrotta (la variante “centrale” dell'insorgenza della patologia). La causa delle violazioni può essere malattie endocrine, lesioni alla testa, circolazione cerebrale impropria, disturbi mentali e nervosi.
- Si verifica un fallimento della funzione di formazione degli ormoni delle ovaie a causa della comparsa di malattie infiammatorie o tumorali in esse, danni a questi organi ("variante ovarica"). La comparsa del leiomioma in questo caso è facilitata dagli aborti e dalle operazioni sui genitali, nonché dal mancato rispetto delle norme igieniche e della protezione contro le infezioni sessuali.
- Nella cavità uterina vengono danneggiati i recettori che rispondono agli effetti degli estrogeni (variante “uterina”). Ciò si verifica durante il curettage o un trauma addominale.
Il fattore che provoca l'eccessivo accumulo di estrogeni nel sangue è l'uso di preparati ormonali ad alto contenuto, un disturbo metabolico che porta all'obesità, un cambiamento nella composizione del sangue. La causa di uno scambio improprio può essere la scarsa attività fisica di una donna e l'eccesso di cibo sistematico.
Un ruolo importante è giocato dalla predisposizione ereditaria alla comparsa di tali tumori, nonché dalla presenza di patologie congenite nello sviluppo degli organi genitali. La presenza di malattie vascolari, in cui l'afflusso di sangue a vari organi viene interrotto, contribuisce alla comparsa del leiomioma.
Video: cause dei fibromi, come prevenirne lo sviluppo
Sintomi del leiomioma
Il leiomioma uterino può svilupparsi in modo asintomatico fino a raggiungere una dimensione di 2-3 cm La crescita delle neoplasie porta al dolore dovuto allo stiramento dei tessuti, alla ridotta contrattilità uterina.
Ci sono irregolarità mestruali. Le mestruazioni diventano lunghe e abbondanti. Non conoscendo il motivo, la donna inizia ad assumere farmaci emostatici e antidolorifici. Ciò aiuta ad alleviare le manifestazioni spiacevoli e la visita dal medico viene posticipata. La regolarità del ciclo viene gradualmente disturbata, aumenta la perdita di sangue.
Ci sono segni di un disturbo nel funzionamento della vescica (crampi, minzione frequente) e indigestione. Ciò è dovuto all'effetto compressivo del tumore su altri organi della piccola pelvi.
A causa dell'aumento delle dimensioni dei nodi in una donna, lo stomaco inizia a crescere, come in una donna incinta. È consuetudine stimare la dimensione del leiomioma sia in centimetri che in "settimane ostetriche". La dimensione dell'addome con un aumento del tumore corrisponde alla sua dimensione in una determinata settimana di gravidanza.
Nota: L'ingrossamento dell'addome dovuto alla crescita dei fibromi viene talvolta scambiato per un segno di gravidanza. Anche la presenza delle mestruazioni non disturba, poiché durante questo periodo si verifica una scarica sanguinolenta.

Quali sono le possibili complicazioni
La gravità delle complicanze dipende dalle dimensioni e dalla posizione del leiomioma. I tumori si riscontrano più spesso dopo un aumento delle dimensioni dei linfonodi fino a 5-6 cm o più.
A seconda del tipo di tumore
Sottomucoso Il leiomioma uterino è la causa più comune e tangibile di complicanze quali:
- Disturbi mestruali, manifestati da sanguinamenti prolungati e abbondanti, non solo durante le mestruazioni, ma anche tra di loro.
- Infertilità. Il tumore interferisce con la normale formazione dell'endometrio, rendendo impossibile il mantenimento dell'embrione nell'utero, così come la formazione di una placenta normale. Può bloccare la cervice o le tube di Falloppio.
- Nascita del leiomioma. Sotto l'azione delle contrazioni dei muscoli uterini, un grosso fibroma, situato vicino al collo e con una base sottile, può cadere nella zona vaginale.
- Danni ai vasi del tumore, che portano a pericolosi sanguinamenti uterini, alla comparsa di un "addome acuto" e all'anemia.
Sottoseroso. Non compaiono disturbi della funzione mestruale. Ma le complicazioni non possono essere meno gravi. La torsione del gambo sottile di un tale tumore porta alla necrosi dei suoi tessuti. La decomposizione di un tumore morto nella cavità addominale provoca la peritonite.
La pressione dei nodi sugli organi vicini della piccola pelvi porta all'interruzione del loro lavoro, alla spremitura dei vasi sanguigni, all'infiammazione, al forte dolore all'addome, alla nausea e al vomito. Tali tumori sono più difficili da rilevare e spesso vengono scoperti solo quando compaiono complicazioni.
Intramurale. Con un aumento del tumore, lo stato della rete vascolare e la struttura dello strato muscolare vengono disturbati. Ciò porta ad una diminuzione della contrattilità uterina, a seguito della quale la rimozione del sangue mestruale richiede più tempo del solito. Forse il verificarsi di ristagno di sangue nella cavità del corpo, la comparsa di endometrite ed endometriosi.
Il dolore sordo e costante nell'addome è un segno caratteristico della presenza di un tale tumore.

Leiomioma in gravidanza
Con la formazione di grandi nodi sottomucosi in una donna, l'inizio della gravidanza è difficile a causa di una violazione della struttura della mucosa uterina. Un eccesso di estrogeni, che provoca la comparsa di un tumore, porta alla comparsa di cicli anovulatori, in cui l'ovulo non matura, il concepimento è impossibile. La fissazione dell'embrione nella parete dell'utero è impedita non solo dall'immaturità dell'endometrio, ma anche dall'aumentata contrattilità dell'utero durante la formazione dei fibromi sottomucosi.
Se i nodi sono piccoli, la gravidanza è possibile, ma il tumore in crescita impedisce la crescita del feto, ne compromette l'afflusso di sangue e la nutrizione. Il parto può iniziare alcune settimane prima della data di scadenza, possono verificarsi gravi emorragie.
Dopo che una neoplasia come il leiomioma uterino viene rilevata in una donna incinta, il suo sviluppo viene attentamente monitorato. Se aumenta così tanto da interferire con la crescita del feto, viene rimosso (il più delle volte dopo la 16a settimana di gravidanza). Il parto viene effettuato in anticipo utilizzando un taglio cesareo.
Leiomioma con menopausa
Nelle donne di età superiore ai 50 anni, un tale tumore normalmente non può formarsi. E anche viceversa, un nodo preesistente spesso si risolve da solo. Tuttavia, quando si verificano malattie endocrine, compaiono ancora tumori uterini e il rischio della loro degenerazione in cancro aumenta in modo significativo, soprattutto in presenza di un tumore di tipo diffuso.
Avvertimento: Una donna dovrebbe contattare immediatamente un ginecologo se ha sanguinamento dai genitali durante il periodo postmenopausale. A volte è vitale.
Diagnosi e trattamento
Quando si prescrive il trattamento, vengono specificati la benignità della neoplasia, il numero, la dimensione e la posizione dei linfonodi, nonché la gravità dei sintomi.
Sondaggio
Se viene rilevato un ispessimento della parete e un aumento delle dimensioni dell'utero, viene prescritto un esame con ecografia (transvaginale e addominale), una radiografia dell'utero con una soluzione di contrasto (isterosalpingografia). L'ispezione della cavità dell'organo viene eseguita anche utilizzando un dispositivo ottico (viene eseguita l'isteroscopia). Se necessario, viene prelevato un campione di tessuto dal tumore (biopsia con il metodo laparoscopico), che consente di escludere l'oncologia e chiarire la struttura del fibroma. Inoltre, possono essere prescritte scansioni MRI e TC e un esame del sangue per i livelli ormonali.

Trattamento
Il trattamento utilizza sia metodi conservativi che chirurgici. Quando si sceglie una tecnica, vengono prese in considerazione la dimensione e la posizione dei nodi del leiomioma uterino, nonché l'età della paziente e il suo desiderio di preservare la funzionalità degli organi riproduttivi.
Terapia conservativa viene utilizzato nel caso in cui la dimensione del tumore non superi le 12 settimane ostetriche e non vi siano sintomi pericolosi di complicanze. L'indicazione per tale trattamento è l'intenzione della donna di avere figli in seguito.
Il livello di estrogeni nel corpo è ridotto. In questo caso vengono utilizzati contraccettivi orali (COC), che aiutano a regolare il ciclo, normalizzando il rapporto degli ormoni sessuali femminili.
Per eliminare le conseguenze dell'iperestrogenismo, vengono prescritti preparati progestinici (duphaston, utrogestan, pregnin), che sopprimono l'effetto degli estrogeni sui tessuti uterini. Una diminuzione della produzione di estrogeni si ottiene anche con l'aiuto di farmaci che sopprimono la produzione di ormoni ipofisari che stimolano la formazione di estrogeni nelle ovaie (zoladex).
Per accelerare il processo di regressione del tumore, vengono prescritte procedure fisioterapeutiche (bagni terapeutici, elettroforesi e altri).
Chirurgia. Le indicazioni per la sua attuazione sono le grandi dimensioni dei nodi (più di 3 cm di diametro), l'esistenza di un lungo stelo, un notevole aumento del tumore, una diminuzione del volume libero dell'utero, la presenza di gravi emorragie e anemia. Una controindicazione sarà la presenza di malattie infiammatorie e infettive in una donna, nonché patologie vascolari e malattie del sangue.
Per rimuovere il tumore, il metodo più comunemente utilizzato è la laparoscopia, un'operazione per eliminare la neoplasia attraverso punture nell'addome. Un metodo più traumatico è la laparotomia: rimozione del tumore attraverso un'incisione sopra il pube. Viene utilizzato in presenza di fibromi di grandi dimensioni. In alcuni casi, il tumore viene rimosso (miomectomia) attraverso la vagina.
I metodi più parsimoniosi sono l'UAE (blocco dei vasi sanguigni tumorali), l'ablazione ad ultrasuoni. Con danni estesi all'utero, viene eseguita la sua rimozione parziale o completa.
Video: trattamento dei fibromi uterini con UAE
I fibromi uterini sono un tumore benigno caratterizzato da diversa localizzazione, dimensione, manifestazioni cliniche e caratteristiche patogenetiche di sviluppo. Di norma, i fibromi uterini sono multipli, crescendo da miociti immaturi della membrana muscolare dei vasi.
SINONIMI DI MIOMA UTERINO
Fibromioma, leiomioma.
CODICE ICD-10
D25.0 Leiomioma sottomucoso.
D25.1 Leiomioma intramurale.
D25.2 Leiomioma sottosieroso.
D25.9 Leiomioma non specificato (esame ginecologico primario)
EPIDEMIOLOGIA
Tra tutte le malattie ginecologiche, i fibromi uterini si verificano nel 30-35% dei casi e durante la gravidanza - in
0,5–6,0% delle osservazioni.
CLASSIFICAZIONE DEI MIOMI UTERINI
La classificazione è stata proposta dall’OMS nel 1994.
Leiomioma comune.
Leiomioma cellulare.
Leiomioma epitelioide (leiomioblastoma).
· Leiomiomatosi intravascolare o leiomioma "metastatizzante".
Leiomioma in crescita (proliferante).
· Fibromi maligni.
EZIOLOGIA E PATOGENESI DEL MIOMA UTERINO IN GRAVIDANZA
Il leiomioma uterino è un tumore ormono-dipendente. La formazione e la crescita dei leiomiomi sono associate a una complessa interazione degli ormoni steroidei e dei loro recettori nel miometrio e nel tumore attraverso un complesso di fattori che influenzano i processi di proliferazione, apoptosi e angiogenesi.
Con l'inizio della gravidanza, il contenuto degli ormoni steroidei sessuali nel flusso sanguigno locale dell'utero cambia.
Un aumento del volume dei linfonodi nelle prime 8 settimane di gravidanza può essere associato a iperplasia e ipertrofia cellulare. Dall'ottava settimana di gravidanza fino al suo completamento, l'iperplasia cellulare nei nodi miomatosi viene completamente bloccata e la morte dei miociti nella zona centrale dei nodi viene accelerata. La variazione del volume dei fibromi durante questi periodi è associata a edema tissutale, disturbi emodinamici e linfodinamici, cambiamenti distruttivi e necrosi.
QUADRO CLINICO (SINTOMI) DEI fibromi uterini DURANTE LA GRAVIDANZA
Le manifestazioni dei fibromi uterini durante la gravidanza dipendono dalla posizione, dalle dimensioni dei nodi miomatosi e dalla concomitante patologia dell'utero (processi iperplastici endometriali, adenomiosi, tumori ovarici). Principali sintomi clinici:
Sanguinamento uterino patologico - menometrorragia, spotting intermestruale;
sindrome del dolore - dolore al basso ventre e alla parte bassa della schiena, di diversa natura e intensità;
Violazione delle funzioni degli organi vicini: minzione frequente, stitichezza;
sintomi di "addome acuto" in violazione della circolazione sanguigna nel nodo miomato - segni di irritazione del peritoneo, febbre, disturbi dispeptici.
Forse un decorso asintomatico dei fibromi uterini, in cui non vi sono violazioni della funzione mestruale.
COMPLICAZIONI DELLA GESTAZIONE
Esistono due gruppi a rischio di complicanze durante la gravidanza.
Le donne a basso rischio includono:
-- fino a 35 anni;
- senza patologia extragenitale;
- con localizzazione subperitoneale dei nodi;
- con piccole dimensioni di nodi localizzati per via intramuscolare (fino a 5 cm di diametro);
- con durata della malattia non superiore a 5 anni.
Le donne ad alto rischio includono:
- primipare di età pari o superiore a 35 anni;
-- con localizzazione intramurale di grandi nodi (valore iniziale dell'utero 10-13 settimane di gravidanza);
- con crescita centripeta dei nodi, deformità della cavità uterina;
- con nodi sottomucosi e cervicali;
- in caso di pronunciati cambiamenti miomatosi nell'utero;
- con cambiamenti secondari nel nodo, segni di disturbi circolatori;
- con la placenta situata nella proiezione del nodo miomato (“placenta sul nodo”);
- con mioma uterino ereditario;
- con una durata della malattia superiore a 5 anni;
- affetti da infertilità - in caso di gravidanza indotta;
- con malattie somatiche.
Le complicanze più comuni durante la gravidanza in presenza di fibromi uterini:
Minaccia di interruzione a varie età gestazionali;
ICI con localizzazione dell'istmo cervicale dei linfonodi miomatosi;
PN quando la placenta è localizzata nella proiezione del nodo miomato intermuscolare, con crescita centripeta di fibromi o in presenza di un conglomerato di miomi;
preeclampsia;
ZRP;
Crescita rapida del tumore
PONRP, soprattutto se localizzato parzialmente nella proiezione del nodo miomato;
stretto attaccamento della placenta;
trombosi delle vene del bacino a causa della loro compressione da parte di grandi nodi miomatosi;
Posizione e presentazione errata del feto.
In qualsiasi fase della gravidanza, i pazienti con mioma uterino hanno un alto rischio di interruzione prematura a causa di PI, malnutrizione del nodo miomato, aumento periodico del tono uterino, che si traduce in un aumento del deflusso venoso del sangue e si verifica ischemia miometriale.
La gravidanza è consigliata solo se il rischio è basso. Con un alto grado di rischio, la questione di
il prolungamento della gravidanza viene deciso individualmente, tenendo conto dei seguenti fattori:
Il desiderio persistente di una donna di avere un figlio;
ricovero tardivo sotto controllo medico - in termini di più di 22-24 settimane di gravidanza (con un feto vitale);
Infertilità a lungo termine
L'incapacità di interrompere una gravidanza attraverso il canale del parto naturale (localizzazione dell'istmo cervicale del nodo miomato, placenta previa completa, crescita centripeta dei fibromi bassi).
DIAGNOSTICA DEI MIOMI
Termini di esame delle donne in gravidanza con mioma uterino:
I trimestre - 6-10a settimana di gravidanza;
II trimestre - 14-16 e 22-24 settimane di gravidanza;
III trimestre - 32-34a e 38-39a settimana di gravidanza.
ANAMNESI
Quando fai domande, presta attenzione a:
la presenza di fattori di rischio;
fibromi uterini nelle madri e nei parenti stretti;
la durata e le caratteristiche del decorso della malattia;
· funzione fertile;
disturbi caratteristici (menorragia e/o metrorragia, dolore al basso ventre e alla parte bassa della schiena);
Anemia
Violazione delle funzioni degli organi vicini.
ESAME FISICO
In un esame bimanuale, viene palpato un utero denso, tuberoso, ingrossato (a causa dei nodi miomatosi).
RICERCA DI LABORATORIO
·Esame del sangue clinico.
·Chimica del sangue.
·Analisi generale delle urine.
Emostasiogramma.
STUDI STRUMENTALI
L'ecografia aiuta a valutare il numero, la localizzazione, la struttura dei nodi miomato, la loro relazione con la placenta, la presenza di deformazione della cavità uterina, la natura del flusso sanguigno nel nodo miomato e consente anche di condurre la fetometria, valutare la respirazione movimenti e attività motoria del feto, maturità della placenta.
La dopplerografia viene eseguita per valutare il flusso sanguigno nei vasi dei linfonodi miomatosi, nonché il flusso sanguigno fetale nelle varie fasi della gravidanza.
DIAGNOSI DIFFERENZIALE DEL MIOMA UTERINO IN GRAVIDANZA
I fibromi uterini dovrebbero essere differenziati dai tumori ovarici e dalle malattie trofoblastiche.
INDICAZIONI PER LA CONSULTAZIONE DI ALTRI SPECIALISTI
Concomitante patologia extragenitale.
ESEMPIO DI FORMULAZIONE DELLA DIAGNOSI
Gravidanza 16 settimane. Fibromi uterini con localizzazione sottosierosa del nodo.
TRATTAMENTO DEL MIOMA UTERINO IN GRAVIDANZA
OBIETTIVI DEL TRATTAMENTO
Ridurre il tono dell'utero.
· Prolungamento della gravidanza.
La nascita di un bambino sano.
TRATTAMENTO MEDICO
Antispastici: drotaverina [40 mg (2 ml) 2-3 volte al giorno] per via intramuscolare, seguita da un passaggio alla somministrazione orale (da 120 mg a 240 mg / die).
Agenti antipiastrinici: dipiridamolo (75-150 mg/die un'ora prima dei pasti), pentossifillina (10-20 mg/die ai pasti), piccole dosi di acido acetilsalicilico (80-100 mg/die) fino alla 34a settimana.
Tocolitici: l'esoprenalina (5 ml in 400 ml di soluzione di cloruro di sodio allo 0,9%) viene somministrata per via endovenosa alla velocità di 8 gocce al minuto, aumentando la dose fino a quando l'attività contrattile diminuisce; la velocità media di somministrazione è di 15-20 gocce al minuto, la durata di somministrazione è di 6-12 ore 15 minuti prima della fine della somministrazione endovenosa, il farmaco viene assunto per via orale alla dose di 0,5 mg 4-6 volte al giorno .
Gli antibiotici ad ampio spettro vengono prescritti quando vi sono segni di malnutrizione del tessuto linfonodale.
TRATTAMENTO CHIRURGICO DEL MIOMA UTERINO IN GRAVIDANZA
Indicazioni per la miomectomia durante la gravidanza:
minaccia di aborto e impossibilità di curettage delle pareti della cavità uterina a causa della posizione cervicale o istmica dei nodi;
compressione degli organi pelvici, sindrome del dolore;
dimensione gigantesca del tumore, mancanza di prospettive per lo sviluppo della gravidanza;
malnutrizione nel nodo (dolore, febbre, consistenza morbida del tumore, segni di distruzione e gonfiore del nodo durante l'ecografia).
Il momento ottimale per la miomectomia conservativa è 16-19 settimane di gestazione. Dopo l'intervento chirurgico, è necessaria una terapia infusionale per 2-3 giorni, comprendente soluzioni di cristalloidi e agenti che migliorano la microcircolazione e la rigenerazione dei tessuti. Per prevenire complicazioni infettive, vengono prescritti antibiotici. Applicare mezzi volti a prolungare la gravidanza: antispastici, tocolitici, solfato di magnesio.
PREVENZIONE E PREVISIONE DELLE COMPLICANZE DELLA GESTAZIONE
· Effettuare una prevenzione precoce dell'insufficienza placentare dalle 16 alle 18 settimane, prescrivendo agenti antipiastrinici e antiossidanti.
· Durante tutta la gravidanza si monitora lo stato del sistema fetoplacentare, la crescita del feto e il suo rispetto dell'età gestazionale.
· Monitorare la condizione, la dimensione, la localizzazione dei nodi miomatosi.
· Eliminare tempestivamente le complicanze identificate della gravidanza, utilizzando, tra le altre cose, antispastici e tocolitici.
In qualsiasi trimestre di gravidanza possono svilupparsi complicazioni, per il trattamento delle quali vengono prescritti agenti antipiastrinici, antispastici, tocolitici e antibatterici. In assenza dell'effetto del trattamento conservativo, è indicato un intervento chirurgico: miomectomia conservativa, rimozione dell'utero.
INDICAZIONI AL RICOVERO
Violazione della circolazione sanguigna nel nodo miomato.
Decorso complicato della gravidanza:
--PN;
- ipossia fetale;
--ZRP, ecc.
VALUTAZIONE DELL'EFFICACIA DEL TRATTAMENTO
L'efficacia del trattamento è valutata dai risultati di un esame clinico generale, dai dati ecografici e dall'ecografia Doppler.
SCELTA DELLA DATA E DELLA MODALITÀ DI PARTO NEL MIOMA UTERINO
Nelle donne incinte classificate a basso rischio è possibile il parto attraverso il canale del parto naturale.
Durante il parto, è necessario effettuare un'adeguata riduzione del dolore in combinazione con l'uso di antispastici per la prevenzione e il trattamento delle anomalie del travaglio, dell'ipossia fetale e delle lesioni alla nascita. I farmaci uterotonici possono essere pericolosi per la madre e il feto a causa dell'aggravamento dei cambiamenti degenerativi e necrobiotici nei nodi, quindi possono essere utilizzati solo sotto rigorose indicazioni, contemporaneamente ad antispastici o b-agonisti.
Il parto nelle donne in gravidanza con fibromi uterini è spesso complicato da:
Effusione prematura di OV;
Anomalie dell'attività lavorativa;
il verificarsi di RDS fetale;
Violazioni dovute allo stretto attaccamento della placenta;
PONRP;
sanguinamento ipotonico;
Sanguinamento nella placenta e nel primo periodo postpartum.
Nel decorso complicato della gravidanza, il parto viene spesso effettuato mediante TC seguito da miomectomia (se possibile) o rimozione dell'utero senza appendici.
Il periodo postpartum può essere complicato dalla subinvoluzione dell'utero.
Indicazioni per il taglio cesareo per mioma uterino:
posizione dei nodi del mioma nella cavità pelvica (fibromi cervicali);
la presenza di grandi nodi multipli di mioma intramuscolare;
la combinazione di fibromi uterini con altre malattie e complicazioni della gravidanza, che servono come indicazioni per questa operazione;
condizioni minacciate del feto;
la presenza di una cicatrice sull'utero dopo miomectomia conservativa con apertura della cavità uterina e un decorso complicato del periodo postoperatorio;
nodi miomatosi che impediscono il normale inserimento e avanzamento del feto (crescita centripeta, localizzazione sottomucosa del tumore);
malnutrizione e necrosi del nodo miomato;
Sospetto di malignità del nodo miomato.
Indicazioni per la miomectomia durante il CS:
nodi sottosierosi su una base sottile in qualsiasi localizzazione disponibile;
nodi sottosierosi su una base ampia (escluso il segmento inferiore);
nodi grandi (più di 10 cm) non più di 5;
localizzato intramuralmente o con crescita centripeta di un nodo miomato maggiore di 10 cm (non più di un nodo);
buon accesso ai nodi di varia localizzazione, esclusi quelli intramurali con dimensioni inferiori a 5 cm.
Indicazioni per l'isterectomia:
mioma multiplo con una disposizione bassa di nodi (cervicale, istmo);
malignità del nodo, confermata istologicamente durante l'operazione;
la necessità di rimozione simultanea delle appendici uterine (tumori ovarici, formazioni tubo-ovariche).
INFORMAZIONI PER IL PAZIENTE CON MIOMA
Controindicazioni al mantenimento della gravidanza con mioma uterino:
- sospetto di degenerazione maligna del tumore;
- rapida crescita dei nodi miomatosi;
-localizzazione dell'istmo cervicale del nodo miomato;
- violazione del nodo miomato, necrosi, torsione del nodo sulla gamba;
- tromboflebite delle vene del bacino;
- gravidanza tardiva (età superiore a 40 anni), stato di salute insoddisfacente.
Una donna incinta dovrebbe essere avvertita della possibilità di aborto spontaneo, malnutrizione nel nodo, della necessità di fibromi di grandi dimensioni per eseguire un taglio cesareo, seguito dalla rimozione del nodo o dell'utero.
Il leiomioma uterino è una malattia ormono-dipendente. I livelli di estrogeni e progesterone svolgono un ruolo importante nello sviluppo e nella crescita delle neoplasie. Alti livelli di estrogeni stimolano la crescita ormonale dei fibromi.
Leiomioma
Cos'è un leiomioma? Questa è una neoplasia benigna, la cui comparsa e crescita intensiva sono associate al complesso miometrio di un tumore dell'ormone steroideo e ai suoi recettori. La localizzazione dei linfonodi rispetto allo spessore del miometrio distingue diverse forme della malattia. È anche chiamato fibromioma.
Ogni forma è caratterizzata dalla sua localizzazione nell'organo:
- intramurale;
- sottomucoso;
- subsieroso;
- multiplo;
- non specificato.
Leiomioma intramuraleè una forma comune del tumore. Questa forma è caratterizzata da fallimenti dei cicli mensili, dolore, pressione sugli organi vicini nella piccola pelvi a causa della crescita intensiva. La localizzazione della neoplasia si nota nella profondità della materia muscolare (una forma comune).
Leiomioma sottomucoso- il nodo tumorale cresce sotto la mucosa del corpo dell'organo, si nota la crescita della neoplasia nella parte addominale. Spesso sporge nel lume della cavità uterina, causando difficoltà con la fecondazione.
Leiomioma sottosieroso-situato sotto la membrana sierosa all'esterno dell'organo. Direzione di crescita verso il peritoneo. Non presenta praticamente sintomi, non interrompe il ciclo mensile e può causare un lieve disagio. A causa dell'assenza di manifestazioni, i pazienti spesso non sono consapevoli della loro malattia, il che ritarda la visita dal ginecologo.
Leiomioma multiplo- rappresenta un numero diverso di nodi aventi dimensione e forma diverse. Piccoli tumori fino a 8 settimane, tumori medi fino a 10-12 settimane, fibromi grandi oltre 12 settimane.
Leiomioma uterino, non specificato- una malattia che non ha evidenza a causa di forme visibili nascoste, dimensioni troppo piccole e sviluppo lento. In questo caso, gli esperti possono solo speculare su una possibile neoplasia. Per un mioma non specificato, è necessario un monitoraggio più frequente per individuare più rapidamente la malattia con la nomina di una terapia efficace. La foto sotto mostra esempi di tipi di fibromi.
Cause
Il clima e l'adolescenza, a causa di disturbi nella sfera ormonale, diventano la ragione principale delle neoplasie. Una quantità insufficiente di progesterone (disturbo delle ovaie) può provocare la malattia. Anche le donne che hanno abortito corrono il rischio di sviluppare fibromi.
Il motivo della nascita di un tumore può essere un intervento chirurgico sugli organi femminili e altri fattori di rischio, tra cui:
- vita sessuale promiscua (malattie veneree, infezioni);
- spirale contraccettiva (lesione al tessuto della cervice durante l'installazione e la rimozione);
- parto patologico;
- eccesso di peso, insufficienza del sistema endocrino, malnutrizione;
- mancanza di soddisfazione durante i rapporti sessuali;
- violazione dello stato psico-emotivo;
- uso frequente di forti bevande alcoliche, fumo;
- uso indiscriminato di contraccettivi ormonali.
Sintomi caratteristici
Per il rilevamento tempestivo della malattia, sono necessari esami programmati regolari da parte di un ginecologo. Il fatto è che lo stadio iniziale del tumore, così come le sue piccole dimensioni, non dà praticamente alcun segnale a una donna. Solo all'esame di uno specialista è possibile rilevare un tumore, i sintomi latenti si riferiscono al leiomioma uterino sottomucoso. Anche la forma subsierosa della malattia non presenta sintomi gravi.
Tuttavia, è possibile notare i frequenti sintomi di manifestazione del leiomioma uterino:
- un aumento del volume dell'addome senza un cambiamento visibile in tutto il corpo;
- patologia dei cicli mestruali (avvistamento di perdite al di fuori delle mestruazioni, irregolarità del programma);
- dolori tiranti nell'addome inferiore, sensazione di pressione;
minzione frequente, stitichezza (quando si schiacciano gli organi vicini: vescica, intestino); - difficoltà a concepire (infertilità);
- sanguinamento abbondante con un decorso prolungato (viene rilevato leiomioma sottomucoso).
Trattamento
 La realizzazione di azioni terapeutiche è obbligatoria per tutti i fattori di rischio:
La realizzazione di azioni terapeutiche è obbligatoria per tutti i fattori di rischio:
- neoplasia asintomatica, in rari casi richiede trattamento (si consiglia l'osservazione);
- terapia con agenti contenenti ferro (con grave sanguinamento con anemia identificata);
- una soluzione chirurgica per rimuovere il tumore preservando l'organo, che dà una possibilità
- futura maternità (miomectomia, isterectomia);
- embolizzazione delle arterie uterine (efficace, non in tutti i casi);
- intervento chirurgico per rimuovere la gamba storta del fibroma;
- sviluppo pronunciato con recidive della malattia (raccomandato: isterectomia, rimozione
- utero, talvolta insieme ad altri organi riproduttivi);
- necrosi (rottura della neoplasia).
La fase iniziale della terapia ha lo scopo di fermare e congelare l'ulteriore crescita del tumore. Questa tattica viene utilizzata fino all'inizio della menopausa. Il periodo climatico di una donna contribuisce allo sviluppo inverso dell'endometrio. C'è una diminuzione del volume del tumore e una perdita della funzione contrattile. C'è una diminuzione dell'afflusso di sangue al corpo dell'utero a livello fisiologico. Di conseguenza, il tumore smette di svilupparsi nell'ordine inverso, finché le sue dimensioni non diminuiscono e talvolta si risolvono completamente.
Una soluzione chirurgica per il trattamento del leiomioma uterino è indicata in determinate fasi dello sviluppo:
- forma di formazione di leiomioma cistico con possibilità di torsione della gamba;
- accompagnato da anemia per più di sei mesi (si verifica sullo sfondo della metrorragia);
- pianificare una futura gravidanza;
- sanguinamento che non corrisponde al ciclo mensile;
- accelerazione del tasso di sviluppo delle neoplasie (fino a 4 settimane all'anno);
- nodo di grandi dimensioni;
- dolore nell'addome inferiore, patologia del flusso sanguigno degli organi vicini;
- la crescita attiva del tumore interrompe il funzionamento dei reni e dell'intestino;
- minzione frequente (più di 15 volte al giorno).
Spesso viene presa una decisione chirurgica urgente quando vi sono diversi segni di transizione da un tumore benigno a una neoplasia maligna. Il processo chirurgico può includere varie cure mediche. La soluzione migliore è la rimozione selettiva della massa muscolare, modificando la forma del nodo uterino. Molto spesso, una prognosi positiva si ottiene con forme di neoplasie sottomucose e sebsierose. La forma intramurale è caratterizzata da frequenti recidive della malattia nei primi anni dopo l'intervento.
Un'alternativa ampiamente nota è l'embolizzazione sotto vuoto del flusso sanguigno dei vasi attraverso i quali viene alimentato il nodo. Questo metodo è molto efficace nel trattamento di tutti i tipi di fibromi, di varie forme e dimensioni. C'è una controindicazione all'intervento chirurgico: questa è una forma cistica di fibromi.
Quando i fibromi uterini vengono riscontrati in combinazione con l'adenomiosi, è necessario un trattamento tempestivo ed efficace. Questo può salvarti dalla perdita di organi, soprattutto per le donne in età fertile. Se lo stadio ha una forma avanzata, è inevitabile la rimozione completa della macropreparazione con l'utero.
La terapia raccomandata per i pazienti con fibromi dipende dall'età del paziente, dallo stadio, dall'altezza, dall'attività della neoplasia e da fattori ormonali. A questo proposito, per ciascun paziente viene utilizzato un approccio individuale, basato sui principi della tattica moderna.
Dopo 45 anni, è auspicabile rimuovere l'organo che influenza la comparsa di neoplasie. Durante la menopausa l'utero viene asportato insieme agli annessi, poiché il corpo femminile a questa età non necessita più del lavoro preciso delle ovaie, ed il rischio di parti oncologici è elevato. Nessun corpo, nessun problema.
Per ciascun paziente, il chirurgo seleziona il tipo di metodica chirurgica (laparoscopica, transvaginale, endoscopica, laparotomica).
La chirurgia funzionale ha rafforzato le sue posizioni, che consentono interventi conservativi sull'utero. Ciò consente in molti casi di evitare l’asportazione dell’organo e nei primi due anni di menopausa i fibromi possono scomparire.
La terapia conservativa ha lo scopo di correggere i fallimenti esistenti, vale a dire:
- normalizzazione dello stato del ciclo mestruale;
- mantenere la gravidanza;
- trattamento dell'infertilità (possibile fecondazione in vitro).
Nel trattamento di ciascun paziente, il chirurgo deve rispettare i principi della situazione.
In età riproduttiva, una donna deve mantenere la funzione fertile, monitorare la sfera ormonale, se ci sono fallimenti mestruali, infertilità, questo deve essere trattato. Durante la gravidanza, aderire alla tecnica di conservazione.
Se è prevista la miomectomia, tenere conto della morfologia del tumore (proliferante, semplice). Il mioma proliferante ha un'ulteriore crescita da formazioni microscopiche non rimosse. La recidiva è possibile con successiva correzione dopo l'intervento chirurgico.
Durante la menopausa si dovrebbe osservare la possibilità di oncologia (sarcoma, cancro ovarico).
Se dopo l'intervento chirurgico si forma un fibroma in crescita o non regredito due anni dopo, questo fatto deve essere considerato come un rischio di sviluppo di tumori maligni.
Non dovremmo dimenticare l'efficacia del trattamento ormonale, è distintivo. Dipende dal tipo di disturbo ormonale, dalla densità dei nodi, dal miometrio.
Ai pazienti con dipendenza ereditaria si consiglia un travaglio tempestivo, prima è, meglio è (la prima nascita avviene fino a 23 anni, la seconda fino a 26 anni, la possibilità di una terza nascita viene effettuata fino a 34 anni). Si consiglia di correggere i disturbi sistemici con una terapia di rafforzamento generale.
Se il paziente è predisposto a stati mentali negativi, stress, depressione, allora ha bisogno di un effetto neurotropico.
Trattamento obbligatorio dei disturbi metabolici, polemici e da carenza di ferro.
Prevenzione
Tra le misure preventive, un punto importante è l'esame annuale degli organi genitali femminili da parte di un ginecologo, soprattutto questo aiuta a prevenire i fibromi asintomatici.
Se ci sono piccoli fallimenti nel ciclo mensile, è necessario prestare attenzione al medico. Un ulteriore esame mostrerà qual è il motivo. Il trattamento tempestivo aiuta ad evitare conseguenze gravi. Non puoi aspettare e ritardare il tempo, riferendoti alla sua mancanza.
Un’importante misura preventiva è il rifiuto dell’aborto. L'uso dei contraccettivi deve essere determinato da uno specialista. Non puoi ingoiare incautamente pillole ormonali.
Va ricordato che molto spesso i fibromi superano all'età di 30-36 anni, la crescita dei fibromi fino alla macropreparazione richiede circa 5 anni. Pertanto, a questa età, è più che mai necessario proteggere il proprio corpo dagli effetti dello stress e dei disturbi mentali. Alla stessa età, è necessario evitare di prendere il sole alla luce diretta del sole, rifiutare i solarium e ridurre le visite a saune e bagni. Non puoi congelarti, le gambe sono un barometro delle donne.
La nutrizione dovrebbe essere piena di vitamine, minerali, macronutrienti. La fibra aiuta a mantenere l’aumento di peso. Pertanto, è necessario consumare frutta e verdura nella loro forma grezza.
Video sul leiomioma
Un tumore muscolare benigno che cresce su qualsiasi parete dell’utero influisce sulla capacità riproduttiva. I fibromi uterini durante la gravidanza provocano complicazioni associate al successo della gestazione del feto, pertanto, in presenza di leiomioma, la preparazione pregravida è un prerequisito per il successo della gestazione e la nascita di un bambino.
La pianificazione della concezione desiderata viene effettuata dopo un esame completo e sotto la supervisione obbligatoria di un medico.
Le recensioni degli esperti sono deludenti: i fibromi di grandi dimensioni rappresentano un ostacolo significativo per una gravidanza di successo. Inoltre, un leiomioma di circa 12 settimane è pericoloso per il sanguinamento uterino e richiede un intervento chirurgico. A volte un singolo piccolo nodulo cresce rapidamente, creando problemi alla funzione fertile.
Come mostrano le revisioni dei medici, la gestione di una donna incinta con un piccolo nodo miomato situato sulla parete posteriore dell'utero non presenta alcuna difficoltà. È molto peggio quando è presente un nodo nell'istmo o un mioma multinodulare con nodi situati sulle pareti posteriore e anteriore: in queste situazioni è estremamente difficile concepire e dare alla luce un bambino. Il trattamento dei fibromi uterini durante la gravidanza consiste nel garantire un flusso sanguigno placentare ottimale e salvare la vita del bambino.
Quali sono le possibili complicazioni
I fibromi uterini durante la gravidanza possono portare alle seguenti complicazioni:
- gravidanza congelata fino a 12 settimane;
- minaccia di aborto, in cui ci saranno dolore e spotting;
- aborto abituale (interruzione spontanea di una gravidanza desiderata fino a 12 settimane 2 o più volte);
- grave tossicosi precoce;
- preeclampsia durante la 2a metà della gravidanza (edema, ipertensione arteriosa, funzionalità renale compromessa);
- disturbi della placenta, che sono la base del ritardo della crescita e del ritardo nello sviluppo del feto;
- posizione errata del feto all'interno dell'utero (il nodo miomato cambia la forma del feto, che influenza la posizione del bambino);
- violazioni durante il parto (scarica prematura del liquido amniotico, debolezza delle forze del parto);
- alta probabilità di consegna operativa;
- emorragia postpartum dovuta alla ridotta contrattilità del muscolo uterino.
Il leiomioma è pericoloso in qualsiasi fase della gestazione. Le complicazioni si verificano spesso durante una combinazione di circostanze avverse, quando la placenta si forma sulla parete posteriore o anteriore miomatosa e alterata dell'utero, o un grande nodo contribuisce alla formazione della placenta previa.
Tali situazioni sono individuali, pertanto, in ogni caso, il medico cercherà di fare il massimo per preservare la gravidanza.
Quali sono i fattori sfavorevoli per avere un feto?
Come mostrano le recensioni dei medici, è estremamente difficile rimanere incinta, sopportare e partorire nelle seguenti condizioni:
- nodo sottomucoso, che deforma la cavità uterina;
- fibromi multipli di piccole dimensioni con mestruazioni abbondanti e anemia;
- nodo interstiziale solitario che cresce rapidamente;
- leiomioma complicato da processi iperplastici endometriali o endometriosi;
- fibromi di grandi dimensioni;
- età superiore ai 35 anni, quando, oltre al leiomioma, sono presenti malattie croniche concomitanti.
In alcuni casi, la pianificazione di una futura gravidanza inizia con un intervento chirurgico. Il medico con l'aiuto dell'intervento endoscopico rimuoverà il nodo sottomucoso o sottosieroso. Spesso è necessaria una terapia ormonale preliminare per ridurre le grandi dimensioni dei linfonodi. Il concepimento e il portamento sono strettamente controindicati nei seguenti casi:
- una combinazione di leiomioma e displasia cervicale;
- cambiamenti precancerosi nell'endometrio (iperplasia adenomatosa) sullo sfondo dei fibromi;
- rilevamento di tumori ovarici cistici ad alto rischio di malignità;
- oncopatologia di qualsiasi localizzazione.
Durante la gravidanza, a causa della ridotta protezione immunitaria, qualsiasi tumore canceroso progredisce molto rapidamente, il che rappresenta un vero pericolo per la vita di una donna.
Quali sono le condizioni per una gestazione di successo?
I fibromi uterini durante la gravidanza non creeranno problemi nelle seguenti condizioni:
- piccolo leiomioma;
- l'assenza di disturbi ormonali e la giovane età della donna;
- un nodo interstiziale di piccole dimensioni, la cui dimensione non cambia durante la gestazione;
- assenza di patologia ginecologica (endometriosi, processi iperplastici endometriali).
Il medico sa quando è possibile rimanere incinta e quando il rischio di complicanze è minimo. La pianificazione della concezione desiderata dovrebbe essere effettuata tenendo conto delle raccomandazioni mediche con l'uso obbligatorio di medicinali.
Come prepararsi al concepimento e alla gestazione
La preparazione pregravid comprende una serie di misure diagnostiche e terapeutiche che garantiscono un concepimento e una gestazione favorevoli. Saranno richiesti i seguenti studi:
- rilevamento e trattamento delle infezioni croniche;
- scansione ad ultrasuoni;
- valutazione del background ormonale;
- trattamento combinato per leiomioma.
Le indicazioni per l'intervento chirurgico prima del concepimento desiderato saranno i seguenti tipi di tumore miomato:
- nodo sottosieroso sulla gamba;
- nodo sottomucoso;
- interstiziale con crescita centripeta;
- combinazione di leiomioma con patologia ginecologica (polipo uterino, cisti ovarica).
In alcuni casi, è possibile confondere il mioma e il nodo endometrioide formato nella parete dell'utero. Pertanto, dopo l'operazione, è obbligatorio un esame istologico.
Avendo creato condizioni favorevoli, il medico prescriverà Utrozhestan per preparare l'endometrio al concepimento. Una donna dovrà seguire le raccomandazioni del medico e fare un test in modo tempestivo con un ritardo delle mestruazioni per iniziare la terapia conservativa dal momento della gravidanza.
Quali trattamenti sono efficaci
I fibromi uterini durante la gravidanza richiedono misure terapeutiche obbligatorie per prevenire complicazioni pericolose. Dalle prime date e fino a 12 settimane, dovrebbero essere utilizzati i seguenti farmaci:
- Acido folico per la prevenzione delle malformazioni del feto;
- Utrozhestan per mantenere la gravidanza.
Il dosaggio e la durata della terapia sono determinati dal medico. Oltre a questo insieme obbligatorio di farmaci, uno specialista può consigliare farmaci per migliorare il flusso sanguigno nei vasi uterini e multivitaminici. Qualsiasi dolore addominale o spotting nel 1o trimestre è motivo di ricovero in ospedale.
Utrozhestan può essere utilizzato sotto forma di supposte vaginali o capsule orali. L'analogo del farmaco è Duphaston.
Il medico selezionerà il farmaco individualmente per ciascuna donna incinta.
La presenza del leiomioma influenza in qualsiasi momento la gestione della gravidanza, pertanto il trattamento proseguirà fino alla 36a settimana. L'Utrozhestan nelle candele nel 2o-3o trimestre è necessario per prevenire la nascita pretermine. Lo screening ecografico è necessario per rilevare disturbi placentari e condurre una terapia per la crescita fetale e il ritardo dello sviluppo. Le indicazioni per il taglio cesareo sono le seguenti condizioni:
- istmo e nodo intraligamentare;
- torsione del nodo sulla parete posteriore o anteriore dell'utero;
- necrosi tumorale;
- la presenza di una cicatrice sull'utero.
Come mostrano le recensioni, pianificare e gestire una gravidanza con leiomioma richiede un esame completo e una costante supervisione medica. Secondo le indicazioni, sarà necessaria un'operazione e, dopo la terapia riabilitativa, potrai rimanere incinta. In tutte le fasi della gestazione, dovrebbe essere usato Utrozhestan. Un approccio combinato e integrato al trattamento costituirà la base per la tanto attesa nascita di un bambino sano.

MGMSU, NCAGIP RAMS
Il leiomioma uterino è la neoplasia più comune della piccola pelvi nelle donne e si verifica in circa il 30% dei pazienti di età superiore ai 35 anni, tuttavia, l'analisi del materiale sezionale suggerisce che l'incidenza di questa malattia è molto più elevata.
Sanguinamento uterino, dolore addominale, ritenzione urinaria, stitichezza, infertilità, aborti spontanei e parto prematuro: tutti questi sintomi del leiomioma uterino compromettono significativamente la qualità della vita di una donna. L'indicazione più comune (nel 30-40% dei casi) per l'isterectomia è il leiomioma uterino, un'operazione che elimina il dolore e il sanguinamento anemico, ma non risolve i problemi riproduttivi, al contrario, rende una donna irreversibilmente sterile.
Ad oggi, non ci sono idee chiare sull'eziologia e sulla patogenesi del leiomioma uterino, ma è stato accumulato materiale di ricerca sufficiente per riconsiderare le opinioni precedenti.
I. Fatti che possono ridurre significativamente la vigilanza oncologica nelle pazienti con leiomioma uterino.
1. Secondo numerosi autori, la frequenza di malignità del leiomioma uterino varia dallo 0,18 al 3,1% dei casi. Tale probabilità di sviluppare un processo maligno può essere considerata estremamente bassa, dato che il leiomiosarcoma uterino stesso è un tumore molto raro, che si verifica 30 volte meno spesso di qualsiasi altra neoplasia maligna.
2. Solo il 30-50% dei leiomiomi presenta aberrazioni cromosomiche. Come si può vedere dalle figure, questa caratteristica del leiomioma è contraddittoria, molto probabilmente a causa dei diversi protocolli di ricerca. È stato determinato in modo più accurato che le aberrazioni cromosomiche si trovano più spesso nei cromosomi 7,12 e 14, includono delezioni e traslocazioni. Esistono anche aberrazioni in altri cromosomi, compreso il cromosoma X, ma sono singole e, molto probabilmente, casuali. I tentativi di identificare la relazione delle suddette aberrazioni cromosomiche con i difetti nei geni da loro codificati nel leiomioma sono estremamente controversi e non del tutto compresi. È anche importante notare che esiste uno studio che suggerisce una natura secondaria delle aberrazioni citogenetiche nello sviluppo del leiomioma, basato sull'analisi dei nodi del mioma contenenti cellule con cariotipo sia normale che alterato.
3. Lo studio dei tumori borderline della muscolatura liscia dell'utero, come leiomioma cellulare, leiomioma "bizzarro", leiomioma mitoticamente attivo, leiomioma atipico e leiomioma con un potenziale di malignità non chiaro, ha rivelato che la loro presentazione clinica e la prognosi sono simili al leiomioma tipico . Tuttavia, è necessaria una diagnosi istologica approfondita, basata su tre caratteristiche principali: densità cellulare, atipia cellulare e presenza di figure mitotiche nei nuclei cellulari. Oltre alle caratteristiche di cui sopra, un indicatore importante nella diagnosi differenziale può essere il numero di mastociti in un ampio campo visivo rappresentativo. Pertanto, 16 mastociti in un ampio campo visivo consentono la differenziazione del leiomiosarcoma dal leiomioma cellulare e dal leiomioma "fantasioso", e questa caratteristica ha una sensibilità del 100% e una specificità del 96%.
4. Un certo numero di tumori maligni sovrasintetizzano l'IGF-II (fattore di crescita simile all'insulina), un fattore di crescita con un meccanismo d'azione autocrino-paracrino che supporta e migliora la crescita del tumore. Normalmente la trascrizione del gene che codifica per IGF-II viene effettuata solo dall'allele paterno, in modo monoallelico, cioè si ha il cosiddetto imprinting del gene IGF-I. Nel leiomiosarcoma, a differenza del leiomioma, l'IGF-II è espresso in quantità molto maggiore, il che, come mostrato, è dovuto alla perdita dell'imprinting del gene IGF-II, cioè della sua espressione biallelica, che non si osserva nel leiomioma.
5. Lo studio dell'espressione di vari proto-oncogeni nel tessuto del miometrio normale e nel leiomioma ha rivelato che il livello del proto-oncogene c-fos nel leiomioma è significativamente inferiore rispetto al miometrio circostante. Esistono prove che il c-fos svolge un ruolo importante nella malignità dei tumori benigni. Pertanto, il basso livello di c-fos riscontrato nel leiomioma probabilmente lo protegge dalla trasformazione maligna. Nel leiomioma è stato rilevato anche un basso livello del proto-oncogene c-myc, un aumento della sua espressione è associato a malignità. Inoltre, è stato dimostrato che l'espressione del proto-oncogene nel leiomioma e nel miometrio normale è indipendente dagli ormoni sessuali.
6. Il modello di espressione delle integrine e delle caderine (molecole di adesione cellulare) nel leiomioma corrisponde a quello del normale tessuto muscolare liscio, mentre nel leiomiosarcoma si rileva un danno all'espressione di varie molecole di adesione cellulare. Pertanto, a differenza dei processi in cui la proliferazione e la differenziazione sono strettamente associate ai cambiamenti nell'espressione delle molecole di adesione cellulare (tumori maligni), la crescita e lo sviluppo del leiomioma uterino non sono accompagnati da tali cambiamenti ed è simile in questa caratteristica al miometrio normale. D'altra parte, si può presumere che il mantenimento di un fenotipo benigno da parte del leiomioma sia una conseguenza del normale modello di espressione delle molecole di adesione cellulare sulle cellule muscolari lisce del leiomioma.
Studi immunoistochimici, immunocitochimici, immunochimici e morfologici condotti per confrontare leiomioma e leiomiosarcoma hanno mostrato una differenza significativa tra queste neoplasie.
Il mioma è privo del mutante p53
L'indice dell'etichetta per PCNA e Ki-67 nel leiomiosarcoma è significativamente più alto che nel mioma
Il livello di PCNA/Ki-67 è correlato al livello di apoptosi nel miometrio normale e nel mioma, ma non nel leiomiosarcoma
il rapporto SM1/SM2 delle isoforme della miosina corrisponde a diversi stadi di sviluppo del mioma e si correla con la dinamica di proliferazione/apoptosi, mentre nei leiomiosarcomi uterini, gastrici e intestinali esiste uno specifico rapporto SM1/SM2 e/o non muscolare miosina, che non è parallela alla proliferazione e all'apoptosi in questi tumori.
Pertanto, il leiomioma uterino è una formazione con un potenziale di malignità estremamente basso. Questo è importante, poiché alle donne viene ancora offerto un trattamento chirurgico, giustificato da un'elevata probabilità di sviluppare un tumore maligno.
II. Fisiopatologia
È stato recentemente stabilito che il leiomioma uterino è monoclonale, cioè il suo sviluppo avviene da una singola cellula. Al momento ci sono due teorie sull'origine della cellula progenitrice. Il primo è ontogenetico, il secondo si basa sul fatto che una mutazione somatica secondaria avviene in una cellula miometriale normale sotto l'influenza di fattori non identificati. Vorrei soffermarmi sulla prima teoria in modo più dettagliato.
Lo sviluppo ontogenetico delle cellule muscolari lisce di origine endodermica (sistemi digestivo ed escretore) procede più velocemente delle cellule muscolari lisce di origine mesodermica (sistema riproduttivo); rispettivamente 12 e 30 settimane. Le cellule indifferenziate che si differenziano ulteriormente in cellule muscolari lisce uterine hanno un periodo instabile più lungo durante il quale sono esposte a vari fattori materni come ormoni sessuali e/o fattori di crescita, virus, tossine e altri. È probabile che alcune di queste cellule diventino difettose, diventando così cellule progenitrici dei leiomiomi. Prima dell'inizio del menarca, queste cellule non si manifestano in alcun modo. Dopo il menarca, queste cellule possono iniziare a crescere, ma molto probabilmente ciò richiede un fattore scatenante.
Indipendentemente da come e quando si è formata la cellula progenitrice, le mutazioni in questa cellula portano al fatto che diventa ipersensibile a vari fattori che ne stimolano la proliferazione, mentre le normali cellule del miometrio non mostrano attività proliferativa. È importante notare che si tratta di un processo locale e, come verrà descritto di seguito, la maggior parte dei suoi partecipanti sono sintetizzati nell'utero stesso. Un effetto sistemico, ad esempio uno stato iperestrogenico, non può provocare un processo locale nell'organo bersaglio senza influenzare l'intero organo.
La patogenesi del leiomioma uterino, come la maggior parte delle malattie, coinvolge molti fattori che, interagendo tra loro, realizzano un meccanismo complesso per lo sviluppo del processo patologico. Nella patogenesi del leiomioma uterino si possono distinguere i seguenti fattori: ormoni sessuali, fattori di crescita e un gruppo di fattori la cui relazione con lo sviluppo del leiomioma è stata identificata, ma rispetto ad altri fattori non è stata sufficientemente studiata.
ormoni sessuali
Un aumento dell'incidenza del leiomioma dopo il menarca, un aumento delle dimensioni del leiomioma durante la gravidanza e la sua regressione dopo la menopausa indicano la dipendenza della crescita del leiomioma dagli ormoni sessuali.
Tradizionalmente, gli estrogeni sono stati considerati i principali promotori della crescita dei leiomiomi. Questo fatto dimostra l'esistenza di un gran numero di studi che hanno rivelato un aumento degli estrogeni e dei loro recettori nel leiomioma rispetto al miometrio normale, una diminuzione significativa delle dimensioni del nodo del mioma con ipoestrogenemia creata artificialmente (terapia con agonisti del GRH), come pure così come una significativa diminuzione della conversione dell'estradiolo in estrone nel leiomioma. Sebbene queste osservazioni indichino un ambiente iperestrogenico all’interno del nodulo del mioma, non dimostrano allo stesso tempo la stimolazione diretta della crescita del leiomioma da parte degli estrogeni.
È anche interessante notare che nel miometrio e nell'endometrio che circondano il nodo leiomiomatoso vi è una produzione locale di estrogeni dovuta alla conversione dell'estrone solfato da parte dell'estrone solfatasi in estrone. A sua volta, nel nodo miomato, aumenta l'attività dell'estrone sulfotransferasi, che converte l'estrone nella forma meno attiva: estrone solfato. Inoltre, nel nodo miomato, l'androstenedione è in grado di trasformarsi in estrone. Nel 91% dei casi nel leiomioma e nel 75% dei casi nel miometrio adiacente è stata rilevata l'attività del citocromo P450, responsabile della conversione degli steroidi C19, mentre nel miometrio dell'utero senza nodi miomatosi l'attività di questo enzima non è stato rilevato.
È stato ora scoperto che gli estrogeni stimolano l'espressione dei recettori del progesterone e dell'EGF, la sintesi di IGF-I e IGF-II, aumentano il contenuto di mRNA di collagene di tipo I e III nella cellula e stimolano la produzione locale di ormone paratiroideo simile peptide. L'espressione di questi geni regolati dagli estrogeni è significativamente maggiore nel leiomioma rispetto al miometrio adiacente. Sulla base di queste osservazioni, è stato suggerito che la sensibilità agli estrogeni sia un fattore importante nella patogenesi del leiomioma uterino.
Tuttavia, analogamente agli estrogeni, i livelli di progesterone hanno un ciclo durante gli anni riproduttivi, aumentano significativamente durante la gravidanza e diminuiscono anche durante la menopausa e la terapia con agonisti dell'HGH. Pertanto, è stato piuttosto difficile individuare il ruolo principale di qualcuno nella patogenesi del leiomioma, tenendo conto solo di queste osservazioni.
Nel 1949 Segaloff et al. hanno pubblicato dati sull'aumento della cellularità e dell'attività mitotica dei fibromi in 6 pazienti trattati con progesterone. Successivamente, sono emerse ulteriori prove che suggeriscono un ruolo centrale del progesterone nella crescita del leiomioma uterino. Pertanto, Tiltmam ha dimostrato un aumento significativo del numero di mitosi in un campo visivo nelle preparazioni istologiche del nodo miomato nei pazienti trattati con medrossiprogesterone acetato rispetto al gruppo di controllo. Kawaguchi et al. studiando il ruolo dell'influenza delle fasi del ciclo mestruale sul livello dei mitosi nel leiomioma, ha rivelato che nella fase secretoria il numero di mitosi era significativamente più alto rispetto alla fase proliferativa o durante le mestruazioni, rispettivamente 12,7/3,8/8,3 per 100 campi visivi.
Lo stesso gruppo di autori, studiando le proprietà ultrastrutturali delle cellule di leiomioma in coltura e del miometrio normale, ha scoperto che il mioma e le cellule miometriali in un mezzo contenente estrogeni e progesterone erano più attivi al microscopio elettronico che in un mezzo di controllo e in un mezzo contenente solo estrogeni. . Nelle cellule di leiomioma, sotto l'influenza di estrogeni e progesterone, il numero di miofilamenti e corpi densi aumenta.
Branon et al. ha rivelato un aumento dei recettori del progesterone nel leiomioma rispetto al miometrio normale. Nel miometrio, i recettori del progesterone di tipo A e B sono espressi in quantità uguali. Il progesterone si lega prevalentemente al recettore di tipo B, il tipo A, a sua volta, inibisce l'espressione del recettore di tipo B. Nel 40%, sulla superficie dei linfonodi miomatosi, il recettore di tipo B è sovraespresso.
Si nota inoltre che il progesterone inibisce l'espressione dei recettori degli estrogeni, mentre gli estrogeni aumentano l'espressione dei recettori del progesterone sia nel miometrio che nel leiomioma. Pertanto, il progesterone è in grado di avere un duplice effetto sul leiomioma: in primo luogo, bloccando l'azione degli estrogeni, inibendo l'espressione dei loro recettori, e in secondo luogo, esercitando il suo effetto direttamente attraverso i suoi recettori.
È anche importante evidenziare le osservazioni cliniche che dimostrano il ruolo chiave del progesterone nella crescita del leiomioma uterino.
Nel 1961, Mixson e Hammond descrissero 16 pazienti con leiomioma uterino che assumevano il progestinico sintetico norethinodrel ad una dose sufficiente a mantenere l'amenorrea. In 15 di questi pazienti si è verificato un aumento significativo delle dimensioni dell'utero. 12 settimane dopo la sospensione del farmaco in tutti i pazienti, la dimensione dell'utero è diminuita, nel 70% dei pazienti l'utero è tornato alle sue dimensioni originali. Gli autori hanno concluso che il noretinodrel provoca un aumento rapido ma reversibile dei leiomiomi.
Studi più recenti di Friedman et al. ha dimostrato che la combinazione di agonisti dell'HRH con medrossiprogesterone acetato non porta ad una diminuzione delle dimensioni del nodo del mioma, come si osserva quando si assumono solo agonisti dell'HRH.
L'uso del farmaco antiprogesterone RU-486 in pazienti con leiomioma uterino ha causato una riduzione del 49% delle dimensioni del leiomioma 12 settimane dopo l'inizio del trattamento. Il livello sierico di estradiolo, estrone e progesterone nella fase follicolare iniziale non è cambiato. Studi immunoistochimici hanno rivelato una diminuzione significativa del numero di recettori del progesterone nel leiomioma, mentre il livello dei recettori degli estrogeni non è cambiato, suggerendo la possibilità di regressione del nodo del mioma attraverso l'azione diretta antiprogesterone.
In uno studio recente, utilizzando il marcatore di proliferazione cellulare PCNA, è stato dimostrato che l'estradiolo e il progesterone stimolano la proliferazione delle cellule di leiomioma, mentre le cellule miometriali normali proliferano solo in risposta all'aggiunta di estradiolo. Inoltre, è stato riscontrato che i valori massimi dell'indice dell'etichetta PCNA si osservano nella fase secretoria del ciclo mestruale, in cui domina il progesterone. Si è inoltre scoperto che il progesterone è in grado di aumentare significativamente l'espressione dell'EGF nel leiomioma, che è il suo principale mitogeno, mentre l'estradiolo non ha alcun effetto sull'espressione di questo fattore di crescita. Tuttavia, a differenza del progesterone, l’estradiolo aumenta significativamente l’espressione dei recettori dell’EGF e dei recettori del progesterone.
Pertanto, il progesterone e i progestinici promuovono la crescita dei leiomiomi. Le prove biochimiche, morfologiche e cliniche sopra delineate supportano fortemente questa ipotesi.
Gli estrogeni e il progesterone, insieme o separatamente, sopprimono anche la produzione del fattore di chemiotassi dei monociti - 1 (PCM-1), che è responsabile della chemiotassi e dell'attivazione dei monociti, prodotto da vari tumori e ha un effetto antitumorale, cioè E2 e P sono in grado di stimolare la crescita del nodo miomato attraverso la soppressione della produzione di PCM-1
Fattori di crescita
Come è stato dimostrato in molti studi, il funzionamento del miometrio come tessuto ormono-dipendente è mediato da fattori di crescita che regolano la proliferazione e l’apoptosi delle cellule muscolari lisce, mediano l’azione degli estrogeni e del progesterone e regolano lo stato funzionale delle cellule muscolari lisce. cellule muscolari (secrezione di componenti della matrice extracellulare, espressione di vari recettori, attività contrattile, contatti intercellulari, ecc.). Sulla base di questi dati è stata formulata la teoria dell'estromedina, che consiste nel fatto che gli estrogeni che agiscono sul tessuto del miometrio e del leiomioma provocano la produzione locale di fattori di crescita, che a loro volta manifestano tutti gli effetti degli estrogeni in questi tessuti.
Il principale meccanismo d’azione dei fattori di crescita è autocrino/paracrino; pertanto, questi fattori svolgono un ruolo chiave anche nel processo patologico locale.
I seguenti fattori di crescita svolgono un ruolo chiave nella patogenesi del leiomioma uterino: EGF (fattore di crescita epidermico), IGF-I (fattore di crescita simile all'insulina e le sue proteine leganti che svolgono un ruolo regolatore), TGF beta (fattore di crescita trasformante). Altri due fattori di crescita: bFGF (fattore di crescita basico dei fibroblasti) e PDGF (fattore di crescita piastrinico) sono coinvolti nella patogenesi del leiomioma uterino, ma, a quanto pare, il loro ruolo è secondario o non del tutto compreso. EGF e IGF-I sono strettamente correlati agli ormoni sessuali e sono mediatori della loro azione nell'utero e in altri organi.
I fattori di crescita insulino-simili sono proteine a basso peso molecolare strutturalmente simili alla proinsulina, che stimolano la proliferazione e la differenziazione delle cellule in vari tessuti. L'attività di questi fattori di crescita è modulata da 6 proteine leganti (IGFBP1-6), che hanno un'affinità maggiore rispetto ai recettori dell'IGF. Le proteine leganti circolanti nel sangue proteggono l'IGF dalla distruzione e dalla fuoriuscita dal sistema circolatorio. Nello spazio extravascolare, le proteine leganti trasportano l'IGF alle cellule bersaglio e sono anche in grado di stimolare o inibire il legame dell'IGF ai loro recettori specifici. Ciò è dovuto alla presenza di speciali proteasi che possono scindere il complesso fattore di crescita + proteina legante in frammenti con effetti diversi.
Nel leiomioma uterino e nel miometrio normale sono stati riscontrati IGF I e II, nonché le proteine leganti IGFBP 2,3,4 e 5. L'IGF-I e, in misura minore, l'IGF-II mediano l'azione degli estrogeni sul miometrio e sul miometrio. leiomioma, causando la proliferazione di questi tessuti. Inoltre, questi fattori di crescita sono in grado di stimolare la mitosi delle cellule di leiomioma in assenza di ormoni sessuali.
Dati abbastanza contraddittori riguardanti la concentrazione di IGF-I e IGF-II nel tessuto del leiomioma e nel miometrio circostante. Alcuni autori affermano che la concentrazione di IGF-I e II è aumentata nel leiomioma rispetto al miometrio normale, altri rivelano il rapporto opposto, alcuni autori ottengono dati su un rapporto uguale tra le concentrazioni di queste proteine. Molto probabilmente, ciò è dovuto ai diversi metodi utilizzati da questi ricercatori, nonché alle differenze nella qualità e nel numero dei pazienti selezionati. Tuttavia, i risultati della maggior parte degli autori concordano su un’espressione significativamente maggiore dei recettori dell’IGF-I nel leiomioma e nel miometrio. Nonostante il fatto che la concentrazione di IGF-I nel leiomioma non possa essere modificata, il fatto di aumentare la sensibilità del leiomioma all’IGF-I gioca un ruolo importante, poiché l’IGF-I sintetizzato dal miometrio o dall’endometrio circostante (questo tessuto ha anche un contenuto significativo di questo fattore di crescita), è in grado di stimolare il tessuto del leiomioma eccessivamente sensibile, provocandone la crescita. Negli studi in vitro, la risposta mitotica delle cellule di leiomioma all’integrazione di IGF-I è sempre stata significativamente più alta di quella delle cellule miometriali normali.
Proteina legante 3 (IGFBP-3), che è il principale modificatore dell'attività dei fattori IGF. Formando un complesso IGF+IGFBP-3, previene o potenzia il legame dei fattori IGF ai suoi recettori, inibendo o stimolando così la loro azione sulla cellula bersaglio. Inoltre, IGFBP-3 è anche in grado di inibire in modo indipendente la proliferazione cellulare legandosi ai suoi recettori specifici sulla superficie cellulare.
Un'altra caratteristica dell'IGF-I è la sua capacità di alterare la secrezione di prolattina da parte dei leiomiomi. La prolattina è anche in grado di stimolare la proliferazione delle cellule di leiomioma. È stato precedentemente dimostrato che il miometrio normale e il leiomioma secernono prolattina, tuttavia, l'IGF-I è in grado di aumentare in modo dose-dipendente la produzione di prolattina da parte del leiomioma rispetto al miometrio circostante.
L'EGF, a differenza dei fattori IGF, non ha un sistema proteico legante, tuttavia è un mitogeno più forte per il leiomioma e il miometrio normale rispetto ai fattori IGF. Come notato sopra, la sua produzione nel leiomioma e nel miometrio è stimolata dal progesterone e l'espressione dei recettori aumenta sotto l'influenza degli estrogeni.
Un altro fattore di crescita coinvolto nella patogenesi del leiomioma uterino è il bFGF. Questo fattore di crescita svolge un ruolo centrale nella regolazione della proliferazione, della motilità e della differenziazione cellulare dei tessuti di origine mesodermica. Il bFGF è stato identificato nei tumori benigni e maligni del sistema nervoso centrale, nonché nell'adenocarcinoma endometriale, dove la sua produzione è regolata dagli estrogeni. In quanto fattore angiogenico, il bFGF svolge un ruolo importante nella crescita del tumore mantenendone l'apporto sanguigno.
bFGF è anche un mitogeno per il miometrio e il leiomioma. Nel leiomioma è stato rilevato un contenuto più elevato di questo fattore di crescita rispetto al miometrio circostante. Molto probabilmente, ciò è dovuto al contenuto in eccesso della matrice extracellulare (ECM) nel nodo miomato, mentre il bFGF è localizzato principalmente nell'ECM. bFGF regola la produzione di enzimi responsabili del rimodellamento dell'ECM, come l'attivatore della collagenasi e del plasminogeno, e influenza anche l'espressione delle integrine e di altre molecole di adesione cellulare. La ricerca recente su questo fattore di crescita si è concentrata sulle proprietà uniche di una forma del suo recettore. Si è scoperto che il tipo 1 di questo recettore può essere secreto, cioè esistere senza un dominio transmembrana. È stato dimostrato che questa forma del recettore è coinvolta nel sanguinamento uterino associato al leiomioma, a causa della ridotta angiogenesi nell'endometrio. Una diminuzione del contenuto di questo recettore nello stroma endometriale nelle donne sane si osserva nella fase luteale del ciclo, mentre nelle donne con leiomioma uterino non sono stati rilevati tali cambiamenti e il livello dei recettori bFGF rimane lo stesso. Probabilmente questo fenomeno è in un certo senso collegato al progesterone, che domina in questa fase del ciclo.
Il fattore di crescita trasformante beta (TGFbeta), come descritto sopra, è stato rilevato anche nel miometrio e nel leiomioma, tuttavia la sua particolarità sta nel fatto che nel miometrio, a differenza del leiomioma, questo fattore di crescita presenta un effetto a due fasi. Cioè, a basse concentrazioni, il TGFbeta stimola la proliferazione delle cellule miometriali e ad alte concentrazioni la inibisce. Un effetto simile era assente nel leiomioma. Il TGF beta svolge probabilmente un ruolo regolatore nella regolazione della crescita autocrina, essendo un collegamento inibitorio in contrasto con l'effetto di stimolazione della proliferazione di altri fattori di crescita. Da ciò possiamo concludere che è possibile che nel leiomioma questa regolazione negativa della crescita sia disturbata, che è un altro anello della sua patogenesi.
Per quanto riguarda il fattore di crescita derivato dalle piastrine (PDGF), si sa soltanto che è in grado di stimolare la proliferazione delle cellule del leiomioma e del miometrio. Sono necessarie ulteriori ricerche per determinare il suo posto nella patogenesi del leiomioma, mentre gli viene assegnato un ruolo secondario.
Altri fattori
Altri fattori includono l’ormone della crescita ipofisario.
Nel 1963, gli scienziati francesi scoprirono che nelle donne affette da acromegalia, la frequenza di rilevamento del leiomioma uterino è superiore rispetto al resto della popolazione e, come sapete, con questa malattia, il contenuto dell'ormone della crescita (GH) nel sangue aumenta . L'ormone della crescita regola la crescita e la differenziazione di vari organi bersaglio legandosi al suo recettore specifico. Il maggior numero di recettori del GH si trova nel fegato. È anche noto che il GH stimola la produzione di IGF-I da parte del fegato, che a sua volta media l'effetto del GH sugli organi bersaglio.
I recettori dell'ormone della crescita sono stati identificati nel miometrio e nel leiomioma e non è stata riscontrata alcuna differenza nell'espressione di questo recettore tra i due tessuti. La terapia con agonisti del GRH non modifica l'espressione dei recettori GH nel leiomioma e nel miometrio, da cui si può concludere che i recettori GH non sono regolati dagli estrogeni. È stato inoltre osservato che nelle donne affette da leiomioma il livello stimolato di GH nel sangue è più elevato rispetto ai controlli di età.
Apoptosi nel leiomioma
La crescita del tumore è il risultato di un equilibrio dinamico tra proliferazione cellulare e morte cellulare. Pertanto, la crescita può essere associata sia ad un’eccessiva proliferazione cellulare che a un basso indice di morte cellulare. Relativamente di recente sono stati ottenuti dati secondo cui la cellula è in grado di ricevere segnali sia per la divisione che per la morte, innescando una cascata di processi complessi che portano alla condensazione della cromatina, al cambiamento della permeabilità della membrana, all'increspamento e, di conseguenza, alla frammentazione cellulare con la formazione di cellule circondate da una membrana, i cosiddetti corpi apoptotici. Questo processo è chiamato apoptosi - morte cellulare programmata e, come è stato rivelato, il proto-oncogene Bcl-2, riscontrato per la prima volta nei linfomi a cellule B, svolge un ruolo importante nella regolazione di questo fenomeno. Un aumento dell'espressione di Bcl-2 in una cellula modifica il normale corso dell'apoptosi e quindi aumenta la durata della vita di questa cellula. Pertanto, Bcl-2 svolge un ruolo importante nella crescita del tumore, agendo come uno dei regolatori dell'equilibrio tra proliferazione e morte cellulare; pertanto, l'analisi dell'espressione di questo proto-oncogene e la dipendenza della sua espressione da vari fattori in qualsiasi la neoplasia è una caratteristica fisiopatologica importante.
Studi immunoistochimici hanno rivelato un contenuto più elevato di Bcl-2 nel leiomioma rispetto al miometrio circostante, con la massima espressione osservata nella fase secretoria del progesterone del ciclo mestruale. Non sono stati riscontrati cambiamenti ciclici nell'espressione di Bcl-2 nel miometrio circostante.
In uno studio in vitro, il trattamento di cellule di leiomioma in coltura con progesterone ha causato un rapido aumento dell'espressione di Bcl-2, mentre l'aggiunta di estradiolo ha comportato un leggero aumento dell'espressione di questo proto-oncogene. Sulla base di ciò si può supporre che il progesterone sia coinvolto anche nella crescita dei leiomiomi inducendo l'espressione di Bcl-2, che blocca l'apoptosi e quindi aumenta la durata della vita della cellula.
Quindi, la patogenesi del leiomioma uterino può essere rappresentata come segue: una cellula precursore, che successivamente darà un clone di cellule di leiomioma, può essere formata in due modi. Il primo è associato a disturbi ontogenetici, il secondo implica il verificarsi di una mutazione somatica di un miocita già maturo. Di conseguenza, il miocita mutante è esposto a una complessa cascata di fattori che causano la mitosi della cellula mutante, che a sua volta probabilmente contribuisce alla diffusione delle mutazioni somatiche.
I principali fattori coinvolti nell’avvio e nel mantenimento della crescita dei leiomiomi comprendono estrogeni, progesterone e fattori di crescita. Esiste una sinergia tra estrogeni e progesterone. Il ruolo degli estrogeni può essere approssimativamente etichettato come "ausiliario", mentre il progesterone è probabilmente il mitogeno chiave del leiomioma. Inoltre, il progesterone sembra promuovere la crescita del leiomioma allungando la durata della vita della cellula proteggendola dall'apoptosi.
I fattori di crescita sono mediatori dell'azione degli ormoni sessuali, stimolano la proliferazione delle cellule di leiomioma e causano anche la produzione e la ristrutturazione della matrice extracellulare. I fattori di crescita chiave nella patogenesi del leiomioma uterino sono EGF e IGF-I. Il loro meccanismo d’azione è autocrino/paracrino. I fattori di crescita sono in grado di esercitare il loro effetto indipendentemente dagli ormoni sessuali, che in determinate fasi dello sviluppo del leiomioma possono indicare la possibilità di autonomia di questa formazione.
Anche la possibilità di produzione locale di estrogeni nel leiomioma e nel miometrio circostante è un fattore importante per mantenere la crescita del leiomioma.
Pertanto, sebbene non vi sia ancora un’idea esatta dell’eziologia e della patogenesi del leiomioma uterino, è già stato accumulato materiale sufficiente per modificare l’approccio clinico e diagnostico a questa malattia. Al momento, è in fase di sperimentazione clinica un farmaco (pirfenidone) che può influenzare direttamente i fattori di crescita nel leiomioma uterino, portando alla regressione del nodo miomato, e questo farmaco non si applica agli agenti ormonali. Il compito più importante è identificare l’evidenza di un’associazione tra lo sviluppo del leiomioma uterino e le condizioni spesso associate a questa malattia, come traumi ostetrico-ginecologici, infezioni ed endometriosi.
Riso. 1. Schema presuntivo della patogenesi del leiomioma uterino. (secondo Mitchell S. Rein con modifiche e integrazioni); ER - recettori degli estrogeni; Recettori PR del progesterone
Bibliografia
- John A. Rock Capitolo 276 - Leiomioma uterino; Rakel: La terapia attuale di Conn 1998;\
- Bonatz G., Frahm O.S., Andreas S., Heidorn K., Jonat W., Parwaresch R. Accorciamento dei telomeri nei leiomiomi uterini; Giornale americano di ostetricia e ginecologia: volume 179; Numero 3; ottobre 1998
- Orii A, Mori A, Zhai YL, Toki T, Nikaido T, Fujii S Mastociti nei tumori della muscolatura liscia dell'utero; Int J Gynecol Pathol 1998 ottobre; 17(4):336-42
- Valenti MT, Azzarello G, Vinante O, Manconi R, Balducci E, Guidolin D, Chiavegato A, sartore S Livelli di differenziazione, proliferazione e apoptosi nel leiomioma umano e leiomiosarcoma. J cancro Res Clin Oncol 1998 124:2 93-105
- Andrade LA, Torresan RZ, Sales JF Jr, Vicentini R, De Souza GA Leiomiomatosi endovenosa dell'utero. Un resoconto di tre casi. Pathol Onkol Res 1998; 4(1:44-7)
- Adesanya OO, Zhou J, Bondy CA Regolazione degli steroidi sessuali dell'espressione genica e della proliferazione del sistema del fattore di crescita simile all'insulina nel miometrio dei primati. J Clin Endocrinol Metab Vol 81, N 5, maggio 1996
- Sozen I, Olive DL, Arici A Espressione e regolazione ormonale della proteina chemiotattica monocitaria-1 nel miometrio e nei leiomiomi. Fertil Steril 1998 giugno; 69(6):1095-102
- Van Der Ven Leo TM, Van Buul-Offers SC, Gloudemans T, Bloemen RJ, Roholl PJ, Sussenbach JS, Otter WD. Modulazione dell'azione dei fattori di crescita simili all'insulina da parte delle proteine leganti l'IGF nei tessuti muscolari lisci normali, benigni e maligni J Clin Endocrinol Metab Vol 81, N 10, ottobre 1996
- Shimomura Y, Matsuo H, Samoto T, Maruo T Up-Regulation mediante l'espressione dell'antigene nucleare delle cellule di progesterone e del fattore di crescita epidermico nel leiomioma uterino umano J Clin Endocrin Metab Vol.83 N 6 giugno 1998
- Lee Byung-Seok, Margolin SB, Nowak RA Pirfenidone: un nuovo agente farmacologico che inibisce la proliferazione delle cellule di leiomioma e la produzione di collagene J Clin Endocrin Metab Vol. 83 n. 1 giugno 1998
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0