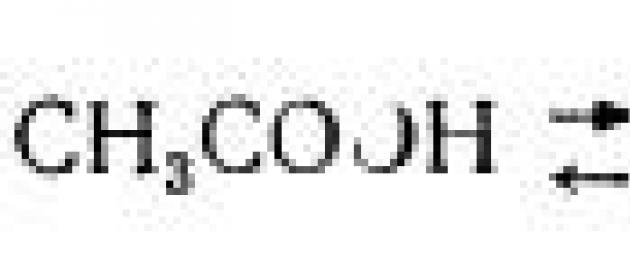Per le reazioni che si verificano nel corpo, la reazione attiva dell'ambiente è di grande importanza.
Sotto la reazione attiva dell'ambiente comprendere la concentrazione nella soluzione di ioni idrogeno o ioni idrossile.
Molte sostanze (elettroliti) si decompongono in ioni in una soluzione acquosa. A seconda della natura dell'elettrolita, il grado di decomposizione (dissociazione) è diverso. L'acqua pura è un elettrolita molto debole che si dissocia in idrogeno e ioni ossidrile:
La quantità di ioni idrogeno e ossidrile nell'acqua pura è trascurabile e ammonta a 0,0000001 g.
Gli acidi in soluzioni acquose si dissociano in uno ione idrogeno e il corrispondente anione:
![]()
e le basi - nello ione idrossile e nel catione corrispondente:
![]()
Se la concentrazione degli ioni idrogeno nella soluzione è uguale alla concentrazione degli ioni ossidrile ([H+]=[OH-]), la reazione è neutra; se la concentrazione di ioni idrogeno è inferiore alla concentrazione di ioni ossidrile ((OH]), la reazione è acida.
Con la stessa normalità delle soluzioni di acido acetico e cloridrico, la reazione attiva in una soluzione di acido acetico è inferiore a quella in una soluzione di acido cloridrico, poiché l'acido acetico si dissocia più debolmente dell'acido cloridrico, per cui c'è meno idrogeno ioni in una soluzione di acido acetico che in una soluzione di acido cloridrico.
Pertanto, la reazione neutra del mezzo è caratterizzata dall'uguaglianza delle concentrazioni di ioni H+ e OH- in soluzione, la reazione acida è caratterizzata dalla predominanza degli ioni idrogeno sugli ioni ossidrile e la reazione alcalina è caratterizzata dalla predominanza di ioni ossidrile su ioni idrogeno. Con un aumento della concentrazione di ioni idrogeno in una soluzione, la concentrazione di ioni ossidrile diminuisce e viceversa. Anche in soluzioni molto acide è sempre presente una quantità insignificante di ioni ossidrile e in soluzioni molto alcaline sono sempre presenti ioni idrogeno. Pertanto, la reazione attiva del mezzo può essere caratterizzata dal contenuto di ioni idrogeno o dal contenuto di ioni idrossile. È consuetudine esprimere la reazione attiva del mezzo in termini di concentrazione di ioni idrogeno, che per l'acqua è pari a 1 * 10w-7. Per non operare nel lavoro pratico con valori numerici così scomodi, la reazione attiva del mezzo è per lo più espressa in termini di valore pH.
L'indice di idrogeno è il logaritmo della concentrazione degli ioni idrogeno, preso con il segno opposto:
![]()
Le variazioni di pH nell'intervallo da 0 a 7 caratterizzano l'acido, il pH 7 neutro e il pH da 7 a 14 alcalino.
Diversi processi chimici procedono diversamente, a seconda che la reazione del mezzo sia acida, neutra o alcalina. La stessa situazione è con i processi che si verificano nelle cellule di un organismo vivente, e qui la reazione dell'ambiente gioca un ruolo importante. Ciò è confermato dal fatto che la costanza della reazione del sangue e dei fluidi tissutali, come la linfa, viene mantenuta con grande accuratezza, nonostante le sostanze formate nei tessuti durante il metabolismo tendano a disturbarlo.
Le proprietà delle proteine si manifestano in stretta dipendenza dalla natura della reazione del mezzo. L'importanza della reazione attiva del mezzo per i processi enzimatici è particolarmente importante.
La reazione dell'ambiente sanguigno e di altri tessuti e organi è leggermente alcalina, vicina al neutro. Nel sangue la costanza del pH si mantiene entro limiti molto ristretti (7,3-7,4). Uno spostamento del pH verso il lato acido o alcalino è il risultato di eventuali disturbi che si verificano nel corpo.
La costanza del pH del sangue è mantenuta dalla regolazione chimica dei sistemi tampone presenti nel sangue e dall'eliminazione dei prodotti finali del metabolismo dai polmoni e dai reni. I polmoni eliminano i prodotti acidi - anidride carbonica, i reni - fosfati e ammoniaca, quest'ultima principalmente dopo essere stata convertita in urea.
Per azione tampone si intende la capacità di una soluzione di resistere alle variazioni di pH che dovrebbero verificarsi a causa dell'aggiunta di un acido o di un alcali.
I sistemi tampone del sangue e dei fluidi tissutali possono mantenere un pH costante durante la formazione di acidi e basi rilasciati durante il metabolismo.
Tra i sistemi tampone, la massima importanza nel corpo sono le proteine, così come i composti minerali: bicarbonati e fosfati di sodio e potassio. I sistemi sanguigni tampone sono: caroonato - H2CO3/NaHCO3, fosfato NaH2PO4/NaHPO4 e proteina-acido/proteina-sale.
Nell'organismo, quando il bicarbonato di sodio NaHCO3 interagisce con l'acido fosforico rilasciato durante lo scambio, si forma acido carbonico:
L'acido carbonico, essendo molto instabile, si decompone rapidamente e viene escreto dal corpo insieme all'aria espirata sotto forma di acqua e anidride carbonica. Ciò garantisce che il pH del sangue rimanga costante. I sali dell'acido fosforico contrastano anche i cambiamenti del pH. Ad esempio, quando l'acido lattico reagisce con il fosfato di sodio disostituito, si formano un sale sodico dell'acido lattico e fosfato di sodio monosostituito:

L'ammoniaca, formata durante lo scambio di basi, si lega con l'acido carbonico libero, dando luogo alla formazione di bicarbonato di ammonio:
La sostanza tampone più importante nel sangue intero è la proteina emoglobina che, grazie alle sue proprietà acide, può legarsi alle basi e formare sali, come l'emoglobina Na.
La capacità tampone del sangue può essere mostrata con il seguente esempio: per spostare il pH del siero sanguigno dal lato alcalino a pH 8,2, è necessario aggiungere 70 volte più alcali che nell'acqua e spostare il pH del sangue sangue a 4,4, è necessario aggiungere al sangue 327 volte più acido cloridrico dell'acqua.
Da un corso di chimica ognuno di noi ricorda le formule di almeno alcune molecole. Anche se non conosci i principi stessi della chimica, probabilmente hai una registrazione simbolica nella tua memoria: H2O, il che significa che una molecola d'acqua è composta da due atomi di idrogeno collegati a un atomo di ossigeno. Ma una tale molecola è chimicamente inattiva, cioè non può reagire con altre sostanze. Questo processo è possibile solo con il decadimento delle molecole in ioni.
Non tutte, ma una certa parte delle molecole d'acqua si dissociano in un catione H+ con carica positiva e un anione con carica negativa OH-. Tale separazione e connessione in una molecola completa avviene costantemente, una parte delle molecole si scompone in ioni e l'altra in questo momento si unisce. Nell'acqua chimicamente pura a temperatura ambiente, 1/10.000.000 del numero totale di molecole è costantemente in uno stato dissociato.
La proporzione delle molecole dissociate può aumentare o diminuire. Le fluttuazioni di temperatura non influenzano questo fenomeno, almeno a temperatura ambiente il numero di molecole rimane lo stesso. D'altro canto, aggiunte di altre sostanze idrosolubili incidono fortemente sul numero di particelle.
L’effetto sul grado di dissociazione può essere triplice:
- Il soluto non modifica la proporzione delle molecole dissociate. Ad esempio, puoi sciogliere il sale da cucina (NaCl) in acqua, che si dissocerà negli ioni Na+ e C1-. La proporzione di ioni H+ e OH- che compongono l'acqua non cambierà.
- Il soluto aumenta la concentrazione di ioni H+. Ad esempio, anche le molecole di acido fosforico H2PO3 si dissociano in due ioni H+ e uno PO3-. Ciò significa che il numero di ioni H+ in una soluzione di acqua e acido fosforico aumenterà, mentre il numero di ioni OH- non cambierà.
- Il soluto aumenta la concentrazione di ioni OH-. Ad esempio, le molecole di idrossido di sodio (NaOH) formano ioni Na+ e OH-. In questo caso, la concentrazione di ioni H+ non cambierà e il numero di ioni OH- nella soluzione aumenterà.
Su questo si può concludere il prologo, saturo di termini complessi, e trarre le principali conclusioni. L'eccesso di H+ dà acqua acido proprietà e un eccesso di OH- - alcalino. Laddove la proporzione delle molecole dissociate non è cambiata, l'acqua ha proprietà neutre. In generale, questa caratteristica dell'acqua si chiama reazione attiva.
Per valutare la reazione attiva in numeri, il cosiddetto indice di idrogeno.È uguale all'antilogaritmo degli ioni H+ in soluzione, cioè per l'acqua chimicamente pura, antilog (1/10.000.000) = 7. Per chi non è molto pratico di matematica e non sa cosa sia l'antilogaritmo, pago attenzione al numero di zeri nella frazione di molecole d'acqua dissociate: coincide con il valore dell'indice di idrogeno. In forma abbreviata, il valore pH dell'acqua neutra è scritto come pH 7. L'abbreviazione pH significa stagno idrogeno, che dal latino significa "indicatore di idrogeno".
Nel senso più generale, a pH 7 l'acqua ha proprietà neutre, a pH 7 è alcalina. Per una indicazione più precisa delle proprietà dell'acqua si chiama:
- pH 1-3 - fortemente acido;
- pH 3-5 - acido;
- pH 5-7 - leggermente acido;
- pH 7 - neutro;
- pH 7-9 - leggermente alcalino;
- pH 9-11 - alcalino;
- pH 11-14 - fortemente alcalino.
Nell'esempio sopra, l'elenco delle varie sostanze che modificano il pH è lungi dall'essere esaurito. Tutti, indipendentemente dalla composizione chimica, influenzano questo valore. Abbassa (o, in altre parole, acidifica l'acqua) gli acidi e i loro sali. L'aumento del valore del pH è facilitato dalla presenza di alcali o sali alcalini nell'acqua. Alcune sostanze non modificano il valore del pH: si tratta di sostanze neutre.
Nella pratica dell'acquario sono da tempo utilizzate diverse sostanze che possono influenzare la reazione attiva. Ad esempio, una diminuzione del valore del pH viene effettuata utilizzando un brodo acido di torba. L'anidride carbonica disciolta nell'acqua ha lo stesso effetto. Quando si allevano pesci d'acquario, viene spesso utilizzato l'acido ortofosforico. L'aumento del valore del pH viene effettuato utilizzando una soluzione di soda da bere (Na2HCO3). Come hai capito, l'acqua può essere acidificata o alcalinizzata con qualsiasi sostanza che abbia le proprietà appropriate, ma per l'uso in un acquario non dovrebbe essere velenosa. Pertanto l'elenco sopra riportato delle sostanze utilizzate nel commercio acquariofilo può ritenersi esaurito.
Spesso, quando si parla del pH dell'acqua, gli acquariofili usano i termini “acidità” o “alcalinità”. Allo stesso tempo, li usano come se un aumento dell’acidità equivalesse ad una diminuzione del pH e viceversa. In realtà, questo è un errore. L'acidità è il numero di residui acidi presenti nell'acqua e si misura in mg/l, ciò significa che alla stessa acidità possono corrispondere valori di pH diversi, a seconda del tipo di forza di questo residuo acido. Ad esempio, l'acido carbonico viene sciolto nella stessa concentrazione in un campione e l'acido cloridrico nell'altro. Poiché le proprietà acide dell'acido cloridrico sono centinaia di volte più forti dell'acido carbonico, il pH nella soluzione di acido cloridrico sarà molto più basso e l'acidità delle soluzioni diventerà la stessa. Lo stesso si può dire dell’alcalinità. È meglio non usare affatto questi termini nella pratica dell'acquariofilia.
I. Sheremetiev
- In contatto con 0
- Google Plus 0
- OK 0
- Facebook 0