Le cellule del sistema immunitario, a cui sono affidate funzioni chiave per l'attuazione dell'immunità acquisita, appartengono ai linfociti, che sono un sottotipo di leucociti. La maggior parte dei linfociti sono responsabili dell'immunità acquisita specifica, poiché possono riconoscere gli agenti infettivi all'interno o all'esterno delle cellule, nei tessuti o nel sangue. I principali tipi di linfociti sono le cellule B e le cellule T, che derivano da cellule staminali emopoietiche pluripotenti; in un adulto si formano nel midollo osseo e i linfociti T subiscono inoltre alcune fasi di differenziazione nel timo. Le cellule B sono responsabili della componente umorale dell'immunità acquisita, producono cioè anticorpi, mentre le cellule T rappresentano la base della componente cellulare della risposta immunitaria specifica. Nel corpo, i precursori dei linfociti vengono continuamente prodotti durante la differenziazione delle cellule staminali ematopoietiche e, a causa di mutazioni nei geni che codificano per le catene variabili degli anticorpi, si formano molte cellule sensibili a una varietà di antigeni potenzialmente esistenti. Nella fase di sviluppo, i linfociti vengono selezionati: rimangono solo quelli che sono significativi dal punto di vista della protezione del corpo, così come quelli che non rappresentano una minaccia per i tessuti del corpo. Parallelamente a questo processo, i linfociti vengono divisi in gruppi in grado di svolgere l'una o l'altra funzione protettiva. Esistono diversi tipi di linfociti. In particolare in base alle caratteristiche morfologiche si dividono in piccoli linfociti e grandi linfociti granulari (LGL). Basandosi sulla struttura delle cellule T esterne, riconoscono bersagli estranei (“non self”), come i microrganismi patogeni, solo dopo che gli antigeni (molecole specifiche del corpo estraneo) sono stati elaborati e presentati in combinazione con i propri (“self ”) biomolecola, chiamata molecola del complesso maggiore di istocompatibilità. principale istocompatibilità complesso, MHC). Esistono numerosi sottotipi di cellule T, comprese le cellule T killer, le cellule T helper e le cellule T regolatrici. citotossicità - killer naturali.
Stadi di differenziazione dei linfociti T e B.
Alcune cellule staminali linfoidi migrano nella ghiandola del timo (timo) e lì maturano in linfociti T; l'altra parte rimane nel midollo osseo e matura in linfociti B. Nel percorso di maturazione (differenziazione) negli organi centrali del sistema immunitario, una cellula staminale attraversa diverse fasi. Queste fasi di maturazione dei linfociti T e B avvengono senza la partecipazione di un antigene e sono quindi chiamate antigene differenziazione indipendente. La prima fase è la comparsa sulla cellula staminale di strutture che indicano quale percorso di differenziazione (linfociti T o B) seguirà il suo sviluppo; si verifica nel midollo osseo.Il precursore precoce dei linfociti B ha sulla sua membrana la cosiddetta catena L surrogata della molecola dell'immunoglobulina, e il precursore precoce dei linfociti T ha una glicoproteina con un peso molecolare di 3,3 * 104 D (GP-33), che successivamente si associa alla catena beta del recettore per il riconoscimento dell'antigene delle cellule T. Queste strutture, che determinano il destino futuro della cellula staminale ematopoietica, svolgono un ruolo importante: 1) stabiliscono il percorso di differenziazione dei linfociti T e B; 2) trasmettere un segnale ai primi precursori dei linfociti T e B, attraverso i quali inizia la loro proliferazione.Ad esempio, nella fase di comparsa della catena L surrogata e GP-33, ce ne sono 3-5 * 106 tali cellule nel midollo osseo e nel timo dei topi. Tuttavia, dopo 4 settimane, il loro numero aumenta di 10-100 volte e ammonta a 5 * 107 - 108 celle. Pertanto, la presenza della catena L surrogata e di GP-33 è lo strumento attraverso il quale il numero di cellule pre-B e pre-T raggiunge il livello richiesto.La seconda fase della differenziazione dei linfociti è la comparsa di precursori immaturi di B e Linfociti T. È determinato dalla comparsa sulla membrana dei linfociti B e T dei recettori per il riconoscimento dell'antigene, con l'aiuto dei quali i linfociti B e T, dopo questa fase di differenziazione, acquisiscono la capacità di riconoscere gli antigeni. il recettore per il riconoscimento dell'antigene (BAGRR) è l'IgM di membrana, mentre per i linfociti T (TAGRR) è una speciale molecola dimerica che ha catene alfa e beta e appartiene alla super famiglia delle immunoglobuline (i recettori per il riconoscimento dell'antigene saranno discussi in dettaglio nelle sezioni sui linfociti T e B). Tra gli stadi I e II ci sono molti altri stadi di differenziazione, di cui non parleremo qui. Pertanto, la comparsa sulla superficie dei primi precursori delle cellule linfoidi di alcune strutture (recettori) serve come segnale che consente alle cellule di differenziarsi in una linea specifica di linfociti. Le cellule precursori che hanno tali recettori migrano in una certa area degli organi immunitari centrali e quindi interagiscono con il microambiente specifico necessario affinché la differenziazione di questa cellula avvenga in quest'area. In risposta al contatto con una cellula progenitrice, le cellule stromali del microambiente locale, a loro volta, sviluppano processi molecolari che mirano alla “formazione” (impegno) delle cellule progenitrici per la loro ulteriore differenziazione in un lignaggio separato.
~L'importanza dell'immunità locale nel processo immunitario.
L'immunità locale è un insieme di adattamenti che proteggono le superfici a contatto con l'ambiente esterno da agenti biologici estranei. Pertanto, l'immunità locale partecipa al mantenimento della costanza dell'ambiente interno del corpo, della sua integrità ed è una parte inseparabile e subordinata dell'immunità generale. Allo stesso tempo, i meccanismi dell’immunità locale sono significativamente unici. Pertanto, rappresenta un sistema autonomo del corpo abbastanza ben definito. La neutralizzazione di microbi e virus patogeni non è l'unica e, forse, non la funzione principale dell'immunità locale. Questo sistema è anche coinvolto nella prevenzione della diffusione di agenti patogeni di malattie infettive da persone malate a persone sane. Pertanto, l’immunità locale è di eccezionale importanza per la stabilità della popolazione. La resistenza locale non può essere ridotta alla sola azione degli anticorpi ed è di natura complessa. Si basa su dispositivi di protezione diversi tra loro. Alcuni di loro sono congeniti ed esistono costantemente, indipendentemente dal fatto che il corpo abbia incontrato o meno l'agente eziologico della malattia. Tra questi figurano alcune proteine contenute nelle secrezioni delle ghiandole del rivestimento interno delle vie respiratorie e digestive, che possono sopprimere (inibire) l'attività patogena di virus e batteri. Tali dispositivi possono essere considerati anche le cellule che assorbono e digeriscono vari microrganismi (macrofagi). Altri tipi di dispositivi includono cellule linfociti T e anticorpi che reagiscono in modo specifico. A seconda dello stato dell'organismo, delle proprietà dell'agente patogeno, delle condizioni in cui avviene la loro interazione, uno o un gruppo di questi dispositivi può acquisire un'importanza fondamentale. Consideriamolo usando l'esempio della resistenza locale del sistema respiratorio agli agenti patogeni delle malattie infettive acute. Si compone di tre complessi principali: adattamenti strutturali e fisiologici della resistenza, fattori immunitari aspecifici e fattori immunitari specifici (Fig. 6). Il primo gruppo di dispositivi di protezione riguarda la struttura e la funzione delle prime vie respiratorie. Il naso e il rinofaringe sono un perfetto “condizionatore” che purifica l'aria, la riscalda e la idrata. Il successivo adattamento dello stesso ordine sono le superfici interne delle vie aeree, rivestite con epitelio ciliato. Le ciglia in continua vibrazione e il liquido che le ricopre sono una “scala mobile” che funziona giorno e notte. La sua sezione superiore è il naso e il rinofaringe, la sezione inferiore è la trachea e i bronchi. Entrambe le sezioni trasportano il fluido insieme a microrganismi e altre particelle nella stessa direzione, verso la faringe. Gas e piccole particelle di inquinamento atmosferico, gli agenti patogeni sopprimono il movimento delle ciglia, indebolendo così la stabilità del sistema respiratorio.
~Caratteristiche del timo legate all'età.
Il timo si forma prima rispetto ad altri organi del sistema immunitario e al momento della nascita ha una massa significativa - in media 13,3 g (da 7,7 a 34,0 g). Dopo la nascita, durante i primi 3 anni di vita del bambino, il timo cresce più rapidamente. Nel periodo da 3 a 20 anni, la massa del timo è abbastanza stabile (in media 25,7-29,4 g, secondo V.I. Puzik). Dopo 20 anni, la massa del timo diminuisce gradualmente a causa dell'involuzione legata all'età. Negli anziani e negli anziani la massa del timo è di 13-15 g Con l'aumentare dell'età, la struttura microscopica del timo cambia. Dopo la nascita (fino a circa 10 anni), il timo è dominato dalla corteccia. Il parenchima timico occupa fino al 90% del volume dell'organo. All'età di 10 anni, le dimensioni della corteccia e del midollo sono approssimativamente uguali. Successivamente la zona corticale si assottiglia e il numero dei timociti diminuisce. Il tessuto adiposo cresce nell'organo insieme al tessuto connettivo; nelle persone di età superiore ai 50 anni arriva fino al 90%. Durante l'involuzione legata all'età, il parenchima timico non scompare completamente, ma rimane sotto forma di isole circondate da tessuto adiposo che si trovano dietro lo sterno.Afflusso di sangue e innervazione del timo. Le rr si estendono al timo dall'arteria mammaria interna, dall'arco aortico e dal tronco brachiocefalico. timici. Nei setti interlobulari si dividono in rami più piccoli, che penetrano nei lobuli, dove si ramificano in capillari. Le vene del timo drenano nelle vene brachiocefaliche e nelle vene mammarie interne.
~Definizione di antigeni e loro natura chimica.
Gli antigeni sono sostanze o corpi che portano l'impronta di informazioni genetiche estranee. Si tratta delle stesse sostanze, quelle “estranee”, contro le quali “lavora” il sistema immunitario. Qualsiasi cellula (tessuto, organo) che non appartiene al corpo (non propria) è un complesso di antigeni per il suo sistema immunitario. Anche alcuni dei tuoi tessuti (il cristallino dell'occhio) sono antigeni. Sono i cosiddetti “tessuti barriera”. Normalmente non entrano in contatto con l'ambiente interno del corpo. La natura chimica degli antigeni è diversa. Queste possono essere proteine: polipeptidi, nucleoproteine, lipoproteine, glicoproteine, polisaccaridi, lipidi ad alta densità, acidi nucleici. Gli antigeni sono divisi in forti, che causano una risposta immunitaria pronunciata, e deboli, quando somministrati, l'intensità della risposta immunitaria è bassa. Gli antigeni forti di solito hanno una struttura proteica. Gli antigeni hanno due proprietà: in primo luogo, sono in grado di indurre lo sviluppo di una risposta immunitaria, questa proprietà è chiamata antigenicità, o azione antigenica; in secondo luogo, sono in grado di interagire con i prodotti della risposta immunitaria indotta da un antigene simile; questa proprietà è chiamata specificità, o funzione antigenica. Alcuni antigeni (solitamente non proteici) non sono in grado di indurre lo sviluppo di una risposta immunitaria (non hanno antigenicità), ma possono interagire con i prodotti della risposta immunitaria. Sono chiamati antigeni inferiori o apteni. Molte sostanze semplici e farmaci sono apteni; quando entrano nel corpo, possono coniugarsi con le proteine dell'organismo ospite o con altri trasportatori e acquisire le proprietà di antigeni a tutti gli effetti.
~Concetti di estraneità, antigenicità, immunogenicità e specificità degli antigeni.
L'estraneità è un concetto inseparabile dall'antigene. Senza estraneità, non esiste antigene applicato a un dato organismo. ad esempio, l'albumina del coniglio non è un antigene per quell'animale, ma è geneticamente estranea alla cavia.L'antigenicità è una misura della qualità antigenica, ad esempio la maggiore o minore capacità di indurre la formazione di anticorpi. Pertanto, un coniglio produce più anticorpi contro la gammaglobulina sierica bovina che contro l'albumina sierica bovina. L’immunogenicità è la capacità di creare immunità. Questo concetto si riferisce principalmente all'A. microbica, che garantisce la creazione di immunità (immunità) alle infezioni. Ad esempio, l'agente eziologico della dissenteria è altamente antigenico, ma non è possibile ottenere un'immunità pronunciata contro la dissenteria. L'agente eziologico della febbre tifoide è sia altamente antigenico che altamente immunogenico. Pertanto, il vaccino contro il tifo crea un'immunità pronunciata. Specificità: caratteristiche antigeniche che distinguono A. gli uni dagli altri. Esistono sostanze che hanno un aspetto specifico, ma non provocano reazioni immunitarie (in particolare la produzione di anticorpi) quando introdotte nel corpo. Tuttavia, interagiscono con gli anticorpi già pronti. Tali sostanze sono chiamate apteni o antigeni difettosi. Gli apteni hanno segni di estraneità, ma non possiedono certe qualità necessarie per la manifestazione di proprietà antigeniche complete. Gli apteni acquisiscono le proprietà dell'A a tutti gli effetti dopo essersi combinati con sostanze di grandi dimensioni ° - proteine, polisaccaridi o polielettroliti artificiali ad alto peso molecolare.
~Dipendente dal timo, antigeni timo-indipendenti, caratteristiche strutturali, distribuzione in natura e sviluppo della risposta immunitaria ad essi.
La maggior parte degli antigeni naturali sono timo-dipendenti. Ciò significa che il pieno sviluppo di una risposta immunitaria specifica a tali antigeni inizia solo dopo la connessione delle cellule T. Idee simili si sono sviluppate sulla base di esperimenti sia in vivo che in vitro. In effetti, i topi neonatali timectomizzati non rispondono affatto all'intero antigene con la produzione di IgG, oppure questa risposta è estremamente bassa. Il trapianto di timo nei topi ripristina la risposta specifica. Quando si utilizza un coniugato di aptene con varie proteine come trasportatore, si è scoperto che le cellule T rispondono al trasportatore (epitopo delle cellule T), mentre le cellule B rispondono all'aptene (epitopo delle cellule B). Esperimenti in vitro hanno dimostrato che oltre al gruppo principale di antigeni timo-dipendenti, esistono antigeni che possono avviare una risposta immunitaria in assenza di cellule T. Sono chiamati antigeni timo-indipendenti. Gli antigeni di questo gruppo appartengono principalmente ai polisaccaridi e sono caratterizzati da ripetizioni multiple di epitopi strutturalmente identici. Tale uniformità porta all'interazione multipunto con le cellule B, che garantisce il loro pieno sviluppo in plasmacellule mature produttrici di anticorpi. Inoltre, la struttura di alcuni antigeni timo-indipendenti contiene sequenze con attività policlonale, mitogenica (ad esempio, lipopolisaccaridi batterici), che contribuisce anche allo sviluppo delle cellule B, bypassando l'aiuto delle cellule T. Anche il metodo di somministrazione dell'antigene è un fattore limitante per la manifestazione dell’immunogenicità. Ad esempio, alcuni antigeni batterici, quando entrano direttamente nel tratto gastrointestinale, non sono in grado di superare l'acidità del succo gastrico come barriera naturale. Allo stesso tempo, questi batteri
~Modalità di introduzione degli antigeni nell'organismo.
Gli antigeni esogeni entrano negli ambienti interni principalmente attraverso i tessuti tegumentari. La pelle è permeabile ai prodotti liposolubili che possono complessarsi con le proteine e quindi trasformarsi in antigeni.
La mucosa delle vie respiratorie in uno stato intatto è facilmente permeabile a numerosi virus patogeni (influenza, ecc.), tossine batteriche (botulismo) e microrganismi (peste, ecc.). La permeabilità della mucosa agli antigeni aumenta notevolmente in caso di violazione della protezione meccanica, soppressione dei riflessi protettivi (starnuti, tosse), indebolimento della paraimmunità e dell'immunità specifica. Gli antigeni esogeni possono penetrare nel corpo per via parenterale, bypassando il tessuto tegumentario (iniezioni parenterali di farmaci contenenti antigeni, introduzione di sostanze antigeniche da punture di insetti, animali velenosi). Gli antigeni endogeni di organi con potenti barriere possono penetrare nei mezzi liquidi e contattare il tessuto linfoide solo quando le strutture della barriera sono danneggiate. In altri casi, gli antigeni endogeni si formano durante: a) l'interruzione della sintesi proteica nelle cellule e l'esocitosi delle proteine di composizione inadeguata in mezzi liquidi; b) durante la denaturazione delle proteine cellulari ed extracellulari sotto l'influenza di fattori fisici; c) quando complessato con composti chimici estranei. Il tratto gastrointestinale nei bambini del primo periodo postnatale ha un'elevata permeabilità fisiologica agli antigeni a causa del sottosviluppo della barriera intestinale. Nei bambini di questa età, le proteine che non hanno perso la loro specificità antigenica (proteine del latte vaccino, proteine vegetali, ecc.) possono essere facilmente assorbite dal chimo.
~Struttura delle principali classi di immunoglobuline e loro funzioni.
gGè la principale immunoglobulina nel siero di una persona sana (rappresenta il 70-75% della frazione totale delle immunoglobuline), più attiva nella risposta immunitaria secondaria e nell'immunità antitossica. A causa delle sue piccole dimensioni (coefficiente di sedimentazione 7S, peso molecolare 146 kDa) è l'unica frazione di immunoglobuline in grado di trasportare attraverso la barriera placentare e quindi fornire immunità al feto e al neonato. Le IgG contengono il 2-3% di carboidrati; due frammenti F ab che legano l'antigene e un frammento FC. Il frammento F ab (50-52 kDa) è costituito dall'intera catena L e dalla metà N-terminale della catena H, collegate da un legame disolfuro, mentre il frammento FC (48 kDa) è formato dalle metà C-terminali della catena H le catene H.
IgM sono un pentamero di un'unità base a quattro catene contenente due catene μ. In questo caso, ciascun pentamero contiene una copia di un polipeptide con una catena J (20 kDa), che viene sintetizzato da una cellula produttrice di anticorpi e si lega covalentemente tra due frammenti FC adiacenti di immunoglobulina. Compaiono durante la risposta immunitaria primaria dei linfociti B ad un antigene sconosciuto e costituiscono fino al 10% della frazione immunoglobulinica. Sono le immunoglobuline più grandi (970 kDa). Contiene il 10-12% di carboidrati.
IgA Le IgA sieriche costituiscono il 15-20% della frazione immunoglobulinica totale, con l'80% delle molecole di IgA presenti in forma monomerica nell'uomo. La funzione principale delle IgA è quella di proteggere le mucose dei tratti respiratorio, genito-urinario e gastrointestinale dalle infezioni. Le IgA secretorie si presentano in forma dimerica in combinazione con la componente secretoria e si trovano nelle secrezioni sierose-mucose (ad esempio saliva, lacrime, colostro, latte, secrezioni della mucosa del sistema genito-urinario e respiratorio). Contiene il 10-12% di carboidrati, peso molecolare 500 kDa.
IG D costituisce meno dell'1% della frazione immunoglobulinica plasmatica e si trova principalmente sulla membrana di alcuni linfociti B. Le funzioni non sono del tutto chiare, si tratta presumibilmente di un recettore antigenico ad alto contenuto di carboidrati legati alle proteine per i linfociti B che non hanno ancora presentato l'antigene. Peso molecolare 175 kDa.
~Differenziazione antigene-dipendente e antigene-indipendente dei linfociti B.
La differenziazione dei linfociti B è convenzionalmente divisa in due fasi: indipendente dall'antigene (in cui avviene il riarrangiamento dei geni delle immunoglobuline e la loro espressione) e dipendente dall'antigene (in cui avvengono l'attivazione, la proliferazione e la differenziazione in plasmacellule). Si distinguono le seguenti forme intermedie di linfociti B in maturazione: La differenziazione antigene-dipendente dei linfociti B avviene negli organi linfatici periferici nei centri germinali. La formazione di questi centri inizia subito dopo la nascita, sebbene la capacità di sintetizzare anticorpi di classe M esista già nel periodo embrionale e si manifesti in numerose infezioni intrauterine. La preparazione all'inizio della sintesi anticorpale durante il periodo neonatale comporta non solo il rapido accumulo di linfociti B, ma anche la preparazione di un trampolino di lancio per la loro differenziazione. La milza con la massa relativa maggiore durante il periodo neonatale diventa un tale trampolino di lancio e il numero di follicoli in essa contenuti aumenta rapidamente durante il primo anno di vita. Durante la differenziazione antigene-indipendente dei linfociti B avviene la formazione sequenziale di geni, prima per la catena H, poi per la catena L, l'assemblaggio del gene completo dell'immunoglobulina M, la formazione prima di IgM citoplasmatiche e infine , dei recettori delle immunoglobuline di membrana IgM e IgD.
~Risposta immunitaria umorale agli antigeni timo-dipendenti e timo-indipendenti.
Gli antigeni ai quali le cellule T e B partecipano alla risposta immunitaria sono chiamati antigeni T-dipendenti. Tuttavia, alcuni antigeni sono in grado di attivare le cellule B senza l’aiuto delle cellule T. Questi sono antigeni T-indipendenti. Questi antigeni condividono una serie di proprietà comuni. Pertanto, sono tutte grandi molecole polimeriche con determinanti antigenici ripetuti. Molti di essi (a condizione che la loro concentrazione sia elevata) sono in grado di attivare cloni di cellule B specifici per altri antigeni (fenomeno della specificità policlonale). Spesso mostrano una maggiore resistenza al degrado.
La risposta umorale primaria agli antigeni T-indipendenti è solitamente un po’ più debole rispetto agli antigeni T-dipendenti e raggiunge il suo picco un po’ prima. In entrambi i casi si producono principalmente IgM. Tuttavia, le risposte immunitarie secondarie a questi due tipi di antigeni differiscono notevolmente. Quando viene reintrodotto un antigene T-indipendente, la risposta assomiglia a quella primaria, mentre la reazione secondaria agli antigeni T-dipendenti è molto più forte di quella primaria e la maggior parte degli anticorpi formati sono IgG, cioè si verifica un passaggio isotipico a IgG e l'affinità degli anticorpi aumenta. Tuttavia, va notato che l’attivazione T-indipendente delle cellule B fornisce un vantaggio in termini di sopravvivenza perché consente all’organismo di rispondere più rapidamente agli agenti microbici. Molti antigeni batterici agiscono indipendentemente dall’assistenza delle cellule T perché sono induttori estremamente potenti della sintesi di citochine IL-1, IL-6 e TNF-alfa macrofagi.
~Partecipazione delle immunoglobuline alla risposta immunitaria primaria e secondaria.
Dinamica della produzione di anticorpi. Risposta immunitaria primaria e secondaria.
La risposta primaria avviene al contatto iniziale con l'agente patogeno (antigene), la risposta secondaria avviene al contatto ripetuto. Principali differenze:
Durata del periodo di latenza (più lungo durante il periodo primario);
Il tasso di crescita degli anticorpi (più veloce nel secondario);
La quantità di anticorpi sintetizzati (di più con contatti ripetuti);
La sequenza di sintesi di anticorpi di diverse classi (nel primario, l'IgM predomina per un tempo più lungo, nel secondario, gli anticorpi IgG vengono rapidamente sintetizzati e predominano).
La risposta immunitaria secondaria è dovuta alla formazione cellule della memoria immunitaria. Un esempio di risposta immunitaria secondaria è l’incontro con un agente patogeno dopo la vaccinazione.
Il ruolo degli anticorpi nella formazione dell'immunità.
Gli anticorpi sono importanti nella formazione immunità acquisita post-infettiva e post-vaccinazione.
1. Legandosi alle tossine, gli anticorpi le neutralizzano, fornendo immunità antitossica.
2. Bloccando i recettori dei virus, gli anticorpi impediscono l'assorbimento dei virus sulle cellule e partecipano all'immunità antivirale.
3. Il complesso antigene-anticorpo innesca la via classica di attivazione del complemento con le sue funzioni effettrici (lisi batterica, opsonizzazione, infiammazione, stimolazione dei macrofagi).
4. Gli anticorpi partecipano all'opsonizzazione dei batteri, promuovendo una fagocitosi più efficiente.
5. Gli anticorpi promuovono l'escrezione di antigeni solubili dal corpo (con urina, bile) sotto forma di complessi immuni circolanti.
Le IgG svolgono il ruolo più importante nell'immunità antitossica, le IgM - nell'immunità antimicrobica (fagocitosi degli antigeni corpuscolari), in particolare contro i batteri gram-negativi, le IgA - nell'immunità antivirale (neutralizzazione dei virus), le IgA - nell'immunità locale delle mucose, le IgE - nelle reazioni di ipersensibilità immediata.
Nessun materiale simile(
~Sistema del complemento, funzioni e suo ruolo biologico.
Sistema di complemento- un complesso di proteine complesse costantemente presenti nel sangue. Si tratta di un sistema a cascata di enzimi proteolitici finalizzato alla protezione umorale dell’organismo dall’azione di agenti estranei; è coinvolto nella realizzazione della risposta immunitaria dell’organismo. È una componente importante sia dell’immunità innata che acquisita. Funzioni biologiche] Ora si distinguono le seguenti funzioni: Funzione opsonizzante. Immediatamente dopo l'attivazione del sistema del complemento si formano componenti opsonizzanti che rivestono organismi patogeni o complessi immunitari, attirando i fagociti. La presenza di un recettore per C3b sulla superficie delle cellule fagocitiche migliora il loro attaccamento ai batteri opsonizzati e attiva il processo di assorbimento. Solubilizzazione (cioè dissoluzione) degli immunocomplessi (da parte della molecola C3b). Con la carenza del complemento si sviluppa la patologia del complesso immunitario (condizioni simili al LES). [LES = lupus eritematoso sistemico] Coinvolgimento nelle reazioni infiammatorie. L'attivazione del sistema del complemento porta al rilascio di sostanze biologicamente attive (istamina, serotonina, bradichinina) dai basofili tissutali (mastociti) e dai granulociti basofili nel sangue, che stimolano la risposta infiammatoria (mediatori dell'infiammazione). Funzioni di C3a: agire come fattore chemiotattico, provocando la migrazione dei neutrofili verso il sito del suo rilascio; indurre l'attaccamento dei neutrofili all'endotelio vascolare e tra loro; attivare i neutrofili, inducendoli a sviluppare un'esplosione respiratoria e una degranulazione; stimolare la produzione dei leucotrieni da parte dei neutrofili Funzione citotossica o litica. Nella fase finale di attivazione del sistema del complemento, dai componenti tardivi del complemento si forma un complesso di attacco di membrana (MAC) che attacca la membrana di un batterio o di qualsiasi altra cellula e la distrugge.Fattore C3e, formato dalla scissione del fattore C3b , ha la capacità di provocare la migrazione dei neutrofili dal midollo osseo, e in questo caso essere causa di leucocitosi.
Test che caratterizzano il sistema immunitario B.
I dati scoperti sull'effetto stimolante della monarda sul sistema immunitario T sono stati confermati in esperimenti sulla linea murina C57BL6 che è poco reattiva agli eritrociti di pecora, cioè le frazioni volatili dell'olio essenziale di monarda hanno aumentato la risposta immunitaria nella linea murina che era poco responsiva agli eritrociti di pecora fino al livello osservato negli animali della linea CBA che erano altamente reattivi a questo antigene.
Il midollo osseo, l’organo centrale dell’immunità, controlla la maturazione delle cellule B.
Esistono due popolazioni di linfociti: linfociti T (linfociti timo-dipendenti) e linfociti B (linfociti borsa-dipendenti). I precursori delle cellule T lasciano il midollo osseo nel sangue ed entrano nella ghiandola del timo. I precursori delle cellule B rimangono nel midollo osseo, dove avviene la formazione del sistema immunitario B.
I linfociti T sono responsabili del rigetto dei tessuti estranei e delle forme cellulari di immunità, i linfociti B sono responsabili dell'immunità umorale. Sulla superficie dei linfociti T e B si trovano i recettori che riconoscono l'antigene. Tra i linfociti T, ci sono tre tipi di cellule: T-killer (assassini), T-helper (aiutanti), T-soppressori (regolatori del sistema immunitario).
La risposta immunitaria viene effettuata come risultato dell'interazione delle cellule T e B e dei macrofagi. Il loro lavoro congiunto costituisce la base della risposta immunologica dell'organismo, in cui ciascun gruppo di cellule svolge le sue funzioni rigorosamente definite. Studiando il sistema immunitario B, il numero relativo di linfociti B nel sangue periferico di tutti i soggetti del gruppo principale era simile, vale a dire un aumento abbastanza pronunciato dell'EAC-ROC (linfociti B). Nel soggetto K., il numero di EAS-ROK è aumentato di 1,5 volte, nel soggetto T. - di 3,8 volte, nel soggetto F. - di 2 volte. C'era una differenza statisticamente significativa (P<0,05) между средним числом В-лимфоцитов у лиц основной группы до начала исследований и после окончания эксперимента (соответственно 18,3 против 40,0; Р<0,05). Относительное количество В-лимфоцитов в группе кратковременного пребывания в условиях IA non è cambiato in modo significativo. Si è verificata una leggera diminuzione dell'attività funzionale del sistema immunitario B dopo una lunga permanenza dei soggetti in condizioni IA: il livello degli anticorpi eterofili normali nel siero di tutti e 3 gli esaminati non superava 1:3. Un altro indicatore che caratterizza l'attività funzionale del sistema immunitario B, la concentrazione nel siero del sangue, è rimasta entro i limiti normali in tutti quelli esaminati dopo la fine dell'esperimento.
Determinazione della concentrazione delle immunoglobuline sieriche e secretorie;
Concentrazione di immunoglobuline IgG, IgA, IgM
La concentrazione di immunoglobuline delle tre classi principali - G, A, M - consente di valutare il potenziale della risposta immunitaria umorale (anticorpo) senza tenere conto della specificità dell'antigene.
Un aumento della concentrazione di immunoglobuline di una (G), due (G, M) o tutte e tre le classi (G, A, M) può essere osservato in alcune malattie autoimmuni, linfoproliferative e nell'AIDS.
La determinazione del contenuto dell'immunoglobulina G sierica ha significato clinico e diagnostico per: infezioni ricorrenti, epatite, CTD, mieloma multiplo, infezione da HIV, patologia oncologica, per il monitoraggio della terapia immunosostitutiva (per immunodeficienze primarie e secondarie della formazione di anticorpi).
La determinazione del contenuto dell'immunoglobulina A sierica ha significato clinico e diagnostico per: diarrea cronica, sindrome da malassorbimento; infezioni respiratorie batteriche ricorrenti, otiti, meningiti; asma bronchiale; reazioni anafilattiche post-trasfusionali; DZTD (lupus eritematoso sistemico, artrite reumatoide, dermatomiosite); malattie tumorali del sistema linfoide (mieloma, leucemia, linfoma, reticolosarcoma); epatite cronica, cirrosi epatica.
La determinazione del contenuto dell'immunoglobulina M sierica ha significato clinico e diagnostico per: infezioni ricorrenti, croniche o gravi; artrite reumatoide e malattie autoimmuni; malattie tumorali; epatite cronica, cirrosi epatica; per monitorare il trattamento della macroglobulinemia di Waldenström.
L'intero percorso di sviluppo dei linfociti B da una cellula staminale emopoietica pluripotente alla formazione di plasmacellule che sintetizzano anticorpi e cellule B di memoria comprende antigene-indipendente E stadio di differenziazione antigene-dipendente . La differenziazione antigene-indipendente dei linfociti B avviene nel midollo osseo; si basa sul riarrangiamento dei geni delle immunoglobuline, che porta alla formazione di cloni di linfociti B che esprimono immunoglobuline recettoriali di varie specificità sulla loro superficie. Durante il processo di differenziazione antigene-dipendente negli organi linfoidi periferici, i linfociti B vengono attivati a seguito del riconoscimento degli antigeni corrispondenti mediante recettori di riconoscimento dell'antigene immunoglobulinico (ARR); la loro proliferazione e differenziazione in plasmacellule che sintetizzano anticorpi e cellule B della memoria. In questa fase avviene anche il riarrangiamento dei geni delle immunoglobuline, che porta alla sintesi di diversi isotipi di immunoglobuline.
La formazione dei linfociti B inizia nell'embriogenesi e continua per tutta la vita. Durante il periodo embrionale, i linfociti B si formano nel sacco vitellino, nel fegato fetale e nel midollo osseo embrionale. Dopo la nascita, l’unica fonte di linfociti B nei mammiferi e nell’uomo è il midollo osseo.
Principali fasi della differenziazione dei linfociti B
Un diagramma che riflette le fasi principali della differenziazione dei linfociti B è presentato in Fig. 19.
Figura 19. Principali fasi della differenziazione dei linfociti B
· HSC – cellule staminali emopoietiche del midollo osseo;
· LSC – cellula staminale linfoide (comune precursore della linfopoiesi);
· pB – precursore dei linfociti B;
· B 0 – linfociti;
· B 1 – linfociti (linfociti B naive);
· B 2 – linfociti;
L'antenato dei linfociti B, come altre cellule del sangue, è la cellula staminale ematopoietica pluripotente del midollo osseo (HSC). Attraverso lo stadio di cellula staminale linfoide (LSC) - il precursore comune di tutti i linfociti (T e B-) - avviene la formazione di precursori dei linfociti B (pB), che poi si trasformano in linfociti B0 immaturi. Questa differenziazione avviene nel midollo osseo senza interazione con gli antigeni.
I precursori dei linfociti B si formano da cellule staminali linfoidi sotto l'influenza del microambiente delle cellule stromali del midollo osseo. Le cellule stromali supportano lo sviluppo delle cellule pB attraverso interazioni dirette cellula-cellula attraverso varie molecole di adesione cellulare (VLA-4, VCAM-1, ecc.), nonché attraverso molecole della superficie delle cellule stromali come SCF (fattore delle cellule staminali). Le cellule stromali del midollo osseo secernono anche una serie di citochine: IL-3,4,6 e IL-7, che supporta lo sviluppo delle cellule pB nelle prime fasi del loro sviluppo.
I linfociti B 0 migrano quindi attraverso il flusso sanguigno e popolano le zone indipendenti dal timo degli organi linfoidi periferici. Lì, l'ulteriore maturazione e differenziazione dei linfociti B avviene negli stadi B 1 e B 2 e acquisiscono la capacità di sintetizzare tutte le classi di immunoglobuline in risposta agli antigeni che entrano nel corpo.
Linfociti B0è una popolazione di linfociti B immunologicamente immaturi. Sulla loro superficie sono presenti solo recettori per il riconoscimento dell'antigene appartenenti alla classe IgM. Tuttavia, la densità di questi recettori per unità di superficie cellulare è molto bassa, quindi non possono garantire un'interazione efficace con l'antigene e non sintetizzano le IgM nel sangue periferico. Lo stadio B 0 corrisponde al momento della formazione dei cloni dei linfociti B. Un clone di linfociti B è un gruppo di linfociti B che presentano sulla loro superficie recettori immunoglobulinici con la stessa specificità. Allo stadio B 0 passano i linfociti B del midollo osseo selezione negativa, a seguito della quale i cloni di linfociti B autoreattivi muoiono per apoptosi o subiscono modifica del recettore, che priva i loro recettori immunoglobulinici della capacità di interagire con i propri antigeni. Questi processi sono alla base della formazione della tolleranza delle cellule B centrali.
Vengono anche chiamati linfociti B0 immaturi che lasciano il midollo osseo e vanno alla periferia linfociti B transitori. Al contatto con gli antigeni nella periferia, i linfociti B transitori funzionalmente immaturi entrano in uno stato di anergia o muoiono per apoptosi.
I linfociti B1 lo sono linfociti B naïve che non hanno ancora incontrato l'antigene, hanno un'aspettativa di vita piuttosto breve (da 5-6 giorni a 3-4 mesi). Se i linfociti B 1 naive non incontrano un antigene corrispondente alla loro specificità, muoiono, poiché non saranno in grado di diventare linfociti B 2 residenti situati nei follicoli linfoidi.
Sulla superficie dei linfociti B 1 vengono espressi simultaneamente IgM E IG D la stessa specificità antigenica, ma IG D- i recettori sui linfociti B 1 sono rappresentati in misura molto minore. Sebbene l'IgD sia un caratteristico marcatore di superficie dei linfociti B naive maturi, la sua funzione non è stata ancora chiarita, ma è stato dimostrato che la presenza di IgD è necessaria per lo sviluppo dei linfociti B e la loro risposta alla maggior parte degli antigeni. La densità delle IgM recettoriali per unità di superficie delle cellule B 1 è significativamente più alta rispetto allo stadio B 0.
Quando incontrano un antigene corrispondente alla loro specificità, i linfociti B 1 naive lo riconoscono con l'aiuto del VCR, si attivano e iniziano a proliferare, seguito dalla differenziazione in plasmacellule che sintetizzano anticorpi. Tuttavia, i linfociti B 1 possono reagire direttamente prevalentemente con antigeni timo-indipendenti con la sintesi di IgM. Linfociti B1 innescati dall'antigene- questo è già completo cellule B mature, ma non sono ancora progredite allo stadio B 2 e non sono diventate linfociti B follicolari residenti.
Linfociti B2(chiamato anche linfociti B follicolari , O Linfociti B-2 ) sono formati da linfociti B 2 innescati e si trovano principalmente nei follicoli dei linfonodi e di altri organi linfoidi, dove entrano in contatto con l'antigene presentato sulla superficie dell'APC. Successivamente proliferano per formare centri germinali del follicolo e si differenziano in plasmacellule che sintetizzano anticorpi. I linfociti B 2 sono una vasta popolazione costituita da cellule immunocompetenti mature. Sulla superficie dei linfociti B 2, l'immunoglobulina D (differenziazione) è espressa in alte concentrazioni e contiene anche recettori per il riconoscimento dell'antigene appartenenti a tutte le classi di immunoglobuline. I linfociti B 2 sono in grado di rispondere a qualsiasi antigene (sia timo-indipendente che timo-dipendente) e sintetizzare immunoglobuline di tutte le classi, che costituiscono la base della risposta immunitaria adattativa umorale secondaria. Per la loro attivazione necessitano dell'aiuto dei T-helper, la cui interazione avviene nei follicoli linfoidi sia attraverso il contatto diretto di queste cellule sia con l'ausilio delle citochine sintetizzate dai T-helper (IL-2, IFN-γ, IL- 4, IL-5, ecc.).
I segnali provenienti dalle cellule T helper inducono la commutazione degli isotipi di immunoglobuline nei linfociti follicolari B2, che garantisce la produzione di anticorpi con proprietà ottimali necessarie per combattere questo antigene. Man mano che si sviluppa una risposta immunitaria, l’affinità media degli anticorpi prodotti aumenta (un processo chiamato maturazione dell’affinità). Ciò si verifica perché nel processo di proliferazione del clone di linfociti B che risponde all'antigene, in queste cellule si verificano ipermutazioni somatiche e quindi la selezione delle varianti che legano l'antigene più efficacemente (quei linfociti B i cui BCR hanno la massima affinità per un dato antigene). epitopo delle cellule B).
I linfociti B 2 si differenziano non solo in plasmacellule che sintetizzano le immunoglobuline, ma da loro si formano e Cellule B della memoria , memorizzando informazioni sull'antigene. Le cellule B della memoria sono piccoli linfociti B di lunga durata formati da cellule B mature a seguito della stimolazione dell'antigene con la partecipazione dei linfociti T. Quando questo antigene viene reintrodotto nell'organismo, i linfociti B della memoria accelerano il riconoscimento dell'antigene, la proliferazione del corrispondente clone di linfociti B e la rapida sintesi di un gran numero di anticorpi specifici contro di esso.
I linfociti B della memoria, in assenza di antigene, possono anche trasformarsi in plasmacellule e sintetizzare anticorpi di una certa specificità, garantendo l'immunità. Pertanto, per i virus del vaiolo, della poliomielite e del morbillo, questo processo dura quasi una vita, per la tossina tetanica - solo circa 5 anni, per il bacillo della dissenteria - circa 1 mese. Il problema di potenziare l'immunogenicità e aumentare la durata della memoria immunologica è molto importante per la creazione di vaccini efficaci.
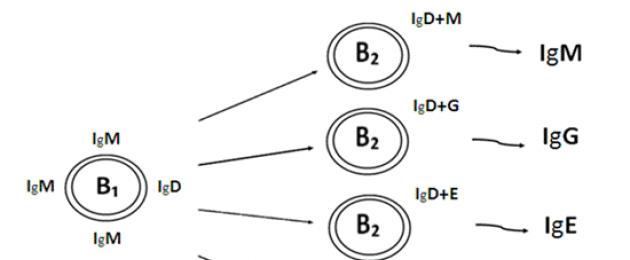
Allo stadio B 2 come risultato della differenziazione antigene-dipendente all'interno di ciascun clone di linfociti B che reagiscono alternativamente ad un dato antigene, come risultato della commutazione dei geni che codificano per la sintesi di catene pesanti di molecole di immunoglobuline, si formano quattro gruppi principali di linfociti B 2: Bm, Bg, Be, Ba, che effettuano la sintesi e la secrezione rispettivamente di IgM, IgG, IgE e IgA. Questo processo è schematicamente rappresentato in Fig. 20.

Figura 20. Differenziazione dei linfociti B2
Il primo gruppo nel processo di differenziazione è formato da un gruppo di linfociti B 2, sulla cui superficie sono presenti IgD e IgM; queste cellule sintetizzeranno le IgM per l'esportazione. Quindi, in seguito allo scambio di geni durante il processo di differenziazione, si forma un gruppo di linfociti B 2, contenenti IgD e IgG sulla superficie, che sintetizzano IgG contro un dato antigene; il terzo gruppo è formato dai linfociti B 2, che presentano sulla loro superficie IgD e IgE e sintetizzano le IgE; e, infine, il quarto - linfociti B 2 contenenti IgD e IgA sulla superficie, si differenziano in plasmacellule che sintetizzano IgA. L'IgD, contenuto sulla superficie dei linfociti B 2, ha solo una forma legata alla membrana e normalmente non viene praticamente sintetizzato per l'esportazione, quindi è contenuto in tracce nel plasma sanguigno. Il meccanismo d'azione di questa immunoglobulina non è stato ancora ben studiato, ma è stato dimostrato sperimentalmente che la sua rimozione dalla superficie dei linfociti B porta alla loro perdita della capacità di reagire agli antigeni timo-dipendenti.
Così, Quando un qualsiasi antigene (timo-indipendente o timo-dipendente) entra nel corpo, le IgM vengono sintetizzate per prime contro questo antigene nel processo della risposta immunitaria umorale, UN poi arriva la sintesi di tutte le altre classi di immunoglobuline: IgG, IgE e IgA, che fornisce una protezione efficace di tutti gli organi e tessuti del corpo.
Dalle cellule staminali e nei mammiferi adulti - solo nel midollo osseo. La differenziazione dei linfociti B avviene in più fasi, ciascuna delle quali è caratterizzata dalla presenza di determinati marcatori proteici e dal grado di riarrangiamento genetico dei geni delle immunoglobuline.
L'attività anormale dei linfociti B può essere causa di malattie autoimmuni e allergiche.
YouTube enciclopedico
1 / 5
✪ Linfociti B (cellule B)
✪ Linfociti B e linfociti T delle popolazioni CD4+ e CD8+
✪ Come i linfociti uccidono le cellule tumorali in oncologia
✪ Attivazione della risposta immunitaria
✪ Linfociti T citotossici
Sottotitoli
Parleremo dell'immunità umorale, che è associata ai linfociti B. Linfociti B, o cellule B, li disegnerò in blu. Diciamo che questo è un linfocita B. I linfociti B sono un sottoinsieme dei globuli bianchi. Si formano nel midollo osseo. B proviene dalla Borsa di Fabricius, ma non entreremo in questi dettagli. I linfociti B contengono proteine sulla loro superficie. Circa 10.000. Sono cellule straordinarie e presto vi dirò perché. Tutti i linfociti B hanno proteine sulla loro superficie che assomigliano a questa. Ne disegnerò un paio. Queste sono le proteine. Più precisamente, complessi proteici costituiti da quattro proteine separate, chiamati anticorpi legati alla membrana. Qui si trovano gli anticorpi legati alla membrana. Anticorpi legati alla membrana. Diamo un'occhiata più da vicino a loro. Probabilmente hai già sentito questa parola. Abbiamo anticorpi contro diversi tipi di influenza, così come contro diversi tipi di virus, e di questo ne parleremo più avanti. Tutti gli anticorpi sono proteine. E sono spesso chiamate immunoglobuline. Insegnare biologia amplia il mio vocabolario. Anticorpi e immunoglobuline. Significano tutti la stessa cosa e sono proteine che si trovano sulla superficie della membrana delle cellule B. Sono legati alla membrana. Di solito, quando si parla di anticorpi, si intendono gli anticorpi liberi che circolano nel corpo. E ti dirò di più su come sono fatti. E ora un punto molto, molto interessante riguardante gli anticorpi legati alla membrana e le cellule B in particolare. Sta nel fatto che ogni cellula B contiene sulla sua membrana solo un tipo di anticorpi legati alla membrana. Ogni cellula B... In questo modo, lasciamene disegnare un'altra. Ecco la seconda cellula B. Ha anche gli anticorpi, ma sono leggermente diversi. Vediamo cosa. Li disegnerò nello stesso colore e poi esamineremo le loro differenze. Quindi questo è un anticorpo legato alla membrana, questo è un altro. E queste sono due cellule B. Ed entrambi contengono anticorpi sulle loro membrane. Una e due cellule B hanno regioni variabili anticorpali che possono assumere configurazioni diverse. Potrebbero assomigliare a questo o a questo. Presta attenzione a questi frammenti. Questo e questo li evidenzierò con un colore separato. Questo frammento è invariato per tutti, lascia che sia verde ovunque. E questi frammenti sono variabili. Cioè, mutevole. E questa cella ha questo frammento variabile: lo contrassegnerò in rosa. E ciascuno di questi anticorpi legati alla membrana plasmatica ha un frammento variabile come questo. Altre cellule B contengono frammenti variabili diversi. Li contrassegnerò con un colore diverso. Ad esempio, viola. Cioè, i frammenti variabili saranno diversi. Ce ne sono un totale di 10.000 sulla superficie e ognuno di essi avrà gli stessi frammenti variabili, ma saranno diversi dai frammenti variabili di questa cellula B. Cioè sono possibili circa 10 miliardi di combinazioni di frammenti variabili. Sono 10 alla decima potenza, ovvero 10 miliardi di combinazioni di frammenti variabili. Scriviamolo: 10 miliardi di combinazioni di frammenti variabili. E qui sorge la prima domanda - e non ti ho ancora detto a cosa servono questi frammenti variabili - come nasce una così grande varietà di combinazioni? È ovvio che queste proteine - o forse non così ovvio - ma tutte queste proteine che compongono la maggior parte delle cellule sono prodotte dai geni di quella cellula. Se immagini il nucleo di una cellula, il nucleo contiene DNA. E la cellula ha un nucleo. All'interno del nucleo c'è il DNA. Se entrambe le cellule sono cellule B, presumo che abbiano un'origine comune e sicuramente lo stesso DNA? Non dovrebbero avere lo stesso DNA? Qui metto un punto interrogativo. Se condividono il DNA, allora perché le proteine che producono sono diverse le une dalle altre? Come cambiano? Ed è per questo che penso che le cellule B - e vedrai che questo vale anche per le cellule T - siano così sorprendenti perché nel processo del loro sviluppo, nel processo dell'ematopoiesi, che significa lo sviluppo dei linfociti, in uno dei Nelle fasi del loro sviluppo c'è un'intensa miscelazione di quei frammenti di DNA che codificano questi frammenti proteici. Si verifica una miscelazione intensiva. Quando parliamo di DNA, intendiamo che è necessario preservare quante più informazioni possibile e non ottenere la massima mescolanza. Tuttavia, nel processo di maturazione dei linfociti, cioè delle cellule B, in uno degli stadi della loro maturazione, avviene un deliberato rimescolamento del DNA che codifica questo e quel frammento. Questo è ciò che spiega la diversità dei diversi frammenti variabili di queste immunoglobuline legate alla membrana. E ora scopriamo perché questa diversità è necessaria. Esiste un numero enorme di microrganismi che possono infettare il nostro corpo. I virus mutano e si evolvono, proprio come i batteri. E non si sa cosa penetrerà nel corpo. Con l’aiuto delle cellule B e delle cellule T, il sistema immunitario fornisce protezione creando molte combinazioni di frammenti variabili che possono legarsi a diversi organismi nocivi. Immaginiamo che si tratti di un nuovo tipo di virus appena apparso. In precedenza, un tale virus non esisteva e ora la cellula B entra in contatto con questo virus, ma non può attaccarsi ad esso. E un'altra cellula B contatta questo virus, ma ancora una volta non succede nulla. Forse diverse migliaia di cellule B entrano in contatto con questo virus e non saranno in grado di attaccarsi ad esso, ma abbiamo una tale abbondanza di cellule B contenenti un numero enorme di combinazioni diverse di frammenti variabili sui recettori che alla fine alcune cellule B associato a questo virus. Ad esempio, questo. O questo. E crea una connessione. Sarà in grado di formare un legame con una porzione della superficie di questo virus. O con una sezione della superficie di un nuovo batterio o con qualche proteina estranea. E l'area sulla superficie di un batterio a cui si lega una cellula B, come questa, è chiamata epitopo. Epitopo. E dopo che la cellula B si è legata a un agente patogeno sconosciuto - e ricordate che altre cellule B non sono riuscite a farlo - solo questa cellula ha una combinazione specifica, una di 10 alla decima potenza. Ci sono meno combinazioni di 10 alla decima potenza. Durante il processo di sviluppo scompaiono tutte quelle combinazioni che possono legarsi alle cellule del nostro corpo, alle quali non dovrebbe esserci risposta immunitaria. In altre parole, le combinazioni che forniscono una risposta immunitaria alle cellule del corpo scompaiono gradualmente. Cioè, in realtà non ci sono 10 alla decima potenza, o, in altre parole, 10 miliardi di combinazioni di queste proteine, il loro numero è inferiore, esclude le combinazioni che possono entrare in contatto con le proprie cellule, ma il numero di combinazioni già pronte è sempre lo stesso c'è molto a che fare con il contatto con un frammento di un agente patogeno di natura virale o batterica. E una volta che una di queste cellule B si è associata a un agente patogeno, invia un segnale che è adatta per questo nuovissimo agente patogeno. Dopo essersi legato a un nuovo agente patogeno, avviene la sua attivazione. Dopo il legame con un nuovo agente patogeno, avviene l'attivazione. Diamo un'occhiata a questo in modo più dettagliato. L'attivazione, infatti, richiede il coinvolgimento delle cellule T helper, ma non entreremo nei dettagli in questo video. In questo caso siamo interessati al legame di una cellula B con un agente patogeno e diciamo che questo porta all'attivazione. Ma tieni presente che nella maggior parte dei casi sono necessarie anche le cellule T helper. E discuteremo più tardi del perché sono così importanti. Questo è una sorta di meccanismo per assicurare il nostro sistema immunitario contro gli errori. Una volta che una cellula B è stata attivata, inizia a clonare. È una coppia perfetta per il virus e inizia a clonarsi. Clona te stesso. Si divide e si riproduce. Immaginiamolo. Di conseguenza, appaiono molte varianti di questa cella. Le sue molte opzioni. Descriviamoli. E tutti hanno recettori sulla membrana. Ce ne sono anche circa diecimila. Non li disegnerò tutti, ma ne disegnerò un paio su ciascuna membrana. Quando si dividono, queste cellule si differenziano anche, cioè si dividono in base alle loro funzioni. Esistono due forme principali di differenziazione. Vengono prodotte centinaia di migliaia di tali cellule. Alcuni di essi diventano cellule di memoria. Celle di memoria. Queste sono anche cellule B che mantengono a lungo un recettore ideale con un frammento variabile ideale. Disegniamo qui un paio di recettori. Queste sono le celle della memoria... Eccole. Alcune cellule diventano celle di memoria e il loro numero aumenta nel tempo. Se questo agente patogeno ti infetta, ad esempio, tra 10 anni, avrai più di queste cellule in stock, il che significa che c'è un'alta probabilità che entrino in contatto con esso e si attivino. Alcune cellule si trasformano in cellule effettrici. Tali cellule eseguono determinate azioni. Le cellule si trasformano e diventano cellule B effettrici o plasmacellule. Queste sono fabbriche per la produzione di anticorpi. Fabbriche per la produzione di anticorpi. Gli anticorpi prodotti contengono esattamente la stessa combinazione originariamente presente sulla membrana plasmatica. Producono anticorpi, di cui abbiamo discusso, producono anticorpi. Producono un'enorme quantità di proteine che hanno la capacità unica di legarsi a un nuovo agente patogeno, questo pericoloso organismo. Hanno una capacità legante unica. Le cellule effettrici attivate producono circa 2000 anticorpi al secondo. E si scopre che improvvisamente un'enorme quantità di anticorpi penetra nei tessuti e inizia a circolare in tutto il corpo. L'importanza del sistema umorale è che con l'improvvisa comparsa di virus sconosciuti che infettano il nostro corpo, in risposta inizia la produzione di anticorpi. Sono prodotti dalle cellule effettrici, dopo le quali anticorpi specifici si legano ai virus. Lo rappresenterò in questo modo. Anticorpi specifici. Anticorpi specifici iniziano a legarsi ai virus, fornendo benefici in diversi modi. Diamo un'occhiata a loro. Innanzitutto, “contrassegnano” gli agenti patogeni per la successiva cattura. Per attivare la fagocitosi, questo processo è chiamato opsonizzazione. Opsonizzazione. Questo è il processo di "marcatura" dell'agente patogeno in modo che sia più facile per i fagociti catturarlo e assorbirlo; gli anticorpi informano i fagociti che questo oggetto è già pronto per la cattura, che questo particolare oggetto deve essere catturato. In secondo luogo, il funzionamento dei virus è complicato. Dopotutto, ai virus è collegato un oggetto abbastanza grande. Pertanto, è più difficile per loro penetrare nelle cellule. E in terzo luogo, in ciascuno di questi anticorpi ci sono due catene pesanti identiche e due catene leggere identiche. Due catene leggere. Ciascuna di queste catene ha un frammento variabile specifico e ciascuna di queste catene può legarsi a un epitopo sulla superficie del virus. E cosa succede quando uno di essi si lega all’epitopo di un virus e l’altro a quello di un altro? Di conseguenza, questi virus sembrano restare uniti e questo è ancora più efficace. Non possono più svolgere le loro funzioni. Non saranno in grado di penetrare nelle membrane cellulari e sono etichettati. Sono opsonizzati e possono essere catturati dai fagociti. Parleremo ancora delle cellule B. Mi sembra sorprendente che si creino così tante combinazioni, che risultano sufficienti per riconoscere quasi tutti i possibili organismi presenti nei nostri fluidi corporei, ma non abbiamo ancora risposto alla domanda su cosa succede quando gli agenti patogeni riescono a sopravvivere entrare nelle cellule, o quando abbiamo a che fare con cellule tumorali, e come le cellule già infette vengono distrutte.
Differenziazione delle cellule B
I linfociti B provengono da cellule staminali ematopoietiche pluripotenti, che danno origine anche a tutte le cellule del sangue. Le cellule staminali si trovano in un determinato microambiente, che ne garantisce la sopravvivenza, l'autorinnovamento o, se necessario, la differenziazione. Il microambiente determina quale percorso si svilupperà la cellula staminale (eritroide, mieloide o linfoide).
La differenziazione dei linfociti B è convenzionalmente divisa in due fasi: indipendente dall'antigene (in cui avviene il riarrangiamento dei geni delle immunoglobuline e la loro espressione) e dipendente dall'antigene (in cui avvengono l'attivazione, la proliferazione e la differenziazione in plasmacellule). Si distinguono le seguenti forme intermedie di linfociti B in maturazione:
- I primi precursori delle cellule B non sintetizzano catene pesanti e leggere di immunoglobuline, contengono geni IgH e IgL germinali, ma contengono un marcatore antigenico comune alle cellule pre-B mature.
- Cellule pro-B precoci: riarrangiamenti DJ nei geni IgH.
- Cellule pro-B tardive - riarrangiamenti V-DJ nei geni IgH.
- Grandi cellule pre-B - geni IgH riarrangiati in VDJ; il citoplasma contiene catene pesanti della classe μ ed è espresso il recettore delle cellule pre-B.
- Piccole cellule pre-B - riarrangiamenti VJ nei geni IgL; nel citoplasma sono presenti catene pesanti di classe μ.
- Piccole cellule B immature - geni IgL riarrangiati in VJ; sintetizzare catene pesanti e leggere; le immunoglobuline (recettori delle cellule B) sono espresse sulla membrana.
- Le cellule B mature sono l'inizio della sintesi delle IgD.
Le cellule B viaggiano dal midollo osseo agli organi linfoidi secondari (milza e linfonodi), dove subiscono ulteriore maturazione, presentazione dell'antigene, proliferazione e differenziazione in plasmacellule e cellule B di memoria.
Cellule B
L'espressione delle immunoglobuline di membrana da parte di tutte le cellule B consente la selezione clonale sotto l'influenza dell'antigene. Durante la maturazione, la stimolazione dell'antigene e la proliferazione, l'insieme dei marcatori delle cellule B cambia in modo significativo. Man mano che maturano, le cellule B passano dalla sintesi di IgM e IgD alla sintesi di IgG, IgA, IgE (mentre le cellule mantengono la capacità di sintetizzare IgM e IgD - fino a tre classi contemporaneamente). Quando si cambia la sintesi isotipica, la specificità antigenica degli anticorpi viene mantenuta. Si distinguono i seguenti tipi di linfociti B maturi:
- Le cellule B stesse (chiamate anche linfociti B “naive”) sono linfociti B non attivati che non sono stati in contatto con l’antigene. Non contengono corpi biliari; i monoribosomi sono sparsi nel citoplasma. Sono polispecifici e hanno una debole affinità per molti antigeni.
- Le cellule B della memoria sono linfociti B attivati che, grazie alla cooperazione con le cellule T, sono tornati allo stadio di piccoli linfociti. Sono un clone longevo di cellule B, forniscono una risposta immunitaria rapida e producono una grande quantità di immunoglobuline dopo somministrazione ripetuta dello stesso antigene. Si chiamano cellule della memoria perché permettono al sistema immunitario di “ricordare” l’antigene per molti anni dopo che la sua azione ha cessato. Le cellule B della memoria forniscono immunità a lungo termine.
- Le plasmacellule rappresentano l'ultimo stadio di differenziazione delle cellule B attivate dall'antigene. A differenza delle altre cellule B, trasportano pochi anticorpi di membrana e sono in grado di secernere anticorpi solubili. Sono cellule di grandi dimensioni con un nucleo situato in posizione eccentrica e un apparato sintetico sviluppato: il reticolo endoplasmatico ruvido occupa quasi l'intero citoplasma e anche l'apparato di Golgi è sviluppato. Sono cellule di breve durata (2-3 giorni) e vengono rapidamente eliminate in assenza dell'antigene che ha causato la risposta immunitaria.
Marcatori delle cellule B
Una caratteristica delle cellule B è la presenza di anticorpi legati alla membrana superficiale appartenenti alle classi IgM e IgD. In combinazione con altre molecole di superficie, le immunoglobuline formano un complesso ricettivo di riconoscimento dell'antigene, il recettore delle cellule B responsabile del riconoscimento dell'antigene. Sulla superficie dei linfociti B si trovano anche antigeni che riconoscono il complesso epitopo-MHC II. Il T-helper attivato secerne citochine che migliorano la funzione di presentazione dell'antigene, nonché citochine che attivano i linfociti B - induttori di attivazione e proliferazione. I linfociti B si attaccano con l'aiuto di anticorpi legati alla membrana, che agiscono come recettori, al "loro" antigene e, a seconda dei segnali ricevuti dal T-helper, proliferano e si differenziano in una plasmacellula che sintetizza anticorpi, o degenerano in cellule B della memoria. Allo stesso tempo, il risultato dell'interazione in questo sistema a tre cellule dipenderà dalla qualità e dalla quantità dell'antigene. Il meccanismo descritto è valido per antigeni polipeptidici che sono relativamente instabili all'elaborazione fagocitaria, i cosiddetti. antigeni timo-dipendenti. Per gli antigeni timo-indipendenti (che hanno un'elevata polimerità con epitopi che si ripetono frequentemente, relativamente resistenti alla digestione fagocitica e che possiedono proprietà mitogene), non è richiesta la partecipazione di un T-helper: l'attivazione e la proliferazione dei linfociti B avviene a causa dell'azione mitogenica dell'antigene attività.
Ruolo delle cellule B nella presentazione dell'antigene
Le cellule B sono in grado di internalizzare le loro immunoglobuline di membrana insieme al loro antigene associato e quindi presentare frammenti di antigene in complesso con le molecole MHC di classe II. A basse concentrazioni di antigene e durante una risposta immunitaria secondaria, le cellule B possono fungere da principali cellule presentanti l'antigene.
Celle B-1 e B-2
Esistono due sottopopolazioni di cellule B: B-1 e B-2. La sottopopolazione B-2 è costituita da linfociti B ordinari, che includono tutti i suddetti. B-1 è un gruppo relativamente piccolo di cellule B presenti negli esseri umani e nei topi. Possono costituire circa il 5% della popolazione totale delle cellule B. Tali cellule compaiono durante il periodo embrionale. Sulla loro superficie esprimono IgM e una piccola quantità (o nessuna) di IgD. Il marcatore di queste cellule è CD5. Tuttavia, non è un componente essenziale della superficie cellulare. Nel periodo embrionale, le cellule B1 emergono dalle cellule staminali del midollo osseo. Durante la vita, il pool di linfociti B-1 è mantenuto dall’attività di cellule progenitrici specializzate e non viene rifornito da cellule derivate dal midollo osseo. La cellula precursore si reinsedia dal tessuto emopoietico alla sua nicchia anatomica - le cavità addominale e pleurica - anche nel periodo embrionale. Quindi, l'habitat dei linfociti B-1 sono le cavità barriera.
I linfociti B-1 differiscono significativamente dai linfociti B-2 nella specificità dell'antigene degli anticorpi prodotti. Gli anticorpi sintetizzati dai linfociti B-1 non hanno una diversità significativa di regioni variabili delle molecole di immunoglobuline, ma, al contrario, sono limitati nel repertorio di antigeni riconosciuti e questi antigeni sono i composti più comuni delle pareti cellulari batteriche. Tutti i linfociti B-1 sono come un clone non molto specializzato, ma decisamente orientato (antibatterico). Gli anticorpi prodotti dai linfociti B-1 sono quasi esclusivamente IgM; il cambio di classe di immunoglobuline nei linfociti B-1 non è “intenzionale”. Pertanto, i linfociti B-1 sono una “squadra” di “guardie di frontiera” antibatteriche nelle cavità della barriera, progettate per rispondere rapidamente ai microrganismi infettivi che “fuoriescono” attraverso le barriere tra quelli diffusi. Nel siero di una persona sana, la parte predominante delle immunoglobuline è il prodotto della sintesi dei linfociti B-1, ad es. si tratta di immunoglobuline relativamente polispecifiche per scopi antibatterici.
linfociti B(Le cellule B, dalla bursa fabricii degli uccelli, dove furono scoperte per la prima volta) sono un tipo funzionale di linfociti che svolgono un ruolo importante nel fornire l'immunità umorale. Quando esposti all'antigene o stimolati dalle cellule T, alcuni linfociti B si trasformano in plasmacellule, in grado di produrre anticorpi. Altri linfociti B attivati diventano Cellule B della memoria. Oltre a produrre anticorpi, le cellule B svolgono molte altre funzioni: agiscono come cellule presentanti l’antigene e producono citochine ed esosomi.
Negli embrioni umani e in altri mammiferi, i linfociti B si formano nel fegato e nel midollo osseo dalle cellule staminali e nei mammiferi adulti solo nel midollo osseo. La differenziazione dei linfociti B avviene in più fasi, ciascuna delle quali è caratterizzata dalla presenza di determinati marcatori proteici e dal grado di riarrangiamento genetico dei geni delle immunoglobuline.
L'attività anormale dei linfociti B può causare malattie autoimmuni e allergiche.
Esistono diversi sottotipi di linfociti B. Funzione principale delle cellule B- partecipazione effettrice alle reazioni immunitarie umorali, differenziazione a seguito della stimolazione antigenica in plasmacellule che producono anticorpi. Lo sviluppo dei linfociti B durante il periodo postembrionale avviene nel midollo osseo. Sotto l'influenza del microambiente cellulare del midollo osseo e dei fattori umorali del midollo osseo cellula staminale linfoide Si formano i linfociti B. Le prime fasi dello sviluppo dei linfociti B dipendono dal contatto diretto con gli elementi stromali. Gli stadi successivi dello sviluppo dei linfociti B si verificano sotto l'influenza di fattori umorali nel midollo osseo.
La formazione delle cellule B nel feto avviene nel fegato e successivamente nel midollo osseo. Il processo di maturazione delle cellule B avviene in due fasi:
- antigene-indipendente,
- antigene-dipendente.
Fase antigene-indipendente. Nel processo di maturazione, il linfocita B passa attraverso lo stadio di linfocita pre-B, una cellula che prolifera attivamente e che possiede catene H citoplasmatiche di tipo C mu (cioè IgM). Lo stadio successivo, il linfocita B immaturo, è caratterizzato dalla comparsa sulla superficie di IgM di membrana (recettore). Lo stadio finale della differenziazione antigene-indipendente è la formazione di un linfocita B maturo, che può avere due recettori di membrana con la stessa specificità antigene (isotipo): IgM e IgD. I linfociti B maturi lasciano il midollo osseo e popolano la milza, i linfonodi e altri accumuli di tessuto linfoide, dove il loro sviluppo è ritardato fino a quando non incontrano il “loro” antigene, cioè il “loro” antigene. prima che avvenga la differenziazione antigene-dipendente.
Differenziazione antigene-dipendente include:
- Attivazione,
- proliferazione,
- differenziazione delle cellule B in plasmacellule e cellule B della memoria.
L'attivazione avviene in vari modi, che dipendono dalle proprietà degli antigeni e dalla partecipazione di altre cellule (macrofagi, T-helper). La maggior parte degli antigeni che inducono la sintesi di anticorpi richiedono la partecipazione delle cellule T – antigeni timo-dipendenti – per indurre una risposta immunitaria. Gli antigeni timo-indipendenti (LPS, polimeri sintetici ad alto peso molecolare) sono in grado di stimolare la sintesi di anticorpi senza l'ausilio dei linfociti T.
Linfociti B con l'aiuto dei suoi recettori immunoglobulinici riconosce e lega l'antigene. Contemporaneamente alla cellula B, l'antigene, presentato dal macrofago, viene riconosciuto dal T helper (T helper 2), che si attiva e inizia sintetizzare fattori di crescita e differenziazione. Attivato da questi fattori, il linfocita B subisce una serie di divisioni e contemporaneamente si differenzia in plasmacellule che producono anticorpi.
I percorsi di attivazione delle cellule B e la cooperazione cellulare nella risposta immunitaria a vari antigeni e con la partecipazione di popolazioni con e senza popolazioni di cellule B dell'antigene Lyb5 differiscono. L'attivazione dei linfociti B può essere effettuata:
- Antigene T-dipendente con la partecipazione delle proteine MHC classe 2 T-helper;
- Antigene T-indipendente contenente componenti mitogeni;
- attivatore policlonale (LPS);
- immunoglobuline anti-mu;
Antigene T-indipendente che non ha una componente mitogenica.
Una cellula staminale emopoietica che migra nel timo si trasforma (differenzia) sotto l'influenza del microambiente timico in un linfocita T. Scopo della differenziazione:
- insegnare il riconoscimento del materiale estraneo entrato nel corpo e la sua distruzione (cioè l'attuazione dell'effetto letale);
- creare tolleranza per gli antigeni self. Il timo svolge un ruolo importante in questi processi, poiché è l'organo in cui avviene la differenziazione antigene-indipendente delle cellule T e la creazione (generazione) di un insieme estremamente diversificato (repertorio) di recettori delle cellule T che riconoscono l'antigene.
Inizialmente, la cellula staminale emopoietica entra nella zona corticale del timo e si trasforma in un precursore precoce del linfocita T. Il fenotipo di questa cellula è il seguente: TAGRR-alfa, beta +, CD3+ CD4-, CD8-, cioè è caratterizzata dalla presenza di un recettore di riconoscimento delle cellule T, che contiene catene alfa e beta, struttura CD3, ma manca di molecole CD4 e CD8.
Inoltre, qui nella zona corticale del timo, sotto l'influenza del microambiente timico, degli ormoni timici e, soprattutto, dell'IL-7, il precursore precoce del linfocita T si trasforma in un linfocita T immaturo, il cui fenotipo è come segue: TAGRR-alfa, beta+, CD3+, CD4+, CD8+. Un insieme di tali strutture di membrana indica che questa cellula è in grado di: 1) riconoscere qualsiasi antigene utilizzando TAGRR-alfa, beta; 2) dopo il riconoscimento, trasmettono un segnale all'interno della cellula per attivarla utilizzando la struttura CD3; 3) si trasformano in cellule sia CD4+ (helper) che CD8+ (killer) durante lo sviluppo del collegamento effettore della risposta immunitaria.
Nella fase successiva della differenziazione, il precursore immaturo del linfocita T passa nel midollo del timo, dove viene completato lo stadio di maturazione timica. In questo caso si verificano due eventi importanti: 1) viene indotta tolleranza agli autoantigeni; quindi, la possibilità di sviluppare una malattia autoimmune è ridotta al minimo; 2) esiste una divisione dei linfociti T in due sottopopolazioni: CD4 + CD8- (aiutanti) e CD4-CD8 + (assassini) (non bisogna dimenticare che le molecole TAGRR-alfa, beta e CD3 sono immagazzinate sulla loro membrana) . Questa fase viene implementata anche con l'importante partecipazione di IL-7.
Lasciando il timo, i linfociti T maturi a riposo, che si trovano nella fase G(O) del ciclo cellulare, si depositano nelle zone T degli organi linfoidi periferici. Tali linfociti T sono caratterizzati dalle seguenti proprietà:
- la capacità di riconoscere antigeni estranei che gli vengono presentati sotto forma di peptide utilizzando molecole MHC di classe I e di classe II e di sviluppare la parte efferente della risposta immunitaria;
- incapacità di riconoscere la maggior parte degli antigeni autologhi, sia in forma solubile che come molecole sulla membrana cellulare. Questo è il principale ostacolo allo sviluppo di una risposta autoimmune.
Alcuni linfociti T che lasciano il timo sono ancora in grado di riconoscere gli antigeni self, ma tali linfociti T (e linfociti B) vanno incontro a divisione (distruzione) negli organi periferici o sono in uno stato di anergia (incapacità di attivare e implementare il parte efferente della risposta immunitaria).
I linfociti T helper (cellule CD4+) sono rappresentati da tre sottopopolazioni: le cosiddette. null T-helper (Tx0), che si differenziano in T-helper di tipo 1 (Tx1) e di tipo 2 (Tx2). In questa differenziazione il ruolo principale è svolto da IL-12, IL-2, interferone gamma, IL-10, IL-4, IL-5.
I linfociti T helper (cellule CD4+) sono coinvolti nel riconoscimento del peptide antigenico, che viene presentato utilizzando molecole MHC di classe P. In questo caso, è necessario un ulteriore segnale costimolatorio per attivare il linfocita T.
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0