L'endocardite infettiva (IE) è un'infezione microbica intravascolare dell'endocardio delle strutture cardiovascolari e di materiali estranei intracardiaci sul percorso del flusso sanguigno, che rimane una malattia grave e imprevedibile dal punto di vista prognostico. Il numero delle endocarditi nosocomiali, delle endocarditi del cuore operato è in aumento, le EI nei tossicodipendenti e le EI primarie negli anziani sono diventate più comuni.
I principali agenti causali dell'EI sono streptococco viridescente, stafilococchi aurei e coagulasi negativi, enterococchi.
La diagnosi di EI si basa sulle manifestazioni cliniche della malattia (febbre, soffio cardiaco, splenomegalia, vasculite periferica), confermate da un'emocoltura positiva con l'identificazione dell'agente patogeno e dai dati EchoCG (segni di distruzione valvolare, vegetazione sulle valvole e strutture sottovalvolari). Il risultato dell'infezione valvolare è la formazione di una cardiopatia nell'EI primaria (endocardite su cuore intatto) e un cambiamento nella forma del difetto nei pazienti con cardiopatia sottostante (IE secondaria). Secondo il decorso clinico, tradizionalmente si distingue l'endocardite acuta e subacuta. Le principali complicanze dell’EI sono l’insufficienza cardiaca progressiva e il tromboembolismo. Alcuni pazienti sviluppano sindromi sistemiche da complessi immunitari (glomerulonefrite, vasculite, miocardite, sierosite). Nel trattamento dell'EI, il ruolo principale è svolto dall'uso di antibiotici battericidi in cicli lunghi (4-6 settimane), solitamente in una combinazione di 2 o 3 farmaci, e dal trattamento chirurgico (sostituzione della valvola).
Parole chiave: endocardite infettiva, agenti patogeni, diagnostica ecografica, terapia antibiotica, trattamento chirurgico.
INTRODUZIONE
Nella letteratura nazionale, le prime descrizioni e studi di IE appartengono a V.I. Ilyinsky e M. Shah-Paronian (1864), A.P. Langovoi (1884), in straniero - V. Osler (1885), E. Liebman e G. Shotmuller (1910). Nel 1941 B.A. Chernogubov ha proposto il concetto di indipendenza della cosiddetta endocardite settica "protratta" rispetto alla cardiopatia reumatica, come i suoi predecessori.
L'EI è una malattia relativamente rara, l'incidenza varia da 16 a 116 casi per 1 milione di abitanti all'anno in diverse regioni. La malattia è possibile a qualsiasi età, attualmente la percentuale di pazienti in età anziana e senile è notevolmente aumentata (circa il 50%), gli uomini sono più spesso malati.
La diagnosi e il trattamento dell'EI rappresentano uno dei problemi più difficili della cardiologia moderna. La crescente refrattarietà della microflora, il processo distruttivo sull'apparato valvolare, l'insufficienza cardiaca progressiva sullo sfondo della distruzione delle valvole cardiache, il tromboembolia da vegetazioni valvolari determinano una prognosi grave della malattia (la mortalità intraospedaliera è del 16-27%). ).
Di particolare difficoltà nella gestione dei pazienti con EI sono i gruppi di pazienti con sindromi da immunodeficienza: pazienti affetti da HIV, pazienti affetti da AIDS. Sono importanti anche altre cause di ridotta immunità, disadattamento sociale, tossicodipendenza, alcolismo e uso di immunosoppressori.
DEFINIZIONE E CLASSIFICAZIONE DI IE
L'EI è un'infezione microbica intravascolare localizzata sull'endocardio delle strutture cardiovascolari e sui materiali estranei intracardiaci situati nel percorso del flusso sanguigno.
La malattia è solitamente caratterizzata dalla localizzazione dell'infezione sulla valvola, meno spesso - endocardio parietale o endotelio di grandi vasi; accompagnato dalla formazione di difetti cardiaci (rigurgito valvolare) e insufficienza cardiaca progressiva. Una percentuale significativa di pazienti presenta tromboembolia e lesioni immunocomplesse: vasculite, glomerulonefrite, sierosite.
L'IE porta alla distruzione della valvola e alla formazione di malattie cardiache.
La classificazione operativa di IE evidenzia:
Alla deriva: IE acuta e subacuta.
Corso subacuto L'IE è la più comune (circa il 90% di tutti i casi di EI). Le malattie cardiache di solito si sviluppano entro 1 mese, la durata della malattia va da 1,5 a 3-4 mesi. Nella pratica clinica, il cardiologo incontra molto spesso un decorso subacuto, quindi questa opzione sarà dettagliata nella sezione "quadro clinico della malattia". Nella letteratura nazionale ed europea si distingue anche un decorso prolungato di EI (una forma poco manifesta di EI subacuta). Questa forma della malattia può essere causata da microrganismi a bassa virulenza (streptococco, pneumococco), è caratterizzata da un decorso relativamente benigno e spesso presenta notevoli difficoltà nella diagnosi differenziale con altre malattie infiammatorie del cuore. EI protratta senza chiari segni della malattia, con subfebbre
Una temperatura elevata può essere osservata in pazienti debilitati con grave insufficienza cardiaca, epatite grave o nefrite con insufficienza renale, nei pazienti anziani.
IE acuta ha una durata massima di 1,5 mesi. Questa è sepsi con infezione valvolare. La distruzione della valvola può svilupparsi molto rapidamente - entro 7-10 giorni dalla comparsa dei primi segni della malattia, che richiede un trattamento chirurgico immediato - sostituzione della valvola interessata. La malattia è solitamente causata da una flora altamente virulenta (Staphylococcus aureus, microrganismi NASEK, Pseudomonas aeruginosa, funghi patogeni, ecc.), è grave e l'insufficienza cardiaca si sviluppa rapidamente. La prognosi è molto grave, le dosi massime dei moderni antibiotici battericidi, così come il trattamento chirurgico, non sempre aiutano, si osservano spesso ascessi miocardici, generalizzazione del processo e sviluppo di sepsi. Questa forma di EI è rara (meno del 10%).
Con la nomina anticipata della terapia antibiotica, differenze nel corso acuto E subacuto L'EI è spesso confusa, per questo gli esperti della Società Europea di Cardiologia (2004) non raccomandano di differenziare la forma acuta da quella subacuta nella diagnosi di EI.
L'IE subacuta è la più comune.
In base allo stato precedente delle strutture interessate del cuore, l'IE si distingue sulle valvole naturali, comprese quelle primarie (su valvole intatte) e secondarie (su valvole cardiache precedentemente danneggiate), e sull'IE della protesi valvolare, che è divisa in precoce ( fino a 1 anno dopo l’intervento al cuore) e tardivamente. Attualmente predomina l’EI primaria (circa il 60-80% di tutti i casi della malattia). L'EI primaria è solitamente causata da microrganismi più virulenti (Staphylococcus aureus, microrganismi NASEC, enterococco, ecc.) ed è più grave di quella secondaria. L'EI secondaria si sviluppa sullo sfondo di una malattia cardiaca già esistente: difetti cardiaci (reumatici, calcificanti degenerativi negli anziani, traumatici, congeniti), cardiomiopatia. L'EI secondaria è più spesso causata da un'infezione streptococcica ed è più lieve dell'EI primaria.
La forma predominante di EI è un processo su una valvola precedentemente invariata (IE primaria).
Esistono varianti speciali di IE:
IE tossicodipendenti;
IE parietale;
IE nell'emodialisi cronica;
EI nelle cardiomiopatie (ipertrofiche, congestizie, restrittive);
EI nosocomiale (avvenuta entro 72 ore dal ricovero o direttamente correlata a procedure invasive in un ospedale nei 6 mesi precedenti);
Presenza o assenza di IE nel passato
IE è apparso per la prima volta,
EI ricorrente o recidiva di EI (nuovo episodio di EI dopo aver risolto l'infezione in un precedente episodio di EI);
Attività di processo
L'IE attiva è caratterizzata da febbre in combinazione con la rilevazione di microrganismi nel sangue o nel materiale ottenuto durante l'intervento chirurgico,
IE posticipata (curata);
Stato diagnostico
EI affidabile (in conformità con i criteri diagnostici modificati per EI Duke, 2000),
Possibile EI (esiste una forte evidenza clinica per sospettare EI, ma il coinvolgimento endocardico non è stato ancora dimostrato o una potenziale diagnosi di EI viene presa in considerazione nella diagnosi differenziale in un paziente febbrile che non ha escluso EI);
Localizzazione di IE
IE con malattia della valvola mitrale
IE con malattia della valvola aortica
IE con malattia della valvola tricuspide
IE con malattia della valvola polmonare,
Muro IE,
Caratterizzazione microbiologica dell'EI
Tipo di agente patogeno (EI streptococcica, EI stafilococcica, ecc.).
IE con emocoltura negativa.
EI sierologicamente negativa.
IE PCR-negativo.
Gruppo di streptococchi viridescenti (S.sanguis, S.oralis, S.salivaris, S.mutans, S.milleri, Gemella morbillorum)è stato identificato da G. Schotmuller come il principale agente eziologico dell'EI all'inizio del XX secolo. L'agente eziologico rimane importante al momento attuale e spesso causa EI dopo varie manipolazioni nella cavità orale - per malattia parodontale, estrazione di denti, tonsillectomia, ecc. Tale IE di solito risponde bene al trattamento con penicilline, cefalosporine, tuttavia, negli ultimi anni, sono state trovate anche forme resistenti.
Staphylococcus aureus e coagulasi-negativi (S.epidermidis e altri), attualmente dominano tra gli agenti causali dell'EI. Di norma, si tratta di forme gravi della malattia, la selezione degli antibiotici necessari è difficile, poiché vi è una crescente incidenza di stafilococchi resistenti all'oxacillina / meticillina, spesso è necessario un trattamento chirurgico: sostituzione della valvola. Gli stafilococchi sono agenti causali comuni dell'EI nei tossicodipendenti.
L'importanza dei microrganismi gram-negativi nell'eziologia della malattia è aumentata: Escherichia coli, Pseudomonas aeruginosa, Enterobacteriaceae, Salmonella, ecc. Microrganismi NASEC (Haemophilus aprophilus, Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae), abitanti comuni delle vie respiratorie superiori dell'uomo, oggi sono molto spesso anche gli agenti causali dell'EI. Occasionalmente, di regola, con l'EI dei tossicodipendenti si osserva un'associazione polimicrobica.
Gli agenti causali più comuni dell'EI sono gli stafilococchi (aurei e coagulasi negativi) e gli streptococchi.
Studi microbiologici in IE
La varietà degli agenti causali dell'IE moderna rende piuttosto difficile il compito di isolarli dal sangue, la determinazione qualitativa dell'agente patogeno richiede competenze speciali da parte del personale medico dotato di un laboratorio microbiologico con mezzi nutritivi accumulativi, una serie di mezzi per vari microrganismi. Se si sospetta un'endocardite infettiva, le emocolture dovrebbero essere eseguite il prima possibile prima della prescrizione degli antibiotici - entro le prime 24-48 ore in conformità con le attuali raccomandazioni (American
Tabella 5.2
Gli agenti patogeni più probabili in gruppi di pazienti con EI a seconda delle situazioni epidemiologiche
(Associazione americana del cuore, 2005)
Segno epidemiologico | Agenti causativi tipici di IE |
Pazienti sottoposti a intervento chirurgico di sostituzione della valvola cardiaca meno di un anno fa (IE precoce della valvola protesica) | Stafilococchi coagulasi negativi, S.aureus, bastoncini gram-negativi aerobici, funghi, Corinebatterio |
Pazienti sottoposti a intervento chirurgico di sostituzione della valvola cardiaca più di un anno fa (IE protesica tardiva della valvola) | S.aureus, streptococchi del gruppo verde, enterococchi, funghi, gruppo NASEK |
Tossicodipendenti (uso di droghe per via endovenosa), pazienti ospedalizzati con cateteri endovenosi e altri dispositivi intravascolari | S.aureus, compresi i ceppi resistenti all'oxacillina; stafilococchi coagulasi-negativi, streptococchi I-emolitici, funghi, batteri aerobi gram-negativi, compresi Pseudomonas aeruginosa, associazione polimicrobica |
Pazienti con dispositivi intracardiaci permanenti | S.aureus, stafilococchi coagulasi-negativi, funghi, batteri aerobi gram-negativi, Corinebatterio |
Pazienti con malattie e infezioni del sistema genito-urinario, dopo interventi sul tratto genito-urinario, parto, aborto | enterococco, streptococchi di gruppo b (S.agalactiae), Listeria monocytogenes, batteri aerobi gram-negativi, Neisseria gonorrhoeae |
Pazienti con malattie croniche della pelle, comprese le infezioni | S.aureus, Streptococchi I-emolitici |
Pazienti con scarsa salute dentale dopo trattamenti dentistici | Streptococchi del gruppo verde, Abiotrofia difettosa, Granulicatella, Gemella, Gruppo NASEK |
La fine del tavolo. 5.2
Pazienti con malattie intestinali | S. bovis, Enterococcus, Closnridium septicum |
Pazienti con alcolismo, cirrosi epatica | Bartonella, Aeromonas, Listeria, S.polmonite, I - streptococchi emolitici |
Pazienti con ustioni | S.aureus, funghi, batteri aerobi gram-negativi, inclusi P.aeruginosa |
Pazienti con diabete | S.aureus, Sono streptococco emolitico S.polmonite |
Dopo essere stato morso da cani e gatti | Bartonella, Pasteurella, Capnocytophaga |
Contatto con latte contaminato e animali da allevamento infetti | Brucella, Coxiella burnetii, Erysipelothrix |
Pazienti con condizioni immunosoppressive (infezione da HIV, tumori solidi, trapianto di organi, uso a lungo termine di glucocorticoidi, citostatici) | S.aureus, Salmonella, S.polmonite, Aspergillus, Candida, Enterococcus |
Pazienti con polmonite, meningite | S.polmonite |
Associazione del cuore, 2006). La mancanza di crescita è spesso associata alle emocolture di un paziente trattato con antibiotici. Se il paziente ha già ricevuto antibiotici, le colture dovrebbero essere effettuate tre giorni dopo l'interruzione degli antibiotici a breve termine o 6-7 giorni dopo l'interruzione degli antibiotici a lungo termine, se le condizioni del paziente lo consentono.
Coltura del sangue. Per rilevare la batteriemia, si consiglia di effettuare prelievi separati di sangue venoso almeno tre volte nella quantità di 5-10 ml con un intervallo di 1 ora, indipendentemente dalla temperatura corporea. Quando viene identificato un agente patogeno, è necessario determinarne la sensibilità agli antibiotici. Poiché non tutti i microrganismi in coltura possono essere riconosciuti come l'agente eziologico dell'EI, si ritiene che entro 3 giorni il paziente debba sottoporsi a 10-12 colture e se lo stesso microbo viene isolato in 2-3 di esse, allora può essere riconosciuto come un vero patogeno. Singole semine possono essere associate a contaminazione dell'ambiente, delle mani del personale, errori nelle apparecchiature batteriologiche, ecc.
Metodi sierologici e studi PCR efficace nella diagnosi di EI causata da piante difficili da coltivare Bartonella, Legionella, Clamidia, Coxiella burnetti E Troferima.
Il rispetto delle regole raccomandate per l'emocoltura e l'uso di moderni metodi sierologici o molecolari per la rilevazione di microrganismi in caso di risultati negativi della coltura consente di determinare l'eziologia dell'endocardite infettiva nell'80-90% dei pazienti.
Tuttavia, nel 5-20% dei pazienti, l'emocoltura non è isolata. I patogeni rari dell'EI che non crescono sui terreni convenzionali o che non richiedono la diagnosi sierologica includono: Bartonella, Chlamydia, Coxiella burnetii, Brucella, Legionella, Tropheryma whippleii, Nocardia, Non- Candida funghi (Aspergillo). Con un’emocoltura negativa, la malattia può essere più grave e la sua prognosi è molto peggiore rispetto ai pazienti con un’emocoltura nota.
PATOGENESI
L'EI dovrebbe essere considerata una malattia indipendente e non una manifestazione particolare della sepsi. Alla luce della teoria della “cascata settica” (H.S. Warren, 1999), la malattia esordisce come un problema valvolare
infezione seguita dall'inclusione di infiammazione sistemica e con generalizzazione alla sepsi nelle forme acute. La ragione principale del decorso acuto dell'EI è l'elevato numero e la virulenza dei batteri. Allo stesso tempo, nell'EI acuta e subacuta, l'immunocompromissione può fungere da sfondo sul quale si sviluppa più facilmente una malattia infettiva (pazienti con alcolismo cronico, tossicodipendenti, pazienti con infezione da HIV, pazienti con cirrosi epatica e altri).
Infezione iniziale dell'endocardio ha origine dal flusso sanguigno durante la batteriemia. L'ingresso di microrganismi nel flusso sanguigno è facilitato da: cattive condizioni dei denti, lesioni e infezioni della pelle, processi suppurativi, ustioni, infezioni focali, malattie infiammatorie croniche o tumori dell'intestino, organi del sistema genito-urinario, tossicodipendenza ( somministrazione di farmaci per via endovenosa). La batteriemia iatrogena si osserva nelle procedure dentistiche e in altre procedure mediche invasive, in particolare nella chirurgia a cuore aperto, nei cateteri endovenosi e nei dispositivi intracardiaci e nell'emodialisi. Spesso l'EI, soprattutto subacuta, causata dalla flora gram-positiva, si sviluppa a causa di una batteriemia transitoria senza "porte" visibili dell'infezione.
La colonizzazione iniziale dell'endocardio nella batteriemia è presumibilmente facilitata da due condizioni: 1) microdanneggiamenti meccanici dell'endotelio, che portano al contatto diretto del sangue con le strutture subendoteliali e causano la deposizione di minuscoli coaguli di sangue nei siti di danno, a cui i batteri, in particolare gli streptococchi sono attaccati; I batteri fissati in fibrina attirano i monociti e inducono da parte loro la produzione di fattore tissutale e citochine, questi mediatori attivano le piastrine, la cascata della coagulazione e la produzione di citochine, integrine e fattore tissutale da parte delle cellule endoteliali adiacenti, provocando la crescita di vegetazioni trombotiche infette. 2) infiammazione locale, che promuove l'espressione di N-integrine da parte delle cellule endoteliali, che legano la fibronectina plasmatica e facilitano la fissazione sull'endotelio di agenti patogeni che presentano proteine leganti la fibronectina sulla superficie, come lo Staphylococcus aureus. In risposta all'invasione batterica, le cellule endoteliali producono fattori tissutali e citochine, tra cui la coagulazione del sangue, la diffusione dell'infiammazione e la formazione di vegetazioni infette; batteri, che secernono proteine attive di membrana, lisano
avvolgono le cellule endoteliali. La tromboendocardite non infettiva - microtrombi sull'endocardio - si forma più spesso in luoghi di microtraumi emodinamici associati a determinati disturbi emodinamici nei difetti cardiaci. L'EI può verificarsi in assenza di qualsiasi patologia cardiaca pregressa, ma il rischio di EI è molto più elevato tra i pazienti con difetti cardiaci, EI, protesi valvolari e sottoposti a chirurgia cardiaca ricostruttiva, prolasso della valvola mitrale, cardiomiopatia ipertrofica.
Nei casi di EI primaria, vengono prese in considerazione le seguenti possibilità per lo sviluppo di tromboendocardite non infettiva. Nei pazienti anziani e senili, i cambiamenti degenerativi calcifici nelle valvole mitrale e aortica e i disturbi legati all'età nell'omeostasi reologica svolgono un ruolo importante. Per i pazienti giovani vengono considerate condizioni riprodotte sperimentalmente in cui, a causa dell'ipercoagulazione, è possibile la formazione di trombi in vari distretti del sistema cardiovascolare e, in particolare, sull'endocardio valvolare; tali condizioni sono stress (sforzo fisico, freddo, psico-emotivo), disadattamento sociale, che comprende, insieme alle violazioni dell'alimentazione, dell'igiene e le suddette condizioni stressanti).
Le proprietà dei microrganismi che determinano la loro capacità di aderire ai microtrombi, così come la loro resistenza all'attività battericida del siero, sono uno dei motivi della predominanza dei singoli microrganismi nella struttura eziologica dell'EI.
Insufficienza cardiaca nell'IE caratterizzato da:
Formazione sulla superficie dell'endocardio "vegetazione" contenente piastrine, fibrina, eritrociti, cellule infiammatorie e colonie di microrganismi. La riproduzione dei microrganismi nelle vegetazioni, causando un'ulteriore crescita delle vegetazioni, per ragioni sconosciute, va oltre il controllo dei meccanismi di difesa antinfettivi dell'organismo e senza trattamento antibiotico o chirurgico l'endocardite progredisce portando alla morte del paziente.
Man mano che IE progredisce, ci sono ulcerazione, rotture, distruzione di valvole, nonché diffusione dell'infezione ad altre strutture del cuore: ascessi di aree adiacenti del miocardio e anello fibroso della valvola, aneurisma del seno di Valsalva, formazione di fistole intracardiache.
Questi cambiamenti patologici portano a rigurgito valvolare(acuto o subacuto), lo sviluppo di insufficienza cardiaca nella maggior parte dei pazienti in diversi periodi della malattia e l'emergere di nuovi disturbi di conduzione con il coinvolgimento delle vie.
Il tasso di sviluppo e il grado dei processi distruttivi in IE non hanno analoghi. Nell'EI acuta le strutture valvolari vengono distrutte in pochi giorni, tanto da rendere necessario un trattamento chirurgico immediato, altrimenti il paziente muore per grave insufficienza cardiaca. Nell'EI subacuta, il processo di formazione dell'insufficienza valvolare (con un alto grado di rigurgito) è più lento: un mese o più. Morfologicamente l'EI è descritta come poliposi-ulcerativa (Fig. 5.1, vedi inserto). Con il regresso del processo infiammatorio-distruttivo le vegetazioni microbiche vanno incontro a fibrosi e calcificazione, ma anche in questa fase sono possibili complicanze tromboemboliche o embolie con frammenti di vegetazioni calcificate.
Manifestazioni extracardiache dell'EI
Il decorso della malattia è caratterizzato infiammazione sistemica e intossicazione settica, spesso accompagnata da lesioni multiorgano non cardiache, secondarie e associate allo sviluppo patologia immunocomplessa O complicanze tromboemboliche, nonché infezioni metastatiche e setticemia.
Tornando alla teoria della "cascata settica", è necessario chiarire che i suoi fattori scatenanti sono considerati le endotossine di microrganismi gram-negativi e i lipopolisaccaridi cellulari di batteri e funghi gram-positivi. Stimolano il rilascio di mediatori dell'infiammazione come il fattore di necrosi tumorale, le interleuchine, le chinine. Questi mediatori danneggiano l'endotelio, favoriscono la stasi del sangue a livello dei capillari, agiscono come vasocostrittori o vasodilatatori, contribuendo alla formazione di una sindrome infiammatoria sistemica.
Un’ampia gamma di lesioni extracardiache nell’EI è dovuta a meccanismi immunopatogenetici. L'ingresso massiccio di antigeni batterici nel sangue durante l'EI porta all'attivazione policlinale (stimolazione) dei linfociti B. Nella milza iperplastica c'è una formazione attiva di centri germinali, che corrisponde ai processi di proliferazione e
differenziazione dei linfociti B durante lo sviluppo della risposta umorale timo-dipendente. Un aumento del numero di plasmacellule nel sangue e nel midollo osseo indica anche l'attivazione del collegamento B. Viene attivata anche la sintesi delle immunoglobuline, in particolare M. Gli anticorpi contro l'agente patogeno costituiscono circa il 15% degli anticorpi formati (Miller N., 1978). Tra gli altri, viene rilevato il fattore reumatoide, la crioglobulemia di tipo misto è osservata nel 90% dei pazienti con EI. Una conseguenza importante della produzione attiva di anticorpi è la formazione di complessi immuni circolanti (CIC), che secondo vari dati vengono rilevati nel 50-100% dei pazienti con EI. Tali manifestazioni extracardiache dell'EI come sierosite, vasculite cutanea e glomerulonefrite costituiscono la triade classica della patologia immunocomplessa. Nell'EI esistono inoltre i presupposti per l'insorgenza sia di ipercoagulabilità sistemica (attivazione del sistema di coagulazione da parte di endotossine batteriche, CEC e danno alle strutture valvolari) che di manifestazioni emorragiche.
La batteriemia + i cambiamenti nell'endotelio (cuore e vasi sanguigni) sono i prerequisiti per l'insorgenza dell'EI.
QUADRO CLINICO
I cardiologi hanno maggiori probabilità di incontrare IE primaria subacuta, la cui clinica sarà descritta in modo più dettagliato.
L’EI subacuta è una malattia polimorfica, che rende la diagnosi estremamente difficile. Le manifestazioni cliniche dell’EI presentano diverse combinazioni di sintomi:
Batteriemia e infiammazione sistemica;
Segni di endocardite;
embolia periferica;
Lesioni vascolari e d'organo immunocomplesse. La malattia può svilupparsi sullo sfondo della batteriemia dopo o durante
momento dell'estrazione di un dente, mal di gola, malattia respiratoria, foruncolosi, panaritium, tonsillectomia, cistoscopia, interventi ginecologici o senza motivo apparente in completa salute.
Caratterizzato da febbre di tipo sbagliato, che dura per settimane, anche con dosi moderate di antibiotici, accompagnata da brividi che vanno dal travolgente alla mera sensazione
freddezza, pelle d'oca sulla schiena. Se si sospetta l'EI, si raccomanda la termometria ogni 3 ore durante il giorno, poiché si possono osservare "candele" di temperatura a breve termine. In alcuni pazienti con EI, la temperatura può essere subfebbrile e persino normale (pazienti con grave insufficienza circolatoria, glomerulonefrite cronica, insufficienza renale, pazienti anziani e senili).
In esame: pelle pallida, eruzioni petecchiali emorragiche sulla pelle, emorragie subungueali. Nei pazienti non trattati a lungo termine si osserva un sintomo di "dita a tamburo", molto più spesso - i cosiddetti "occhiali da orologio" - il rigonfiamento delle unghie sulle mani. Molto tipiche dell'EI sono le emorragie della piega anteriore della congiuntiva - macchie di Lukin - una sindrome quasi patognomonica dell'EI o della sepsi generalizzata. Raramente si riscontrano estese emorragie nel tessuto adiposo sottocutaneo - macchie di Janevie, con oftalmoscopia nel fondo - macchie di Roth. Sotto la pelle, soprattutto sulla superficie palmare delle mani, noduli di Osler densi, violacei e dolorosi al tatto. Il danno articolare è più comune sotto forma di artralgia o raramente - artrite a rapida transizione delle articolazioni medie e piccole delle estremità.
Con il decorso attivo dell'EI si nota una rapida perdita di peso dei pazienti, a volte di 4-6 kg a settimana (in assenza di un trattamento adeguato).
I sintomi "periferici" elencati dell'EI negli ultimi anni sono piuttosto rari, il che è associato all'inizio precoce del trattamento antibiotico per varie condizioni febbrili, inclusa l'EI. Tuttavia, dovrebbero essere ricercati con perseveranza, poiché la maggior parte di essi ha un grande valore diagnostico nella "febbre di origine sconosciuta".
La sconfitta dell'endocardio è la principale nel quadro clinico dell'EI. Nel decorso subacuto primario della malattia, i segni di cardiopatia, nella maggior parte dei casi insufficienza aortica, compaiono già nella 3a settimana di malattia. Si comincia a sentire un soffio proto-diastolico sull'aorta e nel punto Botkin, che diventa più grossolano in un breve periodo di tempo. Il rumore amplifica con un'inclinazione del paziente avanti, alle mani alzate. Di solito è presente anche un soffio sistolico, che si associa alla presenza di ampie vegetazioni sulle valvole. Con la formazione di malformazioni aortiche possono comparire improvvisamente rumori con perforazione delle valvole.
La comparsa di pressione sanguigna "aortica" (alta sistolica e bassa diastolica) può coincidere con un'insufficienza ventricolare sinistra in rapido sviluppo (asma cardiaco, edema polmonare) con danno all'IE della valvola aortica. Significativamente prima rispetto ai difetti reumatici compaiono altri segni vascolari di insufficienza aortica: "danza della carotide", doppio tono di Traube, rumore di Vinogradov-Durozier, rumore di Flint. Tutti questi sintomi sono solitamente accompagnati da una grave distruzione della valvola aortica.
Quando la valvola mitrale è danneggiata, si verifica un nuovo soffio da rigurgito mitralico. Con vegetazioni relativamente grandi sulla valvola mitrale si può osservare un restringimento dell'orifizio mitralico, soprattutto nell'endocardite secondaria, dove si è già verificata una stenosi reumatica. Il soffio da rigurgito può diventare particolarmente aspro con avulsione dei lembi o rottura delle corde su qualsiasi valvola cardiaca interessata.
La formazione di un difetto con un "nuovo" soffio da rigurgito valvolare è la principale nella clinica IE.
Nell'EI secondaria, sullo sfondo della cardiopatia reumatica esistente, viene prestata attenzione alla rapida progressione della malattia cardiaca sullo sfondo della febbre alta.
La diagnosi di EI parietale, ascessi valvolari, fistole miocardiche purulente è particolarmente difficile. Molto spesso, l'endocardite parietale si verifica sullo sfondo della marantica negli anziani, con neoplasie maligne con metastasi, sullo sfondo della sepsi generalizzata. La diagnosi di endocardite parietale e di ascessi valvolari è migliorata significativamente con l'introduzione dell'ecocardiografia transesofagea nella pratica clinica.
Il danno miocardico in un modo o nell'altro viene rilevato morfologicamente in tutti i casi di EI, ma spesso non si osserva un quadro clinico dettagliato della miocardite, di solito con la cosiddetta variante "immunologica" della malattia. Con lo sviluppo precoce della miocardite, si verifica una rapida espansione delle cavità cardiache. Segni di insufficienza circolatoria (palpitazioni, mancanza di respiro, gonfiore delle gambe, attacchi d'asma) con un apparato valvolare relativamente intatto possono essere associati a miocardite. C'è una sordità dei toni cardiaci, che si allunga PQ fino al blocco A-V completo, extrasistoli,
raramente - fibrillazione atriale. Nel sangue si trova un alto livello di LDH-1, CPK, MB-CPK, mioglobina.
Le lesioni pericardiche con un quadro clinico pronunciato nell'EI sono rare, sebbene gli studi ecocardiografici mostrino in molti pazienti piccole pericarditi essudative (300-400 ml di liquido) e scompaiano rapidamente con la terapia antibiotica. A volte sopra lo sterno è possibile ascoltare lo sfregamento della pericardite. Con gli ascessi miocardici si può sviluppare una pericardite essudativa purulenta, che aggrava bruscamente il decorso della malattia e può richiedere un trattamento chirurgico urgente.
Un segno frequente di EI, anche all'esordio della malattia, è il tromboembolismo (reni, milza, arti e vasi mesenterici), accompagnato da complicanze gravi, talvolta fatali. Il tromboembolismo delle arterie coronarie è raro, il che è associato alle peculiarità del riempimento delle arterie coronarie in diastole, ma nell'EI si verificano infarti miocardici embolici.
Il tromboembolismo è un sintomo comune dell’EI anche all’esordio della malattia.
Le lesioni vascolari sono molto caratteristiche dell'EI. Si tratta di vasculiti cutanee, così come di noduli di Osler (vasculite con aneurisma vascolare, vegetazione microbica al suo interno, successivo sviluppo di un microaneurisma vascolare, sua rottura). I noduli di Osler sono più spesso localizzati sulla superficie palmare delle mani, sugli stinchi. Particolarmente pericolosi sono gli aneurismi micotici delle arterie nei vasi cerebrali con una possibile rottura dell'aneurisma e lo sviluppo di un ictus con una clinica di paralisi improvvisa e coma cerebrale con esito fatale, fino a tagli transitori, paralisi, linguaggio a breve termine disturbi, ecc.
Complicanze neurologiche (ictus embolici, emorragie subaracnoidee, ascessi cerebrali, ecc.) si osservano nel 5-19% dei casi di EI. Raramente si verificano meningiti purulente, encefaliti, tromboembolie dell'arteria retinica centrale con cecità improvvisa.
Con EI sulla valvola tricuspide (più spesso "endocardite da tossicodipendente"), si osservano embolia polmonare, polmonite infartuale con emottisi, ascessi polmonari multipli, polmonite "settica" (Fig. 5.2, vedere inserto).
Spesso il fegato è colpito nell'EI subacuta: infarti epatici con dolore intenso e ittero o senza pronuncia
manifestazioni cliniche, epatite di origine tossica o immunologica. Il fegato è solitamente ingrossato, denso, doloroso. Le frazioni di bilirubina, transaminasi, fosfatasi alcalina aumentano, le frazioni proteiche cambiano. Il danno epatico può dipendere dalla terapia antibiotica (cefalosporine, vancomicina). In questo caso, la sospensione degli antibiotici porta ad una rapida normalizzazione della funzionalità epatica, ma la decisione di sospenderli sullo sfondo dell'endocardite attuale rappresenta sempre un problema terapeutico.
L'ingrossamento della milza è uno dei sintomi più importanti dell'EI, ma ci sono pazienti senza ingrossamento della milza. Gli infarti embolici si trovano spesso nel tessuto della milza, e quindi i pazienti lamentano un forte dolore nell'ipocondrio sinistro, a volte la pleurite del lato sinistro si sviluppa con un infarto della milza, è possibile la rottura spontanea della milza.
Il coinvolgimento della milza e del fegato sono manifestazioni comuni dell'EI.
La glomerulonefrite da immunocomplessi era considerata classica per l'EI. Attualmente è meno comune e procede in modo benigno. Di norma, con la cura dell'EI si verifica una guarigione o una remissione a lungo termine della glomerulonefrite. Uno scarso valore prognostico è stato occasionalmente osservato nell'EI (secondo i nostri dati, nel 2,3% dei pazienti) glomerulonefrite subacuta (proliferativa extracapillare) con insufficienza renale irreversibile rapidamente progressiva. Anche l’aminoidosi renale è rara.
Quasi la metà dei pazienti con EI sviluppa sindromi sistemiche da complessi immunitari (sierosite, glomerulonefrite, artrite, miocardite)
In assenza di una terapia adeguata e tempestiva per l’EI, di solito si verifica una generalizzazione del processo con danni a molti organi e sistemi.
FORME SPECIALI DI IE
Nell'ultimo decennio si sono diffuse "nuove" forme di IE. Questa è "endocardite da tossicodipendenti", causata da stafilococchi o microflora gram-negativa. Procede gravemente, molto spesso colpisce la valvola tricuspide (sebbene sia possibile
sconfitta e altre valvole), complicata da tromboembolia polmonare, ascessi polmonari, ha spesso un decorso ricorrente.
Tabella 5.3
Situazioni cliniche per sospettare un'endocardite infettiva
Le principali situazioni che consentono di sospettare IE: |
Febbre inspiegabile da più di 1 settimana + soffio di rigurgito (soprattutto quelli nuovi). Febbre inspiegabile da più di 1 settimana + nuovi sintomi di insufficienza cardiaca. Febbre inspiegabile da più di 1 settimana + manifestazioni tipiche sulla pelle (noduli di Osler, macchie di Janevier) e congiuntiva (macchie di Lukin). Febbre inspiegabile + emocoltura positiva (con un agente patogeno caratteristico dell'EI). Febbre inspiegabile per più di 1 settimana in pazienti a rischio di EI (difetti cardiaci, protesi valvolari o altre strutture intracardiache, tossicodipendenti per via parenterale). Febbre inspiegabile per più di 1 settimana associata a procedure recenti che possono causare batteriemia (l'intervallo tra la procedura e la comparsa della febbre è inferiore a 2 settimane). Sepsi di origine sconosciuta |
Situazioni particolari che sollevano il sospetto di IE: |
Tromboembolia di origine sconosciuta. Ictus inspiegabili o emorragia subaracnoidea nei giovani. Ascessi polmonari multipli nei tossicodipendenti. Ascessi periferici ad eziologia sconosciuta (ascessi renali, milza, corpi vertebrali, endoftalmite endogena). Febbre inspiegabile per più di 1 settimana + per la prima volta ha sviluppato disturbi della conduzione atrioventricolare e ventricolare. Valvola protesica + nuova disfunzione protesica |
Situazioni che richiedono la considerazione dell'IE in differenziale diagnosi |
Glomerulonefrite acuta o rapidamente progressiva. Febbre inspiegabile da più di 1 settimana + dolore alla parte bassa della schiena. Ematuria + mal di schiena, sospetto infarto renale. Vasculite emorragica |
È stato identificato un ampio gruppo di endocarditi “nosocomiali” associate ad attività mediche: endocarditi di protesi valvolari, con scarsa cura delle cannule endovenose con infusioni a goccia, con emodialisi cronica, con posizionamento di pacemaker artificiale, dopo bypass aortocoronarico, ecc. L'intero gruppo di EI, poiché di norma è causato da flora non streptococcica, è difficile, è difficile da trattare con antibiotici. Con lo sviluppo dell'ecocardiografia, l'endocardite con cardiomiopatia ipertrofica e EI parietale ha cominciato a essere rilevata più spesso.
È aumentato significativamente il numero di pazienti con EI negli anziani e nell'età senile. L'IE in questa fascia di età può essere in parte nosocomiale.
La clinica di IE degli anziani e dell'età senile ha parecchie caratteristiche. Molto presto, a volte nelle prime settimane della malattia, l'insufficienza cardiaca progredisce, più spesso si osserva l'effetto cardiotossico degli antibiotici. La diagnosi di EI è difficile, poiché a questa età si verificano numerose malattie che si manifestano con febbre alta e intossicazione. Non sono rare le combinazioni tra EI e queste malattie (endocardite e tumori del colon, del pancreas, endocardite e pielonefrite, endocardite e colite ulcerosa poliposa, EI e mieloma, EI e malattie linfoproliferative). In questo gruppo di pazienti si osservano più spesso complicanze tromboemboliche (dei vasi cerebrali), rotture di aneurismi micotici e stati psicotici.
Forme particolari di EI: nei tossicodipendenti (valvola tricuspide), su protesi valvolari, nell'emodialisi cronica, nell'anziano.
DIAGNOSI DI LABORATORIO
La diagnosi batteriologica è dettagliata nella sezione «L'eziologia di IE». Va sottolineato che un'emocoltura non rilevata non esclude la diagnosi di EI.
Nel sangue, il numero dei leucociti è spesso aumentato, ma può essere normale. Nella formula dei leucociti si osserva uno spostamento graduale verso i mielociti. La diminuzione del contenuto di emoglobina ed eritrociti è caratteristica e ha il valore prognostico.
La VES è solitamente aumentata a 50-70 mm / ora, sebbene nei pazienti con difetti cardiaci congeniti di tipo "blu" con grave insufficienza cardiaca congestizia, a volte con glomerulonefrite con grave insufficienza renale, la VES può essere normale o bassa. Possibile trombocitopenia o trombocitosi. Proteina C-reattiva positiva, il cui livello riflette l'attività dell'IE. Il livello delle α2 e γ-globuline è aumentato. Potrebbe esserci una reazione Wasserman falsa positiva e questo crea alcune difficoltà diagnostiche.
Viene determinato un livello elevato di IgM e IgG, le frazioni del complemento C3 e C4 vengono ridotte. Il livello del CIC è solitamente elevato, ma con risultati favorevoli del trattamento si osserva una sua diminuzione.
Negli esami delle urine con febbre alta - albuminuria, con infarto renale - ematuria. Con lo sviluppo della glomerulonefrite diffusa - albuminuria persistente, cilindri ialini e granulari, eritrocituria con eritrociti freschi e alterati. Forse una diminuzione della filtrazione glomerulare, un aumento del contenuto di urea e creatinina nel sangue.
Una emocoltura negativa non esclude la diagnosi di EI.
DIAGNOSI ECOCARDIOGRAFICA
Il principale metodo strumentale per la diagnosi di EI è l'ecocardiografia transtoracica o transesofagea. Il ruolo dell'ecocardiografia è quello di cercare vegetazioni, che di solito sono formazioni ecopositive aggiuntive di varie forme, dimensioni e densità attaccate a valvole, corde o altre parti dell'endocardio, che di solito galleggiano lungo la corrente e sono caratterizzate da un movimento caotico e ad alta velocità (Fig. 5.3 (vedi inserto), Fig. 5.4), valutando la disfunzione valvolare, individuando la diffusione dell'infezione all'esterno dell'apparato valvolare.
Ecocardiografia transtoracica (TTE) raccomandato per tutti i pazienti con sospetta EI. Di importanza diagnostica è l'identificazione di vegetazioni associate all'endocardio valvolare o parietale, soprattutto quando localizzate in luoghi tipici (lungo la traiettoria del flusso rigurgito) o associate a materiale protesico impiantato senza altre caratteristiche anatomiche
Riso. 5.4. Ecocardiografia transtoracica in un paziente con EI. Vegetazioni calcificate multiple (indicate dalle frecce) su tutti i lembi della valvola aortica
spiegazioni; ascessi o fistole intracardiaci; nuova insufficienza valvolare; difetto della nuova protesi valvolare. Nell'EI, le valvole mitrale e aortica sono più spesso colpite, ma nei tossicodipendenti sono colpite anche la valvola tricuspide e, occasionalmente, la valvola polmonare.
Ecocardiografia transesofagea (TEE) ha un'elevata sensibilità per il rilevamento di vegetazioni e ascessi ed è indicato per EI di protesi valvolari, con esito negativo di TTE in pazienti con elevata probabilità clinica di EI e complicanze di EI.
TTE e TPE possono dare risultati falsi negativi se le vegetazioni sono piccole o se si verifica un distacco della vegetazione con embolia. La capacità dell’ecocardiografia di predire la tromboembolia è limitata. Il rischio maggiore si verifica con vegetazioni mobili di grandi dimensioni (più di 10 mm) sulla valvola mitrale anteriore.
Indicazioni per studi ecocardiografici ripetuti:
TPE dopo TTE positiva in pazienti ad alto rischio di complicanze;
TPE 7-10 giorni dopo il primo TPE se l'EI rimane sospettata o se il decorso clinico è allarmante durante il trattamento precoce dell'EI. In alcuni casi, le vegetazioni si sono ingrandite e sono diventate visibili a questo punto, oppure possono apparire ascessi o fistole. Un aumento delle dimensioni delle vegetazioni dopo la riregistrazione, nonostante un'appropriata terapia antibiotica, è associato ad un aumento del rischio di complicanze e della necessità di un intervento chirurgico;
Peggioramento inspiegabile dei sintomi dell’insufficienza cardiaca, alterazione del soffio cardiaco, nuovo blocco atrioventricolare o aritmia;
Lo studio ecocardiografico dinamico (con una frequenza di 10-14 giorni) consente di monitorare le dimensioni e la densità acustica della vegetazione, diagnosticare complicanze. A fronte del trattamento in corso, la dimensione della vegetazione può diminuire fino alla scomparsa della vegetazione, e la densità acustica può aumentare man mano che si organizzano.
L'ecocardiografia è il metodo principale per individuare la vegetazione sulle valvole cardiache e le conseguenze devastanti dell'EI (perforazioni dei lembi, rotture delle corde, fistole e ascessi).
CRITERI PER LA DIAGNOSI
La diagnosi di EI acuta si basa sull'identificazione dei sintomi di sepsi e dei segni di malattia della valvola cardiaca. La clinica per la sepsi è brillante e dimostrativa, il tasso di distruzione valvolare nell'EI acuta è elevato - 7-10 giorni, quindi di solito non ci sono grossi problemi diagnostici. Inoltre, nella maggior parte dei casi di EI acuta, le "porte" dell'infezione sono note.
I principali sintomi e segni della sepsi sono: febbre frenetica o persistente (39-40°C) e oltre, accompagnata da brividi e sudorazione profusa; grave condizione generale del paziente a causa di intossicazione; sviluppo frequente di DIC; splenomegalia; setticopiemia; emocoltura positiva, spesso già sullo sfondo della terapia antibatterica; insufficienza vascolare; la presenza di una "porta" di infezione. Negli esami del sangue: anemia, VES bruscamente aumentata, leucocitosi con un forte spostamento a sinistra (fino ai mielociti), granularità toxogenica, trombocitopenia. Può anche determinare
condividono uno stato di immunodeficienza, secondaria nella maggior parte dei casi, con diminuzione delle immunoglobuline, depressione del sistema T, alterata fagocitosi. L'ecocardiografia rivela una distruzione rapidamente progressiva della valvola interessata, un alto grado di rigurgito nell'ecocardiografia Doppler. Il processo potrebbe non essere limitato alle valvole; è possibile sviluppare pericardite purulenta, ascessi e fistole purulente nel miocardio. Il decorso della malattia è brillante, evidente e, anche in assenza di sindromi da complesso immunitario periferico (sono meno frequenti nelle forme acute di EI), la diagnosi viene fatta abbastanza rapidamente. Non è necessario fare riferimento ai criteri diagnostici nei casi di EI acuta da parte di un medico esperto.
La diagnosi di EI acuta si basa sull'identificazione dei sintomi di sepsi e di malattia della valvola cardiaca.
Al contrario, la diagnosi di EI subacuta è un compito estremamente difficile. La malattia in questa variante è clinicamente polimorfa, i segni ecocardiografici (vegetazione microbica, rigurgito, distruzione valvolare, ecc.) possono essere assenti nelle prime 4-6 settimane di malattia. La fonte dell’infezione non è sempre evidente o difficile da associare al quadro clinico. Diverse sindromi di EI subacuta possono emergere e influenzare negativamente la direzione della ricerca diagnostica. Ad esempio, i sintomi della glomerulonefrite possono fungere da “maschera” renale per l’EI.
Di seguito sono riportati i criteri per l'IE DUKE (Duke Endocarditic Service, USA, 1994), adottati nei paesi di lingua inglese, la loro modifica proposta da V.P. Tyurin nel 2001, nonché i criteri per la diagnosi di EI subacuta, sviluppati presso il Dipartimento di Terapia della Facoltà dell'Università Medica Statale Russa nel 1992.
Si propone di prendere in considerazione la diagnosi di EI subacuta: "autentico- con una combinazione di 2 criteri clinici principali con 1 aggiuntivo e almeno 2 paraclinici; "probabile- con una combinazione di 2 criteri principali, di cui uno è il soffio da rigurgito, con 1 aggiuntivo anche in assenza di conferma paraclinica; "possibile- con una combinazione di criteri clinici e paraclinici di base e aggiuntivi, ma senza rumore di rigurgito e presenza di criteri ecocardiografici, mentre non sono escluse altre aree di ricerca diagnostica.
Tabella 5.4
Criteri diagnostici per Duke IE (modificati da J. Li, approvati dall'American Heart Association nel 2005)
Alterazioni patologiche: vegetazioni o ascessi intracardiaci, confermati dall'esame istologico, che hanno rivelato endocardite attiva.
B. Criteri clinici:
OTTIMI CRITERI
o NASEKgroup O Staphylococcus aureus,
Endocardite infettiva accertata |
A. Segni patologici: Microrganismi rilevati durante l'esame batteriologico o istologico di vegetazioni, emboli o campioni di ascessi intracardiaci, Alterazioni patologiche: vegetazioni o ascessi intracardiaci, confermati dall'esame istologico, che hanno rivelato endocardite attiva. Per la diagnosi è sufficiente identificare uno dei criteri sopra indicati. B. Criteri clinici: due criteri maggiori, oppure uno maggiore e tre minori, oppure cinque criteri minori |
Possibile endocardite infettiva |
Un criterio maggiore e uno minore oppure tre criteri minori |
Endocardite infettiva esclusa |
Una diagnosi alternativa indubbia che spiega i sintomi della malattia, La scomparsa dei sintomi dell'endocardite infettiva durante il trattamento antibiotico in meno di 4 giorni, Assenza di evidenza patologica di endocardite infettiva all'intervento o all'autopsia con terapia antibiotica da meno di 4 giorni, Numero insufficiente di criteri per probabile endocardite infettiva sopra elencati |
Criteri clinici per l'endocardite infettiva |
OTTIMI CRITERI |
1. Emocoltura positiva: Tipici agenti patogeni dell'EI isolati da due campioni di sangue separati: Streptococchi viridans, Streptococcus bovis, o NASEKgroup (Haemophilus spp., Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eirenella spp., Kingella kingae), O Staphylococcus aureus, o enterococchi acquisiti in comunità in assenza di un focus primario, |
La fine del tavolo. 5.4
patogeni compatibili con EI isolati da emocoltura nelle seguenti condizioni: almeno due campioni di sangue positivi prelevati a distanza di almeno 12 ore l'uno dall'altro, o tre risultati positivi su tre, o la maggioranza dei risultati positivi da quattro o più campioni di sangue (intervallo tra il prelievo il primo e l'ultimo campione dovrebbero durare almeno 1 ora), Rilevazione singola Coxiella burnetii o titolo IgG verso questo microrganismo >1:800. 2. Evidenza di danno endocardico: Ecocardiografia transtoracica positiva (transesofagea in presenza di protesi valvolari in pazienti con possibile EI secondo criteri clinici o identificazione di complicanze sotto forma di ascesso perivalvolare): vegetazione fresca sulla valvola o sulle sue strutture di supporto o materiale impiantato, o un ascesso, oppure nuova disfunzione della valvola protesica, Rigurgito valvolare di nuova formazione (la crescita o il cambiamento del soffio cardiaco esistente non vengono presi in considerazione) |
PICCOLI CRITERI |
Predisposizione: condizioni cardiache predisponenti o frequenti iniezioni endovenose (incluso abuso di farmaci e sostanze). Temperatura corporea 38°C e superiore. Fenomeni vascolari: embolia delle grandi arterie, infarti polmonari settici, aneurismi micotici, emorragie intracerebrali, emorragie della piega transitoria della congiuntiva e lesioni di Janevier. Fenomeni immunologici: glomerulonefrite, noduli di Osler, macchie di Roth e fattore reumatoide. Risultati microbiologici: emocoltura positiva che non soddisfa i criteri principali (escluse singole colture positive di stafilococchi coagulasi-negativi, solitamente Staphylococcus epidermidis, e organismi non causativi di EI) o evidenza sierologica di infezione attiva con un potenziale patogeno di EI (Coxiella burnetii, brucella, clamidia, legionella) |
Tabella 5.5
Criteri per la diagnosi di EI subacuta, sviluppati presso il Dipartimento di Terapia della Facoltà dell'Università Medica Statale Russa (1992)
Tabella 5.6
Criteri diagnostici Duke modificati da V.P. Tiurin, 2001
Grandi criteri |
1. Emocoltura positiva da almeno 2 campioni di sangue separati, indipendentemente dal tipo di agente patogeno. 2. Segni EchoCG di EI: vegetazioni sulle valvole cardiache o sulle strutture sottovalvolari, ascesso o disfunzione della valvola protesica, insufficienza valvolare di nuova diagnosi |
Piccoli criteri |
1. Precedente malattia valvolare o dipendenza da droghe per via endovenosa. 2. Febbre superiore a 38 °C. 3. Sintomi vascolari: embolie arteriose, infarti polmonari, aneurismi micotici, emorragie intracraniche, sintomo di Lukin. 4. Manifestazioni immunitarie: glomerulonefrite, noduli di Osler, macchie di Roth, fattore reumatoide. 5. Ingrossamento della milza. 6. Anemia. |
L'IE è considerato significativo se: vengono presentati 2 criteri maggiori o 1 criterio maggiore e 3 minori o 5 criteri minori.
L'EI subacuta è caratterizzata da diversità clinica, che complica significativamente la diagnosi. L'uso di criteri diagnostici sistematizza la ricerca diagnostica.
Dal nostro punto di vista, la cosiddetta EI “probabile” consente di iniziare la terapia antibiotica. Allo stesso tempo, va ricordato che la combinazione di sintomi come febbre, vasculite, splenomogalia è anche caratteristica del LES, della vasculite sistemica, delle malattie linfoproliferative e fino a quando non viene rilevata la vera lesione valvolare (endocardite) con rumore di rigurgito, la diagnosi la ricerca dovrebbe continuare.
DIAGNOSI DIFFERENZIALE
La diagnosi differenziale dell’EI acuta non è molto difficile a causa dei chiari segni della malattia.
1. Il quadro clinico è dominato dalla sepsi stessa: febbre frenetica o monotona, intossicazione grave, piemia settica, DIC, sintomi di shock tossico.
2. In questo contesto, si manifesta una clinica di progressiva distruzione valvolare con lo sviluppo di rigurgito di grandi volumi e grave insufficienza cardiaca.
3. Di norma, ci sono evidenti "porte di infezione", un'emocoltura positiva viene seminata ripetutamente, anche quando viene iniziata la terapia antibiotica.
4. I cambiamenti del sangue sono caratteristici: anemia grave, forte aumento della VES, leucocitosi con spostamento a sinistra, granularità tossigena dei neutrofili, trombocitopenia. Si può anche determinare uno stato di immunodeficienza: diminuzione delle immunoglobuline, depressione del sistema T, fagocitosi.
In combinazione con i segni ecocardiografici di EI, che compaiono entro 1-2 settimane dalla malattia, la diagnosi di EI acuta diventa abbastanza affidabile nelle prime fasi della malattia, il che non esclude la sua prognosi severa.
L'EI acuta è la sepsi ("porta dell'infezione", emocoltura) con rapida distruzione della valvola e sviluppo di insufficienza cardiaca.
L'EI subacuta, in quanto malattia con quadro clinico polimorfico, è invece molto difficile da diagnosticare precocemente. Le principali malattie che richiedono la differenziazione dall'EI subacuta sono elencate di seguito.
1. A causa dell’elevata prevalenza delle malattie linfoproliferative, la loro differenziazione dall’EI subacuta viene prima di tutto.
2. Nei pazienti con cardiopatia reumatica, la comparsa di febbre immotivata è spesso motivo di sovradiagnosi di EI. D'altra parte, insufficienza cardiaca progressiva, febbre dopo infezioni respiratorie acute, comparsa dei cosiddetti positivi. I "test reumatici" hanno contribuito per molti anni alla sovradiagnosi della febbre reumatica in pazienti con una causa completamente diversa di sviluppo dei sintomi: IE secondaria, compreso il tromboembolismo poco manifesto (prolungato), di piccoli rami dell'arteria polmonare, ecc.
3. La diagnosi differenziale più difficile dell'EI con fenomeni immunitari (nefrite, sierosite, vasculite, miocardite) e LES subacuto o cronico con sviluppo di valvulite - endocardite di Libman-Sacks. I sintomi paraclinici, ad eccezione di segni ecocardiografici convincenti di EI, possono non essere informativi. I più convincenti e decisivi nella diagnosi sono i segni di una malattia cardiaca in rapido sviluppo con una grande quantità di rigurgito e distruzione delle strutture valvolari e sottovalvolari nell'EI, che è del tutto insolito per l'endocardite nel LES e altre malattie denominate malattie diffuse del tessuto connettivo.
4. Gli anziani spesso hanno bisogno di distinguere tra sintomi paraneoplastici febbrili e altri sintomi paraneoplastici (sierosite, vasculite) e EI subacuta. In questo contingente di pazienti si possono rilevare segni di patologia valvolare, molto spesso - calcificazione idiopatica delle strutture fibrose e valvolari. Astenia, anemia, VES accelerata, perdita di peso accompagnano varie malattie. La febbre è caratteristica delle malattie oncologiche dell'intestino, dei reni, del pancreas. Differenziale dell'algoritmo
l'esame differenziale è nel piano della diagnostica approfondita dei processi oncologici della localizzazione specificata.
5. L'EI subacuta può svilupparsi sullo sfondo dell'immunopatologia: linfoma, paraproteinemia. Abbiamo osservato l'aggiunta di IE in un contesto di mieloma multiplo, morbo di Crohn e linfomi. Forse lo sviluppo dell'endocardite marantica nei processi oncologici di varia localizzazione con successiva infezione.
Sulla base di quanto sopra, l'algoritmo raccomandato per la ricerca diagnostica di uno stato febbrile di origine inspiegabile in pazienti con segni (o senza di essi) di patologia valvolare dovrebbe concentrarsi sui segni clinici ed ecografici dell'EI: vegetazione, distruzione, soffio di rigurgito, aumento della congestione insufficienza cardiaca. Di grande importanza è la presenza della sindrome tromboembolica in accordo con la localizzazione dell'endocardite. È impossibile escludere la nomina di antibiotici ad ampio spettro per scopi diagnostici nella diagnosi di EI "probabile".
L'EI subacuta deve essere distinta dalle altre malattie febbrili (linfomi, tumori, malattie diffuse del tessuto connettivo).
TRATTAMENTO
Il trattamento dell’EI è difficile e ogni singolo paziente deve risolvere un problema con molte incognite. Soffermiamoci sui principi generali del trattamento dell'IE.
1. Nel trattamento dell'EI, utilizzare antibiotici battericidi e, se possibile, per via endovenosa, perché. i microrganismi responsabili sono strettamente murati nella fibrina della vegetazione, la vascolarizzazione delle valvole è scarsamente espressa e l'effetto che sopprime l'infezione si ottiene solo con antibiotici battericidi.
2. È necessario prescrivere antibiotici in anticipo, mentre il processo è localizzato solo sulla valvola e la sua generalizzazione non è arrivata. Purtroppo questa disposizione richiede una diagnosi precoce dell’EI, cosa che non sempre è possibile.
3. Gli antibiotici non devono essere somministrati prima dell'emocoltura batteriologica iniziale.
4. La scelta del regime terapeutico è determinata dal patogeno isolato dell'EI. Se l'agente eziologico non viene rilevato dall'emocoltura o è necessario iniziare urgentemente la terapia, vengono applicati regimi terapeutici empirici.
5. Le dosi di antibiotici utilizzate devono essere quanto più tollerate possibile. È inaccettabile ridurre i dosaggi dopo aver ricevuto l'effetto iniziale nel corso del trattamento. Molto spesso, questa tattica porta alla resistenza alla terapia e alle ricadute precoci.
6. Il trattamento dell'EI dovrebbe essere a lungo termine, la durata media dell'uso di antibiotici è di 4-6 settimane dal momento in cui si ottiene l'effetto iniziale. Il calcolo dei giorni per la durata raccomandata del trattamento antibiotico dovrebbe iniziare il primo giorno in cui l'emocoltura diventa negativa. Con lo sviluppo della resistenza alla terapia, potrebbe essere necessario cambiare il farmaco, allungare il corso del trattamento, trasferire il paziente in una struttura di cardiochirurgia.
7. Il trattamento antibiotico dei pazienti con EI delle valvole naturali dopo intervento chirurgico con impianto di una valvola artificiale dovrebbe essere coerente con i regimi di trattamento per l'EI delle valvole protesiche. Se si ottiene la crescita di microrganismi dai tessuti rimossi, dopo l'intervento chirurgico si raccomanda un ciclo completo di terapia antimicrobica; in assenza di crescita, la durata del trattamento può essere ridotta del numero di giorni di trattamento per EI prima dell’intervento chirurgico.
Principi per la scelta degli antibiotici
È più semplice scegliere un antibiotico per il trattamento dell'EI se si conosce l'agente causale e la sua sensibilità agli antibiotici. In condizioni reali, spesso non è possibile isolare rapidamente una vera emocoltura e non tutti i microrganismi isolati possono essere riconosciuti come veri agenti patogeni.
Con gli agenti patogeni streptococcici è meglio usare la penicillina fino a 20 milioni di unità. e più sale sodico al giorno o ampicillina 8-12 g, solitamente in combinazione con alcuni aminoglicosidi (gentamicina - 240 mg al giorno, netilmicina fino a 200 mg). Con l'inefficacia di tale combinazione, si possono usare le cefalosporine: ceft-
riaxon - 2 g al giorno, fortum - 4-5 g al giorno, i farmaci di riserva sono thienam - 4 g al giorno, vancomicina fino a 2 g al giorno. Nell'EI causata da enterococchi resistenti ai suddetti antibiotici (un problema terapeutico urgente!) si può utilizzare la teicoplanina.
Con l'EI causata da stafilococchi, aureus e bianchi, vengono spesso utilizzati l'augmentin (amoxiclav) fino a 4-8 g al giorno, unazina, varie cefalosporine, in particolare ceftriaxone e fortum; rifampicina fino a 0,9-1,2 g al giorno, tienam e vancomicina.
Organismi NASEC: ceftriaxone e fortum sono i più efficaci, può essere utilizzata la vancomicina.
L'endocardite da brucella e da clamidia è sensibile al trattamento con doxaciclina, eritromicina, aminoglicosidi, clotrimazolo.
L'EI causata da funghi patogeni è molto grave. Il trattamento prevede l'uso di amfotericina B e 5-fluorocitosina, seguita dalla sostituzione della valvola. La prognosi dell'endocardite fungina è solitamente molto grave.
Con un'eziologia sconosciuta dell'endocardite, il trattamento viene solitamente iniziato con una combinazione di ampicillina (8-12 g al giorno) con aminoglicosidi. Al posto dell'ampicillina si possono utilizzare le ureidopenicilline (azlocillina, piperacillina fino a 20 g al giorno).
Con l'inefficacia del gruppo delle penicilline, vengono utilizzate cefalosporine (kefzol, fortum, ceftriaxone), thienam, ciprofloxacina, vancomicina, teikoplaxina.
La scelta della terapia nei pazienti affetti da EI con emocoltura negativa è molto più difficile e la prognosi della malattia è peggiore rispetto a quella dell'EI con un patogeno noto.
Quando si sceglie un antibiotico, viene presa in considerazione un'emocoltura nota, con un'eziologia sconosciuta di IE, il trattamento inizia con una combinazione di ampicillina e aminoglicosidi.
Nella terapia complessa dell'EI, la terapia immunosostitutiva gioca un ruolo significativo: i complessi immunoglobulinici utilizzati come bolo o in un piccolo contagocce (100 ml) - octogam, endobulina, consentono di superare la resistenza dei microrganismi agli antibiotici. La plasmaferesi viene utilizzata anche come fattore aggiuntivo nella lotta contro antigeni batterici, tossine, ecc.
I glucocorticoidi sono usati raramente per trattare l'EI, poiché dopo un effetto positivo immediato, le recidive di endocardite sono molto più comuni. Inoltre i glucocorticoidi, pur riducendo l’eventuale febbre, non consentono una valutazione oggettiva dell’effetto di un antibiotico. Tuttavia, con l'EI possono verificarsi situazioni che richiedono l'uso del prednisolone: condizioni di emergenza - shock batterico, quando prednisolone o desametasone vengono somministrati per via endovenosa, con intolleranza allergica agli antibiotici e anche con sindromi immunologiche (miocardite, nefrite, vasculite, artrite ). In questo caso, il prednisolone viene prescritto dopo aver ottenuto l'effetto iniziale della terapia antibiotica e viene anche annullato 1-1,5 settimane prima della fine del trattamento antibiotico.
Trattamenti chirurgici
Di seguito sono riportate le indicazioni per il trattamento chirurgico.
1. Sostituzione valvolare infetta per EI acuta e subacuta causata da un'infezione altamente virulenta resistente alla terapia antibiotica (batteriemia persistente con emocoltura positiva una settimana dopo l'inizio del trattamento antibiotico). Questo è l'unico modo per salvare la vita di questi pazienti.
2. Insufficienza cardiaca progressiva dovuta al rapido sviluppo della distruzione valvolare.
3. EI causata da agenti patogeni inizialmente resistenti alla terapia antimicrobica (funghi patogeni, Pseudomonas aeruginosa, ecc.).
4. Endocardite da protesi. In un certo numero di pazienti, l'endocardite da protesi può essere curata con antibiotici senza intervento chirurgico (O.M. Butkevich, V.P. Tyurin, D. Kais, ecc.).
5. Ascessi del miocardio, ascessi dell'anello valvolare, fistole purulente del miocardio.
6. Vegetazioni grandi (più di 10 mm), sciolte e mobili sulle corde, distacchi delle valvole, pericolo di tromboembolia negli organi vitali.
Dal punto di vista della prognosi del trattamento chirurgico, si raccomanda di trasferire il paziente con l'aiuto della terapia antibiotica in una remissione instabile e quindi di operare. Non dovremmo dimenticare anche l'endocardite postoperatoria della valvola protesica.
PREVENZIONE
Sembra ragionevole l’uso profilattico obbligatorio di antibiotici per brevi periodi nei soggetti ad aumentato rischio di sviluppare EI per interventi medici o diagnostici che possono causare batteriemia (vedi sotto). 30 min-1 ora prima delle manipolazioni si somministrano 1.000.000 di unità di penicillina o 2 g di oxacillina (mapicillina) per 1-3 giorni, oppure si utilizzano altri schemi (Tabella 5.3).
Il rischio di sviluppare EI nella patologia cardinale è presentato come segue.
Malattie con alto rischio Connessioni IE:
Valvole cardiache protesiche (compresi trapianti biologici);
Difetti cardiaci congeniti complessi di tipo "cianotico" (anche dopo correzione chirurgica);
Endocardite infettiva precedentemente trasferita;
Vasi sistemici o polmonari formati chirurgicamente. Malattie con rischio medio Connessioni IE:
Cardiopatia valvolare acquisita;
Difetti cardiaci congeniti di tipo “non cianotico”, inclusa la valvola aortica bicuspide (è escluso il difetto interatriale secondario);
Prolasso della valvola mitrale con grave rigurgito o significativo ispessimento della valvola (degenerazione mixomatosa);
Cardiomiopatia ipertrofica. Malattie con a basso rischio Connessioni IE:
Difetto del setto interatriale secondario;
Dopo interventi chirurgici di legatura del dotto arterioso aperto e plastica di un difetto del setto interatriale;
Prolasso della valvola mitrale senza rigurgito;
Dopo un intervento chirurgico di bypass dell'arteria coronaria;
Dopo l'impianto di un pacemaker;
Con soffi cardiaci funzionali.
La profilassi è raccomandata nei pazienti ad alto o moderato rischio di EI, interventi parodontali, pulizia profilattica di denti o impianti, adenoidectomia tonsillite, broncoscopia rigida, chirurgia biliare o intestinale, chirurgia della prostata, cistoscopia.
Nelle persone con un aumentato rischio di sviluppare EI (difetti cardiaci, protesi valvolari, EI pregressa), si raccomanda l'uso profilattico di antibiotici per procedure diagnostiche e terapeutiche accompagnate da batteriemia (interventi chirurgici, cistoscopia, ecc.)
Durante le procedure mediche nel cavo orale, nelle vie respiratorie, nell'esofago (la profilassi antibatterica è diretta principalmente contro gli streptococchi del gruppo verde e del gruppo NASEC): In assenza di allergia alla penicillina: amoxicillina 2 g (bambini 50 mg/kg) per via orale 1 ora prima della procedura; amoxicillina o ampicillina 2 g (bambini 50 mg/kg) per via endovenosa nell'arco di 30-60 minuti. prima della procedura se è impossibile assumere il farmaco all'interno; Per l'allergia alla penicillina: clindamicina 600 mg (bambini 20 mg/kg) o azitromicina o claritromicina 500 mg (bambini 15 mg/kg) 1 ora prima della procedura, o cefalexina 2 g (bambini 50 mg/kg) per via orale 1 ora prima della procedura |
Nelle procedure mediche sugli organi urogenitali o sul tratto gastrointestinale, la profilassi antibatterica è mirata agli enterococchi, Streptococcus bovis, Enterobatteriacee: Se non sei allergico alla penicillina: Pazienti ad alto rischio: amoxicillina o ampicillina 2 g per via endovenosa + gentamicina 1,5 mg/kg per via endovenosa in 30-60 minuti. prima della procedura, dopo 6 ore amoxicillina o ampicillina 1 g per via orale o ampicillina 1 g EV o IM; Pazienti del gruppo a rischio intermedio: amoxicillina o ampicillina 2 g (bambini 50 mg/kg) per via intramuscolare o endovenosa nell'arco di 30-60 minuti. prima della procedura o amoxicillina 2 g (bambini 50 mg/kg) per via orale 1 ora prima della procedura. Se allergico alla penicillina: Pazienti ad alto rischio: vancomicina 1 g (bambini 20 mg/kg) per via endovenosa 1-2 ore prima della procedura + gentamicina 1,5 mg/kg per via endovenosa o intramuscolare; Pazienti del gruppo a rischio intermedio: vancomicina 1 g (bambini 20 mg/kg) per via endovenosa 1-2 ore prima della procedura |
© Utilizzo dei materiali del sito solo in accordo con l'amministrazione.
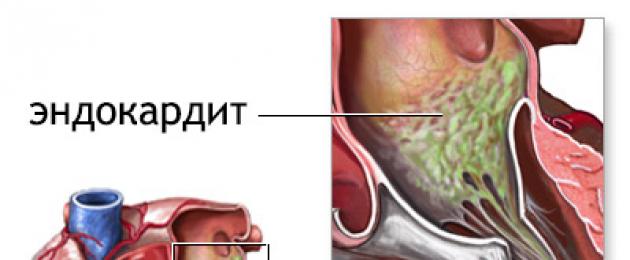
Endocardite - una malattia che colpisce il rivestimento interno del cuore, nonché le valvole aortiche e cardiache. Questa è una patologia grave e pericolosa per la vita, caratterizzata da un rapido sviluppo, dal pericolo di embolia dei vasi sanguigni, degli organi vitali interni e dallo sviluppo di processi immunopatologici.
L'endocardite è divisa in infettiva (batterica) e non infettiva. Sebbene nella stragrande maggioranza dei casi l'endocardite sia di natura infettiva, esistono patologie che si sviluppano come reazione ai cambiamenti metabolici nell'ambito di un processo immunopatologico o con danno meccanico al cuore.
L'endocardite non infettiva comprende:
- Endocardite verrucosa atipica con;
- Endocardite reumatica;
- Endocardite nell'artrite reumatoide e reattiva;
- Endocardite fibroplastica di Leffer;
- Endocardite trombotica non batterica.
Quasi sempre, le malattie di cui sopra indicano che il rischio di sviluppare endocardite infettiva (IE) in questi casi è estremamente elevato, vale a dire rappresenta il pericolo maggiore per la vita del paziente.
Cause di endocardite infettiva
 La malattia si verifica raramente, ma recentemente si è osservata una tendenza costante verso un aumento dell'incidenza di EI, che è associata ad un aumento della resistenza (resistenza) della microflora batterica agli antibiotici a seguito di mutazioni. Un altro motivo dell’aumento dell’incidenza dell’endocardite settica è l’aumento del numero di persone che assumono farmaci per via endovenosa.
La malattia si verifica raramente, ma recentemente si è osservata una tendenza costante verso un aumento dell'incidenza di EI, che è associata ad un aumento della resistenza (resistenza) della microflora batterica agli antibiotici a seguito di mutazioni. Un altro motivo dell’aumento dell’incidenza dell’endocardite settica è l’aumento del numero di persone che assumono farmaci per via endovenosa.
Molto spesso, gli agenti causali di questa malattia sono microrganismi patogeni gram-positivi: nella maggior parte dei casi si tratta di infezioni da stafilococco, streptococco, enterococco. Molto meno spesso, il suo sviluppo è provocato da altri microrganismi, tra cui possono esserci batteri gram-negativi, rari agenti patogeni atipici e infezioni fungine.
La sconfitta della membrana cardiaca nell'EI si verifica con la batteriemia. Sinonimo del concetto di "endocardite infettiva" sono definizioni come endocardite settica o batterica. La batteriemia (presenza di batteri nel sangue) può svilupparsi in condizioni favorevoli anche dopo le procedure più innocue.
Le procedure ad alto rischio di sviluppare batteriemia sono:
- Operazioni dentistiche con danni alle mucose del cavo orale e delle gengive;
- Esecuzione di broncoscopia utilizzando strumenti rigidi;
- Cistoscopia, manipolazioni e interventi chirurgici sugli organi del sistema urinario, se è presente una componente infettiva;
- Biopsia condotta del tratto urinario o della prostata;
- Operazione sulla ghiandola prostatica;
- Adenoidectomia, tonsillectomia (rimozione di tonsille e adenoidi);
- Interventi eseguiti sulle vie biliari;
- Litotripsia eseguita in precedenza (distruzione di calcoli nei reni, nelle vie urinarie, nella cistifellea);
- Operazioni ginecologiche.
I cardiologi identificano i gruppi a rischio che presentano i prerequisiti per l’infiammazione dell’endocardio, che richiedono una terapia antimicrobica per prevenire l’endocardite.
Il gruppo ad alto rischio comprende:
- Pazienti che hanno avuto in precedenza endocardite batterica;
- Operato per la sostituzione della valvola cardiaca se sono stati utilizzati materiali meccanici o biologici;
- Avere complessi congeniti e acquisiti con disturbi legati all'aorta, ai ventricoli cardiaci - i cosiddetti difetti "blu";
Le seguenti categorie di pazienti sono a rischio moderato:
- Pazienti con;
- Con ipertrofico;
- Avere tutti gli altri difetti cardiaci (congeniti e acquisiti), non rientrare nel primo gruppo a rischio, senza cianosi.
I pazienti con le seguenti diagnosi sono meno a rischio di sviluppare questa malattia:
- e navi;
- Difetto del setto interatriale e interventricolare, compreso quello operato, fino a sei mesi dopo l'intervento;
- Pacemaker e defibrillatori impiantati;
- nessun danno alla valvola.
Video: endocardite. Perché è importante curare i denti in tempo?
Come si sviluppa l'IE?
Il periodo che intercorre tra la penetrazione dell'infezione e lo sviluppo della clinica EI varia da alcuni giorni a diversi mesi. Dipende dalla virulenza dell'agente patogeno, dallo stato del sistema immunitario del paziente e del cuore.
All'interno della cavità cardiaca, l'agente patogeno si deposita sui lembi valvolari e inizia a crescere, con la formazione di colonie di microrganismi (vegetazione). Oltre ai microrganismi, contengono eritrociti, leucociti, piastrine, fibrina. Con il progredire dell’infezione, la superficie delle valvole si deforma, formando una superficie irregolare o ulcere con rivestimento trombotico.

Quando la deformazione raggiunge dimensioni significative, le valvole cardiache perdono la capacità di chiudersi ermeticamente, che porta allo sviluppo di disturbi emodinamici e al verificarsi di insufficienza cardiaca acuta. Questa condizione si sviluppa rapidamente e rappresenta un pericolo per la vita del paziente. Dalla valvola distrutta possono staccarsi pezzi di valvole distrutte, frammenti di colonie di microrganismi. Con il flusso sanguigno vengono trasportati attraverso la circolazione polmonare e sistemica, possono causare ischemia di organi importanti, che è accompagnata da vari disturbi neurologici, paresi e paralisi e altre gravi complicazioni.
Classificazione dell'endocardite
Quando si effettua una diagnosi, il medico deve formulare una diagnosi raffinata che caratterizzi le principali caratteristiche inerenti a questo tipo di malattia, che consenta di avere un'idea più precisa e dettagliata del decorso della malattia.
- In base all'attività del processo patologico si distingue l'endocardite attiva, curata e ricorrente;
- Secondo la probabilità e la certezza della diagnosi (probabile o certa);
- Per tipo di agente infettivo (determinato o non stabilito);
- Dalla natura della valvola interessata, se vengono applicate le protesi.

Si distinguono anche diversi tipi di flusso e gravità del processo infiammatorio, tenendo conto delle caratteristiche iniziali delle valvole danneggiate.
- L'endocardite settica acuta può svilupparsi entro poche ore o giorni, è caratterizzata da grave febbre frenetica, rapido sviluppo di complicanze nel sistema cardiovascolare. L'EI acuta si distingue per una pronunciata capacità di penetrare nei tessuti circostanti, dovuta al tipo di agente patogeno con un elevato livello di virulenza;
- L'endocardite infettiva subacuta si sviluppa più lentamente, dalla penetrazione dell'agente patogeno nella cavità del cuore alle manifestazioni cliniche che richiedono da alcune settimane a diversi mesi. Il suo decorso è più favorevole, poiché il suo agente patogeno è meno aggressivo e capace di penetrare nei tessuti circostanti.
Inoltre, la malattia è classificata nei seguenti tipi:
- EI primaria: è interessato l'endocardio inizialmente intatto;
- EI secondaria: può svilupparsi sullo sfondo di malattie cardiache esistenti.
- La cosiddetta EI "protesica" si sviluppa quando una valvola cardiaca artificiale viene infettata.
IE nei bambini, sintomi
Nei bambini piccoli, dal periodo neonatale fino ai 2 anni di età, possibile sviluppo di EI congenita. Poiché la causa di questa malattia sono le malattie infettive della madre o l'infezione intrauterina del feto. Forse lo sviluppo dell'endocardite acquisita nei bambini, come complicazione dell'infezione da meningococco, salmonellosi, brucellosi, scarlattina, HIV. Più spesso nei bambini, la valvola aortica è colpita, l'infiammazione porta a cambiamenti distruttivi, perforazione, rottura delle valvole. Il decorso di questa malattia è difficile da sopportare per i bambini, il rischio di complicazioni e morte è alto.
Segni e metodi per diagnosticare l'EI
L'endocardite settica inizia in modo acuto. All'improvviso, la temperatura corporea sale a 39-40 C, si avvertono forti brividi, dolori ai muscoli e alle articolazioni. Le mucose e la pelle diventano pallide, compaiono piccole eruzioni cutanee (eruzione emorragica), sono presenti eruzioni cutanee nodulari sulla pianta dei piedi e sui palmi di una tonalità cremisi (noduli di Osper), che scompaiono pochi giorni dopo l'inizio della malattia. Se si unisce un'infezione, le eruzioni cutanee suppurano e successivamente si cicatrizzano. Alle falangi delle unghie, le dita degli arti superiori e inferiori si ispessiscono, assumono un aspetto caratteristico, noto come "bacchette", e le unghie - "clessidre". Potrebbero esserci emorragie sotto le unghie sotto forma di strisce bruno-rossastre.
Quando si ascoltano i toni cardiaci, i rumori estranei sono chiaramente definiti, con toni e intensità diversi, a seconda del grado di danno alle valvole, spesso viene diagnosticata contemporaneamente l'insufficienza cardiaca.
Se è interessato il lato destro del cuore e si sviluppa un infarto polmonare, possono svilupparsi pleurite, emottisi ed edema polmonare. Quasi sempre i pazienti hanno danni renali sotto forma di nefrite, c'è il rischio di sviluppare insufficienza renale. Non meno spesso si sviluppa un danno alla milza, al fegato con lo sviluppo di epatite, ascesso o infarto epatico. In alcuni casi si verificano danni agli occhi che possono portare alla cecità. Spesso ci sono manifestazioni di artralgia, con lo sviluppo di periostite, emorragia ed embolia dei vasi del periostio, i pazienti lamentano dolore alle ossa.
Questi sono i classici segni dell'endocardite, ma a volte sono modificati o parzialmente assenti. Per chiarire la diagnosi, è necessario identificare la presenza di un microrganismo patogeno nel sangue, per il quale il sangue arterioso viene esaminato con metodi di laboratorio. Le vegetazioni di microrganismi sulla valvola cardiaca possono essere rilevate utilizzando. Spesso, nella fase iniziale della malattia, l'endocardite non può essere riconosciuta, poiché sintomi simili o simili possono accompagnare altre malattie infettive acute.

figura: segni e complicanze dell'endocardite
Se si sospetta un'EI, il medico deve valutare insieme tutti i segni della malattia. Se la prima coltura del sangue non ha dato un risultato positivo, viene ripetuta più volte. Inoltre, se si sospetta questa malattia, dovrebbe essere prescritto un ecocardiogramma, poiché questo è il metodo più informativo che consente di rilevare e visualizzare la patologia della valvola cardiaca e la crescita di microrganismi. Nel corso del trattamento con l'aiuto dell'ecocardiografia, viene monitorata l'efficacia della terapia. In alcuni casi, secondo le indicazioni, viene eseguita una biopsia diagnostica dell'endocardio per confermare la diagnosi.
- Gli esami del sangue biochimici e generali confermano il processo infiammatorio in corso nel corpo;
- La radiografia del torace determina i cambiamenti nei polmoni con;
- L'ecografia del cuore consente di determinare visivamente la presenza di IE e descriverla in dettaglio.
Video: endocardite infettiva all'ecocardiografia
Nel video: endocardite infettiva della valvola tricuspide, vegetazione. Ecocardiografia, accesso apicale.
Trattamento dell'endocardite infettiva e aspecifica
Dopo aver confermato la diagnosi di IE il medico prescrive una terapia antibiotica massiccia: al paziente vengono somministrati antibiotici in grandi dosi per via endovenosa. Dopo aver determinato l'agente patogeno, è necessario scegliere il farmaco più efficace in grado di sopprimere i microrganismi patogeni; per questo, l'agente patogeno dell'endocardite viene seminato in un ambiente sterile in laboratorio ed esposto a diversi farmaci. Il trattamento per l'endocardite viene effettuato a lungo, per 1,5-2 mesi fino alla completa distruzione dell'infezione, che deve essere confermata da ripetuti esami del sangue microbiologici, monitoraggio delle condizioni del paziente, ecocardiografia, ultrasuoni e altri metodi diagnostici.
 L’endocardite fungina è più difficile da trattare. Molto spesso, vengono rilevati in pazienti indeboliti con immunità depressa, che in precedenza avevano ricevuto un trattamento antibatterico inefficace a lungo termine; in pazienti con malattie sistemiche croniche: tumori maligni, infezione da HIV,. In caso di grave insufficienza cardiaca, si può decidere di eseguire un intervento chirurgico sul cuore ed asportare crescite microbiche.
L’endocardite fungina è più difficile da trattare. Molto spesso, vengono rilevati in pazienti indeboliti con immunità depressa, che in precedenza avevano ricevuto un trattamento antibatterico inefficace a lungo termine; in pazienti con malattie sistemiche croniche: tumori maligni, infezione da HIV,. In caso di grave insufficienza cardiaca, si può decidere di eseguire un intervento chirurgico sul cuore ed asportare crescite microbiche.
Con la nomina di un trattamento antibatterico, le manifestazioni acute della malattia possono diminuire, tuttavia, se i microrganismi sono resistenti agli antibiotici, possono ricoprirsi con una pellicola protettiva sotto la quale persiste l'infezione. Questo periodo può durare a lungo, quando si verificano le condizioni adatte, la pellicola viene distrutta, i microrganismi vengono nuovamente attivati, provocando una ricaduta della malattia entro 2-3 settimane dalla fine del trattamento.
Allo stesso tempo, viene effettuata una terapia sintomatica per mantenere l'attività cardiaca del paziente, alleviare i fenomeni di intossicazione e prevenire la formazione di coaguli di sangue. Tutte le attività dovrebbero essere svolte con un monitoraggio costante della composizione del sangue per vedere in tempo la dinamica della malattia.
Se durante l'EI si verificano malattie valvolari, insufficienza cardiaca pericolosa per la vita, embolia vascolare o focolai di infezione all'esterno dell'anello valvolare, i medici possono decidere che è necessario un intervento chirurgico durante la fase attiva della malattia per salvare la vita del paziente. Durante l'intervento chirurgico, i chirurghi correggono il difetto delle valvole, suturando i lembi strappati. Con la completa distruzione delle valvole possono essere eseguite.

Foto: sostituzione della valvola mitrale
Nel trattamento dell'endocardite non infettiva, si dovrebbe prestare grande attenzione al trattamento della malattia di base.. Per eliminare le vegetazioni vengono prescritti farmaci anticoagulanti che contribuiscono alla loro scomparsa.
Qual è la prognosi per l'endocardite?
Fino a poco tempo fa, fino all'introduzione della terapia antibiotica e chemioterapica, la prognosi di questa malattia era estremamente sfavorevole, c'era un alto tasso di mortalità tra i pazienti e i casi di guarigione erano isolati. Attualmente, la prognosi dipende da molti fattori correlati.
Con una combinazione favorevole di circostanze, dal 55 all'85% di tutti i pazienti guarisce con questa diagnosi. In misura maggiore, il decorso della malattia e la prognosi dipendono dall'aggressività e dalla patogenicità dell'agente infettivo e dalla suscettibilità all'infezione del paziente stesso.
Indipendentemente dalla gravità della malattia, l'endocardite nella maggior parte dei casi colpisce l'intera vita futura di una persona, poiché in futuro ci sarà sempre il rischio di sviluppare una malattia della valvola cardiaca e complicazioni correlate. Questi includono lo sviluppo della miocardite - infiammazione dello strato intermedio del muscolo cardiaco, che ha conseguenze ancora più gravi, poiché può portare allo sviluppo di cardiomiopatia, al rapido sviluppo di insufficienza cardiaca e disturbi del ritmo cardiaco. Questa condizione può richiedere una terapia sintomatica aggiuntiva. Un grande pericolo è l'insufficienza renale e la conseguente intossicazione del corpo.
Prevenzione delle malattie
Per ridurre al minimo il rischio di sviluppare questa formidabile malattia, dovresti seguire semplici regole e monitorare la tua salute:
- È necessario disinfettare tempestivamente i focolai di infezioni nel corpo, trattare la carie, le malattie del rinofaringe. È necessario prestare attenzione anche alle malattie croniche più comuni: tonsillite, sinusite, rinite; le malattie renali acute e croniche richiedono particolare attenzione e attenzione.
- Dopo gli interventi chirurgici nelle persone a rischio, è necessario effettuare una terapia antibatterica a scopo profilattico. Le operazioni comprendono tutte le procedure dentistiche, comprese le manipolazioni sulle gengive con violazione della mucosa orale.
- Dovrebbero essere evitate situazioni stressanti, eccessivo stress fisico e psicologico, infezioni virali acute;
- Dopo aver sofferto di endocardite infettiva, i pazienti dovrebbero essere in un dispensario permanente con un cardiologo, seguire corsi tempestivi di terapia riabilitativa nei sanatori;
- È necessario rafforzare intenzionalmente la tua immunità, per questo devi mangiare completamente, condurre uno stile di vita sano e assumere regolarmente multivitaminici;
- L'immunizzazione tempestiva contro i virus della parotite, del morbillo e della rosolia è di grande beneficio nel prevenire lo sviluppo di complicanze;
I pazienti con endocardite infettiva dovrebbero monitorare attentamente la propria salute per tutta la vita, quindi saranno in grado di condurre uno stile di vita attivo e completo senza timore di sviluppare una ricaduta della malattia.
Video: conferenza sull'endocardite infettiva
L'endocardite infettiva (IE) è un'infezione dell'endocardio, solitamente batterica (solitamente streptococcica e stafilococcica) o fungina. Di solito si tratta di infezioni batteriche delle strutture endocardiche, di regola, con il coinvolgimento delle valvole cardiache, nonché con la partecipazione di corpi estranei intracardiaci (valvole, sonde di pacemaker).
Frequenzaè di circa 3-10/100.000, mortalità 20-30%.
Data la presenza di diversi agenti patogeni, è estremamente importante nella pianificazione della terapia distinguere tra le seguenti condizioni:
- Endocardite della valvola nativa ed endocardite tardiva della valvola protesica (> 12 mesi dopo l'intervento): causata prevalentemente da ceppi di stafilococco sensibili alla meticillina
aureus, vari tipi di streptococchi, nonché Enterococcus faecalis e - Endocardite valvolare protesica precoce (< 12 месяцев после операции): вызывается преимущественно метициллин-резистентными штаммами Staphylococcus aureus, коагулазонегативными стафилококками и грамотрицательными возбудителями.
Fattori di rischio per l'endocardite:
- Avere un difetto cardiaco
- Condizione dopo un intervento chirurgico al cuore, sostituzione della valvola
- Presenza di un pacemaker
- Abuso di alcol, droghe per via endovenosa
- febbre reumatica
- Condizione dopo l'endocardite
- Diabete mellito, insufficienza renale, cirrosi epatica, terapia immunosoppressiva, tumori maligni
- Condizione dopo interventi chirurgici o terapeutici (ad esempio installazioni PPM), interventi dentistici, traumi.
La diagnosi di IS richiede l'emocoltura e l'ecocardiografia. Il trattamento per l’EI è una terapia antibiotica a lungo termine, talvolta un trattamento chirurgico.
L’endocardite può verificarsi a qualsiasi età. I consumatori di droghe per via endovenosa e i pazienti con condizioni immunocompromesse corrono un rischio più elevato di contrarre la malattia.
I cambiamenti più significativi nell’epidemiologia dell’endocardite infettiva si sono verificati negli ultimi 10-15 anni. Se in passato l'EI colpiva spesso i giovani, negli ultimi tempi si è verificato un netto aumento del numero di endocarditi infettive nei gruppi di età più avanzata. Allo stesso tempo, la stragrande maggioranza di loro non presentava precedenti lesioni valvolari, ma era spesso sottoposta a procedure diagnostiche invasive. La frequenza dell'endocardite infettiva dipende dalle condizioni sociali. Nei paesi in via di sviluppo, dove il ruolo dei reumatismi rimane elevato, l’EI è più comune nei giovani che negli anziani. Nei paesi sviluppati, l’incidenza è di 3-10 casi ogni 100.000 pazienti/anno, con 1,5-2,5 casi tra i giovani e 14,5 casi ogni 15.000 persone nelle fasce di età più anziane (70-80 anni).
La mortalità per endocardite infettiva è dell'11-27% durante il trattamento ospedaliero. Nel primo periodo post-stazionario la mortalità resta molto elevata, raggiungendo il 18-40%.
Gli uomini si ammalano più spesso delle donne 2 volte.
Frequenza. L'endocardite infettiva si verifica con una frequenza dello 0,03-0,3%.
Classificazione dell'endocardite infettiva
L'endocardite infettiva può avere un decorso lento e subacuto oppure un decorso più acuto e fulminante con un alto rischio di sviluppare un rapido scompenso.
Endocardite batterica subacuta (PBE). Sebbene aggressiva, di solito si sviluppa in modo insidioso e progredisce lentamente (da settimane a mesi). Il PBE è più comunemente causato dallo streptococco. L'endocardite subacuta streptococcica si sviluppa spesso sulle valvole colpite dopo una batteriemia asintomatica dovuta a infezioni parodontali, gastrointestinali e urogenitali.
L'endocardite batterica acuta (ABE) di solito si sviluppa improvvisamente e progredisce rapidamente (cioè entro pochi giorni). Quando l’infezione è altamente virulenta o l’impatto batterico è massiccio, l’endocardite batterica acuta può colpire le normali valvole cardiache.
L'endocardite protesica della valvola si sviluppa più frequentemente dopo la sostituzione della valvola aortica che dopo la sostituzione della valvola mitrale e colpisce nella stessa misura sia le protesi meccaniche che quelle biologiche. L'insorgenza precoce dell'infezione è dovuta principalmente all'infezione durante l'intervento chirurgico da batteri resistenti agli antimicrobici (Staphylococcus epidermidis, difteroidi, bacilli coliformi, Candida, Aspergillus). L'esordio tardivo dell'infezione è dovuto principalmente all'infezione intraoperatoria con organismi a bassa virulenza o batteriemia asintomatica transitoria, più comunemente streptococchi; stafilococco aureo epidermico, difteroidi e bacilli gram-negativi, Haemophilus influenzae, Actinobacillus actinomycetemcomitans (gruppo NASEK) e Cardiobacterium hominis che necessitano di terreni specifici per la loro crescita.
Tipi di endocardite infettiva
È consuetudine distinguere 4 principi alla base della definizione di tipologiaendocardite infettiva:
- localizzazione dei processi; tipo di valvola (artificiale, naturale);
- il luogo in cui si è verificata la malattia (ospedale, extraospedale, connessione con l'introduzione di farmaci);
- attività di processo;
- endocardite infettiva ricorrente o reinfezione.
Cause di endocardite infettiva
L'endocardite infettiva acuta è spesso causata da batteri: Staphylococcus aureus, streptococco piogenico, batteri gram-negativi (Proteus, Pseudomonas aeruginosa, gruppo NASEK).
Oltre un secolo di ricerche sulla diagnosi e sul trattamento dell’endocardite infettiva hanno dimostrato che praticamente tutti i batteri possono causare la malattia. Tuttavia, solo i batteri che causano batteriemia sono di particolare importanza: hanno la capacità di persistere a lungo nel flusso sanguigno, hanno una maggiore capacità di colonizzare l'endocardio e di formare un biofilm sulle superfici artificiali.
Tali capacità sono possedute, prima di tutto, da stafilococchi, streptococchi, enterococchi. Questi microrganismi sono menzionati all'inizio-metà del XX secolo. e nelle ultime opere dell'inizio del XXI secolo. È stato accertato che la capacità di colonizzare l'endocardio è regolata dalla presenza della proteina adesina sulla superficie del microrganismo. Tra le molte adesine, quelle che legano il collagene, la fibrina e la fibronectina sono le più importanti.
Pertanto, l'inizio della colonizzazione può essere descritto con il termine "aderenza", che viene effettuato dalle adesine situate sulla superficie del batterio. Tuttavia, affinché avvenga l'"adesione", sono necessari i microrganismi nel sangue. La fonte della batteriemia immediatamente precedente l'EI è raramente praticamente rilevabile.
La fonte della batteriemia è stata identificata nel 48% dei pazienti con EI di valvole naturali e nel 41% dei pazienti con EI di valvole artificiali. Nei pazienti con EI valvolare naturale, la fonte dell’infezione è spesso la cavità orale. La patologia dentale è diventata la fonte della malattia nel 17% dei pazienti. Malattie della pelle, del sistema genito-urinario e del tratto gastrointestinale hanno portato a EI rispettivamente nell'8%, 2% e 9% dei pazienti. Nei pazienti con endocardite infettiva delle valvole artificiali è stato osservato un quadro diverso. Molto spesso, la fonte della batteriemia sono gli interventi medici (14% dei pazienti). Al secondo posto c'erano le malattie del sistema genito-urinario (11%) e le malattie del cavo orale - solo il 3%. Apparentemente, ciò è dovuto al fatto che il periodo preoperatorio prevede la sanificazione dei focolai di infezione.
La batteriemia transitoria è spesso causata dal tipico microbiota orale e intestinale. La frequenza della batteriemia dopo interventi odontoiatrici varia dal 10 al 100%. Nella vita di tutti i giorni, la stragrande maggioranza delle persone sane può sperimentare una batteriemia transitoria quando si lavano i denti. Gli esperti dell'American Heart Association hanno studiato paralleli clinici e batteriologici, ad es. è stata determinata la microflora più caratteristica che ha portato all'endocardite infettiva in pazienti con varie condizioni cliniche e malattie.
L'eziologia dell'EI nei pazienti con valvola artificiale dipende dal tempo trascorso dal momento dell'inserimento della protesi. L'EI precoce è spesso causata da stafilococchi coagulasi-negativi (30-41%), Staph aureus (8-24%), batteri Gram-negativi - 10-15%, enterococchi - 3,3-10%, funghi - fino a 10 %, streptococco viridans - meno dell'1%.
L'endocardite infettiva tardiva provoca uno spettro di agenti patogeni vicino allo spettro dei patogeni naturali.
Le differenze nella flora nel periodo iniziale della malattia sembrano essere dovute al numero significativo di interventi medici e ai frequenti ricoveri ospedalieri.
La visione moderna della patogenesi definisce le fasi: 1a fase - penetrazione della flora dalla fonte dell'infezione nel flusso sanguigno e sviluppo di batteriemia persistente. Questa fase si verifica quando lo stato immunitario cambia. 2a fase: fissazione del microrganismo sulla superficie della valvola, endocardio. In questa fase, un ruolo importante spetta ai precedenti cambiamenti nella valvola, sia di natura organica che derivanti dall'effetto dannoso del getto sanguigno, che è costretto a muoversi a una velocità diversa e turbolenta a causa del difetto della valvola, che crea tutto le condizioni per l'introduzione dei batteri nell'endocardio. Danni ai lembi valvolari possono verificarsi con danni meccanici agli elettrodi del pacemaker, processi degenerativi dovuti a cambiamenti legati all'età. Alterazioni degenerative dei lembi valvolari vengono rilevate nel 50% dei pazienti di età superiore a 60 anni senza quadro clinico di endocardite infettiva. Stadio 3 - cambiamenti iniziali della valvola - segni locali di infiammazione: gonfiore, essudazione, ecc. 4a fase - la formazione di complessi immunitari (produzione di autoanticorpi contro la struttura tissutale alterata), che si depositano in vari organi e determinano la natura sistemica della malattia: danno al cuore, ai reni, al fegato, ai vasi sanguigni.
Nei pazienti anziani. In particolare, cambiamenti nelle valvole cardiache dovuti alla deposizione di calcio, alla formazione di coaguli di sangue sulle pareti del cuore. Inoltre, nei pazienti anziani si osserva un indebolimento del sistema immunitario. Tutto ciò predispone allo sviluppo della malattia. L'aumento dell'incidenza dell'endocardite è associato anche ad un aumento del numero di interventi al cuore.
Patogenesi L'endocardite infettiva è caratterizzata dalle seguenti sindromi.
- sindrome da intossicazione. A partire dal 1o stadio della malattia, i batteri nel corpo del paziente provocano intossicazione, manifestata da debolezza, febbre, aumento della VES, leucocitosi e altre manifestazioni tipiche dell'intossicazione.
- Un aumento della massa batterica, da un lato, mantiene stabile la gravità dell'intossicazione, dall'altro favorisce la crescita di vegetazioni sulle valvole; la crescita delle vegetazioni porta alla separazione dei loro frammenti e alla sindrome embolica.
- Gli emboli settici contribuiscono alla generalizzazione del processo e all'introduzione dell'infezione in quasi tutti gli organi. L'embolo provoca l'occlusione meccanica del vaso, che porta a disturbi regionali del flusso sanguigno (accidente cerebrovascolare acuto (ACV), infarto miocardico embolico, infarto renale, danno retinico embolico, ecc.).
- sindrome autoimmune. Gli immunocomplessi circolanti causano vasculite, polisierosite, glomerulonefrite, capillarite ed epatite.
- Sindrome da insufficienza multiorgano. Innanzitutto, l'insufficienza renale terminale e l'insufficienza cardiaca acuta sono le principali cause di morte nell'EI.
Sintomi e segni di endocardite infettiva
- Temperature subfebbrili o febbre
- Perdita di peso, sudorazione notturna, affaticamento/debolezza, debolezza o perdita di energia, artralgie
- Sepsi con focus sconosciuto
- Segni di insufficienza cardiaca (dispnea, edema periferico)
- Disturbi del ritmo cardiaco
- Nuovi soffi al cuore
- Fenomeni embolici: ischemia periferica, petecchie, noduli di Osler, sintomi al sistema nervoso centrale (fino al 30% dei pazienti): perdita neurologica (encefalite embolica focale), deficit visivo (microembolia retinica)
- Disfunzione epatica (l'insufficienza renale acuta è stata descritta in circa il 30% dei pazienti); di solito cause multifattoriali: glomerulonefrite vasculitica, infarti renali, insufficienza di perfusione in infezioni sistemiche, tossicità da antibiotici, tossicità da mezzi di contrasto.
Le manifestazioni dell'endocardite infettiva all'esordio della malattia sono varie e dipendono sia da precedenti alterazioni delle valvole, sia dal tipo di microrganismo che ha causato la malattia.
L'endocardite infettiva esordisce come quadro clinico di una malattia infettiva acuta, accompagnata da febbre, grave intossicazione, danno multiorgano e insufficienza circolatoria a rapida insorgenza. Allo stesso modo, l'esordio della malattia si manifesta con una leggera febbre, sintomi inespressi, che rendono difficile la diagnosi della malattia. In una situazione del genere, un paziente che lamenta debolezza, perdita di peso corporeo, fa un lungo viaggio attraverso medici di varie specialità, finché non diventa evidente la comparsa di specifici cambiamenti della valvola. Oltre il 90% dei pazienti nota febbre, debolezza, perdita di appetito, perdita di peso, sudorazione, mialgia. Nell'85% dei pazienti nelle prime fasi della malattia compare un soffio caratteristico dell'insufficienza mitralica, aortica o tricuspide.
Emorragie tipiche, glomerulonefrite ed epatosplenomegalia si notano in circa il 30% dei pazienti con EI. Circa un terzo dei pazienti sviluppa una sindrome embolica di varia gravità. La complessità del quadro clinico dell'insorgenza della malattia impone al medico di assumere una possibile IE nelle seguenti situazioni.
- La comparsa di "nuovi" rumori nell'immagine auscultatoria del cuore. Modificazione del quadro auscultatorio di una cardiopatia preesistente.
- La comparsa di un'embolia in assenza di un'evidente fonte di emboli.
- La comparsa di febbre in un paziente con una valvola artificiale installata con un pacemaker.
- La comparsa di febbre in un paziente precedentemente trattato per endocardite infettiva.
- Febbre in un paziente con cardiopatia congenita.
- Febbre in un paziente immunocompromesso.
- Febbre conseguente a procedure che predispongono alla batteriemia.
- Febbre in un paziente con insufficienza cardiaca congestizia.
- La comparsa di febbre in un paziente con noduli di Osler, emorragie, embolie.
- La comparsa della febbre sullo sfondo della sindrome epatolienale.
La manifestazione dell'EI si manifesta con una serie di sintomi tipici; la loro rilevazione nei pazienti consente di ottimizzare la diagnostica.
Più tipico perendocardite infettiva:
- sindrome infiammatoria sistemica: febbre, brividi, sudorazione notturna, leucocitosi da spostamento a sinistra, anemia, emocolture positive;
- sindrome da intossicazione: debolezza, perdita di appetito, mialgia, artralgia, perdita di peso;
- sindrome emodinamica: formazione di cardiopatia valvolare con valvole precedentemente invariate e formazione di malattia valvolare combinata;
- sindrome da lesione autoimmune: glomerulonefrite, miocardite, epatite, vasculite;
- sindrome tromboembolica: embolia nel cervello, intestino, milza, rene, retina.
La manifestazione della malattia è regolata dal tipo di agente patogeno. Pertanto, l'EI stafilococcica è caratterizzata da intossicazione significativa, febbre frenetica, grave gravità della condizione, rapida comparsa di "screening" - embolia settica; L'endocardite infettiva fungina è caratterizzata da un modello di occlusione delle grandi arterie. Un quadro tipico dell'endocardite infettiva, descritto da W. Osler all'inizio del 20° secolo, è caratteristico dello streptococco viridescente.
La conclusione principale dell'analisi del quadro clinico dell'insorgenza della malattia è un'ampia gamma di sintomi e sindromi, che non possono essere algoritmizzati nemmeno all'inizio del 21° secolo. La sua interpretazione richiede un'elevata professionalità del medico.
Negli anziani l'endocardite infettiva non è la stessa che si verifica nei giovani. Spesso all'inizio della malattia i sintomi sono lievi. Mal di testa, vertigini, debolezza, malessere possono disturbare. Il paziente è pallido, letargico, l'appetito è ridotto. Sullo sfondo di un aumento della temperatura, il dolore al cuore è allarmante. A volte appare una piccola eruzione cutanea sulla pelle, soprattutto sulla superficie interna delle mani.
Per un'impostazione precisa diagnosi di endocardite infettivaè necessario condurre una serie di studi in ambito ospedaliero: un ECG, un esame del sangue per rilevare i microbi che hanno causato la malattia, un esame del sangue generale, ecc.
Valore prognostico dei sintomi clinici dell'esordio della malattia
La mortalità ospedaliera nei pazienti con EI varia dal 9,6 al 26%. Il tasso di mortalità estremamente elevato, anche nell'era del trattamento antibiotico e dell'intervento chirurgico precoce, richiede l'introduzione nella pratica quotidiana di una valutazione prognostica preliminare dei sintomi dell'insorgenza della malattia. Ciò consentirà di ottimizzare il trattamento della malattia, ad esempio, considerando il trattamento chirurgico come principale già nella fase di insorgenza della malattia. La valutazione prognostica dei sintomi si basa su 4 fattori: il ritratto clinico del paziente; manifestazioni extracardiache della malattia; caratteristiche dell'agente eziologico della malattia; risultati dell'ecocardiogramma. La prognosi è sempre più difficile quando l'endocardite infettiva è localizzata sulle valvole del cuore "sinistro", e un paziente con insufficienza circolatoria rapidamente progressiva, glomerulonefrite e flora accertata di S. aureus ha un alto rischio di morte e necessita di un trattamento chirurgico al più presto. fasi della malattia. Il rischio di morte in questi pazienti raggiunge il 79%. Bassi valori di EF o la loro rapida diminuzione in breve tempo, diabete mellito, accidente cerebrovascolare (è possibile un'embolia ad altri organi) aumentano il rischio di morte di oltre il 50%. Pertanto, nelle moderne tattiche di gestione di un paziente, il principio della valutazione prognostica precoce delle condizioni dei pazienti è chiaramente formato per formare un gruppo di pazienti che richiedono il trattamento chirurgico il più presto possibile.
La presenza di almeno uno dei sintomi è sufficiente per valutare la prognosi del paziente come severa.
Sintomi nel periodo post-debutto
Uno dei sintomi più comuni della malattia è la febbre. Il grado di aumento della temperatura corporea è diverso. Con un esordio acuto della malattia, di norma, la febbre raggiunge un livello elevato e la differenza tra la temperatura corporea massima e minima può raggiungere 2-3 ° C. Con un esordio subacuto della malattia, la temperatura è subfebbrile. I pazienti debilitati potrebbero non avere febbre. L'assenza di febbre è considerata un indicatore prognostico del decorso grave della malattia. Nei casi più gravi, la febbre è accompagnata da brividi e sudorazione profusa. Molto spesso, tutto / l'aumento della temperatura avviene durante la notte, il che porta allo "sfarfallio" del paziente.
Insieme alla febbre compaiono sintomi caratteristici dell'insufficienza circolatoria: mancanza di respiro, tachicardia. La base dell'insufficienza circolatoria non è solo il disturbo dell'emodinamica intracardiaca dovuto alla distruzione delle valvole, ma anche lo sviluppo di miocardite. La combinazione di miocardite e distruzione dei lembi valvolari porta alla rapida formazione di rimodellamento delle camere cardiache. Durante questo periodo, il medico che ascolta regolarmente il cuore, oltre ai rumori caratteristici, determina una diminuzione del volume del primo tono al 1° punto di auscultazione. Questo si riferisce ai segni di una prognosi severa. Nello stesso periodo è possibile un cambiamento nel colore della pelle. S.P. Botkin, W. Osler descrisse questo colore come il colore del caffè con il latte e gli attribuì grande importanza. Nella clinica moderna questo sintomo ha perso il suo significato e non viene nemmeno menzionato nei manuali come importante dal punto di vista diagnostico.
Ogni paziente nota artralgia, mialgia. Il dolore è sistemico e solitamente simmetrico. Il dolore locale non è tipico e richiede l'esclusione dell'embolia o dell'insorgenza di osteomielite.
Un paziente su tre mostra chiaramente segni di rapida perdita di peso. Questo è un sintomo importante che riflette il grado di intossicazione e la gravità della prognosi. Le osservazioni di pazienti con endocardite infettiva hanno dimostrato che l'eccesso di tessuto adiposo prima della malattia è associato al numero di decessi.
Un paziente su sette nota mal di testa e aumento della pressione sanguigna. Il suo aumento si basa sullo sviluppo di glomerulonefrite, che è accompagnato da proteinuria, diminuzione della velocità di filtrazione glomerulare e aumento dei livelli di creatinina. Il controllo della velocità di filtrazione glomerulare è obbligatorio per tutti i pazienti con endocardite infettiva, poiché consente di calcolare adeguatamente le dosi di antibiotici somministrati. Durante il periodo di un quadro clinico dettagliato, il medico si aspetta tradizionalmente di rilevare manifestazioni caratteristiche della malattia alla periferia: noduli di Osler, macchie di Roth, emorragie del letto ungueale, macchie di Janeway. Queste stimmate della malattia erano di grande importanza nell’era pre-antibatterica, ma sono rare nella clinica moderna, la loro frequenza<5%.
S.P. Botkin attribuiva grande importanza alla palpazione della milza, evidenziando diversi tipi di densità del suo bordo, che consentono di valutare la gravità della malattia. Nell’era del trattamento antibiotico dell’EI, la splenomegalia grave può essere osservata in meno del 5% dei pazienti.
Pertanto, il quadro clinico dell’endocardite infettiva è cambiato in modo significativo. La clinica è dominata da un'alta frequenza di forme cancellate, sindrome da intossicazione, sindrome da lesioni autoimmuni e sindrome da disturbi emodinamici. Praticamente nessun sintomo di shock.
Con un farmaco antibatterico adeguatamente selezionato, la febbre può essere fermata fino a 7-10 giorni. La persistenza della febbre per lungo tempo indica la presenza di un agente infettivo S. aureus o l'aggiunta di un'infezione nosocomiale (secondaria) o la presenza di un ascesso.
La normalizzazione della temperatura non significa la guarigione del paziente. In molti modi, il quadro clinico del periodo post-esordio della malattia è costituito da complicanze della malattia. Le complicanze tipiche dell'endocardite infettiva sono l'insufficienza circolatoria, il processo infettivo incontrollato (ascesso, aneurisma, fistola, crescita della vegetazione, persistenza della temperatura > 7-10 giorni), embolia, manifestazioni neurologiche, insufficienza renale acuta. Una complicazione si osserva nel 70% dei pazienti, due complicazioni contemporaneamente - nel 25% dei pazienti.
Nei tossicodipendenti, la valvola tricuspide è più spesso colpita con lo sviluppo di tromboembolia settica nei vasi del piccolo circolo (polmonite infartuale bilaterale multipla con decadimento).
Trattamento dell'endocardite infettiva
Con endocardite infettiva o solo se sospetta, il paziente deve essere ricoverato urgentemente! L'autotrattamento a casa è in pericolo di vita.
In ambiente ospedaliero, il trattamento del paziente inizia con la nomina di antibiotici. Inizialmente prescritta penicillina. Ha una bassa tossicità e viene utilizzato in grandi dosi (20 milioni di unità al giorno o più se necessario). Ma negli anziani va comunque usato con cautela, poiché a dosaggi elevati può aumentare l’insufficienza cardiaca e il dolore al cuore.
Di solito la penicillina viene combinata con qualche altro antibiotico. Ad esempio, con la gentamicina (a una dose media di 240-300 mg al giorno). In alcuni casi vengono utilizzati ampiks, oxacillina (6-10 mg al giorno), cefalosporine (4-10 g al giorno).
Inoltre, vengono utilizzati anche farmaci di gruppi come agenti antipiastrinici, anticoagulanti, glucocorticoidi, immunoglobuline, agenti disintossicanti.
Con una forte distruzione delle valvole cardiache, viene decisa la questione dell'esecuzione di un'operazione al cuore. Nei pazienti anziani, l'operazione viene eseguita in un momento precedente (nelle prime 3-4 settimane di malattia), altrimenti in futuro si verificheranno rapidamente gravi complicazioni.
Medicina tradizionale può essere utilizzato solo come trattamento ausiliario e solo durante il periodo di recupero!
- Occorrente: fiori di mughetto - 4 g.
- Cucinando. Preparare un infuso di 4 g di materia prima e 200 ml di acqua bollente.
- Applicazione. Prendi 1 cucchiaio. l. ogni 2 ore
- Il miele ha proprietà medicinali.
Trattamento antimicrobico
Questo trattamento è il cardine del trattamento per l’endocardite infettiva. Sono stati gli antibiotici a trasformare l'EI da una malattia mortale assolutamente incurabile in una malattia curabile. Negli ultimi decenni si sono verificati sviluppi significativi nello studio della flora che causa l'EI, che hanno permesso di formulare le principali tendenze nel moderno trattamento antibatterico dell'endocardite infettiva.
- Ovunque si è osservato una crescente resistenza degli agenti patogeni agli antibiotici utilizzati e un aumento del numero di ceppi di stafilococchi resistenti all'oxacillina. Ad esempio, nella Federazione Russa, l'incidenza dello S. aureus resistente all'oxacillina è del 33,5%. La stessa cifra negli Stati Uniti è raddoppiata in 5 anni. Tra il 2002 e il 2007, l’incidenza degli enterococchi resistenti alla vancomicina è aumentata dal 4,5% al 10,2%. La tendenza generale è la registrazione diffusa di ceppi multiresistenti di stafilococco, enterococco, pneumococco e altri microrganismi. Ciò ha portato ad una diminuzione dell’efficacia dei tradizionali regimi di trattamento antibiotico per l’endocardite infettiva.
- È dimostrato il fatto della sopravvivenza della microflora dopo il trattamento antibatterico nelle vegetazioni e nei film batterici che ricoprono la valvola artificiale. I batteri in essi contenuti sono praticamente protetti dai farmaci antibatterici. Gli esperti vedono una soluzione a questo problema nell'aumento della durata del trattamento da 2 a 4-6 settimane per l'EI delle proprie valvole e fino a 6 mesi per l'EI delle valvole protesiche.
- L'accento è posto sull'uso precoce di un regime di una combinazione di farmaci antibatterici, che dovrebbe essere discusso in tutti i casi di persistenza della febbre durante il trattamento antibatterico.
- Viene sottolineata l'organizzazione capillare di un servizio microbiologico di alta qualità, che consente di scegliere il più presto possibile un trattamento antibatterico eziologicamente giustificato. È molte volte più efficace del trattamento antibiotico empirico dell’EI con un agente patogeno sconosciuto.
- Nei casi gravi di endocardite infettiva, la combinazione di trattamento antibatterico e chirurgico seguita dalla correzione del regime di trattamento antibatterico dopo l'intervento chirurgico basato su materiale PCR di vegetazioni ed emboli è stata riconosciuta come la più efficace.
Il trattamento dell’endocardite infettiva con antibiotici è diviso in due approcci fondamentalmente diversi. A - trattamento dell'EI con un patogeno identificato e B - trattamento dell'EI con un patogeno sconosciuto.
Trattamento dell'endocardite infettiva con un agente patogeno accertato
Endocardite infettiva streptococcica
Streptococchi sensibili alla penicillina
La tattica di scelta della modalità di utilizzo degli antibiotici dipende dal valore della concentrazione minima inibente (MIC). Se l'IPC<0,125 мг/л (в 90% случаев неосложненного течения инфекционного эндокардита), то двухнедельное лечение пенициллином в комбинации с цефтриаксоном или гентамицином (или нетимицином) оптимально. Назначая аминогликозиды (гентамицин, нетимицин), следует удостовериться, что функция почек сохранена. При умеренном снижении их функции или исходно нормальных показателях можно обсуждать режим использования гентамицина 1 раз в день. Больным с аллергией на?-лактамные антибиотики показан ванкомицин.
L’antibiotico teicoplanina, ampiamente discusso, manca di prove conclusive efficaci.
Streptococchi resistenti alla penicillina
Se MIC > 0,125 mg/l, ma<2,0 мг/л, то стрептококки относительно резистентны. Если МПК >2,0 mg/l, tale ceppo viene riconosciuto come assolutamente resistente. In numerose raccomandazioni, i ceppi sono riconosciuti come assolutamente resistenti se la MIC > 0,5 mg/l. Recentemente si è registrato un aumento significativo dei ceppi assolutamente resistenti alle penicilline, superando il livello del 30%. Il quadro clinico di tale endocardite infettiva è caratterizzato dalla gravità del decorso, la mortalità è del 17%. Nonostante gli antibiotici di base comuni nel trattamento dei ceppi penicillino-resistenti e sensibili alla penicillina dell'EI, si distinguono la durata del trattamento e la combinazione di farmaci antibatterici. Il regime di trattamento breve è escluso. La durata del trattamento aumenta da 2 settimane per i ceppi penicillina-sensibili a 4 settimane per i ceppi penicillino-resistenti. Con una MIC elevata, la vancomicina diventa il farmaco di scelta. Qualsiasi forma di resistenza (relativa o assoluta) implica una durata del trattamento con aminoglicosidi fino a 4 settimane insieme ai farmaci di base.
L'endocardite infettiva causata da questi agenti patogeni è relativamente rara nella clinica moderna. Data l'elevata incidenza della meningite (caratteristica della polmonite da streptococco), è importante determinare come trattare l'endocardite infettiva, se è associata o meno a meningite. Nei casi in cui la meningite è assente, le tattiche di trattamento sono determinate a livello dell'IPC (ceppo sensibile, relativamente sensibile, resistente). In combinazione con la meningite, la penicillina dovrebbe essere esclusa a causa della sua scarsa capacità di penetrare nel liquido cerebrospinale.
Il farmaco d’elezione in questa situazione è il ceftriaxone.
Gli streptococchi P-emolitici hanno una serie di caratteristiche:
- il gruppo A è caratterizzato da un decorso relativamente lieve della malattia e, di regola, è rappresentato da ceppi sensibili alla penicillina;
- il gruppo B ha iniziato a essere rilevato recentemente nei pazienti;
- per i microrganismi dei gruppi B, C e G è caratteristica un'elevata incidenza di ascessi. A questo proposito, la questione del trattamento chirurgico deve essere affrontata fin dai primi giorni di malattia.
Per tutti i gruppi, la scelta del regime streptococcico dipende dall'IPC. Il regime di trattamento breve è controindicato categoricamente.
Endocardite infettiva da stafilococco aureo
L'endocardite infettiva causata da S. aureus è caratterizzata da un decorso grave e da una rapida distruzione della valvola. L'EI causata da ceppi coagulasi-negativi è caratterizzata dalla formazione di un ascesso perivalvolare, complicanze settiche metastatiche. Se viene verificata la flora stafilococcica, la durata del trattamento dovrebbe superare le 4 settimane e raggiungere le 6 settimane.
Quando si identifica la flora stafilococcica, la questione più importante per il medico è la sensibilità della flora alla meticillina. La flora resistente alla meticillina è caratterizzata da un decorso grave e da un'elevata mortalità. Il farmaco principale, il farmaco di scelta nel trattamento dell’EI da stafilococco è l’oxacillina. È stata dimostrata l'elevata efficacia dell'oxacillina nell'EI stafilococcica delle proprie valvole del lato sinistro con un decorso senza complicazioni con una durata del trattamento di 4 settimane, con complicanze dell'endocardite infettiva, una durata del trattamento di 6 settimane. Per l'endocardite infettiva da stafilococco non complicata delle valvole cardiache destre, si raccomanda un ciclo di trattamento di 2 settimane. Clinicamente, non esistono prove convincenti dell’efficacia clinica della gentamicina nell’EI da stafilococco, tuttavia, la posizione concordata degli esperti consente di aggiungere la gentamicina al trattamento con oxacillina per 3-5 giorni per l’EI di valvole naturali e fino a 2 settimane per l’EI di valvole protesiche .
L'inclusione della rifampicina nel trattamento antibatterico combinato dell'endocardite infettiva è dovuta al fatto che la rifampicina è altamente efficace contro le pellicole batteriche che ricoprono le superfici metalliche di pacemaker e valvole artificiali. Nei pazienti con una reazione allergica alla penicillina (non una reazione di tipo anafilattico), sono possibili le cefalosporine di 4a generazione. Con una reazione anafilattica alla penicillina, è possibile solo la vancomicina con gentamicina.
I pazienti con stafilococchi resistenti alla meticillina e alla vancomicina costituivano una nicchia speciale nel trattamento dell'endocardite infettiva. Il monitoraggio della flora nei pazienti affetti da EI mostra che negli ultimi 3-5 anni il livello di resistenza è aumentato rapidamente. In caso di resistenza alla meticillina, il farmaco di scelta è la vancomicina. La nomina di altri gruppi (in pratica in queste situazioni vengono prescritti i carbapenemi) è errata, perché Gli MRSA sono resistenti ad essi. La prognosi di un paziente con EI causata da ceppi resistenti alla vancomicina è grave. In questa situazione è possibile utilizzare menezolid. È in fase di studio il ruolo di un nuovo antibiotico quinupristin dalfopristin (synercyte), un nuovo lipopeptide ciclico - daptomicina (6 mg/kg al giorno per via endovenosa). In tutti i casi di resistenza alla vancomicina, il paziente deve essere gestito insieme a un farmacologo clinico.
In caso di EI protesica della valvola, il medico deve determinare con precisione la data dell'intervento. Se l'endocardite infettiva da stafilococco si è sviluppata prima di 1 anno, è stata causata da stafilococco aureo resistente alla meticillina coagulasi-negativo. In questa situazione, la combinazione di vancomicina con rifampicina e gentamicina per 6 settimane è ottimale. Se il ceppo è resistente alla gentamicina o ad altri aminoglicosidi, è necessario aggiungere un fluorochinolone al posto dell'aminoglicoside nella combinazione di tre antibiotici.
Endocardite infettiva enterococcica
L'endocardite infettiva enterococcica è causata nel 90% dei casi da Enterococcus faecalis e molto meno spesso da E. faecium. Entrambi i ceppi sono caratterizzati da una sensibilità estremamente bassa agli antibiotici, che ovviamente richiede un trattamento decente fino a 6 settimane e una combinazione obbligatoria di farmaci antibatterici basata sulla sinergia dell'attività battericida delle penicilline, della vancomicina con gli aminoglicosidi. L'essenza di questa combinazione è che le penicilline e la vancomicina aumentano la permeabilità della membrana dell'enterococco agli aminoglicosidi. L'aumento della permeabilità porta alla creazione di un'alta concentrazione di farmaci nei ribosomi all'interno della cellula, che porta ad un pronunciato effetto battericida. Le linee guida statunitensi (AHA) ed europee differiscono sulla scelta del primo farmaco nel trattamento dell'endocardite infettiva enterococcica. Negli Stati Uniti la penicillina è consigliata a una dose massima di 30 milioni UI/die. Nelle raccomandazioni europee il farmaco di scelta è l’amoxicillina, 200 mg/kg al giorno, per via endovenosa, o l’ampicillina alla stessa dose. Il secondo farmaco di scelta per il trattamento combinato è la gentamicina. Se la flora è resistente alla gentamicina, deve essere sostituita con streptomicina alla dose di 15 mg / kg al giorno per via endovenosa o intramuscolare ogni 12 ore, è obbligatorio il monitoraggio della funzionalità renale. L'eliminazione della flora enterococcica è efficace solo con una combinazione di penicilline e aminoglicosidi.
In un certo numero di pazienti si nota resistenza alla serie di penicilline; in queste situazioni, la preparazione della penicillina viene sostituita con vancomicina. Quando il ceppo di Enterococchi è poliresistente, anche alla vancomicina, è consigliabile iniziare il trattamento con minezolid, 1200 mg/die, per via endovenosa, in 2 dosi.
I seguenti punti sono importanti per la pratica:
- solo due aminoglicosidi, gentamicina e streptomicina, hanno un'azione sinergica con le penicilline, gli altri aminoglicosidi non hanno tale effetto;
- se l'endocardite infettiva enterococcica è causata da E. faecalis resistente alla penicillina, alla vancomicina e agli aminoglicosidi, la durata del trattamento deve superare le 8 settimane;
- è possibile una combinazione di due antibiotici α-lattamici: ampicilline con ceftriaxone o carbapenem (glipenem) con ampicillina. Tuttavia, questa esperienza è stata poco studiata, classe di evidenza 2C.
Endocardite infettiva causata dal gruppo NASEK
Un certo numero di microrganismi gram-negativi sono riuniti nel gruppo NASEC. Complessivamente questi microrganismi causano dal 5 al 10% di tutti i casi di endocardite infettiva delle valvole naturali. Una caratteristica distintiva del NASEK è la crescita lenta, che rende difficile determinare la concentrazione minima inibente. Numerosi microrganismi del gruppo NASEC secernono β-lattamasi, il che rende difficile l’uso delle penicilline non protette come farmaci di prima scelta. È stata dimostrata l'efficacia del ceftriaxone alla dose di 2 mg al giorno per 4 settimane.
Per i ceppi che non producono β-lattamasi, si è dimostrato efficace l'ampicillina, 12 g al giorno, IV, 4-6 dosi, più gentamicina, 3 mg/kg al giorno, in 2 o 3 dosi. Durata del trattamento - 4 settimane.
L'efficacia del fluorochinolone ciprofloxacina, 400 mg, per via endovenosa 2 volte al giorno, sul NASEC è inferiore a quella della combinazione di aminopenicillina + aminoglicoside.
Nel 2007, l'International Infective Endocarditis Group ha segnalato EI causata da flora gram-negativa non NASEC. Tale IE è stata rilevata in 49 (8%) dei 276 pazienti con IE inclusi nel registro. La gravità del decorso della malattia consente ai ricercatori di raccomandare il trattamento chirurgico il prima possibile + trattamento con antibiotici p-lattamici insieme a aminoglicosidi.
Endocardite infettiva da agenti patogeni rari
Nella stragrande maggioranza dei casi, gli agenti patogeni rari non vengono rilevati con i metodi convenzionali e il paziente rientra nella categoria delle endocarditi infettive con un agente patogeno non identificato. Nell'ultimo anno, tali agenti patogeni includono microrganismi. Nonostante la loro rarità, è obbligatorio uno speciale esame batteriologico dopo emocolture negative.
La durata dell'endocardite infettiva causata da rare forme di microrganismi non è stata stabilita. I farmaci batteriostatici doxiciclina, eritromicina sono usati nel trattamento dell'endocardite infettiva solo in questa situazione.
Trattamento empirico
Quando non è stato possibile identificare la flora che ha causato l'endocardite infettiva, o l'analisi microbiologica non è possibile, o il paziente è in attesa dei risultati di laboratorio, il medico deve determinare la scelta del farmaco antibatterico. Quando si prende una decisione, è necessario sapere se esiste una protesi valvolare, quando è stata installata, se il paziente ha precedentemente ricevuto (quando) un trattamento antibatterico (quale), se esiste un'intolleranza agli antibiotici p-lattamici.
In queste situazioni si consiglia di iniziare il trattamento con ampicillina-sulbactam, 12 g/die, in associazione con gentamicina. In caso di intolleranza alla penicillina, la vancomicina viene prescritta in combinazione con ciprofloxacina e gentamicina. Nell’IE della valvola protesica, la combinazione di vancomicina con rifampicina e gentamicina è efficace. È opportuno aggiungere cefipime a questa combinazione se la protesi è stata eseguita 2 mesi prima della malattia e la probabilità di aggiunta di aerobi gram-negativi è alta.
Prevenzione dell'endocardite infettiva
Innanzitutto la prevenzione dell'endocardite infettiva va effettuata nei pazienti con valvole alterate, cioè con difetti cardiaci, indipendentemente dal fatto che siano stati operati o meno.
Come misura prioritaria, i focolai di infezione di qualsiasi localizzazione vengono disinfettati. Durante l'estrazione di un dente, la tonsillectomia, l'installazione di un catetere urinario e la sua rimozione, qualsiasi operazione urologica, fibrogastroscopia, colonscopia, è necessario utilizzare antibiotici profilatticamente in brevi cicli. Se al paziente viene diagnosticata un'intolleranza ai farmaci penicillinici, vengono utilizzate amoxicilline, 2 g 1 ora prima dell'intervento (è possibile l'ampicillina). Con intolleranza alle aminopenicilline, vengono utilizzati i macrolidi.
Per interventi nell'area urogenitale, fibrocolonscopia, gastroscopia in pazienti ad alto rischio di endocardite infettiva, è consigliabile un trattamento profilattico con una combinazione di farmaci: ampicillina, 2,0 g per via endovenosa + gentamicina, 1,5 mg/kg per via endovenosa un'ora prima della manipolazione e un'ora dopo la manipolazione, somministrare per via orale ampicillina, 2,0 g Nei pazienti a rischio moderato è possibile limitare l'uso di questa combinazione solo prima dell'intervento. In caso di intolleranza alle aminopenicilline in pazienti ad alto e moderato rischio, è consigliabile utilizzarle insieme alla vancomicina nel regime terapeutico 1-2 ore prima dell'intervento.
Sopravvivenza e mortalità nei pazienti con endocardite infettiva
La sopravvivenza a 10 anni è del 60-90%; Il traguardo dei 20 anni viene raggiunto dal 50% dei pazienti guariti. La sopravvivenza dipende da una serie di fattori. È più elevato quando la malattia esordisce più precocemente, nei pazienti sottoposti a trattamento chirurgico. Una grande mortalità a lungo termine è associata a NK.
ENDOCARDITE INFETTIVA, ACUTA E SUACCUTA- si tratta di una malattia che si manifesta in modo acuto o subacuto a seconda del tipo di sepsi, caratterizzata da alterazioni infiammatorie o distruttive nell'apparato valvolare del cuore, endocardio parietale, endotelio dei grandi vasi, circolazione dell'agente patogeno nel sangue, danno tossico al organi, sviluppo di reazioni immunopatologiche, presenza di complicanze tromboemboliche.
La causa di questa malattia sono agenti patogeni come streptococchi, stafilococchi, enterococchi.
Lo sviluppo dell'endocardite infettiva richiede la presenza di batteriemia, danno endocardico, indebolimento della resistenza del corpo. L'ingresso massiccio nel flusso sanguigno dell'agente patogeno e la sua virulenza sono condizioni necessarie, ma non sufficienti per lo sviluppo dell'endocardite infettiva. In una situazione normale, il microrganismo nel letto vascolare non può essere fissato sull'endotelio, poiché viene più spesso assorbito dai fagociti. Ma se l'agente patogeno viene catturato "nella rete" del trombo parietale, le cui strutture lo proteggono dai fagociti, allora l'agente patogeno si moltiplica nel sito di fissazione. L'impianto dell'agente patogeno avviene più spesso in luoghi con flusso sanguigno lento, endotelio ed endocardio danneggiati, dove si creano condizioni favorevoli per fissare nel flusso sanguigno una colonia di microrganismi inaccessibili alla distruzione.
L'endocardite infettiva acuta si presenta come una complicanza della sepsi, caratterizzata dal rapido sviluppo della distruzione valvolare e da una durata non superiore a A-5 settimane. Il decorso subacuto è più comune (dura più di 6 settimane). Un sintomo caratteristico è la febbre con andamento ondulato, c'è un'elevata condizione di subfebbrile, supposte di temperatura sullo sfondo di una temperatura normale o subfebrilare. Tegumenti come il caffè con latte. La sconfitta dell'endocardio si manifesta con lo sviluppo di difetti mitralici e aortici. La sconfitta dei polmoni nell'endocardite infettiva si manifesta con mancanza di respiro, ipertensione polmonare, emottisi. Un aumento del fegato è associato alla reazione del mesenchima dell'organo al processo settico. Il danno renale si manifesta sotto forma di glomerulonefrite, nefropatia tossica infettiva, infarto renale, amiloidosi. Il danno al sistema nervoso centrale è associato allo sviluppo di meningite, meningoencefalite, emorragie parenchimali o subaracnoidee. Il danno agli organi visivi si manifesta con l'improvviso sviluppo di embolia dei vasi retinici con cecità parziale o completa, lo sviluppo di uveite.
Diagnostica
Sulla base di reclami, dati clinici e di laboratorio. Nell'esame del sangue generale - anemia, leucocitosi o leucopenia, aumento della VES, in un esame del sangue biochimico - diminuzione dell'albumina, aumento delle globuline, aumento della proteina C-reattiva, fibrinogeno. Emocoltura positiva per patogeni tipici dell'endocardite infettiva. L'ecocardiografia consente di identificare il segno morfologico dell'endocardite infettiva - vegetazione, valutare il grado e la dinamica del rigurgito valvolare, diagnosticare ascessi valvolari, ecc.
Diagnosi differenziale
Con reumatismi, malattie diffuse del tessuto connettivo, febbre di origine sconosciuta.
Endocardite infettiva subacuta
L'endocardite infettiva subacuta (SIE) nella maggior parte dei casi viene diagnosticata in un quadro clinico dettagliato. Dal momento in cui compaiono i primi sintomi clinici alla diagnosi, spesso trascorrono 2-3 mesi. Il 25% di tutti i casi di PIE vengono diagnosticati durante un intervento di chirurgia cardiaca o un'autopsia.
Clinica PIE. Nei casi classici si manifesta prima la febbre con brividi e aumento della sudorazione. Un aumento della temperatura corporea da subfebbrile a frenetico si verifica nel 68-100% dei pazienti. Spesso la febbre ha un carattere ondulatorio, che è associato a un'infezione respiratoria o all'esacerbazione di un'infezione focale cronica. La Torta stafilococcica è caratterizzata da febbre, brividi che durano settimane e sudorazione profusa. In alcuni pazienti affetti da PIE, la temperatura corporea aumenta solo in determinate ore del giorno. Allo stesso tempo, è normale quando la PIE è combinata con glomerulonefrite, insufficienza renale, grave scompenso cardiaco, soprattutto negli anziani. In questi casi è consigliabile misurare la temperatura ogni 3 ore per 3-4 giorni e non prescrivere antibiotici.
La sudorazione può essere sia generale che locale (testa, collo, metà anteriore del corpo, ecc.). Si verifica quando la temperatura scende e non apporta miglioramenti al benessere. Con la sepsi streptococcica, si osservano brividi nel 59% dei casi. Nella maggior parte dei casi, è impossibile identificare la porta d'ingresso dell'infezione nella PIE. Pertanto, febbre, brividi e aumento della sudorazione sono la triade caratteristica della sepsi subacuta.
Dei fenomeni di intossicazione, perdita di appetito ed efficienza, debolezza generale, perdita di peso, mal di testa, artralgia, mialgia. In alcuni pazienti, il primo sintomo della malattia è un'embolia nei vasi della circolazione sistemica. L'embolia nei vasi cerebrali viene interpretata come una lesione aterosclerotica negli anziani, il che rende difficile una diagnosi tempestiva. Durante l'osservazione ospedaliera, tali individui riscontrano febbre, anemia, aumento della VES fino a 40-60 mm / h. Una tale clinica si osserva con la sepsi streptococcica.
All'esordio della malattia raramente vengono diagnosticati sintomi come mancanza di respiro, tachicardia, aritmia e cardialgia. Circa il 70% dei pazienti affetti da PIE hanno la pelle pallida con una sfumatura giallastra ("café au lait"). Trova petecchie sulle superfici laterali del corpo, braccia, gambe. Molto raramente c'è un sintomo positivo di Lukin-Libman. I nodi di Osler si trovano sui palmi sotto forma di piccoli noduli rossi dolorosi. Le eruzioni cutanee emorragiche si verificano con la sepsi stafilococcica subacuta. Forse lo sviluppo di necrosi con emorragie nella pelle. I suddetti cambiamenti cutanei sono dovuti a vasculite immunitaria e perivasculite. La mono e oligoartrite delle grandi articolazioni, la mialgia e l'artralgia vengono diagnosticate nel 75% dei pazienti. Negli ultimi decenni, la clinica della PIE primaria è cambiata, le lesioni cutanee stanno diventando meno comuni.
Il sintomo patognomonico della PIE sono i soffi cardiaci, che si verificano in connessione con il danno valvolare con lo sviluppo del rigurgito aortico. Valore diagnostico ha un soffio diastolico, che è meglio udibile in posizione seduta con il busto inclinato in avanti o a sinistra. Con la graduale distruzione dei lembi della valvola aortica, l'intensità del soffio diastolico lungo il bordo sinistro dello sterno aumenta e il secondo tono sull'aorta diventa più debole. C'è una diminuzione della pressione sanguigna diastolica a 50-60 mm Hg. Arte. con una differenza significativa nella pressione del polso. Il polso diventa alto, veloce, forte (altus, celer, magnus) - polso di Corrigan. I confini del cuore vengono spostati a sinistra e in basso. L'insufficienza della valvola aortica può formarsi entro 1-2 mesi.
Molto meno frequentemente, la PIE primaria colpisce la valvola mitrale o tricuspide. La presenza e l'aumento dell'intensità del soffio sistolico all'apice del cuore con un indebolimento del primo tono testimonia la sconfitta della valvola mitrale. A causa del rigurgito mitralico successivamente aumenta la cavità del ventricolo sinistro (LV) e dell'atrio. La sconfitta della valvola tricuspide con insufficienza viene diagnosticata nei tossicodipendenti. Di importanza diagnostica è l'aumento del soffio sistolico sul processo xifoideo dello sterno, che aumenta all'altezza dell'inspirazione, meglio a destra (sintomo Rivero-Corvalo). Spesso l'insufficienza tricuspide è combinata con un decorso ricorrente di tromboembolia dei rami piccoli e medi dell'arteria polmonare. Nella Torta secondaria, l'infiammazione batterica delle valvole si sviluppa sullo sfondo di malattie cardiache reumatiche o congenite. Poiché i processi distruttivi avvengono in violazione dell'emodinamica intracardiaca, durante l'osservazione dinamica aumenta l'intensità del rumore o appare un nuovo soffio valvolare. A volte si può sentire una sorta di rumore musicale: "il cigolio dell'uccello". Il suo aspetto è dovuto alla perforazione dei lembi valvolari e può svilupparsi un'insufficienza cardiaca ventricolare sinistra acuta. Un processo purulento-metastatico dalle valvole può spostarsi nel miocardio e nel pericardio con lo sviluppo della miopericardite. Un aumento dello scompenso cardiaco cronico, delle aritmie, del blocco cardiaco, del rumore di attrito pericardico, ecc. indica un danno al miocardio e al pericardio.
Un'importante sindrome della PIE sono le complicanze tromboemboliche e purulento-metastatiche. Le metastasi purulente penetrano nella milza (58,3%), nel cervello (23%), nei polmoni (7,7%). Vengono descritti casi di embolia del midollo spinale con paraplegia, vasi coronarici del cuore con sviluppo di infarto miocardico e arteria retinica centrale con cecità in un occhio. Con l'embolia, la milza è moderatamente ingrossata, alla palpazione nella parte destra è morbida, sensibile. Si nota dolore acuto con perisplenite o infarto della milza. L'ingrossamento e il danno alla milza vengono diagnosticati utilizzando metodi quali tomografia computerizzata, ecografia, scansione.
Al secondo posto dopo la sconfitta della milza - danno ai reni. Ematuria macroscopica con proteinuria e forte mal di schiena caratteristici di tromboembolia e microinfarto renale. In alcuni casi, l’EI primaria inizia come glomerulonefrite diffusa (“PE da maschera renale”). È caratterizzato da microematuria, proteinuria, aumento della pressione sanguigna. Di grande importanza nella glomerulonefrite appartiene all'infiammazione dell'immunocomplesso con la deposizione di depositi immunitari sulla membrana basale. Il danno renale nella PIE peggiora la prognosi a causa del rischio di sviluppare insufficienza renale cronica.
I cambiamenti nel sangue dipendono dalla gravità del processo settico. L'EI acuta è caratterizzata da anemia ipocromica rapidamente progressiva con aumento della VES fino a 50-70 mm/h, che si sviluppa entro 1-2 settimane. L'anemia ipo- o normocromica viene diagnosticata nella metà dei pazienti con PIE, mentre entro pochi mesi si verifica una diminuzione dei livelli di emoglobina. Con lo scompenso cardiaco non vi è alcun aumento della VES. Il numero di leucociti varia dalla leucopenia alla leucocitosi. Una leucocitosi significativa indica la presenza di complicanze purulente (polmonite ascessuale, attacchi cardiaci, embolia). Nell'EI acuta, la leucocitosi raggiunge 20-10 al nono grado / l con uno spostamento a sinistra (fino a 20-30 neutrofili da taglio).
Tra i metodi diagnostici ausiliari, di particolare importanza è lo studio delle urine, in cui si riscontrano proteinuria, cilindridruria ed ematuria. Nel sangue c'è disproteinemia con una diminuzione del livello di albumina, un aumento delle globuline alfa-2 e gamma fino al 30-40%. La torta è caratterizzata da ipercoagulabilità con un aumento del livello di fibrinogeno e proteina C. L'elettrocardiografia rivela aritmia extrasistolica, fibrillazione e flutter atriale, vari disturbi della conduzione in soggetti con miopericardite.
Altre notizie
Endocardite

informazioni generali
Endocardite- infiammazione del guscio (interno) del tessuto connettivo del cuore, che riveste le sue cavità e valvole, spesso di natura infettiva. Si manifesta con elevata temperatura corporea, debolezza, brividi, mancanza di respiro, tosse, dolore toracico, ispessimento delle falangi ungueali come "bacchette". Spesso porta a danni alle valvole cardiache (di solito aortica o mitrale), allo sviluppo di difetti cardiaci e insufficienza cardiaca. Sono possibili ricadute, la mortalità nell'endocardite raggiunge il 30%.
L'endocardite infettiva si verifica quando sono presenti le seguenti condizioni: batteriemia transitoria, danno all'endocardio e all'endotelio vascolare, cambiamenti nell'emostasi e nell'emodinamica, compromissione dell'immunità. La batteriemia può svilupparsi con focolai esistenti di infezione cronica o manipolazioni mediche invasive.
Il ruolo principale nello sviluppo dell'endocardite infettiva subacuta appartiene allo streptococco verde, nei casi acuti (ad esempio dopo un intervento chirurgico a cuore aperto) - allo Staphylococcus aureus, meno spesso Enterococcus, pneumococco, E. coli. Negli ultimi anni, la composizione degli agenti infettivi dell'endocardite è cambiata: è aumentato il numero di endocarditi acute primarie di natura stafilococcica. Con la batteriemia Staphylococcus aureus, l'endocardite infettiva si sviluppa in quasi il 100% dei casi.
Le endocarditi causate da microrganismi gram-negativi e anaerobici e le infezioni fungine sono gravi e non rispondono bene alla terapia antibiotica. L'endocardite fungina si verifica più spesso con il trattamento antibiotico prolungato nel periodo postoperatorio, con cateteri venosi a lunga permanenza.
L'adesione (adesione) dei microrganismi all'endocardio è facilitata da alcuni fattori generali e locali. Tra i fattori comuni vi sono gravi disturbi immunitari osservati nei pazienti con trattamento immunosoppressivo, negli alcolisti, nei tossicodipendenti e negli anziani. Locali includono danni anatomici congeniti e acquisiti alle valvole cardiache, disturbi emodinamici intracardiaci che si verificano con difetti cardiaci.
La maggior parte delle endocarditi infettive subacute si sviluppa con cardiopatie congenite o con lesioni reumatiche delle valvole cardiache. I disturbi emodinamici causati da difetti cardiaci contribuiscono ai microtraumi valvolari (principalmente mitralico e aortico), ai cambiamenti nell'endocardio. Sulle valvole del cuore si sviluppano caratteristici cambiamenti ulcerativi-verrucosi che assomigliano a un cavolfiore (strato polipo di masse trombotiche sulla superficie delle ulcere). Le colonie microbiche contribuiscono alla rapida distruzione delle valvole, possono verificarsi sclerosi, deformazioni e rotture. La valvola danneggiata non può funzionare normalmente: si sviluppa un'insufficienza cardiaca, che progredisce molto rapidamente. Esiste una lesione immunitaria dell'endotelio di piccoli vasi della pelle e delle mucose, che porta allo sviluppo di vasculite (trombovasculite, tossicosi capillare emorragica). Caratterizzato da una violazione della permeabilità delle pareti dei vasi sanguigni e dalla comparsa di piccole emorragie. Spesso ci sono lesioni delle arterie più grandi: coronarie e renali. Spesso l'infezione si sviluppa sulla valvola protesica, nel qual caso l'agente eziologico è molto spesso lo streptococco.
Lo sviluppo dell'endocardite infettiva è facilitato da fattori che indeboliscono la reattività immunologica del corpo. L’incidenza dell’endocardite infettiva è in costante aumento in tutto il mondo. Il gruppo a rischio comprende persone con danni aterosclerotici, traumatici e reumatici alle valvole cardiache. I pazienti con difetto del setto ventricolare e coartazione dell'aorta presentano un alto rischio di endocardite infettiva. Attualmente è aumentato il numero di pazienti portatori di protesi valvolari (meccaniche o biologiche), pacemaker artificiali (pacemaker). Il numero di casi di endocardite infettiva è in aumento a causa dell'uso di infusioni endovenose prolungate e frequenti. I tossicodipendenti spesso soffrono di endocardite infettiva.

Classificazione dell'endocardite infettiva
Per origine si distinguono l'endocardite infettiva primaria e secondaria. Il primario di solito si verifica in condizioni settiche di varie eziologie sullo sfondo di valvole cardiache invariate. Secondario: si sviluppa sullo sfondo di una patologia già esistente di vasi sanguigni o valvole con malformazioni congenite, reumatismi, sifilide, dopo un intervento chirurgico di sostituzione della valvola o commissurotomia.
Secondo il decorso clinico si distinguono le seguenti forme di endocardite infettiva:
- acuto - durata fino a 2 mesi, si sviluppa come complicazione di una condizione settica acuta, lesioni gravi o manipolazioni mediche sui vasi, cavità cardiache: sepsi angiogenica (catetere) nosocomiale (nosocomiale). È caratterizzato da un agente patogeno altamente patogeno, gravi sintomi settici.
- subacuto - che dura più di 2 mesi, si sviluppa con un trattamento insufficiente dell'endocardite infettiva acuta o della malattia di base.
- protratto.
Nei tossicodipendenti, le caratteristiche cliniche dell'endocardite infettiva sono la giovane età, la rapida progressione dell'insufficienza ventricolare destra e l'intossicazione generale, il danno polmonare infiltrativo e distruttivo.
Nei pazienti anziani, l'endocardite infettiva è causata da malattie croniche dell'apparato digerente, presenza di focolai infettivi cronici e danni alle valvole cardiache. Esistono endocarditi infettive attive e inattive (guarite). A seconda dell'entità del danno, l'endocardite si manifesta con un danno limitato ai lembi delle valvole cardiache o con una lesione che si estende oltre la valvola.
Si distinguono le seguenti forme di endocardite infettiva:
- tossico-infettivo - caratterizzato da batteriemia transitoria, adesione dell'agente patogeno all'endocardio alterato, formazione di vegetazioni microbiche;
- infettivo-allergico o immuno-infiammatorio - sono caratteristici i segni clinici di danno agli organi interni: miocardite, epatite, nefrite, splenomegalia;
- distrofico: si sviluppa con la progressione del processo settico e dell'insufficienza cardiaca. È caratteristico lo sviluppo di lesioni gravi e irreversibili degli organi interni, in particolare la degenerazione tossica del miocardio con numerose necrosi. Il danno miocardico si verifica nel 92% dei casi di endocardite infettiva prolungata.
Sintomi di endocardite infettiva
Il decorso dell'endocardite infettiva può dipendere dalla durata della malattia, dall'età del paziente, dal tipo di agente patogeno e anche dalla precedente terapia antibiotica. Nei casi di un agente patogeno altamente patogeno (Staphylococcus aureus, microflora gram-negativa), di solito si osserva una forma acuta di endocardite infettiva e lo sviluppo precoce di insufficienza multiorgano, e quindi il quadro clinico è caratterizzato da polimorfismo.
Le manifestazioni cliniche dell'endocardite infettiva sono dovute principalmente a batteriemia e tossinemia. I pazienti lamentano debolezza generale, mancanza di respiro, affaticamento, mancanza di appetito, perdita di peso. Un sintomo caratteristico dell'endocardite infettiva è la febbre: un aumento della temperatura da subfebbrile a frenetico (estenuante), con brividi e sudorazione profusa (a volte, sudorazioni torrenziali). Si sviluppa anemia, manifestata dal pallore della pelle e delle mucose, a volte acquisendo un colore "terroso", grigio-giallastro. Sono presenti piccole emorragie (petecchie) sulla pelle, sulla mucosa del cavo orale, sul palato, sulla congiuntiva degli occhi e nelle pieghe palpebrali, alla base del letto ungueale, nella regione della clavicola, derivanti dalla fragilità del sangue vasi. Il danno ai capillari viene rilevato con una lieve lesione alla pelle (un sintomo di pizzicotto). Le dita assumono la forma di bacchette e le unghie di occhiali da orologio.
La maggior parte dei pazienti con endocardite infettiva presenta danni al muscolo cardiaco (miocardite), soffi funzionali associati ad anemia e danno valvolare. Con danni ai lembi delle valvole mitrale e aortica si sviluppano segni della loro insufficienza. A volte c'è angina, occasionalmente c'è uno sfregamento del pericardio. La malattia valvolare acquisita e il danno miocardico portano allo scompenso cardiaco.
Nella forma subacuta di endocardite infettiva, l'embolia dei vasi del cervello, dei reni e della milza si verifica con depositi trombotici che si staccano dalle cuspidi delle valvole cardiache, accompagnati dalla formazione di attacchi cardiaci negli organi colpiti. Si riscontrano epato e splenomegalia, da parte dei reni - lo sviluppo di glomerulonefrite diffusa ed extracapillare, meno spesso - sono possibili nefrite focale, artralgia e poliartrite.
Complicanze dell'endocardite infettiva
Le complicanze fatali dell'endocardite infettiva sono shock settico, embolia cerebrale, cardiaca, sindrome da distress respiratorio, insufficienza cardiaca acuta, insufficienza multiorgano.
Con l'endocardite infettiva si osservano spesso complicazioni a carico degli organi interni: reni (sindrome nefrosica, infarto, insufficienza renale, glomerulonefrite diffusa), cuore (cardiopatia valvolare, miocardite, pericardite), polmoni (infarto, polmonite, ipertensione polmonare, ascesso ), fegato (ascesso, epatite, cirrosi); milza (attacco cardiaco, ascesso, splenomegalia, rottura), sistema nervoso (ictus, emiplegia, meningoencefalite, ascesso cerebrale), vasi sanguigni (aneurismi, vasculite emorragica, trombosi, tromboembolia, tromboflebite).
Diagnosi di endocardite infettiva
Raccogliendo l'anamnesi, il paziente scopre la presenza di infezioni croniche e interventi medici passati. La diagnosi finale di endocardite infettiva è confermata da dati strumentali e di laboratorio. In un esame del sangue clinico vengono rilevati una grande leucocitosi e un forte aumento della VES. Le emocolture multiple per identificare l'agente eziologico dell'infezione hanno un importante valore diagnostico. Al culmine della febbre si consiglia il prelievo di sangue per la coltura batteriologica.
I dati di un esame del sangue biochimico possono variare ampiamente in una particolare patologia d'organo. Con l'endocardite infettiva, si verificano cambiamenti nello spettro proteico del sangue: (aumento delle α-1 e α-2-globuline, successivamente - γ-globuline), nello stato immunitario (aumento della CEC, dell'immunoglobulina M, dell'attività emolitica totale del complemento diminuisce, aumenta il livello degli anticorpi anti-tessuto).
Un prezioso studio strumentale per l'endocardite infettiva è l'EchoCG, che consente di rilevare vegetazioni (di dimensioni superiori a 5 mm) sulle valvole cardiache, che è un segno diretto di endocardite infettiva. Una diagnosi più accurata viene effettuata utilizzando la risonanza magnetica e la TC MS del cuore.
Trattamento dell'endocardite infettiva
In caso di endocardite infettiva, il trattamento è necessariamente ospedaliero, fino a quando le condizioni generali del paziente non migliorano, vengono prescritti riposo a letto e dieta. Il ruolo principale nel trattamento dell'endocardite infettiva è assegnato alla terapia farmacologica, principalmente antibatterica, che viene iniziata immediatamente dopo l'emocoltura. La scelta dell'antibiotico è determinata dalla sensibilità dell'agente patogeno ad esso, è preferibile prescrivere antibiotici ad ampio spettro.
Nel trattamento dell'endocardite infettiva, gli antibiotici penicillinici in combinazione con gli aminoglicosidi hanno un buon effetto. L'endocardite fungina è difficile da trattare, quindi l'amfotericina B viene prescritta per un lungo periodo (diverse settimane o mesi). Usano anche altri agenti con proprietà antimicrobiche (diossidina, globulina antistafilococcica, ecc.) E metodi di trattamento non farmacologici: autotrasfusione di sangue irradiato con radiazioni ultraviolette.
Con malattie concomitanti (miocardite, poliartrite, nefrite), al trattamento vengono aggiunti farmaci antinfiammatori non ormonali: diclofenac, indometacina. In assenza dell'effetto del trattamento farmacologico, è indicato l'intervento chirurgico. Le valvole cardiache protesiche vengono eseguite con l'escissione delle aree danneggiate (dopo che la gravità del processo si è attenuata). Gli interventi chirurgici devono essere eseguiti da un cardiochirurgo solo secondo le indicazioni e accompagnati da antibiotici.
Prognosi dell'endocardite infettiva
L’endocardite infettiva è una delle malattie cardiovascolari più gravi. La prognosi dell'endocardite infettiva dipende da molti fattori: lesioni valvolari esistenti, tempestività e adeguatezza della terapia, ecc. La forma acuta di endocardite infettiva senza trattamento termina con la morte dopo 1–1,5 mesi, la forma subacuta - dopo 4–6 mesi. Con un'adeguata terapia antibiotica, la mortalità è del 30%, con infezione delle valvole protesiche - 50%. Nei pazienti anziani, l'endocardite infettiva è più indolente, spesso non viene diagnosticata immediatamente e ha una prognosi peggiore. Nel 10-15% dei pazienti si nota la transizione della malattia in una forma cronica con ricadute di esacerbazione.
Prevenzione dell'endocardite infettiva
Le persone con un rischio maggiore di sviluppare endocardite infettiva sono soggette al necessario monitoraggio e controllo. Ciò vale, innanzitutto, per i pazienti con protesi valvolari cardiache, difetti cardiaci congeniti o acquisiti, patologia vascolare, con una storia di endocardite infettiva, con focolai di infezione cronica (carie, tonsillite cronica, pielonefrite cronica).
Lo sviluppo della batteriemia può accompagnare varie manipolazioni mediche: interventi chirurgici, esami strumentali urologici e ginecologici, procedure endoscopiche, estrazione di denti, ecc. Per questi interventi a scopo profilattico viene prescritto un ciclo di terapia antibiotica. È inoltre necessario evitare l'ipotermia, le infezioni virali e batteriche (influenza, tonsillite). È necessario effettuare la sanificazione dei focolai di infezione cronica almeno 1 volta in 3-6 mesi.
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0