Si tratta di agenti preventivi progettati per trattare la base della malattia: l'infiammazione cronica persistente delle vie aeree. L'effetto terapeutico del loro uso regolare si sviluppa dopo 2 settimane o anche un mese o più. Ciò impone la necessità del loro uso a lungo termine nelle forme persistenti di asma, che dovrebbe essere spiegato ai pazienti. I mezzi di terapia di base per l'AD comprendono farmaci non ormonali (stabilizzatori della membrana dei mastociti e antileucotrieni) e ormonali (GCS). Questi ultimi, a loro volta, si dividono in GCS inalatori (IGCS) e sistemici (per somministrazione orale e parenterale).
Stabilizzatori della membrana dei mastociti sodio cromoglicato e sodio nedocromile. Il meccanismo d'azione dei farmaci è associato al blocco della degranulazione dei mastociti. Dai mastociti vengono rilasciate alcune sostanze biologicamente attive, che sono coinvolte nella reazione infiammatoria dei bronchi. Gli stabilizzatori della membrana dei mastociti inibiscono il rilascio di queste sostanze biologicamente attive. Con l'uso locale prolungato a livello dell'albero bronchiale, questi farmaci hanno un effetto antinfiammatorio specifico, che porta ad una diminuzione dell'iperreattività bronchiale e delle manifestazioni cliniche dell'asma. Un vantaggio importante dei cromoni è la sicurezza del loro uso a lungo termine e lo svantaggio non è sempre un'efficacia antinfiammatoria sufficiente rispetto ai glucocorticosteroidi inalatori. Inoltre, i cromoni sono inefficaci nel trattamento delle esacerbazioni dell'asma bronchiale. Questi farmaci vengono utilizzati per l'asma episodico lieve, prima dell'attività fisica o dell'imminente esposizione a un allergene. Uno dei misteri dell’uso di questi farmaci è la mancanza di prevedibilità dei risultati. In presenza di ovvie indicazioni per l'uso, il farmaco può essere inefficace e in altri casi ha un effetto significativo, nonostante i prerequisiti per l'uso meno convincenti. A questo proposito, è consigliabile condurre un ciclo di trattamento di 4-6 settimane con una valutazione dell'efficacia in 2-3 settimane. In caso di efficacia insufficiente è possibile lo scambio di questi farmaci o il collegamento di IGCS.
Il farmaco antistaminico ketotifene è anche uno stabilizzatore della membrana dei mastociti. Il ketotifene ha un duplice meccanismo d'azione: è un bloccante dell'istamina H1 e un bloccante della degranulazione dei mastociti. A quest’ultimo è associato il suo utilizzo per la prevenzione degli attacchi d’asma, soprattutto di natura allergica. L'indicazione per l'uso predominante è la combinazione di BA con segni extrapolmonari di allergia. L'effetto terapeutico del farmaco si sviluppa lentamente, entro 1-2 mesi ed è relativamente debole. A questo proposito, il ketotifene viene solitamente utilizzato come parte della complessa terapia della BA, perché. permette di ridurre la necessità di broncodilatatori e, in alcuni casi, il dosaggio dei farmaci di base. Il principale effetto collaterale che ne limita l'uso è la sedazione (sonnolenza, lievi vertigini, ritardo mentale), che solitamente scompare o diminuisce dopo 5-6 giorni di trattamento. La sedazione può essere utile nei pazienti con una componente neuropsichiatrica dell'AD.
Farmaci antileucotrieni
presentato da zafirlukast e monterlukast, simili nell'efficacia clinica. L'indicazione per il loro uso predominante è l'aspirina BA. Sono efficaci anche nell'asma da sforzo fisico. Costituiscono un'importante aggiunta alla terapia antiasmatica di base attualmente disponibile. Secondo il meccanismo d'azione, sono antagonisti competitivi, altamente selettivi e altamente attivi dei mediatori infiammatori peptidici: i leucotrieni. Sono utilizzati per la prevenzione degli attacchi e come terapia di mantenimento dell'asma, nonché farmaci di prima scelta per l'inefficacia dei beta-2-agonisti. Il vantaggio di questo gruppo di farmaci è la loro somministrazione orale (per i pazienti che hanno difficoltà a usare gli inalatori), una buona tolleranza, rari effetti collaterali, incl. nessun effetto sedativo. La monoterapia con farmaci antileucotrieni è possibile solo nell'asma lieve. Nei casi più gravi - solo come parte di una terapia antinfiammatoria complessa. Allo stesso tempo, in alcuni casi, è possibile una diminuzione graduale dei dosaggi dei corticosteroidi inalatori e/o sistemici.
Negli ultimi anni sono stati compiuti progressi significativi nel trattamento asma bronchiale (BA). Apparentemente ciò è dovuto alla definizione dell'asma come malattia infiammatoria cronica delle vie respiratorie e, di conseguenza, all'uso diffuso di farmaci per via inalatoria glucocorticosteroidi (GCS) come farmaci antinfiammatori di base. Tuttavia, nonostante i progressi compiuti, il livello di controllo sul decorso della malattia non può essere considerato soddisfacente. Quindi, ad esempio, quasi un paziente su tre con asma si sveglia di notte almeno una volta al mese a causa dei sintomi della malattia. Più della metà dei pazienti ha limitazioni nell’attività fisica, più di un terzo è costretto a saltare la scuola o ad assentarsi dal lavoro. Oltre il 40% dei pazienti è costretto a ricorrere alle cure di emergenza a causa dell’esacerbazione della malattia. Le ragioni di questa situazione sono diverse e la mancanza di consapevolezza da parte del medico della patogenesi della BA e, di conseguenza, la scelta delle tattiche terapeutiche sbagliate giocano un ruolo importante in questo.
Definizione e classificazione dell'asma
L'asma bronchiale è una malattia cronica delle vie respiratorie, in cui sono coinvolte molte cellule: mastociti, eosinofili e linfociti T. Negli individui predisposti, questa infiammazione porta a ripetuti episodi di respiro sibilante, mancanza di respiro, costrizione toracica e tosse, soprattutto di notte e/o al mattino presto. Questi sintomi sono accompagnati da un'ostruzione diffusa ma variabile dell'albero bronchiale, almeno parzialmente reversibile, spontaneamente o sotto l'influenza del trattamento. L'infiammazione provoca anche un aumento della risposta delle vie aeree a vari stimoli (iperreattività).
Le disposizioni principali della definizione dovrebbero essere considerate come segue:
1. La BA è una malattia infiammatoria cronica persistente delle vie respiratorie, indipendentemente dalla gravità del decorso.
2. Il processo infiammatorio porta a iperreattività bronchiale, ostruzione e sintomi respiratori.
3. L'ostruzione delle vie aeree è reversibile, almeno parzialmente.
4. L'atopia è una predisposizione genetica alla produzione di immunoglobuline di classe E (potrebbe non essere sempre presente).
L'asma bronchiale può essere classificata sulla base dell'eziologia, della gravità del decorso e delle caratteristiche della manifestazione dell'ostruzione bronchiale.
Tuttavia, attualmente l’asma bronchiale dovrebbe essere classificata innanzitutto in base al grado di gravità, cioè in base al grado di gravità.
questo è ciò che riflette la gravità del processo infiammatorio nelle vie respiratorie e determina la tattica della terapia antinfiammatoria.
La gravità è determinata dai seguenti indicatori:
Numero di sintomi notturni a settimana. Numero di sintomi diurni al giorno e alla settimana. Molteplicità di applicazione dei b2-agonisti a breve durata d'azione. La gravità dell’attività fisica e dei disturbi del sonno. Valori del picco di flusso espiratorio (PEF) e sua percentuale con il valore corretto o migliore. Fluttuazioni giornaliere del PSV. La quantità di terapia.
Esistono 5 gradi di gravità del decorso della BA: lieve intermittente; lieve persistente; moderato persistente; grave persistente; grave persistente dipendenza dagli steroidi (Tabella 1).
BA di flusso intermittente: sintomi di asma meno di una volta alla settimana; riacutizzazioni brevi (da alcune ore a diversi giorni). Sintomi notturni 2 volte al mese o meno; funzione polmonare asintomatica e normale tra le riacutizzazioni: picco di flusso espiratorio (PEF) > 80% del previsto e fluttuazione del PEF inferiore al 20%.
BA flusso lieve e persistente. Sintomi 1 volta a settimana o più spesso, ma meno di 1 volta al giorno. Le riacutizzazioni della malattia possono interferire con l’attività e il sonno. I sintomi notturni si verificano più spesso di 2 volte al mese. PSV oltre l'80% del dovuto; fluttuazioni del PSV 2030%.
BA di moderata gravità. sintomi quotidiani. Le riacutizzazioni interrompono l'attività e il sonno. I sintomi notturni si verificano più di una volta alla settimana. Assunzione giornaliera di agonisti b2 a breve durata d'azione. PSV 6080% del dovuto. Fluttuazioni del PSV superiori al 30%.
Asma grave: sintomi persistenti, frequenti riacutizzazioni, frequenti sintomi notturni, attività fisica limitata alle manifestazioni asmatiche. PSV inferiore al 60% del dovuto; fluttuazioni superiori al 30%.
Va notato che la determinazione della gravità dell'asma mediante questi indicatori è possibile solo prima dell'inizio del trattamento. Se il paziente sta già ricevendo la terapia necessaria, è necessario tenere conto anche del suo volume. Pertanto, se un paziente ha un'asma lieve persistente secondo il quadro clinico, ma allo stesso tempo riceve un trattamento medico corrispondente ad un'asma grave persistente, a questo paziente viene diagnosticata una BA grave.
Asma grave steroido-dipendente: indipendentemente dalla presentazione clinica, un paziente in trattamento a lungo termine con corticosteroidi sistemici deve essere considerato affetto da asma grave.
Corticosteroidi inalatori
Consigliato approccio graduale alla terapia dell’asma a seconda della gravità del suo decorso (Tabella 1). Tutti i farmaci per il trattamento dell'asma sono divisi in due gruppi principali: per il controllo a lungo termine del processo infiammatorio e farmaci per alleviare i sintomi acuti dell'asma. La base della terapia per il controllo a lungo termine del processo infiammatorio sono i glucocorticosteroidi inalatori (IGCS), che dovrebbero essere utilizzati dal secondo stadio (decorso lieve e persistente) al quinto (decorso steroido-dipendente grave). Pertanto, attualmente, gli ICS sono considerati agenti di prima linea per il trattamento dell’AD. Maggiore è la gravità dell’asma, maggiori saranno le dosi di ICS da utilizzare. Numerosi studi hanno dimostrato che i pazienti che hanno iniziato il trattamento con ICS entro 2 anni dall’esordio hanno mostrato benefici significativi nel migliorare il controllo dei sintomi dell’asma rispetto a quelli che hanno iniziato il trattamento con ICS più di 5 anni dopo l’esordio della malattia.
Meccanismi d'azione e farmacocinetica
Gli IGCS sono in grado di legarsi a specifici recettori nel citoplasma, attivarli e formare con essi un complesso, che poi dimerizza e si sposta nel nucleo cellulare, dove si lega al DNA e interagisce con i meccanismi di trascrizione di enzimi chiave, recettori e altri proteine complesse. Ciò porta alla manifestazione dell'azione farmacologica e terapeutica.
L'effetto antinfiammatorio degli ICS è associato al loro effetto inibitorio sulle cellule infiammatorie e sui loro mediatori, compresa la produzione di citochine, l'interferenza con il metabolismo dell'acido arachidonico e la sintesi di leucotrieni e prostaglandine, e la prevenzione della migrazione e dell'attivazione delle cellule infiammatorie . Gli ICS aumentano la sintesi delle proteine antinfiammatorie (lipocortina1), aumentano l'apoptosi e riducono il numero di eosinofili inibendo l'interleuchina5. Pertanto, l'ICS porta alla stabilizzazione delle membrane cellulari, riduce la permeabilità vascolare, migliora la funzione dei recettori b sia sintetizzandone di nuovi che aumentandone la sensibilità e stimola le cellule epiteliali.
Gli IGCS differiscono dai glucocorticosteroidi sistemici per le loro proprietà farmacologiche: lipofilicità, rapida inattivazione, breve emivita plasmatica. È importante considerare che il trattamento degli ICS è locale (topico), che fornisce effetti antinfiammatori pronunciati direttamente nell'albero bronchiale con manifestazioni sistemiche minime.
La quantità di ICS erogata nelle vie respiratorie dipende dalla dose nominale del farmaco, dal tipo di inalatore, dalla presenza o assenza di un propellente e dalla tecnica di inalazione. Fino all’80% dei pazienti ha difficoltà nell’utilizzare gli aerosol dosati.
La caratteristica più importante per la manifestazione della selettività e del tempo di ritenzione del farmaco nei tessuti è lipofilia. A causa della lipofilicità, gli ICS si accumulano nel tratto respiratorio, il loro rilascio dai tessuti rallenta e aumenta la loro affinità per il recettore dei glucocorticoidi. I corticosteroidi inalatori altamente lipofili vengono catturati più velocemente e meglio dal lume dei bronchi e vengono trattenuti a lungo nei tessuti delle vie respiratorie. L'IGCS differisce dai farmaci sistemici per la loro azione topica (locale). Pertanto è inutile prescrivere inalazioni di corticosteroidi sistemici (idrocortisone, prednisolone e desametasone): questi farmaci, indipendentemente dal metodo di applicazione, hanno solo un effetto sistemico.
Numerosi studi randomizzati e controllati con placebo condotti su pazienti asmatici hanno dimostrato l’efficacia di tutte le dosi di ICS rispetto al placebo.
Sistemico biodisponibilità consiste in orale e inalazione. Dal 20 al 40% della dose inalata del farmaco entra nelle vie respiratorie (questo valore varia significativamente a seconda della modalità di somministrazione e della tecnica inalatoria del paziente). La biodisponibilità polmonare dipende dalla percentuale del farmaco nei polmoni, dalla presenza o assenza del trasportatore (i migliori indicatori sono gli inalatori che non contengono freon) e dall'assorbimento del farmaco nelle vie respiratorie. Il 60-80% della dose inalata si deposita nell'orofaringe e viene deglutita, subendo poi un metabolismo completo o parziale nel tratto gastrointestinale e nel fegato. La disponibilità orale dipende dall'assorbimento nel tratto gastrointestinale e dalla gravità dell'effetto di primo passaggio attraverso il fegato, per cui i metaboliti già inattivi entrano nella circolazione sistemica (ad eccezione del beclometasone 17 monopropionato, il metabolita attivo del beclometasone dipropionato). . Dosi di ICS fino a 1000 mcg/die (per fluticasone fino a 500 mcg/die) hanno uno scarso effetto sistemico.
Tutti gli IGCS hanno un digiuno eliminazione sistemica paragonabile al flusso sanguigno epatico. Questo è uno dei fattori che riducono l’effetto sistemico degli ICS.
Caratteristiche dei farmaci più comunemente utilizzati
Gli ICS comprendono beclometasone dipropionato, budesonide, fluticasone propionato, flunisolide, triamcinolone acetonide, mometasone furoato.
Sono disponibili sotto forma di aerosol dosati, inalatori di polvere e soluzioni per inalazione attraverso un nebulizzatore (budesonide).
Beclometasone dipropionato. Viene utilizzato nella pratica clinica da oltre 20 anni e rimane uno dei farmaci più efficaci e frequentemente utilizzati. È consentito l'uso del farmaco nelle donne in gravidanza. Disponibile come inalatore aerosol predosato (Becotide 50 mcg, Becloforte 250 mcg, Aldecin 50 mcg, Beclocort 50 e 250 mcg, Beclomet 50 e 250 mcg/dose), inalatore predosato attivato dal respiro (Beclazone Easy Breathing 100 e 250 mcg /dose), inalatore a polvere (Bekodisk 100 e 250 mcg/dose inalatore Diskhaler; inalatore multidose Easyhaler, Beclomet 200 mcg/dose). Per gli inalatori Becotide e Becloforte, vengono prodotti speciali distanziatori ォVolumaticサ (distanziatore per valvola di grande volume per adulti) e ォBabyhalerサ (distanziatore per valvola di piccolo volume a 2 con una maschera facciale in silicone per bambini piccoli).
Budesonide. Farmaco moderno altamente attivo. Utilizzato come inalatore aerosol predosato (Budesonide-mite 50 mcg/dose; Budesonide-mite 200 mcg/dose), inalatore di polvere (Pulmicort Turbuhaler 200 mcg/dose; Benacort Cyclohaler 200 mcg/dose) e sospensione per nebulizzatore (Pulmicort 0,5 e 0,25 mg/dose). Pulmicort Turbuhaler è l'unica forma di dosaggio IGCS che non contiene un trasportatore. Per gli inalatori predosati Budesonide Mite e Budesonide Forte viene prodotto un distanziatore. Budesonide è parte integrante del farmaco combinato Symbicort.
Budesonide ha l'indice terapeutico più favorevole, grazie alla sua elevata affinità per i recettori dei glucocorticoidi e al metabolismo accelerato dopo assorbimento sistemico nei polmoni e nell'intestino. Budesonide è l'unico ICS per il quale è stato dimostrato il monouso. Il fattore che garantisce l'efficacia dell'uso di budesonide una volta al giorno è la ritenzione di budesonide nel tratto respiratorio sotto forma di deposito intracellulare dovuto all'esterificazione reversibile (formazione di esteri di acidi grassi). Con una diminuzione della concentrazione di budesonide libera nella cellula, le lipasi intracellulari vengono attivate e la budesonide rilasciata dagli esteri si lega nuovamente al recettore. Questo meccanismo non è caratteristico di altri GCS e consente di prolungare l'effetto antinfiammatorio. Diversi studi hanno dimostrato che l’immagazzinamento intracellulare può essere più importante in termini di attività del farmaco che di affinità recettoriale.
Studi recenti sul farmaco Pulmicort Turbuhaler hanno dimostrato che non influenza la crescita finale con l'uso a lungo termine nei bambini, la mineralizzazione ossea, non provoca angiopatia e cataratta. L'uso di Pulmicort è consigliato anche alle donne in gravidanza: è stato riscontrato che il suo utilizzo non provoca un aumento del numero di anomalie fetali. Pulmicort Turbuhaler è il primo e unico ICS ad aver ottenuto la classificazione ォBサ dalla FDA (Organizzazione statunitense per il controllo dei farmaci) nella classificazione dei farmaci in gravidanza. Questa categoria comprende medicinali sicuri da assumere durante la gravidanza. Il resto degli ICS sono classificati come ォCサ (non sono raccomandati durante la gravidanza).
Fluticasone propionato. Il farmaco più altamente attivo fino ad oggi. Ha una biodisponibilità orale minima (
L'articolo discute i fattori che influenzano il grado di efficacia e sicurezza, le caratteristiche della farmacodinamica e della farmacocinetica dei moderni glucocorticosteroidi inalatori, inclusa la ciclesonide, un nuovo glucocorticosteroide inalatorio per il mercato russo.
L'asma bronchiale (BA) è una malattia infiammatoria cronica delle vie aeree caratterizzata da ostruzione bronchiale reversibile e iperreattività bronchiale. Insieme all'infiammazione, e forse come risultato di processi rigenerativi, si formano cambiamenti strutturali nelle vie aeree, che sono considerati come un processo di rimodellamento bronchiale (trasformazione irreversibile), che comprende iperplasia delle cellule caliciformi e delle ghiandole caliciformi dello strato sottomucoso, iperplasia e ipertrofia della muscolatura liscia, aumento della vascolarizzazione dello strato sottomucoso, accumulo di collagene nelle aree sotto la membrana basale e fibrosi subepiteliale.
Secondo documenti di consenso internazionali (Global Initiative for Asthma – “Strategia globale per il trattamento e la prevenzione dell’asma bronchiale”, revisione 2011) e nazionali, i glucocorticosteroidi inalatori (IGCS), che hanno un effetto antinfiammatorio, sono farmaci di prima linea nella il trattamento dell’asma bronchiale moderata e grave.
L'uso a lungo termine di glucocorticosteroidi inalatori migliora o normalizza la funzione polmonare, riduce le fluttuazioni giornaliere del picco di flusso espiratorio e riduce anche la necessità di glucocorticosteroidi sistemici (GCS), fino alla loro completa abolizione. Con l'uso prolungato di farmaci, si previene il broncospasmo indotto dall'antigene e lo sviluppo di un'ostruzione irreversibile delle vie aeree, si riduce la frequenza delle esacerbazioni della malattia, il numero di ricoveri e la mortalità dei pazienti.
Il meccanismo d'azione dei glucocorticosteroidi inalatori è mirato ad effetti antiallergici e antinfiammatori; questo effetto si basa sui meccanismi molecolari di un modello a due stadi dell'azione GCS (effetti genomici ed extragenomici). L'effetto terapeutico dei glucocorticosteroidi (GCS) è associato alla loro capacità di inibire la formazione di proteine proinfiammatorie (citochine, ossido nitrico, fosfolipasi A2, molecole di adesione dei leucociti, ecc.) nelle cellule e di attivare la formazione di proteine con azione anti-infiammatoria. effetto infiammatorio (lipocortina-1, endopeptidasi neutra, ecc.). ).
L'effetto locale dei glucocorticosteroidi inalatori (IGCS) si manifesta con un aumento del numero di recettori beta-2-adrenergici sulle cellule muscolari lisce bronchiali; una diminuzione della permeabilità vascolare, una diminuzione dell'edema e della secrezione di muco nei bronchi, una diminuzione del numero di mastociti nella mucosa bronchiale e un aumento dell'apoptosi degli eosinofili; una diminuzione del rilascio di citochine infiammatorie da parte dei linfociti T, dei macrofagi e delle cellule epiteliali; una diminuzione dell'ipertrofia della membrana sottoepiteliale e la soppressione dell'iperreattività tessuto-specifica e non specifica. I corticosteroidi inalatori inibiscono la proliferazione dei fibroblasti e riducono la sintesi del collagene, che rallenta la velocità di sviluppo del processo sclerotico nelle pareti dei bronchi.
I glucocorticosteroidi inalatori (IGCS), a differenza di quelli sistemici, hanno un'elevata selettività, un'attività antinfiammatoria pronunciata e una minima attività mineralcorticoide. Con la via di somministrazione del farmaco inalatoria, circa il 10-50% della dose nominale si deposita nei polmoni. La percentuale di deposizione dipende dalle proprietà della molecola IGCS, dal sistema di veicolazione del farmaco nelle vie respiratorie (tipologia di inalatore) e dalla tecnica inalatoria. La maggior parte della dose di ICS viene ingerita, assorbita dal tratto gastrointestinale (GIT) e rapidamente metabolizzata nel fegato, il che fornisce un elevato indice terapeutico di ICS.
I glucocorticosteroidi inalatori (IGCS) differiscono in attività e biodisponibilità, il che fornisce una certa variabilità nell’efficacia clinica e nella gravità degli effetti collaterali nei diversi farmaci di questo gruppo. I moderni glucocorticosteroidi inalatori (IGCS) hanno un'elevata lipofilicità (per superare meglio la membrana cellulare), un alto grado di affinità per il recettore dei glucocorticoidi (GCR), che fornisce un'attività antinfiammatoria locale ottimale, e una bassa biodisponibilità sistemica e, quindi, un bassa probabilità di sviluppare effetti sistemici.
Quando si utilizzano diversi tipi di inalatori, l'efficacia di alcuni farmaci varia. All’aumentare della dose di ICS aumenta l’effetto antinfiammatorio, tuttavia, a partire da una certa dose, la curva dose-effetto assume la forma di un plateau, cioè l'effetto del trattamento non aumenta e aumenta la probabilità di sviluppare effetti collaterali caratteristici dei glucocorticosteroidi sistemici (GCS). I principali effetti metabolici indesiderati dei corticosteroidi sono:
- effetto stimolante sulla gluconeogenesi (con conseguente iperglicemia e glicosuria);
- una diminuzione della sintesi proteica e un aumento della sua degradazione, che si manifesta con un bilancio negativo dell'azoto (perdita di peso, debolezza muscolare, atrofia cutanea e muscolare, smagliature, emorragie, ritardo della crescita nei bambini);
- ridistribuzione dei grassi, aumento della sintesi di acidi grassi e trigliceridi (ipercolesterolemia);
- attività mineralcorticoide (porta ad un aumento del volume sanguigno circolante e ad un aumento della pressione sanguigna);
- bilancio negativo del calcio (osteoporosi);
- inibizione del sistema ipotalamo-ipofisi, con conseguente diminuzione della produzione dell'ormone adrenocorticotropo e del cortisolo (insufficienza surrenalica).
Dato che il trattamento con glucocorticosteroidi inalatori (IGCS), di regola, è di natura a lungo termine (e in alcuni casi permanente), la preoccupazione di medici e pazienti sulla capacità dei glucocorticosteroidi inalatori di causare effetti collaterali sistemici aumenta naturalmente .
Preparati contenenti glucocorticosteroidi inalatori
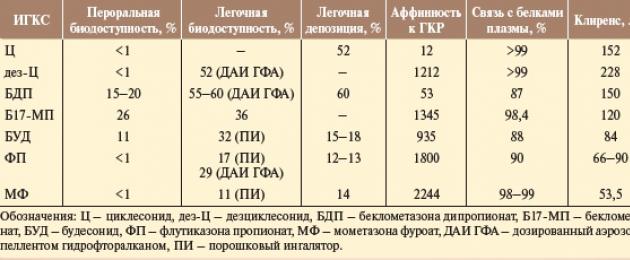
Sul territorio della Federazione Russa sono registrati e approvati per l'uso i seguenti glucocorticosteroidi inalatori: budesonide (una sospensione per nebulizzatore viene utilizzata da 6 mesi, sotto forma di inalatore di polvere - da 6 anni), fluticasone propionato (utilizzato da 1 anno), beclometasone dipropionato (usato dai 6 anni), mometasone furoato (sul territorio della Federazione Russa è consentito nei bambini dai 12 anni) e ciclesonide (consentito nei bambini dai 6 anni). Tutti i farmaci hanno dimostrato efficacia, tuttavia, le differenze nella struttura chimica si riflettono nelle proprietà farmacodinamiche e farmacocinetiche degli ICS e, di conseguenza, nel grado di efficacia e sicurezza del farmaco.L'efficacia dei glucocorticoidi inalatori (IGCS) dipende principalmente dall'attività locale, che è determinata dall'elevata affinità (affinità per il recettore dei glucocorticoidi (GCR), dall'elevata selettività e dalla durata della persistenza nei tessuti. Tutti gli IGCS moderni conosciuti hanno un'elevata attività glucocorticoide locale, che è determinato dall'affinità dell'IGCS con la GKR (di solito rispetto al desametasone, la cui attività è considerata pari a 100) e dalle proprietà farmacocinetiche modificate.
Cyclesonide (affinità 12) e beclometasone dipropionato (affinità 53) non hanno attività farmacologica iniziale e solo dopo l'inalazione, entrando negli organi bersaglio ed essendo esposti alle esterasi, si trasformano nei loro metaboliti attivi - descyclesonide e beclometasone 17-monopropionato - e diventano farmacologicamente attivo. L'affinità per il recettore dei glucocorticoidi (GCR) è maggiore per i metaboliti attivi (1200 e 1345, rispettivamente).

L'elevata lipofilia e il legame attivo con l'epitelio respiratorio, nonché la durata dell'associazione con GCR, determinano la durata dell'azione del farmaco. La lipofilicità aumenta la concentrazione dei glucocorticosteroidi inalatori (IGCS) nel tratto respiratorio, rallenta il loro rilascio dai tessuti, aumenta l'affinità e prolunga la relazione con i GCR, sebbene la linea di lipofilicità ottimale degli IGCS non sia stata ancora determinata.
Nella misura maggiore, la lipofilia si manifesta nella ciclesonide, nel mometasone furoato e nel fluticasone propionato. Cyclesonide e budesonide sono caratterizzati dall'esterificazione che avviene a livello intracellulare nei tessuti polmonari e dalla formazione di coniugati reversibili di acidi grassi di descyclesonide e budesonide. La lipofilia dei coniugati è molte decine di volte superiore alla lipofilia della dezciclesonide e della budesonide intatte, che determina la durata della permanenza di quest'ultima nei tessuti delle vie respiratorie.
Gli effetti dei glucocorticosteroidi inalatori sulle vie respiratorie e i loro effetti sistemici dipendono in misura maggiore dal dispositivo inalatorio utilizzato. Considerando che i processi di infiammazione e rimodellamento avvengono in tutti i distretti delle vie respiratorie, comprese le parti distali e i bronchioli periferici, si pone il problema della modalità ottimale di somministrazione del farmaco ai polmoni, indipendentemente dallo stato di pervietà bronchiale e dal rispetto delle prescrizioni la tecnica di inalazione. La dimensione delle particelle preferita della preparazione per inalazione, che ne garantisce una distribuzione uniforme nei bronchi grandi e distali, è 1,0-5,0 µm per gli adulti e 1,1-3,0 µm per i bambini.
Al fine di ridurre il numero di errori legati alla tecnica inalatoria, con conseguente diminuzione dell’efficacia del trattamento e aumento della frequenza e della gravità degli effetti collaterali, i metodi di somministrazione dei farmaci vengono costantemente migliorati. Un inalatore predosato (MAI) può essere utilizzato con un distanziatore. L'uso di un nebulizzatore può fermare efficacemente l'esacerbazione dell'asma bronchiale (BA) in regime ambulatoriale, riducendo o eliminando la necessità della terapia infusionale.
Secondo l'accordo internazionale sulla conservazione dello strato di ozono terrestre (Montreal, 1987), tutti i produttori di farmaci per inalazione sono passati a forme di inalatori di aerosol predosati (MAI) privi di CFC. Il nuovo propellente norflurano (idrofluoroalcano, HFA 134a) ha influenzato significativamente la dimensione delle particelle di alcuni glucocorticosteroidi inalatori (IGCS), in particolare della ciclesonide: una percentuale significativa delle particelle del farmaco ha una dimensione compresa tra 1,1 e 2,1 micron (particelle extrafini). A questo proposito, gli IGCS sotto forma di PDI con HFA 134a presentano la percentuale più alta di deposizione polmonare, ad esempio il 52% per la ciclesonide, e la sua deposizione nelle parti periferiche dei polmoni è del 55%.
La sicurezza dei glucocorticosteroidi inalatori e la probabilità di sviluppare effetti sistemici sono determinate dalla loro biodisponibilità sistemica (assorbimento dalla mucosa gastrointestinale e assorbimento polmonare), dal livello della frazione libera del farmaco nel plasma sanguigno (legame con le proteine plasmatiche) e dal livello dell’inattivazione del GCS durante il passaggio primario attraverso il fegato (presenza/assenza di metaboliti attivi).
I glucocorticosteroidi inalatori vengono rapidamente assorbiti dal tratto gastrointestinale e dalle vie respiratorie. L'assorbimento dei glucocorticosteroidi (GCS) dai polmoni può essere influenzato dalla dimensione delle particelle inalate, poiché le particelle inferiori a 0,3 micron si depositano negli alveoli e vengono assorbite nella circolazione polmonare.
Quando si utilizza un inalatore aerosol predosato (MAI), solo il 10-20% della dose inalata viene erogata nel tratto respiratorio, mentre fino al 90% della dose viene depositata nella regione orofaringea e deglutita. Inoltre, questa parte dei glucocorticosteroidi inalatori (IGCS), essendo assorbita dal tratto gastrointestinale, entra nella circolazione epatica, dove la maggior parte del farmaco (fino all'80% o più) viene inattivata. I corticosteroidi inalatori entrano nella circolazione sistemica principalmente sotto forma di metaboliti inattivi. Pertanto, la biodisponibilità orale sistemica per la maggior parte dei glucocorticosteroidi inalatori (ciclesonide, mometasone furoato, fluticasone propionato) è molto bassa, quasi zero.

Va tenuto presente che parte della dose di ICS (circa il 20% di quella nominalmente accettata e, nel caso del beclometasone dipropionato (beclometasone 17-monopropionato) - fino al 36%), entrando nel tratto respiratorio e venendo rapidamente assorbita , entra nella circolazione sistemica. Inoltre, questa parte della dose può causare effetti avversi sistemici extrapolmonari, soprattutto quando si prescrivono dosi elevate di ICS. Di non poca importanza in questo aspetto è la tipologia di inalatore utilizzato con gli ICS, poiché quando la polvere secca di budesonide viene inalata attraverso Turbuhaler, la deposizione polmonare del farmaco aumenta di 2 volte o più rispetto all'inalazione da PDI.
Per i glucocorticosteroidi inalatori (IGCS) con un'elevata frazione di biodisponibilità inalatoria (budesonide, fluticasone propionato, beclometasone 17-monopropionato), la biodisponibilità sistemica può aumentare in presenza di processi infiammatori nella mucosa bronchiale. Ciò è stato stabilito in uno studio comparativo sugli effetti sistemici in termini di livello di diminuzione del cortisolo plasmatico dopo un uso singolo di budesonide e beclometasone propionato alla dose di 2 mg a 22 ore da fumatori sani e non fumatori. Va notato che dopo l'inalazione di budesonide, il livello di cortisolo nei fumatori era inferiore del 28% rispetto ai non fumatori.
I glucocorticosteroidi inalatori (IGCS) hanno un'associazione piuttosto elevata con le proteine plasmatiche; in ciclesonide e mometasone furoato, questo rapporto è leggermente più elevato (98-99%) che in fluticasone propionato, budesonide e beclometasone dipropionato (90, 88 e 87%, rispettivamente). I glucocorticosteroidi inalatori (IGCS) hanno una clearance rapida, il suo valore è approssimativamente uguale al valore del flusso sanguigno epatico e questo è uno dei motivi delle manifestazioni minime di effetti indesiderati sistemici. D’altro canto, la rapida clearance conferisce agli ICS un elevato indice terapeutico. La clearance più rapida, superiore alla velocità del flusso sanguigno epatico, è stata riscontrata nella dezciclesonide, il che comporta un elevato profilo di sicurezza del farmaco.
È quindi possibile individuare le principali proprietà dei glucocorticosteroidi inalatori (IGCS), da cui dipende principalmente la loro efficacia e sicurezza, soprattutto durante la terapia a lungo termine:
- una grande percentuale di particelle fini, che garantisce un'elevata deposizione del farmaco nelle parti distali dei polmoni;
- elevata attività locale;
- elevata lipofilia o capacità di formare coniugati grassi;
- basso grado di assorbimento nella circolazione sistemica, elevato legame con le proteine plasmatiche ed elevata clearance epatica per prevenire l'interazione di GCS con GCR;
- bassa attività mineralcorticoide;
- elevata compliance e facilità di dosaggio.
Ciclisonide (Alvesco)
Cyclesonide (Alvesco) - un glucocorticosteroide inalatorio non alogenato (IGCS), è un profarmaco e, sotto l'azione delle esterasi nel tessuto polmonare, viene convertito in una forma farmacologicamente attiva - desciclesonide. La dezciclesonide ha un'affinità 100 volte maggiore per il recettore dei glucocorticoidi (GCR) rispetto alla ciclesonide.La coniugazione reversibile della descyclesonide con acidi grassi altamente lipofili garantisce la formazione di un deposito del farmaco nel tessuto polmonare e il mantenimento di una concentrazione efficace per 24 ore, che consente l'utilizzo di Alvesco una volta al giorno. La molecola del metabolita attivo è caratterizzata da elevata affinità, associazione rapida e lenta dissociazione con il recettore dei glucocorticoidi (GCR). 
La presenza del norflurano (HFA 134a) come propellente garantisce una quota significativa di particelle extrafini del farmaco (dimensione da 1,1 a 2,1 micron) e un'elevata deposizione del principio attivo nelle piccole vie aeree. Considerando che i processi di infiammazione e rimodellamento avvengono in tutte le parti delle vie respiratorie, comprese le parti distali e i bronchioli periferici, si pone la questione della modalità ottimale per somministrare il farmaco ai polmoni, indipendentemente dallo stato di pervietà bronchiale.
In uno studio di T.W. de Vries et al. Utilizzando l'analisi di diffrazione laser e il metodo dei diversi flussi inspiratori, è stato effettuato un confronto tra la dose erogata e la dimensione delle particelle di vari glucocorticosteroidi inalatori: fluticasone propionato 125 µg, budesonide 200 µg, beclometasone (HFA) 100 µg e ciclesonide 160 µg.
La dimensione aerodinamica media delle particelle di budesonide era 3,5 µm, fluticasone propionato - 2,8 µm, beclometasone e ciclesonide - 1,9 µm. L'umidità dell'aria ambiente e la velocità del flusso inspiratorio non hanno avuto effetti significativi sulla dimensione delle particelle. Cyclesonide e beclometasone (HFA) presentavano la frazione più grande di particelle fini con dimensioni comprese tra 1,1 e 3,1 µm.
Dato che la ciclesonide è un metabolita inattivo, la sua biodisponibilità orale tende a zero, evitando così effetti indesiderati locali come la candidosi orofaringea e la disfonia, come dimostrato in numerosi studi.
La ciclesonide e il suo metabolita attivo dezciclesonide, quando rilasciati nella circolazione sistemica, si legano quasi completamente alle proteine plasmatiche (98-99%). Nel fegato, la dezciclesonide viene inattivata dall'enzima CYP3A4 del sistema del citocromo P450 in metaboliti inattivi idrossilati. Ciclesonide e dezciclesonide hanno la clearance più rapida tra i glucocorticosteroidi inalatori (IGCS) (152 e 228 l/h, rispettivamente), il suo valore supera significativamente la velocità del flusso sanguigno epatico e fornisce un elevato profilo di sicurezza. 
I problemi di sicurezza dei glucocorticosteroidi inalatori (IGCS) sono i più rilevanti nella pratica pediatrica. Numerosi studi internazionali hanno stabilito un’elevata efficacia clinica e un buon profilo di sicurezza della ciclesonide. In due studi identici multicentrici, in doppio cieco, controllati con placebo sulla sicurezza e l'efficacia di Alvesco (ciclesonide), hanno preso parte 1.031 bambini di età compresa tra 4 e 11 anni. L'uso di ciclesonide 40, 80 o 160 mcg una volta al giorno per 12 settimane non ha portato alla soppressione della funzione del sistema ipotalamo-ipofisi-surrene e ad alterazioni del livello di cortisolo nelle urine quotidiane (rispetto al placebo). In un altro studio, la terapia con ciclesonide per 6 mesi non ha prodotto una differenza statisticamente significativa nel tasso di crescita lineare tra i bambini del gruppo di trattamento attivo e del gruppo placebo.
La dimensione extrafine delle particelle, l'elevata deposizione polmonare di ciclesonide e il mantenimento di una concentrazione efficace per 24 ore, da un lato, la bassa biodisponibilità orale, i bassi livelli della frazione libera del farmaco nel plasma sanguigno e la rapida eliminazione, dall'altro, forniscono un alto indice terapeutico e buon profilo di sicurezza di Alvesco. La durata della persistenza della ciclesonide nei tessuti determina la sua elevata durata d'azione e la possibilità di un singolo utilizzo al giorno, che aumenta significativamente la compliance del paziente a questo farmaco.
© Oksana Kurbacheva, Ksenia Pavlova
I glucocorticosteroidi (GC) sono ampiamente utilizzati in quasi tutte le branche della medicina, compresa la pneumologia. Sono basilari, cioè i principali nel trattamento di tutte le varianti patogenetiche dell'asma bronchiale persistente, a partire dalla gravità lieve. Tuttavia, come dimostra l'esperienza, la nomina di GC provoca preoccupazione non solo tra i pazienti, ma anche tra i medici. Una terapia steroidea prematura e inadeguata può portare non solo a un decorso incontrollato di asma bronchiale, ma anche allo sviluppo di condizioni potenzialmente letali che richiedono la nomina di una terapia steroidea sistemica molto più seria. A sua volta, la terapia steroidea sistemica a lungo termine, anche a piccole dosi, può formare malattie e sindromi iatrogene (vasculite, osteoporosi, sindrome di Itsenko-Cushing, obesità, ipertensione arteriosa, diabete mellito, miodistrofia, ecc.). Cercheremo di rispondere alla domanda su come controllare l’asma con steroidi sicuri ed efficaci e su come evitare possibili complicazioni.
Quindi, gli obiettivi del trattamento dei pazienti con asma bronchiale sono:
Raggiungere e mantenere il controllo dei sintomi.
Prevenzione delle riacutizzazioni.
Mantenimento degli indicatori della funzione della respirazione esterna, il più vicino possibile al livello normale.
Nessuna restrizione all’attività fisica, compresa l’educazione fisica e lo sport.
Assenza di effetti collaterali ed eventi avversi da farmaci.
Prevenzione della formazione di ostruzione bronchiale irreversibile.
Prevenzione della morte per asma.
Questi obiettivi riflettono la comprensione dell'asma bronchiale come una malattia cronica con uno sviluppo progressivo del processo infiammatorio nelle vie aeree, che porta alla manifestazione di vari sintomi della malattia (da lievi a pronunciati), a seconda del grado di questa infiammazione. A questo proposito è opportuno ricordare ai lettori la moderna definizione di asma bronchiale, riportata nella “Strategia globale per il trattamento e la prevenzione dell'asma bronchiale”; (GINA-2002):
L'asma bronchiale è una malattia infiammatoria cronica delle vie aeree nella quale svolgono un ruolo numerose cellule ed elementi cellulari. L'infiammazione cronica provoca un concomitante aumento dell'iperreattività delle vie aeree, portando a episodi ricorrenti di respiro sibilante, mancanza di respiro, costrizione toracica e tosse, soprattutto di notte o al mattino presto. Questi episodi sono solitamente associati a un'ostruzione diffusa ma variabile del flusso aereo, spesso reversibile, sia spontaneamente che con il trattamento.
Attualmente, l'asma bronchiale dovrebbe essere classificato principalmente in base alla gravità, poiché è questo che riflette la gravità del processo infiammatorio nelle vie respiratorie e determina la tattica della terapia antinfiammatoria.
Gravità determinato dai seguenti indicatori:
1. Numero di sintomi notturni a settimana.
2. Numero di sintomi diurni al giorno e alla settimana.
3. La frequenza d'uso dei beta2-agonisti a breve durata d'azione.
4. La gravità dell'attività fisica e dei disturbi del sonno.
5. Valoridel picco di flusso espiratorio (PEV) e sua percentuale con il valore corretto o migliore.
6. Fluttuazioni giornaliere del PSV.
7. Il volume della terapia.
Ci sembra che i più importanti nel determinare la gravità non siano solo e non tanto i sintomi e gli indicatori della funzione della respirazione esterna (RF), ma la quantità di terapia di base necessaria per mantenere la normale vita umana.
Approccio graduale al trattamento dell'asma bronchiale riflette la quantità di terapia, a seconda della gravità del suo decorso. Come si può vedere dalle tabelle presentate, tutti i farmaci per il trattamento dell'asma bronchiale sono divisi in due gruppi principali: per il controllo a lungo termine del processo infiammatorio (di base e alternativo) e per il sollievo dei sintomi acuti dell'asma. La base della terapia per il controllo a lungo termine del processo infiammatorio sono i glucocorticoidi inalatori (IGCS), che dovrebbero essere utilizzati nell'asma bronchiale persistente di qualsiasi gravità. Attualmente gli ICS sono considerati agenti di prima linea nel trattamento dell’asma bronchiale.
Maggiore è la gravità del decorso dell'asma bronchiale, maggiori dovrebbero essere le dosi di steroidi inalatori. Numerosi studi hanno dimostrato che i pazienti che hanno iniziato il trattamento con ICS entro 2 anni dall’esordio hanno mostrato benefici significativi nel migliorare il controllo dei sintomi dell’asma rispetto a quelli che hanno iniziato tale terapia dopo 5 anni o più.
L'effetto antinfiammatorio degli ICS è associato al loro effetto inibitorio sulle cellule infiammatorie e sui loro mediatori, compresa la produzione di citochine, l'interferenza con il metabolismo dell'acido arachidonico e la sintesi di leucotrieni e prostaglandine, una diminuzione della permeabilità microvascolare, la prevenzione di infezioni dirette migrazione e attivazione delle cellule infiammatorie e aumento della sensibilità dei recettori beta della muscolatura liscia. Gli ICS aumentano la sintesi delle proteine antinfiammatorie (lipocortina-1), aumentano l'apoptosi e riducono il numero di eosinofili inibendo l'interleuchina-5. Pertanto, i corticosteroidi inalatori portano alla stabilizzazione delle membrane cellulari, riducono la permeabilità vascolare, migliorano la funzione dei recettori beta sia sintetizzandone di nuovi che aumentandone la sensibilità e stimolano le cellule epiteliali.
Gli IGCS differiscono dai glucocorticosteroidi sistemici per le loro proprietà farmacologiche: lipofilicità, rapida inattivazione, breve emivita plasmatica. È importante considerare che il trattamento degli ICS è locale (topico), che fornisce effetti antinfiammatori pronunciati direttamente nell'albero bronchiale con manifestazioni sistemiche minime. La quantità di ICS erogata nelle vie respiratorie dipende dalla dose nominale del farmaco, dal tipo di inalatore, dalla presenza o assenza di un propellente e dalla tecnica di inalazione. Va tenuto presente che circa l'80% dei pazienti riscontra difficoltà nell'utilizzo di aerosol dosati.
La caratteristica più importante per la manifestazione della selettività e del tempo di ritenzione del farmaco nei tessuti è la lipofilicità. A causa della lipofilicità, gli ICS si accumulano nel tratto respiratorio, il loro rilascio dai tessuti rallenta e aumenta la loro affinità per il recettore dei glucocorticoidi. I corticosteroidi inalatori altamente lipofili vengono catturati più velocemente e meglio dal lume dei bronchi e vengono trattenuti a lungo nei tessuti delle vie respiratorie. Il fluticasone propionato (flixotide) ha la più alta lipofilia e attività antinfiammatoria, che ne consente l'utilizzo a dosi più basse. Budesonide (pulmicort), come hanno dimostrato gli studi, forma coniugati intracellulari, che hanno anche una lipofilicità pronunciata. È la lipofilia degli ICS che li distingue dai farmaci sistemici, quindi è inutile prescrivere inalazioni di corticosteroidi sistemici (idrocortisone, prednisolone e desametasone) - questi farmaci, indipendentemente dal metodo di utilizzo, hanno solo un effetto sistemico.
Gli ICS includono beclometasone dipropionato (BDP), budesonide (BUD), fluticasone propionato (FP), flunisolide (FLU) e triamcinolone acetonide (TA), mometasone furoato. Sono disponibili sotto forma di aerosol dosati, polvere secca e soluzioni da utilizzare nei nebulizzatori.
Numerosi studi randomizzati e controllati con placebo condotti su pazienti con asma bronchiale hanno dimostrato l’efficacia di tutte le dosi di ICS rispetto al placebo (Evidenza A). Tutti gli ICS a dosi equipotenti hanno effetti antinfiammatori (Evidenza A). Pertanto, in GINA-2002 è stato introdotto il concetto di dosi equipotenti o equivalenti, indicando che diversi ICS differiscono l'uno dall'altro nel grado di azione antinfiammatoria. Sono indicate dosi equipotenti approssimative.
Le informazioni riguardanti l’effetto sistemico degli ICS sono molto contraddittorie. La biodisponibilità sistemica è costituita da orale e polmonare. La disponibilità orale dipende dall'assorbimento nel tratto gastrointestinale e dalla gravità dell'effetto di "primo passaggio" attraverso il fegato, per cui metaboliti già inattivi entrano nella circolazione sistemica (ad eccezione del beclometasone 17-monopropionato, il metabolita attivo del beclometasone dipropionato). ). La biodisponibilità polmonare dipende dalla percentuale del farmaco nei polmoni (che dipende dal tipo di inalatore utilizzato), dalla presenza o assenza di un trasportatore (gli inalatori che non contengono freon hanno i migliori risultati) e dall'assorbimento del farmaco. nel tratto respiratorio. Ad esempio, il beclometasone dipropionato con un vettore freon (CFC, CFC o CFC - clorofluorocarburo) viene utilizzato in dosi doppie rispetto a quando si utilizza un vettore privo di CFC (HFA o HFA - idrofluoroalcano). Va notato che dosi di ICS fino a 1000 mcg/die hanno un effetto sistemico minimo, incomparabile con l’uso di qualsiasi steroide sistemico.
I corticosteroidi inalatori differiscono tra loro non solo in termini di biodisponibilità sistemica, ma anche in una serie di altri indicatori che ne determinano l’efficacia e la sicurezza, inclusa l’azione sistemica.
Pertanto, dai dati presentati sopra, si può vedere che il fluticasone propionato, che ha un’elevata affinità per l’HCC, ha l’effetto antinfiammatorio più pronunciato e dovrebbe essere usato a dosi pari alla metà di quelle del beclometasone dipropionato e del budesonide in veicoli di somministrazione comparabili. La flunisolide deve essere utilizzata a dosi più elevate rispetto a beclometasone e budesonide per ottenere un effetto antinfiammatorio comparabile.
Effetti indesiderati degli ICS. Va sottolineato che gli IGCS hanno effetti collaterali minimi con una corretta selezione e tecnica di inalazione. Le manifestazioni indesiderabili locali più frequentemente osservate: candidosi del cavo orale e dell'orofaringe, disfonia, talvolta tosse, derivante dall'irritazione delle vie respiratorie superiori. Tuttavia, spesso è possibile prevenirli utilizzando un dispositivo dotato di distanziatore. Sciacquare la bocca con acqua (seguito da sputi) dopo l'inalazione e utilizzare un distanziatore può prevenire lo sviluppo di candidosi orale e orofaringea. Tutti i corticosteroidi inalatori attualmente esistenti vengono assorbiti nei polmoni e quindi, inevitabilmente, alcuni di essi entrano nella circolazione sistemica. Il rischio di effetti avversi sistemici dei corticosteroidi inalatori dipende dalla dose e dall'attività dei corticosteroidi, nonché dalla biodisponibilità, dall'assorbimento nell'intestino, dal metabolismo durante il primo passaggio attraverso il fegato e dall'emivita della parte assorbita nel fegato. polmoni e probabilmente nell'intestino. Pertanto, gli effetti sistemici saranno diversi per i diversi corticosteroidi inalatori. Diversi studi comparativi hanno dimostrato che budesonide e fluticasone propionato hanno effetti sistemici minori rispetto a BDP e triamcinolone. Il rischio di effetti sistemici dipende anche dal tipo di inalatore: l’uso di distanziatori riduce la biodisponibilità sistemica e il rischio di effetti avversi sistemici della maggior parte dei corticosteroidi. Quando si utilizza un turbohaler, l'efficacia della budesonide raddoppia.
Terapia combinata
Sebbene gli ICS siano il pilastro della terapia dell’asma, non sempre controllano completamente i sintomi dell’asma. A questo proposito, si è reso necessario prescrivere beta2-agonisti per via inalatoria non solo su richiesta, ma anche regolarmente. Pertanto, esiste la necessità di una nuova classe di farmaci, esente dai difetti inerenti ai beta2-agonisti a breve durata d'azione e con un comprovato effetto protettivo e antinfiammatorio a lungo termine sulle vie respiratorie. Sono stati creati e attualmente ampiamente utilizzati beta2-agonisti a lunga durata d'azione, rappresentati sul mercato farmaceutico da due farmaci: salmeterolo xinafoato e formoterolo fumarato. Le moderne linee guida per il trattamento dell'asma raccomandano l'aggiunta di beta2-agonisti a lunga durata d'azione in caso di insufficiente controllo dell'asma bronchiale con monoterapia con glucocorticoidi inalatori (a partire dal 2° stadio). Numerosi studi hanno dimostrato che la combinazione (IGCS + beta2-agonista a lunga durata d'azione) è più efficace del raddoppio della dose di glucocorticoidi inalatori e porta ad un maggiore miglioramento della funzionalità polmonare e ad un migliore controllo dei sintomi dell'asma. Si è verificata anche una diminuzione del numero di riacutizzazioni nei pazienti sottoposti a terapia di combinazione e un miglioramento significativo della qualità della vita. Pertanto, l'emergere di farmaci combinati, i cui componenti sono un corticosteroide inalatorio e un beta2-agonista a lunga durata d'azione, riflette l'evoluzione delle opinioni sul trattamento dell'asma bronchiale.
Il vantaggio principale della terapia di combinazione è l’aumento dell’efficacia del trattamento con l’uso di dosi più basse di corticosteroidi inalatori. Inoltre, la combinazione di due farmaci in un inalatore rende più facile per il paziente seguire le prescrizioni del medico e potenzialmente migliora la compliance.
Queste classi di farmaci (IGCS e beta2-agonisti a lunga durata d'azione) dovrebbero essere considerate come sinergici, a causa dei loro effetti complementari a livello molecolare e recettoriale.
Gli ICS aumentano il numero di recettori beta e aumentano la loro attività. i recettori beta, a loro volta, innescano una cascata di reazioni biochimiche intracellulari, che porta all'attivazione del recettore dei glucocorticoidi e alla formazione di un complesso GCS + GCR attivo sotto l'azione di dosi più basse di ICS, aumentano la traslocazione dello steroide attivo complesso recettoriale al nucleo, dove interagisce con una regione specifica del gene bersaglio (elemento sensibile ai glucocorticoidi, HSE). Ciò porta ad un aumento dell'attività antinfiammatoria e ancora ad un aumento della sintesi dei recettori beta (vedi figura).
Studi controllati hanno inoltre dimostrato che somministrare ICS e beta2-agonisti a lunga durata d'azione come prodotto combinato è altrettanto efficace che somministrarli separatamente (Evidenza B). Gli inalatori con combinazioni fisse di farmaci sono più convenienti per i pazienti, aumentano la compliance e forniscono la somministrazione simultanea di un beta2-agonista e di ICS. Attualmente esistono due farmaci a combinazione fissa: fluticasone propionato più salmeterolo (Seretide) e budesonide più formoterolo (Symbicort).
Multidisco segreto. I componenti costitutivi sono salmeterolo xinafoato e fluticasone propionato. Fornisce un elevato controllo sui sintomi dell'asma bronchiale. Viene utilizzato solo come terapia di base. Possono essere assegnati a partire dalla seconda fase. Il farmaco si presenta in dosaggi di 50/100 mcg, 50/250 mcg, 50/500 mcg/dose.
I componenti che compongono Seretide sono utilizzati da molto tempo: fluticasone propionato - dal 1993, salmeterolo xinafoato - dal 1990.
fluticasone propionato- uno dei farmaci antinfiammatori più altamente attivi fino ad oggi. Le dosi terapeutiche equivalenti (equipotenti) di fluticasone sono quasi 2 volte inferiori a quelle di beclometasone dipropionato. Il farmaco ha una bassa biodisponibilità sistemica (~1%) e la biodisponibilità assoluta è del 10-30%, a seconda del tipo di inalatore. Il fluticasone ha un'elevata affinità per i recettori dei glucocorticoidi e ha una lunga associazione con tali recettori. Per prevenire la raucedine e lo sviluppo di candidosi, quando si assume il fluticasone, è necessario seguire le stesse regole di quando si assumono altri ICS, ad es. sciacquare la bocca e la gola con acqua dopo l'inalazione. A causa dell'elevato effetto antinfiammatorio, il fluticasone è indicato anche per i pazienti con asma bronchiale grave e dipendenza da corticosteroidi sistemici. Le dosi di fluticasone devono essere selezionate rigorosamente individualmente, a seconda della gravità del decorso, della risposta alla terapia antinfiammatoria e della sensibilità individuale del paziente.
Salmeterolo xinafoato si riferisce a beta2-agonisti per via inalatoria a lunga durata d'azione con un inizio d'azione lento. Studi condotti alla fine degli anni ’90 hanno dimostrato che l’uso di beta2-agonisti a lunga durata d’azione, che comprendono salmeterolo e formoterolo, può non solo prevenire i sintomi notturni e l’asma indotta dall’esercizio fisico, ma anche quasi dimezzare la dose di ICS necessaria per ottenere un adeguato controllo dell’asma bronchiale. asma. . Studi clinici condotti hanno dimostrato che i beta2-agonisti a lunga durata d'azione hanno un effetto stabilizzante sui mastociti, inibiscono il rilascio di istamina mediato da IgE da parte loro, il che porta ad una diminuzione delle concentrazioni sistemiche e locali di istamina. Riducono inoltre la permeabilità capillare polmonare in misura maggiore rispetto agli ICS. È importante notare che gli effetti antinfiammatori dei beta2-agonisti a lunga durata d'azione non possono svolgere un ruolo decisivo nei pazienti con asma bronchiale, poiché una diminuzione della sensibilità dei recettori beta2-adrenergici (desensibilizzazione) e della regolazione "down" (diminuzione nel numero di recettori) nelle cellule infiammatorie avviene più velocemente che nei miociti bronchiali. Pertanto, con l'uso sistematico di stimolanti beta2-adrenergici, la tolleranza ai loro effetti antinfiammatori si sviluppa abbastanza rapidamente. Tuttavia, a causa della capacità degli ICS di aumentare il numero e la funzione dei recettori beta2-adrenergici, riducendone la desensibilizzazione e la "down-regulation", l'attività antinfiammatoria dei beta2-agonisti a lunga durata d'azione può manifestarsi clinicamente quando ICS e beta2-agonisti gli agonisti vengono somministrati insieme. Il salmeterolo viene prescritto solo come farmaco per la terapia di base e non viene utilizzato secondo necessità. Devono essere utilizzate solo le dosi raccomandate e per alleviare i sintomi devono essere utilizzati beta2-agonisti a breve durata d’azione. Va notato che il salmeterolo ha anche una serie di proprietà inaspettate, in particolare provoca una diminuzione della patogenicità. P.aeruginosa ed effetto protettivo contro H.influenzae in colture dell'epitelio delle vie respiratorie.
Gli studi clinici condotti con il farmaco "Seretide" hanno dimostrato la sua elevata efficienza. Inoltre, la sua efficacia nell’asma bronchiale è risultata superiore a quella dei suoi componenti somministrati separatamente.
Seretide è disponibile in inalatori di polvere multidisco. Questo dispositivo per inalazione consente non solo di dosare accuratamente il farmaco, ma anche di calcolare la dose. In Russia, seretide è disponibile nei seguenti dosaggi: salmeterolo 50 mcg e fluticasone propionato 100 mcg; 50 microgrammi di salmeterolo e 250 microgrammi di fluticasone propionato.
Va ricordato che seretide non è prescritto per alleviare i sintomi dell'asma bronchiale, per questo è preferibile prescrivere beta2-agonisti a breve durata d'azione.
Nel nostro paese è stato condotto uno studio sulla qualità della vita dei pazienti con asma bronchiale che assumevano seretide (ICAR), che ha confermato che l'assunzione di seretide migliora la qualità della vita dei pazienti, promuove la cooperazione paziente-medico ed è più comoda da usare. Anche lo studio delle preferenze dei pazienti ha dimostrato il vantaggio della combinazione di farmaci.
Turbohaler Symbicort. I componenti costitutivi sono budesonide e formoterolo fumarato. Viene presentato sul mercato russo in un dosaggio di 160 / 4,5 mcg / dose (le dosi del farmaco sono indicate come dose di uscita).
Il farmaco ha una rapida insorgenza d'azione (entro 1-3 minuti) grazie alla rapida azione del formoterolo. Può essere utilizzato una volta, poiché è stato dimostrato l'effetto 24 ore su 24 della budesonide. Tutto questo insieme crea la possibilità di un dosaggio flessibile del farmaco.
Glucocorticosteroidi sistemici
Gli steroidi sistemici per l'asma bronchiale vengono solitamente utilizzati per via orale e molto meno spesso - per via endovenosa ad alte dosi (terapia del polso) durante un'esacerbazione della malattia.
I meccanismi d'azione proposti sono gli stessi dell'ICS. Tuttavia, i corticosteroidi sistemici possono raggiungere cellule bersaglio diverse rispetto ai corticosteroidi inalatori e formare complicanze sistemiche con l’uso a lungo termine.
È necessario distinguere tra la nomina di corticosteroidi sistemici in caso di segni di esacerbazione dell'asma bronchiale e come farmaci per il controllo a lungo termine dell'asma bronchiale persistente. L’uso di steroidi sistemici per il controllo dell’asma a lungo termine definisce immediatamente il paziente come grave e richiede ICS ad alte dosi e beta2-agonisti per via inalatoria a lunga durata d’azione (Tabelle 3-5, passo 4). È inaccettabile controllare l’asma bronchiale solo con steroidi sistemici. La mancata prescrizione di corticosteroidi inalatori in questo caso è un grave errore medico, che porta allo sviluppo di gravi complicanze sistemiche con controllo insufficiente del processo infiammatorio nei polmoni. Sono note complicazioni legate all'uso prolungato di corticosteroidi sistemici: osteoporosi, ipertensione arteriosa, diabete mellito, soppressione dell'attività funzionale del sistema ipotalamo-ipofisi-surrene, cataratta, glaucoma, obesità, assottigliamento della pelle con formazione di strie e aumento della permeabilità capillare, debolezza muscolare. Se persiste la necessità di un uso a lungo termine di corticosteroidi sistemici, nonostante il volume massimo della terapia inalatoria, dal momento della prescrizione della terapia steroidea sistemica in qualsiasi forma, il paziente deve ricevere una terapia preventiva per l'osteoporosi.
Va notato che l’indice terapeutico (rapporto effetto/effetto indesiderato) nel trattamento a lungo termine dell’asma bronchiale con corticosteroidi inalatori è sempre più elevato rispetto a qualsiasi terapia corticosteroidea orale o parenterale a lungo termine. I corticosteroidi inalatori sono più efficaci di quelli orali, assunti a giorni alterni. Se si intende effettuare una terapia a lungo termine con corticosteroidi orali, è necessario prestare attenzione alle misure che riducono gli effetti indesiderati sistemici. Per il trattamento a lungo termine, i preparati orali sono preferibili a quelli parenterali. È meglio somministrare corticosteroidi orali come il prednisone, il prednisolone o il metilprednisolone perché hanno effetti mineralcorticoidi minimi, un'emivita relativamente breve e una lieve attività della muscolatura striata. Se possibile, dovrebbero essere somministrati a giorni alterni. L'uso a lungo termine del triamcinolone è indesiderabile a causa del frequente sviluppo di distrofia muscolare, perdita di peso, debolezza, lesioni del tratto gastrointestinale; i preparati a base di triamcinolone sono categoricamente controindicati nelle donne in gravidanza e nei bambini. Il desametasone nell'asma bronchiale non è indicato per l'uso a lungo termine a causa della pronunciata soppressione della funzione della corteccia surrenale, della capacità di trattenere i liquidi e della bassa efficacia contro l'HCC nei polmoni.
Se possibile, nella terapia a lungo termine, i corticosteroidi orali devono essere somministrati una volta al giorno, al mattino, ogni giorno o a giorni alterni. Va sottolineato ancora una volta che la scelta dei corticosteroidi sistemici per la terapia di mantenimento ricade attualmente su farmaci a breve durata d'azione. L'uso di forme depositate a lunga durata d'azione nel trattamento dell'asma bronchiale è fortemente sconsigliato.
Qualsiasi paziente a cui vengono prescritti corticosteroidi sistemici per il controllo dell'asma bronchiale deve essere sottoposto ad un esame approfondito al fine di stabilire le ragioni che hanno portato alla necessità di questo tipo di trattamento. I fattori più importanti sono: errori medici nel trattamento dell’asma bronchiale (mancata somministrazione di ICS, sottostima della gravità dell’asma bronchiale negli stadi precedenti, tentativo di controllare l’infiammazione durante una riacutizzazione con basse dosi di corticosteroidi, che porta alla nomina di corticosteroidi sistemici per un lungo periodo, uso di beta-bloccanti, selezione errata di un sistema di somministrazione per ICS), bassa compliance, esposizione continua ad allergeni. In alcuni casi, viene effettuata una diagnosi errata di asma bronchiale, in cui i sintomi respiratori sono il risultato di un'altra patologia (vasculite sistemica, sclerodermia sistemica, dermatomiosite, aspergillosi broncopolmonare, malattia da reflusso gastroesofageo, isteria, ecc.). Nel 5% dei casi si verifica resistenza agli steroidi, caratterizzata dalla resistenza dei recettori degli steroidi ai farmaci steroidei. Attualmente si distinguono due sottogruppi: pazienti con vera resistenza agli steroidi (tipo II), che non presentano effetti collaterali con l'uso a lungo termine di alte dosi di glucocorticoidi sistemici, e pazienti con resistenza acquisita (tipo I), che presentano effetti collaterali da prendendo steroidi sistemici. Nell'ultimo sottogruppo, la resistenza può molto probabilmente essere superata aumentando la dose di glucocorticoidi e prescrivendo farmaci che hanno un effetto additivo.
È necessario sviluppare programmi diagnostici e terapeutici per i pazienti sottoposti a terapia steroidea sistemica. Dovrebbe essere effettuata un'attenta diagnosi differenziale per escludere altre malattie che imitano il quadro clinico dell'asma bronchiale.
Il medico deve affrontare il compito di controllare il processo infiammatorio nell'asma bronchiale con le dosi di mantenimento più basse di ICS sia sistemici che inalatori. L’introduzione nella pratica clinica di glucocorticosteroidi altamente lipofili, in particolare del fluticasone propionato, può ridurre significativamente o addirittura eliminare completamente i corticosteroidi sistemici. Sfortunatamente, al momento non esistono schemi fissi per ridurre il GCS sistemico. Pertanto, il medico deve valutare correttamente il quadro clinico della malattia, suggerire le possibili cause di dipendenza da steroidi e prescrivere la dose massima di ICS altamente efficaci, come il fluticasone propionato. È obbligatorio raccomandare l’uso del picco di flusso giornaliero e tenere conto dell’assunzione di beta2-agonisti secondo necessità come controllo della funzione respiratoria. È necessario ridurre gradualmente il GCS sistemico in un contesto di assunzione costante di dosi elevate di ICS. Ci sembra opportuno ridurre lentamente i corticosteroidi sistemici, riducendo la dose non prima di ogni 3-4 settimane, per evitare lo sviluppo di complicanze. Si consiglia di effettuare un esame del sangue ad ogni riduzione della dose. Un possibile aumento della VES e dell'eosinofilia può indicare una manifestazione di una malattia sistemica, inclusa la vasculite. È anche auspicabile indagare il livello basale di cortisolo, poiché dopo la cessazione della terapia a lungo termine con dosi soppressive di corticosteroidi sistemici è possibile lo sviluppo di insufficienza surrenalica. Sullo sfondo di una diminuzione dei corticosteroidi sistemici, è impossibile ridurre le dosi di mantenimento dei corticosteroidi inalatori. Dopo la sospensione degli steroidi sistemici, deve essere effettuata una titolazione della dose di ICS tenendo conto delle raccomandazioni dell’approccio graduale. Sembra appropriato prescrivere una terapia di combinazione ai pazienti con asma bronchiale grave steroido-dipendente.
L'anello centrale nella patogenesi dell'asma bronchiale (BA) è l'infiammazione allergica cronica del tratto respiratorio inferiore. Questa circostanza determina la scelta dei glucocorticosteroidi (GCS) come farmaci principali e più efficaci utilizzati per la terapia di base (quotidiana) della BA e per il trattamento delle esacerbazioni di questa malattia.
I GCS sono attualmente considerati i farmaci più efficaci per il trattamento di base dell’AD. Secondo la scala di valutazione adottata nella medicina basata sull’evidenza, l’uso delle GCS è una raccomandazione di primo livello (livello di raccomandazione A). In un gran numero di studi, l'uso di questi farmaci è stato accompagnato da un miglioramento significativo della funzione respiratoria, un aumento della spirometria, una diminuzione della gravità dei sintomi dell'asma bronchiale, una diminuzione dell'iperreattività bronchiale e un miglioramento della qualità della vita (Livello di evidenza A). Pertanto, i corticosteroidi hanno un effetto positivo su quasi tutte le manifestazioni di AD e dovrebbero essere utilizzati costantemente in tutti i pazienti, ad eccezione dei pazienti con decorso lieve e intermittente della malattia.
L'ampia introduzione dei corticosteroidi nella pratica del trattamento dell'asma è diventata possibile solo con l'avvento delle forme utilizzate per inalazione. L'uso di inalazioni di corticosteroidi ha permesso, in primo luogo, di potenziare gli effetti locali (in relazione al tratto respiratorio) della terapia con corticosteroidi e, in secondo luogo, di ridurre la gravità e la frequenza delle reazioni avverse ai farmaci (ADR) associate all'azione sistemica dei corticosteroidi. questi farmaci.
L'uso di corticosteroidi sotto forma di inalazioni consente ai pazienti di evitare completamente lo sviluppo di complicazioni formidabili della terapia con corticosteroidi, come un'ulcera del tratto gastrointestinale superiore, il diabete steroideo e l'ipertensione. D'altra parte, con l'uso di corticosteroidi sotto forma di inalazioni, i NLR come la sindrome di Cushing, l'insufficienza surrenalica secondaria, il glaucoma, ecc., si verificano meno frequentemente.
Tuttavia, nonostante tutti i vantaggi di questo metodo, in alcuni casi i corticosteroidi inalatori non sono sufficientemente efficaci.
- Nei pazienti con esacerbazione dell'asma o con un decorso molto grave della malattia, accompagnato da una significativa diminuzione della pervietà bronchiale, l'uso di corticosteroidi per via inalatoria è inefficace, poiché una grave ostruzione bronchiale riduce significativamente il flusso di questi farmaci nelle vie respiratorie medie e inferiori. tratto. Si ritiene che con l'ostruzione bronchiale, in cui la velocità di picco del flusso espiratorio diminuisce a un livello inferiore a 200 ml / s, l'uso di corticosteroidi inalatori sia inefficace.
- In un certo numero di pazienti (vecchiaia, malattie che si verificano con memoria e intelligenza compromesse), quando si utilizzano inalatori, sorgono problemi significativi, che spesso non possono essere eliminati, il che a sua volta non consente una terapia inalatoria a tutti gli effetti.
- Nell'asma molto grave o in presenza di relativa resistenza del paziente all'azione dei corticosteroidi, può verificarsi un'inefficacia completa o parziale dei corticosteroidi inalatori quando utilizzati a dosi elevate.
- I corticosteroidi inalatori sono praticamente inefficaci in numerosi pazienti affetti da forme cliniche particolari di asma, ad esempio asma a decorso labile1.
Pertanto, la questione dell'uso dei corticosteroidi sistemici (corticosteroidi per somministrazione orale, endovenosa o intramuscolare sotto forma di farmaci a lunga durata d'azione - forme di deposito) rimane piuttosto rilevante, nonostante l'alto rischio di ADR e la presenza di inalazioni meno "pericolose" forme.
La scelta del farmaco per uso sistemico
Le moderne linee guida per la pratica clinica raccomandano l'uso di agenti per il trattamento dell'AD che forniscano una combinazione di elevata attività antinfiammatoria e minima attività mineralcorticoide. La tabella mostra che farmaci come il prednisolone e il metilprednisolone soddisfano maggiormente questi requisiti.
Farmacocinetica dei corticosteroidi sistemici utilizzati per il trattamento dell'asma
Dal punto di vista della farmacocinetica, questi farmaci si distinguono per un'elevata biodisponibilità orale (circa il 100%). Nel prednisolone e nel metilprednisolone, la concentrazione massima nel sangue si osserva già 0,5-1,5 ore dopo la somministrazione. La velocità del loro assorbimento può essere influenzata dall'assunzione simultanea di cibo, mentre la velocità di assorbimento diminuisce, ma la biodisponibilità rimane allo stesso livello. Questi farmaci vengono rapidamente metabolizzati nel fegato (l'emivita è rispettivamente di 60 e 200 minuti) ed escreti nelle urine come coniugati degli acidi solforico e glucuronico.
Allo stesso tempo, a causa dell'elevata lipofilia, il prednisolone e il metilprednisolone sono distribuiti attivamente nei tessuti del corpo e l'emivita dai tessuti è di 0,5-1,5 giorni. .
L'efficacia del GCS è potenziata dalla somministrazione simultanea di eritromicina (rallenta il metabolismo dei glucocorticoidi nel fegato), salicilati (un aumento della frazione dei glucocorticoidi non associati alle proteine), estrogeni. Gli induttori degli enzimi epatici microsomiali - fenobarbital, fenitoina, rifampicina - riducono l'efficacia di questi farmaci.
I GCS indeboliscono l'effetto degli anticoagulanti, dei farmaci antidiabetici e antipertensivi e aumentano l'effetto della teofillina, dei simpaticomimetici, degli immunosoppressori, dei farmaci antinfiammatori non steroidei.
Importante per il trattamento dell'asma è l'interazione dei corticosteroidi con i b2-agonisti. Con l'uso sistematico di stimolanti b2-adrenergici, la tolleranza alla loro azione broncodilatatrice si sviluppa abbastanza rapidamente (si osserva una diminuzione della sensibilità dei recettori - desensibilizzazione e una diminuzione del loro numero - down-regulation). I GCS sono in grado di aumentare il numero di recettori b-adrenergici, aumentandone la trascrizione e prevenendo lo sviluppo di desensibilizzazione e down-regulation.
Farmacodinamica e NLR dei corticosteroidi sistemici utilizzati per il trattamento dell'AD
Secondo le loro caratteristiche farmacodinamiche, prednisolone e metilprednisolone praticamente non differiscono l'uno dall'altro. Entrambi i farmaci hanno un pronunciato effetto antinfiammatorio (principalmente nelle forme allergiche e immunitarie del processo infiammatorio), inibiscono la sintesi di prostaglandine, leucotrieni e citochine, causano una diminuzione della permeabilità capillare, riducono la chemiotassi delle cellule immunocompetenti e sopprimono l'attività di fibroblasti, linfociti T, macrofagi ed eosinofili.
D'altra parte, l'uso di questi farmaci porta ad un ritardo nell'apporto di sodio e acqua nell'organismo (a causa di un aumento del riassorbimento nei tubuli renali distali) e ad un aumento del peso corporeo.
Una diminuzione dell'assorbimento del calcio dal cibo sotto l'influenza di corticosteroidi, una diminuzione del suo accumulo nel tessuto osseo e una maggiore escrezione di calcio nelle urine creano i prerequisiti per lo sviluppo di un altro NLR dei corticosteroidi: l'osteoporosi. Con l'uso prolungato di prednisolone e metilprednisolone, si nota lo sviluppo della sindrome di Cushing, del diabete steroideo, della stimolazione dei processi catabolici nella pelle, nel tessuto osseo e nei muscoli (fino allo sviluppo della distrofia muscolare e delle lesioni cutanee). Questi farmaci possono causare ipertensione arteriosa (ipertensione steroidea), linfocitopenia, monocitopenia ed eosinopenia.
L'uso a lungo termine di corticosteroidi sistemici (specialmente in combinazione con ipossia cronica) provoca la formazione di ulcere gastriche steroidee e aumenta il rischio di sanguinamento dal tratto gastrointestinale superiore.
Una delle conseguenze più spiacevoli dell'uso prolungato di corticosteroidi è lo sviluppo di un'insufficienza surrenalica secondaria con l'abolizione dei corticosteroidi. Il rischio di sviluppare insufficienza surrenalica secondaria è significativamente aumentato:
- quando si utilizzano dosi > 2,5-5 mg/die. (in termini di prednisolone2);
- con durata del trattamento >10-14 giorni;
- quando si assumono farmaci la sera.
Caratteristiche della farmacodinamica dei corticosteroidi sistemici nei pazienti con asma
Quando si assumono 40 mg di prednisolone per via orale, il farmaco inizia ad agire (un indicatore stimato nei pazienti con asma dall'entità dell'aumento del volume espiratorio forzato in 1 secondo - FEV1) già 3 ore dopo l'assunzione del farmaco. L'effetto massimo (in termini di effetto sulla pervietà bronchiale) si osserva 9 ore dopo l'assunzione del farmaco e persiste anche 24 ore dopo una singola dose. Il livello di FEV1 raggiunge il valore iniziale dopo 36 ore. Questi dati si riferiscono a pazienti con asma in condizioni stabili. Meta-analisi sull’uso di corticosteroidi in pazienti con grave (livello FEV1<50% от должной величины) обострением БА показал, что значимое увеличение ОФВ1 у больных с обострением наблюдается не ранее чем через 12—24 ч после начала лечения3 .
Con la somministrazione orale ripetuta di corticosteroidi in pazienti con un decorso stabile di asma (prednisolone 20 mg al giorno per 3 settimane), nella prima settimana di trattamento, il 70% dei pazienti ha mostrato un miglioramento della pervietà bronchiale (aumento del FEV1 > 10% da base). Allo stesso tempo, la risposta massima al trattamento con prednisolone è stata osservata già dopo 5,1 giorni. .
In generale, l’efficacia dei corticosteroidi sistemici nei pazienti con asma è dose-dipendente e aumenta con l’assunzione costante di questi farmaci rispetto a quelli alternati. L’efficacia dei corticosteroidi sistemici nel fermare le riacutizzazioni dell’asma (stimata dal numero di pazienti che hanno evitato il ricovero ospedaliero a causa dell’uso di corticosteroidi sistemici) è molto più elevata se utilizzati entro la prima ora dopo la comparsa dei sintomi della riacutizzazione.
APPLICAZIONE DELLE CGV SISTEMICHE NELLA PRATICA DAL PUNTO DI VISTA DELLA MEDICINA BASATA SULL'EVIDENZA
Dal punto di vista della medicina basata sull’evidenza, si possono distinguere diverse indicazioni per la nomina di corticosteroidi sistemici.
Terapia per l'esacerbazione dell'asma
Secondo la strategia globale per l’asma, i corticosteroidi sistemici dovrebbero essere utilizzati per tutte le riacutizzazioni dell’asma tranne quelle più lievi4 (livello di raccomandazione A), soprattutto quando:
- dopo la prima somministrazione di b2-agonisti non si osserva alcun miglioramento a lungo termine delle condizioni del paziente;
- l'esacerbazione della BA si è sviluppata nonostante il fatto che il paziente stia già assumendo GCS per via orale;
- precedenti riacutizzazioni hanno richiesto l'uso di corticosteroidi sistemici;
- è necessario aumentare le dosi di corticosteroidi inalatori durante le riacutizzazioni dell'asma (grado di raccomandazione D).
- Un parere simile è condiviso dagli esperti della British Thoracic Society, che ha anche sviluppato i propri criteri per la prescrizione di corticosteroidi sistemici per le riacutizzazioni dell'asma (livello di raccomandazione D):
- peggioramento e peggioramento dei sintomi "giorno dopo giorno";
- calo del picco di flusso espiratorio al di sotto del 60% del valore individuale migliore;
- disturbi del sonno dovuti a sintomi di asma;
- la presenza costante di sintomi di asma al mattino (prima di mezzogiorno);
- diminuzione della risposta ai broncodilatatori inalatori;
- l'emergenza/aumento della necessità di broncodilatatori inalatori.
Sulla base di queste raccomandazioni, per alleviare le riacutizzazioni, i GCS dovrebbero essere assunti per via orale, poiché la somministrazione di questi farmaci per via endovenosa non fornisce ulteriori benefici. I corticosteroidi per via endovenosa dovrebbero essere utilizzati solo in quei pazienti che, per una serie di motivi, non possono assumere farmaci in compresse (grado di raccomandazione A).
I migliori risultati si ottengono prescrivendo corticosteroidi entro la prima ora dalla comparsa dei sintomi di riacutizzazione (grado di raccomandazione B).
Il trattamento di una riacutizzazione inizia con l'uso di prednisolone orale in dosi da 60 a 80 mg o idrocortisone - da 300 a 400 mg al giorno. Queste dosi sono adeguate per la maggior parte dei pazienti ospedalizzati (grado di raccomandazione B).
La terapia con GCS deve essere continuata per 10-14 giorni negli adulti e 3-5 giorni nei bambini (livello di raccomandazione D), anche se in alcuni casi, ad esempio, con persistenza prolungata dei sintomi di riacutizzazione, il ciclo di trattamento può essere esteso fino a tre settimane (livello di raccomandazione C) .
Non esistono prove dei benefici derivanti dalla riduzione graduale della dose di corticosteroidi orali (grado di raccomandazione B), pertanto l'abolizione dei corticosteroidi dovrebbe essere effettuata contemporaneamente. Naturalmente, in questo caso, il paziente deve iniziare a prendere i corticosteroidi per via inalatoria in anticipo (alcuni giorni prima della sospensione del prednisolone).
Una riduzione graduale della dose è indicata nei casi in cui il paziente assume corticosteroidi sistemici per più di 2-3 settimane. In questo caso, la dose viene ridotta gradualmente (nell'arco di diverse settimane). Una situazione simile può verificarsi nel caso in cui al paziente non siano stati prescritti corticosteroidi per via inalatoria, poiché è impossibile annullare l'assunzione orale di corticosteroidi prima di unirsi alla terapia con corticosteroidi per via inalatoria.
Di solito, dopo la dimissione dall'ospedale, i pazienti continuano a ricevere corticosteroidi sistemici (30-60 mg/die) per almeno 7-10 giorni5 (livello di raccomandazione A), soprattutto se in ospedale non sono stati prescritti corticosteroidi inalatori.
BA grave
I pazienti con un decorso asmatico molto grave, i cui sintomi della malattia persistono nonostante l'uso delle dosi massime di corticosteroidi inalatori, sono candidati alla terapia con corticosteroidi sistemici. In questo caso, la nomina di GCS all'interno deve essere preceduta dall'uso di tutti i mezzi aggiuntivi a disposizione del medico per controllare il decorso dell'asma (β2-agonisti prolungati, teofilline prolungate, ecc.) (livello di raccomandazione A). I pazienti che necessitano di corticosteroidi orali continuativi devono ricevere anche corticosteroidi inalatori (livello di raccomandazione A) per mantenere la dose di mantenimento al minimo. Per la terapia a lungo termine con corticosteroidi orali, il farmaco deve essere somministrato una volta al mattino ogni giorno o a giorni alterni.
Asma "difficile".
Asma "difficile" è un termine medico coniato da Barnes a metà degli anni '90. Questo concetto combina diverse forme di asma bronchiale che presentano particolari difficoltà terapeutiche: asma labile (vedi sopra), asma associata al ciclo mestruale, asma resistente al GCS, asma in pazienti con ipersensibilità agli allergeni fungini e professionali, ecc. La maggior parte delle forme di asma “difficile” è la necessità di assumere quotidianamente corticosteroidi per via orale (in alcuni casi ad alte dosi).
Sicurezza del trattamento
L'uso di corticosteroidi all'interno richiede un monitoraggio costante da parte del medico per la sicurezza del trattamento e la correzione delle inevitabili complicanze. Il paziente deve essere informato sulle possibili ADR, nonché utilizzare le regole più semplici per la loro prevenzione (ad esempio, assumere il farmaco solo al mattino).
Le misure più rilevanti in questo senso sono le seguenti:
- attenta raccolta e analisi dei reclami associati al tratto gastrointestinale superiore, con sospetto dello sviluppo di un'ulcera steroidea - EGDS; prescrizione profilattica di farmaci antiulcera in pazienti con anamnesi di malattie dello stomaco (ranitidina o omeprozolo 1 compressa alla sera);
- controllo del livello della pressione sanguigna e sua correzione farmacologica;
- test regolari dei livelli di zucchero nel sangue;
- esame regolare da parte di un oftalmologo;
- densitometria annuale6, somministrazione profilattica di preparati di calcio e vitamina D3;
- studi volti a identificare invasioni fungine e tubercolosi.
Nei pazienti con herpes, così come nelle persone che sono state in contatto con pazienti con varicella, l'uso del GCS deve essere interrotto immediatamente.
Conclusione
I corticosteroidi sistemici continuano a occupare un posto importante nel trattamento dell'asma grazie alla loro elevata efficacia, ma il loro utilizzo è inevitabilmente accompagnato dallo sviluppo della NLR. L'obiettivo del medico è determinare correttamente le indicazioni per l'uso dei corticosteroidi sistemici, minimizzarne l'uso combinandoli con corticosteroidi inalatori e altri farmaci (b2-agonisti a lunga durata d'azione, teofilline prolungate, ecc.) o utilizzando cicli di trattamento alternati.
D'altra parte, non bisogna trascurare la nomina di cicli brevi (e relativamente sicuri) di corticosteroidi in pazienti con esacerbazione della BA o ritardare la loro nomina fino all'ultimo. L'uso di corticosteroidi all'interno è una tattica terapeutica generalmente riconosciuta per il trattamento dell'asma e serve principalmente gli interessi del paziente stesso.
Tuttavia, in tutti i casi di utilizzo delle CGV è necessario un controllo mirato e la successiva correzione delle inevitabili ADR.
A.N.Tsoi, dottore in scienze mediche, professore
V. V. Arkhipov
MMA loro. I. M. Sechenov, Mosca
Letteratura
- Barnes P. J., Chung K. F., Page C. P. Mediatori infiammatori dell'asma: un aggiornamento // PHARM. REV. 1998 vol. 50. N. 4. 515-596.
- Rapporto del workshop NHLBI/OMS: Strategia globale per la gestione e la prevenzione dell'asma // Pubblicazione NIH. N. 02-3659. Febbraio 2002. P. 1-177 (traduzione russa, Mosca: Atmosfera, 2002).
- Medicina basata sull'evidenza // Farmacologia clinica. 1999, 6, pag. 3-9.
- Barnes P. J., Pedersen S., Busse W. W. Efficacia e sicurezza dei corticosteroidi inalatori // Am. J. Respi. Critico. Cura Med. 1998. 157. s 51-s 53.
- Lipworth B. J. Trattamento dell'asma acuto // Lancet. 1997. 350 (suppl. II). Pag. 18-23.
- Barnes P.J., Woolcock A.J. Asma difficile // Eur. Respira. J. 1998.12: 1209-1218.
- Ayres J. G. Classificazione e gestione dell'asma fragile // Br. J.Hosp. Med. 1997.57: 387-389.
- Mosby's Drug Consult.Mosby's GenRx(r), 2002, 12a ed. Versione Internet. Sito web: www.mdconsult.com
- Barnes P. J., Chung K. F., Page C. P. Mediatori infiammatori dell'asma: un aggiornamento // PHARM. REV. 1998 vol. 50. n. 4.515-596.
- Barnes P. J. Effetti dei b2-agonisti e degli steroidi sui b2-adrenorecettori // Eur. Respira. Rev. 1998,8:55; 210-215.
- Kia Soong Tan, McFarlane L. C., Lipworth B. J. La somministrazione concomitante di prednisolone a basse dosi protegge dalla subsensibilità in vivo dei recettori beta2-adrenergici indotta dal formoterolo regolare. Petto 1998; vol. 113: N. 1; 34-41.
- Mak J. C. W., Nishikawa M., Barnes P. J. I glucocorticosteroidi aumentano la trascrizione del recettore b2-adrenergico nel polmone umano // Am. J Physiol. 1995.268:L41-46.
- Ellul-Micallef R., Borthwick R. C., McHardy G. J. R. L'andamento temporale della risposta al prednisolone nell'asma bronchiale cronico // Scienza clinica e medicina molecolare Clin. sci. Mod. Med. 1974.47 105-117.
- Ellul-Micallef R., Borthwick R. C., McHardy G. J. R. L'effetto del prednisolone orale sullo scambio di gas nell'asma bronchiale cronica // Br. J.Clin. Farmaco. 1980.9:479-482.
- Ellul-Micallef R., Johansson S. A. Studi di risposta alla dose acuta nell'asma bronchiale con un nuovo corticosteroide, budesonide // Br. J.Clin. Farmaco. 15:419-422.1983.
- Rodrigo G, Rodrigo C. Corticosteroidi nella terapia del pronto soccorso dell'asma acuto dell'adulto // Torace. 1999. 116: 285-295.
- Webb J., Clark T. J. H., Chilvers C. Andamento temporale della risposta al prednisolone nell'ostruzione cronica del flusso aereo. Torace. 1981.36:18-21.
- Lin R. Y., Persola G. R., Westfal R. E. Amministrazione precoce di corticosteroidi parenterali nell'asma acuto // American Journal of Emergency Medicine. Volume 15. N. 7. Novembre 1997. P. 621-625.
- Rapporto canadese sul consenso sull'asma, 1999 // CMAJ. 1999; 161 .
- Le linee guida britanniche sulla gestione dell’asma: revisione del 1995 e presa di posizione. Torace, 1997; 52 (supplemento I): 1-21.
2 Il prednisolone alla dose di 5 mg è equivalente nella sua attività GCS a 4 mg di metilprednisolone.
3 Allo stesso tempo, è difficile differenziare l'aumento del FEV1 dovuto all'effetto antinfiammatorio del GCS dall'aumento del FEV1 sotto l'influenza dei broncodilatatori, che sono stati ricevuti da tutti i pazienti con grave esacerbazione di BA.
4 Sotto l'esacerbazione di BA si intende:
- richiedere cure mediche d'urgenza e/o ricovero ospedaliero in relazione al peggioramento del decorso della BA;
- la necessità di recepire le GCS;
- un aumento significativo (> 2 volte) della necessità di b2-agonisti per via inalatoria rispetto al basale per due o più giorni consecutivi;
- diminuzione del livello del picco di flusso espiratorio o del volume espiratorio forzato in 1 secondo<50% от должного значения.
5 La raccomandazione degli esperti occidentali, dove, di regola, la durata del ricovero è breve.
6 È particolarmente importante controllare gli indicatori del metabolismo minerale osseo nelle donne in età di menopausa, nelle persone con ereditarietà sfavorevole, nei pazienti con una storia di fratture delle estremità, ecc.
- In contatto con 0
- Google Plus 0
- OK 0
- Facebook 0