MACROFAGI. I macrofagi (dal greco antico, grande mangiatore) sono un tipo speciale di grandi globuli bianchi che, contemporaneamente a quelle cellule che, di fatto, sono i loro predecessori, creano una simbiosi chiamata sistema dei fagociti mononucleari (dal greco antico, “a assorbire (mangiare) cellula"). In questo caso, monoblasti, promociti e monociti fungono da cellule precursori.
Origine e scopo dei macrofagi
I macrofagi sono chiamati cellule “spazzino” per un motivo, poiché tutto ciò con cui entrano in contatto viene assorbito e distrutto attraverso la digestione. Una certa percentuale di macrofagi si trova costantemente in determinati luoghi: nei capillari e nei linfonodi, nel fegato, nei polmoni, nei tessuti connettivi e nervosi, nelle ossa, compreso il midollo osseo. Altri vagano tra le cellule, accumulandosi gradualmente in quei luoghi in cui è più probabile che uno o l'altro agente infettivo entri nel corpo.
Tutti i tipi di macrofagi hanno origine dai monociti del sangue e i monociti, a loro volta, derivano dai promonociti del midollo osseo, che maturano gradualmente dalle cellule progenitrici precedenti fino al raggiungimento di un certo stadio. In particolare, i macrofagi hanno un circuito di feedback con queste cellule progenitrici; forniti grazie alla loro capacità di produrre citochine (fattori di crescita) nel sangue, che entrano nel midollo osseo con il sangue, favorendo così i processi naturali di divisione cellulare che si sono formati in precedenza. Questo processo si attiva, ad esempio, in presenza di alcune infezioni, quando molti macrofagi muoiono nella lotta contro i “nemici”, vengono sostituiti da nuovi macrofagi, che maturano ad un ritmo accelerato nel midollo osseo.
Come “funzionano” i macrofagi in presenza di infezioni nel corpo?
GcMAF è un farmaco unico per attivare l'attività dei macrofagi
Sfortunatamente per noi, nonostante le loro enormi capacità, i macrofagi potrebbero essere inattivi. Ad esempio, tutte le cellule tumorali, così come quelle virali e infettive, producono la proteina alfa-N-acetilgalattosaminidasi (nagalasi), che blocca la produzione della glicoproteina GcMAF, che stimola l'attivazione dei macrofagi, interferendo così con il normale funzionamento del sistema immunitario. sistema immunitario. E in assenza di attività del sistema immunitario, i tumori maligni si sviluppano in modo incontrollabile e il livello delle infezioni virali aumenta. In questo caso esiste un farmaco chiamato GcMAF, che attiva i macrofagi e potenzia l’attività della risposta immunitaria. Puoi acquistare GcMAF autentico presso la clinica del Dr. Vedov.
Articolo per il concorso “bio/mol/text”: Il sistema immunitario è una potente difesa a più livelli del nostro corpo, che è sorprendentemente efficace contro virus, batteri, funghi e altri agenti patogeni provenienti dall’esterno. Inoltre, il sistema immunitario è in grado di riconoscere e distruggere efficacemente le proprie cellule trasformate, che possono degenerare in tumori maligni. Tuttavia, i malfunzionamenti del sistema immunitario (per ragioni genetiche o di altro tipo) portano al fatto che un giorno le cellule maligne prendono il sopravvento. Un tumore troppo cresciuto diventa insensibile agli attacchi del corpo e non solo evita con successo la distruzione, ma “riprogramma” attivamente le cellule protettive per soddisfare i propri bisogni. Comprendendo i meccanismi utilizzati dai tumori per sopprimere la risposta immunitaria, possiamo sviluppare contromisure e provare a spostare l’equilibrio verso l’attivazione delle difese dell’organismo per combattere la malattia.
Questo articolo è stato presentato al concorso di lavori scientifici divulgativi “bio/mol/text”-2014 nella categoria “Best Review”.
Lo sponsor principale del concorso è l'azienda lungimirante Genotech.
Il concorso è stato sostenuto da RVC OJSC.
Tumore e immunità: un dialogo drammatico in tre parti con un prologo
Per molto tempo si è creduto che la ragione della scarsa efficacia della risposta immunitaria nel cancro fosse che le cellule tumorali sono troppo simili a quelle normali e sane perché il sistema immunitario, sintonizzato per cercare “estranei”, possa riconoscerli correttamente. Questo spiega precisamente il fatto che il sistema immunitario resiste con maggior successo ai tumori di natura virale (la loro frequenza aumenta bruscamente nelle persone che soffrono di immunodeficienza). Tuttavia, in seguito divenne chiaro che questo non era l’unico motivo.
Se questo articolo tratta gli aspetti immunitari del cancro, allora il lavoro “Non esistono artigli più terribili al mondo...” Puoi leggere le caratteristiche del metabolismo del cancro. -Ed.
Si è scoperto che l'interazione delle cellule tumorali con il sistema immunitario è molto più diversificata. Il tumore non si limita a “nascondersi” dagli attacchi, ma può sopprimere attivamente la risposta immunitaria locale e riprogrammare le cellule immunitarie, costringendole a soddisfare i propri bisogni maligni.
Il “dialogo” tra una cellula degenerata, fuori controllo, con la sua progenie (cioè un futuro tumore) e l'organismo si sviluppa in più fasi, e se all'inizio l'iniziativa è quasi tutta dalla parte delle difese dell'organismo, poi alla fine (in caso di sviluppo di una malattia) - va sul lato del tumore. Diversi anni fa, gli immunologi oncologici formularono il concetto di “immunoediting” ( immunoediting), descrivendo le fasi principali di questo processo (Fig. 1).
Figura 1. Immunoediting (immunoediting) durante lo sviluppo di un tumore maligno.
La prima fase dell'immunoediting è il processo di eliminazione ( eliminazione). Sotto l'influenza di fattori cancerogeni esterni o come risultato di mutazioni, una cellula normale viene "trasformata" - acquisisce la capacità di dividersi indefinitamente e di non rispondere ai segnali regolatori del corpo. Ma allo stesso tempo, di regola, inizia a sintetizzare speciali "antigeni tumorali" e "segnali di pericolo" sulla sua superficie. Questi segnali attraggono le cellule del sistema immunitario, principalmente i macrofagi, le cellule natural killer e le cellule T. Nella maggior parte dei casi, distruggono con successo le cellule “viziate”, interrompendo lo sviluppo del tumore. Tuttavia, a volte tra queste cellule “precancerose” ce ne sono diverse la cui immunoreattività – la capacità di provocare una risposta immunitaria – è indebolita per qualche motivo, sintetizzano meno antigeni tumorali, sono meno riconosciute dal sistema immunitario e, essendo sopravvissute alla prima ondata di la risposta immunitaria, continuano a dividersi.
In questo caso, l'interazione del tumore con il corpo entra nella seconda fase, la fase di equilibrio ( equilibrio). In questo caso il sistema immunitario non è più in grado di distruggere completamente il tumore, ma è comunque in grado di limitarne efficacemente la crescita. In tale stato di “equilibrio” (e non rilevabile con i metodi diagnostici convenzionali), i microtumori possono esistere nel corpo per anni. Tuttavia, tali tumori latenti non sono statici: le proprietà delle cellule che li compongono cambiano gradualmente sotto l'influenza di mutazioni e successiva selezione: tra le cellule tumorali in divisione, quelle che sono più capaci di resistere al sistema immunitario ricevono un vantaggio, e alla fine le cellule compaiono nel tumore - immunosoppressori. Sono in grado non solo di evitare passivamente la distruzione, ma anche di sopprimere attivamente la risposta immunitaria. Essenzialmente, si tratta di un processo evolutivo in cui il corpo “fa emergere” involontariamente l’esatto tipo di cancro che lo ucciderà.
Questo momento drammatico segna la transizione del tumore al terzo stadio di sviluppo: l'evitamento ( fuga), - in cui il tumore è già insensibile all'attività delle cellule del sistema immunitario, inoltre, volge la loro attività a proprio vantaggio. Comincia a crescere e metastatizzare. È questo tipo di tumore che viene solitamente diagnosticato dai medici e studiato dagli scienziati: i due stadi precedenti si verificano nascosti e le nostre idee al riguardo si basano principalmente sull'interpretazione di una serie di dati indiretti.
Dualismo della risposta immunitaria e suo significato nella cancerogenesi
Esistono molti articoli scientifici che descrivono come il sistema immunitario combatte le cellule tumorali, ma un numero altrettanto elevato di pubblicazioni dimostra che la presenza di cellule del sistema immunitario nell’ambiente immediato del tumore è un fattore negativo correlato all’accelerazione della crescita del cancro e delle metastasi. Nell’ambito del concetto di immunoediting, che descrive come la natura della risposta immunitaria cambia con lo sviluppo del tumore, questo duplice comportamento dei nostri difensori ha finalmente trovato una spiegazione.
Esamineremo alcuni dei meccanismi che determinano questo processo, utilizzando come esempio i macrofagi. Il tumore utilizza tecniche simili per ingannare altre cellule dell'immunità innata e acquisita.
Macrofagi: “cellule guerriere” e “cellule curative”
I macrofagi sono forse le cellule più famose del sistema immunitario innato: fu con lo studio delle loro capacità di fagocitosi che Metchnikoff iniziò l'immunologia cellulare classica. Nel corpo dei mammiferi, i macrofagi sono l'avanguardia del combattimento: essendo i primi a rilevare il nemico, non solo cercano di distruggerlo da soli, ma attirano anche altre cellule del sistema immunitario sul campo di battaglia, attivandole. E dopo la distruzione degli agenti estranei, iniziano a partecipare attivamente all'eliminazione del danno causato, sviluppando fattori che promuovono la guarigione delle ferite. I tumori sfruttano questa duplice natura dei macrofagi a proprio vantaggio.
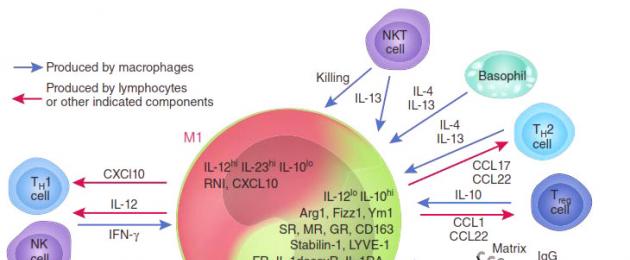
A seconda dell'attività predominante si distinguono due gruppi di macrofagi: M1 e M2. I macrofagi M1 (sono anche chiamati macrofagi attivati classicamente) - "guerrieri" - sono responsabili della distruzione di agenti estranei (comprese le cellule tumorali), sia direttamente che attirando e attivando altre cellule del sistema immunitario (ad esempio, T-killer cellule). I macrofagi M2 - "guaritori" - accelerano la rigenerazione dei tessuti e assicurano la guarigione delle ferite.
La presenza di un gran numero di macrofagi M1 nel tumore ne inibisce la crescita e in alcuni casi può addirittura causare una remissione quasi completa (distruzione). E viceversa: i macrofagi M2 secernono molecole - fattori di crescita, che stimolano inoltre la divisione delle cellule tumorali, cioè favoriscono lo sviluppo di tumori maligni. È stato dimostrato sperimentalmente che le cellule M2 (“guaritrici”) di solito predominano nell’ambiente del tumore. Ancora peggio: sotto l'influenza di sostanze secrete dalle cellule tumorali, i macrofagi M1 attivi vengono “riprogrammati” nel tipo M2, smettono di sintetizzare citochine antitumorali come l'interleuchina-12 (IL12) o il fattore di necrosi tumorale (TNF) e iniziano a rilasciare molecole nelle cellule tumorali. l'ambiente, accelerando la crescita del tumore e la germinazione dei vasi sanguigni che ne forniranno il nutrimento, ad esempio il fattore di crescita tumorale (TGFb) e il fattore di crescita vascolare (VGF). Smettono di attrarre e avviare altre cellule del sistema immunitario e iniziano a bloccare la risposta immunitaria locale (antitumorale) (Fig. 2).

Figura 2. Macrofagi M1 e M2: la loro interazione con il tumore e altre cellule del sistema immunitario.
Le proteine della famiglia NF-kB svolgono un ruolo chiave in questa riprogrammazione. Queste proteine sono fattori di trascrizione che controllano l'attività di più geni necessari per l'attivazione M1 dei macrofagi. I membri più importanti di questa famiglia sono p65 e p50, che insieme formano l'eterodimero p65/p50, che nei macrofagi attiva molti geni associati alla risposta infiammatoria acuta, come il TNF, molte interleuchine, chemochine e citochine. L’espressione di questi geni attira sempre più cellule immunitarie, “evidenziando” per loro l’area di infiammazione. Allo stesso tempo, un altro omodimero della famiglia NF-kB - p50/p50 - ha l'attività opposta: legandosi agli stessi promotori, ne blocca l'espressione, riducendo il grado di infiammazione.
Entrambe le attività dei fattori di trascrizione NF-kB sono molto importanti, ma l'equilibrio tra loro è ancora più importante. È stato dimostrato che i tumori rilasciano specificamente sostanze che interrompono la sintesi della proteina p65 nei macrofagi e stimolano l’accumulo del complesso inibitorio p50/p50. In questo modo (oltre a molti altri), il tumore trasforma i macrofagi M1 aggressivi in complici inconsapevoli del proprio sviluppo: i macrofagi di tipo M2, percependo il tumore come un'area danneggiata del tessuto, accendono il programma di ripristino, ma i fattori di crescita che secernono aggiungono solo risorse per la crescita del tumore. Questo completa il ciclo: il tumore in crescita attira nuovi macrofagi, che vengono riprogrammati e ne stimolano la crescita invece della distruzione.
La riattivazione della risposta immunitaria è una direzione attuale nella terapia antitumorale
Pertanto, nell'ambiente immediato dei tumori si trova una complessa miscela di molecole, che attivano e inibiscono la risposta immunitaria. Le prospettive di sviluppo di un tumore (e quindi le prospettive di sopravvivenza dell'organismo) dipendono dall'equilibrio degli ingredienti di questo “cocktail”. Se prevalgono gli immunoattivatori, significa che il tumore non ha affrontato il compito e verrà distrutto o la sua crescita sarà fortemente inibita. Se predominano le molecole immunosoppressive, significa che il tumore è riuscito a captare la chiave e inizierà a progredire rapidamente. Comprendendo i meccanismi che consentono ai tumori di sopprimere il nostro sistema immunitario, possiamo sviluppare contromisure e spostare l’equilibrio verso l’eliminazione dei tumori.
Gli esperimenti dimostrano che la “riprogrammazione” dei macrofagi (e di altre cellule del sistema immunitario) è reversibile. Pertanto, uno dei settori promettenti dell’oncoimmunologia oggi è l’idea di “riattivare” le cellule del sistema immunitario del paziente per aumentare l’efficacia di altri metodi di trattamento. Per alcuni tipi di tumori (ad esempio i melanomi) ciò consente di ottenere risultati impressionanti. Un altro esempio scoperto dal gruppo di Medzhitov è il comune lattato, una molecola che viene prodotta quando c'è carenza di ossigeno nei tumori a crescita rapida a causa dell'effetto Warburg. Questa semplice molecola stimola la riprogrammazione dei macrofagi, inducendoli a sostenere la crescita del tumore. Il lattato viene trasportato nei macrofagi attraverso canali di membrana e la potenziale terapia consiste nel bloccare questi canali.
Buon pomeriggio, cari lettori!
L'ultima volta vi ho parlato di un gruppo molto importante di cellule del sangue, che sono i veri combattenti in prima linea nella difesa immunitaria. Ma non sono gli unici partecipanti alle operazioni per catturare e distruggere gli “agenti nemici” nel nostro corpo. Hanno assistenti. E oggi voglio continuare la mia storia e studiare funzioni
leucociti - agranulociti.
Questo gruppo comprende anche i linfociti, il cui citoplasma manca di granularità.
Monocitiè il più grande rappresentante dei leucociti. Il diametro della sua cellula è di 10 – 15 micron, il citoplasma è pieno di un grande nucleo a forma di fagiolo. Ce ne sono pochi nel sangue, solo il 2-6%. Ma nel midollo osseo si formano in grandi quantità e maturano nelle stesse microcolonie dei neutrofili. Ma quando entrano nel sangue, le loro strade divergono. I neutrofili viaggiano attraverso i vasi sanguigni e sono sempre pronti N. 1. E i monociti si diffondono rapidamente in tutti gli organi e lì si trasformano in macrofagi. La metà di essi va al fegato e il resto viene distribuito alla milza, all'intestino, ai polmoni, ecc.

Macrofagi– questi sono sedentari, finalmente maturati. Come i neutrofili, sono capaci di fagocitosi, ma hanno inoltre una propria sfera di influenza e altri compiti specifici. Al microscopio, un macrofago è una cellula molto visibile con dimensioni impressionanti fino a 40 - 50 micron di diametro. Si tratta di una vera e propria fabbrica mobile per la sintesi di proteine speciali per i propri bisogni e per quelli delle cellule vicine. Si scopre che un macrofago può sintetizzarne e secernerne fino a 80 al giorno! vari composti chimici. Potresti chiederti: quali sostanze attive secernono i macrofagi? Dipende da dove vivono i macrofagi e dalle funzioni che svolgono.
Funzioni dei leucociti:
Cominciamo con il midollo osseo. Esistono due tipi di macrofagi coinvolti nel processo di rinnovamento del tessuto osseo: gli osteoclasti e gli osteoblasti. Gli osteoclasti circolano costantemente attraverso il tessuto osseo, trovando vecchie cellule e distruggendole, lasciando spazio libero per il futuro midollo osseo, e gli osteoblasti formano nuovo tessuto. I macrofagi svolgono questo lavoro sintetizzando e secernendo speciali proteine, enzimi e ormoni stimolanti. Ad esempio, per distruggere le ossa sintetizzano la collagenasi e la fosfatasi e per far crescere i globuli rossi - l'eritropoietina.
Esistono anche cellule “infermiera” e cellule “infermiera” che garantiscono una rapida riproduzione e la normale maturazione delle cellule del sangue nel midollo osseo. L'ematopoiesi nelle ossa si verifica nelle isole: nel mezzo di una tale colonia c'è un macrofago e intorno si affollano globuli rossi di diverse età. Eseguendo la funzione di una madre che allatta, il macrofago fornisce nutrimento alle cellule in crescita: aminoacidi, carboidrati, acidi grassi.
Svolgono un ruolo speciale nel fegato. Lì vengono chiamate cellule di Kupffer. Lavorando attivamente nel fegato, i macrofagi assorbono varie sostanze e particelle nocive provenienti dall'intestino. Insieme alle cellule del fegato partecipano alla lavorazione degli acidi grassi, del colesterolo e dei lipidi. Pertanto, risultano inaspettatamente coinvolti nella formazione di placche di colesterolo sulle pareti dei vasi sanguigni e nella comparsa di aterosclerosi.

Non è ancora del tutto chiaro dove abbia inizio il processo aterosclerotico. Forse qui viene innescata una reazione errata alle "loro" lipoproteine nel sangue e i macrofagi, come cellule immunitarie vigili, iniziano a catturarle. Si scopre che la golosità dei macrofagi ha lati sia positivi che negativi. Catturare e distruggere i microbi è, ovviamente, una buona cosa. Ma un eccessivo assorbimento di sostanze grasse da parte dei macrofagi è dannoso e probabilmente porta a una patologia pericolosa per la salute e la vita umana.
Ma è difficile per i macrofagi separare ciò che è buono e ciò che è cattivo, quindi il nostro compito è alleviare il destino dei macrofagi e prenderci cura della nostra salute e di quella del fegato: monitorare la nutrizione, ridurre il consumo di alimenti contenenti grandi quantità di grassi e colesterolo e rimuovere le tossine due volte l'anno.
Ora parliamo di macrofagi, lavorare nei polmoni.

L'aria inalata e il sangue nei vasi polmonari sono separati da un bordo sottile. Capisci quanto sia importante garantire la sterilità delle vie aeree in queste condizioni! Esatto, qui questa funzione è svolta anche dai macrofagi che vagano nel tessuto connettivo dei polmoni.
Sono sempre pieni dei resti di cellule polmonari morte e di microbi inalati dall'aria circostante. I macrofagi dei polmoni si moltiplicano immediatamente nell'area della loro attività e il loro numero aumenta notevolmente nelle malattie croniche delle vie respiratorie.
Attenzione fumatori! Le particelle di polvere e le sostanze catramose del fumo di tabacco irritano notevolmente le prime vie respiratorie
percorsi, danneggiano le cellule mucose dei bronchi e degli alveoli. I macrofagi polmonari, ovviamente, catturano e neutralizzano queste sostanze chimiche dannose. Nei fumatori, l'attività, il numero e persino la dimensione dei macrofagi aumentano notevolmente. Ma dopo 15-20 anni il limite della loro affidabilità è esaurito. Le delicate barriere cellulari che separano aria e sangue vengono rotte, l'infezione penetra nelle profondità del tessuto polmonare e inizia l'infiammazione. I macrofagi non sono più in grado di funzionare completamente come filtri microbici e lasciano il posto ai granulociti. Pertanto, il fumo a lungo termine porta alla bronchite cronica e alla diminuzione della superficie respiratoria dei polmoni. I macrofagi eccessivamente attivi corrodono le fibre elastiche del tessuto polmonare, causando difficoltà di respirazione e ipossia.
La cosa più triste è che quando sono usurati, i macrofagi cessano di svolgere funzioni molto importanti: la capacità di combattere le cellule maligne. Pertanto, l’epatite cronica è irta dello sviluppo di tumori al fegato e la polmonite cronica – del cancro ai polmoni.
Macrofagi milza.
Nella milza, i macrofagi svolgono la funzione di “assassini”, distruggendo i globuli rossi che invecchiano. Sulle membrane dei globuli rossi sono esposte proteine infide, che sono un segnale per l'eliminazione. A proposito, la distruzione dei vecchi globuli rossi avviene sia nel fegato che nel midollo osseo stesso, ovunque ci siano macrofagi. Nella milza questo processo è più evidente.
Pertanto, i macrofagi sono grandi lavoratori e i più importanti addetti al nostro corpo, svolgendo contemporaneamente diversi ruoli chiave:
- partecipazione alla fagocitosi,
- conservazione ed elaborazione di nutrienti importanti per i bisogni dell'organismo,
- rilascio di diverse dozzine di proteine e altre sostanze biologicamente attive che regolano la crescita delle cellule del sangue e di altri tessuti.
Bene, lo sappiamo funzioni dei leucociti - monociti e macrofagi.
E ancora una volta non c'era più tempo per i linfociti. Di loro, i più piccoli difensori del nostro corpo, parleremo la prossima volta.
Nel frattempo, diventiamo più sani e rafforziamo il nostro sistema immunitario ascoltando la musica curativa di Mozart - Sinfonia del cuore:
Ti auguro buona salute e prosperità!
Autori
Sarbaeva N.N., Ponomareva Yu.V., Milyakova M.N.
Secondo il paradigma “M1/M2”, esistono due sottotipi di macrofagi attivati: classicamente attivati (M1) e alternativamente attivati (M2), che esprimono vari recettori, citochine, chemochine, fattori di crescita e molecole effettrici. Tuttavia, dati recenti indicano che, in risposta ai cambiamenti nei segnali microambientali, i macrofagi possono esibire proprietà uniche che non consentono loro di essere classificati in nessuno di questi sottotipi.
I macrofagi svolgono un ruolo importante nella risposta del corpo al materiale impiantato: cateteri, stent, endoprotesi, impianti dentali. I macrofagi fagocitano le particelle di usura dalla superficie delle protesi articolari, avviano l’infiammazione nell’area protesica e l’osteolisi e controllano la formazione di una capsula fibrosa attorno ai corpi estranei. Viene presentata una breve panoramica dei fattori che causano la migrazione, l'adesione e l'attivazione dei macrofagi, l'analisi delle loro caratteristiche funzionali su varie superfici, inclusi materiali biodegradabili e non degradabili in vivo e in vitro.
introduzione
La medicina moderna è attualmente impossibile da immaginare senza l'uso di prodotti impiantabili installati nel corpo per vari periodi di tempo al fine di ripristinare l'anatomia e la funzione di organi e tessuti persi o colpiti da un processo patologico. La biocompatibilità dei materiali sintetici o dei costrutti di ingegneria tissutale è una questione importante che influenza i risultati di tali impianti. La reazione al materiale protesico si sviluppa nella seguente sequenza: alterazione dei tessuti, infiltrazione di cellule di infiammazione acuta, poi cronica con formazione di tessuto di granulazione e capsula fibrosa. La gravità di queste reazioni determina la biocompatibilità del dispositivo impiantato. I macrofagi svolgono un ruolo importante nella reazione del corpo al materiale installato: cateteri, stent, endoprotesi, impianti dentali, ecc.
Morfologia dei macrofagi
I macrofagi sono una popolazione cellulare eterogenea. Il macrofago ha una forma irregolare, stellata, multiprocessata, pieghe e microvilli sulla superficie cellulare, un'abbondanza di microvescicole endocitiche, lisosomi primari e secondari. Il nucleo rotondo o ellissoidale è situato centralmente, l'eterocromatina è localizzata sotto l'involucro nucleare. Le caratteristiche strutturali di una cellula dipendono in gran parte dall'appartenenza all'organo e al tessuto, nonché dal suo stato funzionale. Pertanto, le cellule di Kupffer sono caratterizzate da un glicocalice, i macrofagi alveolari contengono corpi lamellari (tensioattivi), un complesso di Golgi ben sviluppato, un reticolo endoplasmatico ruvido e molti mitocondri, mentre nelle cellule microgliali ci sono pochi mitocondri. Nel citoplasma dei macrofagi peritoneali e alveolari è presente un gran numero di corpi lipidici contenenti substrati ed enzimi per la generazione di prostaglandine. I macrofagi aderenti e in movimento formano strutture di breve durata contenenti actina - podosomi - sotto forma di una densa parte centrale da cui si irradiano microfilamenti. I podosomi possono fondersi per formare strutture di ordine superiore chiamate rosette, che distruggono efficacemente le proteine della matrice extracellulare sottostante.
Funzioni dei macrofagi
I macrofagi fagocitano materiale estraneo e detriti di tessuto cellulare, stimolano e regolano la risposta immunitaria, inducono una risposta infiammatoria e partecipano ai processi riparativi e allo scambio di componenti della matrice extracellulare. La varietà delle funzioni svolte spiega l'espressione da parte di queste cellule di un gran numero di recettori associati alla membrana plasmatica, intracellulari e secreti. I recettori del sistema immunitario innato PRR (recettori di riconoscimento del pattern) sono attivati da un'ampia gamma di ligandi (ad eccezione del CD163), fornendo il riconoscimento di strutture altamente conservate della maggior parte dei microrganismi, i cosiddetti PAMP (pattern molecolari associati ai patogeni, pattern molecolari associati ai patogeni). modelli associati) e simili con loro strutture molecolari endogene DAMP (modelli molecolari associati al danno), formati a seguito di danno e morte cellulare, modifica e denaturazione delle strutture proteiche della matrice extracellulare. La maggior parte di essi media l'endocitosi e l'eliminazione di agenti endogeni ed esogeni potenzialmente pericolosi, ma allo stesso tempo molti di essi svolgono funzioni di segnalazione, regolando la sintesi di mediatori proinfiammatori, promuovendo l'adesione e la migrazione dei macrofagi (tabella).
La membrana plasmatica dei monociti/macrofagi esprime anche recettori specializzati che legano uno o più ligandi strutturalmente simili: il frammento Fc dell'immunoglobulina G, fattori di crescita, corticosteroidi, chemochine e citochine, anafilotossine e molecole costimolatorie. Le funzioni di molti di questi recettori sono mediate non solo dal legame dei ligandi, ma anche dall'interazione con altri recettori (C5aR-TLR, MARCO-TLR, FcγR-TLR), che fornisce una regolazione fine della sintesi di pro- e anti -mediatori dell'infiammazione. Una caratteristica del sistema recettoriale dei macrofagi è la presenza di recettori trappola per citochine e chemochine proinfiammatorie (Il-1R2 sui macrofagi M2a; CCR2 e CCR5 sui macrofagi M2c), la cui attivazione blocca la trasmissione intracellulare del corrispondente segnale proinfiammatorio. L'espressione dei recettori cellulari è specie, organo e tessuto-specifica e dipende dallo stato funzionale dei macrofagi. I recettori cellulari dei macrofagi studiati in dettaglio sono mostrati nella tabella.
Migrazione di monociti/macrofagi
I macrofagi tissutali derivano principalmente dai monociti del sangue, che migrano nei tessuti e si differenziano in popolazioni diverse. La migrazione dei macrofagi è diretta dalle chemochine: CCL2 CCL3, CCL4, CCL5, CCL7, CCL8, CCL13, CCL15, CCL19, CXCL10, CXCL12; fattori di crescita VEGF, PDGF, TGF-b; frammenti del sistema del complemento; istamina; proteine granulari dei leucociti polimorfonucleati (PMNL); Fosfolipidi e loro derivati.
Nelle fasi iniziali della risposta infiammatoria, i PMN organizzano e modificano una rete di chemochine secernendo CCL3, CCL4 e CCL19 e rilasciando azurosidina, proteina LL37, catepsina G, defensine (HNP 1-3) e proteinasi 3 preformate in granuli, che assicurano l'adesione dei monociti all'endotelio, esibendo così le proprietà dei chemiotattici. Inoltre, le proteine granulari PMN inducono la secrezione di chemochine da parte di altre cellule: l'azurosidina stimola la produzione di CCL3 da parte dei macrofagi e la proteinasi-3 e HNP-1 inducono la sintesi di CCL2 da parte dell'endotelio. Le proteinasi PMN sono in grado di attivare molte chemochine proteiche e i loro recettori. Pertanto, la proteolisi di CCL15 da parte della catepsina G migliora notevolmente le sue proprietà attrattive. I neutrofili apoptotici attraggono i monociti attraverso segnali presumibilmente mediati dalla lisofosfatidilcolina.
Qualsiasi danno tissutale porta all'accumulo di macrofagi. Nell'area del danno vascolare, il coagulo di sangue e le piastrine rilasciano TGF-β, PDGF, CXCL4, leucotriene B4 e IL-1, che hanno proprietà chemioattraenti pronunciate contro monociti/macrofagi. I tessuti danneggiati sono una fonte delle cosiddette allarmine, che includono componenti della matrice extracellulare distrutta, proteine da shock termico, anfoterina, ATP, acido urico, IL-1a, IL-33, DNA mitocondriale di detriti cellulari, ecc. Stimolano il cellule vitali rimanenti dei tessuti danneggiati e dell'endotelio dei vasi sanguigni alla sintesi di chemochine, alcune delle quali sono fattori diretti della chemiotassi. L'infezione dei tessuti porta alla comparsa delle cosiddette molecole associate ai patogeni: lipopolisaccaridi, carboidrati della parete cellulare e acidi nucleici batterici. Il loro legame con i recettori di membrana e intracellulari dei macrofagi innesca il processo di espressione dei geni delle chemochine, che forniscono un ulteriore reclutamento di fagociti.
Attivazione dei macrofagi
I macrofagi vengono attivati da una varietà di molecole di segnalazione, causandone la differenziazione in vari tipi funzionali (Fig. 1). I macrofagi classicamente attivati (fenotipo M1) sono stimolati dall'IFNg, così come dall'IFNg insieme a LPS e TNF. Le loro funzioni principali sono la distruzione dei microrganismi patogeni e l'induzione di una risposta infiammatoria. La polarizzazione nella direzione M1 è accompagnata dalla secrezione di mediatori proinfiammatori. Esprimono recettori per IL-1 – IL-1R1, TLR e molecole costimolatrici, la cui attivazione garantisce l'amplificazione della risposta infiammatoria. Insieme alle citochine proinfiammatorie, i macrofagi secernono anche la citochina antinfiammatoria IL-10, con un rapporto IL-12/IL-10 tipicamente elevato. Le proprietà battericide dei macrofagi M1 sono determinate dalla produzione di radicali liberi di azoto e ossigeno generati da iNOS e dal complesso NADPH ossidasi. Essendo cellule effettrici nella risposta dell'organismo alle infezioni batteriche, allo stesso tempo sopprimono la risposta immunitaria adattativa inibendo la proliferazione delle cellule T stimolate. IL-12 secreto dai macrofagi M1 svolge un ruolo chiave nella polarizzazione Th1 e IL-1b e IL-23 dirigono la risposta immunitaria lungo la via Th17. . Studi recenti hanno dimostrato che i macrofagi M1, oltre alle proprietà proinfiammatorie, presentano proprietà riparative: secernono VEGF, che stimola l'angiogenesi e la formazione di tessuto di granulazione.

L'attivazione alternativa dei macrofagi (fenotipo M2) si osserva quando vengono stimolati da interleuchine, glucocorticoidi, complessi immunitari, agonisti TLR, ecc. Migrano verso zone di invasione elmintica, si accumulano nei loci di fibrosi, nella guarigione di ferite cutanee e formazioni neoplastiche. I macrofagi M2 sono capaci di proliferazione attiva in situ. Presentano una maggiore capacità di fagocitosi rispetto ai macrofagi M1 ed esprimono un maggior numero di recettori associati: CD36 – recettore scavenger delle cellule apoptotiche; CD206 – recettore del mannosio; CD301 – recettore per i residui di galattosio e N-acetilglucosamina; CD163 è un recettore per il complesso emoglobina-aptoglobina. I macrofagi di questo tipo sono caratterizzati da un basso rapporto IL-12/IL-10.
I macrofagi attivati in alternativa sono suddivisi in sottotipi: M2a, M2b e M2c. Un esempio del fenotipo M2a dei macrofagi sono le cellule che si accumulano attorno alle larve di elminti e protozoi, i cui allergeni inducono una risposta immunitaria Th2, accompagnata dalla produzione di IL-4 e IL-13. Non secernono quantità significative di citochine proinfiammatorie e sintetizzano uno spettro speciale di chemochine e recettori di membrana. Si ritiene che siano caratterizzati dalla sintesi di IL-10, tuttavia, in vitro, i macrofagi non sempre producono questa citochina e possono mostrare un'elevata attività trascrizionale dei geni IL-12 e IL-6. Una caratteristica importante di questa popolazione è la sintesi dell'antagonista del recettore dell'IL-1 (IL-1ra), che, legandosi all'IL-1, ne blocca gli effetti proinfiammatori.
I macrofagi M2a sopprimono la risposta infiammatoria bloccando la formazione della popolazione M1 attraverso le citochine dei linfociti Th2 da loro reclutati, o a causa della chemochina prodotta CCL17, che, insieme a IL-10, inibisce la differenziazione dei macrofagi in direzione M1 . Le cellule del fenotipo M2a sono considerate tipici macrofagi riparativi. La chemochina CCL2 da loro sintetizzata è un chemiotattico dei precursori dei miofibroblasti - fibrociti; secernono fattori che assicurano il rimodellamento del tessuto connettivo.
La polarizzazione nella direzione M2b è ottenuta mediante stimolazione del recettore Fcg insieme agli agonisti TLR e ai ligandi del recettore IL-1. Funzionalmente, sono vicini ai macrofagi M1, producendo mediatori proinfiammatori e monossido di azoto (NO), ma allo stesso tempo sono caratterizzati da un alto livello di sintesi di IL-10 e da una ridotta produzione di IL-12. I macrofagi M2b aumentano la produzione di anticorpi. La chemochina CCL1 da loro sintetizzata promuove la polarizzazione dei linfociti nella direzione Th2. I macrofagi M2c hanno proprietà soppressive: inibiscono l'attivazione e la proliferazione dei linfociti CD4+ causata dalla stimolazione antigenica e promuovono l'eliminazione delle cellule T attivate. In vitro, il sottotipo M2c si ottiene stimolando i fagociti mononucleati con glucocorticoidi, IL-10, TGF-β, prostaglandina E2, ecc. Non hanno attività battericida, producono una piccola quantità di citochine, secernono fattori di crescita e alcune chemochine. I macrofagi M2c esprimono recettori per la fagocitosi e molte chemochine proinfiammatorie, che presumibilmente non servono ad eccitare i segnali corrispondenti, ma sono trappole per i mediatori proinfiammatori, bloccandone le funzioni.
La natura dell'attivazione dei macrofagi non è strettamente determinata e stabile. La possibilità di trasformazione del fenotipo M1 in M2 è stata dimostrata con un cambiamento nello spettro delle citochine stimolanti e dovuta all'efferocitosi. Dopo aver fagocitato le cellule apoptotiche, i macrofagi riducono drasticamente la sintesi e la secrezione dei mediatori infiammatori CCL2, CCL3, CXCL1, CXCL 2, TNF-a, MG-CSF, IL-1b, IL-8 e aumentano notevolmente la produzione di TGF-b. Durante lo sviluppo dell'obesità è prevista la trasformazione inversa del fenotipo M2 in M1.
Molti autori mettono in dubbio l'esistenza nell'organismo di due popolazioni chiaramente distinguibili di macrofagi M1 e M2. Una combinazione di segni di attivazione classica e alternativa è caratteristica dei macrofagi delle ferite della pelle umana. Pertanto, insieme alle citochine TNF-a e IL-12 tipiche dei macrofagi M1, dimostrano la sintesi dei marcatori dei macrofagi M2: IL-10, CD206, CD163, CD36 e recettori per IL-4. Un tipo di macrofagi diversi da M1/M2 con attività fibrinolitica pronunciata è stato trovato nel fegato di topi in un modello di fibrosi reversibile e nel tessuto epatico umano con cirrosi. Esprimono i geni dell'arginasi 1, dei recettori del mannosio e dell'IGF, secernono MMP-9, MMP-12, mostrano una pronunciata capacità di proliferazione e fagocitosi, ma non sintetizzano IL-10, IL-1ra, TGF-b. Una popolazione speciale di macrofagi si forma nella milza del topo durante l'infezione da micobatteri. Inibiscono la proliferazione dei linfociti T e la loro secrezione di citochine sia Th1 che Th2, stimolando la polarizzazione in Th17. direzione. I macrofagi soppressivi hanno un fenotipo unico: esprimono geni attivi nei macrofagi M1 - IL-12, IL-1b, IL-6, TNF-a, iNOS e allo stesso tempo i geni CD163, IL-10, recettori del mannosio e altri marcatori di Macrofagi M2.
Questi studi mostrano chiaramente che le popolazioni di macrofagi formatesi in condizioni naturali differiscono significativamente dalle popolazioni M1 e M2 ottenute in vitro. Percependo una varietà di segnali di attivazione, il macrofago risponde “su richiesta”, secernendo adeguatamente i mediatori ai cambiamenti nell'ambiente, quindi, in ogni caso specifico, si forma il proprio fenotipo, a volte, forse anche unico.
Risposta dei macrofagi al materiale estraneo
Il contatto dei macrofagi con materiale estraneo, sia sotto forma di piccole particelle che sotto forma di superfici estese, porta alla loro attivazione. Uno dei gravi problemi in traumatologia e ortopedia associati alla reazione a un corpo estraneo è lo sviluppo dell'instabilità articolare dopo l'endoprotesi, che, secondo alcuni dati, viene rilevata nel 25-60% dei pazienti nei primi anni dopo l'operazione e non tende a diminuire.
La superficie delle protesi ortopediche si usura con la formazione di particelle che si infiltrano nei tessuti molli. Le proprietà chimiche del materiale determinano la possibilità di opsonizzazione delle particelle da parte delle proteine del plasma sanguigno e il tipo di recettori superficiali che avviano la fagocitosi. Pertanto, il polietilene, che attiva il complemento, subisce opsonizzazione e viene “riconosciuto” dal recettore del complemento CR3, mentre le particelle di titanio vengono assorbite dalla cellula attraverso il recettore MARCO, opsonina-indipendente. La fagocitosi di particelle metalliche, polimeri sintetici, ceramiche e idrossiapatite da parte dei macrofagi innesca la sintesi di mediatori proinfiammatori e dell'induttore dell'osteoclastogenesi RANKL. CCL3 secreto dai macrofagi provoca la migrazione degli osteoclasti e IL-1b, TNF-a, CCL5 e PGE2 ne stimolano la differenziazione e l'attivazione. Gli osteoclasti riassorbono l'osso nell'area protesica, ma la formazione di nuovo osso viene soppressa, poiché il materiale corpuscolare inibisce la sintesi del collagene, inibisce la proliferazione e la differenziazione degli osteoblasti e ne induce l'apoptosi. La risposta infiammatoria causata dalle particelle da usura è considerata la causa principale dell’osteolisi.
Il contatto dei tessuti con materiale che non può essere fagocitato avvia una cascata di eventi nota come risposta al corpo estraneo o reazione tissutale. Consiste nell'adsorbimento delle proteine plasmatiche, nello sviluppo di una risposta infiammatoria, inizialmente acuta, successivamente cronica, nella proliferazione di miofibroblasti e fibroblasti e nella formazione di una capsula fibrosa che delimita il corpo estraneo dai tessuti circostanti. Le principali cellule dell'infiammazione persistente all'interfaccia materiale/tessuto sono i macrofagi; la sua gravità determina il grado di fibrosi nella zona di contatto. L'interesse per lo studio delle reazioni tissutali è associato principalmente all'uso diffuso di materiali sintetici in vari campi della medicina.
L'adsorbimento delle proteine del plasma sanguigno è il primo stadio dell'interazione dei materiali impiantati con i tessuti corporei. La composizione chimica, l'energia libera, la polarità dei gruppi funzionali superficiali e il grado di idrofilicità superficiale determinano la quantità, la composizione e i cambiamenti conformazionali nelle proteine legate, che costituiscono la matrice per la successiva adesione cellulare, compresi i macrofagi. I più significativi a questo riguardo sono il fibrinogeno, le IgG, le proteine del sistema del complemento, la vitronectina, la fibronectina e l'albumina.
Uno strato di fibrinogeno si forma rapidamente su quasi tutti i materiali estranei. Sulle superfici idrofobiche, il fibrinogeno forma un monostrato di proteine strettamente legate, parzialmente denaturate, i cui epitopi sono aperti all’interazione con i recettori cellulari. Sui materiali idrofili, il fibrinogeno si deposita più spesso sotto forma di un rivestimento multistrato sciolto e gli strati esterni sono denaturati debolmente o praticamente non denaturati, lasciando i siti di legame inaccessibili ai recettori cellulari dei macrofagi e delle piastrine.
Molti polimeri sintetici hanno la capacità di assorbire componenti del sistema del complemento e di attivarlo con la formazione del complesso C3-convertasi. I frammenti C3a e C5a da esso generati sono chemioattraenti e attivatori dei fagociti, iC3b funge da ligando per il recettore di adesione cellulare. La cascata di attivazione può essere avviata sia attraverso vie classiche (mediate da molecole JgG adsorbite) che attraverso vie alternative. Quest'ultimo viene avviato dal legame del componente C3 a superfici recanti gruppi funzionali, ad esempio – OH-, provocandone l'idrolisi. La via alternativa può essere attivata anche dopo la via classica o insieme ad essa per opera della C3 convertasi della via classica, che genera frammenti di C3b, il fattore scatenante del ciclo di amplificazione, che si fissano sulle superfici. Tuttavia, l'assorbimento e anche l'inizio dell'idrolisi di C3 non portano sempre alla comparsa di un segnale di amplificazione. Ad esempio, C3 è fortemente assorbito dal polivinilpirrolidone, ma la sua proteolisi su questa superficie è debolmente espressa. Le superfici fluorurate, il silicone e il polistirene attivano debolmente il complemento. Per le reazioni cellulari su superfici estranee, non è importante solo l'attivazione del sistema del complemento, ma è importante anche il legame di altre proteine mediato dai suoi frammenti.
Il ruolo dell'albumina risiede nella sua capacità di legare le proteine del sistema del complemento. Non promuove l'adesione dei macrofagi e, a differenza del fibrinogeno, non induce la loro sintesi di TNF-a. La fibronectina e la vitronectina, proteine ricche di sequenze RGD (regioni di aminoacidi ARG-GLY-ASP), si trovano solitamente sui materiali impiantati.
Per quanto riguarda la vitronectina, non è noto se sia adsorbita direttamente sulla superficie del materiale o se faccia parte del complesso del complemento di attacco della membrana inattivato fissato su di essa. Il suo significato per lo sviluppo della reazione tissutale è che garantisce l'adesione più forte e duratura dei macrofagi. L'interazione dei macrofagi con il substrato è assicurata da recettori cellulari per le proteine integrine (avβ3, a5β1, CR3), ricchi di sequenze RGD (Tabella). Il blocco dell'adesione dei macrofagi con mimetici RGD solubili, o la rimozione del recettore CR3 dalla loro superficie, riduce l'intensità della reazione tissutale, riducendo lo spessore della capsula fibrosa in formazione.
I macrofagi attaccati si fondono per formare cellule multinucleate (cellule giganti da corpo estraneo - GCTC). Gli induttori di questo processo sono IFNg, IL-1, IL-2, IL-3, IL-4, IL-13 e GM-CSF, che stimolano l'espressione dei recettori del mannosio, che svolgono un ruolo importante nella fusione cellulare. GKIT funzionano come macrofagi: hanno la capacità di fagocitare, generare radicali di ossigeno e azoto, sintetizzare citochine e fattori di crescita. La natura dell'attività sintetica di queste cellule dipende apparentemente dalla loro "età": nelle prime fasi dello sviluppo della reazione tissutale si esprimono IL-1a, TNF-a, e successivamente si passa ad attività antinfiammatorie e antinfiammatorie. mediatori profibrogenici - IL-4, IL-10, IL-13, TGF-β.
La risposta dei macrofagi ai materiali estranei è stata studiata in varie condizioni in vitro e in vivo. Negli esperimenti in vitro vengono presi in considerazione l'intensità della loro adesione sulla superficie studiata e la formazione di HCIT, il numero di geni “accesi”, il numero di enzimi sintetizzati e secreti, citochine e chemochine. Nelle monocolture di fagociti mononucleari adesi a varie superfici, non si verifica la loro polarizzazione nelle direzioni M1 e M2, ma la formazione di macrofagi di tipo misto che secernono mediatori sia pro- che antinfiammatori con uno spostamento verso questi ultimi nel corso di processi a lungo termine. coltivazione. L'assenza di un "gold standard" - un materiale di controllo stabile che si è dimostrato valido quando impiantato in un organismo vivente, con il quale i materiali testati potrebbero essere confrontati, così come l'uso di linee cellulari di macrofagi non standardizzate, diversi metodi di loro differenziazione rendono difficile confrontare i risultati del lavoro di diversi autori. Tuttavia, gli studi in vitro consentono di giudicare la citotossicità dei materiali e di determinare la reazione dei macrofagi alla loro modificazione chimica. Informazioni preziose sono state ottenute studiando l'attivazione dei macrofagi sulla superficie di vari collageni, nativi e modificati chimicamente. I collageni nativi inducono in vitro la sintesi di molecole segnale da parte dei macrofagi, sia stimolando la risposta infiammatoria (TNF-a, IL-6, IL-8, IL-1β, IL-12, CCL2) sia sopprimendola (IL-1ra, IL -10), nonché metalloproteasi della matrice e loro inibitori. . Le proprietà proinfiammatorie di tali materiali dipendono dal metodo di decellularizzazione e sterilizzazione del materiale di partenza, che ne modifica significativamente le caratteristiche. Le endoprotesi di collagene ottenute utilizzando tecnologie diverse dal collagene nativo variano nella loro capacità di indurre l'espressione di citochine proinfiammatorie da praticamente inerti ad altamente attive. L'iniezione di collagene con varie sostanze chimiche modifica la natura della reazione dei macrofagi. Il trattamento con glutaraldeide porta a citotossicità, che si manifesta con danni alla membrana citoplasmatica, ridotta adesione e ridotta vitalità dei macrofagi. Allo stesso tempo, la loro produzione di IL-6 e TNF-a aumenta e la sintesi di IL-1ra viene soppressa rispetto ai macrofagi aderiti al collagene nativo e cucito con carbodiimmide. Il trattamento con carbodiimmide conferisce proprietà ottimali al collagene, che non è citotossico, non provoca un aumento significativo della secrezione di citochine proinfiammatorie e metalloproteasi e non sopprime la sintesi di IL-10 e IL-1ra rispetto al collagene nativo.
Per ridurre la reazione tissutale, nei materiali collagenici vengono introdotti componenti della matrice intercellulare, nativa o modificata. J. Kajahn et al. (2012) hanno creato un'imitazione in vitro del microambiente proinfiammatorio delle endoprotesi, che promuoveva la differenziazione dei monociti nella direzione M1. Nelle stesse condizioni, l’ulteriore acido ialuronico solfato introdotto nel substrato di collagene ha ridotto la secrezione di citochine proinfiammatorie da parte dei macrofagi e aumentato la produzione di IL-10. Secondo gli autori, ciò indica la polarizzazione M2 dei macrofagi, favorendo la rigenerazione e il ripristino delle proprietà funzionali dei tessuti circostanti. La risposta dei macrofagi ai materiali lentamente degradabili e stabili in vitro è generalmente uniforme e simile alla risposta ai biomateriali, sebbene sia ancora evidente una certa specificità della risposta. Titanio, poliuretano, polimetilmetacrilato, politetrafluoroetilene sono deboli induttori di mediatori infiammatori, sebbene il titanio promuova una maggiore secrezione di TNF-a e IL-10 rispetto al poliuretano, e la peculiarità del polipropilene è di stimolare la produzione della chemochina profibrogenica CCL18. Il PEG, proposto come substrato per il trasferimento cellulare, provoca un'espressione marcata ma in rapido aumento di IL-1β, TNF-a, IL-12, tuttavia, la sua copolimerizzazione con oligopeptide di adesione cellulare migliora la biocompatibilità del materiale, riducendo significativamente l'espressione di citochine proinfiammatorie.
La risposta dei macrofagi a vari materiali in vitro non caratterizza completamente il loro comportamento nel corpo. Nelle monocolture non ci sono fattori di interazione con altre popolazioni cellulari e il polimorfismo fenotipico non viene preso in considerazione: in condizioni naturali, non solo i precursori monocitici migrano verso l'impianto, ma anche i macrofagi tissutali maturi, la cui risposta può differire significativamente da quelli reclutati dal sangue. Lo studio dell'attività secretoria dei macrofagi circostanti le endoprotesi installate nei tessuti animali e umani è molto difficile. Il metodo principale per caratterizzare i macrofagi basati sul paradigma M1-M2 in situ erano i dati provenienti dall'immunocitochimica delle proteine marcatrici iNOS, CD206, CD163, CD80, CD86. Si ipotizza che la presenza di questi marcatori nei macrofagi in vivo determini la loro polarizzazione nelle direzioni M1 e M2 con la sintesi dei corrispondenti spettri di cito- e chemochine, ma, data la possibilità dell'esistenza di macrofagi di tipo misto, questa caratteristica non è del tutto corretto.
 Tuttavia, gli esperimenti in vivo consentono di tracciare il destino del materiale impiantato e la dinamica della risposta dei macrofagi su un lungo periodo, il che è particolarmente importante per le endoprotesi e i dispositivi per tutta la vita. I più studiati sotto questo aspetto sono i biomateriali degradabili a base di collagene. Le prime cellule infiammatorie a migrare verso tali materiali sono i PMN, ma questo effetto è transitorio e la popolazione della seconda ondata è rappresentata dai macrofagi. La loro reazione dipende dalle proprietà fisico-chimiche del collagene. Quanto più duro è il trattamento chimico, tanto più il collagene si differenzia da quello nativo, tanto più “estraneo” diventa per i macrofagi e tanto più marcata è la reazione tissutale. Frammenti di impianti realizzati con collagene cucito che si degrada lentamente e installati tra gli strati muscolari della parete addominale di un ratto promuovono la formazione di GCI e l'incapsulamento del materiale. I macrofagi migranti, a giudicare dall'espressione dei recettori CCR7 e CD206, possono essere attribuiti in alcuni casi al fenotipo M1, ma in molti casi non è possibile determinare la loro appartenenza ai fenotipi conosciuti.
Tuttavia, gli esperimenti in vivo consentono di tracciare il destino del materiale impiantato e la dinamica della risposta dei macrofagi su un lungo periodo, il che è particolarmente importante per le endoprotesi e i dispositivi per tutta la vita. I più studiati sotto questo aspetto sono i biomateriali degradabili a base di collagene. Le prime cellule infiammatorie a migrare verso tali materiali sono i PMN, ma questo effetto è transitorio e la popolazione della seconda ondata è rappresentata dai macrofagi. La loro reazione dipende dalle proprietà fisico-chimiche del collagene. Quanto più duro è il trattamento chimico, tanto più il collagene si differenzia da quello nativo, tanto più “estraneo” diventa per i macrofagi e tanto più marcata è la reazione tissutale. Frammenti di impianti realizzati con collagene cucito che si degrada lentamente e installati tra gli strati muscolari della parete addominale di un ratto promuovono la formazione di GCI e l'incapsulamento del materiale. I macrofagi migranti, a giudicare dall'espressione dei recettori CCR7 e CD206, possono essere attribuiti in alcuni casi al fenotipo M1, ma in molti casi non è possibile determinare la loro appartenenza ai fenotipi conosciuti.
Nel corso del tempo, intorno all'impianto compaiono macrofagi M2, che si trovano principalmente nella capsula fibrosa. Le endoprotesi realizzate con collagene di maiale non cucito, collagene umano e bovino e collagene di pecora cucito con diisocianato, che vengono rapidamente distrutti nel corpo del ratto, stimolano la nuova formazione di tessuto connettivo e muscolare a tutti gli effetti. Non contribuiscono alla formazione dell'HCIT e non sono incapsulati. Alcuni fagociti mononucleati che si accumulano all'interfaccia tessuto/materiale non hanno marcatori del fenotipo M1/M2, alcuni contengono entrambi i marcatori e alcuni sono macrofagi M2. La sottopopolazione M1 di macrofagi è assente su tali impianti. L'analisi istomorfometrica ha mostrato una correlazione positiva tra il numero di macrofagi portatori di marcatori del fenotipo M2 nelle prime fasi della reazione tissutale in via di sviluppo e gli indicatori di successo del rimodellamento tissutale nella zona di impianto.
La reazione tissutale ai materiali non degradabili esiste durante tutto il tempo della loro presenza nel corpo. La sua intensità è modulata dalle proprietà fisico-chimiche dei materiali: nella serie poliestere, politetrafluoroetilene, polipropilene - il primo polimero provoca l'infiammazione e la fusione dei macrofagi più pronunciate, l'ultimo - il minimo e la gravità della fibrosi per tutti questi materiali correla positivamente con la quantità di HCIT sulla superficie dei polimeri sintetici. Nonostante il gran numero di studi che hanno studiato la risposta infiammatoria ai vari materiali, le caratteristiche dei macrofagi che si accumulano su di essi non sono state sufficientemente studiate. M.T. Lupo et al. (2014) hanno dimostrato che prevalentemente macrofagi con marcatori del fenotipo M1 (CD86+CD206-) si accumulano sui fili e tra i nodi di una rete di polipropilene impiantata nella parete addominale di un ratto.
Un gel della matrice intercellulare del tessuto connettivo applicato al polipropilene riduce il numero dei macrofagi M1 e del GCT e allo stesso tempo inibisce la crescita dei microvasi. Questo fenomeno è in buon accordo con i risultati degli studi che dimostrano l’espressione dei fattori angiogenici M1 da parte dei macrofagi della ferita e la soppressione della vasculogenesi durante il loro blocco. Si sa poco sull'attività sintetica dei macrofagi e sullo spettro delle loro molecole biologicamente attive che forniscono reazioni tissutali. Nel topo, i macrofagi che secernono IL-6 e CCL2, IL-13 e TGF-β si accumulano alla periferia della zona di impianto della rete di nylon e, allo stesso tempo, IL-4 è espresso nella popolazione cellulare, incluso nel GCIT , aderivano alle fibre dell'endoprotesi , IL-10, IL-13 e TGF-β. IL-4 e IL-13 sono potenti mediatori profibrogenici; non solo polarizzano i macrofagi nella direzione M2a, promuovendo la produzione di fattori di crescita, ma anche, attraverso l’induzione dell’espressione di TGF-β da parte dei fibroblasti, stimolano la loro sintesi di collagene. IL-10 e CCL2 hanno anche un effetto profibrogenico, fornendo chemiotassi dei precursori dei miofibroblasti: i fibrociti. Si può presumere che siano i macrofagi a creare un ambiente favorevole allo sviluppo della fibrosi attorno ai materiali non degradabili.
La formazione di tessuto fibroso può avere effetti sia negativi che positivi sugli esiti dei pazienti. Nella pratica erniologica, uno dei problemi principali è la trasformazione del tessuto fibroso associata all'impianto di un'endoprotesi in polipropilene (Fig. 2, dati propri), che, sullo sfondo di tattiche chirurgiche irrazionali, nel 15-20% dei casi porta alla sviluppo di ernie ricorrenti di varie localizzazioni.
 Negli ultimi anni si sono sviluppate in modo particolarmente intenso le tecnologie di impianto dentale basate sull'integrazione delle strutture installate attraverso lo sviluppo del tessuto connettivo (Fig. 3, dati propri). Nonostante la fibrointegrazione degli impianti sia riconosciuta da numerosi specialisti come una valida opzione, continua la ricerca di nuovi materiali che favoriscano i processi di osteointegrazione.
Negli ultimi anni si sono sviluppate in modo particolarmente intenso le tecnologie di impianto dentale basate sull'integrazione delle strutture installate attraverso lo sviluppo del tessuto connettivo (Fig. 3, dati propri). Nonostante la fibrointegrazione degli impianti sia riconosciuta da numerosi specialisti come una valida opzione, continua la ricerca di nuovi materiali che favoriscano i processi di osteointegrazione.
A questo proposito, di notevole importanza sono lo studio delle popolazioni cellulari nell'area protesica, lo sviluppo di metodi e approcci per bloccare un'eccessiva reazione infiammatoria che porta alla fibrosi e stimolare la rigenerazione riparativa nel sito di impianto di vari materiali.
Conclusione
I macrofagi sono una popolazione polimorfica di cellule il cui fenotipo è determinato da segnali microambientali. Svolgono un ruolo decisivo nella risposta del corpo al materiale estraneo utilizzato per endoprotesi, cateterizzazione, stent e altri tipi di trattamento. La natura della reazione e la sua gravità dipendono sia dalle dimensioni del materiale impiantato che dalle sue proprietà fisico-chimiche e possono avere implicazioni sia positive che negative per il corpo del paziente. Per i materiali degradabili a base di collagene, è stata dimostrata la dipendenza del tipo di attivazione dei macrofagi e della velocità di rigenerazione del tessuto connettivo dal metodo di lavorazione delle materie prime di collagene. Ciò apre grandi opportunità per gli specialisti che sviluppano nuovi metodi per la decellularizzazione dei tessuti, la modifica chimica e la sterilizzazione dei materiali di collagene al fine di ottenere impianti per la medicina rigenerativa.
I problemi associati all'attivazione dei macrofagi da parte di materiali non degradabili, a quanto pare, dovrebbero essere risolti diversamente. I macrofagi che fagocitano indossano microparticelle sulla superficie delle endoprotesi articolari e i macrofagi che migrano verso le estese superfici degli impianti sintetici danno origine a un'infiammazione persistente a lungo termine, all'osteolisi nel primo caso e alla fibrosi nel secondo. La mitigazione di questo effetto sarà molto probabilmente ottenuta bloccando la migrazione direzionale, l’adesione e l’attivazione di monociti/macrofagi, il che richiederà una conoscenza di questi processi più approfondita di quella di cui disponiamo attualmente.
Il macrofago è multiforme e onnipresente
Centotrenta anni fa, il meraviglioso ricercatore russo I.I. Mechnikov, negli esperimenti sulle larve di stelle marine dello Stretto di Messina, fece una scoperta sorprendente che cambiò radicalmente non solo la vita del futuro premio Nobel, ma capovolse anche le idee allora sul sistema immunitario.
Inserendo una spina rosa nel corpo trasparente della larva, lo scienziato scoprì che la scheggia era circondata e attaccata da grandi cellule ameboidi. E se il corpo estraneo fosse piccolo, queste cellule erranti, che Mechnikov chiamava fagociti (dal greco divoratore), potevano assorbire completamente l'alieno.
Per molti anni si è creduto che i fagociti svolgessero la funzione di “truppe a reazione rapida” nel corpo. Tuttavia, la ricerca degli ultimi anni ha dimostrato che, grazie alla loro enorme plasticità funzionale, queste cellule “determinano anche il clima” di molti processi metabolici, immunologici e infiammatori, sia normali che patologici. Ciò rende i fagociti un bersaglio promettente nello sviluppo di strategie per il trattamento di una serie di gravi malattie umane.
A seconda del loro microambiente, i macrofagi tissutali possono svolgere varie funzioni specializzate. Ad esempio, i macrofagi del tessuto osseo - gli osteoclasti, rimuovono anche l'idrossiapatite di calcio dall'osso. Se questa funzione è insufficiente, si sviluppa la malattia del marmo: l'osso diventa eccessivamente compattato e allo stesso tempo fragile.
Ma forse la proprietà più sorprendente dei macrofagi si è rivelata la loro enorme plasticità, cioè la capacità di modificare il loro programma trascrizionale (“accendere” determinati geni) e il loro aspetto (fenotipo). La conseguenza di questa caratteristica è l'elevata eterogeneità della popolazione cellulare dei macrofagi, tra cui non esistono solo cellule “aggressive” che difendono l'organismo ospite; ma anche cellule con funzione “polare”, responsabili dei processi di ripristino “pacifico” dei tessuti danneggiati.
"Antenne" lipidiche
Il macrofago deve il suo potenziale “dai molti volti” all’insolita organizzazione del materiale genetico – la cosiddetta cromatina aperta. Questa variante non completamente studiata della struttura del genoma cellulare garantisce rapidi cambiamenti nel livello di espressione genica (attività) in risposta a vari stimoli.
Lo svolgimento di una particolare funzione da parte di un macrofago dipende dalla natura degli stimoli che riceve. Se lo stimolo viene riconosciuto come "estraneo", si verifica l'attivazione di quei geni (e, di conseguenza, delle funzioni) del macrofago che mirano a distruggere l'"alieno". Tuttavia, il macrofago può anche essere attivato segnalando molecole del corpo stesso, che inducono questa cellula immunitaria a partecipare all'organizzazione e alla regolazione del metabolismo. Pertanto, in condizioni di “tempo di pace”, cioè in assenza di un agente patogeno e del processo infiammatorio da esso causato, i macrofagi partecipano alla regolazione dell’espressione dei geni responsabili del metabolismo dei lipidi e del glucosio e alla differenziazione delle cellule del tessuto adiposo.
L'integrazione tra le direzioni "pacifiche" e "militari" reciprocamente esclusive del lavoro dei macrofagi viene effettuata modificando l'attività dei recettori nel nucleo cellulare, che sono un gruppo speciale di proteine regolatrici.
Tra questi recettori nucleari meritano una menzione speciale i cosiddetti sensori lipidici, ovvero proteine capaci di interagire con i lipidi (ad esempio acidi grassi ossidati o derivati del colesterolo) (Smirnov, 2009). L’interruzione di queste proteine regolatrici sensibili ai lipidi nei macrofagi può causare disturbi metabolici sistemici. Ad esempio, una carenza nei macrofagi di uno di questi recettori nucleari, denominato PPAR-gamma, porta allo sviluppo del diabete di tipo 2 e ad uno squilibrio del metabolismo dei lipidi e dei carboidrati in tutto il corpo.
Metamorfosi cellulari
Nell'eterogenea comunità dei macrofagi, in base alle caratteristiche di base che ne determinano le funzioni fondamentali, si distinguono tre principali sottopopolazioni cellulari: i macrofagi M1, M2 e Mox, che sono coinvolti, rispettivamente, nei processi di infiammazione, riparazione dei tessuti danneggiati e protezione dell’organismo dallo stress ossidativo.
Il macrofago M1 “classico” è formato da una cellula precursore (monocito) sotto l'influenza di una cascata di segnali intracellulari che vengono attivati dopo il riconoscimento di un agente infettivo mediante speciali recettori situati sulla superficie cellulare.
La formazione del "mangiatore" M1 avviene a seguito di una potente attivazione del genoma, accompagnata dall'attivazione della sintesi di oltre un centinaio di proteine, i cosiddetti fattori infiammatori. Questi includono enzimi che promuovono la generazione di radicali liberi dell'ossigeno; proteine che attirano altre cellule del sistema immunitario nel sito dell'infiammazione, nonché proteine che possono distruggere la membrana batterica; le citochine infiammatorie sono sostanze che hanno la proprietà di attivare le cellule immunitarie e di avere un effetto tossico sul resto dell'ambiente cellulare. La fagocitosi viene attivata nella cellula e il macrofago inizia a distruggere e digerire attivamente tutto ciò che incontra (Shvarts, Svistelnik, 2012). Ecco come appare un focus di infiammazione.
Tuttavia, già nelle fasi iniziali del processo infiammatorio, il macrofago M1 inizia a secernere attivamente sostanze antiinfiammatorie: molecole lipidiche a basso peso molecolare. Questi segnali di “secondo livello” iniziano ad attivare i suddetti sensori lipidici in nuovi monociti “reclute” che arrivano nel sito dell’infiammazione. All'interno della cellula viene innescata una catena di eventi, a seguito della quale un segnale di attivazione viene inviato ad alcune sezioni regolatrici del DNA, migliorando l'espressione dei geni responsabili dell'armonizzazione del metabolismo e allo stesso tempo sopprimendo l'attività “proinfiammatoria” (cioè, provocando infiammazione) geni (Dushkin, 2012).

Pertanto, come risultato dell'attivazione alternativa, si formano i macrofagi M2, che completano il processo infiammatorio e promuovono la riparazione dei tessuti. La popolazione di macrofagi M2 può, a sua volta, essere suddivisa in gruppi a seconda della loro specializzazione: spazzini di cellule morte; cellule coinvolte nella risposta immunitaria acquisita, nonché macrofagi, fattori che secernono che contribuiscono alla sostituzione del tessuto morto con tessuto connettivo.
Un altro gruppo di macrofagi, i Moss, si forma in condizioni di cosiddetto stress ossidativo, quando aumenta il pericolo di danni ai tessuti da parte dei radicali liberi. Ad esempio, i muschi costituiscono circa un terzo di tutti i macrofagi nella placca aterosclerotica. Queste cellule immunitarie non solo sono resistenti ai fattori dannosi stessi, ma partecipano anche alla difesa antiossidante del corpo (Gui et al., 2012).
Kamikaze schiumoso
Una delle metamorfosi più intriganti di un macrofago è la sua trasformazione in una cosiddetta cellula schiumosa. Tali cellule sono state trovate nelle placche aterosclerotiche e hanno preso il nome dal loro aspetto specifico: al microscopio assomigliavano a schiuma di sapone. In sostanza, una cellula schiumosa è lo stesso macrofago M1, ma traboccante di inclusioni grasse, costituite principalmente da composti insolubili in acqua di colesterolo e acidi grassi.
È stata avanzata l'ipotesi, ormai generalmente accettata, secondo cui le cellule schiumose si formano nella parete dei vasi aterosclerotici a causa dell'assorbimento incontrollato di lipoproteine a bassa densità da parte dei macrofagi, che trasportano il colesterolo "cattivo". Tuttavia, si è successivamente scoperto che l'accumulo di lipidi e un aumento drammatico (decine di volte!) della velocità di sintesi di un certo numero di lipidi nei macrofagi possono essere provocati sperimentalmente dalla sola infiammazione, senza alcuna partecipazione di lipoproteine a bassa densità ( Duškin, 2012).
Questa ipotesi è stata confermata da osservazioni cliniche: si è scoperto che la trasformazione dei macrofagi in cellule schiumose avviene in varie malattie di natura infiammatoria: nelle articolazioni - con artrite reumatoide, nel tessuto adiposo - con diabete, nei reni - con insufficienza acuta e cronica , nel tessuto cerebrale - con encefalite . Ci sono voluti però circa vent’anni di ricerca per capire come e perché un macrofago durante l’infiammazione si trasforma in una cellula piena di lipidi.

Si è scoperto che l'attivazione delle vie di segnalazione proinfiammatorie nei macrofagi M1 porta allo “spegnimento” di quegli stessi sensori lipidici che in condizioni normali controllano e normalizzano il metabolismo dei lipidi (Dushkin, 2012). Quando vengono “spenti”, la cellula inizia ad accumulare lipidi. Allo stesso tempo, le inclusioni lipidiche risultanti non sono affatto serbatoi passivi di grasso: i lipidi inclusi nella loro composizione hanno la capacità di potenziare le cascate di segnalazione infiammatoria. L'obiettivo principale di tutti questi drammatici cambiamenti è attivare e rafforzare con ogni mezzo la funzione protettiva del macrofago, volta a distruggere gli “estranei” (Melo, Drorak, 2012).
Tuttavia, livelli elevati di colesterolo e acidi grassi hanno un costo per la cellula schiumosa: ne stimolano la morte attraverso l'apoptosi, la morte cellulare programmata. Sulla superficie esterna della membrana di tali cellule “condannate” si trova il fosfolipide fosfatidilserina, che normalmente si trova all'interno della cellula: il suo aspetto all'esterno è una sorta di “campana a morto”. Questo è il segnale “mangiami” percepito dai macrofagi M2. Assorbendo le cellule schiumose apoptotiche, iniziano a secernere attivamente i mediatori dello stadio finale e riparativo dell'infiammazione.
Bersaglio farmacologico
L'infiammazione come tipico processo patologico e la partecipazione chiave dei macrofagi in esso è, in un modo o nell'altro, una componente importante principalmente delle malattie infettive causate da vari agenti patologici, dai protozoi e batteri ai virus: infezioni da clamidia, tubercolosi, leishmaniosi, tripanosomiasi , ecc. Allo stesso tempo, i macrofagi, come accennato in precedenza, svolgono un ruolo importante, se non guida, nello sviluppo delle cosiddette malattie metaboliche: aterosclerosi (il principale colpevole delle malattie cardiovascolari), diabete, malattie neurodegenerative del cervello (morbo di Alzheimer e di Parkinson, conseguenze di ictus e lesioni cranio-cerebrali), artrite reumatoide e cancro.
Le moderne conoscenze sul ruolo dei sensori lipidici nella formazione di vari fenotipi di macrofagi hanno reso possibile lo sviluppo di una strategia per il controllo di queste cellule in varie malattie.
Pertanto, si è scoperto che nel processo di evoluzione, i bacilli della clamidia e della tubercolosi hanno imparato a utilizzare i sensori lipidici dei macrofagi per stimolare un'attivazione alternativa (in M2) dei macrofagi che non è pericolosa per loro. Grazie a ciò, il batterio della tubercolosi assorbito dal macrofago può, nuotando come formaggio nel burro nelle inclusioni lipidiche, attendere con calma il suo rilascio e, dopo la morte del macrofago, moltiplicarsi, utilizzando il contenuto delle cellule morte come cibo (Melo, Drorak, 2012).
Se in questo caso utilizziamo attivatori sintetici dei sensori lipidici, che impediscono la formazione di inclusioni grasse e, di conseguenza, impediscono la trasformazione “schiumosa” dei macrofagi, allora è possibile sopprimere la crescita e ridurre la vitalità degli agenti patogeni infettivi. Almeno negli esperimenti sugli animali, è già stato possibile ridurre significativamente la contaminazione dei polmoni dei topi con bacilli tubercolari utilizzando uno stimolatore di uno dei sensori lipidici o un inibitore della sintesi degli acidi grassi (Lugo-Villarino et al., 2012).
 Un altro esempio sono malattie come l’infarto del miocardio, l’ictus e la cancrena degli arti inferiori, le complicanze più pericolose dell’aterosclerosi, che sono causate dalla rottura delle cosiddette placche aterosclerotiche instabili, accompagnata dall’immediata formazione di un coagulo sanguigno e dal blocco del un vaso sanguigno.
Un altro esempio sono malattie come l’infarto del miocardio, l’ictus e la cancrena degli arti inferiori, le complicanze più pericolose dell’aterosclerosi, che sono causate dalla rottura delle cosiddette placche aterosclerotiche instabili, accompagnata dall’immediata formazione di un coagulo sanguigno e dal blocco del un vaso sanguigno.
La formazione di tali placche aterosclerotiche instabili è facilitata dalla cellula macrofago/schiuma M1, che produce enzimi che dissolvono il rivestimento di collagene della placca. In questo caso, la strategia di trattamento più efficace è quella di trasformare la placca instabile in una placca stabile e ricca di collagene, che richiede la trasformazione del macrofago “aggressivo” M1 in quello “pacificato” M2.
I dati sperimentali indicano che tale modificazione del macrofago può essere ottenuta sopprimendo in esso la produzione di fattori proinfiammatori. Tali proprietà sono possedute da una serie di attivatori sintetici dei sensori lipidici, nonché da sostanze naturali, ad esempio la curcumina, un bioflavonoide presente nella radice della curcuma, una nota spezia indiana.
Va aggiunto che tale trasformazione dei macrofagi è rilevante per l’obesità e il diabete di tipo 2 (la maggior parte dei macrofagi nel tessuto adiposo ha un fenotipo M1), nonché nel trattamento delle malattie neurodegenerative del cervello. In quest’ultimo caso, nel tessuto cerebrale si verifica l’attivazione “classica” dei macrofagi, che porta al danno neuronale e all’accumulo di sostanze tossiche. La trasformazione degli aggressori M1 in pacifici custodi M2 e Mox che distruggono la “spazzatura” biologica potrebbe presto diventare la strategia principale per il trattamento di queste malattie (Walace, 2012).
La degenerazione cancerosa delle cellule è indissolubilmente legata all'infiammazione: ad esempio, ci sono tutte le ragioni per ritenere che il 90% dei tumori nel fegato umano siano conseguenza dell'epatite infettiva e tossica. Pertanto, per prevenire il cancro, è necessario controllare la popolazione dei macrofagi M1.
Tuttavia, non tutto è così semplice. Pertanto, in un tumore già formato, i macrofagi acquisiscono prevalentemente segni dello stato M2, che favorisce la sopravvivenza, la riproduzione e la diffusione delle stesse cellule tumorali. Inoltre, tali macrofagi iniziano a sopprimere la risposta immunitaria antitumorale dei linfociti. Pertanto, per il trattamento dei tumori già formati, è in fase di sviluppo un'altra strategia, basata sulla stimolazione dei segni dell'attivazione classica di M1 nei macrofagi (Solinas et al., 2009).
Un esempio di questo approccio è la tecnologia sviluppata presso l’Istituto di immunologia clinica di Novosibirsk della filiale siberiana dell’Accademia russa delle scienze mediche, in cui i macrofagi ottenuti dal sangue di malati di cancro vengono coltivati in presenza dello stimolante zymosan, che si accumula nelle cellule. I macrofagi vengono quindi iniettati nel tumore, dove lo zymosan viene rilasciato e inizia a stimolare la classica attivazione dei macrofagi “tumorali”.

Oggi sta diventando sempre più chiaro che i composti che inducono la metamorfosi dei macrofagi hanno un pronunciato effetto ateroprotettivo, antidiabetico, neuroprotettivo e proteggono anche i tessuti nelle malattie autoimmuni e nell'artrite reumatoide. Tuttavia, i farmaci attualmente disponibili nell’arsenale di un medico praticante – fibrati e derivati del tiazolidone – sebbene riducano la mortalità in queste gravi malattie, hanno anche gravi effetti collaterali.
Queste circostanze stimolano chimici e farmacologi a creare analoghi sicuri ed efficaci. All'estero, negli Stati Uniti, in Cina, Svizzera e Israele, vengono già condotti costosi studi clinici su composti simili di origine sintetica e naturale. Nonostante le difficoltà finanziarie, anche i ricercatori russi, compresa Novosibirsk, stanno dando il loro contributo alla soluzione di questo problema.
Pertanto, presso il Dipartimento di Chimica dell'Università statale di Novosibirsk, è stato ottenuto un composto sicuro TS-13, che stimola la formazione di fagociti Mox, che ha un pronunciato effetto antinfiammatorio e ha un effetto neuroprotettivo in un modello sperimentale del morbo di Parkinson ( Dyubchenko et al., 2006; Zenkov et al., 2009).
Presso l'Istituto di Chimica Organica di Novosibirsk dal nome. N. N. Vorozhtsov SB RAS ha creato farmaci antidiabetici e antiaterosclerotici sicuri che agiscono su più fattori contemporaneamente, grazie ai quali il macrofago “aggressivo” M1 si trasforma in “pacifico” M2 (Dikalov et al., 2011). Di grande interesse sono anche i preparati erboristici ottenuti da uva, mirtilli e altre piante utilizzando la tecnologia meccanochimica sviluppata presso l'Istituto di chimica dello stato solido e meccanochimica della SB RAS (Dushkin, 2010).
Con l'aiuto del sostegno finanziario dello Stato, in un futuro molto prossimo sarà possibile creare mezzi nazionali per la manipolazione farmacologica e genetica dei macrofagi, grazie ai quali ci sarà una reale opportunità di trasformare queste cellule immunitarie da nemici aggressivi in amici che aiutare il corpo a mantenere o ripristinare la salute.
Letteratura
Dushkin M. I. Macrofago/cellula schiumosa come attributo dell'infiammazione: meccanismi di formazione e ruolo funzionale // Biochimica, 2012. T. 77. P. 419-432.
Smirnov A.N. Segnalazione lipidica nel contesto dell'aterogenesi // Biochimica. 2010. T. 75. pp. 899-919.
Schwartz Ya. Sh., Svistelnik A. V. Fenotipi funzionali dei macrofagi e il concetto di polarizzazione M1-M2. Parte 1 Fenotipo proinfiammatorio. // Biochimica. 2012. T.77. pp. 312-329.
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0