Eziologia. L'Ancylostoma brasiliense raggiunge solitamente la maturità sessuale solo nei cani e nei gatti. Le larve, uscendo dalle uova rilasciate nelle feci, raggiungono lo stadio filariforme e hanno la capacità di penetrare nella pelle. Nell'uomo le larve risiedono nella pelle e migrano determinando la formazione di tratti eritematosi visibili sulla superficie cutanea.
Epidemiologia e distribuzione. La diffusione dell'elmintiasi tra le persone richiede condizioni adeguate: temperatura ambiente e umidità per lo sviluppo delle uova fino allo stadio di larve filariformi infettive. Le spiagge e altre aree umide e sabbiose sono aree ad alto rischio perché gli animali scelgono queste aree per defecare e le uova di A. brasiliense si sviluppano bene in tale terreno. Negli Stati Uniti, la malattia è stata segnalata negli stati meridionali lungo la costa atlantica e il Golfo del Messico.
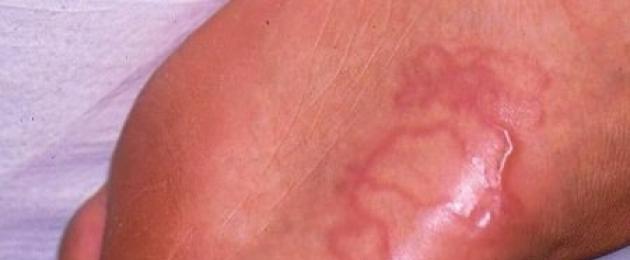
Patogenesi e manifestazioni cliniche. I luoghi di penetrazione cutanea delle larve diventano evidenti poche ore dopo la loro penetrazione. La migrazione delle larve nella pelle è accompagnata da un forte prurito. Grattarsi può portare a infezioni batteriche. Entro 1 settimana dalla papula rossa primaria si sviluppano elementi lineari eritematosi casuali, la cui lunghezza può raggiungere i 15-20 cm e, se non trattate, le larve possono rimanere vitali per diverse settimane e mesi.
La sindrome di Loeffler è stata osservata in 26 su 52 casi di eruzione cutanea strisciante. Infiltrati polmonari volatili transitori accompagnati da un aumento del numero di eosinofili nel sangue e nell'espettorato sono stati interpretati come una reazione allergica all'infestazione da elminti, ma potrebbero essere stati un riflesso della migrazione polmonare delle larve.
Dati di laboratorio. Gli eosinofili si trovano negli elementi della pelle, ma la leucocitosi eosinofila è moderata, tranne nei casi della sindrome di Loeffler. La percentuale di eosinofili nel sangue può aumentare fino al 50%, nell'espettorato fino al 90%. Le larve vengono trovate sulla biopsia cutanea solo in rari casi.
Trattamento. Il miglior farmaco è il tiabendazolo; dovrebbe essere somministrato per via orale alla dose suggerita per il trattamento della strongiloidosi (vedi sotto). Se necessario, il trattamento può essere ripetuto. Il farmaco può essere utilizzato localmente come sospensione acquosa al 10%. L'applicazione locale evita la tossicità generale del farmaco. Le infezioni batteriche superficiali vengono soppresse utilizzando medicazioni umide e sollevando l'arto. Per il prurito intenso si consigliano antistaminici orali.
Previsione. Se non trattata, la malattia dura diversi mesi. Il trattamento ha solitamente successo.
Prevenzione.CÈ necessario evitare che cani e gatti contaminino le aree ricreative e le aree gioco dei bambini.
Foto della sindrome della larva errante
PALLA PELOSA (miasi lineare)
Sinonimi: malattia strisciante, linea migratoria.
Eziologia e patogenesi
Le miasi sono causate principalmente da larve di tafani equini o bovini (Hypoderma bovis, Hypoderma lineatum; Gasterophilus haemorrhoidalis; G. interstinalis).
In rari casi, la malattia può essere causata da larve di elminti caratteristici dell'uomo (strongiloides stercoralis, ecc.).
Si sviluppa principalmente nelle persone che si prendono cura di cavalli e bovini, associati a lavori agricoli (coltivazione e fertilizzazione del terreno), così come nei bambini che entrano in contatto con terreno, sabbia o fanno il bagno in acque contaminate da larve in fase invasiva. È possibile che le mosche depongano le uova direttamente sulla pelle o sui capelli umani, seguite dallo sviluppo delle larve e dalla loro penetrazione nell'epidermide.
Il quadro clinico della malattia causata dalle larve dei nematodi e dalla mosca gastrica dei cavalli (famiglia Gasterophilidae) è simile, il che rende difficile esprimere un giudizio sul tipo di agente patogeno basato solo sulle manifestazioni cliniche. Secondo Madjarov la malattia causata dalle larve dei nematodi può essere più grave. Ciò riguarda i cambiamenti della pelle (la possibilità di sviluppare eruzioni vescicolari, bollose, piodermite), ma soprattutto - reazioni generali: mal di testa, nausea, brividi. A quanto pare, ciò dipende anche dal numero di larve che sono penetrate nella pelle.
Le miasi causate dalle larve del tafano cavallo e dei nematodi sono caratterizzate clinicamente dalla presenza di una striscia continua, eritemato-edematosa, arrotolata, la cui lunghezza e il cui contorno dipendono dalla durata della presenza delle larve nella pelle e dalla direzione del loro movimento. movimento. La larva si muove abbastanza velocemente. La diffusione delle strisce provocate dalle larve di Strongyloides è considerata particolarmente rapida, da qui il nome Larka currens. Secondo E.P. Tikhomirova, la larva si è spostata di 12 cm nella pelle in 1 ora. In questo caso può apparire uno schema bizzarro: curve, zigzag, figure policicliche.
Uno dei pazienti descritti da Katz aveva circa 200 lesioni attive.
Nell'osservazione di A. A. Kalamkaryan (1954), c'erano così tante strisce che era difficile contarle.
Smith descrisse una strongiloidosi cutanea localizzata alle natiche, clinicamente simile all'eritema anulare centrifugo.
Disturbi soggettivi: prurito, bruciore. Secondo Peters e Kramer, le miasi causate da larve di mosche del genere Hypoderma si manifestano con alterazioni infiammatorie cutanee più pronunciate (e talvolta fenomeni generali più o meno gravi) rispetto a quelle causate da larve del genere Gasterophilus.
Introduzione nella pelle delle larve del tafano bovino sottocutaneo (Hypoderma bovis) e nell'esofago (Hypoderma lineatum) fam. L'ipodermatide non è accompagnato dallo sviluppo di strisce continue, poiché le larve migrano nel tessuto sottocutaneo. Le larve si muovono rapidamente - fino a 12 cm in 12 ore, solitamente in direzione della parte superiore del corpo e della testa, dove compaiono gonfiore e indurimento rossastro-bluastro, accompagnati da dolore, che scompaiono dopo pochi giorni, per poi ricomparire durante la migrazione .
Il quadro clinico può assomigliare all'angioedema, all'eritema nodoso. Quando le larve fuoriescono dalla pelle appare un infiltrato simili a foruncoli, all'apice con liquido sieroso. Le larve possono penetrare nell'occhio, provocando forte dolore, ampio gonfiore, sanguinamento e possono anche essere accompagnati da danni al nervo ottico, distacco della retina e cecità.
Il verme esiste finché le larve vivono nella pelle.
La miasi osservata nei paesi europei procede in modo più favorevole rispetto ai paesi con un clima caldo. Si verifica l'autoguarigione, poiché le larve non trovano nella pelle le condizioni per completare il ciclo vitale, ma migrano molto raramente e quindi muoiono dopo settimane o mesi.
Istopatologia
Nel derma - infiltrazione di neutrofili ed eosinofili attorno alle ghiandole sebacee e ai follicoli piliferi; talvolta si determina l'avanzamento delle larve negli strati superiori dell'epidermide.
Diagnosi differenziale
È necessario differenziare i vermi dall'orticaria causata artificialmente (orticaria factitia), dalla scabbia.
Rimozione della larva con un ago sotto il controllo di una lente d'ingrandimento dopo aver pulito la pelle con vaselina, metodi usati per trattare pazienti con scabbia, agenti antielmintici.
Articoli sull'argomento "Vermi"
Acquista WORMIL in farmacia:
Prezzi per VORMIL
(198 offerte)
Mostra azione contro gli elminti intestinali (nematodi Enterobius vermicularis, Ascaris lumbricoides, Triсhiurus triсhiura, Strongiloides stercoralis, Necator americanus, Cutaneous Larva Migrans Ancylostoma duodenale; cestodi Taenia solium, Hymenolepsis nana, Taenia saginata; trematodi Clonorchis sinensis e Opisthorhis vi verrini), nonché contro protozoi (Giardia lamblia). Attivo contro le elmintiasi tissutali (Echinococcus granulosus - echinococcosi cistica ed Echinococcus multilocularis - echinococcosi alveolare). L'albendazolo è efficace anche nel trattamento dell'infestazione da larve di T. Solium (neurocistecercosi) e Gnatostoma spinigerum (capillariosi). Quando si usa Wormila le cisti granulari dell'echinococco diminuiscono di dimensioni o vengono eliminate.
Dopo la somministrazione interna, l'albendazolo viene scarsamente assorbito dal tratto gastrointestinale, fino a circa il 5%. Quando si consumano cibi grassi contemporaneamente all'albendazolo, si osserva un aumento dell'assorbimento della sostanza. Al primo passaggio attraverso il fegato, viene rapidamente metabolizzato. Il metabolita principale, l'albendazolo solfato, è attivo al 50% dell'effetto della sostanza primaria. L'emivita è di 8,5 ore. I metaboliti dell'albendazolo vengono escreti dal corpo con la bile (principalmente) e l'urina (piccole quantità). Se assunto per un lungo periodo (in grandi dosi per il trattamento delle cisti), la rimozione dei metaboliti dalle cisti si osserva nell'arco di diverse settimane.
Indicazioni per l'uso:
Modalità di applicazione:
Dosaggio Wormila determinato individualmente. Masticare le compresse prima di deglutire. Per anchilostoma, ascariasis, enterobiasi, necatoriasi, trichinosi nei bambini di età superiore a 2 anni e negli adulti, vengono prescritti 400 mg (1 compressa) 1 volta al giorno per 3-5 giorni.
Per la taeniasi, la strongiloidosi e l'imenolepiasi nei bambini di età superiore ai 2 anni e negli adulti, vengono prescritti 400 mg (1 compressa) 1 volta al giorno per 3 giorni. In caso di imenolipedosi confermata è necessario ripetere il ciclo di terapia dopo 21 giorni.
Per la clonorchiasi, l'opistorchiasi, l'infestazione mista di Chlonorchis sinensis e Opisthorchis viverrini, ai bambini di età superiore a 2 anni e agli adulti vengono prescritti 400 mg (1 compressa) 2 volte al giorno per 3 giorni.
Per il trattamento della giardiasi nei bambini dai 2 ai 12 anni Vermil utilizzare 1 compressa (400 mg) 1 volta al giorno per 5 giorni.
Per l'echinococcosi cistica, per i pazienti di peso superiore a 60 kg, il farmaco viene prescritto a 400 mg (1 compressa) 2 volte al giorno. Il corso del trattamento è di 28 giorni. Se il peso del paziente è inferiore a 60 kg, viene prescritto alla dose di 15 mg/kg/die (diviso in 2 dosi). La dose massima consentita è 800 mg/giorno. Se necessario, effettuare 3 cicli di trattamento con un intervallo di 2 settimane.
Per l'echinococcosi alveolare, vengono prescritti 400 mg (1 compressa) 2 volte al giorno per i pazienti di peso superiore a 60 kg. Si consigliano 3 cicli di trattamento di 28 giorni, con un intervallo di 2 settimane. Per i pazienti di peso inferiore a 60 kg, viene prescritto alla dose di 15 mg/kg/die (diviso in 2 dosi). La dose massima consentita è 800 mg/giorno. Se necessario, la terapia può essere continuata per diversi mesi/anni.
In caso di infestazione da Cutaneous larva migrans (larve migratrici cutanee) Vermil Prescrivere 400 mg (1 compressa) per 1-3 giorni.
Per il trattamento della neurocistecircosi, vengono prescritti 400 mg (1 compressa) 2 volte al giorno per i pazienti di peso superiore a 60 kg. Il corso della terapia dipende dal risultato e può durare da 1 settimana a un mese. Per i pazienti di peso inferiore a 60 kg, viene prescritto alla dose di 15 mg/kg/die (diviso in 2 dosi). La dose massima consentita è 800 mg/giorno. Il ciclo di terapia può essere ripetuto dopo 7-14 giorni.
Ad adulti e bambini con capillariasi vengono prescritti 400 mg (1 compressa) 1 volta al giorno per 10 giorni.
Ad adulti e bambini con gnatostomosi vengono prescritti 400 mg (1 compressa) 1 volta al giorno per 10-20 giorni.
Effetti collaterali:
Dal sistema digestivo: vomito, secchezza delle fauci, stomatite, bruciore di stomaco, flatulenza, nausea, dolore addominale, diarrea, stitichezza.
Dal sistema nervoso: mal di testa, sonnolenza o insonnia, vertigini, disorientamento, confusione, allucinazioni, convulsioni.
Dall'organo della visione: diminuzione dell'acuità visiva.
Reazioni di ipersensibilità: orticaria, dermatite, prurito, pemfigo, febbre.
Sistema sanguigno: pancitopenia, leucopenia.
Controindicazioni:
Gravidanza e allattamento;
Reazioni di ipersensibilità all'albendazolo o ad altri componenti Wormila ;
Età fino a 2 anni;
Periodo pregraviduale.
Gravidanza:
Vormil è strettamente controindicato durante la gravidanza e l'allattamento. Prima di prescrivere il farmaco, si consiglia di effettuare un test di gravidanza per evitare l'assunzione di Vormil nelle fasi iniziali.
Interazione con altri farmaci:
È possibile aumentare la concentrazione dei metaboliti dell'albendazolo in combinazione con praziquantel, cimetidina e desametasone.
Overdose:
In caso di sovradosaggio Wormila sono possibili i seguenti sintomi: visione offuscata, vomito, nausea, sonnolenza, allucinazioni visive, vertigini, epatomegalia, disturbi del linguaggio, perdita di coscienza, ittero, colore arancione o rosso-bruno di urina, pelle, saliva, sudore, lacrime e feci. Trattamento: lavanda gastrica, somministrazione di enterosorbenti, terapia di supporto e sintomatica.
Modulo per il rilascio:
Vormil - compresse masticabili da 400 mg di albendazolo in 1 compressa. Nella confezione sono presenti 3 compresse.
Vormil - sospensione per somministrazione interna di 400 mg di albendazolo in 10 ml. In una bottiglia di vetro - 10 ml del farmaco.
Condizioni di archiviazione:
In un luogo protetto dalla portata dei bambini e con accesso alla luce a temperatura ambiente.
Composto:
Vormil - compresse masticabili
Principio attivo (in 1 compressa): albendazolo 400 mg.
Ingredienti inattivi: amido di mais, cellulosa microcristallina, talco purificato, biossido di silicio colloidale, magnesio stearato, sodio amido glicolato, sodio metilidrossibenzoato, sodio propilidrossibenzoato, aspartame ed essenza di frutta mista.
Vormil - sospensione per uso interno
Principio attivo (in 1 flacone da 10 ml): albendazolo 400 mg.
Componenti inattivi: sodio metilidrossibenzoato, saccarosio, sodio propilidrossibenzoato, eritrosina, croscarmellosa sodica, sodio benzoato, glicerolo, essenza di frutta mista, polisorbato 80, essenza di lampone, acqua depurata.
Inoltre:
Se i parametri di laboratorio superano la norma di più di 2 volte rispetto al limite superiore, Vormil viene interrotto fino alla completa normalizzazione.
Durante il trattamento Vormilè necessario monitorare il livello dei leucociti all'inizio di ogni ciclo e ogni 14 giorni del ciclo di terapia di 28 giorni.
In caso di sviluppo di leucopenia, l'uso del farmaco viene continuato se la leucopenia è insignificante e non progredisce.
Vormil (compresse, sospensione) – istruzioni per l'uso, recensioni, analoghi, prezzo
Composto
Qualsiasi medicinale contiene principi attivi e un numero di inattivi. Il principio attivo di questo farmaco è l'albendazolo. A seconda della forma di rilascio, Vormil ha una diversa composizione di sostanze inattive. Pertanto, il farmaco rilasciato in compresse contiene:
Se parliamo di Vormil, rilasciato sotto forma di sospensione per uso interno, le sostanze inattive in questo caso sono:
Modulo per il rilascio
1. Pillole.
2. Sospensione per uso interno.
3. Borse.
Una compressa masticabile di Wormil contiene 400 mg di albendazolo. La confezione comprende 3 compresse e le istruzioni per l'uso del medicinale.
Vormil si adatta bene agli elminti che compaiono nell'intestino umano, così come ai protozoi. L'uso del farmaco secondo le istruzioni aiuta a ridurre le dimensioni delle cisti granulari dell'echinococco e alla loro ulteriore distruzione.
Lo stomaco del paziente è in grado di assorbire solo il 5% del medicinale. La combinazione del farmaco con cibi grassi e nutrienti aumenta significativamente questo indicatore. L'emivita del farmaco dal corpo richiederà circa 8,5 ore. I metaboliti del principio attivo albendazolo vengono escreti principalmente nella bile e parzialmente nelle urine. Dopo aver interrotto l'assunzione di Vormil, i metaboliti continueranno a essere rilasciati per diverse settimane. Tuttavia, questo vale per le situazioni in cui il paziente assume il farmaco da molto tempo.
Indicazioni per l'uso
Tutte queste malattie sono legate alle infezioni da elminti.
Prevenzione dei vermi con Vormil
Vormil - istruzioni per l'uso
Prima di iniziare a usare il farmaco, si consiglia di consultare un medico, che prescriverà un dosaggio individuale. Come con la maggior parte dei farmaci che hanno effetti collaterali, gli esperti consigliano di leggere le istruzioni incluse nelle compresse o nelle supposte.
Prima dell'uso diretto, la compressa deve essere masticata e lavata con una piccola quantità di acqua.
Pertanto, è possibile suddividere l'uso del medicinale in base alle malattie e alla categoria di età del paziente:
- Bambini di età superiore ai due anni e adulti per il trattamento ascariasis, necatoriasis, trichinosi, infezione da anchilostomi, enterobiasi I medici prescrivono solitamente Vormil alla dose di 400 mg una volta al giorno per i successivi 5 giorni.
- Per le stesse categorie di età, Vormil viene prescritto nel dosaggio già descritto per le malattie strongiloidosi, taeniasi e imenolepiasi. La durata totale del trattamento non deve superare i tre giorni. Tuttavia, queste malattie richiedono solitamente un trattamento preventivo ripetuto dopo 21 giorni.
- Trattamento dell'opistorchiasi e clonorchiasi richiede l'uso del medicinale per via orale nei successivi tre giorni dal momento della prima somministrazione del farmaco. Il dosaggio rimane standard: 400 mg al giorno.
- Giardiasi infantile trattato con Vormil in 5 giorni alla dose di 400 mg al giorno.
- Ci vuole un po' più di tempo per guarire capillariosi– 10 giorni di uso continuo del farmaco internamente garantiranno risultati.
- Gnatostomiasi richiede un lungo periodo di osservazione. Il paziente deve assumere Vormil per 20 giorni. Successivamente, hai bisogno di un'altra consultazione con un medico.
- Echinococcosi cistica. che si verifica in pazienti il cui peso supera i 60 kg, viene trattato alla dose di 400 mg al giorno. Il trattamento continua per 28 giorni. Un'ulteriore terapia può, a discrezione del medico, essere ripetuta dopo 2-3 settimane. L'intera procedura per eliminare la malattia consiste in tre cicli. Tuttavia, vale la pena prestare attenzione al fatto che la dose di farmaco assunta al giorno non deve in nessun caso superare gli 800 mg.
- Per i pazienti con lo stesso peso corporeo, Vormil è prescritto per il trattamento echinococcosi alveolare. Le compresse vengono assunte due volte al giorno. Succede che la malattia può ripresentarsi, quindi il trattamento può essere continuato a discrezione del medico.
- Larve migranti cutanee trattato con Vormil per 3 giorni.
- Pelle può anche reagire all'allergene con l'orticaria. dermatite. prurito o febbre.
- Sistema emopoietico- l'ultimo sistema che può mostrare la sua “insoddisfazione” sotto forma di pancitopenia o leucopenia. Pertanto, i medici consigliano di monitorare attentamente il livello dei leucociti nel sangue del paziente durante l’assunzione di Vormil. Nei casi in cui la leucopenia non progredisce o è, in generale, insignificante, il trattamento con Vormil non viene annullato. A proposito, la leucopenia è una malattia associata a una diminuzione del numero di leucociti nel sangue periferico. La pancitopenia è considerata una malattia più grave, poiché la sua essenza è una diminuzione del numero di tutti e tre i componenti del sangue: i globuli rossi. piastrine e leucociti. Se questa malattia viene rilevata in un paziente, il farmaco viene sospeso per non iniziare la fase cronica, poiché quest'ultima comporta la morte.
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0
Controindicazioni
Nonostante il fatto che Vormil venga solitamente prescritto a tutti i membri della famiglia per il trattamento e la prevenzione delle malattie sopra descritte, questo farmaco presenta ancora controindicazioni. È strettamente controindicato durante la gravidanza e l'allattamento. Anche se una donna si sta semplicemente preparando a diventare presto madre, non dovrebbe assumere questo medicinale. In altre parole, una donna nel periodo preconcezionale dovrebbe prestare particolare attenzione a questo tipo di mezzi.
Vormil inoltre non deve essere assunto dai bambini di età inferiore ai due anni. Alcune persone possono soffrire di ipersensibilità ad alcuni componenti del farmaco (sia attivi che non attivi). Le reazioni allergiche più comuni si verificano al componente attivo di Wormila - albendazolo.
Effetti collaterali
Gli effetti collaterali durante l'utilizzo di Vormil possono verificarsi in 5 sistemi:
- Apparato digerente. Il paziente può vomitare. stomatite. bocca asciutta. bruciore di stomaco. nausea, flatulenza. mal di stomaco. stitichezza e diarrea. Riguardo sistema nervoso. poi possono comparire disturbi sotto forma di mal di testa e sonnolenza. insonnia. vertigini. disorientamento, confusione, spasmi agli arti e persino allucinazioni. Inoltre, sono possibili anche problemi alla vista. Molto spesso ciò si manifesta nella sua nitidezza insufficiente.
Vormil durante la gravidanza
Secondo le istruzioni allegate al farmaco, è severamente vietato l'uso di Vormil durante la gravidanza. Se la gravidanza è appena stata pianificata, la futura mamma dovrebbe comunque fare attenzione e non assumere il farmaco. Ciò è dovuto principalmente all'effetto del farmaco sul fegato.
Vermil per bambini
Sfortunatamente, i bambini soffrono molto spesso di infestazioni da elminti. Questo farmaco può essere prescritto a un bambino dopo i due anni sotto forma di sospensione, sciroppo o compresse. Molti genitori preferiscono la sospensione perché, grazie al suo basso livello di tossicità, è sicura per il corpo del bambino. Per la giardiasi, il medico consiglia di assumere Vormil una compressa per cinque giorni.
Interazione con altri farmaci
Analoghi
Oggi il mercato dei farmaci può sempre offrirti di sostituire il tuo farmaco con un altro che abbia le stesse indicazioni per l'uso e anche un dosaggio corrispondente al farmaco precedente. Per i farmacisti e i rappresentanti del sistema sanitario è considerato farmaco analogo un farmaco che porta la stessa denominazione comune internazionale del farmaco originale.
Per Vormil, tali analoghi sono Aldazol, Medizol, Nemozol. Farmox. Consideriamo più in dettaglio le proprietà farmacologiche di ciascuno dei farmaci presentati.
Le stesse indicazioni per l'uso caratterizzano i due restanti analoghi di un farmaco come Vormil. Tuttavia, nonostante le note speciali contenute nelle istruzioni allegate a questi farmaci, non dovresti seguirle ciecamente. È meglio lasciare che sia il medico stesso a consigliarti questo o quel farmaco, poiché ogni organismo è individuale e ciò che è adatto a una persona sarà completamente inaccettabile per un'altra, causandogli danni. A volte capita che i medici, conoscendo le malattie concomitanti, possano prescrivere un analogo, ma a condizione che il paziente lo prenda insieme ad altri farmaci, e viceversa, qualcosa può essere annullato.
Sinonimi
I farmaci sinonimi salvano i pazienti quando la farmacia non è in grado di fornire la medicina necessaria. Se hai urgentemente bisogno di sostituire Vormil con un altro farmaco, chiedi al tuo farmacista la disponibilità di farmaci come Nemozol, Gelmodol-VM o Sanoxal. Sebbene questi farmaci abbiano nomi commerciali diversi, hanno tutti la stessa composizione di principi attivi.
Wormil o Vermox?
Prezzo
I prezzi per Vormil sono abbastanza accettabili per l'acquirente medio. Per gli acquirenti ucraini, i prezzi di questo medicinale vanno da 25 a 29 UAH. In Russia, Vormil può essere acquistato in farmacia al prezzo di 151 rubli.
Le larve hanno la capacità di “migrare” in tutto il corpo. Lasciano sulla pelle lunghi segni filiformi, di colore rosso. Una volta entrati negli organi interni, interferiscono con il normale funzionamento. A seconda dell'organo in cui penetrano le larve, è possibile diagnosticare ittero, insufficienza renale e disturbi dell'apparato digerente. Particolarmente pericolose sono le larve che penetrano nel sistema nervoso centrale o nel cervello.
Sintomi
La presenza di larve nel corpo umano è caratterizzata dalla comparsa di passaggi simili a serpenti sulla pelle, più spesso su gambe, braccia e glutei. Possono intrecciarsi, divergere e convergere in una palla. Tutto ciò è accompagnato da un forte prurito, una sensazione di bruciore e la comparsa di vesciche dolorose. Sono possibili sintomi come febbre, nausea, vertigini.
Trattamento
Per prevenire l'infezione da parte delle larve, è necessario mantenere l'igiene e mangiare solo frutta e verdura trattata termicamente. Durante le vacanze, cerca di evitare specchi d'acqua discutibili.
Sondaggio
La diagnosi di larve migranti cutanee viene solitamente stabilita sulla base dell'anamnesi del paziente e del quadro clinico della malattia. Esami visivi come la radiografia o l'endoscopia aiuteranno a rilevare le larve negli organi interni.
La larva migrans è l'elmintiasi, una malattia pericolosa caratterizzata dalla presenza di larve di elminti animali nei tessuti, nell'epidermide e negli organi interni. Le larve nel corpo umano aumentano di dimensioni e iniziano a migrare, causando problemi di salute. La malattia è imprevedibile e la mancanza di trattamento può portare alla guarigione spontanea o al peggioramento della condizione e alla morte. Il trattamento è prescritto dal medico a seconda della forma della larva migrans.
Cause
Luoghi caldi, ombreggiati e umidi diventano ambienti favorevoli alla riproduzione delle larve. Gli stagni sono pericolosi in estate, soprattutto se ci sono animali domestici al pascolo nelle vicinanze o cani che vagano nelle vicinanze. Nella sabbia vicino all'acqua, sotto i rami degli alberi, le uova possono accumularsi e trasformarsi in larve; correre a piedi nudi su un terreno contaminato può infettarsi. Sono a rischio le persone che svolgono professioni agricole e che entrano in contatto con il suolo.
L'infezione nella forma viscerale si verifica attraverso l'ingresso di uova di elminto nel corpo umano attraverso la cavità orale, ad esempio quando si ingerisce acqua da uno stagno mentre si nuota o si mangia cibo non lavato.
Sintomi
Sia nella forma cutanea che in quella viscerale della malattia, può verificarsi febbre: alta temperatura, tremori nel corpo, nausea e vertigini.
I sintomi della malattia potrebbero non comparire immediatamente dopo l’infezione, ma diversi mesi dopo.
Diagnostica
Nella forma cutanea della larva migrans, la diagnosi della malattia può essere difficile perché alcuni casi clinici assomigliano alla scabbia o ad altre malattie della pelle. Tuttavia, con un attento esame da parte di un medico esperto, questo sembra ancora possibile.
Trattamento
Prevenzione
La principale prevenzione contro la larva migrans è l'igiene: lavare accuratamente frutta e verdura prima di mangiarle, non nuotare in specchi d'acqua la cui acqua è discutibile, indossare indumenti protettivi quando si lavora nei campi.
Una malattia comune tra i viaggiatori di ritorno dai paesi tropicali.
Preciso morbilità sconosciuta negli Stati Uniti perché la malattia non è registrata. Un sondaggio del CDC ha rilevato che il 35-52% dei cani nei rifugi per animali sono infetti da vermi che possono causare malattie negli esseri umani. La larva migrans cutanea è la seconda infezione elmintica più comune.
Nel nostro Paese il contagio si verifica soprattutto in Florida e sulla costa del Golfo.
I bambini si ammalano più spesso degli adulti.
Causato da nematodi succhiatori di sangue (teste storte) presenti nei cani e nei gatti, ad esempio Ancylostorna braziliense, Ancylostoma caniurri.
Uova vermi trasmesso attraverso gli escrementi di cani e gatti.
Le larve si schiudono in sabbia/terreno umido e caldo.
Durante la fase dell'infezione, le larve penetrano nella pelle.
Diagnosi delle larve migranti cutanee
Diagnosi della larva migrans cutaneaè istituito sulla base dell'anamnesi e del quadro clinico.
Tane serpiginose o lineari bruno-rossastre sollevate sopra la superficie, lunghe 1-5 cm.
Forte .
I sintomi continuano per diverse settimane o mesi.
Arti inferiori, in particolare piedi (73%), glutei (13-18%) e addome (16%)
Non mostrato. In rari casi, gli esami del sangue possono rivelare eosinofilia o livelli aumentati di immunoglobulina E.
Diagnosi differenziale delle larve migratrici cutanee
In caso di infezione larva migrante cutanea Spesso si attribuiscono erroneamente le seguenti malattie:
Infezioni fungine della pelle. Le lesioni si presentano come caratteristiche placche squamose e chiazze a forma di anello con risoluzione centrale. Se il tratto serpiginoso della larva migrans cutanea è a forma di anello, spesso si presume erroneamente la dermatofitosi.
Dermatite da contatto. La differenza sta nella localizzazione delle lesioni, nella presenza di vescicole e nell'assenza dei classici tratti serpiginosi.
Eritema migrante nella malattia di Lyme. Le lesioni sono solitamente macchie o placche a forma di anello, ma non hanno forma serpiginosa e non sono sollevate sopra la superficie cutanea.
Fitofotodermatite. Nella fase acuta, la fitofotodermite si manifesta con gonfiore e vescicole, successivamente compaiono focolai di iperpigmentazione postinfiammatoria. Tali focolai possono verificarsi dopo aver visitato la spiaggia, ma non sono causati dalla sabbia infestata dalle larve, ma dalla preparazione di bevande con succo di lime.

Trattamento delle infestazioni cutanee da larva migrans
Tiabendazolo orale è l'unico farmaco approvato dalla Federal Drug Administration per il trattamento di pazienti affetti da larva migrans cutanea.
Dalle compresse da 500 mg si può preparare una crema topica (15%) su base idrosolubile. Sono stati condotti pochi studi sull’efficacia delle forme di dosaggio sistemiche e topiche, risalenti agli anni ’60.
La crema è una buona scelta per i bambini che non riescono a deglutire le compresse. - La dose orale raccomandata è di 25 mg/kg ogni 12 ore per 2-5 giorni (la dose non deve superare i 3 g al giorno). La crema viene applicata localmente 2-3 volte al giorno per cinque giorni sui passaggi larvali, coprendo 2-3 cm di pelle sopra le lesioni.
- L'efficacia è del 75-89% con la terapia sistemica e del 96-98% con il trattamento locale.
- La terapia sistemica è leggermente meno ben tollerata; le reazioni avverse comprendono nausea (49%), vomito (16%) e mal di testa (7%). Non sono stati rilevati effetti collaterali per i farmaci topici.
Ivermectina(stromectolo) (non approvato dalla Federal Drug Administration per questo uso).
- Si raccomanda una dose singola di 0,2 mg/kg (12-24 mg).
- L'efficacia con una singola dose è del 100%.
- In una serie di sei studi non sono stati rilevati effetti collaterali.
- Molti esperti considerano questo farmaco il farmaco di scelta.
Albendazoloè stato prescritto con successo da oltre 25 anni, ma non è nemmeno approvato dalla Federal Drug Administration per questo uso.
- La dose raccomandata è 400-800 mg al giorno per 3-5 giorni.
- L'efficienza supera il 92%.
- Viene utilizzata una dose di 800 mg al giorno per tre giorni o più; gli effetti collaterali gastrointestinali possono verificarsi nel 27% dei pazienti.
Crioterapia inefficaci e perfino dannosi e dovrebbero essere evitati.
Gli antistaminici possono alleviare il prurito.
Se si verifica un'infezione secondaria, devono essere prescritti antibiotici.
I recinti di sabbia per bambini devono essere protetti dagli animali.
Per i proprietari di animali domestici: tenere gli animali lontani dalle spiagge, trattarli per la sverminazione se necessario e pulire adeguatamente gli escrementi.
L'osservazione è necessaria per le lesioni persistenti.
Esempio clinico di larve migranti cutanee. La madre di un bambino di 18 mesi ha consultato un medico a causa di un'eruzione cutanea pruriginosa sui piedi e sui glutei del bambino. Il medico che visitò il ragazzo per la prima volta fece una diagnosi errata di dermatofitosi della pelle liscia. Il trattamento con crema al clotrimazolo non ha avuto successo. Il bambino non riusciva a dormire a causa del prurito costante e perdeva peso a causa del deterioramento dell'appetito. È stato ricoverato nel reparto di terapia intensiva, dove il medico curante ha scoperto che prima della sua prima visita dal medico, la famiglia era tornata da un viaggio ai Caraibi. Il bambino giocava sulle spiagge, dove spesso correvano i cani locali. Il medico riconobbe il modello serpiginoso delle eruzioni cutanee delle larve migranti e trattò con successo il bambino con tiabendazolo topico.
Malattie umane causate dalla migrazione delle larve dei nematodi
La larva migrans è un gruppo di malattie causate da larve di elminti animali che migrano nel corpo umano, provocando lesioni cutanee e danni agli organi interni. Gli agenti causali possono essere vari rappresentanti delle classi di nematodi, trematodi e cestodi. Una volta nel corpo umano, le larve di elminti animali, di regola, non si sviluppano fino allo stadio sessualmente maturo, ma possono migrare attraverso i tessuti, causando gravi danni agli organi, facilitati dalla durata e dai percorsi spesso pervertiti di migrazione dell'agente patogeno.
Toxocariasi
L'agente eziologico della toxocariasi è un nematode della famiglia Anisakoidae (Skrjabin et Korokhin, 1945) del genere Toxocara (Stiles, 1905). Sono note due specie di Toxocara: Tocsocara canis (Werner, 1782) - un elminto che colpisce principalmente i rappresentanti della famiglia dei cani, e Toxocara mystax (Zeder, 1800) - un elminto della famiglia dei gatti, a volte chiamato Tocsocara cati in inglese paesi di lingua parlata. Il ruolo di T. canis nella patologia umana è stato dimostrato, ma il ruolo di T. mystax è ancora in discussione, per cui attualmente con il termine “toxocariasi” si intende solo una malattia umana causata da Toxocara canis.
1) una persona è un ospite insolito per il suo agente patogeno;
2) gli agenti patogeni nel corpo umano non raggiungono uno stato sessualmente maturo;
3) il complesso dei sintomi è causato dalla migrazione di larve o elminti adulti nella pelle o negli organi interni di una persona.
A seconda dei sintomi prevalenti si distinguono le forme cutanea, viscerale e oculare della larva migrans. Successivamente, nel 1969, P. Beaver propose, nei casi in cui l’agente eziologico fosse noto, di designare la malattia non con il termine vago “larva migrans”, ma con un nome specifico derivato dal nome dell’agente eziologico (dirofilariasi, gnatostomiasi , angiostrongilosi, capillariasi, sparganosi, ecc.). Chiamò toxocariasi l'infestazione causata dai nematodi del cane (Toxocara canis).
I principali modi in cui i cani vengono infettati da Toxocara includono:
1) infezione intrauterina attraverso la placenta da parte delle larve;
2) ingestione di larve vive da parte dei cuccioli con il latte di un cane allattante;
3) l'ingestione di uova invasive con particelle di terreno (più spesso nei cani adulti, porta all'invasione dei brevetti);
4) ingestione di larve infettive con tessuti di ospiti paratenici.
Sieroprevalenza della popolazione. La prevalenza della toxocariasi nei residenti viene solitamente determinata esaminando campioni di siero sanguigno nelle reazioni sierologiche, più spesso in un test immunoassorbente enzimatico. Attualmente sono stati ottenuti numerosi dati sulla sieroprevalenza della toxocariasi nei residenti di vari territori della Federazione Russa e dei paesi della CSI. Questa cifra è, ad esempio, a Mosca e nella regione di Tula - 5,4%, in Daghestan - 7,4%, nella regione di Irkutsk - 6,0%. L'incidenza minima è nell'Oblast autonomo di Chukotka, nella regione della Kamchatka. In Lituania, la prevalenza tra i pazienti che richiedono cure ambulatoriali è dell’11,5%. La sieroprevalenza della toxocariasi viene costantemente studiata in molti paesi del mondo; è più alta in Colombia (68,2%) e Taiwan (51,4%), nei Paesi Bassi è significativamente più bassa (6,1%) e in Giappone solo al 3,6%. Va ricordato che non tutte le persone con risultati positivi ai test sierologici per la toxocariasi ce l'hanno. Secondo i nostri dati, il numero di pazienti in diversi focolai rappresenta l'1,5% del numero di sieropositivi.
I granulomi nella toxocariasi possono formarsi in qualsiasi organo e tessuto a causa di meccanismi di reazione di tipo ritardato. Al centro del granuloma c'è una zona di necrosi, lungo la periferia c'è un gran numero di eosinofili, oltre a istociti, neutrofili, cellule linfoidi, epitelioidi e macrofagi. Numerosi granulomi nella toxocariasi si trovano nel fegato, nei polmoni, così come nel pancreas, nel miocardio, nei linfonodi mesenterici e nel cervello. Pertanto, dal punto di vista istomorfologico, la toxocariasi è una granulomatosi eosinofila disseminata come manifestazione di una reazione allergica di tipo ritardato.
I risultati di numerose infezioni sperimentali di ospiti paratenici con Toxocara hanno dimostrato che la distribuzione delle larve nei tessuti e la loro sopravvivenza variano molto poco tra lo stesso tipo di ospite, e le manifestazioni cliniche della toxocariasi dipendono fortemente dalla dose irritante e dalla frequenza di reinfestazione. . L'infezione di ospiti paratenici con uova invasive di Toxocara porta entro pochi giorni a danni al fegato con marcata infiltrazione eosinofila del tessuto interstiziale. In questo caso nel fegato si formano molti granulomi con e senza larve. Successivamente, lungo la periferia dello strato cellulare del granuloma con la larva si forma una capsula fibrosa. I granulomi si formano rapidamente anche nei polmoni, il che porta a iperemia ed edema del tessuto polmonare, una reazione linfoide attiva e quindi alla comparsa di polmonite e alveolite. Durante i primi giorni dopo l'infezione, le larve entrano nel cervello, nei reni, nei muscoli e in altri organi e tessuti.
Clinica. La gamma delle manifestazioni cliniche dipende dall’intensità della dose infettante e dalla frequenza delle reinfezioni, dalla diffusione delle larve in determinati organi e tessuti, nonché dal grado di risposta immunitaria dell’ospite. La toxocariasi è caratterizzata da un decorso lungo e ricorrente (da diversi mesi a diversi anni), associato alla periodica ripresa della migrazione delle larve di Toxocara. Rari casi fatali di toxocariasi sono associati alla migrazione delle larve nel miocardio e in aree funzionalmente importanti del sistema nervoso centrale.
Il rapporto tra la frequenza delle varie forme cliniche di toxocariasi non è stato ancora sufficientemente studiato, tuttavia, secondo il Center for Disease Control degli Stati Uniti, la toxocariasi viscerale rappresenta il 20%, la toxocariasi oculare il 67%, quella asintomatica il 13% il numero totale di casi registrati nel 1981. In Slovacchia (1993), la toxocariasi viscerale rappresenta il 36%, la toxocariasi oculare il 26% dei casi. Negli ultimi anni è stato stabilito (Lysenko A.Ya., Feldman E.V., Rybak E.A.) che la toxocariasi nei bambini porta ad una diminuzione dell'efficacia della vaccinazione e della rivaccinazione contro il morbillo, la difterite e il tetano. Nei bambini non infetti, i titoli anticorpali medi spesso superano il livello protettivo anche prima della rivaccinazione, mentre in quelli infetti da larve di Toxocara questo livello rimane al di sotto del livello protettivo anche dopo la rivaccinazione. Rispetto ad altre infezioni da elminti (enterobiasi, ascariasi), T. canis ha l'effetto immunosoppressivo polivalente più attivo.
Toxocariasi viscerale La toxocariasi viscerale colpisce sia i bambini che gli adulti, sebbene questa malattia sia più comune nei bambini. Lo sviluppo della toxocariasi viscerale avviene a seguito dell'infezione da un gran numero di larve ed è associato, ad esempio, nei bambini, all'abitudine alla geofagia. I principali sintomi della toxocariasi sono febbre ricorrente, sindrome polmonare, ingrossamento del fegato, linfoadenopatia, eosinofilia, ipergammaglobulinemia. Secondo i nostri dati, nei bambini affetti da toxocariasi la temperatura aumenta solitamente a mezzogiorno o alla sera, accompagnata da un leggero brivido, più spesso di lieve entità, meno spesso febbrile. Una reazione termica si osserva solitamente durante il periodo delle manifestazioni polmonari (62% dei casi). La sindrome da danno polmonare si manifesta nel 65% dei pazienti affetti da toxocariasi viscerale e varia ampiamente: dai fenomeni catarrali alle gravi condizioni asmatiche. I pazienti soffrono di catarri ricorrenti, bronchiti e broncopolmoniti. Le preoccupazioni includono tosse secca, frequenti attacchi di tosse notturna e in alcuni casi grave mancanza di respiro con respiro asmatico e cianosi. All'auscultazione si sentono rantoli secchi, spesso umidi. Con la toxocariasi sono noti casi di sviluppo di polmonite grave, che si è verificata con complicazioni e si è conclusa con la morte. In diversi pazienti sotto la nostra supervisione che soffrivano di asma bronchiale da molto tempo, è stato possibile stabilire l'eziologia toxocariatica della malattia identificando un alto livello di anticorpi specifici. Cicli ripetuti di terapia specifica hanno portato al sollievo di manifestazioni specifiche della malattia e ad un graduale recupero completo. Uno studio simile condotto nei Paesi Bassi ha dimostrato che tra i bambini con asma bronchiale o bronchite ricorrente, la toxocariasi è stata rilevata con una frequenza del 19,2% (nel gruppo di controllo - 9,9%). L'esame radiografico, secondo i nostri dati, rivela infiltrati eosinofili multipli o singoli, pattern polmonari aumentati e un pattern di infiltrazione broncopolmonare nel 33,2% dei pazienti. Insieme alla sindrome da danno polmonare, molto spesso si verifica un aumento delle dimensioni del fegato (fino all'80% secondo le nostre osservazioni). Alla palpazione il fegato appare compatto, liscio e spesso teso. Circa il 20% dei pazienti ha una milza ingrossata, il 67% ha un ingrossamento dei linfonodi, fino alla linfoadenopatia sistemica, soprattutto nei bambini. I linfonodi sono piccoli, indolori e non fusi con i tessuti circostanti. Oltre alle manifestazioni elencate, il 46% dei pazienti da noi osservati presentava sindrome addominale (dolore addominale, gonfiore, nausea, talvolta vomito, diarrea). In 32 pazienti la malattia è accompagnata da vari tipi di eruzioni cutanee ricorrenti (eritematose, orticarioidi). Alla palpazione si rilevano piccole compattazioni nelle aree dell'eruzione cutanea. Un'indagine condotta nell'ambito dello studio già citato nei Paesi Bassi tra i bambini con diagnosi di eczema dovuto alla toxocariasi ha dimostrato che tra loro il 13,2% aveva titoli elevati di anticorpi specifici contro la toxocariasi. In alcuni casi, la toxocariasi si verifica con lo sviluppo di miocardite, apparentemente di natura allergica. Sono state descritte anche pancreatite eosinofila, varie lesioni renali e granulomi eosinofili nella mucosa rettale. Recentemente alcuni ricercatori, insieme a quelli viscerali e oculari, hanno individuato la forma neurologica della toxocariasi. Quando le larve di Toxocara migrano nel cervello, si manifestano segni di danno al sistema nervoso centrale sotto forma di convulsioni di tipo “piccolo male”, crisi epilettiformi, paresi e paralisi. Va notato che la frequenza di titoli elevati di anticorpi antitossici nei pazienti con crisi epilettiche è maggiore rispetto al gruppo di controllo di individui sani, ma è la stessa in quelli con una causa nota e sconosciuta di crisi epilettiche. Molto probabilmente, l'epilessia non è una conseguenza, ma solo un fattore predisponente all'infezione da toxocariasi. l'infezione da toxocariasi provoca anche vari disturbi neurologici, manifestati in cambiamenti nel comportamento: iperattività e influenza in una vasta gamma di reazioni comportamentali - apprendimento, esplorazione dell'ambiente esterno, risoluzione di una serie di problemi per uscire da una situazione difficile. Collegare direttamente tali fenomeni con la toxocariasi è molto problematico, tuttavia, uno degli studi sieroepidemiologici ha mostrato una connessione tra difficoltà di lettura, incapacità di concentrazione e basso livello di intelligenza con la malattia dei bambini in età prescolare affetti da toxocariasi (1984). Uno studio condotto su bambini di età compresa tra 1 e 15 anni a New York ha dimostrato che i bambini infetti da Toxocara presentavano deviazioni significative rispetto ai bambini sani in molti test neuropsicologici e nelle funzioni motorie e cognitive. Ad oggi sono stati descritti 2 casi di toxocariasi disseminata con danno simultaneo a fegato, polmoni e sistema nervoso centrale in pazienti immunocompromessi (uno durante radioterapia per un tumore maligno e uno durante trattamento con corticosteroidi per una malattia autoimmune).
Toxocariasi oculare. Lo sviluppo della toxocariasi oculare è associato all'infezione umana con un numero minimo di larve. I pazienti con toxocariasi oculare sono generalmente più anziani di quelli con toxocariasi viscerale, la risposta immunitaria alle infezioni non è così forte e i loro titoli di anticorpi specifici anti-toxocariasi sono generalmente bassi. I primi casi di toxocariasi oculare furono identificati all'inizio degli anni '50. nostro secolo, quando H. Wilder, dopo aver condotto un esame istologico di 46 occhi enucleati in bambini per retinoblastoma (24 casi), malattia di Coats, endoftalmite, trovò larve di nematodi o capsule ialine in 24 casi. Un cambiamento caratteristico era un ascesso eosinofilo con un centro necrotico. In 20 di questi 24 casi, la malattia è stata clinicamente classificata come retinoblastoma. Successivamente, la toxocariasi oculare cominciò a essere diagnosticata in diversi paesi con sufficiente coerenza. Clinicamente nei bambini, la malattia si manifesta sotto forma di strabismo, diminuzione della vista e leucocoria. Le larve possono essere rilevate durante l'esame oftalmologico, ad esempio nell'area del nervo ottico o nell'area maculare. Tutti i casi di toxocariasi oculare sono divisi in 2 gruppi principali: granulomi solitari ed endoftalmite cronica con essudazione. Quasi sempre, solo un occhio è affetto da toxocariasi. Con la toxocariasi oculare, di regola, non si trova più di una larva. Una forma peculiare di danno oculare durante la toxocariasi fu descritta da Hogan e colleghi nel 1965. La larva fu trovata alla periferia della retina in un bambino con pars planite cronica. Nel corpo vitreo era presente un essudato sotto forma di “palle di neve”. Secondo alcuni autori (Perkins, 1966), il 10% dei casi di uveite cronica sono associati a toxocariasi oculare. In alcuni casi (ad esempio, con la migrazione intraretinica della larva), durante l'oftalmoscopia è possibile osservare il movimento della larva e il paziente presenta uno scotoma migrante nel campo visivo. Il danno al nervo ottico causato dalla larva di Toxocara può portare alla cecità unilaterale. In questo caso il disco e la retina circostante sono infiltrati da linfociti ed eosinofili, le plasmacellule. Riassumendo i dati disponibili sui danni agli occhi dovuti alla toxocariasi, l'oftalmologo V.M. Cherednichenko (1985) identifica le seguenti forme:
1. granulomi nella parte posteriore dell'occhio, 2. granulomi periferici, 3. uveite, 4. pars planite, 5. endoftalmite cronica, 6. ascesso nel vitreo, 7. neurite ottica, 8. cheratite, 9. larve migratrici nel corpo vitreo.
Non esistono metodi affidabili per diagnosticare la toxocariasi oculare. In molti casi, la diagnosi è determinata solo dall'esame istologico. Brown (1970) riferì che dei 245 occhi da lui enucleati a causa della diagnosi di retinoblastoma, larve di Toxocara furono trovate in 88 (35,9%). Ulteriori metodi per diagnosticare la toxocariasi oculare sono le reazioni immunologiche (che non sono sempre informative in caso di toxocariasi oculare), l'ecografia e l'esame radiografico. Nel 1977, in casi dubbi di retinoblastoma, fu proposto di eseguire un test sierologico per la toxocariasi della camera anteriore puntata e nel 1979 una biopsia del corpo vitreo.
Incidenza della toxocariasi. Abbiamo calcolato il numero stimato di persone affette da toxocariasi viscerale nella Federazione Russa. Il numero previsto di pazienti tra i bambini sotto i 14 anni è di 184mila persone, nella fascia di età sopra i 14 anni - 366mila. In totale, il numero stimato di pazienti con toxocariasi può essere vicino a 550mila persone, ovvero 380 ogni 100mila abitanti. Per confronto, ricordiamo che lo stesso indicatore per l'ascariasi nel 1993 era 71,8. È abbastanza ovvio che la toxocariasi oculare è ancora più sottodiagnosticata della toxocariasi viscerale. Ciò emerge da un confronto con i dati degli USA, dove tra i 700-1000 casi di toxocariasi registrati annualmente dal Center for Disease Control (secondo gli specialisti del Centro le informazioni sono lungi dall'essere complete), 500-600 casi di toxocariasi oculare tenere conto della toxocariasi oculare, vale a dire 67%.
Diagnostica di laboratorio. Una delle manifestazioni principali e più costanti della forma viscerale della toxocariasi è l'eosinofilia persistente a lungo termine fino allo sviluppo di reazioni ematiche eosinofile-leucemoidi. Tipicamente, il livello relativo di eosinofili supera il 30% e in alcuni casi può raggiungere il 90%. In alcuni casi di toxocariasi oculare si osserva anche un elevato livello di eosinofilia (fino al 44%), ma in generale è meno pronunciato e non così costante. Anche il numero totale di leucociti aumenta a 15-20*109/l e, in alcuni casi, a 80*109/l. L’eosinofilia può persistere per mesi o addirittura anni. La puntura del midollo osseo rivela un'iperplasia eosinofila, la VES è solitamente aumentata, a volte in modo significativo. Con un lungo decorso della malattia, l'anemia dei pazienti aumenta gradualmente, il numero di globuli rossi diminuisce e il livello di emoglobina diminuisce. Il livello delle proteine sieriche totali aumenta a causa delle β-globuline. Nel primo periodo della malattia predominano le immunoglobuline di classe M, successivamente vengono rilevate le immunoglobuline di classe G. Il livello di immunoglobuline di classe E aumenta in modo particolarmente brusco, che in alcuni pazienti supera la norma di 25-30 volte. Con la toxocariasi dell'occhio, questi fenomeni non sono così pronunciati e possono essere assenti.
Valore diagnostico dei segni clinici della toxocariasi viscerale in punti
(secondo L.T. Glickman, 1978) Segni: Valore diagnostico in punti:
Eosinofilia del sangue periferico (5)
Leucocitosi (4)
Aumento della VES (4)
Iperglobulinemia (3)
Ipoalbuminemia (3)
Anemia (2)
Febbre ricorrente (3.5)
Sindrome polmonare (3.5)
Segni radiografici di danno polmonare (2)
Aumento delle dimensioni del fegato (4)
Disturbi neurologici (1.5)
Lesioni cutanee (1)
Linfoadenopatia (1)
Con una combinazione di sintomi e segni superiore a 12 punti in totale, l'ipotesi di toxocariasi può essere considerata sufficientemente giustificata dal punto di vista clinico per esaminare il paziente per toxocariasi utilizzando un metodo immunologico. Una storia epidemiologica è essenziale per fare una diagnosi di toxocariasi. L'indicazione di tenere un cane in famiglia o di avere uno stretto contatto con cani, o la presenza dell'abitudine alla pica indicano un rischio relativamente elevato di contrarre la toxocariasi. L'allergia al pelo degli animali è comune anche nei casi di infestazione toxocarica.
Trattamento. Il problema della terapia specifica per la toxocariasi non può essere considerato risolto. Risultati soddisfacenti si ottengono con l'uso di mintezol (tiabendazolo), vermox (metobendazolo) e ditrazina (dietilcarbamazina). Il mintezol viene solitamente prescritto alla dose di 25-50 mg per 1 kg di peso corporeo al giorno per 5-10 giorni consecutivi. Gli effetti collaterali osservati associati all'influenza di Mintezol sono a breve termine e scompaiono rapidamente dopo la sospensione del farmaco. Questi includono perdita di appetito, nausea, mal di testa, sonnolenza e dolore addominale. Il farmaco viene rapidamente assorbito dal tratto gastrointestinale ed escreto dai reni. Non sono stati rilevati effetti negativi sul sistema cardiovascolare e sugli organi respiratori. Vermox viene prescritto, indipendentemente dall'età, 100 mg 2 volte al giorno per 2-4 settimane. Per gli adulti, la dose giornaliera viene talvolta aumentata a 300 mg. Gli effetti collaterali (dolore addominale, nausea, diarrea) si verificano molto raramente. Il citrato di ditrazina viene prescritto alla dose di 2-6 mg per 1 kg di peso corporeo al giorno per 2-4 settimane. Durante il trattamento possono verificarsi reazioni avverse: mal di testa, vertigini, nausea e talvolta febbre. Uno studio comparativo sull’efficacia del tiabendazolo e dell’albendazolo nel trattamento della toxocariasi viscerale e oculare, condotto nel 1989 a Zurigo (D. Sturchler, P. Schubarth) ha dimostrato l’elevata efficacia di entrambi i farmaci se usati alla dose di 10 mg/kg peso corporeo per 5 giorni. Quando possibile, gli autori raccomandano di preferire l'albendazolo. Poiché questi farmaci hanno un effetto teratogeno, non dovrebbero essere usati per trattare le donne in gravidanza. Gli effetti collaterali che si verificano quando si utilizzano i farmaci di cui sopra possono essere associati non solo all'effetto tossico dei farmaci antielmintici, ma anche alla reazione del corpo alla morte delle larve di Toxocara. Pertanto, durante il processo di trattamento è consigliabile prescrivere anche antistaminici.
I criteri per l'efficacia del trattamento dovrebbero essere considerati una progressiva diminuzione del livello di eosinofilia, una regressione delle manifestazioni cliniche della malattia, una diminuzione del livello di anticorpi specifici fino a un livello pari a 1:800 e inferiore. Con un lento miglioramento dei parametri clinici e di laboratorio, i cicli di terapia specifica vengono effettuati dopo 3-4 mesi. A volte sono necessari 4-5 cicli di trattamento.
Anisakiasi
La diagnosi viene effettuata sulla base delle informazioni sul consumo di aringa cruda, merluzzo, quadro clinico e esame morfologico del materiale bioptico. A volte le larve possono essere trovate nel vomito o nelle feci di un paziente. Attualmente sono stati sviluppati criteri per l'identificazione morfologica delle larve di anisakidi. Vengono utilizzati anche test sierologici con un antigene specifico. Nessun trattamento è stato sviluppato. Puoi aspettarti un effetto dall'uso di mebendazolo e tiabendazolo. In caso di ostruzione intestinale, l'area interessata dell'intestino viene resecata. Con un trattamento tempestivo, la prognosi è buona.
Le misure preventive comprendono l'adesione alla tecnologia corretta per la lavorazione del pesce (eviscerazione rapida), la conservazione del pesce nei congelatori a una temperatura di -20°C per 60 ore e la corretta cottura del pesce.
Angiostrongilosi
Gnatostomiasi
Dirofilariosi
È stato descritto l'effetto dell'uso di tiabendazolo e mebendazolo.
Sindrome da eosinofilia tropicale
Questa sindrome era precedentemente associata alla migrazione dei nematodi animali nell'uomo. La maggior parte degli autori ritiene che il fattore eziologico sia la migrazione delle microfilarie di W. bancrofti. L'eosinofilia tropicale corrisponde a focolai endemici di wucheriosi (India, Sri Lanka, Isole del Pacifico). La malattia è caratterizzata dallo sviluppo della sindrome polmonare a lungo termine del tipo della sindrome di Loeffler e dell'endomiocardite, con conseguente endomiocardiofibrosi. Si osserva ipereosinofilia persistente nel sangue e talvolta sindrome epatolienale. Sindrome polmonare nell'eosinofilia tropicale - La sindrome di Weingarten è patogeneticamente e clinicamente vicina alla malattia che si sviluppa quando una persona viene infettata da specie aliene di elminti. Questa sindrome si manifesta con parossismi di tosse, spesso con una grave componente asmatica, mancanza di respiro, dolore toracico, febbre moderata, meno spesso alta, ipereosinofilia, VES elevata, ipergammaglobulinemia. L'esame radiografico rivela un pattern bronco-vascolare accentuato nei polmoni, ombre maculate a piccolo fuoco, soprattutto nei campi polmonari medio e inferiore, con pesantezza radiale proveniente dall'ilo dei polmoni. Quando si effettuano diagnosi differenziali, è necessario ricordare la possibilità di sviluppare malattie idiopatiche, in particolare la sindrome di Loeffler sullo sfondo della vasculite eosinofila.