L'emoglobinuria parossistica notturna (EPN) è una malattia rara (orfana) con un quadro clinico vario. La perdita della proteina GPI-AP, dovuta a mutazioni somatiche sulla superficie cellulare, è un anello importante nella patogenesi. Emolisi, trombosi e citopenie sono manifestazioni cliniche caratteristiche. Il gold standard per la diagnosi è la citometria a flusso. Il trapianto di cellule staminali e l’agente biologico eculizumab rappresentano le opzioni terapeutiche più moderne.
Metodi moderni di diagnosi e trattamento dell'emoglobinuria parossistica notturna
L'emoglobinuria parossistica notturna (APG) è una malattia rara (orfana) con presentazione clinica varia. La perdita della proteina GPI-AP, dovuta a mutazioni somatiche sulla superficie cellulare, è l'elemento principale nella patogenesi. Emolisi, trombosi e citopenia sono sintomi caratteristici. Il gold standard della diagnosi è la citometria a flusso. Il trapianto di cellule staminali e l'agente biologico ekulizumab sono i metodi di trattamento più moderni.
L’emoglobinuria parossistica notturna (EPN) è una malattia rara (orfana). Il tasso di mortalità per EPN è di circa il 35% entro 5 anni dall’esordio della malattia. Sfortunatamente, la maggior parte dei casi rimane non diagnosticata. Le manifestazioni cliniche sono varie e si possono osservare pazienti con diagnosi quali anemia aplastica, trombosi ad eziologia sconosciuta, anemia emolitica, anemia refrattaria (sindrome mielodisplastica). L'età media dei pazienti è di 30-35 anni.
L'anello principale della patogenesi è la perdita, dovuta a mutazione somatica, della proteina GPI-AP (proteina ancorante del glicosil-fosfatidilinositolo) sulla superficie cellulare. Questa proteina è un'ancora, se persa alcune proteine importanti non possono attaccarsi alla membrana. Molte proteine perdono la capacità di unirsi, che viene utilizzata per diagnosticare l'EPN mediante immunofenotipizzazione (eritrociti CD59 -, granulociti CD16 -, CD24 -, monociti CD14 -). Le cellule con segni dell'assenza delle proteine studiate sono chiamate clone EPN. Tutte queste proteine devono interagire con le proteine del sistema del complemento, in particolare con C3b e C4b, distruggendo i complessi enzimatici delle vie classiche e alternative del complemento e arrestando così la reazione a catena del complemento. L'assenza delle suddette proteine porta alla distruzione cellulare quando viene attivato il sistema del complemento.
Esistono tre principali sindromi cliniche nella EPN: emolitica, trombotica, citopenica. Ogni paziente può avere una, due o tutte e tre le sindromi. La forma “classica” è la manifestazione della malattia sotto forma di grave emolisi ± trombosi; il midollo osseo in questa forma è ipercellulare. Esiste una forma separata di combinazione di EPN e insufficienza del midollo osseo (EPN + anemia aplastica, EPN + sindrome mielodisplastica), quando non ci sono manifestazioni cliniche pronunciate, ma ci sono segni di laboratorio indiretti di emolisi. Infine, esiste una terza forma, subclinica, in cui non sono presenti segni clinici e di laboratorio di emolisi, ma è presente insufficienza midollare e un piccolo clone EPN (≤ 1%).
L'emolisi è in gran parte associata all'assenza della proteina CD59 (inibitore di membrana della lisi reattiva (MIRL)) sulla superficie dei globuli rossi. L'emolisi nella EPN è intravascolare, quindi possono comparire urine scure (emosiderinuria) e grave debolezza. Gli esami di laboratorio indicano una diminuzione dell'aptoglobina (una reazione di difesa fisiologica durante l'emolisi), un aumento della lattato deidrogenasi (LDH), un test positivo per l'emoglobina libera nelle urine (emosiderinuria), una diminuzione dell'emoglobina con conseguente aumento dei reticolociti e un aumento della frazione di bilirubina non legata. Per diagnosticare la EPN vengono utilizzati il test Hem (emolisi dei globuli rossi mediante l'aggiunta di alcune gocce di acido a un campione di sangue) e il test del saccarosio (l'aggiunta di saccarosio attiva il sistema del complemento).
Attualmente si ritiene che l'emolisi avvenga quasi costantemente, ma abbia periodi di intensificazione. Una grande quantità di emoglobina libera innesca una cascata di manifestazioni cliniche. L'emoglobina libera si lega attivamente all'ossido nitrico (NO), portando ad un'alterata regolazione del tono della muscolatura liscia, dell'attivazione e dell'aggregazione piastrinica (dolore addominale, disfagia, impotenza, trombosi, ipertensione polmonare). L'emoglobina libera che non si lega all'aptoglobina danneggia i reni (tubulonecrosi acuta, nefropatia pigmentaria) e dopo alcuni anni può portare all'insufficienza renale. L'urina scura al mattino è dovuta all'attivazione del sistema del complemento dovuta all'acidosi respiratoria durante il sonno. L'assenza di urine scure in alcuni pazienti in presenza di altri segni di laboratorio di emolisi (aumento di LDH) non contraddice la diagnosi ed è spiegata dal legame dell'emoglobina libera con l'aptoglobina e l'ossido nitrico, riassorbimento dell'emoglobina nei reni.
La trombosi viene diagnosticata nel 40% dei pazienti ed è la principale causa di morte; la trombosi delle vene del fegato (sindrome di Budd-Chiari) e l'embolia polmonare sono più comuni. La trombosi nella EPN ha le sue caratteristiche: spesso coincide con episodi di emolisi e si verifica nonostante la terapia anticoagulante e un piccolo clone EPN. Le basi fisiopatologiche della trombosi riguardano l'attivazione piastrinica dovuta alla carenza di CD59, l'attivazione endoteliale, la fibrinolisi compromessa, la formazione di microparticelle e il rilascio di fosfolipidi nel sangue come risultato dell'attivazione del sistema del complemento. Numerosi autori indicano un aumento dei D-dimeri e del dolore addominale come i principali predittori di trombosi.
La patogenesi della sindrome da insufficienza midollare nella EPN non è chiara. Nel midollo osseo coesistono cellule staminali normali (GPI+) e cellule con una mutazione (GPI-). La comparsa di un piccolo clone EPN (meno dell'1%) viene spesso osservata in pazienti con anemia aplastica e sindrome mielodisplastica.
Il gold standard per la diagnosi della EPN è l'immunofenotipizzazione delle cellule del sangue periferico per la presenza del clone EPN. La conclusione dello studio indica la dimensione del clone EPN negli eritrociti (CD 59 -), nei granulociti (CD16 -, CD24 -) e nei monociti (CD14 -). Un altro metodo diagnostico è FLAER (aerolisi della tossina inattiva marcata in modo fluorescente), un'aerolisi della tossina batterica etichettata con tag fluorescenti che si lega alla proteina GPI e avvia l'emolisi. Il vantaggio di questo metodo è la possibilità di testare tutte le linee cellulari in un campione, lo svantaggio è l'impossibilità di testare con un numero molto basso di granulociti, come si osserva nell'anemia aplastica.
Il trattamento può essere suddiviso in terapia di mantenimento, prevenzione della trombosi, immunosoppressione, stimolazione dell'eritropoiesi, trapianto di cellule staminali e trattamento con agenti biologici. La terapia di mantenimento comprende trasfusioni di globuli rossi, somministrazione di acido folico, vitamina B12 e integratori di ferro. La maggior parte dei pazienti affetti dalla forma “classica” di EPN dipende dalle trasfusioni di sangue. L'emocromatosi, con danni al cuore e al fegato, si osserva raramente nei pazienti affetti da EPN, poiché l'emoglobina viene filtrata nelle urine. Sono stati descritti casi di emosiderosi renale.
La prevenzione della trombosi viene effettuata con warfarin ed eparina a basso peso molecolare, l'INR dovrebbe essere al livello di 2,5-3,5. Il rischio di trombosi non dipende dalle dimensioni del clone EPN.
L'immunosoppressione viene effettuata con ciclosporina e immunoglobulina antitimocitaria. Durante l'emolisi acuta, il prednisolone viene utilizzato in un breve ciclo.
Il trapianto di cellule staminali è l’unico metodo che offre una possibilità di guarigione completa. Sfortunatamente, le complicazioni e le difficoltà nella selezione dei donatori associate al trapianto allogenico limitano l’uso di questo metodo. Il tasso di mortalità dei pazienti affetti da EPN dopo trapianto allogenico è del 40%.
Dal 2002 il farmaco eculizumab, che è un agente biologico, è utilizzato in tutto il mondo. Il farmaco è un anticorpo che blocca la componente C5 del sistema del complemento. L'esperienza con l'uso ha dimostrato un aumento della sopravvivenza, una diminuzione dell'emolisi e della trombosi e un miglioramento della qualità della vita. .
Caso clinico della variante “classica” della EPN.
Paziente D., 29 anni. Reclami di debolezza, sclera gialla, urina scura al mattino, alcuni giorni l'urina è gialla, ma torbida, con un odore sgradevole. Nel maggio 2007 è apparsa per la prima volta l'urina scura. Nel settembre 2007 è stata visitata presso il Centro di ricerca ematologica (HRC), Mosca. Sulla base della presenza di un test Hem positivo e di un test del saccarosio, rilevamento nel sangue del 37% (norma - 0) di un clone di eritrociti con immunofenotipo CD55-/CD59-, emosiderinuria, anemia, reticolocitosi nel sangue fino a 80 % (norma - 0,7-1%), iperbilirubinemia A causa della bilirubina indiretta, è stata fatta una diagnosi: EPN, folato secondario e anemia da carenza di ferro.
L'emolisi si è intensificata durante la gravidanza nel 2008. Nel giugno 2008, alla 37a settimana, è stato eseguito un taglio cesareo a causa del distacco parziale della placenta e del pericolo di ipossia fetale. Il periodo postoperatorio è stato complicato da insufficienza renale acuta e grave ipoproteinemia. Sullo sfondo della terapia intensiva, l'insufficienza renale acuta si è risolta il quarto giorno, la conta ematica è tornata alla normalità e la sindrome dell'edema è stata alleviata. Una settimana dopo, la temperatura sale a 38-39 ° C, debolezza, brividi. È stata fatta una diagnosi di metroendometrite. La terapia si è rivelata inefficace, è stata eseguita l'asportazione dell'utero e delle tube. Il periodo postoperatorio è stato complicato da insufficienza epatica con sindromi di colestasi, citolisi, infiammazione mesenchimale, grave ipoproteinemia e trombocitopenia. Secondo i dati ecografici, è stata diagnosticata la trombosi delle vene native del fegato e della vena porta. Sono state effettuate terapia antibatterica e anticoagulante, somministrazione di epatoprotettori, prednisolone, terapia sostitutiva con FFP, EMOLT e tromboconcentrato.
È stata riammessa al Centro statale di ricerca a causa della trombosi delle vene portali e native del fegato, della trombosi dei piccoli rami dell'arteria polmonare, dello sviluppo di complicazioni infettive e del rapido aumento dell'ascite. La terapia anticoagulante intensiva e la terapia antibiotica hanno portato alla ricanalizzazione parziale della vena porta e delle vene del fegato ed è stata osservata una diminuzione dell'ascite. Successivamente al paziente è stata somministrata per lungo tempo eparina a basso peso molecolare – Clexane.
Attualmente, secondo gli indicatori di laboratorio, il paziente continua ad avere emolisi - una diminuzione dell'emoglobina a 60-65 g/l (normale 120-150 g/l), reticolocitosi fino all'80% (normale - 0,7-1%), e aumento del livello di LDH a 5608 U/ l (normale -125-243 U/l), iperbilirubinemia fino a 300 µmol/l (normale - 4-20 µmol/l). Immunofenotipizzazione del sangue periferico: il valore totale del clone eritrocitario EPN è 41% (normale - 0), granulociti - FLAER-/CD24- 97,6% (normale - 0), monociti - FLAER-/CD14- 99,3% (normale - 0 ). La terapia sostitutiva continua viene effettuata con globuli rossi lavati (2-3 trasfusioni ogni 2 mesi), acido folico, integratori di ferro e vitamina B12. Dato il rischio trombogenico molto elevato si effettua terapia con warfarin (INR – 2,5). Il paziente è stato inserito nel registro nazionale della PNG per la pianificazione del trattamento con eculizumab.
Caso clinico di una combinazione di anemia aplastica ed EPN.
Paziente E., 22 anni. Reclami di debolezza generale, acufeni, gengive sanguinanti, lividi sul corpo, perdita di peso di 3 kg, aumento della temperatura corporea a 38 gradi.
L'esordio della malattia è graduale, intorno ad 1 anno, quando cominciano a comparire dei lividi sul corpo. Sei mesi fa è iniziato il sanguinamento delle gengive e la debolezza generale è aumentata. Nell'aprile 2012 è stata registrata una diminuzione dell'emoglobina fino a 50 g/l. Nel Central District Hospital la terapia con integratori di vitamina B12 e ferro non ha prodotto effetti positivi. Nel reparto di ematologia del Republican Clinical Hospital: anemia grave, HB - 60 g/l, leucopenia 2,8 × 10 9 / l (normale - 4,5-9 × 10 9 / l), trombopenia 54 × 10 9 / l (normale - 180-320 × 10 9 /l), aumento LDH - 349 U/l (normale 125-243 U/l).
Secondo la biopsia dell'aspirato del midollo osseo, c'è una diminuzione della linea dei megacariociti. Immunofenotipizzazione del sangue periferico: il valore totale del clone eritrocitario EPN è 5,18%, granulociti - FLAER-/CD24- 69,89%, monociti - FLAER-/CD14- 70,86%.
Il paziente ha ricevuto tre trasfusioni di globuli rossi. Attualmente si sta valutando la possibilità del trapianto allogenico di cellule staminali o della terapia biologica.
AV. Kosterina, A.R. Akhmadeev, M.T. Savinova
Università medica statale di Kazan
Ospedale Clinico Repubblicano del Ministero della Salute della Repubblica del Tatarstan, Kazan
Anna Valentinovna Kosterina – assistente presso il Dipartimento di Terapia Ospedaliera del KSMU
Letteratura:
1. Luzzatto L. Emoglobinuria parossistica notturna. Ematologia 2000 // Programma educativo dell'American Society of Hematology. - 2000. - R. 28-38.
2. Parker C., Omine M., Richards S. et. al. per il gruppo di interesse internazionale EPN. Diagnosi e gestione dell'emoglobinuria parossistica notturna // Sangue. - 2005. -Vol. 106, n. 12. - R. 3699-709.
3. Hillman P., Lewis S.M., Bessler M., Luzzatto L., Dacie J.V. Storia naturale dell'emoglobinuria parossistica notturna // N. Engl. J.Med. - 1995. -Vol. 333, n. 19. - R. 1253-8.
4. Brodsky R.A., Mukhina G.L., Li S. et. al. Rilevamento e caratterizzazione migliorati dell'emoglobinuria parossistica notturna utilizzando aerolisina fluorescente // Am. J. Clin. Pathol. - 2000. -Vol. 114, n. 3. - R. 459-66.
5. Hall C., Richards S., Hillman P. La profilassi primaria con warfarin previene la trombosi nell'emoglobinuria parossistica notturna (EPN) // Sangue. - 2003. -Vol. 102, n. 10. - R. 3587-91.
6. Kelly R.J., Hill A., Arnold L.M. et. al. Trattamento a lungo termine con eculizumab nell'emoglobinuria parossistica notturna: efficacia sostenuta e sopravvivenza migliorata // Sangue. - 2011. -Vol. 117, n. 25. - R. 6786-92.
L'emoglobinuria parossistica notturna (EPN) è una malattia acquisita che si manifesta con anemia emolitica persistente, emoglobinuria parossistica o persistente ed emolisi intravascolare. La rarità di questo tipo di anemia emolitica è caratterizzata dal fatto che la EPN colpisce 1 persona su mezzo milione, per lo più giovani.
Le cause della malattia sono attualmente sconosciute. Si presume che si verifichi a causa della presenza di un clone anormale di globuli rossi inclini all'emolisi intravascolare. A sua volta, l'inferiorità dei globuli rossi è una conseguenza di difetti strutturali e biochimici nella loro membrana. È noto che in una membrana difettosa viene attivata la perossidazione lipidica, che favorisce la rapida lisi dei globuli rossi; inoltre, nel processo patologico sono coinvolti cloni anormali di granulociti e piastrine. Il ruolo principale nell'insorgenza delle complicanze trombotiche della EPN appartiene alla distruzione intravascolare degli eritrociti e all'avvio della coagulazione del sangue da parte di fattori rilasciati durante questo processo. La EPN, di regola, inizia gradualmente e procede cronicamente con crisi periodiche. Le crisi sono provocate da infezioni virali, interventi chirurgici, stress psico-emotivo, mestruazioni e dall'uso di numerosi farmaci e alimenti.
Sintomi dell'emoglobinuria parossistica notturna
Sintomi della EPN durante una crisi:
- dolore parossistico nella cavità addominale;
- dolore nella regione lombare;
- ittero della pelle e della sclera; ipertermia; pastosità facciale;
- colore nero delle urine, soprattutto di notte;
- un forte calo della pressione sanguigna;
- ingrossamento transitorio della milza;
- cessazione della produzione di urina.
In alcuni casi, la crisi emolitica termina con la morte.
Sintomi della EPN al di fuori della crisi:
- debolezza generale;
- colore della pelle pallido con una tinta itterica;
- anemia;
- tendenza alla trombosi; ematuria; ipertensione; ingrossamento del fegato; dispnea; battito cardiaco; frequenti malattie infettive.
Diagnostica
- Esame del sangue: anemia (normocromica, successivamente ipocromica), leucocitopenia e trombocitopenia moderate, il livello di ferro nel siero è significativamente ridotto.
- Esame delle urine: colorazione nera, emoglobinuria, emosiderinuria, proteinuria. Il test della benzidina nelle urine di Gregersen è positivo.
- Il test specifico di Ham è positivo.
- Il test specifico di Hartmann è positivo.
- Puntura del midollo osseo: iperplasia della linea emopoietica rossa, ma nei casi più gravi si può osservare anche ipoplasia del midollo osseo e aumento della quantità di tessuto adiposo nel midollo osseo.
Trattamento dell'emoglobinuria parossistica notturna
Il trattamento della EPN è sintomatico e consiste principalmente in trasfusioni di sangue sostitutive, la cui quantità e frequenza dipendono dalla “risposta” a queste misure. Nel trattamento della EPN, il metandrostenolone viene utilizzato alla dose di 30-50 mg/die per almeno 2-3 mesi. La lotta contro l'ipoplasia del midollo osseo viene effettuata mediante l'uso endovenoso di immunoglobulina antitimocitaria alla dose di 150 mg/die per 4-10 giorni. Si consiglia di assumere integratori di ferro per os in piccole dosi. A volte i corticosteroidi ad alti dosaggi hanno un buon effetto. L'ipoplasia del midollo osseo con lo sviluppo di complicanze trombotiche sono indicazioni per il suo trapianto. Sono stati descritti casi isolati di guarigione dalla EPN; in alcuni casi, la durata di un decorso favorevole della malattia è di diversi decenni.
Farmaci essenziali
Ci sono controindicazioni. È necessaria una consulenza specialistica.
Catad_tema Malattie del sangue - articoli
ICD10: D61.1, D61.2, D61.3, D61.8, D61.9
Anno di approvazione (frequenza di revisione): 2014 (revisionato ogni 2 anni)
ID: KR121
Associazioni professionali:
- Società Nazionale di Ematologia
Approvato
Società russa di ematologi
Concordato
Consiglio Scientifico del Ministero della Salute della Federazione Russa__ __________201_
Criteri di qualità
Livello di prova
Misure diagnostiche
Eseguire un esame del sangue clinico avanzato
Sono stati eseguiti studi morfologici e citochimici del preparato di midollo osseo
È stato eseguito uno studio citogenetico sulle cellule del midollo osseo
È stato eseguito uno studio morfologico (istologico) di un preparato di midollo osseo
È stata eseguita una radiografia del torace e/o una tomografia computerizzata del torace e del cervello
Criteri di qualità basati sugli eventi (semantica, contenuto, processo).
È stato eseguito uno studio morfologico e/o istologico e/o citogenetico standard su un campione di midollo osseo
È stata effettuata terapia immunosoppressiva combinata (in assenza di controindicazioni)
È stata eseguita la tipizzazione HLA dei fratelli
È stata effettuata una consultazione presso il centro trapianti entro 3 mesi dal momento in cui è stato determinato il decorso refrattario
Criteri temporanei di valutazione della qualità
La terapia immunosoppressiva è stata eseguita entro 1 mese dalla conferma istologica e/o citogenetica della diagnosi (in assenza di controindicazioni mediche)
I parametri clinici ed ematologici sono stati valutati durante la terapia almeno 2 volte a settimana fino al raggiungimento di una risposta ematologica completa
È stato eseguito uno studio morfologico di un preparato di midollo osseo con una valutazione dell'ematopoiesi del midollo osseo dopo il completamento del programma terapeutico
È stato eseguito uno studio citogenetico standard su un preparato di midollo osseo (studio di almeno 20 metafasi) e/o uno studio sul midollo osseo utilizzando l'ibridazione fluorescente (nel caso in cui lo studio citogenetico non fosse informativo per identificare le anomalie caratteristiche della sindrome mielodisplastica)
Il clone dell'emoglobinuria parossistica notturna è stato determinato utilizzando la citometria a flusso altamente sensibile ogni 6-12 mesi, sono stati valutati i segni clinici e di laboratorio dell'emolisi
Prima della fase successiva del trattamento è stato eseguito uno studio morfologico e/o istologico e/o citogenetico standard
Sono stati effettuati cicli ripetuti di globulina antitimocitaria e tipizzazione HLA (per determinare la disponibilità di donatori di midollo osseo allogenici, in assenza di risposta dopo 3-6 mesi)
Bibliografia
1. Kokhno A.V., Pimenova M.A., Parovichnikova E.N., Domracheva E.V. S.V.G. Rilevazione di anomalie del cariotipo nascoste nella sindrome mielodisplastica. / S. V. G. Kokhno A.V., Pimenova M.A., Parovichnikova E.N., Domracheva E.V. // Ematologia e trasfusiologia – 2014. – T. 59 – N. 1 – 25–28 p.
- Anemia aplastica di Kulagin A.D. / Kulagin A.D. / ed. K.V.A. Lisukov I.A. – – Novosibirsk: Nauka, 2008. vol. La scienza.
- Mikhailova E.A. Protocollo per il programma di trattamento dei pazienti con anemia aplastica: terapia immunosoppressiva combinata / ed. V.G.Savchenko. Mosca: Praktika, 2012. – 135–150 pp.
- L'affabile M.G. Evoluzione clonale nell'anemia aplastica. / M. G. Afable, R. V Tiu, J. P. Maciejewski // Ematologia Am. Soc. Ematolo. Educazione Programma – 2011. – T. 2011 – 90–5 p.
- Bacigalupo A. Strategie di trattamento per pazienti con grave anemia aplastica. / A. Bacigalupo // Trapianto di midollo osseo. – 2008. – T. 42 Suppl 1 – N. SUPPL.1 – S42–S44с.
- Borowitz M.J. Linee guida per la diagnosi e il monitoraggio dell'emoglobinuria parossistica notturna e dei disturbi correlati mediante citometria a flusso. / M. J. Borowitz, F. E. Craig, J. A. Digiuseppe, A. J. Illingworth, W. Rosse, D. R. Sutherland, C. T. Wittwer, S. J. Richards // Citometria B. Clin. Cytom. – 2010. – T. 78 – N. 4 – 211–30 p.
- Kulagin A. Valore prognostico della presenza di cloni di emoglobinuria parossistica notturna in pazienti con anemia aplastica trattati con immunosoppressione combinata: risultati di uno studio prospettico condotto a due centri / A. Kulagin, I. Lisukov, M. Ivanova, I. Golubovskaya, I. Kruchkova, S. Bondarenko, V. Vavilov, N. Stancheva, E. Babenko, A. Sipol, N. Pronkina, V. Kozlov, B. Afanasyev // Br. J. Ematolo. – 2014. – T. 164 – N. 4 – 546–554 pag.
- Marsh J.C.W. Linee guida per la diagnosi e la gestione dell'anemia aplastica / J. C. W. Marsh, S. E. Ball, J. Cavenagh, P. Darbyshire, I. Dokal, E. C. Gordon-Smith, J. Keidan, A. Laurie, A. Martin, J. Mercieca, S. B. Killick, R. Stewart, J. A. L. Yin // Fr. J. Ematolo. – 2009. – T. 147 – N. 1 – 43–70 p.
- Marsh J.C.W. Linee guida per la diagnosi e la gestione dell'anemia aplastica. / J. C. W. Marsh, S. E. Ball, J. Cavenagh, P. Darbyshire, I. Dokal, E. C. Gordon-Smith, J. Keidan, A. Laurie, A. Martin, J. Mercieca, S. B. Killick, R. Stewart, J. A. L. Yin / /Fr. J. Ematolo. – 2009. – T. 147 – N. 1 – 43–70 p.
- Marsh J.C.W. Gestione del paziente con anemia aplastica refrattaria: quali sono le opzioni? J. C. W. Marsh, A. G. Kulasekararaj – 2014. – T. 122 – 3561–3567 pp.
- Scheinberg P. Globulina antitimocitaria di cavallo come terapia di salvataggio dopo globulina antitimocitaria di coniglio per anemia aplastica grave / P. Scheinberg, D. Townsley, B. Dumitriu, P. Scheinberg, B. Weinstein, O. Rios, C. O. Wu, N. S. Young // Am . J. ematolo. – 2014. – T. 89 – N. 5 – 467–469 pag.
- Scheinberg P. Come tratto l'anemia aplastica acquisita. / P. Scheinberg, N. S. Young // Sangue – 2012. – T. 120 – N. 6 – 1185–96 p.
- Il giovane N.S. Epidemiologia dell'anemia aplastica // Difetto del midollo osseo. Sindr. - 1–46 secondi.
- Il giovane N.S. Il problema della clonalità nell’anemia aplastica: l’enigma del dottor Dameshek, riposato // Sangue. – 1992. – T. 79. – N. 6. – 1385–1392 p.
- Il giovane N.S. Meccanismi fisiopatologici nell'anemia aplastica acquisita. // Ematologia Am. Soc. Ematolo. Educazione Programma. – 2006. – 72–77 pag.
- Il giovane N.S. La relazione tra anemia aplastica ed EPN. // Interno J. ematolo. – 2002. – T. 76 Supplemento 2. – 168–172 pag.
- Zeng Y. La complessa fisiopatologia dell'anemia aplastica acquisita. / Y. Zeng, E. Katsanis // Clin. Esp. Immunolo. – 2015. – T. 180 – N. 3 – 361–70 pag.
- Vinogradova M.A. Complicazioni infettive in pazienti con anemia aplastica / Vinogradova M.A. – Mosca: tesi di laurea in scienze mediche / Istituzione statale “Centro di ricerca ematologica dell’Accademia russa delle scienze mediche”, 2009.
Appendice A1. Composizione del gruppo di lavoro
Voitsekhovsky V.V. dottore, Blagoveshchensk
Vopilina N.A. Ospedale clinico regionale GBUZ Tambov dal nome. V.D.Babenko", Tambov
Gaponova TV Candidato di scienze mediche, vicedirettore generale del Centro scientifico ematologico dell'istituzione di bilancio dello Stato federale del Ministero della sanità russo, Mosca
Golubeva M.E.. "Centro ematologico cittadino" presso l'istituto sanitario comunale di bilancio "GKP n. 5", perm
Kaporskaya T.S. Candidato di Scienze Mediche, Capo del Dipartimento di Ematologia, Ospedale Clinico Regionale dell'Ordine del Distintivo d'Onore di Irkutsk, Irkutsk,
Kljasova G.A. Dottore in Scienze Mediche, Professore, Direttore del Laboratorio Scientifico e Clinico di Microbiologia, Centro di Ricerca Ematologica dell'Istituto di Bilancio dello Stato Federale del Ministero della Sanità russo, Mosca,
Konstantinova T.S. Direttore del Dipartimento di Ematologia, Centro Regionale di Ematologia, Ospedale Clinico Regionale n. 1 di Sverdlovsk, Ekaterinburg,
Kulagin d.C. Dottore in scienze mediche, vice primario presso la clinica dell'istituto statale di istruzione di bilancio di istruzione professionale superiore "Università medica statale di San Pietroburgo". acad. IP Pavlov" Ministero della Sanità russo, Istituto di ricerca di ematologia e trapianto pediatrica di San Pietroburgo dal quale prende il nome. R.M.Gorbacheva,
Lapin V.A. Candidato in scienze mediche, capo del dipartimento di ematologia, Ospedale clinico regionale di Yaroslavl, Yaroslavl
Mikhailova E.A. Dottore in Scienze Mediche, Professore, Ricercatore Capo presso il Dipartimento di Chemioterapia per le Neoplasie Ematologiche e le Depressioni Emopoietiche, Istituto di Bilancio dello Stato Federale, Centro Scientifico Ematologico del Ministero della Salute della Russia, Mosca,
Parovichnikova E.N. Dottore in Scienze Mediche, Direttore del Dipartimento Scientifico e Clinico di Chemioterapia dell'Emoblastosi, della Depressione Emopoietica e del Trapianto di Midollo Osseo, Istituzione Finanziaria dello Stato Federale, Centro di Ricerca Ematologica del Ministero della Salute della Russia, Mosca,
Ploskikh M.A. GBUZ PC "Ospedale Clinico Regionale di Perm", Perm
Savchenko V.G. Accademico, dottore in scienze mediche, professore, direttore generale del Centro di ricerca ematologica dell'istituzione di bilancio dello Stato federale del Ministero della sanità russo, Mosca,
Samoilova O.S. Candidato di scienze mediche, capo del dipartimento di ematologia, ospedale clinico regionale di Nizhny Novgorod della regione di Nizhny Novgorod. N.A. Semashko, Nizhny Novgorod,
Skripkina N.S. ematologo GAUZ JSC "Ospedale Clinico Regionale dell'Amur", Blagoveščensk,
Tikunova T.S. OGBUZ "Ospedale Clinico Regionale di Belgorod di St. Joasaph", Belgorod
Troitskaya V.V. Candidato di Scienze Mediche, Direttore del Dipartimento Scientifico e Clinico di Chemioterapia delle Neoplasie Ematologiche e delle Depressioni Ematopoietiche, Centro di Ricerca Ematologica dell'Istituto di Bilancio dello Stato Federale del Ministero della Salute della Russia, Mosca,
Ustinova E.N. Candidato di Scienze Mediche, Ricercatore presso il Dipartimento di Chemioterapia per le Neoplasie Ematologiche e le Depressioni dell'Ematopoiesi, Centro di Ricerca Ematologica dell'Istituto di Bilancio dello Stato Federale del Ministero della Salute della Russia, Mosca,
Chagorova TV GBUZ "Dispensario oncologico regionale", Penza
Specialisti in ematologia;
Specialisti in oncologia;
Terapisti specializzati;
Metodologia di raccolta delle prove
Metodi utilizzati per la raccolta/selezione delle prove: ricerca in banche dati elettroniche.
Descrizione dei metodi utilizzati per la raccolta/selezione delle evidenze: la base di evidenze per le raccomandazioni sono le pubblicazioni incluse nella Cochrane Library, nei database EMBASE e MEDLINE. La profondità della ricerca è stata di 10 anni.
|
Livelli di prova |
Descrizione |
|
Meta-analisi di alta qualità, revisioni sistematiche di studi randomizzati e controllati (RCT) o RCT con rischio molto basso di bias |
|
|
Meta-analisi ben condotte, sistematiche o RCT con basso rischio di bias |
|
|
Meta-analisi, sistematiche o RCT con un alto rischio di bias |
|
|
Revisioni sistematiche di alta qualità di studi caso-controllo o di coorte. Revisioni di alta qualità di studi caso-controllo o di coorte con rischio molto basso di effetti confondenti o bias e moderata probabilità di causalità |
|
|
Studi caso-controllo o di coorte ben condotti con rischio moderato di effetti confondenti o bias e moderata probabilità di causalità |
|
|
studi caso-controllo o di coorte con un alto rischio di effetti confondenti o bias e una moderata probabilità di causalità |
|
|
Studi non analitici (ad esempio: case report, serie di casi |
|
|
Opinione di un esperto |
Metodi utilizzati per valutare la qualità e la forza delle prove:
Consenso degli esperti;
Metodi utilizzati per analizzare le prove:
Revisioni sistematiche con tabelle di evidenza.
Descrizione dei metodi utilizzati per analizzare le prove:
Quando si selezionano le pubblicazioni come potenziali fonti di prova, la metodologia utilizzata in ciascuno studio viene esaminata per garantirne la validità. L’esito dello studio influenza il livello di evidenza assegnato alla pubblicazione, che a sua volta influenza la forza delle raccomandazioni che ne derivano.
L’esame metodologico si basa su diverse domande chiave che si concentrano su quelle caratteristiche del disegno dello studio che hanno un impatto significativo sulla validità dei risultati e delle conclusioni.
Il processo di valutazione può indubbiamente essere influenzato dal fattore soggettivo. Per ridurre al minimo potenziali bias, ogni studio è stato valutato in modo indipendente, vale a dire almeno due membri indipendenti del gruppo di lavoro. Eventuali differenze nelle valutazioni sono state discusse da tutto il gruppo nel suo complesso. Se era impossibile raggiungere un consenso, veniva coinvolto un esperto indipendente.
Tabelle delle prove:
le tabelle delle prove sono state completate dai membri del gruppo di lavoro.
Metodi utilizzati per formulare raccomandazioni:
consenso degli esperti.
Indicatori di buona pratica (Good Prastic Points – GPPs):
Analisi economica:
Non è stata effettuata alcuna analisi dei costi e le pubblicazioni di farmacoeconomia non sono state esaminate.
Valutazione di esperti esterni;
Valutazione di esperti interni.
|
Descrizione |
|
|
Almeno una meta-analisi, revisione sistematica o RCT valutato 1++, direttamente applicabile alla popolazione target e che dimostri robustezza dei risultati, o insieme di prove che includono risultati dello studio classificati 1+, direttamente applicabili alla popolazione target e che dimostrano la robustezza complessiva dei risultati |
|
|
un insieme di prove consistente in risultati di studio classificati 2++, direttamente applicabili alla popolazione target e che dimostrino la robustezza complessiva dei risultati, o prove estrapolate da studi classificati 1++ o 1+ |
|
|
un insieme di prove costituito da risultati di studio classificati 2+, direttamente applicabili alla popolazione target e che dimostrano la robustezza complessiva dei risultati; O prove estrapolate da studi classificati 2++ |
|
|
Prove di livello 3 o 4; O prove estrapolate da studi classificati 2+ |
|
Queste bozze di raccomandazioni sono state sottoposte a revisione paritaria da esperti indipendenti a cui è stato chiesto di commentare principalmente la misura in cui l’interpretazione delle prove alla base delle raccomandazioni era chiara.
Sono stati ricevuti commenti da medici di base e terapisti locali riguardo alla chiarezza delle raccomandazioni e alla loro valutazione dell'importanza delle raccomandazioni come strumento di lavoro nella pratica quotidiana.
Una versione preliminare è stata inviata anche a un revisore non medico per commenti dal punto di vista del paziente.
RCHR (Centro Repubblicano per lo Sviluppo Sanitario del Ministero della Salute della Repubblica del Kazakistan)
Versione: Protocolli clinici del Ministero della Salute della Repubblica del Kazakistan - 2015
Emoglobinuria parossistica notturna [marchiafava-micheli] (D59.5)
Oncoematologia
informazioni generali
Breve descrizione
Consigliato
Consigli degli esperti
RSE presso il RVC “Centro Repubblicano”
sviluppo sanitario"
ministero della Salute
e sviluppo sociale
Repubblica del Kazakistan
del 9 luglio 2015
Protocollo n. 6
Definizione:
Emoglobinuria parossistica notturna (EPN)è una malattia ematica sistemica progressiva, acquisita, pericolosa per la vita, caratterizzata da emolisi intravascolare cronica, insufficienza del midollo osseo, aumento del rischio di complicanze trombotiche, insufficienza renale e ipertensione polmonare. .
Nome del protocollo: Emoglobinuria parossistica notturna negli adulti
Codice protocollo:
Codice ICD-10:
D59.5 - Emoglobinuria parossistica notturna.
Data di sviluppo del protocollo: 2015
Abbreviazioni utilizzate nel protocollo:
* - farmaci acquistati come parte di un'importazione una tantum;
AA - anemia aplastica;
AH - ipertensione arteriosa;
BP: pressione sanguigna;
ALaT - alanina aminotransferasi;
ACaT - aspartato aminotransferasi;
HIV - virus dell'immunodeficienza umana;
GGTP - gammaglutamil transpeptidasi;
ELISA - test immunoenzimatico;
TC - tomografia computerizzata;
LDH-lattato deidrogenasi;
MDS - sindrome mielodisplastica;
MPO - mieloperossidasi;
NE - naftil esterasi;
CBC: emocromo completo;
EPN - emoglobinuria parossistica notturna;
sPNH - emoglobinuria parossistica subclinica;
BMT - trapianto di midollo osseo;
Ecografia Doppler;
USDG - Ecografia Doppler;
Ultrasuoni: esame ecografico;
EF - frazione di eiezione;
FGDS - fibrogastroduodenoscopia;
RR - frequenza respiratoria;
FC - frequenza cardiaca;
ECG - elettrocardiografia;
EchoCG - ecocardiografia;
NMRT - tomografia a risonanza magnetica nucleare;
CD - cluster di differenziazione;
HLA - sistema antigene leucocitario umano;
Hb - emoglobina;
Ht - ematocrito;
Tr - piastrine.
Utenti del protocollo: terapisti, medici di base, oncologi, ematologi.
Scala del livello di evidenza.
|
Classificazione
Classificazione clinica:
Esistono 3 forme principali di EPN.
1. Forma classica caratterizzata da segni clinici e laboratoristici di emolisi intravascolare senza segni di altre malattie associate a insufficienza del midollo osseo (anemia aplastica (AA), sindrome mielodisplastica (MDS), mielofibrosi idiopatica).
2. EPN diagnosticata in pazienti con AA (AA/PNG), MDS (MDS/PNG) ed estremamente raramente con mielofibrosi (mielofibrosi idiopatica/EPN), quando in queste malattie si riscontrano segni clinici e/o laboratoristici di emolisi intravascolare e si determina nel sangue periferico un clone di cellule con fenotipo EPN.
3. Forma subclinica malattie ( AA/sPNH, MDS/sPNH, mielofibrosi idiopatica/sPNH), diagnosticato in pazienti senza segni clinici e laboratoristici di emolisi, ma in presenza di un clone minore di cellule con fenotipo EPN (solitamente<1 %). Следует отметить, что субклиническое течение ПНГ может отмечаться и при большем размере клона.
L'isolamento della forma subclinica di EPN non ha alcun significato clinico indipendente, ma è necessario per garantire il monitoraggio di tali pazienti a causa della probabilità di un aumento delle dimensioni del clone e della progressione dell'emolisi, che può prevalere tra le manifestazioni cliniche e richiedere un'adeguata terapia.
Tenendo conto del fatto che la forma subclinica della EPN nell'AA e/o nelle MDS non ha alcun significato clinico indipendente.
Forma PNG classica.
I pazienti con EPN classica presentano tipicamente una grave emolisi intravascolare con aumento dei livelli sierici di lattato deidrogenasi (LDH), reticolocitosi e diminuzione dei livelli di aptoglobina. Con questa variante della EPN non sono presenti segni morfologici definitivi di altre patologie del midollo osseo (AA, MDS, mielofibrosi) e le anomalie del cariotipo non sono caratteristiche
EPN nel contesto delle sindromi da insufficienza del midollo osseo (AA/EPN, MDS/EPN).
Nei pazienti con AA/EPN e MDS/EPN vengono diagnosticati segni clinici e di laboratorio di emolisi intravascolare. In diverse fasi dello sviluppo della malattia possono prevalere sintomi di insufficienza del midollo osseo o emolisi intravascolare e in alcuni casi esiste una combinazione di entrambi. Nonostante il fatto che nei pazienti con un piccolo clone EPN la malattia si manifesti solitamente con sintomi minimi e si notino solo segni di laboratorio di emolisi intravascolare, è necessario il monitoraggio (due volte all'anno). Ciò è dovuto al fatto che nel tempo è possibile l'espansione del clone con lo sviluppo di grave emolisi e un alto rischio di complicanze trombotiche.
Forma subclinica di EPN (AA/sPNH, MDS/sPNH).
I pazienti con EPN subclinica non presentano segni clinici o di laboratorio di emolisi. Piccole popolazioni di cellule carenti di GPIAP possono essere rilevate solo utilizzando la citometria a flusso altamente sensibile. La forma subclinica della EPN può essere diagnosticata nel contesto di malattie caratterizzate da compromissione della funzionalità del midollo osseo, principalmente AA e MDS. È molto importante monitorare attentamente questi pazienti per identificare segni di emolisi ed espansione clonale, poiché il 15-17% dei pazienti con AA/EPN subclinica hanno Col tempo si sviluppa la forma emolitica di AA/EPN.
Diagnostica
Elenco delle misure diagnostiche di base e aggiuntive:
Esami diagnostici di base (obbligatori) eseguiti in regime ambulatoriale:
· esame del sangue generale (contando i reticolociti in uno striscio);
· immunofenotipizzazione del sangue periferico per determinare la percentuale di eritrociti EPN di tipo I, II e III mediante citometria a flusso;
· esame del sangue biochimico (bilirubina totale, bilirubina diretta, LDH);
· Test di Coombs;
· mielogramma.
Ulteriori accertamenti diagnostici effettuati in regime ambulatoriale:
· determinazione della concentrazione di acido folico e vitamina B12;
· coagulogramma;
esame citogenetico standard del midollo osseo;
· analisi generale delle urine
· ELISA per marcatori di epatite virale;
· ELISA per i marcatori dell'HIV;
· ELISA per marcatori dei virus del gruppo dell'herpes;
· HLA - tipizzazione;
· ECG;
· Ultrasuoni degli organi addominali (fegato, milza, pancreas, cistifellea, linfonodi, reni, nelle donne - pelvi;
L'elenco minimo degli esami da effettuare in caso di ricovero programmato:
· esame del sangue generale (contaggio della leucemia, delle piastrine e dei reticolociti in uno striscio);
· mielogramma;
· gruppo sanguigno e fattore Rh
· esame del sangue biochimico (proteine totali, albumina, bilirubina totale, bilirubina diretta, creatinina, urea, ALaT, ASaT, GGTP, glucosio, LDH, proteina C-reattiva, fosfatasi alcalina);
· Test di Coombs;
· Ecografia degli organi addominali e della milza;
· Ultrasuoni degli organi pelvici - per le donne.
Esami diagnostici di base (obbligatori) effettuati a livello ospedaliero:
Analisi del sangue generale (contando leucemia, piastrine e reticolociti in uno striscio);
- immunofenotipizzazione del sangue periferico per determinare la percentuale di eritrociti EPN di tipo I, II e III mediante citometria a flusso;
- esame del sangue biochimico (bilirubina totale, bilirubina diretta, LDH);
- Test di Coombs
- mielogramma.
- esame citogenetico standard del midollo osseo;
- ELISA per marcatori di epatite virale;
- ELISA per i marcatori dell'HIV;
- ELISA per marcatori di virus del gruppo dell'herpes;
· Radiografia degli organi del torace.
Ulteriori esami diagnostici effettuati a livello ospedaliero:
· determinazione del livello di aptoglobina.
· gruppo sanguigno e fattore Rh;
· esame del sangue biochimico (proteine totali, albumina, bilirubina totale, bilirubina diretta, creatinina, urea, ALaT, ACaT, glucosio, LDH, GGTP, proteina C-reattiva, fosfatasi alcalina);
· metabolismo del ferro (determinazione del livello di ferro nel siero, della capacità totale di legare il ferro del siero e del livello di ferritina);
· Determinazione della concentrazione di acido folico e vitamina B12;
· coagulogramma;
· HLA - tipizzazione;
· analisi generale delle urine;
· determinazione del livello di emosiderina nelle urine;
· Test di Reberg-Tareev (determinazione della velocità di filtrazione glomerulare);
· ECG;
· Ultrasuoni degli organi addominali (fegato, milza, pancreas, cistifellea, linfonodi, reni, nelle donne - pelvi;
Radiografia degli organi del torace;
· Ecografia Doppler delle arterie e delle vene;
· ecocardiografia;
· FGDS (dilatazione delle vene dell'esofago);
monitoraggio quotidiano della pressione arteriosa;
· Monitoraggio ECG 24 ore su 24.
Misure diagnostiche effettuate nella fase di assistenza medica di emergenza:
· raccolta dei reclami e dell'anamnesi;
· esame fisico.
Criteri diagnostici per la diagnosi:
Denunce e anamnesi:
- debolezza;
- affaticabilità rapida;
- aumento del sanguinamento.
Anamnesi:
dovresti prestare attenzione a:
- debolezza a lungo termine;
- affaticamento rapido;
- frequenti malattie infettive;
- attacchi acuti di dolore nella regione lombare;
- scurimento delle urine, soprattutto di notte e al mattino;
- Sindrome di Budd-Chiari (trombosi della vena epatica);
- trombosi di varie localizzazioni;
- aumento del sanguinamento;
- la comparsa di eruzioni cutanee emorragiche sulla pelle e sulle mucose;
- registrazione del dispensario per AA o MDS.
Esame fisico[
8
]:
- una combinazione di pallore e giallo della pelle;
- eruzioni emorragiche - petecchie, ecchimosi di varie localizzazioni;
- fiato corto;
- tachicardia;
- fegato ingrossato;
- milza ingrossata.
Ricerca di laboratorio:
Se si sospetta EPN, la citometria a flusso consente di effettuare una diagnosi accurata. La citometria a flusso è il metodo più sensibile e informativo.
· Analisi del sangue generale: La conta dei reticolociti è solitamente elevata e gli strisci di sangue periferico mostrano globuli rossi morfologicamente non diversi dal normale. A causa dell'emolisi, nel sangue sono spesso presenti normoblasti e si nota policromatofilia. A causa della significativa perdita di ferro nelle urine, i pazienti affetti da EPN hanno un'elevata probabilità di sviluppare una carenza di ferro e quindi i globuli rossi assumono l'aspetto caratteristico dell'IDA: ipocromici con tendenza alla microcitosi. è spesso ridotto. Si può osservare anche pancitopenia di varia gravità. Tuttavia, a differenza dell'anemia aplastica, la reticolocitosi di solito si manifesta insieme alla citopenia.
· Chimica del sangue: La quantità di bilirubina, emoglobina libera e metaemoglobina nel siero del sangue aumenta. Ci sono segni di emolisi intravascolare, cioè una diminuzione o assenza di aptoglobina, un aumento di LDH, un aumento del livello di emoglobina libera e ferro nelle urine. Bassi livelli di aptoglobina sono costantemente osservati nell'emolisi intravascolare, ma si verificano anche nei casi di emolisi extravascolare, in particolare nell'emolisi cronica. Poiché l'aptoglobina è anche un reagente della fase acuta, la sua forte diminuzione o assenza è molto informativa.
· Nelle urine: Possono essere rilevate ematuria e proteinuria. Segni costanti di significato diagnostico sono l'emosiderinuria e la rilevazione di detriti ematici nelle urine.
· Studio morfologico: L'iperplasia eritroide viene rilevata nel midollo osseo. Spesso si rileva ipoplasia del midollo osseo e un ridotto contenuto di siderociti e sideroblasti.
· Immunofenotipizzazione: Un segno precoce e affidabile del fenotipo EPN è l'espressione delle proteine correlate a GPI: l'espressione di CD14 e CD48 è determinata sui monociti, CD16 e CD66b - sui granulociti, CD48 e CD52 - sui linfociti, CD55 e CD59 - sugli eritrociti, CD55, CD58.
Studi strumentali:
· Ultrasuoni degli organi addominali: aumento delle dimensioni del fegato e della milza.
· Ecografia Doppler delle arterie e delle vene: la presenza di trombosi di arterie e vene
· ECG: Conduzione compromessa degli impulsi nel muscolo cardiaco.
· EcoCG: segni di insufficienza cardiaca (HF)<60%), снижение сократимости, диастолическая дисфункция, легочная гипертензия, пороки и регургитации клапанов.
· TC/RMN corpo intero: rilevamento di trombosi (cerebrale, portale, ecc.)
· TAC del segmento toracico: alterazioni infiltrative nel tessuto polmonare, segni di ipertensione polmonare.
· FGDS: vene varicose dell'esofago.
· Spirografia: Test di funzionalità polmonare.
Indicazioni per la consultazione con specialisti:
· medico per la diagnostica e la terapia endovascolare radiografica - installazione di un catetere venoso centrale da un accesso periferico (PICC);
· epatologo – per la diagnosi e il trattamento dell'epatite virale;
· ginecologo - gravidanza, metrorragia, menorragia, consultazione quando si prescrivono contraccettivi orali combinati;
· dermatovenerologo - sindrome cutanea n.
· specialista in malattie infettive - sospetto di infezioni virali;
· cardiologo - ipertensione non controllata, insufficienza cardiaca cronica, disturbi del ritmo cardiaco e della conduzione;
· neurologo accidente cerebrovascolare acuto, meningite, encefalite, neuroleucemia;
· neurochirurgo - accidente cerebrovascolare acuto, sindrome da lussazione;
· nefrologo (efferentologo) - insufficienza renale;
· oncologo - sospetto di tumori solidi;
otorinolaringoiatra - per la diagnosi e il trattamento delle malattie infiammatorie dei seni paranasali e dell'orecchio medio;
· oculista - disturbi della vista, malattie infiammatorie dell'occhio e delle appendici;
· proctologo - ragade anale, paraproctite;
· psichiatra - psicosi;
· psicologo – depressione, anoressia, ecc.;
· rianimatore - trattamento della sepsi grave, dello shock settico, della sindrome da danno polmonare acuto con sindrome da differenziazione e condizioni terminali, installazione di cateteri venosi centrali.
· reumatologo - sindrome di Sweet;
· chirurgo toracico - pleurite essudativa, pneumotorace, zigomicosi polmonare;
· trasfusiologo – per la scelta del mezzo trasfusionale in caso di test antiglobulinico indiretto positivo, trasfusioni inefficaci, perdita ematica acuta e massiva;
· urologo - malattie infettive e infiammatorie dell'apparato urinario;
· tisiatra - sospetto di tubercolosi;
· chirurgo - complicanze chirurgiche (infettive, emorragiche);
· chirurgo maxillo-facciale - malattie infettive e infiammatorie del sistema dentofacciale.
Diagnosi differenziale
Diagnosi differenziale.
La diagnosi differenziale viene fatta con altri tipi di anemia emolitica e con la variante citopenica della EPN - con l'anemia aplastica.
Anemia da carenza di B-12. Spesso è necessaria la diagnosi differenziale tra EPN, che si manifesta con pancitopenia ed emolisi, e anemia da carenza di vitamina B12 con sindrome emolitica. In entrambe queste malattie, l'emolisi è piuttosto pronunciata. Le differenze tra queste malattie sono presentate nella tabella:
Tavolo. Differenze diagnostiche differenziali tra anemia da carenza di vitamina B12 ed EPN.
| Segni | Anemia da carenza di vitamina B12 con sindrome emolitica | EPN con pancitopenia |
| Essenza nosologica | Anemia causata dalla ridotta formazione dei globuli rossi e dell'emoglobina a causa della carenza di vitamina B-12 | Una variante dell'anemia emolitica acquisita - emolisi intravascolare, EPN |
| Urina nera | - | + |
| La comparsa di emosiderina ed emoglobina nelle urine | - | + |
| Aumento del contenuto di emobina libera nel sangue | - | + |
| Indice del colore del sangue | Aumento (anemia ipercromica) | Diminuzione (anemia ipocromica) |
| Contenuto di ferro nel sangue | Normale o leggermente aumentato | Ridotto |
| Tipo megaloblastico di emopoiesi (secondo il mielogramma) | Caratteristica | Non tipico |
| Neutrofili ipersegmentati nel sangue periferico | Caratteristica | Non tipico |
Anemia aplastica.È necessario differenziare l'AA dall'EPN quando l'anemia aplastica è accompagnata dallo sviluppo della sindrome emolitica. È noto che l'emoglobinuria parossistica notturna si manifesta con anemia, tendenza alla leucopenia e trombocitopenia. Pertanto, la situazione diagnostica può essere piuttosto complicata quando i sintomi di entrambe le malattie sono molto simili. Va sottolineato qui che i sintomi principali dell'emoglobinuria parossistica notturna sono l'emosiderinuria e l'emoglobinuria, nonché un alto livello di emoglobina libera nel plasma. Questi sintomi non sono presenti nell’anemia aplastica. La diagnosi differenziale di queste due malattie è presentata nella tabella.
Tavolo. Differenze diagnostiche differenziali tra AA con emolisi ed EPN.
| Segni | AA con emolisi | PNG |
| Passaggio di urina intensamente scura (nera), soprattutto di notte | - | + |
| Dolore all'addome e alla regione lombare | - | + |
| Trombosi dei vasi periferici delle estremità, dei reni e di altre localizzazioni | - | + |
| Milza ingrossata | - | + |
| Reticolocitosi | - | + |
| Alto livello di emoglobina libera nel sangue | - | + |
| Aplasia del midollo osseo | Caratteristica | È raro, più spesso c'è iperplasia della linea ematopoietica rossa |
| Iperplasia del tessuto ematopoietico nel campione bioptico del trapano | - | + |
| Emosiderinuria ed emoglobinuria | - | + |
Anemia emolitica autoimmune. A causa della presenza di emoglobinuria ed emosiderinuria nei pazienti, è necessario distinguere tra EPN con anemia emolitica autoimmune. Principali differenze diagnostiche differenziali:
· in caso di anemia emolitica autoimmune i test del saccarosio e dell'Hema sono negativi, in caso della malattia di Marchiafava-Micheli positivi;
· nell’anemia emolitica autoimmune con emolisine calde, il siero del paziente provoca l’emolisi dei globuli rossi del donatore.
Trattamento
Obiettivi del trattamento:
Raggiungere e mantenere la remissione (vedi paragrafo 15 - Indicatori di efficacia del trattamento).
Tattiche di trattamento:
Trattamento non farmacologico:
Modalità II: sicurezza generale.
Dieta: Si sconsiglia ai pazienti neutropenici di seguire una dieta specifica ( livello di evidenza B).
Trattamento farmacologico.
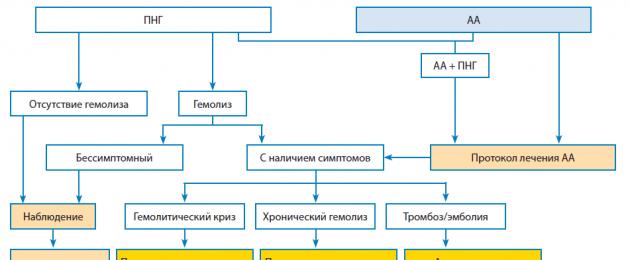
Nella figura è presentato l'algoritmo generale per il trattamento dei pazienti affetti da EPN, a seconda della forma della malattia e della gravità dell'emolisi.
Algoritmo di trattamento per i pazienti affetti da EPN.
Terapia con eclizumab.
Eculizumab è un anticorpo monoclonale umanizzato che si lega alla componente C5 del complemento. Ciò impedisce la scissione di C5 in C5a e C5b, inibendo così la formazione di citochine proinfiammatorie (tramite C5a) e MAC (tramite C5b).
Attualmente, uno studio multicentrico, randomizzato, in doppio cieco, controllato con placebo, TRIUMPH, ha valutato l’efficacia di eculizumab nello stabilizzare i livelli di emoglobina e nel ridurre la dipendenza dalle trasfusioni in 87 pazienti trasfusione-dipendenti affetti da EPN nel corso di 6 mesi di terapia.
Nello studio sono stati inclusi pazienti di età superiore a 18 anni sottoposti ad almeno 4 trasfusioni di mezzi contenenti eritrociti nell'ultimo anno, con un clone eritrocitario EPN di tipo III di almeno il 10%, un livello piastrinico di almeno 100 mila/μl, e un aumento dell'LDH pari a ≥1,5 normale. Tutti i pazienti hanno ricevuto un vaccino antimeningococcico prima di iniziare la terapia.
Il risultato principale dello studio è stata la stabilizzazione dei livelli di emoglobina nel 49% dei pazienti trattati con eculizumab (p<0,001) и снижение необходимости в трансфузиях в этой группе до нуля (в группе плацебо за 6 месяцев потребовалось от 6 до 16 трансфузий), а также улучшение качества жизни.
I risultati di questo studio hanno fornito la base per l’approvazione da parte della FDA di eculizumab per la EPN con emolisi dipendente da trasfusione.
Uno studio di R. Hillman et al. e i successivi studi prospettici presentano alcune limitazioni che rendono difficile estrapolare i risultati a tutti i pazienti affetti da EPN, descritti in dettaglio nel rapporto della FDA e nella revisione Cochrane di Arturo J Martí-Carvajal:
· L'efficacia è stata studiata solo in pazienti di età superiore a 18 anni;
· Anche i dati sui pazienti anziani sono limitati (solo 15 pazienti nello studio avevano più di 65 anni);
· Lo studio ha incluso solo pazienti trasfusione-dipendenti con emolisi;
· L'esiguo numero di pazienti con episodi trombotici e l'elevata frequenza di prescrizione della profilassi anticoagulante non consentono di valutare l'effetto di eculizumab sul rischio di complicanze trombotiche e sconsigliano l'uso di anticoagulanti nei pazienti trattati con eculizumab. La riduzione relativa della frequenza degli episodi trombotici durante la profilassi anticoagulante e la terapia con eculizumab è dell'81%;
· Il questionario sulla qualità della vita utilizzato non è stato validato per i pazienti affetti da EPN e il miglioramento della qualità della vita potrebbe essere associato solo ad un aumento dei livelli di emoglobina;
· Breve periodo di osservazione;
· Lo studio è stato sponsorizzato dal produttore del farmaco;
· Non sono disponibili dati sull'effetto di eculizumab rispetto al placebo sulla sopravvivenza globale, sul rischio di trasformazione in AML e MDS. Un aumento della sopravvivenza globale è stato dimostrato in un solo studio con controllo storico (periodo dal 1997 al 2004). Nel 2013 sono stati pubblicati i dati di tre studi prospettici su 195 pazienti con EPN ed emolisi che hanno mostrato un tasso di sopravvivenza del 97,6% a 36 mesi, ma non è stato effettuato alcun confronto con un gruppo placebo.
· I dati sull'uso di eculizumab nelle donne in gravidanza sono limitati. La gravidanza aumenta l’incidenza di gravi complicanze potenzialmente letali della EPN. Esiste un’elevata probabilità che eculizumab attraversi la barriera emato-placentare e il latte materno. A causa della rarità della malattia, attualmente non esistono studi controllati sull’efficacia di eculizumab nelle donne in gravidanza. Vengono descritti due casi di prescrizione di eculizumab a donne incinte dalla 4a e 5a settimana di gestazione con successive gravidanze non complicate e la nascita di bambini sani.
· Anche con un trattamento a lungo termine, della durata di circa 30 mesi, circa il 18% dei pazienti rimane dipendente dalle trasfusioni. Una possibile spiegazione di questo fenomeno è la partecipazione del frammento C3 del complemento ai processi di emolisi intravascolare, che non viene inibito da eculizumab.
Eculizumab può essere raccomandato per l'inclusione nel programma di trattamento per le seguenti categorie di pazienti con EPN classica di età superiore a 18 anni:
Dipendenza trasfusionale dovuta a emolisi cronica ( livello di evidenza A);
presenza di complicanze trombotiche ( livello di provaD);
gravidanza in pazienti affetti da EPN ( livello di provaD).
Nel determinare le indicazioni per la terapia con eculizumab, i soli livelli di LDH non dovrebbero essere presi in considerazione.
Modalità di somministrazione e dosaggio di eculizumab
Il farmaco viene somministrato per via endovenosa, mediante flebo, nell'arco di 25-45 minuti - per gli adulti.
Il ciclo di trattamento prevede un ciclo iniziale di 4 settimane seguito da un ciclo di mantenimento. Il ciclo iniziale è di 600 mg del farmaco una volta alla settimana per 4 settimane. Terapia di mantenimento: 900 mg nella 5a settimana, seguiti da 900 mg del farmaco ogni (14±2) giorni.
Emolisi "rivoluzionaria".
Il regime terapeutico standard con eculizumab è sufficiente per il blocco completo e stabile dell’emolisi mediata dal complemento. In alcuni pazienti, a causa di
peculiarità del metabolismo dei farmaci o durante le infezioni, può svilupparsi un'emolisi “interessante”. In questa situazione, i segni di emolisi compaiono entro 2-3 giorni
prima della successiva somministrazione di eculizumab. I pazienti possono sviluppare emoglobinuria, ritorno dei sintomi originali (mancanza di respiro, debolezza, spasmo della muscolatura liscia, ecc.), necessità di trasfusioni, aumento del livello di LDH, reticolociti e diminuzione del livello di aptoglobina. Il trattamento dell’emolisi improvvisa comporta la riduzione dell’intervallo tra le somministrazioni di eculizumab a 12 giorni o l’aumento della dose a 1.200 mg per 1-2 somministrazioni.
Prevenzione e trattamento dell'infezione menincoccica.
Durante il trattamento con eculizumab è necessario monitorare la comparsa dei sintomi dell'infezione e prescrivere tempestivamente antibiotici per le infezioni batteriche. Se viene diagnosticata un'infezione da meningococco, la successiva somministrazione del farmaco viene annullata.
Il meccanismo d’azione del farmaco eculizumab suggerisce un aumento del rischio di sviluppare infezione da meningococco ( Neisseria meningitidis) alla luce del suo utilizzo (livello di prova B).
Tutti i pazienti devono essere vaccinati contro il meningococco 2 settimane prima di iniziare il farmaco, nonché rivaccinazioni tra 2,5-3 anni di terapia. Il vaccino coniugato tetravalente maggiormente preferito è quello contro i sierotipi A, C, Y e W135. Se è necessario un trattamento urgente con eculizumab in un paziente non vaccinato, la terapia può essere iniziata nel contesto di un'appropriata profilassi antibiotica, che deve continuare per 2 settimane dopo la vaccinazione contro l'infezione meningococcica.
Terapia sintomatica.
In caso di trattamento con eculizumab, la terapia sintomatica prevede la somministrazione di acido folico (5 mg/die), vitamina B12 (in caso di carenza), integratori di ferro (in caso di carenza), anticoagulanti (warfarin, eparina a basso peso molecolare) per complicanze trombotiche, trasfusioni di sangue prodotti a seconda dei sintomi clinici, idratazione durante lo sviluppo di una crisi emolitica. Gli integratori di ferro devono essere prescritti con cautela a causa della possibilità di un aumento dell'emolisi.
Terapia anticoagulante.
Dopo un evento trombotico può essere raccomandata una terapia a lungo termine (per tutta la vita) con anticoagulanti (derivati cumarinici o eparine). La terapia per la sindrome di Budd-Chiari richiede che il paziente si trovi in un reparto chirurgico specializzato per la trombolisi locale e sistemica. La terapia anticoagulante per la prevenzione primaria della trombosi può essere indicata in casi selezionati quando viene rilevato un clone EPN in ≥ 50% dei granulociti e in presenza di rischi aggiuntivi di complicanze trombotiche, ad eccezione dei pazienti con aplasia del midollo osseo.
Supporto trasfusionale.
Indicazioni per la trasfusione di componenti del sangue:
Sospensione/massa eritrocitaria.
· in relazione alla sospensione/massa eritrocitaria è necessaria la selezione per gruppo sanguigno e fattore Rh;
· per pazienti con storia di trasfusioni multiple è consigliabile selezionare i seguenti antigeni: Kell, Duffy, Kidd, MNSs;
· immediatamente prima della trasfusione della sospensione/massa eritrocitaria è necessario effettuare un test di compatibilità con i sieri standard;
· valori soglia ai quali si considera la necessità di trasfusione di sospensione/massa di globuli rossi: Hb<80 г/мл, Ht <25%;
· il calcolo del volume massimo di sospensione/massa eritrocitaria è determinato dalla seguente formula: Hb (g/dL) x4 x peso del ricevente (kg).
Concentrato piastrinico.
· Il concentrato piastrinico deve essere selezionato in base al gruppo sanguigno e al fattore Rh;
· trasfusione di concentrato piastrinico per prevenire il sanguinamento, effettuata a livello di Tr<10 тыс кл/мкл;
· ai pazienti con febbre febbrile, sanguinamento delle mucose si consiglia di sottoporsi a trasfusione di concentrato piastrinico a livello Tr<20 тыс кл/мкл;
· quando si pianifica un intervento invasivo per un paziente, si consiglia di effettuare una trasfusione di concentrato piastrinico a livello Tr<50 тыс кл/мкл;
· dose terapeutica di piastrine consigliata per gli adulti: 3 x 10 11 cellule/l in un volume di 200-300 ml.
Valutazione dell’efficacia della trasfusione:
fermare il sanguinamento;
Determinazione del livello piastrinico il giorno successivo - livello Tr persistente<20 тыс кл/мкл свидетельствует о рефрактерности к трансфузиям;
· se si escludono tutte le cause di trombocitopenia è necessario testare la presenza di anticorpi antileucociti;
· Se vengono rilevati anticorpi, la trasfusione di piastrine deve essere effettuata da un donatore HLA compatibile.
Plasma fresco congelato.
Poiché il PFC contiene complemento, le sue trasfusioni possono provocare lo sviluppo di emolisi nei pazienti affetti da EPN. Si consiglia di evitare trasfusioni di PFC in caso di EPN.
Terapie farmacologiche erogate in regime ambulatoriale:
− elenco dei medicinali essenziali con indicazione della forma di rilascio (aventi una probabilità di utilizzo del 100%):
Farmaci antineoplastici e immunosoppressori
. eculizumab*300 mg, concentrato per soluzione per infusione, 10 mg/ml.
· filgrastim, soluzione iniettabile 0,3 mg/ml, 1 ml;
· ondansetron, soluzione iniettabile 8 mg/4 ml.
Agenti antibatterici
Azitromicina, compressa/capsula, 500 mg;
· amoxicillina/acido clavulanico, compressa rivestita con film, 1000 mg;
· moxifloxacina, compressa, 400 mg;
Ofloxacina, compressa, 400 mg;
· compressa di ciprofloxacina, 500 mg;
· metronidazolo, compressa, 250 mg, gel dentale 20 g;
· eritromicina, compressa 250 mg.
· anidulafungina, polvere liofilizzata per soluzione iniettabile, 100 mg/flacone;
· clotrimazolo, soluzione per uso esterno 1% 15ml;
Fluconazolo, capsula/compressa 150 mg.
· aciclovir, compressa da 400 mg, gel in tubo da 100.000 unità da 50 g;
Famciclovir compresse da 500 mg.
Soluzioni utilizzate per correggere i disturbi dell'equilibrio idrico, elettrolitico e acido-base
· destrosio, soluzione per infusione al 5% 250ml;
· cloruro di sodio, soluzione per infusione 0,9% 500 ml.
· eparina, soluzione iniettabile 5000 UI/ml, 5 ml; (per il lavaggio del catetere)
· rivaroxaban, compressa;
acido tranexamico, capsula/compressa 250 mg;
· ambroxolo, soluzione per somministrazione orale e inalazione, 15 mg/2 ml, 100 ml;
· atenololo, compressa 25 mg;
· drotaverina, compressa 40 mg;
Levofloxacina, compressa, 500 mg;
Lisinopril, compressa da 5 mg;
· metilprednisolone, compressa, 16 mg;
· omeprazolo, capsula 20 mg;
Prednisolone, compressa, 5 mg;
· smectite diottaedrica, polvere per preparazione della sospensione per somministrazione orale 3,0 g;
· torasemide, compressa 10 mg;
· fentanil, sistema terapeutico transdermico 75 mcg/h; (per il trattamento del dolore cronico nei pazienti oncologici)
Trattamento farmacologico fornito a livello ospedaliero:
− elenco dei medicinali essenziali con indicazione della forma di rilascio (aventi una probabilità di utilizzo del 100%):
· eculizumab*300 mg, concentrato per soluzione per infusione, 10 mg/ml.
− elenco dei medicinali aggiuntivi indicante la forma di rilascio (probabilità di utilizzo inferiore al 100%):
Medicinali che indeboliscono l’effetto tossico dei farmaci antitumorali
. filgrastim, soluzione iniettabile 0,3 mg/ml, 1 ml;
. ondansetron, soluzione iniettabile 8 mg/4 ml.
Agenti antibatterici
· azitromicina, compressa/capsula, 500 mg, polvere liofilizzata per la preparazione di soluzione per infusione endovenosa, 500 mg;
· amikacina, polvere per iniezione, 500 mg/2 ml o polvere per soluzione iniettabile, 0,5 g;
· amoxicillina/acido clavulanico, compressa rivestita con film, 1000 mg, polvere per soluzione per somministrazione endovenosa e intramuscolare 1000 mg+500 mg;
· vancomicina, polvere/liofilizzato per soluzione per infusione 1000 mg;
· gentamicina, soluzione iniettabile 80 mg/2 ml 2 ml;
· imipinem, cilastatina polvere per soluzione per infusione, 500 mg/500 mg;
· colistimetato di sodio*, liofilizzato per la preparazione della soluzione per infusione, 1 milione di unità/flacone;
· compressa di metronidazolo da 250 mg, soluzione per infusione allo 0,5% 100 ml, gel dentale 20 g;
Levofloxacina, soluzione per infusione 500 mg/100 ml, compressa 500 mg;
linezolid, soluzione per infusione 2 mg/ml;
· meropenem, liofilizzato/polvere per soluzione iniettabile 1,0 g;
· moxifloxacina, compressa 400 mg, soluzione per infusione 400 mg/250 ml
· ofloxacina, compressa 400 mg, soluzione per infusione 200 mg/100 ml;
· piperacillina, tazobactam polvere per soluzione iniettabile 4,5 g;
tigeciclina*, polvere liofilizzata per soluzione iniettabile 50 mg/flacone;
Ticarcillina/acido clavulanico, polvere liofilizzata per la preparazione della soluzione per infusione 3000 mg/200 mg;
cefepime, polvere per soluzione iniettabile 500 mg, 1000 mg;
· cefoperazone, sulbactam polvere per soluzione iniettabile 2 g;
· ciprofloxacina, soluzione per infusione 200 mg/100 ml, compressa da 100 ml, 500 mg;
· eritromicina, compressa 250 mg;
Ertapenem liofilizzato, per la preparazione di una soluzione per iniezioni endovenose e intramuscolari 1 g.
Farmaci antifungini
· amfotericina B*, polvere liofilizzata per soluzione iniettabile, 50 mg/flacone;
· anidulofungina, polvere liofilizzata per soluzione iniettabile, 100 mg/flacone;
voriconazolo, polvere per soluzione per infusione 200 mg/flacone;
voriconazolo, compressa, 50 mg;
· itraconazolo soluzione orale 10 mg/ml 150,0;
· caspofungin, liofilizzato per la preparazione della soluzione per infusione 50 mg;
· clotrimazolo, crema per uso esterno 1% 30g, soluzione per uso esterno 1% 15ml;
· micafungin, polvere liofilizzata per la preparazione di soluzione iniettabile 50 mg, 100 mg;
· fluconazolo, capsula/compressa 150 mg, soluzione per infusione 200 mg/100 ml, 100 ml.
Farmaci antivirali
· aciclovir, crema per uso esterno, 5% - 5,0, compressa - 400 mg, polvere per soluzione per infusione, 250 mg;
· valaciclovir, compressa, 500 mg;
· valganciclovir, compressa, 450 mg;
· ganciclovir*, liofilizzato per soluzione per infusione 500 mg;
Famciclovir, compresse, 500 mg n. 14.
Medicinali usati per la pneumocistosi
· sulfametossazolo/trimetoprim, concentrato per soluzione per infusione (80 mg+16 mg)/ml, 5 ml;
· sulfametossazolo/trimetoprim, compressa da 480 mg.
Ulteriori farmaci immunosoppressori:
· desametasone, soluzione iniettabile 4 mg/ml 1 ml;
· metilprednisolone, compressa 16 mg, soluzione iniettabile 250 mg;
· prednisolone, soluzione iniettabile 30 mg/ml 1 ml, compressa 5 mg.
Soluzioni utilizzate per correggere disturbi dell'equilibrio idrico, elettrolitico e acido-base, nutrizione parenterale
· albumina, soluzione per infusione al 10%, 100 ml;
· albumina, soluzione per infusione al 20% 100 ml;
· acqua per preparazioni iniettabili, soluzione iniettabile 5 ml;
· destrosio, soluzione per infusione 5% - 250 m, 5% - 500 ml; 40% - 10 ml, 40% - 20 ml;
· cloruro di potassio, soluzione per somministrazione endovenosa 40 mg/ml, 10 ml;
· gluconato di calcio, soluzione iniettabile al 10%, 5 ml;
· cloruro di calcio, soluzione iniettabile al 10% 5 ml;
· solfato di magnesio, soluzione iniettabile al 25% 5 ml;
· mannitolo, soluzione iniettabile 15% -200,0;
· sodio cloruro, soluzione per infusione 0,9% 500 ml;
· sodio cloruro, soluzione per infusione 0,9% 250ml;
· soluzione per infusione di cloruro di sodio, cloruro di potassio, acetato di sodio in flaconi da 200 ml, 400 ml;
· soluzione per infusione di cloruro di sodio, cloruro di potassio, acetato di sodio 200ml, 400ml;
· soluzione per infusione di cloruro di sodio, cloruro di potassio, bicarbonato di sodio 400 ml;
L-alanina, L-arginina, glicina, L-istidina, L-isoleucina, L-leucina, L-lisina cloridrato, L-metionina, L-fenilalanina, L-prolina, L-serina, L-treonina, L-triptofano , L-tirosina, L-valina, sodio acetato triidrato, sodio glicerofosfato pentiidrato, potassio cloruro, magnesio cloruro esaidrato, glucosio, calcio cloruro diidrato, emulsione di oli di oliva e di soia miscela per inf.: contenitori a tre camere 2 l
· amido idrossietilico (pentastarco), soluzione per infusione al 6% 500 ml;
· complesso di aminoacidi, emulsione per infusione contenente una miscela di oli di oliva e di soia in rapporto 80:20, una soluzione di aminoacidi con elettroliti, una soluzione di destrosio, con un contenuto calorico totale di 1800 kcal Contenitore a tre sezioni da 1.500 ml .
Medicinali utilizzati per la terapia intensiva (farmaci cardiotonici per il trattamento dello shock settico, miorilassanti, vasopressori e anestetici):
· aminofillina, soluzione iniettabile 2,4%, 5 ml;
· amiodarone, soluzione iniettabile, 150 mg/3 ml;
· atenololo, compressa 25 mg;
· atracurio besilato, soluzione iniettabile, 25 mg/2,5 ml;
· atropina, soluzione iniettabile, 1 mg/ml;
· diazepam, soluzione per uso intramuscolare ed endovenoso 5 mg/ml 2 ml;
· dobutamina*, soluzione iniettabile 250 mg/50,0 ml;
· dopamina, soluzione/concentrato per la preparazione della soluzione iniettabile 4%, 5 ml;
· insulina semplice;
· ketamina, soluzione iniettabile 500 mg/10 ml;
· morfina, soluzione iniettabile 1% 1 ml;
· norepinefrina*, soluzione iniettabile 20 mg/ml 4,0;
· pipecuronio bromuro, polvere liofilizzata per preparazioni iniettabili 4 mg;
· propofol, emulsione per somministrazione endovenosa 10 mg/ml 20 ml, 10 mg/ml 50 ml;
· rocuronio bromuro, soluzione per somministrazione endovenosa 10 mg/ml, 5 ml;
· tiopentale sodico, polvere per la preparazione della soluzione per somministrazione endovenosa 500 mg;
· fenilefrina, soluzione iniettabile 1% 1ml;
· fenobarbital, compressa 100 mg;
immunoglobulina umana normale, soluzione per infusione;
· epinefrina, soluzione iniettabile 0,18% 1 ml.
Medicinali che influenzano il sistema di coagulazione del sangue
· acido aminocaproico, soluzione al 5% -100 ml;
· complesso coagulante anti-inibitorio, polvere liofilizzata per la preparazione della soluzione iniettabile, 500 UI;
· eparina, soluzione iniettabile 5000 UI/ml, 5 ml, gel in tubo 100000 UI 50 g;
· spugna emostatica, misura 7*5*1, 8*3;
· nadroparina, soluzione iniettabile in siringhe preriempite, 2850 UI anti-Xa/0,3 ml, 5700 UI anti-Xa/0,6 ml;
· enoxaparina, soluzione iniettabile in siringhe da 4000 anti-Xa UI/0,4 ml, 8000 anti-Xa UI/0,8 ml.
Altri medicinali
· bupivacaina, soluzione iniettabile 5 mg/ml, 4 ml;
· lidocaina, soluzione iniettabile, 2%, 2 ml;
· procaina, soluzione iniettabile 0,5%, 10 ml;
· soluzione normale di immunoglobulina umana per somministrazione endovenosa 50 mg/ml - 50 ml;
· omeprazolo, capsula 20 mg, polvere liofilizzata per la preparazione della soluzione iniettabile 40 mg;
· famotidina, polvere liofilizzata per la preparazione di soluzione iniettabile 20 mg;
Ambroxol, soluzione iniettabile, 15 mg/2 ml, soluzione per somministrazione orale e inalazione, 15 mg/2 ml, 100 ml;
· amlodipina, compressa/capsula 5 mg;
· acetilcisteina, polvere per soluzione per somministrazione orale, 3 g;
· desametasone, collirio 0,1% 8 ml;
Difenidramina, soluzione iniettabile 1% 1 ml;
· drotaverina, soluzione iniettabile al 2%, 2 ml;
· captopril, compressa 50 mg;
· ketoprofene, soluzione iniettabile 100 mg/2ml;
lattulosio, sciroppo 667 g/l, 500 ml;
· cloramfenicolo, sulfadimetossina, metiluracile, trimecaina unguento per uso esterno 40g;
Lisinopril, compressa da 5 mg;
· metiluracile, pomata ad uso topico in tubo 10% 25g;
· nafazolina gocce nasali 0,1% 10ml;
· nicergolina, liofilizzato per la preparazione della soluzione iniettabile 4 mg;
· iodio-povidone, soluzione per uso esterno 1 l;
· salbutamolo, soluzione per nebulizzatore 5 mg/ml-20 ml;
· smectitediottaedrico, polvere per la preparazione della sospensione per somministrazione orale 3,0 g;
· spironolattone, capsula 100 mg;
· tobramicina, collirio 0,3% 5ml;
· torasemide, compressa 10 mg;
· tramadolo, soluzione iniettabile 100 mg/2ml;
tramadolo, soluzione orale (gocce) 100 mg/1 ml 10 ml;
· fentanil, sistema terapeutico transdermico 75 mcg/h (per il trattamento del dolore cronico nei pazienti oncologici);
· acido folico, compressa, 5 mg;
· furosemide, soluzione iniettabile 1% 2 ml;
· cloramfenicolo, sulfadimetossina, metiluracile, trimecaina unguento per uso esterno 40g;
· clorexidina, soluzione 0,05% 100ml;
· cloropiramina, soluzione iniettabile 20 mg/ml 1 ml.
Terapie farmacologiche erogate in fase di emergenza: non viene effettuato.
Altri tipi di trattamento:
Altri tipi di cure erogate in regime ambulatoriale: non applicare.
Altre tipologie di servizi erogati a livello stazionario:
Trapianto di midollo osseo (livello di evidenza B)
Le indicazioni per il BMT nella EPN sono simili a quelle dell'anemia aplastica grave.
Sebbene eculizumab aiuti a controllare l’emolisi intravascolare e le complicanze associate alla EPN, in primo luogo la dipendenza dalle trasfusioni, il trapianto allogenico di midollo osseo (BMT) rimane l’unico metodo radicale per ottenere una cura per questa malattia. Tuttavia, il BMT è associato ad un’elevata mortalità. Pertanto, in uno studio retrospettivo su 26 pazienti affetti da EPN provenienti dall'Italia che hanno ricevuto BMT, il tasso di sopravvivenza a 10 anni è stato del 42% e la probabilità di sopravvivenza a 2 anni in 48 pazienti che hanno ricevuto BMT da un fratello HLA-identico, secondo del Registro Internazionale dei Trapianti di Midollo Osseo, ammonta al 56%. Indipendentemente dalle indicazioni per le quali viene eseguito il trapianto di midollo osseo, l’incidenza delle complicanze rimane molto elevata. L'incidenza della malattia del trapianto contro l'ospite nei pazienti affetti da EPN è del 42-54%, la metà dei pazienti sviluppa malattia epatica veno-occlusiva, mancato attecchimento o rigetto e, inoltre, permane il rischio di espansione del clone EPN. Il BMT e le complicanze associate influiscono negativamente sulla qualità della vita dei pazienti.
Altri tipi di trattamento forniti durante le cure mediche di emergenza: non applicare.
Caratteristiche della gestione dei pazienti in gravidanza.
La gravidanza nella EPN è associata a livelli elevati di mortalità materna e infantile (rispettivamente 11,6% e 7,2%).
Attualmente sono stati descritti solo casi isolati di terapia con eculizumab durante la gravidanza con esito favorevole per la madre e il feto. Non ci sono effetti teratogeni del farmaco. Durante la gravidanza, la terapia con eculizumab non deve essere interrotta. Se la paziente non ha precedentemente ricevuto eculizumab, il farmaco può essere prescritto durante la gravidanza. In questo caso, la terapia con eculizumab deve essere continuata per 3 mesi dopo il parto. In caso di emolisi improvvisa durante la gravidanza, può essere necessario un aggiustamento della dose del farmaco (ad esempio, terapia di mantenimento 900 mg a settimana).
Intervento chirurgico:
Intervento chirurgico erogato in regime ambulatoriale: non viene effettuato.
Intervento chirurgico erogato in regime di ricovero:
Con lo sviluppo di complicanze infettive e sanguinamenti potenzialmente letali, i pazienti vengono sottoposti a interventi chirurgici per indicazioni di emergenza.
Ulteriore gestione:
Durante la terapia con eculizumab si consigliano i seguenti esami di laboratorio: emocromo completo con determinazione dei reticolociti, LDH, creatinina ematica, peptide natriuretico cerebrale B (se possibile), D-dimero, sideremia, ferritina, test diretto dell'antiglobulina. La dimensione del clone EPN viene monitorata in base ai risultati della citometria a flusso altamente sensibile.
Nei pazienti trattati con eculizumab si è osservato un aumento statisticamente significativo delle dimensioni del clone EPN. Nello studio TRIUMPH, il clone di eritrociti EPN di tipo III è aumentato dal 28,1% al 56,9% in 26 settimane, mentre non è cambiato nel gruppo placebo. Se eculizumab viene interrotto, è necessario il monitoraggio delle dimensioni del clone EPN, del livello di reticolociti, aptoglobina, LDH, bilirubina e D-dimeri per il rilevamento tempestivo dell'emolisi e la prevenzione di potenziali complicanze.
Indicatori di efficacia del trattamento:
Non è stato ancora sviluppato un sistema specifico per valutare la risposta alla terapia nella EPN. Nel valutare l'effetto del trattamento, vengono presi in considerazione:
· manifestazioni cliniche - debolezza;
· livello di emoglobina;
· la necessità di trasfusioni di emocomponenti;
episodi trombotici;
· attività emolitica (livello dei reticolociti, LDH, aptoglobina).
Farmaci (principi attivi) utilizzati nel trattamento
| Spugna emostatica |
| Azitromicina |
| Albumina umana |
| Ambroxolo |
| Amikacina |
| Acido aminocaproico |
| Aminoacidi per nutrizione parenterale+Altri medicinali (Emulsioni di grassi + Destrosio + Multiminerale) |
| Aminofillina |
| Amiodarone |
| Amlodipina |
| Amoxicillina |
| Amfotericina B |
| Anidulafungina |
| Complesso coagulante antiinibitorio |
| Atenololo |
| Atracurium besilato |
| Atropina |
| Acetilcisteina |
| Aciclovir |
| Bupivacaina |
| Valaciclovir |
| Valganciclovir |
| Vancomicina |
| Acqua per preparazioni iniettabili |
| Voriconazolo |
| Ganciclovir |
| Gentamicina |
| Eparina sodica |
| Amido idrossietilico |
| Desametasone |
| Destrosio |
| Diazepam |
| Difenidramina |
| Dobutamina |
| Dopamina |
| Drotaverina (Drotaverina) |
| Imipenem |
| Immunoglobulina umana normale |
| Itraconazolo |
| Cloruro di potassio (Cloruro di potassio) |
| Gluconato di calcio |
| Cloruro di calcio |
| Captopril |
| Caspofungina |
| Ketamina |
| Ketoprofene |
| Acido clavulanico |
| Clotrimazolo |
| Colistimetato di sodio |
| Complesso di aminoacidi per nutrizione parenterale |
| Concentrato piastrinico (CT) |
| Lattulosio |
| Levofloxacina |
| Lidocaina |
| Lisinopril |
| Linezolid |
| Solfato di magnesio |
| Mannitolo |
| Meropenem |
| Metilprednisolone |
| Metiluracile (diossometiltetraidropirimidina) |
| Metronidazolo |
| Micafungina |
| Moxifloxacina |
| Morfina |
| Nadroparina calcio |
| Acetato di sodio |
| Idrocarbonato di sodio |
| Cloruro di sodio |
| Nafazolina |
| Nicergolina |
| Noradrenalina |
| Omeprazolo |
| Ondansetrone |
| Ofloxacina |
| Bromuro di pipecuronio |
| Piperacillina |
| Plasma fresco congelato |
| Iodio povidone |
| Prednisolone |
| Procaina |
| Propofol |
| Rivaroxaban |
| Rocuronio bromuro |
| Salbutamolo |
| Smectite diottaedrica |
| Spironolattone |
| Sulbactam |
| Sulfadimetossina |
| Sulfametossazolo |
| Tazobactam |
| Tigeciclina |
| Ticarcillina |
| Tiopentale sodico |
| Tobramicina |
| Torasemide |
| Tramadolo |
| Acido tranexamico |
| Trimecaina |
| Trimetoprim |
| Famotidina |
| Famciclovir |
| Fenilefrina |
| Fenobarbital |
| Fentanil |
| Filgrastim |
| Fluconazolo |
| Acido folico |
| Furosemide |
| Cloramfenicolo |
| Clorexidina |
| Cloropiramina |
| Cefepime |
| Cefoperazone |
| Cilastatina |
| Ciprofloxacina |
| Eculizumab |
| Enoxaparina sodica |
| Epinefrina |
| Eritromicina |
| Massa dei globuli rossi |
| Sospensione eritrocitaria |
| Ertapenem |
Gruppi di farmaci secondo ATC utilizzati nel trattamento
Ricovero ospedaliero
Indicazioni per il ricovero:
Indicazioni per il ricovero d'urgenza:
· EPN di nuova diagnosi;
· complicanze trombotiche;
· crisi emolitica;
neutropenia febbrile.
Indicazioni per il ricovero programmato:
· esame, determinazione di ulteriori tattiche di trattamento;
trapianto allogenico di midollo osseo.
Prevenzione
Azioni preventive: NO.
Informazione
Fonti e letteratura
- Verbali delle riunioni del Consiglio di esperti dell'RCHR del Ministero della Salute della Repubblica del Kazakistan, 2015
- Riferimenti: 1. Rete scozzese di linee guida intercollegiate (SIGN). SIGN 50: un manuale per gli sviluppatori di linee guida. Edimburgo: segno; 2014. (Pubblicazione SIGN n. 50). . Disponibile dall'URL: http://www.sign.ac.uk 2. Kulagin A.D., Lisukov I.A., Ptushkin V.V., Shilova E.R., Cvetaeva N.V., Mikhailova E. A. Linee guida cliniche nazionali per la diagnosi e il trattamento dell'emoglobinuria parossistica notturna, Oncoematologia 2/2014 p.20-28 3. Parker C., Omine M., Richards S. et al. Diagnosi e gestione dell'emoglobinuria parossistica notturna. Sangue 2005; 106:3699–709. 4. de Latour R. P., Mary J. Y., Salanoubat C. et al. Emoglobinuria parossistica notturna: storia naturale delle sottocategorie di malattie. Sangue 2008; 112: 3099–106. 5. Brodsky R. A. Come tratto l'emoglobinuria parossistica notturna. Sangue 2009; 113:6522–7. 6. Movalia M. K., Weitz I., Lim S. H., Illingworth A. Incidenza di cloni EPN in base al codice diagnostico che utilizza la citometria a flusso ad alta sensibilità. Sangue (abstract del convegno annuale dell'ASH) 2011; 118:1033. 7. Wanachiwanawin W., Siripanyaphinyo U., Piyawattanasakul N., Kinoshita T. Uno studio di coorte sulla natura dei cloni di emoglobinuria parossistica notturna e delle mutazioni PIG-A in pazienti con anemia aplastica. Eur J Ematolo 2006; 76:502–9. 8. Ematologia; L'ultimo libro di consultazione. Sotto la direzione generale del Dottore in Scienze Mediche. Il professor K.M. Abdulkadyrova. Mosca: Casa editrice Eksmo; San Pietroburgo: Casa editrice Sova, 2004; 294-299. 9. Borowitz M. J., Craig F. E., Digiuseppe J. A. et al. Linee guida per la diagnosi e il monitoraggio dell'emoglobinuria parossistica notturna e dei disturbi correlati mediante citometria a flusso. CitometriaB Clin Cytom 2010; 78(4):211–30. 10. Schubert J., Alvarado M., Uciechowski P. et al. Diagnosi dell'emoglobinuria parossistica notturna mediante immunofenotipizzazione delle cellule del sangue periferico. Br J Haematol1991; 79:487–92 11. Okorokov A. N. Diagnosi delle malattie degli organi interni, volume 4, Diagnosi delle malattie del sistema sanguigno. Casa editrice: M: Letteratura medica 2001. p.67, p.100, p.163. 12. Gardner A, Mattiuzzi G, Faderl S, Borthakur G, Garcia-Manero G, Pierce S, Brandt M, Estey E. Confronto randomizzato di diete cotte e non cotte in pazienti sottoposti a terapia di induzione della remissione per leucemia mieloide acuta. J Clin Oncol. 10 dicembre 2008; 26(35):5684-8. 13. Carr SE, Halliday V. Indagare sull'uso della dieta neutropenica: un'indagine sui dietisti del Regno Unito. Dieta J Hum Nutr. 28 agosto 2014. 14. Boeckh M. Dieta neutropenica: buona pratica o mito? Trapianto di midollo sanguigno Biol. settembre 2012; 18(9):1318-9. 15. Trifilio, S., Helenowski, I., Giel, M. et al. Mettere in discussione il ruolo di una dieta neutropenica dopo il trapianto di cellule staminali emopoietiche. Trapianto di midollo sanguigno Biol. 2012; 18:1387–1392. 16. DeMille, D., Deming, P., Lupinacci, P., e Jacobs, L.A. L'effetto della dieta neutropenica in ambito ambulatoriale: uno studio pilota. Forum OncolNurs. 2006; 33: 337–343 17. Hillman P, Sala C, Marsh JC et al. Effetto di eculizumab sull'emolisi e sulla necessità di trasfusioni in pazienti con emoglobinuria parossistica notturna. N Engl J Med 2004; 350: 552–9. 18. Hillmen P., Young N. S., Schubert J. et al. L'inibitore del complemento eculizumab nell'emoglobinuria parossistica notturna. N Engl J Med 2006;355:1233–43. 19. Brodsky R. A., Young N. S., Antonioli E. et al. Studio multicentrico di fase 3 sull'inibitore del complemento eculizumab per il trattamento di pazienti con emoglobinuria parossistica notturna. Sangue 2008; 111(4):1840–7. 20. Kelly R. J., Hill A., Arnold L. M. et al. Trattamento a lungo termine con eculizumab nell'emoglobinuria parossistica notturna: efficacia sostenuta e sopravvivenza migliorata.Blood 2011; 117:6786–92. 21. Hillmen P., Muus P., Roth A. et al. Sicurezza ed efficacia a lungo termine del trattamento prolungato con eculizumab in pazienti con emoglobinuria parossistica notturna. Br J Haemotol 2013;162(1):62–73. 22. Dmytrijuk A, Robie-Suh K, Cohen MH, Rieves D, Weiss K, Pazdur R. Rapporto FDA: eculizumab (Soliris) per il trattamento di pazienti con emoglobinuria parossistica notturna Oncologo. settembre 2008; 13(9):993-1000. 23. Martí-Carvajal AJ, Anand V, Cardona AF, Solà I. Eculizumab per il trattamento dei pazienti con emoglobinuria parossistica notturna. Sistema database Cochrane Rev. 30 ottobre 2014; 10:CD010340. 24. Kelly R, Arnold L, Richards S, Hill A, Bomken C, Hanley J, Loughney A, Beauchamp J, Khursigara G, Rother RP, Chalmers E, Fyfe A, Fitzsimons E, Nakamura R, Gaya A, Risitano AM, Schubert J, Norfolk D, Simpson N, Hillman P. La gestione della gravidanza nell'emoglobinuria parossistica notturna su eculizumab a lungo termine. British Journal of Haematology.2010; 149:446–450. 25. Risitano AM. Emoglobinuria parossistica notturna e sistema del complemento: recenti approfondimenti e nuove strategie anticomplementari Adv Exp Med Biol. 2013; 735:155-72. 26. Emoglobinuria parossistica notturna (EPN). Raccomandazioni della società per la diagnosi e la terapia delle malattie ematologiche e oncologiche, 2012. www.dgho-onkopedia.de 27. Hall C., Richards S., Hillmen P. La profilassi primaria con warfarin previene la trombosi nell'emoglobinuria parossistica notturna (EPN). Sangue 2003; 102: 3587–91. 28. Santarone S., Bacigalupo A., Risitano A. M. et al. Trapianto di cellule staminali emopoietiche per emoglobinuria parossistica notturna: risultati a lungo termine di uno studio retrospettivo per conto del Gruppo Italiano Trapianto Midollo Osseo (GITMO). Haematologica 2010; 95:983–8. 29. Saso R., Marsh J., Cevreska L. et al. Trapianti di midollo osseo per emoglobinuria parossistica notturna. Br J Haematol 1999; 104:392–6. 30. de Latour R. P., Schrezenmeier H., Mary J-Y. et al. Trapianto di cellule staminali per emoglobinuria parossistica notturna: uno studio congiunto in corso del gruppo AAWP EBMT e della Società francese di ematologia (EBMTabstract 316). Trapianto di midollo osseo 2009; 43 (Suppl 1): 57–8. 31. Armitage J. O. Trapianto di midollo osseo. N Engl J Med 1994; 330:827–38. 32. Benavides Lopez E. Espansione clonale PNH in seguito a trapianto di midollo osseo: caso clinico. Haematologica 2011; 96:524. 33. Fraser C. J., Bhatia S., Ness K. et al. Impatto della malattia cronica del trapianto contro l'ospite sullo stato di salute dei sopravvissuti al trapianto di cellule ematopoietiche: un rapporto dal Bone Marrow Transplant Survivor Study. Blood 2006; 108:2867–73. 34. Bieri S., Roosnek E., Helg C. et al.Qualità della vita e integrazione sociale dopo SCT ematopoietico allogenico. Trapianto di midollo osseo 2008; 42:819–27.
Informazione
Elenco degli sviluppatori di protocolli con dettagli sulle qualifiche:
1) Kemaykin Vadim Matveevich - Candidato di scienze mediche, JSC "Centro scientifico nazionale di oncologia e trapianti", capo del dipartimento di oncoematologia e trapianto di midollo osseo.
2) Anton Anatolyevich Klodzinsky - Candidato di scienze mediche, Centro scientifico nazionale di oncologia e trapianti JSC, ematologo presso il Dipartimento di oncoematologia e trapianto di midollo osseo.
3) Ramazanova Raigul Mukhambetovna - Dottore in scienze mediche, professore alla JSC "Kazakh Medical University of Continuing Education", capo del corso di ematologia.
4) Gabbasova Saule Telembaevna - RSE presso l'RSE "Istituto di ricerca kazako di oncologia e radiologia", capo del dipartimento di emoblastosi.
5) Karakulov Roman Karakulovich - Dottore in scienze mediche, professore, accademico del MAI RSE presso l'Istituto di ricerca kazako di oncologia e radiologia, ricercatore capo del dipartimento di emoblastosi.
6) Tabarov Adlet Berikbolovich - Capo del Dipartimento di Gestione Innovativa della RSE presso la RSE "Ospedale dell'Amministrazione del Centro Medico del Presidente della Repubblica del Kazakistan", farmacologo clinico, pediatra.
7) Rapilbekova Gulmira Kurbanovna, dottore in scienze mediche. JSC “Centro scientifico nazionale per la maternità e l'infanzia” - capo del dipartimento di ostetricia n. 1.
Dichiarazione di assenza di conflitto di interessi: assente.
Revisori:
1) Afanasyev Boris Vladimirovich - Dottore in scienze mediche, direttore dell'Istituto di ricerca di oncologia, ematologia e trapianto infantile intitolato a R.M. Gorbacheva, capo del dipartimento di ematologia, transfusiologia e trapiantologia, istituto statale di bilancio per l'istruzione professionale superiore, prima università medica statale di San Pietroburgo. IP Pavlova.
2) Rakhimbekova Gulnar Ayapbekkyzy - Dottore in scienze mediche, professore, Centro medico scientifico nazionale JSC, capo del dipartimento.
3) Pivovarova Irina Alekseevna - Dottore in Medicina, Master in Business Administration, Capo ematologo freelance del Ministero della Sanità e dello Sviluppo Sociale della Repubblica del Kazakistan.
Indicazione delle condizioni per la revisione del protocollo: revisione del protocollo dopo 3 anni e/o quando diventano disponibili nuove metodiche diagnostiche e/o terapeutiche con un livello di evidenza più elevato.
Files allegati
Attenzione!
- Automedicando, puoi causare danni irreparabili alla tua salute.
- Le informazioni pubblicate sul sito web MedElement e nelle applicazioni mobili "MedElement", "Lekar Pro", "Dariger Pro", "Diseases: Therapist's Guide" non possono e non devono sostituire una consultazione faccia a faccia con un medico. Assicurati di contattare una struttura medica se hai malattie o sintomi che ti preoccupano.
- La scelta dei farmaci e il loro dosaggio devono essere discussi con uno specialista. Solo un medico può prescrivere il medicinale giusto e il suo dosaggio, tenendo conto della malattia e delle condizioni del corpo del paziente.
- Il sito web MedElement e le applicazioni mobili "MedElement", "Lekar Pro", "Dariger Pro", "Disseases: Therapist's Directory" sono esclusivamente informazioni e risorse di riferimento. Le informazioni pubblicate su questo sito non devono essere utilizzate per modificare senza autorizzazione le prescrizioni del medico.
- Gli editori di MedElement non sono responsabili per eventuali lesioni personali o danni alla proprietà derivanti dall'uso di questo sito.
In questo gruppo di pazienti non vi è alcuna tendenza familiare all'anemia, nessuna concomitante anomalia congenita e nessun disturbo nel periodo neonatale. L’anemia aplastica può manifestarsi a qualsiasi età nei bambini e negli adulti; talvolta può essere associata a specifica intossicazione o infezione, ma spesso tale connessione non si osserva e quindi l’anemia viene considerata “idiopatica”.
Alcuni farmaci, come la 6-mercaptopurina, il metotrexato, la ciclofosfamina e il busulfan, hanno una capacità prevedibile e dose-dipendente di sopprimere il midollo osseo. Se questa depressione continua, porterà ad un’aplasia del midollo osseo, che di solito si risolve rapidamente dopo la sospensione del farmaco. Questi farmaci danneggiano le normali cellule del midollo osseo attraverso lo stesso meccanismo con cui inibiscono la crescita delle cellule leucemiche. I principi biochimici della loro azione sono abbastanza ben studiati. Anche il danno da radiazioni al midollo osseo rientra in questa categoria.
Altri farmaci, come il chinino, il cloramfenicolo, il fenilbutazone e gli anticonvulsivanti, utilizzati a dosi terapeutiche normali, possono causare un’aplasia profonda del midollo osseo in un numero molto limitato di persone e questa aplasia non può essere prevista in anticipo. Spesso è irreversibile e circa la metà dei pazienti muore. Anche l'intossicazione da insetticidi come il DDT e alcuni solventi organici rientra in questa categoria. Spesso non è chiaro se l’anemia possa essere collegata a un particolare farmaco. Una condizione necessaria per tale connessione è l'assunzione di farmaci negli ultimi 6 mesi. Il più conosciuto e studiato tra questi è il cloramfenicolo. Questo farmaco è in cima alla lista degli agenti eziologici noti nel gruppo di pazienti con anemia aplastica acquisita descritti da Scott et al., e negli stessi gruppi di bambini malati da Shahidi. Gurman ha osservato a Sydney 16 casi in 8 anni in cui si credeva che la malattia fosse associata all'uso di cloramfenicolo. Incidenza assoluta di anemia aplastica acquisita fatale in popolazioni senza esposizione nota a farmaci pericolosi e esposizione nota a una varietà di farmaci, incluso il cloramfenicolo.
Il trattamento con cloramfenicolo aumenta di 13 volte la probabilità di sviluppare anemia aplastica, ma è anche chiaro che questo aumento è piccolo. Per altri farmaci il rischio è ancora più basso. Tuttavia, il Comitato per la sicurezza dei medicinali del Regno Unito raccomanda che per tutte le malattie diverse dalla febbre tifoide e dalla meningite da influenza emofila, il cloramfenicolo debba essere utilizzato per via sistemica solo dopo che attenti test clinici e di solito di laboratorio abbiano indicato che un altro antibiotico non sarà sufficiente. Non dovrebbe mai essere usato sistemicamente per una semplice infezione.
Il meccanismo di sviluppo dell'anemia aplastica sotto l'influenza del cloramfenicolo non è chiaro. L’insorgenza di anemia aplastica non è correlata alla dose o alla durata del trattamento, né può essere spiegata da un’escrezione insufficiente in individui sensibili. In vitro, è possibile dimostrare l’inibizione della sintesi dell’acido nucleico nelle cellule normali del midollo osseo, ma solo a concentrazioni del farmaco che superano quelle utilizzate in vivo. È stato suggerito che piccole quantità di cloramfenicolo possano essere consumate nel latte di mucche trattate per mastite e che queste piccole quantità possano sensibilizzare il midollo osseo alle successive dosi terapeutiche. Si è inoltre ipotizzato che esista un sinergismo non ancora scoperto con altri farmaci, che probabilmente sono innocui se usati da soli. Nel discutere l’eziologia dell’aplasia letale pancitopenica causata dal cloramfenicolo, va notato che una percentuale significativa di pazienti trattati con questo farmaco sperimenta una soppressione del midollo osseo completamente diversa, reversibile e dose-dipendente. In 10 dei 22 pazienti trattati con cloramfenicolo, sono stati riscontrati vacuoli multipli di grandi dimensioni negli eritroblasti precoci del midollo osseo, spesso accompagnati da una diminuzione del numero di globuli rossi e reticolociti. Questi cambiamenti scompaiono una settimana dopo la sospensione del farmaco. Il loro sviluppo sembra essere facilitato dall’aumento delle dosi, dalla clearance plasmatica ritardata e dall’eritropoiesi accelerata. Gli stessi vacuoli possono essere osservati in caso di carenza di fenilalanina o riboflavina.
Per quanto riguarda l'eziologia di altre aplasie indotte da farmaci, c'è sempre stata la tentazione di ipotizzare l'azione di meccanismi immunitari, forse come un farmaco - aptene. Tuttavia, questi meccanismi non sono mai stati dimostrati. Solo in una situazione clinica, vale a dire la malattia del trapianto contro l’ospite in neonati immunologicamente incompetenti che hanno ricevuto trasfusioni, è stata stabilita l’origine immunologica dell’anemia aplastica. Anche lo sviluppo di una grave reazione anafilattoide dopo una riesposizione accidentale al DDT in un paziente sensibile suggerisce un meccanismo immunitario. Newwig ha proposto tre spiegazioni per l'aplasia indotta da farmaci: a) un effetto diretto e tossico sulle cellule del midollo osseo, ad esempio, dopo esposizione professionale cronica al benzene; b) vera allergia, le cui manifestazioni si manifestano rapidamente dopo il contatto con una piccola dose; c) contatto prolungato con dosi elevate, cioè “allergia ad alte dosi”. Questa è la forma più comune. L'autore lo spiega principalmente con il danno alle membrane cellulari. Si può anche sospettare una predisposizione genetica, come indicato da un caso di discrasia ematica dopo esposizione al cloramfenicolo in gemelli identici. Articoli di revisione sull'anemia aplastica indotta da farmaci di Newwig sono stati recentemente pubblicati su Lancet.
Problemi simili sorgono in connessione con un'infezione virale che precede lo sviluppo dell'anemia aplastica. Questo fenomeno è stato ben studiato nell'epatite infettiva. L'anemia aplastica si è sviluppata in 5 pazienti di età compresa tra 4 e 19 anni 1-7 settimane dopo la comparsa dell'epatite. Sono stati descritti numerosi casi simili, inclusi 3 casi da Schwartz et al. Questi autori hanno notato che nell'epatite infettiva si verifica spesso una temporanea diminuzione del numero di granulociti, piastrine ed emoglobina e che i cambiamenti progressivi che portano all'aplasia del midollo osseo in un numero molto piccolo di pazienti possono rappresentare una continuazione dell'intero processo, probabilmente a seconda della situazione. predisposizione genetica. Qui puoi vedere un'analogia con l'intossicazione da cloramfenicolo. La pancitopenia con ipoplasia transitoria del midollo osseo è stata descritta anche in associazione con una serie di infezioni causate da virus a RNA, inclusi virus della rosolia e microvirus influenzali, virus parainfluenzali, virus della parotite e del morbillo. Due infezioni virali sperimentali nei topi, vale a dire MVH-3 e il ceppo Trinidad dell'encefalite equina venezuelana, causano pancitopenia e ipoplasia del midollo osseo e il virus può essere coltivato dal midollo osseo. Come per altre cause di anemia aplastica, si presume un processo autoimmune.
In circa la metà dei casi di anemia aplastica acquisita non è possibile riscontrare alcuna storia di gravi infezioni precedenti o di esposizione ad agenti tossici. Wolf ha pubblicato un vasto materiale, comprendente 334 casi di pancitopenia acquisita, e in 191 casi, cioè il 57,2%, l'anemia è stata riconosciuta come idiopatica.
Nel materiale di Gurman, il numero relativo di pazienti con anemia idiopatica era inferiore, cioè 28 su 104, che soffrivano di aplasia acquisita. In 5 casi su 17 secondo Shahidi e in 5 casi su 9 secondo Desposito l'anemia era idiopatica. Non è ancora chiaro se le malattie in questi casi siano causate dall’infezione da un virus non identificato. Almeno alcuni dei casi idiopatici sembrano rientrare in un gruppo speciale che potrebbe essere chiamato preleucemia o leucemia in fase aplastica.
Mehlhorn et al descrivono 6 bambini a cui è stata diagnosticata una forte e indiscutibile evidenza di anemia aplastica di età compresa tra 1 anno, 11 mesi e 6 anni, ma tutti questi bambini hanno successivamente sviluppato leucemia linfoblastica acuta tra 9 settimane e 20 mesi. Questi 6 pazienti avevano una caratteristica comune: una risposta terapeutica più rapida del solito alla terapia iniziale con corticosteroidi rispetto all'anemia aplastica. Gurman ha notato la stessa cosa, e anche noi abbiamo osservato questo effetto in un caso in cui la leucemia linfoblastica acuta si è sviluppata dopo 3 mesi. Questa rapida risposta della pancitopenia al trattamento con soli corticosteroidi è marcatamente diversa dalla solita mancanza di risposta in altri casi di anemia aplastica. Va notato che è stata descritta una trasformazione leucemica simile dell'anemia aplastica causata dal benzene e dal cloramfenicolo.
Sintomi dell'anemia aplastica acquisita
L'anemia aplastica acquisita è caratterizzata approssimativamente dagli stessi sintomi e segni oggettivi della forma costituzionale, ma non sono presenti pigmentazione, bassa statura e anomalie congenite dello scheletro o degli organi interni. La fascia di età in cui si manifesta la malattia è più ampia, con la possibile eccezione dell'aplasia da cloramfenicolo, in cui il “picco” di massima incidenza si colloca tra il 3° e il 7° anno. Il 43% dei pazienti con la forma acquisita della malattia nell'ampio riassunto di Wolf: e il 67% nell'ampio riassunto di Gurman avevano una storia di contatti, a volte ripetuti, di solito nei 6 mesi precedenti, con farmaci o sostanze chimiche note per essere predisposti a anemia aplastica.Newman et al hanno descritto 14 bambini affetti da pancitopenia idiopatica e hanno notato che, oltre ai tre segni principali - anemia, febbre e porpora, c'erano importanti segni negativi, cioè l'assenza di epatosplenomegalia, linfoadenopatia, ulcere orali e ittero. Tuttavia si possono osservare porpora della mucosa orale e sanguinamento delle gengive. A volte può essere presente una linfoadenopatia infiammatoria associata a sepsi locale.
Se un bambino sviluppa urine rosse, si deve presumere lo sviluppo di emoglobinuria parossistica notturna.
Diagnostica di laboratorio
Il quadro del sangue periferico è approssimativamente lo stesso della forma costituzionale, ma la neutropenia è più profonda, talvolta avvicinandosi all'agranulocitosi. Inoltre è presente un'aplasia più marcata del midollo osseo, costituito quasi interamente da aree adipose prive di cellule emiche. Il 5-90% dei progenitori eritroidi ancora presenti nel midollo osseo mostrano alterazioni megaloblastiche e altri segni di “diseritropoiesi”. Nei pazienti con soppressione midollare inversa dose-correlata causata dal cloramfenicolo, si osserva vacuolizzazione dei precursori eritroidi e mieloidi nel midollo osseo, simile a quanto si può osservare con il deficit di fenilalanina. Il livello di emoglobina fetale può essere elevato nella stessa misura delle forme costituzionali, ma in modo meno permanente. Si pensava che livelli superiori a 400 μg% (o 5%) indicassero una prognosi migliore per la malattia acquisita, ma l'analisi di casi più recenti trattati presso lo stesso istituto non ha confermato questi risultati, probabilmente a causa dell'uso di un metodo diverso.L'aminaciduria, osservata in circa la metà dei pazienti con la forma costituzionale, è assente e non vi è alcun ritardo nell'età ossea.
Più della metà dei pazienti adulti affetti da questa malattia presentano linfopenia e ipogammaglobulinemia con livelli di IgG subnormali.
Emolisi associata, inclusa emoglobinuria parossistica notturna. Alcuni pazienti con anemia aplastica hanno una durata di vita ridotta dei globuli rossi. Ciò suggerisce che il difetto degli eritrociti a volte non è solo quantitativo, ma anche qualitativo. In questo caso si può osservare un aumento del sequestro nella milza. La reticolocitosi, che dovrebbe essere presente, è solitamente esclusa a causa dell'aplasia del midollo osseo. In alcuni casi, il contenuto di aptoglobina è ridotto. Una delle cause dell'emolisi in questa malattia è un'insolita sindrome combinata di emoglobinuria parossistica notturna (EPN) e anemia aplastica. Questa sindrome dovrebbe essere assunta quando un paziente con anemia aplastica presenta un aumento della bilirubina o una reticolocitosi spontanea. La diagnosi è confermata dal test dell'emolisi sierica acida (ASH) per l'EPN e dai test per l'emosiderinuria. In alcuni casi la EPN può essere rilevata solo esaminando la popolazione più sensibile di globuli rossi, ovvero i reticolociti e i globuli rossi giovani, ottenuta rimuovendo attentamente con una pipetta lo strato sottostante il coagulo leucociti-piastrine dopo aver centrifugato 20-35 ml di sangue a 500 G.
Tipicamente, in questa sindrome, la EPN viene rilevata sullo sfondo dell'anemia aplastica, spesso dopo che l'eritropoiesi è stata ripristinata in una certa misura. In diversi casi è stata osservata la sequenza inversa, vale a dire un'insufficienza midollare grave o fatale sviluppatasi in un contesto di EPN. Lewis e Days hanno testato sistematicamente tutti i loro pazienti con anemia aplastica e hanno scoperto che 7 su 46 (15%) presentavano criteri di laboratorio per EPN. 2 di loro hanno successivamente sviluppato un quadro tipico di EPN. Affrontando la questione da un punto di vista diverso, gli autori hanno scoperto che almeno 15 pazienti su 60 affetti da EPN presentavano inizialmente segni di aplasia. In genere, la EPN è una malattia che colpisce gli uomini adulti. Tuttavia, la forma che si manifesta con aplasia sembra manifestarsi in età più giovane e può colpire i bambini. Gardner ha osservato 11 pazienti di questo tipo, compresi quelli di età compresa tra 6 e 25 anni, 2 pazienti avevano 7 e 9 anni. Questi due erano ragazzi. La loro anemia aplastica è durata 2 e 5 anni prima della diagnosi di EPN.
Una caratteristica interessante di questa sindrome combinata è che l'anemia aplastica può essere di tipo Fanconi, può essere acquisita dopo il contatto con cloramfenicolo, tranquillanti, insetticidi, erbicidi e altre sostanze, oppure può essere idiopatica. Lewis e Days ritengono che la relazione primaria sia tra l'aplasia del midollo osseo e l'EPN e non tra i fattori eziologici che causano il danno al midollo osseo e l'EPN. Entrambi questi autori, così come Gardner e Bloom, suggeriscono che durante il periodo di aplasia si verifica una mutazione somatica delle cellule staminali del midollo osseo, che porta alla comparsa di un clone secondario di eritrociti patologici inerenti alla EPN, che iniziano ad essere prodotto durante la successiva rigenerazione del midollo osseo. Va aggiunto che, sebbene il difetto caratteristico della EPN sia concentrato negli eritrociti, anche i granulociti risultano alterati. Il metodo della finestra cutanea mostra una diminuzione della loro attività fagocitica e dell'attività della fosfatasi alcalina. Al contrario, nell'anemia aplastica non complicata, l'attività della fosfatasi alcalina nei granulociti è solitamente aumentata.
Trattamento
Il trattamento è in linea di principio lo stesso dell'anemia aplastica costituzionale, ma è necessario garantire che ogni contatto con il farmaco o l'agente tossico, se noto, venga interrotto. L'esposizione ripetuta può causare una recidiva fatale nei pazienti sopravvissuti al primo attacco di aplasia e può persino provocare uno shock anafilattico fatale.Le misure di supporto comprendono anche le trasfusioni di sangue mentre l'anemia è abbastanza grave da causare sintomi, solitamente a un livello di emoglobina del 4-6 g%. La massa di globuli rossi viene utilizzata non solo per il trattamento di sanguinamenti evidenti, ma si dovrebbe cercare di aumentare il livello all'8-9 g%. Un livello più elevato di emoglobina porta ad un’inibizione più grave dell’eritropoiesi. Il sanguinamento trombocitopenico viene trattato con infusioni rapide di plasma ricco di piastrine o concentrati piastrinici (4 unità/m2). Le iniezioni intramuscolari dovrebbero essere evitate. Durante tutte le procedure è necessario osservare una rigorosa asepsi e le infezioni devono essere trattate vigorosamente con antibiotici battericidi. Poiché la neutropenia è solitamente particolarmente grave nelle forme acquisite di anemia aplastica, durante la fase neutropenica è possibile utilizzare uno speciale regime neutropenico: sciacquare la bocca con una soluzione allo 0,1% di hibitan 4 volte al giorno dopo i pasti (a base di antisettico puro senza detergenti e coloranti ); lubrificare le narici con unguento alla naseptina 3 volte al giorno; bagno quotidiano. Lubrificare le gengive con gel dentale Hibitan all'1% 2 volte al giorno (invece di lavarsi i denti). Quando i pazienti sono ricoverati in ospedale, è necessario un qualche tipo di isolamento con barriera reversibile per ridurre il rischio di infezione da parte della microflora ospedaliera. La terapia antibiotica sistemica profilattica dovrebbe essere completamente evitata poiché aumenta la suscettibilità alle infezioni fungine e resistenti agli antibiotici. Un'infezione incipiente può manifestarsi come una maggiore tendenza al sanguinamento. Con l'infezione non solo diminuisce la conta piastrinica, ma aumenta anche la tendenza emorragica per un dato numero di piastrine.
Androgeni. La terapia specifica con androgeni + corticosteroidi si effettua allo stesso modo delle forme costituzionali, cioè ossimetalone per via orale - 4-5 mg/kg al giorno + prednisolone 5 mg 2 volte al giorno nei bambini fino a 20 kg di peso, 5 mg 3 volte al giorno per pesi corporei da 20 a 40 kg e 4 volte al giorno per pesi corporei superiori a 40 kg. La differenza è che nelle forme acquisite di anemia l'effetto si ottiene in una percentuale minore di pazienti, la risposta al trattamento è più lenta, ma la remissione nei pazienti trattabili continua dopo la sospensione degli androgeni e dei corticosteroidi. Nell'anemia di Fanconi, l'insufficienza del midollo osseo recidiva rapidamente dopo l'interruzione di questa terapia. È stato anche sottolineato che questa circostanza può essere utilizzata in casi difficili per differenziare la forma acquisita da quella costituzionale.
I primi risultati del trattamento con androgeni e steroidi furono davvero impressionanti. Dei 17 bambini con anemia aplastica acquisita (tossica in 12 casi, idiopatica in 5 casi), 10 presentavano reticolocitosi persistente, con un picco del 5-15% dopo 1-7 mesi di trattamento combinato con androgeni e corticosteroidi. Di questi bambini, 9 sono sopravvissuti e i loro livelli di emoglobina sono successivamente aumentati. In 3 bambini è stata osservata reticolocitosi transitoria senza altre reazioni. La discrepanza tra i tempi di insorgenza della reticolocitosi e l'aumento dell'emoglobina in questi pazienti è stata spiegata dall'emolisi. Inoltre, i globuli rossi, che si formano nella fase iniziale della rigenerazione del midollo osseo, sono ipocromici con un livello normale di ferro nel siero e un aumento del contenuto di protoporfirina libera nei globuli rossi, che indica un blocco cellulare nella sintesi dell'emoglobina . L'aumento massimo dell'emoglobina è stato osservato 2-15 mesi dopo l'inizio del trattamento con androgeni. Studiando la dinamica del midollo osseo nelle prime fasi del trattamento, sono stati trovati gruppi di cellule reticolari che maturano e si trasformano in focolai eritroidi in quei pazienti che successivamente sviluppano una risposta al trattamento. In tutti i pazienti con aumento dell'emoglobina si è verificato anche un aumento del numero di cellule segmentate fino a oltre 1500 per 1 µl, ma la risposta piastrinica è stata meno pronunciata e ha raggiunto solo 25.000-90.000 per 1 µl. Tipicamente, il numero di neutrofili segmentati aumentava più lentamente del livello di emoglobina e il numero di piastrine aumentava ancora più lentamente. La durata totale del trattamento con androgeni in questi pazienti variava da 2 a 15 mesi; dopo la cessazione del trattamento, sono rimasti in remissione indefinitamente. 2 pazienti che hanno risposto positivamente al trattamento avevano aplasia idiopatica e 8 avevano aplasia tossica. Tra i pazienti che non hanno risposto, 3 presentavano forme di aplasia idiopatica e 4 tossiche. Gli autori hanno suggerito che il trattamento a lungo termine con alte dosi di corticosteroidi può compromettere la funzionalità del midollo osseo a causa di un aumento della quantità di tessuto adiposo nel midollo osseo.
Desposito et al hanno ottenuto risultati simili utilizzando androgeni + steroidi. In 5 bambini su 9 con anemia aplastica acquisita si è verificato un pronunciato miglioramento ematologico, che si è rivelato stabile. 2 bambini avevano una forma idiopatica e 3 una forma tossica. (Dei pazienti che non hanno risposto al trattamento, 3 avevano anemia idiopatica e 1 anemia tossica.) Sono stati osservati rapporti temporali simili. La conta piastrinica è aumentata significativamente solo 9-17 mesi dopo l'inizio del trattamento, e anche allora ha raggiunto solo 50.000 in un paziente e 100.000 per 1 μl in 2 pazienti, mentre l'emoglobina e le cellule segmentate erano normali. Il trattamento è stato interrotto dopo 7-11 mesi; in 4 pazienti su 5, i livelli di emoglobina sono temporaneamente diminuiti per 1-3 mesi. I pazienti sono stati seguiti per un periodo da 1 a 3 anni. Durante questo periodo non hanno avuto ricadute.
Secondo questi due rapporti, è stata osservata una risposta positiva in poco più della metà dei bambini e il trattamento è stato efficace sia nella forma idiopatica che in quella tossica di anemia aplastica. Tra i pazienti con forme tossiche, la frequenza delle reazioni è stata forse leggermente superiore.
Fino alla pubblicazione dell'ultimo di questi articoli, si aveva l'impressione che i pazienti raramente sopravvivessero senza il trattamento con androgeni. Il miglioramento della sopravvivenza osservato nei due rapporti più recenti è stato attribuito ai progressi nella terapia sintomatica, compresi gli antibiotici e le trasfusioni di piastrine. In particolare, l’articolo di Hayne et al getta nuova luce sulla storia naturale della malattia e sembra colmare il divario tra pazienti trattati con androgeni e pazienti non trattati con androgeni (in 30 pazienti su 33 l’eziologia dell’anemia era tossica piuttosto che idiopatica, il che può spiegare la prognosi più favorevole). Gurman, in una revisione di 104 bambini affetti da anemia aplastica acquisita di Boston e Sydney, ha indicato che la sopravvivenza globale era del 34% con il trattamento combinato di androgeni e corticosteroidi e del 19% con corticosteroidi o terapia di supporto da sola.
Rapporti più recenti, compresi i risultati dello stesso Boston Children's Hospital, sono meno soddisfacenti. La mortalità era del 70-80% nonostante gli androgeni, i corticosteroidi e le cure di supporto. La curva di sopravvivenza è a due fasi. Molti pazienti allo stadio iniziale muoiono a causa di infezioni e sanguinamento entro i primi 6 mesi. Attualmente, l’efficacia degli androgeni nei pazienti con grave aplasia acquisita è messa in discussione.
Segni prognostici. Secondo il lavoro di Gurman, la prognosi sembra essere peggiore nell'anemia aplastica dopo infezioni, soprattutto epatite infettiva, o dopo un singolo breve ciclo di cloramfenicolo. La prognosi è migliore nei casi idiopatici, così come nei pazienti con anemia, il che può essere spiegato con l'assunzione di anticonvulsivanti o con cicli ripetuti di cloramfenicolo. È stato suggerito che il midollo osseo di un bambino che sviluppa anemia aplastica dopo un breve ciclo sia spesso più depresso di quello di un bambino la cui pancitopenia è indotta solo da cicli ripetuti di farmaci. È noto che nei bambini con grave ipocellularità del midollo osseo, una prognosi particolarmente grave è indicata da un numero di linfociti nel midollo osseo superiore all'85%, da un numero di neutrofili inferiore a 200 in 1 μl o da piastrine inferiori a 20.000 in 1 ml. Sulla base di questi dati, Hamitt et al hanno suggerito che l'aplasia grave dopo l'epatite dovrebbe essere considerata un'indicazione per il trapianto precoce di midollo osseo poiché solo il 10% circa dei pazienti di questo tipo sopravvive con terapia di mantenimento + androgeni e steroidi.
Trapianto di midollo osseo . A causa del fallimento dei trattamenti con androgeni per l’anemia aplastica acquisita grave, i ricercatori si sono rivolti alla possibilità del trapianto di midollo osseo. Dopo infusioni endovenose di midollo osseo di gemelli identici, in 5 casi su 10 si è verificato un rapido recupero della funzione del midollo osseo. Se non sono disponibili donatori gemelli identici, un ostacolo importante è il possibile rigetto del trapianto o, se sopravvive, la malattia del trapianto contro l'ospite. Tuttavia, tra i fratelli normali, esiste una possibilità su 4 che venga trovato un donatore istocompatibile, selezionato utilizzando la tipizzazione HL-A e una coltura mista di linfociti per identificare i restanti loci di istocompatibilità. Queste precauzioni riducono il problema dell’incompatibilità dell’innesto, ma non lo risolvono completamente. Per ridurre o eliminare la possibilità di rigetto, è necessaria un'ulteriore terapia immunosoppressiva, come ciclofosfamide ad alte dosi prima del trapianto di midollo osseo e un ciclo di metotrexato dopo il trapianto. Prima di tentare questa misura terapeutica, è necessario effettuare una massiccia terapia di supporto, comprendente l'assistenza al paziente in un ambiente sterile, trasfusioni di leucociti e piastrine nei primi giorni critici, nonché la presenza di un'équipe medica con vasta esperienza. Thomas et al descrivono la tecnica di raccolta, lavorazione e infusione del midollo osseo. 24 pazienti (di cui 8 di età inferiore a 14 anni) con anemia aplastica grave (14 casi di anemia idiopatica, 4 casi di anemia post-epatite, 4 indotti da farmaci, 1 - EPN, 1 - anemia di Fanconi), che non hanno risposto alla terapia convenzionale trattamento, hanno ricevuto trapianti da fratelli identici in HL-A. In 21 pazienti è stata osservata una rapida rigenerazione del midollo osseo, che nella maggior parte dei casi, come determinato utilizzando marcatori genetici, era dovuta alle cellule del donatore. In 4 pazienti il trapianto è stato rifiutato e sono morti. Quattro pazienti sono morti per malattie secondarie, 11 persone vivono con trapianti funzionanti. Il periodo di osservazione variava da 141 giorni a 823 giorni. Dieci pazienti sono tornati a un normale stile di vita attivo. Questi risultati, ottenuti da un gruppo di ricercatori di Seattle, hanno spinto altri a utilizzare questo metodo. Nella fig. La Figura 25 mostra il risultato del primo trapianto nel Regno Unito, eseguito dal team di trapianto di midollo osseo del Royal Marsden Hospital. È possibile che questa sia la via da seguire nel trattamento dei singoli pazienti con segni prognostici sfavorevoli quando cercano aiuto per la prima volta.
Vari tipi di trattamento. Nei pazienti refrattari ad altri trattamenti e con midollo osseo cellulare, è indicata la splenectomia. Tuttavia, in un ampio gruppo di casi, l'effetto atteso di questa operazione non è stato confermato e poiché la splenectomia è piuttosto pericolosa in questi pazienti con trombocitopenia, generalmente non è raccomandata. Una possibile eccezione sono i pazienti con un elemento di emolisi e con sequestro rilevato di globuli rossi nella milza. È stato accertato che la splenectomia aumenta l'aspettativa di vita delle piastrine nei pazienti con aplasia che non traggono più beneficio dalla trasfusione piastrinica.
Per l'anemia aplastica è stata proposta la somministrazione di fitoemoagglutinina per via endovenosa, ma i dati finora raccolti non supportano le ipotesi sulla fattibilità di questo metodo. Il trattamento con ferro è controindicato, così come il trattamento con cobalto, che provoca nausea, vomito e ingrossamento della tiroide. L'acido folico e la vitamina B12 sono inefficaci anche nei pazienti con alterazioni megaloblastiche.
Rivista femminile www.
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0