SCAMBIO DI CALORE.
1. Trasferimento di calore.
Scambio termico o trasferimento di caloreè il processo di trasferimento dell'energia interna da un corpo a un altro senza compiere lavoro.
Esistono tre tipi di trasferimento di calore.
1) Conduttività termicaè lo scambio termico tra corpi a diretto contatto.
2) Convezioneè il trasferimento di calore in cui il calore viene trasferito da flussi di gas o liquidi.
3) Radiazioneè il trasferimento di calore mediante radiazione elettromagnetica.
2. La quantità di calore.
La quantità di calore è una misura della variazione dell'energia interna di un corpo durante lo scambio di calore. Indicato con la lettera Q.
L'unità di misura della quantità di calore = 1 J.
La quantità di calore ricevuta da un corpo da un altro corpo come risultato del trasferimento di calore può essere spesa per aumentare la temperatura (aumento dell'energia cinetica delle molecole) o per modificare lo stato di aggregazione (aumento dell'energia potenziale).
3. Capacità termica specifica di una sostanza.
L'esperienza mostra che la quantità di calore necessaria per riscaldare un corpo di massa m dalla temperatura T 1 alla temperatura T 2 è proporzionale alla massa corporea m e alla differenza di temperatura (T 2 - T 1), cioè
Q = cm(T 2 - T 1 ) = conMΔ T,
Conè detta capacità termica specifica della sostanza del corpo riscaldato.
![]()
Il calore specifico di una sostanza è uguale alla quantità di calore che deve essere impartita a 1 kg di sostanza per riscaldarlo di 1 K.
Unità di capacità termica specifica =.
I valori di capacità termica di varie sostanze possono essere trovati nelle tabelle fisiche.
Esattamente la stessa quantità di calore Q verrà rilasciata quando il corpo viene raffreddato da ΔT.
4. Calore specifico di vaporizzazione.
L’esperienza dimostra che la quantità di calore necessaria per convertire un liquido in vapore è proporzionale alla massa del liquido, cioè
Q = lm,
dove è il coefficiente di proporzionalità lè chiamato calore specifico di vaporizzazione.
Il calore specifico di vaporizzazione è pari alla quantità di calore necessaria per trasformare in vapore 1 kg di liquido al punto di ebollizione.
Unità di misura del calore specifico di vaporizzazione.
Nel processo inverso, la condensazione del vapore, viene rilasciata calore nella stessa quantità spesa per la vaporizzazione.
5. Calore specifico di fusione.
L’esperienza dimostra che la quantità di calore necessaria per trasformare un solido in un liquido è proporzionale alla massa del corpo, cioè
Q = λ M,
dove il coefficiente di proporzionalità λ è detto calore specifico di fusione.
Il calore specifico di fusione è pari alla quantità di calore necessaria per trasformare un corpo solido del peso di 1 kg in un liquido al punto di fusione.
Unità di misura del calore specifico di fusione.
Nel processo inverso, la cristallizzazione di un liquido, viene rilasciata calore nella stessa quantità spesa per la fusione.
6. Calore specifico di combustione.
L'esperienza dimostra che la quantità di calore rilasciata durante la combustione completa del carburante è proporzionale alla massa del carburante, cioè
Q = QM,
Dove il fattore di proporzionalità q è chiamato calore specifico di combustione.
Il calore specifico di combustione è pari alla quantità di calore rilasciata durante la combustione completa di 1 kg di carburante.
Unità di misura del calore specifico di combustione.
7. Equazione del bilancio termico.
Due o più corpi sono coinvolti nello scambio termico. Alcuni corpi emettono calore, mentre altri lo ricevono. Il trasferimento di calore avviene finché le temperature dei corpi non diventano uguali. Secondo la legge di conservazione dell’energia la quantità di calore ceduta è uguale a quella ricevuta. Su questa base viene scritta l'equazione del bilancio termico.
Considera un esempio.
Un corpo di massa m 1 , la cui capacità termica è c 1 , ha temperatura T 1 , e un corpo di massa m 2 , la cui capacità termica è c 2 , ha temperatura T 2 . Inoltre, T1 è maggiore di T2. Questi corpi vengono messi in contatto. L'esperienza mostra che un corpo freddo (m 2) inizia a riscaldarsi e un corpo caldo (m 1) inizia a raffreddarsi. Ciò suggerisce che parte dell'energia interna di un corpo caldo viene trasferita a uno freddo e le temperature si uniformano. Indichiamo la temperatura totale finale con θ. 
La quantità di calore trasferita da un corpo caldo a uno freddo
Q trasferito. = C 1 M 1 (T 1 – θ )
La quantità di calore ricevuta da un corpo freddo da uno caldo
Q ricevuto. = C 2 M 2 (θ – T 2 )
Secondo la legge di conservazione dell'energia Q trasferito. = Q ricevuto., cioè.
C 1 M 1 (T 1 – θ )= C 2 M 2 (θ – T 2 )
Apriamo le parentesi ed esprimiamo il valore della temperatura totale a regime θ.
![]()
Il valore della temperatura θ in questo caso sarà ottenuto in Kelvin.
Tuttavia, poiché nelle espressioni per Q è passato. e Q viene ricevuto. se c'è una differenza tra due temperature, ed è la stessa sia in Kelvin che in gradi Celsius, allora il calcolo può essere effettuato in gradi Celsius. Poi
![]()
In questo caso il valore della temperatura θ sarà ottenuto in gradi Celsius.
L'allineamento delle temperature dovuto alla conduzione del calore può essere spiegato sulla base della teoria cinetica molecolare come lo scambio di energia cinetica tra le molecole durante la collisione nel processo di movimento termico caotico.
Questo esempio può essere illustrato con un grafico. 
Viene chiamato il processo di trasferimento di energia da un corpo a un altro senza compiere lavoro scambio di calore O trasferimento di calore. Il trasferimento di calore avviene tra corpi che hanno temperature diverse. Quando si stabilisce il contatto tra corpi a temperatura diversa, una parte dell'energia interna viene trasferita da un corpo a temperatura più alta a un corpo a temperatura più bassa. Viene chiamata l'energia trasferita al corpo a seguito del trasferimento di calore quantità di calore.
Capacità termica specifica di una sostanza:
Se il processo di trasferimento del calore non è accompagnato da lavoro, allora, in base alla prima legge della termodinamica, la quantità di calore è uguale alla variazione dell'energia interna del corpo: .
L'energia media del movimento traslatorio casuale delle molecole è proporzionale alla temperatura assoluta. La variazione dell'energia interna di un corpo è pari alla somma algebrica delle variazioni dell'energia di tutti gli atomi o molecole, il cui numero è proporzionale alla massa del corpo, quindi la variazione dell'energia interna e, di conseguenza, la quantità di calore è proporzionale alla massa e alla variazione di temperatura:


Il fattore di proporzionalità in questa equazione si chiama capacità termica specifica di una sostanza. Il calore specifico indica la quantità di calore necessaria per aumentare di 1 K la temperatura di 1 kg di sostanza.
Lavoro in termodinamica:
In meccanica il lavoro è definito come il prodotto dei moduli di forza e spostamento per il coseno dell'angolo formato da essi. Il lavoro viene compiuto quando una forza agisce su un corpo in movimento ed è uguale alla variazione della sua energia cinetica.
In termodinamica non si considera il movimento di un corpo nel suo insieme; si tratta del movimento delle parti di un corpo macroscopico l'una rispetto all'altra. Di conseguenza, il volume del corpo cambia e la sua velocità rimane uguale a zero. Il lavoro in termodinamica è definito allo stesso modo della meccanica, ma è uguale alla variazione non dell'energia cinetica del corpo, ma della sua energia interna.
Quando viene compiuto il lavoro (compressione o espansione), l'energia interna del gas cambia. La ragione di ciò è la seguente: durante le collisioni elastiche delle molecole di gas con un pistone in movimento, la loro energia cinetica cambia.
Calcoliamo il lavoro compiuto dal gas durante l'espansione. Il gas agisce sul pistone con una forza  , Dove
, Dove  è la pressione del gas, e
è la pressione del gas, e  - superficie
- superficie  pistone. Quando il gas si espande, il pistone si muove nella direzione della forza
pistone. Quando il gas si espande, il pistone si muove nella direzione della forza  per una breve distanza
per una breve distanza  . Se la distanza è piccola, la pressione del gas può essere considerata costante. Il lavoro del gas è:
. Se la distanza è piccola, la pressione del gas può essere considerata costante. Il lavoro del gas è:
Dove  - variazione del volume del gas.
- variazione del volume del gas.
Nel processo di espansione il gas compie un lavoro positivo poiché la direzione della forza e dello spostamento coincidono. Nel processo di espansione il gas cede energia ai corpi circostanti.
Il lavoro compiuto dai corpi esterni su un gas differisce dal lavoro del gas solo nel segno  , perché la forza
, perché la forza  agire sul gas è opposto alla forza
agire sul gas è opposto alla forza  , con cui il gas agisce sul pistone, ed è ad esso uguale in valore assoluto (terza legge di Newton); e il movimento rimane lo stesso. Pertanto il lavoro delle forze esterne è pari a:
, con cui il gas agisce sul pistone, ed è ad esso uguale in valore assoluto (terza legge di Newton); e il movimento rimane lo stesso. Pertanto il lavoro delle forze esterne è pari a:
 .
.
Prima legge della termodinamica:
La prima legge della termodinamica è la legge di conservazione dell'energia, estesa ai fenomeni termici. Legge di conservazione dell'energia: l'energia in natura non nasce dal nulla e non scompare: la quantità di energia è immutata, cambia solo da una forma all'altra.
In termodinamica vengono considerati i corpi, la cui posizione del baricentro praticamente non cambia. L'energia meccanica di tali corpi rimane costante e solo l'energia interna può cambiare.
L'energia interna può essere modificata in due modi: trasferimento di calore e lavoro. Nel caso generale, l'energia interna cambia sia per lo scambio di calore che per la prestazione del lavoro. La prima legge della termodinamica è formulata proprio per questi casi generali:
La variazione dell'energia interna del sistema durante la transizione da uno stato all'altro è uguale alla somma del lavoro delle forze esterne e della quantità di calore trasferito al sistema:

Se il sistema è isolato non viene svolto lavoro su di esso e non scambia calore con i corpi circostanti. Secondo la prima legge della termodinamica l'energia interna di un sistema isolato rimane invariata.
Dato che  , la prima legge della termodinamica può essere scritta come segue:
, la prima legge della termodinamica può essere scritta come segue:

La quantità di calore ceduta al sistema va a modificare la sua energia interna e a compiere lavoro sui corpi esterni da parte del sistema.
Seconda legge della termodinamica: è impossibile trasferire calore da un sistema più freddo a uno più caldo in assenza di altri cambiamenti simultanei in entrambi i sistemi o nei corpi circostanti.
730. Perché si usa l'acqua per raffreddare alcuni meccanismi?
L'acqua ha un'elevata capacità termica specifica, che contribuisce a una buona rimozione del calore dal meccanismo.
731. In quale caso si dovrebbe spendere più energia: per riscaldare di 1 °C un litro d'acqua o per riscaldare di 1 °C cento grammi d'acqua?
Per riscaldare un litro d'acqua, poiché maggiore è la massa, maggiore è l'energia necessaria da spendere.
732. Forchette di cupronichel e d'argento della stessa massa furono immerse in acqua calda. Ricevono la stessa quantità di calore dall'acqua?
Una forchetta in cupronichel riceverà più calore, perché il calore specifico del cupronichel è maggiore di quello dell'argento.
733. Un pezzo di piombo e un pezzo di ghisa della stessa massa furono colpiti tre volte con una mazza. Quale parte è diventata più calda?
Il piombo si riscalda di più perché la sua capacità termica specifica è inferiore a quella della ghisa e per riscaldare il piombo è necessaria meno energia.
734. Un pallone contiene acqua, l'altro contiene cherosene della stessa massa e temperatura. In ciascuna fiaschetta veniva gettato un cubo di ferro ugualmente riscaldato. Cosa si riscalderà a una temperatura più alta: acqua o cherosene?
Cherosene.
735. Perché nelle città costiere le escursioni termiche in inverno e in estate sono meno marcate che nelle città dell'entroterra?
L'acqua si riscalda e si raffredda più lentamente dell'aria. In inverno si raffredda e sposta masse d'aria calda sulla terraferma, rendendo più caldo il clima sulla costa.
736. Il calore specifico dell'alluminio è 920 J/kg °C. Cosa significa questo?
Ciò significa che sono necessari 920 J per riscaldare 1 kg di alluminio di 1 °C.
737. Barre di alluminio e rame della stessa massa di 1 kg vengono raffreddate di 1 °C. Di quanto cambierà l'energia interna di ciascun blocco? Quale barra cambierà di più e di quanto?
738. Quale quantità di calore è necessaria per riscaldare un chilogrammo di billetta di ferro a 45 °C?

739. Quanto calore è necessario per riscaldare 0,25 kg di acqua da 30°C a 50°C?

740. Come cambierà l'energia interna di due litri d'acqua riscaldati di 5 °C?

741. Quanto calore è necessario per riscaldare 5 g di acqua da 20 °C a 30 °C?
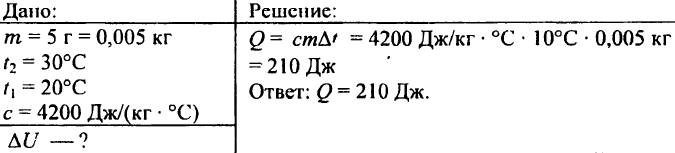
742. Quale quantità di calore è necessaria per riscaldare a 72 °C una palla di alluminio del peso di 0,03 kg?
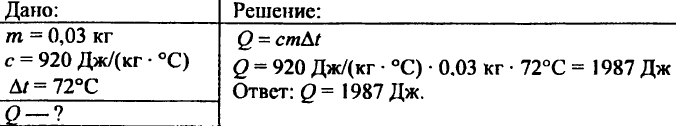
743. Calcola la quantità di calore necessaria per riscaldare 15 kg di rame di 80 °C.

744. Calcola la quantità di calore necessaria per riscaldare 5 kg di rame da 10 °C a 200 °C.

745. Quale quantità di calore è necessaria per riscaldare 0,2 kg di acqua da 15 °C a 20 °C?

746. L'acqua del peso di 0,3 kg si è raffreddata di 20 °C. Di quanto si riduce l'energia interna dell'acqua?

747. Quanto calore è necessario per portare 0,4 kg di acqua dalla temperatura di 20 °C alla temperatura di 30 °C?

748. Quanto calore viene speso per riscaldare 2,5 kg di acqua di 20 °C?

749. Quanto calore è stato rilasciato quando 250 g di acqua sono raffreddati da 90 °C a 40 °C?

750. Quale quantità di calore è necessaria per riscaldare 0,015 litri di acqua di 1 °C?
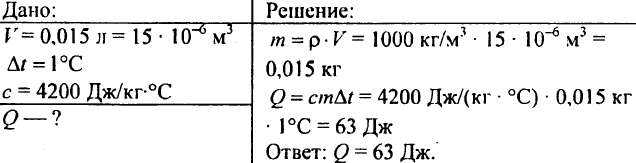
751. Calcolare la quantità di calore necessaria per riscaldare a 10 °C uno stagno del volume di 300 m3?
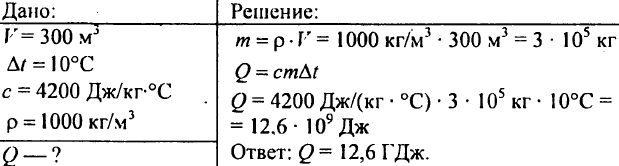
752. Quanto calore bisogna impartire a 1 kg d'acqua per innalzarne la temperatura da 30°C a 40°C?
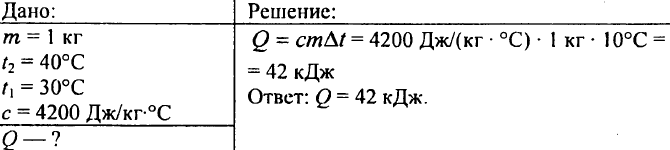
753. L'acqua con un volume di 10 litri si è raffreddata da una temperatura di 100 °C a una temperatura di 40 °C. Quanto calore viene rilasciato in questo caso?

754. Calcola la quantità di calore necessaria per riscaldare 1 m3 di sabbia di 60 °C.

755. Volume d'aria 60 m3, capacità termica specifica 1000 J/kg °C, densità dell'aria 1,29 kg/m3. Quanto calore è necessario per portarlo a 22°C?

756. L'acqua veniva riscaldata di 10 ° C, spendendo 4,20 103 J di calore. Determina la quantità di acqua.

757. L'acqua del peso di 0,5 kg riportava 20,95 kJ di calore. Qual era la temperatura dell'acqua se la temperatura iniziale dell'acqua era 20°C?

758. In una pentola di rame del peso di 2,5 kg si versano 8 kg di acqua a 10 °C. Quanto calore è necessario per portare ad ebollizione l'acqua in una pentola?

759. In un mestolo di rame del peso di 300 g si versa un litro d'acqua alla temperatura di 15° C. Quanto calore è necessario per riscaldare l'acqua nel mestolo di 85° C?

760. Un pezzo di granito riscaldato del peso di 3 kg viene posto in acqua. Il granito trasferisce 12,6 kJ di calore all'acqua, raffreddandosi di 10 °C. Qual è la capacità termica specifica della pietra?

761. A 5 kg di acqua a 12°C è stata aggiunta acqua calda a 50°C, ottenendo un impasto con temperatura di 30°C. Quanta acqua è stata aggiunta?

762. Acqua a 20°C è stata aggiunta a 3 litri di acqua a 60°C per ottenere acqua a 40°C. Quanta acqua è stata aggiunta?

763. Quale sarà la temperatura della miscela se si mescolano 600 g di acqua a 80 °C con 200 g di acqua a 20 °C?

764. Un litro d'acqua a 90°C fu versato in acqua a 10°C, e la temperatura dell'acqua divenne 60°C. Quanta acqua fredda c'era?
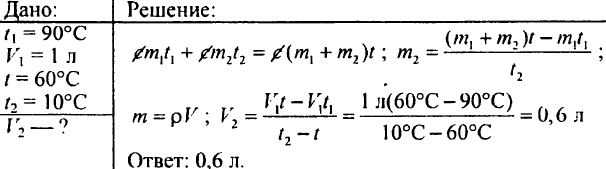
765. Determinare quanta acqua calda riscaldata a 60°C si deve versare in un recipiente se il recipiente contiene già 20 litri di acqua fredda alla temperatura di 15°C; la temperatura della miscela deve essere di 40°C.

766. Determina quanto calore è necessario per riscaldare 425 g di acqua di 20 °C.

767. Di quanti gradi si scalderanno 5 kg di acqua se l'acqua riceve 167,2 kJ?

768. Quanto calore è necessario per riscaldare m grammi di acqua da una temperatura t1 a una temperatura t2?
769. In un calorimetro si versano 2 kg di acqua alla temperatura di 15 °C. A quale temperatura si scalderà l'acqua del calorimetro se vi si immerge un peso di ottone di 500 g riscaldato a 100 °C? La capacità termica specifica dell'ottone è 0,37 kJ/(kg °C).

770. Sono presenti pezzi di rame, stagno e alluminio dello stesso volume. Quale di questi pezzi ha la capacità termica più grande e quale quella più piccola?

771. Nel calorimetro sono stati versati 450 g di acqua, la cui temperatura è di 20 °C. Quando in quest'acqua furono immersi 200 g di limatura di ferro riscaldati a 100°C, la temperatura dell'acqua divenne 24°C. Determinare la capacità termica specifica della segatura.

772. Un calorimetro di rame del peso di 100 g contiene 738 g di acqua, la cui temperatura è 15 °C. In questo calorimetro furono calati 200 g di rame ad una temperatura di 100 °C, dopodiché la temperatura del calorimetro salì a 17 °C. Qual è la capacità termica specifica del rame?

773. Una palla d'acciaio del peso di 10 g viene estratta dal forno e immersa nell'acqua alla temperatura di 10 °C. La temperatura dell'acqua è salita a 25°C. Qual è la temperatura della pallina nel forno se la massa dell'acqua è 50 g? La capacità termica specifica dell'acciaio è 0,5 kJ/(kg °C).

777. 50 g di acqua a 19 °C vengono versati in acqua del peso di 150 g a una temperatura di 35 °C. Qual è la temperatura della miscela?

778. In un bollitore di ghisa del peso di 2 kg alla temperatura di 10 °C è stata versata acqua del peso di 5 kg a 90 °C. Qual era la temperatura dell'acqua?

779. Uno scalpello d'acciaio del peso di 2 kg fu riscaldato ad una temperatura di 800 °C e poi calato in un recipiente contenente 15 litri di acqua alla temperatura di 10 °C. A quale temperatura verrà riscaldata l'acqua nella nave?

(Indicazione. Per risolvere questo problema, è necessario creare un'equazione in cui la temperatura desiderata dell'acqua nella nave dopo che la taglierina è stata abbassata viene presa come incognita.)
780. Quale temperatura raggiungerà l'acqua se si mescolano 0,02 kg di acqua a 15 °C, 0,03 kg di acqua a 25 °C e 0,01 kg di acqua a 60 °C?

781. Per riscaldare una classe ben ventilata è necessaria una quantità di calore di 4,19 MJ all'ora. L'acqua entra nei radiatori del riscaldamento a 80°C ed esce a 72°C. Quanta acqua dovrebbe essere fornita ai radiatori ogni ora?

782. Piombo del peso di 0,1 kg alla temperatura di 100 °C fu immerso in un calorimetro di alluminio del peso di 0,04 kg contenente 0,24 kg di acqua alla temperatura di 15 °C. Successivamente nel calorimetro è stata stabilita la temperatura di 16°C. Qual è la capacità termica specifica del piombo?

Come già sappiamo, l'energia interna di un corpo può cambiare sia durante l'esecuzione di lavoro, sia per trasferimento di calore (senza svolgere lavoro). La principale differenza tra lavoro e quantità di calore è che il lavoro determina il processo di conversione dell'energia interna del sistema, che è accompagnato dalla trasformazione dell'energia da un tipo all'altro.
Nel caso in cui il cambiamento nell'energia interna proceda con l'aiuto di trasferimento di calore, il trasferimento di energia da un corpo all'altro viene effettuato a causa di conduttività termica, radiazioni o convezione.
Viene chiamata l'energia che un corpo perde o acquista durante il trasferimento di calore la quantità di calore.
Quando si calcola la quantità di calore, è necessario sapere quali quantità lo influenzano.
Da due bruciatori identici riscalderemo due recipienti. In una nave 1 kg di acqua, nell'altra - 2 kg. Inizialmente la temperatura dell'acqua nei due recipienti è la stessa. Possiamo vedere che nello stesso tempo l'acqua in uno dei vasi si riscalda più velocemente, sebbene entrambi i vasi ricevano la stessa quantità di calore.
Quindi concludiamo: maggiore è la massa di un dato corpo, maggiore è la quantità di calore che dovrebbe essere spesa per abbassare o aumentare la sua temperatura dello stesso numero di gradi.
Quando il corpo si raffredda, cede agli oggetti vicini maggiore è la quantità di calore, maggiore è la sua massa.
Sappiamo tutti che se dobbiamo riscaldare un bollitore pieno d'acqua alla temperatura di 50°C, impiegheremo meno tempo in questa azione rispetto a riscaldare un bollitore con lo stesso volume d'acqua, ma solo fino a 100°C. Nel primo caso verrà dato meno calore all'acqua rispetto al secondo.
Pertanto, la quantità di calore richiesta per il riscaldamento dipende direttamente da quanti gradi il corpo può riscaldarsi. Possiamo concludere: la quantità di calore dipende direttamente dalla differenza di temperatura del corpo.
Ma è possibile determinare la quantità di calore necessaria non per riscaldare l'acqua, ma per qualche altra sostanza, ad esempio petrolio, piombo o ferro.
 Riempi un recipiente con acqua e l'altro con olio vegetale. Le masse dell'acqua e dell'olio sono uguali. Entrambe le navi verranno riscaldate uniformemente sugli stessi bruciatori. Iniziamo l'esperimento alla stessa temperatura iniziale dell'olio vegetale e dell'acqua. Cinque minuti dopo, misurando la temperatura dell'olio e dell'acqua riscaldati, noteremo che la temperatura dell'olio è molto più alta della temperatura dell'acqua, sebbene entrambi i fluidi abbiano ricevuto la stessa quantità di calore.
Riempi un recipiente con acqua e l'altro con olio vegetale. Le masse dell'acqua e dell'olio sono uguali. Entrambe le navi verranno riscaldate uniformemente sugli stessi bruciatori. Iniziamo l'esperimento alla stessa temperatura iniziale dell'olio vegetale e dell'acqua. Cinque minuti dopo, misurando la temperatura dell'olio e dell'acqua riscaldati, noteremo che la temperatura dell'olio è molto più alta della temperatura dell'acqua, sebbene entrambi i fluidi abbiano ricevuto la stessa quantità di calore.
La conclusione ovvia è: Quando si riscaldano masse uguali di olio e acqua alla stessa temperatura, sono necessarie quantità diverse di calore.
E traiamo subito un'altra conclusione: la quantità di calore necessaria per riscaldare il corpo dipende direttamente dalla sostanza di cui è composto il corpo stesso (il tipo di sostanza).
Pertanto, la quantità di calore necessaria per riscaldare il corpo (o rilasciata durante il raffreddamento) dipende direttamente dalla massa del corpo, dalla variabilità della sua temperatura e dal tipo di sostanza.
La quantità di calore è indicata dal simbolo Q. Come altri vari tipi di energia, la quantità di calore è misurata in joule (J) o in kilojoule (kJ).
1 kJ = 1000 J
Tuttavia, la storia mostra che gli scienziati hanno iniziato a misurare la quantità di calore molto prima che un concetto come l'energia apparisse in fisica. A quel tempo, fu sviluppata un'unità speciale per misurare la quantità di calore: una caloria (cal) o una chilocaloria (kcal). La parola ha radici latine, calorus - calore.
1kcal = 1000cal
Caloriaè la quantità di calore necessaria per aumentare di 1°C la temperatura di 1 g di acqua
1 cal = 4,19 J ≈ 4,2 J
1 kcal = 4190 J ≈ 4200 J ≈ 4,2 kJ
Avete domande? Non sai come fare i compiti?
Per ottenere l'aiuto di un tutor, registrati.
La prima lezione è gratuita!
sito, con la copia totale o parziale del materiale, è richiesto un collegamento alla fonte.
Come sapete, durante vari processi meccanici si verifica un cambiamento nell'energia meccanica. La misura della variazione dell'energia meccanica è il lavoro delle forze applicate al sistema:
Durante il trasferimento di calore si verifica un cambiamento nell'energia interna del corpo. La misura della variazione dell'energia interna durante il trasferimento di calore è la quantità di calore.
Quantità di caloreè una misura della variazione dell'energia interna che il corpo riceve (o cede) nel processo di trasferimento del calore.
Pertanto, sia il lavoro che la quantità di calore caratterizzano la variazione di energia, ma non sono identici all'energia. Non caratterizzano lo stato del sistema stesso, ma determinano il processo di trasferimento di energia da una forma all'altra (da un corpo all'altro) quando lo stato cambia e dipendono essenzialmente dalla natura del processo.
La principale differenza tra lavoro e quantità di calore è che il lavoro caratterizza il processo di modifica dell'energia interna del sistema, accompagnato dalla trasformazione dell'energia da un tipo all'altro (da meccanica a interna). La quantità di calore caratterizza il processo di trasferimento dell'energia interna da un corpo all'altro (da più riscaldato a meno riscaldato), non accompagnato da trasformazioni energetiche.
L'esperienza mostra che la quantità di calore necessaria per riscaldare un corpo di massa m da una temperatura all'altra si calcola con la formula
dove c è la capacità termica specifica della sostanza;
![]()
L'unità SI del calore specifico è il joule per chilogrammo-Kelvin (J/(kg K)).
Calore specifico c è numericamente uguale alla quantità di calore che deve essere impartita a un corpo di massa 1 kg per riscaldarlo di 1 K.
Capacità termica corpo è numericamente uguale alla quantità di calore necessaria per modificare la temperatura corporea di 1 K:
![]()
L'unità SI della capacità termica di un corpo è il joule per Kelvin (J/K).
Per trasformare un liquido in vapore a temperatura costante, la quantità di calore necessaria è
dove L è il calore specifico di vaporizzazione. Quando il vapore si condensa, viene rilasciata la stessa quantità di calore.
- In contatto con 0
- Google Plus 0
- OK 0
- Facebook 0







