730. Perché si usa l'acqua per raffreddare alcuni meccanismi?
L'acqua ha un'elevata capacità termica specifica, che facilita una buona rimozione del calore dal meccanismo.
731. In quale caso è necessario spendere più energia: riscaldare di 1 °C un litro d'acqua o riscaldare di 1 °C cento grammi d'acqua?
Per riscaldare un litro d'acqua, maggiore è la massa, maggiore è l'energia necessaria.
732. Forchette d'argento cupronichel e d'argento di uguale massa furono immerse in acqua calda. Riceveranno la stessa quantità di calore dall'acqua?
Una forchetta in cupronichel riceverà più calore perché il calore specifico del cupronichel è maggiore di quello dell'argento.
733. Un pezzo di piombo e un pezzo di ghisa della stessa massa furono colpiti tre volte con una mazza. Quale pezzo è diventato più caldo?
Il piombo si riscalda di più perché la sua capacità termica specifica è inferiore a quella della ghisa e richiede meno energia per riscaldare il piombo.
734. Un pallone contiene acqua, l'altro contiene cherosene della stessa massa e temperatura. In ciascuna fiaschetta è stato lasciato cadere un cubo di ferro ugualmente riscaldato. Cosa si riscalderà a una temperatura più alta: acqua o cherosene?
Cherosene.
735. Perché le escursioni termiche in inverno e in estate sono meno marcate nelle città costiere che nelle città dell'entroterra?
L'acqua si riscalda e si raffredda più lentamente dell'aria. In inverno si raffredda e sposta masse d'aria calda sulla terraferma, rendendo più caldo il clima sulla costa.
736. Il calore specifico dell'alluminio è 920 J/kg °C. Cosa significa questo?
Ciò significa che per riscaldare 1 kg di alluminio di 1 °C è necessario spendere 920 J.
737. Barre di alluminio e rame della stessa massa di 1 kg vengono raffreddate di 1 °C. Di quanto cambierà l'energia interna di ciascun blocco? Per quale barra cambierà di più e di quanto?
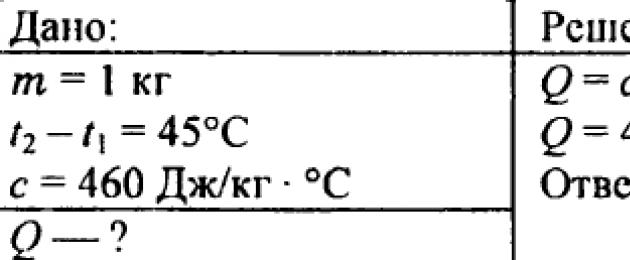
738. Quale quantità di calore è necessaria per riscaldare un chilogrammo di billetta di ferro di 45 °C?
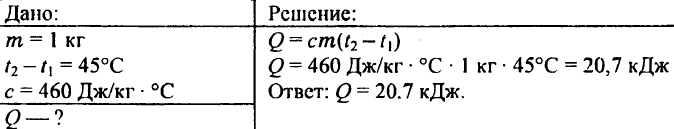
739. Quale quantità di calore è necessaria per riscaldare 0,25 kg di acqua da 30 °C a 50 °C?

740. Come cambierà l'energia interna di due litri d'acqua riscaldati di 5 °C?

741. Quale quantità di calore è necessaria per riscaldare 5 g di acqua da 20 °C a 30 °C?
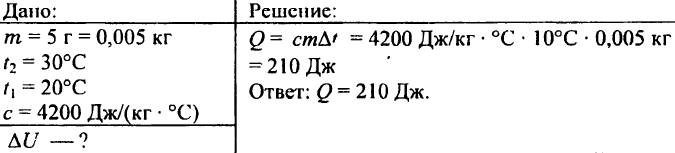
742. Quale quantità di calore è necessaria per riscaldare a 72 °C una palla di alluminio del peso di 0,03 kg?

743. Calcola la quantità di calore necessaria per riscaldare 15 kg di rame di 80 °C.

744. Calcola la quantità di calore necessaria per riscaldare 5 kg di rame da 10 °C a 200 °C.

745. Quale quantità di calore è necessaria per riscaldare 0,2 kg di acqua da 15 °C a 20 °C?

746. L'acqua del peso di 0,3 kg si è raffreddata di 20 °C. Di quanto è diminuita l'energia interna dell'acqua?

747. Quale quantità di calore è necessaria per riscaldare 0,4 kg di acqua da una temperatura di 20 °C a una temperatura di 30 °C?

748. Quale quantità di calore viene spesa per riscaldare 2,5 kg di acqua di 20 °C?
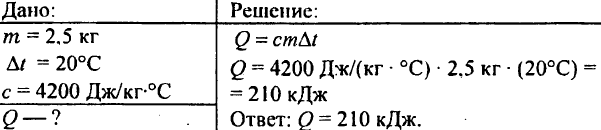
749. Quale quantità di calore è stata rilasciata quando 250 g di acqua sono raffreddati da 90 °C a 40 °C?
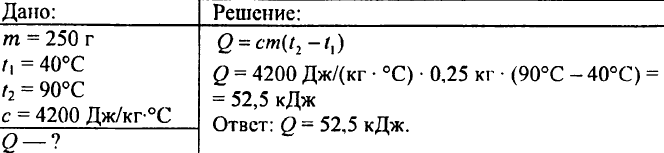
750. Quale quantità di calore è necessaria per riscaldare 0,015 litri di acqua di 1 °C?

751. Calcolare la quantità di calore necessaria per riscaldare a 10 °C uno stagno del volume di 300 m3?

752. Quale quantità di calore bisogna aggiungere a 1 kg di acqua per aumentarne la temperatura da 30 °C a 40 °C?

753. L'acqua con un volume di 10 litri si è raffreddata da una temperatura di 100 °C a una temperatura di 40 °C. Quanto calore è stato rilasciato durante questo?

754. Calcola la quantità di calore necessaria per riscaldare 1 m3 di sabbia di 60 °C.

755. Volume d'aria 60 m3, capacità termica specifica 1000 J/kg °C, densità dell'aria 1,29 kg/m3. Quanto calore è necessario per portarlo a 22°C?
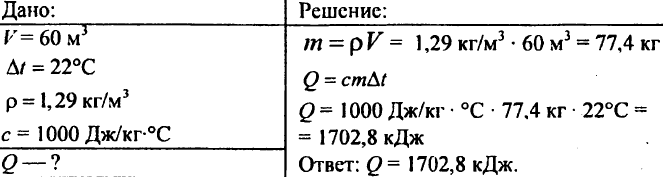
756. L'acqua è stata riscaldata di 10 °C, consumando 4,20·103 J di calore. Determina la quantità di acqua.

757. All'acqua del peso di 0,5 kg sono stati impartiti 20,95 kJ di calore. Quale sarebbe la temperatura dell'acqua se la temperatura iniziale dell'acqua fosse 20 °C?
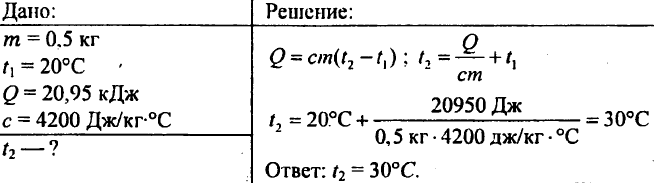
758. Una pentola di rame del peso di 2,5 kg viene riempita con 8 kg di acqua a 10 °C. Quanto calore è necessario per portare a ebollizione l'acqua nella padella?

759. In un mestolo di rame del peso di 300 g si versa un litro d'acqua alla temperatura di 15 °C.Quanta quantità di calore è necessaria per portare l'acqua nel mestolo a 85 °C?

760. Un pezzo di granito riscaldato del peso di 3 kg viene posto in acqua. Il granito trasferisce 12,6 kJ di calore all'acqua, raffreddandosi di 10 °C. Qual è la capacità termica specifica della pietra?

761. A 5 kg di acqua a 12°C è stata aggiunta acqua calda a 50°C, ottenendo un impasto con temperatura di 30°C. Quanta acqua hai aggiunto?

762. A 3 litri di acqua a 60°C è stata aggiunta acqua a 20°C, ottenendo acqua a 40°C. Quanta acqua hai aggiunto?

763. Quale sarà la temperatura della miscela se si mescolano 600 g di acqua a 80 °C con 200 g di acqua a 20 °C?

764. Un litro d'acqua a 90 °C fu versato in acqua a 10 °C, e la temperatura dell'acqua arrivò a 60 °C. Quanta acqua fredda c'era?

765. Determinare quanta acqua calda riscaldata a 60 °C deve essere versata in un recipiente se il recipiente contiene già 20 litri di acqua fredda alla temperatura di 15 °C; la temperatura della miscela deve essere di 40°C.

766. Determina quanto calore è necessario per riscaldare 425 g di acqua di 20 °C.

767. Di quanti gradi si scalderanno 5 kg di acqua se l'acqua riceve 167,2 kJ?

768. Quanto calore è necessario per riscaldare m grammi di acqua dalla temperatura t1 alla temperatura t2?
769. In un calorimetro si versano 2 kg di acqua alla temperatura di 15 °C. A quale temperatura si scalderà l'acqua del calorimetro se vi si immerge un peso di ottone di 500 g riscaldato a 100 °C? La capacità termica specifica dell'ottone è 0,37 kJ/(kg °C).

770. Sono presenti pezzi di rame, stagno e alluminio dello stesso volume. Quale di questi pezzi ha la capacità termica più grande e quale quella più piccola?

771. Nel calorimetro furono versati 450 g di acqua, la cui temperatura era di 20 °C. Quando in quest'acqua furono immersi 200 g di limatura di ferro riscaldati a 100 °C, la temperatura dell'acqua raggiunse i 24 °C. Determinare la capacità termica specifica della segatura.

772. Un calorimetro di rame del peso di 100 g contiene 738 g di acqua, la cui temperatura è 15 °C. In questo calorimetro furono calati 200 g di rame ad una temperatura di 100 °C, dopodiché la temperatura del calorimetro salì a 17 °C. Qual è la capacità termica specifica del rame?
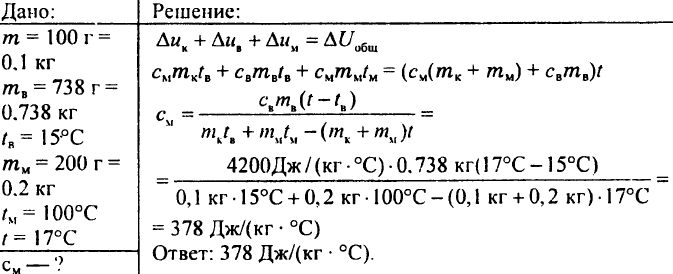
773. Una palla d'acciaio del peso di 10 g viene tolta dal forno e posta in acqua alla temperatura di 10 °C. La temperatura dell'acqua è salita a 25°C. Qual era la temperatura della pallina nel forno se la massa d'acqua era di 50 g? La capacità termica specifica dell'acciaio è 0,5 kJ/(kg °C).

777. 50 g di acqua a 19 °C sono stati versati in acqua del peso di 150 g alla temperatura di 35 °C. Qual è la temperatura della miscela?

778. In un recipiente di ghisa del peso di 2 kg alla temperatura di 10 °C è stata versata acqua del peso di 5 kg a 90 °C. Qual era la temperatura dell'acqua?

779. Un cutter d'acciaio del peso di 2 kg venne riscaldato alla temperatura di 800 °C e poi calato in un recipiente contenente 15 litri di acqua alla temperatura di 10 °C. A quale temperatura si scalderà l'acqua nella nave?

(Indicazione: per risolvere questo problema, è necessario creare un'equazione in cui viene considerata come sconosciuta la temperatura sconosciuta dell'acqua nel recipiente dopo aver abbassato la taglierina.)
780. Che temperatura avrà l'acqua se si mescolano 0,02 kg di acqua a 15 °C, 0,03 kg di acqua a 25 °C e 0,01 kg di acqua a 60 °C?

781. Per riscaldare una classe ben ventilata, la quantità di calore richiesta è di 4,19 MJ all'ora. L'acqua entra nei radiatori del riscaldamento a 80 °C e li esce a 72 °C. Quanta acqua dovrebbe essere fornita ai radiatori ogni ora?

782. Piombo del peso di 0,1 kg alla temperatura di 100 °C fu immerso in un calorimetro di alluminio del peso di 0,04 kg contenente 0,24 kg di acqua alla temperatura di 15 °C. Dopo di che la temperatura nel calorimetro raggiunse i 16 °C. Qual è il calore specifico del piombo?

In questa lezione impareremo a calcolare la quantità di calore necessaria per riscaldare un corpo o ceduta da esso durante il raffreddamento. Per fare ciò, riassumeremo le conoscenze acquisite nelle lezioni precedenti.
Inoltre, impareremo, utilizzando la formula per la quantità di calore, a esprimere le quantità rimanenti da questa formula e a calcolarle, conoscendo altre quantità. Verrà inoltre considerato un esempio di problema con una soluzione per il calcolo della quantità di calore.
Questa lezione è dedicata al calcolo della quantità di calore quando un corpo viene riscaldato o rilasciato quando si raffredda.
La capacità di calcolare la quantità di calore richiesta è molto importante. Ciò può essere necessario, ad esempio, quando si calcola la quantità di calore che deve essere trasmessa all'acqua per riscaldare una stanza.
Riso. 1. La quantità di calore che deve essere impartita all'acqua per riscaldare la stanza
Oppure per calcolare la quantità di calore rilasciata quando il carburante viene bruciato in vari motori:

Riso. 2. La quantità di calore rilasciata quando il carburante viene bruciato nel motore
Questa conoscenza è necessaria anche, ad esempio, per determinare la quantità di calore che viene rilasciata dal Sole e cade sulla Terra:

Riso. 3. La quantità di calore rilasciata dal Sole e che cade sulla Terra
Per calcolare la quantità di calore è necessario sapere tre cose (Fig. 4):
- peso corporeo (che solitamente può essere misurato utilizzando una bilancia);
- la differenza di temperatura con la quale un corpo deve essere riscaldato o raffreddato (solitamente misurata utilizzando un termometro);
- capacità termica specifica del corpo (che può essere determinata dalla tabella).

Riso. 4. Cosa devi sapere per determinarlo
La formula con cui viene calcolata la quantità di calore è simile alla seguente:
In questa formula compaiono le seguenti quantità:
La quantità di calore misurata in joule (J);
La capacità termica specifica di una sostanza si misura in ;
- differenza di temperatura, misurata in gradi Celsius ().
Consideriamo il problema del calcolo della quantità di calore.
Compito
Un bicchiere di rame con una massa di grammi contiene acqua con un volume di un litro ad una temperatura. Quanto calore deve essere trasferito ad un bicchiere d'acqua affinché la sua temperatura diventi uguale a ?

Riso. 5. Illustrazione delle condizioni problematiche
Per prima cosa scriviamo una breve condizione ( Dato) e convertire tutte le quantità nel sistema internazionale (SI).
|
Dato: |
SI |
|
|
Trovare: |
Soluzione:
Innanzitutto, determina quali altre quantità sono necessarie per risolvere questo problema. Utilizzando la tabella della capacità termica specifica (Tabella 1) troviamo (capacità termica specifica del rame, poiché per condizione il vetro è rame), (capacità termica specifica dell'acqua, poiché per condizione c'è acqua nel vetro). Inoltre sappiamo che per calcolare la quantità di calore abbiamo bisogno di una massa d'acqua. Secondo la condizione, ci viene dato solo il volume. Pertanto, dalla tabella prendiamo la densità dell'acqua: (Tabella 2).
Tavolo 1. Capacità termica specifica di alcune sostanze,
Tavolo 2. Densità di alcuni liquidi
Ora abbiamo tutto ciò che serve per risolvere questo problema.
Si noti che la quantità finale di calore sarà costituita dalla somma della quantità di calore necessaria per riscaldare il vetro di rame e della quantità di calore richiesta per riscaldare l'acqua al suo interno:
Calcoliamo innanzitutto la quantità di calore necessaria per riscaldare un vetro di rame:
Prima di calcolare la quantità di calore necessaria per riscaldare l'acqua, calcoliamo la massa dell'acqua utilizzando una formula che ci è familiare dal grado 7:
Ora possiamo calcolare:
Allora possiamo calcolare:
Ricordiamo cosa significano i kilojoule. Il prefisso "kilo" significa ![]() .
.
Risposta:.
Per comodità di risolvere i problemi relativi alla determinazione della quantità di calore (i cosiddetti problemi diretti) e delle quantità associate a questo concetto, è possibile utilizzare la tabella seguente.
|
Quantità richiesta |
Designazione |
Unità |
Formula di base |
Formula per quantità |
|
Quantità di calore |
Quando discutiamo dei metodi di riscaldamento di una casa, delle opzioni per ridurre le perdite di calore, dobbiamo capire cos'è il calore, in quali unità viene misurato, come viene trasferito e come viene perso. Questa pagina fornirà le informazioni di base del corso di fisica necessarie per considerare tutte le questioni di cui sopra.
Il calore è uno dei modi per trasferire energia
L'energia che un corpo riceve o perde nel processo di scambio termico con l'ambiente è chiamata quantità di calore o semplicemente calore.
In senso stretto, il calore è uno dei modi per trasferire energia e solo la quantità di energia trasferita al sistema ha un significato fisico, ma la parola "calore" è inclusa in concetti scientifici consolidati come flusso di calore, capacità termica, calore di transizione di fase, calore di una reazione chimica, conducibilità termica, ecc. Pertanto, laddove l'uso di tale parola non sia fuorviante, i concetti di “calore” e “quantità di calore” sono sinonimi. Tuttavia, questi termini possono essere utilizzati solo se viene data loro una definizione esatta, e in nessun caso la “quantità di calore” può essere considerata uno dei concetti originali che non necessitano di definizione. Per evitare errori, il concetto di "calore" dovrebbe essere inteso proprio come il metodo di trasferimento di energia, e la quantità di energia trasferita con questo metodo è denotata dal concetto di "quantità di calore". Si raccomanda di evitare il termine “energia termica”.
Il calore è la parte cinetica dell'energia interna di una sostanza, determinata dall'intenso movimento caotico delle molecole e degli atomi di cui tale sostanza è costituita. La temperatura è una misura dell'intensità del movimento molecolare. La quantità di calore posseduta da un corpo ad una data temperatura dipende dalla sua massa; ad esempio, alla stessa temperatura, una tazza grande d'acqua contiene più calore di una piccola, e un secchio di acqua fredda può contenere più calore di una tazza di acqua calda (sebbene la temperatura dell'acqua nel secchio sia inferiore) .
Il calore è una forma di energia e pertanto deve essere misurato in unità di energia. L'unità SI dell'energia è il joule (J). È anche possibile utilizzare un'unità di quantità di calore non sistemica, la caloria: la caloria internazionale è pari a 4,1868 J.
Scambio termico e trasmissione del calore
Il trasferimento di calore è il processo di trasferimento del calore all'interno di un corpo o da un corpo all'altro a causa delle differenze di temperatura. L'intensità del trasferimento di calore dipende dalle proprietà della sostanza, dalla differenza di temperatura e obbedisce alle leggi della natura stabilite sperimentalmente. Per creare sistemi di riscaldamento o raffreddamento funzionanti in modo efficiente, vari motori, centrali elettriche e sistemi di isolamento termico, è necessario conoscere i principi del trasferimento di calore. In alcuni casi lo scambio termico non è auspicabile (isolamento termico di forni fusori, astronavi, ecc.), mentre in altri dovrebbe essere il più ampio possibile (caldaie a vapore, scambiatori di calore, utensili da cucina). Esistono tre tipi principali di trasferimento di calore: conduzione, convezione e trasferimento di calore radiante.
Conduttività termica
Se c'è una differenza di temperatura all'interno del corpo, l'energia termica si sposta dalla parte più calda del corpo a quella più fredda. Questo tipo di trasferimento di calore, causato da movimenti termici e collisioni di molecole, è chiamato conduttività termica. La conduttività termica dell'asta è stimata dal valore flusso di calore, che dipende dal coefficiente di conduttività termica, dall'area della sezione trasversale attraverso la quale viene trasferito il calore e dal gradiente di temperatura (il rapporto tra la differenza di temperatura alle estremità dell'asta e la distanza tra loro). L'unità del flusso di calore è il watt.
CONDUTTIVITÀ TERMICA DI ALCUNE SOSTANZE E MATERIALI
Sostanze e materiali Conduttività termica, W/(m^2*K)
Metalli
Alluminio ___________________205
Bronzo _______________________105
Tungsteno ___________________159
Ferro _____________________________________________67
Rame _______________________389
Nichel _____________________________________________58
Piombo _____________________________________________35
Zinco _______________________113
Altri materiali
Amianto _______________________0.08
Calcestruzzo _________________________________0,59
Aria _______________________0.024
Piumino di edredone (sciolto) ______0,008
Legno (noce) ________________0.209
Segatura _______________________0.059
Gomma (spugna) ____________0,038
Vetro _______________________0,75
Convezione
La convezione è lo scambio di calore dovuto al movimento di masse d'aria o di liquido. Quando viene fornito calore a un liquido o a un gas, l'intensità del movimento molecolare aumenta e, di conseguenza, la pressione aumenta. Se un liquido o un gas non è limitato in volume, si espande; la densità locale del liquido (gas) diminuisce e, grazie alle forze di galleggiamento (di Archimede), la parte riscaldata del mezzo si sposta verso l'alto (motivo per cui l'aria calda nella stanza sale dai radiatori al soffitto). Nei casi semplici di flusso di fluido attraverso un tubo o di flusso attorno a una superficie piana, il coefficiente di scambio termico convettivo può essere calcolato teoricamente. Tuttavia non è stato ancora possibile trovare una soluzione analitica al problema della convezione per un flusso turbolento di un mezzo.
Radiazione termica
Il terzo tipo di trasferimento di calore - trasferimento di calore radiante - differisce dalla conduttività termica e dalla convezione in quanto il calore in questo caso può essere trasferito attraverso il vuoto. La sua somiglianza con altri metodi di trasferimento del calore è che anch'esso è causato da differenze di temperatura. La radiazione termica è un tipo di radiazione elettromagnetica.
Il Sole è un potente emettitore di energia termica; riscalda la Terra anche a una distanza di 150 milioni di km. L'intensità della radiazione solare è di circa 1,37 W/m2.
La velocità di trasferimento del calore per conduzione e convezione è proporzionale alla temperatura, mentre il flusso di calore radiante è proporzionale alla quarta potenza della temperatura.
Capacità termica
Sostanze diverse hanno capacità diverse di immagazzinare calore; questo dipende dalla loro struttura molecolare e dalla densità. La quantità di calore necessaria per aumentare di un grado (1 °C o 1 K) la temperatura di un'unità di massa di una sostanza è chiamata capacità termica specifica. La capacità termica è misurata in J/(kg K).
Solitamente si distingue tra capacità termica a volume costante ( CV) e capacità termica a pressione costante ( Con p), se durante il processo di riscaldamento il volume del corpo o la pressione, rispettivamente, vengono mantenuti costanti. Ad esempio, per riscaldare un grammo d'aria in un pallone di 1 K, è necessario più calore che per lo stesso riscaldamento in un recipiente sigillato con pareti rigide, poiché parte dell'energia impartita al pallone viene spesa per espandere l'aria, e non riscaldandolo. Quando riscaldato a pressione costante, parte del calore viene utilizzato per produrre il lavoro di dilatazione del corpo, e parte viene utilizzata per aumentare la sua energia interna, mentre quando riscaldato a volume costante tutto il calore viene speso per aumentare l'energia interna; a causa di ciò S R sempre più di CV. Nei liquidi e nei solidi, la differenza tra S R E CV relativamente piccolo.
Macchine termiche
I motori termici sono dispositivi che convertono il calore in lavoro utile. Esempi di tali macchine includono compressori, turbine, motori a vapore, a benzina e a reazione. Uno dei motori termici più famosi è la turbina a vapore, utilizzata nelle moderne centrali termoelettriche. Uno schema semplificato di tale centrale elettrica è mostrato nella Figura 1.

Riso. 1. Schema semplificato di una centrale elettrica con turbina a vapore alimentata a combustibili fossili.
Il fluido di lavoro, l'acqua, viene convertito in vapore surriscaldato in una caldaia a vapore, riscaldata bruciando combustibili fossili (carbone, petrolio o gas naturale). Il vapore ad alta pressione fa ruotare l'albero di una turbina a vapore, che aziona un generatore che produce elettricità. Il vapore di scarico si condensa quando viene raffreddato dall'acqua corrente, che assorbe parte del calore. Successivamente l'acqua viene fornita alla torre di raffreddamento, da dove parte del calore viene rilasciata nell'atmosfera. La condensa viene restituita alla caldaia a vapore tramite una pompa e l'intero ciclo viene ripetuto.
Un altro esempio di motore termico è un frigorifero domestico, il cui diagramma è mostrato in Fig. 2.

Nei frigoriferi e nei condizionatori domestici l'energia necessaria per fornirla viene fornita dall'esterno. Il compressore aumenta la temperatura e la pressione della sostanza operativa del frigorifero: freon, ammoniaca o anidride carbonica. Il gas surriscaldato viene fornito al condensatore, dove si raffredda e condensa cedendo calore all'ambiente. Il liquido in uscita dai tubi del condensatore passa attraverso la valvola di strozzamento nell'evaporatore e parte di esso evapora, il che è accompagnato da un forte calo di temperatura. L'evaporatore preleva calore dalla camera frigorifera, che riscalda il fluido di lavoro presente nelle tubazioni; questo liquido viene fornito dal compressore al condensatore e il ciclo si ripete nuovamente.
Come già sappiamo, l'energia interna di un corpo può cambiare sia durante l'esecuzione di un lavoro, sia attraverso lo scambio di calore (senza svolgere lavoro). La principale differenza tra lavoro e quantità di calore è che il lavoro determina il processo di conversione dell'energia interna del sistema, che è accompagnato dalla trasformazione dell'energia da un tipo all'altro.
Nel caso in cui si verifichi un cambiamento nell'energia interna con l'aiuto di trasferimento di calore, il trasferimento di energia da un corpo all'altro viene effettuato a causa di conduttività termica, radiazioni o convezione.
Viene chiamata l'energia che un corpo perde o acquista durante il trasferimento di calore quantità di calore.
Quando si calcola la quantità di calore, è necessario sapere quali quantità lo influenzano.
Riscalderemo due recipienti utilizzando due bruciatori identici. Un recipiente contiene 1 kg di acqua, l'altro contiene 2 kg. Inizialmente la temperatura dell'acqua nei due recipienti è la stessa. Possiamo vedere che nello stesso tempo l'acqua in uno dei vasi si riscalda più velocemente, sebbene entrambi i vasi ricevano la stessa quantità di calore.
Quindi concludiamo: maggiore è la massa di un dato corpo, maggiore è la quantità di calore che deve essere spesa per abbassare o aumentare la sua temperatura dello stesso numero di gradi.
Quando un corpo si raffredda, cede agli oggetti vicini una quantità maggiore di calore, maggiore è la sua massa.
Sappiamo tutti che se dobbiamo riscaldare un bollitore pieno d'acqua a una temperatura di 50°C, impiegheremo meno tempo in questa azione rispetto a riscaldare un bollitore con lo stesso volume d'acqua, ma solo a 100°C. Nel caso numero uno, verrà ceduto all’acqua meno calore rispetto al caso due.
Pertanto, la quantità di calore richiesta per il riscaldamento dipende direttamente dal fatto che quanti gradi il corpo può riscaldarsi. Possiamo concludere: la quantità di calore dipende direttamente dalla differenza di temperatura corporea.
Ma è possibile determinare la quantità di calore necessaria per riscaldare non l’acqua, ma qualche altra sostanza, ad esempio petrolio, piombo o ferro?
 Riempi un recipiente con acqua e riempi l'altro con olio vegetale. Le masse dell'acqua e dell'olio sono uguali. Riscalderemo entrambe le navi in modo uniforme su bruciatori identici. Iniziamo l'esperimento a uguali temperature iniziali di olio vegetale e acqua. Cinque minuti dopo, dopo aver misurato la temperatura dell'olio e dell'acqua riscaldati, noteremo che la temperatura dell'olio è molto più alta della temperatura dell'acqua, sebbene entrambi i liquidi abbiano ricevuto la stessa quantità di calore.
Riempi un recipiente con acqua e riempi l'altro con olio vegetale. Le masse dell'acqua e dell'olio sono uguali. Riscalderemo entrambe le navi in modo uniforme su bruciatori identici. Iniziamo l'esperimento a uguali temperature iniziali di olio vegetale e acqua. Cinque minuti dopo, dopo aver misurato la temperatura dell'olio e dell'acqua riscaldati, noteremo che la temperatura dell'olio è molto più alta della temperatura dell'acqua, sebbene entrambi i liquidi abbiano ricevuto la stessa quantità di calore.
La conclusione ovvia è: Quando si riscaldano masse uguali di olio e acqua alla stessa temperatura, sono necessarie quantità diverse di calore.
E traiamo subito un'altra conclusione: la quantità di calore necessaria per riscaldare un corpo dipende direttamente dalla sostanza di cui è costituito il corpo stesso (il tipo di sostanza).
Pertanto, la quantità di calore necessaria per riscaldare un corpo (o rilasciata durante il raffreddamento) dipende direttamente dalla massa del corpo, dalla variabilità della sua temperatura e dal tipo di sostanza.
La quantità di calore è indicata con il simbolo Q. Come altri diversi tipi di energia, la quantità di calore si misura in joule (J) o kilojoule (kJ).
1 kJ = 1000 J
Tuttavia, la storia mostra che gli scienziati iniziarono a misurare la quantità di calore molto prima che il concetto di energia apparisse in fisica. A quel tempo, fu sviluppata un'unità speciale per misurare la quantità di calore: calorie (cal) o kilocalorie (kcal). La parola ha radici latine, calor - calore.
1kcal = 1000cal
Caloria– questa è la quantità di calore necessaria per riscaldare 1 g di acqua di 1°C
1 cal = 4,19 J ≈ 4,2 J
1 kcal = 4190 J ≈ 4200 J ≈ 4,2 kJ
Hai ancora domande? Non sai come fare i compiti?
Per ottenere aiuto da un tutor, registrati.
La prima lezione è gratuita!
sito web, quando si copia il materiale in tutto o in parte, è richiesto un collegamento alla fonte.
L'energia interna di un corpo può cambiare a causa del lavoro di forze esterne. Per caratterizzare la variazione di energia interna durante il trasferimento di calore, viene introdotta una quantità chiamata quantità di calore e denotata Q.
Nel sistema internazionale l’unità di misura del calore, così come del lavoro e dell’energia, è il joule: = = = 1 J.
In pratica, talvolta viene utilizzata un'unità non sistemica della quantità di calore: la caloria. 1 cal. = 4,2 J.
Va notato che il termine “quantità di calore” è infelice. È stato introdotto in un momento in cui si credeva che i corpi contenessero un liquido calorico senza peso e inafferrabile. Il processo di scambio termico consiste presumibilmente nel fatto che il calorico, fluendo da un corpo all'altro, porta con sé una certa quantità di calore. Ora, conoscendo le basi della teoria cinetica molecolare della struttura della materia, comprendiamo che non c'è contenuto calorico nei corpi, il meccanismo per modificare l'energia interna del corpo è diverso. Tuttavia, il potere della tradizione è grande e continuiamo a usare un termine introdotto sulla base di idee errate sulla natura del calore. Allo stesso tempo, comprendendo la natura del trasferimento di calore, non si dovrebbero ignorare completamente le idee sbagliate al riguardo. Al contrario, tracciando un'analogia tra il flusso di calore e il flusso di un ipotetico liquido calorico, la quantità di calore e la quantità di calorico, quando si risolvono determinate classi di problemi, è possibile visualizzare i processi in corso e correttamente risolvere i problemi. Alla fine, le equazioni corrette che descrivono i processi di trasferimento del calore una volta venivano ottenute sulla base di idee errate sul calorico come vettore di calore.
Consideriamo più in dettaglio i processi che possono verificarsi a seguito dello scambio di calore.
Versare un po' d'acqua nella provetta e chiuderla con un tappo. Appendiamo la provetta a un'asta fissata su un supporto e poniamo sotto di essa una fiamma libera. La provetta riceve una certa quantità di calore dalla fiamma e la temperatura del liquido al suo interno aumenta. All’aumentare della temperatura aumenta l’energia interna del liquido. Si verifica un intenso processo di vaporizzazione. I vapori liquidi in espansione eseguono un lavoro meccanico per spingere il tappo fuori dalla provetta.
Conduciamo un altro esperimento con un modello di cannone ricavato da un pezzo di tubo di ottone, montato su un carrello. Da un lato il tubo è chiuso ermeticamente con un tappo di ebanite attraverso il quale viene fatto passare un perno. I fili sono saldati al perno e al tubo, terminando con terminali ai quali è possibile fornire tensione dalla rete di illuminazione. Il modello cannone è quindi una sorta di caldaia elettrica.
 |
Versare un po' d'acqua nella canna del cannone e chiudere il tubo con un tappo di gomma. Colleghiamo la pistola a una fonte di alimentazione. La corrente elettrica che passa attraverso l'acqua la riscalda. L'acqua bolle, provocando un'intensa formazione di vapore. La pressione del vapore acqueo aumenta e, infine, svolgono il lavoro di spingere il tappo fuori dalla canna della pistola.
La pistola, a causa del rinculo, rotola in direzione opposta all'espulsione del tampone.
Entrambe le esperienze sono accomunate dalle seguenti circostanze. Nel processo di riscaldamento del liquido in vari modi, la temperatura del liquido e, di conseguenza, la sua energia interna sono aumentate. Affinché il liquido potesse bollire ed evaporare intensamente, era necessario continuare a riscaldarlo.
I vapori liquidi, grazie alla loro energia interna, eseguivano lavoro meccanico.
 |
Investighiamo la dipendenza della quantità di calore necessaria per riscaldare un corpo dalla sua massa, dalle variazioni di temperatura e dal tipo di sostanza. Per studiare queste dipendenze utilizzeremo acqua e petrolio. (Per misurare la temperatura nell'esperimento, viene utilizzato un termometro elettrico costituito da una termocoppia collegata a un galvanometro a specchio. Una giunzione della termocoppia viene immersa in un recipiente con acqua fredda per garantirne la temperatura costante. L'altra giunzione della termocoppia misura la temperatura del liquido in fase di studio).
L'esperienza si compone di tre serie. Nella prima serie, per una massa costante di un liquido specifico (nel nostro caso l'acqua), viene studiata la dipendenza della quantità di calore necessaria per riscaldarlo dalle variazioni di temperatura. Giudicheremo la quantità di calore ricevuta dal liquido dal riscaldatore (stufa elettrica) in base al tempo di riscaldamento, supponendo che esista una relazione direttamente proporzionale tra loro. Affinché il risultato dell'esperimento corrisponda a questa ipotesi, è necessario garantire un flusso di calore stazionario dalla stufa elettrica al corpo riscaldato. Per fare ciò, la stufa elettrica è stata accesa in anticipo, in modo che all'inizio dell'esperimento la temperatura della sua superficie cessasse di cambiare. Per riscaldare il liquido in modo più uniforme durante l'esperimento, lo mescoleremo utilizzando la termocoppia stessa. Registreremo le letture del termometro a intervalli regolari fino a quando il punto luminoso raggiungerà il bordo della scala.
Concludiamo: esiste una relazione direttamente proporzionale tra la quantità di calore necessaria per riscaldare un corpo e la variazione della sua temperatura.
Nella seconda serie di esperimenti confronteremo le quantità di calore necessarie per riscaldare liquidi identici di masse diverse quando la loro temperatura cambia della stessa quantità.
Per comodità di confronto dei valori ottenuti, la massa d'acqua per il secondo esperimento verrà considerata due volte inferiore a quella del primo esperimento.
Registreremo nuovamente le letture del termometro a intervalli regolari.
Confrontando i risultati del primo e del secondo esperimento si possono trarre le seguenti conclusioni.
Nella terza serie di esperimenti confronteremo le quantità di calore necessarie per riscaldare masse uguali di liquidi diversi quando la loro temperatura cambia della stessa quantità.
Riscalderemo l'olio su una stufa elettrica, la cui massa è uguale alla massa dell'acqua nel primo esperimento. Registreremo le letture del termometro a intervalli regolari.
Il risultato dell'esperimento conferma la conclusione che la quantità di calore necessaria per riscaldare un corpo è direttamente proporzionale alla variazione della sua temperatura e, inoltre, indica la dipendenza di questa quantità di calore dal tipo di sostanza.
Poiché l'esperimento ha utilizzato olio, la cui densità è inferiore alla densità dell'acqua, e riscaldare l'olio a una certa temperatura ha richiesto meno calore che riscaldare l'acqua, si può presumere che la quantità di calore richiesta per riscaldare un corpo dipenda dalla sua densità.
Per verificare questa ipotesi, riscalderemo simultaneamente masse uguali di acqua, paraffina e rame su un riscaldatore a potenza costante.
Dopo lo stesso tempo, la temperatura del rame è di circa 10 volte e quella della paraffina di circa 2 volte superiore alla temperatura dell'acqua.
Ma il rame ha una densità maggiore e la paraffina ha una densità inferiore rispetto all'acqua.
L'esperienza dimostra che la grandezza che caratterizza la velocità di variazione della temperatura delle sostanze da cui sono costituiti i corpi coinvolti nello scambio termico non è la densità. Questa quantità è chiamata capacità termica specifica di una sostanza ed è indicata con la lettera c.
 |
Un dispositivo speciale viene utilizzato per confrontare le capacità termiche specifiche di diverse sostanze. Il dispositivo è costituito da rack in cui sono fissate una sottile lastra di paraffina e una striscia con aste passate attraverso di essa. Alle estremità delle aste sono fissati cilindri di alluminio, acciaio e ottone di uguale massa.
Riscaldiamo i cilindri alla stessa temperatura immergendoli in un recipiente con acqua appoggiato su un fornello caldo. Fissiamo le bombole calde alle cremagliere e le liberiamo dal fissaggio. I cilindri toccano contemporaneamente la piastra di paraffina e, sciogliendo la paraffina, iniziano ad affondarvi. La profondità di immersione di cilindri della stessa massa in una piastra di paraffina, quando la loro temperatura cambia della stessa quantità, risulta essere diversa.
L'esperienza dimostra che le capacità termiche specifiche di alluminio, acciaio e ottone sono diverse.
Dopo aver effettuato opportuni esperimenti con la fusione di solidi, la vaporizzazione di liquidi e la combustione di carburante, otteniamo le seguenti dipendenze quantitative.
Per ottenere unità di quantità specifiche, devono essere espresse dalle formule corrispondenti e nelle espressioni risultanti sostituire unità di calore - 1 J, massa - 1 kg e capacità termica specifica - 1 K.
Otteniamo le seguenti unità: capacità termica specifica – 1 J/kg·K, altri calori specifici: 1 J/kg.
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0