Un set di reagenti diagnostici veterinari per determinare la concentrazione
ferro nel sangue degli animali.
Il ferro fa parte dei pigmenti respiratori (principalmente emoglobina e parzialmente mioglobina), citocromi, enzimi contenenti ferro (catalasi, mieloperossidasi). Questo cosiddetto ferro eme, che lega in modo reversibile l'ossigeno e partecipa al trasporto dell'ossigeno, a una serie di reazioni redox, svolge un ruolo importante nei processi di emopoiesi. Il ferro partecipa al metabolismo della porfirina, alla sintesi del collagene e al funzionamento del sistema immunitario. Negli animali il ferro non si trova sotto forma di cationi liberi, ma solo in associazione con proteine, la più importante delle quali è la transferrina. La concentrazione di ferro nel siero dipende dal riassorbimento nel tratto gastrointestinale, dall'accumulo nell'intestino, nella milza e nel midollo osseo, dalla sintesi e dalla degradazione dell'emoglobina e dalla sua perdita da parte dell'organismo. Il livello di ferro nel siero varia durante la giornata (è più alto al mattino), a seconda del sesso e dell'età dell'animale. I valori medi di ferro nelle femmine sono inferiori rispetto ai maschi, ma sia in quelle che negli altri i valori del ferro diminuiscono con l'età. Il contenuto di ferro nelle donne è anche associato alla gravidanza. Nonostante l'instabilità dei livelli di ferro nel siero, lo studio di questo parametro è importante per lo screening, la diagnosi differenziale della carenza di ferro e di altre anemia, nonché la valutazione dell'efficacia del trattamento dei pazienti con anemia da carenza di ferro.
Unità di misura: µmol/l.
Valori di riferimento: cane - 20,0-30,0 µmol/l, gatto - 15,0-40,0 µmol/l, cavallo - 20,0-23,0 µmol/l, bovino - 27,0- 40,0 mlmol/l, maiale - 16,0-36,0 µmol/l.
Aumento dei livelli di ferro (iperferremia): aumento dell'apporto nel corpo; emocromatosi; eccessiva somministrazione parenterale di preparati di ferro; trasfusioni di sangue ripetute; avvelenamento acuto con preparati di ferro in animali giovani; anemia: anemia emolitica, anemia ipo- e aplastica; anemia ipercromica da carenza folica; talassemia; nefrite; malattia del fegato (epatite acuta, epatite cronica); leucemia acuta; intossicazione da piombo; l'uso di alcuni medicinali.
Diminuzione dei livelli di ferro (ipoferremia): anemia da carenza di ferro; malattie infettive acute e croniche; sepsi; collagenosi; tumori (compresa leucemia acuta e cronica, mieloma); aumento della perdita di ferro da parte dell'organismo (perdita di sangue acuta e cronica); apporto insufficiente di ferro nel corpo (dieta lattiero-vegetariana, sindrome da malassorbimento, malattie dello stomaco e dell'intestino); aumento dell'apporto di ferro da parte dell'organismo (gravidanza, alimentazione, crescita degli animali, aumento dell'attività fisica); remissione dell'anemia perniciosa (avitaminosi B12); ipotiroidismo; Sindrome nevrotica; malattie epatiche croniche (epatite, cirrosi); prendendo alcuni medicinali.
Caratteristiche
Linearità nell'intervallo da 3,0 a 179 µmol/l.
La deviazione dalla linearità non supera il 5%.
Sensibilità - non più di 2,0 µmol/l.
Il coefficiente di variazione non è superiore al 5%.
Costo dell'analisi
Sugli analizzatori biochimici semiautomatici (URIT-800 Vet, BS 3000 P, Clima MC-15), il costo medio dell'analisi per 25 indicatori è di circa 9 rubli.
Su analizzatori automatici (DIRUI CS-T240, iMagic-V7) - 7 rubli.
Imballaggio
Sono possibili due tipi di imballaggio:
1. Per i monoreagenti - come parte del kit 1 reagente: 204 ml/408 misurazioni (3 flaconi da 68 ml) e 612 ml/1224 misurazioni (9 flaconi da 68 ml);
2. Per bireagenti - come parte di un set di 2 reagenti: 170 ml / 340 misurazioni (2 fiale da 68 ml + 2 fiale da 17 ml) e 510 ml / 1020 misurazioni (6 fiale da 68 ml + 6 fiale da 17 ml ).
Consegna
Il trasporto e la conservazione dei kit devono essere effettuati a una temperatura di 2-8ºС nella confezione del produttore durante l'intero periodo di validità. È consentito trasportare e conservare i set a temperature fino a 25ºС per non più di 5 giorni. Non è consentito il congelamento dei componenti del kit.
La durata di conservazione del kit è di 18 mesi.
I reagenti 1 e 2 dopo l'apertura delle fiale possono essere conservati a una temperatura di 2-8ºС in un luogo protetto dalla luce per l'intero periodo di validità dei kit, a condizione che le fiale siano sufficientemente sigillate.
Il reagente di lavoro può essere conservato a una temperatura di 2-8ºС per non più di un mese o a temperatura ambiente (15-25ºС) per non più di 5 giorni.
Per ottenere risultati affidabili è necessario attenersi scrupolosamente alle istruzioni per l'uso del kit.
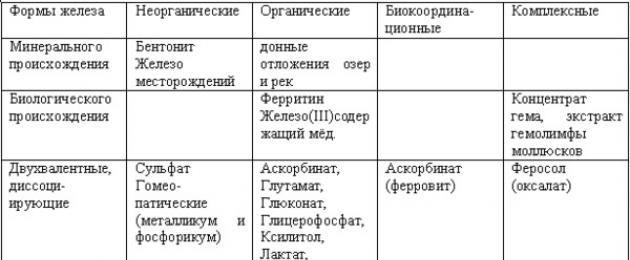
solfato ferroso- una sostanza chimica, che è un sale di acido solforico e ferro 2-valente. Combinandolo con sette molecole d'acqua si forma un composto che nella vita di tutti i giorni si chiama solfato di ferro.
Questo composto chimico ha anche vari altri nomi con cui viene venduto e utilizzato in diverse aree: solfato di ferro, solfato ferroso, sale di ferro dell'acido solforico, tetraossosolfato di ferro (II), solfato di ferro (II).
In natura, il solfato ferroso ha un analogo: un minerale chiamato melanterite.
Il solfato ferroso è stato scoperto dall'umanità molto tempo fa, i metodi del suo utilizzo sono contenuti negli antichi testi greci di mille e mezzo anni fa. Oggi viene utilizzato in vari campi dell'industria, della medicina, della veterinaria e dell'agricoltura. L'ambito del suo utilizzo in vari settori è estremamente ampio, quindi di seguito elencheremo le aree in cui viene utilizzato molto spesso e la sua sostituzione con altri analoghi degrada la qualità del farmaco o del prodotto.
Caratteristiche qualitative del solfato ferroso
La qualità del solfato ferroso è determinata in conformità con gli standard stabiliti da GOST 6981-084 Per quanto riguarda le caratteristiche fisico-chimiche del solfato ferroso prodotto industrialmente per il 1o grado, frazione di massa:
- il solfato ferroso dovrebbe essere almeno del 52%;
- l'acido solforico libero non deve essere superiore allo 0,3%;
- le sostanze che non si dissolvono in acqua non devono superare lo 0,2%.
Per la seconda elementare, frazione di massa:
- il solfato ferroso dovrebbe essere almeno del 47%;
- l'acido solforico libero non deve essere superiore all'1%;
- le sostanze che non si dissolvono in acqua non devono superare l'1%.
Applicazione in agricoltura
In agricoltura il solfato ferroso viene utilizzato per:
- miglioramento chimico di vari terreni;
- per la distruzione di licheni e muschi;
- come un farmaco che distrugge con successo le spore di vari funghi;
- per controllare lumache e altri parassiti di giardini e piantagioni forestali;
- trattamento delle piante affette da clorosi.
Anche in agricoltura, il solfato ferroso viene utilizzato per aumentare la produttività della massa verde in crescita, poiché la sostanza è uno dei componenti di molti enzimi ossidativi che svolgono un ruolo importante nei processi di respirazione delle piante. Il solfato di ferro viene utilizzato come fertilizzante per la carenza di ferro nei terreni.
Buoni risultati si ottengono con l'alimentazione fogliare di ribes e fragole con una soluzione acquosa di solfato ferroso, preparata in ragione di cinque-dieci grammi del farmaco per dieci litri di acqua.
Spesso il solfato di ferro viene utilizzato in combinazione con fertilizzanti organici, introducendo nel terreno una miscela di cento grammi di solfato ferroso e dieci chilogrammi di sostanza organica.
Coloro che sono impegnati nella viticoltura conoscono bene le qualità benefiche del solfato ferroso. L'irrorazione primaverile con una soluzione di questa sostanza del terreno attorno alle viti distrugge funghi e batteri, e l'impatto sulle viti stesse rallenta lo sviluppo delle gemme, il che aiuta la pianta a sopportare più facilmente le prime gelate. Anche le talee di vite vengono trattate con vetriolo di ferro: attecchiscono e germinano meglio.
Le foglie di vite non devono essere trattate con una soluzione di solfato ferroso: la soluzione può causare ustioni.
Il solfuro di ferro viene utilizzato anche per trattare gli alberi da giardino di pomacee per distruggere i licheni, i muschi e gli insetti dannosi. Per fare questo, preparare una soluzione in ragione di 500 grammi di vetriolo per dieci litri di acqua. Per gli arbusti, così come per le drupacee, la concentrazione è leggermente inferiore: trecento grammi per dieci litri di acqua.
È importante ricordare che il trattamento con solfato ferroso non dovrebbe essere consentito se è stato effettuato il trattamento con calce: in questi casi viene utilizzato solfato di rame.
Il solfato ferroso è efficace nel trattamento della clorosi: per questo, una soluzione viene aggiunta al terreno attorno alla vite in ragione di grammi di solfato di ferro, venti grammi di acido ascorbico o citrico per dieci litri di acqua. Per combattere la clorosi delle ortensie, di altri colori, si utilizza una soluzione di trenta grammi di solfato ferroso per dieci litri di acqua e si spruzzano le piante malate con una pausa di sei giorni fino al completo recupero.
Il solfato di ferro è utilizzato anche in medicina veterinaria. Quando si alimentano suinetti e vitelli.
L'uso del solfato ferroso in medicina
In ambito farmaceutico, i preparati che utilizzano solfato ferroso sono classificati in due gruppi clinici e farmacologici:
- stimolanti dell'emopoiesi;
- preparati contenenti micro e macro elementi.
Viene utilizzato per il trattamento dell'anemia da carenza di ferro, come farmaci antianemici per la carenza di ferro per il normale processo di creazione di mioglobina, emoglobina, alcuni enzimi negli organi emopoietici per stimolare l'eritropoiesi.
Il solfato ferroso è stato utilizzato in medicina fin dai tempi antichi. Nella Rus' veniva usato per curare le "pallide infermità", l'antico medico greco Melampas curò con esso il principe ereditario Ificlas Thesalius mille e mezzo anni fa, Ibn-Sina lo usò per combattere la magrezza patologica e per migliorare la carnagione, Paracelso lo raccomandava come un tonico per l'idropisia. All'inizio del XIX secolo, le pillole Blodius proposte dal medico francese Pierre Blaud erano considerate il miglior rimedio per il trattamento del "pallido intorpidimento", dell'anemia e della debolezza generale: consistevano di solfato ferroso e carbonato di potassio.
Oggi i preparati a base di solfato ferroso vengono utilizzati per malattie come
- anemia da carenza;
- periodo dell'allattamento al seno;
- insufficienza secretoria nella gastrite cronica;
- periodo di crescita attiva;
- gravidanza;
- malnutrizione;
- dopo la resezione dello stomaco;
- ulcera duodenale;
- ulcera allo stomaco;
- prematurità nei bambini;
- diminuzione della resistenza del corpo;
- sanguinamento e perdita di sangue.
Sebbene i preparati a base di solfato ferroso siano venduti in farmacia senza prescrizione medica, esistono ancora alcune restrizioni al loro utilizzo. Tra le controindicazioni:
- emocromatosi;
- ipersensibilità;
- emosiderosi;
- porfiria tardiva della pelle;
- talassemia;
- emolisi cronica;
- malattie del tratto gastrointestinale che violano l'assorbimento del ferro;
- anemia sideroblastica;
- anemia emolitica e aplastica;
- varie anemie non associate a carenza di ferro.
I farmaci vengono prescritti ai pazienti, in particolare ai bambini, in dosaggi che tengono conto del ricalcolo del ferro attivo.
I medicinali contenenti solfato ferroso non devono essere prescritti in caso di trasfusioni di sangue frequenti.
I farmaci che utilizzano il ferro sono presentati nella tabella.

È interessante notare che le proprietà del solfato ferroso in relazione al miglioramento dei processi di trasferimento dell'ossigeno dal sangue ai muscoli hanno suscitato interesse per questa sostanza da parte dei medici sportivi. Tuttavia, uno studio approfondito sulle prestazioni atletiche degli atleti che hanno utilizzato il farmaco come integratore alimentare non ha rivelato la sua efficacia.
L'uso del solfato ferroso nella costruzione
Questa sostanza chimica è stata a lungo utilizzata per aumentare la durabilità degli edifici in legno.
Sin dagli antichi greci, le persone erano alla ricerca di materiali che aiutassero a proteggere il legno delle case dalla decomposizione. Li hanno ricoperti con oli vegetali, poi vari colori e vernici. L’effetto, nella migliore delle ipotesi, fu di breve durata. Pitture e vernici si staccarono e in questi luoghi iniziarono rapidamente a svilupparsi processi di decadimento.
Il modo di distruggere batteri e funghi che distruggono il legno con l'aiuto di vari prodotti chimici si è rivelato molto più efficace. Oggi questo metodo è chiamato biocida. Si basa sull'impregnazione del legno con impregnanti (soluzioni antisettiche).Tra gli impregnanti più efficaci c'è il vetriolo di ferro.
Per proteggere il legno, una soluzione di solfato di ferro:
- applicato su superfici in legno con pennelli;
- applicato su parti in legno spruzzando con uno spray;
- le strutture in legno vengono completamente immerse in una soluzione di solfato ferroso, mentre per aumentarne l'efficienza vengono riscaldate in una soluzione.
Un effetto positivo ancora maggiore è dato dal trattamento industriale delle strutture in legno con solfato di ferro. Viene eseguito utilizzando uno dei seguenti metodi:
- impregnato con una soluzione di solfato ferroso in autoclavi;
- utilizzando l'impregnazione per diffusione, durante la quale uno strato di materiale pastoso viene applicato sulle parti in legno, che contiene solfato di ferro, cadendo gradualmente nel materiale, impregnandone completamente la struttura.
Nelle zone rurali dei paesi scandinavi, ancora oggi, per dipingere case e recinzioni viene utilizzata un'antica composizione speciale per proteggerle dalla decomposizione a base di solfato ferroso. La composizione comprende:
- acqua 9 litri;
- vetriolo di ferro - 1,56 chilogrammi;
- farina - 0,72 chilogrammi;
- pigmento di calce secca - 1,56 chilogrammi;
- sale - 0,36 chilogrammi.
Si introduce gradualmente 1/3 dell'acqua nella farina e si mescola fino ad ottenere una pasta, che viene filtrata e poi scaldata costantemente, mescolando bene, quindi si aggiungono sale, pigmento di calce e solfato di ferro - dopo che sono completamente sciolti, il si aggiunge il resto dell'acqua preriscaldandola.
Se si desidera dare alla vernice qualsiasi colore, vengono aggiunti i pigmenti appropriati. La vernice su superfici in legno viene applicata senza primer e in due strati. Il consumo di vernice in questo caso è di 0,3 chilogrammi per metro quadrato. La durata minima di tali superfici in condizioni atmosferiche in Norvegia, nelle regioni settentrionali della Finlandia, è di vent'anni.
I vantaggi delle impregnazioni a base di builder di solfato ferroso includono la sua buona solubilità in acqua (la soluzione al 25% può essere preparata in acqua fredda, il 55% in acqua calda), nonché il fatto che tali soluzioni non corrodono le parti in ferro.
Quando si utilizzano soluzioni di solfato ferroso come antisettico, le precauzioni di sicurezza richiedono che tutto il lavoro venga svolto con guanti di gomma e un respiratore.
In Russia è stato inventato e realizzato un metodo per la produzione di fibre di legno e pannelli truciolari per l'industria dell'edilizia e dei mobili da materiali in legno contenenti cellulosa e lignina attraverso la loro lavorazione passo dopo passo. In una delle fasi, l'elemento principale di una tecnologia complessa è un agente modificante come il solfato di ferro, che viene introdotto nella pasta di legno riscaldata dal vapore a t=190°C e quindi pressato in tavole a t=190°C .
Poiché questo metodo non utilizza sostanze di natura fenolica, si ottengono tavole ad alta resistenza ecologiche che non sono soggette a processi di putrefazione e non emettono formaldeide durante il funzionamento. Tali piastre sono anche facili da lavorare, resistenti all'umidità e poco combustibili.
L'additivo modificante del solfato di ferro allo stesso tempo aumenta significativamente la resistenza del materiale delle piastrelle, riduce il tempo necessario per la produzione delle lastre. Nel settore edile, il solfato ferroso viene utilizzato anche nella produzione di miscele di clinker, intonaci secchi e cementi per rimuovere gli ioni di cromo esavalente.
L'uso del solfato di ferro nell'industria del mobile
L'incisione del legno svolge la funzione non solo di protezione, ma anche di conferirgli un nuovo aspetto estetico. Il colore risultante di un prodotto in legno dipende dal tipo di specie legnosa. Quindi nel decapaggio con solfato ferroso:
- in una concentrazione dallo 0,5% al 2% il legno di quercia è dipinto in un colore scuro, quasi nero;

- ad una concentrazione dal 2% al 4% il legno di faggio diventa marrone;
- ad una concentrazione del 4%, il legno di betulla acquisisce un colore giallo-marrone;
- a concentrazioni dal 2% al 4% il legno di pino acquisisce un colore grigio-marrone.
L'uso del solfato ferroso nell'industria leggera
In quest'area dell'economia viene utilizzato il solfato ferroso, uno dei componenti principali della tecnologia nella produzione di inchiostri, incisione di tessuti e tintura di pelletteria.
Già nel XV secolo in Francia fu sviluppato un metodo per tingere la pelle per rilegature di libri con una composizione a base di solfato ferroso e noci galliche con soda. In questo modo si otteneva una buccia sottile dal colore grigio scuro uniforme. La tintura con solfato di ferro si basa sul processo chimico di ossidazione dei tannini naturali che compongono la pelle, con conseguente formazione di composti colorati che non si sciolgono in acqua. Gli svantaggi di questo antico metodo includono il danneggiamento delle zone più sottili da parte del sale minerale in caso di vestizione non uniforme della pelle.
La comparsa dei coloranti sintetici nel XIX secolo e il rapido sviluppo successivo di quest'area dell'industria chimica non portarono allo spostamento del solfato ferroso dalla tecnologia di tintura della pelle.
Si è scoperto che tali coloranti senza l'uso del comprovato solfato ferroso in molti casi, specialmente durante la lavorazione della pelle al cromo, portano a macchie irregolari, rivelando visivamente in modo nitido difetti precedentemente invisibili. Il solfato ferroso si è rivelato indispensabile nella produzione di pelli di alta qualità.
L'uso del solfato di ferro nella produzione di vernici
Il solfato di ferro viene utilizzato nella produzione di pigmenti sintetici a base di ossido di ferro, che determinano il colore delle vernici.
Per reazione tra carbonato di sodio e solfato di ferro in presenza di ossigeno atmosferico (a volte sostituito con sale di Berthollet), si ottiene il pigmento Giallo Marte. Questo pigmento sintetico viene utilizzato per realizzare vernici artistiche e materiali per dipingere il legno. Preparato in un rapporto di 1:8 con un riempitivo, tale pigmento è chiamato "ocra sintetica".
Pigmento "Rosso Marte". Si ottiene termicamente dal solfato ferroso. Innanzitutto, il solfato di ferro viene disidratato riscaldandolo a 400°C e poi calcinato a temperature comprese tra 700°C e 825°C. Le tonalità del pigmento risultante dipendono dalla qualità della tecnologia di produzione e possono variare dal rosso-arancio al viola e al lampone, dal rosa al lilla. Il colore è determinato dalla dimensione e dalla forma dei cristalli di pigmento risultanti, per i colori chiari la dimensione va da 0,35 micron a 0,45 micron e per le tonalità scure - 2,5 micron. Nei colori chiari i cristalli hanno forma particellare aciculare, mentre nei colori scuri sono lamellari.
Il pigmento rosso Marte è molto richiesto: viene utilizzato per la produzione di vari smalti e vernici, per la tintura di plastica, carta e linoleum. La disidratazione del solfato ferroso e la sua calcinazione vengono effettuate in forni rotativi.
Il colore del pigmento risultante dipende anche dalle temperature durante la produzione. A temperature da 700°C a 725°C si ottengono pigmenti con una tinta giallastra, a temperature da 725°C a 825°C si ottengono pigmenti con una tinta bluastra.
È anche possibile ottenere varie tonalità nella produzione di pigmenti a base di solfato ferroso introducendo additivi, ad esempio l'uso di cloruro di sodio conferisce una tinta viola al pigmento risultante.
Il pigmento marrone di Marte è prodotto dal solfato di ferro mediante precipitazione in presenza di solfato di manganese con ammoniaca. Il precipitato formatosi viene separato e quindi ossidato con aria in ambiente alcalino, lavato, essiccato e seguito da calcinazione a temperature comprese tra 180°C e 200°C.
L'uso del solfato ferroso nella lucidatura dell'acciaio
Azzurramento- questo è un processo tecnologico per ottenere una pellicola di ossido sulla superficie dell'acciaio, che non solo protegge l'acciaio, ma gli conferisce anche un bell'aspetto. Il processo di brunitura viene effettuato in soluzioni acide o alcaline, che includono solfato ferroso.
Volendo ottenere una pellicola bluastra, utilizzate questa soluzione:
- solfato ferroso - 30 chilogrammi;
- acido cloridrico - 30 chilogrammi;
- mercurio dell'acido nitrico - 30 chilogrammi;
- alcool etilico - 120 chilogrammi.
La soluzione viene riscaldata a 20°C e in essa il prodotto siderurgico viene lavorato per venti minuti.
Se necessario, per ottenere una tonalità di bluastro rosso scuro, utilizzare la seguente soluzione:
- solfato ferroso - 3 chilogrammi;
- alcool etilico - 3 chilogrammi;
- acqua - 100 chilogrammi;
- rame acido nitrico - 1,2 chilogrammi.
La soluzione viene riscaldata a 25°C e la superficie del prodotto in acciaio viene inumidita con una spazzola morbida, lasciata asciugare e nuovamente inumidita. Il procedimento viene ripetuto più volte fino ad ottenere la tonalità di rosso desiderata.
Quando si blua per ottenere sfumature rosso scuro, a volte si formano macchie di ruggine: vengono rimosse con cura con un pennello umido e la soluzione viene applicata nuovamente.
Per fissare la pellicola protettiva formata sulla superficie, viene quindi trattata con uno dei 2 metodi.
- Metodo 1. Vengono lavati a lungo in acqua corrente, quindi fatti bollire per cinque minuti in una soluzione di tre chilogrammi di sapone per cento litri di acqua.
- Metodo 2. Vengono lavati a lungo in acqua calda, quindi immersi per 2 minuti in una soluzione di bicromato di sodio riscaldata a 70 ° C (12 chilogrammi per cento litri di acqua).
Nella fase finale della brunitura, il prodotto in acciaio viene essiccato e quindi accuratamente lubrificato con una sorta di olio per macchine.
L'uso del solfato ferroso per la tintura della lana
Il vetriolo di ferro viene utilizzato nei processi di tintura della lana ottenuta dalle pecore, come abrasione, cioè per fissare il colore della lana tinta in modo che dopo il lavaggio i prodotti da essa non siano soggetti a muta. Gli svantaggi di questo metodo, utilizzato da molto tempo, includono l'acquisizione di una colorazione leggermente giallastra da parte del prodotto dopo il trattamento con solfato ferroso.
L'uso del solfato ferroso nella galvanica
In questo settore della produzione industriale, il solfato ferroso viene utilizzato nella fabbricazione di stampi e matrici. L'accuratezza dimensionale dello stampo, l'assenza di rugosità durante l'elettroformatura, durante la quale le copie metalliche risultanti vengono separate dal modello che funge da base per la deposizione del metallo, gioca un ruolo molto importante dopo il completamento del processo. Allo stesso tempo, è importante che la superficie del modello, gli strati applicati per il livellamento abbiano proprietà conduttive. Per soddisfare questi requisiti tecnologici, vengono utilizzati elettroliti solfati, che includono solfato di ferro. Il processo di elettroformatura viene effettuato sotto costante controllo.
La galvanica con l'utilizzo di solfato ferroso è un processo piuttosto lungo. Il tempo di deposizione di strati metallici spessi può richiedere diverse settimane. Ma il tempo di attesa viene ripagato dall'elevata qualità delle superfici risultanti e dal rispetto della precisione dimensionale.
Le superfici dei modelli prima dell'applicazione degli elettroliti vengono accuratamente lavate e sgrassate, quindi completamente asciugate.
L'uso del solfato ferroso per la produzione di inchiostro
L'utilizzo del solfato ferroso per la preparazione dell'inchiostro è forse il metodo più antico per ottenere soluzioni per l'applicazione di immagini su carta. Si basa sui processi di acquisizione del colore nero quando si mescolano soluzioni di tannini e solfato di rame.
Il solfato ferroso è un componente integrale di antiche composizioni per crittografia, immagini. Le iscrizioni sono state applicate su carta, tela con soluzione di tannino all'1% 0,1 M, quindi al momento giusto sono state strofinate con una soluzione di solfato ferroso 0,1 M e l'iscrizione è diventata visibile.
Precauzioni di sicurezza quando si lavora con solfato ferroso
Non esistono misure speciali di sicurezza antincendio per il solfato ferroso. Questa sostanza non è infiammabile, non è esplosiva. Tuttavia, per quanto riguarda la salute, rappresenta qualche pericolo se maneggiato con noncuranza.
Questa sostanza chimica appartiene alla terza classe di tossicità, che combina materiali moderatamente pericolosi per la salute umana.
Quando si utilizza il solfato, non è consentito superare la concentrazione di aerosol di solfato ferroso nell'aria delle aree di lavoro in concentrazioni superiori al massimo consentito, ovvero 2 mg / m².
Reagente per la determinazione ghiandola(metodo diretto).
Metodo colorimetrico diretto per la determinazione del ferro senza deproteinizzazione nel siero e nel plasma.
Rapporto: Campione/Reagente 1/Reagente 2: 1/12,5/1. Due reagenti liquidi. Lunghezza d'onda 600 nm. Linearità 1000 µg/dl. Il punto finale della reazione è di 5 minuti a 37°C. È richiesto un campione bianco. Lo standard è incluso nel set. I volumi R1 e R2 sono equalizzati per gli analizzatori automatici.
Di più
Reagenti biochimici per la determinazione del ferro nel sangue
L'azienda Lames offre l'acquisto di un set di reagenti biochimici per la determinazione del ferro nel siero e nel plasma sanguigno mediante il metodo colorimetrico senza deproteinizzazione. Un'analisi biochimica per determinare il ferro nel sangue è prescritta in caso di sospetta anemia, ipovitaminosi, varie malattie infettive e disturbi digestivi. L'analisi colorimetrica è diventata la più comune: i reagenti biochimici mostrano il ferro nel sangue nel modo più accurato possibile e lo studio è considerato semplice da eseguire.
L'essenza e i vantaggi del metodo
Il contenuto di ferro nel sangue viene rilevato in un ambiente acido: sotto la sua influenza, i complessi proteici si dissociano, a seguito dei quali il ferro viene ridotto a ioni bivalenti. Si legano al cromogeno e si forma un complesso dal colore pronunciato. In base alla sua intensità, la quantità di ferro nel sangue, la norma e le deviazioni da essa sono determinate con il metodo colorimetrico.
L'utilizzo di questo metodo presenta diversi vantaggi:
- Facile da usare. L'analisi può essere effettuata manualmente o con l'ausilio di analizzatori semiautomatici e non necessita di apparecchiature sofisticate.
- Elevata precisione di ricerca. Ti consente di riconoscere anche piccole deviazioni dalla norma e utilizzare i dati ottenuti nella diagnosi.
- Basso costo dei reagenti biochimici. La nostra azienda offre l'acquisto di kit già pronti per più studi.
Vantaggi di ordinare da Lames
La nostra organizzazione fornisce reagenti biochimici di alta qualità da partner stranieri di fiducia, sono garantite l'elevata precisione e l'efficienza delle analisi. Vengono offerte forniture una tantum o regolari di reagenti biochimici: è possibile acquistarli con consegna a condizioni vantaggiose.
Reazioni qualitative per il ferro (III)
Ioni di ferro (III ) in soluzione può essere determinato utilizzando reazioni qualitative. Esaminiamone alcuni. Prendi per l'esperimento una soluzione di cloruro di ferro ( III).
1. III) - reazione con alcali.
Se la soluzione contiene ioni ferro ( III ), si forma idrossido di ferro ( III ) Fe(OH) 3 . La base è insolubile in acqua e di colore marrone. (idrossido di ferro ( II ) Fe(OH)2 . - anche insolubile, ma di colore grigio-verde). Un precipitato marrone indica la presenza di ioni ferro nella soluzione iniziale ( III).
FeCl 3 + 3 NaOH = Fe(OH) 3 ↓+ 3 NaCl
2. Reazione qualitativa allo ione ferro ( III ) - reazione con sale sanguigno giallo.
Il sale giallo del sangue è l'esacianoferrato di potassioK 4 [ Fe( CN) 6]. (Per la determinazione del ferro (II) utilizzare il sale rosso sangueK 3 [ Fe( CN)6]). Ad una porzione di una soluzione di cloruro di ferro, aggiungere una soluzione di sale giallo del sangue. Il precipitato blu del blu di Prussia* indica la presenza di ioni ferrici nella soluzione iniziale.
3 A 4 +4 FeCl3 = K Fe ) ↓ + 12 KCl
3. Reazione qualitativa allo ione ferro ( III ) - reazione con tiocianato di potassio.
Per prima cosa diluiamo la soluzione di prova, altrimenti non vedremo il colore atteso. In presenza di uno ione ferro (III) quando si aggiunge il tiocianato di potassio si forma una sostanza rossa. È tiocianato di ferroIII). Rodanide dal greco "rodeos" - rosso.
FeCl 3 + 3KSNC= Fe( SNC) 3 + 3 KCl
Il blu di Prussia fu ottenuto per caso all'inizio del XVIII secolo a Berlino dal tintore Diesbach. Disbach acquistò da un commerciante una insolita potassa (carbonato di potassio): una soluzione di questa potassa diventava blu quando venivano aggiunti sali di ferro. Durante il controllo della potassa, si è scoperto che era calcinata con sangue bovino. La tintura si è rivelata adatta ai tessuti: brillante, stabile ed economica. Ben presto divenne nota la ricetta per ottenere la vernice: la potassa veniva fusa con sangue animale essiccato e limatura di ferro. Mediante la lisciviazione di tale lega si otteneva il sale sanguigno giallo. Ora il blu di Prussia viene utilizzato per ottenere inchiostri da stampa e polimeri coloranti. .
Attrezzatura: matracci, pipetta.
Sicurezza . Osservare le regole per la gestione di soluzioni e soluzioni alcaline esacianoferrati. Evitare il contatto di soluzioni di esacianoferrati con acidi concentrati.
Dichiarazione di esperienza –Elena Makhinenko, testo– Dottorato di ricerca Paolo Bespalov.
La quantità predominante prodotta cloruro ferrico utilizzato per il trattamento delle acque industriali e reflue.
Il problema della depurazione delle acque industriali e reflue è uno dei compiti più importanti della protezione ambientale. La coagulazione è uno dei metodi più comuni di trattamento delle acque reflue. L'essenza del metodo di coagulazione è l'interazione di sostanze che inquinano le acque reflue con coagulanti minerali. I coagulanti più comunemente usati sono cloruro ferrico , che, a seguito dell'idrolisi, forma un idrossido di ferro scarsamente solubile Fe(OH) 3 . Nel processo di formazione di questo idrossido, le impurità inorganiche e organiche vengono catturate con la formazione di scaglie sciolte, che possono essere facilmente rimosse dagli effluenti trattati. Nel processo di formazione e sedimentazione, le sostanze sospese (limo, cellule di plancton, grandi microrganismi, resti vegetali, ecc.), le particelle colloidali e quella parte degli ioni inquinanti che sono associati sulla superficie di queste particelle vengono incluse nel L'elevata velocità di sedimentazione delle scaglie di idrossido determina il vantaggio del cloruro ferrico rispetto al solfato di alluminio. Il processo di sedimentazione dei fanghi con l'aiuto del cloruro ferrico procede più velocemente e più in profondità, inoltre, il cloruro ferrico influisce favorevolmente sulla decomposizione biochimica dei fanghi. Il consumo di cloruro ferrico è di 30 g per metro cubo. contatore delle acque reflue Il trattamento chimico delle acque reflue riduce il contenuto di impurità insolubili fino al 95% e impurità solubili fino al 25%.
Durante il trattamento delle acque reflue, i microrganismi e i composti tossici contenuti nell'acqua vengono distrutti ipoclorito di sodio.
Ipoclorito di sodio può essere utilizzato per trattare acque reflue contenenti sali di ammonio, composti fenolici, mercurio. Il grado di purificazione raggiunge il 99,9%.
A seguito di studi sull'efficacia dei disinfettanti utilizzati nell'industria alimentare, l'ipoclorito di sodio è stato valutato come il prodotto più efficace ed economico. Ha mostrato un'elevata efficienza d'impatto su quasi tutti i tipi di cellule vegetali, spore e batteri. Solitamente utilizzare una soluzione contenente 30 - 40 mg/l di cloro attivo.
Il cloruro ferrico viene utilizzato anche come catalizzatore nei processi di sintesi organica, ossidazione del bitume di petrolio e nella produzione di resine resistenti al calore. È un agente clorurante vigoroso, quindi può essere utilizzato per l'estrazione selettiva dei singoli componenti dei minerali.
Le soluzioni acquose di cloruro ferrico hanno proprietà di incisione moderata, quindi vengono utilizzate per incidere circuiti stampati, fogli di rame e parti metalliche prima della galvanizzazione.
È noto l'uso del cloruro ferrico come additivo al cemento Portland per accelerare il processo di presa. Il rapporto acqua/cemento (A/C) è consigliato entro 0,4 - 0,5. L'aggiunta di cloruro ferrico permette di aumentare il valore di V/C. L'aggiunta di cloruro ferrico aumenta la resistenza del calcestruzzo.
Caratteristiche tecniche della soluzione di cloruro ferrico.
1. Frazione di massa di cloruro ferrico - non inferiore al 40%;
2. La densità della soluzione a 20°C non è inferiore a 1,41 g/cu. cm;
3. Frazione di massa di cloruro ferrico - non più dell'1%;
4. Frazione di massa di sostanze insolubili in acqua - non più del 2%;
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0