introduzione
Per molti secoli, gli scienziati hanno studiato le popolazioni microbiche e i meccanismi della loro formazione, e solo alla fine del secolo scorso hanno riscontrato una forma speciale di organizzazione delle culture batteriche: una comunità di microrganismi capace di colonizzare oggetti ambientali ed esistere non solo sotto forma di microplancton, ma anche biofilm appositamente organizzati. I biofilm sono comunità eterogenee mobili e in costante cambiamento (Chebotar, 2012), che possono essere formate da batteri di una o più specie e sono costituiti sia da cellule attive che da cellule dormienti o incolte. La formazione di comunità così altamente specializzate è una delle principali strategie per la sopravvivenza delle colture batteriche non solo nell'ambiente, ma anche nel corpo umano. In generale, i biofilm sono un gruppo di cellule microbiche circondate da uno spesso strato mucoso ad alto peso molecolare.
Meccanismo di formazione del biofilm
Tipicamente, i microrganismi esistono sotto forma di masse fluttuanti o singole colonie, ma alcuni rappresentanti del regno batterico tendono ad attaccarsi a una specifica superficie del substrato e formare un biofilm, il cui meccanismo di formazione è complesso, strettamente regolato e comprende quattro fasi successive.
Fase 1: attacco reversibile (primario) alla superficie. Il primo stadio della formazione del biofilm è caratterizzato dall'adesione reversibile associata all'azione di forze fisico-chimiche non specifiche tra molecole e strutture sulla superficie dei microrganismi (elementi della parete cellulare, flagelli, pili) e il substrato solido dovuta a varie interazioni: van der Wals, idrofobo, ionico, elettrostatico;
Fase 2: adesione irreversibile alla superficie. Dopo l'adsorbimento, la cellula batterica si muove lungo la superficie del substrato, legandosi saldamente ad esso attraverso fattori di adesione, nonché con l'aiuto di adesine non polimeriche, che distinguono gli elementi strutturali delle superfici del tessuto ospite: collagene, elastina, glicoproteine , acido ialuronico. Nella stessa fase, oltre al forte attaccamento al substrato, si verificano: perdita di motilità batterica, interazioni intercellulari, scambio genico tra microrganismi della stessa specie e di specie diverse.
Fase 3: maturazione - maturazione 1 . Dopo essersi attaccati saldamente al substrato e aver scambiato i geni, i batteri attaccati iniziano a sintetizzare una matrice circostante esopolisaccaride nota come sostanza polimerica extracellulare ( extracellulare polimerico sostanza), che è un “muco” protettivo e costituisce l’85% di tutto il biofilm maturo (Chebotar, 2012; Frolova, 2015). Questa matrice favorisce la formazione di un primo biofilm di piccole colonie batteriche. I componenti di un esopolisaccaride variano a seconda di quali microrganismi ne fanno parte.
Fase 4: crescita - maturazione 2 . In questa fase si forma un biofilm maturo, dopodiché è il momento dei colonizzatori secondari, cioè delle cellule che si attaccano ai batteri già localizzati sulla superficie (Afinogenova, 2011).
I biofilm maturi sono in grado di perdere singoli frammenti che, diffondendosi nel macroorganismo, si attaccano ai substrati e formano nuovi biofilm. Inoltre, nei biofilm maturi, i batteri non si dividono, poiché sono circondati da una matrice densa e mantengono un’elevata vitalità.
La formazione del biofilm avviene abbastanza rapidamente. L’attaccamento dei batteri tra loro avviene in pochi minuti, le colonie strettamente legate si formano in 2-4 ore e la produzione di una sostanza polimerica extracellulare avviene entro 6-12 ore, dopodiché i batteri che formano il biofilm diventano ampiamente tolleranti alla antibiotici e disinfettanti, antisettici. Inoltre, i biofilm si riprendono rapidamente dopo l’impatto meccanico (Chebotar, 2012).
Ultrastruttura dei biofilm
L'ultrastruttura dei biofilm è stata determinata utilizzando la microscopia laser a scansione confocale. La matrice extracellulare delle cellule microbiche ha una struttura specifica ed è formata da strutture tridimensionali a forma di fungo o colonnari. L'esopolisaccaride rilasciato nella fase di maturazione del biofilm è rappresentato da un eteropolisaccaride a doppio strato, universale per ogni tipo di microrganismo. Il suo strato esterno contiene polisaccaridi allo stato idratato (destrano, acido ialuronico, cellulosa) e lo strato interno è pieno di vescicole di membrana che possono agire come fattori di patogenicità (tali vescicole contengono fosfatasi alcalina C, proteasi, lisozima). Le sostanze vescicolari svolgono anche la funzione di lisi delle cellule batteriche indebolite, i cui frammenti diventano successivamente un fattore di crescita e una fonte di nutrimento per altri membri del biofilm.
Tutti i componenti della matrice sono separati da canali attraverso i quali viene effettuato il trasporto di nutrienti e ossigeno, nonché il rilascio dei prodotti metabolici finali delle cellule batteriche. Le strutture superficiali, i ramnolipidi, costituiti da una miscela di polisaccaridi, proteine, acidi nucleici e altre sostanze, sono responsabili della formazione e del mantenimento di tali canali di trasporto.
La matrice del biofilm contiene anche DNA extracellulare, che è coinvolto nei processi di adesione, nelle interazioni intercellulari e determina l'esistenza specifica delle comunità di biofilm (Tets, 2012).
Morfologia delle cellule che compongono il biofilm
Utilizzando la microscopia elettronica, è stato stabilito che nelle fasi iniziali della formazione del biofilm, la morfologia dei microrganismi non cambia (Frolova, 2015). Nelle fasi successive, le strutture batteriche acquisiscono specificità morfologica associata allo stato attaccato e alla convivenza collettiva. Inoltre, le cellule all'interno del biofilm subiscono la sostituzione delle strutture superficiali, aumenta la frequenza di scambio di materiale genetico tra gli individui della comunità e l'organizzazione ultrastrutturale viene deformata.
Proprietà e ruolo nella protezione delle popolazioni batteriche
I biofilm sono uno dei fattori protettivi più significativi, aumentando significativamente la tolleranza dei batteri a situazioni di stress (mancanza di ossigeno e sostanze nutritive durante il digiuno), a fattori del sistema immunitario del corpo umano, all'azione di condizioni esterne (antibiotici, disinfettanti, sterilizzazione ). Tale tolleranza contribuisce all'acquisizione di una resistenza assoluta a fattori che potrebbero distruggere i batteri se fossero allo stato libero.
Il ruolo protettivo dei biofilm consiste nelle seguenti proprietà:
- Proprietà barriera. I biofilm impediscono alle grandi molecole e alle cellule che causano l’infiammazione di penetrare in profondità nella loro matrice e fungono da barriera alla diffusione per piccoli agenti antimicrobici;
- Proprietà protettive cumulative. I batteri (sia della stessa specie che di specie diverse) sono in grado di scambiarsi fattori protettivi (prodotti metabolici o geni), cioè svolgere una protezione reciproca. Pertanto, i batteri di una specie resistenti agli antibiotici possono trasferire i geni responsabili della resistenza ai batteri di un'altra specie sensibili a un dato antibiotico, aumentando così la loro resistenza all'azione del fattore;
- Una proprietà di scambio che garantisce il trasferimento di geni e prodotti di scarto tra microrganismi che fanno parte dello stesso biofilm (Chebotar, 2012; Tets, 2012);
- La proprietà dell'inattività, cioè la formazione di sottopopolazioni immobili (inattive, non metabolizzanti, dormienti), è una proprietà chiave inerente esclusivamente ai biofilm. Affinché un antibiotico possa agire su un microrganismo, deve essere metabolicamente attivo. Pertanto, i batteri inattivi nei biofilm sono i più resistenti a questo tipo di influenza (Tets, 2012; Frolova, 2015).
Diversità dei sistemi che regolano la formazione del biofilm
Le cellule all'interno della matrice intercellulare hanno « senso del quorum" ( quorum rilevamento) - la capacità di trasmettere informazioni e regolare il proprio comportamento grazie alla secrezione di molecole di segnalazione. In altre parole, è un sistema regolatore situato all’interno del biofilm. Esistono tre sistemi conosciuti che differiscono tra loro nella natura degli autoinduttori:
- Viene utilizzato prevalentemente da batteri gram-negativi e le molecole segnale sono l'omoserina lattone acilato, che si lega a una proteina regolatrice che interagisce con due enzimi regolatori: luciferasi e omoserina lattone sintasi. L'attivazione delle proteine regolatrici induce la creazione di cluster di biofilm da parte dei microbi (Tets, 2012; Turkutyukov, 2013).
- È caratteristico dei batteri gram-positivi e funziona utilizzando forme lineari e cicliche di peptidi, furani, lattoni e loro derivati, secreti nell'ambiente esterno. Alcuni di essi interagiscono con le chinasi sensore che si legano alla membrana, che trasmettono segnali attraverso la membrana, mentre altri vengono trasportati nella cellula utilizzando permeasi, dove si legano ai recettori intracellulari. Il meccanismo di segnalazione di tali sistemi è la cascata fosforilazione-defosforilazione. Le molecole di informazione interagiscono con sistemi a due componenti, che includono una proteina chinasi segnale associata alla membrana. La chinasi rileva il peptide messaggero, quindi lo fosforila e attiva una proteina regolatrice che si lega al DNA e regola la trascrizione. I peptidi segnale di questo sistema sono codificati nel cromosoma e le proteine recettrici sono codificate nei plasmidi. Pertanto, con l'aiuto di tale comunicazione, vengono traslocati plasmidi che trasportano geni di resistenza agli antibiotici, geni di emolisina, batteriocine e geni di virulenza.
- Si trova in tutti i microrganismi e le molecole di segnalazione sono rappresentate da butirrolattone, chinolo, idrossichetoni e luciferasi. I batteri hanno proteine sensori recettoriali che legano gli autoinduttori, formando un complesso che interagisce con una chinasi legata alla membrana. La chinasi viene fosforilata, il fosfato viene trasferito ad una proteina citoplasmatica, quindi ad una proteina regolatrice che si lega al DNA. Successivamente, vengono attivati i geni che codificano gli RNA regolatori, il che porta alla cessazione dell'espressione dei componenti delle strutture cellulari che implementano le comunicazioni intercellulari intraspecifiche.
Un sistema regolatorio così complesso, basato sulla produzione di molecole induttrici di segnale, viene effettuato a diversi livelli di influenza: trascrizionale, traduzionale, post-traduzionale. Grazie al "quorum sensing", nella popolazione del biofilm si verificano costantemente due tipi di selezione: positiva e negativa, ovvero le cellule con proprietà vantaggiose vengono preservate e i batteri con fenotipi "non necessari" vengono distrutti (Tets, 2012).
Partecipazione del sistema TA (sistema tossina-antitossina) alla formazione del biofilm
Parlando di biofilm, vale la pena notare che non tutti i microrganismi sono in grado di formarli. Il processo di sintesi della matrice esopolisaccaridica è determinato da alcuni fattori. Lo dicono gli ultimi risultati di una ricerca dell'Università di Strasburgo. Louis Pasteur può sostenere che per la formazione di un biofilm è necessaria la presenza di una proteina specializzata. Ad esempio, per formare una comunità Staphylococcus aureusè richiesta la presenza della proteina SasG (in complesso con Zn 2+). La proteina SasG è una proteina legante l'RNA che attiva:
1) crescita delle strutture superficiali dei batteri - flagelli, pili;
2) sintesi di polisaccaridi extracellulari;
3) garantisce la formazione di tolleranza.
Un insieme di due o più geni strettamente correlati, che insieme codificano sia la proteina che il corrispondente bloccante, è responsabile della secrezione della proteina SasG.
Questo sistema è chiamato modulo TA. È localizzato in un plasmide. Questo è un sistema piuttosto complesso che fornisce non solo la capacità dei batteri di formare biofilm, ma ne garantisce anche la vitalità nel suo complesso. Secondo il lavoro di (Yamaguchi, 2011), se la cellula figlia viene privata del plasmide, l'antitossina instabile (bloccante) ereditata con il citoplasma della cellula madre viene distrutta e la proteina tossica stabile uccide la cellula.
Inoltre, il modulo TA è responsabile di:
1) regolazione genetica: alcune tossine agiscono come repressori generali dell'espressione genica, mentre altre sono più specifiche;
2) controllo della crescita: come notato, le tossine batteriostatiche non uccidono la cellula ospite, ma ne limitano la crescita;
3) resistenza cellulare: in alcune popolazioni batteriche esiste una sottopopolazione di cellule resistenti a più classi di antibiotici. La sottopopolazione è controllata da sistemi tossina-antitossina. Queste cellule resistenti e a crescita lenta proteggono la popolazione dalla completa estinzione.
4) morte cellulare programmata e sopravvivenza dei suoi "parenti stretti" - diversi livelli di resistenza delle cellule della popolazione a condizioni di stress, causando la morte programmata di alcune cellule, che impedisce l'estinzione dell'intera popolazione (la cellula morta diventa una fonte di alimentazione per il resto).
5) contrastare i batteriofagi: quando un batteriofago interrompe la trascrizione e la traduzione delle proteine cellulari, l'attivazione dei sistemi tossina-antitossina limita la replicazione dei fagi.
Aspetti clinici dello studio dei biofilm
Attualmente, il ruolo dei biofilm microbici nella comparsa e nello sviluppo di molte malattie infettive è stato dimostrato in modo affidabile. Si tratta di infezioni delle valvole cardiache e delle protesi articolari, infezioni delle superfici delle ferite. Le ferite rappresentano un substrato ideale per la contaminazione microbica con successiva formazione di biofilm. I biofilm nella ferita creano un ambiente con un certo microclima, caratterizzato da un basso contenuto di ossigeno. I biofilm ritardano la migrazione e la proliferazione dei cheratinociti, inibendo così i meccanismi immunitari protettivi, e all’esterno creano uno strato protettivo impenetrabile agli antimicrobici topici (Chebotar, 2012a).
Patologie infettive tipiche del biofilm sono la gengivite (infiammazione delle gengive), la stomatite (infiammazione della mucosa orale) e la formazione di tartaro. L'otite - il problema otorinolaringoiatrico più comune - è accompagnata anche dalla formazione di biofilm, non solo batterici, ma anche fungini.
Oltre alle infezioni delle ferite, i biofilm svolgono un ruolo nella cronicizzazione delle malattie del sistema urinario, delle infezioni associate a cateteri e impianti (cateteri, pacemaker, valvole cardiache, dispositivi ortopedici), malattie cardiovascolari (sinusite, endocardite). In altre parole, i biofilm svolgono un ruolo fondamentale nella patogenesi di un’ampia gamma di malattie infettive sia superficiali che profonde. Tutte queste malattie sono difficili da trattare, hanno un alto tasso di recidiva e alcune di esse possono causare la morte.
Se si sospetta la presenza di microrganismi che formano biofilm In vivo vengono presi in considerazione i seguenti fattori:
1) il distacco dei biofilm nel torrente sanguigno o nelle vie urinarie può portare alla formazione di emboli;
2) i biofilm di batteri gram-negativi possono produrre endotossina (lipopolisaccaride), che porta a shock tossico-infettivo e sindrome da coagulazione intravascolare disseminata;
3) i batteri nei biofilm possono scambiare plasmidi di resistenza (trasferimento di resistenza da specie a specie);
4) i batteri nel biofilm non sono sensibili al sistema immunitario dell’ospite;
5) i biofilm possono ridurre la sensibilità dei batteri a un agente antimicrobico.
Gli ultimi tre punti indicano che i biofilm sono altamente resistenti agli antibiotici. Tuttavia, nei loro confronti è più appropriato usare il termine tolleranza. Un esempio dell'emergere del fenomeno della tolleranza è la proteina SasG Stafilococco aureola. La sua biosintesi provoca un fallimento nel ciclo post-replicazione, che interrompe il funzionamento dell'enzima batterico girasi (un analogo della topoisomerasi-4 nei batteri). Ciò porta alla comparsa di persistenti.
Le cellule persistenti sono cellule uniche di comunità batteriche che, avendo lo stesso set di geni di altri microrganismi nella comunità, sono molte volte resistenti a fattori esterni, a differenza delle cellule che le circondano (Ulyanov, 2014). I persistenti differiscono dai batteri ordinari nella loro fisiologia: anche in condizioni favorevoli, formano attorno a sé una matrice esopolisaccaridica, spesso crescono molto più lentamente dei batteri ordinari e, come già accennato, sono altamente resistenti ai fattori esterni. I batteri persistenti costituiscono una piccola parte della comunità batterica, ma il loro numero aumenta durante la fase di crescita stazionaria. È interessante notare che le cellule figlie hanno la stessa resistenza ai fattori esterni delle cellule persistenti dei genitori.
Consideriamo il meccanismo della resistenza persistente. Supponiamo che una colonia batterica sia influenzata da un fattore esterno, ad esempio un antibiotico. L’antibiotico inibisce l’attività della girasi (topoisomerasi-4), a seguito della quale si verificano rotture del DNA a doppio filamento nella cellula batterica, ma solo in quelle aree in cui la girasi è attiva, cioè nell’area del “ forcella di replicazione”. Se le cellule sono protette da una sostanza polimerica extracellulare e il numero di tali posti non è superiore a due o quattro, i sistemi cellulari proteggono il batterio dalla morte riparando i danni. Nelle normali cellule batteriche a crescita rapida si verificano molte di queste rotture e il DNA viene degradato quando viene utilizzato un antibiotico, mentre il DNA dei batteri persistenti viene preservato. Gli effetti degli antibiotici possono variare, ma tutti affrontano lo stesso problema: quelli persistenti a crescita lenta e ben protetti sono meno suscettibili allo stress e hanno il tempo di essere “messi fuori servizio” prima che venga causato loro un danno irreversibile.
Le informazioni fornite non esauriscono i dati sulle caratteristiche dei biofilm microbici. Va notato che, nonostante l'ampio materiale teorico e l'importanza del problema, le questioni relative all'attività di formazione di biofilm di microrganismi patogeni e condizionatamente patogeni nella microflora nosocomiale di ospedali medici di vario profilo rimangono irrisolte. Non esistono farmaci efficaci contro i biofilm e la microflora nelle matrici extracellulari, né mezzi per combattere i biofilm maturi. Questo problema richiede ulteriore sviluppo.
Bibliografia
1. Yamaguchi Y., Inouye M. Regolazione della crescita e della morte in Escherichia coli mediante sistemi tossina-antitossina. Nature Reviews Microbiology 2011, 9(11):779-790.
2. Afinogenova A.G., Dorovskaya E.N. Biofilm microbici delle ferite: stato della questione // Traumotologia e Ortopedia. – 2011. – N. 3. – P.119–125.
3. Balko A.B., Balko O.I., Avdeeva L.V. Formazione di biofilm da parte di ceppi di Pseudomonas aeruginosa // Giornale microbiologico. – 2013. – N. 2. – P.50–56.
4. Maltsev S.V., Mansurova G.Sh. Cos'è il biofilm? // Medicina pratica. – 2011. – N. 53. – P.7–10.
5. Tets V.V., Tets. G.V. Biofilm microbici e problemi di terapia antibiotica // Pneumologia pratica. – 2013. – N. 4. – pp. 60–64.
6. Turkutyukov V.B., Ibragimova T.D., Fomin D.V. Caratteristiche molecolari della morfologia dei biofilm formati da ceppi di batteri gram-negativi non fermentanti // Pacific Medical Journal. – 2013. – N. 4. – P.44–47.
7. Ulyanov V.Yu., Definitionseva S.V., Shvidenko I.G., Norkin I.A., Korshunov G.V., Gladkova E.V. Cinetica biologica dei biofilm di ceppi clinici di Staphylococcus aureus e Pseudomonas aeruginosa isolati da pazienti con complicanze broncopolmonari nella malattia traumatica del midollo spinale // Diagnostica clinica di laboratorio. – 2014. – N. 8. – P.43–47.
8. Frolova Ya.N. Proprietà biologiche dei biofilm di ceppi tossigeni di Corinobacterium Diphtheriae gravis TOX +: dis. ... candidato di scienze biologiche: 06/12/2015 / Frolova Yana Nikolaevna. – Rostov, 2015. – 118 pag.
9. Chebotar I.V. Il meccanismo dell'immunità antibiofilm // Bollettino dell'Accademia russa delle scienze mediche. – 2012. – T.67. – N. 12. – P.22–29.
10. Chebotar I.V., Konchalova E.D., Bugrova M.L. Strutture vescicolari nel sistema “Neutrofili – Staphylococcus aureus biofilm” // Immunologia infettiva. – 2012a. – N. 61. – P.35–39.
A. G. Khomenko
Mycobacterium tuberculosis può entrare nel corpo in vari modi: per via aerogena, enterale (attraverso il tratto gastrointestinale), attraverso la pelle e le mucose danneggiate, attraverso la placenta durante lo sviluppo fetale. Tuttavia, la principale via di infezione è aerogena.
Certo ruolo protettivo durante l’infezione aerogena Il sistema di pulizia mucociliare svolge un ruolo importante, consentendo la rimozione parziale di particelle di polvere, gocce di muco, saliva ed espettorato contenenti microrganismi penetrati nei bronchi. In caso di infezione enterale la funzione di assorbimento dell'intestino può avere una certa importanza.
Cambiamenti locali nel sito di introduzione dei micobatteri sono causati principalmente dalla reazione delle cellule polinucleari, che è sostituita da una forma più avanzata di reazione protettiva con la partecipazione di macrofagi che effettuano la fagocitosi e la distruzione dei micobatteri. Il processo di interazione dei macrofagi polmonari con vari microrganismi, incluso il Mycobacterium tuberculosis, è complesso e non del tutto compreso. Il risultato dell'interazione tra macrofagi e micobatteri è determinato dallo stato del sistema immunitario, dal livello di PCTI che si sviluppa durante l'infezione da tubercolosi, nonché da una serie di altri fattori, compresi quelli che determinano la capacità digestiva dei macrofagi.
Fagocitosi si compone di tre fasi: la fase di contatto, in cui i macrofagi, sfruttando i recettori presenti sulla membrana cellulare, fissano i micobatteri; fasi di penetrazione dei micobatteri nel macrofago mediante invaginazione della parete del macrofago e “avvolgimento” del microbatterio; fasi di digestione, quando i lisosomi dei macrofagi si fondono con i fagosomi contenenti micobatteri. Gli enzimi rilasciati negli isosomi dei fagi distruggono i micobatteri. Nel processo di fagocitosi, anche i meccanismi di perossidazione svolgono un ruolo importante.
Il Mycobacterium tuberculosis, come alcuni altri microrganismi, quando entrano nei macrofagi, può persistere e persino continuare a riprodursi. Nei casi in cui il processo di digestione dei micobatteri viene bloccato, i macrofagi vengono distrutti e i micobatteri vengono rilasciati dalle cellule che li hanno assorbiti.
I macrofagi, che hanno fagocitato i micobatteri e li digeriscono, rilasciano nello spazio extracellulare frammenti di micobatteri distrutti, enzimi proteolitici, mediatori (inclusa l'interleuchina-1), che attivano i linfociti T, in particolare le cellule T helper.
Le cellule T-helper attivate secernono mediatori: linfochine (inclusa l'interleuchina-2), sotto l'influenza delle quali nuovi macrofagi migrano nella posizione dei micobatteri. Allo stesso tempo, la sintesi del fattore di inibizione della migrazione viene soppressa e l'attività enzimatica dei macrofagi aumenta sotto l'influenza del fattore di attivazione dei macrofagi. I linfociti attivati secernono anche un fattore reattivo cutaneo, che provoca una reazione infiammatoria e un aumento della permeabilità vascolare. La soppressione del PCZT e la reazione positiva alla tubercolina sono associate a questo fattore [Medunitsyn N.V. et al., 1980]. Oltre alle cellule T-helper, lo stato immunitario è influenzato in modo significativo dalle cellule T-soppressori e dai monociti soppressori, che inibiscono la risposta immunitaria.
Oltre ai linfociti T e ai macrofagi, un ruolo importante nella patogenesi del processo di tubercolosi appartiene alle sostanze rilasciate durante la distruzione dei micobatteri. Queste sostanze (frazioni) sono state studiate in dettaglio. È stato dimostrato che il fattore cordonale (il fattore di virulenza del Mycobacterium tuberculosis, che determina la loro crescita su un mezzo nutritivo denso sotto forma di "trecce") provoca un processo infiammatorio acuto e che i solfatidi aumentano la tossicità del fattore cordonale e, soprattutto, sopprimono la formazione di fagolisosomi nei macrofagi, che proteggono i micobatteri localizzati a livello intracellulare dalla distruzione.
Con proliferazione intensiva di micobatteri nel corpo umano, a causa della fagocitosi inefficace, viene rilasciato un gran numero di sostanze tossiche, viene indotto un PCI pronunciato, che contribuisce alla comparsa di una componente essudativa dell'infiammazione con lo sviluppo della necrosi caseosa e la sua riproduzione. Durante questo periodo, il numero di soppressori T aumenta, il numero di aiutanti T diminuisce, il che porta all'inibizione della PCRT. Ciò provoca la progressione del processo di tubercolosi.
Con una popolazione batterica relativamente piccola in condizioni di PCZT e fagocitosi efficace, si osserva la formazione di granulomi tubercolari. Un tale granuloma si sviluppa come risultato delle reazioni PCZT [Averbakh M. M. et al., 1974]. L'accumulo di cellule mononucleate attorno ai neutrofili contenenti l'antigene e la loro successiva trasformazione avviene sotto l'influenza regolatrice delle linfochine prodotte dai linfociti T (in particolare le cellule T-helper) e che sono mediatori della reazione granulomatosa. Poiché la dimensione della popolazione batterica, così come la natura del decorso delle reazioni immunologiche nei diversi stadi dell'infezione tubercolare, cambiano, le reazioni morfologiche nei pazienti affetti da tubercolosi sono caratterizzate da una grande diversità.
A seconda del luogo d'introduzione del Mycobacterium tuberculosis un focolaio infiammatorio, o affetto primario, può formarsi nei polmoni, nella cavità orale, nelle tonsille, nell'intestino, ecc. In risposta alla formazione di un affetto primario, si sviluppa un processo specifico nei linfonodi regionali e si forma un complesso tubercolare primario. È stato stabilito che la tubercolosi primaria, che si sviluppa a seguito del primo contatto di un macroorganismo con un agente patogeno, può manifestarsi non solo sotto forma di un complesso di tubercolosi primaria, come si pensava in precedenza. Come risultato dell'infezione primaria, è possibile lo sviluppo della tubercolosi dei linfonodi intratoracici, della pleurite, del tubercoloma e del processo focale.
La tubercolosi primaria a seguito di un'infezione “fresca” si sviluppa solo nel 7-10% degli individui infetti, il resto soffre di infezione tubercolare primaria senza manifestazioni cliniche. Una volta che si verifica l'infezione, si manifesta solo con cambiamenti nelle reazioni alla tubercolina.
Anche V.I. Puzik (1946), A.I. Kagramanov (1954) ed altri stabilirono che la formazione del complesso primario è spesso preceduta da un periodo di “microbismo latente”, in cui il mycobacterium tuberculosis, entrando nell'organismo, vi rimane, senza causare una reazione infiammatoria. In questo caso, i micobatteri si trovano più spesso nei linfonodi, soprattutto in quelli intratoracici. In questi casi, i cambiamenti locali nei polmoni o in altri organi sotto forma di focolai di tubercolosi primaria si verificano nel periodo tardivo dell'infezione primaria e non nel sito di penetrazione dei micobatteri nel corpo, ma nelle aree più favorevoli allo sviluppo di infiammazione tubercolare.
L'assenza di manifestazioni cliniche e morfologiche dell'infezione primaria da tubercolosi può essere spiegata dall'alto livello di resistenza naturale alla tubercolosi e può anche essere una conseguenza dell'immunità acquisita a seguito della vaccinazione BCG.
In presenza di manifestazioni locali, la tubercolosi primaria può manifestarsi con lo sviluppo di un processo diffuso di tipo complicato o, che attualmente si osserva molto più spesso, di tipo non complicato con una reazione infiammatoria limitata.
Di norma, la tubercolosi primaria guarisce con lievi cambiamenti residui, apparentemente dovuti all'elevata resistenza naturale e alla vaccinazione di massa e alla rivaccinazione con BCG.
I micobatteri rimasti in focolai residui o le loro forme alterate dovrebbero essere considerati un antigene della tubercolosi, la cui presenza è necessaria per il mantenimento dell'immunità specifica da parte dei linfociti sensibilizzati. Un certo ruolo, anche se ancora poco compreso, nel mantenimento dell’immunità antitubercolare appartiene all’immunità delle cellule B e ai meccanismi genetici.
Prove ricevute il ruolo dell'ereditarietà durante il processo di tubercolosi. Fattori genetici influenzano la risposta del sistema immunitario durante la proliferazione del Mycobacterium tuberculosis nel corpo umano e, in particolare, determinano l'interazione tra macrofagi, linfociti T e B, la produzione di linfochine, monochine e altre citochine da parte dei linfociti T e B e macrofagi, una risposta immunitaria complessa, che determina sensibilità o resistenza allo sviluppo della tubercolosi. Il collegamento dei genotipi HLA con la tubercolosi è stato rivelato nelle famiglie in cui genitori e figli avevano la tubercolosi.
L'accumulo di alcuni tipi HLA specifici in gruppi di pazienti con un decorso sfavorevole della malattia indica l'associazione di alcuni geni del complesso HLA (principalmente i loci B e DR con una predisposizione alla tubercolosi) [Khomenko A. G., 1985].
Il periodo dell'infezione primaria può concludersi con la guarigione con cambiamenti residui minimi (piccoli) o abbastanza pronunciati. Queste persone sviluppano l'immunità acquisita. La persistenza di micobatteri persistenti in focolai residui non solo supporta l'immunità acquisita, ma crea contemporaneamente anche il rischio di riattivazione endogena del processo tubercolare a causa della reversione delle forme alterate dell'agente patogeno della tubercolosi nella forma batterica e della proliferazione della popolazione micobatterica.
La reversione delle forme persistenti di micobatteri in forme moltiplicative avviene in condizioni di riattivazione endogena dei focolai di tubercolosi e altri cambiamenti residui. Il meccanismo della riattivazione endogena, così come lo sviluppo del processo tubercolare, non sono stati sufficientemente studiati.
Al centro della riattivazione sono la progressiva proliferazione della popolazione batterica e un aumento del numero dei micobatteri [Khomenko A.G., 1986]. Tuttavia, fino ad oggi non si sa esattamente cosa e quali condizioni contribuiscano alla regressione dell’agente patogeno della tubercolosi, che era in uno stato persistente. È stato stabilito che la riattivazione della tubercolosi e lo sviluppo delle sue varie forme cliniche si osservano più spesso in soggetti con alterazioni residue in presenza di fattori che riducono l'immunità.
È anche possibile un altro modo di sviluppare la tubercolosi secondaria- esogeno, associato a nuova (ripetuta) infezione da microbatteri della tubercolosi (superinfezione). Ma anche con il percorso esogeno di sviluppo della tubercolosi secondaria, la penetrazione dei micobatteri in un organismo già infetto non è sufficiente, anche con una massiccia superinfezione ripetuta. È necessaria una combinazione di una serie di condizioni e fattori di rischio che riducono l’immunità. La tubercolosi secondaria è caratterizzata da un'ampia varietà di forme cliniche.
Principali tipologie di alterazioni patomorfologiche nei polmoni e in altri organi sono caratterizzati da:
- lesioni con reazione tissutale prevalentemente produttiva, decorso favorevole, cronico e tendenza alla guarigione;
- alterazioni infiltrativo-polmonari con reazione tissutale prevalentemente essudativa e tendenza a sviluppare necrosi caseosa o risolvere la conseguente reazione infiammatoria;
- cavità della tubercolosi - il risultato della decomposizione delle masse caseose formate e del loro rigetto attraverso i bronchi di drenaggio con la formazione di una cavità di decomposizione.
Varie combinazioni dei principali cambiamenti patomorfologici della tubercolosi creano i prerequisiti per una varietà estremamente ampia di cambiamenti della tubercolosi, specialmente nel decorso cronico della malattia con periodi alternati di esacerbazione e cedimento del processo. A ciò va aggiunto che dalle zone colpite formatesi i micobatteri possono diffondersi attraverso il flusso della linfa o del sangue alle zone non colpite e ai vari organi. L'esito della malattia dipende dal suo decorso: progressivo o regressivo, dall'efficacia del trattamento e dalla reversibilità dei cambiamenti formati durante il processo patologico.
È stato dimostrato che in condizioni di fame e persino di denutrizione, soprattutto quando la dieta contiene proteine e vitamine insufficienti, spesso si verifica la riattivazione della tubercolosi. A fattori che contribuiscono alla riattivazione, comprendono varie malattie: diabete mellito, linfogranulomatosi, silicosi, ulcera peptica dello stomaco e del duodeno, condizioni dopo la resezione dello stomaco e del duodeno, malattie infiammatorie polmonari croniche, malattie mentali che si manifestano con sindrome depressiva, alcolismo, situazioni stressanti, AIDS, malattie a lungo termine termine utilizzare glucocorticoidi, citostatici e immunosoppressori.
Decorso e risultati della tubercolosi dovrebbero essere considerati solo nel contesto di una chemioterapia specifica in corso, che viene utilizzata per tutti i pazienti con tubercolosi attiva. Durante la chemioterapia, si verifica una diminuzione della popolazione di micobatteri a causa dell'effetto distruttivo della chemioterapia sugli agenti patogeni della tubercolosi. Di conseguenza, il numero di micobatteri diminuisce drasticamente e si creano condizioni più favorevoli per i processi riparativi e la sanogenesi.
Allo stesso tempo, quando si utilizzano le combinazioni più efficaci dei moderni farmaci chemioterapici, si osserva un diverso decorso del processo tubercolare: regressione seguita da guarigione, stabilizzazione del processo senza cura clinica con conservazione della cavità, tubercoloma o altri cambiamenti, temporanei cedimento del processo infiammatorio con conseguente insorgenza di esacerbazione, sviluppo di un processo cronico o progressione della malattia .
Pertanto, la riduzione della popolazione di micobatteri sotto l'influenza di farmaci chemioterapici specifici non porta sempre alla guarigione. La conclusione del processo tubercolare e la successiva cura dipendono non solo dalla riduzione della popolazione di micobatteri, ma anche dalla capacità dei processi riparativi dell'organismo di garantire la regressione del processo tubercolare e la sua cessazione. Infiammazione tubercolare
I cambiamenti patomorfologici negli organi e nei tessuti durante la tubercolosi sono diversi e dipendono dalla forma, dallo stadio, dalla localizzazione e dall'entità del processo patologico.
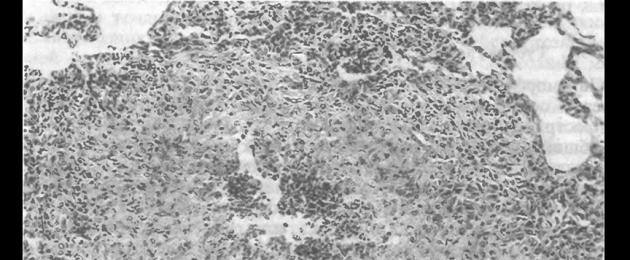
Comune alla maggior parte delle forme di tubercolosi sono cambiamenti specifici in combinazione con reazioni non specifiche o paraspecifiche. Cambiamenti specifici includono l'infiammazione tubercolare, il cui decorso è accompagnato dalla formazione di un tubercolo tubercolare, o granuloma, e da una lesione più grande. I cambiamenti non specifici sono varie reazioni che causano le cosiddette maschere della tubercolosi.
Morfologia dell'infiammazione tubercolare dipende dalla reattività dell'organismo e dalla virulenza dell'agente patogeno. In un focolaio tubercolare possono predominare i fenomeni di essudazione, necrosi o proliferazione e il focolaio, in base a ciò, può essere prevalentemente essudativo, nevrotico o produttivo. I processi immunologici svolgono un ruolo importante nello sviluppo dell'infiammazione della tubercolosi.
Nell'area dell'infiammazione si sviluppa prima una reazione che non presenta segni tipici della tubercolosi. In esso si esprimono in varia misura i fenomeni di alterazione e di essudazione. I disturbi del sistema microcircolatorio vengono prima. Influenzano la struttura fine della parete alveolare e i meccanismi del loro sviluppo possono essere rintracciati a livello ultrastrutturale [Erokhin V.V., 1987]. Nelle prime fasi dell'infiammazione, i cambiamenti nell'organizzazione submicroscopica degli elementi costitutivi della parete alveolare sono associati ad un aumento della permeabilità capillare, allo sviluppo di edema interstiziale intracellulare e intraalveolare con lisciviazione del tensioattivo alveolare da parte del fluido edematoso.
Successivamente aumentano i cambiamenti distrofici nel tessuto alveolare, ma insieme ad essi sorgono processi compensatori e riparativi, volti a sviluppare l'organizzazione intracellulare e ad aumentare l'attività funzionale delle rimanenti cellule del setto interalveolare. Nella fase successiva dell'infiammazione - proliferativa - compaiono elementi specifici della tubercolosi (cellule epitelioidi e giganti di Pirogov-Langhans) e al centro del focolaio della tubercolosi si formano aree di una sorta di necrosi caseosa omogenea (cagliata).
Sulla base dei dati della microscopia elettronica e dell'autoradiografia sulla dinamica della trasformazione cellulare, è stata stabilita una connessione genetica tra le cellule del granuloma lungo la linea cellulare gigante monocita [Serov V.V., Shekhter A.B., 1981; Erokhin V.V., 1978, 1987; Danneberg AM, 1982; SpectorW-G., 1982]. I macrofagi sintetizzano e accumulano attivamente enzimi lisosomiali e svolgono una funzione fagocitaria. Il materiale assorbito, che include Mycobacterium tuberculosis, viene localizzato e digerito nei fagosomi e nei fagolisosomi.
Le cellule epitelioidi sono formate da cellule mononucleate e macrofagi che si accumulano nel focolaio dell'infiammazione tubercolare nelle prime fasi della reazione infiammatoria. Hanno un grande nucleo di forma ovale, solitamente con 1-2 nucleoli. Il citoplasma di queste cellule contiene mitocondri, granuli, l'apparato di Golgi, un sistema ben sviluppato di tubuli e cisterne del reticolo citoplasmatico granulare e non granulare e singoli piccoli fagosomi. Il numero di mitocondri, elementi del reticolo e inclusioni lisosomiali varia ampiamente ed è determinato dallo stato funzionale della cellula.
Le cellule giganti di Pirogov-Langhans possono essere formate da cellule epitelioidi o macrofagi durante la loro proliferazione, nonché come risultato della fusione di cellule epitelioidi. Il citoplasma delle cellule giganti contiene un gran numero di nuclei, solitamente situati sotto forma di un anello o di un ferro di cavallo lungo la periferia delle cellule, molti mitocondri, lisosomi, elementi del reticolo citoplasmatico granulare e un complesso di Golgi ben sviluppato. Le cellule giganti sono capaci di fagocitosi, nel loro citoplasma si trovano varie inclusioni residue e sono caratterizzate da un'elevata attività degli enzimi idrolitici e respiratori.
Oltre alle cellule epitelioidi e giganti, il tessuto di granulazione tubercolare contiene solitamente un numero significativo di cellule linfoidi e plasmatiche, nonché leucociti neutrofili. I fibroblasti vengono rilevati nelle parti periferiche dello strato di granulazione. Intorno alla fonte dell'infiammazione si trova spesso una zona perifocale di reazione infiammatoria aspecifica. Con il progredire del processo, si osserva un aumento della necrosi caseosa, una maggiore infiltrazione del tessuto di granulazione con cellule mononucleate e cellule linfoidi, nonché neutrofili e un'espansione della zona di infiammazione perifocale. Un processo specifico si diffonde per contatto e per vie linfatiche.
Man mano che il focolaio tubercolare guarisce, le masse di necrosi caseosa diventano più dense e in quest'ultima si depositano piccoli granelli di sali di calcio. Nel tessuto di granulazione aumenta il numero di fibroblasti e fibrille di collagene, che si uniscono in fibre di collagene, che formano una capsula di tessuto connettivo attorno al focolaio tubercolare. Successivamente, il tessuto di granulazione specifico viene sempre più sostituito da tessuto fibroso. Il numero di elementi cellulari tra le fibre di collagene diminuisce e talvolta le fibre di collagene subiscono ialinosi.
In tali focolai e focolai post-tubercolari sono state trovate forme alterate di Mycobacterium tuberculosis, in particolare la forma L, che ci consente di comprendere meglio il ruolo dei vecchi focolai tubercolotici nella patogenesi delle forme secondarie di tubercolosi [Puzik V.I., Zemskova Z.S., Dorozhkova I.R., 1981, 1984]. La riattivazione della tubercolosi e la formazione di varie forme di tubercolosi polmonare secondaria si basano sulla reversione e sulla proliferazione della popolazione batterica sullo sfondo dello sviluppo di insufficienza della protezione specifica e non specifica del microrganismo.
Reazioni aspecifiche o paraspecifiche possono formarsi in vari organi e tessuti: sistema nervoso e cardiovascolare, organi emopoietici, articolazioni, membrane sierose, ecc. Nel sistema cardiovascolare e negli organi parenchimali queste reazioni si manifestano come infiltrazione istiocitaria e linfocitaria focale o diffusa, in i linfonodi - proliferazione delle cellule reticolari ed endoteliali, nei polmoni - la formazione di noduli linfoidi. AI Strukov (1959) ritiene che queste reazioni siano di natura tossico-allergica.
V.I. Puzik (1946) li considera il risultato dell'azione del Mycobacterium tuberculosis nei primi periodi di sviluppo del processo infettivo. La connessione di queste reazioni con l'immunità cellulare e umorale è mostrata [Averbakh M. M., 1976].
Grazie alle misure preventive antitubercolari e al trattamento specifico, vi è un significativo patomorfosi della tubercolosi. La vera patomorfosi comprende una diminuzione del numero di polmoniti caseose (che indica un aumento dell'immunità) e una formazione più frequente di tubercolomi. Le forme di tubercolosi miliare e di meningite tubercolare (soprattutto nei bambini) sono diventate meno comuni.
Le manifestazioni di patomorfosi indotta, causate da un trattamento specifico, sono cavità isolate attorno alle quali si risolve rapidamente l'infiammazione perifocale, completo riassorbimento o sviluppo di piccole cicatrici a forma di stella nella tubercolosi ematogena disseminata, rigetto di masse caseoso-necrotiche con formazione di una cavità cistiforme al posto della cavità nella tubercolosi fibroso-cavernosa.
L'uso dei farmaci chemioterapici più efficaci porta ad una cura completa dalla tubercolosi. Più spesso si osserva un diverso decorso dell'infiammazione tubercolare: stabilizzazione e sviluppo inverso, acquisizione di natura cronica con periodi di cedimento ed esacerbazione di un processo specifico. Di decisiva importanza è il macroorganismo, lo stato dei suoi meccanismi di difesa, la capacità di resistere all'azione di uno stimolo antigenico, nonché lo sviluppo di processi riparativi a tutti gli effetti.
Le manifestazioni cliniche e morfologiche dell'infezione primaria da Mycobacterium tuberculosis sono solitamente chiamate tubercolosi primaria. Tubercolosi primaria si sviluppa solo nel 7-10% degli individui infetti, molto spesso bambini, mentre nel resto l'infezione si manifesta solo nei test della tubercolina [Khomenko A. G., 1989]. L'assenza di manifestazioni cliniche dell'infezione primaria è spiegata dall'elevato livello di resistenza non specifica e specifica alla tubercolosi, sviluppatasi a seguito della vaccinazione anti-TBC con BCG.
L’organismo affronta l’infezione da tubercolosi attraversando un periodo di reazioni “minori” non specifiche e specifiche. Di conseguenza, il corpo acquisisce l'immunità alla tubercolosi e la malattia non si sviluppa. Attualmente, meno spesso di prima, il decorso cronico dell'infezione primaria da tubercolosi si osserva sotto forma di varie reazioni paraspecifiche, o "maschere della tubercolosi".
La forma più comune di tubercolosi primaria è la broncoadenite, che spesso si manifesta senza caseinfezione dei linfonodi e formazione di focolai nei polmoni. Con una diminuzione della resistenza del corpo e un'infezione più massiccia, si sviluppa un'infiammazione specifica nei linfonodi con la formazione di focolai di necrosi formaggiosa. Le alterazioni si diffondono alla capsula e alle aree adiacenti del polmone, con la formazione di un infiltrato ilare, solitamente di natura aspecifica. Il processo può diffondersi alle pareti dei bronchi con la formazione di microfistole.
Durante la guarigione nei linfonodi si osserva il riassorbimento dell'infiammazione perifocale, l'ispessimento della caseosi, la deposizione di sali di calcio nella caseosi e un aumento dei cambiamenti fibrosi nella capsula e nella regione ilare circostante.
La tubercolosi primaria può manifestarsi con la formazione di un focolaio tubercolare primario nel polmone. Questo focolaio è di natura polmonare con caseosi al centro e un'ampia zona perifocale di infiammazione all'esterno. Dopo la formazione dell'affezione polmonare si nota un danno ai linfonodi regionali con un “percorso” di vasi linfatici alterati tra di loro. Ciò corrisponde all'immagine del complesso primario con i suoi tre componenti costitutivi.
Durante la guarigione, l'infiammazione perifocale si risolve, la caseosi nella lesione si ispessisce, i sali di calcio si depositano e attorno alla lesione si forma una capsula di tessuto connettivo. Può verificarsi la sostituzione completa della lesione caseosa con fibrosi. Nei linfonodi predominano i processi di incapsulamento e calcificazione delle masse caseose.
In caso di progressione del complesso primario, il focolaio polmonare aumenta di dimensioni, va incontro a caseinfezione con formazione di cavità pneumoniogeniche acute. Intorno alla cavità si forma quindi una capsula di tessuto connettivo e il processo progredisce fino alla tubercolosi fibrocavernosa.
Il decorso progressivo della tubercolosi primaria può manifestarsi sotto forma di tubercolosi miliare a seguito della “svolta” dell'infezione nel flusso sanguigno. È importante ricordare la possibilità di diffusione acuta dell'infezione; È necessario diagnosticare tali casi in modo tempestivo, poiché il trattamento precoce ha un buon effetto.
Di conseguenza, il periodo dell'infezione primaria, insieme alla diffusione dell'infezione attraverso il tratto linfatico, è caratterizzato anche da screening ematogeni, che caratterizzano la bacillemia con la comparsa di focolai di infiammazione specifica in vari organi e tessuti. Lesioni di screening nei polmoni che si formano durante vari periodi di tubercolosi primaria sono spesso un reperto accidentale durante un esame anatomico a raggi X di persone che non soffrono di forme attive di tubercolosi.
Tali lesioni consistono in caseosi circondate da una capsula fibrosa povera di elementi cellulari. Le lesioni, di regola, sono multiple, localizzate nei segmenti superiori dei polmoni sotto la pleura. Con un'esacerbazione del processo in questi focolai inizia la tubercolosi secondaria, caratterizzata da danno locale all'organo. Pertanto, i focolai post-primari sono di grande importanza nella patogenesi della tubercolosi secondaria.
Uno studio sulla reversione dei protoplasti di batteri e funghi ha rivelato somiglianze nel corso di questo processo. Convenzionalmente, può essere suddiviso in tre fasi: 1) rigenerazione della parete cellulare, 2) reversione, comparsa di cellule revertanti, 3) ripristino della normale citocinesi e comparsa di cellule nella forma originale.
Allo stesso tempo, ogni gruppo di microrganismi ha le proprie caratteristiche di reversione del protoplasto, associate alla struttura delle cellule e delle pareti cellulari, alla natura del metabolismo e alla citocinesi.
Reversione dei protoplasti batterici. Se, durante il trattamento con lisozima o penicillina in un ambiente isotonico, la parete cellulare della cellula batterica non viene completamente rimossa, quando questi agenti vengono esclusi dall'ambiente, si verifica un rapido recupero cellulare. Se la parete cellulare viene completamente rimossa, il vero protoplasto risultante non è in grado di rigenerarlo in condizioni normali. Una delle condizioni che consente a tali forme di ritornare al loro stato originale è la presenza di una base solida o semisolida nel mezzo di coltura. Può essere gelatina (5-30%), agar (0,7-2%), filtri a membrana, cellule batteriche uccise o pareti cellulari. Inoltre è preferibile l'uso di un substrato solido.
Reversione dei protoplasti dei funghi filamentosi. Il ritorno alle forme miceliali nei protoplasti fungini avviene sia in liquido che sulla superficie di un mezzo solido o in uno strato di agar semiliquido. Molti ricercatori hanno dimostrato che la reversione dei protoplasti fungini può avvenire in tre modi, diversi nella natura della formazione del micelio primario. Con il primo metodo i protoplasti inizialmente formano una catena di cellule simili al lievito (fino a 20 cellule). Successivamente quella terminale, già osmoticamente stabile, produce un'ifa primaria che forma il micelio. Secondo modo la reversione inizia con la rigenerazione della parete cellulare da parte dei protoplasti, a seguito della quale diventano resistenti allo shock osmotico. Il protoplasto forma quindi un tubo germinale. Terza via la reversione dei protoplasti fungini è insolita. Il protoplasto, mantenendo la sua forma sferica, forma un nuovo guscio a forma di ripiano, quindi il contenuto del protoplasto madre viene trasferito lì. Se appare una catena di tali membrane, il citoplasma si muove lungo questa catena, lasciando dietro di sé "ombre" delle pareti cellulari. L'ultima cellula della catena forma l'ifa primaria. I protoplasti fungini possono regredire in tre modi, oppure una specie mostra tutte e tre le modalità di reversione. È difficile dire cosa influenza la scelta del metodo di reversione, forse le caratteristiche della specie dell'organismo, il tipo di citocinesi, il metodo di ottenimento e le condizioni di incubazione dei protoplasti o la composizione del mezzo di rigenerazione.
I protoplasti in crescita e inversione sono un buon modello per studiare la biosintesi della parete cellulare e la relazione tra crescita cellulare e divisione nucleare.
4.2. Coltivazione di cellule vegetali
L'idea della possibilità di coltivare cellule al di fuori del corpo fu espressa alla fine del XIX secolo. Periodo dal 1892 al 1902 può essere considerata la preistoria dello sviluppo del metodo di coltura delle cellule e dei tessuti vegetali. A quel tempo, gli scienziati tedeschi H. Fechting, K. Rechinger, G. Haberlandt tentarono di far crescere pezzi di tessuto, gruppi di cellule e peli isolati dalle piante. Senza raggiungere il successo sperimentale, questi primi ricercatori espressero però una serie di idee che furono successivamente implementate.
Nel corso dei successivi 20 anni furono ottenuti i primi risultati sulla coltivazione di tessuti animali su terreni nutritivi con l'aggiunta di siero. Ma nel mondo vegetale non è stato ottenuto alcun successo significativo, nonostante i tentativi di creare mezzi nutritivi ottimali in grado di garantire l’esistenza e la riproduzione a lungo termine delle cellule vegetali in vitro.
Nel 1922, W. Robbins e Cotte dimostrarono indipendentemente la possibilità di coltivare cellule meristematiche dell'apice della radice di pomodoro e mais su terreni nutritivi sintetici. Questi esperimenti segnarono l'inizio dell'uso del metodo di coltivazione di cellule e organi vegetali isolati.
Negli anni '30 e '60, grazie al lavoro di un gran numero di scienziati (F. White, R. Gautre e altri), il numero di specie vegetali le cui cellule e tessuti sono stati coltivati in vitro ha raggiunto un numero significativo (più di 150) . Sono state descritte le composizioni dei terreni nutritivi, sono state determinate le esigenze delle colture in termini di vitamine e stimolanti della crescita, sono stati sviluppati metodi per ottenere e coltivare grandi masse di sospensioni cellulari, nonché coltivare una singola cellula isolata da una sospensione. F. Steward, lavorando con una coltura di floema di carota isolato, ne ottenne piante intere nel 1958. Un contributo significativo allo sviluppo della coltura di cellule e tessuti vegetali è stato dato dalla ricerca di R. G. Butenko e dei suoi colleghi, che hanno utilizzato questi metodi per studiare la fisiologia delle cellule vegetali e la morfogenesi delle piante.
Negli anni successivi furono proposti metodi per ottenere protoplasti isolati da tessuti vegetali e furono trovate condizioni di coltivazione in cui essi erano in grado di formare una nuova parete cellulare, dividersi e dare origine a linee cellulari. Utilizzando protoplasti isolati, sono stati sviluppati metodi per l'ibridazione delle cellule somatiche fondendo i protoplasti con PEG (polietilenglicole) e introducendo in essi RNA virale, organelli cellulari e cellule batteriche. Usando il metodo della coltura del meristema, sono state ottenute piante esenti da virus, economicamente importanti con alti tassi di riproduzione.
Attualmente continua attivamente lo sviluppo di metodi per la coltivazione di cellule profonde, metodi per l'elettrofusione di protoplasti isolati, ecc.
L'uso di metodi per ottenere varianti somaclonali, aploidi sperimentali e screening di mutanti biochimici ha portato all'emergere di ceppi cellulari più produttivi adattati alle condizioni di coltivazione, utilizzati per creare nuove forme e varietà di piante agricole, medicinali, ornamentali e di altro tipo.
Gli agenti causali della tubercolosi sono i micobatteri acido-resistenti, scoperti da R. Koch nel 1882. Sono noti diversi tipi di Mycobacterium tuberculosis: Mycobacterium tuberculosis (specie umana), Mycobacterium africanum (specie intermedia) e Mycobacterium bovis (specie bovina), che appartengono al genere Mycobacterium, famiglia Mycobacteriacae, ordine Actinomycetalis. Gli agenti causali della tubercolosi nell'uomo più spesso (nel 92% dei casi) sono i micobatteri tubercolosi della specie umana; i micobatteri bovini e intermedi causano lo sviluppo della tubercolosi nell'uomo rispettivamente nel 5 e 3% dei casi. Nella moderna classificazione microbiologica, i micobatteri della specie aviaria (M. avium) sono classificati come micobatteri non tubercolari del complesso avium - intracellulare, che possono essere agenti causali della micobatteriosi nell'uomo e negli animali.
Il Mycobacterium tuberculosis è costituito da bastoncini sottili, diritti o leggermente ricurvi, lunghi 1-10 (solitamente 1-4) micron, larghi 0,2-0,6 micron, omogenei o granulari con estremità leggermente arrotondate (Fig. 1.1), immobili e non formano endospore. , conidi e capsule. La morfologia e le dimensioni delle cellule batteriche variano in modo significativo, il che dipende dall'età delle cellule e soprattutto dalle condizioni di vita e dalla composizione del mezzo nutritivo. Utilizzando la microscopia elettronica, sono stati identificati i principali elementi strutturali del Mycobacterium tuberculosis: la parete cellulare, la membrana citoplasmatica e il suo derivato - mesosoma, citoplasma, sostanza nucleare - nucleotide.
La parete cellulare limita l'esterno della cellula, fornendo protezione meccanica e osmotica. Al microscopio elettronico, nella parete cellulare si distinguono tre strati spessi 10 nm; lo strato superficiale, la microcapsula, è costituito da polisaccaridi e svolge un ruolo importante nella vita del micobatterio, compreso assicurarne la resistenza agli effetti avversi. La parete cellulare contiene antigeni specie-specifici. I vaccini preparati dalle pareti cellulari del Mycobacterium tuberculosis hanno virulenza e immunogenicità diverse. L'immunità più pronunciata è causata dai vaccini realizzati con le pareti cellulari di micobatteri altamente virulenti. Le pareti cellulari causano lo sviluppo di ipersensibilità di tipo ritardato (DHT) e la formazione di anticorpi nel corpo di animali sani. Tuttavia, le loro forti proprietà sensibilizzanti e la presenza di un fattore cordonale tossico (fattore di virulenza) complicano significativamente l'iperimmunizzazione del Mycobacterium tuberculosis con questa frazione.
Fig. 11 Mycobacterium tuberculosis Contrasto negativo x 35.000
kulosis [Averbakh M. M. et al., 1976; Romanova R. Yu., 1981]. Il compito è isolare i componenti con elevata attività protettiva dalle frazioni della parete cellulare.
Secondo i concetti moderni, la membrana citoplasmatica situata sotto la parete cellulare comprende complessi lipoproteici. Ad esso sono associati diversi sistemi enzimatici, in particolare quelli redox. I processi responsabili
specificità delle reazioni cellulari dei micobatteri all’ambiente.
La membrana citoplasmatica del Mycobacterium tuberculosis, per invaginazione nel citoplasma, forma un sistema di membrane intracitoplasmatiche, o mesosoma. I mesosomi sono multifunzionali. Ad essi è associata la localizzazione di numerosi sistemi enzimatici; partecipano alla sintesi del materiale della parete cellulare e fungono da intermediario tra il nucleo e il citoplasma. Uno sviluppo debole o l'assenza di mesosomi è stato notato in ceppi avirulenti di Mycobacterium tuberculosis e nelle loro forme L [Katz L.N., Volk A.V., 1974]. Il citoplasma del Mycobacterium tuberculosis è costituito da granuli e vacuoli di varie dimensioni. La parte principale delle inclusioni a granulometria fine è rappresentata dai ribosomi, sui quali viene sintetizzata una proteina specifica.
La sostanza nucleare del Mycobacterium tuberculosis determina le proprietà specifiche della cellula, le più importanti delle quali sono la sintesi proteica e la trasmissione dei caratteri ereditari alla prole. È stato stabilito che il principale metodo di riproduzione di questi batteri è la divisione delle cellule madri in due cellule figlie.
È stato stabilito che il portatore di informazioni genetiche batteriche non sono solo i cromosomi, ma anche gli elementi non cromosomici: i plasmidi. La principale differenza tra cromosomi e plasmidi è la loro dimensione. Il cromosoma è molte volte più grande del plasmide e, di conseguenza, trasporta una grande quantità di informazioni genetiche. L'interazione dei plasmidi con il cromosoma è possibile. I plasmidi, a causa delle loro piccole dimensioni, sono ben adattati al trasferimento da cellula a cellula. La ricerca sui plasmidi non è solo teorica, ma anche pratica. Si ritiene che i geni per la resistenza del Mycobacterium tuberculosis alla chemioterapia siano localizzati sia sul cromosoma che sul plasmide.
Sono state descritte numerose varianti morfologiche dei micobatteri: forme giganti con rami ispessiti a forma di fiasco, forme filamentose, micelioformi e clavatrici, difteroidi e actinomicotiche. Il Mycobacterium tuberculosis può essere più lungo o più corto, più spesso o più sottile del solito, omogeneo o granulare. A volte appaiono come catene o singoli grappoli di grani coccoidi.
Il fenomeno della variabilità nel Mycobacterium tuberculosis fu scoperto subito dopo la loro scoperta. Già nel 1888, I. I. Mechnikov riferì che nelle culture, oltre ai tipici bacilli di Koch, si trovano forme polimorfiche di questi microrganismi sotto forma di brevi collegamenti collegati a coppie e formazioni giganti con rami a forma di fiasco. La prima segnalazione sulla possibilità dell'esistenza di forme filtrabili nel Mycobacterium tuberculosis risale al 1910 (A. Fontes). Durante la chemioterapia della tubercolosi distruttiva sperimentale, così come dopo la sua cessazione, negli omogenati della parete della cavità, passati attraverso filtri batterici con una dimensione dei pori di 0,2 micron,
forme molto piccole, con una struttura semplificata, dell'agente eziologico della tubercolosi, chiamate ultrapiccole (Fig. 1.2). Successivamente è stato dimostrato che queste forme, attraverso ripetuti passaggi biologici, sono in grado di regredire nella classica forma bastoncellare [KhomenkoA. G. et al., 1982, 1989]. Uno dei tipi di variabilità di molti batteri è la formazione di forme L. La capacità di formare forme L è stata dimostrata anche nel Mycobacterium tuberculosis [Dorozhkova I. R., 1974; Shmelev N.A., Zemskova Z. S, 1974]. Si è scoperto che la trasformazione dei micobatteri in forme L è migliorata sotto l'influenza di farmaci antitubercolari. L'espettorato di pazienti “abacillari” con forme distruttive di tubercolosi può contenere forme L di micobatteri che possono rimanere nell'organismo per lungo tempo e successivamente, in condizioni appropriate, ritornare alla variante a forma di bastoncino [KhomenkoA. G. et al., 1980]. Di conseguenza, l'abachilazione delle cavità di tali pazienti non significa ancora la loro sterilizzazione rispetto al Mycobacterium tuberculosis.
Oltre alla variabilità morfologica, il Mycobacterium tuberculosis è caratterizzato da un'ampia variabilità di altre caratteristiche, in particolare dalla resistenza all'acido. Quest'ultimo si manifesta con la capacità di trattenere il colore anche con decolorazioni intense con alcool acido ed è un tratto caratteristico di tutti i tipi di micobatteri, per il loro alto contenuto di acido micolico e di lipidi. La perdita parziale o totale della resistenza agli acidi porta alla formazione di una popolazione mista composta da individui acido-resistenti e non acido-resistenti, oppure una popolazione completamente non acido-resistente.
Il Mycobacterium tuberculosis è molto resistente ai fattori ambientali. In condizioni naturali, in assenza di luce solare, la loro vitalità può persistere per diversi mesi; in luce diffusa, gli agenti patogeni muoiono dopo 1-42 mesi. Il Mycobacterium tuberculosis persiste nella polvere stradale fino a 10 giorni, sulle pagine dei libri fino a 3 mesi, nell'acqua fino a 5 mesi. Allo stesso tempo, una coltura di microrganismi irradiati dalla luce solare muore entro IV2 ore e sotto l'influenza dei raggi ultravioletti - dopo 2-3 minuti. Quando si fa bollire l'espettorato umido, i micobatteri muoiono dopo 5 minuti, l'espettorato essiccato - dopo 25 minuti. I composti che rilasciano cloro attivo libero (soluzioni di cloramina al 3-5%, soluzioni di candeggina al 10-20%, ecc.) provocano la morte del Mycobacterium tuberculosis entro 3-5 ore.
Il Mycobacterium tuberculosis è considerato aerobio, sebbene vi siano prove che alcune delle sue specie possano essere considerate anaerobi facoltativi. Questi micobatteri si riproducono molto lentamente (una divisione cellulare avviene in 14-18 ore). La crescita visibile al microscopio di microcolonie coltivate su terreno liquido a una temperatura di 37°C viene rilevata nei giorni 5-7, la crescita visibile di colonie su terreno solido coltivato alla stessa temperatura viene rilevata nei giorni 14-20.
Per il normale sviluppo del Mycobacterium tuberculosis sono necessari speciali mezzi nutritivi contenenti carbonio, azoto, ossigeno, idrogeno, fosforo, magnesio, potassio, sodio, ferro, cloro e zolfo. Questi microrganismi necessitano anche di alcuni fattori di crescita, che includono composti legati alle vitamine del gruppo B, biotina, nicotina, riboflavina, ecc. Tutti questi fattori sono inclusi negli speciali terreni nutritivi utilizzati per la coltivazione del Mycobacterium tuberculosis, da cui vengono isolati i terreni contenenti glicerolo, mezzi proteici (uova, siero di latte, patate) e mezzi privi di proteine (sintetici), che includono sali minerali. In base alla loro consistenza si possono classificare in solidi, semiliquidi e liquidi. I più utilizzati sono i terreni a uovo denso di Levenstein-Jensen, Ogawa, Petragnani e Gelber, vari terreni agar di Middlebrook, terreni sintetici e semisintetici di Soton, Dubos, Proskauer-Heck, Shula, Shkolnikova, ecc.
Sui mezzi nutritivi liquidi, i microbatteri della tubercolosi crescono sotto forma di una pellicola secca e rugosa (forma P), color crema, che sale verso le pareti del vaso, mentre il mezzo rimane trasparente. Durante lo sviluppo intracellulare dei micobatteri, così come durante la loro coltivazione in mezzi liquidi, viene chiaramente rilasciato un caratteristico fattore cordonale (trealosio-6,6-dimicolato). Si trova sulla superficie delle cellule di molti micobatteri e, secondo alcuni ricercatori, è legato alla loro virulenza, favorendo la convergenza delle cellule microbiche e la loro crescita sotto forma di trecce serpentine.
Su terreni solidi, il Mycobacterium tuberculosis cresce sotto forma di un rivestimento squamoso cremoso, rugoso o secco, formando colonie dai bordi irregolari, sollevate al centro; man mano che crescono acquisiscono un aspetto verrucoso, che ricorda il cavolfiore.
Sotto l'influenza di sostanze antibatteriche, il Mycobacterium tuberculosis può acquisire resistenza ai farmaci. Le colture di tali micobatteri non sono sempre tipiche; possono essere umide, morbide (variante S) e talvolta contenere singole colonie lisce o pigmentate.
1.2. PATOGENESI
Il Mycobacterium tuberculosis può entrare nel corpo in vari modi: per via aerogena, enterale (attraverso il tratto gastrointestinale), attraverso la pelle e le mucose danneggiate, attraverso la placenta durante lo sviluppo fetale. Tuttavia, la principale via di infezione è aerogena.
Un certo ruolo protettivo durante l'infezione aerogena è svolto dal sistema di pulizia mucociliare, che consente di rimuovere parzialmente particelle di polvere, gocce di muco, saliva ed espettorato contenenti microrganismi penetrati nei bronchi. In caso di infezione enterale la funzione di assorbimento dell'intestino può avere una certa importanza.
I cambiamenti locali nel sito di penetrazione del micobatterio sono causati principalmente dalla reazione delle cellule polinucleari, che viene sostituita da una forma più avanzata di reazione protettiva con la partecipazione dei macrofagi che effettuano la fagocitosi e la distruzione del micobatterio. Il processo di interazione dei macrofagi polmonari con vari microrganismi, incluso il Mycobacterium tuberculosis, è complesso e non del tutto compreso. Il risultato dell'interazione tra macrofagi e micobatteri è determinato dallo stato del sistema immunitario, dal livello di PCTI che si sviluppa durante l'infezione da tubercolosi, nonché da una serie di altri fattori, compresi quelli che determinano la capacità digestiva dei macrofagi.
La fagocitosi è composta da tre fasi: la fase di contatto, in cui i macrofagi, utilizzando i recettori presenti sulla membrana cellulare, fissano i micobatteri; fasi di penetrazione del micobatterio nel macrofago mediante invaginazione della parete del macrofago e “avvolgimento” del micobatterio; fasi della digestione, quando i lisosomi dei macrofagi si fondono con i fagosomi contenenti micobatteri. Gli enzimi rilasciati nei fagolisosomi distruggono i micobatteri. Nel processo di fagocitosi, anche i meccanismi di perossidazione svolgono un ruolo importante.
Il Mycobacterium tuberculosis, come alcuni altri microrganismi, quando entrano nei macrofagi, può persistere e persino continuare a riprodursi. Nei casi in cui il processo di digestione dei micobatteri viene bloccato, i macrofagi vengono distrutti e i micobatteri vengono rilasciati dalle cellule che li hanno assorbiti.
I macrofagi, che hanno fagocitato i micobatteri e li digeriscono, rilasciano nello spazio extracellulare frammenti di micobatteri distrutti, enzimi proteolitici, mediatori (inclusa l'interleuchina-1), che attivano i linfociti T, in particolare i T-helper. Le cellule T-helper attivate rilasciano mediatori: linfochine (inclusa l'interleuchina-2), sotto l'influenza delle quali nuovi macrofagi migrano nella posizione del micobatterio. Allo stesso tempo, la sintesi del fattore di inibizione della migrazione viene soppressa e l'attività enzimatica dei macrofagi aumenta sotto l'influenza del fattore di attivazione dei macrofagi. I linfociti attivati secernono anche un fattore reattivo cutaneo, che provoca una reazione infiammatoria e un aumento della permeabilità vascolare. La soppressione del PCZT e la reazione positiva alla tubercolina sono associate a questo fattore [Medunitsyn N.V. et al., 1980]. Oltre ai T-helper, lo stato immunitario è influenzato in modo significativo dai T-soppressori e dai monociti soppressori, che inibiscono la risposta immunitaria.
Oltre ai linfociti T e ai macrofagi, un ruolo importante nella patogenesi del processo di tubercolosi appartiene alle sostanze rilasciate durante la distruzione dei micobatteri. Queste sostanze (frazioni) sono state studiate in dettaglio. È stato dimostrato che il fattore cordonale (il fattore di virulenza del Mycobacterium tuberculosis, che determina la loro crescita su un mezzo nutritivo denso sotto forma di "trecce") provoca un processo infiammatorio acuto e che i solfatidi aumentano la tossicità del fattore cordonale e, soprattutto, sopprimono la formazione di fagolisosomi nei macrofagi, che proteggono i micobatteri localizzati a livello intracellulare dalla distruzione.
Con un'intensa proliferazione di micobatteri nel corpo umano, a causa della fagocitosi inefficace, viene rilasciato un gran numero di sostanze tossiche, viene indotto un PCI pronunciato, che contribuisce alla comparsa di una componente essudativa dell'infiammazione con lo sviluppo della necrosi caseosa e la sua proliferazione . Durante questo periodo, il numero di soppressori T aumenta, il numero di aiutanti T diminuisce, il che porta all'inibizione della PCRT. Ciò provoca la progressione del processo di tubercolosi.
Con una popolazione batterica relativamente piccola in condizioni di PCZT e fagocitosi efficace, si osserva la formazione di granulomi tubercolari. Un tale granuloma si sviluppa come risultato delle reazioni PCZT [Averbakh M. M. et al., 1974]. L'accumulo di cellule mononucleate attorno ai neutrofili contenenti l'antigene e la loro successiva trasformazione avviene sotto l'influenza regolatrice delle linfochine prodotte dai linfociti T (in particolare le cellule T helper) e sono mediatori della reazione granulomatosa. Poiché la dimensione della popolazione batterica, così come la natura del decorso delle reazioni immunologiche nei diversi stadi dell'infezione tubercolare, cambiano, le reazioni morfologiche nei pazienti affetti da tubercolosi sono caratterizzate da una grande diversità.
A seconda del luogo di introduzione del Mycobacterium tuberculosis, si può formare un focolaio infiammatorio, o affetto primario, nei polmoni, nella cavità orale, nelle tonsille, nell'intestino, ecc. In risposta alla formazione dell'affetto primario, si sviluppa un processo specifico nel si formano i linfonodi regionali e il complesso della tubercolosi primaria. È stato stabilito che la tubercolosi primaria, che si sviluppa a seguito del primo contatto di un macroorganismo con un agente patogeno, può manifestarsi non solo sotto forma di un complesso di tubercolosi primaria, come si pensava in precedenza. Come risultato dell'infezione primaria, è possibile lo sviluppo della tubercolosi dei linfonodi intratoracici, della pleurite, del tubercoloma e del processo focale.
La tubercolosi primaria a seguito di un'infezione “fresca” si sviluppa solo nel 7-10% degli individui infetti, il resto soffre di infezione tubercolare primaria senza manifestazioni cliniche. Una volta che si verifica l'infezione, si manifesta solo con cambiamenti nelle reazioni alla tubercolina.
Anche V.I. Puzik (1946), A.I. Kagramanov (1954) ed altri stabilirono che la formazione del complesso primario è spesso preceduta da un periodo di “microbismo latente”, in cui il mycobacterium tuberculosis, entrando nell'organismo, vi rimane, senza causare una reazione infiammatoria. In questo caso, i micobatteri si trovano più spesso nei linfonodi, soprattutto in quelli intratoracici. In questi casi, cambiamenti locali nei polmoni o in altri organi sotto forma di focolai di tubercolosi primaria si verificano nel periodo tardivo dell'infezione primaria e non nel sito di penetrazione del micobatterio nel corpo, ma nelle aree più favorevoli allo sviluppo della tubercolosi. infiammazione.
L'assenza di manifestazioni cliniche e morfologiche dell'infezione primaria da tubercolosi può essere spiegata dall'alto livello di resistenza naturale alla tubercolosi e può anche essere una conseguenza dell'immunità acquisita a seguito della vaccinazione BCG.
In presenza di manifestazioni locali, la tubercolosi primaria può manifestarsi con lo sviluppo di un processo diffuso di tipo complicato o, che attualmente si osserva molto più spesso, di tipo non complicato con una reazione infiammatoria limitata.
Di norma, la tubercolosi primaria guarisce con lievi cambiamenti residui, apparentemente dovuti all'elevata resistenza naturale e alla vaccinazione di massa e alla rivaccinazione con BCG.
I micobatteri rimasti in focolai residui o le loro forme alterate dovrebbero essere considerati un antigene della tubercolosi, la cui presenza è necessaria per il mantenimento dell'immunità specifica da parte dei linfociti sensibilizzati. Un certo ruolo, anche se ancora poco compreso, nel mantenimento dell’immunità antitubercolare appartiene all’immunità delle cellule B e ai meccanismi genetici.
Sono state ottenute prove del ruolo dell'ereditarietà durante il processo di berculosis. Fattori genetici influenzano la risposta del sistema immunitario durante la proliferazione del Mycobacterium tuberculosis nel corpo umano e, in particolare, determinano l'interazione tra macrofagi, linfociti T e B, la produzione di linfochine, monochine e altre citochine da parte dei linfociti T e B e macrofagi e la complessa risposta immunitaria, che determina la sensibilità o la resistenza allo sviluppo della tubercolosi. Il collegamento dei genotipi HLA con la tubercolosi è stato rivelato nelle famiglie in cui genitori e figli avevano la tubercolosi.
L'accumulo di alcuni tipi HLA specifici in gruppi di pazienti con un decorso sfavorevole della malattia indica l'associazione di alcuni geni del complesso HLA (principalmente i loci B e DR con una predisposizione alla tubercolosi) [Khomenko A. G., 1985].
Il periodo dell'infezione primaria può concludersi con la guarigione con cambiamenti residui minimi (piccoli) o abbastanza pronunciati. Queste persone sviluppano l'immunità acquisita. La persistenza di micobatteri persistenti in focolai residui non solo supporta l'immunità acquisita, ma crea contemporaneamente anche il rischio di riattivazione endogena del processo tubercolare a causa della reversione delle forme alterate dell'agente patogeno della tubercolosi nella forma batterica e della proliferazione della popolazione micobatterica.
La reversione delle forme persistenti di micobatteri in forme moltiplicative avviene in condizioni di riattivazione endogena dei focolai di tubercolosi e altri cambiamenti residui. Il meccanismo della riattivazione endogena, così come lo sviluppo del processo tubercolare, non sono stati sufficientemente studiati.
La riattivazione si basa sulla progressiva proliferazione della popolazione batterica e sull'aumento del numero dei micobatteri [Khomenko A.G., 1986]. Tuttavia, fino ad oggi non si sa esattamente cosa e quali condizioni contribuiscano alla regressione dell’agente patogeno della tubercolosi, che era in uno stato persistente. È stato stabilito che la riattivazione della tubercolosi e lo sviluppo delle sue varie forme cliniche si osservano più spesso in soggetti con alterazioni residue in presenza di fattori che riducono l'immunità.
Un'altra possibile via di sviluppo della tubercolosi secondaria è quella esogena, associata ad una nuova (ripetuta) infezione da Mycobacterium tuberculosis (superinfezione). Ma anche con il percorso esogeno di sviluppo della tubercolosi secondaria, la penetrazione dei micobatteri in un organismo già infetto non è sufficiente, anche con una massiccia superinfezione ripetuta. È necessaria una combinazione di una serie di condizioni e fattori di rischio che riducono l’immunità. La tubercolosi secondaria è caratterizzata da un'ampia varietà di forme cliniche. I principali tipi di cambiamenti patomorfologici nei polmoni e in altri organi sono caratterizzati da: a) focolai con una reazione tissutale prevalentemente produttiva, un decorso cronico favorevole e una tendenza alla guarigione; b) alterazioni infiltrativo-polmonari con reazione tissutale prevalentemente essudativa e tendenza a sviluppare necrosi caseosa o risolvere la conseguente reazione infiammatoria; c) cavità tubercolare - il risultato della decomposizione delle masse caseose formate e del loro rigetto attraverso i bronchi di drenaggio con la formazione di una cavità di decomposizione.
Varie combinazioni dei principali cambiamenti patomorfologici della tubercolosi creano i prerequisiti per una varietà estremamente ampia di cambiamenti della tubercolosi, specialmente nel decorso cronico della malattia con periodi alternati di esacerbazione e cedimento del processo. A ciò va aggiunto che dalle zone colpite formatesi i micobatteri possono diffondersi attraverso il flusso della linfa o del sangue alle zone non colpite e ai vari organi. L'esito della malattia dipende dal suo decorso: progressivo o regressivo, dall'efficacia del trattamento e dalla reversibilità dei cambiamenti formati durante il processo patologico. È stato dimostrato che in condizioni di fame e persino di denutrizione, soprattutto quando la dieta contiene proteine e vitamine insufficienti, spesso si verifica la riattivazione della tubercolosi. I fattori che contribuiscono alla riattivazione includono varie malattie: diabete mellito, linfogranulomatosi, silicosi, ulcera peptica dello stomaco e del duodeno, condizioni dopo la resezione dello stomaco e del duodeno, malattie infiammatorie croniche polmonari, malattie mentali che si verificano con sindrome depressiva, alcolismo, situazioni stressanti, AIDS , uso a lungo termine di glucocorticoidi, citostatici e immunosoppressori. Il decorso e gli esiti della tubercolosi dovrebbero essere considerati solo nel contesto di una chemioterapia specifica, utilizzata per tutti i pazienti con tubercolosi attiva. Durante la chemioterapia si verifica una diminuzione della popolazione di micobatteri a causa dell'effetto distruttivo della chemioterapia sugli agenti patogeni della tubercolosi. Di conseguenza, il numero di micobatteri diminuisce drasticamente e si creano condizioni più favorevoli per i processi riparativi e la sanogenesi. Allo stesso tempo, quando si utilizzano le combinazioni più efficaci dei moderni farmaci chemioterapici, si osserva un diverso decorso del processo tubercolare: regressione seguita da guarigione, stabilizzazione del processo senza cura clinica con conservazione della cavità, tubercoloma o altri cambiamenti, temporanei cedimento del processo infiammatorio con conseguente insorgenza di esacerbazione, sviluppo di un processo cronico o progressione della malattia .
Pertanto, la riduzione della popolazione di micobatteri sotto l'influenza di farmaci chemioterapici specifici non porta sempre alla guarigione. La conclusione del processo tubercolare e la successiva cura dipendono non solo dalla riduzione della popolazione di micobatteri, ma anche dalla capacità dei processi riparativi dell'organismo di garantire la regressione del processo tubercolare e la sua cessazione.
1.3. ANATOMIA PATOLOGICA
1.3.1. Infiammazione tubercolare
I cambiamenti patomorfologici negli organi e nei tessuti durante la tubercolosi sono diversi e dipendono dalla forma, dallo stadio, dalla localizzazione e dall'entità del processo patologico.
Comuni alla maggior parte delle forme di tubercolosi sono cambiamenti specifici in combinazione con reazioni aspecifiche o paraspecifiche. Cambiamenti specifici includono l'infiammazione tubercolare, il cui decorso è accompagnato dalla formazione di un tubercolo tubercolare, o granuloma, e da una lesione più grande. I cambiamenti non specifici sono varie reazioni che causano le cosiddette maschere della tubercolosi.
La morfologia dell'infiammazione tubercolare dipende dalla reattività dell'organismo e dalla virulenza dell'agente patogeno. In un focolaio tubercolare possono predominare i fenomeni di essudazione, necrosi o proliferazione e il focolaio, in base a ciò, può essere prevalentemente essudativo, necrotico o produttivo. I processi immunologici svolgono un ruolo importante nello sviluppo dell'infiammazione della tubercolosi. Nell'area dell'infiammazione si sviluppa prima una reazione che non presenta segni tipici della tubercolosi. In esso si esprimono in varia misura i fenomeni di alterazione e di essudazione. I disturbi del sistema microcircolatorio vengono prima. Influenzano la struttura fine della parete alveolare e i meccanismi del loro sviluppo possono essere rintracciati a livello ultrastrutturale [Erokhin V.V., 1987]. Nelle prime fasi dell'infiammazione, i cambiamenti nell'organizzazione submicroscopica degli elementi costitutivi della parete alveolare sono associati ad un aumento della permeabilità capillare, allo sviluppo di edema interstiziale intracellulare e intraalveolare con lisciviazione del tensioattivo alveolare da parte del fluido edematoso.
Successivamente aumentano i cambiamenti distrofici nel tessuto alveolare, ma insieme ad essi sorgono processi compensatori e riparativi, volti a sviluppare l'organizzazione intracellulare e ad aumentare l'attività funzionale delle rimanenti cellule del setto interalveolare. Nella fase successiva dell'infiammazione - proliferativa - compaiono elementi specifici della tubercolosi (cellule epitelioidi e giganti di Pirogov-Langhans), al centro del focolaio tubercolare si formano aree di una sorta di necrosi caseosa (cagliata) omogenea (Fig. 1.3). Sulla base dei dati della microscopia elettronica e dell'autoradiografia sulla dinamica della trasformazione cellulare, è stata stabilita una connessione genetica tra le cellule del granuloma lungo la linea cellulare gigante monocita [Serov V.V., Shekhter A.B., 1981; Erokhin V.V., 1978, 1987; Danneberg AM, 1982; Spector W. G., 1982]. I macrofagi sintetizzano e accumulano attivamente enzimi lisosomiali e svolgono una funzione fagocitaria. Il materiale assorbito, che include Mycobacterium tuberculosis, viene localizzato e digerito nei fagosomi e nei fagolisosomi. Cellule epitelioidi 
sono formati da cellule mononucleate e macrofagi che si accumulano nel focolaio dell'infiammazione tubercolare nelle prime fasi della reazione infiammatoria. Hanno un grande nucleo di forma ovale, solitamente con 1-2 nucleoli.Il citoplasma di queste cellule contiene mitocondri, granuli, l'apparato di Golgi, un sistema ben sviluppato di tubuli e cisterne del reticolo citoplasmatico granulare e non granulare e cellule singole. piccoli fagosomi. Il numero di mitocondri, elementi del reticolo e inclusioni lisosomiali varia ampiamente ed è determinato dallo stato funzionale della cellula.
Le cellule giganti di Pirogov-Langhans possono essere formate da cellule epitelioidi o macrofagi durante la loro proliferazione, nonché come risultato della fusione di cellule epitelioidi. Il citoplasma delle cellule giganti contiene un gran numero di nuclei, solitamente situati sotto forma di un anello o di un ferro di cavallo lungo la periferia delle cellule, molti mitocondri, lisosomi, elementi del reticolo citoplasmatico granulare e un complesso di Golgi ben sviluppato. Le cellule giganti sono capaci di fagocitosi, nel loro citoplasma si trovano varie inclusioni residue e sono caratterizzate da un'elevata attività degli enzimi idrolitici e respiratori.
Oltre alle cellule epitelioidi e giganti, il tessuto di granulazione tubercolare contiene solitamente un numero significativo di cellule linfoidi e plasmatiche, nonché leucociti neutrofili. I fibroblasti vengono rilevati nelle parti periferiche dello strato di granulazione. Intorno alla fonte dell'infiammazione si trova spesso una zona perifocale di reazione infiammatoria aspecifica. Con il progredire del processo, si osserva un aumento della necrosi caseosa, una maggiore infiltrazione del tessuto di granulazione con cellule mononucleate e cellule linfoidi, nonché neutrofili e un'espansione della zona di infiammazione perifocale. Un processo specifico si diffonde per contatto e per vie linfatiche.
Man mano che il focolaio tubercolare guarisce, le masse di necrosi caseosa diventano più dense e in quest'ultima si depositano piccoli granelli di sali di calcio. Nel tessuto di granulazione aumenta il numero di fibroblasti e fibrille di collagene, unendosi in fibre di collagene, che formano una capsula di tessuto connettivo attorno al focolaio tubercolare. Successivamente, il tessuto di granulazione specifico viene sempre più sostituito da tessuto fibroso. Il numero di elementi cellulari tra le fibre di collagene diminuisce e talvolta le fibre di collagene subiscono ialinosi. In tali focolai e focolai post-tubercolari sono state trovate forme alterate di Mycobacterium tuberculosis, in particolare la forma L, che ci consente di comprendere meglio il ruolo dei vecchi focolai tubercolotici nella patogenesi delle forme secondarie di tubercolosi [Puzik V. I., Zemskova Z. S., Dorozhkova I. R., 1981, 1984]. La riattivazione della tubercolosi e la formazione di varie forme di tubercolosi polmonare secondaria si basano sulla reversione e sulla proliferazione della popolazione batterica sullo sfondo dello sviluppo di insufficienza della protezione specifica e non specifica del microrganismo.
"Ambiente interno del corpo" - Il corpo umano contiene circa 20 litri. Ambiente interno del corpo Tessuto Sangue Linfa (intercellulare) Fluido. La relazione tra i componenti dell'ambiente interno del corpo. Ambiente interno del corpo. L'ambiente interno del corpo è un insieme di fluidi che prendono parte ai processi metabolici e mantengono la costanza dell'ambiente interno.
“Organi del corpo” - Il cuore umano batte in media 70 volte al minuto. Batteri. Quali regole per la tutela dei sensi sono “criptate” nei disegni? 3. Quale scienza studia le piante? Felci. 7. Che tipo di pianta non fiorisce mai? Polmoni. Cervello. 3a elementare "Noi e la nostra salute. Siamo sopraffatti dalla sonnolenza, riluttanti a muoverci.
“Immunità biologica” - Attrezzature: consolidamento delle conoscenze. Se lo si desidera, preparare un messaggio “Dalla storia della trasfusione di sangue”. Schema “Tipi di immunità”. Quali tipi di immunità esistono? Tavolo “Sangue”, ritratti di I.I. Mechnikov, L. Pasteur. Le persone sono particolarmente spesso portatrici del bacillo della tubercolosi. Passivo. Fagocitosi La fagocitosi e la produzione di anticorpi costituiscono un unico meccanismo protettivo chiamato immunità.
"Proporzioni umane" - Dati sui cambiamenti legati all'età nelle proporzioni corporee nei ragazzi: di solito la pressione sanguigna è più alta del normale. Tipo brachimorfo. Proporzioni del corpo ed età umana. Il cuore è posizionato trasversalmente grazie al diaframma alto. Aumento del rischio di ipotensione arteriosa. Cambiamenti legati all’età nelle proporzioni corporee. Tipo dolicomorfo.
“Struttura umana” - Come funziona il nostro corpo? Abbassiamo le mani al comando "due". Quindi abbiamo guardato la casa e l'aereo. Cuore. Il sole ci solleva per fare esercizio, alza le mani al comando “uno”. Senza aria, una persona può vivere solo per un breve periodo. Cervello. Il cibo trasformato entra nell'intestino. Com'è organizzata la casa? Qual è il segreto della nostra salute?
"La costanza dell'ambiente interno del corpo" - Nastro di globuli rossi. Globuli bianchi. I.I. Mechnikov. Plasma del sangue. Piastrine. Sangue. Il concetto di “ambiente interno del corpo”. Globuli rossi. Emoglobina. Leucociti. Fluidi del corpo umano. Elementi formati di sangue. Protrombina. Campione microscopico di sangue umano. Fluido tissutale. Componenti. Ambiente interno del corpo.
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0