A. G. Khomenko
Mycobacterium tuberculosis può entrare nel corpo in vari modi: per via aerogena, enterale (attraverso il tratto gastrointestinale), attraverso la pelle e le mucose danneggiate, attraverso la placenta durante lo sviluppo fetale. Tuttavia, la principale via di infezione è aerogena.
Certo ruolo protettivo durante l’infezione aerogena Il sistema di pulizia mucociliare svolge un ruolo importante, consentendo la rimozione parziale di particelle di polvere, gocce di muco, saliva ed espettorato contenenti microrganismi penetrati nei bronchi. In caso di infezione enterale la funzione di assorbimento dell'intestino può avere una certa importanza.
Cambiamenti locali nel sito di introduzione dei micobatteri sono causati principalmente dalla reazione delle cellule polinucleari, che è sostituita da una forma più avanzata di reazione protettiva con la partecipazione di macrofagi che effettuano la fagocitosi e la distruzione dei micobatteri. Il processo di interazione dei macrofagi polmonari con vari microrganismi, incluso il Mycobacterium tuberculosis, è complesso e non del tutto compreso. Il risultato dell'interazione tra macrofagi e micobatteri è determinato dallo stato del sistema immunitario, dal livello di PCTI che si sviluppa durante l'infezione da tubercolosi, nonché da una serie di altri fattori, compresi quelli che determinano la capacità digestiva dei macrofagi.
Fagocitosi si compone di tre fasi: la fase di contatto, in cui i macrofagi, sfruttando i recettori presenti sulla membrana cellulare, fissano i micobatteri; fasi di penetrazione dei micobatteri nel macrofago mediante invaginazione della parete del macrofago e “avvolgimento” del microbatterio; fasi di digestione, quando i lisosomi dei macrofagi si fondono con i fagosomi contenenti micobatteri. Gli enzimi rilasciati negli isosomi dei fagi distruggono i micobatteri. Nel processo di fagocitosi, anche i meccanismi di perossidazione svolgono un ruolo importante.
Il Mycobacterium tuberculosis, come alcuni altri microrganismi, quando entrano nei macrofagi, può persistere e persino continuare a riprodursi. Nei casi in cui il processo di digestione dei micobatteri viene bloccato, i macrofagi vengono distrutti e i micobatteri vengono rilasciati dalle cellule che li hanno assorbiti.
I macrofagi che fagocitano i micobatteri e svolgono la loro digestione secernono nei frammenti dello spazio extracellulare dei micobatteri distrutti, enzimi proteolitici, mediatori (inclusa l'interleuchina-1), che attivano i linfociti T, in particolare i T-helper.
Gli aiutanti T attivati secernono mediatori: le linfochine (inclusa l'interleuchina-2), sotto l'influenza delle quali nuovi macrofagi migrano nel sito dei micobatteri. Allo stesso tempo, la sintesi del fattore di inibizione della migrazione viene soppressa, l'attività enzimatica dei macrofagi aumenta sotto l'influenza del fattore di attivazione dei macrofagi. I linfociti attivati secernono anche un fattore reattivo cutaneo, che provoca una risposta infiammatoria e un aumento della permeabilità vascolare. Questo fattore è associato alla soppressione del PCCT e ad una reazione positiva alla tubercolina [Medunitsyn N. V. et al., 1980]. Oltre ai T-helper, lo stato immunitario è significativamente influenzato dai T-soppressori e dai monociti soppressori, che sopprimono la risposta immunitaria.
Oltre ai linfociti T e ai macrofagi, un ruolo importante nella patogenesi del processo tubercolare appartiene alle sostanze rilasciate durante la distruzione dei micobatteri. Queste sostanze (frazioni) sono state studiate in dettaglio. È stato dimostrato che il fattore cordonale (il fattore di virulenza del Mycobacterium tuberculosis, che determina la loro crescita su un mezzo nutritivo denso sotto forma di "trecce"), provoca un processo infiammatorio acuto e i solfatidi aumentano la tossicità del fattore cordonale e , soprattutto, sopprime la formazione di fagolisosomi nei macrofagi, che impedisce la distruzione dei micobatteri localizzati a livello intracellulare.
Con proliferazione intensiva di micobatteri nel corpo umano, a causa della fagocitosi inefficace, viene rilasciato un gran numero di sostanze tossiche, viene indotto un pronunciato PCCT, che contribuisce alla comparsa di una componente essudativa dell'infiammazione con lo sviluppo della necrosi caseosa e la sua riproduzione. Durante questo periodo, il numero di soppressori T aumenta, il numero di aiutanti T diminuisce, il che porta all'inibizione della PCRT. Ciò provoca la progressione del processo di tubercolosi.
Con una popolazione batterica relativamente piccola in condizioni di PCZT e fagocitosi efficace, si osserva la formazione di granulomi tubercolari. Un tale granuloma si sviluppa come risultato delle reazioni PCZT [Averbakh M. M. et al., 1974]. L'accumulo di cellule mononucleate attorno ai neutrofili contenenti l'antigene e la loro successiva trasformazione avviene sotto l'influenza regolatrice delle linfochine prodotte dai linfociti T (in particolare le cellule T-helper) e che sono mediatori della reazione granulomatosa. Poiché la dimensione della popolazione batterica, così come la natura del decorso delle reazioni immunologiche nei diversi stadi dell'infezione tubercolare, cambiano, le reazioni morfologiche nei pazienti affetti da tubercolosi sono caratterizzate da una grande diversità.
A seconda del luogo d'introduzione del Mycobacterium tuberculosis un focolaio infiammatorio, o affetto primario, può formarsi nei polmoni, nella cavità orale, nelle tonsille, nell'intestino, ecc. In risposta alla formazione di un affetto primario, si sviluppa un processo specifico nei linfonodi regionali e si forma un complesso tubercolare primario. È stato stabilito che la tubercolosi primaria, che si sviluppa a seguito del primo contatto di un macroorganismo con un agente patogeno, può manifestarsi non solo sotto forma di un complesso di tubercolosi primaria, come si pensava in precedenza. Come risultato dell'infezione primaria, è possibile lo sviluppo della tubercolosi dei linfonodi intratoracici, della pleurite, del tubercoloma e del processo focale.
La tubercolosi primaria a seguito di un'infezione “fresca” si sviluppa solo nel 7-10% degli individui infetti, il resto soffre di infezione tubercolare primaria senza manifestazioni cliniche. Una volta che si verifica l'infezione, si manifesta solo con cambiamenti nelle reazioni alla tubercolina.
Anche V.I. Puzik (1946), A.I. Kagramanov (1954) ed altri stabilirono che la formazione del complesso primario è spesso preceduta da un periodo di “microbismo latente”, in cui il mycobacterium tuberculosis, entrando nell'organismo, vi rimane, senza causare una reazione infiammatoria. In questo caso, i micobatteri si trovano più spesso nei linfonodi, soprattutto in quelli intratoracici. In questi casi, i cambiamenti locali nei polmoni o in altri organi sotto forma di focolai di tubercolosi primaria si verificano nel periodo tardivo dell'infezione primaria e non nel sito di penetrazione dei micobatteri nel corpo, ma nelle aree più favorevoli allo sviluppo di infiammazione tubercolare.
L'assenza di manifestazioni cliniche e morfologiche dell'infezione primaria da tubercolosi può essere spiegata dall'alto livello di resistenza naturale alla tubercolosi e può anche essere una conseguenza dell'immunità acquisita a seguito della vaccinazione BCG.
In presenza di manifestazioni locali, la tubercolosi primaria può manifestarsi con lo sviluppo di un processo diffuso di tipo complicato o, che attualmente si osserva molto più spesso, di tipo non complicato con una reazione infiammatoria limitata.
Di norma, la tubercolosi primaria guarisce con lievi cambiamenti residui, apparentemente dovuti all'elevata resistenza naturale e alla vaccinazione di massa e alla rivaccinazione con BCG.
I micobatteri rimasti in focolai residui o le loro forme alterate dovrebbero essere considerati un antigene della tubercolosi, la cui presenza è necessaria per il mantenimento dell'immunità specifica da parte dei linfociti sensibilizzati. Un certo ruolo, anche se ancora poco compreso, nel mantenimento dell’immunità antitubercolare appartiene all’immunità delle cellule B e ai meccanismi genetici.
Prove ricevute il ruolo dell'ereditarietà durante il processo di tubercolosi. Fattori genetici influenzano la risposta del sistema immunitario durante la proliferazione del Mycobacterium tuberculosis nel corpo umano e, in particolare, determinano l'interazione tra macrofagi, linfociti T e B, la produzione di linfochine, monochine e altre citochine da parte dei linfociti T e B e macrofagi, una risposta immunitaria complessa, che determina sensibilità o resistenza allo sviluppo della tubercolosi. Il collegamento dei genotipi HLA con la tubercolosi è stato rivelato nelle famiglie in cui genitori e figli avevano la tubercolosi.
L'accumulo di alcuni tipi HLA specifici in gruppi di pazienti con un decorso sfavorevole della malattia indica l'associazione di alcuni geni del complesso HLA (principalmente i loci B e DR con una predisposizione alla tubercolosi) [Khomenko A. G., 1985].
Il periodo dell'infezione primaria può concludersi con la guarigione con cambiamenti residui minimi (piccoli) o abbastanza pronunciati. Queste persone sviluppano l'immunità acquisita. La persistenza di micobatteri persistenti in focolai residui non solo supporta l'immunità acquisita, ma crea contemporaneamente anche il rischio di riattivazione endogena del processo tubercolare a causa della reversione delle forme alterate dell'agente patogeno della tubercolosi nella forma batterica e della proliferazione della popolazione micobatterica.
La reversione delle forme persistenti di micobatteri in forme moltiplicative avviene in condizioni di riattivazione endogena dei focolai di tubercolosi e altri cambiamenti residui. Il meccanismo della riattivazione endogena, così come lo sviluppo del processo tubercolare, non sono stati sufficientemente studiati.
Al centro della riattivazione sono la progressiva proliferazione della popolazione batterica e un aumento del numero dei micobatteri [Khomenko A.G., 1986]. Tuttavia, fino ad oggi non si sa esattamente cosa e quali condizioni contribuiscano alla regressione dell’agente patogeno della tubercolosi, che era in uno stato persistente. È stato stabilito che la riattivazione della tubercolosi e lo sviluppo delle sue varie forme cliniche si osservano più spesso in soggetti con alterazioni residue in presenza di fattori che riducono l'immunità.
È anche possibile un altro modo di sviluppare la tubercolosi secondaria- esogeno, associato a nuova (ripetuta) infezione da microbatteri della tubercolosi (superinfezione). Ma anche con il percorso esogeno di sviluppo della tubercolosi secondaria, la penetrazione dei micobatteri in un organismo già infetto non è sufficiente, anche con una massiccia superinfezione ripetuta. È necessaria una combinazione di una serie di condizioni e fattori di rischio che riducono l’immunità. La tubercolosi secondaria è caratterizzata da un'ampia varietà di forme cliniche.
Principali tipologie di alterazioni patomorfologiche nei polmoni e in altri organi sono caratterizzati da:
- lesioni con reazione tissutale prevalentemente produttiva, decorso favorevole, cronico e tendenza alla guarigione;
- alterazioni infiltrativo-polmonari con reazione tissutale prevalentemente essudativa e tendenza a sviluppare necrosi caseosa o risolvere la conseguente reazione infiammatoria;
- cavità della tubercolosi - il risultato della decomposizione delle masse caseose formate e del loro rigetto attraverso i bronchi di drenaggio con la formazione di una cavità di decomposizione.
Varie combinazioni dei principali cambiamenti patomorfologici della tubercolosi creano i prerequisiti per una varietà estremamente ampia di cambiamenti della tubercolosi, specialmente nel decorso cronico della malattia con periodi alternati di esacerbazione e cedimento del processo. A ciò va aggiunto che dalle zone colpite formatesi i micobatteri possono diffondersi attraverso il flusso della linfa o del sangue alle zone non colpite e ai vari organi. L'esito della malattia dipende dal suo decorso: progressivo o regressivo, dall'efficacia del trattamento e dalla reversibilità dei cambiamenti formati durante il processo patologico.
È stato dimostrato che in condizioni di fame e persino di denutrizione, soprattutto quando la dieta contiene proteine e vitamine insufficienti, spesso si verifica la riattivazione della tubercolosi. A fattori che contribuiscono alla riattivazione, comprendono varie malattie: diabete mellito, linfogranulomatosi, silicosi, ulcera peptica dello stomaco e del duodeno, condizioni dopo la resezione dello stomaco e del duodeno, malattie infiammatorie polmonari croniche, malattie mentali che si manifestano con sindrome depressiva, alcolismo, situazioni stressanti, AIDS, malattie a lungo termine termine utilizzare glucocorticoidi, citostatici e immunosoppressori.
Decorso e risultati della tubercolosi dovrebbero essere considerati solo nel contesto di una chemioterapia specifica in corso, che viene utilizzata per tutti i pazienti con tubercolosi attiva. Durante la chemioterapia, si verifica una diminuzione della popolazione di micobatteri a causa dell'effetto distruttivo della chemioterapia sugli agenti patogeni della tubercolosi. Di conseguenza, il numero di micobatteri diminuisce drasticamente e si creano condizioni più favorevoli per i processi riparativi e la sanogenesi.
Allo stesso tempo, quando si utilizzano le combinazioni più efficaci dei moderni farmaci chemioterapici, si osserva un diverso decorso del processo tubercolare: regressione seguita da guarigione, stabilizzazione del processo senza cura clinica con conservazione della cavità, tubercoloma o altri cambiamenti, temporanei cedimento del processo infiammatorio con conseguente insorgenza di esacerbazione, sviluppo di un processo cronico o progressione della malattia .
Pertanto, la riduzione della popolazione di micobatteri sotto l'influenza di farmaci chemioterapici specifici non porta sempre alla guarigione. La conclusione del processo tubercolare e la successiva cura dipendono non solo dalla riduzione della popolazione di micobatteri, ma anche dalla capacità dei processi riparativi dell'organismo di garantire la regressione del processo tubercolare e la sua cessazione. Infiammazione tubercolare
I cambiamenti patomorfologici negli organi e nei tessuti durante la tubercolosi sono diversi e dipendono dalla forma, dallo stadio, dalla localizzazione e dall'entità del processo patologico.
Comune alla maggior parte delle forme di tubercolosi sono cambiamenti specifici in combinazione con reazioni non specifiche o paraspecifiche. Cambiamenti specifici includono l'infiammazione tubercolare, il cui decorso è accompagnato dalla formazione di un tubercolo tubercolare, o granuloma, e da una lesione più grande. I cambiamenti non specifici sono varie reazioni che causano le cosiddette maschere della tubercolosi.
Morfologia dell'infiammazione tubercolare dipende dalla reattività dell'organismo e dalla virulenza dell'agente patogeno. In un focolaio tubercolare possono predominare i fenomeni di essudazione, necrosi o proliferazione e il focolaio, in base a ciò, può essere prevalentemente essudativo, nevrotico o produttivo. I processi immunologici svolgono un ruolo importante nello sviluppo dell'infiammazione della tubercolosi.
Nell'area dell'infiammazione si sviluppa prima una reazione che non presenta segni tipici della tubercolosi. In esso si esprimono in varia misura i fenomeni di alterazione e di essudazione. I disturbi del sistema microcircolatorio vengono prima. Influenzano la struttura fine della parete alveolare e i meccanismi del loro sviluppo possono essere rintracciati a livello ultrastrutturale [Erokhin V.V., 1987]. Nelle prime fasi dell'infiammazione, i cambiamenti nell'organizzazione submicroscopica degli elementi costitutivi della parete alveolare sono associati ad un aumento della permeabilità capillare, allo sviluppo di edema interstiziale intracellulare e intraalveolare con lisciviazione del tensioattivo alveolare da parte del fluido edematoso.
Successivamente aumentano i cambiamenti distrofici nel tessuto alveolare, ma insieme ad essi sorgono processi compensatori e riparativi, volti a sviluppare l'organizzazione intracellulare e ad aumentare l'attività funzionale delle rimanenti cellule del setto interalveolare. Nella fase successiva dell'infiammazione - proliferativa - compaiono elementi specifici della tubercolosi (cellule epitelioidi e giganti di Pirogov-Langhans) e al centro del focolaio della tubercolosi si formano aree di una sorta di necrosi caseosa omogenea (cagliata).
Sulla base dei dati della microscopia elettronica e dell'autoradiografia sulla dinamica della trasformazione cellulare, è stata stabilita una connessione genetica tra le cellule del granuloma lungo la linea cellulare gigante monocita [Serov V.V., Shekhter A.B., 1981; Erokhin V.V., 1978, 1987; Danneberg AM, 1982; SpectorW-G., 1982]. I macrofagi sintetizzano e accumulano attivamente enzimi lisosomiali e svolgono una funzione fagocitaria. Il materiale assorbito, che include Mycobacterium tuberculosis, viene localizzato e digerito nei fagosomi e nei fagolisosomi.
Le cellule epitelioidi sono formate da cellule mononucleate e macrofagi che si accumulano nel focolaio dell'infiammazione tubercolare nelle prime fasi della reazione infiammatoria. Hanno un grande nucleo di forma ovale, solitamente con 1-2 nucleoli. Il citoplasma di queste cellule contiene mitocondri, granuli, l'apparato di Golgi, un sistema ben sviluppato di tubuli e cisterne del reticolo citoplasmatico granulare e non granulare e singoli piccoli fagosomi. Il numero di mitocondri, elementi del reticolo e inclusioni lisosomiali varia ampiamente ed è determinato dallo stato funzionale della cellula.
Le cellule giganti di Pirogov-Langhans possono essere formate da cellule epitelioidi o macrofagi durante la loro proliferazione, nonché come risultato della fusione di cellule epitelioidi. Il citoplasma delle cellule giganti contiene un gran numero di nuclei, solitamente situati sotto forma di un anello o di un ferro di cavallo lungo la periferia delle cellule, molti mitocondri, lisosomi, elementi del reticolo citoplasmatico granulare e un complesso di Golgi ben sviluppato. Le cellule giganti sono capaci di fagocitosi, nel loro citoplasma si trovano varie inclusioni residue e sono caratterizzate da un'elevata attività degli enzimi idrolitici e respiratori.
Oltre alle cellule epitelioidi e giganti, il tessuto di granulazione tubercolare contiene solitamente un numero significativo di cellule linfoidi e plasmatiche, nonché leucociti neutrofili. I fibroblasti vengono rilevati nelle parti periferiche dello strato di granulazione. Intorno alla fonte dell'infiammazione si trova spesso una zona perifocale di reazione infiammatoria aspecifica. Con il progredire del processo, si osserva un aumento della necrosi caseosa, una maggiore infiltrazione del tessuto di granulazione con cellule mononucleate e cellule linfoidi, nonché neutrofili e un'espansione della zona di infiammazione perifocale. Un processo specifico si diffonde per contatto e per vie linfatiche.
Man mano che il focolaio tubercolare guarisce, le masse di necrosi caseosa diventano più dense e in quest'ultima si depositano piccoli granelli di sali di calcio. Nel tessuto di granulazione aumenta il numero di fibroblasti e fibrille di collagene, che si uniscono in fibre di collagene, che formano una capsula di tessuto connettivo attorno al focolaio tubercolare. Successivamente, il tessuto di granulazione specifico viene sempre più sostituito da tessuto fibroso. Il numero di elementi cellulari tra le fibre di collagene diminuisce e talvolta le fibre di collagene subiscono ialinosi.
In tali focolai e focolai post-tubercolari sono state trovate forme alterate di Mycobacterium tuberculosis, in particolare la forma L, che ci consente di comprendere meglio il ruolo dei vecchi focolai tubercolotici nella patogenesi delle forme secondarie di tubercolosi [Puzik V.I., Zemskova Z.S., Dorozhkova I.R., 1981, 1984]. La riattivazione della tubercolosi e la formazione di varie forme di tubercolosi polmonare secondaria si basano sulla reversione e sulla proliferazione della popolazione batterica sullo sfondo dello sviluppo di insufficienza della protezione specifica e non specifica del microrganismo.
Reazioni aspecifiche o paraspecifiche possono formarsi in vari organi e tessuti: sistema nervoso e cardiovascolare, organi emopoietici, articolazioni, membrane sierose, ecc. Nel sistema cardiovascolare e negli organi parenchimali queste reazioni si manifestano come infiltrazione istiocitaria e linfocitaria focale o diffusa, in i linfonodi - proliferazione delle cellule reticolari ed endoteliali, nei polmoni - la formazione di noduli linfoidi. AI Strukov (1959) ritiene che queste reazioni siano di natura tossico-allergica.
V. I. Puzik (1946) li considera il risultato dell'azione del Mycobacterium tuberculosis nei primi periodi dello sviluppo del processo infettivo. La connessione di queste reazioni con l'immunità cellulare e umorale è mostrata [Averbakh M. M., 1976].
Grazie alle misure preventive antitubercolari e al trattamento specifico, vi è un significativo patomorfosi della tubercolosi. La vera patomorfosi comprende una diminuzione del numero di polmoniti caseose (che indica un aumento dell'immunità), una formazione più frequente di tubercolomi. Cominciarono a manifestarsi forme meno comuni di tubercolosi miliare e meningite tubercolare (soprattutto nei bambini).
Manifestazioni di patomorfosi indotta dovute al trattamento specifico sono cavità isolate attorno alle quali si risolve rapidamente l'infiammazione perifocale, completo riassorbimento o sviluppo di piccole cicatrici a forma di stella nella tubercolosi ematogena disseminata, rigetto di masse caseoso-necrotiche con formazione di una cavità cistica a livello sede della cavità nella tubercolosi fibroso-cavernosa.
L'uso dei farmaci chemioterapici più efficaci porta ad una cura completa dalla tubercolosi. Più spesso si osserva un diverso decorso dell'infiammazione tubercolare: stabilizzazione e sviluppo inverso, acquisizione di natura cronica con periodi di cedimento ed esacerbazione di un processo specifico. Di decisiva importanza è il macroorganismo, lo stato dei suoi meccanismi di difesa, la capacità di resistere all'azione di uno stimolo antigenico, nonché lo sviluppo di processi riparativi a tutti gli effetti.
Le manifestazioni cliniche e morfologiche dell'infezione primaria da Mycobacterium tuberculosis sono solitamente chiamate tubercolosi primaria. Tubercolosi primaria si sviluppa solo nel 7-10% degli individui infetti, molto spesso bambini, mentre nel resto l'infezione si manifesta solo nei test della tubercolina [Khomenko A. G., 1989]. L'assenza di manifestazioni cliniche dell'infezione primaria è spiegata dall'elevato livello di resistenza non specifica e specifica alla tubercolosi, sviluppatasi a seguito della vaccinazione anti-TBC con BCG.
L’organismo affronta l’infezione da tubercolosi attraversando un periodo di reazioni “minori” non specifiche e specifiche. Di conseguenza, il corpo acquisisce l'immunità alla tubercolosi e la malattia non si sviluppa. Attualmente, meno spesso di prima, il decorso cronico dell'infezione primaria da tubercolosi si osserva sotto forma di varie reazioni paraspecifiche, o "maschere della tubercolosi".
La forma più comune di tubercolosi primaria è la broncoadenite, che spesso si manifesta senza caseinfezione dei linfonodi e formazione di focolai nei polmoni. Con una diminuzione della resistenza del corpo e un'infezione più massiccia, si sviluppa un'infiammazione specifica nei linfonodi con la formazione di focolai di necrosi formaggiosa. Le alterazioni si diffondono alla capsula e alle aree adiacenti del polmone, con la formazione di un infiltrato ilare, solitamente di natura aspecifica. Il processo può diffondersi alle pareti dei bronchi con la formazione di microfistole.
Durante la guarigione nei linfonodi si osserva il riassorbimento dell'infiammazione perifocale, l'ispessimento della caseosi, la deposizione di sali di calcio nella caseosi e un aumento dei cambiamenti fibrosi nella capsula e nella regione ilare circostante.
La tubercolosi primaria può manifestarsi con la formazione di un focolaio tubercolare primario nel polmone. Questo focolaio è di natura polmonare con caseosi al centro e un'ampia zona perifocale di infiammazione all'esterno. Dopo la formazione dell'affezione polmonare si nota un danno ai linfonodi regionali con un “percorso” di vasi linfatici alterati tra di loro. Ciò corrisponde all'immagine del complesso primario con i suoi tre componenti costitutivi.
Durante la guarigione, l'infiammazione perifocale si risolve, la caseosi nella lesione si ispessisce, i sali di calcio si depositano e attorno alla lesione si forma una capsula di tessuto connettivo. Può verificarsi la sostituzione completa della lesione caseosa con fibrosi. Nei linfonodi predominano i processi di incapsulamento e calcificazione delle masse caseose.
In caso di progressione del complesso primario, il focolaio polmonare aumenta di dimensioni, va incontro a caseinfezione con formazione di cavità pneumoniogeniche acute. Intorno alla cavità si forma quindi una capsula di tessuto connettivo e il processo progredisce fino alla tubercolosi fibrocavernosa.
Il decorso progressivo della tubercolosi primaria può manifestarsi sotto forma di tubercolosi miliare a seguito della “svolta” dell'infezione nel flusso sanguigno. È importante ricordare la possibilità di diffusione acuta dell'infezione; È necessario diagnosticare tali casi in modo tempestivo, poiché il trattamento precoce ha un buon effetto.
Di conseguenza, il periodo dell'infezione primaria, insieme alla diffusione dell'infezione attraverso il tratto linfatico, è caratterizzato anche da screening ematogeni, che caratterizzano la bacillemia con la comparsa di focolai di infiammazione specifica in vari organi e tessuti. Lesioni di screening nei polmoni che si formano durante vari periodi di tubercolosi primaria sono spesso un reperto accidentale durante un esame anatomico a raggi X di persone che non soffrono di forme attive di tubercolosi.
Tali lesioni consistono in caseosi circondate da una capsula fibrosa povera di elementi cellulari. Le lesioni, di regola, sono multiple, localizzate nei segmenti superiori dei polmoni sotto la pleura. Con un'esacerbazione del processo in questi focolai inizia la tubercolosi secondaria, caratterizzata da danno locale all'organo. Pertanto, i focolai post-primari sono di grande importanza nella patogenesi della tubercolosi secondaria.
È stato accumulato materiale sperimentale che dimostra la capacità di NF di riprendere la crescita in condizioni favorevoli. Le condizioni di reversione prevedono l'utilizzo di diversi induttori di reversione (fisici, chimici, biotici), ma possono comportare anche solo l'abolizione degli effetti avversi, come ad esempio dimostrato per i microrganismi esposti ai raggi gamma.
Tra i fattori fisici, la causa più comune di reversione è un aumento della temperatura da 0,5-6°C a 20-22°C o fino a 37°C, o un riscaldamento a breve termine fino a 45°C. Il rapido aumento delle CFU nei microcosmi è visto come una conferma della reversione piuttosto che della ricrescita delle poche cellule sopravvissute.
In alcuni casi, l’ottimizzazione della temperatura non riesce a stimolare la reversione. V. parahaemolyticus regredisce quando la temperatura sale a 25°C in combinazione con l'uso di un ambiente con sale minimo. Gli NF di V. harveyi e V. fischeri riprendono la crescita quando integrati con fonti organiche o inorganiche di decompositori di azoto, carbonio o perossido di idrogeno.
Tra gli induttori chimici della reversione NF, è noto un gruppo di composti che distruggono il perossido di idrogeno (antiossidanti). Tali composti includono piruvato di sodio, catalasi, vitamina E. Vengono introdotti direttamente nei microcosmi come protettori o nei mezzi nutritivi destinati alla reversione. Ciò ha permesso di ottenere la reversione di E. coli, V. parahaemolyticus. L'efficacia della reversione è influenzata dalla composizione chimica del mezzo e dal suo stato di aggregazione (preferibilmente mezzi nutritivi liquidi).
Per invertire la NF, fattori biotici di crescita vengono aggiunti ai mezzi nutritivi: siero fetale, surnatante della coltura in crescita o proteina Rpf ricombinante isolata da essa. È stata segnalata l'influenza delle citochine sull'inversione della NF. I ceppi virulenti di Salmonella non coltivati sono stati invertiti in vitro e in vivo in presenza del fattore di necrosi tumorale (TNF).
A volte l'unico modo efficace per regredire è il passaggio attraverso un organismo suscettibile. Ad esempio, la ricoltivazione di ceppi patogeni NF di Salmonella introdotti nel corpo di animali sensibili ha sempre portato a un risultato positivo. La bonifica parallela delle stesse sospensioni in vitro non ha dato risultati positivi.
La verità sulla reversione, e non sulla ripresa della crescita delle cellule sopravvissute, rimane la questione più controversa. La crescita da un piccolo inoculo viene utilizzata come prova della reversione. La crescita di una coltura da una piccola quantità di cellule vegetative avviene molto più lentamente rispetto alle varianti con NF.
Le strutture cellulari non sono state studiate con precisione, poiché le cellule stesse non sono state coltivate, ma sono conosciute esclusivamente da frammenti di DNA. A quanto pare, sarà ancora necessario separare gli “incolti” in culture pure. Tuttavia, ciò richiede metodi di analisi genetica economici, veloci e accessibili a qualsiasi laboratorio. Quindi, ad esempio, dopo aver scoperto il DNA "incoltivabile" in un campione, puoi iniziare a selezionare terreni e condizioni, controllando ogni volta con metodi genetici: la colonia cresciuta è il "microrganismo incoltivabile" desiderato o no? In caso contrario, variare nuovamente l'ambiente e le condizioni finché, alla fine, quello “incoltivabile” diventa coltivato. Un altro modo possibile per “guardarli in faccia” è provare a mettere una sorta di etichetta fluorescente o radioattiva sul DNA isolato “non coltivato”, rilasciarlo nella natura e vedere con chi si ibrida secondo il principio di complementarità. Per quanto riguarda l'organizzazione del DNA, generalmente non tutto il DNA viene utilizzato per la diagnosi, ma solo la regione che codifica l'RNA ribosomiale 16S, e qui non ci sono differenze fondamentali tra batteri, archaea e quelli “non coltivati”. L'RNA 16S è stato scelto per una serie di ragioni completamente biologiche. Ma questo approccio è anche “fuori dalla povertà”: analizzare l’intero DNA è molto costoso e richiede molta manodopera; il sequenziamento completo del genoma è stato eseguito per pochissimi procarioti (ricordate quanti sforzi e quanti laboratori in tutto il mondo sono stati coinvolti nel genoma umano, ma i batteri hanno solo 10 volte meno geni dei nostri).
Uno studio sulla reversione dei protoplasti di batteri e funghi ha rivelato somiglianze nel corso di questo processo. Convenzionalmente, può essere suddiviso in tre fasi: 1) rigenerazione della parete cellulare, 2) reversione, comparsa di cellule revertanti, 3) ripristino della normale citocinesi e comparsa di cellule nella forma originale.
Allo stesso tempo, ogni gruppo di microrganismi ha le proprie caratteristiche di reversione del protoplasto, associate alla struttura delle cellule e delle pareti cellulari, alla natura del metabolismo e alla citocinesi.
Reversione dei protoplasti batterici. Se, durante il trattamento con lisozima o penicillina in un ambiente isotonico, la parete cellulare della cellula batterica non viene completamente rimossa, quando questi agenti vengono esclusi dall'ambiente, si verifica un rapido recupero cellulare. Se la parete cellulare viene completamente rimossa, il vero protoplasto risultante non è in grado di rigenerarlo in condizioni normali. Una delle condizioni che consente a tali forme di ritornare al loro stato originale è la presenza di una base solida o semisolida nel mezzo di coltura. Può essere gelatina (5-30%), agar (0,7-2%), filtri a membrana, cellule batteriche uccise o pareti cellulari. Inoltre è preferibile l'uso di un substrato solido.
Reversione dei protoplasti dei funghi filamentosi. Il ritorno alle forme miceliali nei protoplasti fungini avviene sia in liquido che sulla superficie di un mezzo solido o in uno strato di agar semiliquido. Molti ricercatori hanno dimostrato che la reversione dei protoplasti fungini può avvenire in tre modi, diversi nella natura della formazione del micelio primario. Con il primo metodo i protoplasti inizialmente formano una catena di cellule simili al lievito (fino a 20 cellule). Successivamente quella terminale, già osmoticamente stabile, produce un'ifa primaria che forma il micelio. Secondo modo la reversione inizia con la rigenerazione della parete cellulare da parte dei protoplasti, a seguito della quale diventano resistenti allo shock osmotico. Il protoplasto forma quindi un tubo germinale. Terza via la reversione dei protoplasti fungini è insolita. Il protoplasto, mantenendo la sua forma sferica, forma un nuovo guscio a forma di ripiano, quindi il contenuto del protoplasto madre viene trasferito lì. Se appare una catena di tali membrane, il citoplasma si muove lungo questa catena, lasciando dietro di sé "ombre" delle pareti cellulari. L'ultima cellula della catena forma l'ifa primaria. I protoplasti fungini possono regredire in tre modi, oppure una specie mostra tutte e tre le modalità di reversione. È difficile dire cosa influenza la scelta del metodo di reversione, forse le caratteristiche della specie dell'organismo, il tipo di citocinesi, il metodo di ottenimento e le condizioni di incubazione dei protoplasti o la composizione del mezzo di rigenerazione.
I protoplasti in crescita e inversione sono un buon modello per studiare la biosintesi della parete cellulare e la relazione tra crescita cellulare e divisione nucleare.
4.2. Coltivazione di cellule vegetali
L'idea della possibilità di coltivare cellule al di fuori del corpo fu espressa alla fine del XIX secolo. Periodo dal 1892 al 1902 può essere considerata la preistoria dello sviluppo del metodo di coltura delle cellule e dei tessuti vegetali. A quel tempo, gli scienziati tedeschi H. Fechting, K. Rechinger, G. Haberlandt tentarono di far crescere pezzi di tessuto, gruppi di cellule e peli isolati dalle piante. Senza raggiungere il successo sperimentale, questi primi ricercatori espressero però una serie di idee che furono successivamente implementate.
Nel corso dei successivi 20 anni furono ottenuti i primi risultati sulla coltivazione di tessuti animali su terreni nutritivi con l'aggiunta di siero. Ma nel mondo vegetale non è stato ottenuto alcun successo significativo, nonostante i tentativi di creare mezzi nutritivi ottimali in grado di garantire l’esistenza e la riproduzione a lungo termine delle cellule vegetali in vitro.
Nel 1922, W. Robbins e Cotte dimostrarono indipendentemente la possibilità di coltivare cellule meristematiche dell'apice della radice di pomodoro e mais su terreni nutritivi sintetici. Questi esperimenti segnarono l'inizio dell'uso del metodo di coltivazione di cellule e organi vegetali isolati.
Negli anni '30 e '60, grazie al lavoro di un gran numero di scienziati (F. White, R. Gautre e altri), il numero di specie vegetali le cui cellule e tessuti sono stati coltivati in vitro ha raggiunto un numero significativo (più di 150) . Sono state descritte le composizioni dei terreni nutritivi, sono state determinate le esigenze delle colture in termini di vitamine e stimolanti della crescita, sono stati sviluppati metodi per ottenere e coltivare grandi masse di sospensioni cellulari, nonché coltivare una singola cellula isolata da una sospensione. F. Steward, lavorando con una coltura di floema di carota isolato, ne ottenne piante intere nel 1958. Un contributo significativo allo sviluppo della coltura di cellule e tessuti vegetali è stato dato dalla ricerca di R. G. Butenko e dei suoi colleghi, che hanno utilizzato questi metodi per studiare la fisiologia delle cellule vegetali e la morfogenesi delle piante.
Negli anni successivi furono proposti metodi per ottenere protoplasti isolati da tessuti vegetali e furono trovate condizioni di coltivazione in cui essi erano in grado di formare una nuova parete cellulare, dividersi e dare origine a linee cellulari. Utilizzando protoplasti isolati, sono stati sviluppati metodi per l'ibridazione delle cellule somatiche fondendo i protoplasti con PEG (polietilenglicole) e introducendo in essi RNA virale, organelli cellulari e cellule batteriche. Usando il metodo della coltura del meristema, sono state ottenute piante esenti da virus, economicamente importanti con alti tassi di riproduzione.
Attualmente continua attivamente lo sviluppo di metodi per la coltivazione di cellule profonde, metodi per l'elettrofusione di protoplasti isolati, ecc.
L'uso di metodi per ottenere varianti somaclonali, aploidi sperimentali e screening di mutanti biochimici ha portato all'emergere di ceppi cellulari più produttivi adattati alle condizioni di coltivazione, utilizzati per creare nuove forme e varietà di piante agricole, medicinali, ornamentali e di altro tipo.

 Persistenza Dal lat. persisto - rimanere costantemente, rimanere, esistenza a lungo termine, presenza di un'infezione per lungo tempo nel corpo degli animali e dell'uomo, senza manifestazioni cliniche patologiche (corso latente, remissione del processo infettivo), o capace in determinate condizioni ( squilibrio immunitario e deficienza immunitaria di varie eziologie - stress, ipotermia, infezione intercorrente, esacerbazione di una malattia cronica, ecc.) all'attivazione con esito della malattia (decorso attivo, esacerbazione del processo infettivo).
Persistenza Dal lat. persisto - rimanere costantemente, rimanere, esistenza a lungo termine, presenza di un'infezione per lungo tempo nel corpo degli animali e dell'uomo, senza manifestazioni cliniche patologiche (corso latente, remissione del processo infettivo), o capace in determinate condizioni ( squilibrio immunitario e deficienza immunitaria di varie eziologie - stress, ipotermia, infezione intercorrente, esacerbazione di una malattia cronica, ecc.) all'attivazione con esito della malattia (decorso attivo, esacerbazione del processo infettivo).
 Meccanismi di persistenza: - Formazione di forme L Mimetismo antigenico Copertura immunoglobulinica Capacità di secernere sostanze che interferiscono con l'azione dei fattori immunitari Assorbimento delle proteine ospiti sulla superficie cellulare e protezione dal sistema immunitario ospite Fattori antifagocitici: Capsule Microcapsule Coperture mucose Sostanze che ridurre la chemiotassi, fagocitosi incompleta, ecc.
Meccanismi di persistenza: - Formazione di forme L Mimetismo antigenico Copertura immunoglobulinica Capacità di secernere sostanze che interferiscono con l'azione dei fattori immunitari Assorbimento delle proteine ospiti sulla superficie cellulare e protezione dal sistema immunitario ospite Fattori antifagocitici: Capsule Microcapsule Coperture mucose Sostanze che ridurre la chemiotassi, fagocitosi incompleta, ecc.
 Azione dei batteri sulle citochine: Azione Distrugge le citochine Batteri H. aeruginosa con l'aiuto degli enzimi L. pneumophila Lega le citochine E. coli Inibisce la sintesi delle citochine Citochine IL-2, TNF-a, IF-γ IL-2 IL-1, IL-2, TNF-a, GMCSF S. typhimurium, S. flexneri TNF M. tuberculosis TRF (3 M. avium IL-6 L. monocytogenes IL-3, CSF-1 E. coli IL-2, IL-4, IL-5, IF-γ Y. enterocolitica, B. suis, V. TNFa cholerae, B. anthracis P. aeruginosa TNFa, IL-1, IF-γ S. typhimurium IL-2
Azione dei batteri sulle citochine: Azione Distrugge le citochine Batteri H. aeruginosa con l'aiuto degli enzimi L. pneumophila Lega le citochine E. coli Inibisce la sintesi delle citochine Citochine IL-2, TNF-a, IF-γ IL-2 IL-1, IL-2, TNF-a, GMCSF S. typhimurium, S. flexneri TNF M. tuberculosis TRF (3 M. avium IL-6 L. monocytogenes IL-3, CSF-1 E. coli IL-2, IL-4, IL-5, IF-γ Y. enterocolitica, B. suis, V. TNFa cholerae, B. anthracis P. aeruginosa TNFa, IL-1, IF-γ S. typhimurium IL-2

 Attività antilisozima e antilattoferrina: Microrganismi n Attività antilattoferrina, Attività antilisozima ng/ml, μg/ml M ± DS S. aureus S. haemolyticus S. epidermidis E. coli Klebsiella spp. 15 22,72 ± 1,88 10,1 ± 2,17* 16 20,08 ± 1,41 4,40 ± 1,12 15 11,50 ± 1,45* 9,91 ± 0,82* 16 22,0,67* 2,58 ± 0,27* 12 18,17 ± 3,20 1,64 ± 0,15 12 19,40 ± 2,47 3,24 ± 0,27* 14 18,13 ± 0,64 1,83 ± 0,28 Pazienti con malattie reumatiche Controllo *Statisticamente significativo
Attività antilisozima e antilattoferrina: Microrganismi n Attività antilattoferrina, Attività antilisozima ng/ml, μg/ml M ± DS S. aureus S. haemolyticus S. epidermidis E. coli Klebsiella spp. 15 22,72 ± 1,88 10,1 ± 2,17* 16 20,08 ± 1,41 4,40 ± 1,12 15 11,50 ± 1,45* 9,91 ± 0,82* 16 22,0,67* 2,58 ± 0,27* 12 18,17 ± 3,20 1,64 ± 0,15 12 19,40 ± 2,47 3,24 ± 0,27* 14 18,13 ± 0,64 1,83 ± 0,28 Pazienti con malattie reumatiche Controllo *Statisticamente significativo
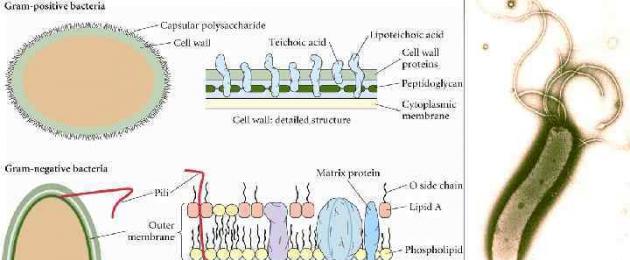
 La formazione della forma L è costituita da batteri che sono parzialmente o completamente privi di parete cellulare, ma mantengono la capacità di svilupparsi. La comparsa delle forme L è causata dall'esposizione ad agenti che bloccano la produzione della parete cellulare: 1. antibiotici (penicilline cicloserina, cefalosporine, vancomicina), 2. enzimi (lisozima, amidasi, endopeptidasi), 3. raggi ultravioletti e x- raggi, 4. aminoacido glicina.
La formazione della forma L è costituita da batteri che sono parzialmente o completamente privi di parete cellulare, ma mantengono la capacità di svilupparsi. La comparsa delle forme L è causata dall'esposizione ad agenti che bloccano la produzione della parete cellulare: 1. antibiotici (penicilline cicloserina, cefalosporine, vancomicina), 2. enzimi (lisozima, amidasi, endopeptidasi), 3. raggi ultravioletti e x- raggi, 4. aminoacido glicina.
 Background: La lettera L è la prima lettera del nome del Lister Institute di Londra, dove per la prima volta la dottoressa in scienze Emmy Kleineberger-Nobel nel 1935 attirò l'attenzione sullo sviluppo di cellule morfologicamente molto insolite in una coltura di batteri Streptobacillus moniliformis, isolato dal fluido dell'orecchio di un ratto.
Background: La lettera L è la prima lettera del nome del Lister Institute di Londra, dove per la prima volta la dottoressa in scienze Emmy Kleineberger-Nobel nel 1935 attirò l'attenzione sullo sviluppo di cellule morfologicamente molto insolite in una coltura di batteri Streptobacillus moniliformis, isolato dal fluido dell'orecchio di un ratto.
 vacuoli a forma di L di Bacillus subtilis, scala - 500 nm. Diversità delle forme L di Bacillus subtilis, su una scala di 10 µm.
vacuoli a forma di L di Bacillus subtilis, scala - 500 nm. Diversità delle forme L di Bacillus subtilis, su una scala di 10 µm.
 Forme a L Caratteristiche delle forme a L: 1. La sintesi di una parete cellulare completa è impossibile.Il ritorno alla forma vegetativa quando i fattori ambientali sono normalizzati.Il ritorno alla forma vegetativa è impossibile. Ulteriore esistenza come nei micoplasmi Proprietà culturali simili. 3. Trasformazione graduale da strutture gram-positive a strutture gram-negative. Formazione di forme L stabili e instabili. 5. Cambiamento nelle proprietà antigeniche (perdita di antigeni K e O). Acquisire la capacità di persistere. 6. Riduzione della virulenza dovuta alla perdita di vari fattori di patogenicità (adesione, invasione, endotossina, ecc.) stabile Sistema di controllo genetico della sintesi della parete cellulare (peptidoglicano) 2. 4. instabile Somiglianza dei cambiamenti morfologici: formazione di filamenti, fibrosi , forme a salsiccia, sferiche e granulari.
Forme a L Caratteristiche delle forme a L: 1. La sintesi di una parete cellulare completa è impossibile.Il ritorno alla forma vegetativa quando i fattori ambientali sono normalizzati.Il ritorno alla forma vegetativa è impossibile. Ulteriore esistenza come nei micoplasmi Proprietà culturali simili. 3. Trasformazione graduale da strutture gram-positive a strutture gram-negative. Formazione di forme L stabili e instabili. 5. Cambiamento nelle proprietà antigeniche (perdita di antigeni K e O). Acquisire la capacità di persistere. 6. Riduzione della virulenza dovuta alla perdita di vari fattori di patogenicità (adesione, invasione, endotossina, ecc.) stabile Sistema di controllo genetico della sintesi della parete cellulare (peptidoglicano) 2. 4. instabile Somiglianza dei cambiamenti morfologici: formazione di filamenti, fibrosi , forme a salsiccia, sferiche e granulari.


 Meccanismo della fagocitosi: Chemotassi Forze dell'interazione fisico-chimica Gradiente di concentrazione 2. Stadio di adesione Osonizzazione (AT, C 3 b, fibronectina, surfattano) Interazione fisico-chimica 3. Endocitosi 4. Microbicidalità Ossigeno-indipendente Ossigeno-dipendente
Meccanismo della fagocitosi: Chemotassi Forze dell'interazione fisico-chimica Gradiente di concentrazione 2. Stadio di adesione Osonizzazione (AT, C 3 b, fibronectina, surfattano) Interazione fisico-chimica 3. Endocitosi 4. Microbicidalità Ossigeno-indipendente Ossigeno-dipendente

 macroorganismo 1. Fusione compromessa del fagosoma con il lisosoma (mycobacterium tuberculosis, protozoi, toxoplasma) 2. Resistenza agli enzimi lisosomiali (gonococchi, streptococchi gr A, micobatteri, ersinia) 3. Persistenza a lungo termine nel citoplasma (chlamydia, rickettsia) microrganismo
macroorganismo 1. Fusione compromessa del fagosoma con il lisosoma (mycobacterium tuberculosis, protozoi, toxoplasma) 2. Resistenza agli enzimi lisosomiali (gonococchi, streptococchi gr A, micobatteri, ersinia) 3. Persistenza a lungo termine nel citoplasma (chlamydia, rickettsia) microrganismo

 Meccanismo di persistenza della clamidia Inclusioni tipiche contenenti corpi elementari e reticolari 48 ore dopo l'incubazione Modello patomorfologico di persistenza. Dopo aver subito uno shock termico, le inclusioni più piccole contengono grandi forme patologiche di clamidia
Meccanismo di persistenza della clamidia Inclusioni tipiche contenenti corpi elementari e reticolari 48 ore dopo l'incubazione Modello patomorfologico di persistenza. Dopo aver subito uno shock termico, le inclusioni più piccole contengono grandi forme patologiche di clamidia
 Il macrofago non presenta l'antigene principale (MOMP) Espressione dei primi prodotti genetici lisosoma Sovraccarico antigenico Iperproduzione di Ig A, G HRT Mimetismo antigenico Vescicole esocitotiche contenenti sfingomielina, CG hps 60 - proteine da shock termico Lipopolisaccaride. Stato non espresso tra corpi reticolari ed elementari MOMP- non espresso
Il macrofago non presenta l'antigene principale (MOMP) Espressione dei primi prodotti genetici lisosoma Sovraccarico antigenico Iperproduzione di Ig A, G HRT Mimetismo antigenico Vescicole esocitotiche contenenti sfingomielina, CG hps 60 - proteine da shock termico Lipopolisaccaride. Stato non espresso tra corpi reticolari ed elementari MOMP- non espresso

 + Attività antifagocitica: 1. Parete cellulare densa di corpi elementari (legami disolfuro tra strutture proteiche MOMP) 2. Forza dei corpi reticolari (capsula polisaccaridica) “fallimento” dell'esplosione respiratoria Attivazione di SPOL e danno alle membrane delle proprie cellule
+ Attività antifagocitica: 1. Parete cellulare densa di corpi elementari (legami disolfuro tra strutture proteiche MOMP) 2. Forza dei corpi reticolari (capsula polisaccaridica) “fallimento” dell'esplosione respiratoria Attivazione di SPOL e danno alle membrane delle proprie cellule
 TNFα γIF IL-1 1. Aumento dell'espressione di Ag Membrane cellulari (GC, Fc) Attivazione di fibroblasti e cellule epiteliali (fagociti non professionali) 2. Stimolazione di IL 1 e IL 2 3. Attivazione dell'atto fagocitario 4. Stimolazione di Ig produzione 5. Induzione di radicali liberi
TNFα γIF IL-1 1. Aumento dell'espressione di Ag Membrane cellulari (GC, Fc) Attivazione di fibroblasti e cellule epiteliali (fagociti non professionali) 2. Stimolazione di IL 1 e IL 2 3. Attivazione dell'atto fagocitario 4. Stimolazione di Ig produzione 5. Induzione di radicali liberi
 Mediatori della persistenza Chlamydia trachomatis Effetto mediatore Basse concentrazioni di interferone g Forte diminuzione della quantità di triptofano endogeno (attivazione dell'enzima indolammina-2,3-diossigenasi, che scompone il triptofano in N-formilchinurenina) TNF-a Carenza di triptofano endogeno Indiretto, mediante attivazione di b-IF (blocca la riproduzione dei microrganismi intracellulari, migliorando l'espressione delle proteine della membrana cellulare) Necessario per la costruzione del deficit di MOMP c. HMF ed elevata quantità di c. AMP Mancanza di attivazione degli enzimi necessari per la differenziazione di RT in ET Deficit e/o azione degli antagonisti del Ca 2+ Compromissione dell'aggregazione dei vacuoli endosomiali
Mediatori della persistenza Chlamydia trachomatis Effetto mediatore Basse concentrazioni di interferone g Forte diminuzione della quantità di triptofano endogeno (attivazione dell'enzima indolammina-2,3-diossigenasi, che scompone il triptofano in N-formilchinurenina) TNF-a Carenza di triptofano endogeno Indiretto, mediante attivazione di b-IF (blocca la riproduzione dei microrganismi intracellulari, migliorando l'espressione delle proteine della membrana cellulare) Necessario per la costruzione del deficit di MOMP c. HMF ed elevata quantità di c. AMP Mancanza di attivazione degli enzimi necessari per la differenziazione di RT in ET Deficit e/o azione degli antagonisti del Ca 2+ Compromissione dell'aggregazione dei vacuoli endosomiali
 Mediatori della persistenza di Chlamydia trachomatis (continua) L-isoleucina L'effetto può essere dovuto all'inclusione di un prodotto metabolico dell'a-metilbutarile. COSÌ. E nella sintesi degli acidi grassi da parte di C. trachomatis con successiva incorporazione di trigliceridi “estranei” nella membrana cellulare, portando alla sua destabilizzazione.Carenza di cisteina.Un amminoacido essenziale che controlla la differenziazione di RT in ET (incluso in i 3 più importanti per la differenziazione proteica), una diminuzione del numero di ponti disolfuro delle pareti cellulari.
Mediatori della persistenza di Chlamydia trachomatis (continua) L-isoleucina L'effetto può essere dovuto all'inclusione di un prodotto metabolico dell'a-metilbutarile. COSÌ. E nella sintesi degli acidi grassi da parte di C. trachomatis con successiva incorporazione di trigliceridi “estranei” nella membrana cellulare, portando alla sua destabilizzazione.Carenza di cisteina.Un amminoacido essenziale che controlla la differenziazione di RT in ET (incluso in i 3 più importanti per la differenziazione proteica), una diminuzione del numero di ponti disolfuro delle pareti cellulari.
 “Driva genetica”, o mimetismo antigenico: sequenza aminoacidica 264 -286 del principale fattore sigma della RNA polimerasi della clamidia (Chl. trachomatis). L 7 (peptide II), una delle proteine ribosomiali AT Malattie reumatiche autoimmuni
“Driva genetica”, o mimetismo antigenico: sequenza aminoacidica 264 -286 del principale fattore sigma della RNA polimerasi della clamidia (Chl. trachomatis). L 7 (peptide II), una delle proteine ribosomiali AT Malattie reumatiche autoimmuni
 Persistenza della via insensibile alla citocolasina di Francisella tularensis Caspasi 3 e 9 TNF, IL 1 23 -k. Da endosomi
Persistenza della via insensibile alla citocolasina di Francisella tularensis Caspasi 3 e 9 TNF, IL 1 23 -k. Da endosomi
 + Antiisozima Antilattoferrina Attività anticomplementare dell'LPS francisella tularentis S-LPS R-LPS Virulenza residua virulenta Bassa sensibilità dell'ospite Proteina legante LPS – LBP LPS inerte Eliminazione rapida Alta sensibilità dell'ospite Morte dell'organismo persistenza
+ Antiisozima Antilattoferrina Attività anticomplementare dell'LPS francisella tularentis S-LPS R-LPS Virulenza residua virulenta Bassa sensibilità dell'ospite Proteina legante LPS – LBP LPS inerte Eliminazione rapida Alta sensibilità dell'ospite Morte dell'organismo persistenza

 Persistenza e mutagenesi adattativa nei biofilm: La resistenza dei biofilm alle influenze esterne è caratterizzata dal termine “persistenza” (dall'inglese persistenza - resistenza, vitalità). Cellule morte
Persistenza e mutagenesi adattativa nei biofilm: La resistenza dei biofilm alle influenze esterne è caratterizzata dal termine “persistenza” (dall'inglese persistenza - resistenza, vitalità). Cellule morte
 L'importanza della persistenza nei biofilm Secondo il Center for Disease Control (CDC USA), circa il 65% di tutte le infezioni sono causate dalla formazione di biofilm nel macroorganismo.La formazione di biofilm su tutti i dispositivi medici introdotti nel macroorganismo (cateteri, protesi, stent, ecc.); Formazione di biofilm sugli strumenti medici...
L'importanza della persistenza nei biofilm Secondo il Center for Disease Control (CDC USA), circa il 65% di tutte le infezioni sono causate dalla formazione di biofilm nel macroorganismo.La formazione di biofilm su tutti i dispositivi medici introdotti nel macroorganismo (cateteri, protesi, stent, ecc.); Formazione di biofilm sugli strumenti medici...

 batteri+dna. J (sintesi chaperone) y. E. coli pmr. C (sintesi dei fosfolipidi) y. S. typhimurium Condizioni sfavorevoli Espressione dei geni SOS gene rmf, inibitore della traduzione Geni shock da caldo e da freddo rec. A, ehm. DC, uvr. AB, sul. A Celle persistenti htr. A, htp. X, csp. H,clp. B, cbp. AB Geni del sistema tossinantitossina din. J/yaf. D, sì. M, rel. ESSERE, maz. EF
batteri+dna. J (sintesi chaperone) y. E. coli pmr. C (sintesi dei fosfolipidi) y. S. typhimurium Condizioni sfavorevoli Espressione dei geni SOS gene rmf, inibitore della traduzione Geni shock da caldo e da freddo rec. A, ehm. DC, uvr. AB, sul. A Celle persistenti htr. A, htp. X, csp. H,clp. B, cbp. AB Geni del sistema tossinantitossina din. J/yaf. D, sì. M, rel. ESSERE, maz. EF
 Gene A Gene T Gene P Ribosoma antitossina antibiotica Proteina difettosa Proteina normale Complesso T-A Nessuna persistenza della sintesi proteica
Gene A Gene T Gene P Ribosoma antitossina antibiotica Proteina difettosa Proteina normale Complesso T-A Nessuna persistenza della sintesi proteica
 Le principali tossine e il loro luogo di applicazione in E. Coli: attività bersaglio della tossina Processo Ccd B DNA girasi Rotture del doppio filamento Replicazione Rel E Traduzione dei ribosomi Scissione dell'm RNA Traduzione Maz F RNA Endoribonucleasi Traduzione Par E DNA girasi Rotture del doppio filamento Replica Doc Traduzione dei ribosomi Scissione dell'm RNA Traduzione Vap C RNA Endoribonucleasi Sconosciuto Ξ-tossina Sconosciuto Fosfotransferasi Sconosciuto Anca A EF-TU Proteina chinasi Traduzione Anca B Traduzione ribosomi M. Scissione dell'RNA Traduzione
Le principali tossine e il loro luogo di applicazione in E. Coli: attività bersaglio della tossina Processo Ccd B DNA girasi Rotture del doppio filamento Replicazione Rel E Traduzione dei ribosomi Scissione dell'm RNA Traduzione Maz F RNA Endoribonucleasi Traduzione Par E DNA girasi Rotture del doppio filamento Replica Doc Traduzione dei ribosomi Scissione dell'm RNA Traduzione Vap C RNA Endoribonucleasi Sconosciuto Ξ-tossina Sconosciuto Fosfotransferasi Sconosciuto Anca A EF-TU Proteina chinasi Traduzione Anca B Traduzione ribosomi M. Scissione dell'RNA Traduzione
 Fattore Sigma della RNA polimerasi Rpo. S Mutagenesi adattativa: ? Gli “adattativi” sono mutazioni che si verificano in una popolazione di microrganismi a riproduzione lenta o dormiente durante un periodo di stress prolungato e che contrastano le cause di questo stress. Veillonella parvula Streptococcus mutans Resistenza agli antibiotici
Fattore Sigma della RNA polimerasi Rpo. S Mutagenesi adattativa: ? Gli “adattativi” sono mutazioni che si verificano in una popolazione di microrganismi a riproduzione lenta o dormiente durante un periodo di stress prolungato e che contrastano le cause di questo stress. Veillonella parvula Streptococcus mutans Resistenza agli antibiotici
 Lewis K. 2008 ritiene che il modo principale per combattere la persistenza nei biofilm siano i “pazienti distratti”...
Lewis K. 2008 ritiene che il modo principale per combattere la persistenza nei biofilm siano i “pazienti distratti”...

- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0