Persistenza Dal lat. persisto - permanenza permanente, permanenza, lunga esistenza, presenza di una lunga permanenza di un'infezione nel corpo degli animali e dell'uomo, senza manifestazioni clinico-patologiche (corso latente, remissione del processo infettivo), o capace in determinate condizioni (sistema immunitario squilibrio e immunodeficienza di varie eziologie - stress, ipotermia , infezione intercorrente, esacerbazione di una malattia cronica, ecc.) all'attivazione con esito della malattia (decorso attivo, esacerbazione del processo infettivo).
Persistenza Dal lat. persisto - permanenza permanente, permanenza, lunga esistenza, presenza di una lunga permanenza di un'infezione nel corpo degli animali e dell'uomo, senza manifestazioni clinico-patologiche (corso latente, remissione del processo infettivo), o capace in determinate condizioni (sistema immunitario squilibrio e immunodeficienza di varie eziologie - stress, ipotermia , infezione intercorrente, esacerbazione di una malattia cronica, ecc.) all'attivazione con esito della malattia (decorso attivo, esacerbazione del processo infettivo).
 Meccanismi di persistenza: - Formazione di forme L Mimetismo antigenico Rivestimento immunoglobulinico Capacità di secernere sostanze che interferiscono con l'azione dei fattori immunitari Assorbimento delle proteine ospiti sulla superficie cellulare e protezione dal sistema immunitario ospite Fattori antifagocitici: Capsule Microcapsule Mucose Sostanze che riducono chemiotassi Fagocitosi incompleta, ecc.
Meccanismi di persistenza: - Formazione di forme L Mimetismo antigenico Rivestimento immunoglobulinico Capacità di secernere sostanze che interferiscono con l'azione dei fattori immunitari Assorbimento delle proteine ospiti sulla superficie cellulare e protezione dal sistema immunitario ospite Fattori antifagocitici: Capsule Microcapsule Mucose Sostanze che riducono chemiotassi Fagocitosi incompleta, ecc.
 Azione dei batteri sulle citochine: Azione Distrugge le citochine I batteri H. aeruginosa con l'aiuto degli enzimi L. pneumophila Legano le citochine di E. coli Inibiscono la sintesi delle citochine Citochine IL-2, TNFa, IF-y IL-2 IL-1, IL- 2, TNFa, GMCSF S. typhimurium, S. flexneri TNFa M. tuberculosis TRF(3 M. avium IL-6 L. monocytogenes IL-3, CSF-1 E. coli IL-2, IL-4, IL-5, IF-y Y. enterocolitica, B. suis, V. TNFa cholerae, B. anthracis P. aeruginosa TNFa, IL-1, IF-y S. typhimurium IL-2
Azione dei batteri sulle citochine: Azione Distrugge le citochine I batteri H. aeruginosa con l'aiuto degli enzimi L. pneumophila Legano le citochine di E. coli Inibiscono la sintesi delle citochine Citochine IL-2, TNFa, IF-y IL-2 IL-1, IL- 2, TNFa, GMCSF S. typhimurium, S. flexneri TNFa M. tuberculosis TRF(3 M. avium IL-6 L. monocytogenes IL-3, CSF-1 E. coli IL-2, IL-4, IL-5, IF-y Y. enterocolitica, B. suis, V. TNFa cholerae, B. anthracis P. aeruginosa TNFa, IL-1, IF-y S. typhimurium IL-2

 Attività anti-lisozima e anti-lattoferrina: Microrganismi n Attività anti-lattoferrina, Attività anti-lisozima ng/ml, μg/ml M ± DS S. aureus S. haemolyticus S. epidermidis E. coli Klebsiella spp. 15 22, 72 ± 1, 88 10, 1 ± 2, 17* 16 20, 08 ± 1, 41 4, 40 ± 1, 12 15 11, 50 ± 1, 45* 9, 91 ± 0, 82* 16 22 , 84 ± 1,41 4,19 ± 0,61 12 7,83 ± 1,13* 8,92 ± 2,45* 15 5,65 ± 0,62 1,24 ± 0,25 12 23,87 ± 0, 67* 2, 58 ± 0, 27* 12 18, 17 ± 3, 20 1, 64 ± 0. 15 12 19, 40 ± 2, 47 3, 24 ± 0, 27* 14 18, 13 ± 0, 64 1 , 83 ± 0, 28 Pazienti con malattie reumatiche Controllo *Statisticamente significativo
Attività anti-lisozima e anti-lattoferrina: Microrganismi n Attività anti-lattoferrina, Attività anti-lisozima ng/ml, μg/ml M ± DS S. aureus S. haemolyticus S. epidermidis E. coli Klebsiella spp. 15 22, 72 ± 1, 88 10, 1 ± 2, 17* 16 20, 08 ± 1, 41 4, 40 ± 1, 12 15 11, 50 ± 1, 45* 9, 91 ± 0, 82* 16 22 , 84 ± 1,41 4,19 ± 0,61 12 7,83 ± 1,13* 8,92 ± 2,45* 15 5,65 ± 0,62 1,24 ± 0,25 12 23,87 ± 0, 67* 2, 58 ± 0, 27* 12 18, 17 ± 3, 20 1, 64 ± 0. 15 12 19, 40 ± 2, 47 3, 24 ± 0, 27* 14 18, 13 ± 0, 64 1 , 83 ± 0, 28 Pazienti con malattie reumatiche Controllo *Statisticamente significativo
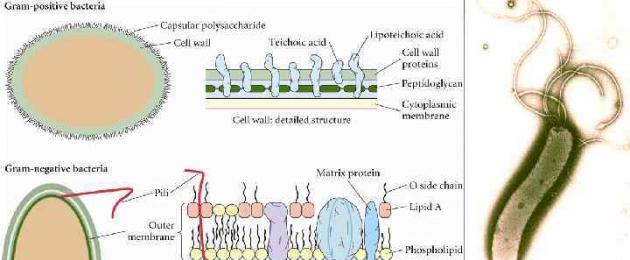
 La formazione della forma L - batteri, parzialmente o completamente privi di parete cellulare, ma che mantengono la capacità di svilupparsi. La comparsa delle forme L deriva dall'esposizione ad agenti che bloccano la produzione della parete cellulare: 1. antibiotici (penicilline cicloserina, cefalosporine, vancomicina), 2. enzimi (lisozima, amidasi, endopeptidasi), 3. ultravioletti e raggi X , 4. amminoacido glicina.
La formazione della forma L - batteri, parzialmente o completamente privi di parete cellulare, ma che mantengono la capacità di svilupparsi. La comparsa delle forme L deriva dall'esposizione ad agenti che bloccano la produzione della parete cellulare: 1. antibiotici (penicilline cicloserina, cefalosporine, vancomicina), 2. enzimi (lisozima, amidasi, endopeptidasi), 3. ultravioletti e raggi X , 4. amminoacido glicina.
 Background: La lettera L è la prima lettera del nome del Lister Institute di Londra, dove la dottoressa Emmy Kleineberger-Nobel per prima attirò l'attenzione nel 1935 sullo sviluppo di cellule morfologicamente molto insolite in una coltura batterica di Streptobacillus moniliformis isolata dall'orecchio di ratto fluido.
Background: La lettera L è la prima lettera del nome del Lister Institute di Londra, dove la dottoressa Emmy Kleineberger-Nobel per prima attirò l'attenzione nel 1935 sullo sviluppo di cellule morfologicamente molto insolite in una coltura batterica di Streptobacillus moniliformis isolata dall'orecchio di ratto fluido.
 vacuoli a forma di L di Bacillus subtilis, scala - 500 nm. Varietà di forme L di Bacillus subtilis, su una scala di 10 µm.
vacuoli a forma di L di Bacillus subtilis, scala - 500 nm. Varietà di forme L di Bacillus subtilis, su una scala di 10 µm.
 Forme a L Caratteristiche delle forme a L: 1. La sintesi di una parete cellulare completa è impossibile. Ritorno alla forma vegetativa quando i fattori ambientali sono normalizzati. Il ritorno alla forma vegetativa è impossibile. Ulteriore esistenza come nei micoplasmi Proprietà culturali simili. 3. Trasformazione graduale da strutture gram-positive a strutture gram-negative. Formazione di forme L stabili e instabili. 5. Cambiamento delle proprietà antigeniche (perdita degli antigeni K e O). Acquisizione della capacità di persistenza. 6. Ridotta virulenza dovuta alla perdita di vari fattori di patogenicità (adesione, invasione, endotossina, ecc.) stabile Sistema di controllo genetico della sintesi della parete cellulare (peptidoglicano) 2. 4. Forme granulari instabili.
Forme a L Caratteristiche delle forme a L: 1. La sintesi di una parete cellulare completa è impossibile. Ritorno alla forma vegetativa quando i fattori ambientali sono normalizzati. Il ritorno alla forma vegetativa è impossibile. Ulteriore esistenza come nei micoplasmi Proprietà culturali simili. 3. Trasformazione graduale da strutture gram-positive a strutture gram-negative. Formazione di forme L stabili e instabili. 5. Cambiamento delle proprietà antigeniche (perdita degli antigeni K e O). Acquisizione della capacità di persistenza. 6. Ridotta virulenza dovuta alla perdita di vari fattori di patogenicità (adesione, invasione, endotossina, ecc.) stabile Sistema di controllo genetico della sintesi della parete cellulare (peptidoglicano) 2. 4. Forme granulari instabili.


 Meccanismo della fagocitosi: Chemotassi Forze dell'interazione fisico-chimica Gradiente di concentrazione 2. Stadio di adesione Osonizzazione (AT, C 3 b, fibronectina, surfattano) Interazione fisico-chimica 3. Endocitosi 4. Microbicidità Ossigeno-indipendente Ossigeno-dipendente
Meccanismo della fagocitosi: Chemotassi Forze dell'interazione fisico-chimica Gradiente di concentrazione 2. Stadio di adesione Osonizzazione (AT, C 3 b, fibronectina, surfattano) Interazione fisico-chimica 3. Endocitosi 4. Microbicidità Ossigeno-indipendente Ossigeno-dipendente

 macroorganismo 1. Violazione della fusione del fagosoma con lisosoma (mycobacterium tuberculosis, protozoi, toxoplasma) 2. Resistenza agli enzimi lisosomiali (gonococchi, streptococchi gr A, micobatteri, ersinia) 3. Persistenza a lungo termine nel citoplasma (clamidia, rickettsia) microrganismo
macroorganismo 1. Violazione della fusione del fagosoma con lisosoma (mycobacterium tuberculosis, protozoi, toxoplasma) 2. Resistenza agli enzimi lisosomiali (gonococchi, streptococchi gr A, micobatteri, ersinia) 3. Persistenza a lungo termine nel citoplasma (clamidia, rickettsia) microrganismo

 Meccanismo di persistenza della clamidia Inclusioni tipiche contenenti corpi elementari e reticolari 48 ore dopo l'incubazione Modello patomorfologico di persistenza. Dopo lo shock termico, le inclusioni più piccole contengono grandi forme patologiche di clamidia.
Meccanismo di persistenza della clamidia Inclusioni tipiche contenenti corpi elementari e reticolari 48 ore dopo l'incubazione Modello patomorfologico di persistenza. Dopo lo shock termico, le inclusioni più piccole contengono grandi forme patologiche di clamidia.
 Il macrofago non presenta l'AG principale (MOMP) Espressione dei prodotti genetici precoci lisosoma Sovraccarico antigenico Iperproduzione di Ig A, G DTH Mimetismo antigenico Vescicole esocitiche contenenti sfingomielina, KG hps 60 - proteine da shock termico Lipopolisaccaride. Non espressa Condizione tra corpi reticolari ed elementari MOMP- non espressa
Il macrofago non presenta l'AG principale (MOMP) Espressione dei prodotti genetici precoci lisosoma Sovraccarico antigenico Iperproduzione di Ig A, G DTH Mimetismo antigenico Vescicole esocitiche contenenti sfingomielina, KG hps 60 - proteine da shock termico Lipopolisaccaride. Non espressa Condizione tra corpi reticolari ed elementari MOMP- non espressa

 + Attività antifagocitica: 1. Parete cellulare densa dei corpi elementari (legami disolfuro tra le strutture della proteina MOMP) 2. Forza dei corpi reticolari (capsula polisaccaridica) "fallimento" dell'esplosione respiratoria Attivazione di POL e danni alle membrane del proprio corpo proprie cellule
+ Attività antifagocitica: 1. Parete cellulare densa dei corpi elementari (legami disolfuro tra le strutture della proteina MOMP) 2. Forza dei corpi reticolari (capsula polisaccaridica) "fallimento" dell'esplosione respiratoria Attivazione di POL e danni alle membrane del proprio corpo proprie cellule
 TNFα γIF IL-1 1. Aumento dell'espressione di AG Membrane cellulari (GCS, Fc) Attivazione di fibroblasti e cellule epiteliali (fagociti non professionali) 2. Stimolazione di IL 1 e IL 2 3. Attivazione dell'atto fagocitario 4. Stimolazione della produzione di Ig 5. Induzione di radicali liberi
TNFα γIF IL-1 1. Aumento dell'espressione di AG Membrane cellulari (GCS, Fc) Attivazione di fibroblasti e cellule epiteliali (fagociti non professionali) 2. Stimolazione di IL 1 e IL 2 3. Attivazione dell'atto fagocitario 4. Stimolazione della produzione di Ig 5. Induzione di radicali liberi
 Mediatori di persistenza Chlamydia trachomatis Effetto mediatore Basse concentrazioni di interferone g Una forte diminuzione della quantità di triptofano endogeno (attivazione dell'enzima indolamine-2,3-diossigenasi, che scompone il triptofano in N-formilchinurenina) TNF-a Carenza di triptofano endogeno Mediato, dall'attivazione di b-IF (blocca la riproduzione dei microrganismi intracellulari, migliorando l'espressione delle proteine di membrana delle cellule) Necessario per la costruzione di MOMP Carenza di c. HMF ed elevata quantità di c. AMP Assenza di attivazione degli enzimi necessari per la differenziazione di RT in ET Deficit e/o azione degli antagonisti del Ca 2+ Violazione dell'aggregazione dei vacuoli endosomiali
Mediatori di persistenza Chlamydia trachomatis Effetto mediatore Basse concentrazioni di interferone g Una forte diminuzione della quantità di triptofano endogeno (attivazione dell'enzima indolamine-2,3-diossigenasi, che scompone il triptofano in N-formilchinurenina) TNF-a Carenza di triptofano endogeno Mediato, dall'attivazione di b-IF (blocca la riproduzione dei microrganismi intracellulari, migliorando l'espressione delle proteine di membrana delle cellule) Necessario per la costruzione di MOMP Carenza di c. HMF ed elevata quantità di c. AMP Assenza di attivazione degli enzimi necessari per la differenziazione di RT in ET Deficit e/o azione degli antagonisti del Ca 2+ Violazione dell'aggregazione dei vacuoli endosomiali
 Mediatori della persistenza Chlamydia trachomatis (continua) L-isoleucina L'effetto può essere dovuto all'inclusione di un prodotto metabolico dell'a-metilbutarile. Co. E nella sintesi degli acidi grassi da parte di C. trachomatis con successiva incorporazione di trigliceridi "estranei" nella membrana cellulare, con conseguente destabilizzazione delle sue pareti.
Mediatori della persistenza Chlamydia trachomatis (continua) L-isoleucina L'effetto può essere dovuto all'inclusione di un prodotto metabolico dell'a-metilbutarile. Co. E nella sintesi degli acidi grassi da parte di C. trachomatis con successiva incorporazione di trigliceridi "estranei" nella membrana cellulare, con conseguente destabilizzazione delle sue pareti.
 "Driva genetica", o mimetismo antigenico: sequenze di aminoacidi 264-286 del principale fattore sigma della RNA polimerasi della clamidia (Chl. trachomatis). L 7 (peptide II), una delle proteine ribosomiali AT Malattie reumatiche autoimmuni
"Driva genetica", o mimetismo antigenico: sequenze di aminoacidi 264-286 del principale fattore sigma della RNA polimerasi della clamidia (Chl. trachomatis). L 7 (peptide II), una delle proteine ribosomiali AT Malattie reumatiche autoimmuni
 Persistenza della via insensibile alla citocolasina di Francisella tularensis Caspasi 3 e 9 TNF, IL 1 23 -k. Da endosomi
Persistenza della via insensibile alla citocolasina di Francisella tularensis Caspasi 3 e 9 TNF, IL 1 23 -k. Da endosomi
 + Anti-isoenzima Anti-lattoferrina Attività anti-complementare di LPS francisella tularentis S-LPS R-LPS Virulenza residua virulenta Bassa sensibilità dell'ospite Proteina legante LPS – LBP LPS inerte Eliminazione rapida Alta sensibilità dell'ospite Persistenza della morte corporea
+ Anti-isoenzima Anti-lattoferrina Attività anti-complementare di LPS francisella tularentis S-LPS R-LPS Virulenza residua virulenta Bassa sensibilità dell'ospite Proteina legante LPS – LBP LPS inerte Eliminazione rapida Alta sensibilità dell'ospite Persistenza della morte corporea

 Persistenza e mutagenesi adattativa nei biofilm: La resistenza dei biofilm agli influssi esterni è caratterizzata dal termine “persistenza” (dall'inglese persistence – resistenza, sopravvivenza). cellule morte
Persistenza e mutagenesi adattativa nei biofilm: La resistenza dei biofilm agli influssi esterni è caratterizzata dal termine “persistenza” (dall'inglese persistence – resistenza, sopravvivenza). cellule morte
 Importanza della persistenza nei biofilm Secondo il Center for Disease Control (CDC USA), circa il 65% di tutte le infezioni sono dovute alla formazione di biofilm nel macroorganismo Formazione di biofilm su tutti i dispositivi medici introdotti nel macroorganismo (cateteri, protesi, stent, eccetera.); Formazione di biofilm sugli strumenti medici…
Importanza della persistenza nei biofilm Secondo il Center for Disease Control (CDC USA), circa il 65% di tutte le infezioni sono dovute alla formazione di biofilm nel macroorganismo Formazione di biofilm su tutti i dispositivi medici introdotti nel macroorganismo (cateteri, protesi, stent, eccetera.); Formazione di biofilm sugli strumenti medici…

 batterio+dna. J (sintesi chaperone) E. coli pmr. C (sintesi dei fosfolipidi) a. S. typhimurium Condizioni sfavorevoli Espressione genica SOS gene rmf, inibitore della traduzione Geni shock da caldo e freddo rec. A, ehm. DC, uvr. AB, sul. A Celle persistenti htr. A, htp. X, csp. H, cl. B, cbp. AB Geni del sistema “tossinantitossina” din. J/yaf. D, sì. M, rel. ESSERE, maz. EF
batterio+dna. J (sintesi chaperone) E. coli pmr. C (sintesi dei fosfolipidi) a. S. typhimurium Condizioni sfavorevoli Espressione genica SOS gene rmf, inibitore della traduzione Geni shock da caldo e freddo rec. A, ehm. DC, uvr. AB, sul. A Celle persistenti htr. A, htp. X, csp. H, cl. B, cbp. AB Geni del sistema “tossinantitossina” din. J/yaf. D, sì. M, rel. ESSERE, maz. EF
 Gene A Gene T Gene P Ribosoma antitossina antibiotica Proteina difettosa Proteina normale Complesso T-A Nessuna persistenza della sintesi proteica
Gene A Gene T Gene P Ribosoma antitossina antibiotica Proteina difettosa Proteina normale Complesso T-A Nessuna persistenza della sintesi proteica
 Principali tossine e loro sito di applicazione in E. coli: attività bersaglio della tossina Processo Ccd B DNA girasi Rotture del doppio filamento Replicazione Rel E Traduzione dei ribosomi Scissione di m RNA Traduzione di Maz F RNA Endoribonucleasi Traduzione di Par E DNA girasi Rotture del doppio filamento Replicazione Doc RNA Traduzione Vap C RNA Endoribonucleasi Sconosciuto Ξ-tossina Sconosciuto Fosfotransferasi Sconosciuto Anca A EF-TU Proteina chinasi Traduzione Anca B Traduzione scissione dell'mRNA dei ribosomi Traduzione
Principali tossine e loro sito di applicazione in E. coli: attività bersaglio della tossina Processo Ccd B DNA girasi Rotture del doppio filamento Replicazione Rel E Traduzione dei ribosomi Scissione di m RNA Traduzione di Maz F RNA Endoribonucleasi Traduzione di Par E DNA girasi Rotture del doppio filamento Replicazione Doc RNA Traduzione Vap C RNA Endoribonucleasi Sconosciuto Ξ-tossina Sconosciuto Fosfotransferasi Sconosciuto Anca A EF-TU Proteina chinasi Traduzione Anca B Traduzione scissione dell'mRNA dei ribosomi Traduzione
 Fattore Sigma della RNA polimerasi Rpo. S Mutagenesi adattativa: ? "Adattivo" si riferisce a mutazioni che si verificano in una popolazione di microrganismi a riproduzione lenta o dormiente durante un periodo di stress prolungato e che contrastano le cause di questo stress. Veillonella parvula Streptococcus mutans Resistenza agli antibiotici
Fattore Sigma della RNA polimerasi Rpo. S Mutagenesi adattativa: ? "Adattivo" si riferisce a mutazioni che si verificano in una popolazione di microrganismi a riproduzione lenta o dormiente durante un periodo di stress prolungato e che contrastano le cause di questo stress. Veillonella parvula Streptococcus mutans Resistenza agli antibiotici
 Lewis K. 2008 ritiene che il modo principale per combattere la persistenza nei biofilm sia la “distrazione del paziente”…
Lewis K. 2008 ritiene che il modo principale per combattere la persistenza nei biofilm sia la “distrazione del paziente”…

"L'ambiente interno del corpo" - Nel corpo umano ci sono circa 20 litri. L'ambiente interno del corpo Tessuto Sangue Linfa (intercellulare) Fluido. La relazione tra i componenti dell'ambiente interno del corpo. L'ambiente interno del corpo. L'ambiente interno del corpo è un insieme di fluidi che prendono parte ai processi del metabolismo e mantengono la costanza dell'ambiente interno.
"Organi del corpo" - In un minuto, il cuore umano fa una media di 70 battiti. batteri. Quali regole per la tutela dei sensi sono “codificate” nei disegni? 3. Quale scienza studia le piante? felci. 7. Che tipo di pianta non fiorisce mai? Polmoni. Cervello. Grado 3 "Noi e la nostra salute. La sonnolenza ci ha sopraffatto, Riluttanza a muoversi.
"Immunità biologica" - Attrezzature: consolidamento delle conoscenze. Se lo si desidera, preparare un messaggio "Dalla storia della trasfusione di sangue". Schema "Tipi di immunità". Quali tipi di immunità esistono? Tavolo "Sangue", ritratti di I.I. Mechnikov, L. Pasteur. Soprattutto spesso le persone sono portatrici del bacillo della tubercolosi. Passivo. Fagocitosi La fagocitosi e la produzione di anticorpi rappresentano un unico meccanismo di difesa chiamato immunità.
"Proporzioni di un uomo" - Dati sui cambiamenti legati all'età nelle proporzioni corporee nei ragazzi: di solito, la pressione sanguigna è più alta del normale. Tipo brachimorfo. Proporzioni del corpo ed età umana. Il cuore si trova trasversalmente a causa del diaframma alto. Aumento del rischio di ipotensione arteriosa. Cambiamenti legati all’età nelle proporzioni corporee. Tipo dolicomorfo.
"La struttura dell'uomo" - Come funziona il nostro corpo? Abbassiamo le mani al comando "due". Quindi, abbiamo considerato la casa e l'aereo. Cuore. Il sole ci solleva per fare esercizio, alza le mani al comando “uno”. Senza aria, una persona può vivere per un tempo molto breve. Cervello. Il cibo trasformato entra nell'intestino. Com'è organizzata la casa? Qual è il segreto della nostra salute?
"La costanza dell'ambiente interno del corpo" - Nastro di eritrociti. Globuli bianchi. I.I. Mechnikov. plasma del sangue. piastrine. Sangue. Il concetto di “ambiente interno del corpo”. Eritrociti. Emoglobina. Leucociti. Fluidi del corpo umano. Elementi formati di sangue. Protrombina. Micropreparazione del sangue umano. fluido tissutale. Componenti. L'ambiente interno del corpo.
L'infezione persistente è una malattia causata da batteri che vivono nel corpo umano. Alcuni di loro non rappresentano una minaccia per la salute, ma altri rappresentano una minaccia costante e quindi i meccanismi di difesa del corpo controllano attentamente la loro riproduzione. La lunga permanenza di tali agenti "dormienti" è la causa della malattia.
Quali sono queste infezioni?
Facendo riferimento alla terminologia medica, la persistenza è la capacità dei microrganismi che causano un'infezione di rimanere a lungo nel corpo umano senza mostrare sintomi clinici. Allo stesso tempo, sono capaci, in determinate condizioni, di attivarsi, provocando lo sviluppo di una malattia infettiva.Il meccanismo che innesca lo sviluppo o l'attivazione di un'infezione persistente dipende direttamente dallo stato di salute di una persona, dalla forza del suo corpo nel bloccare un'infezione latente.
Un'infezione persistente può avere una forma latente, il che significa un decorso asintomatico dell'infezione, non accompagnato dal rilascio nell'ambiente esterno. In una forma latente, l'infezione o il virus non possono essere rilevati utilizzando le consuete misure diagnostiche utilizzate in medicina.
Sotto l'influenza di fattori esterni, un'infezione persistente può manifestarsi clinicamente. Questi fattori includono:
- immunità ridotta (leggi di più);
- forte stress;
- ipotermia;
- diminuzione delle funzioni protettive del corpo sullo sfondo di un'altra malattia.
agenti causali dell'infezione
Non tutti i microrganismi sono in grado di esistere nel corpo umano e allo stesso tempo "non impersonificarsi". I virus che possono persistere devono necessariamente avere una proprietà come l'esistenza intracellulare in un microrganismo. Questi agenti includono:
- clamidia;
- micoplasmi;
- elicobatterio;
- virus del gruppo herpesvirus;
- epatite;
- toxoplasma.
Un'infezione cronica persistente può colpire qualsiasi cellula del corpo e comparire solo se la persona ha già avuto l'infezione in precedenza. Nel corpo, l'agente infettivo rimane in forma latente e si aggrava quando le funzioni protettive del corpo diminuiscono in una persona.
I seguenti individui sono a rischio di infezione cronica persistente:
- donatori di sangue;
- neonati prematuri;
- donne incinte;
- malati di cancro;
- personale medico;
- pazienti con immunodeficienza.
Il decorso delle infezioni acute differisce dal decorso dei processi infettivi che causano virus persistenti. Ad esempio, se un'infezione acuta (influenza, morbillo, ecc.) Si manifesta immediatamente, le infezioni persistenti si verificano in modo cronico con possibili epidemie di processi patologici. Pertanto, le infezioni persistenti hanno due forme: latente (remissione) e esacerbata (quando il virus viene attivato).
Il processo infiammatorio che causa un'infezione persistente porta a cambiamenti in tutti i sistemi del corpo: morfologico, metabolico, strutturale. Ciò si riflette negli organi e nel loro lavoro.

In una forma latente, è impossibile riconoscere da sola un'infezione latente, poiché non ci sono segni che lo indichino. In questi casi anche la diagnosi è difficile. Ma l’infezione cronica persistente dà alcuni segnali. Tutto dipende da dove si trova esattamente il focus dell'infiammazione. Ad esempio, con danni agli organi del sistema genito-urinario, i pazienti lamentano tali manifestazioni:
- minzione dolorosa;
- minzione frequente;
- urina torbida o presenza di coaguli di sangue o pus al suo interno.
- brividi;
- febbre
- debolezza e dolore muscolare (fino alla completa incapacità di alzarsi dal letto);
- ingrossamento della milza;
- confusione.
È importante capire che è difficile fare una diagnosi accurata sulla base di tali segni e che l'infezione latente stessa può essere completamente trascurata.
Diagnosi e trattamento
Solo gli esami di laboratorio possono confermare la presenza o l’assenza di un’infezione cronica persistente. Questo:- esame cistoscopico del materiale biologico (raschiamento dell'uretra, esame delle urine e della saliva) - consente di rilevare le cellule caratteristiche di un virus persistente;
- diagnostica biologica molecolare: aiuta a identificare il genoma del DNA virale;
- test immunoenzimatico: aiuta a rilevare anticorpi specifici.
- Terapia con farmaci antivirali (Foscarnet, Ganciclovir).
- Terapia con agenti immunitari. È necessario perché spesso un'infezione persistente diventa acuta sullo sfondo dell'immunodeficienza.
L'infezione persistente è una patologia molto complessa che si manifesta individualmente per ciascun paziente, quindi è importante un approccio terapeutico basato sullo stato di salute del paziente e sulla sua storia medica generale.
Caratteristiche dell'infezione nei bambini
Poiché il corpo del bambino è debole e diventa più forte solo durante l'adolescenza, è molto vulnerabile allo sviluppo di infezioni persistenti. I neonati e i bambini di età inferiore ai 10 anni sono particolarmente suscettibili alle malattie virali.I bambini possono “contrarre” un’infezione persistente in due modi:
- da un'altra persona o animale malato, in contatto con un ambiente infetto;
- dall'ambiente esterno, poiché il corpo del bambino non interferisce con il virus, che entra liberamente in un ambiente favorevole e lì si moltiplica.

È possibile identificare una malattia virale dai seguenti segni:
- febbre (temperatura da 38 a 40 gradi);
- mal di testa persistente;
- letargia;
- mancanza di appetito;
- sudorazione abbondante;
- dolore muscolare;
- nausea e vomito.
- febbre;
- raucedine o completa perdita della voce;
- tosse;
- congestione nasale e secrezione di pus dai seni.
- attenersi ad un menù arricchito con frutta, verdura e latticini;
- cerca di abbassare la temperatura: i bambini fino a un anno possono mettere una candela e ai bambini di età superiore a un anno può essere somministrato Ibuprofene per i bambini.
Perde completamente o parzialmente la parete cellulare o i precursori della sua biosintesi, crescendo sotto forma di piccole colonie caratteristiche. Scoperto per la prima volta nel 1935 da E. Klieneberger in una coltura di Streptobacillus moniliformis isolata da K. Levaditi et al. nel 1932 dal liquido articolare di un paziente affetto da eritema articolare epidemico. Lo Streptobacillus moniliformis è un bacillo gram-negativo, emoglobinofilo, con rigonfiamenti simili a perline alle estremità, che cresce bene su agar sangue (10-20%) e siero coagulato.
Studiando un'infezione sperimentale nei ratti, Klineberger ha isolato diversi ceppi contenenti, oltre alle tipiche forme batteriche, microrganismi polimorfici che sono molto simili nell'aspetto delle colonie e nella morfologia agli organismi simili alle pleuropolmonie - organismi simili alle pleuropolmonie (P PL O). Questi microrganismi sono stati chiamati in onore di Ying. Lister - a forma di L.
Per molti anni Klineberger ha considerato le forme L come rappresentanti dei simbionti PPLO del batterio Streptobacillus moniliformis. La prova dell'esistenza simbiotica di due diversi microrganismi è stata l'assenza di reversione dei batteri dalle forme L per 13 anni (350 passaggi).
Vari esperimenti Amer. il ricercatore Daines (L. Dienes) e altri hanno dimostrato l'errore del concetto di Klineberger. È stato dimostrato che le forme L di Streptobacillus moniliformis, Fusiformis necrophorus e altri batteri sono in grado di ritornare alla specie batterica originale. La formazione delle forme L dei batteri è descritta con i nomi "trasformazione L", "conversione L", "induzione delle forme L".
VD Timakov e G. Ya Kagan hanno ricevuto forme L di molti tipi di batteri, hanno studiato la loro biologia, le proprietà e il ruolo nella patologia (malattia cardiaca reumatica, endocardite settica, meningoencefalite, hron, gonorrea, ecc.).
La trasformazione nella forma a L è una proprietà, con ogni probabilità, insita in tutti i batteri. I farmaci che hanno un effetto L-trasformatore bloccano alcuni collegamenti nella biosintesi delle pareti cellulari, principalmente il peptidoglicano (mureina), oppure li distruggono. I farmaci che inducono le forme L di batteri includono: 1) antibiotici con lo spettro d'azione appropriato, ad esempio penicillina, cicloserina, lisostafina, ecc.; 2) enzimi murolitici - lisozima, endoacetilesosaminidasi della lisina associata ai fagi dello streptococco di gruppo C, ecc.; 3) alcuni aminoacidi (glicina, ecc.).
L'induzione delle forme L di batteri dipende dalle condizioni e dai terreni di coltura: è necessario creare un fisico. ambiente che contribuisce alla stabilizzazione della membrana batterica osmoticamente fragile e protegge le forme L dalla morte.
La composizione del terreno e le condizioni di coltivazione variano a seconda del tipo di batteri; la concentrazione semisolida e semiliquida del gel di agar, la presenza di siero di cavallo normale e la selezione della concentrazione osmotica dei sali sono necessarie per preservare l'integrità del la membrana citoplasmatica dei batteri della forma L.
Esistono forme L di batteri instabili e stabili. Le forme instabili conservano alcuni elementi della parete cellulare o dei suoi precursori e, durante il passaggio su terreni senza un agente L-induttore, ritornano alla specie batterica originale. Le forme stabili perdono completamente i componenti della parete cellulare e non sono in grado di ripristinarla, quindi non ritornano al tipo originario di batteri, anche con ripetuti passaggi su terreni senza agente induttore, nonché su terreni contenenti succinato di sodio o gelatina, che promuove la reversione dei batteri dalle forme L.
Le forme L di batteri crescono sotto forma di due tipi di colonie: A. e B. Le colonie di tipo A sono più spesso inerenti alle forme L stabili di batteri, sono molto piccole (50-100 micron), crescono nell'agar , crescono bene in gruppi, le singole colonie spesso non danno crescita. Gli elementi minimi riproduttivi delle colonie di tipo A, completamente prive di parete cellulare, non hanno recettori recettivi per i fagi. Le colonie di tipo B sono più spesso inerenti a forme L instabili di batteri; sono più grandi, 0,5-2 mm di dimensione, con un delicato bordo di pizzo e un centro che cresce nel terreno. Le colonie sono dominate da corpi sferici di diversa densità ottica; contengono meno elementi submicroscopici rispetto alle colonie di tipo A. Conservano alcuni elementi della parete cellulare, recettori fago-recettori e possono essere agglutinati dal siero della specie originaria.
La differenziazione delle colonie nei tipi A e B è condizionata, così come il fenomeno della stabilizzazione delle forme L. Nelle colture di forme L stabili di batteri possono essere contenute colonie di tipo B, mentre nelle colture di forme L instabili possono essere contenute colonie di tipo A.
Le colonie di batteri della forma L contengono: 1) corpi sferici di diversa densità ottica e dimensioni; 2) corpi elementari o granuli situati in gruppi, nonché intracellularmente in formazioni sferiche o vacuoli più grandi; 3) corpi poco sagomati, informi, in continua crescita; 4) forme contorte; 5) corpi grandi con inclusioni sotto forma di vacuoli. Le forme L dei batteri differiscono nel polimorfismo (Fig. 1, 1-6) e allo stesso tempo sono fondamentalmente le stesse nei diversi tipi di batteri / il che non consente loro di differenziarsi in base al morfolo, un segno.
Insieme alla perdita della parete cellulare nelle forme L dei batteri, si perdono i mesosomi, il che porta all'attaccamento diretto della membrana citoplasmatica al nucleoide; non si osserva il ripristino dei mesosomi nel processo di reversione.
La mancanza di una parete cellulare causa la disorganizzazione della divisione e della pluralità del morfolo, manifestazioni all'atto della riproduzione delle L-forme dei batteri. Le forme L dei batteri si riproducono per divisione, gemmazione o disintegrazione della cellula in piccoli granuli.
Le caratteristiche fisiologiche, antigeniche e patogene di queste forme sono determinate dalla struttura della loro membrana citoplasmatica e possibilmente dal citoplasma.
Le forme L dei batteri si formano non solo in vitro, ma anche in vivo; possono persistere nel corpo e trasformarsi nella forma batterica originale.

La Figura 2 mostra i risultati dell'ottenimento di forme L di S. typhi in vivo sotto l'influenza della penicillina. Batteri e antibiotico sono stati somministrati simultaneamente per via intraperitoneale ai topi. Con l'introduzione di 100 unità di penicillina per 1 g di peso si sono formate forme L instabili, regredite alle forme batteriche originarie dopo 24-48 ore, che hanno causato la morte degli animali. Con l'introduzione di 2000 unità di penicillina per 1 g di peso per 24-48 ore. si formarono forme L stabili, sottoposte a fagocitosi; morte degli animali nei prossimi 5 giorni. non è stato osservato. Dati simili sono stati ottenuti studiando l'induzione in vivo di forme L di altri batteri.
Lo schema originale di allocazione delle forme L da patol, il materiale è sviluppato, i bordi hanno permesso di allocare e identificare le forme L di batteri dal liquido cerebrospinale di pazienti con meningite purulenta e cardiopatia reumatica.

La Figura 3 mostra le micrografie delle forme L isolate dal sangue di un paziente con cardiopatia reumatica e dei loro revertanti formatisi a seguito della regressione agli streptococchi, successivamente identificati come Streptococcus hemolyticus di gruppo A.
Anticorpi contro forme L stabili di Streptococcus hemolyticus sono stati trovati nell'87,9% dei pazienti con reumatismi, nel 77% dei pazienti con miocardite infettiva-allergica e solo nell'11% delle persone sane (V. D. Timakov, G. Ya. Kagan, 1973). Forme L di diversi tipi di batteri si trovano nell'hron, nella batteriuria, nella pielonefrite, nelle forme abatteriche della tubercolosi, nella cardiopatia reumatica, ecc.
La patogenicità delle forme L di batteri è stata dimostrata sperimentalmente, è noto l'hron, l'artrite causata dalla somministrazione intrarticolare di forme L di Streptococcus hemolyticus, la tonsillite delle scimmie complicata da miocardite interstiziale, indotta dalla somministrazione endovenosa di forme L di batteri Streptococcus hemolyticus, pielonefrite di ratti e conigli, causata da forme L di batteri del genere Proteus e Streptococcus faecalis, meningoencefalite del coniglio associata a forme L di meningococco e listeriosi di pecore e conigli causata dall'introduzione di forme L di Listeria monocytogenes. Patol, i processi causati dalle forme L di batteri differiscono nel patol a sviluppo graduale. i fenomeni, la corrente prolungata e la persistenza dell'attivatore nella forma L che sostiene la transizione di una malattia in hron, una forma. La persistenza delle forme L di batteri è stata stabilita sperimentalmente sulle forme L di Mycobacterium tuberculosis e Streptococcus hemolyticus.

Con una singola infezione intraperitoneale di topi bianchi con forme L stabili di Streptococcus hemolyticus e successiva osservazione per un anno, l'antigene della forma L viene preservato in tutti gli organi interni. La Figura 4, 1 mostra un esempio della localizzazione delle forme L di Streptococcus hemolyticus nella milza dopo 3 settimane. dopo l'infezione, nella figura 4, 2 - dopo 27 settimane. La persistenza a lungo termine delle forme L nel corpo è accompagnata da un aumento dell'effetto dannoso; sviluppo di miocardite interstiziale e glomerulonefrite grave.
La formazione di forme L di batteri in vivo, la loro connessione con molti processi cronici, la possibilità di inversione delle forme batteriche con il ripristino della loro virulenza e il verificarsi di ricadute che di conseguenza non possono essere trattate con una terapia efficace, mettono il miele . microbiologia, il problema di trovare modi per affrontare varianti di microrganismi che hanno perso la parete cellulare (sferoplasti, protoplasti, forme L). Le ricerche vengono condotte da due posizioni diametralmente opposte: 1) prevenire la possibilità di induzione di forme L in vivo (un percorso difficile da controllare); 2) l'uso di farmaci che inducono la formazione di forme L, seguito dall'uso di altri farmaci che sono inefficaci contro le cellule intatte, ma penetrano intracellularmente solo nelle forme L dei batteri e li distruggono. Questo percorso è il più promettente. Esistono prove dell'efficacia delle combinazioni di penicillina e kanamicina utilizzate per il trattamento della pielonefrite. La penicillina induce la formazione di forme L di batteri, che vengono distrutti dalla penetrazione intracellulare della kanamicina, che non ha alcun effetto sui batteri intatti.
Bibliografia: Peshkov M. A. Citologia dei batteri, p. 151, M.-L., 1955; Timakov V.D e Kagan G. Ya. Forme L di batteri e famiglia delle micoplasmataceae in patologia, M., 1973, bibliogr.; essi, Forme L di batteri, la famiglia delle micoplasmataceae e il problema della persistenza microbica, Zhurn, mikr., epid e immuno., n° 4, p. 3, 1977, bibliogr.; Dienes L. La morfologia del Li di Klieneberger e la sua relazione con lo streptobacillus monoliformis, J. Bact., v. 54, pag. 231, 1947; Dinenes L.a. Weinberger H. Le forme L dei batteri, Bact. Rev., v. 15, pag. 245, 1951; Klieneberger E. La presenza naturale di organismi simili alla pleuropolmonite, la sua apparente simbiosi con lo streptobacillus moniliformis e gli altri batteri, J. Path. Bact., v. 40, pag. 93, 1935; K li eneberger-N obel E. Organismi simili alla pleuropneumonia (PPLO) mycoplasmataceae, L.-N. Y., 1962; Protoplasti microbici, sferoplasti e forme L, ed. di LB Guze, Baltimora, 1968.
V. D. Timakov, G. Ya. Kagan.
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0