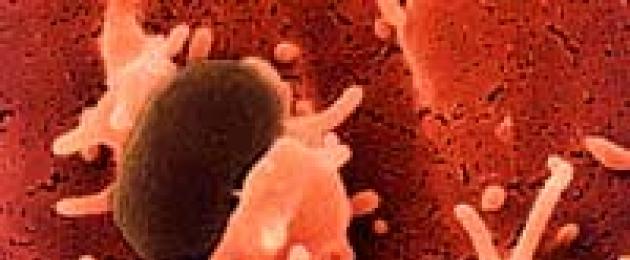
coli (Escherichia coli, lat. ; abbreviazione comune Escherichia coli) - un tipo di batteri gram-negativi a forma di bastoncino, anaerobi facoltativi, che fa parte della normale microflora del tratto gastrointestinale umano.
Tipo di Escherichia coli ( Escherichia coli) è compreso nel genere Escherichia (lat. Escherichia), la famiglia delle Enterobacteriaceae (lat. Enterobatteriacee), l'ordine degli enterobatteri (lat. Enterobatteri), una classe di gamma-proteobatteri (lat. proteobatteri γ), un tipo di proteobatteri (lat. Proteobatteri), il regno dei batteri.
Esistono numerose varietà di Escherichia coli ( ), compresi più di 100 tipi patogeni ("enterovirulenti"), combinati in quattro classi: enteropatogeni, enterotossigeni, enteroinvasivi e. Non ci sono differenze morfologiche tra Escherichia patogena e non patogena.
Escherichia coli. informazioni generali
Escherichia coli ( ) sono stabili nell'ambiente, persistono a lungo nel suolo, nell'acqua, nelle feci. Tollerano bene l'essiccazione. Gli E. coli hanno la capacità di moltiplicarsi negli alimenti, soprattutto nel latte. Muoiono rapidamente se bolliti ed esposti a disinfettanti (cloro, formalina, fenolo, sublimato, idrossido di sodio, ecc.). Gli Escherichia coli sono più stabili nell'ambiente esterno rispetto ad altri enterobatteri. La luce solare diretta li uccide in pochi minuti, una temperatura di 60°C e una soluzione di acido carbolico all'1% entro 15 minuti.
Gli Escherichia coli sono più stabili nell'ambiente esterno rispetto ad altri enterobatteri. La luce solare diretta li uccide in pochi minuti, una temperatura di 60°C e una soluzione di acido carbolico all'1% entro 15 minuti. Alcuni Escherichia coli hanno flagelli e sono mobili. Altri Escherichia coli sono privi di flagelli e della capacità di muoversi.
Escherichia coli nell'intestino e nelle feci umane
Numero di Escherichia coli tra gli altri rappresentanti della microflora intestinale non supera l'1%, ma svolgono un ruolo importante nel funzionamento del tratto gastrointestinale. Escherichia coli Escherichia coli sono i principali concorrenti della microflora opportunistica in termini di colonizzazione dell'intestino. Escherichia coli E.coli assorbono ossigeno dal lume intestinale, dannoso per i bifidobatteri e i lattobacilli benefici per l'uomo. Escherichia coli Escherichia coli produrre una serie di vitamine necessarie per l'uomo: B1, B2, B3, B5, B6, biotina, B9, B12, K, acidi grassi (acetico, formico e numerosi ceppi anche lattici, succinici e altri), partecipa alla il metabolismo del colesterolo, della bilirubina, della colina, degli acidi biliari, influenza l'assorbimento del ferro e del calcio.Compaiono nell'intestino umano nei primi giorni dopo la nascita e permangono per tutta la vita ad un livello di 10 6 -10 8 CFU / g del contenuto dell'intestino crasso. Nelle feci di una persona sana, l'Escherichia coli (tipico) viene rilevato nella quantità di 10 7 -10 8 CFU / g, mentre il numero di Escherichia coli lattosio-negativi non deve superare 10 5 CFU / g ed Escherichia coli emolitico dovrebbe essere assente.
Deviazioni dai valori indicati sono un segno di disbatteriosi:
- riduzione dell'Escherichia coli tipica a 10 5 -10 6 CFU / g, oppure aumento del contenuto dell'Escherichia tipica a 10 9 -10 10 ; CFU/g è definito come il primo grado di disordini microbiologici
- un aumento della concentrazione di Escherichia coli emolitico fino a 10 5 -10 7 CFU/g è definito come disturbo microbiologico di secondo grado
Con una crescita eccessiva di Escherichia coli, a seguito di disbatteriosi, oltre ai batteriofagi, nella terapia farmacologica vengono utilizzati vari probiotici (Bifidumbacterin, Lactobacterin, Acylact, Acipol, ecc.) e / o adeguati a un ceppo specifico e. coli e la causa della disbatteriosi antibiotici (negli adulti).
(E. coli) - l'agente eziologico più comune della peritonite batterica spontanea - infiammazione della cavità addominale in assenza di un'ovvia fonte di infezione.
Escherichia coli enteropatogeno
 L'Escherichia coli enteropatogeno viene spesso indicato con l'abbreviazione latina ETEC. Le infezioni intestinali causate da ceppi enteropatogeni di Escherichia coli si sviluppano più spesso nell'intestino tenue nei bambini del primo anno di vita, compresi i neonati. La malattia è accompagnata da grave diarrea con feci acquose senza aggiunta di sangue, forte dolore all'addome e vomito. Enteropatogeno sono una causa comune di diarrea negli ospedali di maternità. I ceppi ETEC sono la principale causa di diarrea acquosa acuta nei paesi in via di sviluppo, soprattutto durante la stagione calda e umida. Sia nei paesi sviluppati che in quelli in via di sviluppo, i ceppi di Escherichia coli enteropatogeni sono la causa più comune di "diarrea del viaggiatore", che di solito si risolve senza trattamento.
L'Escherichia coli enteropatogeno viene spesso indicato con l'abbreviazione latina ETEC. Le infezioni intestinali causate da ceppi enteropatogeni di Escherichia coli si sviluppano più spesso nell'intestino tenue nei bambini del primo anno di vita, compresi i neonati. La malattia è accompagnata da grave diarrea con feci acquose senza aggiunta di sangue, forte dolore all'addome e vomito. Enteropatogeno sono una causa comune di diarrea negli ospedali di maternità. I ceppi ETEC sono la principale causa di diarrea acquosa acuta nei paesi in via di sviluppo, soprattutto durante la stagione calda e umida. Sia nei paesi sviluppati che in quelli in via di sviluppo, i ceppi di Escherichia coli enteropatogeni sono la causa più comune di "diarrea del viaggiatore", che di solito si risolve senza trattamento. L'E. coli enteropatogeno ha due importanti fattori di virulenza:
- fattore di colonizzazione, grazie al quale l'ETEC aderisce agli enterociti dell'intestino tenue
- fattore tossico: i ceppi ETEC producono enterotossine termolabili (LT) e/o termostabili (ST) che provocano la secrezione di succhi ed elettroliti, che porta a diarrea acquosa. Gli ETEC non distruggono l'orletto a spazzola e non penetrano nella mucosa intestinale
Escherichia coli enterotossigena
Gli Escherichia coli enterotossigeni hanno la capacità di attaccarsi alle cellule epiteliali della mucosa dell'intestino tenue e produrre tossine che causano diarrea. L'E. coli enterotossigeno è la principale causa di diarrea acuta nei bambini e negli adulti e una causa comune della cosiddetta "diarrea del viaggiatore".Escherichia coli enteroemorragica
L'Escherichia coli enteroemorragico (EHEC) è la causa della colite emorragica, nonché di una malattia grave - la sindrome emolitica uremica (anemia emolitica microangiopatica associata a insufficienza renale; abbreviazione HUS o HUS).La colite emorragica è caratterizzata da un esordio acuto sotto forma di forti dolori addominali crampiformi e diarrea acquosa, che presto diventa sanguinolenta. Di solito non c'è febbre, ma in alcuni la temperatura corporea può raggiungere i 39°C. Nei casi lievi, la colite emorragica dura da 7 a 10 giorni. Circa il 5% dei casi di colite emorragica sono complicati da sindrome emorragica, insufficienza renale acuta e anemia emolitica.
La fonte dell'infezione nel maggio 2011 in Germania e in altri paesi europei era un ceppo di Escherichia coli enteroemorragico STEC produttore della tossina Shiga (sinonimo: produttore di verotossina - VTEC).
 L'infezione da STEC o VTEC-E. coli avviene più spesso attraverso il cibo o attraverso il contatto ravvicinato con persone o animali malati. Un piccolo numero di STEC/VTEC è sufficiente per innescare la malattia. .
L'infezione da STEC o VTEC-E. coli avviene più spesso attraverso il cibo o attraverso il contatto ravvicinato con persone o animali malati. Un piccolo numero di STEC/VTEC è sufficiente per innescare la malattia. .
È stato accertato che l'agente eziologico dell'infezione europea nel maggio 2011 è l'Escherichia coli del sierogruppo Escherichia coli O104 (sierotipo Escherichia coli O104:H4), che ha nel suo genoma un gene responsabile della produzione della tossina di tipo 2 simile a Shiga. A differenza del classico Escherichia coli enteroemorragico ( Escherichia coli O157:H7), ceppi E.coli O104:H4 non hanno il gene eae responsabile della produzione della proteina intimina, che è un fattore di adesione.
Tensioni Escherichia coli O104:H4 isolato dai pazienti era resistente agli antibiotici beta-lattamici a causa della produzione di beta-lattamasi ad ampio spettro, ma rimaneva sensibile al gruppo degli aminoglicosidi (gentamicina) e ai fluorochinoloni.
Dopo l'infezione da Escherichia coli enteroemorragico, il periodo di incubazione dura molto spesso da 48 a 72 ore, ma può variare da 1 a 10 giorni. I sintomi dell'infezione comprendono crampi addominali e diarrea, spesso con presenza di sangue. Possono verificarsi febbre e vomito. La maggior parte dei pazienti guarisce entro 10 giorni. A volte l’infezione può portare a condizioni pericolose per la vita come la sindrome emolitica uremica.
Lavoro del corso
Caratteristiche biologiche dell'Escherichia coli
introduzione
Escherichiosi (colibacillosi) - Una malattia infettiva batterica acuta di giovani animali da allevamento, compresi gli uccelli (principalmente fino a 2 settimane di età), manifestata da diarrea abbondante, segni di grave intossicazione e disidratazione del corpo.
Procede in forme enteritiche, settiche ed enterotossiemiche. Sono stati stabiliti più di 150 tipi. Negli animali domestici e nell'uomo sono noti più di dieci sierotipi di Escherichia coli che causano la colibacillosi.
È generalmente accettato che l'E. coli viva nell'intestino degli animali. Di norma, non causa malattie.
Il materiale per isolare l'Escherichia coli sono oggetti ambientali (acqua, suolo, tamponi da vari oggetti), in caso di malattie - feci, vomito, urina, contenuto duodenale o sangue, nonché prodotti alimentari sospettati come fonte di infezione. Il materiale viene seminato su terreni diagnostici differenziali, seguito dall'isolamento di una coltura pura di E. coli. L'identificazione viene effettuata studiando le caratteristiche morfologiche, biochimiche e antigeniche. Il passaggio finale consiste nel determinare il biovar dell'Escherichia coli, in particolare il sierogruppo e il sierovar.
1.Riferimento storico
malattia da patogenicità del virus coli
Escherichia coli
(Batteri del gruppo Escherichia coli) Nel 1885, Escherich scoprì un microrganismo chiamato Escherichia coli (Escherichia coli). Questo microrganismo è un abitante permanente dell'intestino crasso dell'uomo e degli animali. Oltre a E. coli, il gruppo dei batteri intestinali comprende specie epifite e fitopatogene, nonché specie la cui ecologia (origine) non è stata ancora stabilita. I batteri del gruppo Escherichia coli comprendono i generi Escherichia (rappresentante tipico di E. coli), Citrobacter (rappresentante tipico di Citr. coli citrovorum), Enterobacter (rappresentante tipico di Ent. aerogenes), che sono combinati in un'unica famiglia Enterobacteriaceae a causa della le proprietà morfologiche e culturali comuni. Sono caratterizzati da diverse proprietà enzimatiche e struttura antigenica.
Per la prima volta la malattia nei vitelli fu diagnosticata nel 1891 da K. Ieysen in Danimarca. Nella letteratura specializzata sono noti numerosi sinonimi con i quali è stata descritta la patologia: colibacillosi, colisepsi, colienterite, coli-diarrea, "diarrea bianca dei vitelli", dispepsia tossica. La patologia ha una distribuzione globale, accompagnata da grandi perdite. In Germania, l'incidenza della colibacillosi nei vitelli degli anni Trenta ha raggiunto il 42-48%, tra i puledri il 19,7%. In Francia, in alcuni anni, in alcune aziende agricole, la mortalità degli animali è stata del 40-55%. Negli USA le perdite dovute alla colibacillosi sono definite pari al 10% dell’incidenza totale dei vitelli. La malattia degli animali giovani con indicatori diversi è osservata in tutti i paesi dell'Europa, dell'Asia, ecc. (Ya.E. Kolyakov, 1970).
In Russia, la malattia è registrata in tutte le regioni. Negli allevamenti della regione dell'Amur nel 1946-1969, tra i vitelli morti il primo giorno di vita, il numero di risultati di laboratorio positivi per la colibacillosi era pari al 28,7% del numero di campioni studiati tra i vitelli anziani. 2-3 giorni - 34%, 4-7 giorni - 22,5%, 8-14 giorni - 19,4%, 15-21 giorni - 14,3%. Sono stati studiati 3829 campioni di materiale patologico (Yu.P. Mozzhukhin, 1971). A Primorye, nel 1967-1970, furono effettuati 746 esami per la colibacillosi, di cui dal 38% al 55% risultarono positivi ogni anno (E.A. Kiryanov, 1974). La mortalità nei singoli focolai della malattia tra i vitelli ha raggiunto il 46,6% e in media all'anno il 32%. (E.A. Kiryanov, 1977, 1979). Nel territorio di Khabarovsk, nello studio di 258 campioni elaborati nel 1972-1975, il numero di conferme positive per la colibacillosi dei vitelli è stato del 12,4%. In questi anni non furono diagnosticati casi di colibacillosi tra i suinetti (E.A. Kiryanov, M.F. Sosnin, 1978). A Sakhalin nel 1972-1976, il numero di casi positivi di diagnosi di colibacillosi nei vitelli era compreso tra il 2,1 e il 46,2%. (E.A. Kiryanov, V.G. Kurdyukov et al., 1981). Nella regione dell'Amur nel 1972-1976, furono esaminati 1696 oggetti per colibacillosi, vitelli, la frequenza dei risultati positivi per anno variava dal 15,4 al 27,9%, tra i suinetti - 17,3-35%. Sono stati studiati 287 cadaveri (E.A. Kiryanov, I.F. Tyutrin, 1981). La colibacillosi nella zona dell'Estremo Oriente negli anni analizzati è stata riscontrata anche tra visoni, uccelli e conigli.
2. Caratterizzazione biologica
.1 Proprietà morfologiche
Gli E. coli sono piccoli bastoncini Gram-negativi (2 - 3 micron di lunghezza, 0,5 - 0,7 micron di larghezza) con estremità arrotondate. L'ultrastruttura è simile a quella di altri batteri Gram-negativi. Negli strisci sono disposti in modo casuale, non formano spore, peritrichi (i flagelli si estendono lungo il perimetro del batterio). Gli Escherichia coli sono mobili. Alcuni ceppi sono microincapsulati, pili.
E. coli non forma spore.
2.2 Beni culturali
La temperatura ottimale per la crescita dell'Escherichia è 37°C, pH 7,2 ... 7,4, l'anaerobio facoltativo è senza pretese nei confronti dei mezzi nutritivi.
Quando si semina su brodo di carne e peptone (MPB), agar di carne e peptone (MPA):
Sul MPB danno crescita abbondante con notevole torbidità del terreno; il sedimento è piccolo, di colore grigiastro, facilmente fratturabile. Formano un anello parietale, la pellicola sulla superficie del brodo è solitamente assente.
Sull'MPA, le colonie sono trasparenti con una tinta grigio-blu e si fondono facilmente tra loro (vedere Appendice 2).
Quando si semina su terreni differenziali:
su terreno Endo formano colonie piatte rosse di medie dimensioni con riflessi metallici scuri (E. coli). (Vedi allegato 3)
su terreno Levin, gli Escherichia coli danno colonie colorate del colore dell'indicatore, poiché sono in grado di decomporre il lattosio contenuto in questi terreni.
sui mezzi Hiss, l'Escherichia coli può formare gas. Sui terreni selettivi-differenziali le colonie assumono un colore corrispondente al colore del terreno.
sul terreno di Ploskirev - rispettivamente rosso con una sfumatura gialla o incolore.
su agar sangue (KA) può dare un'emolisi completa.
2.3 Proprietà biochimiche
L'E. coli produce numerosi enzimi saccarolitici, fermenta rapidamente il glucosio e altri carboidrati, molto spesso con formazione di acido e gas. Quasi tutti i biotipi di Escherichia coli fermentano costantemente manitolo, arabinosio, maltosio con formazione di acido; oltre il 90% dei ceppi - lattosio, sorbitolo; a intermittenza: saccarosio, raffinosio, ramnosio, xilosio, dulcite, salicina; di regola l'adonite e l'inositolo non fermentano. E.coli non utilizza citrato di ammonio, malonato di sodio, non cresce su terreno di cianuro di potassio, non riduce nitrati e nitriti, non scompone l'urea, non liquefa la gelatina, la maggior parte dei ceppi forma indolo e non rilascia H 2S. Escherichia coli dà una reazione positiva con metilrot e una reazione di Voges-Proskauer negativa: (Per impostare la reazione di Voges-Proskauer, 1 cm cubo di una soluzione alcolica al 6% di alfa-naftolo viene aggiunto a 2,5 cc di coltura batterica, e poi 0,4 cm cubi di una soluzione acquosa di KOH al 40%, agitare accuratamente la provetta e dopo 3-5 minuti tenere conto dei risultati. Se nella coltura è presente acetilmetilcarbinolo, diventa rosa - una reazione positiva, il colore giallo di la coltura indica una reazione negativa, in caso di reazione dubbia la coltura diventa arancione chiaro.). E. coli non sintetizza gli enzimi citocromo ossidasi e fenilalanina deaminasi, decarbossila lisina, ornitina e deidrolizza l'arginina in modo incoerente. Arrotolare il latte.
2.4 Struttura antigenica
Secondo le proprietà antigeniche e, soprattutto, tossinogeniche, esistono due varianti di E. coli:
Escherichia coli opportunista;
bacilli patogeni che causano diarrea.
E. coli contiene antigeni O, K e H. O (somatico): gli antigeni di E. coli sono associati al lipopolisaccaride (LPS) della parete cellulare. La specificità immunochimica dell'antigene O è determinata dalla composizione di esasaccaridi nelle unità ripetitive della sezione terminale della catena polisaccaridica, che è collegata all'altra estremità tramite 2-cheto-3-desossiottonato (KDO) al lipide A. Ad esempio, la struttura LPS di uno dei ceppi di Escherichia coli è presentata come segue:
Il numero di zuccheri nello stesso collegamento terminale, così come il numero di collegamenti determinanti nei diversi sierogruppi di Escherichia, non è lo stesso. La specificità degli antigeni O dell'Escherichia coli viene solitamente determinata nella reazione di agglutinazione con sieri agglutinanti O o OB su un vetrino, meno spesso con altri metodi.
Gli antigeni K sono antigeni di superficie associati alla capsula e all'LPS dell'Escherichia coli. Sono divisi in antigeni A, B e L, che differiscono tra loro per la sensibilità alle alte temperature e agli agenti chimici. La massima resistenza al calore (fino a 100°C per 2 ½ ora), alcol e 1 N. La soluzione HCl ha l'antigene A, l'antigene L meno stabile. Nella maggior parte degli Escherichia coli, gli antigeni K sono polisaccaridi acidi contenenti acidi uronici. Alcuni antigeni K contengono solo proteine. Gli E. coli con antigeni K non vengono agglutinati dal siero omologo di O-coli. Questa caratteristica è inerente alle culture viventi e si perde dopo che sono state bollite o sterilizzate in autoclave. La presenza di antigeni K viene stabilita anche nella reazione di adsorbimento delle agglutinine e negli studi immunoelettroforetici.
Gli antigeni H-flagellati o flagellari sono inerenti ai ceppi attivamente mobili. Sono associati alla proteina flagellina e determinano il tipo di specificità immunochimica dell'Escherichia coli. Gli antigeni H sono termolabili. Vengono completamente distrutti quando vengono bolliti per 2½ ore.
Nell'E. coli sono stati descritti circa 170 antigeni O, 97 antigeni K e 50 antigeni H. I ceppi di Escherichia coli dotati di ciglia contengono antigeni ciliati proteici. Si trovano nella reazione di emoagglutinazione.
Gli Escherichia coli vengono designati in base alle formule antigeniche: al primo posto viene messo il numero dell'antigene O, al secondo il numero dell'antigene K e al terzo l'antigene H. Il tipo di antigene K è indicato tra parentesi. Ad esempio, K(B) o K(L). I numeri degli antigeni O, K e H sono separati dai due punti. Secondo le formule antigeniche, viene stabilita l'appartenenza del ceppo studiato a un certo gruppo sierologico.
Le epidemie epizootiche di colibacillosi causano molto spesso ceppi patogeni di Escherichia dei seguenti sierogruppi:
nei vitelli - 08, 09, 015, 020, 026, 035, 078, 086, 0101, 0115, 0117, 0119, 0141, meno spesso 02, 033, 041, 055, 0103, 0127, 0137;
nei suinetti - 06, 026, 033, 0101, 0136, 0139, 0141, 0142, 0149, 0152, 0157;
negli agnelli - 04, 08, 09, 015, 020, 028, 035, 041, 078, 0101, 0137;
negli uccelli - 01, 02, 08, 015, 018, 026.055, 078, 0111, 0113, 0128, 0141.
2.5 Plasmidi
E. coli può contenere vari plasmidi: profago, fattore di fertilità, fattore colicinogenico, fattore di resistenza, fattore antigenico, fattore enterotossigeno e altri. I profagi possono causare cambiamenti nei singoli segni di Escherichia coli, ad esempio l'antigene O (lisogenia (dal greco l ý sis - decomposizione, decadimento e ... genia - origine, creazione), la capacità geneticamente determinata dei batteri di lisarsi con il rilascio di un batteriofago un numero di generazioni dopo l'infezione diretta con esso. La teoria della lisogenia fu sviluppata nel 1950 dagli scienziati francesi A. Lvov e A. Gutman, i quali dimostrarono che lo stato lisogenico è associato alla presenza di una struttura potenzialmente infettiva, il profago, nelle cellule batteriche. In ogni generazione di batteri lisogeni, una frazione molto piccola di cellule (~ 1 cellula per milione) subisce la lisi, con il rilascio di da 70 a 150 particelle del cosiddetto fago temperato. La frequenza della transizione del profago verso uno stato infettivo (induzione del profago) può essere aumentata da numerosi agenti (ad esempio, i raggi ultravioletti). Dopo l'infezione di una cellula batterica con un fago temperato, il processo di infezione può svilupparsi in due direzioni: lungo il percorso del ciclo litico, che, proprio come quando i batteri vengono infettati da fagi virulenti, termina con la lisi cellulare e il rilascio di progenie dei fagi nell'ambiente; lungo il percorso della lisogenizzazione, quando, a seguito di processi biosintetici nella cellula, si sviluppa l'immunità al fago infettante, il DNA del fago viene incluso nel DNA del batterio e successivamente si replica insieme ad esso come suo componente (profago), e il batterio sopravvive e diventa lisogenico. Il destino della cellula viene deciso nelle prime fasi dell'infezione e dipende principalmente dal momento della formazione dell'immunità. Se lo stato di immunità si instaura prima che lo sviluppo dell'infezione raggiunga lo stadio che porta irreversibilmente alla lisi, può verificarsi la lisogenizzazione. Il genoma dei batteri può contenere contemporaneamente profagi di diversi fagi diversi (sesso e lisogenia). In questo caso, la cellula è immune a tutti questi fagi. A seguito della lisogenizzazione, alcune proprietà della cellula batterica possono cambiare (la cosiddetta conversione lisogenica), a causa dell'acquisizione di nuove informazioni genetiche da parte del batterio. I batteri lisogeni ottenuti artificialmente non differiscono nelle loro proprietà dai batteri lisogeni presenti in condizioni naturali. In una piccola parte della progenie di una cellula lisogena si verifica la "guarigione": la perdita di un profago. Le cellule che hanno perso il profago danno origine a linee non lisogeniche. La frequenza di questo processo può essere aumentata, ad esempio, dall'azione dei raggi ultravioletti. Quindi, lisogenia. - una forma complessa di infezione virale nei batteri, in cui un gran numero di generazioni cellulari passa dal momento dell'infezione dei batteri da parte di un fago alla lisi cellulare).
I plasmidi F determinano la polarità sessuale e causano la formazione di ciglia sessuali (sex-pili). I plasmidi Col controllano la produzione di colicine, che inibiscono la crescita di batteri filogeneticamente correlati. I plasmidi R sono responsabili della resistenza dell'E. coli agli antibiotici. Il plasmide K88 controlla la sintesi dell'antigene con lo stesso nome e dei fili che determinano le proprietà adesive dell'Escherichia coli enteropatogeno ed enterotossigeno; I plasmidi possono essere di due tipi. Uno di questi determina la sintesi dell'enterotossina termolabile, l'altro dell'enterotossina termolabile e termostabile.
2.6 Formazione di tossine
E. coli produce un'endotossina associata all'LPS (lipopolisaccaride), che fa parte dell'antigene O. L'attività biologica dell'endotossina è espressa in modo diverso nei diversi sierogruppi di Escherichia coli. Le proprietà tossiche dell'endotossina sono determinate dall'intera molecola di LPS, poiché un lipide o un polisaccaride ha una bassa tossicità. L'endotossina colpisce il sistema di coagulazione del sangue, provoca il fenomeno di Schwartzman e altri fenomeni, ha proprietà pirogene, adiuvanti, protettive e mitogeniche. A piccole dosi stimola e a grandi dosi inibisce la reazione fagocitica.
Molti sierogruppi di E. coli producono endotossine. Si ritiene che alcuni sierogruppi di Escherichia coli causino diarrea simile al colera nell'uomo, altri solo negli animali (maiali, vitelli).
E. coli produce due tipi di enterotossine. L'enterotossina termostabile viene inattivata solo dopo bollitura per 30 minuti, dializzata lentamente attraverso cellophane, e rimane attiva a valori di pH acidi e dopo trattamento con trypsin e pronase. Peso molecolare 10 3-104. Non ha proprietà antigeniche. L'enterotossina termolabile viene inattivata dopo 30 minuti di riscaldamento a 60°C, pH 4,0-5,0, sotto l'azione della pronasi e non viene dializzata. La specificità antigenica delle enterotossine termolabili prodotte da diversi sierogruppi e colerogeno è la stessa. Stimolano l'attività dell'adenilato ciclasi e provocano l'accumulo di adenosina monofosfato ciclico (cAMP), che porta a una ridotta secrezione e allo sviluppo di diarrea acuta.
2.7 Resistenza
La resistenza di E. coli a fattori esterni è comune per i batteri asporogenici. Nell'ambiente esterno (acqua, suolo) sopravvive, a seconda delle condizioni specifiche, per diversi mesi. Riscaldato in sospensione muore a 55° dopo un'ora, a 60° - dopo 15 minuti, in soluzione di fenolo all'1% - dopo 10 minuti, in soluzione di cloruro mercurico 1:1000 - dopo 2 minuti. E. coli ha una sensibilità selettiva al verde brillante e ai sali dell'acido tetrationico. Questa è la base per l'uso di numerosi media selettivi. Molti ceppi di E. coli sono altamente sensibili alla monomicina, kanamicina, gentamicina.
2.8 Patogenicità
L'Escherichia coli - commensali dell'intestino crasso - può causare processi infiammatori purulenti negli organi e nei tessuti con una forte diminuzione della resistenza dell'organismo.
La virulenza dell'Escherichia coli si manifesta nell'adesività dell'Escherichia coli, cioè nell'adesione ai villi dell'epitelio intestinale, nella riproduzione nel lume dell'intestino tenue e crasso, nella penetrazione nelle cellule epiteliali e nella riproduzione intracellulare, nonché nella soppressione di l'attività fagocitaria dei macrofagi e dei leucociti polimorfonucleati. L'Escherichia coli - gli agenti causali della colienterite negli animali giovani e delle malattie simili al colera negli animali adulti - si moltiplicano sulla superficie delle cellule epiteliali intestinali. L'Escherichia coli - gli agenti causali di malattie simili alla dissenteria - penetrano nelle cellule epiteliali e si moltiplicano in esse. La manifestazione della virulenza di E. coli dipende dalla dose di batteri penetrati nell'intestino. La virulenza dell'Escherichia coli è determinata in colture di tessuti, esperimenti su animali da laboratorio nella riproduzione di colienterite sperimentale, polmonite e altri processi. La capacità di penetrazione viene stabilita mediante il test cheratocongiuntivale di Sheren introducendo una coltura di E. coli nella congiuntiva dell'occhio della cavia.
E.coli può causare danni significativi a un animale. I ceppi che vivono nell'intestino crasso e sono agenti patogeni opportunisti possono oltrepassare il tratto gastrointestinale e, con una diminuzione dell'immunità e il loro accumulo, possono causare varie malattie pioinfiammatorie non specifiche (cistite, colecistite, coli-sepsi e altre). Tali malattie sono chiamate escherichiosi parenterale.
I ceppi diarroici di E. coli che entrano nell'organismo dall'esterno possono causare epidemie di escherichiosi enterale (epidemica).
Molto spesso, gli animali appena nati soffrono di escherichiosi epidemica, in cui il sistema immunitario non si è ancora completamente formato; hanno solo IgG ottenute dalla madre attraverso la placenta (e le IgM proteggono dai batteri gram-negativi); l'acidità del succo gastrico è bassa; si sta appena formando la normale microflora.
Ma l’Escherichia diarroica può infettare gli animali più anziani, così come gli adulti. Inoltre, l'escherichiosi può procedere, ad esempio, secondo il tipo di colera (ceppi enterotossigeni), dissenteria (ceppi enteroinvasivi), colite emorragica (ceppi enteroemorragici). A volte l'Escherichia coli causa colisepsi, peritonite, endotossicità (shock settico). Inoltre, l'Escherichia coli può causare intossicazione alimentare.
2.9 Patogenesi
La particolarità di questa infezione sta nel fatto che l'insorgenza e lo sviluppo della malattia sono determinati dall'originalità delle reazioni protettive negli animali giovani e in misura molto minore dipendono dalle proprietà dell'agente microbico e dalla dose dell'infezione . Di grande importanza nella patogenesi dell'insorgenza della malattia sono i cambiamenti nell'attività enzimatica delle ghiandole del tratto gastrointestinale, la comparsa di disbatteriosi, una diminuzione delle proprietà antagoniste, enzimatiche e vitaminiche della microflora intestinale. La tossicosi nella colienterite è dovuta a una serie di ragioni. Insieme alla colitossina secreta dai tipi sierologici patogeni di Escherichia coli e dai prodotti di decomposizione dei corpi microbici, i prodotti tossici formati dal cibo vengono assorbiti dall'intestino a causa delle violazioni dei processi di digestione e della velocità del suo movimento nel lume intestinale. Questi prodotti tossici e antigeni dell'Escherichia coli colpiscono le terminazioni nervose e direttamente sui centri nervosi, sulle pareti dei vasi sanguigni e dei tessuti. Il secondo fattore che ha un enorme impatto sulle manifestazioni cliniche della tossicosi è un cambiamento nella massa del sangue circolante, causato da un forte spasmo delle arteriole con una significativa espansione dei capillari e delle piccole vene. Allo stesso tempo, a causa dell'espansione dei vasi della cavità addominale, si verifica una ridistribuzione della massa del sangue, la sua deposizione nella cavità addominale e la creazione di anemia nei vasi del cervello, della pelle e dei reni. L'aumento della permeabilità vascolare porta alla comparsa di edema tissutale dovuto al passaggio delle proteine e della parte liquida del sangue negli spazi intercellulari. L'aumento della coagulazione del sangue e il deterioramento della circolazione sanguigna sono facilitati anche da grandi perdite frequenti di acqua e di sali feci liquide, vomito, aumento dell'evaporazione dalla superficie della pelle, nonché con la respirazione. Tutto ciò porta a una violazione della circolazione sanguigna, a un deterioramento dell'apporto di ossigeno ai tessuti, a una diminuzione dell'attività cardiaca e a una diminuzione della formazione di urina.
L'aumento del livello di potassio in questi pazienti è a breve termine e viene rapidamente sostituito da una progressiva diminuzione del suo livello nel siero del sangue sullo sfondo di una maggiore perdita di potassio nelle urine e nelle feci.
Un certo ruolo nel quadro dello sviluppo della tossicosi è giocato da un calo quasi costante e prolungato della funzione della corteccia surrenale con una diminuzione della produzione e della secrezione di ormoni glucocorticoidi che regolano il tono vascolare, il metabolismo delle proteine e dei carboidrati e ripristinano le cellule danneggiate permeabilità.
2.10 Ecologia
Il serbatoio dell'Escherichia coli in natura è l'uomo, il cui colon animale è popolato da diversi biotipi di questo microbo.
Il numero di E. coli in 1 g di feci varia da diversi milioni a 1-3 miliardi di individui. Nel corso della vita si verificano molteplici cambiamenti di biovarianti di E. coli nell'intestino. Un certo ruolo in questo processo è giocato dalla dieta, dalle infezioni pregresse, dal trattamento con farmaci chemioterapici, dagli antibiotici e da altri fattori.
3. Diagnostica di laboratorio
Quando si riscontrano batteri tipici di E. coli per proprietà morfologiche, tintoriali e colturali, non si studiano le proprietà biochimiche, ma si esaminano immediatamente in RA su vetro con sieri agglutinanti antiadesivi, prima con il complesso, e poi a risultato positivo ottenuti con sieri monovalenti. Il risultato della reazione viene preso in considerazione entro un minuto. I controlli sono:
) coltura di prova + soluzione fisiologica;
) coltura + siero di coniglio normale diluito 1:10.
Le colture coltivate su MPA vengono testate con i sieri K 88, 987 P e A 20, le colture dal terreno di Mink - con i sieri K 99 e F41. Quando l'AR è positiva, le colture vengono classificate come agenti causali di escherichiosi e questo completa il loro ulteriore studio. In assenza di Escherichia con antigeni adesivi, la coltura viene identificata sulla base dello studio delle caratteristiche enzimatiche. L'E. coli è caratterizzato dalla scissione del glucosio e del lattosio con formazione di acido e gas, rilascio di indolo, assenza di ureasi e incapacità di utilizzare citrati.
Nelle colture identificate come E. coli, l'affiliazione al sierogruppo O viene stabilita come indicatore indiretto di patogenicità o la patogenicità viene studiata in un test biologico su topi bianchi e polli.
Il sierogruppo O dell'Escherichia è stabilito come segue. Colture coltivate su MPA smussata a 37 0C per 18-20 ore, lavato via con soluzione salina, trasferito in provette sterili asciutte, riscaldate a bagnomaria a 100 0Con 1 ora per distruggere gli antigeni L e B termolabili di superficie o autoclavare a 120°C per 2 ore per distruggere l'antigene A termostabile. La sospensione riscaldata di batteri viene centrifugata a 2000...3000 min -110...15 minuti e il sedimento viene utilizzato come antigene per fissare l'AR sul vetro. Il resto dell'antigene viene diluito con soluzione salina sterile ad una concentrazione cellulare di 5 108/ml e inserire il tubo RA.
La determinazione dell'affiliazione al sierogruppo delle colture inizia con l'impostazione dell'RA sul vetro con sieri polivalenti di gruppo: i sieri polivalenti vengono applicati goccia a goccia su vetro pulito e privo di grassi. La coltura precipitata mediante centrifugazione viene introdotta in ciascuna goccia mediante un'ansa e miscelata bene, il risultato viene preso in considerazione entro 3 minuti. Una reazione positiva è caratterizzata dalla formazione di agglutinato a grana fine e dalla limpidezza del liquido. Se il risultato è negativo, l'intera goccia rimane torbida.
Un antigene agglutinato da uno dei sieri del gruppo polivalente viene esaminato in RA su vetro con sieri monovalenti diluiti 1:10 e inclusi in questo siero polivalente. Quindi, con il siero monovalente che ha dato una reazione positiva, l'RA viene posto in provette in un volume di 1 ml. Il siero viene diluito con soluzione salina 1:25 al titolo indicato sull'etichetta: preparare innanzitutto la diluizione iniziale - aggiungere 0,1 ml di siero a 2,4 ml di soluzione salina, versare 0,5 ml di soluzione salina nelle restanti provette, trasferire 0 dalla soluzione salina iniziale diluire 0,5 ml della miscela nella seconda, mescolare, dalla seconda alla terza, ecc., dall'ultima provetta si prelevano 0,5 ml della miscela e dalla prima 1,5 ml. Aggiungere 0,5 ml di antigene a tutte le provette. Contemporaneamente vengono posti i controlli: 1) antigene + soluzione fisiologica (per escludere autoagglutinazione); 2) siero diluito 1:25 senza antigene (per evitare la flocculazione). Tutte le provette vengono agitate, mantenute in un termostato a 37 ° C per 16...18 ore e poi a temperatura ambiente - 6...8 ore.La reazione viene letta mediante un agglutinoscopio.
I risultati vengono presi in considerazione secondo il metodo generalmente accettato e sono indicati con croci (++++, +++, ++, +, -).
Per un metodo diagnostico accelerato e un aumento della frequenza dei risultati positivi, viene utilizzato il metodo degli anticorpi luminescenti, una modifica del metodo Koons e Chestnut (Coons, Kaplan, 1950). Lo striscio viene preparato direttamente dalle feci (diluite 5-10 volte con soluzione fisiologica), oppure dopo una crescita preliminare per 3-24 ore su terreno Endo o in brodo liquido. Dopo il trattamento con un siero fluorescente specifico, con un risultato positivo, nel preparato si rileva una brillante luminosità delle cellule batteriche se osservate al microscopio a fluorescenza.
4. Trattamento e prevenzione
Trattamento.Tutte le attività vengono svolte più o meno allo stesso modo della salmonellosi. Il siero contro l'Escherichia coli non è sempre efficace perché non sempre corrisponde al tipo di agente causale della colibacillosi. L'effetto più efficace è fornito dall'uso orale di clortetraciclina cloridrato (0,01-0,02 g ciascuno), ossitetraciclina (0,025 g ciascuno) o micerina (0,01 g per 1 kg di peso vivo).
Gli antibiotici sono ampiamente utilizzati per trattare gli animali malati (O. 3. Iskhakov et al., 1984):
Ampicillina, il farmaco viene somministrato per via orale, individualmente o in gruppo, 20 mg per kg di peso corporeo 3 volte al giorno;
Biovit. L'antibiotico viene prescritto con mangime, acqua, colostro 2 volte al giorno alla dose di 0,25 g per kg di peso vivo. Il corso di prevenzione dura 5-20 giorni;
Vitatetrina. A scopo terapeutico, somministrano individualmente 40 mg per kg di peso vivo con un intervallo di 12 ore.Il corso del trattamento dura 5-7 giorni;
Gentamicina. L'antibiotico viene somministrato per via intramuscolare alla dose di 1,5 mg per kg di peso vivo per 5-7 giorni;
Levomicetina. Assegnare per via orale 20 mg per 1 kg di peso vivo;
Mix-10. Somministrare con mangime alla dose di 3-4 kg per 1 tonnellata di mangime. Il corso del trattamento è di 7-10 giorni;
Noromandomixina. Dosi per vitelli 100 mg per 1 kg di peso vivo. L'antibiotico viene somministrato per via orale. Il corso del trattamento è di 7 giorni;
Orimicina. Viene somministrato per via intramuscolare, sottocutanea, intraperitoneale o per via endovenosa lenta alla dose di 4-30 mg per kg di peso animale 2 volte al giorno. Il volume della soluzione iniettata è 10-20 ml. Il corso del trattamento dura 5-7 giorni;
Polimixina M solfato. Somministrare all'interno 2-3 volte al giorno sotto forma di soluzione acquosa di 4 mg per kg di peso vivo;
Solvovetina. Si somministra per via intramuscolare dopo 12 ore alla dose di 0,15 ml per kg di peso vivo. Le iniezioni vengono ripetute per 5-7 giorni;
Spectam B. Spectam viene somministrato per via orale 20-30 minuti prima di bere il colostro. Dose: 40-60 mg per kg di peso vivo dell'animale 2 volte al giorno, 3 giorni consecutivi.
Oltre agli antibiotici, la colibacillosi mostra l'uso di farmaci sulfanilammidici: autoapiridazina, ftazina, sulfadimetossina, sulfamonometossina, enteroseptol, intestopan, mexaform, nevigrom, ecc. (R.M. Salimov, 1985; V.A. Fortushny, 1985; V.I. Prodanov, 1974; V. V. Mityushin, 1985; L. I. Gershkovich, 1966; V. A. Gumul et al., 1985). Recentemente sono stati proposti Lers e Startin per il trattamento dei vitelli affetti da colibacillosi, fornendo un effetto terapeutico fino all'88%. (N.I. Ovsyanov et al., 1984; I.D. Kolesnichenko et al., 1985).
Misure di controllo e prevenzione. Una volta stabilita la diagnosi, i vitelli malati vengono isolati e curati. I vitelli nati vengono alimentati con 80-100 ml di siero iperimmune e 10 ml di coliprotectan. Coliprotektan viene somministrato entro due giorni fino a 60 ml. Ogni giorno i rifiuti e il letame vengono rimossi dai locali. Il letame viene conservato in un luogo designato per la disinfezione biotermica. Anche le macchine o le gabbie nel dispensario dei vitelli vengono disinfettate quotidianamente. Disinfettare l'inventario, le grondaie del letame, i passaggi del letame.
Nella sezione in cui vengono tenuti i vitelli malati, lo spazio tra le gabbie di trasferimento viene allungato. Disinfettare l'aria interna. Il personale che lavora nella stalla dei vitelli è dotato di tute e calzature. Non è consentita la visita al dispensario e al ricovero dei vitelli da parte di persone non autorizzate. Il compito centrale della lotta alla colibacillosi è creare condizioni normali per l'alimentazione e l'allevamento delle mucche, nonché garantire l'allevamento degli animali giovani. A questo proposito, le mucche dovrebbero essere nutrite sulla base di diete biologicamente complete. Gli animali devono essere attivamente esercitati. L'organizzazione dell'esercizio attivo nelle mucche è un potente fattore che impedisce l'accumulo di plasmidi con patogenicità e resistenza ai farmaci.
Altrettanto importante nel sistema di prevenzione della diffusione dell'Escherichia patogena è la corretta organizzazione del parto e dell'allevamento dei vitelli appena nati. Per le mucche al parto, ogni azienda agricola è dotata di imbiancatura di maternità in due sezioni in ragione del 10-15% dei posti del numero totale di mucche. In ciascuna di queste sezioni vengono costruite diverse scatole. Prima del parto viene effettuata la toilette e la disinfezione della pelle della mucca. La scatola disinfettata è piena di biancheria da letto di buona qualità. Il parto è accettato su tela pulita. Nella prima ora dopo la nascita, per prevenire la colibacillosi, il vitello viene alimentato con 80-100 ml di siero iperimmune, poi colostro.
L'allevamento dei vitelli nati è organizzato in box. Per fare ciò, il dispensario è diviso in 4 sezioni isolate con ingressi separati, ventilazione autonoma e rete fognaria. In ogni sezione sono installate singole celle. Le sezioni vengono compilate in 3-4 giorni. Quando li si utilizza, si osserva il principio "tutto è vuoto - tutto è occupato". Vengono tenuti in gabbie individuali per 10 giorni, poi vengono trasferiti dal dispensario al mantenimento in gruppo. Cercano di garantire che i vitelli nell'allevamento siano collocati sezione per sezione in una o due gabbie di gruppo. Le celle e la sezione rilasciata nel dispensario sono sottoposte a pulizia e disinfezione meccanica. Dopodiché la sezione non viene occupata per cinque giorni, le viene concesso un “riposo biologico”.
Gli allevamenti effettuano una prevenzione specifica della colibacillosi. Per fare questo, le mucche e le giovenche in gravidanza profonda vengono vaccinate con idrossido di alluminio, vaccino formolo-tnomersale contro la colibacillosi di vitelli e agnelli. Le mucche e le manze vengono immunizzate 1,5-2 mesi prima del parto per via intramuscolare due volte con una pausa di 10-15 giorni. La vaccinazione delle mucche fornisce un'alta concentrazione di anticorpi nel colostro, che proteggono il vitello nato dall'influenza dell'Escherichia patogena. L'uso del vaccino nelle mucche riduce l'incidenza della colibacillosi nei vitelli di 1,5-3 volte, la mortalità di 5-10 volte (VV Kolchak, 1983).
Inoltre, per prevenire la malattia, per i vitelli è indicato l'uso del siero di sangue bovino prelevato nella stessa azienda agricola, nonché delle normali globuline, colifagi. Bere brodo di coltura acidofilo, il latte acidofilo ha un effetto positivo. Un buon effetto è l'uso di colibacterin, bifidumbacterin. Il bifidumbacterin viene prescritto 2-3 dosi 2-3 volte al giorno per 3-4 giorni G.V. Gnatenko et al (1983), si consiglia di trattare le vacche gravide con streptomicina. Il farmaco alla dose di 500 UI per 1 kg di peso vivo viene somministrato per via intramuscolare 2 volte al giorno per 3 giorni consecutivi. Secondo i loro dati, l'incidenza dei vitelli ottenuti da vacche trattate si riduce al 7,1%, senza alcun decesso. In assenza di tale trattamento, l'incidenza dei vitelli raggiunge l'80%, la mortalità fino al 61%.
Conclusione
E. coli, Escherichia coli: abbiamo sentito questo nome più di una volta nei servizi televisivi sulle epidemie degli ultimi anni in alcune città russe (Ivanovo, Smolensk, Chelyabinsk). Quando una persona che non ha familiarità con la microbiologia ascolta la radio o guarda storie simili in televisione, ha l'impressione che l'E. coli possa solo danneggiare l'uomo e che debba essere eliminato con tutti i mezzi possibili.
Ma se diamo uno sguardo più da vicino a questo microrganismo, vedremo che l'E. coli può apportare molti benefici all'umanità e che i suoi effetti dannosi possono essere significativamente limitati da adeguate misure sanitarie e igieniche e da un trattamento adeguato. È un oggetto molto conveniente per portare l'ingegneria genetica e altri studi progettati per aiutare in futuro nel trattamento di pazienti con varie malattie.
Nel nostro paese, questi studi non vengono condotti così attivamente come negli Stati Uniti, a causa della mancanza di fondi per tali lavori, ma se questo problema verrà superato nel prossimo futuro, gli scienziati russi avranno tutte le possibilità di scoprire gli ultimi metodi di trattamento associato all'uso di Escherichia coli (anche l'enorme entusiasmo degli scienziati nazionali, compreso l'interesse della moderna gioventù scientifica, gioca un ruolo significativo qui).
Elenco della letteratura usata
1.Borisov L.B. Escherichia coli enteropatogeni e loro fagi, L., 1976.
2. STB, pp. 366-368.
Gnatenko G.V., Tupia L.G. Rakitsky D.T. Esperienza nella lotta alla colibacillosi nei vitelli. - Medicina veterinaria, Kiev: "Harvest", 1983, n. 57
Gumul V.A., Afanasiev L.A., Maulanov A. 3. Clinica e trattamento della colibacillosi nei vitelli. - Bollettino di scienze agrarie del Kazakistan, 1985, n. 2.
Kaufman F. Una famiglia di batteri intestinali, trans. dall'inglese, M., 1959.
Kiryanov E.A. Microflora patogena dei ruminanti. - Nel libro: Lotta contro le malattie degli animali da allevamento in Transbaikalia e in Estremo Oriente. Sab. scientifico Atti dell'Istituto agricolo di Blagoveshchensk, Blagoveshchensk, 1974.
Kiryanov E.A. Malattie dei vitelli e loro prevenzione nelle fattorie collettive e statali del Primorsky Krai. - Vladivostok, 1977.
Kiryanov E.A., Sosnin M.F. Situazione epizootica e problemi delle mandrie di animali sani nella regione dell'Amur. - Aumento della produttività degli animali da allevamento in Estremo Oriente. Sab. scientifico tr. Istituto Agrario Primorskij, n. 47, Ussurijsk, 1978.
Kiryanov E.A., Galiulina R.V. Prevenzione delle malattie dei giovani animali da allevamento. - Vladivostok, 1979.
Kiryanov E.A., Tyutrin I.F. Cenni sulla patologia infettiva degli animali da allevamento. - Riproduzione della mandria e assistenza sanitaria veterinaria nelle condizioni di allevamento intensivo di animali in Estremo Oriente. Sab. scientifico tr. Istituto agricolo Primorsky, Ussurijsk, 1981.
Kolchak V.V. Colibacillosi dei vitelli e misure per combatterla negli allevamenti della regione dell'Amur (metodo, raccomandazioni). - Novosibirsk: SO VASKhNIL, 1983,
Kolyakov I - E-, Gitelson S. S., Kavruk L.S. colibacillosi nei vitelli. - M: "Spike", 1970.
Luria S., Darnell J., Virologia generale, trad. dall'inglese, M., 1970; Ravin VK, Lysogenia, M., 1971.
Microbiologia medica, virologia e immunologia, ed. LIBBRE. Borisov e A.M. Smirnova, pag. 269-273, M., Medicina, 1994.
Enciclopedia medica, pagina 252.
Metodi di ricerca sanitaria e microbiologica di oggetti ambientali, ed. GI Sidorenko, M., 1978.
Microbiologia e immunologia, ed. AA. Vorobyova, pag. 289-293, M., Medicina, 1999.
Minkevich I.E. Batteri del gruppo Escherichia coli come microrganismi indicativi sanitari, L., 1949.
Mozzhukhin Yu.P. Sull'epizootologia della colibacillosi nei vitelli e nei suinetti nella regione dell'Amur. - Nel libro: Materiali del XIX convegno scientifico. Blagoveshchensk, 1971
Ovsyanov N.I., Ovladeva M.A., Naumova K.N. Farmaco Lers per la diarrea del vitello. - Terra siberiana, Estremo Oriente, 1984, n. 2
Infezioni intestinali acute, ed. TV. Peradze, pag. 73, L., 1973.
Pozdeev OK Microbiologia medica, pag. 351-357, M., Geotar-med, 2002.
Prodanov V.I. Materiali per lo studio delle malattie gastrointestinali dei vitelli neonati. - Nel libro: Prevenzione e cura delle malattie dei giovani animali da allevamento. Mosca: Kolos, 1974
Salimov R.M. Farmaci per il colibac-
teriosi. - Siberiano, Estremo Oriente, 1985. Tabachnik A.L., Girshovich E.S., Temper R.M. E.coli enterotossigenico, Zhurn. micr., epid. e immuno., n. 3, pag. 31, 1977.
Fortushny V.A. Sulfagina per la colibacillosi nei vitelli. - Veterinario, 1985, n. 9
Tutoraggio
Hai bisogno di aiuto per imparare un argomento?
I nostri esperti ti consiglieranno o forniranno servizi di tutoraggio su argomenti di tuo interesse.
Presentare una domanda indicando subito l'argomento per conoscere la possibilità di ottenere una consulenza.
L'Escherichia coli (E.coli) è un batterio Gram-negativo, a forma di bastoncino, che si trova comunemente nella parte inferiore dell'intestino degli organismi a sangue caldo (endotermici). La maggior parte dei ceppi di E. coli sono innocui, ma alcuni sierotipi sono patogeni e possono causare gravi intossicazioni alimentari negli esseri umani e la loro presenza nei prodotti può persino comportare il ritiro dei prodotti dal mercato. I ceppi innocui fanno parte della normale flora intestinale e possono essere benefici per l’organismo producendo vitamina K2 e prevenendo la produzione di batteri patogeni nell’intestino.
introduzione
L'Escherichia coli e i batteri correlati costituiscono circa lo 0,1% della flora intestinale e la via di trasmissione oro-fecale è la via principale attraverso la quale i ceppi patogeni del batterio causano la malattia. Le cellule sono in grado di sopravvivere fuori dal corpo per un periodo di tempo limitato, rendendole organismi indicatori ideali per testare campioni ambientali per la contaminazione fecale. Il batterio può anche essere coltivato facilmente ed economicamente in laboratorio ed è stato studiato intensamente per oltre 60 anni. E. coli è l'organismo modello procariotico più ampiamente studiato e una specie importante nei campi della biotecnologia e della microbiologia, dove funge da organismo ospite per gran parte del lavoro del DNA ricombinante. Il pediatra e batteriologo tedesco Theodor Escherich scoprì l'E. coli nel 1885, ed è ora classificato come parte della famiglia delle Enterobacteriaceae gamma-proteobacterium.
Sierotipi
I ceppi patogeni di E. coli possono essere classificati in base agli elementi che possono suscitare una risposta immunitaria negli animali, come segue: Antigene O: parte dello strato lipopolisaccaridico Antigene K: capsula Antigene H: flagellina Ad esempio, il ceppo EDL933 di E. coli appartiene a il gruppo O157: H7 .
antigene O
La membrana esterna della cellula di E. coli contiene milioni di molecole di lipopolisaccaridi (LPS), che consistono in:
Antigene O, polimero di oligosaccaridi ripetitivi immunogenici (1-40 unità)
Regione principale degli oligosaccaridi fosforilati non ripetitivi
Lipide A (endotossina)
L'antigene O viene utilizzato per la sierotipizzazione di E. coli e queste designazioni dei gruppi O vanno da O1 a O181, ad eccezione di alcuni gruppi storicamente eliminati, vale a dire O31, O47, O72, O67, O93 (ora K84), O94 e O122; i gruppi da 174 a 181 sono preliminari (O174 = OX3 e O175 = OX7) o in fase di studio (da 176 a 181 - STEC/VTEC). Inoltre, esistono sottotipi per molti gruppi O (ad esempio O128ab e O128ac). Va notato, tuttavia, che gli anticorpi contro diversi antigeni O reagiscono in modo crociato con altri antigeni O e in parte con antigeni K non solo di E. coli, ma anche di altre specie batteriche di Escherichia e delle specie Enterobacteriaceae. L'antigene O è codificato dal cluster di geni rfb. Il gene del ruolo (cld) codifica per un regolatore della lunghezza della catena O del lipopolisaccaride.
Antigene K
Il polisaccaride capsulare acido (ACP) è uno strato polisaccaridico spesso e mucillaginoso che circonda alcuni agenti patogeni di E. coli. Esistono due gruppi separati di gruppi dell'antigene K, chiamati gruppo I e gruppo II (mentre un piccolo gruppo intermedio (K3, K10 e K54/K96) è stato classificato come gruppo III). Il primo gruppo (I) è costituito da polisaccaridi capsulari (grandi) da 100 kDa, mentre il secondo (II) è associato a malattie extraintestinali ed è inferiore a 50 kDa. Gli antigeni del gruppo IK si trovano solo con alcuni antigeni O (gruppi O8, O9, O20 e O101), sono ulteriormente suddivisi in base all'assenza (IA, simile nella struttura alle specie Klebsiella) o alla presenza (IB) di aminozuccheri e alcuni antigeni K del gruppo I sono attaccati al nucleo lipidico A del lipopolisaccaride (KLPS), in modo simile agli antigeni O (e, essendo strutturalmente identici agli antigeni O, sono in alcuni casi considerati antigeni K solo quando co-espressi con un altro vero antigene O). Gli antigeni K del gruppo II assomigliano a quelli dei batteri Gram-positivi e variano notevolmente nella composizione e sono ulteriormente suddivisi in base ai loro componenti acidi. Di norma, il 20-50% delle catene CPS sono associate ai fosfolipidi. In totale sono stati riconosciuti 60 diversi antigeni K (K1, K2A/AC, K3, K4, K5, K6, K7 (= K56), K8, K9 (= O104), K10, K11, K12 (K82 ) , K13 (= K20 e = K23), K14, K15, K16, K18a, K18ab (= K22), K19, K24, K26, K27, K28, K29, K30, K31, K34, K37, K39, K40, K41 , K42, K43, K44, K45, K46, K47, K49 (o46), K50, K51, K52, K53, K54 (= K96), K55, K74, K84, K85ab/acro (= O141), K87 (= O32 ) , K92, K93, K95, K97, K98, K100, K101, K102, K103, KX104, KX105 e KX106).
Antigene H
L'antigene H è il principale componente flagellare coinvolto nel movimento di E. coli. Di solito è codificato dal gene FLIC. Sono stati identificati 53 antigeni H, numerati da H1 a H56 (H13 e H22 non erano antigeni di E. coli ma appartengono al gruppo Citrobacter freundii e H50 è risultato essere uguale a H10).
Ruolo nello sviluppo delle malattie
Negli esseri umani e negli animali domestici, i ceppi virulenti di E. coli possono causare varie malattie. Nell'uomo: gastroenterite, infezioni del tratto urinario e meningite neonatale. Più raramente, i ceppi virulenti possono anche causare sindrome emolitico uremica, peritonite, mastite, setticemia e polmonite da batteri Gram-negativi.
Infezioni gastrointestinali
Ogni singolo batterio è un cilindro arrotondato. Alcuni ceppi di E. coli, come O157:H7, O104:H4, O121, O26, O103, O111, O145 e O104:H21, producono tossine potenzialmente letali. L'intossicazione alimentare da E. coli può essere causata dal consumo di verdure non lavate o di carne tagliata male e poco cotta. O157: H7 è noto anche per causare complicazioni gravi e persino pericolose per la vita, come la sindrome emolitica uremica. Questo ceppo è associato alle epidemie di E. coli del 2006 negli Stati Uniti dovute agli spinaci freschi. O104: Il ceppo H4 è altrettanto virulento. Contro di essa non sono altrettanto sviluppati trattamenti antibiotici e protocolli terapeutici di supporto (può essere molto enteroemorragico, come O157:H7, causando diarrea sanguinolenta, ma anche più enteroaggregante, cioè aderisce bene e aderisce alle membrane intestinali). Questo ceppo è responsabile dell’epidemia mortale di E. coli in Europa nel giugno 2011. La gravità della malattia varia notevolmente; può essere fatale, soprattutto nei bambini piccoli, negli anziani o nei soggetti immunocompromessi, ma più spesso è più lieve. In precedenza, nel 1996, la scarsa igiene nella preparazione della carne in Scozia aveva causato la morte di sette persone per avvelenamento da E. coli e centinaia di persone infette. E. coli può ospitare enterotossine sia resistenti al calore che termolabili. Queste ultime, chiamate LT, contengono una subunità A e cinque subunità B situate in una singola olotossina e sono molto simili per struttura e funzione alle tossine del colera. Le subunità B facilitano l'attacco e l'ingresso della tossina nelle cellule ospiti intestinali, mentre la subunità A viene degradata e impedisce alle cellule di assorbire acqua, causando diarrea. LT viene secreto durante la via di secrezione di tipo 2. Se l’E. coli fuoriesce dal tratto gastrointestinale attraverso una perforazione (ad esempio, da un’ulcera, da un’appendice rotta o a causa di un errore chirurgico) ed entra nell’addome, solitamente causa una peritonite, che può essere fatale se non trattata. Tuttavia, l'E. coli è estremamente sensibile agli antibiotici come la streptomicina o la gentamicina. Studi recenti suggeriscono che il trattamento antibiotico dell'E. coli enteropatogeno potrebbe non migliorare l'esito della malattia, poiché potrebbe aumentare significativamente la probabilità di sviluppare la sindrome emolitico-uremica. E. coli nella mucosa intestinale si osserva in numero maggiore nelle malattie infiammatorie intestinali, nel morbo di Crohn e nella colite ulcerosa. Un numero elevato di ceppi invasivi di E. coli è presente in gran numero nel tessuto infiammato e il numero di batteri nelle aree infiammate è correlato alla gravità dell'infiammazione intestinale. Le infezioni gastrointestinali possono portare allo sviluppo di cellule T della memoria, che attaccano i microbi intestinali nel tratto intestinale. L’intossicazione alimentare può innescare una risposta immunitaria ai batteri microbici intestinali. Alcuni ricercatori suggeriscono che ciò potrebbe portare a malattie infiammatorie intestinali.
Virulenza
L'E. coli (EC) è classificato in base alle caratteristiche sierologiche e alle proprietà di virulenza. I virotipi includono: Escherichia coli enterotossigena(ETEC) è l'agente eziologico della diarrea (senza febbre) nell'uomo, nei suini, nelle pecore, nelle capre, nei bovini, nei cani e nei cavalli. L'ETEC utilizza adesine fimbriali (proiezioni dalla superficie cellulare batterica) per legare le cellule enterocitarie nell'intestino tenue. L'ETEC può produrre due enterotossine proteiche: la più grande delle due proteine, l'enterotossina LT, è simile per struttura e funzione alla tossina del colera. Una proteina più piccola, l’enterotossina ST, provoca l’accumulo di cGMP nelle cellule bersaglio e la successiva secrezione di liquidi ed elettroliti nel lume intestinale. I ceppi ETEC non sono invasivi e non lasciano il lume intestinale. L'ETEC è la principale causa batterica di diarrea nei bambini nei paesi in via di sviluppo e anche la causa più comune di diarrea del viaggiatore. Ogni anno l’ETEC causa oltre 200 milioni di casi di diarrea e 380.000 decessi, soprattutto tra i bambini dei paesi in via di sviluppo. Escherichia coli enteropatogeno (EPEC)è l'agente eziologico della diarrea nell'uomo, nei conigli, nei cani, nei gatti e nei cavalli. Come l'ETEC, anche l'EPEC causa diarrea, ma i meccanismi molecolari della colonizzazione e dell'eziologia sono diversi. L'EPEC non ha le tossine ST e LT, ma utilizza un'adesina nota come intimina per legare le cellule intestinali dell'ospite. Questa virulenza ha molti fattori di virulenza simili a Shigella e può contenere la tossina Shiga. Il legame con la mucosa intestinale provoca un riarrangiamento dell'actina nella cellula ospite, portando a deformità significative. Le cellule EPEC sono moderatamente invasive (cioè invadono le cellule ospiti) e provocano una risposta infiammatoria. I cambiamenti nell'ultrastruttura delle cellule intestinali dovuti al "legamento e appiattimento" sono molto probabilmente la principale causa di diarrea nei soggetti affetti da EPEC. Escherichia coli enteroinvasivo (EIEC) riscontrabile solo negli esseri umani. L'infezione da EIEC provoca una sindrome identica alla dissenteria, con diarrea profusa e febbre alta. E. coli enteroemorragico (EHEC) trovato negli esseri umani, nei bovini e nelle capre. Il membro più famigerato di questo virotipo è il ceppo O157:H7, che provoca diarrea sanguinolenta senza febbre. L’EHEC può causare la sindrome emolitica uremica e la sindrome da insufficienza renale improvvisa. Utilizza fimbrie batteriche per l'adesione (il comune E. coli pilus, ECP), è moderatamente invasivo e contiene una tossina Shiga codificata dai fagi che può indurre un'intensa risposta infiammatoria. Enteroaggregante E. coli (EAEU) si trova solo nel corpo umano, così chiamato perché ha pili che aggregano cellule di coltura di tessuti. Gli EAEC si legano alla mucosa intestinale, provocando diarrea acquosa senza febbre. Gli EAEC non sono invasivi. Producono emolisina ed enterotossina ST, simili all'ETEC. E. coli adesivo-invasivo (AIEC) trovato nel corpo umano. Gli AIEC sono in grado di invadere le cellule epiteliali intestinali e moltiplicarsi a livello intracellulare. È probabile che gli AIEC siano in grado di proliferare in modo più efficiente negli organismi con un’immunità innata difettosa. Sono associati alla mucosa intestinale nella malattia di Crohn.
Epidemiologia delle infezioni gastrointestinali
La trasmissione dell'E. coli patogeno avviene spesso per via oro-fecale. Le vie di trasmissione comuni includono: Preparazione del cibo poco igienica, inquinamento del letame agricolo, irrigazione delle colture con acqua contaminata o sporca proveniente da liquami grezzi, presenza di maiali selvatici su terreni arabili o consumo diretto di acque reflue contaminate. I latticini e i bovini sono i principali serbatoi di E. coli O157:H7 e possono trasportarlo in modo asintomatico e diffonderlo attraverso le feci. Gli alimenti associati alle epidemie di E. coli includono cetrioli, carne macinata cruda, germogli di semi crudi o spinaci, latte crudo, succhi non pastorizzati, formaggio non pastorizzato e alimenti contaminati da operatori alimentari infetti attraverso la via oro-fecale. Secondo la Food and Drug Administration statunitense, il ciclo di trasmissione fecale-orale può essere interrotto da un’adeguata preparazione del cibo, dalla prevenzione della contaminazione incrociata, dall’uso di barriere come guanti per gli operatori alimentari, dalla politica sanitaria pubblica, dall’assistenza medica richiesta dai lavoratori del settore alimentare se sono malati, pastorizzazione di succhi o latticini e requisiti adeguati di lavaggio delle mani. L'E. coli produttore della tossina Shiga (STEC), in particolare il sierotipo O157:H7, è stato trasmesso anche attraverso le mosche, nonché attraverso il contatto diretto con animali da fattoria, animali di mini zoo e particelle sospese nell'aria nell'ambiente di contenimento degli animali.
Infezioni del tratto urinario
Gli Escherichia coli uropatogeni (UPEC) sono responsabili di circa il 90% delle infezioni del tratto urinario (UTI) osservate in persone con anatomia normale. Nelle infezioni ascendenti, i batteri fecali colonizzano l’uretra e si diffondono dal tratto urinario alla vescica, nonché ai reni (causando pielonefrite) o alla prostata negli uomini. Poiché le donne hanno un’uretra più corta rispetto agli uomini, hanno 14 volte più probabilità di soffrire di IVU ascendenti. L'Escherichia coli uropatogeno utilizza le fimbrie P (pili associati alla pielonefrite) per legare le cellule uroteliali del tratto urinario e colonizzare la vescica. Queste adesine legano specificamente i frammenti D-galattosio-D-galattosio sull'antigene P dei gruppi sanguigni degli eritrociti e delle cellule uroepiteliali. Circa l'1% della popolazione mondiale è carente di questo recettore e la sua presenza o assenza media rispettivamente la suscettibilità o la non suscettibilità di un individuo alle infezioni del tratto urinario da E. coli. L'Escherichia coli uropatogeno produce alfa e beta emolisina, che causano la lisi delle cellule del tratto urinario. Un altro fattore di virulenza comunemente presente nell'UPEC è la famiglia delle adesine Dr, che sono particolarmente associate alla cistite e alla pielonefrite associata alla gravidanza. Le adesine Dr legano l'antigene del gruppo sanguigno Dr (DRA), che è presente sul fattore di accelerazione del decadimento (DAF) sugli eritrociti e su altri tipi di cellule. Lì, le adesine Dr inducono lo sviluppo di lunghe estensioni cellulari che avvolgono i batteri, accompagnato dall'attivazione di diverse cascate di segnalazione, inclusa l'attivazione della PI-3-chinasi. L'UPEC può bypassare le difese immunitarie innate dell'organismo (ad esempio, il sistema del complemento) invadendo le cellule superficiali per formare comunità batteriche intracellulari (ICB). Inoltre, hanno la capacità di formare antigeni K, polisaccaridi capsulari che promuovono la formazione di biofilm. Gli E. coli produttori di biofilm non sono raggiungibili dai fattori immunitari e dalla terapia antibiotica e spesso contribuiscono allo sviluppo di infezioni croniche del tratto urinario. Le infezioni da E. coli che producono l'antigene K si verificano solitamente nel tratto urinario superiore. Le infezioni discendenti si verificano, anche se relativamente raramente, quando le cellule di E. coli entrano negli organi del tratto urinario superiore (reni, vescica o ureteri) dal flusso sanguigno.
Meningite neonatale (NMEC)
Prodotto da un sierotipo di Escherichia coli che contiene un antigene capsulare chiamato K1. La colonizzazione dell'intestino neonatale con questi ceppi, presenti nella vagina della madre, porta alla batteriemia, che a sua volta porta alla meningite. E a causa dell'assenza di anticorpi IgM della madre (non attraversano la placenta perché FcRn media solo la trasmissione di IgG), inoltre, vale la pena considerare anche il fatto che l'organismo riconosce l'antigene K1 come parte di se stesso, poiché assomiglia ai glicopeptidi cerebrali e porta allo sviluppo di un grave grado di meningite nei neonati.
Ruolo nello sviluppo del cancro o nell’invecchiamento cellulare
Esistono alcuni ceppi di E. coli che contengono un'isola genomica di polichetide sintasi (PKS) la cui funzione è quella di codificare un meccanismo multienzimatico che produce una sostanza genotossica chiamata colibactina. La colibactina può causare l’invecchiamento cellulare o il cancro danneggiando il DNA. Tuttavia, la barriera mucosa impedisce all'E. coli di raggiungere la superficie degli enterociti. Solo quando si sviluppano alcune lesioni infiammatorie con l'infezione da E. coli il batterio è in grado di iniettare la colibactina negli enterociti, provocando lo sviluppo del tumore.
malattie degli animali
Negli animali, ceppi virulenti di E. coli causano varie malattie, tra le altre: setticemia e diarrea nei vitelli neonati, mastite acuta nelle mucche da latte, la colibacillosi è anche associata a malattie respiratorie croniche con micoplasma, causando periepatite, pericardite, polmoni settici, peritonite, ecc. d. nel pollame e l'Alabama marcisce nei cani. La maggior parte dei sierotipi isolati dal pollame sono patogeni solo per gli uccelli. Pertanto, le fonti aviari di E. coli non sembrano essere importanti fonti di infezioni in altri animali.
Diagnostica di laboratorio
Nei campioni di feci, la microscopia mostrerà bastoncini Gram-negativi, senza una disposizione specifica delle cellule. Successivamente, l'agar MacConkey o l'agar EMB (o entrambi) vengono piastrati nelle feci. Sull'agar MacConkey si formano colonie rosso scuro perché il microrganismo è lattosio positivo e la fermentazione di questo zucchero farà abbassare il pH medio risultando in un terreno più scuro. La crescita su agar EMB produce colonie nere con una lucentezza metallica nero-verdastra. Questo serve per diagnosticare l'E. coli. L'organismo è anche lisina positivo e cresce su TSI con un profilo (A/A/g+/H2S-). Inoltre, IMViC (+ + - -) per E. coli; perché è indolo positivo (anello rosso) e rosso metile positivo (rosso brillante), ma VP negativo (nessun cambiamento - incolore) e citrato negativo (nessun cambiamento - verde). I test per la tossina possono utilizzare cellule di mammifero in coltura tissutale, che vengono rapidamente uccise dalla tossina Shiga. Sebbene questo metodo sia sensibile e molto specifico, è lento e costoso. Tipicamente, la diagnosi viene effettuata mediante coltura in terreno di sorbitolo MacConkey e quindi mediante tipizzazione dell'antisiero. Tuttavia, le analisi al lattice e alcune tipizzazioni dell'antisiero hanno ora mostrato reazioni crociate con colonie non-E. coli O157. Inoltre, non tutti i ceppi di E. coli O157 associati alla SEU non fermentano il sorbitolo. Il Consiglio di Stato e gli epidemiologi territoriali raccomandano che i laboratori clinici controllino almeno tutte le feci con sangue per individuare la presenza di questo agente patogeno. I Centri statunitensi per il controllo e la prevenzione delle malattie raccomandano: "Tutte le feci inviate per i test di routine in pazienti con diarrea acuta acquisita in comunità (indipendentemente dall'età, dalla stagione o dalla presenza o assenza di sangue nelle feci) devono essere simultaneamente coltivate per E. coli O157: H7 (O157 STEC) ed eseguire il test con un test che rileva le tossine Shiga per rilevare STEC non-O157."
Terapia antibatterica e resistenza
Le infezioni batteriche vengono solitamente trattate con antibiotici. Tuttavia, la sensibilità agli antibiotici varia tra i ceppi di E. coli. Essendo un organismo Gram-negativo, l’E. coli è resistente a molti antibiotici efficaci contro gli organismi Gram-positivi. Gli antibiotici che possono essere usati per trattare l'infezione da E. coli includono l'amoxicillina e altre penicilline semisintetiche, molte cefalosporine, carbapenemi, aztreonam, trimetoprim-sulfametossazolo, ciprofloxacina, nitrofurantoina e aminoglicosidi. La resistenza agli antibiotici è un problema crescente. Ciò è dovuto in parte all’uso eccessivo di antibiotici, ma in parte è probabilmente dovuto all’uso degli antibiotici come promotori della crescita nei mangimi animali. Uno studio pubblicato sulla rivista Science nell'agosto 2007 ha rilevato che il tasso di mutazione adattativa nell'E. coli è "dell'ordine di 10-5 per genoma, per generazione, 1.000 volte superiore rispetto alle stime precedenti". Questa scoperta potrebbe avere implicazioni per lo studio e la gestione della resistenza agli antibiotici batterici. L’E. coli resistente agli antibiotici può anche trasferire i geni responsabili della resistenza agli antibiotici ad altri tipi di batteri, come lo Staphylococcus aureus, attraverso un processo chiamato trasferimento genico orizzontale. I batteri E. coli spesso trasportano diversi plasmidi resistenti ai farmaci e in condizioni di stress sono in grado di trasferire facilmente questi plasmidi ad altre specie. In effetti, l'E. coli è un membro frequente del biofilm, dove esistono molti tipi di batteri in stretta vicinanza l'uno all'altro. Questa miscelazione di specie consente ai ceppi di E. coli di accettare e trasferire plasmidi da e verso altri batteri. Pertanto, E. coli e altri enterobatteri sono importanti serbatoi di resistenza agli antibiotici traducibile.
Ceppi di beta-lattamasi
La resistenza agli antibiotici beta-lattamici è diventata un problema particolare negli ultimi decenni poiché i ceppi batterici che producono beta-lattamasi ad ampio spettro sono diventati più comuni. Questi enzimi beta-lattamasi rendono molte, se non tutte, le penicilline e le cefalosporine inefficaci come terapia. Gli E. coli produttori di beta-lattamasi a spettro esteso (E. coli ESBL) sono altamente resistenti a una serie di antibiotici e le infezioni causate da questi ceppi sono difficili da trattare. In molti casi, solo due antibiotici orali e un gruppo molto limitato di antibiotici endovenosi rimangono efficaci. Nel 2009, in India e Pakistan, è stato scoperto un gene sul batterio E. coli, chiamato gene della metallo-beta-lattamasi di Nuova Delhi (in breve NDM-1), che conferisce resistenza anche all’antibiotico carbapenemico somministrato per via endovenosa. La crescente preoccupazione per la prevalenza di questa forma di “superbatterio” nel Regno Unito ha portato alla richiesta di ulteriori monitoraggi e strategie per affrontare le infezioni e i decessi in tutto il Regno Unito. I test di sensibilità dovrebbero determinare il trattamento di tutte le infezioni per le quali il microrganismo può essere isolato per la coltura.
Terapia fagica
La terapia fagica, l'uso di virus che prendono di mira i batteri patogeni, è stata sviluppata negli ultimi 80 anni, principalmente nei paesi dell'ex Unione Sovietica, dove è stata utilizzata per prevenire la diarrea causata da E. coli. Attualmente, la terapia fagica per gli esseri umani è disponibile solo presso il centro di terapia fagica nella Repubblica di Georgia e in Polonia. Tuttavia, il 2 gennaio 2007, la FDA degli Stati Uniti ha dato l'approvazione a Omnilytics per il fago O157:H7 che uccide l'E. coli negli animali vivi destinati alla macellazione per il consumo umano. Il fago T4 delle Enterobacteriaceae, un fago ampiamente studiato, prende di mira l'E. coli.
Vaccinazione
I ricercatori stanno lavorando attivamente per sviluppare vaccini sicuri ed efficaci per ridurre le infezioni da E. coli in tutto il mondo. Nel marzo 2006, un vaccino che suscita una risposta immunitaria contro il polisaccaride specifico O157:H7 di E. coli coniugato con l'esotossina A ricombinante di Pseudomonas aeruginosa (O157-rEPA) è stato segnalato come sicuro nei bambini di età compresa tra due e cinque anni. Il lavoro precedente ha già indicato che è sicuro per gli adulti. Sono previsti studi clinici di fase III per testare l’efficacia su larga scala del trattamento. Nel 2006, Fort Dodge Animal Health (Wyeth) ha introdotto un vaccino efficace, vivo e attenuato per controllare l’aerocistite e la peritonite nei polli. Il vaccino è un vaccino avirulento geneticamente modificato che ha mostrato protezione contro O78 e ceppi non tipizzabili. Nel gennaio 2007, l'azienda biofarmaceutica canadese Bioniche ha annunciato lo sviluppo di un vaccino per il bestiame che riduce la quantità di O157:H7 nel letame di un fattore 1000, ovvero ucciderà circa 1000 batteri patogeni per grammo di letame. Nell'aprile 2009, un ricercatore della Michigan State University ha annunciato di aver sviluppato un vaccino funzionante per il ceppo di E. coli. Il dottor Mahdi Saeed, professore di epidemiologia e malattie infettive presso i Colleges of Veterinary and Human Medicine della Michigan State University, ha depositato un brevetto per la sua scoperta e ha contattato le aziende farmaceutiche per commercializzarla.
"Il corso dei fagi - Origini". Laboratorio di Cold Spring Harbor. 2006. Archiviata dall'originale il 16 settembre 2006. Estratto il 03-12-2007
E.COLI (ESCHERICHIA COLI)
coli (Escherichia coli, lat. escherichia coli; abbreviazione comune E. coli) è un tipo di batteri gram-negativi a forma di bastoncino che fa parte della normale microflora del tratto gastrointestinale umano.
Tipo di Escherichia coli (e. coli) è un membro del genere Escherichia (latino escherichia), la famiglia degli enterobatteri (latino enterobacteriaceae), l'ordine enterobatteri (lat. enterobacteriales), classe dei gamma-proteobatteri (lat. γ proteobatteri), tipo di proteobatteri (lat. proteobatteri), regno dei batteri.
Esistono un gran numero di varietà di E. coli (escherichia coli), inclusi più di 100 tipi patogeni (“enterovirulenti”), raggruppati in quattro classi: enteropatogeni, enterotossigeni, enteroinvasivi ed enteroemorragici. Non ci sono differenze morfologiche tra Escherichia patogena e non patogena.
Escherichia coli. informazioni generali
Escherichia coli (Escherichia coli) stabile nell'ambiente esterno, immagazzinato per lungo tempo nel suolo, nell'acqua, nelle feci. Tollerano bene l'essiccazione. Gli E. coli hanno la capacità di moltiplicarsi negli alimenti, soprattutto nel latte. Muoiono rapidamente se bolliti ed esposti a disinfettanti (cloro, formalina, fenolo, sublimato, idrossido di sodio, ecc.). Escherichia coli più stabile nell’ambiente rispetto ad altri enterobatteri. La luce solare diretta li uccide in pochi minuti, una temperatura di 60°C e una soluzione di acido carbolico all'1% entro 15 minuti.
Alcuni Escherichia coli hanno flagelli e sono mobili. Altri Escherichia coli sono privi di flagelli e della capacità di muoversi.
Escherichia coli nell'intestino e nelle feci umane
Il numero di Escherichia coli tra gli altri rappresentanti della microflora intestinale non supera l'1%, ma svolgono un ruolo importante nel funzionamento del tratto gastrointestinale. Gli Escherichia coli sono i principali concorrenti della microflora opportunistica in termini di colonizzazione dell'intestino. L'Escherichia coli preleva ossigeno dal lume intestinale, dannoso per i bifidobatteri e i lattobacilli benefici per l'uomo. E. coli produce una serie di vitamine necessarie per l'uomo: B1, B2, B3, B5, B6, B9, B12, K, partecipa al metabolismo del colesterolo, bilirubina, colina, bile e acidi grassi, influenza l'assorbimento del ferro e calcio.
Escherichia coli nell'intestino umano compaiono nei primi giorni dopo la nascita e persistono per tutta la vita ad un livello di 106-108 CFU/g del contenuto dell'intestino crasso. Nelle feci di una persona sana, l'Escherichia coli (tipico) viene rilevato nella quantità di 107-108 CFU / g, mentre il numero di Escherichia coli lattosio-negativi non deve superare 105 CFU / g e l'Escherichia coli emolitico dovrebbe essere assente .
Deviazioni dai valori indicati sono un segno di disbatteriosi:
- una diminuzione dell'Escherichia coli tipica a 105-106 CFU / g, o un aumento del contenuto dell'Escherichia tipica a 109-1010 CFU / g è definita come disturbo microbiologico di primo grado
- un aumento della concentrazione di Escherichia coli emolitico fino a 105-107 CFU/g è definito come disturbo microbiologico di secondo grado

Escherichiosi
Sierotipi patogeni di Escherichia coli può essere la causa dell'escherichiosi - varie malattie infettive che si verificano con intossicazione, febbre, solitamente con danni al tratto gastrointestinale, meno spesso - vie urinarie, vie biliari, altri organi o con lo sviluppo di sepsi. L'escherichiosi è più comune nei bambini piccoli. Il meccanismo di diffusione dell'escherichiosi del tratto gastrointestinale è fecale-orale. Molto spesso, l'infezione avviene attraverso cibo o acqua contaminati.
Escherichia coli enteropatogeno
Escherichia coli enteropatogeno spesso abbreviato in latino - ETEC. Le infezioni intestinali causate da ceppi enteropatogeni di Escherichia coli si sviluppano più spesso nell'intestino tenue nei bambini del primo anno di vita, compresi i neonati. La malattia è accompagnata da grave diarrea con feci acquose senza aggiunta di sangue, forte dolore all'addome e vomito. L'escherichia coli enteropatogena è una causa comune di diarrea negli ospedali di maternità. I ceppi ETEC sono la principale causa di diarrea acquosa acuta nei paesi in via di sviluppo, soprattutto durante la stagione calda e umida. Sia nei paesi sviluppati che in quelli in via di sviluppo, i ceppi di Escherichia coli enteropatogeni sono la causa più comune di diarrea del viaggiatore, che di solito si risolve senza trattamento.
Escherichia coli enterotossigena
Escherichia coli enterotossigena hanno la capacità di attaccarsi alle cellule epiteliali della mucosa dell'intestino tenue e produrre tossine che causano diarrea. Gli Escherichia coli enterotossigeni sono la principale causa di diarrea acuta nei bambini e negli adulti e la causa più comune della cosiddetta "diarrea del viaggiatore".
Escherichia coli enteroemorragica
Escherichia coli enteroemorragica (EHEC) sono la causa della colite emorragica, nonché di una malattia grave: la sindrome emolitica uremica (anemia emolitica microangiopatica associata a insufficienza renale; abbreviazione HUS o HUS).
La colite emorragica è caratterizzata da un esordio acuto sotto forma di forti dolori addominali crampiformi e diarrea acquosa, che presto diventa sanguinolenta. Di solito non c'è febbre, ma in alcuni la temperatura corporea può raggiungere i 39°C. Nei casi lievi, la colite emorragica dura 7-10 giorni. Circa il 5% dei casi di colite emorragica sono complicati da sindrome emorragica, insufficienza renale acuta e anemia emolitica.
La fonte dell'infezione nel maggio 2011 in Germania e in altri paesi europei era un ceppo di Escherichia coli enteroemorragico STEC produttore della tossina Shiga (sinonimo: produttore di verotossina - VTEC).
L'infezione da STEC o VTEC-E. coli avviene più spesso attraverso il cibo o attraverso il contatto ravvicinato con persone o animali malati. Una piccola quantità di Escherichia coli STEC/VTEC è sufficiente per avviare la malattia.
È stato stabilito che l'agente eziologico dell'infezione europea nel maggio 2011 è il sierogruppo E. coli O104 (sierotipo E. coli O104:H4), che ha nel suo genoma un gene responsabile della produzione della tossina di tipo 2 simile a Shiga.
I ceppi di E. coli O104:H4 isolati dai pazienti erano caratterizzati da resistenza agli antibiotici beta-lattamici dovuta alla produzione di beta-lattamasi ad ampio spettro, ma rimanevano sensibili al gruppo degli aminoglicosidi (gentamicina) e ai fluorochinoloni.
Dopo l'infezione da Escherichia coli enteroemorragico, il periodo di incubazione dura molto spesso da 48 a 72 ore, ma può variare da 1 a 10 giorni. I sintomi dell'infezione comprendono crampi addominali e diarrea, spesso con presenza di sangue. Possono verificarsi febbre e vomito. La maggior parte dei pazienti guarisce entro 10 giorni. A volte l’infezione può portare a condizioni pericolose per la vita come la sindrome emolitica uremica.
Escherichia coli enteroinvasiva
Escherichia coli enteroinvasiva spesso abbreviato in latino - EIEC. L'Escherichia coli enteroinvasivo causa malattie simili nella manifestazione alla dissenteria batterica (causata da Shigella). I ceppi EIEC sono simili ai ceppi Shigella sia dal punto di vista biochimico che sierologico. Come nel caso della Shigella, l'E. coli enteroinvasivo invade le cellule epiteliali del colon e vi si moltiplica. Il paziente ha dolore all'addome, abbondante diarrea acquosa mista a sangue.
Nei paesi in via di sviluppo, i ceppi di EIEC sono rari. Causano epidemie periodiche di infezioni di origine alimentare tra bambini e adulti. I sintomi della malattia hanno molto in comune con le manifestazioni della shigellosi. Presumibilmente contro l'EIEC sono efficaci gli stessi antibiotici che contro la Shigella, a condizione che il ceppo di questo ceppo rimanga in una zona particolare, ma l'efficacia della terapia non è mai stata valutata in studi controllati.
Escherichia coli - l'agente eziologico delle malattie degli organi genito-urinari
L'infezione da E. coli (così come da altri microbi uropatogeni che vivono nell'intestino) degli organi genito-urinari, soprattutto nelle donne, si verifica spesso direttamente dal tratto gastrointestinale con igiene insufficiente o pratiche sessuali specifiche.
Gli Escherichia coli sono la causa di:
- circa l’80% delle infezioni del tratto urinario acquisite in comunità
- Il 64% di tutte le malattie con prostatite acuta
- L'80% di tutte le prostatiti croniche
- per i pazienti di età superiore ai 35 anni - soprattutto epididimite (processo infiammatorio nell'epididimo), orchite (infiammazione dei testicoli) ed epididimo-orchite (infiammazione combinata del testicolo e dell'epididimo)
- Il 70-95% delle infezioni del tratto urinario raggiungono la vescica o i reni per via ascendente
- altre malattie delle vie urinarie.
Batteriuria - la presenza di batteri nelle urine può essere un segno di infiammazione delle vie urinarie, della vescica, dei reni. In assenza di sintomi, la vera batteriuria (infezione del tratto urinario) viene diagnosticata in presenza di almeno 105 corpi microbici di Escherichia coli (o altri enterobatteri) in 1 ml di urina appena emessa, altrimenti si presume che si sia verificata una contaminazione dell'urina durante la sua somministrazione. collezione. Se la batteriuria non è accompagnata da alcun sintomo, viene chiamata asintomatica. La batteriuria asintomatica non sempre richiede un trattamento immediato.
In presenza di sintomi o quando l'urina viene raccolta tramite catetere, la soglia diagnostica può essere significativamente ridotta. In particolare, in presenza di sintomi clinici (febbre, brividi, nausea, vomito, dolore alla regione lombare, disuria) e di rilascio di almeno 10 leucociti in 1 μl di urina, il criterio per la diagnosi di pielonefrite acuta è la presenza di almeno 104 Escherichia coli (o altri enterobatteri patogeni) in 1 ml di urina appena escreta. La cistite acuta viene diagnosticata in presenza di sintomi clinici appropriati, nell'isolamento di almeno 10 leucociti in 1 μl di urina e nella rilevazione di almeno 102 Escherichia coli (o altri batteri coliformi) in 1 ml di urina.
Ceppi di Escherichia coli: probiotici e componenti farmaceutici
L'Escherichia coli Nissle 1917 (DSM 6601) è considerato il probiotico più efficace nel contribuire a ridurre l'infiammazione e ritardare il prossimo attacco di colite ulcerosa.
Ceppi di Escherichia coli appositamente selezionati sono inclusi nella composizione dei farmaci: Hilak forte (ceppo DSM 4087), Bifikol (ceppo M-17), Colibacterin (ceppo M-17) e altri.
Antibiotici attivi contro l'Escherichia coli
Agenti antibatterici attivi contro l'Escherichia coli: amoxicillina, levofloxacina, nifuratel, nifuroxazide, rifaximina, furazolidone, ciprofloxacina.
SOSTANZA: l'invenzione riguarda la biotecnologia e riguarda l'ottenimento di produttori di preparati probiotici - preparati batterici a base di colture vive di microrganismi simbionti utilizzati per la prevenzione e il trattamento della disbatteriosi e di altri disturbi del tratto gastrointestinale. Un plasmide non coniugativo e non mobilizzabile p Сolap è stato introdotto nel ceppo Escherichia coli M17, produttore del preparato probiotico colibacterin, che trasporta i geni per la produzione della colicina E1 e il determinante della resistenza all'ampicillina a dosi fino a 150 mg /l. Il ceppo risultante è privo di un fenotipo adesivo indesiderato inattivando il gene dell'adesina fimH pili di tipo 1 integrando il gene della resistenza alla kanamicina - neomicina npt. Il ceppo E.coli M17 fim H::Kan/p Colap è stato depositato presso il VKPM con il numero B-7448, ciò consente di realizzare un preparato probiotico con ridotta capacità di colonizzare nicchie diverse da quella intestinale, con aumentata attività antagonista e residente in corso di terapia antibiotica. Le caratteristiche introdotte nel ceppo costruito sono stabilmente preservate nella popolazione. Ciò facilita la preparazione di una preparazione standard in base al ceppo e garantisce che quando la preparazione viene assunta da un paziente senza concomitante terapia antibiotica, non si verifichi l'eliminazione del plasmide. 4 illustrazioni, 1 tab.
La presente invenzione riguarda il settore delle biotecnologie e riguarda la creazione di un ceppo migliorato di Escherichia coli, utilizzabile per ottenere probiotici, preparati batterici a base di colture vive di microrganismi simbionti. I probiotici (altri nomi di farmaci in questo gruppo: normoflora, eubiotici, microbiotici) sono uno strumento efficace per la prevenzione e il trattamento della disbatteriosi intestinale. La disbatteriosi è un cambiamento pronunciato nelle specie e nel rapporto quantitativo dei microbi, che si manifesta nel rapido sviluppo di microrganismi opportunistici, in particolare batteri del gruppo intestinale (Enterobacteriaceae), ed è accompagnato da varie manifestazioni dolorose. Una causa importante di disbatteriosi è l'uso di antibiotici e altri antimicrobici [Krasnogolovets VN "Significato clinico della disbatteriosi intestinale derivante dall'uso di antibiotici". Nel libro. "L'uso del colibacterin per la prevenzione e il trattamento delle malattie intestinali e la tecnologia della sua produzione". M., 1967, pag. 223 - 243]. Attualmente in Russia sono noti preparati di probiotici "Colibacterin" e "Bifikol", ottenuti sulla base del ceppo Escherichia coli M17, che, in sostanza, è un derivato del ceppo E. coli isolato da A. Nissle e utilizzato per ottenere il farmaco "Mutaflor" (Germania) [Peretz L.G. "Colibacterin secco. Nuovi metodi di diagnostica, cura e prevenzione delle malattie intestinali". Nel libro. "Estratti delle relazioni al Plenum del Consiglio medico accademico del Ministero della sanità della RSFSR". M., 1961, pag. 52-54]. Tuttavia, a differenza del ceppo originale, il ceppo E. coli M17 ha perso la capacità di sintetizzare la colicina B e, quindi, ha ridotto la sua attività antagonista contro i batteri del gruppo intestinale [Shemchuk L.F. "Standardizzazione dei colibatteri", Ph.D. candidato in scienze biologiche, M., 1983, p. 16]. Un altro svantaggio del ceppo E. coli M17 e del suo predecessore è la presenza di un fenotipo di fimbrie Mn di tipo 1 altamente adesivo, che è insolito e indesiderabile per un ceppo intestinale. Tale fenotipo si trova spesso in ceppi isolati dal macroorganismo nelle infezioni del tratto urinario e nella polmonite nosocomiale [Sokurenko E.V., Chesnokova V.L. "Un metodo per modificare il fenotipo adesivo degli isolati selvatici di E. coli in applicazione a ceppi - produttori del farmaco colibatterino". Bollettino di Biologia e Medicina Sperimentale, 1997, Volume 124, N 9, p. 334 - 338]. Lo svantaggio del ceppo E. coli M17 è anche la sua sensibilità agli antibiotici. Pertanto, i preparati basati su di esso non possono essere efficaci durante l'assunzione di antibiotici. Nel frattempo, l'uso simultaneo di antibiotici e probiotici può prevenire lo sviluppo della disbatteriosi e quindi aumentare l'efficacia delle misure terapeutiche e ridurre la durata del trattamento. L'obiettivo dell'invenzione è creare un ceppo di E. coli - un derivato di E. coli M17, che consenta di eliminare gli svantaggi sopra menzionati del noto ceppo di E. coli M17, vale a dire: attività antagonista ridotta, fenotipo adesivo indesiderato, sensibilità agli antibiotici. Il risultato tecnico consiste nella costruzione di un ceppo con aumentata attività antagonista, ridotta capacità di colonizzare nicchie diverse da quelle intestinali primarie nel macroorganismo e con resistenza a dosi moderate di antibiotici penicillinici. Questo obiettivo viene raggiunto utilizzando metodi genetici e di ingegneria genetica per costruire un ceppo di E. coli M17 fimH::kan/pColap, che produce colicina E1, è resistente a concentrazioni moderate di ampicillina (fino a 150 UI/ml) e contiene un gene fimH inattivato, che codifica per l'adesione fimbriale. Il ceppo E. coli M17 fimH::kan/pColap è stato depositato nella Collezione tutta russa di microrganismi industriali con il numero di registrazione B-7448. Il design brevettato del ceppo si basa sulle seguenti disposizioni. Abbiamo dimostrato per la prima volta che l'inattivazione del gene dell'adesina fimH dei pili di tipo 1 nel genoma del ceppo M17 di Escherichia coli e l'introduzione di un plasmide pColap non coniugativo e non mobilizzabile che trasporta i geni per la produzione della colicina E1 e il determinante della resistenza all'ampicillina a dosi fino a 150 mg/l nel ceppo Escherichia coli M17 consente di creare un preparato probiotico con ridotta capacità di colonizzare nicchie diverse da quella intestinale, con aumentata attività antagonista e residente in presenza di antibiotici terapia. L'essenza della soluzione brevettata di ingegneria genetica è illustrata da disegni, dove:
Nella FIG. 1 mostra uno schema per ottenere un ceppo ricombinante di E. coli M17fimH::kan/pColap con un difetto nel gene dell'adesina fimH del pili di tipo 1,
Nella FIG. 2 - schema costruttivo del plasmide ibrido pColap,
Nella FIG. La Figura 3 mostra i risultati di uno studio sull'attività adesiva del ceppo di Escherichia coli costruito M17 fimH::kan/pColap,
Nella FIG. 4 - risultati degli studi di stabilità del ceppo costruito di Escherichia coli M17 fimH::kan/pColap. Dopo aver ricevuto il ceppo E. coli M17 fimH::kan/pColap come fonte è stato utilizzato l'analogo più vicino: il ceppo E. coli M17. Per eliminare l'adesina fimbriale, che conferisce un fenotipo Mn altamente adesivo indesiderato alle cellule M17 di E. coli, è stato ottenuto un ceppo ricombinante in cui il gene di resistenza alla kanamicina-neomicina npt è stato integrato nel gene cromosomico fimH che codifica l'adesina. A questo scopo è stato utilizzato il plasmide pCH103, un derivato del plasmide R6K, che ha un sistema di replicazione pir-dipendente e può essere mantenuto solo in ceppi contenenti il gene pir che ne assicura la replicazione [Sokurenko E.V., Chesnokova V.L. "Un metodo per modificare il fenotipo adesivo degli isolati selvatici di E. coli in applicazione a ceppi - produttori del farmaco colibatterino". Bollettino di Biologia e Medicina Sperimentale, 1997, Volume 124, N 9, p. 334 - 338]. Il plasmide pCH103 trasporta il gene di resistenza all'ampicillina e un frammento cromosomico contenente i geni del cluster fim, in cui l'integrità del gene fimH viene interrotta dall'inserimento del gene di resistenza alla kanamicina (neomicina) npt. Una volta trasformato in E. coli M17, non può essere mantenuto nelle cellule e possono formarsi trasformanti resistenti alla kanamicina quando è integrato nell'intero cromosoma come risultato di un singolo crossover o come risultato di un doppio crossover (Fig .1). I trasformanti della seconda classe rimangono sensibili all'ampicillina. Tra questi, è stato selezionato un ceppo denominato E. coli M17fimH::kan (o M17 fimH::npt). Lo studio condotto ha confermato l'assenza di adesione mannosio-sensibile nel ceppo ottenuto; FimH - fenotipo. Per aumentare l'attività antagonista del ceppo di E. coli M17 e renderlo resistente all'ampicillina basata sul plasmide ColE1 mediante metodi noti ["Metodi di genetica molecolare e ingegneria genetica", 1990, Novosibirsk, "Nauka", ramo siberiano, p. 7-10, 39-44] è stato costruito un plasmide ibrido pColap (FIG. 1). Il plasmide originale ColE1, isolato da un ceppo di E. coli non patogeno, è stato studiato in dettaglio. Ha una gamma piuttosto ristretta di ospiti (principalmente ceppi di Escherichia coli) ed è mantenuto stabilmente nelle cellule batteriche. Si conosce la sua sequenza nucleotidica completa, le funzioni di tutti i suoi elementi genetici e la regolazione della loro attività. Il plasmide determina la sintesi della colicina E1, che ha un effetto dannoso sulle cellule dei batteri correlati. Lo svantaggio del plasmide ColE1 è la sua capacità di mobilitarsi in altre cellule utilizzando plasmidi coniugativi, dovuta alla presenza della regione mob nella sua struttura. Utilizzando l'endonucleasi di restrizione BspLu11.1, questa regione è stata completamente rimossa e, allo stesso tempo, altri elementi genetici del plasmide non sono stati praticamente influenzati. Quindi, utilizzando l'endonucleasi di restrizione BspH1, un frammento contenente il gene b1a che codifica per la sintesi delle lattamasi è stato eliminato dal noto vettore pUC19 e legato con un frammento del plasmide ColE1 privo della regione mob. Il risultato è stato il plasmide pColap. Questo plasmide non è coniugativo e non mobilizzabile e quindi praticamente non può essere trasferito alle cellule di altri batteri. A differenza del vettore pUC19 e di altri plasmidi, pColap fornisce solo un livello moderato di resistenza all'ampicillina ai ceppi di E. coli che ha trasformato (Tabella 1). Un tale deterioramento nell'espressione del gene - lattamasi è osservato a causa di violazioni nella regione del promotore del gene (Gilbert box) e 5" - il sito che aumenta l'efficienza dell'espressione, che si è verificato a seguito di manipolazioni genetiche durante il costruzione del plasmide ricombinante pColap La sensibilità dei ceppi portatori di pColap a concentrazioni elevate Pertanto, se per qualche motivo la presenza di ceppi contenenti questo plasmide nell'intestino di un paziente diventa indesiderabile, o se, a seguito di qualche evento eccezionale, il Il plasmide viene trasferito ad un altro ceppo, quindi tutte le cellule che lo contengono possono essere eliminate. Il ceppo di E. coli M17 fimH::kan è stato trasformato con il plasmide pColap per produrre il ceppo di E. coli M17 fimH::kan/pColap. 1,5 - 2 micron di lunghezza. Segni culturali e fisiologici. Agar carne-peptone e brodo di agar Hotinger. Dopo 36 ore di crescita a 37°C si formano colonie rotonde biancastre traslucide con un diametro di 1,5 - 2,5 mm, la superficie delle colonie è liscia, i bordi sono regolari, la struttura è omogenea, la consistenza è pastosa, facilmente emulsionabile. Terreno minimo agarizzato M9 con glucosio (0,2%). Dopo 40 ore di crescita forma colonie di 1-2 mm di diametro, grigio-biancastre, traslucide, rotonde, convesse, con bordi lisci. Brodo di carne e peptone e brodo di Hotinger. Dopo 18-24 ore di crescita a 37°C si presenta una forte torbidità uniforme, un piccolo precipitato, un odore caratteristico. Terreno minimo liquido M9 con glucosio (0,2%). Dopo 20-24 ore di crescita con aerazione si osserva una forte torbidità uniforme, l'odore è debole o assente. Crescita mediante iniezione in agar carne-peptone. Buona crescita durante tutta l'iniezione. Il microrganismo è un anaerobio facoltativo. Relazione con la temperatura e il pH dell'ambiente. Cresce bene a temperature comprese tra 30 e 42 o C e ad un pH compreso tra 6,8 e 7,2. proprietà biochimiche. Assorbe bene glucosio, saccarosio, lattosio, fruttosio, mannosio, xilosio, mannitolo e sorbitolo con formazione di acido e gas. Ramnosio, galattosio e arabinosio - con debole formazione di acido; salicina - con formazione ritardata di acido e gas; raffinosio - solo con formazione di acido. L'inositolo non viene assorbito. L'idrogeno solforato non si forma; produce indolo. atteggiamento nei confronti degli antibiotici. Resistente all'ampicillina a concentrazioni nel mezzo fino a 150 mg/L. produzione di batteriocine. Produce la colicina E1. Contenuto di plasmidi. Le cellule contengono un plasmide multicopia non coniugativo e non mobilizzabile pColap (5239 bp), che determina la resistenza all'ampicillina e la sintesi della colicina E1. Il ceppo ha una formula antigenica O2:L1:H6 ed è agglutinato dal siero con un titolo sierico di almeno 1:64000. L'invenzione è illustrata da esempi che caratterizzano la resistenza all'ampicillina di ceppi che trasportano vari plasmidi, la stabilità dei loro tratti durante la coltivazione. Esempio 1. Studio della crescita del ceppo di E. coli M17 e dei suoi derivati contenenti plasmidi su terreni con diverse concentrazioni di ampicillina (Tabella 1). I ceppi studiati di Escherichia coli (tabella 1) sono stati coltivati per 18 ore in brodo Luria (LB - 10 g di triptone, 5 g di estratto di lievito, 5 g di NaCl per 1 litro di acqua distillata) a 37 o C con aerazione. Successivamente sono state preparate diluizioni seriali di colture batteriche fino a 10 -7 in soluzione salina e ciascuna coltura è stata seminata su piastre con LA (LB + 1,6% agar) contenente ampicillina alle seguenti concentrazioni (μg/ml): 5, 50, 75, 100 , 125, 150, 200, 250. La crescita delle colonie è stata valutata dopo 18-24 ore. I risultati sono presentati nella tabella 1. Come si può vedere dalla tabella 1, il ceppo originale di Escherichia coli M17 è altamente sensibile all'ampicillina. Il plasmide pUC19 contenuto nel ceppo M17/pUC19, che è stato la fonte del gene della lattamasi per il plasmide pColap da noi costruito, rende la cellula batterica resistente a concentrazioni di ampicillina fino a 2 g/l. Allo stesso tempo, il plasmide pColap contenuto nel ceppo M17 fimH::kan/pColap fornisce resistenza a concentrazioni di ampicillina non superiori a 150 mg/l. Pertanto, i ceppi risultanti hanno un livello moderato di resistenza all’ampicillina. Esempio 2. Studio delle proprietà adesive e determinazione del fenotipo adesivo del ceppo E. coli M17 e suoi derivati. Il fenotipo adesivo è stato determinato mediante il metodo standard dello "studio della crescita". Da una coltura fresca dei ceppi batterici studiati con una densità ottica di 1,0 ad una lunghezza d'onda di 540 nm è stata preparata una sospensione di cellule batteriche in soluzione salina fisiologica. Parallelamente, sono state preparate piastre per microtitolazione con pozzetti a fondo piatto con substrati immobilizzati nei pozzetti per l'adesione, vale a dire: MN (mannano di lievito), PH (RNasi B bovina) e BSA (albumina sierica bovina). Successivamente la sospensione batterica è stata posta nei pozzetti e incubata per 40 minuti. Le cellule batteriche non legate sono state lavate accuratamente con soluzione salina. Ai pozzetti è stato aggiunto un mezzo nutriente ricco e incubati con agitazione costante a 37 oC per 2,5 - 3 ore fino alla comparsa di torbidità nei pozzetti. La densità ottica in ciascun pozzetto è stata letta su un lettore automatico di micropiastre (Molecular Devices, Inc., Menlo Park, California, USA). In questo esperimento sono stati studiati i seguenti ceppi di E. coli: M17 - il ceppo originale; M17 fimH::kan - ceppo M17 con gene dell'adesina fimH inattivato: M17 fimH: : kan/pPKL91 - ceppo fimH::kan trasformato con il plasmide pPKL91 contenente il gene regolatore fimB, comprendente l'espressione dei pili di tipo 1 da parte di una cellula batterica; ceppo M17fimH::kan/pColap - Ceppo M17 fimH::kan trasformato con il plasmide pColap da noi costruito, portante determinanti della resistenza all'ampicillina e della produzione di colicina E1. I risultati dello studio dell'attività adesiva di ceppi di E. coli M17 e derivati del ceppo di E. coli M17, valutati utilizzando il metodo degli "studi di crescita", sono presentati nelle Figg. 3 (in ordinata sono riportati i valori di densità ottica alla lunghezza d'onda di 540 nm; in ascissa sono riportati i ceppi di E. coli studiati: 1 - M17; 2 - M17 fimH::kan, 3 - M17fimH::kan/pPKL91, 4 - M17 fimH ::kan/pColap). Come si può vedere dalla figura. 3, il ceppo M17 originale di E. coli si lega bene sia alla RNasi B che al mannano, indicando un fenotipo adesivo MH indesiderabile per il ceppo intestinale di E. coli. Il ceppo ricombinante M17 fimH::kan da noi ottenuto presenta attività adesiva pari a zero sia da solo che dopo l'introduzione di un plasmide in esso, inclusa l'espressione dei pili di tipo 1. L'attività adesiva pari a zero viene mantenuta in questo ceppo anche dopo l'introduzione del plasmide pColap (ceppo M17 fimH::kan/pColap). Esempio 3. Studio della stabilità dei tratti del ceppo di Escherichia coli M17 fimH::kan/pColap determinati dal plasmide pColap. Il plasmide pColap da noi costruito garantisce la produzione di colicina E1 e la resistenza all'ampicillina. La conservazione di queste caratteristiche dipende dalla stabilità del mantenimento del plasmide nelle cellule batteriche: la perdita del plasmide è accompagnata dalla perdita delle caratteristiche corrispondenti. La stabilità nel mantenimento della resistenza all'ampicillina e della colicinogenicità dei ceppi ottenuti è stata determinata quando sono stati coltivati in un mezzo nutriente liquido in assenza di un agente selettivo per 100 generazioni. Il plasmide ColE1 originale è stato utilizzato come controllo positivo e il plasmide pBR322, un derivato di ColE1 che non contiene il cer locus, che influisce sulla stabilità dei plasmidi, è stato utilizzato come controllo negativo. Le colture dei ceppi M17 fimH::kan/pColap, M17/ColE1 e M17/pBR322 sono state coltivate per 18 ore con aerazione potenziata a 37 oC in LB con ampicillina (100 μg/ml). Il ceppo M17/ColE1 è stato coltivato nelle stesse condizioni ma senza ampicillina. Le colture risultanti contenevano circa 10° di cellule batteriche per ml. Quindi, 10 μl (10 6) della coltura batterica corrispondente sono stati aggiunti a provette con 10 ml di LB (senza aggiunta di antibiotico). La sospensione risultante è stata coltivata come descritto sopra. Con tale coltivazione, le cellule batteriche hanno avuto il tempo di compiere 10 divisioni. Ripetendo questa operazione 10 volte, abbiamo ottenuto una coltura batterica che aveva attraversato 100 generazioni dalla prima inoculazione nel terreno senza agente selettivo. Campioni di colture batteriche sono stati prelevati prima di ogni inoculazione e testati per le proprietà di resistenza all'ampicillina e la produzione di colicina. Per questo, le sospensioni cellulari sono state piastrate su piastre LA fino all'ottenimento di singole colonie. Successivamente, è stata testata la capacità di crescere sullo stesso terreno in presenza di ampicillina (100 μg/ml) di 100 colonie di ciascun ceppo. Inoltre, è stata testata la capacità delle colonie di produrre colicina E1. A tale scopo è stato utilizzato un test con l'applicazione dell'agar superiore (Miller J. "Experiments in molecolare genetics", M., "Mir", 1976, pp. 183-189). Il test è il seguente: su piastre con un terreno nutritivo solido contenente l'1,6% di agar, le colonie in esame vengono forate con un replicatore o uno stuzzicadenti. Le piastre vengono incubate a 37°C per 3-4 ore, la produzione di colicina viene indotta mediante irradiazione ultravioletta per 4-5 secondi e incubate nelle stesse condizioni durante la notte. Le cellule vengono quindi lisate con vapore di cloroformio a temperatura ambiente per 30–40 minuti. È importante assicurarsi che nella fase successiva tutto il cloroformio sia evaporato dalla tazza. Adagiare sullo strato inferiore dell'agar 3 - 5 ml di agar semiliquido (0,7%) contenente 10 7 / ml di cellule batteriche del ceppo test di E. coli (sensibile alla colicina E1). Incubare per una notte a 37°C. Registrare la presenza di zone di illuminazione nello strato di coltura di prova attorno alle macchie dei ceppi studiati. I risultati di stabilità del ceppo di Escherichia coli costruito M17/pColap sono mostrati in FIG. 2 (ColE1 corrisponde al ceppo M17/ColE1, pBR322 al ceppo M17/pBR322, pColap al ceppo M17/pColap). La presenza del plasmide nella cellula batterica deriva dalla preservazione delle sue proprietà originarie (colicinogenicità e/o resistenza all'ampicillina). I risultati dell'esperimento (Fig. 2) indicano che il plasmide pBR322 privato del cer locus viene rapidamente eliminato dalla popolazione batterica quando coltivato in un terreno privo di antibiotici, mentre gli altri due plasmidi (ColE1 originale e pColap ricombinante) sono ereditati stabilmente dalle cellule in queste condizioni. Questa proprietà è uno degli importanti vantaggi del nostro progetto, poiché, da un lato, facilita la preparazione di un preparato standard basato su un ceppo contenente pColap e, dall'altro, garantisce che non avvenga l'eliminazione del plasmide quando il farmaco viene assunto da un paziente senza concomitante terapia antibiotica. Applicabilità industriale. La descrizione sopra riportata del metodo per costruire il ceppo brevettato di Escherichia coli M17 rimH::kan/pColap è sufficiente per ottenere nuovamente il ceppo utilizzando tecniche, reagenti e apparecchiature standard utilizzati nella ricerca di ingegneria genetica.
RECLAMO
Ceppo batterico Escherichia coli M 17 fim H::kan/p Colap VKPM B-7448 utilizzato per ottenere un preparato probiotico.- In contatto con 0
- Google Plus 0
- OK 0
- Facebook 0