Ottenere cloro (reazione di permanganato di potassio e acido cloridrico)
Gli esperimenti con il cloro di solito iniziano con la produzione di cloro. In precedenza, alcune università e istituti di ricerca avevano bombole di cloro, ma non avevo nemmeno la possibilità di vederle. La maggior parte dei metodi per ottenere il cloro gassoso si riducono all'ossidazione dei cloruri in un ambiente acido (appunto, all'ossidazione dell'acido cloridrico). Come agenti ossidanti può servire un'ampia varietà di sostanze: permanganato di potassio, dicromato di potassio (quando riscaldato), ipoclorito di calcio (cloro), clorato di potassio, biossido di manganese (quando riscaldato) e altri.
In precedenza, il permanganato di potassio e l'acido cloridrico venivano spesso utilizzati per la produzione di cloro in laboratorio. In particolare, questo esperimento è stato dimostrato durante le lezioni di chimica nelle scuole. La scelta dell'acido cloridrico e del permanganato era dovuta al fatto che queste sostanze erano economiche e facilmente reperibili: il permanganato si vendeva in qualsiasi farmacia, e l'acido cloridrico tecnico si poteva acquistare nei negozi di ferramenta (era usato come disincrostante economico ed efficace, ecc.).
Ma la scelta del permanganato e dell'acido cloridrico per la produzione di cloro si spiega anche con il fatto che queste due sostanze reagiscono bene già a temperatura ambiente, mentre nel caso del biossido di manganese o del bicromato di potassio è necessario il riscaldamento per liberare il cloro.
Un buon ed economico agente ossidante per la produzione di cloro è la candeggina. La sua formula può essere scritta condizionalmente come segue: CaCl 2 Ca(ClO) 2, cioè Questa sostanza contiene cloruro e ipoclorito. Affinché inizino a reagire con il rilascio di cloro, è sufficiente aggiungere un acido forte (e non necessariamente acido cloridrico - è adatto anche acido solforico). Ma tutto questo è solo teorico: in pratica, i negozi ora vendono spesso a basso -candeggina di qualità, che si è decomposta da tempo. Sotto l'azione dell'acido, una tale "candeggina" rilascia cloro, ma molto poco. Sì, e la candeggina ora non è affatto economica come una volta.
Piccole quantità di cloro possono essere ottenute aggiungendo acido a una soluzione di ipoclorito di sodio (agente "Bianchezza"). Sfortunatamente, con "Belizna" la storia è quasi la stessa della "candeggina": produttori e venditori la diluiscono spudoratamente con acqua (di conseguenza, invece del 5% di cloro attivo, spesso contiene l'1-2%).
Nella maggior parte degli esperimenti descritti di seguito, il permanganato di potassio e l'acido cloridrico sono serviti come fonte di cloro. Secondo i nostri tempi, questo è molto irrazionale, ma volevo iniziare esperimenti con il cloro e non perdere tempo ed energie per padroneggiare il metodo per ottenere il cloro da altre sostanze. In alcuni casi, al posto dell'acido cloridrico (che è quasi esaurito), ho utilizzato acido solforico al 40% e cloruro di sodio. In questo caso la miscela doveva essere riscaldata su un fornello.
La reazione è stata condotta in un pallone conico da 300 ml, dove è stato preventivamente versato il permanganato. Il pallone era coperto con un'allungamento a sezioni sottili, al quale era attaccato un tubo di silicone per rimuovere il cloro. La parte superiore dell'allungo (a cui è attaccato un frigorifero durante la distillazione) era chiusa con un tappo con un tubo di vetro. Una siringa con acido cloridrico concentrato è stata collegata al tubo utilizzando un tubo in PVC (la siringa ha sostituito l'imbuto gocciolatore).
Sulla via del cloro, metto una bottiglia di lavaggio con una soluzione satura di cloruro di sodio - per rimuovere l'acido cloridrico dal gas (l'acido cloridrico si dissolve bene non solo in acqua, ma anche in una soluzione salina satura - a differenza del cloro, che è molto peggio solubile in una soluzione salina satura che in acqua). Per raccogliere il cloro ho utilizzato vari fiaschi e barattoli (inoltre, durante la raccolta del cloro, è consigliabile coprire il recipiente con un tappo di sughero o un batuffolo di cotone - non l'ho indovinato subito).
Se si utilizza il cloro per esperimenti di combustione, è consigliabile versare in anticipo la sabbia sul fondo del pallone, altrimenti il vetro potrebbe rompersi. Non c'era sabbia a portata di mano e ho preso il sale da cucina secco - anche questo non è male, ma il sodio colora la fiamma di giallo (a volte questo interferisce).
Ottenere il cloro e fare esperimenti con il cloro può essere descritto come laborioso, a volte estenuante. Non bisogna dimenticare che il cloro è il primo agente di guerra chimica utilizzato con successo su larga scala, quindi tutti gli esperimenti dovrebbero essere condotti in buone condizioni di corrente o all'aria aperta. Il cloro non è una sostanza particolarmente tossica, ma è abbastanza capace di provocare ustioni alle mucose e, in caso di lavoro imprudente, sono possibili conseguenze anche peggiori. Un conoscente ha detto che durante un seminario studentesco ha ricevuto cloro. Quando il cloro cominciò a risaltare, annusò la fiaschetta secondo tutte le regole: con un gesto della mano diresse l'aria verso il viso. Non ne ho sentito l'odore. Quindi lo sfortunato sperimentatore si chinò sulla fiaschetta e fece un respiro profondo - riprese subito fiato: se non fosse stato per l'aiuto di altri due studenti, questo avrebbe potuto finire con la morte per soffocamento.
__________________________________________________
Nella reazione tra acido cloridrico e permanganato di potassio nella fase finale, il riscaldamento è ancora auspicabile, perché. in caso contrario, il permanganato si trasformerà in ossido idrato di manganese marrone (IV), che porta ad un consumo eccessivo di permanganato. Affinché il biossido di manganese si trasformi in cloruro di manganese (II), sono necessari il riscaldamento e un eccesso di acido.
I processi redox sono alla base dei più importanti fenomeni della natura animata e inanimata: combustione, decomposizione di sostanze complesse, sintesi di composti organici. Il permanganato di potassio, le cui proprietà studieremo nel nostro articolo, si riferisce a quelli utilizzati in condizioni di laboratorio e industriali. La sua capacità ossidante dipende dallo stato di ossidazione dell'atomo, che cambia nel corso della reazione. Consideriamolo su esempi specifici di eventi che coinvolgono molecole KMnO 4.
Caratteristica della sostanza
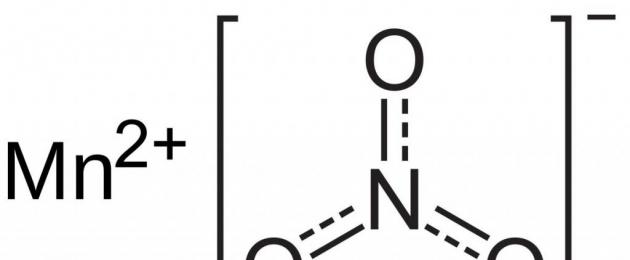
Il composto che stiamo considerando (permanganato di potassio) è una delle sostanze più utilizzate nell'industria: i composti del manganese. Il sale è rappresentato da cristalli sotto forma di prismi regolari viola scuro. Si scioglie bene in acqua e forma una soluzione color lampone con ottime caratteristiche battericide. Pertanto, la sostanza ha trovato ampia applicazione sia in medicina che nella vita di tutti i giorni come agente battericida. Come altri composti del manganese eptavalente, il sale è in grado di ossidare molti composti di natura organica e inorganica. La decomposizione del permanganato di potassio viene utilizzata nei laboratori chimici per ottenere piccoli volumi di ossigeno puro. Il composto ossida l'acido solfito in solfato. Nell'industria, KMnO 4 viene utilizzato per isolare il cloro gassoso dall'acido cloridrico. Inoltre ossida la maggior parte delle sostanze organiche ed è in grado di convertire i sali ferrosi sotto forma di composti ferrici.

Esperimenti con permanganato di potassio
La sostanza, chiamata nella vita di tutti i giorni permanganato di potassio, si decompone se riscaldata. I prodotti della reazione contengono ossigeno libero, biossido di manganese e un nuovo sale - K 2 MnO 4 . In laboratorio questo processo viene effettuato per ottenere ossigeno puro. L'equazione chimica per la decomposizione del permanganato di potassio può essere rappresentata come segue:
2KMnO4 \u003d K2MnO4 + MnO2 + O2.
La sostanza secca, costituita da cristalli viola a forma di prismi regolari, viene riscaldata ad una temperatura di +200 °C. Il catione manganese, che fa parte del sale, ha uno stato di ossidazione +7. Diminuisce nei prodotti di reazione rispettivamente a +6 e +4.

Ossidazione dell'etilene
Gli idrocarburi gassosi appartenenti a varie classi di composti organici hanno legami singoli e multipli tra gli atomi di carbonio nelle loro molecole. Come determinare la presenza di legami pi greco alla base della natura insatura di un composto organico? A tale scopo, gli esperimenti chimici vengono eseguiti facendo passare la sostanza in esame (ad esempio etene o acetilene) attraverso il viola, osservandone lo scolorimento poiché il legame insaturo viene distrutto. La molecola di etilene viene ossidata e si trasforma da un idrocarburo insaturo in un alcol saturo biatomico - glicole etilenico. Questa reazione è qualitativa per la presenza di doppi o tripli legami.
Caratteristiche delle manifestazioni chimiche di KMnO4
Se cambiano gli stati di ossidazione dei reagenti e dei prodotti di reazione, si verifica una reazione di ossido-riduzione. Si basa sul fenomeno del movimento degli elettroni da un atomo all'altro. Come nel caso della decomposizione del permanganato di potassio e in altre reazioni, la sostanza presenta proprietà pronunciate di un agente ossidante. Ad esempio, in una soluzione acidificata di solfito di sodio e permanganato di potassio, si formano solfati di sodio, potassio e manganese, nonché acqua:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H20.
In questo caso, lo ione zolfo è un agente riducente e il manganese, che fa parte del complesso MnO 4 - anione, presenta le proprietà di un agente ossidante. Accetta cinque elettroni, quindi il suo stato di ossidazione va da +7 a +2.
L'influenza del mezzo sul corso di una reazione chimica
A seconda della concentrazione di ioni idrogeno o gruppi ossidrile, si distingue la natura acida, alcalina o neutra della soluzione in cui avviene la reazione redox. Ad esempio, con un contenuto in eccesso di cationi idrogeno, uno ione manganese con uno stato di ossidazione di +7 nel permanganato di potassio lo abbassa a +2. In un ambiente alcalino, ad un'alta concentrazione di gruppi idrossilici, il solfito di sodio, interagendo con il permanganato di potassio, viene ossidato in solfato. Uno ione manganese con uno stato di ossidazione +7 passa in un catione con una carica di +6, che è nella composizione di K 2 MnO 4 , la cui soluzione ha un colore verde. In un ambiente neutro, il solfito di sodio e il permanganato di potassio reagiscono tra loro e il biossido di manganese precipita. Lo stato di ossidazione del catione manganese diminuisce da +7 a +4. Nei prodotti della reazione si trovano anche solfato di sodio e idrossido di sodio alcalino.

L'uso di sali dell'acido manganese
Nell'industria vengono spesso utilizzati il permanganato di potassio quando riscaldato e altri processi redox che coinvolgono sali dell'acido manganese. Ad esempio, l'ossidazione di molti composti organici, il rilascio di cloro gassoso dall'acido cloridrico, la conversione dei sali ferrosi in trivalenti. In agricoltura, una soluzione di KMnO 4 viene utilizzata per il trattamento pre-semina di semi e terreno, in medicina viene utilizzata per trattare la superficie delle ferite, disinfettare le mucose infiammate della cavità nasale e viene utilizzata per disinfettare gli articoli per l'igiene personale.
Nel nostro articolo non solo abbiamo studiato in dettaglio il processo di decomposizione del permanganato di potassio, ma abbiamo anche considerato le sue proprietà ossidanti e le applicazioni nella vita quotidiana e nell'industria.
Ossidanti sono particelle (atomi, molecole o ioni) che accettare elettroni durante una reazione chimica. In questo caso, lo stato di ossidazione dell'agente ossidante andando giù. Allo stesso tempo, ossidanti si stanno riprendendo.
Restauratori sono particelle (atomi, molecole o ioni) che donare elettroni durante una reazione chimica. In questo caso, lo stato di ossidazione dell'agente riducente si alza. Allo stesso tempo, restauratori sono ossidati.
Le sostanze chimiche possono essere suddivise in ossidanti tipici, tipici agenti riducenti e sostanze che possono esibire proprietà sia ossidanti che riducenti. Alcune sostanze praticamente non mostrano attività redox.
A ossidanti tipici includere:
- sostanze semplici - non metalli con le più forti proprietà ossidanti (fluoro F 2, ossigeno O 2, cloro Cl 2);
- ionimetalli o non metalli Con stati di ossidazione altamente positivi (solitamente più alti). : acidi (HN +5 O 3, HCl +7 O 4), sali (KN +5 O 3, KMn +7 O 4), ossidi (S +6 O 3, Cr +6 O 3)
- composti che ne contengono alcuni cationi metallici avendo stati di ossidazione elevati: Pb 4+ , Fe 3+ , Au 3+ ecc.
Agenti riducenti tipici di solito è:
- sostanze semplici: metalli(le capacità riducenti dei metalli sono determinate da una serie di attività elettrochimica);
- sostanze complesse che contengono atomi o ioni di non metalli con uno stato di ossidazione negativo (solitamente inferiore).: composti binari dell'idrogeno (H 2 S, HBr), sali di acidi privi di ossigeno (K 2 S, NaI);
- alcuni composti contenenti cationi con il più basso stato di ossidazione positiva(Sn 2+, Fe 2+, Cr 2+), che, donando elettroni, possono aumentare il loro stato di ossidazione;
- composti contenenti ioni complessi, costituiti da non metalli con uno stato di ossidazione positivo intermedio(S +4 O 3) 2–, (НР +3 O 3) 2– , in cui gli elementi possono, donando elettroni, aumentare il suo stato di ossidazione positivo.
La maggior parte delle altre sostanze possono manifestarsi proprietà sia ossidanti che riducenti.

Gli agenti ossidanti e riducenti tipici sono mostrati nella tabella.

Nella pratica di laboratorio quelli più comunemente utilizzati sono i seguenti ossidanti :
permanganato di potassio (KMnO4);
bicromato di potassio (K 2 Cr 2 O 7);
acido nitrico (HNO 3);
acido solforico concentrato (H 2 SO 4);
perossido di idrogeno (H 2 O 2);
ossidi di manganese (IV) e piombo (IV) (MnO 2 , PbO 2);
nitrato di potassio fuso (KNO 3) e si scioglie di alcuni altri nitrati.
A riduttori che si applicano V pratica di laboratorio relazionare:
- magnesio (Mg), alluminio (Al), zinco (Zn) e altri metalli attivi;
- idrogeno (H 2) e carbonio (C);
- ioduro di potassio (KI);
- solfuro di sodio (Na 2 S) e idrogeno solforato (H 2 S);
- solfito di sodio (Na 2 SO 3);
- cloruro di stagno (SnCl 2).
Classificazione delle reazioni redox
Le reazioni redox sono solitamente suddivise in quattro tipi: reazioni intermolecolari, intramolecolari, reazioni di sproporzione (autoossidazione-autoriduzione) e reazioni di controsproporzione.
Reazioni intermolecolari procedere con una variazione del grado di ossidazione elementi diversi da reagenti diversi. Allo stesso tempo, si formano vari prodotti di ossidazione e riduzione .
2Al0+Fe +3 2 O 3 → Al +3 2 O 3 + 2Fe 0,
C 0 + 4HN +5 O 3 (conc) = C +4 O 2 + 4N +4 O 2 + 2H 2 O.
Reazioni intramolecolari sono reazioni in cui elementi diversi da un reagente trasferirsi in prodotti diversi come:
(N-3 H4) 2 Cr+6 2 O 7 → N 2 0 + Cr +3 2 O 3 + 4 H 2 O,
2 NaN +5 O -2 3 → 2 NaN +3 O 2 + O 0 2 .
Reazioni di sproporzione (auto-ossidazione-auto-recupero) - si tratta di reazioni in cui l'agente ossidante e l'agente riducente - lo stesso elemento dello stesso reagente, che entra prodotti diversi:
3Br2 + 6 KOH → 5KBr + KBrO3 + 3H2O,
Riproporzionamento (proporzione, controsproporzione ) sono reazioni in cui sono presenti un agente ossidante e un agente riducente lo stesso elemento, Quale di reagenti diversi entra uno Prodotto. Reazione inversa alla sproporzione.
2H 2 S -2 + S + 4 O 2 \u003d 3S + 2 H 2 O

Regole base per la compilazione delle reazioni redox
Le reazioni redox sono accompagnate da processi di ossidazione e riduzione:
Ossidazioneè il processo di donazione di elettroni da parte di un agente riducente.
Recupero è il processo di aggiunta di elettroni a un agente ossidante.
Ossidante riprendendoe l'agente riducente ossidato .
Nelle reazioni redox, il saldo elettronico: Il numero di elettroni donati dall'agente riducente è uguale al numero di elettroni ricevuti dall'agente ossidante. Se il saldo viene redatto in modo errato, non sarà possibile elaborare OVR complessi.
Vengono utilizzati diversi metodi per compilare le reazioni redox (ORR): il metodo del bilancio elettronico, il metodo del bilancio elettrone-ione (metodo della mezza reazione) e altri.
Considera in dettaglio metodo della bilancia elettronica .
È abbastanza facile "riconoscere" l'OVR: è sufficiente organizzare gli stati di ossidazione in tutti i composti e determinare che gli atomi cambiano lo stato di ossidazione:
K + 2 S -2 + 2K + Mn +7 O -2 4 = 2K + 2 Mn +6 O -2 4 + S 0
Scriviamo separatamente gli atomi degli elementi che cambiano lo stato di ossidazione, nello stato PRIMA della reazione e DOPO la reazione.
Lo stato di ossidazione viene modificato dagli atomi di manganese e zolfo:
S -2 -2e = S 0
Mn +7 + 1e = Mn +6
Il manganese assorbe 1 elettrone, lo zolfo dona 2 elettroni. Allo stesso tempo, è necessario conformarsi saldo elettronico. Pertanto è necessario raddoppiare il numero di atomi di manganese e lasciare invariato il numero di atomi di zolfo. Indichiamo i coefficienti di equilibrio sia prima dei reagenti che prima dei prodotti!
Schema per la compilazione di equazioni OVR utilizzando il metodo della bilancia elettronica:

Attenzione! In una reazione possono essere presenti diversi agenti ossidanti o riducenti. Il bilancio deve essere redatto in modo che il numero TOTALE di elettroni donati e ricevuti sia lo stesso.
Schemi generali delle reazioni redox
I prodotti delle reazioni redox spesso dipendono da condizioni di processo. Prendere in considerazione i principali fattori che influenzano il decorso delle reazioni redox.
Il fattore determinante più ovvio è mezzo della soluzione di reazione - . Di norma (ma non necessariamente) tra i reagenti è elencata la sostanza che definisce il terreno. Sono possibili le seguenti opzioni:
- attività ossidativa si intensifica in un ambiente più acido e l'ossidante si riduce più profondamente(ad esempio il permanganato di potassio, KMnO 4, dove Mn +7 si riduce a Mn +2 in ambiente acido e a Mn +6 in ambiente alcalino);
- attività ossidativa si intensifica in un ambiente più alcalino e l'agente ossidante viene ridotto più profondamente (ad esempio, il nitrato di potassio KNO 3, dove N +5, quando interagisce con un agente riducente in un mezzo alcalino, viene ridotto a N -3);
- oppure l'agente ossidante non è praticamente soggetto a cambiamenti nell'ambiente.

Il mezzo di reazione consente di determinare la composizione e la forma di esistenza dei restanti prodotti OVR. Il principio di base è che si formano prodotti che non interagiscono con i reagenti!
Nota! E Se il mezzo della soluzione è acido, tra i prodotti della reazione non possono essere presenti basi e ossidi basici, perché interagiscono con l'acido. Al contrario, in un mezzo alcalino, è esclusa la formazione di acido e ossido acido. Questo è uno degli errori più comuni e più grossolani.
Inoltre, la direzione del flusso OVR viene influenzata la natura dei reagenti. Per esempio, durante l'interazione dell'acido nitrico HNO 3 con agenti riducenti, si osserva uno schema: maggiore è l'attività dell'agente riducente, maggiore è la riduzione dell'azoto N + 5.
Con un aumento temperatura la maggior parte degli OVR tendono ad essere più intensi e profondi.
Nelle reazioni eterogenee, la composizione dei prodotti è spesso influenzata da finezza del solido . Ad esempio, lo zinco in polvere con acido nitrico forma un prodotto, mentre lo zinco granulare forma prodotti completamente diversi. Maggiore è il grado di macinazione del reagente, maggiore è la sua attività, Generalmente.
Considera gli ossidanti da laboratorio più tipici.
Schemi fondamentali delle reazioni redox
Schema per il recupero dei permanganati
I permanganati contengono un potente agente ossidante - manganese nello stato di ossidazione +7. I sali di manganese +7 colorano la soluzione Viola colore.

I permanganati, a seconda del mezzo della soluzione di reazione, vengono ridotti in diversi modi.
IN ambiente acido il recupero è più profondo Mn2+. L'ossido di manganese nello stato di ossidazione +2 presenta quindi proprietà basiche in ambiente acido si forma il sale. Sali di manganese +2 incolore. IN soluzione neutra il manganese viene recuperato al grado di ossidazione +4 , con l'istruzione ossido anfotero MnO 2 — marrone sedimento insolubile in acidi e alcali. IN alcalino nell'ambiente, il manganese è ridotto al minimo, al livello più vicino stati di ossidazione +6 . I composti del manganese +6 mostrano proprietà acide, in un mezzo alcalino formano sali - manganati. I manganati danno la soluzione colorazione verde .

Considerare l'interazione del permanganato di potassio KMnO 4 con il solfuro di potassio in mezzi acidi, neutri e alcalini. In queste reazioni, il prodotto di ossidazione dello ione solfuro è S 0 .
5 K 2 S + 2 KMnO 4 + 8 H 2 SO 4 \u003d 5 S + 2 MnSO 4 + 6 K 2 SO 4 + 8 H 2 O,
3 K 2 S + 2 KMnO 4 + 4 H 2 O = 2 MnO 2 ↓ + 3 S↓ + 8 KOH,
Un errore comune in questa reazione è l'indicazione dell'interazione di zolfo e alcali nei prodotti di reazione. Tuttavia, lo zolfo interagisce con gli alcali in condizioni piuttosto difficili (temperatura elevata), che non corrisponde alle condizioni per questa reazione. In condizioni normali, sarà corretto indicare separatamente esattamente lo zolfo molecolare e gli alcali e non i prodotti della loro interazione.
K 2 S + 2 KMnO 4 - (KOH) \u003d 2 K 2 MnO 4 + S ↓
Sorgono difficoltà anche durante la compilazione di questa reazione. Il fatto è che in questo caso non è necessario scrivere la molecola del mezzo (KOH o altri alcali) nei reagenti per equalizzare la reazione. Gli alcali prendono parte alla reazione e determinano il prodotto della riduzione del permanganato di potassio, ma i reagenti e i prodotti vengono equalizzati anche senza la sua partecipazione. Questo apparentemente paradosso può essere facilmente risolto se ricordiamo che una reazione chimica è solo una notazione condizionale che non indica ogni processo in corso, ma è solo un riflesso della somma di tutti i processi. Come determinarlo da solo? Se agisci secondo lo schema classico - coefficienti di equilibrio-equilibrio - equalizzazione dei metalli, vedrai che i metalli sono equalizzati dai coefficienti di equilibrio e la presenza di alcali sul lato sinistro dell'equazione di reazione sarà superflua.
Permanganati ossidare:
- non metalli con uno stato di ossidazione negativo alle sostanze semplici (con stato di ossidazione 0), eccezioni — fosforo, arsenico - fino a +5 ;
- non metalli con uno stato di ossidazione intermedio al massimo grado di ossidazione;
- metalli attivi positivo stabile il grado di ossidazione del metallo.
KMnO 4 + NeMe (d.d. più basso) = NeMe 0 + altri prodotti
KMnO 4 + NeMe (s.o. intermedio) = NeMe (s.o. superiore) + altri prodotti
KMnO 4 + Me 0 = Me (stabile s.d.) + altri prodotti
KMnO 4 + P -3, As -3 = P +5, As +5 + altri prodotti
Schema di recupero del cromato/bicromato
Una caratteristica del cromo con valenza VI è che forma 2 tipi di sali in soluzioni acquose: cromati e bicromati, a seconda del mezzo della soluzione. Cromati metallici attivi (ad esempio K 2 CrO 4) sono sali stabili in alcalino ambiente. Dicromati (bicromati) di metalli attivi (ad esempio K 2 Cr 2 O 7) - sali, stabili in un ambiente acido .
I composti del cromo (VI) sono ridotti a composti del cromo (III). . I composti del cromo Cr +3 sono anfoteri e, a seconda del mezzo della soluzione, esistono in soluzione in varie forme: in un mezzo acido sotto forma sali(i composti anfoteri formano sali quando interagiscono con gli acidi), in un mezzo neutro - insolubile idrossido di cromo (III) anfotero Cr(OH) 3 e in un ambiente alcalino si formano composti di cromo (III). sale complesso, Per esempio, esaidrossicromato di potassio (III) K 3 .

Composti del cromo VI ossidare:
- non metalli in uno stato di ossidazione negativo alle sostanze semplici (con stato di ossidazione 0), eccezioni — fosforo, arsenico - fino a +5;
- non metalli in uno stato di ossidazione intermedio al massimo grado di ossidazione;
- metalli attivi dalle sostanze semplici (punto di ossidazione 0) ai composti con positivo stabile il grado di ossidazione del metallo.
Cromato/bicromato + neMe (d.d. negativo) = neMe 0 + altri prodotti
Cromato/bicromato + NeMe (s.d. positiva intermedia) = NeMe (s.d. più alta) + altri prodotti
Cromato / bicromato + Me 0 \u003d Me (stabile s.d.) + altri prodotti
Cromato/bicromato + P, As (d.d. negativo) = P, As +5 + altri prodotti
Decomposizione dei nitrati
I sali nitrati contengono azoto in stato di ossidazione +5 - forte ossidante. Tale azoto può ossidare l'ossigeno (O -2). Ciò accade quando i nitrati vengono riscaldati. In questo caso, nella maggior parte dei casi, l'ossigeno viene ossidato allo stato di ossidazione 0, vale a dire Prima molecolare ossigeno O2 .
A seconda del tipo di metallo che costituisce il sale, durante la decomposizione termica (temperatura) dei nitrati si formano diversi prodotti: se metallo attivo(nella serie di attività elettrochimica sono al magnesio), quindi l'azoto viene ridotto allo stato di ossidazione +3 e dopo decomposizione si formano sali di nitrito e ossigeno molecolare .
Per esempio:
2NaNO3 → 2NaNO2 + O2 .
I metalli attivi si presentano in natura sotto forma di sali (KCl, NaCl).
Se un metallo è nella serie dell'attività elettrochimica a destra del magnesio e a sinistra del rame (compresi magnesio e rame) , allora si produce la scomposizione ossido di metallo in uno stato di ossidazione stabile, ossido nitrico (IV)(gas marrone) e ossigeno. Durante la decomposizione si forma anche ossido di metallo nitrato di litio .
Per esempio, decomposizione nitrato di zinco:
2Zn(NO 3) 2 → 2ZnО + 4NO 2 + O 2.
I metalli di media attività si trovano più spesso in natura sotto forma di ossidi (Fe 2 O 3, Al 2 O 3, ecc.).
ioni metalli, situato nella serie dell'attività elettrochimica a destra del rame sono forti agenti ossidanti. A decomposizione dei nitrati essi, come N+5, partecipano all'ossidazione dell'ossigeno e si riducono a sostanze semplici, cioè si forma il metallo e i gas vengono rilasciati ossido nitrico (IV) e ossigeno .
Per esempio, decomposizione nitrato d'argento:
2AgNO3 → 2Ag + 2NO2 + O2 .
I metalli inattivi si presentano in natura sotto forma di sostanze semplici.
Alcune eccezioni!
Decomposizione nitrato di ammonio :
Nella molecola del nitrato di ammonio è presente sia un agente ossidante che un agente riducente: l'azoto nello stato di ossidazione -3 mostra solo proprietà riducenti, l'azoto nello stato di ossidazione +5 solo ossidanti.
Quando riscaldato, nitrato di ammonio decomposizione. A temperature fino a 270 o C, ossido nitrico (I)("gas esilarante") e acqua:
NH4NO3 → N2O + 2H2O
Questo è un esempio di reazione controsproporzione .
Lo stato di ossidazione dell'azoto risultante è la media aritmetica dello stato di ossidazione degli atomi di azoto nella molecola originale.
A una temperatura più elevata, l'ossido nitrico (I) si decompone in sostanze semplici - azoto E ossigeno:
2NH4NO3 → 2N2+O2+4H2O
A decomposizione nitrito di ammonio NH4NO2 si verifica anche una controsproporzione.
Lo stato di ossidazione dell'azoto risultante è anche uguale alla media aritmetica degli stati di ossidazione degli atomi di azoto iniziali: l'agente ossidante N +3 e l'agente riducente N -3
NH4NO2 → N2 + 2H2O
Decomposizione termica nitrato di manganese(II). accompagnato da ossidazione del metallo:
Mn(NO 3) 2 \u003d MnO 2 + 2NO 2
Nitrato di ferro (II). a basse temperature si decompone in ossido di ferro (II), quando riscaldato il ferro viene ossidato allo stato di ossidazione +3:
2Fe(NO3) 2 → 2FeO + 4NO2 + O2 a 60°C
4Fe(NO3) 2 → 2Fe2 O3 + 8NO2 + O2 a >60°C
Nitrato di nichel (II).
si decompone in nitrito quando riscaldato.
Proprietà ossidanti dell'acido nitrico
Acido nitrico HNO 3 quando interagisce con i metalli è praticamente non forma mai idrogeno , a differenza della maggior parte degli acidi minerali.
Ciò è dovuto al fatto che l'acido contiene un agente ossidante molto forte: l'azoto nello stato di ossidazione +5. Quando interagiscono con agenti riducenti - metalli, si formano vari prodotti di riduzione dell'azoto.
Acido nitrico + metallo \u003d sale metallico + prodotto di riduzione dell'azoto + H 2 O
L'acido nitrico può essere convertito in ossido nitrico (IV) NO 2 (N +4); ossido nitrico (II) NO (N+2); ossido nitrico (I) N 2 O ("gas esilarante"); azoto molecolare N 2 ; nitrato di ammonio NH4NO3. Di norma, si forma una miscela di prodotti con la predominanza di uno di essi. L'azoto viene ridotto in questo caso agli stati di ossidazione da +4 a −3. La profondità del recupero dipende principalmente per natura agente riducente E dalla concentrazione di acido nitrico . Ecco come funziona la regola: minore è la concentrazione dell'acido e maggiore è l'attività del metallo, più elettroni riceve l'azoto e più si formano prodotti ridotti.
Alcuni modelli ti permetteranno di determinare correttamente il prodotto principale della riduzione dell'acido nitrico da parte dei metalli nella reazione:
- sotto azione acido nitrico molto diluito SU metalli solitamente formato nitrato di ammonio NH4NO3;
Per esempio, interazione dello zinco con acido nitrico molto diluito:
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
- acido nitrico concentrato nel freddo passiva alcuni metalli - cromo Cr, alluminio Al e ferro Fe . Quando la soluzione viene riscaldata o diluita, la reazione procede;
passivazione del metallo - si tratta del trasferimento della superficie metallica ad uno stato inattivo dovuto alla formazione di sottili strati di composti inerti sulla superficie metallica, in questo caso principalmente ossidi metallici, che non reagiscono con l'acido nitrico concentrato
- Acido nitrico non reagisce con i metalli del sottogruppo del platino — oro Au, platino Pt, e palladio Pd;
- quando si interagisce acido concentrato con metalli inattivi e metalli di media attività nitrico l'acido è ridotto a ossido nitrico (IV) NO2 ;
Per esempio, ossidazione del rame con acido nitrico concentrato:
Cu + 4HNO 3 \u003d Cu (NO 3) 2 + 2NO 2 + 2H 2 O
- quando si interagisce acido nitrico concentrato con metalli attivi formato Monossido di azoto (I)N2O ;
Per esempio, ossidazione sodio concentrato acido nitrico:
Na + 10HNO3 \u003d 8NaNO3 + N2O + 5H2O
- quando si interagisce acido nitrico diluito con metalli inattivi (nella serie di attività a destra dell'idrogeno) l'acido è ridotto a ossido nitrico (II) NO ;
- quando si interagisce acido nitrico diluito con metalli ad attività intermedia O ossido nitrico (II) NO, o ossido nitrico N 2 O, o azoto molecolare N 2 - in funzione di ulteriori fattori (attività del metallo, grado di macinazione del metallo, grado di diluizione acida, temperatura).
- quando si interagisce diluire l'acido nitrico con metalli attivi formato azoto molecolare N2 .
Per una determinazione approssimativa dei prodotti della riduzione dell'acido nitrico nell'interazione con diversi metalli, propongo di utilizzare il principio del pendolo. I principali fattori che spostano la posizione del pendolo sono la concentrazione dell'acido e l'attività del metallo. Per semplificare utilizziamo 3 tipi di concentrazioni di acido: concentrato (più del 30%), diluito (30% o meno), molto diluito (meno del 5%). Dividiamo i metalli in base all'attività in attivi (prima dell'alluminio), medi (dall'alluminio all'idrogeno) e inattivi (dopo l'idrogeno). I prodotti della riduzione dell'acido nitrico sono disposti in ordine decrescente in base al grado di ossidazione:
NO2; NO; N2O; N2; NH4NO3
Più il metallo è attivo, più ci spostiamo verso destra. Maggiore è la concentrazione o minore è la diluizione dell'acido, più ci spostiamo a sinistra.
Per esempio , l'acido concentrato e il rame metallico inattivo Cu interagiscono. Pertanto, ci spostiamo nella posizione di estrema sinistra, si formano ossido nitrico (IV), nitrato di rame e acqua.
L'interazione dei metalli con l'acido solforico
Acido solforico diluito interagisce con i metalli come un normale acido minerale. Quelli. interagisce con i metalli che si trovano in una serie di tensioni elettrochimiche fino all'idrogeno. L'agente ossidante qui sono gli ioni H +, che vengono ridotti all'idrogeno molecolare H 2. In questo caso, i metalli vengono ossidati, di regola, a minimo grado di ossidazione.
Per esempio:
Fe + H 2 SO 4 (razb) \u003d FeSO 4 + H 2
interagisce con i metalli trovandosi in una serie di tensioni sia prima che dopo l'idrogeno.
H 2 SO 4 (conc) + metallo \u003d sale metallico + prodotto di riduzione dello zolfo (SO 2, S, H 2 S) + acqua
Quando l'acido solforico concentrato interagisce con i metalli, si formano un sale metallico (in uno stato di ossidazione stabile), acqua e un prodotto di riduzione dello zolfo - anidride solforosa S +4 O 2, zolfo molecolare S o idrogeno solforato H 2 S -2, a seconda del grado di concentrazione, dell'attività del metallo, del suo grado di macinazione, della temperatura, ecc. Quando l'acido solforico concentrato interagisce con i metalli, non si forma idrogeno molecolare!
I principi di base dell'interazione dell'acido solforico concentrato con i metalli:
1. acido solforico concentrato passiva alluminio, cromo, ferro a temperatura ambiente, o al freddo;
2. acido solforico concentrato non interagisce Con oro, platino e palladio ;
3. CON metalli inattivi acido solforico concentrato recupera a ossido di zolfo (IV).
Per esempio, il rame viene ossidato con acido solforico concentrato:
Cu 0 + 2H 2 S +6 O 4 (conc) = Cu +2 SO 4 + S +4 O 2 + 2H 2 O
4. Quando si interagisce con metalli attivi e zinco forme concentrate di acido solforicozolfo S o idrogeno solforato H 2 S 2- (a seconda della temperatura, del grado di macinazione e dell'attività del metallo).
Per esempio , interazione dell'acido solforico concentrato con lo zinco:
8Na0 + 5H2S +6 O4(conc) → 4Na2 + SO4 + H2S — 2 +4H2O
Perossido di idrogeno
Il perossido di idrogeno H 2 O 2 contiene ossigeno nello stato di ossidazione -1. Tale ossigeno può sia aumentare che diminuire lo stato di ossidazione. Pertanto, il perossido di idrogeno mostra proprietà sia ossidanti che riducenti.
Quando interagisce con agenti riducenti, il perossido di idrogeno mostra le proprietà di un agente ossidante e viene ridotto allo stato di ossidazione -2. Di norma, il prodotto della riduzione del perossido di idrogeno è l'acqua o lo ione idrossido, a seconda delle condizioni di reazione. Per esempio:
S +4 O 2 + H 2 O 2 -1 → H 2 S +6 O 4 -2
Quando interagisce con agenti ossidanti, il perossido viene ossidato in ossigeno molecolare (stato di ossidazione 0): O 2 . Per esempio :
2KMn +7 O 4 + 5H 2 O 2 -1 + 3H 2 SO 4 → 5O 2 0 + 2Mn +2 SO 4 + K 2 SO 4 + 8H 2 O
Tutor di chimica
Continuazione. Vedere nel n. 22/2005; 1, 2, 3, 5, 6, 8, 9, 11, 13, 15, 16, 18, 22/2006;
3, 4, 7, 10, 11, 21/2007;
2, 7, 11, 18, 19/2008
ATTIVITÀ 26
10 ° grado(primo anno di studio)
Manganese. Permanganato di potassio e suoi prodotti di recupero
in vari ambienti
1. Posizione nella tabella di D.I. Mendeleev, possibili valenze e stati di ossidazione.
2. Breve storia della scoperta e origine del nome.
3. Proprietà fisiche e chimiche.
4. Ritrovamento in natura e principali metodi di ottenimento.
5. Il composto più importante del manganese è il permanganato di potassio. Prodotti del suo recupero a seconda dell'ambiente della soluzione.
Il manganese si trova in un sottogruppo laterale del gruppo VII del D.I. Mendeleev. Questo è un elemento con valenza variabile. Nei composti, il manganese presenta stati di ossidazione +2, +3, +4, +6, +7, i principali dei quali sono gli stati di ossidazione +2 e +4.
Il manganese fu scoperto nel 1774 dai chimici svedesi K. Scheele e J. Gunn calcinando il minerale pirolusite (MnO 2) con carbone. Il nome dell'elemento è probabilmente una corruzione della parola "manganes", che significa "scolorire, far brillare". Questo nome ha origine artigianale ed è associato all'effetto decolorante della pirolusite sul vetro una volta fuso.
Proprietà fisiche e chimiche
Il manganese è un metallo argenteo, piuttosto refrattario. Nell'aria e nell'acqua è passivato, ma allo stato finemente suddiviso può essere ossidato e interagisce con l'acqua per formare idrossido. In generale, il manganese può essere caratterizzato come un metallo abbastanza attivo (soprattutto allo stato finemente disperso).
Mn+O2MnO2 ( T= 400°C).
Metalli (-).
Non metalli (+):
Mn+Cl2MnCl2,
3Mn + N2Mn3N2 .
H2O (+/-):*
![]()
Ossidi basici (-).
Ossidi acidi (-).
Basi (-).
Acidi non ossidanti (+):
Mn + 2HCl \u003d MnCl 2 + H 2.
Acidi ossidanti (+):
Mn + 2H 2 SO 4 (conc.) \u003d MnSO 4 + SO 2 + 2H 2 O,
3Mn + 8HNO 3 (soluzione) = 3Mn (NO 3) 2 + 2NO + 4H 2 O,
Mn + 4HNO 3 (conc.) = Mn (NO 3) 2 + 2NO 2 + 2H 2 O.
Sali (+/-):
Mn + CuCl 2 \u003d MnCl 2 + Cu,
La reazione Mn + CaCl 2 non va.
In natura il manganese si trova principalmente sotto forma di ossidi, quindi il principale metodo industriale per ottenerlo è la sua riduzione (solitamente utilizzando silicio, carbonio o alluminio):
MnO2 + CMn + CO2,
![]()
Inoltre, il manganese si ottiene mediante elettrolisi di soluzioni dei suoi sali, ad esempio:
Il composto più importante del manganese è il permanganato di potassio.
Prodotti del suo recupero a seconda del mezzo della soluzione
Il permanganato di potassio (KMnO 4) è un sale dell'acido permanganico HMnO 4. L'acido permanganico è molto forte, esiste solo in soluzione acquosa. Il permanganato di potassio è il sale più famoso e ampiamente utilizzato di questo acido. È una sostanza cristallina viola scuro, quasi nera, scarsamente solubile in acqua. Le soluzioni di permanganato di potassio a bassa concentrazione hanno un colore cremisi, con un aumento della concentrazione il colore diventa viola (questo colore è caratteristico dello ione permanganato). Nelle soluzioni acquose, questo sale non subisce idrolisi, perché. formato da una base forte e un acido forte. Quando riscaldato, il permanganato di potassio si decompone facilmente per formare manganato di potassio, ossido di manganese (IV) e ossigeno:
2KMnO4 K2 MnO4 + MnO2 + O2 .
Il permanganato di potassio è un forte agente ossidante dovuto allo ione permanganato contenente manganese nel più alto stato di ossidazione di +7. La natura dei prodotti di riduzione di KMnO 4 dipende dal mezzo in cui avviene la reazione.
In un ambiente acido, gli ioni permanganato vengono ridotti a ioni Mn 2+. A causa della formazione di sali di manganese incolori, il colore della soluzione cambia da viola a incolore.
![]()
2KMnO4 + 5Na2SO3 + 6HCl = 2MnCl2 + 5Na2SO4 + 2KCl + 3H2O.
IN ambiente neutro gli ioni permanganato sono ridotti all'ossido di manganese (IV), un precipitato marrone di MnO 2 precipita, lo stato di ossidazione del manganese diminuisce da +7 a +4.
![]()
2KMnO 4 + 3Na 2 SO 3 + H 2 O \u003d 2MnO 2 + 3Na 2 SO 4 + 2KOH.
In un ambiente alcalino, gli ioni permanganato vengono ridotti a ioni manganato. Di conseguenza, la soluzione diventa verde; lo stato di ossidazione del manganese diminuisce da +7 a +6.
![]()
2KMnO 4 + Na 2 SO 3 + 2KOH \u003d 2K 2 MnO 4 + Na 2 SO 4 + H 2 O.
Come agente ossidante, il permanganato di potassio è ampiamente utilizzato nella pratica di laboratorio. Inoltre, il permanganato di potassio è ampiamente usato in medicina come antisettico. Il permanganato di potassio viene anche utilizzato come fonte solida per ottenere ossigeno.
Test sul tema "Manganese e suoi composti"
1. Quale ossido è acido?
a) MnO; b) Mn2O3;
c) MnO2; d) Mn2O7.
2. Composto contenente , in un ambiente con pH
3. Nella reazione di ossidazione del solfato di ferro (II) con permanganato di potassio in un mezzo di acido solforico, la somma dei coefficienti davanti ai reagenti è:
a) 11; b) 15; c)16; d) 20.
4. In quale dei seguenti composti l'atomo di manganese ha il più alto stato di ossidazione possibile?
a) Permanganato di potassio; b) manganato di potassio;
c) solfuro di manganese; d) acido permanganico.
5. Quale degli ossidi di manganese ha la massima frazione massica di ossigeno?
a) MnO; b) Mn2O3; c) MnO2; d) Mn2O7.
6. La densità di una soluzione di acido solforico al 36,2% è 1,27 g/ml. Calcolare la concentrazione molare (in mol/l) dell'acido in questa soluzione.
a) Dati insufficienti per risolvere il problema;
b) 4.7; c) 36,2; d) 0,0047.
7. Quanti elettroni contiene uno ione permanganato?
c) 58; d) 120.
8. Quale massa di ioduro di potassio (in g) è stata ossidata con permanganato di potassio in soluzione di acido cloridrico se si sono formati 6,3 g di sale di manganese?
a) 8.3; b) 4,15; c) 16.6; d) 41.5.
9. La somma di tutti i coefficienti nella reazione di ossidazione dell'idrossido di ferro (II) appena precipitato con permanganato di potassio in una soluzione acquosa è:
a) 5; b) 6; alle 8; d) 11.
10. Il numero di legami -in una molecola di acido permanganico è:
a) 5; b) 3; alle 6; d) 0.
Chiave per il test
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| G | V | G | un, g | G | B | V | G | G | B |
Compiti qualitativi per la discussione
interazione a coppie di sostanze
È conveniente risolvere problemi di questo tipo utilizzando il reticolo di Pletner. In questo caso, è necessario tenere conto della possibilità che si verifichino reazioni alternative (nel caso della formazione di sali acidi e medi, nel caso di una concentrazione sconosciuta di acidi ossidanti, ecc.).
1. Discutere la possibilità di interazione a coppie tra le seguenti sostanze: acido cloridrico, cloruro di calcio, nitrato d'argento, carbonato di potassio, idrossido di sodio, cloro. Scrivi le equazioni di reazione.
Soluzione
Risolviamo utilizzando il reticolo di Pletner.
| Sostanze | HCl | CaCl2 | AgNO3 | K2CO3 | NaOH | Cl2 |
| HCl | – | – | + (1a equazione) |
+ (2a equazione) |
+ (3a equazione) |
– |
| CaCl2 | – | – | + (4a equazione) |
+ (6a equazione) |
+ (7a equazione) |
– |
| AgNO3 | + (1a equazione) |
+ (4a equazione) |
– | + (5a equazione) |
+ (ottava equazione) |
– |
| K2CO3 | + (2a equazione) |
+ (6a equazione) |
+ (5a equazione) |
– | – | – |
| NaOH | + (3a equazione) |
+ (7a equazione) |
+ (ottava equazione) |
– | – | + (9a e 10a equazione) |
| Cl2 | – | – | – | – | + (9a e 10a equazione) |
– |
1) HCl + AgNO 3 \u003d AgCl + HNO 3.
2) 2HCl + K 2 CO 3 \u003d 2KCl + H 2 O + CO 2.
3) HCl + NaOH = NaCl + H2O.
4) CaCl 2 + 2AgNO 3 \u003d 2AgCl + Ca (NO 3) 2.
5) 2AgNO3 + K2CO3 = Ag2CO3 + 2KNO3.
6) CaCl2 + K2CO3 = CaCO3 + 2KCl.
7) CaCl 2 + 2NaOH \u003d Ca (OH) 2 + 2NaCl.
8) 2AgNO 3 + 2NaOH \u003d Ag 2 O + 2NaNO 3 + H 2 O.
9) 2NaOH + Cl2NaCl + NaClO + H2O.
10) 6NaOH + 3Cl2 5NaCl + NaClO3 + 3H2O.
Risposta. 9 opzioni per possibili coppie
2. Quali delle seguenti sostanze reagiscono tra loro: rame, acido nitrico concentrato, carbonio, zolfo, alluminio, cloruro di ferro (III), carbonato di sodio? Scrivi le equazioni di reazione.
Risposta. 14 opzioni per possibili coppie
interazioni (14 equazioni di reazione).
3. Determinare quali sostanze possono interagire tra loro: zinco, cloro, monossido di carbonio, ossido di sodio, idrossido di sodio, acido nitrico, cloruro di rame (II). Scrivi le equazioni di reazione.
Risposta. 12 opzioni per possibili coppie
interazioni (15 equazioni di reazione).
4. Quali delle seguenti sostanze possono interagire tra loro: bromo, idrossido di potassio, ammoniaca, acido cloridrico, ioduro di potassio, zinco. Scrivi le equazioni di reazione.
Risposta. 8 opzioni per possibili coppie
interazioni (10 equazioni di reazione).
5. Determinare quali sostanze possono interagire tra loro: calcio, acqua, ossido di rame (II), idrogeno, idrossido di calcio, acido solforico concentrato, ioduro di sodio. Scrivi le equazioni di reazione.
Risposta. 7 opzioni possibili in coppia
interazioni (7 equazioni di reazione).
6. Discutere la possibilità di interazione a coppie tra le seguenti sostanze: solfato di sodio, acetato di piombo (II), solfuro di potassio, cloruro di alluminio, nitrato di bario. Scrivi le equazioni di reazione.
Risposta. 5 opzioni per possibili coppie
interazioni (5 equazioni di reazione).
* Il segno (+/–) significa che questa reazione non procede con tutti i reagenti o in condizioni specifiche.
Continua
- In contatto con 0
- Google Plus 0
- OK 0
- Facebook 0