5. Durante il digiuno e il lavoro fisico si attiva la lipolisi nel tessuto adiposo e aumenta il flusso di acidi grassi nel tessuto. Gli acidi grassi diventano un’importante fonte di energia per tessuti come il muscolo scheletrico, il miocardio e il fegato. Tuttavia, il cervello non può utilizzare gli acidi grassi come fonte di energia perché non penetrano la barriera ematoencefalica, essendo molecole idrofobiche. Pertanto, in tali situazioni, soprattutto durante la fame prolungata, il fegato trasforma circa il 50% degli acidi grassi che lo inseriscono in altre fonti di energia - corpi chetonici, che può essere utilizzato dal tessuto nervoso.
ARGOMENTO 8.9. CORPI CHETONICI: SINTESI E CATABOLISMO.
CHETOACIDOSI
1. Esistono tre tipi di corpi chetonici: β-idrossibutirrato, acetoacetato E acetone.
Solo i primi due sono fonti di energia e possono essere ossidati nei tessuti. Normalmente, la concentrazione di corpi chetonici nel sangue è bassa ed è pari a 1-3 mg / dL. La sintesi dei corpi chetonici aumenta con:
digiuno;
Attività fisica intensa e prolungata;
Mangiare cibi ricchi di grassi, ma poveri di carboidrati (dieta Atkins, dieta "Cremlino");
diabete mellito.
I corpi chetonici sono acidi idrosolubili, quindi, a differenza degli acidi grassi, possono attraversare la barriera ematoencefalica e, insieme al glucosio, fungere da fonte di energia per il tessuto nervoso, soprattutto dopo 3-5 giorni di digiuno, quando la concentrazione dei corpi chetonici nel sangue aumenta in modo significativo (Fig. 8.20).
I muscoli scheletrici e i reni utilizzano i corpi chetonici anche a bassi livelli ematici.
Riso. 8.20. Cambiamenti nella concentrazione di glucosio, acidi grassi e corpi chetonici nel plasma sanguigno durante il digiuno
2. La sintesi dei corpi chetonici avviene nei mitocondri del fegato e in piccola quantità nello strato corticale dei reni. Il substrato iniziale per la sintesi è l'acetil-CoA, che si forma a seguito della β-ossidazione degli acidi grassi. La situazione in cui aumenta la sintesi dei corpi chetonici si sviluppa come segue. Durante il digiuno, l'ormone glucagone (o adrenalina durante il lavoro fisico) attraverso il sistema adenilatociclasi nel tessuto adiposo attiva la scomposizione dei grassi. Gli acidi grassi vengono rilasciati nel sangue e trasportati insieme all'albumina al fegato. Nel fegato aumenta il tasso di β-ossidazione e si forma una grande quantità di acetil-CoA. La velocità delle reazioni del ciclo di Krebs in queste condizioni è ridotta a causa dell'inibizione degli enzimi regolatori del ciclo del citrato da parte degli inibitori allosterici di ATP e NADH, la cui concentrazione aumenta a causa della β-ossidazione attiva. Inoltre, ad un'elevata concentrazione di NADH, l'ossalacetato viene ridotto a malato e in questa forma viene trasferito nel citosol, dove la reazione procede nella direzione opposta. L'ossalacetato diventa un substrato per la gluconeogenesi ed è meno disponibile per l'interazione con l'acetil-CoA. Di conseguenza, nei mitocondri si accumula acetil-CoA, che viene utilizzato per la sintesi dei corpi chetonici (Fig. 8.21, 8.22).
Il meccanismo classico di formazione dell'obesità prevede un aumento della capacità di formare grasso e la sua deposizione nel tessuto adiposo, principalmente in “depositi di grasso”, e la difficoltà a mobilitare il grasso dai tessuti. L'aumento dell'accumulo di grasso nel corpo è dovuto non tanto ai grassi introdotti per via esogena e formati per via endogena, quanto ai carboidrati. L'attivazione dei cicli metabolici che promuovono la neoformazione dei grassi dai carboidrati nell'obesità si esprime principalmente nel tessuto adiposo. Naturalmente dovrebbe occupare un posto centrale tra i meccanismi patogenetici dell'obesità.
Il tessuto adiposo in una persona sana rappresenta fino al 20% del peso corporeo, ma in un soggetto obeso può raggiungere il 40-50%, ed in alcuni casi arrivare al 70%. La maggior parte del tessuto adiposo è costituito da trigliceridi (70-90%). Il normale tessuto adiposo non è un semplice deposito di grasso. Ha un'elevata attività metabolica. È sottoposto continuamente a processi metabolici intensivi, come la sintesi e l'idrolisi dei lipidi: la sintesi degli acidi grassi, anche provenienti dai carboidrati, la loro esterificazione in trigliceridi o grasso neutro, la sua deposizione e scomposizione con formazione di acidi grassi e l'utilizzo del quest’ultimo per scopi energetici. In una persona sana, i processi di lipogenesi e lipolisi sono equilibrati. La sintesi dei grassi è fornita da due cicli metabolici: glicolitico e pentoso.
La via glicolitica prevede la sintesi del glicerolo dal glucosio attraverso la formazione di α-glicerofosfato. Il glicerolo libero nel tessuto adiposo viene utilizzato per sintetizzare i trigliceridi. Le fasi del ciclo pentoso comprendono la formazione di acido piruvico da monosaccaridi e amminoacidi glucogenici, la decarbossilazione, seguita dalla formazione di acetil-CoA. L'acetil-CoA, con la partecipazione dell'adenosina trifosfato (ATP) e del NADP-H2, viene condensato attraverso una serie di passaggi in acidi grassi superiori. Se il ciclo pentoso è inattivo, nel mezzo predomina il NADP non ridotto e i processi di liposintesi non sono intensi. Con la predominanza di NADP ridotto, o NADP-H2, nel mezzo, viene attivata la liposintesi.
È noto che la deposizione di grasso nel tessuto adiposo avviene principalmente a causa della sua neoplasia da carboidrati alimentari. L'intensità delle reazioni del ciclo pentoso determina la velocità di formazione degli acidi grassi dal glucosio. Nel tessuto adiposo, rispetto ad altri tessuti del corpo, il ciclo dei pentoso fosfati ha la massima attività. Il rapporto tra questo e il ciclo glicolitico nel tessuto adiposo è di circa 1:1, nel fegato di 1:12, mentre nel tessuto intestinale lo scambio del ciclo pentoso non avviene affatto [Leites SM, 1967]. Calcoli basati sui risultati di studi con carbonio marcato hanno mostrato che il tessuto adiposo utilizza circa il 50% del glucosio che vi è entrato nelle reazioni di glicolisi e il 50% viene ossidato dal pentoso fosfato e da altre vie metaboliche alternative.
È stato dimostrato che i processi di liposintesi nell'obesità sono in larga misura potenziati da un aumento dell'attività non della glicolisi, ma del ciclo del pentoso fosfato [Shonka G., Ermolenko R. I., 1960]. Un'alimentazione eccessiva, in particolare l'assunzione eccessiva di carboidrati dal cibo, è considerata uno dei fattori gravi che contribuiscono all'attivazione del ciclo del pentoso fosfato.
Fino a poco tempo fa, il rapporto enzimatico nel tessuto adiposo veniva studiato solo in esperimenti su animali [Leites SM, Davtyan NK, 1965; Pokrovsky A. A., Pilenitsyna R. A., 1966; Kogp, 1955, 1959; Korn et al., 1957]. Molti studi hanno dimostrato l'importante ruolo delle lipasi (idrolasi degli esteri del glicerolo e degli acidi grassi; EC 3.1.1.3) nei processi metabolici nel tessuto adiposo.
Esistono diversi tipi di lipasi, la cui attività è regolata da vari fattori: lipasi attivata dall'adrenalina; lipasi che agisce nel tessuto non stimolato; lipoproteina lipasi, la cui attività aumenta se incubata con eparina. La lipasi mobilizzatrice dei grassi idrolizza i trigliceridi, garantisce l'ingresso dei NEFA nel sangue e il loro successivo utilizzo come materiale energetico. La lipasi del tessuto adiposo, oltre all'adrenalina, viene attivata dalla norepinefrina, l'ormone somatotropico, ACTH. La lipoproteina lipasi ha effetti sia lipolitici che liposintetici sui trigliceridi del tessuto adiposo. Oltre all'eparina, l'attività della lipoproteina lipasi aumenta l'aggiunta di insulina e glucosio al mezzo di incubazione. La lipoproteina lipasi nel tessuto adiposo prepara le lipoproteine del sangue per l'assimilazione e la sintesi dei trigliceridi.
In una persona con un metabolismo normale, che non soffre di obesità, entrambe le lipasi, essendo abbastanza attive, bilanciano in una certa misura i processi di lipogenesi e liposintesi [Davtyan N. K., 1962; Leites S. M. Davtyan N. K., 1963, 1965; Davtyan N. K., Burtman R. N., 1964; Nestel, Havel, 1962; Stern et al., 1962; Chlouverakis, 1963, 1979, ecc.].
Negli animali obesi l'attività lipolitica del tessuto adiposo è ridotta. Molti autori [Leites S. M., 1962, 1967; Kekwick, Pawan, 1963, 1964 e altri] hanno riferito che nell'obesità, l'effetto lipolitico di diete appositamente selezionate, comprese quelle a basso valore energetico e ad alto contenuto di grassi, è dovuto all'attivazione degli enzimi lipolitici.
Questo divenne un prerequisito per determinare l'attività delle lipasi nel tessuto adiposo sottocutaneo nei pazienti obesi presso l'Istituto di nutrizione dell'Accademia delle scienze mediche dell'URSS [Pokrovsky A. A., Oleneva V. A., Pilenitsina R. A., 1964]. Le osservazioni hanno dimostrato che in tutte le persone obese l'attività di entrambe le lipasi è drasticamente ridotta. L'attività della lipasi mobilizzatrice dei grassi nei pazienti obesi è ridotta di 5 volte, la lipasi lipoproteica di 2,6 volte. Gli stessi rapporti sono stati mantenuti con l'uso di attivatori: adrenalina ed eparina.
La diminuzione simultanea dell'attività di due enzimi ad azione opposta ha permesso di avanzare un'ipotesi sulla profonda inerzia metabolica del tessuto adiposo nei pazienti obesi. Tuttavia, con un'attività enzimatica generalmente bassa, l'attività dell'enzima che provvede alla lipolisi è particolarmente ridotta.
Il rapporto tra lipoproteine e lipasi mobilitanti i grassi nel tessuto adiposo sottocutaneo mostra in modo molto provocatorio la predominanza della liposintesi sulla lipolisi nei pazienti obesi con un'inerzia metabolica generale del tessuto adiposo. È stato dimostrato che lo spostamento dell'attività enzimatica verso la liposintesi è chiaramente visibile dopo stimolazione con attivatori fisiologici. In queste condizioni, il rapporto tra l'attività delle lipoproteine e delle lipasi mobilitanti i grassi nel tessuto adiposo nelle persone obese ha superato la cifra corrispondente nelle persone sane più che in Obraz. È necessario non solo valutare questo fenomeno dal punto di vista della riduzione dei processi di ossidazione biologica, sconvolgendo l'equilibrio dinamico tra la mobilitazione dei NEFA da parte del tessuto adiposo nell'obesità e l'insufficienza del loro utilizzo a fini energetici da parte di altri tessuti dell'organismo. corpo, ma anche ipotizzare una sorta di blocco della rimozione permanente dei NEFA dai depositi di grasso, che è direttamente correlato all'inibizione della lipolisi dovuta alla diminuzione dell'attività enzimatica.
Negli ultimi anni è aumentato l’interesse per un altro enzima del tessuto adiposo, la glucosio-6-fosfato deidrogenasi (G-6-PDH). Questo enzima è un enzima chiave nel ciclo del pentoso fosfato e nel tessuto adiposo la via del pentoso per la conversione del glucosio-6-fosfato funziona in modo molto intenso. Il glucosio-6-fosfato viene ossidato dalla deidrogenasi a 6-fosfogluconato, che viene poi ulteriormente ossidato da un'altra deidrogenasi. Il tessuto adiposo rimane la fonte più ricca di deidrogenasi che disidratano gli acidi grassi superiori. A questo proposito, l'attività del tessuto adiposo è 2-3 volte superiore all'attività del fegato, dei muscoli e dei reni - 30 volte [Leites SM, 1948, 1954]. L'elevata attività della via del pentoso G-6-PDG indica ancora una volta la grande capacità del tessuto adiposo di generare NADPH2, necessario per la biosintesi degli acidi grassi. L'attività del G-6-PDH aumenta con l'aumento dell'ingrasso degli animali normali, nonché quando si alimentano i ratti con alimenti arricchiti con carboidrati. Sia quello che l'altro, evidentemente, sono spiegati dal rafforzamento della lipogenesi in condizioni di esperienze.
L'attività del G-6-PDG nel tessuto adiposo è stata determinata in una microsezione di tessuto adiposo sottocutaneo ottenuto mediante escissione dalla parete addominale anteriore [Mokina MN, 1971]. È stato utilizzato il metodo spettrofotometrico di Kornberg e Horecker modificato da Yu. L. Zakharyin (1967). L'attività è espressa in micromoli di NADP ridotti in 1 minuto per 1 g di proteina disciolta. Le proteine nel tessuto adiposo sono state determinate con il metodo Lowry (1967). 23 persone (13 uomini di età compresa tra 18 e 54 anni e 10 donne di età compresa tra 16 e 50 anni) con peso corporeo normale sono servite da controllo. Nel gruppo di controllo è stata ottenuta una biopsia durante l'intervento chirurgico per appendicite.
I valori medi dell'attività del G-6-PDG nelle persone con peso corporeo normale erano 20,42+3,28 μM/(min·g) di proteine.
Nei nostri studi sull’obesità, l’attività del G-6-PDG è stata significativamente ridotta di 3,7 volte rispetto alla norma. La gravità dell’obesità non ha influenzato l’attività enzimatica.
L'attività più bassa dell'enzima è stata riscontrata nelle persone obese da molto tempo. Quindi, se l'obesità è nata dall'infanzia o è durata 15-20 anni, l'attività del G-6-PDH era compresa tra 4,46 ± 0,76-4,92 ± 1,45 U e la durata della malattia non era superiore a 3-5 anni era di 12,69±1,75 unità. Nei pazienti di quest'ultimo gruppo, che hanno raggiunto relativamente recentemente diversi gradi di obesità, l'attività dell'enzima era quasi 3 volte superiore.
Di conseguenza, nei pazienti obesi, insieme alla bassa attività degli enzimi lipolitici nel tessuto adiposo, l'attività della glucosio-6-fosfato deidrogenasi, uno degli enzimi che forniscono la quantità necessaria di NADP per la biosintesi degli acidi grassi, l'enzima chiave del tessuto adiposo ciclo pentoso, è significativamente ridotto. Di conseguenza, la liposintesi viene in una certa misura inibita. I dati presentati confermano ancora una volta l'ipotesi sulla peculiare inerzia dei processi metabolici, sull'inibizione delle reazioni enzimatiche nei pazienti obesi.
40. Sotto l'azione della colesterolo esterasi, si formano:
Acido grasso. Glicerolo. Colesterolo. colesterolo e acidi grassi
41. Le lipoproteine “antiaterogeniche” includono:
Chilomicroni. lipoproteine ad alta densità . Lipoproteine a bassa densità. Micelle.
42. I cambiamenti nel contenuto delle lipoproteine del sangue nei bambini con l'età cambiano come segue:
Il contenuto di VLDL è aumentato. Il contenuto di HDL diminuisce.
43. Le caratteristiche legate all'età dei lipidi nel sangue nei bambini includono quanto segue:
Contenuto ridotto di lipidi totali. Contenuto TAG ridotto. Ridotto contenuto di acidi grassi liberi. Il contenuto di acidi grassi liberi è aumentato.
44. Le peculiarità dell'assimilazione dei grassi nei bambini includono:
Come sono nei neonati?
La digestione dei grassi inizia nello stomaco. Aumento dell'attività della lipasi pancreatica. Ridotta attività della lipasi pancreatica Diminuita sintesi degli acidi biliari. Gli acidi biliari non svolgono un ruolo decisivo.
45. Il ruolo principale del tessuto adiposo bruno nei neonati è:
È una riserva di grassi. Partecipa alla termoregolazione del corpo. Svolge un ruolo importante nella protezione meccanica.
46. Le caratteristiche dell'utilizzo dei corpi chetonici nei bambini sono le seguenti:
ossidazione più lenta. Ossidazione più rapida. Non ha differenze.
Compiti situazionali
1. A un bambino è stata diagnosticata una pancreatite cronica. I processi di digestione sono disturbati, frequente dispepsia.
Come si spiegano i disturbi di digestione in questa malattia? Quali preparati enzimatici sono indicati
2. Un bambino con un peso corporeo basso inappropriato per l'età è stato ricoverato in clinica. L'esame ha rivelato discinesia delle vie biliari e disturbi della secrezione biliare.
È possibile spiegare la perdita di peso corporeo con una diminuzione del flusso della bile, perché i grassi possono essere sintetizzati nel corpo dal glucosio? Come ripristinare lo stato del metabolismo lipidico?
3. Dopo una lunga malattia, il bambino ha perso molto peso. Quali vitamine dovrebbe prescrivere per accelerare la sintesi dei grassi nel corpo? Quale scambio deve essere ulteriormente attivato?
4. Un bambino di 6 anni manifesta un rapido affaticamento e non è in grado di svolgere un lavoro fisico. Nello studio della biopsia muscolare è stata riscontrata una maggiore inclusione di triacilgliceridi e una ridotta concentrazione di carnitina. Spiegare i disturbi biochimici che portano ad una diminuzione della forza muscolare.
6. Un bambino piccolo ha una funzionalità compromessa dei polmoni, del cervello e dei muscoli. L'acetil-CoA carbossilasi è assente nella biopsia epatica e nei fibroblasti cutanei.
Quale via metabolica è disturbata? Quali sono le possibili cause di disfunzione dei vari tessuti?
7. In un giovane di 20 anni, la concentrazione di colesterolo totale nel sangue è di 15 mmol/l, il contenuto di LDL è raddoppiato. Durante le conversazioni con il paziente, si è scoperto che suo padre è morto all'età di 45 anni a causa di un infarto miocardico. Suggerire la causa dell'ipercolesterolemia in questo paziente. Che consigli gli si possono dare?
8. Dopo una corsa di 10 km, il contenuto di corpi chetonici nel sangue di un atleta aumenta. Spiegare il motivo di questo fenomeno.
METABOLISMO DEI GRASSI
Test
1. Il colesterolo svolge funzioni biologiche nel corpo umano e animale:
Partecipa alla costruzione delle membrane cellulari. Fonte di energia. Substrato iniziale nella biosintesi degli acidi biliari Substrato iniziale nella biosintesi degli ormoni steroidei Substrato iniziale nella biosintesi della vitamina D.
2. I componenti della sfingomielina sono:
Glicerolo. Sfingosina. Oligosaccaride. Monosaccaride. Acido grasso . Acido fosforico Colina.
2. Il colesterolo viene trasportato dai tessuti periferici al fegato come parte delle lipoproteine del sangue:
Chilomicroni. LDL. VLDL. HDL.
4. Gli eicosanoidi includono derivati dell'acido arachidonico:
Prostaglandine, prostacicline, trombossani . Catecolamine. Leucotrieni .
5. L'enzima chiave della lipolisi è
TAG lipasi. DAG-lipasi. MAG-lipasi.
6. I substrati iniziali nel processo di formazione dei corpi chetonici sono:
Piruvato. Acetil-CoA Beta-idrossi, beta-metilglutaril-CoA. Lattato. Fosfoglicerolo.
7. I prodotti intermedi della sintesi del colesterolo sono sostanze:
Acido mevalonico Beta-idrossi, beta-metilglutaril-CoA Squalene. Acido beta-idrossibutirrico. Carnitina. Acido arachidonico.
8. L'enzima di lipolisi TAG-lipasi attiva gli ormoni:
Insulina. Glucagone, lipotropina. Paratormone. Adrenalina. Aldosterone.
9. Il contenuto massimo di colesterolo nel sangue di una persona adulta sana corrisponde normalmente al valore:
5,2 mmol/l . 8,2 mmol/l. 2,0 mmol/l. 10,0 mmol/l.
10. Sostanze necessarie per la sintesi dei glicosfingolipidi:
Derivati UDP dei monosaccaridi. Acido fosforico. Acidi grassi Sfingosina. Glicerolo.
11. I prodotti intermedi della beta-ossidazione degli acidi grassi sono sostanze:
acido mevalonico. Beta-idrossiacil-CoA. Beta-idrossi, beta-metilglutaril-CoA. Enoil-CoA Beta-chetoacil-CoA.
12. L'enzima chiave nella sintesi del colesterolo è:
Acetil-CoA acetiltransferasi. Beta-idrossi, beta-metilglutaril-CoA sintetasi (HMG-CoA sintetasi). Beta-idrossi, beta-metilglutaril-CoA reduttasi (HMG-CoA reduttasi).
13. I glicerofosfolipidi contengono sostanze:
Glicerolo. Sfingosina. Acidi grassi saturi.Acidi grassi insaturi.Etanolamina.Serina.Acido fosforico . Inositolo Colina.
14. Le sostanze di natura steroide sono:
Cerebrosidi. Esteri del colesterolo Ormoni della corteccia surrenale Ormoni sessuali Acidi biliari Vitamina D. Gangliosidi. Colesterolo. Lecitina.
15. I componenti dei gangliosidi della materia grigia del cervello sono:
Glicerolo. Sfingosina, oligosaccaridi, acidi grassi. Acido fosforico.
16. Il trasporto del colesterolo dal sangue a vari tessuti avviene come parte delle lipoproteine:
Chilomicroni. VLDL. LDL. HDL.
17. I corpi chetonici includono composti:
Acido acetoacetico . Acido ossalacetico. Acido succinico. Acetone Acido beta-idrossibutirrico. acido piruvico.
177. La lipogenesi attiva l'ormone:
Insulina. Somatotropina. Catecolamine. Glucagone. tiroxina.
18. Enzima fosfolipasi A 2 - uno degli enzimi chiave per la formazione di eicosanoidi biologicamente attivi è coinvolto nella scissione dei legami nelle molecole di glicerofosfolipido:
Tra glicerolo e un acido grasso in posizione alfa. Tra glicerolo e un acido grasso in posizione beta. Tra glicerina e acido fosforico. Tra acido fosforico e colina.
19. Il valore del coefficiente di aterogenicità (colesterolo totale - colesterolo HDL) / Colesterolo HDL) in un adulto è normalmente pari a:
1,0-2,0. 3,0-3,5. 2,0-3,0. 4,0-4,5. 1,3-2,5. 4,5-5,5
20. I corticosteroidi sono inibitori dell'enzima di sintesi degli eicosanoidi:
Fosfolipasi A2. Lipossigenasi. Ciclossigenasi.
21. L'aspirina, avendo un effetto antinfiammatorio, è un inibitore dell'enzima coinvolto nella sintesi degli eicosanoidi:
Fosfolipasi A2. Ciclossigenasi. Lipossigenasi. Citocromo ossidasi.
22. Le sfingolipidosi includono:
Gangliosidosi. Cerebrosidosi. Aterosclerosi. Sfingomielinosi
10. I corpi di acetone vengono utilizzati più attivamente come fonti di energia durante il digiuno prolungato:
Cervello. Muscoli scheletrici. muscolo cardiaco . Tessuto connettivo
11. NADPH 2 per la sintesi del colesterolo e degli acidi grassi fornisce:
Ciclo dell'acido tricarbossilico. Via dei pentoso fosfati . β-ossidazione degli acidi grassi.
La prima cosa che accade quando si utilizzano grassi neutri durante il digiuno e l'esercizio fisico è l'attivazione degli enzimi responsabili dell'eliminazione degli acidi grassi dal triacilglicerolo. Il primo enzima ad essere attivato si chiama lipasi triacilglicerolica o TAG lipasi.
Attualmente esiste un concetto moderno e diverso della regolazione degli enzimi responsabili della mobilitazione dei triacilgliceroli nelle cellule. Secondo questa teoria, in realtà è sensibile agli ormoni Lipasi HSL (lipasi ormono-sensibile, qui DAG-lipasi), non TAG-lipasi.
Questa pagina delinea lo schema ancora accettato, ma obsoleto, per la regolazione della lipolisi.
Oltre alla TAG-lipasi, gli adipociti contengono anche diacilglicerolo lipasi(DAG-lipasi) e monoacilglicerolo lipasi(MAG-lipasi), che sono costantemente attivi, ma a riposo la loro attività non si manifesta a causa della mancanza di un substrato. Non appena i diacilgliceroli compaiono nella cellula dopo il lavoro della TAG lipasi, la lipasi DAG costantemente attiva inizia a funzionare, il prodotto della sua reazione, il monoacilglicerolo (MAG), è un substrato della lipasi MAG. Gli acidi grassi e il glicerolo risultanti lasciano la cellula.
Idrolisi dei triacilgliceroli da parte delle lipasi delle cellule adipose
Per regolare l'attività della TAG-lipasi, è necessaria la presenza di un'influenza ormonale (adrenalina, glucagone, somatotropina, insulina e numerosi altri ormoni).
Attivazione della lipasi triacilglicerolo
L’attivazione ormono-dipendente della lipolisi negli adipociti da parte dell’adrenalina e del glucagone avviene quando il corpo è stressato ( fame, lungo lavoro muscolare, raffreddamento). L'attività della TAG-lipasi dipende principalmente dal rapporto insulina/glucagone.
In generale, la sequenza degli eventi di attivazione della lipolisi secondo lo schema classico, ma ormai obsoleto, è la seguente:
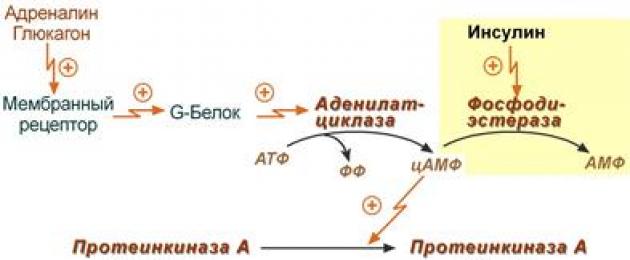
- Molecola ormone(adrenalina, glucagone, ACTH) interagisce con il suo recettore.
- Il complesso attivo ormone-recettore agisce sulla membrana proteina G.
- La proteina G attiva l'enzima adenilato ciclasi.
- L'adenilato ciclasi converte l'ATP in AMP ciclico(cAMP) è un secondo messaggero (messaggero).
- Il cAMP attiva allostericamente l'enzima proteina chinasi A.
- La proteina chinasi A fosforila TAG lipasi e attivarlo.
- TAG lipasi si divide dai triacilgliceroli ad un acido grasso in posizione 1 o 3 per formarsi diacilglicerolo(DAG).

Meccanismo a cascata dell'attivazione della TAG-lipasi
Oltre agli ormoni che influenzano l'attività dell'adenilato ciclasi attraverso le proteine G, esistono altri meccanismi di attivazione. Per esempio, ormone della crescita aumenta la quantità di adenilato ciclasi, glucocorticoidi promuovere la sintesi della TAG-lipasi.
Calcolo del bilancio energetico della β-ossidazione: Nel calcolare la quantità di ATP formata durante la β-ossidazione degli acidi grassi, è necessario tenere conto:
* la quantità di acetil-SCoA formata - è determinata dalla consueta divisione del numero di atomi di carbonio nell'acido grasso per 2;
*numero di cicli di β-ossidazione. Il numero di cicli di β-ossidazione è facile da determinare basandosi sull'idea di un acido grasso come una catena di unità a due atomi di carbonio. Il numero di pause tra le unità corrisponde al numero di cicli di β-ossidazione. Lo stesso valore può essere calcolato con la formula (n / 2 -1), dove n è il numero di atomi di carbonio nell'acido,
*numero di doppi legami in un acido grasso. Nella prima reazione di β-ossidazione, la formazione di un doppio legame avviene con la partecipazione del FAD. Se nell'acido grasso è già presente un doppio legame, questa reazione non è necessaria e non si forma FADH2. Il numero di FADH2 non formati corrisponde al numero di doppi legami. Le rimanenti reazioni del ciclo procedono senza cambiamenti;
*la quantità di energia ATP spesa per l'attivazione (corrisponde sempre a due legami macroergici).
Ossidazione degli acidi grassi con numero dispari di atomi di carbonio. F-tu con un numero dispari di atomi di carbonio entri nel corpo con cibi vegetali e frutti di mare. La loro ossidazione procede nel modo consueto fino all'ultima reazione, in cui viene campionato il propionil-SCoA. L'essenza delle trasformazioni del propionil-SCoA si riduce alla sua carbossilazione, isomerizzazione e conversione del succinil-SCoA. Queste reazioni coinvolgono biotina e B12.
Ossidazione degli acidi grassi insaturi. Quando gli acidi grassi insaturi vengono ossidati, la cellula necessita di ulteriori enzimi isomerasi. Queste isomerasi spostano i doppi legami nei residui di acidi grassi dalla posizione γ alla posizione β e trasferiscono i doppi legami naturali dalla posizione cis alla trasposizione. In questo modo il doppio legame già esistente viene preparato per la β-ossidazione e la prima reazione del ciclo, in cui è coinvolto il FAD, viene saltata.
Glicerolo- alcool trivalente, solubile in acqua e facilmente assorbibile dall'intestino ed entra nel fegato attraverso la vena porta. Ossidazione del glicerolo
Il glicerolo viene prima fosforilato con ATP in glicerofosfato (3-fosfoglicerolo). Quindi, sotto l'azione della glicerofosfato deidrogenasi NAD-dipendente, viene ossidato a 3-fosfogliceraldeide. La fosfogliceraldeide può essere ulteriormente ossidata ad acido piruvico e lattico.
Relazione tra β-ossidazione con CK e DT: Pertanto, la molecola dell'acido grasso alla fine si scompone in prodotti con solo due atomi di carbonio, che vengono convertiti nel ciclo dell'acido tricarbossilico. I coenzimi ridotti vengono successivamente riossidati nella catena respiratoria con contemporanea formazione di fosfati macroergici. In termini di formazione di ATP, l'ossidazione degli acidi grassi costituisce la principale riserva energetica dell'organismo.
Regolazione della β-ossidazione: L’enzima chiave è la carnitina aciltransferasi 1, un enzima allosterico; nel fegato, il suo inibitore allosterico è il malonil-CoA. Attiva: catecolamine, ormone della crescita, glucagone. Inibisce: insulina.
Il valore E nell'ossidazione ha per i muscoli scheletrici (50% E), per il muscolo cardiaco (70%), il cervello e altri tessuti nervosi, così come gli eritrociti non utilizzano acidi grassi per l'ossidazione; non entrano nel cervello, perché non attraversano la barriera ematoencefalica.
23. Lipolisi e lipogenesi. Senso. Dipendenza della lipogenesi dal ritmo della nutrizione e dalla composizione degli alimenti. Regolazione della lipolisi e lipogenesi. Trasporto e utilizzo degli acidi grassi formati durante la mobilizzazione dei grassi.
Sintetizzati durante e immediatamente dopo il pasto (lipogenesi) e immagazzinati nel tessuto adiposo, i triacilgliceroli sono la forma di deposito degli acidi grassi saturi e monoinsaturi. Viene anche chiamata la scomposizione dei triacilgliceroli (trigliceridi). lipolisi o mobilizzazione dei grassi. Funziona costantemente nelle cellule adipose e di solito c'è un equilibrio tra la sintesi e la scomposizione dei TAG.
Anche a riposo, il fegato, il cuore, i muscoli scheletrici e altri tessuti (eccetto eritrociti e neuroni) ricevono più del 50% della loro energia dall'ossidazione degli acidi grassi del tessuto adiposo dovuta alla lipolisi di fondo. Man mano che le riserve di glucosio diminuiscono, le cellule ottengono sempre più energia dall’ossidazione degli acidi grassi. Pertanto, gli acidi grassi saturi agiscono come una sorta di buffer energetico nel corpo. La mobilitazione dei triacilgliceroli e l'ossidazione degli acidi grassi si attivano in normali situazioni di stress fisiologico - stress emotivo, lavoro muscolare, fame, in condizioni patologiche - diabete mellito di tipo I, altre malattie ormonali (ipercorticismo, ipertiroidismo). Come risultato della lipolisi, negli adipociti si formano glicerolo libero e acidi grassi. Il glicerolo viene trasportato con il sangue al fegato e ai reni, dove viene fosforilato e ossidato nel metabolita della glicolisi diidrossiacetone fosfato. A seconda delle condizioni, il DAP può essere coinvolto nelle reazioni di gluconeogenesi (durante il digiuno, l'esercizio muscolare) o ossidato nella glicolisi ad acido piruvico. Acido grasso vengono trasportati nel sangue in combinazione con albumina plasmatica:
Durante lo sforzo fisico - nei muscoli,
In condizioni normali e durante il digiuno, tuttavia, nei muscoli e nella maggior parte dei tessuti, circa il 30% degli acidi grassi viene catturato dal fegato.
Durante la fame e l'esercizio fisico, dopo essere penetrati nelle cellule, gli acidi grassi entrano nel percorso della β-ossidazione.
In generale, la mobilizzazione del grasso può essere pensata come una sequenza dei seguenti eventi:
1. Lipolisi: degradazione ormone-dipendente dei TAG nel tessuto adiposo o riserva di TAG nella cellula stessa.
2.Trasporto degli acidi grassi dal tessuto adiposo attraverso il sangue in combinazione con l'albumina.
3. Penetrazione dell'acido grasso nel citosol della cellula bersaglio.
4. Attivazione degli acidi grassi mediante l'aggiunta di HS-CoA.
5.Movimento degli acidi grassi nei mitocondri dipendente dalla carnitina.
6. Ossidazione degli acidi grassi per formare gruppi acetile (sotto forma di acetil-S-CoA).
7. Combustione dell'acetil-S-CoA nel ciclo dell'acido citrico o sintesi (solo nel fegato) di corpi chetonici.
Solo quelli gratuiti possono essere utilizzati come fonte di energia, ad es. acidi grassi non esterificati. Pertanto, i trigliceridi vengono prima idrolizzati da specifici enzimi tissutali - lipasi - in glicerolo e acidi grassi liberi. Gli ultimi depositi di grasso possono passare nel plasma sanguigno (mobilitazione degli acidi grassi superiori), dopodiché vengono utilizzati dai tessuti e dagli organi del corpo come materiale energetico. Il tessuto adiposo contiene diverse lipasi, di cui le più importanti sono la lipasi trigliceride (la cosiddetta lipasi ormono-sensibile), la lipasi digliceride e la lipasi monogliceride. L'attività degli ultimi due enzimi è 10-100 volte superiore all'attività del primo. La lipasi trigliceride è attivata da numerosi ormoni (ad esempio epinefrina, norepinefrina, glucagone, ecc.), mentre la lipasi digliceride e la lipasi monogliceride non sono sensibili alla loro azione. La lipasi del trigliceride è un enzima regolatore. La prima cosa che accade quando si utilizzano grassi neutri durante il digiuno e l'esercizio fisico è l'attivazione dell'enzima responsabile della scissione del primo acido grasso dal triacilglicerolo. L'enzima è chiamato triacilglicerolo lipasi ormono-sensibile o TAG lipasi. Negli adipociti sono presenti, oltre alla TAG lipasi, anche la diacilglicerolo lipasi (DAG lipasi) e la monoacilglicerolo lipasi (MAG lipasi), la cui attività è elevata e costante, ma tale attività non si manifesta a riposo a causa della mancanza di un substrato. Non appena i diacilgliceroli compaiono nella cellula dopo il lavoro della TAG-lipasi, la DAG-lipasi costantemente attiva inizia a funzionare, il prodotto della sua reazione, il monoacilglicerolo (MAG), è un substrato della MAG-lipasi. Gli acidi grassi e il glicerolo risultanti lasciano la cellula. Per regolare l'attività della TAG-lipasi è necessaria la presenza di un'influenza ormonale (epinefrina, glucagone, somatotropina, insulina, ecc.).
In generale, la sequenza degli eventi di attivazione della lipolisi è la seguente:
1. Una molecola ormonale (adrenalina, glucagone, ACTH) interagisce con il suo recettore.
2. Il complesso attivo ormone-recettore agisce sulla proteina G di membrana.
La proteina 3.G attiva l'enzima adenilato ciclasi.
4. L'adenilato ciclasi converte l'ATP in cAMP, un secondo messaggero (messaggero).
5. Il cAMP attiva allostericamente l'enzima proteina chinasi A.
6. La proteina chinasi A fosforila la TAG lipasi e la attiva.
7. La TAG-lipasi scinde un acido grasso dai triacilgliceroli in posizione 1 o 3 per formare diacilglicerolo (DAG). La lipasi attiva dei trigliceridi scompone i trigliceridi in digliceridi e acidi grassi. Quindi, sotto l'azione delle lipasi di- e monogliceridi, si formano i prodotti finali della lipolisi: glicerolo e acidi grassi liberi, che entrano nel flusso sanguigno.
Il tasso di lipolisi dei trigliceridi non è costante, è soggetto all'influenza regolatoria di vari fattori, tra i quali quelli neuroormonali sono di particolare importanza.
Gli acidi grassi liberi associati alle albumine plasmatiche sotto forma di complessi entrano con il flusso sanguigno negli organi e nei tessuti, dove il complesso si decompone e gli acidi grassi subiscono β-ossidazione o vengono parzialmente utilizzati per la sintesi di trigliceridi, glicerofosfolipidi , sfingofosfolipidi e altri composti, nonché per l'esterificazione del colesterolo. Durante il lavoro fisico e altre condizioni del corpo che richiedono un maggiore consumo energetico, aumenta il consumo di trigliceridi del tessuto adiposo come riserva energetica.
Attiva: catecolamine (adrenalina), glucagone, tiroxina, cortisolo, cAMP. Inibisce: insulina.
La lipogenesi è la sintesi del grasso a partire dal glicerolo e dagli acidi grassi. Si verifica nel fegato e nel tessuto adiposo. La glicerina e gli acidi grassi devono essere in forma attiva. Nel tessuto adiposo non è presente la glicerolo chinasi, quindi la forma attiva si ottiene dal DOAP, un metabolita della glicolisi (dal glucosio). La sintesi dei grassi avviene durante il periodo di assorbimento (dopo aver mangiato). Le molecole di grasso negli adipociti sono combinate con una grande goccia e costituiscono una forma compatta di deposito delle riserve di E. Lo scambio di grasso nel tessuto adiposo procede molto attivamente: in pochi giorni viene completamente aggiornato. Nel fegato vengono prelevati quotidianamente 20-50 g di grassi, che entrano nel sangue come parte delle VLDL. Enzima chiave: aciltransferasi. Attiva: insulina, estrogeni e ATP. Inibiscono: catecolamine, ormone della crescita, iodotironine, ACTH, ADP. Sintesi dei grassi neutri avviene a causa dell'esterificazione del glicero-1-fosfato con due acidi grassi attivati. Il gruppo fosfato dell'acido fosfatidico formato viene scisso dalle fosfatasi, il che porta alla formazione di diacilglicerolo, che poi reagisce con un altro acido grasso attivato, formando triacilglicerolo. I triacilgliceroli costituiscono il deposito energetico del corpo. Hanno un calore di ossidazione molto elevato, pari a 37,6 kJ/mol. I grassi sono localizzati nelle cellule adipose (adipociti) e sono caratterizzati da un elevato tasso metabolico. La loro trasformazione è regolata direttamente dagli ormoni, in particolare dall'insulina e dall'adrenalina. Reazioni biosintesi dei lipidi può entrare nel reticolo endoplasmatico liscio delle cellule di tutti gli organi. Il substrato per la sintesi dei grassi de novo è il glucosio. Come sapete, entrando nelle cellule, il glucosio viene convertito in glicogeno, pentosi e ossidato in acido piruvico. Quando la disponibilità è elevata, il glucosio viene utilizzato per la sintesi del glicogeno, ma questa opzione è limitata dal volume cellulare. Pertanto, il glucosio "cade" nella glicolisi e viene convertito in piruvato direttamente o tramite uno shunt del pentoso fosfato. Nel secondo caso si forma NADPH, che sarà necessario successivamente per la sintesi degli acidi grassi. Il piruvato entra nei mitocondri e viene decarbossilato in acetil-SCoA ed entra nel ciclo TCA. Tuttavia, a riposo, in presenza di un eccesso di energia nella cellula, le reazioni del TCA (in particolare la reazione dell'isocitrato deidrogenasi) vengono bloccate da un eccesso di ATP e NADH. Di conseguenza, si accumula il primo metabolita del TCA, il citrato. Lungo il gradiente di concentrazione, si sposta nel citosol, dove viene scisso per formare acetil-SCoA, che viene ulteriormente utilizzato nella biosintesi del colesterolo, degli acidi grassi e dei triacilgliceroli. L'ossalacetato, anch'esso formato dal citrato, viene ridotto ad acido malico e restituito ai mitocondri *tramite la navetta malato-aspartato (non mostrata), *dopo la decarbossilazione del malato in piruvato da parte dell'enzima malico NADP-dipendente. Il NADPH formato verrà utilizzato nella sintesi degli acidi grassi.
Digiuno, lavoro muscolare, riposo nel periodo postassorbimento. Nel periodo post-assorbimento e durante il digiuno i chilomicroni e le VLDL sono assenti nel sangue. Poiché questa condizione è solitamente accompagnata da ipoglicemia, il glucagone viene secreto dal pancreas per compensare. Sotto l'influenza del glucagone e di altri ormoni nei depositi di grasso, viene attivata la scomposizione dei TAG in acidi grassi e glicerolo (lipolisi). Il trasporto degli acidi grassi immessi nel sangue viene effettuato dall'albumina. Durante il lavoro fisico, gli ormoni adrenalina, somatotropina e glucocorticoidi, che colpiscono gli adipociti, provocano anche la lipolisi e il rilascio di acidi grassi nel sangue. In combinazione con l'albumina, questi acidi vengono consegnati principalmente al muscolo per garantire la contrazione muscolare. A riposo, quando i processi di digestione sono già terminati, durante il digiuno a breve e lungo termine, durante l'attività fisica nella maggior parte delle cellule, ad eccezione dei neuroni e degli eritrociti, gli acidi grassi vengono bruciati nei processi di β-ossidazione e TCA, fornendo il 50% o più dell'energia totale della cellula. Nel fegato, durante il digiuno prolungato (più di 20 ore), gli acidi grassi vengono inviati alla chetogenesi per la sintesi dei corpi chetonici. I corpi chetonici vengono ulteriormente trasportati in tutto il corpo, convertiti in acetil-SCoA e utilizzati per fornire energia alle cellule.
24. Biosintesi degli acidi grassi: sequenza di reazioni, significato fisiologico, regolazione.
La biosintesi degli acidi grassi avviene più attivamente nel citosol delle cellule del fegato, dell'intestino, del tessuto adiposo a riposo o dopo aver mangiato.
Convenzionalmente si possono distinguere 4 fasi della biosintesi:
1. Formazione di acetil-SCoA da glucosio, altri monosaccaridi o aminoacidi chetogenici.
2. Trasferimento di acetil-SCoA dai mitocondri al citosol: *può essere in complesso con la carnitina, simile al modo in cui gli acidi grassi superiori vengono trasportati nei mitocondri, ma qui il trasporto va in una direzione diversa, *di solito nella composizione dell'acido citrico formato nella prima reazione del TCA.
Il citrato proveniente dai mitocondri nel citosol viene scisso dall'ATP-citrato-liasi in ossalacetato e acetil-SCoA. L'ossalacetato viene ulteriormente ridotto a malato e quest'ultimo entra nei mitocondri (navetta malato-aspartato) o viene decarbossilato in enzima piruvato-malico (enzima "malico").
3. Formazione di malonil-SCoA da acetil-SCoA. La carbossilazione dell'acetil-SCoA è catalizzata dall'acetil-SCoA carbossilasi, un complesso multienzimatico di tre enzimi.
4. Sintesi dell'acido palmitico. Viene effettuato dal complesso multienzimatico "acido grasso sintasi" (sinonimo di palmitato sintasi), che comprende 6 enzimi e una proteina che trasporta l'acile (ACP). La proteina che trasporta l'acile include un derivato dell'acido pantotenico, la 6-fosfopantetina (PP), che ha un gruppo HS, simile a HS-CoA. Uno degli enzimi del complesso, la 3-chetoacil sintasi, ha anche un gruppo HS nella cisteina. L'interazione di questi gruppi determina l'inizio e la continuazione della biosintesi degli acidi grassi, vale a dire dell'acido palmitico. Le reazioni di sintesi richiedono NADPH. Nelle prime due reazioni, la malonil-SCoA è attaccata sequenzialmente alla fosfopantetina della proteina che trasporta l'acile e l'acetil-SCoA alla cisteina della 3-chetoacil sintasi. La 3-chetoacil sintasi catalizza la terza reazione, il trasferimento del gruppo acetile a C2 del malonile con l'eliminazione del gruppo carbossilico. Inoltre, il gruppo cheto nelle reazioni di riduzione (3-chetoacil reduttasi), disidratazione (disidratasi) e ancora riduzione (enoil reduttasi) si trasforma in metilene con la formazione di un acile saturo associato alla fosfopantetina. L'aciltransferasi trasferisce l'acile risultante alla cisteina della 3-chetoacil sintasi, la malonil-SCoA è attaccata alla fosfopantetina e il ciclo viene ripetuto 7 volte fino alla formazione di un residuo di acido palmitico. Successivamente, l'acido palmitico viene scisso dal sesto enzima del complesso, la tioesterasi. Allungamento della catena degli acidi grassi
L'acido palmitico sintetizzato, se necessario, entra nel reticolo endoplasmatico o nei mitocondri. Qui, con la partecipazione di malonil-S-CoA e NADPH, la catena si estende a C18 o C20. Anche gli acidi grassi insaturi (oleico, linoleico, linolenico) possono allungarsi con formazione di derivati dell'acido eicosanoico (C20). Ma il doppio legame viene introdotto dalle cellule animali non più di 9 atomi di carbonio, quindi gli acidi grassi polinsaturi ω3 e ω6 vengono sintetizzati solo dai corrispondenti precursori.
Sintetizzatore-Xia in org-me principalmente acido palmitico. Se necessario, arrivederci a un gran numero di atomi di carbonio. Insaturo bene arr-Xia sulle membrane dell'EPS con la partecipazione di O2, NADH e B5. Sotto l'influenza degli enzimi desaturasi, vengono campionati gli acidi palmitico e oleico. I polinsaturi (linoleico, arachidonico, linolenico) dovrebbero essere forniti con il cibo. La fonte di carboidrati per la sintesi del pozzo to-t è l'acetil-CoA, campionato durante la scomposizione dei carboidrati. Un eccesso di carboidrati che entrano nell'org-m si trasforma in bene per te e poi in grassi.
L'enzima limitante è l'acetil-CoAcarbossilasi. Attivatori allosterici - ATP e citrato, inibitori - acidi grassi a catena lunga. L'insulina, gli estrogeni attivano, le catecolamine e lo stress inibiscono la sintesi degli acidi grassi. Significato: nel decadimento degli idrocarburi arr. acetil-Coa, che viene utilizzato nella sintesi degli acidi grassi, ad es. l'HC in eccesso viene immagazzinato come grasso.
25. Modi di formazione e utilizzo dell'acetil-CoA. Biosintesi e significato dei corpi chetonici. I limiti dei cambiamenti nella concentrazione dei corpi chetonici nel sangue sono normali, durante la fame e il diabete mellito.
Acetil-CoAè il metabolita centrale del metabolismo lipidico.
Fonti: 1) Glucosio 2) Glicerina 3) AA) (con lavoro muscolare intenso di breve durata) 4) Acidi grassi (in-ossidazione durante lavoro muscolare prolungato, a digiuno, al freddo, in gravidanza e nel diabete). Le modalità di utilizzo dell'acetil-CoA formato dipendono dallo stato funzionale della cellula (carica energetica) e dalla sua specificità. Se c'è abbastanza ATP nelle cellule, viene utilizzato per la sintesi del pozzo-t, perché. L'ATP attiva gli enzimi chiave della sintesi e il loro accumulo stimola la sintesi dei grassi. La disgregazione dei grassi è inibita e anche la β-ossidazione è inibita. Lavoro muscolare intenso, stress, aumento della secrezione di catecolamine attiva la lipolisi, β-ossidazione a - t; in questo caso viene attivata la sintesi dei corpi chetonici e del TCA.
Modi d'uso: 1. ossidato nel ciclo di Krebs (90%); 2. utilizzato nella sintesi degli acidi grassi (9%) 3. Formazione di B-idrossi-p-metilglutarilCoA (e da esso colesterolo o corpi chetonici -1%)
In condizioni accompagnate da una diminuzione del glucosio nel sangue, le cellule di organi e tessuti sperimentano la fame di energia. Poiché l’ossidazione degli acidi grassi è un processo “labour intensive”, e il tessuto nervoso generalmente non è in grado di ossidare gli acidi grassi, il fegato facilita l’utilizzo di questi acidi da parte dei tessuti, ossidandoli preventivamente in acido acetico e convertendo quest’ultimo in un modulo di trasporto - corpi chetonici. I corpi chetonici comprendono tre composti di struttura simile: acetoacetato, 3-idrossibutirrato e acetone. Lo stimolo per la formazione dei corpi chetonici è l'apporto di grandi quantità di acidi grassi al fegato. Come già accennato, in condizioni che attivano la lipolisi nel tessuto adiposo, almeno il 30% degli acidi grassi formati viene trattenuto dal fegato. Queste condizioni includono il digiuno, il diabete di tipo I e l’attività fisica prolungata. Poiché la sintesi dei TAG in queste condizioni è impossibile, gli acidi grassi dal citosol entrano nei mitocondri e vengono ossidati per formare chetoni. Oltre alle situazioni indicate, il numero di corpi chetonici nel sangue aumenta con l'avvelenamento da alcol e il consumo di cibi grassi. Con una dieta ricca di grassi, soprattutto nei bambini, gli acidi grassi non hanno il tempo di essere inclusi nella composizione di TAG e VLDL e passano parzialmente nei mitocondri, aumentando la sintesi dei corpi chetonici. Nell'avvelenamento da alcol, il substrato per la sintesi dei chetoni è l'acetil-SCoA, che viene sintetizzato durante la neutralizzazione dell'etanolo. In condizioni normali avviene anche la sintesi dei corpi chetonici, sebbene in quantità molto minori. Per questo vengono utilizzati sia acidi grassi che residui privi di azoto di aminoacidi chetogenici e misti. . Sintesi dell'acetoacetato si verifica solo nei mitocondri del fegato, quindi viene ridotto a 3-idrossibutirrato o decarbossilato spontaneamente in acetone. Inoltre, tutti e tre i composti entrano nel sangue e vengono trasportati attraverso i tessuti. L'acetone, essendo una sostanza volatile, viene facilmente rimosso con l'aria espirata e il sudore. Tutti i corpi chetonici possono essere escreti nelle urine. I corpi chetonici vengono utilizzati dalle cellule di tutti i tessuti, ad eccezione del fegato e dei globuli rossi. Soprattutto attivamente, anche nella norma, vengono consumati dal miocardio e dallo strato corticale delle ghiandole surrenali. Le reazioni di utilizzazione dei corpi chetonici coincidono approssimativamente con la direzione inversa delle reazioni di sintesi. Nel citosol, il 3-idrossibutirrato viene ossidato, l'acetoacetato risultante penetra nei mitocondri, viene attivato dal succinil-SCoA e si trasforma in acetil-SCoA, che brucia nel ciclo TCA.
Regolazione della sintesi dei corpi chetonici. L'enzima regolatore per la sintesi dei corpi chetonici è l'HMG-CoA sintasi.
*HMG-CoA sintasi - enzima inducibile; la sua sintesi aumenta con l'aumento della concentrazione di acidi grassi nel sangue. La concentrazione di acidi grassi nel sangue aumenta con la mobilitazione dei grassi dal tessuto adiposo sotto l'azione del glucagone, dell'adrenalina, cioè. durante il digiuno o il lavoro fisico.
*L'HMG-CoA sintasi è inibita da elevate concentrazioni di coenzima A libero.
*Quando aumenta l’apporto di acidi grassi alle cellule del fegato, il CoA si lega ad esse, la concentrazione di CoA libero diminuisce e l’enzima diventa attivo.
*Se diminuisce l'apporto di acidi grassi nelle cellule del fegato, aumenta di conseguenza la concentrazione di CoA libero, che inibisce l'enzima. Di conseguenza, la velocità di sintesi dei corpi chetonici nel fegato dipende dall'assunzione di acidi grassi.
I corpi chetonici si formano nel fegato e svolgono le seguenti funzioni caratteristiche: 1. Energia. I muscoli scheletrici e cardiaci, il cervello e altri tessuti extraepatici forniscono il fabbisogno energetico dovuto al catabolismo dei corpi chetonici. Il fegato non può ossidare i corpi chetonici. 2. Necessario per la formazione delle guaine mieliniche dei nervi e della sostanza bianca del cervello.
L'utilizzo dei corpi chetonici avviene nei mitocondri. Il beta-idrossibutirrato viene convertito in acetoacetato e l'acetoacetato reagisce con l'intermedio TCA, il succinil-CoA. Con il digiuno prolungato, i corpi chetonici diventano la principale fonte di energia per i muscoli scheletrici, il cuore e i reni. Pertanto, il glucosio viene immagazzinato per l'ossidazione nel cervello e nei globuli rossi. Già 2-3 giorni dopo l'inizio del digiuno, la concentrazione di corpi chetonici nel sangue è sufficiente perché possano passare nelle cellule cerebrali e ossidarsi, riducendo il fabbisogno di glucosio. Il β-idrossibutirrato (Fig. 8-34), entrando nelle cellule, viene disidratato dalla deidrogenasi NAD-dipendente e convertito in acetoacetato. L'acetoacetato viene attivato interagendo con succinil-CoA, un donatore di CoA: Acetoacetato + succinil-CoA → Acetoacetil-CoA + succinato
La reazione è catalizzata dalla succinil-CoA-acetoacetato-CoA transferasi. Questo enzima non è sintetizzato nel fegato, quindi il fegato non utilizza i corpi chetonici come fonte di energia, ma li produce "per l'esportazione". I corpi chetonici sono buone molecole di combustibile; l'ossidazione di una molecola di β-idrossibutirrato in CO2 e H2O garantisce la sintesi di 27 molecole di ATP. L'equivalente di un legame macroergico di ATP (in una molecola di succinil-CoA) viene utilizzato per attivare l'acetoacetato, quindi la resa totale di ATP durante l'ossidazione di una molecola di β-idrossibutirrato è di 26 molecole.
Normalmente, i processi di sintesi e utilizzo dei corpi chetonici sono equilibrati, quindi la concentrazione di corpi chetonici nel sangue e nei tessuti è solitamente molto bassa ed è pari a 0,12-0,30 mmol / l. Normalmente il numero di CT nel sangue è 1 -3 mg, nelle urine 40 mg. Con diabete mellito 10-50 mg nelle urine. L'accumulo di corpi chetonici nell'organismo è chiamato chetosi ed è accompagnato da chetonemia e chetonuria. Chetosi fisiologica - durante la fame, il lavoro muscolare pesante, nei neonati. Patologico - con diabete mellito. Tuttavia, durante la fame generale o di carboidrati, l’equilibrio tra la formazione e l’utilizzo dei corpi chetonici può essere disturbato. Ciò è dovuto al fatto che la velocità di formazione dei corpi chetonici dipende dalla velocità di ossidazione degli acidi grassi nel fegato e il processo di ossidazione accelera con l'aumento della lipolisi (disgregazione dei grassi) nel tessuto adiposo. Il rafforzamento della lipolisi può avvenire sotto l'azione dell'ormone adrenalina, durante il lavoro muscolare, durante il digiuno. In caso di carenza di insulina (diabete mellito) si verifica anche un aumento della lipolisi. Con l'aumento della lipolisi, aumenta il tasso di utilizzo dei corpi chetonici, che sono importanti fonti di energia durante il lavoro muscolare, la fame.
Il graduale esaurimento delle riserve di carboidrati nel diabete mellito porta ad un relativo ritardo nell'utilizzo dei corpi chetonici dalla chetogenesi. Il motivo del ritardo: non ci sono abbastanza succinil-CoA e PIEC, che sono principalmente un prodotto del metabolismo dei carboidrati. Pertanto, l'espressione è vera: "I grassi bruciano nella fiamma dei carboidrati". Ciò significa che per un utilizzo efficace dei prodotti di degradazione dei grassi sono necessari i prodotti del metabolismo dei carboidrati: succinil-CoA e PEA.
Pertanto, durante la carenza di carboidrati, aumenta la concentrazione di corpi chetonici nel sangue. Nel 3o giorno di digiuno, la concentrazione di corpi chetonici nel sangue sarà di circa 2-3 mmol / l, e con un ulteriore digiuno sarà molto più alta. Questa condizione è chiamata iperchetonemia. Nelle persone sane, durante il lavoro muscolare e durante il digiuno, si osserva iperchetonemia, ma è insignificante.
Una situazione simile è tipica del diabete mellito. Nel diabete mellito, le cellule sono permanentemente gravemente carenti di carboidrati, perché il glucosio non penetra bene nelle cellule. Si verifica un'attivazione della lipolisi e aumenta la formazione di corpi chetonici. Nelle forme gravi di diabete mellito, la concentrazione di corpi chetonici nel sangue può essere ancora più elevata e raggiungere valori potenzialmente letali: fino a 20 mmol / lo più. Tutti i corpi chetonici sono acidi organici. Il loro accumulo porta ad uno spostamento del pH verso il lato acido. In clinica, un aumento della concentrazione di corpi chetonici nel sangue è chiamato iperchetonemia e uno spostamento simultaneo del pH verso il lato acido è chiamato chetoacidosi. Il lavoro di molti sistemi enzimatici viene interrotto. Un aumento della concentrazione di acetoacetato porta ad una formazione accelerata di acetone. L'acetone è una sostanza tossica (solvente organico). Si dissolve nei componenti lipidici delle membrane cellulari e le disorganizza. Tutti i tessuti del corpo soffrono e soprattutto le cellule del tessuto nervoso. Ciò può manifestarsi con perdita di coscienza (coma iperglicemico). In casi molto gravi può verificarsi la morte. Il corpo cerca di difendersi, quindi una parte dei corpi chetonici viene escreta nelle urine. La comparsa di corpi chetonici nelle urine è chetonuria. Per riconoscere il coma iper e ipoglicemico, viene utilizzata la diagnostica espressa dei corpi chetonici. Si basa sul fatto che l'iperchetonemia porta all'escrezione di corpi chetonici nelle urine (chetonuria). Pertanto, viene effettuata una reazione cromatica per la presenza di corpi chetonici nelle urine. In precedenza, la diagnosi veniva fatta dall'odore di acetone dalla bocca del paziente con coma iperglicemico (odore di mele marce).
26. Sintesi del colesterolo, regolazione. Il significato biologico del colesterolo. Aterosclerosi. Fattori di rischio per lo sviluppo dell'aterosclerosi.
colesterolo- uno steroide, caratteristico solo per gli organismi animali. È sintetizzato in molti tessuti umani, ma il principale sito di sintesi è il fegato. Più del 50% del colesterolo è sintetizzato nel fegato, il 15-20% nell'intestino tenue, il resto del colesterolo è sintetizzato nella pelle, nella corteccia surrenale e nelle gonadi. Nell'organismo viene sintetizzato circa 1 g di colesterolo al giorno; con il cibo arrivano 300-500 mg. Il colesterolo (colesterolo) è un alcol monovalente. Include anelli di ciclopentanoperidrofenantrene e una catena laterale a 8 atomi di carbonio. Biosintesi del colesterolo avviene nel reticolo endoplasmatico. La fonte di tutti gli atomi di carbonio nella molecola è l'acetil-SCoA, che proviene dai mitocondri come parte del citrato, proprio come nella sintesi degli acidi grassi. La biosintesi del colesterolo consuma 18 molecole di ATP e 13 molecole di NADPH. La formazione del colesterolo avviene in più di 30 reazioni, che possono essere raggruppate in diverse fasi: 1. Sintesi dell'acido mevalonico. Le prime due reazioni di sintesi coincidono con le reazioni di chetogenesi, ma dopo la sintesi del 3-idrossi-3-metilglutaril-SCoA entra in azione l'enzima idrossimetil-glutaril-SCoA reduttasi (HMG-SCoA reduttasi), formando acido mevalonico.
2. Sintesi dell'isopentenil difosfato. In questa fase, tre residui di fosfato vengono attaccati all'acido mevalonico, quindi viene decarbossilato e deidrogenato.
- In contatto con 0
- Google Plus 0
- OK 0
- Facebook 0