L'articolo presenta i risultati di studi sperimentali sulla scelta del metodo e sullo sviluppo di un metodo per la determinazione quantitativa del fillochinone (vitamina K1) nelle piante. È stato dimostrato il vantaggio del metodo cromatografico (HPLC a fase inversa) rispetto al metodo spettrofotometrico nella determinazione del fillochinone nella composizione del complesso BAS delle piante. In conformità con le raccomandazioni della Conferenza internazionale sull'armonizzazione dei requisiti tecnici per la registrazione dei prodotti farmaceutici per uso umano, la metodologia sviluppata è stata convalidata in termini di specificità, linearità, riproducibilità e accuratezza. È stato stabilito che il metodo proposto è specifico, lineare, riproducibile e accurato. Sull'esempio dei tipi farmacopeici di materie prime contenenti vitamina K1, è stata dimostrata l'universalità dell'applicazione della tecnica nell'analisi di oggetti vegetali.
fillochinone
vitamina K1
foglie di ortica
corteccia di viburno
colonne di mais con stimmi
erba della borsa del pastore
convalida
1. Abyshev A. Z. Sintesi, proprietà e controllo di qualità dei preparati vitaminici e delle sostanze vitaminiche: un sussidio didattico / A. Z. Abyshev, S.N. Trusov, N.I. Kotova, M. P. Blinova. - San Pietroburgo. : Casa editrice SPFHA, 2010. - 136 p.
2. GOST R ISO 5725-2002 "Accuratezza (correttezza e precisione) dei metodi e dei risultati di misurazione" A 6 ore - Introdotto. 23.04.02. - M.: Gosstandart della Russia; Casa editrice degli standard, 2002.
3. Farmacopea statale dell'URSS. Problema. 2 Metodi generali di analisi. Materie prime vegetali medicinali / Ministero della Sanità dell'URSS. - 11a edizione, aggiungi. - M., 1989. - 400 pag.
4. Norme sui bisogni fisiologici di energia e sostanze nutritive per vari gruppi della popolazione della Federazione Russa. Linee guida MP 2.3.1.2432 -08
5. Nosov A. M. Piante medicinali. - M.: EKSMO-Press, 1999. - 350 p.
6. Pogodin I.S., Luksha E.A. Sviluppo di un metodo per la determinazione quantitativa dei lattoni sesquiterpenici nell'erba amara di Saussure // Problemi moderni di scienza ed educazione. - 2013. - N. 1; URL: www.sito/107-8426
introduzione
La vitamina K appartiene alla classe delle vitamine liposolubili che agiscono sul sistema emostatico. Le vitamine naturali del gruppo K comprendono due tipi di composti chinoidi metilati con catene laterali rappresentate da unità isoprenoidi: le vitamine K 1 e K 2. La struttura di queste vitamine si basa sul sistema 1,4-naftochinone. La vitamina K1 (fillochinone) è sintetizzata da tutti gli organismi fotosintetici. La vitamina K 2 (menachinone) è sintetizzata dalla microflora dell'intestino crasso. Il ruolo biologico delle vitamine del gruppo K è quello di attivare i fattori dei sistemi di coagulazione e anticoagulante dei mammiferi.
Attualmente, il fabbisogno fisiologico di vitamina K è determinato per gli adulti - 120 mcg / giorno e per i bambini - da 30 a 75 mcg / giorno.
Nella pratica medica, i preparati erboristici contenenti fillochinone vengono utilizzati per correggere le complicanze emorragiche. L'undicesima edizione della Farmacopea di Stato comprende le seguenti tipologie di materie prime vegetali officinali ad effetto emostatico vitamina K-dipendente: corteccia di viburno (Cortex Viburni), colonne con stimmi di mais (Styli cum stigmatis Zeae maydis), foglie di ortica (Folia Urticae ), erba della borsa del pastore (Herba Bursae pastoris). È stato stabilito che la vitamina K 1 è contenuta anche nell'erba di achillea, poligono di pepe, poligono renale e poligono, il che determina la possibilità di utilizzare queste materie prime per sanguinamento gastrico, uterino ed emorroidario. Nella Farmacopea di Stato non esistono attualmente metodi per la determinazione del fillochinone nei materiali vegetali. Per valutare la fattibilità dell'utilizzo di materiali vegetali medicinali come fonti di vitamina K1, un problema urgente è risolvere i problemi di standardizzazione e sviluppo di metodi volti a determinare il contenuto di fillochinone negli oggetti vegetali.
Obiettivo del lavoro: sviluppo di un metodo per la determinazione della vitamina K1 in materiali vegetali officinali.
Materiali e metodi di ricerca
Gli oggetti dello studio erano tipi ufficiali di materiali vegetali medicinali: corteccia di viburno, colonne con stimmi di mais, foglie di ortica, erba della borsa del pastore. Tutti i tipi di materie prime sono state acquistate tramite catene di farmacie. La scelta di un metodo razionale per determinare la vitamina K 1 è stata effettuata sulla base di una valutazione delle caratteristiche di validazione ottenute utilizzando metodi di analisi cromatografici e spettrofotometrici. Per sviluppare un metodo per la determinazione quantitativa del fillochinone nei materiali vegetali, abbiamo utilizzato il metodo della cromatografia ad alta pressione (HPLC) ad alte prestazioni in fase inversa con un rilevatore a matrice di diodi su uno strumento Shimadzu LC-20 Prominence in modalità isocratica sotto le seguenti condizioni: una colonna analitica riempita con adsorbente PerfectSil 300 ODS C18, 4,6x250 mm, con una dimensione delle particelle di 5 micron; composizione della fase mobile: acetonitrile-isopropanolo-acqua nel rapporto 75:20:5; rilevamento ad una lunghezza d'onda di 254 nm; temperatura della colonna - temperatura ambiente; velocità della fase mobile 1 ml/min; il volume del campione iniettato è di 20 µl. I risultati sono stati valutati dal tempo di ritenzione (t r) del fillochinone, coincidente con l'indice t r РСО (20,00±1,00 min.) e dall'area del picco del fillochinone. I risultati sono stati elaborati utilizzando il software LC Solutions.
La determinazione spettrofotometrica del contenuto di vitamina K1 è stata effettuata su uno strumento UNICO 2802S in una cuvetta di quarzo con uno spessore dello strato di 1 cm.
I risultati sono stati elaborati utilizzando il programma STATISTICA 8.0. Per descrivere i risultati ottenuti, dopo aver verificato la normalità della distribuzione, il valore della media (X cf), deviazione standard (S), deviazione standard relativa (RSD), varianza (S 2), intervallo di confidenza della media (Δx cf) è stato assegnato a un livello di significatività di α=0,05.
Come campione standard, è stato utilizzato un campione standard di lavoro (RSO) di vitamina K 1 isolato mediante cromatografia su colonna preparativa da un estratto esano di foglie di ortica. Il campione standard di lavoro è un liquido oleoso giallo, viscoso, non essiccante, praticamente insolubile in acqua, solubile in solventi organici e oli vegetali, punto di fusione -20ºС. Le caratteristiche spettrali della soluzione alcolica del campione standard di lavoro (dopo la rimozione dell'esano) sono mostrate nelle Figg. 1.
Riso. 1. Spettro nella regione UV e visibile di una soluzione della RSO di fillochinone (vitamina K1)
Per massimizzare l'estrazione della vitamina K1 dai campioni studiati, sono stati selezionati i seguenti parametri di preparazione del campione: il grado di macinazione delle materie prime, il tipo di estraente, i rapporti quantitativi tra materie prime ed estraente, il tempo e la frequenza di estrazione, il condizioni di temperatura e luce di estrazione.
Risultati e discussione. Al fine di sviluppare un metodo razionale per determinare il contenuto di vitamina K 1, sono state selezionate le condizioni per la sua estrazione dalle materie prime. Le foglie di ortica servivano come oggetto per lo sviluppo della tecnica. Tenendo conto dell'instabilità del fillochinone agli effetti dell'energia luminosa, tutte le fasi dello studio sono state condotte in condizioni che implicavano la protezione degli estratti dalla luce. La completezza dell'estrazione è stata determinata mediante il metodo HPLC mediante l'area del picco con t r 20,00±2,00 min. Come risultato della valutazione dell'influenza dei fattori di preparazione del campione sulla completezza dell'estrazione del fillochinone, sono stati selezionati i seguenti parametri e condizioni: finezza della materia prima - particelle che passano attraverso un setaccio con un diametro del foro di 0,5 mm; estraente - esano; il rapporto quantitativo "materia prima:estraente" - 1:25; esposizione singola per 60 minuti; regime di temperatura - temperatura ambiente (20-22ºС).
Per sviluppare un metodo per la determinazione della vitamina K 1 nelle piante mediante metodo spettrofotometrico, è stata preliminarmente effettuata un'analisi comparativa degli spettri di assorbimento di estratti da materie prime della farmacopea (Fig. 2) e di una soluzione di fillochinone RSO (Fig. 1). Di conseguenza, si è riscontrato che non è possibile dimostrare la presenza di vitamina K1 nelle materie prime entro il massimo di riferimento (249 nm), a causa dell'assenza di questo massimo nello spettro di tutti gli oggetti studiati. Pertanto, il metodo per la determinazione della vitamina K1 nel complesso totale delle sostanze biologicamente attive delle materie prime vegetali mediante metodo spettrofotometrico diretto non può essere inizialmente convalidato positivamente in termini di "specificità". È possibile aumentare la specificità del metodo quando si utilizza la spettrofotometria se dalla materia prima viene estratto il fillochinone purificato, il che richiede l'introduzione di ulteriori manipolazioni preparative nella fase di preparazione del campione dell'oggetto di studio. Un'ulteriore purificazione dell'estrazione può influenzare negativamente la rapidità e l'accuratezza della tecnica nel risultato finale.

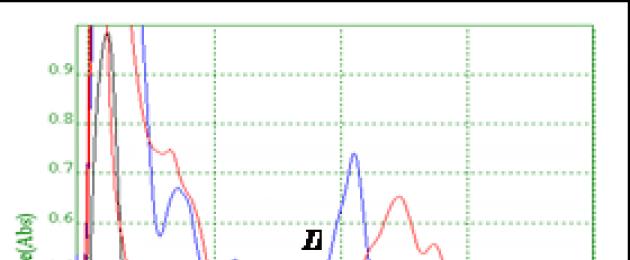
Figura 2 - Spettri di assorbimento di estratti da materiali di piante medicinali contenenti fillochinone (Kp - foglie di ortica, K - corteccia di viburno, Ku - colonne con stimmi di mais, P - erba della borsa del pastore)
L'opzione più accettabile per la determinazione della vitamina K 1 nelle materie prime vegetali è l'uso della cromatografia ad alta pressione (HPLC) ad alte prestazioni in fase inversa con un rilevatore a serie di diodi. Secondo i parametri sviluppati per la preparazione del campione di materie prime per l'analisi, è stata sviluppata la seguente procedura: un campione analitico di materie prime viene frantumato fino a raggiungere una dimensione granulometrica passando attraverso un setaccio con fori di 0,5 mm di diametro. Circa 1,0 g (accuratamente pesati) di materia prima frantumata viene posto in un matraccio conico da 50 ml, riempito con 25 ml di esano, chiuso con un tappo e agitato su un agitatore meccanico per 60 minuti. L'estratto viene filtrato attraverso un filtro di carta in un pallone a fondo tondo e l'esano viene distillato su un evaporatore rotante. Il residuo viene trasferito quantitativamente in un matraccio tarato da 5 ml (picnometro) con 4 ml di etanolo. Diluire il volume della soluzione fino alla tacca con lo stesso solvente e mescolare. 0,02 ml della soluzione vengono iniettati nel cromatografo.
Preparazione di un campione standard: a 0,0005 g di RSO (accuratamente pesati) di fillochinone, aggiungere 4 ml di etanolo, trasferire in un matraccio tarato da 5 ml. Diluire il volume della soluzione fino a volume con solvente e mescolare. 0,02 ml della soluzione vengono iniettati nel cromatografo.
![]() Il contenuto di fillochinone (X) in materie prime assolutamente secche in percentuale è calcolato dalla formula:
Il contenuto di fillochinone (X) in materie prime assolutamente secche in percentuale è calcolato dalla formula:
dove S o è l'area del picco sul cromatogramma di una soluzione di fillochinone PCO; S è l'area del picco del fillochinone sul cromatogramma della soluzione in esame; m o - campione RSO di fillochinone, in g; m - campione di materie prime, in g; W - perdita di peso durante l'essiccazione delle materie prime, in%; P è il contenuto di fillochinone nella RSO del fillochinone, in%.
In base ai risultati della determinazione quantitativa del fillochinone mediante HPLC in fase inversa, è stato determinato il contenuto di vitamina K1 nelle foglie di ortica (Tabella 1).
Tabella 1 - Caratteristiche metrologiche del metodo per la determinazione quantitativa del fillochinone nelle foglie di ortica (%) (n=6)
|
Xav ± Δхav |
||||||
|
0,00425 ± 0,00021 |
A causa del basso contenuto di vitamina K1 nelle materie prime, suggeriamo di effettuare calcoli in mg%, per questo è necessario apportare modifiche alla formula di calcolo per convertire le unità di misura (da g a mg):
![]()
La valutazione di validazione della metodologia è stata effettuata in base agli indicatori: specificità, linearità, precisione (riproducibilità) e accuratezza.
Specificità. L'identificazione del fillochinone è stata confermata dalla coincidenza del tempo di ritenzione del componente analizzato nella materia prima e l'RSO del fillochinone (Fig. 3). I picchi dei composti concomitanti inclusi negli estratti di materiali vegetali sono ben separati dal picco del fillochinone e non influenzano la determinazione analitica.

Riso. Fig. 3. Cromatogramma dell'estratto di foglie di ortica (A - picco 17, tr = 20,37 min corrisponde al fillochinone) e campione standard di lavoro di fillochinone (B - picco 22, tr = 20,71 min)
La linearità e il range analitico della tecnica sono stati confermati dall'analisi di 7 campioni di diverse concentrazioni nell'intervallo dal 13 al 417% della concentrazione (0,12 mg/ml) presa come 100%. Il confronto del rapporto tra il contenuto di fillochinone (mg/ml) nelle soluzioni testate e le aree dei picchi cromatografici ha mostrato che esso è lineare ed è descritto dall'equazione y = 5104417,9 x + 10944,88. Il coefficiente di correlazione (rxy) è 0,999, il che rende possibile l'utilizzo di questa tecnica per la determinazione quantitativa del fillochinone in oggetti vegetali nell'intervallo di concentrazione da 0,016 a 0,5 mg/ml.
La riproducibilità (precisione) è stata determinata conducendo analisi da diversi (due) analisti sullo stesso lotto di materie prime in momenti diversi. Il numero di repliche per ciascun analista è 3, il numero totale di repliche è 6. La deviazione standard relativa, espressa in percentuale (RSD, %), non deve superare il 5%. Secondo i risultati degli studi, l'RSD era dell'1,21%, che caratterizza l'affidabilità dell'analisi nelle condizioni selezionate (Tabella 2).
Tabella 2 – Risultati della determinazione della precisione del metodo
|
ripetizione |
Analista |
Determinato nel campione, mg% |
Caratteristiche metrologiche |
|
|
Xav = 4,00525 mg% S = 0,04850 mg% |
||||
Per determinare l'accuratezza del metodo, campioni di foglie di ortica provenienti da un lotto di materie prime sono stati analizzati in 3 livelli di campione (0,5, 1,0 e 1,5 g ciascuno), campionando tre volte per ciascun livello. Il contenuto di vitamina K1 è stato determinato in mg in un campione di materie prime. Il valore atteso (teorico) è stato preliminarmente calcolato sulla base del valore medio stabilito per il contenuto di vitamina K1 nelle foglie di ortica, pari a 4,1 mg%. Il valore teorico è stato confrontato con il valore reale. Per valutare i risultati ottenuti è stato utilizzato l'indicatore di “apertura” (R), il cui criterio di accettazione è stato adottato entro il 98-102% del valore calcolato.
Tabella 3 - Risultati della determinazione dell'accuratezza della metodologia
|
pesatura delle materie prime, |
Effettivo |
Stimato |
Apribilità |
Metrologico caratteristiche |
||||
I risultati della determinazione dell'accuratezza del metodo, presentati nella Tabella 3, hanno mostrato che l'apertura R è del 98,73%, il valore della deviazione standard relativa (RSD) non supera il 5%, il che caratterizza l'accuratezza del metodo come soddisfacente.
Pertanto, è stato stabilito che il metodo proposto per la determinazione quantitativa della vitamina K1 mediante HPLC nelle foglie di ortica è specifico, riproducibile e accurato. Questo metodo è stato riprodotto per la determinazione della vitamina K1 in altri tipi di materiali vegetali (Tabella 4).
Tabella 4 - Contenuto di vitamina K1 (mg%) nei materiali vegetali medicinali
|
Oggetto (n=6) |
Xav ± Δхav |
||||
|
Colonne con stimmi di mais |
|||||
|
erba della borsa del pastore |
|||||
|
Corteccia di viburno |
Gli studi condotti hanno dimostrato l'opportunità di utilizzare il metodo HPLC in fase inversa per la determinazione del fillochinone nei materiali vegetali. Il vantaggio del metodo HPLC è la possibilità di valutare il contenuto qualitativo e quantitativo di fillochinone in un lotto di materie prime, il che consente di risparmiare significativamente il tempo dedicato all'analisi. Il metodo sviluppato può essere utilizzato per determinare il contenuto di vitamina K1 negli oggetti vegetali.
Revisori:
Grishin A.V. Dottore in Farmacia, Professore, Preside. Dipartimento di Farmacia SBEI HPE Accademia medica statale di Omsk del Ministero della sanità russo, Omsk.
Penevskaya N.A. Dottore in Scienze Mediche, Professore Associato, Preside. Dipartimento di tecnologia farmaceutica con corso di biotecnologia, Accademia medica statale di Omsk del Ministero della sanità russo, Omsk.
Link bibliografico
Luksha E.A., Pogodin I.S., Kalinkina G.I., Kolomiets N.E., Velichko G.N. SVILUPPO DI UN METODO PER LA DETERMINAZIONE QUANTITATIVA DEL FILLOCHINONE (VITAMINA K1) IN OGGETTI VEGETALI // Problemi moderni della scienza e dell'istruzione. - 2014. - N. 3.;URL: http://science-education.ru/ru/article/view?id=13736 (data di accesso: 02/09/2019). Portiamo alla vostra attenzione le riviste pubblicate dalla casa editrice "Academy of Natural History"
Esperienza 1.Determinazione quantitativa della vitamina C.
Il principio del metodo. Il metodo si basa sulla capacità della vitamina C di ridurre il 2,6-diclorofenolindofenolo, che in ambiente acido ha un colore rosso e diventa incolore dopo la riduzione; in un ambiente alcalino, il colore è blu. Per proteggere la vitamina C dalla distruzione, la soluzione in esame viene titolata in un mezzo acido con una soluzione alcalina di 2,6-diclorofenolindofenolo fino alla comparsa di una colorazione rosa.
Per calcolare il contenuto di acido ascorbico in prodotti come cavoli, patate, aghi, rosa canina, ecc., utilizzare la formula:
Dove X- il contenuto di acido ascorbico in milligrammi per 100 g di prodotto; 0,088 - il contenuto di acido ascorbico, mg; UN– risultato della titolazione con soluzione 0,001 N di 2,6-diclorofenolindofenolo, ml; B - volume dell'estratto prelevato per la titolazione, ml; IN - la quantità di prodotto prelevato per l'analisi, g; Gè la quantità totale di estratto, ml; 100 - conversione per 100 g di prodotto.
Conclusione: annotare i risultati dell'esperimento e i dati calcolati.
Esperienza 1.1. Determinazione del contenuto di vitamina C nel cavolo.
L'ordine del lavoro.
Pesare 1 g di cavolo cappuccio, pestare in un mortaio con 2 ml di soluzione di acido cloridrico al 10% (HCl - Acido cloridrico, acido cloridrico, acido cloridrico), aggiungere 8 ml di acqua e filtrare. Misurare 2 ml del filtrato per la titolazione, aggiungere 10 gocce di soluzione di acido cloridrico al 10% e titolare con 2,6-diclorofenolindofenolo fino a quando una colorazione rosa persiste per 30 s, questa è la base principio del metodo reazioni. Calcolare il contenuto di acido ascorbico in 100 g di cavolo secondo la formula sopra. 100 g di cavolo contengono 25-60 mg di acido ascorbico, 100 g di rosa canina 500-1500 mg e aghi 200-400 mg.
Esperienza 1.2. Determinazione del contenuto di vitamina C nelle patate.
L'ordine del lavoro.
Pesare 5 g di patate, macinare in un mortaio con 20 gocce di soluzione di acido cloridrico al 10% (in modo che le patate non scuriscano). L'acqua distillata viene aggiunta gradualmente - 15 ml. La massa risultante viene versata in un bicchiere, la malta viene sciacquata con acqua, versata su una bacchetta di vetro in un bicchiere e titolata con 0,001 N. con una soluzione di 2,6-diclorofenolindofenolo fino a una colorazione rosa, in base a questo principio del metodo reazioni. 100 g di patate contengono vitamina C 1-5 mg.
Conclusione: annotare i risultati dell'esperimento.
Esperienza 1.3. Determinazione del contenuto di vitamina C nelle urine.
Determinare il contenuto di vitamina C nelle urine dà un'idea delle riserve di questa vitamina nell'organismo, poiché esiste una corrispondenza tra la concentrazione di vitamina C nel sangue e la quantità di questa vitamina escreta nelle urine. Tuttavia, con l'ipovitaminosi C, il contenuto di acido ascorbico nelle urine non è sempre ridotto. Spesso è normale, nonostante la grande carenza di questa vitamina nei tessuti e negli organi.
Nelle persone sane, l'introduzione per os di 100 mg di vitamina C porta rapidamente ad un aumento della sua concentrazione nel sangue e nelle urine. Nell'ipovitaminosi C, i tessuti carenti di vitamina trattengono la vitamina C ingerita e la sua concentrazione nelle urine non aumenta. L'urina di una persona sana contiene 20-30 mg di vitamina C o 113,55-170,33 µmol/giorno. Nei bambini, il livello di questa vitamina diminuisce con lo scorbuto e con le malattie infettive acute e croniche.
I metodi per la determinazione quantitativa delle vitamine si basano sulle loro proprietà fisico-chimiche, come le proprietà redox, la capacità di fluorescenza alla luce UV. Vengono utilizzati vari metodi di determinazione: titrimetrico, fotocolorimetrico, spettrofotometrico, fluorimetrico, ecc.
Determinazione quantitativa della vitamina K
La vitamina K nelle foglie di ortica viene determinata con il metodo SPM (tabella 3).
Tabella 3. Determinazione quantitativa della vitamina K nelle foglie di ortica (metodo dell'autore)
Determinazione quantitativa delle sostanze biologicamente attive nella rosa canina.
Acido ascorbico può essere determinato con il metodo titrimetrico, che si basa sulla riduzione del 2,6-diclorofenolindofenolo. Con lo stesso reagente è possibile effettuare la determinazione fotocolorimetrica dell'acido ascorbico. Per fare ciò, la materia prima viene estratta con acido metafosforico al 2%, viene aggiunta una soluzione di 2,6-diclorofenolindofenolo. Dopo 35 secondi effettuare fotocolorimetria. In parallelo, soluzione di controllo colorimetrico di acido metafosforico al 2% con 2,6-diclorofenolindofenolo. L'intensità del colore è proporzionale alla quantità di acido ascorbico.
La determinazione quantitativa dell'acido ascorbico può essere effettuata mediante un metodo fotocolorimetrico utilizzando esacianoferrite di potassio. In un ambiente acido, l'acido ascorbico riduce l'esacianoferrite di potassio in esacianoferrato di potassio, che in presenza di ioni ferro (III) forma il blu di Prussia, seguito dalla sua fotocolorimetria.
Il metodo per la determinazione quantitativa dell'acido ascorbico (secondo SP XI, edizione 2, p. 294) si basa sulla sua capacità di ossidarsi a deidroformio con una soluzione di 2,6-diclorofenolindofenolato e di riportare quest'ultimo a leucoformio . Il punto di equivalenza è stabilito dalla comparsa di un colore rosa, che indica l'assenza di un agente riducente, cioè l'acido ascorbico (il 2,6-diclorofenolindofenolo ha un colore blu in ambiente alcalino, rosso in ambiente acido, e diventa incolore quando ridotto):


1. Determinazione del contenuto di acido ascorbico. (tabella 4). Da un campione analitico di frutti frantumati grossolanamente si preleva un peso di 20 g, si pone in un mortaio di porcellana, dove si macina accuratamente con polvere di vetro (circa 5 g), aggiungendo gradualmente 300 ml di acqua, e si lascia in infusione per 10 minuti. La miscela viene quindi agitata e l'estratto viene filtrato. Aggiungere in una beuta da 100 ml 1 ml del filtrato ottenuto, 1 ml di soluzione di acido cloridrico al 2%, 13 ml di acqua, mescolare e titolare da una microburetta con una soluzione di 2,6-diclorofenolindofenolato di sodio (0,001 mol/l) fino alla comparsa di un colore rosa che non scompare entro 30-60 s. La titolazione viene continuata per non più di 2 minuti. In caso di colorazione intensa del filtrato o di un elevato contenuto di acido ascorbico in esso [consumo di una soluzione di 2,6-diclorofenolindofenolato sodico (0,001 mol/l) superiore a 2 ml] rilevato mediante titolazione di prova, l'estrazione iniziale viene diluito con acqua 2 volte o più.

dove 0,000088 è la quantità di acido ascorbico corrispondente a 1 ml di una soluzione di 2,6-diclorofenolindofenolato di sodio (0,001 mol/l), in grammi; V è il volume di una soluzione di 2,6-diclorofenolindofenolato di sodio (0,001 mol/l) utilizzata per la titolazione, in millilitri; m è la massa delle materie prime in grammi; W - perdita di peso durante l'essiccazione delle materie prime in percentuale.
Appunti. Preparazione di una soluzione di 2,6-diclorofenolindofenolato di sodio (0,001 mol/l): 0,22 g di 2,6-diclorofenolindofenolato di sodio vengono sciolti in 500 ml di acqua appena bollita e raffreddata agitando vigorosamente (la soluzione viene lasciata per una notte per sciogliere il campione). La soluzione viene filtrata in un matraccio tarato con una capacità di 1 litro e il volume della soluzione viene portato alla tacca con acqua. La durata di conservazione della soluzione non è superiore a 7 giorni se conservata in un luogo freddo e buio.
Impostazione del titolo. Diversi cristalli (3-5) di acido ascorbico vengono sciolti in 50 ml di soluzione di acido solforico al 2%; 5 ml della soluzione risultante vengono titolati da una microburetta con una soluzione di 2,6-diclorofenolindofenolato di sodio fino alla comparsa di una colorazione rosa, che scompare entro 1-2 settimane. Altri 5 ml della stessa soluzione di acido ascorbico vengono titolati con una soluzione di iodato di potassio (0,001 mol / l) in presenza di diversi cristalli (circa 2 mg) di ioduro di potassio e 2-3 gocce di soluzione di amido fino a colorazione blu appare. Il fattore di correzione si calcola con la formula:

dove V è il volume della soluzione di iodato di potassio (0,001 mol/l) utilizzato per la titolazione, in millilitri; V1 è il volume della soluzione di 2,6-diclorofenolindofenolato di sodio utilizzata per la titolazione, in millilitri.
2. Determinazione del contenuto di acidi organici liberi. Un campione analitico di materie prime viene frantumato alla dimensione delle particelle che passano attraverso un setaccio con fori di 2 mm di diametro. 25 g di rosa canina tritata vengono posti in un pallone da 250 ml, versati con 200 ml di acqua e mantenuti per 2 ore a bagnomaria bollente, quindi raffreddati, trasferiti quantitativamente in un matraccio tarato da 250 ml, il volume di estrazione viene adeguato al contrassegnare con acqua e mescolare. Prelevare 10 ml di estratto, trasferirli in un matraccio della capacità di 500 ml, aggiungere 200-300 ml di acqua appena bollita, 1 ml di soluzione alcolica di fenolftaleina all'1%, 2 ml di soluzione di blu di metilene allo 0,1% e titolare con una soluzione di idrossido di sodio (0,1 mol/k) finché nella schiuma non appare un colore rosso-lilla.

dove 0,0067 è la quantità di acido malico corrispondente a 1 ml di soluzione di idrossido di sodio (0,1 mol/l), in grammi; V è il volume della soluzione di idrossido di sodio (0,1 mol/l) utilizzato per la titolazione, in millilitri; m è la massa delle materie prime in grammi; W - perdita di peso durante l'essiccazione delle materie prime in percentuale.
Tabella 4. Determinazione quantitativa dell'acido ascorbico nella rosa canina (metodo farmacopea)
Quantificazione delle sostanze chimiche nei fiori di calendula.
Carotenoidi sono determinati nelle materie prime medicinali mediante un metodo fotocolorimetrico basato sulla misurazione dell'intensità del loro colore naturale. È stato sviluppato un metodo spettrofotometrico per la determinazione dei carotenoidi. I carotenoidi vengono estratti dalla materia prima con etere di petrolio, quindi cromatografati su una piastra Silufol nel sistema etere di petrolio-benzene-metanolo (60:15:4), eluiti con cloroformio e spettrofotometricamente alla lunghezza d'onda di 464 nm (-carotene) a 456 nm (β-carotene).
- 1. Circa 1 g (esattamente pesato) di fiori di calendula tritati, setacciati attraverso un setaccio con fori di 1 mm, viene posto in una beuta con una capacità di 250 ml, si aggiungono 50 ml di alcol al 70%, il pallone viene tappato , pesato (con un errore di ± 0,01 g ) e lasciato riposare per 1 ora. Quindi il pallone viene collegato ad un refrigerante a ricadere, riscaldato, mantenendo una leggera ebollizione per 2 ore. Dopo il raffreddamento, il pallone con il contenuto viene nuovamente chiuso con il stesso tappo, pesato e la perdita di massa viene reintegrata con solvente. Il contenuto del pallone viene agitato bene e filtrato su filtro di carta asciutto, scartando i primi 20 ml, in un pallone asciutto da 200 ml (soluzione A).
- Si mette 1 ml della soluzione A in un matraccio tarato della capacità di 25 ml, si aggiungono 5 ml di soluzione di cloruro di alluminio, 0,1 ml di acido acetico e si porta il volume della soluzione alla tacca con alcool al 96% e si lascia per 40 minuti (soluzione B).
Dopo 40 minuti, misurare la densità ottica della soluzione di prova B e della soluzione standard del campione B 1 su uno spettrofotometro al massimo assorbimento ad una lunghezza d'onda di (408 + 2) nm in una cuvetta con uno spessore di 10 mm, utilizzando il soluzioni di riferimento per la soluzione di prova e i campioni standard.
dove: A è la densità ottica della soluzione in esame;
A o è la densità ottica di una soluzione di un campione standard di rutina;
a - un campione di materie prime, g;
a o - peso di un campione standard di rutina, g;
W - contenuto di umidità della materia prima,%;
È consentito determinare il contenuto della somma dei flavonoidi utilizzando il tasso di assorbimento specifico della rutina.
CARATTERISTICA MOTIVAZIONALE DEL TEMA
La nutrizione umana razionale richiede un equilibrio non solo in termini di contenuto di proteine, grassi, carboidrati, ma anche in termini di contenuto di micronutrienti. I risultati dello studio dell'alimentazione reale di vari gruppi di popolazione indicano una significativa prevalenza di poliipovitaminosi, insufficienza di minerali di base e fibre alimentari. La correzione delle carenze di micronutrienti non può essere ottenuta semplicemente aumentando l’assunzione di cibo. Le moderne condizioni di vita e di lavoro della maggior parte della popolazione portano ad una diminuzione dei costi energetici, che richiede una riduzione della quantità di cibo consumato e comporta un consumo insufficiente dei micronutrienti in esso contenuti. La conoscenza delle manifestazioni cliniche delle carenze di micronutrienti, delle fonti di vitamine, minerali e fibre alimentari nella dieta, dei modi per preservare il valore vitaminico degli alimenti, dei metodi di arricchimento preventivo consentono al medico di ottimizzare lo stato nutrizionale dei pazienti.
SCOPO DELLA LEZIONE: conoscere il ruolo biologico, la regolazione e le fonti dei micronutrienti e delle fibre alimentari nella nutrizione; insegnare a determinare la composizione chimica della dieta in base al contenuto di vitamine, minerali, fibre alimentari mediante il metodo di calcolo (sull'esempio dell'analisi del layout del menu della dieta quotidiana di uno studente di medicina), metodi di risparmio vitaminico di conservazione e lavorazione culinaria dei prodotti, fortificazione preventiva.
LAVORO INDIPENDENTE DEGLI STUDENTI DELLA CLASSE
1. Determinazione della composizione qualitativa della dieta quotidiana dello studente in termini di contenuto di vitamine, minerali, fibre alimentari mediante il metodo di calcolo (secondo il layout del menu compilato per l'argomento 3.2.) utilizzando le "Tabelle della composizione chimica ed energetica valore dei prodotti alimentari”.
2. Soluzione di compiti situazionali orientati professionalmente di due tipi, registrazione della soluzione nel protocollo.
3. Lavoro di laboratorio per determinare il contenuto di vitamina C nelle verdure. 3.1. Determinazione del contenuto di vitamina C nelle patate crude e bollite; calcolo della perdita percentuale di vitamina C durante la cottura.
3.2. Determinazione del contenuto di vitamina C nel cavolo; calcolo della perdita percentuale di vitamina C durante la conservazione.
4. Ascolto e discussione degli abstract preparati dagli studenti
sull'incarico individuale del docente.
COMPITO DI AUTOFORMAZIONE
1. Ruolo biologico, razionamento, fonti nutrizionali di vitamine idrosolubili.
2.Ruolo biologico, regolazione, fonti alimentari di vitamine liposolubili.
3. Tipi di carenze vitaminiche.
4. Cause di ipovitaminosi, loro manifestazioni.
5. Tecniche per il mantenimento e l'incremento del valore vitaminico delle diete, prevenzione dell'ipovitaminosi.
6.Ruolo biologico, regolazione, fonti nella nutrizione dei minerali.
7.Ruolo biologico, regolamentazione, fonti di fibra alimentare nella dieta.
PROTOCOLLO DI STUDIO
"_____" ___________20___
Tabella 46
Composizione qualitativa della dieta quotidiana dello studente
| Nomi dei piatti del menu, una serie di prodotti per porzione | Peso, gr | vitamine | Minerali | Fibra alimentare, g | ||||||||
| C mg | In mg | In mg | Un mg | D mg | Camg | P mg | K mg | Fe mg | J µg | |||
| COLAZIONE: | ||||||||||||
| 2a COLAZIONE: | ||||||||||||
| CENA: | ||||||||||||
| CENA: | ||||||||||||
| TOTALE GIORNATA: |
2. Soluzione di un problema situazionale (tipo 1) No. ____
__________________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________
__________________________________________________________________
Soluzione di un problema situazionale (tipo 2) No. ___
__________________________________________________________________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________
__________________________________________________________________
3. Determinazione del contenuto di vitamina C nelle verdure:
tipo di prodotto _____________, peso del prodotto ____________g,
quantità 0,0001n. una soluzione di iodato di potassio, che è andata al titanio
campionamento _____ml;
Formula per il calcolo:
a) patate crude _______ m, patate bollite _______ mg,
perdita di vitamina C durante la cottura _________%
b) cavolo ______ mg, contenuto medio in cavolo _____ mg,
perdita di vitamina C durante la conservazione _____%.
__________________________________________________________________
__________________________________________________________________
__________________________________________________________________
Ho finito il lavoro __________________
Firma del docente _____________
MATERIALE DI RIFERIMENTO
Definizioni degli argomenti
Avitaminosi: completo esaurimento delle risorse vitaminiche del corpo.
ANTIVITAMINICI - composti che escludono parzialmente o completamente le vitamine dalle reazioni metaboliche dell'organismo distruggendole, inattivandole o impedendone l'assimilazione. Gli antivitaminici sono divisi in 2 gruppi:
a) composti simili a strutture (inibitori competitivi; entrano in relazioni competitive con vitamine o loro derivati nelle corrispondenti reazioni metaboliche biochimiche), tra cui sulfamidici, dicumarina, megafen, isoniazide, ecc.
b) composti strutturalmente diversi (antivitaminici naturali; sostanze
che, modificando la molecola o il composto complesso con metaboliti, privano parzialmente o completamente la vitamina della sua azione), tra cui la tiaminasi, l'ascorbinasi, l'avidina, ecc.
Le VITAMINE sono composti organici a basso peso molecolare con elevata attività biologica, necessari per la vita normale, che non sono sintetizzati (o sintetizzati in quantità insufficienti) nell'organismo ed entrano nell'organismo con il cibo. Ruolo biologico vitamine idrosolubiliè determinato dalla loro partecipazione alla costruzione di vari coenzimi, vitamine liposolubili- nel controllo dello stato funzionale delle membrane cellulari e delle strutture subcellulari.
VITAMINE-ANTAGONISTI: B 1 e B 2; A e D; acido nicotinico e colina; tiamina e colina (con la somministrazione prolungata di una vitamina a scopo terapeutico, si riscontrano sintomi di carenza di un'altra).
VITAMINE-SINERGICI: C e P; P, S, K; B 12 e acido folico; C, K, B2; A ed E; E e inositolo (con uso complesso nei preparati multivitaminici, possono potenziare l'effetto biologico l'uno dell'altro). IPOVITAMINOSI: una forte diminuzione dell'apporto da parte del corpo dell'una o dell'altra vitamina.
LA FORMA NASCOSTA (LATENTE) DI CARENZA VITAMINICA non presenta manifestazioni e sintomi esterni, tuttavia ha un effetto negativo sulle prestazioni, sulla resistenza del corpo a vari fattori avversi e prolunga il recupero dopo una malattia.
FIBRE ALIMENTARI - carboidrati ad alto peso molecolare (cellulosa, emicellulosa, pectine, lignina, chitina, ecc.) principalmente di origine vegetale, resistenti alla digestione e all'assimilazione nell'intestino tenue, ma sottoposti a fermentazione completa o parziale nell'intestino crasso.
LE CAUSE PIÙ IMPORTANTI DI IPOVITAMINOSI E AVITAMINOSI
1. Apporto insufficiente di vitamine dal cibo.
1.1. Basso contenuto di vitamine nella dieta.
1.2. Ridurre la quantità totale di cibo consumato a causa del basso dispendio energetico.
1.3. Perdita e distruzione di vitamine nel processo di lavorazione tecnologica dei prodotti alimentari, loro conservazione e cucina irrazionale
in lavorazione.
1.4. Deviazioni da una formula nutrizionale bilanciata (la nutrizione prevalentemente a base di carboidrati richiede tiamina aggiuntiva;
con un'introduzione insufficiente di proteine di alta qualità, le vitamine C, PP, B 1 vengono rapidamente escrete nelle urine, non partecipano ai processi metabolici, la conversione del carotene in vitamina A è ritardata).
1.5. Anoressia.
1.6. Presenza di vitamine in alcuni prodotti in forma non utilizzabile (inositolo sotto forma di fitina nei prodotti a base di cereali).
2. Inibizione della microflora intestinale che produce alcune vitamine (B 6 , K).
2.1. Malattie del tratto gastrointestinale.
2.2. Conseguenze della chemioterapia (disbatteriosi).
3. Violazione dell'assimilazione delle vitamine.
3.1. Malassorbimento delle vitamine nel tratto gastrointestinale
con malattie dello stomaco, dell'intestino, lesioni del sistema epatobiliare, così come nella vecchiaia (alterata secrezione biliare, necessaria per l'assorbimento delle vitamine liposolubili).
3.3. Violazione del metabolismo delle vitamine e formazione delle loro forme biologicamente attive (coenzima) in varie malattie, azione di agenti tossici e infettivi, chemioterapia, nella vecchiaia.
4. Aumento del fabbisogno di vitamine.
4.1. Stati fisiologici particolari del corpo (crescita intensiva, gravidanza, allattamento).
4.2. Condizioni climatiche speciali (il fabbisogno di vitamine aumenta del 30-60% a causa dell'aumento del consumo di energia alle basse temperature dell'aria nella zona climatica del Nord).
4.4. Stress neuropsichico significativo, condizioni stressanti.
4.5. Esposizione a fattori di produzione dannosi (I lavoratori in officine calde esposti ad alte temperature /32 gradi/ con simultanea attività fisica richiedono il doppio di vitamine C, B 1, B 6, acido pantotenico rispetto a 18 gradi).
4.6. Malattie infettive e intossicazioni (nei processi settici gravi, il fabbisogno di vitamina C dell'organismo raggiunge i 300-500 mg al giorno).
4.7. Malattie degli organi interni e delle ghiandole endocrine.
4.8. Maggiore escrezione di vitamine.
5. Disturbi congeniti, geneticamente determinati del metabolismo e delle funzioni delle vitamine.
5.1. Malassorbimento congenito delle vitamine.
5.2. Disturbi congeniti del trasporto delle vitamine nel sangue e attraverso le membrane cellulari.
5.3. Disturbi congeniti della biosintesi delle vitamine (acido nicotinico da triptofano).
5.4. Disturbi congeniti della conversione delle vitamine in coenzimi
forme, gruppi prostetici e metaboliti attivi.
5.5. Violazione dell'inclusione di vitamine nel centro attivo dell'enzima.
5.6. Violazione della struttura dell'apoenzima, ostacolando la sua interazione con il coenzima.
5.7. Violazione della struttura dell'apoenzima, che porta ad una perdita completa o parziale dell'attività enzimatica, indipendentemente dall'interazione con il coenzima.
5.8. Aumento del catabolismo delle vitamine.
5.9. Disturbi congeniti del riassorbimento vitaminico nei reni.
Tabella 47
(per 100 g di parte edibile)
| Prodotti | IN 1 | ALLE 2 | RR | ALLE 6 | CON | E | UN | V-ka-ro-ting | D | ALLE 12 | Fo-lie-vaya acido. | ||||
| mg/100 g | µg/100 g | ||||||||||||||
| pane di segale | 0,18 | 0,11 | 0,67 | 0,17 | - | 2,2 | - | - | - | - | |||||
| Pane di grano. | 0,21 | 0,12 | 2,81 | 0,3 | - | 3,8 | - | - | - | - | |||||
| Fiocchi d'avena. | 0,49 | 0,11 | 1,1 | 0,27 | - | 3,4 | - | - | - | - | |||||
| Semolino | 0,14 | 0,07 | 1,0 | 0,17 | - | 2,5 | - | - | - | - | |||||
| Semole di riso | 0,08 | 0,04 | 1,6 | 0,18 | - | 0,4 | - | - | - | - | |||||
| Grano saraceno. | 0,53 | 0,2 | 4,19 | 0,4 | - | 6,6 | - | - | - | - | |||||
| Miglio | 0,62 | 0,04 | 1,55 | 0,52 | - | 2,6 | - | 0,15 | - | - | |||||
| Pasta | 0,17 | 0,08 | 1,21 | 0,16 | - | 2,1 | - | - | - | - | |||||
| Manzo | 0,07 | 0,18 | 3,0 | 0,39 | sl | - | - | - | - | 2,8 | 8,9 | ||||
| Maiale | 0,52 | 0,14 | 2,4 | 0,33 | sl | - | - | - | - | - | 5,5 | ||||
| Fegato di manzo. | 0,3 | 2,19 | 6,8 | 0,7 | 1,3 | 3,8 | 1,0 | - | |||||||
| La salsiccia è cotta. | 0,25 | 0,18 | 2,47 | 0,19 | - | - | - | - | - | - | |||||
| polli | 0,07 | 0,15 | 3,6 | 0,61 | - | - | 0,1 | - | - | - | 5,8 | ||||
| uova di gallina | 0,07 | 0,44 | 0,2 | 0,14 | - | 0,3 | - | 4,7 | 0,1 | 7,5 | |||||
| Merluzzo | 0,09 | 0,16 | 2,3 | 0,17 | SL. | 0,9 | SL. | - | - | 1,6 | 11,3 | ||||
| Caviale di storione. | 0,3 | 0,36 | 1,5 | 0,29 | 7,8 | - | 0,2 | - | - | ||||||
| Pastore del latte. | 0,03 | 0,13 | 0,1 | - | 1,0 | - | SL. | 0,01 | - | - | - | ||||
| Kefir | 0,03 | 0,17 | 0,14 | 0,06 | 0,7 | 0,1 | SL. | 0,01 | - | 0,4 | 7,8 | ||||
| Panna acida | 0,02 | 0,1 | 0,07 | 0,07 | 0,2 | 0,5 | 0,2 | 0,1 | 0,1 | 0,36 | 8,5 | ||||
| Fiocchi di latte | 0,04 | 0,27 | 0,4 | 0,11 | 0,5 | 0,4 | 0,1 | 0,03 | - | 1,0 | 35,0 | ||||
| Formaggi, duri | 0,02 | 0,3 | 0,3 | 0,1 | 1,6 | 0,5 | 0,2 | 0,1 | - | 2,5 | 10-45 | ||||
| Burro. | sl | 0,01 | 0,1 | - | - | - | 0,5 | 0,34 | - | - | - | ||||
| Olio di girasole raffinato. | _ | - | - | - | - | - | - | - | - | - | |||||
| Piselli | 0,81 | 0,15 | 2,2 | 0,27 | - | 9,1 | - | 0,07 | - | - | |||||
| Patata | 0,12 | 0,05 | 0,9 | 0,3 | 0,1 | - | 0,02 | - | - | ||||||
| cavolo bianco | 0,06 | 0,05 | 0,4 | 0,14 | 0,1 | - | 0,02 | - | - | ||||||
| Cipolla verde | 0,02 | 0,1 | 0,3 | 0,15 | - | - | - | ||||||||
| pomodori | 0,06 | 0,04 | 0,53 | 0,1 | 0,4 | - | 1,2 | - | - | ||||||
| cetrioli | 0,03 | 0,04 | 0,2 | 0,04 | 0,1 | - | 0,06 | - | - | ||||||
| Barbabietola | 0,02 | 0,04 | 0,2 | 0,07 | 0,1 | - | 0,01 | - | - | ||||||
| Carota | 0,06 | 0,07 | 0,13 | 0,6 | - | - | - | ||||||||
| funghi bianchi | 0,02 | 0,3 | 4,6 | 0,07 | 0,6 | - | - | - | - | ||||||
| Mele | 0,01 | 0,03 | 0,3 | 0,08 | 0,6 | - | 0,03 | - | - | 1,6 | |||||
| albicocche | 0,03 | 0,06 | 0,07 | 0,05 | 0,9 | - | 1,6 | - | - | ||||||
| Ciliegie | 0,03 | 0,3 | 0,4 | 0,05 | 0,3 | - | 0,1 | - | - | ||||||
| Lamponi | 0,02 | 0,05 | 0,6 | 0,07 | 0,6 | - | 0,2 | - | - | ||||||
| fragole | 0,03 | 0,05 | 0,3 | 0,06 | 0,5 | - | 0,03 | - | - | ||||||
| Ribes nero. | 0,02 | 0,02 | 0,3 | 0,13 | 0,7 | - | 0,1 | - | - | ||||||
| Olivello spinoso | 0,1 | 0,05 | 0,6 | 0,11 | - | - | - | ||||||||
| La rosa canina è secca. | 0,15 | 0,84 | 1,5 | - | - | - | 6,7 | - | - | - | |||||
| Uva | 0,05 | 0,02 | 0,3 | 0,09 | - | - | SL. | - | - | ||||||
| Limoni | 0,04 | 0,02 | 0,1 | 0,06 | - | - | 0,01 | - | - | ||||||
| arance | 0,04 | 0,03 | 0,2 | 0,06 | 0,2 | - | 0,05 | - | - | ||||||
| Dolci, torte | 0,75 | 0,1 | 0,7 | - | - | - | 0,1 | 0,14 | - | - | - | ||||
| Il lievito viene pressato. | 0,6 | 0,68 | 11,4 | 0,58 | - | - | - | - | - | - | |||||
La determinazione quantitativa dell'acido ascorbico nel materiale di prova viene spesso effettuata utilizzando una soluzione di sodio 2,6-diclorofenolindofenolo, che è blu in un mezzo alcalino e rosa in un mezzo acido. La chimica della reazione può essere espressa come la seguente equazione.
Il principio del metodo si basa sulla capacità dell'acido ascorbico di ripristinare il reagente indofenolo. Quando si titola l'estratto del materiale in esame con una soluzione di 2,6-diclorofenolindofenolo, l'acido ascorbico viene ossidato ad acido deidroascorbico e il reagente indofenolo viene ridotto. La fine della titolazione può essere determinata dal cambiamento di colore. La forma ossidata del 2,6-diclorofenolindofenolo ha un colore blu in un mezzo neutro e alcalino, la forma ridotta acquisisce un colore rosa in un mezzo acido.
L'acido ascorbico viene estratto dal materiale in esame con una soluzione all'1% di acido cloridrico e titolato con una soluzione del reagente indofenolo. Il contenuto di acido ascorbico si calcola dalla quantità di vernice utilizzata per la titolazione.
Va notato che altre sostanze facilmente ossidabili, come il glutatione, la cisteina, ecc., interferiscono con l'esatta determinazione del contenuto di acido ascorbico negli oggetti biologici.
7.7.1. DETERMINAZIONE DELLA VITAMINA C B
MATERIALE VEGETALE
Prelevare un campione del materiale da testare 5-20 g (a seconda del contenuto previsto di acido ascorbico), tagliarlo a pezzetti (patate, carote, aglio orsino, mele, ecc.) macinare accuratamente in un mortaio con un pizzico di vetro o sabbia di quarzo, aggiungendo in porzioni di 4 -5 ml di una soluzione con una frazione in massa di acido metafosforico o cloridrico del 2% fino ad ottenere una sospensione liquida omogenea. La miscela della malta è stata trasferita quantitativamente utilizzando una soluzione dell'acido utilizzato per la macinazione in un matraccio tarato della capacità di 100 ml e il volume totale dell'estratto è stato portato a volume con la stessa soluzione acida. Il contenuto è ben miscelato, infuso per 5-7 minuti e filtrato attraverso un filtro di carta. Il filtrato risultante dovrebbe essere completamente trasparente.
Gli acidi utilizzati per l'estrazione (cloridrico, metafosforico, ossalico) estraggono sia l'acido ascorbico libero che quello legato dal materiale di prova e contribuiscono anche alla stabilità dell'acido ascorbico negli estratti.
Si prendono due matracci conici con una capacità di 100-150 ml e ad uno si aggiungono con una pipetta 20 ml del filtrato risultante e nell'altro 20 ml della soluzione acida utilizzata per macinare il materiale in esame. Il contenuto dei coni viene titolato con il reagente indofenolo finché non viene mantenuto un colore rosa tenue per 30 secondi. Si registrano i risultati e si ripete la titolazione con nuove porzioni dello stesso filtrato. In base al valore medio ottenuto da 2-3 determinazioni, il contenuto di acido ascorbico viene calcolato utilizzando la formula:
![]() ,
,
(a-b)è la differenza tra i volumi del reagente indofenolo utilizzato per la titolazione dei campioni sperimentali (a) e di controllo (b), in ml;
u è il volume totale dell'estratto, ml;
u 1 è il volume del filtrato prelevato per la titolazione, ml;
m è la massa del materiale in esame, g,
100 - ricalcolo per 100 g di materiale.
I tessuti vegetali contengono alcune quantità di altre sostanze riducenti che riducono il 2,6-diclorofenolindofenolo, quindi se è necessario condurre un'analisi particolarmente accurata, è necessario tenerne conto. Per fare ciò, 0,1 o 0,2 ml di una soluzione al 10% di solfato di rame vengono aggiunti ad altre due porzioni di 10-20 ml dell'estratto studiato e riscaldati in un termostato o in un forno per 10 minuti ad una temperatura di 110 ˚С. Raffreddare e titolare con il reagente indofenolo. In presenza di sali di rame e quando riscaldato, l'acido ascorbico viene completamente distrutto. La correzione risultante viene sottratta dai dati di titolazione dei campioni sperimentali.
Analizzando molti frutti e bacche, alcune verdure, si ottengono estratti colorati, il che rende difficile determinare l'acido ascorbico. Per determinare l'acido ascorbico, l'estratto colorato viene trasferito in un'ampia provetta, si aggiungono 2-5 ml di dicloroetano o cloroformio e si titola agitando con una soluzione di reagente indofenolo finché nello strato di dicloroetano o cloroformio appare un colore rosa, che non non scomparire per 30 secondi.
Durante la determinazione, è necessario tenere conto della capacità riducente degli acidi utilizzati per l'estrazione (una miscela di 20 ml di acido cloridrico all'1% e 80 ml di acido metafosforico al 2% o ossalico all'1%). Per fare ciò, due porzioni della miscela di acidi, da 10 ml ciascuna, vengono titolate con un reagente indofenolo fino ad ottenere una colorazione rosa. La correzione risultante (solitamente non superiore a 0,08-0,10 ml di soluzione di vernice) viene sottratta dai dati di titolazione delle soluzioni sperimentali.
|
SODIO 2,6-DICLOROFENOLINDOFENOLO (ACIDO ASCORBICO)
|
|
La massa di acido ascorbico (in mg) corrispondente a 1 ml del reagente indofenolo (una soluzione di sodio 2,6-diclorofenolindofenolo) si calcola con la formula:
dove M è la massa di acido ascorbico in mg, corrispondente a 1 ml di reagente indofenolo;
(u-u 1) - la differenza tra i volumi del reagente indofenolo utilizzato per la titolazione del campione con acido ascorbico (u) e il campione senza acido ascorbico (u 1), ml;
2 - la massa di acido ascorbico in mg contenuta nel campione sperimentale (esperimento principale).
7.7.3. DOSAGGIO DELLA VITAMINA C NEL LATTE
Per determinare l'acido ascorbico nel latte, le proteine vengono preliminarmente precipitate.
Versare in un pallone 50 ml di latte e aggiungere 4 ml di una soluzione satura di acido ossalico, agitare, aggiungere 10 ml di una soluzione satura di cloruro di sodio, agitare e lasciare a temperatura ambiente per 5 minuti. Successivamente si filtra il contenuto del pallone su filtro pieghettato di carta, si misurano con una pipetta 20 ml del filtrato e si titolano con il reagente indofenolo finché persiste una colorazione leggermente rosata per 30 secondi. Prelevare altri 20 ml del filtrato e ripetere la titolazione. Per il calcolo, prendi il risultato medio.
Parallelamente, viene eseguita una determinazione di controllo, per la quale in un pallone vengono mescolati 50 ml di acqua, 4 ml di una soluzione satura di acido ossalico e 10 ml di una soluzione satura di cloruro di sodio. Quindi procedere come nell'esperimento principale.
![]() ,
,
Dove (a-b)è la differenza tra i volumi del reagente indofenolo utilizzato per la titolazione dei campioni sperimentali e di controllo, in ml;
64 è il volume totale del latte dopo l'aggiunta dei precipitanti proteici e grassi;
M è la massa di acido ascorbico corrispondente a 1 ml di reagente indofenolo (vedi paragrafo 7.7.2.), mg;
u è il volume del filtrato prelevato per la titolazione, ml;
u 1 - il volume di latte prelevato per l'analisi, ml.
REAGENTI. Acqua distillata; latte fresco; patate (limoni, carote, mele, cavoli, aglio selvatico, ecc.); soluzione con una frazione in massa di acido metafosforico o cloridrico al 2%; soluzione satura di acido ossalico; soluzione satura di cloruro di sodio; soluzione standard di acido ascorbico appena preparata (in un matraccio tarato con una capacità di 100 ml aggiungere 100 mg di acido ascorbico della qualifica "medica" e, sciogliendosi, portare il volume al segno con una soluzione con una frazione di massa di metafosforico o acido cloridrico al 2%; reagente indofenolo (in un matraccio tarato da 500 ml aggiungere 140-150 mg di 2,6-diclorofenolindofenolo sodico e 200-300 ml di acqua, agitare energicamente fino allo scioglimento della vernice, regolare il volume a macchia con acqua, mescolata e filtrata con filtro di carta in una bottiglia di vetro scuro asciutta; la soluzione si conserva in frigorifero per non più di tre giorni).
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0