Zolfo giallo puro
Un minerale della classe degli elementi nativi. Lo zolfo è un esempio di polimorfismo enantiomorfo ben definito. In natura forma 2 modificazioni polimorfiche: zolfo a-ortorombico e zolfo b-monoclino. Alla pressione atmosferica e alla temperatura di 95,6°C l'a-zolfo si trasforma in b-zolfo. Lo zolfo è vitale per la crescita di piante e animali; fa parte degli organismi viventi e dei loro prodotti di decomposizione; ce n'è in abbondanza, ad esempio, nelle uova, nel cavolo, nel rafano, nell'aglio, nella senape, nelle cipolle, nei capelli, nella lana, ecc. . È presente anche nel carbone e nel petrolio.
Guarda anche:
STRUTTURA

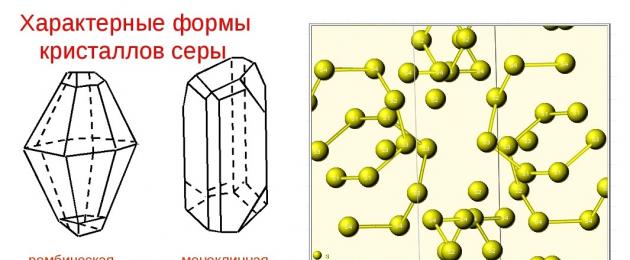
Lo zolfo nativo è solitamente rappresentato dall'a-zolfo, che cristallizza nel sistema rombico, simmetria di tipo rombico-bipiramidale. Lo zolfo cristallino ha due modifiche; uno di essi, ortorombico, si ottiene da una soluzione di zolfo in disolfuro di carbonio (CS 2) facendo evaporare il solvente a temperatura ambiente. In questo caso si formano cristalli traslucidi a forma di diamante di colore giallo chiaro, facilmente solubili in CS 2. Questa modificazione è stabile fino a 96°C; a temperature più elevate la forma monoclina è stabile. Con il raffreddamento naturale dello zolfo fuso in crogioli cilindrici si formano grandi cristalli della modificazione ortorombica dalla forma distorta (ottaedri con angoli o facce parzialmente “tagliati”). Questo materiale è chiamato zolfo in pezzi nell'industria. La modificazione monoclina dello zolfo è costituita da lunghi cristalli aghiformi di colore giallo scuro trasparente, anch'essi solubili in CS 2. Quando lo zolfo monoclino viene raffreddato al di sotto di 96° C, si forma uno zolfo ortorombico giallo più stabile.
PROPRIETÀ

Lo zolfo nativo è di colore giallo, in presenza di impurità è giallo-bruno, arancio, bruno fino al nero; contiene inclusioni di bitume, carbonati, solfati e argilla. I cristalli di zolfo puro sono trasparenti o traslucidi, le masse solide sono traslucide ai bordi. La lucentezza è da resinosa a grassa. Durezza 1-2, nessuna sfaldatura, frattura concoidale. Densità 2,05 -2,08 g/cm 3, fragile. Facilmente solubile in balsamo del Canada, trementina e cherosene. Insolubile in HCl e H 2 SO 4. HNO 3 e acqua regia ossidano lo zolfo, trasformandolo in H 2 SO 4. Lo zolfo differisce significativamente dall'ossigeno nella sua capacità di formare catene e cicli stabili di atomi.
Le più stabili sono le molecole cicliche S8, a forma di corona, che formano zolfo ortorombico e monoclino. Questo è zolfo cristallino, una fragile sostanza gialla. Inoltre sono possibili molecole con catene chiuse (S 4, S 6) e catene aperte. Questa composizione contiene zolfo plastico, una sostanza marrone, che si ottiene mediante un forte raffreddamento dello zolfo fuso (lo zolfo plastico diventa fragile dopo poche ore, acquisisce un colore giallo e si trasforma gradualmente in rombico). La formula dello zolfo è spesso scritta semplicemente S, poiché, sebbene abbia una struttura molecolare, è una miscela di sostanze semplici con molecole diverse.
Lo scioglimento dello zolfo è accompagnato da un notevole aumento di volume (circa il 15%). Lo zolfo fuso è un liquido giallo, facilmente mobile, che sopra i 160 °C si trasforma in una massa marrone scuro molto viscosa. Lo zolfo fuso acquisisce la massima viscosità alla temperatura di 190 °C; un ulteriore aumento della temperatura è accompagnato da una diminuzione della viscosità e sopra i 300 °C lo zolfo fuso ritorna mobile. Questo perché quando lo zolfo viene riscaldato, polimerizza gradualmente, aumentando la lunghezza della catena all'aumentare della temperatura. Quando lo zolfo viene riscaldato oltre i 190°C, le unità polimeriche iniziano a collassare.
Lo zolfo può servire come l'esempio più semplice di elettrete. Quando viene strofinato, lo zolfo acquisisce una forte carica negativa.
MORFOLOGIA

Forma cristalli troncato-bipiramidali, meno spesso bipiramidali, pinacoidali o prismatici spessi, nonché densi aggregati criptocristallini, confluenti, granulari e meno spesso fibrosi fini. Le principali forme nei cristalli: dipiramidi (111) e (113), prismi (011) e (101), pinacoidi (001). Anche incrostazioni e druse di cristalli, cristalli scheletrici, pseudostalattiti, masse polverose e terrose, depositi e adesivi. I cristalli sono caratterizzati da molteplici crescite parallele.
ORIGINE

Lo zolfo si forma durante le eruzioni vulcaniche, durante l'erosione dei solfuri, durante la decomposizione degli strati sedimentari contenenti gesso e anche in connessione con l'attività dei batteri. I principali tipi di depositi di zolfo nativi sono vulcanogeni ed esogeni (chemogenici-sedimentari). Predominano i depositi esogeni; sono associati alle anidrite di gesso che, sotto l'influenza delle emissioni di idrocarburi e idrogeno solforato, vengono ridotte e sostituite da minerali di zolfo-calcite. Tutti i depositi principali hanno una tale genesi metasomatica di infiltrazione. Lo zolfo nativo si forma spesso (ad eccezione di grandi accumuli) a seguito dell'ossidazione di H 2 S. I processi geochimici della sua formazione sono attivati in modo significativo da microrganismi (batteri solfato-riduttori e tionici). I minerali associati sono calcite, aragonite, gesso, anidrite, celestino e talvolta bitume. Tra i depositi vulcanogeni di zolfo nativo, i principali sono idrotermali-metasomatici (ad esempio in Giappone), formati da quarziti e opaliti contenenti zolfo, e limi vulcanici-sedimentari contenenti zolfo di laghi vulcanici. Si forma anche durante l'attività fumarolica. Formatosi nelle condizioni della superficie terrestre, lo zolfo nativo non è ancora molto stabile e, ossidandosi gradualmente, dà origine a solfati, cap. come il gesso.
Utilizzato nella produzione di acido solforico (circa il 50% della quantità estratta). Nel 1890, Hermann Frasch propose di fondere lo zolfo sottoterra e di estrarlo in superficie attraverso pozzi, e attualmente i depositi di zolfo si sviluppano principalmente fondendo lo zolfo nativo dagli strati sotterranei direttamente nella sua posizione. Lo zolfo si trova in grandi quantità anche nel gas naturale (sotto forma di idrogeno solforato e anidride solforosa); durante la produzione del gas si deposita sulle pareti delle tubazioni rendendole inutilizzabili, per questo viene recuperato dal gas il più velocemente possibile dopo la produzione.
APPLICAZIONE

Circa la metà dello zolfo prodotto viene utilizzato nella produzione di acido solforico. Lo zolfo viene utilizzato per la vulcanizzazione della gomma, come fungicida in agricoltura e come zolfo colloidale, un medicinale. Inoltre, lo zolfo nelle composizioni di bitume allo zolfo viene utilizzato per produrre asfalto allo zolfo e come sostituto del cemento Portland per produrre calcestruzzo allo zolfo. Lo zolfo viene utilizzato per la produzione di composizioni pirotecniche, in precedenza veniva utilizzato nella produzione di polvere da sparo e viene utilizzato per la produzione di fiammiferi.
Zolfo (Ing. Zolfo) - S
CLASSIFICAZIONE
| Strunz (ottava edizione) | 1/B.03-10 |
| Nickel-Strunz (10a edizione) | 1.CC.05 |
| Dana (7a edizione) | 1.3.4.1 |
| Dana (ottava edizione) | 1.3.5.1 |
| Ciao, CIM Rif. | 1.51 |
Si possono distinguere i seguenti tipi genetici: 1) igneo, 2) carbonatitico, 3) skarn, 4) idrotermale e pneumatolitico, 5) vulcanogeno-sedimentario, 6) sotterraneo e gasolio, 7) sedimentario.
A depositi magmatici di zolfo dovrebbe essere classificato come depositi di segregazione di rame-nichel, zolfo in cui forma solfuri di, , , e altri metalli e viene estratto come sottoprodotto durante la lavorazione di minerali di metalli non ferrosi. Esempi: Talnakh e altri depositi in Russia, Sudbury in Canada.
A depositi di zolfo carbonatitico comprendono rari gessi-bariti-fluoriti associati alle parti apicali di complessi carbonatitici. Da cui si estrae lo zolfo. Un esempio è il campo Amba-Dongar in India.
A depositi di zolfo di skarn Questi includono depositi di rame e polimetallici, il cui zolfo è rappresentato anche da solfuri di vari metalli: ferro, rame, ecc. Vengono estratti lungo il percorso per produrre metalli. Esempi sono le miniere di rame di Torino degli Urali, i depositi polimetallici di Kara-Mazar nell'Asia centrale.
Tra depositi idrotermali di zolfo Occorre distinguere plutonogenico e vulcanogenico. I depositi plutonogeni comprendono depositi di rame e polimetallici, il cui zolfo forma solfuri di ferro e metalli non ferrosi; viene estratto lungo il percorso. Esempi sono i depositi polimetallici della Transbaikalia. Tra i depositi vulcanici idrotermali spiccano numerose formazioni. Le formazioni di zolfo nativo nelle formazioni vulcaniche dovrebbero essere classificate come questo tipo. Si tratta di depositi metasomatici (più precisamente, impregnazione-metasomatici, poiché parte dello zolfo è formato non per sostituzione, ma per riempimento di vuoti) di zolfo nelle zone vicine alla superficie delle strutture vulcaniche, principalmente tra opalite, e depositi di flussi di zolfo e i crateri si sciolgono, così come i depositi formati da gas contenenti zolfo e acque calde direttamente in superficie.
I depositi metasomatici di impregnazione, che svolgono un ruolo di primo piano nel gruppo vulcanogenico, sono caratterizzati da una certa zonazione metasomatica, e tra le rocce caratteristiche qui ci sono gli stessi minerali di zolfo: opaliti contenenti zolfo e rocce di alunite, propiliti e vulcani montmorillonitizzati. Esempi: Novoe sulle Isole Curili, Melitoyvayamskoye in Kamchatka, una serie di depositi in Giappone. Questo tipo di depositi si verifica quando gas e soluzioni contenenti zolfo agiscono su strutture vulcaniche, mentre un certo numero di metalli vengono intensamente lisciviati, incluso il ferro e, mentre la silice rimane e forma essenzialmente rocce opali - opaliti.
Spesso, insieme allo zolfo nativo e all'alunite minerale contenente zolfo, si nota anche il solfuro di zolfo - melnikovite. I depositi di flussi di zolfo derivano dallo scioglimento di depositi di zolfo precedentemente formati durante l'attivazione dei vulcani. Ad esempio, in Giappone presso il vulcano Sieretoko-Iotsan è stato osservato un flusso di zolfo che trasportava 200mila tonnellate di zolfo. Alcuni vulcani hanno lo zolfo fuso nei loro crateri (ad esempio, nelle Isole Galapagos). Piccoli depositi superficiali di zolfo, compresi i solforati, sono formati da acque e gas contenenti zolfo. Sono conosciuti dal vulcano Mendeleev e da numerosi vulcani in Giappone.
A depositi vulcanici-sedimentari di zolfo Questi includono depositi craterici-lacustri di zolfo nativo, nonché depositi di minerali di solfuro che si formano quando idroterme vulcanogeniche contenenti zolfo entrano nei bacini marini. Un esempio di depositi craterici-lacustri è uno dei grandi depositi dell'Indonesia, Telaga Bodaye. I depositi vulcanici-sedimentari di solfuro comprendono una serie di depositi in Spagna e Portogallo, che svolgono un ruolo significativo nella produzione di solfuro di zolfo. Rientrano in questa tipologia anche alcuni giacimenti di metalli non ferrosi, dai cui minerali si estrae lo zolfo come componente associato.
Di notevole importanza nella produzione di zolfo sono depositi di zolfo sotterranei e di gasolio. I depositi di acque sotterranee si formano durante la sostituzione metasomatica di gesso e anidrite con minerali di zolfo-calcite. Questo processo avviene ad una certa distanza dalla superficie terrestre, cioè può iniziare solo dopo un certo livello di denudazione, facendo avvicinare alla superficie gli orizzonti produttivi del gesso e dell'anidrite. In questo caso giocano un ruolo significativo i processi di erosione, in particolare l’attività delle antiche valli che avvicinano gli strati solfatici alla superficie, nonché la presenza di faglie che facilitano la migrazione dell’acqua, compresa la risalita delle acque profonde. Questo tipo di depositi comprende i più grandi giacimenti di zolfo in Russia, Medio Oriente, ecc. 
Una varietà di depositi di questo tipo sono depositi di zolfo nelle coperture rocciose delle cupole saline. I caprocks, o cappucci residui, si verificano quando le parti superiori delle cupole saline in crescita si dissolvono. La loro struttura è zonale: direttamente sopra i sali, nella regione del loro fronte di dissoluzione, rappresentato dallo “specchio del sale”, si trovano gessi e anidriti, sopra c'è una zona di rocce carbonatiche, e sopra spesso ci sono accumuli di argille , come residuo più insolubile della massa salina. Le rocce della zona del solfato di calcio sono soggette a solforazione (vedi Fig. 30). Un esempio di questo sottotipo di depositi sono i depositi di zolfo del Golfo del Messico.
IN giacimenti di gas zolfo fa parte dell'idrogeno solforato, che viene estratto incidentalmente durante l'estrazione dei gas combustibili naturali. Tali depositi sono noti in Canada, Francia, Russia (giacimenti di gas di Orenburg). Depositi di oli solforosi sono noti in numerosi paesi. Lo zolfo viene recuperato come sottoprodotto durante la lavorazione.
A depositi sedimentari di zolfo includono depositi di anidrite di gesso, da cui si ottiene lo zolfo in diversi paesi, nonché depositi di pietre e marroni contenenti pirite e accumuli di pirite e marcasite in arenarie e rocce argillose, comprese le rocce argillose. I composti dello zolfo vengono estratti dal carbone sia durante l'arricchimento del carbone che durante la produzione di coke. Esempio: bacino della lignite vicino a Mosca. Accumuli, compresi noduli di piriti di ferro, sono noti nei depositi sabbiosi-argillosi di numerosi paesi, compresa la Russia, ecc. Talvolta si notano depositi continui di piriti (non noduli o pani), anche se in questo caso la genesi effusivo-sedimentaria di questi strati non possono essere esclusi e lenti di minerali solidi di pirite.
In alcuni casi è stata notata la formazione di accumuli sedimentari di zolfo nativo, ma non sono stati ancora accertati accumuli industriali di questo tipo.
Lo zolfo (Zolfo) è un elemento della tavola periodica degli elementi chimici e appartiene al gruppo dei calcogeni. Questo elemento partecipa attivamente alla formazione di molti acidi e sali. L'idrogeno e i composti acidi contengono zolfo, solitamente come parte di vari ioni. Un gran numero di sali, tra cui lo zolfo, sono praticamente insolubili in acqua.
Lo zolfo è un elemento abbastanza comune in natura. In base al suo contenuto chimico nella crosta terrestre, gli fu assegnato il numero sedici e, in base alla sua presenza nei corpi idrici, il numero sei. Può verificarsi sia nello stato libero che in quello legato.
I minerali naturali più importanti dell'elemento includono: pirite di ferro (pirite) - FeS 2, blenda di zinco (sfalerite) - ZnS, galena - PbS, cinabro - HgS, stibnite - Sb 2 S 3. Inoltre, il sedicesimo elemento della tavola periodica si trova nel petrolio, nel carbone naturale, nei gas naturali e nello scisto. La presenza di zolfo nell'ambiente acquatico è rappresentata dagli ioni solfato. È la sua presenza in acqua dolce che provoca una durezza costante. È anche uno degli elementi più importanti della vita degli organismi superiori, fa parte della struttura di molte proteine ed è concentrato anche nei capelli.
| Caratteristica | Senso |
|---|---|
| Proprietà dell'atomo | |
| Nome, simbolo, numero | Zolfo/Zolfo (S), 16 |
| Massa atomica (massa molare) | [Comm. 1] a. e.m. (g/mol) |
| Configurazione elettronica | 3s2 3p4 |
| Raggio atomico | 127:00 |
| Proprietà chimiche | |
| Raggio di valenza | 22:00 |
| Raggio ionico | 30 (+6e) 184 (-2e) p.m |
| Elettronegatività | 2.58 (scala Pauling) |
| Potenziale dell'elettrodo | 0 |
| Stato di ossidazione | +6, +4, +2, +1, 0, -1, −2 |
| Energia di ionizzazione (primo elettrone) | 999,0 (10,35) kJ/mol (eV) |
| Proprietà termodinamiche di una sostanza semplice | |
| Densità (in condizioni normali) | 2.070 g/cm³ |
| Temperatura di fusione | 386K (112,85 °C) |
| Temperatura di ebollizione | 717,824 K (444,67 °C) |
| Ud. calore di fusione | 1,23 kJ/mol |
| Ud. calore di vaporizzazione | 10,5 kJ/mol |
| Capacità termica molare | 22,61 J/(Kmol) |
| Volume molare | 15,5 cm³/mol |
|
Reticolo cristallino di una sostanza semplice |
|
| Struttura reticolare | ortorombico |
| Parametri del reticolo | a=10,437 b=12,845 c=24,369 Å |
| Altre caratteristiche | |
| Conduttività termica | (300 K) 0,27 W/(m·K) |
| numero CAS | 7704-34-9 |
Minerale di zolfo
Non si può dire che lo stato libero dello zolfo in natura sia un evento frequente. Lo zolfo nativo è piuttosto raro. È spesso uno dei componenti di alcuni minerali. Il minerale di zolfo è una roccia che contiene zolfo nativo. Le inclusioni di zolfo nelle rocce possono formarsi insieme alle rocce che le accompagnano o successivamente. Il tempo della loro formazione influenza la direzione del lavoro di prospezione ed esplorazione. Gli esperti identificano diverse teorie sulla formazione dello zolfo nei minerali.
- Teoria della singenesi. Secondo questa teoria, lo zolfo e le rocce ospiti si formarono simultaneamente. Il luogo della loro formazione erano bacini poco profondi. I solfati contenuti nell'acqua venivano ridotti in idrogeno solforato con l'aiuto di speciali batteri. Successivamente, salì fino alla zona di ossidazione, in cui l'idrogeno solforato fu ossidato in zolfo elementare. Affondò sul fondo, depositandosi nel limo, che col tempo si trasformò in minerale.
- La teoria dell'epigenesi, secondo cui la formazione delle inclusioni di zolfo è avvenuta più tardi rispetto alle rocce principali. Secondo questa teoria, si ritiene che le acque sotterranee siano penetrate negli strati rocciosi, a seguito dei quali l'acqua si è arricchita di solfati. Successivamente, queste acque sono entrate in contatto con depositi di petrolio o gas, che hanno portato alla riduzione degli ioni solfato con l'aiuto di idrocarburi in idrogeno solforato, che, risalendo in superficie e ossidandosi, ha rilasciato zolfo nativo nei vuoti e nelle fessure delle rocce .
- La teoria del metasomatismo. Questa teoria è uno dei sottotipi della teoria dell'epigenesi. Attualmente viene sempre più confermato. La sua essenza risiede nella conversione del gesso (CaSO 4 -H 2 O) e dell'anidrite (CaSO 4) in zolfo e calcite (CaCO 3-). La teoria fu proposta da due scienziati Miropolsky e Krotov nella prima metà del XX secolo. Alcuni anni dopo fu trovato il deposito di Mishrak, che confermò la formazione di zolfo in questo modo. Tuttavia, il processo di trasformazione del gesso in zolfo e calcite rimane ancora oggi poco chiaro. A questo proposito, la teoria del metasomatismo non è l’unica corretta. Inoltre, oggi sul pianeta ci sono laghi che hanno depositi di zolfo singenetici, tuttavia nel limo non sono stati trovati gesso o anidrite. Tali laghi includono il lago Sernoye, situato vicino a Sernovodsk.
Pertanto, non esiste una teoria univoca sull'origine delle inclusioni di zolfo nei minerali. La formazione della materia dipende in gran parte dalle condizioni e dai fenomeni che si verificano nelle viscere della terra.
Depositi di zolfo
Lo zolfo viene estratto in luoghi in cui è localizzato il minerale di zolfo: depositi. Secondo alcuni rapporti, le riserve mondiali di zolfo ammontano a circa 1,4 miliardi di tonnellate. Oggi sono stati trovati depositi di zolfo in molti angoli della Terra: in Turkmenistan, negli Stati Uniti, nella regione del Volga, vicino alla riva sinistra del Volga, che va da Samara, ecc. A volte la striscia rocciosa può estendersi per diversi chilometri.
Il Texas e la Louisiana sono famosi per le loro grandi riserve di zolfo. Cristalli di zolfo, distinti per la loro bellezza, si trovano anche in Romagna e in Sicilia (Italia). L'isola di Vulcano è considerata la culla dello zolfo monoclino. La Russia, in particolare gli Urali, è famosa anche per i suoi depositi del sedicesimo elemento della tavola periodica di Mendeleev.
I minerali di zolfo sono classificati in base alla quantità di zolfo che contengono. Pertanto, tra questi ci sono minerali ricchi (dal 25% di zolfo) e minerali poveri (circa il 12% della sostanza). I depositi di zolfo, a loro volta, sono suddivisi nei seguenti tipi:
- Depositi stratiformi (60%). Questo tipo di depositi è associato a strati solfato-carbonatici. I corpi minerali si trovano direttamente nelle rocce solfatiche. Possono raggiungere le centinaia di metri di dimensione ed avere uno spessore di diverse decine di metri;
- Depositi a cupola salina (35%). Questa tipologia è caratterizzata da depositi di zolfo grigio;
- Vulcanogenico (5%). Rientrano in questa tipologia i depositi formati da vulcani di struttura giovane e moderna. La forma dell'elemento minerale che si trova in essi è simile a un foglio o a forma di lente. Tali depositi possono contenere circa il 40% di zolfo. Sono caratteristici della cintura vulcanica del Pacifico.
Estrazione dello zolfo
Lo zolfo viene estratto utilizzando uno dei numerosi metodi possibili, la cui scelta dipende dalle condizioni in cui si trova la sostanza. Ce ne sono solo due principali: aperti e sotterranei.
Il metodo di estrazione dello zolfo a cielo aperto è il più popolare. L'intero processo di estrazione di una sostanza con questo metodo inizia con la rimozione di una quantità significativa di roccia da parte degli escavatori, dopodiché il minerale stesso viene frantumato. I blocchi minerali risultanti vengono trasportati allo stabilimento per un ulteriore arricchimento, dopo di che vengono trasportati nell'impresa dove viene fuso lo zolfo e la sostanza viene ottenuta dai concentrati.
Inoltre, a volte viene utilizzato anche il metodo Frasch, che prevede la fusione dello zolfo nel sottosuolo. Si consiglia di utilizzare questo metodo in luoghi in cui la sostanza è profonda. Dopo lo scioglimento sottoterra, la sostanza viene pompata fuori. A tale scopo si formano dei pozzi, che sono lo strumento principale per pompare la sostanza fusa. Il metodo si basa sulla facilità di fusione dell'elemento e sulla sua bassa densità.
Esiste anche un metodo di separazione centrifuga. Tuttavia, presenta un grosso inconveniente, dovuto al fatto che lo zolfo ottenuto con questo metodo presenta molte impurità e richiede un'ulteriore purificazione. Di conseguenza, il metodo è considerato piuttosto costoso.
Oltre ai metodi sopra indicati, in alcuni casi l'estrazione dello zolfo può essere effettuata anche:
- metodo del pozzo;
- metodo acqua-vapore;
- metodo di filtrazione;
- metodo termico;
- metodo di estrazione.
Vale la pena notare che, indipendentemente dal metodo utilizzato durante l'estrazione della sostanza dalle viscere della terra, è necessario prestare particolare attenzione alle precauzioni di sicurezza. Ciò è dovuto alla presenza di idrogeno solforato insieme a depositi di zolfo, che sono tossici per l'uomo e infiammabili.
I calcogeni sono un gruppo di elementi a cui appartiene lo zolfo. Il suo simbolo chimico è S, la prima lettera del nome latino Zolfo. La composizione di una sostanza semplice si scrive utilizzando questo simbolo senza indice. Consideriamo i punti principali riguardanti la struttura, le proprietà, la produzione e l'utilizzo di questo elemento. Le caratteristiche dello zolfo verranno presentate nel modo più dettagliato possibile.
Caratteristiche generali e differenze dei calcogeni
Lo zolfo appartiene al sottogruppo dell'ossigeno. Questo è il sedicesimo gruppo nella moderna forma a lungo periodo del sistema periodico (PS). La versione obsoleta del numero e dell'indice è VIA. Nomi degli elementi chimici del gruppo, simboli chimici:
- ossigeno (O);
- zolfo (S);
- selenio (Se);
- tellurio (Te);
- polonio (Po).
Il guscio elettronico esterno degli elementi di cui sopra ha la stessa struttura. In totale ne contiene 6 che possono partecipare alla formazione di legami chimici con altri atomi. I composti dell'idrogeno corrispondono alla composizione H 2 R, ad esempio H 2 S è idrogeno solforato. Nomi di elementi chimici che formano due tipi di composti con l'ossigeno: zolfo, selenio e tellurio. Le formule generali degli ossidi di questi elementi sono RO 2, RO 3.
I calcogeni corrispondono a sostanze semplici che differiscono significativamente nelle proprietà fisiche. I calcogeni più comuni nella crosta terrestre sono l'ossigeno e lo zolfo. Il primo elemento forma due gas, il secondo solidi. Il polonio, un elemento radioattivo, si trova raramente nella crosta terrestre. Nel gruppo dall'ossigeno al polonio, le proprietà non metalliche diminuiscono e le proprietà metalliche aumentano. Ad esempio, lo zolfo è un tipico non metallo, mentre il tellurio ha una lucentezza metallica e conduttività elettrica.
Elemento n. 16 della tavola periodica D.I. Mendeleev
La massa atomica relativa dello zolfo è 32.064. Tra gli isotopi naturali, il 32 S è il più comune (oltre il 95% in peso). In quantità minori si trovano nuclidi con masse atomiche 33, 34 e 36. Caratteristiche dello zolfo per posizione nel PS e struttura atomica:

- numero di serie - 16;
- la carica del nucleo atomico è +16;
- raggio atomico - 0,104 nm;
- energia di ionizzazione -10,36 eV;
- elettronegatività relativa - 2,6;
- stato di ossidazione nei composti - +6, +4, +2, -2;
- valenza - II(-), II(+), IV(+), VI (+).
Lo zolfo è nel terzo periodo; gli elettroni in un atomo si trovano a tre livelli energetici: sul primo - 2, sul secondo - 8, sul terzo - 6. Tutti gli elettroni esterni sono di valenza. Quando interagisce con elementi più elettronegativi, lo zolfo cede 4 o 6 elettroni, acquisendo stati di ossidazione tipici di +6, +4. Nelle reazioni con idrogeno e metalli, l'atomo attrae i 2 elettroni mancanti finché l'ottetto non si riempie e si raggiunge uno stato stabile. in questo caso si riduce a -2.
Proprietà fisiche delle forme allotropiche rombica e monoclina

In condizioni normali, gli atomi di zolfo sono collegati tra loro ad angolo per formare catene stabili. Possono essere chiusi in anelli, il che suggerisce l'esistenza di molecole di zolfo cicliche. La loro composizione è riflessa dalle formule S 6 e S 8.
Le caratteristiche dello zolfo dovrebbero essere integrate da una descrizione delle differenze tra le modifiche allotropiche che hanno proprietà fisiche diverse.
Rombico, o α-zolfo, è la forma cristallina più stabile. Questi sono cristalli gialli brillanti costituiti da molecole S 8. La densità dello zolfo rombico è 2,07 g/cm3. I cristalli monoclini di colore giallo chiaro sono formati da β-zolfo con una densità di 1,96 g/cm3. Il punto di ebollizione raggiunge 444,5°C.
Preparazione dello zolfo amorfo
Di che colore è lo zolfo allo stato plastico? È una massa marrone scuro, completamente diversa dalla polvere gialla o dai cristalli. Per ottenerlo è necessario sciogliere lo zolfo ortorombico o monoclino. A temperature superiori a 110°C si forma un liquido che con l'ulteriore riscaldamento scurisce, a 200°C diventa denso e viscoso. Se versi rapidamente lo zolfo fuso in acqua fredda, si solidificherà per formare catene a zigzag, la cui composizione è riflessa dalla formula S n.

Solubilità dello zolfo
Alcune modifiche nel disolfuro di carbonio, nel benzene, nel toluene e nell'ammoniaca liquida. Se le soluzioni organiche vengono raffreddate lentamente, si formano cristalli aghiformi di zolfo monoclino. Quando i liquidi evaporano si liberano cristalli trasparenti di zolfo rombico, di colore giallo limone. Sono fragili e possono essere facilmente ridotti in polvere. Lo zolfo non si dissolve in acqua. I cristalli affondano sul fondo del recipiente e la polvere può galleggiare sulla superficie (non bagnata).

Proprietà chimiche
Le reazioni mostrano le tipiche proprietà non metalliche dell'elemento n. 16:
- lo zolfo ossida i metalli e l'idrogeno e si riduce allo ione S 2-;
- la combustione in aria e ossigeno produce di- e triossido di zolfo, che sono anidridi acide;
- in una reazione con un altro elemento più elettronegativo - il fluoro - anche lo zolfo perde i suoi elettroni (si ossida).
Zolfo libero in natura
In termini di abbondanza nella crosta terrestre, lo zolfo è al 15° posto tra gli elementi chimici. Il contenuto medio di atomi di S è pari allo 0,05% della massa della crosta terrestre.
Di che colore è lo zolfo in natura (nativo)? È una polvere giallo chiaro con un odore caratteristico o cristalli gialli con una lucentezza vetrosa. Depositi sotto forma di placer, strati cristallini di zolfo si trovano in aree di vulcanismo antico e moderno: in Italia, Polonia, Asia centrale, Giappone, Messico e Stati Uniti. Spesso durante l'estrazione si trovano bellissime druse e cristalli singoli giganti.
Solfuro di idrogeno e ossidi in natura
Nelle aree di vulcanismo, i composti gassosi dello zolfo affiorano in superficie. Il Mar Nero a una profondità di oltre 200 m è senza vita a causa del rilascio di idrogeno solforato H 2 S. La formula dell'ossido di zolfo è bivalente - SO 2, trivalente - SO 3. I composti gassosi elencati sono presenti in alcuni depositi di petrolio, gas e acque naturali. Lo zolfo è un componente del carbone. È necessario per la costruzione di molti composti organici. Quando l'albume di un uovo di gallina marcisce, viene rilasciato idrogeno solforato, motivo per cui si dice spesso che questo gas abbia l'odore di uova marce. Lo zolfo è un elemento biogenico; è necessario per la crescita e lo sviluppo dell'uomo, degli animali e delle piante.

L'importanza dei solfuri e dei solfati naturali
La caratterizzazione dello zolfo risulterà incompleta se non si dice che l'elemento non si trova solo sotto forma di sostanze semplici e di ossidi. I composti naturali più comuni sono i sali di idrogeno solforato e gli acidi solforici. I solfuri di rame, ferro, zinco, mercurio e piombo si trovano nei minerali calcopirite, pirite, sfalerite, cinabro e galena. I solfati comprendono i sali di sodio, calcio, bario e magnesio, che si formano in natura da minerali e rocce (mirabilite, gesso, selenite, barite, kieserite, epsomite). Tutti questi composti sono utilizzati in vari settori dell'economia, utilizzati come materie prime per lavorazioni industriali, fertilizzanti e materiali da costruzione. Alcuni idrati cristallini sono di grande importanza medica.
Ricevuta
La sostanza gialla allo stato libero si trova in natura a diverse profondità. Se necessario, lo zolfo viene fuso dalle rocce, non portandole in superficie, ma pompando acqua surriscaldata in profondità. Un altro metodo prevede la sublimazione delle rocce frantumate in forni speciali. Altri metodi prevedono la dissoluzione con solfuro di carbonio o la flottazione.
Il fabbisogno industriale di zolfo è elevato, quindi i suoi composti vengono utilizzati per ottenere la sostanza elementare. Nell'idrogeno solforato e nei solfuri, lo zolfo è in forma ridotta. Lo stato di ossidazione dell'elemento è -2. Lo zolfo viene ossidato, aumentando questo valore a 0. Ad esempio, secondo il metodo Leblanc, il solfato di sodio viene ridotto con carbone a solfuro. Da esso si ottiene quindi il solfuro di calcio, trattato con anidride carbonica e vapore acqueo. L'idrogeno solforato risultante viene ossidato con l'ossigeno atmosferico in presenza di un catalizzatore: 2H 2 S + O 2 = 2H 2 O + 2S. La determinazione dello zolfo ottenuto con metodi diversi talvolta dà valori di purezza bassi. La raffinazione o purificazione viene effettuata mediante distillazione, rettifica e trattamento con miscele di acidi.

Applicazione dello zolfo nell'industria moderna
Lo zolfo granulato viene utilizzato per diverse esigenze produttive:
- Produzione di acido solforico nell'industria chimica.
- Produzione di solfiti e solfati.
- Produzione di preparati per la nutrizione delle piante, lotta contro malattie e parassiti delle colture agricole.
- I minerali contenenti zolfo vengono lavorati negli impianti minerari e chimici per produrre metalli non ferrosi. Una produzione correlata è la produzione di acido solforico.
- Introduzione alla composizione di alcuni tipi di acciaio per conferire proprietà speciali.
- La gomma si ottiene attraverso la vulcanizzazione della gomma.
- Produzione di fiammiferi, articoli pirotecnici, esplosivi.
- Utilizzare per la preparazione di vernici, pigmenti, fibre artificiali.
- Sbiancamento dei tessuti.

Tossicità dello zolfo e dei suoi composti
Le particelle di polvere con un odore sgradevole irritano le mucose della cavità nasale e delle vie respiratorie, gli occhi e la pelle. Ma la tossicità dello zolfo elementare non è considerata particolarmente elevata. L'inalazione di idrogeno solforato e biossido può causare gravi avvelenamenti.
Se durante la tostatura dei minerali contenenti zolfo negli impianti metallurgici i gas di scarico non vengono catturati, entrano nell'atmosfera. Combinandosi con gocce e vapore acqueo, gli ossidi di zolfo e di azoto danno origine alle cosiddette piogge acide.
Zolfo e suoi composti in agricoltura
Le piante assorbono gli ioni solfato insieme alla soluzione del terreno. Una diminuzione del contenuto di zolfo porta ad un rallentamento del metabolismo degli aminoacidi e delle proteine nelle cellule verdi. Pertanto, i solfati vengono utilizzati per fertilizzare le colture agricole.

Per disinfettare pollai, scantinati e depositi di verdure, la semplice sostanza viene bruciata oppure i locali vengono trattati con moderni preparati contenenti zolfo. L'ossido di zolfo ha proprietà antimicrobiche, che è stato a lungo utilizzato nella produzione di vini e nella conservazione di frutta e verdura. I preparati di zolfo vengono utilizzati come pesticidi per combattere malattie e parassiti delle colture agricole (oidio e acari).
Applicazione in medicina

I grandi guaritori antichi Avicenna e Paracelso attribuivano grande importanza allo studio delle proprietà medicinali della polvere gialla. Successivamente si è scoperto che una persona che non riceve abbastanza zolfo nel cibo diventa più debole e sperimenta problemi di salute (tra cui prurito e desquamazione della pelle, indebolimento dei capelli e delle unghie). Il fatto è che senza zolfo, la sintesi di aminoacidi, cheratina e processi biochimici nel corpo viene interrotta.
Lo zolfo medico è incluso negli unguenti per il trattamento delle malattie della pelle: acne, eczema, psoriasi, allergie, seborrea. I bagni con zolfo possono alleviare il dolore dei reumatismi e della gotta. Per un migliore assorbimento da parte dell'organismo, sono stati creati preparati contenenti zolfo idrosolubile. Questa non è una polvere gialla, ma una sostanza bianca, finemente cristallina. Quando questo composto viene utilizzato esternamente, viene incluso in un prodotto cosmetico per la cura della pelle.
Il gesso è stato a lungo utilizzato per immobilizzare le parti ferite del corpo umano. prescritto come medicinale lassativo. La magnesia abbassa la pressione sanguigna, che viene utilizzata nel trattamento dell’ipertensione.
Lo zolfo nella storia
Anche nei tempi antichi, una sostanza gialla non metallica attirava l'attenzione umana. Ma fu solo nel 1789 che il grande chimico Lavoisier scoprì che le polveri e i cristalli presenti in natura erano composti da atomi di zolfo. Si credeva che l'odore sgradevole prodotto dalla combustione respingesse tutti gli spiriti maligni. La formula dell'ossido di zolfo, che si ottiene durante la combustione, è SO 2 (biossido). È un gas tossico e inalarlo è pericoloso per la salute. Gli scienziati spiegano diversi casi di estinzione di massa di interi villaggi sulle coste e nelle pianure con il rilascio di idrogeno solforato o anidride solforosa dal suolo o dall'acqua.
L'invenzione della polvere nera aumentò l'interesse militare per i cristalli gialli. Molte battaglie sono state vinte grazie alla capacità degli artigiani di combinare lo zolfo con altre sostanze durante il processo di lavorazione e l'uso del composto più importante, l'acido solforico, si è scoperto già molto tempo fa. Nel Medioevo questa sostanza era chiamata olio di vetriolo e i sali erano chiamati vetriolo. Il solfato di rame CuSO 4 e il solfato di ferro FeSO 4 non hanno ancora perso la loro importanza nell'industria e nell'agricoltura.
La produzione di zolfo aumentò significativamente dopo l’invenzione della polvere nera. Dopotutto, lo zolfo (insieme al carbone e al salnitro) è il suo componente indispensabile. Al giorno d'oggi, lo zolfo è una delle materie prime più importanti per molte industrie chimiche. Il consumo mondiale annuo di zolfo è di circa 20 milioni di tonnellate. I suoi consumatori industriali sono diversi settori: acido solforico, carta, gomma, fiammiferi, ecc. Lo zolfo è anche ampiamente utilizzato per controllare i parassiti agricoli, nella pirotecnica e in parte in medicina. In termini di contenuto nella crosta terrestre (0,03%), lo zolfo è un elemento molto comune. Tuttavia, grandi accumuli di zolfo nativo non sono molto comuni. È più spesso presente in alcuni minerali. Il minerale di zolfo nativo è una roccia intervallata da zolfo puro. Quando si sono formate queste inclusioni: contemporaneamente alle rocce che le accompagnano o successivamente? La direzione del lavoro di prospezione e di esplorazione dipende dalla risposta a questa domanda. Ma, nonostante migliaia di anni di comunicazione con lo zolfo, l’umanità non ha ancora una risposta chiara. I minerali di zolfo vengono estratti in diversi modi, a seconda delle condizioni in cui si trovano. Ma in ogni caso bisogna prestare molta attenzione alle precauzioni di sicurezza. I depositi di zolfo sono quasi sempre accompagnati da accumuli di gas velenosi - composti di zolfo. Inoltre, non dobbiamo dimenticare la possibilità di combustione spontanea.
I minerali di zolfo vengono estratti in diversi modi, a seconda delle condizioni in cui si trovano. Ma in ogni caso bisogna prestare molta attenzione alle precauzioni di sicurezza. I depositi di zolfo sono quasi sempre accompagnati da accumuli di gas velenosi - composti di zolfo. Inoltre, non dobbiamo dimenticare la possibilità di combustione spontanea.
L'estrazione del minerale a cielo aperto avviene in questo modo. Gli escavatori ambulanti rimuovono gli strati di roccia sotto i quali si trova il minerale. Lo strato di minerale viene frantumato mediante esplosioni, dopo di che i blocchi di minerale vengono inviati a un impianto di lavorazione e da lì a una fonderia di zolfo, dove lo zolfo viene estratto dal concentrato. I metodi di estrazione sono diversi. Alcuni di essi saranno discussi di seguito. Qui è opportuno descrivere brevemente il metodo del pozzo per estrarre lo zolfo dal sottosuolo, che ha permesso agli Stati Uniti d'America e al Messico di diventare i maggiori fornitori di zolfo.
Alla fine del secolo scorso furono scoperti ricchi giacimenti di minerale di zolfo nel sud degli Stati Uniti. Ma non è stato facile avvicinarsi agli strati: l'idrogeno solforato è penetrato nelle miniere (vale a dire, la miniera avrebbe dovuto essere sviluppata con il metodo minerario) e ha bloccato l'accesso allo zolfo. Inoltre, le sabbie mobili sabbiose rendevano difficile il passaggio negli strati contenenti zolfo. La soluzione fu trovata dal chimico Hermann Frasch, che propose di sciogliere lo zolfo nel sottosuolo e di pomparlo in superficie attraverso pozzi simili a pozzi petroliferi. Il punto di fusione dello zolfo relativamente basso (meno di 120 ° C) confermò la realtà dell'idea di Frasch. 1890 iniziarono i test che portarono al successo.
In linea di principio, l'installazione di Frasch è molto semplice: un tubo nel tubo. L'acqua surriscaldata viene fornita nello spazio tra i tubi e scorre attraverso di esso nella formazione. E lo zolfo fuso sale attraverso il tubo interno, riscaldato da tutti i lati. La versione moderna dell'installazione Frasch è completata da un terzo: il tubo più stretto. Attraverso di esso, l'aria compressa viene fornita nel pozzo, che aiuta a sollevare lo zolfo fuso in superficie. Uno dei principali vantaggi del metodo Frasch è che consente di ottenere zolfo relativamente puro già nella prima fase di produzione. Questo metodo è molto efficace quando si estraggono minerali ricchi.
In precedenza, si credeva che il metodo di fusione sotterranea dello zolfo fosse applicabile solo nelle condizioni specifiche delle "cupole saline" della costa del Pacifico degli Stati Uniti e del Messico. Tuttavia, gli esperimenti condotti in Polonia e in URSS hanno smentito questa opinione. Nella Polonia popolare già con questo metodo si estraggono grandi quantità di zolfo; nel 1968 furono lanciati i primi pozzi di zolfo nell'URSS.
E il minerale ottenuto nelle cave e nelle miniere deve essere lavorato (spesso con arricchimento preliminare), utilizzando vari metodi tecnologici.
Esistono diversi metodi noti per ottenere lo zolfo dai minerali di zolfo: vapore-acqua, filtrazione, termica, centrifuga ed estrazione.
I metodi termici per l'estrazione dello zolfo sono i più obsoleti. Già nel XVIII secolo, nel Regno di Napoli, lo zolfo veniva fuso in cumuli: i "solfatari". Ancora oggi in Italia lo zolfo viene fuso in forni primitivi, i “calcarones”. Il calore necessario per fondere lo zolfo dal minerale si ottiene bruciando parte dello zolfo estratto. Questo processo è inefficace, le perdite raggiungono il 45%.
L'Italia divenne anche la culla dei metodi acqua-vapore per l'estrazione dello zolfo dai minerali. Nel 1859 Giuseppe Gill ricevette un brevetto per il suo apparecchio, il predecessore delle odierne autoclavi. Il metodo dell’autoclave (significativamente migliorato, ovviamente) è ancora utilizzato in molti paesi.
Nel processo in autoclave, il concentrato di minerale di zolfo arricchito contenente fino all'80% di zolfo viene pompato nell'autoclave sotto forma di pasta liquida con reagenti. Qui viene fornito vapore acqueo sotto pressione. La polpa viene riscaldata a 130° C. Lo zolfo contenuto nel concentrato si scioglie e si separa dalla roccia. Dopo una breve decantazione, lo zolfo fuso viene drenato. Quindi gli "steri" - una sospensione di roccia di scarto in acqua - vengono rilasciati dall'autoclave? Gli sterili contengono una notevole quantità di zolfo e vengono restituiti all'impianto di lavorazione.
In Russia, il metodo dell'autoclave fu utilizzato per la prima volta dall'ingegnere K. G. Patkanov nel 1896.
Le autoclavi moderne sono dispositivi enormi alti quanto un edificio di quattro piani. Tali autoclavi sono installate, in particolare, presso l'impianto di fusione dello zolfo dello stabilimento chimico e minerario di Rozdol nella regione dei Carpazi.
In alcune industrie, ad esempio nel grande impianto di zolfo di Tarnobrzeg (Polonia), la roccia di scarto viene separata dallo zolfo fuso mediante filtri speciali. Recentemente nel nostro Paese è stato sviluppato il metodo di separazione mediante apposite centrifughe. In una parola, "il minerale d'oro (più precisamente, il minerale d'oro) può essere separato dalla roccia di scarto" in diversi modi.
Paesi diversi soddisfano il proprio fabbisogno di zolfo in modi diversi. Messico e Stati Uniti utilizzano principalmente il metodo Frasch. L'Italia, che è al terzo posto tra gli stati capitalisti nella produzione di zolfo, continua a estrarre e lavorare (con metodi diversi) minerali di zolfo dai giacimenti siciliani e dalla provincia di Marco. Il Giappone ha riserve significative di zolfo vulcanico. Francia e Canada, che non hanno zolfo nativo, ne hanno sviluppato la produzione su larga scala dai gas. Inghilterra e Germania non hanno propri depositi di zolfo. Coprono il loro fabbisogno di acido solforico trasformando materie prime contenenti zolfo (principalmente pirite) e importando zolfo elementare.
La Russia soddisfa pienamente le sue esigenze grazie alle proprie fonti di materie prime. Dopo la scoperta e lo sviluppo dei ricchi giacimenti dei Carpazi, l’URSS e la Polonia aumentarono significativamente la produzione di zolfo. Questo settore continua a svilupparsi. In Ucraina furono costruite nuove grandi imprese, furono ricostruiti vecchi impianti sul Volga e in Turkmenistan e fu ampliata la produzione di zolfo dal gas naturale e dai gas di scarico.
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0