Capitolo 1
Rachitismo e malattie simili al rachitismo
RACHITISMO
Sinonimi
Il rachitismo è attivo, infantile.
Definizione
Il rachitismo è un disturbo della mineralizzazione delle ossa in crescita, causato da una discrepanza temporanea tra il fabbisogno di fosfati e calcio da parte dell'organismo in crescita e l'insufficienza dei sistemi che ne assicurano l'apporto al corpo del bambino. Calcio, vitamina D e fosfati sono essenziali per il corpo in crescita.
Codice ICD-X
E55.0 Rachitismo attivo.
Epidemiologia
Casi di rachitismo sono stati descritti in tutti i paesi del mondo, compresi i paesi dell'Africa e dell'Asia. Tenendo conto delle manifestazioni ossee del rachitismo, la sua frequenza tra i bambini piccoli varia, secondo vari autori, dall'1,6 al 35%. Negli ultimi anni, i disturbi della mineralizzazione sono stati spesso rilevati nei bambini adolescenti, soprattutto con carenze nutrizionali, così come nei residenti di pelle scura delle regioni meridionali che si sono trasferiti nei paesi europei.
Prevenzione
Esistono misure di prevenzione prenatale e postnatale, specifiche e non specifiche del rachitismo. La prevenzione prenatale non specifica comprende la corretta routine quotidiana (passeggiate quotidiane obbligatorie, almeno 2 ore al giorno) e la dieta della donna incinta. La dieta dovrebbe contenere quantità sufficienti di vitamine, minerali e oligoelementi. La prevenzione specifica del rachitismo inizia a 32 settimane di gravidanza. Per prevenire disturbi del metabolismo fosfato-calcico, alle donne incinte sane viene prescritta vitamina D in una dose di 200 UI (massimo 400 UI) al giorno a partire dalla 32a settimana di gravidanza solo nei periodi invernale e primaverile dell'anno per 8 settimane . Anche alle donne incinte a rischio che soffrono di malattie somatiche e genitali viene prescritta la vitamina D a partire dalla 32a settimana, indipendentemente dalla stagione.
La prevenzione postnatale non specifica del rachitismo nei bambini comprende un regime razionale con sufficiente insolazione e alimentazione naturale del bambino.
Per i bambini prematuri, la questione della prescrizione di vitamina D viene decisa solo dopo aver ottimizzato i sussidi nutrizionali di fosfati e calcio, poiché l'ipovitaminosi D non è stata identificata nei bambini nati prematuri e l'osteopenia in questi bambini si basa principalmente su una carenza primaria di calcio e fosfati .
Per i bambini sani ma nati a termine la prevenzione specifica del rachitismo viene effettuata a partire da 3-4 settimane di vita con 400-500 UI di vitamina D al giorno nei periodi autunnale, invernale e primaverile con pause per mesi di intensa insolazione (da maggio a Ottobre). La prevenzione viene effettuata durante i primi due anni di vita.
Ai bambini ad alto rischio di rachitismo viene prescritta la vitamina D alla dose di 1000 UI al giorno. La prevenzione specifica del rachitismo viene effettuata meglio con una soluzione acquosa di vitamina D 3 . La forma idrosolubile della vitamina D 3 contiene 500 UI in 1 goccia.
La prevenzione del rachitismo con vitamina D è controindicata nei casi di danno organico perinatale al sistema nervoso, calciuria idiopatica e ipofosfatasia. Ai bambini con fontanella piccola o con sua chiusura precoce viene somministrata una profilassi ritardata, a partire dai 3-4 mesi di vita.
Classificazione
Ci sono il periodo iniziale, l'altezza, la convalescenza e gli effetti residui del rachitismo. In base alla gravità del processo, si distingue il rachitismo
lieve (I grado), moderato (II grado) e grave (III grado). Il decorso può essere acuto o subacuto.
Eziologia e patogenesi
I seguenti fattori contribuiscono allo sviluppo del rachitismo nei bambini.
1. Elevati tassi di crescita dei bambini in tenera età e un aumento del fabbisogno di componenti minerali, soprattutto nei neonati prematuri.
2. Carenza di calcio e fosfati negli alimenti associata a difetti nutrizionali.
Il metabolismo del calcio e dei fosfati è di particolare importanza nel periodo prenatale della vita. Un aumento del rischio di carenza di calcio nelle donne in gravidanza e, di conseguenza, nel feto si verifica se una donna non consuma latticini per vari motivi (vegetarismo, allergia alle proteine del latte, carenza di lattasi, ecc.), con restrizioni dietetiche sulla carne , pesce, uova (carenza di proteine), con un eccesso di fibre, fosfati, grassi negli alimenti o assunzione di enterosorbenti. L'osteopenia, secondo l'osteometria ecografica, è stata rilevata nel 10% dei neonati di madri sane e nel 42% dei bambini di donne con preeclampsia.
Nel latte materno il contenuto di calcio varia da 15 a 40 mg/dl, ed i bambini nei primi mesi di vita ricevono da 180 a 350 mg di calcio al giorno. Allo stesso tempo, la quantità necessaria di calcio per i bambini durante i primi 6 mesi è di almeno 400 mg al giorno. Il contenuto di fosfati nel latte materno varia da 5 a 15 mg/dl, ed i bambini nei primi mesi di vita ricevono da 50 a 180 mg di fosfati al giorno. Per i bambini nella prima metà dell'anno, la quantità richiesta di fosfati dovrebbe essere di almeno 300 mg. Una carenza di calcio e fosfati nella dieta e una violazione del loro rapporto sono possibili se non si rispettano i principi di un'alimentazione razionale dei bambini allattati artificialmente.
Nella patogenesi del rachitismo, una carenza nella dieta di vitamine A, C, gruppo B (soprattutto B 1, B 2, B 6), acido folico e microelementi come zinco, rame, ferro, magnesio, manganese, ecc. è importante.
3. Ridotto assorbimento di calcio e fosfati nell'intestino, aumento dell'escrezione nelle urine o ridotto utilizzo nelle ossa, causato dall'immaturità dei sistemi di trasporto in tenera età o da malattie dell'intestino, del fegato e dei reni. Nei bambini con basso peso alla nascita, lo sviluppo del rachitismo è associato a carenza di fosfato in un contesto di maggiore crescita e di quantità insufficienti di questo ione nel cibo, e il successo della cura del rachitismo è stato assicurato dall'aumento dei fosfati negli alimenti e dall'aumento della loro
sangue. Con la sindrome da malassorbimento si sviluppano ipocalcemia, iperparatiroidismo secondario, basso riassorbimento tubulare di fosfato e successiva ipofosfatemia.
4. Ridotti livelli di calcio e fosfati nel sangue e alterata mineralizzazione ossea con alcalosi prolungata, squilibrio di zinco, magnesio, stronzio, alluminio, per vari motivi.
5. Violazione del rapporto fisiologico degli ormoni osteotropici - ormone paratiroideo e tireocalcitonina, associata a una diminuzione della produzione di ormone paratiroideo (di solito ipoparatiroidismo ereditario).
6. Carenza esotica o endogena di vitamina D, nonché un livello inferiore del metabolita della vitamina D, come modulatore del metabolismo del fosfato e del calcio, nei mesi primaverili dell'anno. La vitamina D entra nel corpo del bambino sotto forma di due composti: ergocalciferolo (vitamina D 2) dal cibo e colecalciferolo (vitamina D 3), formato nella pelle sotto l'influenza dei raggi ultravioletti. È noto che i bambini che sono raramente all'aria aperta non sono sufficientemente forniti di vitamina D. La forma principale di vitamina D che circola nel sangue è il suo prodotto metabolico intermedio - 25-idrossicolecalciferolo (25-OH D 3), che si forma nel fegato. Quindi questo metabolita nei tubuli prossimali dei reni sotto l'azione delle idrossilasi viene trasformato in prodotti finali, i principali dei quali sono 1,25 e 24,25-diossicolecalciferolo. Entrambi i metaboliti - 1,25-(OH) 2 D 3 e 24,25-(OH) 2 D 3 attivano i processi di differenziazione e proliferazione dei condrociti e degli osteoblasti, nonché la produzione di osteocalcina, il principale osso non collagenico proteina. Viene sintetizzato dagli osteoblasti ed è considerato un indicatore sensibile della formazione ossea. È l'1,25-(OH) 2 D 3, insieme all'ormone paratiroideo e alla tireocalcitonina, che assicurano l'omeostasi del fosforo-calcio, i processi di mineralizzazione e la crescita ossea. Ed è ovvio che non sono tanto i deficit esogeni quanto le disfunzioni congenite e acquisite dell'intestino (assorbimento), del fegato e dei reni (metabolismo) a dare un contributo significativo allo sviluppo dell'ipovitaminosi D endogena. Nel primo periodo postnatale, i bambini presentano immaturità dei sistemi enzimatici che metabolizzano la vitamina D e l'attuazione degli effetti tissutali dei suoi metaboliti. Il 24,25-(OH)2D3 è solitamente attivo in condizioni di normocalcemia, garantendo una normale osteogenesi e la disintossicazione della vitamina in eccesso.
Il ruolo dei metaboliti della vitamina D non si limita alla regolazione dei livelli di calcio nel corpo, poiché i loro recettori lo rilevano
mogli non solo nell'intestino tenue e nelle ossa, ma anche nei reni, nel pancreas, nei muscoli scheletrici, nella muscolatura liscia vascolare, nelle cellule del midollo osseo, nonché nei linfociti, monociti, macrofagi. La funzione immunoregolatrice della vitamina D è nota.
La possibilità di sviluppare ipovitaminosi D esogena è improbabile, poiché il fabbisogno umano di questa vitamina (sia adulti che bambini) è di sole 200 UI al giorno. Allo stesso tempo, il suo sviluppo è possibile in assenza di insolazione (disabili, famiglie asociali), malattie renali croniche, quando si utilizzano anticonvulsivanti, insensibilità dei recettori degli organi bersaglio ai metaboliti della vitamina D. La disfunzione epatocellulare può portare ad una diminuzione del contenuto di 25-(OH) D 3, e anche alterato assorbimento della vitamina D in varie malattie intestinali congenite o acquisite.
Quando si determina il livello di 25-(OH)D, la sua diminuzione è al di sotto del livello critico (<10 нг/мл) обнаружено только у 7,5% обследованных детей как с клиническими проявлениями рахита, так и без них. Клиническую картину так называемого классического рахита нельзя однозначно считать проявлением экзогенного гиповитаминоза D. Рахит и гиповитаминоз D - неоднозначные понятия, а развитие костных признаков рахита у детей раннего возраста обусловлено быстрыми темпами роста, высокой скоростью моделирования скелета и дефицитом в растущем организме фосфатов и кальция при несовершенстве путей их транспорта, метаболизма и утилизации (гетерохрония созревания). Поэтому неслучайно в настоящее время рахит нередко относят к пограничным состояниям у детей раннего возраста.
Un problema altrettanto importante in pediatria è lo sviluppo dell'osteopenia. I segni di osteopenia sono più comuni nei neonati prematuri e nei bambini nati da donne con preeclampsia. La frequenza dei segni clinici e radiologici di osteopenia, confermata dall'ecografia ossea, ha raggiunto il 33%. La causa dell'osteopenia è stata una diminuzione del calcio e del fosforo nel latte materno, quando il loro contenuto nella maggior parte delle donne era 2-2,5 volte inferiore al livello ottimale, nonché una diminuzione dei livelli proteici nel latte materno.
7. Ridotto carico motorio e di sostegno e disturbi secondari del metabolismo del calcio in relazione a ciò, insolazione naturale limitata in pazienti neurologici con lussazione congenita dell'anca, bambini internati.
Nell'adolescenza, quando la crescita accelera nuovamente, può verificarsi una carenza di componenti minerali, principalmente calcio, e può svilupparsi il rachitismo. Questa condizione si manifesta con spasmo carpopedale, dolore alle gambe, debolezza e deformità degli arti inferiori. Nel 30% degli adolescenti, nelle zone metafisarie vengono rilevati cambiamenti radiografici caratteristici del rachitismo. Molto spesso, questi casi si verificano nei paesi africani, dove la carenza di calcio negli alimenti è la causa principale del rachitismo. Nelle persone provenienti dalle regioni meridionali che vivono nei paesi europei, i disturbi nutrizionali sono accompagnati da una carenza di vitamina D.
Segni clinici e paraclinici
Attualmente è accettato che per la diagnosi del rachitismo di grado I sia obbligatoria la presenza di alterazioni ossee: flessibilità e dolore alla palpazione delle ossa del cranio, “craniotabe”, ispessimento delle costole alla giunzione della cartilagine con l'osso - “perline del rosario”. ”. L'identificazione dei soli sintomi di ridotta attività autonomica (sudorazione, ansia, irritabilità) non è la base per una diagnosi, come era precedentemente accettato. La conferma di laboratorio del rachitismo di grado I è una lieve ipofosfatemia e un aumento dell'attività della fosfatasi alcalina nel sangue.
Il II grado (moderato) di rachitismo è caratterizzato da cambiamenti pronunciati nelle ossa: tuberosità frontali e parietali, “perline del rosario”, deformità del torace, deformità moderata, spesso vara degli arti inferiori. L'esame radiografico mostra l'espansione delle metafisi delle ossa tubolari e la loro deformazione a forma di coppa. Un esame del sangue biochimico rivela una diminuzione di fosfato e calcio, un aumento dell'attività della fosfatasi alcalina nel sangue.
Il III grado (grave) del rachitismo è caratterizzato da grossolane deformazioni del cranio, del torace e degli arti inferiori, sviluppo ritardato delle funzioni statiche. L'esame radiografico rivela una grossolana ristrutturazione della struttura e rarefazione delle ossa, espansione e offuscamento delle metafisi e possibili fratture senza spostamento (a forma di “bastone verde”). Nel sangue si determina una marcata diminuzione del livello di fosfati e calcio. Oltre ai cambiamenti ossei, i pazienti presentano tachicardia, mancanza di respiro e ingrossamento del fegato.
I primi segni di rachitismo vengono spesso rilevati nei primi mesi di vita - segni di osteomalacia sotto forma di leggera flessibilità
i bordi della grande fontanella e le suture del cranio (“craniotabe”). Entro la fine della prima metà dell'anno (il periodo dell'altezza), questi processi si intensificano e compaiono segni di iperplasia osteoide: deformazioni del cranio (tubercoli frontali e parietali), del torace ("rosario" e "solco di Harrison"), dei muscoli si determina ipotonia. Quando i bambini iniziano ad alzarsi in piedi, si sviluppano rapidamente deformità in varismo degli arti inferiori. Durante questo periodo, i segni radiologici sono più pronunciati: allargamento e irregolarità della fessura metafisaria, deformazione a forma di calice delle parti epimetafisarie delle ossa ("braccialetti"), nuclei di ossificazione offuscati, osteoporosi e uno schema trabecolare ruvido delle parti diafisarie sono determinato. I segni clinici e radiologici più pronunciati del rachitismo si sviluppano principalmente con l'ipofosfatemia, meno spesso con l'ipocalcemia. Un esame del sangue rivela grave ipofosfatemia, lieve ipocalcemia e un aumento significativo dell'attività della fosfatasi alcalina. Durante il periodo di convalescenza (3-4 settimane dall'inizio del trattamento) scompaiono i segni dell'osteomalacia, appare una chiara linea di calcificazione nella zona metafisaria, i livelli dei fosfati si normalizzano, persistono solo lievi ipocalcemia e un moderato aumento dell'attività della fosfatasi alcalina.
Il decorso del rachitismo nei bambini può essere acuto o subacuto. Nel decorso acuto, il quadro clinico è dominato dai segni di osteomalacia nei bambini nei primi sei mesi di vita, successivamente si sviluppa spesso un decorso subacuto con la manifestazione di sintomi di iperplasia osteoide.
A seconda della causa dello sviluppo del processo rachitico, si distinguono 3 forme della malattia: carenza di calcio, carenza di fosfato e rachitismo da carenza di vitamina D. Le cause della carenza di calcio e lo sviluppo di uno stato di carenza di calcio sono la mancanza di calcio negli alimenti, in particolare con l'alimentazione a lungo termine dei bambini con latte materno e un ridotto assorbimento del calcio dovuto alla sindrome da malassorbimento. Il vegetarismo contribuisce alla carenza di calcio. All'inizio dello sviluppo del rachitismo da carenza di calcio, il livello di calcio nel siero diminuisce, poi, dopo la risposta dell'ormone paratiroideo, il livello di calcio si normalizza e il livello di fosfati diminuisce a causa della loro maggiore escrezione nelle urine (diversi biochimici fasi dello stesso processo). Il livello della fosfatasi alcalina è aumentato, il contenuto di 25(OH)2 D è normale. Con grave ipocalcemia, possono verificarsi spasmi muscolari contemporaneamente a manifestazioni ossee,
diminuzione della sensibilità, parestesia, tetania, iperreflessia, laringospasmo, intervallo β-7 esteso sull'ECG.
Rachitismo da carenza di fosfato si sviluppa a causa di un apporto insufficiente di fosfati, spesso come principale causa di osteopenia nei neonati prematuri, con un aumento del fabbisogno di fosfati durante la rapida crescita e un ridotto assorbimento a livello intestinale. Il rachitismo associato a carenza di fosfati è possibile in caso di insufficienza tubulare renale dovuta all'immaturità dei tubuli renali e all'aumentata perdita di fosfati nelle urine o al ridotto riassorbimento dei fosfati in caso di iperparatiroidismo sullo sfondo dell'ipocalcemia, che viene rapidamente compensato dalla lisciviazione dei fosfati. calcio dalle ossa. L'ipofosfatemia si sviluppa con acidosi metabolica, insufficienza renale acuta, osteomalacia oncogenica, uso a lungo termine di glucocorticoidi, ecc. Attualmente, i disturbi del metabolismo del fosfato sono in gran parte associati a cambiamenti nel fattore di crescita dei fibroblasti 23 (FGF23), nella fosfoglicoproteina della matrice extracellulare e in altri metaboliti conosciuti come fosfatonine.
Il segno più caratteristico del rachitismo da carenza di fosfati è una diminuzione del livello di fosfati nel sangue, un livello normale di calcio, un aumento dell'attività della fosfatasi alcalina e un livello invariato dei metaboliti della vitamina D. È la carenza di fosfati , non calcio o vitamina D, che sono correlati al grado di alterazioni dell'osso rachitico e al grado dei segni radiologici del rachitismo.
Carenza esogena o endogena di vitamina D, in quanto modulatore del metabolismo dei fosfati e del calcio, provoca anche il rachitismo, ma ciò è possibile solo nei bambini con insufficiente esposizione solare (famiglie asociali, bambini internati, ecc.), nonché in caso di disturbi del metabolismo della vitamina D. Una dose profilattica di vitamina D è di 400 UI al giorno.
Diagnostica
La diagnosi del rachitismo si basa sull'identificazione delle manifestazioni caratteristiche del sistema scheletrico. La gravità e la durata del rachitismo possono essere determinate mediante determinazione biochimica dell'attività di calcio, fosfato e fosfatasi alcalina nel sangue, nonché mediante esame a raggi X delle ossa dell'avambraccio. Il livello di 25(OH^) nel sangue è l'unico indicatore affidabile della salute del bambino
il corpo con la vitamina D. Normalmente, la concentrazione di questo metabolita nei bambini sani è compresa tra 15 e 40 ng/ml, aumentando in estate, a causa dell'insolazione, fino a 25-40 ng/ml, e diminuendo in inverno e all'inizio della primavera fino a 15-25 ng. /ml. Una diminuzione di questo metabolita a 10 ng/ml indica un apporto marginale di vitamina D all'organismo, mentre un livello pari o inferiore a 5 ng/ml corrisponde a uno stato di vitamina D.
Diagnosi differenziale
Nella pratica pediatrica esistono malattie che replicano fenotipicamente forme gravi di rachitismo. Queste includono forme resistenti alla vitamina D - rachitismo vitamina D-dipendente di tipo I e II, rachitismo vitamina D resistente (fosfato - diabete), malattia di Fanconi - Debre de Toni, acidosi tubulare renale. Per la diagnosi differenziale con le forme di rachitismo resistenti alla vitamina D, è necessario determinare la creatinina nel sangue e nelle urine (per calcolare il riassorbimento tubulare dei fosfati), nonché le funzioni parziali dei tubuli prossimali e distali. In alcuni casi, è necessaria la differenziazione con idrocefalo, ipotiroidismo, sindrome da malassorbimento e alterazioni secondarie del sistema scheletrico quando si utilizzano anticonvulsivanti, glucocorticoidi ed eparina.
Trattamento
L'obiettivo delle misure terapeutiche contro il rachitismo è l'effetto della vitamina D sugli organi bersaglio per ottimizzare il metabolismo del fosfato-calcio.
Trattamento non farmacologico
L'efficacia del trattamento con vitamina D è aumentata da una dieta equilibrata, dall'esposizione all'aria, dai massaggi, dalla ginnastica e dai bagni igienici.
Trattamento medico
I preparati di vitamina D devono essere prescritti tenendo conto delle manifestazioni cliniche, della gravità e della dinamica della malattia: per il rachitismo di grado I - 1000-1500 UI per 30 giorni, per il rachitismo di grado II - 2000-2500 UI per 30 giorni, per il rachitismo di stadio III - 3000 -4000 UI per 45 giorni. Una volta raggiunto il risultato si passa a dosi preventive di vitamina D durante i due anni di vita e in inverno al 3° anno di vita.
Per la prevenzione e il trattamento del rachitismo, è consigliabile utilizzare una soluzione acquosa di vitamina D 3 - 500 UI in 1 goccia, vigantol - 660 UI in 1 goccia e soluzioni oleose domestiche di vitamina D 2 - 1400-1600 UI in 1 goccia.
Previsione
Con il rachitismo lieve, la prognosi è favorevole. Nelle forme moderate e particolarmente gravi permangono deformazioni evidenti del cranio, del torace e degli arti inferiori e sono possibili la formazione di una pelvi rachitica e un ritardo della crescita.
Esame clinico
I bambini che hanno sofferto di rachitismo di II e III grado sono soggetti a visita medica. Vengono esaminati trimestralmente per 3 anni. Durante il secondo anno di vita la prevenzione secondaria viene effettuata nel periodo autunno-invernale, e nel 3° anno di vita solo nel periodo invernale. In questo momento, i bambini affetti da rachitismo possono ricevere una vaccinazione preventiva.
Ipervitaminosi D
La prevenzione del rachitismo effettuata in precedenza con alte dosi di vitamina D, in particolare il metodo “vitamin push”, ha dato origine a una malattia più pericolosa del rachitismo stesso. La soglia di tossicità per la vitamina D presenta ampie variazioni individuali. Con l'ipervitaminosi, D 1,25 (OH) 2 D 3 attiva la funzione degli osteoblasti, che provoca ipercalcemia, aggravata da un aumento dell'assorbimento del calcio nell'intestino, dal suo riassorbimento nei reni e dall'osteoporosi. Un eccesso di 1,25(OH) 2 D 3 porta a danni alle membrane cellulari e subcellulari. Quando i lisosomi vengono distrutti, gli enzimi idrolasi vengono rilasciati ed entrano nelle cellule, l'attività di organi e sistemi, inclusi fegato e reni, viene interrotta, il che compromette le loro funzioni metaboliche ed escretorie e l'equilibrio acido-base viene interrotto. L'ipercalcemia porta alla calcificazione di organi e tessuti, danni ai grandi vasi e alle valvole cardiache.
Il quadro clinico dell'ipervitaminosi D nei bambini del primo anno di vita comprende rigurgito, vomito, perdita di appetito, insufficiente aumento o perdita di peso, poliuria, polidipsia e disidratazione. I bambini più grandi sono caratterizzati da mal di testa, debolezza, dolori articolari, aumento della pressione sanguigna e, meno comunemente, disturbi del ritmo cardiaco e convulsioni.
Complicazioni dell'ipervitaminosi D - pielonefrite dismetabolica, nefrolitiasi, nefrocalcinosi, angiocalcinosi.
Un sovradosaggio di vitamina D durante la gravidanza porta, a seconda della durata della lesione, ad aborti spontanei, induzione di ipercalcemia fetale e si esprime in ritardo della crescita intrauterina come displasia o malnutrizione. La stenosi della valvola aortica, la fibroelastosi metabolica e la displasia dei germi dentali sono specifiche dell'embriofetopatia ipercalcemica.
Criteri di laboratorio per l'ipervitaminosi D:
. aumento dei fosfati e del calcio nel sangue e nelle urine. Il segno più attendibile è l'ipercalciuria - più di 3 mg/kg di peso corporeo;
. aumento compensatorio della calcitonina;
. diminuzione dell'ormone paratiroideo;
. aumento di 25OND superiore a 70 ng/ml.
Il trattamento dell'ipervitaminosi D comprende la sospensione della vitamina D, le radiazioni ultraviolette e l'insolazione. Vengono prescritte vitamine A, E, xidifon, terapia infusionale in modalità iperfusione in combinazione con diuretici (furosemide). Nei casi più gravi è indicata la somministrazione di preparati di fenobarbital e calcitonina (miocalcico, sibacalcina) sotto il controllo dei livelli di calcio nel sangue e nelle urine. La terapia per l'ipervitaminosi D deve essere effettuata in ospedale, preferibilmente nei reparti di nefrologia.
MALATTIE EREDITARIE SIMILI AL rachitismo
Definizione
Le malattie ereditarie simili al rachitismo (tubulopatie), o osteopatie geneticamente determinate, sono un gruppo di malattie geneticamente determinate che portano ad un alterato metabolismo del calcio e del fosforo con conseguente deformazione delle ossa scheletriche. Questo gruppo di malattie comprende:
. rachitismo ipofosfatemico ereditario resistente alla vitamina D (HFRR);
. acidosi tubulare renale (RTA);
. Malattia di Fanconi-Debreu-de-Toni (PDT);
. rachitismo vitamina D-dipendente (VDR); Si trovano i due tipi più comuni di WDRR.
Tipo I: ipofosfatemia legata all'X. Questa variante classica del diabete da fosfato è caratterizzata da una forte diminuzione del riassorbimento del fosfato nei tubuli prossimali dei reni. La clinica si manifesta nei primi anni di vita e si manifesta con ritardo della crescita, gravi deformità in varo degli arti inferiori, nonché alterazioni radiografiche delle ossa scheletriche, ipofosfatemia con iperfosfaturia con normali livelli di calcio nel sangue.
Il tipo II è una forma di rachitismo ipofosfatemico, non legato al cromosoma X, ereditato con modalità autosomica dominante o autosomica recessiva. L'esordio della malattia avviene all'età di 1-2 anni senza ritardo della crescita, ma con deformazione scheletrica e osteomalacia radiologica. I criteri biochimici sono gli stessi.
La malattia PDT, associata ad un alterato trasporto dei metaboliti nei tubuli prossimali, è ereditata con modalità autosomica recessiva. Caratteristico è un ritardo nello sviluppo fisico già nel primo anno di vita, dolore alle ossa sullo sfondo di cambiamenti rachitici nello scheletro; i marcatori biochimici sono iperaminoaciduria, iperfosfaturia, kaliuria, glicosuria sullo sfondo della poliuria e acidosi metabolica. In pratica, è più comune una forma incompleta sotto forma di diabete aminofosfato, che richiede un'attenta diagnosi differenziale con il rachitismo nei bambini piccoli.
La PTA è una sindrome clinica caratterizzata da acidosi metabolica persistente, bassi livelli di bicarbonato e aumento delle concentrazioni di cloruro sierico. Esistono 2 tipi principali di PTA più comunemente diagnosticati.
Tipo I - causato da un difetto nella funzione acidogenetica dei tubuli distali. Ereditarietà autosomica recessiva. È caratterizzata da ritardo della crescita, osteoporosi e alterazioni rachitiche nelle zone epi- e metafisarie, crisi di poliuria e disidratazione, ipercalciuria, nefrocalcinosi con concomitante nefrite interstiziale. Un segno obbligatorio è l'urina alcalina, l'ipoisostenuria e la carenza di basi nel sangue.
Il tipo II, o tipo prossimale di PTA, è associato all'incapacità dei tubuli prossimali di riassorbire i bicarbonati mentre viene preservata la funzione acidogenetica dei tubuli distali. La malattia si manifesta con vomito periodico, aumenti della temperatura di origine sconosciuta, ritardo nello sviluppo fisico, alterazioni scheletriche rachitiche appaiono precoci ed è possibile lo sviluppo di nefrocalcinosi.
Il VRD (rachitismo vitamina D-dipendente) si sviluppa con un disturbo ereditario nella formazione di 1,25(OH)2D nei tubuli renali. I segni principali compaiono nei primi mesi di vita sotto forma di deformazioni scheletriche rachitiche, grave ipotonia muscolare sullo sfondo dell'ipocalcemia e livelli ridotti, meno spesso normali, di fosfato nel sangue e aumento dell'attività della fosfatasi alcalina; nelle urine si riscontrano iperfosfaturia e iperaminoaciduria. Ereditarietà autosomica recessiva.
Il tipo di deformità degli arti inferiori può aiutare nella diagnosi differenziale. Pertanto, la deformità in varo è più spesso caratteristica della VDR ed è possibile con la PDT. Valgo e deformità di tipo misto possono verificarsi con acidosi tubulare renale (RTA) e PDT di tipo distale. Questa divisione dei pazienti in due gruppi consente di restringere il numero delle possibili forme di rachitismo per questo tipo di deformità e quindi facilita l'identificazione dei segni caratteristici già in sede ambulatoriale.
Diagnosi differenziale
La diagnosi differenziale delle malattie simili al rachitismo è presentata nella tabella.
Trattamento
Trattamento non farmacologico
Per tutte le malattie simili al rachitismo, il trattamento non farmacologico è di grande importanza: una dieta equilibrata in calcio, fosforo, magnesio, sali proteici, terapia fisica, massaggi, cure ortopediche per l'osteoporosi.
Trattamento medico
A WDRR L'uso combinato di preparati di vitamina D (da 30.000 a 50.000 UI al giorno) e una soluzione di fosfati inorganici (sotto forma di fosfato di sodio mono e disostituito) ha un effetto positivo sul metabolismo dei fosfati. La durata del trattamento è determinata dalla gravità, dalla durata della malattia e dal livello di fosfati nel sangue. L'uso continuativo di questa combinazione di farmaci per 2-5 anni consente di mantenere il livello di fosfato nel sangue a un livello costante entro 1-1,5 mmol/l, sufficiente a reprimere gradualmente le manifestazioni attive della malattia e prevenire la progressione della malattia. deformità.
Tavolo.Diagnosi differenziale delle malattie simili al rachitismo nei bambini (Krasnovskaya M.A., Pirogova Z.I., 1998)
segni | Rachitismo vitamina D-dipendente | Acidosi tubulare renale |
||
Tipo di eredità | Autosomico recessivo | Dominante, legata all'X Autosomica recessiva, autosomica recessiva (frequenza 1:12.000) | Autosomico recessivo, autosomico recessivo Difetto genetico sconosciuto | Tipi autosomici recessivi 1 e 2. Con glaucoma e osteoporosi e forma familiare autosomica dominante |
Tempi di manifestazione | 5-6 mesi | 1 g 3 mesi - 1 g 6 mesi | 2-3 anni | 5-6 mesi o 2-3 g |
Eziopatogenesi | IOtipo. Assenza o diminuzione dell'attività dell'1,25 deiidrossicolecciferolo dovuta all'assenza dell'enzima 1-idrossilasi renale IItipo. A causa dell'insensibilità dei recettori degli organi bersaglio all'1,25 deidrossicolecalciferolo, la sintesi di questo metabolita non è compromessa | Difetto nel riassorbimento del fosfato nei tubuli renali, dovuto ad un difetto biochimico nella conversione in 25-idrossi-calciferolo nel fegato o ad una violazione della struttura delle proteine coinvolte nel trasporto del fosforo nei tubuli renali | Il trasporto tubulare di aminoacidi, fosfati inorganici e glucosio viene interrotto. Ridotto riassorbimento tubulare di sodio, potassio e acqua, dovuto alla displasia del nefrone | Non installato. La formazione dei sistemi enzimatici che filtrano e riassorbono i bicarbonati è compromessa, lo sviluppo del nefrone è ritardato, displasia dei tessuti |
segni | Rachitismo vitamina D-dipendente | Rachitismo ipofosfatemico D resistente familiare - diabete fosfato | Malattia di De Toni Debre-Fanconi (diabete glucosio-fosfatemico) | Acidosi tubulare renale |
Primi segni clinici | Cambiamenti nel sistema nervoso centrale e nel sistema nervoso autonomo: irritazione, disturbi del sonno, pianto | Deformità vare degli arti inferiori, braccialetti rachitici, andatura “a papera”. | Aumenti irragionevoli di temperatura, polidipsia, poliuria | Cambiamenti nel sistema nervoso centrale: disturbi del sonno, ansia, irritabilità. Poliuria, polidipsia, ipotonia muscolare |
Segni specifici | Alterazioni scheletriche: craniotabe, tuberosità frontali e parietali, rosario, varo degli arti inferiori e del terzo inferiore delle gambe, osteoporosi | Natura progressiva delle deformità in varo degli arti inferiori | Aumenti periodici della temperatura, deformità progressive in varo o valgo, deformità ossee, aumento della funzionalità epatica, stitichezza | Poliuria, polidipsia, ingrossamento del fegato, stitichezza, alluce valgo |
Fisico e mentale sviluppo | Ritardo nel peso e nell'altezza, qualche ritardo nello sviluppo motorio | Carenza di altezza da 2 a 4 mm con peso normale, sviluppo mentale normale | Combinazione di bassa statura e nutrizione gravemente ridotta | Combinazione di bassa statura e sottopeso, sviluppo mentale normale |
segni | Rachitismo vitamina D-dipendente | Rachitismo ipofosfatemico D resistente familiare - diabete fosfato | Malattia di De Toni Debre-Fanconi (diabete glucosio-fosfatemico) | Acidosi tubulare renale |
Caratteristiche del sistema scheletrico e dati radiografici | Deformità ossee soprattutto degli arti inferiori, osteoporosi sistemica, soprattutto delle metafisi, assottigliamento dello strato corticale | Deformità vare degli arti inferiori, grossolane deformazioni delle metafisi, curvatura delle ossa tubolari | Osteoporosi grave, striature trabecolari delle parti distali e prossimali della diafisi | Deformità in valgo degli arti inferiori, osteoporosi sistemica, offuscamento, contorni poco chiari, atrofia ossea concentrica |
Chimica del sangue |
||||
Concentrazione di fosforo | Ridotto | Significativamente ridotto | Ridotto | Ridotto |
Concentrazione di calcio | Ridotto | Norma | Ridotto | Norma |
Attività della fosfatasi alcalina | Promossa | Promossa | Promossa | Promossa |
CBS | Compensato | Compensato metabolico acidosi | Acidosi metabolica | Grave acidosi |
Analisi biochimica delle urine |
||||
Concentrazione di fosforo | Promossa | Promossa | Aumentato o normale | Aumentato o normale |
segni | Rachitismo vitamina D-dipendente | Rachitismo ipofosfatemico D resistente familiare - diabete fosfato | Malattia di De Toni Debre-Fanconi (diabete glucosio-fosfatemico) | Acidosi tubulare renale |
Concentrazione di calcio | Normale o aumentato | Norma | Promossa | Promossa |
Cambiamenti nel sistema urinario | Normale, aminoaciduria, spesso proteinuria, leucocituria | Aminoaciduria normale, relativa | Diminuzione della funzione renale ammonioacidogenetica, glicosuria | Diminuzione della funzionalità renale acidogenetica, pielonefrite secondaria, nefrocalcinosi |
Cambiamenti nel sistema cardiovascolare | Norma | Norma | La pressione sanguigna si riduce, i cambiamenti nel miocardio vengono rilevati sull'ECG | La pressione sanguigna si riduce, i cambiamenti nel miocardio vengono rilevati sull'ECG. |
Quando si tratta la malattia con PDT, è necessario correggere non solo i parametri del metabolismo del fosfato, ma anche normalizzare lo stato acido-base e il livello di potassio. La vitamina D viene prescritta (20.000-30.000 UI al giorno) in combinazione con una soluzione di fosfato, una miscela di citrato e preparati di potassio. La durata dei cicli di tale trattamento e le pause tra di essi sono determinate dal benessere dei pazienti, nonché dai dati biochimici e radiologici.
Nel tipo distale di PTA, la base del trattamento è la lotta all'acidosi. Per questo è consigliabile utilizzare una miscela di citrato della seguente composizione: acido citrico - 140 g, citrato di sodio - 98 g, acqua distillata fino a 1 litro. La miscela viene prescritta 30-45 ml al giorno in 3 dosi frazionate. Per correggere i disturbi del metabolismo del fosforo-calcio, la vitamina D viene utilizzata in una dose di 10.000-20.000 UI al giorno. Allo stesso tempo, i bambini dovrebbero ricevere alimenti contenenti potassio o suoi preparati. La durata del trattamento dipende dai tempi di normalizzazione dello stato acido-base e dagli indicatori del metabolismo del fosforo-potassio.
Negli ultimi anni, l'1-alfa-ossicolecalciferolo, prodotto con il nome di oxidvit, è stato utilizzato con successo nel trattamento dell'ADRD. La dose di oxydevit viene scelta individualmente, variando da 0,25 a 1 mcg al giorno per un periodo da 2 a 6 settimane. Durante il trattamento è obbligatorio monitorare il livello di calcio nel sangue e nelle urine.
La correzione chirurgica delle deformità degli arti inferiori deve essere eseguita solo dopo un esame approfondito dei pazienti e solo dopo la normalizzazione dei disturbi elettrolitici e dello stato acido-base. L’intervento chirurgico non deve essere eseguito prima dei 9-10 anni di età a causa del rischio di recidiva delle deformità. A causa della possibilità di ipercalcemia nei pazienti immobilizzati, i preparati a base di vitamina D e fosfato devono essere temporaneamente sospesi nel periodo pre e postoperatorio. Dovrebbero essere prescritti sotto controllo dei livelli di fosfato e calcio nel sangue dopo che i pazienti iniziano a camminare. Il trattamento chirurgico efficace delle deformità degli arti inferiori è possibile solo con il contatto obbligatorio tra un pediatra e un ortopedico.
capitolo 2
Disturbi alimentari cronici DISTROFIA
Definizione
La distrofia è un disturbo cronico della nutrizione e del trofismo dei tessuti dei principali sistemi del corpo, che interrompe lo sviluppo armonioso del bambino.
*Codice ICD-X.
Classificazione
Esistono tre tipi di distrofia.
. Ipotrofia: carenza di peso corporeo in rapporto all'altezza. Man mano che il processo patologico progredisce, si verifica un ritardo della crescita.
. Ipostatura: un ritardo uniforme in peso e altezza rispetto alle norme di età.
Paratrofia:
Con peso corporeo e altezza uniformemente in eccesso rispetto alle norme di età;
Con una predominanza del peso corporeo sull'altezza.
La forma clinica più comune di distrofia è l'ipotrofia. Esistono forme di malnutrizione congenita (prenatale), acquisita (postnatale) e mista. Secondo la classificazione ICD-X, il termine “malnutrizione prenatale” è stato sostituito da “ritardo della crescita intrauterina” (vedi paragrafo “Neonatologia”).
Oltre alle distrofie causate esogenamente, esiste un gruppo di ipotrofie endogene. Alcuni di essi accompagnano malformazioni congenite di organi e apparati, endocrinopatie o neuropatie congenite e non causano difficoltà nella diagnosi. Altri tipi di malnutrizione derivanti dal malassorbimento primario sono più difficili da riconoscere.
Eziologia
Il ritardo della crescita intrauterina è spesso causato da malattie materne o associato a ipossia intrauterina, infezioni fetali, mutazioni genomiche e cromosomiche.
La causa della malnutrizione acquisita è considerata essere fattori esogeni ed endogeni.
. Fattori esogeni:
Sottoalimentazione quantitativa e qualitativa;
Malattie infettive e somatiche [infezioni virali respiratorie acute (ARVI), malattie gastrointestinali, pielonefrite, sepsi e altre malattie causate da sottoalimentazione e diminuzione dell'appetito].
. Fattori endogeni:
Danno prenatale e neonatale al sistema nervoso centrale;
Patologie endocrine e neuroendocrine (ipotiroidismo, sindrome adronogenitale, nanismo ipofisario);
Malformazioni congenite di vari sistemi corporei (sistema nervoso centrale, malattie cardiache congenite, sistema respiratorio, digestivo e altri);
Enzimopatie ereditarie o congenite (deficit di disaccaridasi, celiachia, fibrosi cistica, enteropatia essudativa);
Condizioni di immunodeficienza primaria;
Disordini metabolici ereditari (galattosemia, omocistinuria, PKU e altre malattie).
La comparsa di ipostatura può essere causata da malattie infettive con decorso prolungato e ricorrente, nonché da violazioni della routine quotidiana del bambino. Lo sviluppo dell'ipostatura è un processo più lungo rispetto allo sviluppo della malnutrizione, pertanto l'ipostatura viene rilevata più spesso nei bambini di età superiore ai sei mesi.
La causa della paratrofia è la sovralimentazione o la cattiva alimentazione con eccesso di carboidrati o proteine. In alcuni casi, una cattiva alimentazione di una donna incinta con un eccesso di carboidrati e una carenza di proteine, vitamine e minerali prepara il terreno per lo sviluppo della paratrofia nel bambino.
Patogenesi
La base della malnutrizione è la mancanza di nutrienti, che causa una diminuzione della produzione di energia. Una carenza crescente porta ad una diminuzione del metabolismo basale; per ripristinarlo è necessario un maggiore consumo delle riserve di glicogeno. Clinicamente, ciò si esprime nel progressivo emaciamento del bambino. Successivamente, c'è uno spreco di materiale plastico - proteine, e si verifica una carenza proteico-energetica del corpo - rallentamento
crescita e maturazione di tutti gli organi e sistemi, compreso il sistema nervoso centrale e il sistema nervoso autonomo. La produzione di enzimi e la loro attività diminuiscono, di conseguenza il sistema digestivo ne soffre maggiormente. Si notano disturbi della cavità e della digestione delle membrane. Clinicamente, ciò si manifesta con l'alternanza di diarrea e stitichezza. La disintossicazione e la funzione sintetica del fegato sono significativamente influenzate (sono possibili ipoproteinemia, ipoalbuminemia, iperaminoaciduria, ipolipidemia, ipofosfolipidemia, ipercolesterolemia e altri sintomi). Se il metabolismo dei carboidrati è disturbato, si notano ipoglicemia, curve glicemiche piatte, disturbi nell'equilibrio vitaminico, metabolismo dell'acqua e dei minerali. La violazione di tutti i tipi di metabolismo porta all'accumulo di prodotti sottoossidati nel corpo, allo sviluppo di acidosi metabolica e tossicosi endogena. L'immunità cellulare e umorale soffre, il che porta alla comparsa di condizioni settiche e tossico-settiche.
Quadro clinico
L'ipostatura è caratterizzata da un ritardo in peso e altezza. Quando si valutano i dati antropometrici, la crescita di un bambino è in ritardo rispetto agli standard di età, ma il peso corporeo rispetto all’altezza effettiva è vicino alla norma. Questo fenomeno è causato da una carenza nutrizionale a lungo termine, che talvolta inizia nel periodo prenatale e continua nel periodo postnatale.
Nell'ipostatura, come nella malnutrizione, il quadro clinico è caratterizzato da segni di malnutrizione con disfunzione di organi e sistemi. L'ipostatura dovrebbe essere distinta dall'ipoplasia associata a caratteristiche costituzionali (ereditarie). Nei bambini con ipoplasia non ci sono segni generali di disturbi trofici.
Le manifestazioni cliniche della paratrofia sono causate da una dieta squilibrata con eccesso di carboidrati e carenza di proteine. Il peso e la lunghezza del corpo soddisfano o superano gli standard di età. La pelle è pallida, pastosa. Il grasso sottocutaneo è distribuito in modo non uniforme, prevalendo sulle cosce e sull'addome. Le feci sono abbondanti e schiumose.
Tavolo.Quadro clinico della malnutrizione (Stroganova L.A., Aleksandrova N.I., 1996)
IO grado | II grado | III grado |
|
Pelle | Pallido. Diminuzione dell'elasticità | Pallido, asciutto, rugoso facilmente. | Grigio, secco, rugoso |
Assottigliamento dello strato di grasso sottocutaneo | Moderatamente espresso sull'addome | Pronunciato sull'addome, sugli arti | Completa scomparsa del grasso corporeo |
Turgore dei tessuti | Moderatamente ridotto | Significativamente ridotto. Pieghe sciolte della pelle sugli arti e sul collo | Nettamente ridotta, la pelle pende in pieghe |
Curva del peso | Appiattito, aumento di peso corporeo ridotto | Piatto, nessun aumento di peso | Cachessia |
Altezza (lunghezza del corpo) | Età appropriata | Lo spazio è di 1-3 cm | Notevole ritardo rispetto alla norma |
Carenza di peso corporeo in relazione a: norma di età in % | 10-15% | 16-30% | Oltre i 30% |
Carenza di peso corporeo rispetto alla norma secondo le tabelle centili | Da P25 a P10 | Da Ryudo RZ | Sotto RZ |
Deficit di peso corporeo in relazione all'altezza secondo le tabelle centili | Da P25 a P10 | Da Ryudo RZ | Sotto RZ |
Indice Chulitskaya (grasso) | 15-20 | 10-0 | |
Appetito | Non alterato o leggermente ridotto | Significativamente ridotto | Bruscamente ridotto al punto di anoressia |
Rigurgito e vomito | Non tipico | Possibile | Succede spesso |
IO grado | II grado | III grado |
|
Carattere della sedia | Non cambiato | Instabile (liquefatto, non digerito, meno spesso - stitichezza) | |
Funzione secretoria ed enzimatica dello stomaco e dell'intestino | Entro limiti normali o moderatamente ridotti (2 volte) | Significativamente ridotto (3-4 volte) | Fortemente ridotto (5-10 volte rispetto alla norma) |
Disbatteriosi | Mancante o IO grado | II grado | III grado |
Belkovogo | Ipoproteinemia. Squilibrio degli aminoacidi | Cambiamenti pronunciati: ipoproteinemia. Bilancio dell'azoto negativo |
|
Grasso | Diminuzione dei livelli di lipidi totali nel sangue | Diminuzione dei livelli di fosfolipidi nel sangue | Disturbi profondi del metabolismo lipidico |
Carboidrato | Non violato | Ipoglicemia | Ipoglicemia. Disturbo della sintesi del glicogeno |
Minerale | Iponatremia e ipokaliemia marcate |
||
Vitamina | Iponatremia e ipokaliemia moderata | Grave iponatriemia e ipokaliemia | Un forte disturbo nella fosforilazione delle vitamine |
Cambiamenti nell'eccitabilità neuro-riflessi | Aumento dell'ansia, emozioni negative | Declino, depressione, letargia | Prevale l’oppressione |
IO grado | II grado | III grado |
|
Riflessi fisiologici | Non violato | Iporeflessia | Grave iporeflessia |
Stato del tono muscolare | Non violato | Ipotonia o distonia | Grave ipotensione o ipertensione |
Sviluppo psicomotorio | Età appropriata | In ritardo | Le abilità precedentemente acquisite scompaiono |
Disturbi del sonno | Non violato | Diminuzione della profondità e della durata del sonno | Tutte le fasi del sonno sono significativamente interrotte |
Termoregolazione | Non rotto | Chiaramente rotto | Notevolmente disturbato |
Immunità | Moderatamente ridotto | Significativamente ridotto | Nettamente ridotto |
Morbilità | Leggermente aumentato | Malattie frequenti con decorso prolungato e ricorrente | Malattie frequenti, a volte cancellate, decorso atipico. In alcuni casi è possibile un risultato in uno stato settico e tossico |
Trattamento
Il trattamento della malnutrizione viene effettuato in modo completo, tenendo conto dell'eziopatogenesi, di una corretta terapia dietetica, della terapia farmacologica, compresa la terapia enzimatica e vitaminica, e della correzione della biocenosi intestinale.
Trattamento non farmacologico Terapia dietetica
La prescrizione di un'alimentazione ottimale è possibile solo in caso di malnutrizione di primo grado in condizioni di tolleranza alimentare preservata. In questo caso, utilizzando il metodo volumetrico, a seconda dell'età, è necessario determinare la quantità di nutrimento mancante. Se il bambino è allattato al seno, è possibile aumentare la quantità di cibo mancante sostenendo l'allattamento al seno. In assenza di latte umano, vengono prescritte formule adattate ("NAN-1", "NAN-2") e "PreNAN" è prescritto per i neonati prematuri. L'ipotrofia di grado si riscontra in gravi malattie cardiache congenite, nei reni e in altri organi. In questi casi, dovrebbero essere presi in considerazione disturbi significativi nei processi metabolici. A questo proposito, la dietoterapia viene eseguita per fasi. Per prima cosa dovresti scoprire la tua tolleranza alimentare: in caso di malnutrizione, lo scarico viene effettuato nella fase 1. Viene calcolato il volume giornaliero del cibo e viene prescritta 1/2 o 2/3 del volume giornaliero di latte materno o una formula adattata, nel grado III - 1/3 del volume giornaliero calcolato di cibo, la quantità mancante di cibo viene reintegrato bevendo tè, viene prescritta una miscela di carotene o miscele altamente idrolizzate (“Alfare” ). Entro 3-7 giorni, aumentando gradualmente il volume, si raggiunge il fabbisogno nutrizionale giornaliero. In questo caso gli ingredienti sono calcolati per 1 kg di peso corporeo.
Trattamento medico
Con grave malnutrizione(II-III gradi) nella 1a fase del trattamento, viene effettuata la terapia infusionale per ridurre l'ipoproteinemia. Al raggiungimento dei 2/3 del volume nutrizionale giornaliero la terapia enzimatica è indicata per 2-3 settimane. Per correggere la biocenosi intestinale vengono prescritti prebiotici e probiotici. Per migliorare la funzionalità epatica vengono prescritti metionina, acido glutammico, acido lipoico e altri farmaci. Per garantire i processi redox, vengono utilizzati per via parenterale acido ascorbico, vitamina B, cocarbossilasi e riboflavina. La vitamina B 12 ha un effetto stimolante generale.
Nei casi gravi di malnutrizione vengono utilizzati steroidi anabolizzanti. Se viene rilevata un'infezione, vengono utilizzati antibiotici.
Trattamento paratrofia: nei bambini nei primi mesi di vita, nei casi in cui si è verificata paratrofia a causa di un eccesso di alimentazione con latte materno, si raccomanda di limitare il tempo di alimentazione del bambino a 10-15 minuti, annullare l'alimentazione notturna e sostituire il tè dolce con decotto vegetale. I bambini con precedente alimentazione eccessiva di carboidrati dovrebbero limitare il consumo di carboidrati facilmente digeribili. Per tutti i tipi di paratrofia, si consiglia la purea di verdure come primo alimento complementare.
Ulteriore gestione
L'osservazione dispensaria è necessaria. I bambini che soffrono di distrofia vengono osservati da un pediatra locale una volta ogni 2 settimane. Dovrebbero essere analizzati l'appetito, le feci, i dati antropometrici e oggettivi del bambino. Calcolano la nutrizione, prescrivono massaggi e ginnastica.
Criteri per il recupero: indicatori normali del trofismo del bambino, buon tono emotivo, indicatori antropometrici corrispondenti all'età, nessun cambiamento funzionale negli organi interni.
IPOVITAMINOSI E IPERVITAMINOSI
Ipovitaminosi
Lo sviluppo dell'ipovitaminosi nei bambini è associato a fattori sia esogeni che endogeni. L'ipovitaminosi esogena è spesso causata da ragioni nutrizionali, mentre l'ipovitaminosi endogena è dovuta ad un assorbimento insufficiente di vitamine nel tratto gastrointestinale o ad un assorbimento compromesso. Vengono identificate le principali manifestazioni cliniche dell'ipovitaminosi nei bambini.
La prevenzione dell'ipovitaminosi consiste nell'organizzare una corretta alimentazione a seconda dell'età. Il fabbisogno vitaminico di un bambino aumenta con malattie infettive, patologie gastroenterologiche, malattie del fegato, dei reni, degli organi respiratori e con la prescrizione di antibiotici e farmaci sulfamidici.
Ipovitaminosi
vitamine | Alimenti ricchi di vitamine | Quadro clinico | Indicatori di laboratorio | Trattamento |
C, acido ascorbico | Rosa canina, agrumi, frutti di bosco (mirtilli rossi, ribes nero), verdure | Scorbuto. Gengivite. Gengive sanguinanti. Petecchie sulla pelle, ematomi. Anemia. Letargia, affaticamento, anoressia, febbricola | Diminuzione della vitamina C nel plasma sanguigno e nelle urine. Resistenza capillare ridotta. Radiografia delle ossa: assottigliamento dei raggi ossei, distruzione, calcificazioni periostali | Somministrazione parenterale di acido ascorbico: 200 mg/die. In futuro, 300-500 mg al giorno |
Bj, tiamina | Alimenti di origine animale e vegetale (latte, carne, uova, cereali, pane di segale, legumi) | Danni al sistema nervoso, polineurite, paralisi, debolezza muscolare. Parestesie, convulsioni. Perdita di appetito, stitichezza. SN. Aritmie. Rigurgito. Vomito | Somministrazione parenterale (im vitamina B: da 5-10 mg a 50 mg al giorno) |
vitamine | Alimenti ricchi di vitamine | Quadro clinico | Indicatori di laboratorio | Trattamento |
B2, riboflavina | Fegato, reni, tuorlo d'uovo, lievito, formaggio, ricotta, piselli | Anemia, “marmellate”, screpolature agli angoli della bocca, lingua secca e rossa, bordo rosso delle labbra | 0,003-0,005 g di vitamina B 2 3 volte al giorno |
|
B3, acido pantotenico | Fegato, reni, tuorlo d'uovo, latte, piselli, carne | Danni alla pelle, ritardo della crescita, anoressia, irritabilità, anemia | 0,2 g 3 volte al giorno per 10-12 giorni |
|
B5, o PP, acido nicotinico | Prodotti di origine animale e vegetale. Cereali, legumi, crusca | Anoressia, intossicazione. Feci schiumose a causa della fermentazione dei carboidrati. Cambiamenti nella cavità orale: lingua screpolata, placca bruno-nera, che si trasforma in iperemia | Prodotti contenenti triptofano. A seconda dell'età, 50-100 mg di vitamina PP al giorno, fino a 10-20 iniezioni per ciclo |
|
B6, piridossina | Carne, pesce, lievito, tuorlo d'uovo, legumi, cereali | Convulsioni nei neonati. Pelle secca e squamosa, irritabilità. Maggiore eccitabilità. Anemia, malnutrizione | Xanureuria (più di 0,005 g/giorno). Colore verde delle urine quando si aggiunge il 10% di cloruro ferrico | Per le convulsioni, 2 ml di soluzione di piridossina al 5% per via intramuscolare. 0,005-0,01 g al giorno 4 volte |
vitamine | Alimenti ricchi di vitamine | Quadro clinico | Indicatori di laboratorio | Trattamento |
B 12, cianocobalamina | Carne, pesce, fegato, rognoni, formaggio | Anemia metablastica, gastrite atrofica, danno al midollo spinale | 5-8 mcg/kg per via intramuscolare a giorni alterni |
|
R, rutina | Tè, rosa canina, scorze di limone e arancia, noci, spinaci | Dolore alle gambe, debolezza, letargia, affaticamento, emorragie cutanee | Bassa resistenza capillare | 100-150 mg di rutina al giorno + 100-300 mg di acido ascorbico |
Fegato, lievito di birra, riso, semi di albicocca | Sensibilità alla fotosensibilità, eruzioni cutanee sotto forma di orticaria | 10-25 mg al giorno. 50 mg di pangamato calcio |
||
B9, acido folico | Foglie verdi (verdure, erbe aromatiche), legumi, barbabietole, fegato, uova, formaggio | Glossite. Anemia. Sviluppo fisico ritardato. Diarrea | 0,01-0,02 g di acido folico 2-3 volte al giorno insieme a vitamina B|, |
|
Ah, retinolo | Uova, fegato, burro, latte. Provitamina A - carote, rosa canina, pomodori, lamponi, olivello spinoso | Pelle secca, pustole sulla pelle, frequenti infezioni virali respiratorie acute, polmonite, otite media, fotofobia, aumento di peso ritardato | 5000-10.000 UI di vitamina A 2 volte al giorno. Nei casi più gravi, la dose è di 500-1000 ME/kg/giorno |
vitamine | Alimenti ricchi di vitamine | Quadro clinico | Indicatori di laboratorio | Trattamento |
E, tocoferolo | Piselli, cereali, insalata, verdure | Anemia, debolezza muscolare, malnutrizione | Bambini prematuri 25-50 mg di vitamina E al giorno |
|
H, biotina | Uovo di gallina, fegato, carne, piselli, merluzzo | Dermatiti, perdita di appetito, gonfiore della lingua, iperestesia, anemia | 100-300 mcg di biotina al giorno |
|
D, colecalciferolo | L’elenco è riportato nel capitolo “Rachite” | |||
K, fillochinone | Fegato, uova, piselli, spinaci, pomodori | Petecchie, ecchimosi (sulla pelle e sulle mucose), sanguinamento intestinale, microematuria, sanguinamento dai siti di iniezione | Livello di protrombina inferiore al 70% | Per il sanguinamento, 0,5-1 ml IM di soluzione all'1% di Vikasol*, poi 0,003-0,01 g 3 volte al giorno per sistema operativo |
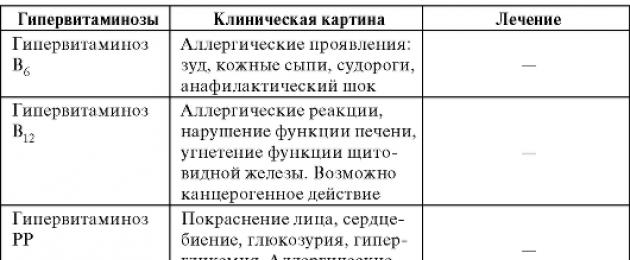
Ipervitaminosi
Queste condizioni si manifestano con l'uso prolungato e incontrollato di vitamine, molto spesso A e D. Le reazioni allergiche si verificano spesso con l'uso parenterale delle vitamine B1, B6PP. Il quadro clinico e il trattamento dell'ipervitaminosi sono presentati nella tabella.
Ipervitaminosi

capitolo 3
Anemia
Definizione
Anemia- una condizione patologica caratterizzata da una diminuzione del livello di emoglobina e/o del numero di globuli rossi per unità di volume di sangue. Il conteggio dei globuli rossi è un indicatore meno oggettivo dell’anemia rispetto al livello di emoglobina. Questa condizione dovrebbe essere diagnosticata quando i livelli di emoglobina sono inferiori ai seguenti valori standard:
. 110 g/l nei bambini da 6 mesi a 5 anni;
. 115 g/l da 5 a 11 anni;
. 120 g/l dai 12 ai 14 anni;
. 120 g/l nelle ragazze sopra i 15 anni;
. 130 g/l nei ragazzi sopra i 15 anni.
Classificazione
Classificazione clinica dell'anemia
In base al grado di gravità si distinguono (a seconda della concentrazione di emoglobina):
. grado lieve (110-90 g/l);
. gravità moderata (90-70 g/l);
. grave (sotto i 70 g/l).
A seconda del volume medio dei globuli rossi:
. microcitico (meno di 80 fl);
. normocitico (81-94 fl);
. macrocitico (più di 95 fl).
Secondo il contenuto medio di emoglobina negli eritrociti:
. ipocromico (meno di 27 pg);
. normocromico (28-33 pg);
. ipercromico (più di 33 pg).
Secondo lo stato di attività rigenerativa del midollo osseo (determinato dalla concentrazione di reticolociti):
. iporigenerativo (meno dell'1%);
. normoregenerativo (1-3%);
. iperrigenerativov iperrigenerativo (più del 3%).
Classificazione eziopatogenetica dell'anemia
Anemie da carenza:
Carenza di ferro;
Carenza vitaminica (carenza di vitamina B, C, acido folico, ecc.);
Carente di proteine;
Carenza di minerali. Anemia postemorragica:
A causa della perdita di sangue acuta;
A causa della perdita cronica di sangue. Anemia ipo- e aplastica.
. Forme congenite.
Con danno all'eritro-, leuco- e trombocitopoiesi:
ι con anomalie congenite dello sviluppo (tipo Fanconi);
ι senza anomalie congenite dello sviluppo (tipo Estren-Dameshek).
Con danno parziale all'ematopoiesi - aplasia eritroide selettiva (tipo Blackfan-Diamond).
. Forme acquisite.
Con danno agli eritrociti, ai leucociti o alla trombocitopoiesi:ι aplastica acuta;
ι ipoplastico subacuto;
ι ipoplastico cronico con una componente emolitica sullo sfondo dell'autoimmunizzazione.
Ipoplastica parziale con danno selettivo dell'ematopoiesi.
anemia emolitica.
. Ereditario:
Membranopatie (microsferocitosi, ellissocitosi, stomatocitosi, xerocitosi, emoglobinuria parossistica notturna, ecc.);
Enzimopatie (difetti del ciclo Embden-Meyerhof, ciclo dei pentoso fosfati, metabolismo dei nucleotidi, metaemoglobinemia);
Difetti nella struttura e nella sintesi dell'emoglobina (anemia falciforme (anemia falciforme e altre malattie dell'emoglobina con emoglobine anormali, talassemia, eritroporfiria).
Acquistato:
Immunitario e immunopatologico (isoimmune - dovuto a trasfusione di sangue incompatibile, malattia emolitica dei neonati, conflitto Rh e AB0, autoimmune, farmaci aptenici, ecc.);
Infettivo [citomegalovirus (CMV), infezione da meningococco, ecc.];
Carenza vitaminica (anemia da carenza di vitamina E del prematuro e anemia causata da avvelenamento con metalli pesanti, veleno di serpente, ecc.);
Sindrome DIC (sindrome della coagulazione intravascolare disseminata) di varie eziologie;
Per varie condizioni patologiche gravi (ad esempio malattie diffuse del tessuto connettivo).
La diagnosi preliminare di anemia deve essere formulata come segue: anemia microsferocitica ipocromica rigenerativa di moderata gravità.
ANEMIA DA CARENZA DI FERRO
Definizione
Anemia da carenza di ferro (IDA) è una condizione caratterizzata da una diminuzione del contenuto di ferro nel siero sanguigno, nel midollo osseo e nei depositi a causa della sua perdita o aumento del fabbisogno, aumento della capacità di legare il ferro del siero sanguigno. Di conseguenza, si sviluppa una violazione della sintesi dell'emoglobina con una diminuzione del suo livello per unità di volume di sangue e una diminuzione della concentrazione media in ciascun globulo rosso, con lo sviluppo di anemia ipocromica e disturbi trofici nei tessuti del corpo.
Codice ICD-X
D50.0 Anemia da carenza di ferro secondaria a perdita di sangue (cronica).
D50.8 Altra anemia da carenza di ferro.
Epidemiologia
L’IDA è la malattia più diffusa al mondo. Secondo l’OMS, fino al 20% della popolazione mondiale soffre di questa malattia.
L'IDA colpisce il 26-60% dei bambini piccoli. Il tasso di incidenza massimo si verifica nella seconda metà della vita e il tasso più basso si osserva nel 3° anno. L’elevata frequenza di anemizzazione nel 1°, 3° e 6° mese di vita è spiegata dall’intensità della crescita dei bambini e dal grande fabbisogno di ferro durante questo periodo del loro sviluppo.
I seguenti bambini dovrebbero essere considerati ad alto rischio di anemia:
Con dermatite atopica, dovuta ad una maggiore perdita di ferro dall'epitelio, compreso l'intestino;
Bambini grandi con intenso aumento di peso nel 1° anno di vita (più di 1 kg al mese di peso corporeo e più di 3 cm di altezza).
Eziologia
Le principali cause della carenza di ferro nel corpo di un bambino e, quindi, che contribuiscono allo sviluppo dell'IDA:
Disfunzione placentare, tossicosi;
Violazione della circolazione uteroplacentare;
Aborto spontaneo e parti multipli;
Sanguinamento feto-materno.
. Aumento del fabbisogno di ferro da parte dell'organismo ad un ritmo accelerato di sviluppo fisico del bambino (eccessivo aumento di peso e/o altezza).
. La carenza di ferro nutrizionale si osserva quando:
Trasferimento precoce all'alimentazione artificiale;
Introduzione tardiva di alimenti complementari (soprattutto carne);
Dieta squilibrata (con predominanza di farina, latticini o cibi vegetariani con consumo insufficiente di carne).
. Una diminuzione dell’assorbimento del ferro a livello intestinale è determinata da:
Per sindromi da malassorbimento congenite e acquisite, malattie infiammatorie intestinali;
Per disturbi funzionali del tratto gastrointestinale (aumento della motilità intestinale).
. Perdita eccessiva di ferro derivante da:
Legatura prematura del cordone;
Sanguinamento intrapartum di varie eziologie (compresa quella iatrogena);
Occulto (sanguinamento nascosto) a causa di vari motivi (inclusa l'infestazione da elminti da parte di parassiti succhiatori di sangue).
Patogenesi
La patogenesi dell'IDA è strettamente correlata alle caratteristiche del metabolismo del ferro nell'organismo e attraversa tre fasi di carenza di ferro.
(OMS, 1977).
. La carenza di ferro prelatente è caratterizzata da un lato dall’esaurimento delle riserve di ferro nei tessuti e dall’altro dal mantenimento di adeguati livelli di trasporto del ferro.
. La carenza di ferro latente è accompagnata da una diminuzione sia delle riserve tissutali che del livello di trasporto del ferro, ma il livello dei globuli rossi e dell'emoglobina rimane normale.
. IDA, che è caratterizzato dall'esaurimento dei depositi di ferro nei tessuti, una forte diminuzione del pool di trasporto del ferro, una diminuzione dei livelli di emoglobina con una diminuzione molto moderata del numero di globuli rossi. In caso di IDA, la sindrome sideropenica è più pronunciata che in caso di carenza di ferro latente.
Patomorfologia
Il ferro è uno dei microelementi più comuni e importanti nel corpo umano. Senza di esso, il trasferimento di ossigeno è impossibile; il ferro è attivamente coinvolto nei processi di ossidazione, nella sintesi proteica e influenza il numero e le proprietà funzionali delle cellule del sistema immunitario immunocompetente. Questo biometallo obbligato è coinvolto nei processi di mitosi cellulare e biosintesi del DNA. La carenza di ferro porta all'immunodeficienza: il contenuto dei linfociti T diminuisce, la risposta della trasformazione esplosiva dei linfociti a vari mitogeni diminuisce, i processi di perossidazione lipidica vengono interrotti, il che porta all'accumulo di coniugati dienici. L'iposideremia porta alla distruzione degli organelli cellulari, mentre la densità dei mitocondri nelle cellule del fegato, nei muscoli e nelle cellule eritroidi diminuisce. Allo stesso tempo, il catabolismo delle catecolamine viene interrotto, la loro concentrazione nei tessuti del sistema nervoso centrale aumenta, il che porta all'attivazione degli effetti adrenergici. L'ipossia provoca iperventilazione dei polmoni, aumento della frequenza cardiaca e del volume del sangue circolante. Tutti questi cambiamenti, che inizialmente hanno carattere compensatorio, portano successivamente a danni organici. Pertanto si sviluppano distrofia miocardica, gastrite cronica, encefalopatia, ecc.
Metabolismo del ferro nel corpo
Il metabolismo del ferro è un processo complesso che comprende stoccaggio, utilizzo, trasporto, distruzione e riutilizzo (riciclaggio). La principale perdita giornaliera di ferro è associata alla desquamazione dell'epitelio del tratto gastrointestinale, respiratorio e urinario, alla desquamazione delle cellule della pelle e delle sue appendici (perdita e taglio di capelli e unghie), all'escrezione dell'oligoelemento nel sudore e nelle urine, ma tutte queste perdite dovrebbero essere considerate minime. Aumentano molte volte nelle ragazze e nelle donne in età riproduttiva a causa della regolare perdita di sangue mestruale.
Quadro clinico
Manifestazioni soggettive di IDA:
Debolezza generale e muscolare, malessere, diminuzione delle prestazioni, diminuzione dell'appetito;
Perversione del gusto (desiderio di mangiare alcune sostanze non commestibili, come il gesso, o cibi non commestibili - pasta cruda, cereali);
Necessità di cibi acidi, piccanti, salati;
Secchezza e formicolio della punta della lingua, difficoltà a deglutire con sensazione di corpo estraneo in gola;
Perversione dell'olfatto (dipendenza da odori sgradevoli, come benzina, cherosene);
Si notano palpitazioni, mancanza di respiro, svenimenti, insonnia, ecc.
Diagnostica
Esame fisico
Un esame obiettivo dei pazienti può rivelare:
Pallore della pelle, che a volte acquisisce una tinta verdastra (era questo colore a giustificare l'antico nome della malattia - "clorosi");
- sclera “blu”, atrofia delle papille della lingua, talvolta crepe sulla punta e lungo i bordi, aree di rossore con epitelio desquamato (lingua “geografica”);
Cambiamenti aftosi nella mucosa orale; labbra screpolate, crepe agli angoli della bocca - cheilite (“marmellate”), danni allo smalto dei denti;
Pelle secca, capelli; unghie fragili;
Bruciore e prurito della vulva; grave debolezza muscolare che non corrisponde alla gravità dell'anemia;
La pelle con IDA diventa secca, a volte compaiono delle crepe;
Occasionalmente si può osservare un leggero ingiallimento dei palmi e del triangolo nasolabiale, associato ad un alterato metabolismo del carotene dovuto alla carenza di ferro nel corpo.
Tutti questi segni clinici della malattia sono più pronunciati nell'IDA grave. Un segno tipico di una carenza di ferro è il danno al tratto gastrointestinale, che crea l'idea sbagliata che il collegamento principale nella patogenesi della malattia sia il danno allo stomaco con il presunto successivo sviluppo di carenza di ferro nell'organismo. Cambiamenti atrofici si verificano nella mucosa non solo del tratto digestivo, ma anche nel sistema respiratorio e nei genitali.
Nei pazienti con IDA, di regola, non c'è ittero generale della pelle, nessuna sindrome emorragica cutanea, nessun ingrossamento della milza e dei linfonodi. I cambiamenti nel sistema cardiovascolare sono caratteristici del concetto di distrofia miocardica e si manifestano con sintomi come suoni cardiaci ovattati, soffio sistolico all'apice del cuore di natura funzionale e varie anomalie sull'ECG.
Ricerca di laboratorio
Esiste una gamma significativa di metodi e strumenti che consentono di verificare in modo affidabile l'IDA utilizzando analizzatori moderni. I metodi e i criteri utilizzati per diagnosticare questa malattia possono essere presentati come segue.
Analisi clinica generale del sangue periferico:
Una diminuzione del livello di emoglobina e, in misura minore, del numero di globuli rossi per unità di volume di sangue (gli indicatori specifici a seconda della gravità dell'anemia sono riportati sopra);
Una diminuzione dell'indice di colore e, quindi, del contenuto medio di emoglobina in un globulo rosso (abbreviazione internazionale - SCH; espresso in picogrammi (pg); norma - 27-35 pg);
Riduzione delle dimensioni e del volume dei globuli rossi;
Aniso- e poichilocitosi degli eritrociti con predominanza di microcitosi;
Ipocromia degli eritrociti;
La conta dei reticolociti è normale o leggermente aumentata;
La conta piastrinica è normale o leggermente aumentata;
La formula dei leucociti è normale. Chimica del sangue:
Diminuzione del contenuto di ferro nel siero inferiore a 14,3 µmol/l (normale 0,7-1,7 mg/l o 12,5-30,4 µmol/l);
Diminuzione dei livelli di ferritina sierica;
Diminuzione della percentuale di saturazione della transferrina con ferro (coefficiente di saturazione plasmatica inferiore al 18%);
Diminuzione delle riserve di ferro secondo il test desferal;
Aumento della capacità di legare il ferro totale (TJCC) 1 e latente (LBCC) (oltre 78 µmol/l) del siero sanguigno; sangue.
Aumento del contenuto di protoporfirina negli eritrociti. La TLC del siero sanguigno nell'IDA è sempre aumentata, al contrario di
altre anemie ipocromiche associate non a carenza di ferro, ma a una violazione della sua inclusione nella molecola dell'emoglobina o alla ridistribuzione del ferro dalle cellule eritroidi alle cellule del sistema macrofagico, ad esempio durante i processi infiammatori.
Studi strumentali
Per identificare la malattia di base che ha causato lo sviluppo dell'anemia, è necessario un esame completo del paziente.
Esame del tratto gastrointestinale (effettuazione di fibrogastroduodenoscopia, determinazione dell'acidità del succo gastrico).
Esame delle feci per sangue occulto (reazione di Gregersen).
Esame a raggi X del tratto digestivo per rilevare vene dilatate dell'esofago, tumori e altre malattie chirurgiche pericolose.
Visita ginecologica di ragazze e giovani donne.
Sigmoidoscopia per rilevare colite ulcerosa, emorroidi o tumori.
1 La capacità legante del ferro del siero è la quantità di ferro che la transferrina presente nel plasma potrebbe legare (normalmente 41-49 µmol/l o 3,5-4,0 mg/l, o 350-400 µg%).
Trattamento
Le tattiche terapeutiche per l'IDA dovrebbero basarsi sulla conoscenza accurata della natura e delle cause della malattia, avere un orientamento eziopatogenetico e seguire determinati principi. Questi includono:
Correzione della carenza di ferro e ripristino delle sue riserve nel corpo, che non possono essere compensate solo dalla dietoterapia, senza l'uso di farmaci contenenti ferro;
La terapia IDA dovrebbe essere effettuata principalmente con integratori orali di ferro;
Il trattamento dell'IDA non viene interrotto dopo la normalizzazione dei livelli di emoglobina, poiché il medico deve affrontare l'importante compito di creare un deposito di ferro nel corpo;
Le trasfusioni di sangue per IDA vengono effettuate solo per motivi di salute.
Trattamento medico
Il posto principale nel trattamento dell'IDA nei bambini piccoli è dato al trattamento specifico con preparati a base di ferro. Per ottenere un effetto terapeutico, è necessario seguire le seguenti raccomandazioni:
È meglio assumere i preparati a base di sale di ferro a stomaco vuoto o lontano dai pasti;
Se il farmaco è scarsamente tollerato, dovresti scegliere un altro farmaco, ma non rifiutare il trattamento;
Gli integratori di ferro dovrebbero essere prescritti in una dose adeguata;
La terapia con la dose specificata di ferro elementare deve essere effettuata fino al raggiungimento dei livelli normali di emoglobina e poi per almeno altri 2 mesi a metà dose per creare un deposito di ferro nell'organismo.
Vengono utilizzati i seguenti integratori di ferro.
. Monocomponente:
. Combinato: preparati contenenti composti di ferro, microelementi e multivitaminici.
. Preparazioni di ferro per uso parenterale - ferrum lek* [complesso di idrossido saccarosio di ferro (III)].
La somministrazione parenterale di integratori di ferro è possibile solo per indicazioni particolari.
In conformità con le raccomandazioni dell'OMS e le linee guida del Ministero della Salute della Federazione Russa del 1997, gli integratori di ferro dovrebbero essere prescritti alla dose di 3 mg/kg al giorno di ferro elementare, indipendentemente dalla gravità dell'anemia.
Criteri per l'efficacia della ferroterapia:
Aumento del livello di emoglobina di 10 g/l a settimana;
La comparsa della crisi reticolare (un aumento del numero di reticolociti di 2 volte nel 10-14esimo giorno);
Aumento del ferro sierico a 1000 mcg/l. Reazioni collaterali e indesiderate durante l'assunzione di farmaci
la carenza di ferro è principalmente associata a dosi eccessive raccomandate dall'OMS e dal Ministero della Salute della Federazione Russa e molto spesso si manifesta con lievi disturbi dispeptici. Gli effetti collaterali più comuni osservati durante il trattamento con ferropreparati salini sono: sapore metallico, scurimento dello smalto dei denti, disturbi dispeptici (nausea, diarrea, sensazione di pienezza allo stomaco, vomito, stitichezza). In rari casi può svilupparsi necrosi della mucosa intestinale.
Prevenzione
Prevenzione della carenza di ferro nelle donne in gravidanza e in allattamento. Ciò è facilitato principalmente da una dieta razionale ed equilibrata e dal rispetto di un regime appropriato.
Alimentazione naturale dei bambini, introduzione tempestiva di alimenti complementari. Identificazione dei bambini a rischio di anemia, che includono:
Bambini di 1-2 anni di età da madri anemiche;
Nascita prematura e sottopeso;
Primi destinatari di alimentazione mista o artificiale;
Con sintomi di dermatite atopica;
Malattia a lungo termine e frequente;
Bambini con malattie intestinali congenite e acquisite.
Si consiglia ai bambini a rischio di anemia di adottare misure preventive specifiche. A partire dall'ottava settimana è necessario prescrivere un integratore di ferro alla dose di 1-1,5 mg/kg di peso corporeo al giorno (ferro elementare). Il corso della terapia è di 1,5-2 mesi.
Ogni 3 ore durante il giorno, al paziente viene chiesto di urinare in tazze diverse. In questo modo si raccolgono 4 porzioni giornaliere e 4 porzioni notturne. L'infermiera deve assicurarsi che il paziente inizi a urinare esattamente all'ora specificata e raccolga attentamente l'urina ogni 3 ore. Ad esempio, ad un paziente viene chiesto di urinare alle 6 del mattino (questa porzione non viene analizzata), poi, a partire dalle 9, ogni porzione viene raccolta separatamente; l'ultima, ottava, porzione verrà consumata alle 6 del mattino successivo.
Normalmente le porzioni giornaliere contengono circa 3/4, 2/3 della quantità totale di urina, poiché una persona beve principalmente durante il giorno. Nelle porzioni con una grande quantità di urina, il peso specifico è inferiore, quindi nelle porzioni notturne è più alto.
Se la diuresi notturna supera quella diurna, cioè si verifica la cosiddetta nicturia, ciò significa che la funzione dei reni di espellere l'acqua è compromessa e il liquido bevuto durante il giorno viene parzialmente trattenuto nel corpo e rilasciato durante la notte. tutte le porzioni sono uguali e così basse indicheranno che la funzione di concentrazione dei reni è compromessa, cioè i reni hanno perso la capacità di secernere quantità relativamente grandi di sostanze dense in una piccola quantità di urina.
Il test Zimnitsky consente di determinare la violazione delle funzioni renali di base.
Il rene è coinvolto nei processi metabolici del corpo. La gluconeogenesi è piuttosto attiva nel rene, soprattutto durante il digiuno, quando il 50% del glucosio che entra nel sangue si forma nel rene. Anche il rene è coinvolto nel metabolismo dei lipidi. Il ruolo del rene nel metabolismo proteico è quello di scomporre le proteine riassorbite dall'urina primaria mediante pinocitosi. Il rene sintetizza importanti componenti delle membrane cellulari: fosfatidilinositolo, acido glucuronico, triacilgliceridi, fosfolipidi; entrano tutti nel sangue.
Il rene è coinvolto nella regolazione di vari parametri corporei: pH, pressione osmotica, pressione arteriosa, costanza della composizione ionica del plasma sanguigno (il rene è l'organo esecutivo preposto alla regolazione degli scambi di Na+, Ca 2+, K+, Mg 2+, CI -);
Il rene produce sostanze biologicamente attive: renina, urochinasi, tromboplastina, serotonina, prostaglandine, bradichinina, trombossano (favorisce l'aggregazione piastrinica, restringe i vasi sanguigni), prostaiklina (inibisce l'aggregazione piastrinica), eritropoietina, trombopoietina, alenosina.
Funzione protettiva del reneè che neutralizza, grazie al gruppo SH, il tripeptide glutadione (presente nelle cellule nefronali), i veleni estranei e le sostanze tossiche.
MALATTIE DI FONDO DEI PRIMI BAMBINI.
Già a metà del XIX secolo S.F. Khotovitsky ha scritto: “Un bambino non è un adulto in miniatura; Ogni età ha la propria costituzione: un’altra per il neonato, un’altra per il bambino, un’altra per il vecchio”. Più il bambino è piccolo, più il suo corpo è diverso da quello di un adulto. Le caratteristiche morfo-funzionali dell'organismo dei bambini nei primi tre anni di vita risiedono nella transitoria immaturità degli organi di eliminazione, metabolismo e immunogenesi. Allo stesso tempo, l'intensità dello sviluppo nell'infanzia e nella prima età non è paragonabile a nessun altro periodo della vita umana. Gli alti tassi di crescita, l'aumento dell'attività motoria durante lo sviluppo e la formazione dell'immunità determinano un fabbisogno adeguato di ingredienti alimentari, materiale energetico e un rapporto ottimale di minerali e vitamine nella nutrizione. Il decorso complicato della gravidanza e del parto, che porta alla mancanza di nutrienti di deposito nel feto nel periodo prenatale, un'alimentazione squilibrata nel periodo postnatale, cure compromesse, disfunzioni intestinali, malattie croniche acute e ricorrenti ripetute predispongono in tenera età a carenze e squilibri nel corpo di alcuni nutrienti, scambio di patologie. Le cosiddette “malattie della crescita” o malattie di fondo si verificano solo nei neonati (ad esempio rachitismo da carenza di vitamina D, malnutrizione, paratrofia) o soprattutto al di sotto dei tre anni (anemia da carenza di ferro).
Il rachitismo da carenza di vitamina D è una malattia che colpisce esclusivamente i bambini piccoli, la cui causa è un disturbo metabolico (principalmente fosforo-calcio). La frequenza del rachitismo in diverse regioni varia dal 36 al 56% (A.I. Ryvkin, 1985). La malattia è nota fin dai tempi di Ippocrate. Già nel 1650, l'anatomista e ortopedico inglese Glisson presentò una descrizione dettagliata del quadro clinico e dell'anatomia patologica del rachitismo, che fu chiamata la malattia "inglese", la "malattia dei bassifondi". Una chiara conferma della natura ecopatologica del rachitismo, dell'attività antirachitica della vitamina D e della possibilità di curare il rachitismo con l'aiuto dell'irradiazione ultravioletta della pelle furono le scoperte fatte negli anni '20 del XIX secolo da E.V. McCollum, E. Mellanby, A.F. Hess. Un gran numero di studi condotti da scienziati pediatrici nazionali sono stati dedicati allo studio delle cause, del trattamento e della prevenzione del rachitismo: N.F. Filatova, A.A. Kiselya, G.N. Speransky, A.F. Tura, K.A. Svyatkina, E.M. Lukyanova e altri.In Transbaikalia, la professoressa, capo del dipartimento di pediatria della ChSMA E.P., ha dato il suo contributo alla descrizione del rachitismo. Chetvertakova. Nonostante i numerosi lavori riguardanti questo problema, rimangono dei “vuoti” nella patogenesi di questa sofferenza. La classificazione della malattia è stata rivista più volte. Un ampio gruppo di patologie è costituito da malattie che presentano un fenotipo di rachitismo, ma non sono associate a carenza nutrizionale di vitamina D. Questa patologia, prevalentemente ereditaria, è stata studiata attivamente dalla metà del secolo scorso. Negli anni '90 del 20 ° secolo, sullo sfondo del peggioramento della situazione economica nel nostro Paese, si è verificato un aumento della frequenza di forme gravi di rachitismo da carenza di vitamina D, anche nei bambini di 2-3 anni, che richiedono una diagnosi differenziale con il rachitismo malattie simili e trattamento attivo.
L’anemia da carenza di ferro è la condizione più comune al mondo. Secondo la letteratura, il 90% dei casi di anemia sono causati da carenza di ferro. Nel mondo, il 43% dei bambini sotto i 4 anni e il 37% dei bambini in età prescolare e in età scolare dai 5 ai 12 anni soffrono di carenza di ferro. La frequenza dell'anemia da carenza di ferro nei bambini in media in Russia raggiunge il 12% e in tenera età in diverse regioni - dal 15% al 47,8% (Khotimchenko S.A., Alekseeva I.A., Baturin A.K., 1999) . Esistono numerosi lavori dedicati alla carenza di ferro nei neonati e nei bambini piccoli. Allo stesso tempo, la ricerca continua a chiarire le cause della carenza di ferro nel corpo, la relazione del metabolismo dei metalli con altre sostanze chimiche, il ruolo della carenza di ferro, nonché il suo eccesso nella destabilizzazione delle membrane cellulari, ecc.
Le distrofie - disturbi alimentari cronici e digestivi - rappresentano il gruppo più numeroso di malattie eterogenee nell'eziologia. Oltre al fattore nutrizionale, lo sviluppo della distrofia può essere causato da eventuali malattie che, da un lato, sono la causa di un disturbo alimentare e, dall'altro, uno dei criteri diagnostici della sofferenza. In ogni caso, quando diagnostica la distrofia in un bambino, il medico effettua un esame approfondito del paziente, escludendo costantemente varie patologie. I pediatri devono occuparsi di disturbi cronici nutrizionali e digestivi dovuti a malformazioni congenite, lesioni del sistema nervoso ed endocrino, malattie del tratto gastrointestinale, ecc. Le distrofie differiscono non solo per una varietà di cause, ma anche per il loro quadro clinico: con un carenza di massa (ipotrofia), con eccesso di massa (paratrofia), con ritardo della crescita o ritardo generale dello sviluppo (ipostatura). La patogenesi della malattia è determinata dalla causa della patologia sottostante. Date le molteplici cause, l’approccio al trattamento per ciascun paziente è strettamente individuale. I principi proposti della terapia dietetica graduale per la malnutrizione sono adeguati principalmente per i disturbi alimentari della nutrizione e della digestione, che sono attualmente relativamente rari.
Nonostante una sezione della pediatria abbastanza ben studiata dedicata alle malattie di base (rachitismo, distrofia, anemia da carenza di ferro), non esiste un approccio unificato alla diagnosi, compresa la diagnosi differenziale, l'interpretazione dei metodi di ricerca di laboratorio e strumentali, la terapia moderna e la prevenzione di queste malattie . Ad esempio, in letteratura non esiste consenso sulla scelta dei farmaci per il trattamento dell'anemia da carenza di ferro (forme saline o complesso ferro-maltosio), sul metodo e sulla durata della ferroterapia. Diverse fonti letterarie raccomandano durate diverse per la prescrizione di una dose terapeutica di vitamina D: da 2–3 a 3–4 settimane. Atteggiamento ambiguo nei confronti delle controindicazioni all'uso della vitamina D 3. Il trattamento dei bambini malnutriti presenta particolari difficoltà. Nelle fonti letterarie a disposizione degli studenti non ci sono praticamente informazioni sulle tattiche di riabilitazione dei bambini affetti da paratrofia.
A sua volta, la mancanza di un approccio unificato agli standard di diagnosi, trattamento e prevenzione delle patologie nella prima infanzia rende difficile l'insegnamento di questa sezione. Lo scopo della pubblicazione del libro di testo "Malattie di fondo nei bambini" è quello di aiutare i futuri pediatri a padroneggiare gli argomenti "rachitismo", "distrofia", "anemia da carenza di ferro" durante la preparazione indipendente e per gli insegnanti ad applicare requisiti uniformi per valutare la conoscenza di studenti di questa sezione di pediatria per tutte le fasi della formazione.
L'anemia è una condizione patologica accompagnata da una diminuzione dei livelli di emoglobina e del numero di globuli rossi per unità di volume di sangue ed è la malattia o sindrome ematologica più comune. Il numero di globuli rossi è un indicatore meno obiettivo dell'anemia, poiché l'eritropenia non è sempre correlata al grado di diminuzione dell'emoglobina. Ecco perché nella pratica generale il criterio principale per l'anemia e la sua gravità è il contenuto di emoglobina. La tabella 1 presenta i criteri diagnostici per l'anemia in base all'età e alla gravità della malattia.
Tabella 1 Criteri diagnostici per l'anemia in base all'età e alla gravità.
Classificazione dell'anemia.
La classificazione dell'anemia si basa sul principio della loro distribuzione secondo i parametri degli eritrociti (Tabella 2), tenendo conto del diametro medio, della saturazione degli eritrociti con emoglobina o indice di colore, nonché della funzione rigenerativa del midollo osseo, valutata mediante il numero di reticolociti.
Tabella 2 Classificazione dell'anemia in base ai parametri eritrocitari.
Attualmente, quando si valutano gli emocromi nelle istituzioni mediche, è ampiamente utilizzato un analizzatore ematologico automatico, con il quale è possibile determinare il volume medio degli eritrociti (MCV), il contenuto medio (MCH) e la concentrazione media di emoglobina negli eritrociti (MCHC), nonché il larghezza della distribuzione degli eritrociti nel volume (RDW), che caratterizza il grado di anisocitosi cellulare. I parametri dei globuli rossi determinati utilizzando un analizzatore ematologico sono presentati nella Tabella 3.
Tabella 3 Classificazione dell'anemia in base ai parametri dei globuli rossi determinati utilizzando un analizzatore ematologico.
Allo stesso tempo, le caratteristiche dell’anemia basate sui parametri eritrocitari non forniscono informazioni sull’eziopatogenesi della malattia. Di seguito è riportata una classificazione dell'anemia a seconda della causa del processo patologico.
Classificazione dell'anemia in base alla patogenesi (Alekseev G.A., 1970, Allan J., Erslev, 1995, Natan, Oski, 1998).
1. Anemia derivante da perdita di sangue acuta.
2. Anemia derivante da carente eritropoiesi.
A. A causa di una maturazione compromessa (principalmente microcitica):
Compromissione dell'assorbimento e dell'uso del ferro, anemia da carenza di ferro;
Trasporto del ferro compromesso (atransferrinemia);
Alterata utilizzazione del ferro (talassemia, anemia sideroblastica);
Riciclo del ferro compromesso (anemia nelle malattie croniche).
B. A causa di una differenziazione compromessa (principalmente normocitica):
Anemia aplastica (congenita e acquisita);
Anemia diseritropoietica congenita.
B. A causa della ridotta proliferazione (principalmente macrocitica):
B 12 - anemia da carenza;
Anemia da carenza di folati.
3. Anemia derivante da una maggiore distruzione delle cellule eritroidi.
A. Emolisi causata da anomalie interne dei globuli rossi:
Membranopatie;
Enzimopatie;
Emoglobinopatie.
B. Emolisi causata da influenze esterne (extracellulari):
Anemia emolitica autoimmune;
Anemia traumatica;
Emoglobinuria parossistica notturna.
4. Anemia di neonati e bambini prematuri.
Le tabelle 4, 5, 6 presentano caratteristiche morfologiche diagnostiche differenziali degli eritrociti in alcune anemie nei bambini.
Tabella 4 Diagnosi differenziale dell'anemia, tenendo conto del volume medio dei globuli rossi.
| Tipo di anemia dipendente dall'MCV | Variante patogenetica dell'anemia | |
| RDW-N | RDW più di 14,5 | |
| Microcitico | Talassemia eterozigote, nelle malattie croniche | IDA, anemia falciforme, beta talassemia, frammentazione dei globuli rossi dell'emoglobina H (due picchi sull'istogramma)* |
| Normocitico | Per malattie croniche, enzimopatia eritrocitaria, emoglobinopatie, sferocitosi ereditaria, postemorragica acuta, leucemia mieloide cronica, mielodepressione citostatica | Carenza mista (IDA e B12), sideroblastica, mielofibrosi |
| Macrocitico | Anemia aplastica, sindrome mielodisplastica | Autoimmune emolitico, megaloblastico |
*L'istogramma riflette graficamente la frequenza di comparsa dei globuli rossi di diversi volumi ed è un analogo della curva di Price-Jones. Tipicamente l'istogramma ha la forma di un singolo picco.
Tabella 5 Diagnosi differenziale dell'anemia in base al numero di reticolociti.
*Il numero di reticolociti può aumentare, ma non corrisponde al grado di emolisi.
Tabella 6 Forme di globuli rossi in alcune anemie infantili.
| Forma dei globuli rossi | Malattia |
| Sferociti | Sferocitosi ereditaria, anemia emolitica autoimmune, crisi da deficit di G-6-PD, emoglobina instabile |
| Elittociti (ovalociti) | Ellissocitosi ereditaria, può essere associata a IDA, talassemia, anemia megaloblastica, mielofibrosi, mieloftiti, sindrome mielodisplastica, deficit di piruvato chinasi |
| Mezzaluna | Anemia falciforme |
| A forma di bersaglio | Talassemia, emoglobina C, malattie del fegato |
| Schizociti (frammentazione dei globuli rossi) | Anemia emolitica meccanica |
| Acantociti | Anemia nelle malattie del fegato, beta-lipoproteinemia |
| Cellule dentali | Stomatocitosi congenita e acquisita |
| Anisocromia, poichilocitosi (echinociti, schizociti) | Anemia nell’insufficienza renale cronica |
| Macroovalocitosi (megalocitosi), Corpi Jolly, Anelli Cabo | Anemia da carenza di vitamina B12 |
| Corpi di Heinz nei globuli rossi | Carenza di G-6PD |
Anemia da carenza di ferro.
L'anemia da carenza di ferro (IDA) è una malattia polietiologica che è il risultato di una diminuzione del contenuto totale di ferro nell'organismo ed è caratterizzata da microcitosi progressiva e ipocromia degli eritrociti.
Secondo la letteratura, il 90% dei casi di anemia sono causati da carenza di ferro. Nel mondo, il 43% dei bambini sotto i 4 anni e il 37% dei bambini in età prescolare e in età scolare tra i 5 e i 12 anni soffrono di una condizione di carenza di ferro (IDS). La frequenza dell'IDA nei bambini in media in Russia raggiunge il 12% e in tenera età in diverse regioni - dal 15% al 47,8% (Khotimchenko S.A., Alekseeva I.A., Baturin A.K., 1999). Alti tassi di crescita, immaturità funzionale dell'apparato digerente, monotonia della nutrizione, frequenti malattie intercorrenti, disfunzione del tratto gastrointestinale e difetti alimentari predispongono allo sviluppo di VDS nei bambini dai 6 mesi ai 3 anni di età.
Il metabolismo del ferro è determinato dal fabbisogno di questo nutriente, dal suo contenuto e dalla biodisponibilità nella dieta, dall'utilizzo nel tratto gastrointestinale, dal trasporto alle cellule, dalla sintesi delle proteine del ferro, dalle perdite (escrezione nelle feci e nelle urine). La sideropenia può svilupparsi a causa di un insufficiente apporto di ferro tramite il cibo, di un ridotto utilizzo del ferro o di un aumento delle perdite. Esistono quattro gruppi di cause di IDA nei bambini.
1. Ridotta deposizione di ferro nel periodo prenatale. Nella prima metà della vita, il ferro nutrizionale, fornito in quantità minime con il latte, non gioca un ruolo importante nell'eritropoiesi del neonato. L'emopoiesi viene effettuata principalmente a causa del deposito di ferro, la cui creazione nel feto sotto forma di ferritina avviene fin dalle prime fasi della gestazione, aumentando rapidamente nel tardo periodo fetale. Il 70% del ferro eme nei bambini sotto i due anni è di origine materna. L’apporto di ferritina al feto dipende dal contenuto di ferro nel corpo della donna e dallo stato della barriera fetoplacentare. Esistono prove convincenti di una diminuzione del ferro tissutale della placenta e del ferro sierico nel cordone ombelicale di un neonato con sideropenia nella madre. La predisposizione di una donna allo sviluppo della VDS è la perdita di sangue, spesso associata a menometrorragia, gravidanze e parti ripetuti e una dieta squilibrata. La gestosi e l'esacerbazione dei processi infiammatori cronici nella seconda metà della gravidanza interrompono le funzioni della barriera fetoplacentare e complicano l'utilizzo del ferro da parte del feto. I bambini prematuri e i neonati di gravidanze multiple hanno sempre bassi livelli di ferro depositato. Nel periodo perinatale, l'anemia postemorragica dei neonati predispone ad una diminuzione del ferro depositato.
2. La carenza nutrizionale è la causa più comune dello sviluppo del VSD. Il fabbisogno giornaliero di ferro dell'organismo dipende dall'età, dal sesso, dall'attività fisica, dalle perdite ed è per i neonati fino a 3 mesi - 4 mg, nella prima metà della vita - 7 mg, per i bambini dai 7 mesi ai 6 anni - 10 mg, per gli scolari in età prepuberale – 12 mg, per i ragazzi – 15 mg, per le ragazze – 18 mg. L'apporto di ferro da parte dell'organismo è legato sia al suo contenuto nella dieta che alla sua biodisponibilità. Gli alimenti ricchi di ferro includono carne rossa, fegato, caviale di storione, alcuni cereali (grano saraceno, miglio, avena), frutta (mirtilli, mirtilli, pesche, mele, cachi, ecc.). Nel latte umano la concentrazione di ferro non supera 2 - 4 mg/l, nel latte vaccino - 1 mg/l. Il contenuto di ferro nella dieta è uno dei fattori più importanti, ma non l'unico, che determina il normale apporto di questo nutriente al corpo umano. Il ferro eme, proveniente da prodotti animali (carne, pesce, pollame) sotto forma di forme complesse legate all'anello porfirinico (emoglobina, mioglobina) e ad altre proteine (ferritina, emosiderina), è ben assorbito a livello intestinale e viene assorbito fino a 15 - 35% del volume totale contenuto nei prodotti alimentari. Il ferro, che fa parte di alcune proteine specifiche (lattoferrina nel latte, ovotransferrina e fosfovitina nell'uovo), viene assorbito meno, ad eccezione del latte materno, in cui la biodisponibilità del nutriente è del 50%. Dai cibi vegetali, l'uomo riceve il ferro sotto forma di sali, fitoferritina e in complessi con acidi organici. La digeribilità del ferro non eme non supera il 2-5%. Il livello di assorbimento del ferro dipende dal fabbisogno individuale, dall'apporto di ferro da parte dell'organismo, dalla sua fonte e dal contenuto negli alimenti, nonché dalla presenza di leganti in questo prodotto che migliorano o inibiscono i processi di utilizzo. Il ferro eme ha un'elevata capacità di assorbimento poiché il suo assorbimento, di norma, non è associato all'azione di altre sostanze contenute nella dieta. Il ferro non eme viene assorbito molto meno bene, poiché il suo assorbimento è influenzato da una serie di composti contenuti nei prodotti alimentari.
Di grande importanza nel processo di assorbimento del ferro è la composizione quantitativa e qualitativa delle proteine. Gli individui con un basso apporto proteico presentano una carenza di ferro, che si spiega con il contenuto piuttosto elevato di ferro eme altamente digeribile nei prodotti proteici e con la formazione di complessi facilmente assorbibili con determinati aminoacidi con la sostanza nutritiva. L'aggiunta di prodotti animali alla dieta può aumentare di 2-3 volte l'assorbimento del ferro dalle verdure. Con una carenza proteica, l'utilizzo del ferro da parte dei globuli rossi diminuisce drasticamente, il che porta ad una diminuzione della concentrazione di emoglobina.
Gli acidi organici (citrico, malico, tartarico) si combinano con il ferro non eme formando complessi altamente solubili. Allo stesso tempo, numerosi composti contenuti nei prodotti a base di soia, tè, caffè, spinaci, latte (fitati, tannino, fosfoproteine, ossalati) formano complessi scarsamente solubili con il ferro e quindi ne inibiscono l'assorbimento.
Il ruolo dell'ipovitaminosi nello sviluppo dell'IDA è stato ben studiato. L'acido ascorbico è attivamente coinvolto nell'assorbimento del ferro non eme nell'intestino, ripristinando il ferro ferrico in una forma bivalente biodisponibile. Formando complessi chelati nell'ambiente acido dello stomaco e mantenendo una forma solubile di ferro non eme che entra nell'ambiente alcalino dell'intestino tenue, la vitamina C elimina l'effetto inibitorio dei fitati e del tannino, che creano questi complessi in un ambiente alcalino. L'utilizzo del ferro aumenta sia con l'aggiunta di acido ascorbico puro che con prodotti ad alto contenuto di esso. È stato suggerito che l'acido ascorbico sia necessario per modulare la sintesi della ferritina. L'acido ascorbico aumenta il rilascio di ferro dai macrofagi e quindi promuove l'eritropoiesi.
Una carenza di riboflavina può portare allo sviluppo di anemia. In condizioni di metabolismo alterato della riboflavina, con un aumento della sua carenza tissutale, si forma una sindrome da eccessiva perdita di ferro nelle urine, l'accumulo nel fegato diminuisce, che può essere dovuto al blocco dell'assunzione di ferro dall'intestino. La carenza di piridossina influisce sullo stato del metabolismo degli aminoacidi (lisina, istidina, metionina), specificamente coinvolti nei processi di assorbimento del ferro a livello intestinale e nella sintesi dell'emoglobina.
Importante nello sviluppo dell'anemia è una violazione del metabolismo di molti microelementi: rame, manganese, nichel, zinco, selenio, ecc. Il rame è un cofattore di vari enzimi coinvolti, incluso nel metabolismo del ferro. Studi sugli animali hanno dimostrato che la cerulloplasmina è necessaria per il trasporto del ferro mediante transferrina. Inoltre, gli ioni rame sono coinvolti nella sintesi dell'eme nei mitocondri, quindi la carenza di rame nel corpo porta ad anemia e neutropenia resistenti al trattamento con ferrofarmaci.
La carenza esogena di zinco, descritta per la prima volta da A.S. Prasad nel 1963 e chiamata malattia di Prasad, è caratterizzata dalla presenza di nanismo, ipogonadismo e IDA.
Uno degli importanti legami patogenetici delle condizioni anemiche è uno squilibrio nel sistema “perossidazione lipidica (LPO) – antiossidanti”. È stato stabilito che l'attivazione dei processi di perossidazione lipidica sullo sfondo dell'inibizione delle risorse antiossidanti del corpo accompagna quasi tutta l'anemia. Ciò, a sua volta, porta ad un aumento della distruzione della membrana e all’accumulo di prodotti tossici della perossidazione lipidica nel sangue. Il trattamento con ferrofarmaci avvia la sovrapproduzione di radicali liberi, causando stress ossidativo. L'enzima antiossidante (AOD) più biologicamente significativo è la superossido dismutasi, un enzima contenente zinco. Inoltre, avendo una valenza costante, lo zinco previene l'ossidazione dei gruppi SH da parte degli ioni ferro e rame.
Il problema del VDN acquista particolare importanza nelle regioni dove la carenza di alcuni microelementi (ad esempio il selenio) è endemica. È noto il ruolo del selenio nel garantire un'adeguata risposta da parte dell'enzima AOD grazie alla sua inclusione nella struttura della glutatione perossidasi (GPO). È stato stabilito che con l'IDA nei bambini piccoli in condizioni di carenza di selenio si verifica una violazione della composizione fosfolipidica delle membrane e una diminuzione dell'attività degli enzimi antiossidanti degli eritrociti, che porta ad un aumento della loro emolisi del perossido (Baranova T.A., 2004).
Pertanto, una delle ragioni principali per lo sviluppo dell’IDA è la cattiva alimentazione. L'alimentazione artificiale precoce dei neonati, soprattutto con formule di latte non adatte, e l'introduzione prematura di alimenti complementari predispongono alla sideropenia; deficit nella dieta di prodotti a base di carne, verdure fresche e frutta sullo sfondo della predominanza di cereali, legumi e latte nella dieta dei bambini di età superiore a un anno, mancanza di correzione nutrizionale nelle regioni in cui la carenza di singoli microelementi è endemica.
3. Le malattie del tratto gastrointestinale (gastrite, enterite, enteropatie congenite e acquisite con sindrome da malassorbimento) portano ad un ridotto utilizzo del ferro
L'IDA è preceduta da una carenza di ferro latente, asintomatica e caratterizzata da una diminuzione della quantità di ferro di riserva. Poiché il microelemento entra insufficientemente nel corpo, il ferro di riserva che entra nel sangue circolante viene consumato. Inizialmente viene utilizzata la ferritina dei macrofagi, come frazione più mobile, e poi l'emosiderina, un compartimento del ferro. Un bilancio negativo del ferro porta ad un maggiore assorbimento del microelemento nell'intestino e ad una maggiore sintesi della transferrina. Il ferro rilasciato dal compartimento di riserva aiuta a mantenere il ferro sierico a livelli fisiologici, ma la ferritina sierica diminuisce. Se la carenza di ferro non viene reintegrata, si sviluppa IDA. Secondo i pediatri russi, la frequenza della carenza di ferro latente tra i bambini nei primi due anni di vita raggiunge il 73% (Rumyantsev A.G., Chernov V.M., 2001) e la probabilità della sua transizione all'anemia è alta.
Il quadro clinico dell'IDA è costituito da due sindromi principali: anemica e sideropenica. La sindrome anemica si manifesta con pallore della pelle e delle mucose, stanchezza fisica e mentale, diminuzione delle prestazioni, tachicardia, vertigini, toni ovattati e soffio sistolico all'auscultazione del cuore. La sindrome sideropenica è caratterizzata da alterazioni distrofiche della pelle e dei suoi annessi sotto forma di perdita di capelli, fragilità, striature delle unghie, koilonychia (unghie a forma di cucchiaio) e lesioni atrofiche delle mucose dell'esofago, dello stomaco, dell'intestino, recettori del naso e della lingua, accompagnati da perversione del gusto e dell'olfatto, gengivite, stomatite angolare, disfagia, dispepsia, sindrome da malassorbimento secondario. Si osservano spesso ipotonia muscolare e dolore dovuti alla carenza di mioglobina. Va notato che i sintomi clinici delle lesioni degenerative della pelle e delle mucose del tratto gastrointestinale sono pronunciati negli adulti e nei bambini più grandi, il che è apparentemente associato a una carenza di ferro a lungo termine. In tenera età predominano disturbi dispeptici, flatulenza, perdita di appetito, difficoltà a deglutire cibi solidi, ipotonia muscolare, compreso il diaframma, che portano al prolasso del fegato e della milza, determinato alla palpazione. Nei bambini più grandi si verifica spesso una diminuzione del tono dei muscoli della vescica, che porta all'incontinenza urinaria quando si ride e si tossisce.
Diagnostica di laboratorio. 1. L'emogramma è caratterizzato da anemia ipocromica, microcitica, rigenerativa, con un numero normale o aumentato di globuli rossi all'esordio della malattia. Con la progressione della carenza di ferro e una diminuzione dell'efficienza dell'eritropoiesi, il numero di eritrociti e reticolociti diminuisce e aumenta con la ferroterapia. Quando si valuta l'emogramma eseguito utilizzando un analizzatore ematologico, si rileva una diminuzione di MCV, MCH, MCHC e un aumento significativo di RDW, tipico dell'IDA, che mostra l'anisocitosi cellulare. La resistenza osmotica degli eritrociti (ORE) è normale o aumentata.
2. Durante un esame del sangue biochimico vengono determinati i principali criteri diagnostici per VHD: il contenuto di ferritina sierica (SF) diminuisce - inferiore a 30 ng/l; il livello della capacità totale di legare il ferro del siero (TIBC) aumenta – oltre 60 µmol/l; la quantità di ferro sierico (SI) diminuisce - meno di 12,5 µmol/l e la saturazione del ferro della transferrina (TIS) - inferiore al 25%. Quando il rapporto NTG scende al di sotto del 16%, è impossibile un'eritropoiesi efficace, che è accompagnata da eritropenia e reticolocitopenia. La carenza di ferro latente viene diagnosticata sulla base di una diminuzione della concentrazione di SF e di un aumento del rapporto valore della vita totale.
3. Non è necessario un mielogramma per diagnosticare l'IDA. La morfologia delle cellule del midollo osseo con carenza di ferro è caratterizzata da iperplasia normoblastica con predominanza di normoblasti policromatofili o ossifili con una diminuzione del volume del citoplasma, con una diminuzione della percentuale di sideroblasti ed emosiderina nelle cellule fino alla sua completa assenza.
L'algoritmo diagnostico per l'anemia da carenza di ferro comprende: 1) raccolta attenta dell'anamnesi (identificazione dei fattori predisponenti alla carenza di ferro);
2) esame clinico del paziente (assenza di ittero, sindrome linfoproliferativa, epatosplenomegalia, presenza di segni di sideropenia);
3) valutazione dell'emogramma (anemia ipocromica, microcitica, rigenerativa in assenza di cambiamenti nel leucogramma, contenuto piastrinico, cambiamenti nella VES).
4) valutazione dell'effetto della terapia con ferro dopo 2-3 settimane (reticolocitosi, tendenza all'aumento dell'emoglobina).
In tutti gli altri casi viene effettuato un ambito diagnostico più ampio, volto ad escludere altre cause di condizioni anemiche.
La tabella 7 riflette i criteri diagnostici differenziali di laboratorio per l'anemia con carenza di ferro nutrizionale, disturbi del suo utilizzo e riutilizzo.
Tabella 7 Parametri di laboratorio per disturbi del metabolismo del ferro.
Nonostante la prognosi dell'IDA sia generalmente favorevole, le conseguenze della carenza di ferro compromettono la salute dei bambini e peggiorano la qualità della vita. La gastroenterocolite sideropenica porta al deterioramento dell'assorbimento del cibo e alla diminuzione dell'immunità locale. La sintesi compromessa di IL-2 è accompagnata da un aumento della frequenza delle malattie respiratorie acute con formazione di focolai di infezioni nasofaringee croniche e linfoadenopatia. La WDS porta alla depressione dell'attività delle monoaminossidasi, una diminuzione della sensibilità dei recettori D2-dopamina, un rallentamento dei processi di sviluppo motorio e mentale dei bambini, una diminuzione dell'intelligenza, un impoverimento delle emozioni e difficoltà di apprendimento a scuola.
Il trattamento inizia con la diagnosi e l’eliminazione della causa del DIV, organizzando un regime razionale e una dieta equilibrata adeguata all’età del bambino. La nutrizione ottimale per i neonati è il latte materno e l'introduzione tempestiva di alimenti complementari e, in sua assenza, formule di latte altamente adattate arricchite con proteine del siero di latte, taurina, carnitina e microelementi. Si consiglia ai bambini di età superiore a 7 mesi di includere prodotti a base di carne con contorno di verdure nella loro dieta quotidiana. Allo stesso tempo, il ferro alimentare fornisce solo il fabbisogno fisiologico giornaliero della sostanza nutritiva, ma non compensa la sua carenza.
La terapia farmacologica per IDA viene effettuata con preparati di ferro, principalmente per uso interno, poiché con la somministrazione parenterale di preparati di ferro la velocità di ripristino dei livelli di emoglobina differisce poco dalla somministrazione orale e il rischio di complicanze, compreso lo sviluppo di emosiderosi, è maggiore . Per il trattamento dei bambini piccoli vengono utilizzate solo forme di dosaggio liquide (soluzioni, sciroppi, gocce). Attualmente esistono due gruppi di preparati contenenti ferro (Tabella 8): composti non ionici rappresentati dal complesso idrossido-polimaltosio del ferro (Maltofer, Ferrum Lek) e ferro-preparati ionici, che includono sali di ferro o suoi composti polisaccaridici . Quando si sceglie un farmaco per la cura dei bambini, si dà la preferenza ai composti del ferro non ionico, che sono altamente tollerabili anche dai pazienti affetti da gastroenterocolite sideropenica, che hanno molti meno effetti collaterali rispetto a quelli ionici, a cui è associato un meccanismo diverso del loro utilizzo. I sali di ferro bivalenti hanno una buona solubilità e un'elevata dissociazione, quindi, una volta nel tratto gastrointestinale, penetrano nelle cellule mucoidi della mucosa intestinale e quindi, seguendo le leggi della diffusione, nel flusso sanguigno, dove il ferro si combina rapidamente con l'apotransferrina, che si trasforma in ferro saturo, transferrina di ferro. Nella fase successiva, sulla membrana cellulare si forma un complesso di transferrina con recettori della transferrina, che penetra nella cellula per endocitosi. Qui, il ferro viene rilasciato dalla transferrina mediante ossidazione endosomiale da parte della ferrossidasi-1 e convertito in ferro ferrico. In questa forma entra nei mitocondri e viene successivamente utilizzato per la sintesi di metalloenzimi, emoglobina, mioglobina, produzione di IL-2, ecc. Quando il ferro viene ossidato, si forma un eccesso di radicali idrossilici. Il ferro ferrico sotto forma di complesso idrossido-polimaltosio, simile all'assorbimento del substrato dell'eme direttamente dal farmaco, viene trasferito alla transferrina e alla ferritina, si lega ad esse e viene quindi depositato nei tessuti, formando un pool di ferro rapidamente venduto . La struttura chimica non ionica del ferro e il meccanismo di trasporto attivo dell'assorbimento dei microelementi proteggono il corpo dagli ioni liberi in eccesso, poiché il ferro non è soggetto ad ossidazione. Inoltre, vengono preservati i processi fisiologici di autoregolazione: quando il corpo è saturo di un microelemento, il suo riassorbimento si interrompe, obbedendo al principio di feedback, che elimina completamente la possibilità di sovradosaggio e avvelenamento.
Tabella 8 Alcuni integratori di ferro per via orale.
| Una droga | Composto | Modulo per il rilascio | Contenuto di ferro elementare |
| Maltofer | Gocce | 50 mg in 1 ml | |
| Maltofer-Fol | Complesso idrossido-polimaltosio, acido folico 0,35 mg | Pillole | 100 mg |
| Ferrum Lek | Complesso idrossido-polimaltosio | Sciroppo | 50 mg in 5 ml |
| Ferrum Lek | Complesso idrossido-polimaltosio | Compresse masticabili | 100 mg |
| Aktiferrina | Solfato ferroso, DL-serina | Capsule | 34,5 mg |
| Gocce di aktiferrina | Solfato ferroso, DL-serina | Gocce | 9,48 mg in 1 ml |
| Sciroppo di aktiferrina | Solfato ferroso, DL-serina | Sciroppo | 34 mg in 5 ml |
| Totema | Gluconato ferroso, gluconato di manganese, gluconato di rame | Soluzione | 50 mg in 5 ml |
| Sorbifer Durules | Solfato ferroso, acido ascorbico 60 mg | Pillole | 100 mg |
| Tardiferon | Solfato ferroso, mucoproteosi, acido ascorbico 30 mg | Pillole | 51 mg |
| Complesso Ferretab. | Fumarato ferroso, acido folico, 0,5 mg | Capsule | 50mg |
| Ferrogradume | Solfato ferroso | Pillole | 105mg |
| Ferrocale | Solfato ferroso, fruttosio difosfato di calcio, cerebrolecitina | Pillole | 40mg |
| Ferroplex | Solfato ferroso, acido ascorbico 30 mg | Confetto | 50mg |
| Ferronato | Fumarato ferroso | Sospensione | 10 mg in 5 ml |
| Ferronal | Gluconato ferroso | Pillole | 30 mg |
| Eferolo | Fumarato ferroso | Capsule | 100 mg |
Il regime di trattamento per l'anemia a seconda della gravità, il cui principio è che quando il livello di emoglobina si normalizza, il trattamento non viene interrotto finché non vengono ripristinate le riserve di ferro nell'organismo, è presentato nella Tabella 9. Durante i primi tre giorni, il il farmaco selezionato viene utilizzato a metà della dose. Gli esami del sangue di controllo vengono ripetuti ogni 7-10 giorni. Nei giorni 5-7 si osserva un miglioramento clinico sotto forma di aumento dell'appetito, del tono muscolare e dell'attività generale, nei giorni 7-10 appare una reticolocitosi fino al 4-8% ("crisi reticolocitaria"), si osserva una tendenza alla normalizzazione dell'emoglobina osservato alle settimane 4-5 e il recupero del SF avviene nell'arco di diverse settimane e mesi. Gli effetti collaterali che si verificano principalmente quando si usano sali di ferro includono un sapore metallico in bocca, scurimento di denti e gengive, dispepsia sotto forma di nausea, vomito, stitichezza, diarrea dovuta all'effetto irritante dei farmaci sulla mucosa dello stomaco e intestino, così come gastroenterocolite sideropenica, che complica il trattamento, dermatosi allergiche.
La somministrazione parenterale di ferrofarmaci (Venofer, Maltofer) viene attualmente effettuata solo per indicazioni, tra cui enteropatia grave con sindrome da malassorbimento, gastroenterocolite ulcerosa, condizioni dopo resezione dello stomaco e/o dell'intestino tenue, continua perdita di sangue. Prima del trattamento è necessario valutare le concentrazioni di SF, SF, TJSS e NTJ. La dose di ferro può essere calcolata utilizzando la formula: ferro iniettabile (mg) = 2,5 mg di ferro/kg di peso corporeo x deficit di emoglobina in g/dL, mentre la dose giornaliera non deve superare i 25 mg per i bambini di peso inferiore a 5 kg, 50 mg - per bambini di peso compreso tra 5 e 10 kg e 100 mg - per bambini di peso compreso tra 10 e 20 kg.
L'avvelenamento acuto con sali di ferro si verifica in caso di sovradosaggio e si manifesta nelle prime 6 - 8 ore con dolore epigastrico, nausea, vomito con sangue, diarrea, melena dovuta a necrosi emorragica della mucosa del tratto gastrointestinale, nonché collasso vascolare . Acidosi metabolica, convulsioni, shock e coma si sviluppano entro 12-24 h. Dopo 2 - 4 giorni compare la necrosi renale ed epatica. L’avvelenamento da sale di ferro è una condizione estremamente grave con elevata mortalità. Le cure d'urgenza consistono nella lavanda gastrica, nell'uso di emetici, di sostanze che legano il farmaco (latte con albume), nella somministrazione intramuscolare di desferal 1 - 2 g ogni 3 -12 ore fino all'eliminazione dell'intossicazione, ma non più di 6 g al giorno , contrastando il collasso, lo shock, l'acidosi.
Nella terapia complessa dell'IDA è indicato l'uso di retinolo, acido ascorbico e riboflavina. Quando si prescrivono sali di ferro per il trattamento di bambini affetti da IDA moderata e grave, sono indicati gli antiossidanti: vitamine A, E, C, preparati contenenti selenio. Nelle regioni endemiche con carenza di selenio, la carenza di selenio viene corretta con una dose giornaliera di 50 mcg.
Le trasfusioni di sangue non sono raccomandate, poiché i pazienti sono generalmente adattati all'anemia. Le trasfusioni di globuli rossi in una dose di 5 - 10 ml/kg di peso corporeo vengono effettuate quando l'emoglobina diminuisce al di sotto di 60 g/l, accompagnata da compromissione dell'emodinamica centrale, precoma anemico, grave ipossia.
I bambini affetti da IDA sono sottoposti a osservazione dispensaria, da cui vengono allontanati un anno dopo la normalizzazione dei parametri clinici e di laboratorio. La vaccinazione viene effettuata quando il livello di emoglobina sale a 110 g/l.
La prevenzione dell'IDA consiste nel garantire il decorso fisiologico della gravidanza, la diagnosi tempestiva e il trattamento dell'IDA nella futura mamma, il mantenimento dell'allattamento al seno fino a 1 - 1,5 anni, l'introduzione tempestiva di alimenti complementari, l'alimentazione razionale dei bambini di età superiore a un anno e la dinamica monitoraggio dei parametri ematologici. La prevenzione specifica dell'IDA viene effettuata nel gruppo a rischio per la formazione di carenza di ferro, che comprende donne ripetutamente incinte; bambini le cui madri hanno sofferto di gestosi nella seconda metà della gravidanza, malattie croniche, anemia, neonati prematuri, gravidanze multiple; bambini piccoli che seguono una dieta squilibrata, hanno perdite di sangue e vivono in regioni ambientalmente sfavorevoli; ragazze della pubertà. Ai fini della prevenzione specifica dell'IDA nei bambini piccoli, si raccomanda alle donne dalla 20a settimana di gravidanza fino alla fine dell'allattamento al seno di assumere integratori di ferro ad azione prolungata alla dose di 100 mg/die in combinazione con vitamine, acido folico (Tardiferon , Ferrogradumet, Fesovit, Hemofer prolongatum, ecc.), nelle regioni carenti di selenio - preparati di selenio. Si consiglia ai bambini che non ricevono latte materno di assumere ferrofarmaci non ionici alla dose di 2 mg/kg di peso corporeo al giorno per 6 mesi a partire dall'età di tre mesi e, per i neonati prematuri provenienti da gravidanze multiple, fino alla fine del periodo primo anno di vita. | | | | | | | | | | | |
INTRODUZIONE
Cari colleghi!
La formazione degli studenti presso una facoltà di medicina (scuola) termina con una certificazione finale, che comprende questioni di pediatria con infezioni infantili. Questo manuale ti aiuterà a prepararti per la prossima certificazione.
Quando ti prepari per la certificazione dovresti:
1. Metti alla prova le tue conoscenze rispondendo alle attività del test in tutte le sezioni e confronta le tue risposte con gli standard. Utilizza i criteri per valutare le tue conoscenze
91-100% delle risposte corrette - "eccellente";
L'81-90% delle risposte corrette sono “buone”;
71-80% delle risposte corrette - "soddisfacente";
Il 70% o meno delle risposte corrette sono “insoddisfacenti”.
2. Se il voto è insoddisfacente, il materiale didattico dovrebbe essere rielaborato.
3. Ripetere la risoluzione delle attività di test.
Ti auguriamo successo!
Requisiti dello standard educativo statale
al livello di formazione degli specialisti nel campo della pediatria
con infezioni infantili per la specialità 0401 "Medicina generale"
Il paramedico deve:
- Sapere: principali manifestazioni cliniche delle singole forme nosologiche, caratteristiche del loro decorso; nozioni di base della comunicazione deontologica con il bambino malato e i parenti; standard passo-passo per fornire assistenza medica ai bambini; metodi di prevenzione delle principali malattie infantili; fasi dello screening neonatale;
- essere in grado di: raccogliere l'anamnesi; condurre un esame obiettivo; diagnosticare patologie infantili; determinare le tattiche di gestione del paziente; fornire assistenza di emergenza; raccogliere materiale per ricerche di laboratorio e valutare i risultati; preparare la documentazione medica; calcolare la dose dei farmaci per il trattamento delle principali malattie; effettuare una diagnosi rapida per l'ipervitaminosi D e il diabete mellito;
- Proprio competenze: prendersi cura di bambini affetti da varie malattie; esecuzione di manipolazioni: iniezioni intradermiche, sottocutanee, intramuscolari, endovenose; posizionare tazze, cerotti di senape, applicare impacchi; misurazione della temperatura corporea; preparazione e conduzione di clisteri medicinali e purificanti, bagni medicinali; lavanda gastrica e intubazione gastrica e duodenale; conteggio della frequenza cardiaca e dei movimenti respiratori; misurazione della pressione sanguigna; instillare gocce nel naso, negli occhi, nelle orecchie; effettuare ossigenoterapia e inalazioni di paraossigeno; utilizzando tabelle centili.
TEST DI SICUREZZA
1. Quando si forniscono cure di emergenza a un bambino con il tipo "rosa" di sindrome ipertermica, è controindicato
a) riscaldamento
b) utilizzo dell'ipotermia craniocerebrale
c) applicare un impacco di ghiaccio sull'area delle grandi navi
d) frizionare la pelle con una soluzione di alcol etilico al 40-50%.
2. L'insieme dei farmaci di emergenza per la laringotracheite stenosante comprende:
a) tintura di termopsi
b) tintura di valeriana
c) prednisolone, idrocortisone
d) vikasol
3. Il principale farmaco antipiretico nella pratica pediatrica, utilizzato per combattere la sindrome ipertermica
a) analgin
b) paracetamolo
c) pipolfen
d) baralgina
4. Decisivo nelle cure d'emergenza per la vera groppa è l'introduzione
a) antibiotico
b) siero antidifterico secondo Bezredko
c) vaccino contro la difterite
d) tossoide
5. Per alleviare la sindrome convulsiva nei bambini, utilizzare
a) difenidramina per via intramuscolare
b) compresse di fenobarbital
c) compresse di seduxen
d) seduxen IM o IV
6. Lo shock anafilattico nei bambini si verifica più spesso dopo l'iniezione
a) penicillina
b) insulina
c) integratori di ferro
d) vitamina B1
7. Quando si forniscono cure di emergenza a un bambino con shock anafilattico, è necessario fornirgli cure
a) posizione orizzontale sul lato, copertura con termofori
b) posizione semiseduta, copertura con termofori
c) posizionarsi con la testa abbassata, applicare un impacco di ghiaccio sulla testa
d) posizione seduta, applicare un impacco di ghiaccio sulla testa
8. I mezzi più efficaci per alleviare lo shock anafilattico in un bambino
a) adrenalina, prednisolone
b) papaverina, dibazolo
c) aminofillina, efedrina
d) lasix, solfato di magnesio
9. Quando si forniscono cure di emergenza a un bambino in coma iperglicemico (diabetico), utilizzare
a) insulina
b) penicillina
c) biseptolo
d) furagina
10. Quando si forniscono cure di emergenza a un bambino in coma ipoglicemico, utilizzare una soluzione
a) cloruro di sodio
b) emodesi
c) novocaina
d) glucosio
Risposte standard
| 1.a | 2. nel | 3.b | 4.b | 5. g | 6.a | 7.a | 8.a | 9.a | 10. g |
ORGANIZZAZIONE DEL TRATTAMENTO E DELLA CURA PREVENTIVA PER I BAMBINI
AL CENTRO FEDERALE E MIDWARE
Organizzazione del lavoro di un paramedico presso una FAP
1. Frequenza delle cure prenatali da parte di un paramedico
2. La prima assistenza prenatale viene eseguita da un paramedico durante la gravidanza fino a (settimana)
3. La seconda assistenza prenatale viene eseguita da un paramedico durante la gravidanza fino a (settimana)
4. Il patrocinio di un neonato viene effettuato da un paramedico
a) una volta alla settimana
b) 2 volte a settimana
c) una volta al mese
d) 2 volte al mese
5. La tutela dei bambini di età compresa tra 1 e 2 anni è effettuata da un paramedico
a) 1 volta al mese.
b) 1 volta ogni 2 mesi.
c) 1 volta ogni 3 mesi.
d) una volta ogni 6 mesi.
6. I bambini sani con sviluppo fisico e neuropsichico normale, che non presentano patologie croniche, appartengono al gruppo sanitario
7. Al gruppo sanitario appartengono i bambini con difetti congeniti dello sviluppo o con patologie croniche in fase di compensazione
8. Appartengono al gruppo sanitario i bambini con gravi malformazioni congenite o gravi patologie croniche in fase di scompenso
9. La tessera vaccinale preventiva è un modulo
10. La storia dello sviluppo di un bambino è una forma
Risposte standard
| 1. b | 2.a | 3. g | 4.a | 5. dentro | 6.a | 7.b | 8. g | 9. pollici | 10.a |
Fasi e periodi dell'infanzia
CARATTERISTICHE ANATOMICHE E FISIOLOGICHE DEGLI ORGANI E SISTEMI DEL BAMBINO
1. La durata del periodo di sviluppo intrauterino è (in settimane di gravidanza)
2. La durata del periodo neonatale è (in mesi)
3. Il neonato ha caratteristiche fisiologiche
a) ipertensione dei muscoli estensori
b) ipertensione dei muscoli flessori
c) ipotonia dei muscoli flessori
d) tono muscolare normale
4. La grande fontanella in un bambino si chiude all'età di (mesi)
5. La cifosi toracica si verifica in un bambino di età compresa tra (mesi)
6. Numero di denti da latte in un bambino di 1 anno
7. Le ghiandole sebacee iniziano a funzionare con l'avanzare dell'età.
a) nell'utero
8. La capacità della vescica di un neonato è (in ml)
9. Il vocabolario di un bambino di un anno lo è
10. Il bambino riconosce sua madre, la distingue dalle altre persone per età
11. L'organo di senso meno sviluppato in un neonato
una visione
b) toccare
12. Il bambino inizia a camminare man mano che invecchia
b) 11-12 mesi
c) 13-14 mesi
d) 15-16 mesi
14. Il numero normale di linfociti in un neonato è (in%)
15. Il numero normale di neutrofili in un bambino è (in%)
16. Lo spessore dello strato di grasso sottocutaneo a livello dell'ombelico in tenera età è
17. Frequenti malattie purulente e fungine ricorrenti, infezioni del tratto respiratorio superiore nei bambini sono manifestazioni
a) ipovitaminosi
b) nutrizione in eccesso
c) immunodeficienza
d) surriscaldamento
18. Termina la sostituzione dei denti da latte con quelli permanenti
a) entro 3-4 anni
b) 5-7 anni
c) 11-12 anni
d) 13-14 anni
Risposte standard
| 1. g | 2.a | 3.b | 4. dentro | 5B | 6. dentro | 7.a | 8.a | 9. pollici | 10.a |
| 11.a | 12.b | 13.a | 14 g | 15.b | 16.b | 17. a | 18. dentro |
NUTRIZIONE PER UN BAMBINO SANO
1. Per un bambino del primo anno di vita è preferibile provvedere all'alimentazione
a) naturale (seno)
b) misto
c) artificiale
d) parenterale
2. Il vantaggio del latte materno rispetto al latte vaccino
a) alto contenuto proteico
b) alto contenuto di vitamine
c) alto contenuto calorico
d) rapporto ottimale dei nutrienti
3. Viene effettuato il primo allattamento al seno di un neonato sano a termine
a) dopo 2-3 ore
b) immediatamente dopo la nascita
c) dopo 6-8 ore
d) dopo 10-12 ore
4. Tipi di alimentazione supplementare per un bambino
a) miscela adattata
c) purea di verdure
d) ricotta
5. L'alimentazione di controllo del bambino viene effettuata per determinare
a) peso corporeo
b) la quantità di latte succhiato
c) quantità di alimenti complementari
d) quantità di mangime supplementare
6. La frequenza delle poppate per un bambino è di 3 mesi. durante il giorno con l'alimentazione artificiale
7. L'intervallo per 5 poppate al giorno è (all'ora)
8. La carne sotto forma di cotoletta al vapore viene introdotta nel menu del bambino fin dall'età
9. Volume giornaliero di latte per i bambini nei primi 10 mesi. la vita non supera (l)
10. Viene chiamata la ridotta capacità secretoria delle ghiandole mammarie
a) ipogalassia
b) galattorrea
c) agalassia
d) mastite
11. Il tuorlo d'uovo viene introdotto entro un periodo di tempo (mesi)
12. La ricotta viene introdotta nella dieta di un bambino dall'età (mese)
13. I succhi di frutta vengono somministrati a un bambino della prima metà dell'anno
a) prima dell'allattamento al seno
b) dopo l'allattamento
c) tra un allattamento e l'altro
d) solo di notte
14. Succhi di frutta e salsa di mele vengono introdotti nella dieta del bambino per fornirgli il necessario nutrimento
a) proteine
b) grassi
15. Il tuorlo d'uovo viene dato a un bambino per provvedere
a) proteine
b) carboidrati
c) vitamine idrosolubili
d) vitamine liposolubili
16. L'introduzione di nuovi alimenti che sostituiscano gradualmente l'allattamento al seno è
a) alimentazione supplementare
b) alimenti complementari
c) alimentazione artificiale
d) alimentazione mista
17. Scopo dell'introduzione di alimenti complementari
a) soddisfare il crescente fabbisogno di nutrienti
b) soddisfare il fabbisogno di grassi
c) soddisfare il fabbisogno di carboidrati
d) soddisfare il fabbisogno di sale da cucina
18. Il primo alimento complementare per un bambino con peso normale è
a) succo di frutta
b) purea di verdure
c) porridge di latte
19. Dovrebbe essere somministrata un'alimentazione supplementare con latte artificiale
a) prima dell'allattamento al seno
b) tra un allattamento e l'altro
c) dopo l'allattamento
d) non ha importanza
20. Il secondo alimento complementare per un neonato è
a) succo di frutta
b) purea di verdure
c) porridge di latte
21. La temperatura della formula durante l'alimentazione artificiale dovrebbe essere
22. La carne macinata viene introdotta nella dieta di un bambino all'età (mesi)
23. Il terzo alimento complementare viene somministrato a un neonato di età (mesi)
24. Il terzo alimento complementare per un neonato è
a) succo di frutta
b) purea di verdure
a) durante la stagione calda
b) nella stagione fredda
c) per malattie
d) durante le vaccinazioni preventive
26. Durante l'alimentazione artificiale, il latte umano viene utilizzato come sostituto
a) succhi di frutta
b) purea di verdure
c) purea di frutta
d) alimenti per lattanti
27. Un segno di sottoalimentazione di un bambino è
a) basso aumento di peso
b) minzione frequente
c) feci abbondanti
d) febbre
28. Fattori che contribuiscono all'atto di succhiare
a) Bisha grumi, lingua grande
b) Bisha grumi, lingua piccola
c) salivazione abbondante, lingua larga
d) salivazione abbondante, lingua piccola
29. La capacità gastrica di un neonato è (in ml)
30. La tendenza dei bambini a rigurgitare è dovuta a
a) scarso sviluppo dello sfintere cardiaco
b) buon sviluppo dello sfintere cardiaco
c) scarso sviluppo dello sfintere pilorico
d) buon sviluppo dello sfintere pilorico
31. Durante l'alimentazione naturale, l'intestino del bambino è dominato da
a) bifidobatteri
b) Escherichia coli
c) lattobacilli
d) enterococchi
32. Durante l'alimentazione artificiale, nell'intestino del bambino predominano:
a) bifidobatteri, lattobacilli
b) Escherichia coli, enterococchi
c) stafilococchi, pneumococchi
d) Proteo, Pseudomonas aeruginosa
a) restrizione dei liquidi
b) restrizione proteica
c) assumere il liquido 20 minuti prima dell'alimentazione
d) assumere le spezie 20 minuti prima dell'alimentazione
34. Indicazioni per trasferire un bambino all'alimentazione artificiale
a) perdita spontanea di latte
b) mancanza di latte
c) difficoltà a rilasciare il latte
d) flusso rapido del latte
35. Indicazioni per introdurre un'alimentazione supplementare al bambino
a) ipogalassia
b) paratrofia
c) rigurgito
d) disfagia
36. Le miscele dolci adattate includono
a) “Bona”
b) Narine
c) 2/3 latte vaccino
d) kefir intero
37. Cominciano a dare alimenti complementari al bambino
a) prima dell'allattamento al seno
b) dopo l'allattamento
c) sostituire completamente un allattamento al seno
d) tra un allattamento e l'altro
38. Lo scopo di introdurre un'alimentazione supplementare per un bambino è quello di garantire
a) mancanza di nutrienti
b) aumentare l'assunzione di sale da cucina
c) ridurre l'assunzione di sale da cucina
d) aumentare l'assunzione di grassi
Risposte standard
| 1.a | 2. g | 3.b | 4.a | 5B | 6.a | 7.b | 8.a | 9.b | 10.a |
| 11. dentro | 12. pollici | 13.b | 14. dentro | 15.g | 16.b | 17.a | 18.b | 19. a | |
| 20. pollici | 21.g | 22.a | 23.g | 24.g | 25. b | 26.g | 27.a | 28.a | 29.a |
| 30.a | 31.a | 32. b | 33. dentro | 34.b | 35.a | 36.a | 37.a | 38.a |
NEONATO E CURA DI LUI
1. Un bambino nato in età gestazionale (a settimana) è considerato a termine.
2. Il peso corporeo medio di un neonato a termine è (in g)
3. La lunghezza corporea media di un neonato a termine è (in cm)
4. Il cordone ombelicale scompare in un neonato a termine (giorno di vita)
5. Per prevenire l'oftalmoblennorrea, viene utilizzata una soluzione
a) furatsilina
b) cloruro di sodio
c) solfacile di sodio
d) poliglucina
6. La perdita iniziale di peso corporeo di un neonato si osserva nei primi (giorni di vita)
7. La diminuzione fisiologica del peso corporeo di un neonato è fino a (in%)
8. La durata dell'eritema fisiologico in un neonato è (giorni)
9. La crisi sessuale in un neonato si manifesta:
a) aumento della temperatura corporea
b) aumento del peso corporeo
c) ghiandole mammarie ingrossate
d) diminuzione della temperatura corporea
10. Le manifestazioni di crisi sessuale in un neonato scompaiono dopo
a) 2-3 giorni
b) 1-2 settimane
c) 5-6 giorni
d) 5-6 settimane
11. L'ittero fisiologico in un neonato a termine scompare a termine (giorni di vita)
12. La temperatura dell'aria nel reparto neonatale dovrebbe essere (in gradi C.)
13. Per prevenire l'irritazione da pannolino, vengono trattate le pieghe della pelle del neonato
a) olio vegetale sterile
b) soluzione salina
c) soluzione di furatsilina
d) soluzione di poliglucina
14. Il cordone ombelicale di un neonato viene trattato quotidianamente con una soluzione
a) alcool etilico 70%, permanganato di potassio 5%.
b) 70% alcool etilico, 5% iodio
c) alcool etilico 90%, permanganato di potassio 3%.
d) 90% alcool etilico, 3% iodio
15. La ferita ombelicale di un neonato viene trattata con una soluzione:
a) Bicarbonato di sodio al 2%.
b) Perossido di idrogeno al 3%.
d) Cloruro di sodio al 5%.
16. Per pulire i passaggi nasali di un neonato, utilizzare
a) cotone idrofilo asciutto
b) tamponi di cotone asciutti lubrificati con olio sterile
c) batuffoli di cotone
d) palline di garza
17. Per pulire i canali uditivi esterni nei bambini piccoli, utilizzare
a) cotone idrofilo asciutto
b) flagelli lubrificati con olio sterile
c) batuffoli di cotone
d) palline di garza
18. Viene trattata la cavità orale di un neonato sano
a) un batuffolo di cotone
b) un batuffolo di garza di cotone
c) palla di garza
d) non trattati
19. La temperatura dell'acqua per un bagno igienico per un neonato è
a) 25 gradi C
b) 30 gradi C
c) 37 gradi C
d) 40 gradi C
20. La durata di un bagno igienico per un neonato è (in minuti)
Risposte standard
| 1. g | 2. nel | 3. dentro | 4. dentro | 5. dentro | 6.b | 7.a | 8.a | 9. pollici | 10.b |
| 11. dentro | 12. pollici | 13.a | 14.a | 15.b | 16.b | 17.a | 18.g | 19. a | 20.b |
MALATTIE DELL'INFANZIA
Malattie dei bambini piccoli
BAMBINI PREMATURI
1. Un bambino è prematuro all'età gestazionale (settimane)
2. Periodo di gestazione per prematurità di primo grado (settimane)
d) inferiore a 29
3. Un neonato prematuro ha
a) forte grido
b) ipertonicità muscolare
c) ipotonia muscolare
d) attività motoria spontanea
4. L'edema del tessuto sottocutaneo nei neonati prematuri è
a) lanugine
b) stridore
c) scleema
5. Il portale d'ingresso più comune per la sepsi neonatale
a) rinofaringe
b) congiuntiva
c) tratto digestivo
d) ferita ombelicale
6. Il kernittero nel neonato è causato da alti livelli di
b) bilirubina
c) glucosio
d) colesterolo
7. Malattia della pelle infettiva di un neonato
a) caldo pungente
b) pemfigo
c) dermatite da pannolino
d) eritema
8. Criteri per il passaggio di un neonato prematuro dall'alimentazione enterale all'alimentazione artificiale
a) la comparsa di un riflesso di suzione
b) aumento di peso
c) aumento delle masse informi di Bisha
d) scomparsa della dispepsia fisiologica
9. L'alimento ideale per i bambini prematuri è
b) "Narino"
c) kefir intero
d) latte materno
10. Per il trattamento e la cura dell'eritema da pannolino lacrimante, si raccomanda
a) trattamento con soluzione di iodio al 2%.
b) lozioni con soluzione di resorcinolo allo 0,5-1%.
c) Soluzione al 2% di verde brillante
d) Soluzione di permanganato di potassio al 5%.
ASPISSIA DEL NEONATO
11. L'asfissia lieve di un neonato è caratterizzata dalla scala Apgar (in punti)
12. Cause comuni di ipossia fetale
a) anemia di una donna incinta
b) precedenti aborti
c) errori nella dieta della donna incinta
d) lesioni meccaniche
13. La prima fase di rianimazione per asfissia di un neonato
a) ventilazione artificiale
b) massaggio cardiaco chiuso
c) correzione dei disturbi metabolici
d) ripristino della pervietà delle vie aeree
14. Seconda fase di rianimazione per asfissia del neonato
a) ripristino della pervietà delle vie aeree
b) ripristino della respirazione esterna
c) correzione dei disturbi emodinamici
d) correzione dei disturbi metabolici
LESIONI ALLA NASCITA
15. La principale causa di lesioni alla nascita al sistema nervoso centrale nei bambini
a) ipossia
b) ipercapnia
c) ipoproteinemia
d) iperglicemia
16. Porta direttamente al verificarsi di traumi alla nascita nei bambini
a) discrepanza tra le dimensioni della testa del feto e del bacino della madre
b) disturbo cromosomico
c) disturbo del metabolismo proteico
d) iperglicemia
17. Il cefaloematoma esterno è un'emorragia
a) nei tessuti molli della testa
b) sopra la dura madre
c) sotto la dura madre
d) sotto il periostio
18. Per ridurre l'edema cerebrale durante le lesioni alla nascita, viene utilizzato il sistema nervoso centrale
a) eparina
b) poliglucina
c) furosemide
d) prednisolone
19. Per mantenere l'attività cardiaca in un bambino con una lesione alla nascita, viene utilizzato il sistema nervoso centrale
a) ipotiazide
b) glucosio
c) prednisolone
Malattie dell'infanzia e della prima infanzia.
Tra le malattie dell'infanzia e della prima infanzia rivestono particolare importanza la distrofia, l'anemia, la diatesi, le malattie ereditarie (fibrosi cistica, galattosemia, celiachia), il rachitismo, la spasmofilia, ecc.
Distrofia.
Distrofia, disturbo cronico della nutrizione e del trofismo tissutale. Si distinguono le seguenti forme di distrofia: malnutrizione, malattie da carenza proteico-energetica, ipovitaminosi, paratrofia, obesità, ipervitaminosi. I principali sintomi della distrofia: diminuzione del turgore dei tessuti, cambiamenti nello spessore della base sottocutanea e nella sua distribuzione, cambiamenti nel peso corporeo e negli indicatori peso-altezza, ritardo nello sviluppo neuropsichico e motorio, diminuzione del tono emotivo, cambiamenti nella tolleranza alimentare (diminuzione, aumento dell'appetito, segni, disturbi della digeribilità), diminuzione della resistenza generale del corpo.
L'ipotrofia può essere congenita e acquisita.
Se il deficit di peso corporeo è pari al 10-20% della norma, viene fatta una diagnosi di malnutrizione di primo grado di gravità. Clinicamente, l'assottigliamento del tessuto sottocutaneo sull'addome è determinato da condizioni generali soddisfacenti, appetito preservato e funzionalità dell'apparato digerente. L'ipotrofia di secondo grado è caratterizzata da un ritardo di peso del 20-30%, dalla scomparsa del tessuto sottocutaneo sull'addome, sul torace e dal suo assottigliamento sui fianchi e sugli arti, feci instabili e ridotta attività degli enzimi digestivi della cavità.
Con l'ipotrofia di grado III, i segni di distrofia sono chiaramente espressi (perdita di peso superiore al 30% della norma), mancanza di tessuto sottocutaneo su tutto il corpo, compreso il viso, e feci "affamate". L'ipoproteinemia e l'anemia da carenza sono pronunciate. Una caratteristica dei bambini con malnutrizione di II e III grado è una forte diminuzione della formazione di enzimi e tolleranza alimentare, disordini metabolici, aumento dell'acidosi, sviluppo di cambiamenti morfologici nella mucosa del tratto digestivo, disbatteriosi, emodinamica disturbi, disturbi del sistema immunitario e di altri sistemi corporei. Nei bambini con malnutrizione di II e III grado si sviluppano facilmente malattie infettive e infiammatorie che hanno un decorso atipico.
Trattamento della distrofia.
Il trattamento della malnutrizione si basa sull'uso di una dieta razionale: per la malnutrizione stadio I. transizione rapida a una dieta nutriente in base all'età, nelle fasi II e III. nutrizione terapeutica frazionata, secondo indicazioni, viene fornita nutrizione parenterale ed enterale, vengono prescritti enzimi e farmaci gastrici e intestinali, stimolanti e vitamine. Trattamento di bambini con ipotrofia di II e soprattutto di III grado. processo lungo e continuo. Inizia in ospedale e, con dinamiche positive con aumento del peso corporeo, continua a casa. I criteri per l'efficacia del trattamento sono un aumento soddisfacente del peso corporeo al raggiungimento dei valori di età, un buon tono emotivo del bambino, condizioni soddisfacenti della pelle e dei tessuti e nessun cambiamento negli organi interni.
L'anemia nei neonati si verifica a causa di un apporto insufficiente o di un ridotto assorbimento delle sostanze necessarie per la costruzione della molecola dell'emoglobina. Circa il 90% dell'anemia infantile è classificata come anemia da carenza, inclusa la carenza di ferro, che viene diagnosticata nel 40% dei bambini nei primi due anni. L'insorgenza della malattia è facilitata dall'insufficiente apporto di ferro, proteine e vitamine dal cibo a causa di una cattiva alimentazione o del digiuno. La causa della malattia può essere malattie intestinali che interferiscono con l'assorbimento del cibo (celiachia, malassorbimento, ecc.). I fattori predisponenti includono la prematurità, la malnutrizione, il rachitismo e l'alimentazione artificiale precoce.
L'anemia si sviluppa gradualmente. Sintomi caratteristici: pelle pallida, letargia del bambino, appetito diminuito o pervertito, diminuzione del tono emotivo. Si notano cambiamenti trofici nella pelle: secchezza, ruvidità, iperpigmentazione o depigmentazione, aumento della fragilità o perdita dei capelli, assottigliamento delle unghie e loro pronunciata fragilità. Si osservano anche atrofia delle papille della lingua e stomatite angolare.
Dal lato del cuore: tachicardia, soffio sistolico sopra l'apice e nel punto di proiezione dell'arteria polmonare, suoni ovattati. Quadro ematico diminuzione dell'emoglobina (norma fino a 5 anni 10,9 mmol/l; dopo 5 anni -11,9 mmol/l) e in misura minore dei globuli rossi, indice cromatico inferiore a 0,8, emosideropenia, aumento della capacità totale del siero di legare il ferro . In altre anemie da carenza si rileva una diminuzione dei livelli di proteine sieriche e si riscontrano megalociti nel sangue periferico. L'anemia da carenza deve essere differenziata da altri tipi di anemia (postemorragica, emolitica, rigenerativa, ecc.).
Trattamento dell'anemia.
Il trattamento consiste in un'alimentazione nutriente e adeguata all'età e nella nomina di un regime appropriato, nella somministrazione di integratori di ferro se ben tollerati per via orale. Nei casi di intolleranza alla somministrazione enterale e nei casi più gravi, gli integratori di ferro vengono somministrati per via parenterale. Allo stesso tempo vengono prescritte vitamine e microelementi. La dose giornaliera di integratori di ferro può essere calcolata utilizzando la formula: Fe = P(78 0,35 x Hb), dove P peso corporeo, kg; Livello effettivo di emoglobina Hb, g/l; Fe quantità totale di ferro in mg che deve essere somministrata per ciclo di trattamento. Per evitare effetti collaterali, a volte è necessario iniziare il trattamento con la metà o un terzo della dose ottimale per ciascuna età.
La prevenzione inizia nel periodo prenatale, prescrivendo vitamine e microelementi alle donne incinte. La prevenzione postnatale si basa sulle caratteristiche costituzionali del bambino. Ai bambini prematuri e ai nati da gravidanze multiple affetti da diatesi allergica da 2 mesi a 1 anno viene prescritta la ferroprofilassi (2 mg/kg al giorno).
Il rachitismo (carenza di vitamina D) è una malattia di un organismo in rapida crescita, osservata principalmente nei bambini del 1o, meno spesso del 2o anno di vita, causata dalla mancanza di vitamina D e dei suoi metaboliti, da un alterato metabolismo del fosforo-calcio e dalla mineralizzazione del l'osso appena formato. Il rachitismo è essenzialmente una malattia generale del corpo, caratterizzata da una varietà di cambiamenti morfofunzionali in vari organi e sistemi, che, sullo sfondo di questa patologia, provoca una maggiore frequenza e un aggravamento del decorso delle malattie dell'apparato respiratorio, della digestione, dell'anemia, diatesi, ecc.
Condizioni patologiche. La prevalenza, le forme e la gravità del rachitismo dipendono dalle condizioni climatiche e dalle condizioni di vita del bambino. L'incidenza del rachitismo è elevata a causa della mancanza di alimentazione e di cure nei neonati prematuri, con ritardo della crescita intrauterina, profonda immaturità degli organi endocrini e dei sistemi enzimatici, nei bambini che hanno subito lesioni cerebrali legate alla nascita e altri tipi di patologie perinatali.
I principali segni di rachitismo: sindrome da disturbo del metabolismo del fosforo-calcio e sindrome ipocinetica. Le manifestazioni precoci a 2-3 mesi sono associate a disfunzione del sistema nervoso sullo sfondo di un ridotto contenuto di fosforo (irrequietezza, sudorazione, lieve eccitabilità in risposta a stimoli lievi), ammorbidimento delle suture e dei bordi della fontanella e distonia muscolare. notato. Dopo 2-3-6 settimane inizia l'altezza del rachitismo, che è caratterizzata da disturbi vegetativi neuromuscolari più pronunciati, il bambino diventa letargico, inattivo, si osserva ipotonia dei muscoli e dei legamenti, si sviluppano distinti cambiamenti nello scheletro (craniotabe, appiattimento dell'occipite, cambiamenti nella configurazione del torace, comparsa di tubercoli frontali e parietali, ispessimenti nella zona del polso (bracciali). La diagnosi consiste nell'effettuare una radiografia delle ossa tubulari (determinazione dell'osteoporosi, offuscamento e indistinzione delle zone di calcificazione). L'ipocalcemia è pronunciata nel sangue (2,0-2,5 mmol/l o meno). Secondo la gravità del decorso, il rachitismo è classificato in I (lieve), II e III.
Trattamento del rachitismo.
Il trattamento viene effettuato con preparati di vitamina D (specifici) sulla base di una buona alimentazione e regime, antilipoxanti (pangamato di potassio, tocoferolo acetato), adattogeni (acido ascorbico e vitamine del gruppo B, dibazolo, acido glutammico), allenamento fisico (terapia fisica, massaggio , nuoto, ecc.).
Prevenzione del rachitismo.
La prevenzione inizia anche nel periodo prenatale attraverso l'uso di vitamine, ergocalciferolo 500 mg al giorno; nel periodo postnatale vengono utilizzate misure preventive aspecifiche (alimentazione, massaggio, ginnastica, rassodamento, sufficiente esposizione all'aria fresca in inverno, irradiazione UV per 10 -15 sessioni).
La diatesi è un'anomalia costituzionale caratterizzata da una predisposizione a determinate malattie o reazioni inadeguate agli stimoli comuni. La diatesi è considerata una condizione in cui il corpo possiede proprietà individuali (ereditate, congenite o acquisite) che lo predispongono a reazioni patologiche agli stimoli esterni, ad alcune malattie e al loro decorso più grave. Una particolarità del corpo dei bambini con diatesi è uno stato di equilibrio instabile dei processi immunitari, neurovegetativi e metabolici, che è alla base di risposte inadeguate a varie influenze esterne e provoca una violazione dell'adattamento alle condizioni ambientali esistenti.
I bambini affetti da diatesi costituiscono la maggior parte della popolazione e spesso soffrono di varie malattie infettive, per cui sono classificati nel gruppo sanitario II. Sotto l'influenza di malattie infettive, situazioni stressanti, influenze ambientali (cattiva alimentazione e regime), la diatesi come condizioni limite si trasformano spesso in malattie ricorrenti del sistema respiratorio, digestivo, epatobiliare, malattie diffuse del tessuto connettivo, dei reni e della pelle.
Si distinguono i seguenti tipi di diatesi:
essudativo-catarrale, linfatico-ipoplastico;
neuroartritico (acido urico, urinamico);
allergico ed emorragico.
La diatesi essudativa-catarrale si basa su anomalie nel metabolismo e cambiamenti ereditari determinati in alcuni sistemi enzimatici, che creano una maggiore ritenzione di sodio, cloro, potassio e acqua nel corpo. I bambini affetti da diatesi essudativo-catarrale sono caratterizzati da una tendenza all'acidosi dovuta all'accumulo di acido urico e di prodotti metabolici sottoossidati, che provoca infiammazione essudativo-catarrale della pelle (dermatite) e delle mucose, lo sviluppo di reazioni allergiche e la decorso prolungato dei processi infiammatori.
Come con la diatesi allergica, esiste una predisposizione a qualsiasi reazione allergica a cibo, medicinali, vaccini, punture di insetti, ecc. La diagnosi di diatesi di questo tipo si basa su cambiamenti caratteristici della pelle e delle mucose, distinti disturbi metabolici e immunologici, immunogramma dati e test allergici.
Diatesi linfatico-ipoplastica o linfatica.
La diatesi linfatico-ipoplastica, o linfatica, è caratterizzata da iperplasia diffusa del tessuto linfoide, nella maggior parte dei casi con simultaneo ingrossamento del timo, ipoplasia di alcuni organi interni, disfunzione endocrina, a seguito della quale la reattività cambia bruscamente, diminuisce la resistenza alle infezioni, e si crea una predisposizione ad un percorso lungo e complicato.
La diatesi linfatica è più comune nei bambini i cui genitori e parenti soffrono di malattie allergiche. I bambini con diatesi linfatica sviluppano facilmente malattie del tratto respiratorio superiore (rinite, faringite, bronchite). Durante le malattie infiammatorie dell'apparato respiratorio si sviluppano la sindrome ostruttiva e la neurotossicosi. Nelle infezioni virali acute (influenza), in situazioni di stress, è possibile la morte improvvisa, nella patogenesi della quale il ruolo principale è giocato dall'insufficienza surrenalica, inerente a questo particolare tipo di diatesi.
Diatesi neuroartritica.
La diatesi neuroartritica si riferisce ad anomalie costituzionali con disturbi nel metabolismo dell'acido urico, accumulo di purine nel corpo e aumento dell'eccitabilità. La base della diatesi neuroartritica è l'ereditarietà di alcuni meccanismi metabolici patologici, principalmente disturbi del metabolismo delle purine con aumento del loro contenuto nel sangue e nelle urine. Il metabolismo dei grassi e l'assorbimento dei carboidrati vengono interrotti e c'è una tendenza alla chetoacidosi. Genitori e parenti di bambini con questo tipo di diatesi, di regola, hanno malattie metaboliche come obesità, colelitiasi, diabete mellito, diatesi dell'acido urico e urolitiasi.
La clinica è dominata da manifestazioni nevrasteniche, metaboliche, spastiche e cutanee. I sintomi sono polimorfici: neurodermite, eruzioni cutanee orticarioidi, appetito instabile, labilità emotiva. Possono comparire ipercinesia coreica, logoneurosi e anuria. Un sintomo caratteristico è il vomito acetonemico periodico, fino alla crisi acetonemica, accompagnato da acetonuria, odore di acetone dalla bocca, esicosi, carenza di potassio, ipocloremia e acidosi. È possibile un'artralgia transitoria. Nella diagnosi, la storia familiare (emicrania, gotta, colecistite, nevralgia, ecc.), Gli esami di laboratorio delle urine e del sangue con la determinazione del contenuto di acido urico e sali sono di grande importanza.
Prevenzione e trattamento della diatesi.
La prevenzione primaria e secondaria della diatesi è una delle soluzioni più promettenti al problema della morbilità e della mortalità infantile. La prevenzione primaria viene effettuata in base alla storia familiare, alle caratteristiche di insorgenza della malattia e allo stile di vita (in primis della futura mamma). In tutti i casi sono necessari un regime di allenamento, una diagnosi tempestiva e il trattamento della tossicosi e di altre complicazioni della gravidanza. Una donna incinta a rischio di reazioni allergiche necessita di una dieta che escluda gli allergeni obbligati (agrumi, cioccolato, miele, fragole, caffè, cacao, funghi, ecc.).
Si consiglia di limitare il consumo di latte intero, uova, dolci, patate, brodi forti, pomodori, noci e dolci culinari. Nella vita di tutti i giorni, si dovrebbe raccomandare di mantenere l'igiene domestica, evitare il contatto con prodotti chimici domestici, animali, ecc. Alla nascita di un bambino, è necessario creare condizioni che impediscano l'allergia del corpo attraverso l'igiene, la routine quotidiana, l'indurimento , indossare abiti in tessuto di cotone, ecc. I bambini con diatesi hanno bisogno dell'allattamento al seno naturale come nessun altro. La dieta di una madre che allatta dovrebbe escludere anche gli alimenti allergenici al latte materno; gli alimenti complementari vengono introdotti a questi bambini non prima di 5 mesi, con un'attenta espansione della dieta. È meglio tenere un diario alimentare. È necessario includere nella dieta del bambino miscele di latte fermentato o integratori alimentari arricchiti con bifidobatteri o lattobacilli.
I bambini con diatesi neuro-artritica non dovrebbero essere sovralimentati; dovrebbero limitare il consumo di formule, principalmente brodi ricchi, salsicce, carne affumicata, prodotti contenenti carne e grassi lattiero-caseari (burro, panna acida), espandere e reintegrare la dieta quotidiana con verdure e piatti a base di frutta, porridge, esclusa acetosa, spinaci, fagiolini, pomodori. Per i bambini con questa forma di diatesi sono indicati l'abomino, il succo gastrico naturale, gli epatoproiettori, il coleretico e le vere e proprie acque minerali alcaline. In caso di vomito acetonemico, il corpo deve essere alcalinizzato utilizzando acqua minerale alcalina (Borjomi), Oralit, Reidron e devono essere prescritti clisteri alcalini. Le condizioni del bambino devono essere monitorate utilizzando un test di controllo per il contenuto di acetone nelle urine.
La prevenzione comprende anche la sanificazione di tutti i focolai di infezione nel bambino e nei parenti. È necessario aderire alla tattica di un piano delicato e individuale per effettuare vaccinazioni preventive con preparazione preliminare. La prevenzione secondaria comprende l'uso di agenti desensibilizzanti, nonché l'eliminazione della disbiosi, delle infestazioni da elminti, delle discinesie del tratto digestivo, un ciclo di terapia vitaminica, sedativi, adattogeni e immunomodulatori. Il trattamento della diatesi ha lo scopo di eliminare le manifestazioni cliniche, prevenire ed eliminare le complicanze delle infezioni virali respiratorie acute e di altre infezioni patogeneticamente associate alla presenza e alla forma della diatesi.
Spasmofilia (tetania infantile)
Con questa malattia, c'è una tendenza alle convulsioni toniche o tonico-cloniche dovute a una diminuzione del livello di calcio ionizzato nel siero del sangue e nel liquido interstiziale con simultanea iperfosfatemia. La spasmofilia può verificarsi con un sovradosaggio di vitamina D, con una serie di malattie accompagnate da febbre, intossicazione, è possibile anche con vomito ripetuto, con un sovradosaggio di alcali somministrati in connessione con alcalosi metabolica.
Ci sono spasmofilie nascoste ed evidenti. La diagnosi della forma latente è difficile e viene effettuata neuropatologicamente sulla base dei sintomi caratteristici. La spasmofilia esplicita si manifesta con laringospasmo, spasmo cardonedale e attacchi eclamptici. Il ricovero in ospedale dei bambini con evidente spasmofilia è obbligatorio. A livello preospedaliero, per alleviare le convulsioni, è possibile somministrare seduxen, regolare la dieta gamma-olio con somministrazione endovenosa obbligatoria di cloruro di calcio. Con la spasmofilia latente sono indicati integratori di calcio (un ciclo di 2-3 settimane), terapia sedativa, trattamento del rachitismo, un regime protettivo e limitazione del consumo di latte vaccino.
Malattie ereditarie.
I bambini di questa età possono anche già avere malattie ereditarie. Esistono circa 3.000 malattie e sindromi ereditarie. Le malattie ereditarie si dividono in tre gruppi principali:
monogenico;
poligenico;
cromosomico.
Le malattie monogeniche sono causate da un difetto in un gene. La frequenza di queste malattie tra i bambini di 1 anno di età è 2:1000 10:1000. Le più comuni sono la fibrosi cistica, la sindrome da malassorbimento, la celiachia, l'emofilia, la fenilchetonuria, la galattosemia, ecc. Le malattie poligeniche (multifattoriali) sono associate all'interruzione dell'interazione di diversi geni e fattori ambientali. Questi includono il diabete mellito, l’obesità, molte malattie renali ed epatiche, malattie allergiche, ecc.
Le malattie cromosomiche si verificano a causa di cambiamenti nel numero o nella struttura dei cromosomi. La frequenza dei difetti cromosomici è 6:1000. Di queste malattie, le più comuni sono la malattia di Down, la sindrome di Klinefelter, ecc .. Diagnosi delle malattie ereditarie La diagnosi delle malattie ereditarie si basa su dati anamnestici, manifestazioni cliniche caratteristiche, test specializzati e dati di laboratorio. La consultazione con un genetista per le malattie ereditarie è obbligatoria. Le malattie della prima infanzia e del periodo prescolare sono caratterizzate da una maggiore incidenza di malattie respiratorie.
Nella prima infanzia, il sistema immunitario continua a svilupparsi, quindi i bambini sono suscettibili a malattie frequenti. Si tratta principalmente di malattie infettive: batteriche e virali. Anche la cerchia sociale allargata del bambino contribuisce alla loro comparsa: durante una passeggiata con altri bambini o in un asilo nido.
Inoltre, a questa età non a tutti i bambini vengono insegnate le regole di igiene; potrebbe esserci ancora l'abitudine di mettere in bocca vari oggetti, giocattoli o dita. Pertanto, la maggior parte dei bambini non può evitare malattie batteriche e virali.
Le malattie infantili più comuni in tenera età sono le infezioni: raffreddori senza fine, infezioni intestinali, influenza, tubinfezioni (intossicazione da tubin), ecc.
È consigliabile che i genitori conoscano le loro manifestazioni, il che aiuterà a sospettare la malattia in modo tempestivo e a consultare un medico. I sintomi di intossicazione all'inizio delle infezioni possono essere simili, ma esistono ancora manifestazioni specifiche.
ARVI
Secondo le statistiche, l'ARVI è la malattia più comune nei bambini, soprattutto in tenera età durante la stagione fredda. L'ARVI rappresenta il 90% di tutte le infezioni nei bambini. In media, un bambino può contrarre un'infezione respiratoria fino a 6-8 volte durante l'anno.
Questa frequenza è dovuta al fatto che il corpo non ha ancora incontrato il virus e non ha sviluppato anticorpi contro di esso. Gli ARVI frequenti non sono una manifestazione di uno stato di immunodeficienza in un bambino, riflettono solo la frequenza di contatto con la fonte di un'infezione virale.
Le infezioni respiratorie causate da virus parainfluenzali, virus influenzali, adenovirus, enterovirus e virus rinosinciziali sono più comuni. Si conoscono oltre 300 varietà di agenti patogeni e non esiste immunità incrociata tra di loro.
Vari virus respiratori infettano le cellule della mucosa a diversi livelli delle vie respiratorie: rinovirus - nella cavità nasale, parainfluenza - nella trachea e nella laringe, influenza - nella trachea e nei bronchi. La causa principale della malattia è il sottosviluppo del sistema immunitario: l'interferone (una sostanza che garantisce la protezione immunitaria locale delle mucose delle vie respiratorie) viene prodotto nei bambini in quantità minori e più lentamente rispetto agli adulti.
I bambini nati e non allattati al seno (cioè non protetti dagli anticorpi materni contro i virus) sono più suscettibili alle malattie; bambini indeboliti che soffrono di malnutrizione e malattie allergiche.
Un bambino viene infettato dalle goccioline trasportate dall'aria nei trasporti pubblici, in un negozio o all'asilo. I virus sono contenuti nell'aria espirata di un paziente e vengono rilasciati quando si tossisce e si starnutisce. Il periodo di incubazione (il tempo che intercorre tra l'infezione e l'insorgenza delle manifestazioni della malattia) è spesso di diverse ore, ma non superiore a 3 giorni.
I sintomi dell'ARVI sono:
- aumento della temperatura - da febbre lieve a febbre alta (può durare diversi giorni);
- (a causa sua il bambino diventa capriccioso);
- dolore alle articolazioni e ai muscoli;
- perdita di appetito;
- fenomeni catarrali (congestione nasale, mal di gola e mal di gola, tosse, raucedine).
Ci sono anche caratteristiche distintive nei sintomi, a seconda del tipo di agente patogeno:
- A parainfluenza le condizioni generali del bambino soffrono meno, l'esordio della malattia è solitamente graduale, la temperatura aumenta entro 37,5 0 C. I segni distintivi caratteristici sono la congestione nasale, la raucedine, la tosse secca e ruvida ("abbaiare") e una complicazione può essere la falsa groppa o stenosi laringea, manifestata da difficoltà respiratorie.
- Infezione da adenovirus più spesso provoca grave intossicazione (mal di testa, letargia, debolezza, mancanza di appetito), febbre alta e febbre prolungata (fino a 2 settimane). I sintomi costanti di questa infezione sono: naso che cola (a causa dell'infiammazione della mucosa nasale), mal di gola (le tonsille palatine si infiammano, si sviluppa la tonsillite), lacrimazione (), ingrossamento multiplo dei linfonodi.
All'esame si rivelano arrossamento e ingrossamento delle tonsille, secrezione purulenta dalle lacune delle tonsille. Il gonfiore delle palpebre e il rossore della congiuntiva possono comparire prima in un occhio e poi nell'altro e persistere per una settimana o più.
In tenera età, l'infezione da adenovirus può causare anche manifestazioni a carico del tratto digestivo: feci acquose con muco per 3-4 giorni e, in rari casi, vomito.
- Per infezione respiratoria sinciziale (infezione da RSV) Tipici sono i danni sia al tratto respiratorio inferiore che a quello superiore: un naso che cola appare sullo sfondo di un aumento della temperatura; dapprima secca e da 3-4 giorni con espettorato, tosse; mancanza di respiro con difficoltà a respirare.
Un bambino su quattro sviluppa la polmonite (). La comparsa di cianosi del triangolo nasolabiale e mancanza di respiro indica la gravità dell'infezione ed è un'indicazione per il ricovero in ospedale del bambino. Una complicazione può anche essere la groppa. Il decorso dipende dall'età: più piccolo è il bambino, maggiore è il rischio di un decorso grave. Il sistema immunitario non è stabile e dopo qualche tempo è possibile contrarre nuovamente l'infezione da RSV.
- Influenza : Dei tre principali tipi di virus, i virus B e C causano più spesso la malattia nei bambini. I segni distintivi sono la predominanza dei sintomi di intossicazione: febbre alta con brividi, dolore agli occhi (i bambini lamentano "dolori agli occhi"), mal di testa, mancanza di appetito, debolezza. Tra i fenomeni catarrali si segnala tosse secca (con danni alla trachea). Il giorno 4-5 diventa bagnato.
I bambini con ARVI dovrebbero essere trattati da un pediatra. Il trattamento correttamente prescritto riduce il rischio di complicanze. In caso di malattia grave è necessario il ricovero ospedaliero. Si consiglia al bambino di riposare a letto, bere molti liquidi caldi (succhi, decotti di frutta secca e rosa canina, tè al limone). Ciò non significa che il bambino debba essere tenuto forzatamente a letto. Quando si sente male, proverà a sdraiarsi. Quando ti senti meglio, lascialo muovere, ma dovresti escludere giochi attivi e ginnastica.
I bambini sotto i 3 anni necessitano di un trattamento farmacologico. Tutti i farmaci per il trattamento dell'ARVI sono divisi in 2 gruppi: e farmaci sintomatici.
In tenera età vengono utilizzati i seguenti farmaci antivirali (ma solo su prescrizione del pediatra):
- Grippferon (gocce nasali) – ha effetti antivirali, antinfiammatori, immunomodulatori;
- Viferon (supposte rettali, unguento nasale);
- Anaferon per bambini è un rimedio omeopatico sotto forma di losanghe (per i bambini la compressa deve essere sciolta in 1 cucchiaio d'acqua);
- Remantadina e Relenza per il trattamento dell'influenza;
- Groprinosina: attiva il sistema immunitario e previene la diffusione dell'infezione.
I farmaci antivirali hanno l'effetto maggiore se prescritti dal primo giorno di malattia.
Gli antibiotici non hanno alcun effetto sul virus. Sono prescritti per malattie gravi, bambini indeboliti con la minaccia di un'infezione batterica, poiché nel 10% dei casi un'infezione virale è complicata dallo sviluppo di una malattia batterica.
Il trattamento sintomatico consiste nell'eliminare le manifestazioni di una malattia respiratoria. La temperatura non deve essere abbassata sotto i 38 0 C: durante la febbre, l'interferone, che inibisce la riproduzione del virus, viene prodotto più velocemente nel corpo. Abbassando la temperatura si inibiscono le reazioni protettive dell'organismo stesso. Solo se c'è una predisposizione alle convulsioni febbrili (cioè con un aumento della temperatura), si riducono anche le temperature più basse (superiori a 37,5 0 C).
I farmaci contenenti Ibuprofene e Paracetamolo (Nurofen, Efferalgan-baby, Panadol-baby) sono usati come antipiretici. L'aspirina è controindicata per i bambini. Per la congestione nasale vengono prescritti Otrivin-baby, Nazol-baby, ecc., Ma per non più di 5 giorni. In caso di infiammazione della gola è meglio non utilizzare spray prima dei 2 anni di età per il rischio di sviluppare broncospasmo. Se puoi insegnare a un bambino a fare i gargarismi, fai i gargarismi con una soluzione di furatsilina o clorofillite e con infuso di camomilla.
Per sbarazzarsi della tosse secca, è importante fornire al bambino abbastanza liquidi e umidificare l'aria. Per facilitare la rimozione dell'espettorato durante una tosse grassa, vengono utilizzati mucolitici. In tenera età (dai 2 anni) è possibile utilizzare Ambroxol (Lazolvan, Ambrobene), Bromexina sciroppata, ACC.
Le inalazioni sono efficaci nel combattere la tosse. Sono convenienti da utilizzare (un dispositivo per inalazione, comodo per l'uso a casa; leggi come utilizzare un nebulizzatore). A temperature normali, puoi usare pediluvi caldi, dopo di che devi asciugare accuratamente i piedi e versare la polvere di senape nei calzini (puoi lasciarli durante la notte).
Laringite
 La laringite nei bambini piccoli può manifestarsi non solo come tosse, ma anche come difficoltà a respirare.
La laringite nei bambini piccoli può manifestarsi non solo come tosse, ma anche come difficoltà a respirare. L'infiammazione della laringe (laringite) è una malattia abbastanza comune in tenera età. Un tipo di esso è la groppa o laringite stenosante, che può svilupparsi sullo sfondo di un'infezione respiratoria o essere di natura allergica.
La frequenza della groppa è spiegata da caratteristiche anatomiche: il gonfiore della mucosa si verifica facilmente nell'area delle corde vocali, quindi, con infiammazione, accumulo di muco e spasmo muscolare riflesso, il passaggio dell'aria durante l'inspirazione diventa difficile.
Molto spesso, la groppa si verifica nei bambini di età compresa tra 2 e 3 anni con parainfluenza, ma può anche essere causata da adenovirus e virus rinosinciziali. I fattori predisponenti sono l'eccesso di peso corporeo e i problemi allergici nel bambino.
I segni della groppa (che possono svilupparsi di notte) sono raucedine o completa perdita della voce, tosse che "abbaia", difficoltà di respirazione e irrequietezza nel bambino. Se compaiono sintomi di groppa, dovresti chiamare immediatamente un'ambulanza.
Tattiche dei genitori prima dell'arrivo del medico:
- il bambino dovrebbe essere calmato, dovrebbe essere garantito l'accesso all'aria umida e molti liquidi;
- somministrare un antipiretico (se c'è una temperatura elevata);
- ripristinare la respirazione attraverso il naso utilizzando gocce.
Lo sviluppo della groppa è un'indicazione per il ricovero di un bambino in ospedale, dove possono essere utilizzati: inalazioni con dilatatori bronchiali, mucolitici; somministrare corticosteroidi a seconda della gravità della groppa.
Infezione da enterovirus
Una malattia comune nei bambini nei primi 3 anni di vita comprende anche l'infezione causata da enterovirus. Il virus è molto stabile nell'ambiente esterno, viene rilasciato dal corpo del paziente e dal portatore del virus quando si tossisce e si parla, nonché con le feci.
L'infezione è possibile attraverso goccioline trasportate dall'aria, contatto domestico (attraverso giocattoli e altri oggetti) e via fecale-orale (attraverso cibo e acqua) se non vengono seguite le norme igieniche. Il periodo di incubazione è di 2-10 giorni.
L'inizio dell'infezione è acuto. La febbre è alta e può essere ondulata. L'infezione è caratterizzata da sintomi di danno agli organi respiratori e digestivi sullo sfondo di intossicazione. Poiché il virus si moltiplica nei linfonodi, si verifica un aumento nella regione del collo e sottomandibolare.
Uno dei segni della malattia è un'eruzione cutanea sulla pelle della metà superiore del busto e delle braccia sotto forma di macchie rosse o vesciche. L'eruzione cutanea scompare dopo 4-5 giorni, lasciando una leggera pigmentazione.
Caratteristico è il danno a vari organi interni con lo sviluppo delle seguenti forme di infezione:
- mal di gola con danno all'orofaringe (con un'eruzione di bolle con contenuto liquido sulla mucosa, che si aprono per formare ulcere ricoperte da uno strato bianco);
- congiuntivite con danni agli occhi (arrossamento della mucosa, lacrimazione, fotofobia, gonfiore delle palpebre);
- miosite con danno ai muscoli del tronco o degli arti (dolore nella zona di questi muscoli);
- L'enterite con danno alla mucosa intestinale si manifesta con feci molli di colore normale, senza muco e sangue, con o senza febbre;
- nel cuore sono possibili danni a diverse parti: il muscolo cardiaco (con sviluppo), la membrana interna e le valvole (endocardite) o tutte le membrane (pancardite); la manifestazione sarà aumento della frequenza cardiaca, dolore cardiaco, calo della pressione sanguigna, disturbi del ritmo;
- il danno al sistema nervoso porta allo sviluppo di (infiammazione del rivestimento del cervello) o encefalite (infiammazione della sostanza cerebrale), i cui segni sono anche forte mal di testa, vomito ripetuto, convulsioni, paralisi e perdita di coscienza ;
- il danno alle cellule del fegato provoca lo sviluppo dell'epatite, i cui sintomi saranno dolore nell'ipocondrio destro, nausea, febbre, debolezza.
Non esistono farmaci specifici per il trattamento dell'infezione da enterovirus, viene effettuato un trattamento sintomatico e viene prescritta una dietoterapia. Vengono adottate misure per prevenire la disidratazione e viene prescritta una terapia di disintossicazione. La durata della malattia è fino a 2 settimane.
Pertosse
 Il vaccino DTP ti salverà dalla pertosse
Il vaccino DTP ti salverà dalla pertosse Questa infezione batterica è causata dalla pertosse. L'infezione da goccioline trasportate dall'aria avviene attraverso il contatto ravvicinato con un paziente, che può anche essere un adulto, poiché l'immunità dopo la vaccinazione si osserva solo per 5-10 anni. La pertosse è particolarmente pericolosa per i bambini sotto i 2 anni di età. La prevalenza della malattia è diminuita a causa della vaccinazione programmata, ma viene ancora spesso registrata a causa del rifiuto di alcuni genitori di vaccinare i propri figli.
Il periodo di incubazione è in media di 5 giorni. L'esordio della malattia è acuto. I sintomi ricordano le infezioni virali respiratorie acute: febbre bassa, tosse secca e lo stato di salute ne risente poco. Diagnosticare la pertosse in questa fase è difficile.
Ma gradualmente le condizioni del bambino peggiorano, la tosse diventa parossistica e spasmodica. Durante un attacco, il viso del bambino diventa rosso e bluastro. L'intensità degli attacchi aumenta; durante un attacco può verificarsi una temporanea cessazione della respirazione (apnea).
Frequenti attacchi di tosse portano a problemi circolatori, compresa la circolazione cerebrale. Alla fine dell'attacco può verificarsi vomito o fuoriuscita di un grumo di muco vitreo.
Nei casi più gravi, il bambino viene ricoverato in ospedale. Il trattamento comprende terapia antibiotica (Augmentin, Azitromicina, Eritromicina, Rulid), ossigenoterapia, sedativi, anticonvulsivanti, farmaci antiallergici, mucolitici (assottigliamento dell'espettorato), immunomodulatori. Nei casi più gravi vengono utilizzati i corticosteroidi.
Il trattamento della pertosse è un processo molto lungo. Gli attacchi di tosse continuano anche dopo l'effetto distruttivo di un antibiotico sul batterio della pertosse, che è associato al danno al centro della tosse da parte delle tossine dell'agente patogeno.
Un attacco può essere scatenato da qualsiasi sostanza irritante. Pertanto, dovresti fornire al bambino un ambiente tranquillo (evitare lo stress) e dare cibo tritato in piccole porzioni. Le passeggiate mattutine vicino allo stagno sono molto importanti e nell'appartamento garantiscono un afflusso di aria fresca e umida.
scarlattina
La scarlattina è un'infezione batterica acuta causata da streptococco, caratterizzata dalla comparsa di mal di gola, eruzioni cutanee, sintomi di intossicazione, febbre e possibile sviluppo di complicanze allergiche e purulento-settiche. L’incidenza è maggiore nella stagione autunno-invernale. Dopo la malattia si sviluppa una forte immunità.
I bambini di solito si ammalano dopo i 2 anni di età; si infettano più spesso all'asilo, dove possono verificarsi focolai ed epidemie. La malattia viene solitamente trasmessa per contatto e per goccioline trasportate dall'aria, ma è possibile anche un'infezione di origine alimentare. Un bambino malato è pericoloso per gli altri da 1 a 21 giorni compresi. L'infezione può essere trasmessa attraverso terzi (quando non è il bambino stesso a entrare in contatto con la persona malata, ma, ad esempio, un genitore che poi trasmette l'infezione al figlio).
Il periodo di incubazione è di 3-7 giorni. L'esordio della malattia è acuto, il bambino diventa letargico, appare mal di testa, la febbre con brividi aumenta rapidamente (la temperatura raggiunge i 39-40 0 C) e può verificarsi vomito. Il primo giorno della malattia, sullo sfondo del rossore della pelle appare un'eruzione cutanea rosa brillante.
La localizzazione primaria delle eruzioni cutanee è sulle superfici laterali del corpo, nelle pieghe naturali della pelle (ascellari, inguinali, glutei) e sul viso. La scarlattina è caratterizzata da gonfiore del viso e triangolo nasolabiale pallido, dove non è presente eruzione cutanea; lucentezza febbrile degli occhi; labbra rosso vivo.
Una manifestazione obbligatoria della scarlattina è: le tonsille ingrossate e il palato molle sono di colore rosso vivo, c'è pus sulla superficie e nelle lacune delle tonsille. I linfonodi sottomandibolari sono ingrossati e dolorosi. I cambiamenti tipici si notano nella lingua. Dapprima si patina, da 2-3 giorni comincia a schiarirsi, acquisendo entro il 4° giorno un aspetto caratteristico: rosso vivo, con papille sporgenti (“lingua cremisi”).
Nei casi più gravi della malattia, il bambino può manifestare agitazione, delirio o convulsioni, il che indica un danno al sistema nervoso centrale. L'eruzione dura circa una settimana e scompare (senza pigmentazione). A 2-3 settimane dall'esordio della malattia si osserva desquamazione della pelle. Un sintomo caratteristico della scarlattina è il peeling lamellare sulla superficie palmare delle mani e dei piedi.
Le complicanze infettive-allergiche dei reni e del cuore si verificano raramente nei bambini piccoli. Può svilupparsi una polmonite. Il portatore batterico può persistere fino ad un mese dopo la malattia o più a lungo (in presenza di infiammazione cronica del rinofaringe).
I bambini affetti da scarlattina vengono solitamente curati a casa, fornendo al bambino isolamento (in una stanza separata per 10 giorni) e piatti separati. Il riposo a letto è prescritto fino a 10 giorni per prevenire complicazioni. Si consiglia una dieta meccanicamente e termicamente delicata (cibo caldo schiacciato) e l'assunzione di molti liquidi. I bambini affetti da forme gravi della malattia vengono ricoverati in ospedale.
Il trattamento farmacologico comprende:
- terapia antibiotica (la base del trattamento): vengono utilizzati antibiotici penicillinici (per via orale o intramuscolare) e, se sono intolleranti, vengono utilizzati macrolidi (eritromicina, Sumamed, ecc.) - la durata del ciclo e la dose sono determinate dal medico;
- farmaci antiallergici (Cetrin, Suprastin, Tavegil, ecc.);
- terapia vitaminica;
- trattamento locale: gargarismi con infusi di camomilla, salvia, calendula, soluzione di furatsilina.
Il bambino viene ricoverato al nido dopo 22 giorni dal momento della malattia. Dopo la scarlattina si nota l'immunità permanente.
Rosolia
Una malattia infettiva virale non grave a trasmissione aerea. I bambini di età superiore a un anno si ammalano, poiché in precedenza erano protetti dagli anticorpi ricevuti dalla madre. Il virus non è altamente contagioso, quindi l'infezione avviene solo attraverso il contatto stretto con un paziente.
Il periodo di incubazione è di 2-3 settimane. Già alla fine di questo periodo si notano un lieve malessere e un ingrossamento dei linfonodi occipitali, cervicali posteriori e parotidei (un segno distintivo della rosolia).
L'esordio dell'infezione è acuto con un moderato aumento della temperatura. Sulla mucosa orale compaiono macchie rosa. Quindi appare un'eruzione cutanea sul viso. Molto rapidamente, durante il primo giorno di malattia, si diffonde su tutta la superficie del corpo e può essere accompagnata da lievi sintomi.
L'eruzione cutanea è abbondante, la maggior parte dei suoi elementi si trovano sulla schiena e sui glutei del bambino, ma non ce ne sono sui palmi delle mani e sulle piante dei piedi. Le eruzioni cutanee sembrano macchie, leggermente sollevate sopra la superficie della pelle. Sul viso, l'eruzione tende a fondersi.
Il 3o o 4o giorno l'eruzione diventa pallida e scompare senza lasciare traccia. Potrebbero rimanere lievi desquamazioni. I linfonodi ingrossati persistono per circa 2 settimane. Le forme atipiche della malattia si verificano senza eruzioni cutanee, ma il periodo infettivo non viene abbreviato.
Per la rosolia viene effettuato un trattamento sintomatico (antipiretici, farmaci antiallergici, bere molti liquidi). La prognosi è generalmente favorevole, le complicanze si verificano estremamente raramente. Il periodo contagioso è di 2 settimane (una settimana prima dell'eruzione cutanea e una settimana dopo).
Varicella
 Un segno caratteristico della varicella è un'eruzione cutanea con vesciche su tutto il corpo.
Un segno caratteristico della varicella è un'eruzione cutanea con vesciche su tutto il corpo. L'infezione si diffonde per via fecale-orale attraverso l'acqua, il cibo, gli oggetti domestici, i giocattoli, le mani sporche (alcuni bambini a questa età continuano a mettere tutto in bocca). Si osserva un aumento stagionale dell'incidenza nel periodo estivo-autunnale.
Le manifestazioni cliniche delle infezioni intestinali acute nei bambini piccoli hanno molto in comune, indipendentemente dal tipo di agente patogeno:
- insorgenza acuta della malattia;
- sintomi di intossicazione (febbre, malessere, debolezza, mancanza di appetito);
- disfunzione intestinale (nausea, vomito, feci molli);
- mal di stomaco.
La natura delle feci può differire:
- abbondante, acquoso – con infezioni intestinali acute causate da virus e microflora opportunistica;
- scarso, con mescolanza di muco e striature di sangue - con dissenteria;
- abbondante, come il fango paludoso - con salmonellosi, ecc.
Con l'infezione da rotavirus si osservano spesso manifestazioni catarrali sotto forma di naso che cola e tosse. Un sintomo caratteristico della dissenteria è un falso bisogno di defecare.
Quasi il 70% dei casi di ACI in giovane età sono da lievi a moderati. Nei casi più gravi, può svilupparsi disidratazione a causa di vomito frequente e feci abbondanti.
Il medico formula la diagnosi sulla base delle manifestazioni cliniche e dei risultati degli esami (coltura batteriologica delle feci e del vomito, esami del sangue sierologici e immunologici).
Le forme lievi di OCI possono essere trattate a casa. Le forme moderate e gravi richiedono controllo medico, somministrazione endovenosa di soluzioni allo scopo di disintossicazione e reintegrazione delle perdite di liquidi e minerali, quindi i bambini vengono curati in ospedale.
Il trattamento dell’OCI comprende:
- riposo a letto o semi-letto;
- dieta: escludere frutta e verdura fresca, brodi, prodotti da forno freschi e succhi; viene introdotta l'alimentazione in piccole porzioni (ma spesso), si consiglia il consumo di latticini fermentati, zuppe viscide e cereali;
- reidratazione (ripristino dell'equilibrio salino alla normalità): somministrazione di soluzioni sotto forma di bevande (Rehydran, Glyukosol, Oralit, decotto di carota e uvetta, infuso di camomilla) o somministrazione a goccia di soluzioni speciali in una vena (nei casi più gravi). La quantità di liquidi necessaria viene determinata dal medico in base al grado di disidratazione e all'età del bambino.
- anche i farmaci antibatterici e antivirali, il loro dosaggio e la durata del ciclo di trattamento dovrebbero essere selezionati dal medico (nifuroxazide, Ersefuril, Viferon sono più spesso usati);
- enterosorbenti (che promuovono la rimozione delle tossine dal corpo) – Smecta, Polyphepam, Enterosgel (dopo 2 anni);
- ripristino della normale microflora intestinale: vengono utilizzati probiotici (Bifiform, Bifidumbacterin, Enterol);
- trattamento sintomatico (antipiretici, preparati enzimatici, ecc.).
Attacchi affettivo-respiratori (ARS)
Si parla di ARP quando il bambino letteralmente “inizia a piangere”, si blocca durante l'inspirazione, le sue labbra diventano blu e il respiro si ferma brevemente (per 30-60 secondi) (apnea). Si verifica uno spasmo dei muscoli laringei e tali attacchi assomigliano al laringospasmo. Oltre agli attacchi “blu”, ci sono anche quelli “bianchi”, che si sviluppano in risposta al dolore e sono simili allo svenimento: il bambino impallidisce, il polso rallenta bruscamente o scompare per un breve periodo.
Singoli ARP, come manifestazione di forti emozioni negative, si osservano in tenera età in un bambino su quattro completamente sano e nel 5% dei bambini si ripetono più volte.
La comparsa dell'ARP è promossa dalla mancanza di calcio nel corpo, che porta allo spasmo della laringe. Con la sindrome di aumentata eccitabilità nervosa, aumenta la probabilità di convulsioni. Non si può escludere una predisposizione ereditaria alla loro insorgenza.
Tipicamente, l'ARP si verifica a 2-3 anni di età. La frequenza degli attacchi varia da diversi al giorno a uno all'anno. Sorgono di riflesso e poi possono scomparire senza lasciare traccia, essendo una caratteristica legata all'età. Ma un bambino del genere deve essere mostrato anche a uno psicologo.
La ricerca ha dimostrato che l'ARP si verifica con la stessa frequenza nei bambini capricciosi con tendenza all'isteria e nei bambini con comportamento normale. L'osservazione da parte di un neurologo pediatrico è necessaria per escludere patologie neurologiche e cardiache. È stata anche provata una connessione tra ARP e malattie del sangue.
Tattiche dei genitori in caso di ARP in un bambino:
- durante un attacco, prendi il bambino tra le braccia, non farti prendere dal panico;
- per ripristinare la respirazione, è necessario dare una pacca sulle guance al bambino, massaggiare le orecchie, asciugare il viso con acqua fredda;
- alcuni bambini si calmano più velocemente se li lasci e ti allontani;
- cerca di distrarre il bambino con qualche azione, senza concentrarti sul suo comportamento;
- Non assecondare i capricci del bambino e non proteggerlo dalle emozioni negative; dovresti insegnargli a gestire le sue emozioni.
Di solito non è necessario il trattamento farmacologico. Per ARP ripetuti, dovresti cercare l'aiuto di uno psicologo.
Infestazioni da elminti (elmintiasi)
In presenza di ossiuri I bambini sono infastiditi da un forte prurito nell'ano, soprattutto intenso di notte. Nel sonno, i bambini graffiano la pelle nella zona perineale, le uova di ossiuri finiscono sotto le unghie del bambino, causando ripetute autoinfezioni.
Ci sono segni generali di elmintiasi:
- perdita di appetito;
- aumento della salivazione;
- carenza di peso corporeo con una corretta alimentazione;
- nausea frequente, vomito;
- dolore addominale (solitamente parossistico, nella zona dell'ombelico);
- gonfiore;
- feci instabili (diarrea e stitichezza);
- pallore della pelle;
- aumento della fatica;
- manifestazioni allergiche sulla pelle;
- sonno agitato;
- aumento senza causa della temperatura 37,1-37,5 0 C;
- squilibrio e capricci.
A ascariasis A causa della migrazione nel corpo, i vermi possono causare focolai di infiammazione del tessuto polmonare, che si manifesta con tosse secca parossistica, mancanza di respiro, broncospasmo e persino emottisi. Sono caratteristiche anche le manifestazioni allergiche cutanee come l'orticaria.
Il dolore addominale può essere così grave da simulare una patologia chirurgica acuta (“addome acuto”). Una massiccia infestazione di nematodi può causare il blocco dei dotti biliari e l'ittero.
In caso di invasione tricocefalo Uno dei sintomi della malattia è l'anemia o il gonfiore di diverse localizzazioni.
Le complicanze dell'enterobiasi includono spesso vulvovaginiti ricorrenti (infiammazione della vagina) nelle ragazze, incontinenza urinaria, eczema dell'area perianale e appendicite.
I bambini con elmintiasi sono inclusi nel gruppo di persone frequentemente malate (infezioni respiratorie acute, stomatite, piodermite, ecc.). Spesso si sviluppano manifestazioni neurologiche: mal di testa, vertigini, tic ossessivi (annusare, sbattere le palpebre, fare smorfie).
La diagnosi può essere confermata analizzando le feci per individuare le uova dei vermi e i raschiamenti delle pieghe della zona perianale (per gli ossiuri). A volte lo studio deve essere ripetuto più volte.
Nel trattamento delle elmintiasi vengono utilizzati la chemioterapia, i rimedi omeopatici e i rimedi erboristici. Cipolle, melograni, semi di zucca e noci hanno proprietà antielmintiche.
Tra i farmaci, il più spesso utilizzato è Vermox (mebendazolo). Anche Difezil e Quantrel sono farmaci efficaci. Ma non dovresti automedicare. Ogni farmaco ha sia indicazioni che controindicazioni. Il trattamento deve essere prescritto da un pediatra o da uno specialista in malattie infettive.
Riepilogo per i genitori
Le principali malattie nei bambini da uno a tre anni sono le infezioni virali o batteriche. Un bambino a questa età inizia ad andare all'asilo, il numero di contatti aumenta, quindi proteggere un bambino dalle malattie non è così facile.
Il sistema immunitario del bambino è ancora in via di sviluppo. L’allattamento al seno e il trasferimento degli anticorpi materni al bambino non hanno poca importanza. Puoi rafforzare il corpo di tuo figlio indurendolo.
È importante che i genitori osservino rigorosamente le regole igieniche e instillino abilità igieniche nei loro figli fin dalla prima infanzia. I genitori dovrebbero conoscere i segni delle malattie infantili più comuni per cercare tempestivamente l'aiuto di un medico. L'automedicazione è pericolosa!
Quale medico contattare
Se il bambino è malato, è necessario contattare un pediatra e, in caso di una condizione grave (febbre incontrollabile, vomito ripetuto, sonnolenza del bambino e disturbi della coscienza, eruzione cutanea in rapida diffusione e altri sintomi gravi), è necessario chiamare un pediatra. ambulanza. Probabilmente il bambino avrà bisogno di cure nel reparto di malattie infettive.
Inoltre, a seconda degli organi interessati, potrebbero essere necessarie consultazioni con specialisti specializzati. Quindi, in caso di miocardite, il paziente viene esaminato da un cardiologo, in caso di meningite, encefalite - da un cardiologo, laringospasmo, otite - da un medico ORL. Un gastroenterologo e uno pneumologo avvisano il paziente se si sviluppano rispettivamente epatite e polmonite.
Se un bambino soffre di raffreddore più di 6 volte l'anno, potrebbe aver bisogno di consultare un immunologo.
1, media: 5,00
su 5)
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0