Белоусова Т.А., Каюмова Л.Н., Горячкина М.В.
Эпидемиология
Бактериальные инфекции кожи , вызывающие ее гнойное воспаление, были выделены в группу инфекционных дерматозов французским ученым H. Leloir в 1891 г. под названием пиодермиты (pyon - гной, derma - кожа). За рубежом пиодермии обычно относят к обширной группе инфекций кожи и мягких тканей (ИКМТ), включающей, помимо инфекций кожи и ее придаточных образований, инфекции подкожно-жировой клетчатки и нижележащих тканей.
В экономически развитых странах ИКМТ составляют 1/3 всех инфекционных заболеваний. По данным отечественных исследований, гнойничковые инфекции кожи составляют 30-40% всей дерматологической патологии у лиц трудоспособного возраста, у военнослужащих этот показатель достигает 60%. В детской дерматологической практике данная патология относится к числу наиболее частых и составляет от 30 до 50% всех случаев обращений к врачу .
Этиология
Основной источник ИКМТ - микроорганизмы, контаминирующие и колонизирующие поверхность кожи. Грамположительные кокки S. aureus и S. Pyogenes, способные проникать в толщу эпидермиса при наличии его повреждений, несомненно, играют ведущую роль в этиологии гнойничковых инфекций кожи. Причем S. aureus является наиболее частым возбудителем, несколько реже встречаются инфекции, вызванные S. pyogenes, а также смешанная инфекция с участием обоих микроорганизмов. Согласно результатам зарубежных многоцентровых исследований, кроме S. aureus, S. pyogenes, в развитии ИКМТ могут принимать участие Corynebacterium diphtheriae, P. aeruginosa, Enterobacteriaceae, Streptococcus spp. Большое значение в определении этиологической роли предполагаемого возбудителя имеет тип инфекции. В отличие от первичных пиодермий вторичные, как и большинство некротизирующих ИКМТ инфекций, имеют полимикробную этиологию.
Важную роль в развитии инфекции играют вирулентность микроорганизма и степень бактериальной обсемененности. Показано, что вероятность развития инфекции прямо пропорциональна степени бактериальной обсемененности и вирулентности микроорганизма и обратно пропорциональна силе защитной реакции организма. Вероятность колонизации увеличивается при наличии заболеваний кожи аллергического генеза. Так, у больных атопическим дерматитом колонизация пораженных участков S. aureus выявляется в 90% случаев .
Патогенез
В возникновении той или иной формы пиодермии большую роль играют: вид патогена, его вирулентность, состояние макроорганизма, а также разнообразные эндогенные и экзогенные предрасполагающие факторы, снижающие барьерную и защитную функции кожи.
Вирулентность стафилококков и стрептококков определяется рядом выделяемых ими патогенных токсинов и энзимов (коагулазой, лейкоцидином, стрептокиназой, гиалуронидазой стрептолизином, гемолизинами и др.), которые облегчают проникновение патогенов в кожу, приводят к повреждению и расслоению всех слоев эпидермиса, вызывают гемолиз и некротизацию дермы и подлежащих тканей, нарушая их нормальный метаболизм .
В возникновении и развитии ИКМТ большое значение имеют реактивность организма, его механизмы сопротивления микробной агрессии. Недостаточность иммунокомпетентной системы при этом носит, как правило, вторичный (приобретенный) характер. Она может формироваться в преморбидный период вследствие перенесенных или сопутствующих тяжелых заболеваний. Заболевания эндокринной системы (ожирение, сахарный диабет, недостаточная активность гипофизарно-надпочечниковой системы, щитовидной, половых желез) способствуют снижению механизмов антиинфекционной защиты организма. Более половины больных (52%) хронической пиодермией злоупотребляют углеводами (как правило, легкоусвояемыми), что создает постоянную перегрузку инсулярного аппарата поджелудочной железы и может способствовать расстройствам углеводного обмена той или иной степени, накоплению в тканях углеводов, являющихся благоприятной питательной средой для пиококков. Существенную роль отводят также себорейному состоянию кожи. Вследствие увеличения количества кожного сала и изменения его химического состава происходит снижение стерилизационных свойств кожи и активации гноеродных кокков .
Немаловажное значение в развитии гнойничковых заболеваний кожи имеют хронические инфекционные заболевания различных органов и тканей: пародонтоз, кариес, гингивит, тонзиллит, фарингит, инфекции урогенитального тракта, дисбактериоз, кишечные интоксикации, снижающие общую и местную антибактериальную резистентность организма и способствующие развитию у больных последующей специфической сенсибилизации, которая отягощает течение инфекционного процесса. Существенную роль в развитии хронической пиодермии играют заболевания центральной и вегетативной нервной системы, умственное или физическое перенапряжение, "истощающие заболевания" - алкоголизм, голодание, неполноценное питание (недостаток белков, витаминов, минеральных солей, гиповитаминозы, особенно А и С. Витамин А участвует в процессе кератинообразования, витамин С регулирует проницаемость сосудистой стенки, является синергистом кортикостероидов). Большую роль в развитии пиодермий играют различные иммунодефицитные состояния, возникающие вследствие врожденного или приобретенного иммунодефицита (ВИЧ-инфекция, прием глюкокортикостероидов, цитостатиков и иммунодепресантов). Дефекты клеточной антибактериальной защиты в виде угнетения фагоцитарной активности нейтрофилов, нарушения хемотаксиса, а также снижение опсонических факторов сыворотки крови и иммуноглобулинов способствуют хронизации инфекции и частым рецидивам .
Важнейшее значение в патогенезе ИКМТ имеют нарушения Т-клеточной системы иммунитета. В основе расстройств специфических механизмов иммунологической реактивности лежит уменьшение числа Т-лимфоцитов в периферической крови, снижение количества СD3- и CD4-клеток и изменение их взаимосвязи с моноцитами, что приводит к ослаблению Т-клеточного иммунного ответа. Недостаточность иммунной системы (иммунологический дисбаланс) больного и антигенная мимикрия возбудителя нередко ведут к хронизации инфекции и формированию бактерионосительства, а нерациональное применение антибиотиков - к резистентности возбудителя .
Весомое значение в развитии бактериальных инфекций кожи имеют неблагоприятные воздействия окружающей среды, нарушающие целостность кожного покрова и создающие "входные ворота" для проникновения инфекции. К ним в первую очередь относят влияние высокой или низкой температуры, повышенной влажности, приводящей к мацерации кожи, повышенное загрязнение и микротравматизации профессиональными факторами (маслами, цементом, угольной пылью). Входные ворота для инфекции возникают при бытовых микротравмах (порезы, уколы), расчесах при зудящих дерматозах. Нарушение кожного барьера в виде сухости и истончения рогового слоя способствуют проникновению микроорганизмов в глубокие слои кожи и подлежащие ткани, что приводит к развитию пиодермического процесса.
Клинические разновидности ИКМТ
ИКМТ представляют собой достаточно многочисленную и разнородную по клинической картине группу заболеваний, приводящих к поражениям различной глубины, распространенности и степени тяжести. Общим, характерным для всех признаком является наличие локального гнойного воспаления, при тяжелом течении сопровождающегося развитием системной воспалительной реакции. Клинические формы зависят от вида этиологического фактора, анатомической локализации, приуроченности к придаткам кожи, глубины и площади поражения, длительности течения процесса.
В отечественной дерматологии принята классификация первичных пиодермий, предложенная J. Jadasson еще в 1934 г. и построенная по этиологическому принципу. В ней выделяют: стафилодермии, преимущественно поражающие кожу вокруг придатков (сально-волосяных фолликулов, потовых желез); стрептодермии, поражающие гладкую кожу преимущественно вокруг естественных отверстий и смешанные стрепто-стафилококковые инфекции. В каждой из трех групп в зависимости от глубины поражения выделяют поверхностные и глубокие формы. Кроме того, гнойничковые заболевания кожи разделяют на первичные, возникающие на неизмененной кожи, и вторичные, развивающиеся как осложнения на фоне уже существующего дерматоза, как правило, зудящего (чесотки, экземы, атопического дерматита). По длительности течения различают острые и хронические пиодермии. Стафилоккоковые пиодермии обычно связаны с придатками кожи (волосяными фолликулами, апокриновыми железами). Для них характерно образование глубокой пустулы, в центре которой формируется полость, заполненная гнойным экссудатом. По периферии располагается зона эритематозно-отечной воспалительной кожи. Нагноительный процесс заканчивается формированием рубца. Стрептококковые пиодермии чаще развиваются на гладкой кожи, вокруг естественных отверстий (полости рта, носа) и начинаются с образования фликтены - поверхностно расположенного пузыря с дряблой складчатой покрышкой, внутри которого содержится серозно-гнойное содержимое. Тонкие стенки фликтены быстро вскрываются, и содержимое изливается на поверхность кожи, ссыхаясь в медово-желтые слоистые корочки. Процесс склонен к распространению по периферии в результате аутоинукуляции. Стафилодермиями чаще страдают мужчины, стрептодермиями - женщины и дети .
В зарубежной литературе все ИКМТ с практической точки зрения делят на три основные группы: первичные пиодермии, в подавляющем большинстве вызванные S. aureus и пиогенными b-гемолитическими стрептококками (преимущественно группы А), и развивающиеся на неизмененной коже (фолликулит, импетиго, рожистое воспаление); вторичные пиодермии развивающиеся на фоне повреждений кожи или сопутствующей соматической патологии (например, пролежни, диабетическая язва стопы, инфекции после укусов животных, послеоперационные раневые и посттравматические инфекции), а также на фоне дерматозов, сопровождающихся зудом и расчесами (аллергический дерматит, псориаз, чесотка и т.д.); некротические инфекции, представляющие наиболее тяжелую форму ИКМТ (целлюлит полимикробной этиологии - синергидный целлюлит, некротизирующий фасциит, мионекроз - газовая гангрена). При данной патологии определение глубины и распространенности поражения является приоритетом врача-хирурга, т.к. только при хирургической обработке можно наиболее точно определить истинную степень распространения инфекции. Начальная тактика ведения этих пациентов одинакова. Она заключается в раннем проведении хирургического вмешательства и назначении адекватной антимикробной терапии .
Лечение ИКМТ
Терапия больных с бактериальными инфекциями кожи должна быть комплексной (этиотропной и патогенетической) и проводиться после тщательного анамнестического, клинического и лабораторного обследования больного. Необходимо выявление и лечение сопутствующих заболеваний, обследование на очаги фокальной инфекции, а в случае длительно персистирующего процесса - исследования иммуностатуса. Основным и единственным методом этиотропного лечения больных ИКМТ являются антибиотики. При острых поверхностных нераспространенных процессах (импетиго, фолликулиты, паронихии) терапия может быть ограничена местным применением антибиотиков и антисептиков. Во всех прочих случаях требуется проведение системной антибактериальной терапии.
Показаниями к назначению системной антибиотикотерапии являются глубокие формы пиодермий: фурункулы (особенно с локализацией на лице и шее), карбункул, гидраденит, рожистое воспаление, целлюлит. Перечисленные формы бактериальных инфекций кожи имеют длительное, нередко хроническое рецидивирующее течение, большую распространенность процесса и часто сопровождаются симптомами общей интоксикации в виде лихорадки, головной боли, слабости, а также развитием регионарных осложнений (лимфаденит, лимфангит). В качестве этиотропного средства антибиотики используются при лечении дерматоза бактериальной природы - болезни Лайма. Они являются препаратами выбора при лечении вульгарных угрей. В дерматовенерологической практике антибиотики широко применяются как для лечения инфекционных дерматозов, так и заболеваний, обусловленных инфекциями, передающимися половым путем (ИППП) .
Перед назначением антибактериального препарата желательно производить посев гноя с определением чувствительности выделенного микроорганизма к различным антибиотикам и по результатам исследования назначать соответствующий препарат. Однако это не всегда выполнимо, особенно при угрозе или развитии осложнений инфекции. Как показывает анализ современной литературы и собственный клинический опыт, сегодня наиболее часто в лечении бактериальных инфекций кожи используются следуюшие группы антибиотиков: 1. β-лактамы: а) природный пенициллин, его дюрантные формы и полусинтетические пенициллины; б) цефалоспорины (1-4 поколения). 2. Макролиды. 3. Тетрациклины. 4. Фторхинолоны.
В последние годы пенициллин и его дюрантные препараты редко применяются в терапии ИКМТ, так как подавляющее число штаммов пиококков приобрели способность продуцировать фермент b-лактамазу (пенициллиназу), подавляющую антибактериальную активность пенициллина. Кроме того, β-лактамы относятся к препаратам, имеющим высокую частоту аллергических реакций.
Тетрациклины, аминогликозиды в настоящее время используются значительно реже. Это связано с большим количеством резистентных штамов микроорганизмов к этим антибиотикам (из чего следует их низкая терапевтическая активность), а также с наличием тяжелых побочных эффектов. Следует помнить, что тетрациклины противопоказаны при беременности, детям и пациентам с печеночной недостаточностью.
Фторхинолоны назначаются в основном при лечении заболеваний, передающихся половым путем, из-за высокой чувствительности к ним возбудителей урогенитальных инфекций, а при пиодермиях используются только при неэффективности других групп антибиотиков. Однако при заболеваниях центральной нервной системы, у беременных, а также в педиатрии диапазон их применения ограничен - они назначаются в основном по жизненным показаниям. Необходимо также не забывать и о фотосенсибилизирующем эффекте фторхинолонов, и связанных с этим мерах предосторожности, особенно весной и летом .
Современная лечебная практика предъявляет к выбору антибиотика определенные требования. Прежде всего препарат должен обладать широким спектром антимикробного действия и минимально выраженной антибиотикорезистентностью к микробным агентам, не иметь тяжелых побочных действий, обладать минимальным риском развития аллергических реакций, быть удобным в применении для пациента (наличие пероральной формы, удобного режима дозирования) и доступным по цене. Кроме того, очень важно, чтобы у антибиотика отсутствовали клинически значимые взаимодействия с другими лекарственными препаратами. На сегодняшний день этим требованиям в полной мере соответствуют антибиотики - макролиды.
Классификация и механизмы фармакотерапевтического действия макролидов
Макролиды уже более 50 лет широко используются в клинической практике. Первый природный антибиотик этой группы - эритромицин (метаболит Streptomyces erythreus) был получен еше в 1952 году. Макролиды можно классифицировать по химической структуре и по происхождению. Основу химической структуры данного класса антибиотиков составляет макроциклическое лактонное кольцо. В зависимости от числа атомов углерода в кольце макролиды подразделяются на 14-, 15- и 16-членные.
Среди макролидов выделяют 3 поколения:
первое поколение: эритромицин, олеандомицин;
второе поколение: спирамицин, рокситромицин, джозамицин, кларитромицин и др.;
третье поколение: азитромицин (Азитрал).
Антибактериальный эффект макролидов основан на нарушении синтеза рибосомальных белков микробной клетки и ингибировании тем самым процесса воспроизведения возбудителя. Они в основном оказывают бактериостатический эффект, что обусловливает целесообразность их назначения в острой фазе воспаления. Макролиды относятся к "тканевым антибиотикам", т.е. при распределении в организме они накапливаются преимущественно не в кровяном русле, а в тех органах и тканях, где имеется воспаление, создавая тем самым высокие концентрации препарата. Хорошо распределяясь в организме, макролиды способны преодолевать гистогематологические барьеры (за исключением гематоэнцефалического), значительно превосходя в этом β-лактамные антибиотики. Однако широкое (и часто необоснованное) применение достаточно быстро привело к появлению высокого процента эритромициноустойчивых штамов возбудителей, особенно стафилококов. Это, в свою очередь, значительно снизило использование эритромицина в клинической практике .
Интерес к макролидам вновь возник в начале 80-х годов XX века, после появления новых поколений антибиотиков этой группы - азалидов (в частности, азитромицина). Азитромицин был синтезирован в 1983 году на основе эритромицина. Препарат по своим фармакокинетическим свойствам превзошел все показатели своего предшественника и стал первым представителем новой группы антибиотиков - азалидов. Уникальность азитромицина базируется на его исключительной фармакокинетике. Азитромицин устойчив в кислой среде, благодаря чему хорошо всасывается после приема внутрь. Одновременный прием с пищей уменьшает всасывание на 50%, поэтому препарат принимают за 1 час до или через 2 часа после еды. Липофильность молекулы азитромицина обеспечивает, помимо высокого уровня всасывания в кишечнике, еще и отличное проникновение препарата в ткани. Быстрое проникновение азитромицина из крови в ткани обеспечивается также низким уровнем связывания азитромицина с белками крови, что дает возможность достигать быстрого терапевтического эффекта при инфекциях, поражающих клетки и ткани. Высокая концентрация препарата в области поражения, в 10-100 раз превышающая концентрацию в кровяном русле, позволяет активно воздействовать на патогенный очаг, тем самым обеспечивая быстрый клинический эффект и скорейшее выздоровление. Современные макролиды (в частности, азитромицин) проявляют наибольщую эффективность в отношении таких возбудителей, как S. pyogenus, S. aureus, S. pneumoniae, некоторых грамотрицательных микроорганизмов (гонококи), а также внутриклеточных возбудителей (в частности, Chlamidia trachomatis и Ureaplasma urealyticum), что обусловливает их высокую востребованность в дерматовенерологической практике .
Важное значение для антибактериальной активности макролидов второго поколения имеет их взаимодействие с нейтрофилами. Благодаря своей способности проникать внутрь нейтрофилов и создавать в них высокие концентрации, многие макролиды позитивным образом модифицируют функции данных клеток, влияя, в частности, на хемотаксис, активность фагоцитоза и киллинга. Наряду с противомикробным действием данные антибиотики обладают умеренной противовоспалительной активностью. Активируя клетки макрофагального ряда, они способны проникать в них и при миграции фагоцитирующих клеток в очаг воспаления поступать туда вместе с ними. Уникальность этих препаратов заключается еще и в том, что они обладают выраженным постантибиотическим эффектом, то есть сохраняют высокие концентрации в очаге воспаления в течение 5-7 дней после отмены. Данный саногенетический эффект позволил разработать короткие курсы лечения, не превышающие 3-5 суток, и удобный режим дозирования (1 раз в сутки). Это, в свою очередь, обеспечивает комплаентность лечения и повышает качество жизни больного. Наиболее выражен постбиотический эффект у азитромицина, что позволяет создавать в очагах инфекции концентрацию антибиотика, многократно превышающую МПК в отношении активных возбудителей при лечении как острых, так и хронических инфекций. В последнее время получены доказательства иммуномодулирующего действия азитромицина в эксперименте на здоровых добровольцах. Первая фаза иммуномодулирующего эффекта состоит в дегрануляции нейтрофилов и оксидантного взрыва, что способствовало активизации защитных механизмов. По достижении эрадикации возбудителей отмечалось уменьшении продукции ИЛ-8 и стимуляция апоптоза нейтрофилов, что минимизировало выраженность воспалительной реакции .
Макролиды, как природные, так и полусинтетические, по сравнению с другими антибиотиками оказывают минимальное влияние на нормальную микрофлору человеческого организма и не вызывают дисбиоза. Поэтому азитромицин рассматривается не только как высокоэффективный, но и наиболее безопасный антибиотик с минимальным числом противопоказаний к назначению. Нежелательные реакции при его приеме в целом встречаются крайне редко и не превышают 5%. Наиболее частыми побочными эффектами являются симптомы со стороны желудочно-кишечного тракта (тошнота, тяжесть в эпигастральной области), которые, как правило, выражены умеренно, не требуют отмены препарата и быстро проходят при приеме лекарств после еды .
Клиническая эффективность азитромицина
Как свидетельствуют сравнительные исследования, при ИКМТ среди антибиотиков, применяющихся в амбулаторной практике, наиболее эффективны макролиды нового поколения, в первую очередь 15- и 16-членные (азитромицин, джозамицин, рокситромицин). Накоплен уже 20-летний положительный опыт применения азитромицина в отечественной дерматовенерологической практике. В дерматологии он являются базовой терапией стафилококковых и стрептококковых поражений кожи и мягких тканей (фурункул, импетиго, целлюлит), а в венерологической практике - при лечении ИППП. В отличие от большинства макролидов у азитромицина отсутствуют клинически значимые взаимодействия с другими лекарственными препаратами. Он не связывается с ферментами комплекса цитохрома Р450, вследствие чего не проявляет реакции лекарственного взаимодействия с препаратами, метаболизирующимися по этому пути. Это свойство является немаловажным, поскольку в реальной клинической практике большинство больных, у которых возникают ИКМТ, имеют фоновые или сопутствующие заболевания, по поводу которых получают соответствующее лечение. Также необходимо подчеркнуть, что наряду с хорошей переносимостью и отсутствием выраженных побочных реакций макролиды (азитромицин) имеют еще одно безусловное преимущество по сравнению с другими группами антибиотиков - это то, что он может назначаться беременным и детям .
В настоящее время одним из наиболее часто применяемых препаратов в клинической практике является препарат Азитрал (азитромицин), производимый фармацевтической компанией "Shreya Life Sciences". Азитрал (азитромицин) аналогичен оригинальному азитромицину - первому представителю подгруппы азалидов из группы макролидных антибиотиков, используемому в лечении ИКМТ и урогенитальных инфекций. Исследования показали, что клиническая эффективность препарата, назначаемого в разовой дозе 500 мг в течение 3 дней, сопоставима с эффективностью большинства широко применяемых антибактериальных средств. Это позволяет в 2-3 раза сократить обычный курс антибиотикотерапии, а уникальный фармакокинетический профиль Азитрала обеспечивает одноразовый суточный прием и высокую комплаентность терапии .
Благодаря особенностям фармакокинетики и своеобразному спектру антимикробного действия, охватывающему основных возбудителей инфекций мочеполового тракта, азитромицин является препаратом первого выбора в терапии сочетанных ИППП, в том числе хронического осложненного урогенитального хламидиоза и ВЗОМТ у небеременных женщин, и альтернативным средством для лечения этого заболевания в период беременности. При однократном приеме 1 г азитромицина (Азитрала) его концентрация в течение недели в ткани предстательной железы и матки превышает МПК для C. trachomatis (0,125 мкг/мл) в 42,5 раза, а в цервикальном канале - в 12 раз, что является терапевтической концентрацией для лечения этой инфекции. Более того, даже спустя 2 недели терапевтическая концентрация азитромицина в ткани предстательной железы превышает МПК для C. trachomatis в 13,6 раз. Авторами было доказано, что именно при таком приеме в тканях, где вегетируют C. trachomatis, поддерживается высокая терапевтическая концентрация препарата в течение 6-8 циклов развития. Полученные данные свидетельствуют о высокой эффективности пульс-терапии Азитралом (по 1 г 1 раз в неделю, курсовая доза 3 г). в комплексном лечении хронического хламидийного уретропростатита и ассоциирующейся с ним микоуреаплазменной и гарднереллезной инфекции. Важно отметить, что препарат Азитрал хорошо переносится больными, доступен по цене и поэтому может широко использоваться в терапии осложненного урогенитального хламидиоза и ВЗОМТ .
Изучение эффективности, безопасности и переносимости азитромицина у 30 детей от 6 месяцев до 3 лет со стафилококковыми инфекциями различной локализации ЛОР-органов и кожи показало, что азитромицин (Азитрал) не уступает по эффективности антистафилококковым пенициллинам. Наряду с высокой эффективностью, характеризующейся быстрой и стойкой обратной динамикой основных клинических симптомов и местных воспалительных изменений в 100% случаев отмечалась хорошая переносимость препарата и отсутствие побочных явлений у всех детей. Широкий спектр антимикробной активности, особенности фармакокинетики, низкий процент нежелательных явлений и ряд преимущества перед другими макролидами обусловливают приоритет использования препарата при различных кожных инфекционных процессах (импетиго, фурункулез, фолликулит, целлюлит, паронихия) у детей. Эффективность азитромицина в педиатрической практике, доказанная клиническими испытаниями, позволяет рекомендовать его в качестве альтернативы b-лактамным антибиотикам, а у детей с отягощенным аллергоанамнезом - как препарат выбора .
Одним из важнейших фармакоэкономических показателей, определяющих выбор антибиотика, является соотношение стоимость/эффективность. Оно определяется, как отношение стоимости лекарственного лечения (для пероральных препаратов она равна стоимости курсовой дозы) к доле успешно пролеченных больных. Следует обратить внимание на то, что Азитрал среди существующих препаратов азитромицина проявляет оптимальное соотношение цена/качество .
Известно, что неэффективность антибиотикотерапии во многом определяется снижением чувствительности к применяемому препарату. В настоящее время клинически значимая резистентность к азитромицину отсутствует. По данным мониторинга антибиотикорезистентности устойчивость к азитромицину и другим макролидам последнего поколения среди возбудителей ИКМТ не превышает 2-10%. Чувствительность штаммов S. pyogenes, выделенных на территории России, к антибиотику азитромицин составляет 92%. Как показано в ряде исследований, клиническая эффективность азитромицина выше, чем у тетрациклинов и b-лактамных антибиотиков. Сравнительное клинико-микробиологическое изучение эффективности при глубоких стафилодермиях 5-дневного курса азитромицина и 10-дневного приема цефалексина показало более высокую терапевтическую активность макролида. Эрадикация возбудителя при применении азитромицина отмечалась в 94%, при цефалексине в 90% случаев, клиническое излечение - соответственно в 56 и 53% случаев. При этом частота побочных реакций, как правило, не требующих отмены препарата, не превышает 5%, что значительно ниже по сравнению с эритромицином (до 14%) или пероральными формами b-лактамов .
Таким образом, азитромицин обладает широким спектром антимикробного действия, высокой бактериостатической активностью по отношению чувствительных к нему инфекций, высокую биодоступность с избирательным действием в очаге воспаления, он малотоксичен, имеет минимум побочных эффектов и удобный режим приема. Следовательно, препарат отвечает современным требованиям рациональной антибиотикотерапии и может быть рекомендован для эффективного применения в дерматовенерологической практике.
Литература
1. Jones M.E., Karlowsky J.A., Draghi D.C, Thornsberry C., Sahm D.F., Nathwani D. Epidemiology and antibiotic susceptibility of bacteria causing skin and soft tissue infections in the USA and Europe: a guide to appropriate antimicrobial treatment. Int J Antimicrob Agent 2003; 22:406-19.
2. Н.Н. Мурашкин, М.Н. Глузмина, Л.С. Галустян. Гнойничковые поражения кожи в практике детского дерматолога: свежий взгляд на старую проблему. РЖКВБ: Научно-практический журнал, 2008, №4, с. 67-71.
3. Белькова Ю.А. Пиодермии в амбулаторной практике. Болезни и возбудители. Клиническая микробиология и антимикробная химиотерапия: № 3, том 7, с. 255-270, 2005.
4. Т.А. Белоусова, М.В. Горячкина. Бактериальные инфекции кожи: проблема выбора оптимального антибиотика. РМЖ 2005, том 13, №16, с. 1086-1089.
5. Таха Т.В., Нажмутдинова Д.К. Рациональный выбор антибиотикотерапии при пиодермиях. РМЖ 2008, том 16, №8, с. 552-555.
6. Новоселов В.С., Плиева Л.Р. Пиодермии. РМЖ 2004, том 12, №5, с. 327-335.
7. Масюкова С.А., Гладько В.В., Устинов М.В., Владимирова Е.В., Тарасенко Г.Н., Сорокина Е.В. Бактериальные инфекции кожи и их значение в клинической практике дерматолога. Consilium medicum 2004, том 6, №3, с. 180-185.
8. T. File. Diagnosis and antimicrobial therapy of skin and soft tissue infections. Ohio, USA. Клиническая микробиология и антимикробная химиотерапия: № 2, том 5, с. 119-125, 2003
9. Шляпников С.А., Федорова В.В. Использование макролидов при хирургичесаких инфекциях кожи и мягких тканей. МРЖ,2004.-т.12,№4,с204-207
10. Гучев И.А., Сидоренко С.В, Французов В.Н. Рациональная антимикробная химиотерапия инфекций кожи и мягких тканей. Антибиотики и химиотерапия. 2003, т.48, 10, с.25-31
11. Parsad D., Pandhi R., Dogras S. A guide to selection and appropriate use ofmacrolides in skin infection Am J Clin Dermatol 2003; 4:389-97
12. Яковлев С.В., .Ухтин С.А. Азитромицин: основные свойства, оптимизация режимов применения на основе фармакокинетических и параметров. Антибиотики и химиотерапия. 2003 т. 48, №2. - с. 22-27
13. Туровский А.Б,.Колбанова И.Г Макролиды в лечении инфекций дыхательных путей с позиций ЛОР-врача: "за" и "против" Consilium medicum, 2010г.,№4, том.12, с.11-14.
14. Прохорович Е.А. Азитромицин. От клинической фармакологии к клинической практике. РМЖ 2006, том 14, №7, с. 567-572
15. Бердникова Н.Г. Актуальные аспекты применения азитромицина (Азитрал) в терапии внебольничных пневмоний у взрослых. РМЖ 2006, том 14, №22, с. 1625-1628.
16. Хрянин А.А., Решетников О.В. Макролиды в лечении хламидийной инфекции у беременных (эффективность, безопасность, экономичность). РМЖ 2008, том 16, №1, с. 23-27.
17. Серов В.Н., Дубницкая Л.В., Тютюнник В.Л. Воспалительные заболевания органов малого таза: диагностические критерии и принципы лечения. РМЖ 2011, том 19, №1, с. 46-50.
18. Талашова С.В. Некоторые аспекты применения антибактериальных препаратов в педиатрии на примере макролидов. РМЖ 2009, том 17, №7, с. 464-466
19. Мазанкова Л.Н., Ильина Н.О. Место азалидов в педиатрической практике. РМЖ 2008, том 16, №3, с. 121-125.
20. Соловьев А.М., Поздняков О.Л., Терещенко А.В. Почему азитромицин считается препаратом выбора для лечения урогенитальной хламидийной инфекции. РМЖ 2006, том 14, №15, с. 1160-1164.
21. Гуров А.В., Изотова Г.Н., Юшкина М.А. Возможности применения препарата Азитрал в терапии гнойно-воспалительных заболеваний ЛОР-органов. РМЖ 2011, том 19, №6, с. 405.
22. Klani R. Double-blind, double-dummy comparison of azithromycin and cephalexin in the treatmen of skin and skin structure infection. Eur.J. Clin. Microbiol. Infect.Dis. 1999,Oct. 10 (10) - p.880-84
Для цитирования:
Белоусова Т.А., Каюмова Л.Н., Горячкина М.В. Системные антибиотики в терапии бактериальных инфекций кожи и мягких тканей: фокус на макролиды // РМЖ. 2011. №21. С. 1317
Эпидемиология Бактериальные инфекции кожи, вызывающие ее гнойное воспаление, были выделены в группу инфекционных дерматозов французским ученым H. Leloir в 1891 г. под названием пиодермиты (pyon - гной, derma - кожа). За рубежом пиодермии обычно относят к обширной группе инфекций кожи и мягких тканей (ИКМТ), включающей, помимо инфекций кожи и ее придаточных образований, инфекции подкожно-жировой клетчатки и нижележащих тканей.
Бактериальные инфекции кожи, вызывающие ее гнойное воспаление, были выделены в группу инфекционных дерматозов французским ученым H. Leloir в 1891 г. под названием пиодермиты (pyon - гной, derma - кожа). За рубежом пиодермии обычно относят к обширной группе инфекций кожи и мягких тканей (ИКМТ), включающей, помимо инфекций кожи и ее придаточных образований, инфекции подкожно-жировой клетчатки и нижележащих тканей.
В экономически развитых странах ИКМТ составляют 1/3 всех инфекционных заболеваний. По данным отечественных исследований, гнойничковые инфекции кожи составляют 30-40% всей дерматологической патологии у лиц трудоспособного возраста, у военнослужащих этот показатель достигает 60%. В детской дерматологической практике данная патология относится к числу наиболее частых и составляет от 30 до 50% всех случаев обращений к врачу .
Этиология
Основной источник ИКМТ - микроорганизмы, контаминирующие и колонизирующие поверхность кожи. Грамположительные кокки S. aureus и S. Pyogenes, способные проникать в толщу эпидермиса при наличии его повреждений, несомненно, играют ведущую роль в этиологии гнойничковых инфекций кожи. Причем S. aureus является наиболее частым возбудителем, несколько реже встречаются инфекции, вызванные S. pyogenes, а также смешанная инфекция с участием обоих микроорганизмов. Согласно результатам зарубежных многоцентровых исследований, кроме S. aureus, S. pyogenes, в развитии ИКМТ могут принимать участие Corynebacte-rium diphtheriae, P. aeruginosa, Enterobacteriaceae, Streptococcus spp. Большое значение в определении этиологической роли предполагаемого возбудителя имеет тип инфекции (табл. 1). В отличие от первичных пиодермий вторичные, как и большинство некротизирующих ИКМТ инфекций, имеют полимикробную этиологию.
Важную роль в развитии инфекции играют вирулентность микроорганизма и степень бактериальной обсемененности. Показано, что вероятность развития инфекции прямо пропорциональна степени бактериальной обсемененности и вирулентности микроорганизма и обратно пропорциональна силе защитной реакции организма. Вероятность колонизации увеличивается при наличии заболеваний кожи аллергического генеза. Так, у больных атопическим дерматитом колонизация пораженных участков S. aureus выявляется в 90% случаев .
Патогенез
В возникновении той или иной формы пиодермии большую роль играют: вид патогена, его вирулентность, состояние макроорганизма, а также разнообразные эндогенные и экзогенные предрасполагающие факторы, снижающие барьерную и защитную функции кожи.
Вирулентность стафилококков и стрептококков определяется рядом выделяемых ими патогенных токсинов и энзимов (коагулазой, лейкоцидином, стрептокиназой, гиалуронидазой стрептолизином, гемолизинами и др.), которые облегчают проникновение патогенов в кожу, приводят к повреждению и расслоению всех слоев эпидермиса, вызывают гемолиз и некротизацию дермы и подлежащих тканей, нарушая их нормальный метаболизм .
В возникновении и развитии ИКМТ большое значение имеют реактивность организма, его механизмы сопротивления микробной агрессии. Недостаточность иммунокомпетентной системы при этом носит, как правило, вторичный (приобретенный) характер. Она может формироваться в преморбидный период вследствие перенесенных или сопутствующих тяжелых заболеваний. Заболевания эндокринной системы (ожирение, сахарный диабет, недостаточная активность гипофизарно-надпочечниковой системы, щитовидной, половых желез) способствуют снижению механизмов антиинфекционной защиты организма. Более половины больных (52%) хронической пиодермией злоупотребляют углеводами (как правило, легкоусвояемыми), что создает постоянную перегрузку инсулярного аппарата поджелудочной железы и может способствовать расстройствам углеводного обмена той или иной степени, накоплению в тканях углеводов, являющихся благоприятной питательной средой для пиококков. Существен-ную роль отводят также себорейному состоянию кожи. Вследствие увеличения количества кожного сала и изменения его химического состава происходит снижение стерилизационных свойств кожи и активации гноеродных кокков .
Немаловажное значение в развитии гнойничковых заболеваний кожи имеют хронические инфекционные заболевания различных органов и тканей: пародонтоз, кариес, гингивит, тонзиллит, фарингит, инфекции урогенитального тракта, дисбактериоз, кишечные интоксикации, снижающие общую и местную антибактериальную резистентность организма и способствующие развитию у больных последующей специфической сенсибилизации, которая отягощает течение инфекционного процесса. Существенную роль в развитии хронической пиодермии играют заболевания центральной и вегетативной нервной системы, умственное или физическое перенапряжение, «истощающие заболевания» - алкоголизм, голодание, неполноценное питание (недостаток белков, витаминов, минеральных солей, гиповитаминозы, особенно А и С. Витамин А участвует в процессе кератинообразования, витамин С регулирует проницаемость сосудистой стенки, является синергистом кортикостероидов). Большую роль в развитии пиодермий играют различные иммунодефицитные состояния, возникающие вследствие врожденного или приобретенного иммунодефицита (ВИЧ-инфекция, прием глюкокортикостероидов, цитостатиков и иммунодепресантов). Дефекты клеточной антибактериальной защиты в виде угнетения фагоцитарной активности нейтрофилов, нарушения хемотаксиса, а также снижение опсонических факторов сыворотки крови и иммуноглобулинов способствуют хронизации инфекции и частым рецидивам .
Важнейшее значение в патогенезе ИКМТ имеют нарушения Т-клеточной системы иммунитета. В основе расстройств специфических механизмов иммунологической реактивности лежит уменьшение числа Т-лимфоцитов в периферической крови, снижение количества СD3- и CD4-клеток и изменение их взаимосвязи с моноцитами, что приводит к ослаблению Т-клеточного иммунного ответа. Недостаточность иммунной системы (иммунологический дисбаланс) больного и антигенная мимикрия возбудителя нередко ведут к хронизации инфекции и формированию бактерионосительства, а нерациональное применение антибиотиков - к резистентности возбудителя .
Весомое значение в развитии бактериальных инфекций кожи имеют неблагоприятные воздействия окружающей среды, нарушающие целостность кожного покрова и создающие «входные ворота» для проникновения инфекции. К ним в первую очередь относят влияние высокой или низкой температуры, повышенной влажности, приводящей к мацерации кожи, повышенное загрязнение и микротравматизации профессиональными факторами (маслами, цементом, угольной пылью). Входные ворота для инфекции возникают при бытовых микротравмах (порезы, уколы), расчесах при зудящих дерматозах. Нарушение кожного барьера в виде сухости и истончения рогового слоя способствуют проникновению микроорганизмов в глубокие слои кожи и подлежащие ткани, что приводит к развитию пиодермического процесса.
Клинические разновидности ИКМТ
ИКМТ представляют собой достаточно многочисленную и разнородную по клинической картине группу заболеваний, приводящих к поражениям различной глубины, распространенности и степени тяжести. Общим, характерным для всех признаком является наличие локального гнойного воспаления, при тяжелом течении сопровождающегося развитием системной воспалительной реакции. Клинические формы зависят от вида этиологического фактора, анатомической локализации, приуроченности к придаткам кожи, глубины и площади поражения, длительности течения процесса.
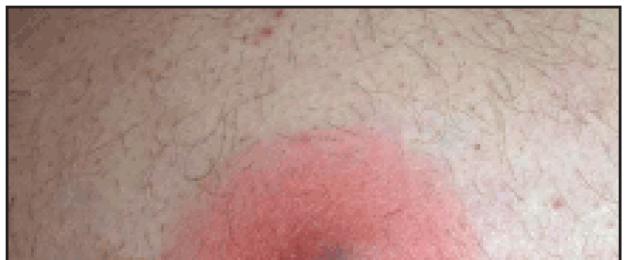
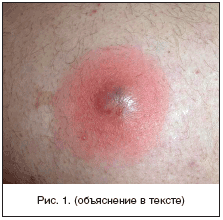
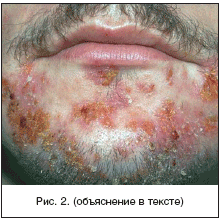
В отечественной дерматологии принята классификация первичных пиодермий, предложенная J. Jadasson еще в 1934 г. и построенная по этиологическому принципу. В ней выделяют: стафилодермии, преимущественно поражающие кожу вокруг придатков (саль-но-волосяных фолликулов, потовых желез); стрептодермии, поражающие гладкую кожу преимущественно вокруг естественных отверстий и смешанные стрепто-стафилококковые инфекции. В каждой из трех групп в зависимости от глубины поражения выделяют поверхностные и глубокие формы. Кроме того, гнойничковые заболевания кожи разделяют на первичные, возникающие на неизмененной кожи, и вторичные, развивающиеся как осложнения на фоне уже существующего дерматоза, как правило, зудящего (чесотки, экземы, атопического дерматита). По длительности течения различают острые и хронические пиодермии. Стафи-лок-коковые пиодермии обычно связаны с придатками кожи (волосяными фолликулами, апокриновыми железами). Для них характерно образование глубокой пустулы, в центре которой формируется полость, заполненная гнойным экссудатом. По периферии располагается зона эритематозно-отечной воспалительной кожи. Нагноительный процесс заканчивается формированием рубца (рис. 1). Стрептококковые пиодермии чаще развиваются на гладкой кожи, вокруг естественных отверстий (полости рта, носа) и начинаются с образования фликтены - поверхностно расположенного пузыря с дряблой складчатой покрышкой, внутри которого содержится серозно-гнойное содержимое. Тонкие стенки фликтены быстро вскрываются, и содержимое изливается на поверхность кожи, ссыхаясь в медово-желтые слоистые корочки. Процесс склонен к распространению по периферии в результате аутоинукуляции (рис. 2). Стафилодермиями чаще страдают мужчины, стрептодермиями - женщины и дети .
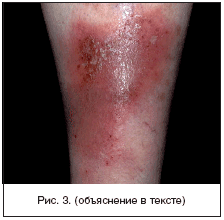
В зарубежной литературе все ИКМТ с практической точки зрения делят на три основные группы: первичные пиодермии, в подавляющем большинстве вызванные S. aureus и пиогенными b-гемолитическими стрептококками (преимущественно группы А), и развивающиеся на неизмененной коже (фолликулит, импетиго, рожистое воспаление); вторичные пиодермии развивающиеся на фоне повреждений кожи или сопутствующей соматической патологии (например, пролежни, диабетическая язва стопы, инфекции после укусов животных, послеоперационные раневые и посттравматические инфекции), а также на фоне дерматозов, сопровождающихся зудом и расчесами (аллергический дерматит, псориаз, чесотка и т.д.); некротические инфекции, представляющие наиболее тяжелую форму ИКМТ (целлюлит полимикробной этиологии - синергидный целлюлит, некротизирующий фасциит, мионекроз - газовая гангрена) (рис. 3). При данной патологии определение глубины и распространенности поражения является приоритетом врача-хирурга, т.к. только при хирургической обработке можно наиболее точно определить истинную степень распространения инфекции. Начальная тактика ведения этих пациентов одинакова. Она заключается в раннем проведении хирургического вмешательства и назначении адекватной антимикробной терапии .
Лечение ИКМТ
Терапия больных с бактериальными инфекциями кожи должна быть комплексной (этиотропной и патогенетической) и проводиться после тщательного анамнестического, клинического и лабораторного обследования больного. Необходимо выявление и лечение сопутствующих заболеваний, обследование на очаги фокальной инфекции, а в случае длительно персистирующего процесса - исследования иммуностатуса. Основным и единственным методом этиотропного лечения больных ИКМТ являются антибиотики. При острых поверхностных нераспространенных процессах (импетиго, фолликулиты, паронихии) терапия может быть ограничена местным применением антибиотиков и антисептиков. Во всех прочих случаях требуется проведение системной антибактериальной терапии.
Показаниями к назначению системной антибиотикотерапии являются глубокие формы пиодермий: фурункулы (особенно с локализацией на лице и шее), карбункул, гидраденит, рожистое воспаление, целлюлит. Перечисленные формы бактериальных инфекций кожи имеют длительное, нередко хроническое рецидивирующее течение, большую распространенность процесса и часто сопровождаются симптомами общей интоксикации в виде лихорадки, головной боли, слабости, а также развитием регионарных осложнений (лимфаденит, лимфангит). В качестве этиотропного средства антибиотики используются при лечении дерматоза бактериальной природы - болезни Лайма. Они являются препаратами выбора при лечении вульгарных угрей. В дерматовенерологической практике антибиотики широко применяются как для лечения инфекционных дерматозов, так и заболеваний, обусловленных инфекциями, передающимися половым путем (ИППП) .
Перед назначением антибактериального препарата желательно производить посев гноя с определением чувствительности выделенного микроорганизма к различным антибиотикам и по результатам исследования назначать соответствующий препарат. Однако это не всегда выполнимо, особенно при угрозе или развитии осложнений инфекции. Как показывает анализ современной литературы и собственный клинический опыт, сегодня наиболее часто в лечении бактериальных инфекций кожи используются следуюшие группы антибиотиков: 1. β-лактамы: а) природный пенициллин, его дюрантные формы и полусинтетические пенициллины; б) цефалоспорины (1-4 поколения). 2. Макролиды. 3. Тетрациклины. 4. Фторхинолоны.
В последние годы пенициллин и его дюрантные препараты редко применяются в терапии ИКМТ, так как подавляющее число штаммов пиококков приобрели способность продуцировать фермент b-лактамазу (пенициллиназу), подавляющую антибактериальную активность пенициллина. Кроме того, β-лактамы относятся к препаратам, имеющим высокую частоту аллергических реакций.
Тетрациклины, аминогликозиды в настоящее время используются значительно реже. Это связано с большим количеством резистентных штамов микроорганизмов к этим антибиотикам (из чего следует их низкая терапевтическая активность), а также с наличием тяжелых побочных эффектов. Следует помнить, что тетрациклины противопоказаны при беременности, детям и пациентам с печеночной недостаточностью.
Фторхинолоны назначаются в основном при лечении заболеваний, передающихся половым путем, из-за высокой чувствительности к ним возбудителей урогенитальных инфекций, а при пиодермиях используются только при неэффективности других групп антибиотиков. Однако при заболеваниях центральной нервной системы, у беременных, а также в педиатрии диапазон их применения ограничен - они назначаются в основном по жизненным показаниям. Необходимо также не забывать и о фотосенсибилизирующем эффекте фторхинолонов, и связанных с этим мерах предосторожности, особенно весной и летом .
Современная лечебная практика предъявляет к выбору антибиотика определенные требования. Прежде всего препарат должен обладать широким спектром антимикробного действия и минимально выраженной антибиотикорезистентностью к микробным агентам, не иметь тяжелых побочных действий, обладать минимальным риском развития аллергических реакций, быть удобным в применении для пациента (наличие пероральной формы, удобного режима дозирования) и доступным по цене. Кроме того, очень важно, чтобы у антибиотика отсутствовали клинически значимые взаимодействия с другими лекарственными препаратами. На сегодняшний день этим требованиям в полной мере соответствуют антибиотики - макролиды.
Классификация и механизмы
фармакотерапевтического действия
макролидов
Макролиды уже более 50 лет широко используются в клинической практике. Первый природный антибиотик этой группы - эритромицин (метаболит Streptomyces erythreus) был получен еше в 1952 году. Макролиды можно классифицировать по химической структуре и по происхождению. Основу химической структуры данного класса антибиотиков составляет макроциклическое лактонное кольцо. В зависимости от числа атомов углерода в кольце макролиды подразделяются на 14-, 15- и 16-членные (табл. 2).
Среди макролидов выделяют 3 поколения:
а) первое поколение: эритромицин, олеандомицин;
б) второе поколение: спирамицин, рокситромицин, джозамицин, кларитромицин и др.;
в) третье поколение: азитромицин (Азитрал).
Антибактериальный эффект макролидов основан на нарушении синтеза рибосомальных белков микробной клетки и ингибировании тем самым процесса воспроизведения возбудителя. Они в основном оказывают бактериостатический эффект, что обусловливает целесообразность их назначения в острой фазе воспаления. Макролиды относятся к «тканевым антибиотикам», т.е. при распределении в организме они накапливаются преимущественно не в кровяном русле, а в тех органах и тканях, где имеется воспаление, создавая тем самым высокие концентрации препарата. Хорошо распределяясь в организме, макролиды способны преодолевать гистогематологические барьеры (за исключением гематоэнцефалического), значительно превосходя в этом β-лактамные антибиотики. Однако широкое (и часто необоснованное) применение достаточно быстро привело к появлению высокого процента эритромициноустойчивых штамов возбудителей, особенно стафилококов. Это, в свою очередь, значительно снизило использование эритромицина в клинической практике .
Интерес к макролидам вновь возник в начале 80-х годов XX века, после появления новых поколений антибиотиков этой группы - азалидов (в частности, азитромицина). Азитромицин был синтезирован в 1983 году на основе эритромицина. Препарат по своим фармакокинетическим свойствам превзошел все показатели своего предшественника и стал первым представителем новой группы антибиотиков - азалидов. Уникаль-ность азитромицина базируется на его исключительной фармакокинетике. Азитромицин устойчив в кислой среде, благодаря чему хорошо всасывается после приема внутрь. Одновременный прием с пищей уменьшает всасывание на 50%, поэтому препарат принимают за 1 час до или через 2 часа после еды. Липофильность молекулы азитромицина обеспечивает, помимо высокого уровня всасывания в кишечнике, еще и отличное проникновение препарата в ткани. Быстрое проникновение азитромицина из крови в ткани обеспечивается также низким уровнем связывания азитромицина с белками крови, что дает возможность достигать быстрого терапевтического эффекта при инфекциях, поражающих клетки и ткани. Высокая концентрация препарата в области поражения, в 10-100 раз превышающая концентрацию в кровяном русле, позволяет активно воздействовать на патогенный очаг, тем самым обеспечивая быстрый клинический эффект и скорейшее выздоровление. Совре-менные макролиды (в частности, азитромицин) проявляют наибольщую эффективность в отношении таких возбудителей, как S. pyogenus, S. aureus, S. pneumoniae, некоторых грамотрицательных микроорганизмов (гонококи), а также внутриклеточных возбудителей (в частности, Chlamidia trachomatis и Ureaplas-ma urealyticum), что обусловливает их высокую востребованность в дерматовенерологической практике .
Важное значение для антибактериальной активности макролидов второго поколения имеет их взаимодействие с нейтрофилами. Благодаря своей способности проникать внутрь нейтрофилов и создавать в них высокие концентрации, многие макролиды позитивным образом модифицируют функции данных клеток, влияя, в частности, на хемотаксис, активность фагоцитоза и киллинга. Наряду с противомикробным действием данные антибиотики обладают умеренной противовоспалительной активностью. Активируя клетки макрофагального ряда, они способны проникать в них и при миграции фагоцитирующих клеток в очаг воспаления поступать туда вместе с ними. Уникальность этих препаратов заключается еще и в том, что они обладают выраженным постантибиотическим эффектом, то есть сохраняют высокие концентрации в очаге воспаления в течение 5-7 дней после отмены. Данный саногенетический эффект позволил разработать короткие курсы лечения, не превышающие 3-5 суток, и удобный режим дозирования (1 раз в сутки). Это, в свою очередь, обеспечивает комплаентность лечения и повышает качество жизни больного. Наиболее выражен постбиотический эффект у азитромицина, что позволяет создавать в очагах инфекции концентрацию антибиотика, многократно превышающую МПК в отношении активных возбудителей при лечении как острых, так и хронических инфекций. В последнее время получены доказательства иммуномодулирующего действия азитромицина в эксперименте на здоровых добровольцах. Первая фаза иммуномодулирующего эффекта состоит в дегрануляции нейтрофилов и оксидантного взрыва, что способствовало активизации защитных механизмов. По достижении эрадикации возбудителей отмечалось уменьшении продукции ИЛ-8 и стимуляция апоптоза нейтрофилов, что минимизировало выраженность воспалительной реакции .
Макролиды, как природные, так и полусинтетические, по сравнению с другими антибиотиками оказывают минимальное влияние на нормальную микрофлору человеческого организма и не вызывают дисбиоза. Поэтому азитромицин рассматривается не только как высокоэффективный, но и наиболее безопасный антибиотик с минимальным числом противопоказаний к назначению. Нежелательные реакции при его приеме в целом встречаются крайне редко и не превышают 5%. Наиболее частыми побочными эффектами являются симптомы со стороны желудочно-кишечного тракта (тошнота, тяжесть в эпигастральной области), которые, как правило, выражены умеренно, не требуют отмены препарата и быстро проходят при приеме лекарств после еды .
Клиническая эффективность азитромицина
Как свидетельствуют сравнительные исследования, при ИКМТ среди антибиотиков, применяющихся в амбулаторной практике, наиболее эффективны макролиды нового поколения, в первую очередь 15- и 16-членные (азитромицин, джозамицин, рокситромицин). Накоп-лен уже 20-летний положительный опыт применения азитромицина в отечественной дерматовенерологической практике. В дерматологии он являются базовой терапией стафилококковых и стрептококковых поражений кожи и мягких тканей (фурункул, импетиго, целлюлит), а в венерологической практике - при лечении ИППП. В отличие от большинства макролидов у азитромицина отсутствуют клинически значимые взаимодействия с другими лекарственными препаратами. Он не связывается с ферментами комплекса цитохрома Р450, вследствие чего не проявляет реакции лекарственного взаимодействия с препаратами, метаболизирующимися по этому пути. Это свойство является немаловажным, поскольку в реальной клинической практике большинство больных, у которых возникают ИКМТ, имеют фоновые или сопутствующие заболевания, по поводу которых получают соответствующее лечение. Также необходимо подчеркнуть, что наряду с хорошей переносимостью и отсутствием выраженных побочных реакций макролиды (азитромицин) имеют еще одно безусловное преимущество по сравнению с другими группами антибиотиков - это то, что он может назначаться беременным и детям .
В настоящее время одним из наиболее часто применяемых препаратов в клинической практике является препарат Азитрал (азитромицин), производимый фармацевтической компанией «Shreya Life Sciences». Азитрал (азитромицин) аналогичен оригинальному азитромицину - первому представителю подгруппы азалидов из группы макролидных антибиотиков, используемому в лечении ИКМТ и урогенитальных инфекций. Исследования показали, что клиническая эффективность препарата, назначаемого в разовой дозе 500 мг в течение 3 дней, сопоставима с эффективностью большинства широко применяемых антибактериальных средств. Это позволяет в 2-3 раза сократить обычный курс антибиотикотерапии, а уникальный фармакокинетический профиль Азитрала обеспечивает одноразовый суточный прием и высокую комплаентность терапии .
Благодаря особенностям фармакокинетики и своеобразному спектру антимикробного действия, охватывающему основных возбудителей инфекций мочеполового тракта, азитромицин является препаратом первого выбора в терапии сочетанных ИППП, в том числе хронического осложненного урогенитального хламидиоза и ВЗОМТ у небеременных женщин, и альтернативным средством для лечения этого заболевания в период беременности. При однократном приеме 1 г азитромицина (Азитрала) его концентрация в течение недели в ткани предстательной железы и матки превышает МПК для C. trachomatis (0,125 мкг/мл) в 42,5 раза, а в цервикальном канале - в 12 раз, что является терапевтической концентрацией для лечения этой инфекции. Более того, даже спустя 2 недели терапевтическая концентрация азитромицина в ткани предстательной железы превышает МПК для C. trachomatis в 13,6 раз. Авторами было доказано, что именно при таком приеме в тканях, где вегетируют C. trachomatis, поддерживается высокая терапевтическая концентрация препарата в течение 6-8 циклов развития. Полученные данные свидетельствуют о высокой эффективности пульс-терапии Азитралом (по 1 г 1 раз в неделю, курсовая доза 3 г). в комплексном лечении хронического хламидийного уретропростатита и ассоциирующейся с ним микоуреаплазменной и гарднереллезной инфекции. Важно отметить, что препарат Азитрал хорошо переносится больными, доступен по цене и поэтому может широко использоваться в терапии осложненного урогенитального хламидиоза и ВЗОМТ .
Изучение эффективности, безопасности и переносимости азитромицина у 30 детей от 6 месяцев до 3 лет со стафилококковыми инфекциями различной локализации ЛОР-органов и кожи показало, что азитромицин (Азитрал) не уступает по эффективности антистафилококковым пенициллинам. Наряду с высокой эффективностью, характеризующейся быстрой и стойкой обратной динамикой основных клинических симптомов и местных воспалительных изменений в 100% случаев отмечалась хорошая переносимость препарата и отсутствие побочных явлений у всех детей. Широкий спектр антимикробной активности, особенности фармакокинетики, низкий процент нежелательных явлений и ряд преимущества перед другими макролидами обусловливают приоритет использования препарата при различных кожных инфекционных процессах (импетиго, фурункулез, фолликулит, целлюлит, паронихия) у детей. Эффективность азитромицина в педиатрической практике, доказанная клиническими испытаниями, позволяет рекомендовать его в качестве альтернативы b-лак-там-ным антибиотикам, а у детей с отягощенным аллергоанамнезом - как препарат выбора .
Одним из важнейших фармакоэкономических показателей, определяющих выбор антибиотика, является соотношение стоимость/эффективность. Оно определяется, как отношение стоимости лекарственного лечения (для пероральных препаратов она равна стоимости курсовой дозы) к доле успешно пролеченных больных. Следует обратить внимание на то, что Азитрал среди существующих препаратов азитромицина проявляет оптимальное соотношение цена/качество .
Известно, что неэффективность антибиотикотерапии во многом определяется снижением чувствительности к применяемому препарату. В настоящее время клинически значимая резистентность к азитромицину отсутствует. По данным мониторинга антибиотикорезистентности устойчивость к азитромицину и другим макролидам последнего поколения среди возбудителей ИКМТ не превышает 2-10%. Чувствительность штаммов S. pyogenes, выделенных на территории России, к антибиотику азитромицин составляет 92%. Как показано в ряде исследований, клиническая эффективность азитромицина выше, чем у тетрациклинов и b-лактамных антибиотиков. Сравнительное клинико-микробиологическое изучение эффективности при глубоких стафилодермиях 5-дневного курса азитромицина и 10-дневного приема цефалексина показало более высокую терапевтическую активность макролида. Эрадикация возбудителя при применении азитромицина отмечалась в 94%, при цефалексине в 90% случаев, клиническое излечение - соответственно в 56 и 53% случаев. При этом частота побочных реакций, как правило, не требующих отмены препарата, не превышает 5%, что значительно ниже по сравнению с эритромицином (до 14%) или пероральными формами b-лактамов .
Таким образом, азитромицин обладает широким спектром антимикробного действия, высокой бактериостатической активностью по отношению чувствительных к нему инфекций, высокую биодоступность с избирательным действием в очаге воспаления, он малотоксичен, имеет минимум побочных эффектов и удобный режим приема. Следовательно, препарат отвечает современным требованиям рациональной антибиотикотерапии и может быть рекомендован для эффективного применения в дерматовенерологической практике.
Литература
1. Jones M.E., Karlowsky J.A., Draghi D.C, Thornsberry C., Sahm D.F., Nathwani D. Epidemiology and antibiotic susceptibility of bacteria causing skin and soft tissue infections in the USA and Europe: a guide to appropriate antimicrobial treatment. Int J Antimicrob Agent 2003; 22:406-19.
2. Н.Н. Мурашкин, М.Н. Глузмина, Л.С. Галустян. Гнойничковые поражения кожи в практике детского дерматолога: свежий взгляд на старую проблему. РЖКВБ: Научно-практический журнал, 2008, №4, с. 67-71.
3. Белькова Ю.А. Пиодермии в амбулаторной практике. Болезни и возбудители. Клиническая микробиология и антимикробная химиотерапия: № 3, том 7, с. 255-270, 2005.
4. Т.А. Белоусова, М.В. Горячкина. Бактериальные инфекции кожи: проблема выбора оптимального антибиотика. РМЖ 2005, том 13, №16, с. 1086-1089.
5. Таха Т.В., Нажмутдинова Д.К. Рациональный выбор антибиотикотерапии при пиодермиях. РМЖ 2008, том 16, №8, с. 552-555.
6. Новоселов В.С., Плиева Л.Р. Пиодермии. РМЖ 2004, том 12, №5, с. 327-335.
7. Масюкова С.А., Гладько В.В., Устинов М.В., Владимирова Е.В., Тарасенко Г.Н., Сорокина Е.В. Бактериальные инфекции кожи и их значение в клинической практике дерматолога. Consilium medicum 2004, том 6, №3, с. 180-185.
8. T. File. Diagnosis and antimicrobial therapy of skin and soft tissue infections. Ohio, USA. Клиническая микробиология и антимикробная химиотерапия: № 2, том 5, с. 119-125, 2003
9. Шляпников С.А., Федорова В.В. Использование макролидов при хирургичесаких инфекциях кожи и мягких тканей. МРЖ,2004.-т.12,№4,с204-207
10. Гучев И.А., Сидоренко С.В, Французов В.Н. Рациональная антимикробная химиотерапия инфекций кожи и мягких тканей. Антибиотики и химиотерапия. 2003, т.48, 10, с.25-31
11. Parsad D., Pandhi R., Dogras S. A guide to selection and appropriate use ofmacrolides in skin infection Am J Clin Dermatol 2003; 4:389-97
12. Яковлев С.В., .Ухтин С.А. Азитромицин: основные свойства, оптимизация режимов применения на основе фармакокинетических и параметров. Антибиотики и химиотерапия. 2003 т. 48, №2. - с. 22-27
13. Туровский А.Б,.Колбанова И.Г Макролиды в лечении инфекций дыхательных путей с позиций ЛОР-врача: «за» и «против» Consilium medicum, 2010г.,№4, том.12, с.11-14.
14. Прохорович Е.А. Азитромицин. От клинической фармакологии к клинической практике. РМЖ 2006, том 14, №7, с. 567-572
15. Бердникова Н.Г. Актуальные аспекты применения азитромицина (Азитрал) в терапии внебольничных пневмоний у взрослых. РМЖ 2006, том 14, №22, с. 1625-1628.
16. Хрянин А.А., Решетников О.В. Макролиды в лечении хламидийной инфекции у беременных (эффективность, безопасность, экономичность). РМЖ 2008, том 16, №1, с. 23-27.
17. Серов В.Н., Дубницкая Л.В., Тютюнник В.Л. Воспалительные заболевания органов малого таза: диагностические критерии и принципы лечения. РМЖ 2011, том 19, №1, с. 46-50.
18. Талашова С.В. Некоторые аспекты применения антибактериальных препаратов в педиатрии на примере макролидов. РМЖ 2009, том 17, №7, с. 464-466
19. Мазанкова Л.Н., Ильина Н.О. Место азалидов в педиатрической практике. РМЖ 2008, том 16, №3, с. 121-125.
20. Соловьев А.М., Поздняков О.Л., Терещенко А.В. Почему азитромицин считается препаратом выбора для лечения урогенитальной хламидийной инфекции. РМЖ 2006, том 14, №15, с. 1160-1164.
21. Гуров А.В., Изотова Г.Н., Юшкина М.А. Возможности применения препарата Азитрал в терапии гнойно-воспалительных заболеваний ЛОР-органов. РМЖ 2011, том 19, №6, с. 405.
22. Klani R. Double-blind, double-dummy comparison of azithromycin and cephalexin in the treatmen of skin and skin structure infection. Eur.J. Clin. Microbiol. Infect.Dis. 1999,Oct. 10 (10) - p.880-84
При атопическом дерматите благоприятные условия для развития инфекции на коже. Часто с кожи или слизистой носоглотки высевают золотистый стафилококк (Staphylococcus aureus), эпидермальный стафилококк (Staphylococcus epidermalis) и условно-патогенные грибы (Malassezia furfur, Candida, Rhodotomla rubra). Токсины микробов поддерживают аллергическое воспаление. Такой дерматит плохо лечится.
Какие бывают инфекции кожи
Стафилококки вызывают стафилодермию, стрептококки — стрептодермию. Чаще всего инфекция на коже смешанная — стрептостафилодермия.
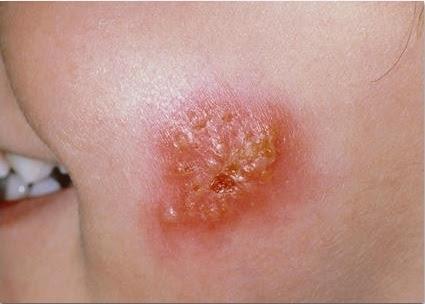
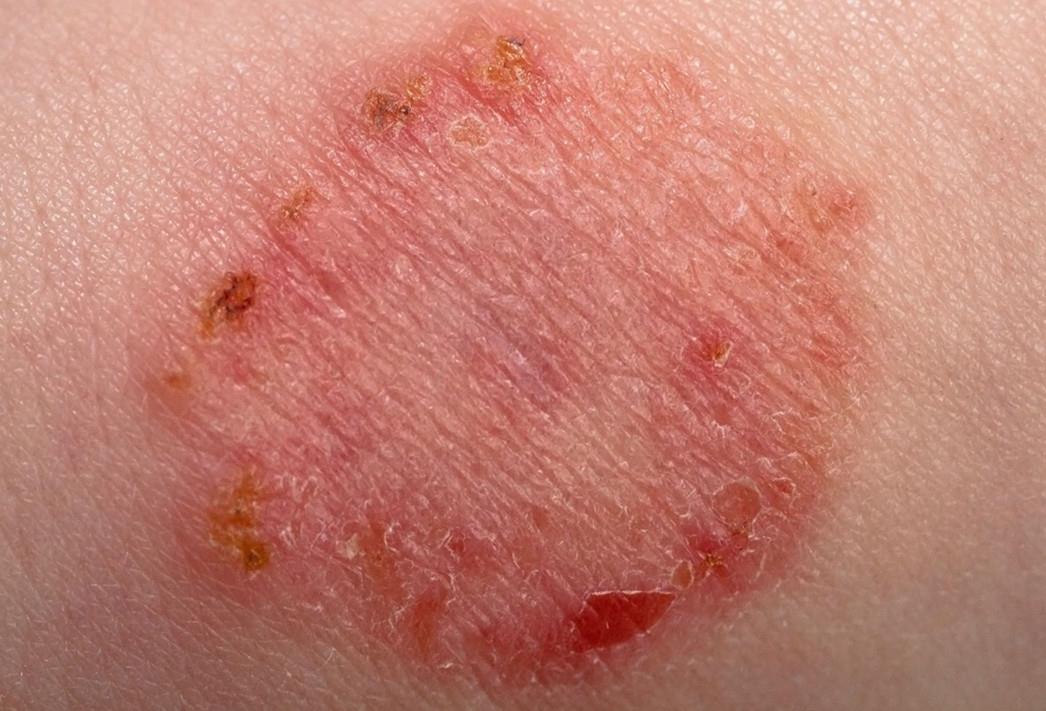
Поверхностные стафилодермии — это маленькие пузырьки с кровянисто-гнойным отделяемым на красном фоне, белые горошинки-гнойнички вокруг волосков, воспаление желез в подмышках, слуховом проходе, коже вокруг ануса и половых органов.
 |
 |
||
| Фото. Разные стадии поверхностной стафилодермии. Начинается все с одного маленького бугорка, вокруг которого по цепочке отпочковываются новые элементы. Бугорки превращаются в пузырьки, а пузырьки — в корочки. | |||
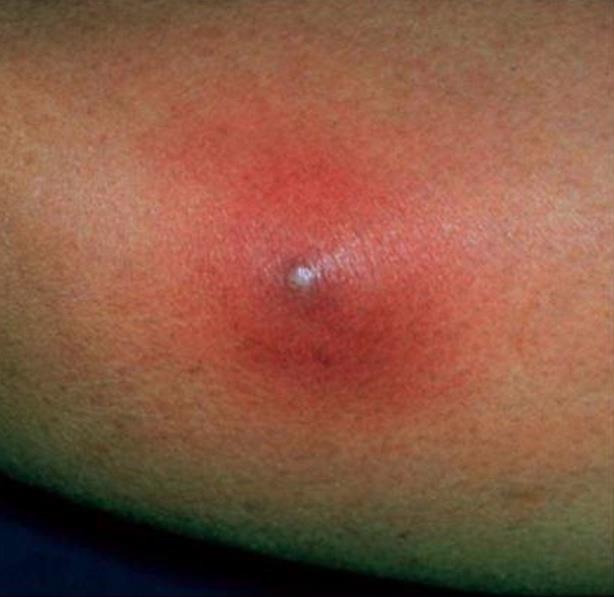
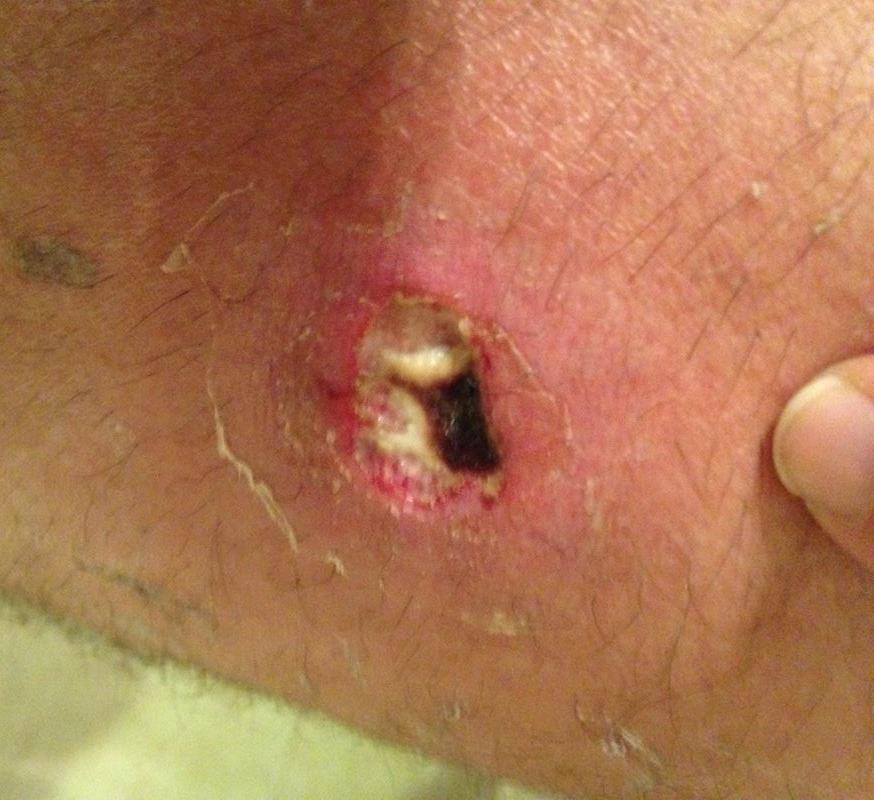
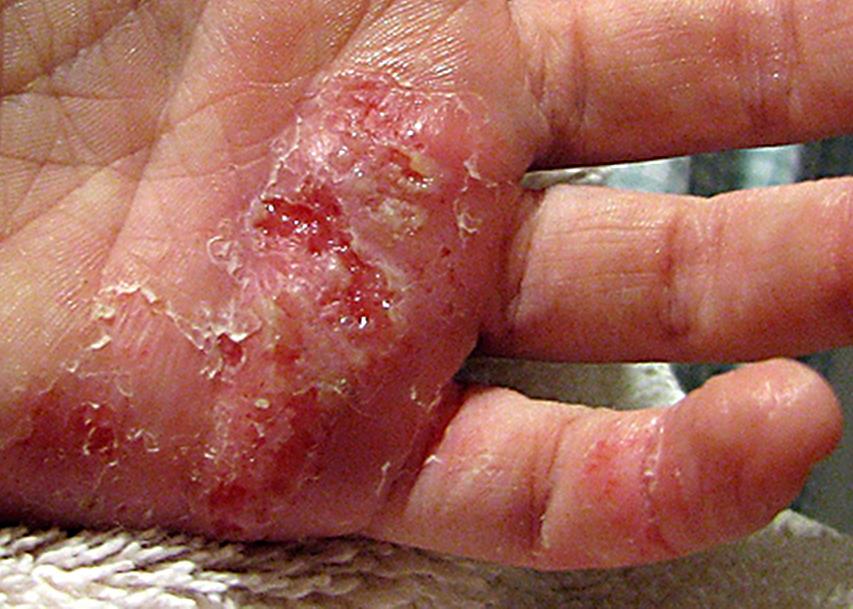
Глубокие стафилодермии — это фурункулы, карбункулы, абсцессы кожи.
 |
 |
 |
|
| Фото. А — фолликулит. Б, В — фурункул. | |||
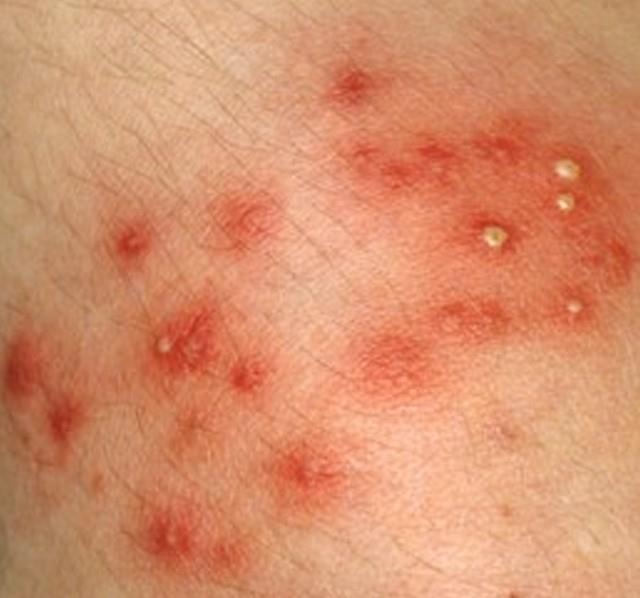
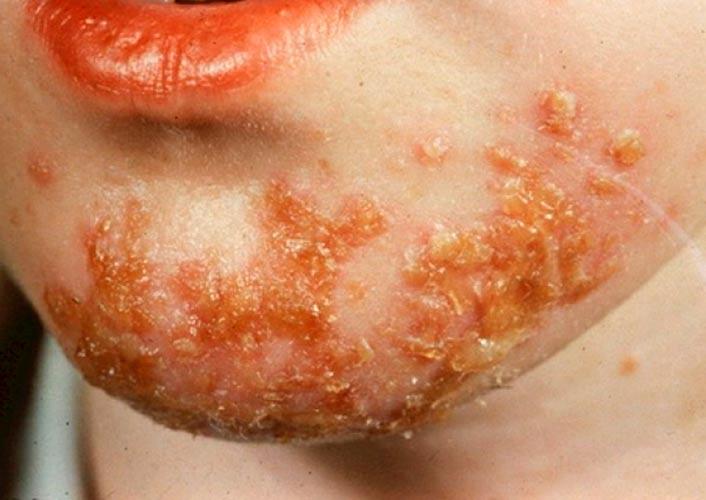
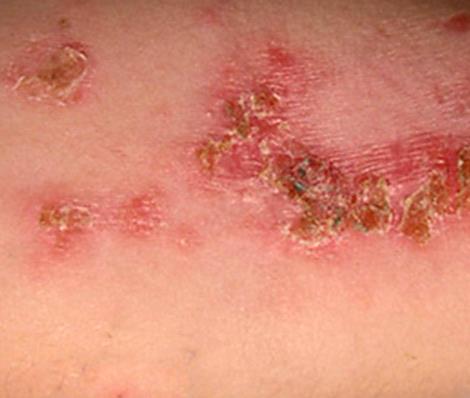
Стрептодермия — это дряблые пузыри на красном фоне быстро вскрываются и образуют язвы с коричневыми корочкам.
 |
 |
 |
|
| Фото. Стрептодермия кожи. | |||
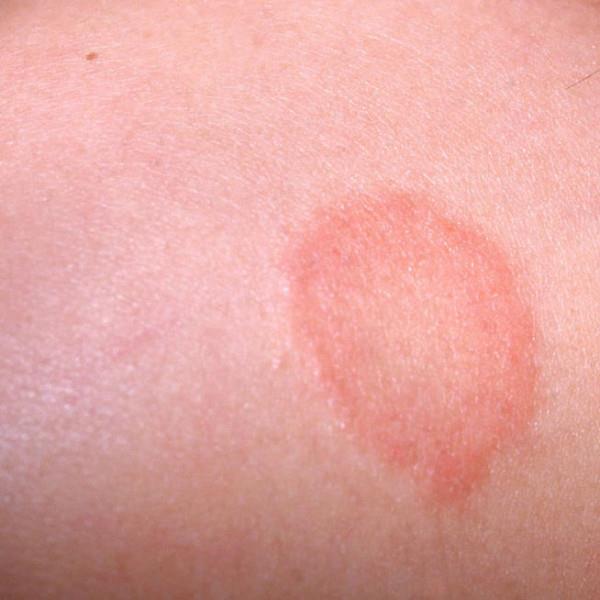
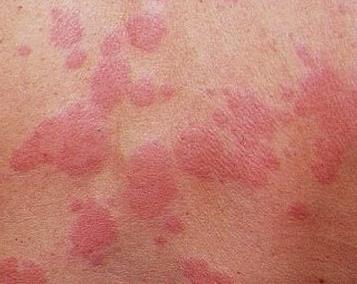
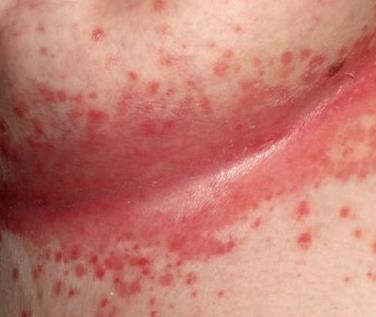
Грибковая инфекция кожи — это ярко красные пятна с четкими приподнятыми краями и очень мелкими точечками-пузырьками; трещины и раздражение с белыми налетами; заеды в углах рта, трещины и воспаление на губах с белым налетом.
 |
 |
 |
|
| Фото. Грибковая инфекция кожи. | |||
Кремы, мази, спреи для лечения инфекции кожи
Для лечения инфекционных осложнений при атопическом дерматите используют крем Тридерм (дешевые аналоги — Акридерм, Кандидерм, Канизон плюс), Пимафукорт (похожие препараты, только без противогрибкового компонента — Кортомицетин, Гиоксизон, Оксикорт), Скин-кап (дешевые аналоги — Цинокап, Десетин, цинковая мазь, Судокрем).
Тридерм содержит гормон (бетаметазона дипропионат 0,05%), антибиотик (гентамицина сульфат 0,1%) и противогрибковое средство (клотримазол). Гормон обладает противовоспалительным и противозудным действием. Антибиотик убивает бактерии, в том числе золотистый стафилококк (Staphylococcus aureus). Противогрибковое средство подавляет рост грибов. Тридерм наносят на очаги высыпаний детям с 2-летнего возраста и взрослым 2-3 раза в сутки 7-14 дней.
Детям первого года жизни рекомендуют препарат Пимафукорт , который содержит гормон гидрокортизон, противогрибковый препарат натамицин, а также антибиотик неомицин. Средство наносится на пораженные участки кожи 2-4 раза в сутки не более 10-14 дней.
После лечения тридермом или пимафукортом можно перейти на длительную терапию кремом Скин-кап . Негормональный препарат Скин-кап содержит активированный цинк перитион. Обладает противовоспалительным, противомикробным и противогрибковым действием (смотри ).
Важно!!! Лечение проводится до полного исчезновения очагов инфекции
Лечебная косметика при атопическом дерматите
После удаления очагов инфекции проводят местную поддерживающую терапию лечебной косметикой.
DARDIA (липо-молочко, липо-крем, липо-бальзам), Mustela Stell Atopia, линия А-Дерма, Авен (Дерма-либур, Сикальфат), Vichy (липидиоз, нутриложи), Laboratoires Nygy-Charlieu (топикрем), Avene (Трикзера), Uriage (Cu-Zn-крем, спрей), Ла Рош-Позе (Липикар, Гидранорм) и др.
После купания необходимо применять увлажняющие и смягчающие средства, соблюдая «правило 3-х минут» — на влажную кожу в течение 3-х минут после купания нанести увлажняющее средство.
При инфекции кожи назначают антибиотики
- если инфекция кожи, протекает с температурой и интоксикацией;
- если в общем анализе крови воспалительные изменения;
- при глубокой стафилодермии — фурункулез, карбункулы, абсцессы;
- если нет эффекта от наружных средств в течение 3-5 дней.
Для лечения инфекции кожи подходят макролиды (Сумамед, Вильпрафен, Клацид) или цефалоспорины II и III поколения (Супракс, Зиннат, в тяжелых случаях — Цефтриаксон внутривенно). Курс лечения составляет 5-7 дней.
Лечение антибиотиками сочетают с наружными средствами. Кожу обрабатывают Мирамистином, Хлоргексидином, Фукорцином, зеленкой, синькой, Хлорфилиптом, Бактробаном, синтимициновой эмульсией, Левомиколем.
Важно!!! Стафилококк в соскобах с кожи при отсутствии жалоб, а также поверхностная стафилодермия не являются показанием для назначения антибиотиков. Лечение ограничивается наружной терапией.
Назначают противогрибковые таблетки
- при инвазивных формах кандидоза (определение в сыворотке крови ЦКА);
- при высеве с кожи дерматомицетов в любых концентрациях;
- если нет эффекта от наружной противогрибковой терапии 3-5 дней.
Для лечения кандидозной инфекции используют флуконазол (Дифлюкан, Флюкостат, Микосист и др.). Он разрешен у детей с рождения. Флуконазол активен против дрожжеподобных грибов рода Candida, Rhodotorula и Malassezia furfur, а также дерматомицет, чувствительных к препарату. Флуконазол назначается по 3-5 мг/кг ежедневно 7-14 дней (капсулы или суспензия).
Тербинафин (ламизил и др.) назначают при инфицировании дерматомицетами и плесневыми грибами (Aspergillus, Penicillium), а также при кандидозной инфекции, устойчивой к флуконазолу. Препарат разрешен с 2-х лет. Дозы: 2-5 лет — 62,5 мг в сутки; 5-12 лет — 125 мг в сутки; 12-15 лет — 250 мг в сутки. Курс составляет 10-14 дней — при легком течении, 2-3 недели — при среднетяжелом, 3-4 недели — при тяжелом течении.
Из-за переоценки возможностей антибиотиков в лечении нагноительных заболеваний можно пропустить момент, когда необходимо приступить к более рациональному первичному или дополнительному оперативному вмешательству. Успех лечения гнойно-воспалительных заболеваний определяется рациональным подходом к каждому больному, изучением особенностей и свойств возбудителя или их ассоциаций. Применение антибиотиков не заменяет хирургического вмешательства, а лишь дополняет его.
На долю антибактериальной и дезинтоксикационной терапии в снижении летальности больных с гнойно-воспалительными заболеваниями приходится 20—30 % успеха; при перитоните успех составляет 20 %; (Wittman D., 1991). 70—80 % успеха определяются хирургической тактикой. Тем не менее, неадекватная антибактериальная терапия играет порой определяющую роль, так, лишь на сутки позже начатое лечение увеличивает летальность при сепсисе на 10 %.
Антибактериальную терапию проводят с учетом состояния больного, свойств возбудителя или их ассоциаций. Антибиотики подбирают с учетом их тропности к органам и тканям и возможности их взаимодействия между собой при комбинированном использовании.
Классические принципы рациональной антибиотикотерапии
Эти принципы состоят в следующем:. возбудитель должен быть чувствительным к антибиотику;
. в очаге инфекционного воспаления должна быть создана терапевтическая концентрация препарата;
. комбинация антибиотиков бактерицидного и бактериостатического действия недопустима;
. нельзя совместно использовать антибиотики со сходными побочными эффектами.
При выборе антибиотиков следует ориентироваться на их активность против тех или иных возбудителей. Сводные данные приводит М.Н. Зубков (2000).
Знание чувствительности микроорганизма необходимо для правильного применения антибиотика, а для прогнозирования клинического эффекта необходимо учитывать его вероятную концентрацию в очаге инфекции и результаты применения препарата для лечения конкретной инфекции.
В практике гнойной хирургии антибактериальную терапию начинают чаще всего с эмпирического подбора препаратов.
Сложившиеся представления об этиологии бактериальных инфекций при разных формах и локализации процесса и основные характеристики антибиотиков являются основой для проведения эмпирической (в том числе комбинированной) антимикробной терапии до выделения возбудителя.
В торакальной хирургии гнойно-деструктивные заболевания легких развиваются чаще на фоне пневмонии, после проведенной амбулаторно или в стационаре длительной антибиотикотерапии. Меньше времени проходит до поступления в стационар при аспирационных абсцессах легкого, гангрене легкого. У детей и больных трудоспособного возраста, когда возбудителями пневмонии чаще являются стафилококки, а антибиотикотерапия раньше не проводилась, лечение начинают с цефалоспоринов (цефазолин, цефомандол) в комбинации с гентамицином, так как полностью нельзя исключить участие в воспалительном деструктивном процессе грамотрицательной флоры.
Ванкомицин назначают сразу при длительных деструктивных пневмониях. При предшествующей антибактериальной терапии с применением цефалоспоринов первой и второй генераций показан ванкомицин в комбинации с цефалоспоринами третьей генерации (клафоран, цефтриаксон) или цефалоспоринов второй генерации с гентамицином. У стариков, ослабленных больных, у страдающих хроническим алкоголизмом, когда возбудителями пневмонии чаще являются клебсиеллы, эмпирическую терапию начинают с цефалоспоринов третьего поколения или коамоксициллина.
Микробная флора при абсцессе легкого, эмпиеме плевры, гнойном медиастините смешанная, часто включает в себя анаэробные микроорганизмы. Эмпирическую терапию в подобных случаях начинают с комбинации цефалоспоринов второго поколения, аминогликозидов и метроджила или комбинации амоксициллина с клавулановой кислотой, аминогликозидов и метроджила или диоксидина. Подобная комбинация обеспечивает широкий спектр антибактериального воздействия при достаточно высокой чувствительности микрофлоры.
Успех общей антибактериальной терапии абсцессов легкого, пиопневмоторакса, эмпиемы плевры возможен лишь при адекватном дренировании и санации гнойных очагов. При деструкции в легком выполняют санационные бронхоскопии, транспариетальные пункции и дренирование абсцесса, а при гангрене легкого — торакоабсцессотомию и некрэктомию. При эмпиеме плевры делают плевральные пункции, аспирационное дренирование. При гнойном медиастините показана экстренная операция и дренирование гнойного очага в средостении.
Тяжелое состояние больных с абсцессами, гангреной легкого, эмпиемой плевры, пиопневмотораксом, гнойным медиастинитом и с выраженным синдромом системного воспалительного ответа, сепсисе, когда возбудители и их чувствительность к антибиотикам неизвестны, эмпирическую антибактериальную терапию начинают сразу с препаратов резерва. Проведение антибактериальной терапии по классическому принципу: антибиотики первого ряда — антибиотики второго ряда — антибиотики резерва в подобных случаях крайне рискованно.
Неадекватная терапия при угрозе сепсиса или при развившемся сепсисе в течение суток создает опасность для жизни больного. В комбинацию антибактериальных препаратов в торакальной гнойной хирургии нужно включать препараты широкого спектра действия в сочетании с препаратами против анаэробной флоры (метроджил, диоксидин, клиндомицин).
Возбудители пневмонии разнообразны, но среди основных (наиболее частых) наряду со стафилококками, пневмококком встречается гемофильная палочка. Это необходимо учитывать при лечении пневмоний. Микроорганизмы рода Haemophilus часто продуцируют бета-лактамазы, которые разрушают пенициллин, ампициллин, цефалоспорины первого поколения. Это особенно важно при хроническом рецидивирующем течении болезни. Наиболее эффективны в подобных случаях цефалоспорины второго поколения или комбинации ампициллина (амоксициллина) с клавулоновои кислотой, сульбактамом. Последние ингибируют бета-лактамазы.
У пожилых, ослабленных больных пневмонии могут быть вызваны клебсиеллами (по старой терминологии — пневмонии, вызванные палочкой Фридлендера). Подобные пневмонии часто сопровождаются деструкцией легких, К. pneumoniae может быть причиной сепсиса и устойчива к цефалоспоринам первого поколения. Антибактериальный эффект удается получить при лечении клебсиельной пневмонии цефалоспоринами второго поколения или ампициллином с клавулоновой кислотой. При длительных хронических процессах К. pneumoniae резистентна ко всем цефалоспоринам.
Сочетание антибиотиков для лечения гнойных заболеваний легких и средостения предложили Т.А. Ванина с соавт. (1996). Для расширения спектра антимикробного действия, улучшения фармакокинетических параметров и одновременного достижения синергидного эффекта рекомендуют: рифампицин + амикацин; рифампицин + колистин; аугментин + хлорамфеникол; ампициллин + флуксоксациллин.
Повышение активности против внутриклеточно расположенных возбудителей (микоплазмы, хламидии) свойственно комбинациям линкомицин + тетрациклин (доксициклин, метациклин); тетрациклины + амикацин + клиндомицин; тетрациклины + фузидин + эритромицин.
Для подавления синтеза бета-лактамаз, продуцируемых пенициллиноустойчивыми штаммами, и повышения активности препаратов предлагают комбинации: аугментин, клафоран или цефазолин + клавулоновая кислота; тиенам, ципрофлоксацин или офлоксацин + линкомицин.
Абдоминальная инфекция имеет полимикробную этиологию, сопровождается большой бактериальной обсемененностью и резистентностью и быстрой сменой возбудителя. Это определяет сложности антибактериальной терапии, которую начинают, как правило, эмпирически. Лечение должно начинаться как можно раньше с учетом предполагаемого возбудителя и его свойств. Показанием к антибактериальной терапии служат ограниченный и распространенный перитонит, локализованные формы гнойной инфекции (деструктивный аппендицит, гнойный гангренозный холецистит, гнойный холангит, панкреонекроз, перфорация желудка и кишечника, экстраабдоминальное осложнение — пневмония, уроинфекция и др.).
При эмпирической терапии следует учитывать полимикробный состав флоры (энтеробактерии, в том числе Е. coli, анаэробные возбудители — бактероиды, главным образом В. Fragilis), возможна как монотерапия, так и комбинированная терапия. Показанием к комбинированной терапии служат распространенный перитонит, абдоминальный сепсис, септический шок, экстраабдоминальные очаги инфекции, полирезистентная микробная флора, иммунодефицитные состояния.
Монотерапия имеет ряд преимуществ — уменьшение риска антагонизма препаратов и токсического воздействия на те или иные органы. Монотерапию в абдоминальной хирургии можно обеспечить лишь при использовании новых антибактериальных препаратов широкого спектра действия — цефалоспоринов второго поколения — цефаперазона (сульбактама), карбопенемов — меранема, имипенема, пиперациллина/тазабактама.
Для комбинированной терапии применяют аминогликозид + клиндамицин; аминогликозид + линкомицин; аминогликозиды + цефалоспорины первого, второго поколения; аминогликозид + пиперациллин или азлоциллин. Комбинацию аминогликозидов с цефалоспориными первого, второго поколений и линкомицином дополняют антианаэробными препаратами (метроджил, клион). Недостатки аминогликозидов состоят в низкой способности проникать в воспаленные ткани и низкой активности в кислой среде в зоне воспаления.
Представляют интерес некоторые варианты антибиотикотерапии при локализованной форме гнойных заболеваний органов брюшной полости. Так, при деструктивном аппендиците используют цефалоспорины второго-третьего поколения (цефуроксим, цефотаксим или цефтриаксон + метронидазол; аминогликозиды + метронидазол; амоксициллин/клавуланат, ампициллин/сульбактам, цефоперазон/сульбактам).
При деструктивном холецистите, гнойном холангите применяют цефалоспорины второго— третьего поколений + метроджил, цефаперазон/сульбактам; фторхинолоны (ципрофлоксацин + офлоксацин + метронидазол).
При бактериальном абсцессе печени показаны цефалоспорины третьего поколения (цефаперазон, цефтриаксон, цефабаксим в сочетании с метроджилом), цефаперазон/сульбактам, амоксициллин/клавуланат, ампициллин/сульбактам, фторхинолоны (дипрофлоксацин, офлоксацин + метроджил).
При панкреонекрозе, гнойном панкреатите эффективны карбапенемы (меранем), цефалоспорины третьего поколения + метронидазол, цефаперазин (сульбактам, фторхинолоны + метроджил).
Антибактериальные препараты в процессе лечения меняют, если бактериологическое исследование показало неадекватность эмпирической терапии. При выявлении флоры, чувствительной к назначенным антибиотикам, следует продолжать применяемую антибактериальную терапию.
Отсутствие клинического эффекта терапии в течение 4 дней при условии радикального хирургического вмешательства и адекватного дренирования, а также повторные хирургические вмешательства служат показанием к смене режима антибиотикотерапии.
Клинические критерии эффективности антибактериальной терапии:
. снижение температуры тела до нормальных или субнормальных цифр на протяжении не менее 2 сут;
. обратное развитие признаков системной воспалительной реакции (нормализация лейкоцитарной формулы, устранение лейкоцитоза, снижение тахикардии);
. разрешение экстраабдоминальных инфекционных осложнений — пневмонии, уроинфекции, нагноения раны.
Риск дисбактериоза, в том числе грибковой инфекции при массивной антибактериальной терапии, сохраняется всегда. Показаниями к назначению противогрибковых препаратов служат полиорганная недостаточность, перфорации кишечника, несостоятельность анастомозов после операций на органах брюшной полости, иммунодефицитное состояние, длительная (более 7 сут) ИВЛ.
Успех эмпирической антибиотикотерапии:
. предполагаемый возбудитель или комбинация возбудителей в зависимости от локализации и характера патологического процесса и клинических проявлений болезни;
. предполагаемая чувствительность микробной флоры к назначаемым антибиотикам;
. тропность антибиотиков к тканям или органам;
. противопоказания к применению тех или иных антибиотиков;
. состояние органов инактивации и выведения антибиотиков из организма;
. комбинация препаратов или монотерапия, перекрывающая полный спектр гноеродной микробной флоры.
Выделение возбудителя, определение его чувствительности к антибактериальным препаратам определяют условия для коррекции лечения и перехода к направленной антибиотикотерапии. Подбор антибактериальных препаратов проводят не только по чувствительности микробной флоры, но и с учетом других моментов (противопоказания, возможность сочетания препаратов, их тропность к тканям и органам и др.).
Даже при проведении целенаправленной терапии обязательно назначают препараты, влияющие на анаэробную флору, особенно при длительных и тяжелых гнойно-воспалительных послеоперационных осложнениях.
Неэффективность традиционной антибактериальной терапии, отрицательные результаты бактериологических посевов в аэробных условиях служат показанием к назначению препаратов, воздействующих на неспорообразующие анаэробы.
При синегнойной инфекции или угрозе ее возникновения в комплексную терапию включают цефтазидим, ципрофлоксацин, амикацин, карбопенемы, цефипим. Для санации гнойных очагов используют растворы полимиксина.
При применении препаратов свыше 3-4 сут в комплексную терапию включают противогрибковые антибиотики (нистатин, леворин, дифлюкан) для профилактики кандидозов, а также эубиотики (бификол, лактобактерин, бифидумбактерин) для предупреждения и лечения дисбактериозов.
При гнойных операциях у больных с абсцессами легкого, эмпиемой плевры, гнойным медиастинитом, остеомиелитом ребер и грудины назначают антибиотики перед операцией. За 1—15 ч до операции можно использовать одну из схем: клафоран 1,0 + карбенициллин 2,0 внутривенно; клиндамицин 0,6 + метронидазол 0,5 г капельно во время операции; тиенам 2 г внутривенно за 1 ч до операции. Если возбудитель верифицирован, препараты назначают в зависимости от его резистентности, при отсутствии антибиотикограммы продолжают введение препаратов в течение 3-5 сут после операции.
Получили широкое распространение при лечении кожных заболеваний. Механизм их действия сложен, он зависит от химической структуры препарата и характера группы, в которую он входит.
Большинство применяемых в настоящее время антибиотиков являются полусинтетическими или полностью синтетическими соединениями, которые иногда значительно активнее, чем их природные аналоги. Антибиотики активны в основном в отношении размножающихся бактерий.
Относительно быстро после внедрения антибиотиков в практику стали появляться сообщения о случаях возникновения устойчивости к ним микроорганизмов. В связи с этим было предложено использовать в практической работе антибиограммы, т. е. определять чувствительность к разным антибиотикам штаммов микроорганизмов, выделяемых у больных.
В то же время было установлено, что иногда возможно излечение инфекционного процесса, несмотря па устойчивость возбудителей к антибиотикам in vitro. Антибиотики, несомненно, оказывают и неспецифическое действие. По-видимому, это служит одной из причин их терапевтической эффективности в тех случаях, когда возбудители болезни резистентные к данному антибиотику. Кроме того, нельзя полностью отождествлять отношение микроорганизмов к антибиотикам in vitro и in vivo.
В дерматологической практике нашли применение представители всех групп антибиотиков. Вначале антибиотики чаще всего использовали при лечении пиодермических заболеваний. Однако затем выяснилось, что сфера их применения в дерматологии значительно шире. Однако очень широкое использование антибиотиков привело не только к возникновению резистентных штаммов микроорганизмов, но и к значительному учащению побочных явлений, большей частью аллергического характера.
Группа пенициллина . Пенициллин является активным терапевтическим средством при ряде заболеваний кожи, в первую очередь при большинстве клинических форм пиодермии как стафилококкового, так и стрептококкового происхождения, включая эпидемическую пузырчатку новорожденных, эксфолиативный дерматит новорожденных, рожу. Он эффективен также при сибирской язве, ангине Симановского-Плаута-Венсана, хронической мигрирующей эритеме и др. Кроме того, пенициллин оказывает благоприятное терапевтическое действие при хроническом атрофирующем акродерматите, лимфоцитоме, герпетиформном импетиго и др. Нередко пенициллин используют при проведении комплексной терапии и ряда других заболеваний — острой и подострой красной волчанки, диффузной и ограниченной склеродермии, красного плоского лишая и др. Пенициллин применяют также в тех случаях, когда различные кожные заболевания осложняются пиококковой инфекцией. Это нередко наблюдается при экземе, почесухе, герпетиформном дерматите и др.
Беизилпенициллина калиевую или натриевую соль вводят внутримышечно по 250 000-500 000 ЕД каждые 3-4 ч или же по 300 000-500 000 ЕД 2 раза в сутки. В качестве растворителя лучше использовать 1 — 2 мл 0,5% раствора новокаина. Курсовую дозу пенициллина определяют в зависимости от возраста больного, характера и тяжести заболевания и, главное, от степени терапевтической эффективности антибиотика в каждом конкретном случае.
Можно применять также новоцин, представляющий собой взвесь новокаиновой соли бензилненициллина в изотоническом растворе натрия хлорида. Новоцин вводят внутримышечно по 300 000 ЕД 3-4 раза в сутки.
Гораздо реже при лечении кожных болезней используют феноксиметилленициллин и бициллин.
Полусинтетические пенициллины весьма эффективны при инфекционных дерматозах, вызванных стафилококками и стрептококками, а также в тех случаях, когда последние осложняют течение неинфекционных дерматозов. По спектру антибактериального действия полусинтетические пенициллины подобны бензилпенициллину, но они эффективны в отношении штаммов микроорганизмов, резистентных к пенициллину, что связано с их устойчивостью к пенициллиназе.
Оксациллин хорошо всасывается из желудочно-кишечного тракта и сохраняет активность в кислой среде желудка, поэтому его назначают не только внутримышечно, но и внутрь за час до еды или через 2-3 ч после еды по 0,25-0,5 г каждые 4-6 ч. Продолжительность лечения варьирует от 7 до 20 дней. Оксациллин, как и метициллин, весьма эффективен при фурункулезе и вульгарном сикозе, превосходя по эффективности эритромицин и олеандомицин.
Ампициллин принимают внутрь независимо от времени приема пищи по 0,5 г 4 — 6 раз в сутки. В связи с тем что ампициллин воздействует также на ряд грамотрицательных микробов, его рассматривают как антибиотик широкого спектра действия.
При сопоставлении результатов лечения угревой сыпи оксациллином и ампициллином выявлено некоторое преимущество оксациллина. Хорошее терапевтическое действие при дерматозах стафилококковой природы оказывает ампиокс, представляющий собой комбинацию ампициллина и оксациллина в соотношении 2:1, так как благодаря содержанию оксациллина препарат активен в отношении пенициллиназообразующих стафилококков.
Препараты группы пенициллина могут вызывать разнообразные побочные явления. Чаще встречаются аллергические кожные высыпания — крапивница, сыпь, напоминающая таковую при кори, скарлатине, краснухе и др. При местном применении этих препаратов нередко развиваются аллергические контактные дерматиты, которые иногда возникают также у лиц, приготовляющих растворы пенициллина. Могут наблюдаться фиксированные высыпания, вызванные пенициллином. Необходимо также иметь в виду возможность появления высыпаний на коже в связи с наличием у больного повышенной чувствительности не к пенициллину, а к растворителям.
Пенициллин может не только обусловливать сенсибилизацию, но и явиться разрешающим фактором в развитии вторичных кожных реакций при грибковых и пиодермических заболеваниях. Особенно часто пенициллиновая сыпь наблюдается у больных эпидермофитией стоп. У лиц, склонных к аллергическим реакциям, особенно у тех, у кого периодически возникают крапивница, отек Квинке, приступы бронхиальной астмы и т.п., лечение пенициллином следует проводить с особой осторожностью. При длительном лечении пенициллином и некоторыми другими антибиотиками может развиться кандидоз.
В случае возникновения аллергических высыпаний при лечении пенициллином следует полностью прекратить его введение, назначить один из антигистаминных препаратов, хлорид кальция, кортикостероидный препарат.
При тяжелых аллергических и токсических явлениях, вызванных пенициллином, в последнее время применяют специфический энзим — пенициллиназу, разрушающую пенициллин, в результате чего он лишается антигенных и аллергизирующих свойств. В случае возникновения анафилактического шока необходимо немедленно ввести адреналин и кортикостероиды внутривенно. При длительном применении пенциллина в больших дозах целесообразно одновременно назначать В1 и В2, а также хлорид кальция.
Группа цефалоспоринов . В дерматологической практике применяют цефалоридин, цефазолин и цефалексин. Эти препараты оказывают бактерицидное действие на грамположительные и грамотрицательные кокковые микроорганизмы, в том числе на стрептококки, устойчивые к пенициллину, а также на сибиреязвенные палочки. При этом цефалоридин вводят внутримышечно по 20-30 мг/кг в сутки в 2-3 приема. Препарат можно применять при наличии у больного аллергии к пенициллину. Цефалексин активен в отношении грамположительной флоры, устойчивой к другим видам антибиотиков, его назначают по 500 мг через 12 ч в течение 7-14 дней.
Тетрациклины — антибиотики широкого спектра действия Они активны в отношении грамположительных и грамотрицательных бактерий, трепонем, риккетсий, хламидий и оказывают слабое действие на кислотоустойчивые бактерии. В основе их антибактериального действия лежит подавление биосинтеза белка микробной клетки на уровне рибосом. При этом микроорганизмы, устойчивые к одному из тетрациклинов, резистентны также к другим препаратам этой группы. Необходимо иметь в виду, что тетрациклины образуют трудно растворимые комплексы с ионами кальция, железа и других тяжелых металлов, поэтому во время лечения тетрациклинами не следует употреблять в пищу молочные продукты. Тетрациклины не рекомендуется принимать во время беременности и детям до 8 лет в связи с возможностью образования нерастворимых комплексов тетрациклина с кальцием и отложения их в костях, а также в эмали и дентине зубов.
В дерматологии из препаратов этой группы чаще применяют тетрациклин. Тетрациклин показан при тех же состояниях, что и пенициллин. Для предупреждения развития кандидоза его целесообразно применять вместе с нистатином. Тетрациклин хорошо зарекомендовал себя при лечении угревой сыпи. Мы назначаем его больным с угревой сыпью на длительный период, при этом в первые 20 дней по 1 000 000 ЕД в сутки, а затем 10 дней по 800 000 ЕД/сут. Имеются отдельные сообщения об эффективности тетрациклина при системной склеродермии.
Следует отметить эффективность тетрациклинов, в частности доксициклина гидрохлорида, у больных синдромом Рейтера, обусловленным хламидийной инфекцией. Доксициклина гидрохлорид, а также метациклина гидрохлорид и хлортетрациклина гидрохлорид иногда эффективны при актиномикозе, опоясывающем лишае, угревой сыпи, тяжело протекающей многоформной экссудативной эритеме и др. Доксициклина гидрохлорид оказывает выраженное действие, особенно в сочетании с левамизолом, у больных кожным лейшманиозом. Дозы препаратов и длительность лечения зависят от характера заболевания, переносимости лечения, а также от выраженности их терапевтического действия.
При поверхностных пиодермиях широко применяют мази и аэрозоли, содержащие тетрациклины, а также тетрациклины и кортикостероиды. Из побочных явлений, возникающих при применении тетрациклинов, следует отметить фиксированную медикаментозную эритему, лихеноидную реакцию, кандидоз, диспепсические явления и др. При длительном лечении тетрациклинами больные должны принимать нистатин, витамины В1 и B2.
Группа стрептомицина. Эта группа включает несколько препаратов, основным из которых является стрептомицина сульфат. Его вводят внутримышечно. Раствор для инъекций готовят непосредственно перед введением из расчета 1 000 000 ЕД на 2-5 мл стерильного изотонического раствора натрия хлорида, воды для инъекций или 0,25-0,5% раствора новокаина. Суточная доза препарата 0,5-1 г. Длительность его введения зависит от формы и тяжести заболевания.
Стрептомицин оказывает выраженное действие на некоторые грамотрицательные и грамположительные бактерии, а также на кислотоустойчивые бактерии и трепонемы. Наибольшее значение в медицинской практике имеет действие стрептомицина на микобактерии туберкулеза и синегнойную палочку.
В дерматологии стрептомицин применяют внутримышечно и местно. Он оказался эффективным при парентеральном применении у больных туберкулезными заболеваниями кожи, в первую очередь туберкулезной волчанкой, колликвативным и уплотненным туберкулезом кожи. Отмечены очень хорошие результаты при введении раствора стрептомицина в очаги поражения и фистулезные ходы. Имеются наблюдения клинического выздоровления некоторых больных острой красной волчанкой после повторного парентерального применения стрептомицина.
Стрептомицин может вызывать побочные явления. Наиболее тяжелым осложнением является токсическое действие на слуховой нерв, следствием чего может быть глухота большей или меньшей степени выраженности. Вероятность развития этого осложнения прямо пропорциональна величине суммарной дозы стрептомицина, введенной больному. Кроме того, стрептомицин может вызвать токсидермию и контактные аллергические дерматиты, так как он является довольно сильным аллергеном. В связи с этим лицам, занятым приготовлением раствора стрептомицина, рекомендуется работать в резиновых перчатках.
Антибиотики-аминогликозиды. Антибиотики этой группы близки по структуре к стрептомицину. Спектр их действия широк, они оказывают бактерицидное действие, особенно на грамотрицательные бактерии. К этим антибиотикам относятся неомицина сульфат, мономицин, канамицин, гентамицина сульфат.
Неомицина сульфат в дерматологии применяют в основном местно; его вводят в состав мазей, кремов, аэрозолей, содержащих кортикостероиды. При этом следует учесть, что неомицин весьма эффективен в отношении стафилококков и малоактивен в отношении стрептококков, поэтому применение наружных средств, содержащих неомицин, показано при поверхностных стафилококковых заболеваниях кожи, а также при зудящих и аллергических дерматозах, осложненных стафилококковой инфекцией.
Мономицин в дерматологической практике применяют главным образом для лечения лейшманиоза кожи. Препарат принимают внутрь по 0,25 г 4-6 раз в сутки, одновременно наружно назначают 2-3% мономициновую мазь. Внутримышечно мономицин вводят по 0,25 г 3 раза в сутки. Его применяю и течение 10-12 дней. Подобно другим антибиотикам этой группы, мономицин оказывает нефротоксическое действие, поэтому лечение кожного лейшманиоза мономицииом проводят под контролем состояния мочи больного.
Канамицин в дерматологии используют для лечения туберкулеза кожи, особенно при устойчивости микобактерий туберкулеза к стрептомицину.
Гентамицина сульфат действует на грамположительную и особенно па грамотрицательную флору. В дерматологической практике его применяют при пиодермии местно в виде 0,1% мази.
Как и препараты группы стрептомицина, антибиотики-аминогликозиды оказывают выраженное ототоксическое действие, поэтому бесконтрольное применение этих препаратов может привести к потере слуха.
Антибиотики-макролиды . В эту группу входит эритромицин, который по спектру действия близок к пенициллину. Оказывая выраженное действие на грамположительную флору, он слабо или совсем не действует на грамотрицательные бактерии. Препарат хорошо переносится, в том числе больными, страдающими аллергическими заболеваниями и в случае непереносимости пенициллина. Показаниями к его применению являются стафилококковые заболевания кожи. Эритромицин назначают внутрь по 0,25 г 3-4 раза в сутки, а также местно в виде эритромициновой мази.
В последние годы в дерматологической практике с успехом применяют эрициклин — препарат, содержащий смесь равных количеств эритромицина и окситетрациклина дигидрата. Причиной высокой лечебной активности комбинированного применения антибиотиков является одновременное действие компонентов на отдельные структурные элементы, ферментные системы и биохимические процессы в клетках микробов-возбудителей. Кроме того, применение сочетания антибиотиков с различной направленностью действия тормозит развитие антибиотикоустойчивости микроорганизмов, способствует восстановлению их чувствительности к антибиотику. Этим объясняется хороший терапевтический эффект эрициклина, назначаемого по 0,25 г 4 раза в сутки в течение 16-20 дней при хронических формах пиодермии, в том числе в комбинации с иммуномодуляторами.
Олеандомицина фосфат иногда дает эффект при заболеваниях, возбудители которых устойчивы к эритромицину. Обычно его применяют в комбинации с тетрациклином в виде препарата олететрина. Помимо кокковой флоры, препарат действует на хламидии, трепонемы, микобактерии туберкулеза. В связи с этим олететрин показан не только при туберкулезе, но и при всех формах пиодермии, болезни Рейтера хламидийной этиологии, туберкулезе кожи, язвенно-некротическом стоматите и др. Олететриновую мазь с успехом применяют при поверхностных пиодермиях.
Группа левомнцетина включает левомицетин и синтомицин. Левомицетин синтетический антибиотик. Его назначают внутрь по 0,5 г 4 раза в сутки при поверхностных пиодермиях, обыкновенных угрях для ликвидации вспышки заболевания, в том числе при устойчивости возбудителя заболевания к пенициллину стрептомицину, сульфаниламидным препаратам.
При лечении левомицетином могут возникать побочные явления, преимущественно аллергического характера: крапивница, коревидные, скарлатиноподобные и варнолиформные высыпания. Он может явиться причиной обострения экземы, сопровождающегося образованием экзематидов; иногда при применении левомнцетина наблюдаются желудочно-кишечные расстройства и др.
Синтомидин из-за возможности развития побочных явлении в настоящее время применяют только для наружного лечения поверхностных пиодермии, трещин сосков и др.
Рифамицины полусинтетические соединения, иногда используемые для лечения хронической пиодермии. Рифампицин в сочетании с диафенилсульфоном и диуцифоном с успехом используется для лечения лепроматозного типа лепры.
Новые антибиотики группы хинолинов — препараты широкого спектра действия, весьма активные в отношении грамположительной и грамотрицательной флоры. Они показаны во всех случаях дермии, при этом эноксацин лучше действует на грамотрицательные бактерии, устойчивые к другим антибиотикам. Эноксанин при пиодермии назначают внутрь по 400 мг. через 12 ч в течение 7-14 дней.
Все перечисленные антибиотики, особенно широкого спектра действия, при длительном применении могут вызвать кандидоз разной локализации. При этом чаще происходит активизация дрожжеподобных грибов на слизистой оболочке полости рта и наружных половых органов, реже кандидоз возникает на слизистой оболочке гортани, глотки, пищевода, прямой кишки, а также в бронхах и легких. Кандидоз внутренних органов может привести к смерти больных.
Основной причиной развития кандидоза при лечении антибиотиками является дисбактериоз, возникающий в результате подавления ими кишечных микроорганизмов — конкурентов дрожжеподобных грибов, вследствие чего нарушается процесс образования этими бактериями витаминов комплекса В, преимущественно В1 и В2. В то же время антибиотики оказывают стимулирующие влияние на рост дрожжеподобных грибов как в пищеварительном тракте, так и в других местах. При этом не исключена возможность токсического действия антибиотиков на слизистую оболочку пищеварительного тракта, что облегчает внедрение и развитие устойчивых к ним грибов.
При подозрении на развитие кандидоза следует произвести соответствующие лабораторные исследования и в случае подтверждения диагноза отменить применявшийся препарат в назначить нистатин, антигистаминные препараты, а также препараты кальция, витамины В1, В2, С. При длительном лечении антибиотиками широкого спектра действия с целью профилактики кандидоза больной должен принимать нистатин, витамины В, и В2.
При наличии пиодермии или осложнений дерматозов инфекцией, вызванной грамположительной флорой, мы наблюдали хороший терапевтический эффект от применения линкомицина гидрохлорида и фузидин-натрия. Мы использовали эти препараты и для санации организма больных дерматозами, у которых имелась фокальная инфекция, например при синдроме Мелькерсона-Розеиталя, многоформной экссудативно» эритеме и др. Имеются отдельные сообщения об эффективности линкомицина при угревой сыпи.
Линкомицина гидрохлорид принимают внутрь за 1-2 ч до еды по 0,5 г 3 раза в сутки или вводят внутримышечно по 0,6 г 2 раза в сутки, а также применяют как наружное средство в виде мази и пасты.
Фузидин-натрий принимают внутрь по 0,5 г 3 раза в сутки.
Грамицидин — антибиотик местного применения. Его выпускают в виде 2% спиртового раствора и с успехом применяют для лечения импетиго, вульгарной эктимы, хронических пиококковых язв, трещин кожи и др.
При заболеваниях, вызванных синегнойной палочкой, показано применение полимиксиновой мази, содержащей 20000 ЕД полимиксина М сульфата на 1 г основы.
Противогрибковые антибиотики активны в отношении различного вида патогенных грибов.
Нистатин и леворий действуют на дрожжеподобные грибы рода Candida и аспергиллы. В связи с этим они эффективны при кандидозе любой локализации. Эти препараты применяются также с профилактической целью для предупреждения развития кандидоза при длительном лечении антибиотиками. С лечебной целью нистатин принимают внутрь по 5 000 000-6 000 000 ЕД/сут, с профилактической — по 1500 000 — 2 000 000 ЕД/сут. Для местного лечения кандидоза используют нистатиновую мазь, в 1 г которой содержится 100 000 ЕД нистатина. Дозы леворина примерно в 2 раза меньше указанных доз нистатина, его назначают по 500 000 ЕД 3 раза в сутки. Местно применяют левориновую мазь.
При лечении кандидоза слизистой оболочки полости рта местно можно рекомендовать полоскания водной взвесью леворина. Эту взвесь можно применить также для лечения кандидоза слизистых оболочек половых органов у женщин. Нистатин очень редко вызывает побочные явления в виде тошноты и расстройства деятельности кишечника.
Высокой антимикотической активностью против дрожжевых и дрожжеподобных грибов обладает полиеновый антибиотик амфотерицип В. Препарат вводят внутривенно при лечении тяжелых форм капдидоза, резистентных к другим методам лечения. При внутривенном введении амфотерицина В нередко возникают побочные явления, иногда тяжелые. Для наружного лечения кандидозов применяют амфотерициновую мазь, содержащую 30 000 ЕД на 1 г основы.
Амфоглюкамин — также противодрожжевой полиеновый антибиотик. В отличие от амфотерицина В его принимают внутрь по 400 000-600 000 ЕД/сут в течение 10 дней. Однако он вызывает те же побочные явления, что и амфотерицин В.
Микогентин против возбудителей глубоких микозов и дрожжеподобных грибов близок к амфотерицину В и обладает высокой активностью. Препарат назначают для приема внутрь при кандидозах по 250 000 ЕД 2 раза в сутки в течение 10- 14 дней. Микогептиновую мазь применяют для наружного лечения кандидоза.
Гризеофульвин-противогрибковый антибиотик, оказывающий фунгистатическое действие на разные виды дерматофитов, в связи с чем его с успехом применяют для лечения трихофитии, микроспории, фавуса, микозов стоп и др. Гризеофульвин принимают внутрь во время еды. Взрослым препарат назначают по 0,5-2 г/сут, при лечении детей разовая и суточная доза зависит от характера заболевания, возраста и массы тела ребенка. Лечение трихомикозов, микозов стоп с поражением ногтей проводят длительно. Одновременно с гризеофульвином рекомендуется принимать витамины С, B1, В2, никотиновую кислоту.
Гризеофульвин — малотоксичный антибиотик. Подавляющее большинство вызываемых им побочных явлений относится к категории легких: головная боль, головокружение, утомляемость, парестезии, тошнота и незначительные желудочно-кишечные расстройства, тяжесть в груди и др. Редко возникают изменения крови. В отдельных случаях возникает сыпь на коже, большей частью аллергического характера. После прекращения приема гризеофульвина побочные явления обычно проходят, причем в большинстве случаев затем можно продолжить лечение этим антибиотиком. При развитии слабо выраженных побочных явлений, как правило, достаточно лишь несколько уменьшить суточную дозу препарата, не прекращая его применения.
Исследования Ж. В. Степановой и соавт. показали, что при длительном лечении детей, больных микроспорией, гризеофульвином он подавляет защитные силы организма, вызывая обострения очагов хронической инфекции, в частности хронического тонзиллита. В связи с этим при выявлении у таких детей признаков хронического тонзиллита, а также других заболеваний ЛОР-органов у них следует как можно раньше санировать носоглотку.
Циклоспорин А, новый иммуносупрессивный антибиотик, по данным Н. Zachariae и К. Thestrup-Pedersen. эффективнее у больных псориазом из-за его селективного действия на Т-хелперы, в том числе и при пустулезном псориазе типа пустулезного акродермагита. Вначале циклоспорин А назначали в дозе 14 мг/кг в сутки, а затем дозу уменьшали до 5 мг/кг.
N. Kato и соавт. отметили, что циклоспорин A дает хорошие результаты при лечении псориаза и ихтиоза.
С. Frances и соавт. сообщили об успешном местном применении циклоспорина А у 4 больных красным плоским лишаем слизистой оболочки полости рта. Препарат растворяли в растительном масле, аппликации проводили 4 раза в сутки, на что было израсходовано 25 мг циклоспорина А. М. Pilgrim сообщила о возникновении саркомы Капоши у 40-летнего больного через 3 мес. после трансплантации почки на фоне иммуносупрессивной терапии циклоспорином А.