Разделы токсикологии
Токсикометрия - количественная оценка токсичности, измерение зависимости "доза - реакция".
Токсикодинамика - изучение механизмов, лежащих в основе токсического действия различных химических веществ, закономерностей формирования токсического процесса, его проявлений.
Токсикокинетика - выяснение механизмов проникновения токсикантов в организм, закономерностей из распределения, метаболизма и выведения.
Токсичность зависит от дозы и экспозиции. Также от изомеров. Тионовые и тиоловые изомеры у ФОС. Введение токсофорных групп.
Механизмы токсичности
Пути проникновения пестицидов в организм животного и человека.
1. Распределение
Перемещение по водной составляющей тела (лимфатическая и кровеносная системы). Липофильные вещества выводятся сложнее гидрофильных.
Факторы, влияющие на скорость расрпотранения:
Скорость потока крови к ткани
Масса ткани
Способонсть вещества передвигаться через мембраны
Сродство вещества к ткани по сравнению с кровью.
1. Взаимодействие с местом действия
2. Нарушение клеток, повреждение
3. Гибель или восстановление
Механизмы, способствующие передвижению крови к месту действия:
Пористость капиллиров
Специфический транспорт через мембраны
Накопление в органеллах клетки
Обратимое внутриклеточное связывание
Препятствующие перемещению:
Связывание протеинами плазмы (ХОС) - альбумин, бета-глобулин, церулоплазмин, альфа и бета-липопротеины, альфа-гликопротеин кислый.
Специфические барьеры (гематоэнцифаллические и плацентарные).
Слой глиальных клеток, покрывающих поверхность капилляров. Омываются с одной стороны кровью, с другой - межклеточной жидкостью.
Плацентный барьер - несколько слоев клеток между внутриплодовой жидкостью и материнской кровеносной системой. Липофльные - диффузией, ЦНС отвечает за биотрансформацию.
Накопление в запасных тканях (ХОС в жировых клетках; свинец - костная ткань).
Связывание с неспецифичным местом действия (ФОС - бутирилхолинэстераза)
Экспорт из клетки
Связывание органами, тканями: печени и почки обладают высокой споосбностью связывания. Жировая ткань: ХОС, пиретроиды. Костная ткань: фтор, свинец, стронций.
Токсические эффекты, классификация токсичности
Влияние на место действия:
Токсикант может нарушать функцию молекулы или ее разрушать:
Нарушение функции - ингибирование: пиретроиды блокируют закрытие ионных каналов, бензимидазолы блокируют полимеризацию тубулина.
Нарушение функций протеинов: реакция с тиоловыми группами протеинов (фталимиды); нарушение функций ДНК мутагены, канцерогены.
Влияние на место действия:
Разрушение молекулы:
Изменение молекулы путем перекрестногосвязывания и фрагментации: сероуглерод и алкилирующие агенты перекрестно связывают цитоскелетарные протеины, ДНК
Спонтанное разрушение: свободные раликалы инициируют разрушение липидов путем захвата водорода из жирных кислот
Острые эффекты:
Дерматотоксичность:
Свойство химиката повреждать кожные покровы путем прямого контакта или резорбтивного действия вследствие проникновение химиката внутрь организма с развитием системных эффектов.
Химический дерматит - процесс, развивающийся в результате местного воздействия токсиканта и сопровождающийся воспалительной реакцией
Неаллергический контактный - бывает раздражающего (цитотоксический эффект) и прижигающего действия (разрушение покровных тканей). Раздражающие - органические растворители, дитиокарбаматы.
Аллергический контактный - после относительно продолжительного контакта.
Токсикодермия - патологический процесс в коже, формирующийся вследствие резорбтивного действия токсиканта. Болезнь - хлоракне.
Пульмонотоксичность - свойство токсиканта вызывать нарушения органов дыхания.
Раздражение - аммиак, хлор, фосфин.
Некрозы клеток - пневмония, отек легких (кадмий, ФОС, диоксид серы, паракват, дихлорметан, керосин).
Фиброзы (образование коллагенных тканей) - силикоз, асбестоз.
Энфизема - окись кадмия, окиси азота, озон.
Гематотоксичность - свойство токсиканта нарушать функции клеток крови, либо клеточный состав крови.
Нарушение свойств гемоглобина, анемия, аплазия костного мозга.
Метгемоглобин - гемоглобин, железо которого трехвалентно. Его уровень менее 1%. метгемоглобинемия развивается под действием ксенобиотиков, которые либо непосредственно окисляют железо, входящее в структуру гемоглобина, лбио превращаются в организме в подобные агенты. Скорость образования метгемоглобина превышает скорость образования гемоглобина. Динитрофенолы, нафтиламины и т.п.
Карбоксигемоглобинемия - образование соответствующего вещества в крови под воздействием CO и карбонилами металлов.
Гемолиз соповождается:
1. Повышением содержания коллоидно-осматических свойств крови из-за возрастания содержания белка.
2. Ускоренным разрушением гемоглобина.
3. Затруднением диссоциации оксигемоглобина.
4. Нефротоксическим действием гемоглобина.
Заболевания:
Аплазия костного мозга - сокращение числа форменных единиц крови.
Тромбоцитопения и лейкемия.
Нейротоксичность - способность пестицида нарушать действие нервной системы вцелом. Места действия: нейрон, аксон, миелиновое содержимое покрытие клеток, система передачи нервных импульсов.
Нейрон - нейронопатия (гибель нейронов). Вещества: мышьяк, азиды, цианиды, этанол, метанол, свинец, ртуть, метилртуть, бромистый метил, триметилолово, ФОС.
Аксон - аксонопатия. Акриламид, сероуглерод, хлордекан, дихлорфеноксиацетат, ФОС, пиретроиды, гексан.
Миелинопатия - повреждение миелинового слоя. Свинец, трихлорфон.
Нарушение действия нервной системы: ХОС, пиретроиды, авермектины, фенилпиразоды, микотоксины, токсины членистоногих.
Гепатотоксичность: свойство химикатов вызывать структурно-функциональные нарушения печени. Повреждения:
Жировое перерождение. Раннее появление предшествует некрозу. Причины:
Нарушение процессов катаболизма липидов
Избыточное поступление жирных кислот в печень
Повреждение механизмов выделения триглицеридов в плазму крови
Некроз печени - дегенеративный процесс, приводящий к гибели клеток. Часть - фокальный некроз, полностью - тотальный некроз. Сопровождается повреждением плазматических мембран и стеатозом. Токсиканты: альфатические и ароматические углеводороды, нитросоединения, нитрозоамины, афлатоксины.
Холестаз - нарушение процесса желчевыделения. Токсиканты: лекарства (сульфаниламиды, эстрадиол), анилины.
Цирроз - образование коллагеновых тяжей, нарушающих нормальную структуру органа, нарушающих внутрипеченочный кровоток, желчеотделение. Этанол, галогеноуглероды.
Канцерогенез
Нефротоксичность - способность пестицида нарушать структурно-функциональные нарушения почек. И
Хроматография - это метод разделения и опреления веществ, основанных на разделении компонентов между двумя фазами. Неподвижной служит твердое пористое вещество (сорбент), или пленка жидкости на твердом веществе. Подвижная фаза представляет собой жидкость или газ, протекающей через неподвижную фазу (иногда под давлением). Компоненты анализируемой смеси (сорбаты) вместе с подвижной фазой передвигаются вдоль стационарной фазы. Ее обычно помещают в стеклянную или металлическую трубку, называемую колонкой. В зависимости от силы взаимодействия с поверхностью сорбента за счет адсорбции или другого механизма компоненты перемещаются вдоль колонки с разной скоростью. Одни компоненты останутся в верхнем слое сорбента, другие, в меньшей степени взаимодействующие с сорбентом, окажутся в нижней части колонки. А некоторые и вовсе покинут колонку вместе с подвижной фазой. Далее вещества попадают в детектор. Наиболее широко применяются ионизационные детекторы, принцип работы которого основан на изменении ионного тока. Он возникает под действием источника ионизации - электрического поля между электродами детектора. В качестве источника ионизации используют: электронную ионную эмиссию, радиоактивные изотопы, электрический разряд.
Взаимодействие токсиканта или продуктов его превращения в организме со структурными элементами биосистем, лежащее в основе развивающегося токсического процесса, называется механизмом токсического действия. Взаимодействие осуществляется за счет физико-химических и химических реакции.
Токсический процесс, инициируемый физико-химическими реакциями, как правило, обусловлен растворением токсиканта в определенных средах (водной или липидной) клеток и тканей организма. При этом существенно изменяются физико-химические свойства среды-растворителя (рН, вязкость, электропроводность, сила межмолекулярных взаимодействий и т.д.). Особенность данного типа взаимодействия - отсутствие строгой зависимости качества развивающегося эффекта от химических свойств молекулы токсиканта. Таким образом, действуют на ткани все кислоты, щелочи, сильные окислители, некоторые органические растворители и лишенные специфической активности высокомолекулярные соединения.
Чаще в основе токсического действия лежат химические реакции токсиканта с определенным структурным элементом живой системы. Структурный компонент биологической системы, с которым вступает в химическое взаимодействие токсикант, называется его "рецептором" или "мишенью".
Механизмы токсического действия подавляющего большинства химических веществ в настоящее время неизвестны. В этой связи, очень многие описываемые ниже классы молекул и молекулярных комплексов, образующих организм, рассматриваются, по большей части, лишь как вероятные рецепторы (мишени) действия ядов. Рассмотрение их в этом ракурсе правомочно, поскольку в основе действия некоторых хорошо изученных токсикантов лежит взаимодействие с представителями именно этих классов биомолекул.
1. Определение понятия "рецептор" в токсикологии
Понятие "рецептор" весьма емкое. Наиболее часто в биологии его используют в следующих смыслах:
1. Общее понятие. Рецепторы - это участки относительно специфического связывания на биосубстрате ксенобиотиков (или эндогенных молекул), при условии, что процесс связывания подчиняется закону действующих масс. В качестве рецепторов могут выступать целые молекулы белков, нуклеиновых кислот, полисахаридов, липидов или их фрагменты. В отношении фрагмента биомолекулы, которая непосредственно участвует в образовании комплекса с химическим веществом, часто используют термин - "рецепторная область". Например, рецептором оксида углерода в организме является молекула гемоглобина, а рецепторной областью - ион двухвалентного железа, заключенный в порфириновое кольцо гема.
2. Селективные рецепторы. По мере эволюционного усложнения организмов формируются специальные молекулярные комплексы - элементы биологических систем, обладающие высоким сродством к отдельным химическим веществам, выполняющим функции биорегуляторов (гормоны, нейромедиаторы и т.д.). Участки биологических систем, обладающие наивысшим сродством к отдельным специальным биорегуляторам, получили название "селективные рецепторы". Вещества, взаимодействующие с селективными рецепторами в соответствии с законом действующих масс, называются лигандами селективных рецепторов. Взаимодействие эндогенных лигандов с селективными рецепторами имеет особое значение для поддержания гомеостаза.
Многие селективные рецепторы состоят из нескольких субъединиц, из которых лишь часть имеет участки связывания лигандов. Нередко термин "рецептор" используют для обозначения только таких лиганд-связывающих субъединиц.
3. Постоянные рецепторы - это селективные рецепторы, строение и свойства которых кодируется с помощью специальных генов или постоянных генных комплексов. На уровне фенотипа изменение рецептора путем генной рекомбинации развивается чрезвычайно редко. Возникающие порой в ходе эволюции вследствие полигенетических трансформаций изменения аминокислотного состава белка, формирующего селективный рецептор, как правило, слабо сказывается на функциональных характеристиках последнего, его сродстве к эндогенным лигандам и ксенобиотикам.
К числу постоянных рецепторов относятся:
Рецепторы нейромедиаторов и гормонов. Как и другие селективные рецепторы, эти рецепторы способны избирательно взаимодействовать и с некоторыми ксенобиотиками (лекарствами, токсикантами). Ксенобиотики могут при этом выступать как в качестве агонистов, так и антагонистов эндогенных лигандов. В итоге активируется или подавляется некая биологическая функция, находящаяся под контролем данного рецепторного аппарата;
Энзимы - белковые структуры, селективно взаимодействующие с субстратами, превращение которых они катализируют. Энзимы также могут взаимодействовать с чужеродными веществами, которые в этом случае становятся либо ингибиторами, либо аллостерическими регуляторами их активности;
Транспортные протеины - избирательно связывают эндогенные лиганды определенного строения, осуществляя их депонирование или перенос через различные биологические барьеры. Токсиканты, взаимодействующие с транспортными протеинами, также выступают либо в качестве их ингибиторов, либо аллостерических регуляторов.
4. Рецепторы с изменяющейся структурой. В основном это антитела и антигенсвязывающие рецепторы Т-лимфоцитов. Рецепторы данного типа формируются в клетках предшественниках зрелых клеточных форм вследствие индуцированной внешними воздействиями рекомбинации 2 - 5 генов, контролирующих их синтез. Если рекомбинация осуществилась в процессе дифференциации клеток, то в зрелых элементах будут синтезироваться рецепторы только определенного строения. Таким способом формируются селективные рецепторы к конкретным лигандам, а пролиферация приводит к появлению целого клона клеток, содержащих эти рецепторы.
Как следует из приведенных определений, в биологии термин "рецептор" в основном используется для обозначения структур, принимающих непосредственное участие в восприятии и передаче биологических сигналов, и способных избирательно связывать помимо эндогенных лигандов (нейромедиаторов, гормонов, субстратов) некоторые чужеродные соединения.
В токсикологии (как и фармакологии) термином "рецептор" обозначают любой структурный элемент живой (биологической) системы, с которым вступает в химическое взаимодействие токсикант (лекарство). В таком прочтении это понятие ввел в химеобиологию в начале ХХ века Пауль Эрлих (1913).
Спектр энергетических характеристик рецептор-лигандного взаимодействия необыкновенно широк: от формирования слабых, легко разрушающихся связей, до образования необратимых комплексов (см. выше). Характер взаимодействия и структура сформировавшегося комплекса зависят не только от строения токсиканта, конформации рецептора, но и от свойств среды: рН, ионной силы и т.д. В соответствии с законом действующих масс, количество образовавшихся комплексов вещество-рецептор определяется энергией взаимодействия (сродством) и содержанием обоих компонентов реакции (вещества и рецептора к нему) в биологической системе.
Рецепторы могут быть "немыми" и активными. "Немой" рецептор - структурный компонент биологической системы, взаимодействие которого с веществом не приводит к формированию ответной реакции (например, связывание мышьяка белками, входящими в состав волос, ногтей). Активный рецептор - структурный компонент биологической системы, взаимодействие которого с токсикантом инициирует токсический процесс. Для того, чтобы избежать терминологических трудностей, для обозначения структурных элементов, взаимодействуя с которыми токсикант инициирует токсический процесс, вместо термина "рецептор", часто используют термин "структура-мишень".
Принимаются постулаты:
Токсическое действие вещества выражено тем сильнее, чем большее количество активных рецепторов (структур-мишеней) вступило во взаимодействие с токсикантом;
Токсичность вещества тем выше, чем меньшее его количество связывается с "немыми" рецепторами, чем эффективнее оно действует на активный рецептор (структуру-мишень), чем большее значение имеет рецептор и повреждаемая биологическая система для поддержания гомеостаза целостного организма.
Любая клетка, ткань, орган содержат огромное количество потенциальных рецепторов различных типов ("запускающих" различные биологические реакции), с которыми могут вступить во взаимодействие лиганды. С учетом вышесказанного, связывание лиганда (как эндогенного вещества, так и ксенобиотика) на рецепторе данного типа является избирательным лишь в определенном диапазоне концентраций. Увеличение концентрации лиганда в биосистеме приводит к расширению спектра типов рецепторов, с которыми он вступает во взаимодействие, а следовательно, изменению его биологической активности. Это также одно из фундаментальных положений токсикологии, доказанное многочисленными наблюдениями.
Мишенями (рецепторами) для токсического воздействия могут быть:
Структурные элементы межклеточного пространства;
Структурные элементы клеток организма;
Структурные элементы систем регуляции клеточной активности.
2. Действие токсиканта на элементы межклеточного пространства
Каждая клетка организма окружена водной средой - интерстициальной или межклеточной жидкостью. Для клеток крови межклеточной жидкостью является плазма крови. Основные свойства межклеточной жидкости: её электролитный состав и определенное осмотическое давление. Электролитный состав определяется главным образом содержанием ионов Na+, K+, Са2+, Cl-, HCO3- и др.; осмотическое давление - присутствием белков, других анионов и катионов. Межклеточная жидкость содержит многочисленные субстраты для клеточного обмена, продукты метаболизма клеток, молекулы-регуляторы клеточной активности.
Попав в межклеточную жидкость, токсикант может изменять её физико-химические свойства, вступать в химическое взаимодействие с её структурными элементами. Изменение свойств межклеточной жидкости немедленно приводит к реакции со стороны клеток. Возможны следующие механизмы токсического действия, обусловленные взаимодействием токсиканта с компонентами межклеточной жидкости:
1. Электролитные эффекты. Нарушение электролитного состава наблюдается при отравлении веществами, способными связывать ионы. Так, при интоксикациях фторидами (F-), некоторыми комплексообразователями (Na2ЭДТА, ДТПА и др.), другими токсикантами (этиленгликолем, метаболизируящим с образованием щавелевой кислоты), происходит связывание ионов кальция в крови и межклеточной жидкости, развивается острая гипокальциемия, сопровождающаяся нарушениями нервной деятельности, мышечного тонуса, свертывающей системы крови и т.д. Нарушение ионного баланса, в ряде случаев, может быть устранено введением в организм растворов электролитов.
2. рН-эффекты. Интоксикация рядом веществ, не смотря на высокую буферную емкость межклеточной жидкости, может сопровождаться существенным нарушением кислотно-основных свойств внутренней среды организма. Так, отравление метанолом приводит к накоплению в организме муравьиной кислоты, вызывающей тяжелый ацидоз. Изменение рН интерстициальной жидкости может быть также следствием вторичных токсических эффектов и развиваться вследствие нарушения процессов биоэнергетики, гемодинамики (метаболический ацидоз/алкалоз), внешнего дыхания (газовый ацидоз/алкалоз). В тяжелых случаях нормализовать рН можно, вводя пострадавшему буферные растворы.
3. Связывание и инактивация структурных элементов межклеточной жидкости и плазмы крови. В плазме крови содержатся структурные элементы, обладающие высокой биологической активностью, способные стать мишенью действия токсикантов. К их числу относятся, например, факторы свертывающей системы крови, гидролитические ферменты (эстеразы), разрушающие ксенобиотики и т.д. Следствием такого действия может стать не только интоксикация, но и аллобиоз. Например, угнетение активности три-о-крезилфосфатом (ТОКФ) карбоксилэстераз плазмы крови, разрушающих фосфорорганические соединеня (ФОС), приводит к существенному повышению токсичности последних.
4. Нарушение осмотического давления. Существенные нарушения осмотического давления крови и интерстициальной жидкости при интоксикациях, как правило, носят вторичный характер (нарушение функций печени, почек, токсический отек легких). Развивающийся эффект пагубным образом сказывается на функциональном состоянии клеток, органов и тканей всего организма.
3. Действие токсикантов на структурные элементы клеток
Структурными элементами клеток, с которыми взаимодействуют токсиканты, как правило, являются:
Липидные элементы биомембран;
Селективные рецепторы эндогенных биорегуляторов (гормонов, нейромедиаторов и т.д.).
ТОКСИКОМЕТРИЯ
ЗАВИСИМОСТЬ "ДОЗА-ЭФФЕКТ" В ТОКСИКОЛОГИИ
Спектр проявлений токсического процесса, определяются строением токсиканта. Однако выраженность развивающегося эффекта является функцией количества действующего агента.
Для обозначения количества вещества, действующего на биологический объект, используют понятие - доза. Например, введение в желудок крысе весом 250 г и кролику весом 2000 г токсиканта в количестве 500 мг, означает, что животным введены дозы равные соответственно 2 и 0,25 мг/кг (более подробно понятие "доза" будет рассмотрено ниже).
Зависимость "доза-эффект" может быть прослежена на всех уровнях организации живой материи: от молекулярного до популяционного. При этом в подавляющем большинстве случаев будет регистрироваться общая закономерность: с увеличением дозы - увеличивается степень повреждения системы; в процесс вовлекается все большее число составляющих её элементов.
В зависимости от действующей дозы практически всякое вещество в определенных условиях может оказаться вредным для организма. Это справедливо для токсикантов, действующих как местно, так и после резорбции во внутренние среды.
На проявление зависимости "доза-эффект" оказывает существенное влияние внутри- и межвидовая изменчивость организмов. Действительно, особи, относящиеся к одному и тому же виду, существенно отличаются друг от друга по биохимическим, физиологическим, морфологическим характеристикам. Эти отличия в большинстве случаев обусловлены их генетическими особенностями. Еще более выражены, в силу тех же генетических особенностей, межвидовые различия. В этой связи дозы конкретного вещества, в которых оно вызывает повреждение организмов одного и того же и, тем более, разных видов, порой очень существенно различаются. Следовательно, зависимость "доза-эффект" отражает свойства не только токсиканта, но и организма, на который он действует. На практике это означает, что количественную оценку токсичности, основанную на изучении зависимости "доза-эффект", следует проводить в эксперименте на различных биологических объектах, и обязательно прибегать к статистическим методам обработки получаемых данных.
Зависимость "доза-эффект" по показателю летальность
4.1.3.1. Общие представления
Поскольку смертельный исход после действия токсиканта - альтернативная реакция, реализующаяся по принципу "все или ничего", этот эффект считают наиболее удобным для определения токсичности веществ, его используют для определения величины среднесмертельной дозы (ЛД50).
Определение острой токсичности по показателю "летальность" проводится методом формирования подгрупп (см. выше). Введение токсиканта осуществляется одним из возможных способов (энтерально, парентерально) при контролируемых условиях. При этом необходимо учитывать, что способ введения вещества самым существенным образом сказывается на величине токсичности.
Используются животные одного пола, возраста, веса, содержащихся на определенной диете, при необходимых условиях размещения, температуре, влажности и т.д. Исследования повторяют на нескольких видах лабораторных животных. После введения тестируемого химического соединения проводят наблюдения, определяя количество павших животных, как правило за период 14 суток. В случае нанесения вещества на кожу, совершенно необходимо регистрировать время контакта, а также оговаривать условия аппликации (из замкнутого или открытого пространства осуществлялось воздействие). Очевидно, что степень поражения кожи и выраженность резорбтивного действия являются функцией как количества нанесенного материала, так и продолжительности его контакта с кожей. При всех, помимо ингаляционного, способах воздействия экспозиционная доза обычно выражается как масса (или объем) тестируемого вещества на единицу массы тела (мг/кг; мл/кг).
Для ингаляционного воздействия экспозиционная доза выражается как количество тестируемого вещества, присутствующего в единице объема воздуха: мг/м3 или части на миллион (ppm - parts per million). При этом способе воздействия очень важно учитывать время экспозиции. Чем продолжительней воздействие, тем выше экспозиционная доза, выше потенциал неблагоприятного действия. Получаемая информация о зависимости "доза-эффект" для различных концентраций вещества во вдыхаемом воздухе должна быть получена при одинаковом времени экспозиции. Эксперимент может быть построен и иначе, а именно различные группы экспериментальных животных ингалируют вещество в одинаковой концентрации, но в течение различного времени.
Для приблизительной оценки токсичности ингаляционно действующих веществ, одновременно учитывающей и концентрацию токсиканта и время его экспозиции, принято использовать величину "токсодоза", рассчитываемую по формуле, предложенной Габером в начале века:
W = C t , где
W - токсодоза (мг мин/м3)
С - концентрация токсиканта (мг/м3)
t - время экспозиции (мин)
Предполагается, что при непродолжительной ингаляции веществ одинаковый эффект (гибель лабораторных животных) будет достигаться как при краткой экспозиции высоких доз, так и более продолжительном воздействии веществ в меньших концентрациях, при этом произведение времени на концентрацию для вещества остается неизменным. Наиболее часто к определению токсодоз веществ, прибегали для характеристики боевых отравляющих веществ.
Интерпретация и практическое использование результатов
Как правило, основной вывод, который делает токсиколог при установлении позитивной зависимости "доза-эффект", состоит в том, что между воздействием исследуемого вещества и развитием токсического процесса существует причинно-следственная связь. Однако информация о зависимости должна интерпретироваться только относительно условий, в которых она получена. Большое количество факторов влияет на её характер, причем специфично для каждого вещества и биологического вида, на представителей которого вещество действует. В этой связи необходимо учитывать ряд обстоятельств:
1. Точность количественной характеристики значения ЛД50 достигается путем тщательного проведения эксперимента и адекватной статистической обработки получаемых результатов. Если при повторении эксперимента по определению токсичности получают количественные данные, отличные от ранее полученных, это может быть следствием вариабильности свойств использованного биологического объекта и условий окружающей среды.
2. Важнейшей характеристикой опасности вещества является время наступления смерти после воздействия токсиканта. Так, вещества с одинаковым значением ЛД50, но разным временем наступления смерти могут представлять различную опасность. Быстро действующие вещества часто рассматриваются как более опасные. Однако вещества "замедленного действия" с очень продолжительным скрытым периодом часто склонны к кумуляции в организме и в силу этого также чрезвычайно опасны. К числу быстро действующих токсикантов относятся боевые отравляющие вещества (ФОВ, синильная кислота, вещества раздражающего действия и т.д.). Вещества замедленного действия - это полигалогенированные полициклические углеводороды (галогенированные диоксины, дибензофураны и т.д.), некоторые металлы (кадмий, талий, ртуть и т.д.) и многие другие.
3. Более полная интерпретация полученных результатов по оценке токсичности, помимо определения количественных характеристик, требует детального изучения причин смерти (см. соответствующий раздел). Если вещество может вызвать различные потенциально смертельные эффекты (остановка дыхания, остановка сердечной деятельности, коллапс и т.д.), необходимо представлять какой из эффектов является ведущим, а также может ли этот феномен стать причиной усложнения зависимости "доза-эффект". Например, различные биологические эффекты могут быть причиной гибели в острой и отставленной фазе интоксикации. Так, интоксикация дихлорэтаном уже в первые часы может привести экспериментальное животное к гибели вследствие угнетения ЦНС (наркотический, неэлектролитный эффект). В поздние периоды интоксикации животное погибает от острой почечной и печеночной недостаточности (цитотоксический эффект). Очевидно это имеет значение и при определении количественных характеристик токсичности. Так, трет-бутилнитрит при внутрибрюшинном введении мышам и регистрации смертельного эффекта в течение 30 минут имеет величину ЛД50 равную 613 мг/кг; при регистрации смертельных случаев в течение 7 суток, ЛД50 составляет 187 мг/кг. Смерть в первые минут, по-видимому, наступает в результате ослабления тонуса сосудов и метгемоглобинообразования, в позднем периоде, от поражения печени.
4. Величина ЛД50, полученная в остром опыте, не является характеристикой токсичности вещества при его многократном подостром или хроническом воздействии. Так, для веществ с высокой способностью к кумуляции, значение смертельной концентрации токсиканта в среде, определенное при однократном введении, может оказаться существенно выше концентрации, вызывающей смерть при длительном воздействии. Для слабо кумулирующих веществ эти различия могут быть не столь существенными.
На практике данные о зависимости "доза-эффект" и значения величин ЛД50 часто используют в следующих ситуациях:
1. Для характеристики острой токсичности веществ в ходе рутинных токсикологических исследований и сравнения токсичности нескольких химических соединений.
ТОКСИКОКИНЕТИКА
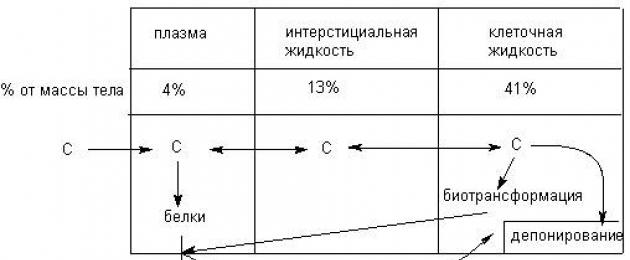
Токсикокинетика - раздел токсикологии, в рамках которого изучаются закономерности, а также качественные и количественные характеристики резорбции, распределения, биотрансформации ксенобиотиков в организме и их элиминации (рисунок 1).
Рисунок 1. Этапы взаимодействия организма с ксенобиотиком
С позиций токсикокинетики организм представляет собой сложную гетерогенную систему, состоящую из большого числа компартментов (отделов): кровь, ткани, внеклеточная жидкость, внутриклеточное содержимое, с различными свойствами, отделенных друг от друга биологическими барьерами. К числу барьеров относятся клеточные и внутриклеточные мембраны, гистогематические барьеры (например, гематоэнцефалический), покровные ткани (кожа, слизистые оболочки). Кинетика веществ в организме - это, по сути, преодоление ими биологических барьеров и распределение между компартментами (рисунок 2).
В ходе поступления, распределения, выведения вещества осуществляются процессы его перемешивания (конвекция), растворения в биосредах, диффузии, осмоса, фильтрации через биологические барьеры.
Конкретные характеристики токсикокинетики определяются как свойствами самого вещества, так и структурно-функциональными особенностями организма.

Рисунок 2. Схема движения веществ в основных компартментах организма
Важнейшими характеристиками вещества, влияющими на его токсикокинетические параметры, являются:
Коэффициент распределения в системе масло/вода - определяет способность накапливаться в соответствующей среде: жиро-растворимиые - в липидах; водо-растворимые - в воде;
Размер молекулы - влияет на способность диффундировать в среде и проникать через поры биологических мембран и барьеров;
Константа диссоциации - определяет относительную часть молекул токсиканта, диссоциировавших в условиях внутренней среды организма, т.е. соотношение молекул, находящихся в ионизированной и неионизированной форме. Диссоциировавшие молекулы (ионы) плохо проникают через ионные каналы и не проникают через липидные барьеры;
Химические свойства - определяют сродство токсиканта к химическим и биохимическим элементам клеток, тканей и органов.
Свойства организма, влияющие на токсикокинетику ксенобиотиков.
Свойства компартментов:
Соотношение воды и жира в клетках, тканях и органах. Биологические структуры могут содержать либо мало (мышечная ткань), либо много жира (биологические мембраны, жировая ткань, мозг);
Наличие молекул, активно связывающих токсикант. Например в костях имеются структуры, активно связывающие не только кальций, но и другие двухвалентные металлы (свинец, стронций и т.д.).
Свойства биологических барьеров:
Толщина;
Наличие и размеры пор;
Наличие или отсутствие механизмов активного или облегченного транспорта химических веществ.
По существующим представлениям сила действия вещества на организм является функцией его концентрации в месте взаимодействия со структурой-мишенью, что в свою очередь определяется не только дозой, но и токсикокинетическими параметрами ксенобиотика. Токсикокинетика формулирует ответ на вопрос, каким образом доза и способ воздействия вещества на организм влияют на развитие токсического процесса?
МЕТАБОЛИЗМ КСЕНОБИОТИКОВ
Многие ксенобиотики, попав в организм, подвергаются биотрансформации и выделяются в виде метаболитов. В основе биотрансформации по большей части лежат энзиматические преобразования молекул. Биологический смысл явления - превращение химического вещества в форму, удобную для выведения из организма, и тем самым, сокращение времени его действия.
Метаболизм ксенобиотиков проходит в две фазы (рисунок 1).

Рисунок 1. Фазы метаболизма чужеродных соединений
В ходе первой фазы окислительно-восстановительного или гидролитического превращения молекула вещества обогащается полярными функциональными группами, что делает ее реакционно-способной и более растворимой в воде. Во второй фазе проходят синтетические процессы конъюгации промежуточных продуктов метаболизма с эндогенными молекулами, в результате чего образуются полярные соединения, которые выводятся из организма с помощью специальных механизмов экскреции.
Разнообразие каталитических свойств энзимов биотрансформации и их низкая субстратная специфичность позволяет организму метаболизировать вещества самого разного строения. Вместе с тем, у животных разных видов и человека метаболизм ксенобиотиков проходит далеко не одинаково, поскольку энзимы, участвующие в превращениях чужеродных веществ, часто видоспецифичны.
Следствием химической модификации молекулы ксенобиотика могут стать:
1. Ослабление токсичности;
2. Усиление токсичности;
3. Изменение характера токсического действия;
4. Инициация токсического процесса.
Метаболизм многих ксенобиотиков сопровождается образованием продуктов существенно уступающих по токсичности исходным веществам. Так, роданиды, образующиеся в процессе биопревращения цианидов, в несколько сот раз менее токсичны, чем исходные ксенобиотики. Гидролитическое отщепление от молекул зарина, зомана, диизопропилфторфосфата иона фтора, приводит к утрате этими веществами способности угнетать активность ацетилхолинэстеразы и существенному понижению их токсичности. Процесс утраты токсикантом токсичности в результате биотрансформации обозначается как "метаболическая детоксикация".
ОСНОВЫ ЭКОТОКСИКОЛОГИИ
Развитие промышленности неразрывно связано с расширением круга используемых химических веществ. Увеличение объемов применяемых пестицидов, удобрений и других химикатов - характерная черта современного сельского хозяйства и лесоводства. В этом объективная причина неуклонного усиления химической опасности для окружающей среды, таящейся в самой природе человеческой деятельности.
Еще несколько десятков лет назад химические отходы производства просто сбрасывали в окружающую среду, а пестициды и удобрения практически бесконтрольно, исходя из утилитарных соображений, распыляли над огромными территориями. При этом, полагали, что газообразные вещества должны быстро рассеиваться в атмосфере, жидкости частично растворяться в воде и уноситься из мест выброса. И хотя твердые продукты в значительной степени накапливались в регионах, потенциальная опасность промышленных выбросов рассматривалась как низкая. Использование же пестицидов и удобрений давало экономический эффект, во много раз превосходящий ущерб, наносимый токсикантами природе.
Однако уже в 1962 году появляется книга Рашель Карсон УМолчаливая веснаФ, в которой автор описывает случаи массовой гибели птиц и рыб от бесконтрольного использования пестицидов. Карсон сделала вывод, что выявляемые эффекты поллютантов на дикую природу предвещают надвигающуюся беду и для человека. Эта книга привлекла всеобщее внимание. Появились общества защиты окружающей среды, правительственные законодательные акты, регламентирующие выбросы ксенобиотиков. С этой книги, по сути, началось развитие новой ветви науки - зкотоксикологии.
В самостоятельную науку экотоксикологию (ecotoxicology) выделил Рене Траут, который впервые, в 1969 году, связал воедино два совершенно разных предмета: экологию (по Кребсу - науку о взаимоотношениях, которые определяют распространение и обитание живых существ) и токсикологию. На самом деле, эта область знаний включает в себя, помимо указанных, элементы и других естественных наук, таких как химия, биохимия, физиология, популяционная генетика и др.
По мере развития, само понятие УэкотоксикологияФ претерпело определенную эволюцию. В 1978 году Батлер рассматривал экотоксикологию как науку, изучающую токсические эффекты химических агентов на живые организмы, особенно на уровне популяций и сообществ, в пределах определенных экосистем. Левин и др. в 1989 г. определили ее как науку, прогнозирующую влияние химических веществ на экосистемы. В 1994 году В. и Т. Форбсы дали следующее определение экотоксикологии: Уобласть знаний, которая суммирует экологические и токсикологические эффекты химических поллютантов на популяции, сообщества и экосистемы, прослеживая судьбу (транспорт, трансформацию и удаление) таких поллютантов в окружающей средеФ.
Таким образом, экотоксикология, по мнению авторов, изучает развитие неблагоприятных эффектов, проявляющихся при действии загрязнителей на самые разнообразные виды живых организмов (от микроорганизмов, до человека), как правило, на уровне популяций или экосистемы в целом, а также судьбу химического вещества в системе биогеоценоза.
Позже в рамках экотоксикологии стали выделять, в качестве самостоятельного направления, один из её разделов, получивший название Утоксикология окружающей средиФ (environmental toxicology).
Сформировалась тенденция использовать термин УэкотоксикологияФ только для обозначения суммы знаний, касающихся эффектов химикатов на экосистемы, исключая человека. Так, по Уолкеру и др. (1996) экотоксикология - учение о вредных эффектах химикатов на экосистемы. Устраняя из круга рассматриваемых экотоксикологией объектов человека, это определение детерминирует различие между экотоксикологией и токсикологией окружающей среды, определяет предмет изучения последней. Термин Утоксикология окружающей средыФ предлагается использовать только для исследований прямого действия УзагрязнителейФ окружающей среды на человека.
В процессе изучения эффектов химических веществ, присутствующих в окружающей среде, на человека и человеческие сообщества, токсикология окружающей среды оперирует уже устоявшимися категориями и понятиями классической токсикологии и применяет, как правило, ее традиционную экспериментальную, клиническую, эпидемиологическую методологию. Объектом исследований при этом являются механизмы, динамика развития, проявления неблагоприятных эффектов действия токсикантов и продуктов их превращения в окружающей среде на человека.
Разделяя в целом такой подход, и положительно оценивая его практическую значимость, следует однако заметить, что методологические различия между экотоксикологией и токсикологией окружающей среды полностью стираются, когда перед исследователем ставятся задачи оценить опосредованное действия загрязнителей на человеческие популяции (например, обусловленное токсической модификацией биоты), или, напротив, выяснить механизмы действия химикатов, находящихся в среде, на представителей того или иного отдельного вида живых существ. В этой связи, с теоретических позиций, Утоксикология окружающей средыФ, как наука, является лишь частной проблемой УэкотоксикологииФ, при этом методология, понятийный аппарат и структура наук - едины.
1. Ксенобиотический профиль среды
С позиций токсиколога абиотические и биотические элементы того, что мы называем окружающей средой - все это сложные, порой особым образом организованные агломераты, смеси бесчисленного количества молекул.
Для экотоксикологии интерес представляют лишь молекулы, обладающие биодоступностью, т.е. способные взаимодействовать немеханическим путем с живыми организмами. Как правило, это соединения, находящиеся в газообразном или жидком состоянии, в форме водных растворов, адсорбированные на частицах почвы и различных поверхностях, твердые вещества, но в виде мелко дисперсной пыли (размер частиц менее 50 мкм), наконец вещества, поступающие в организм с пищей.
Часть биодоступных соединений утилизируется организмами, участвуя в процессах их пластического и энергетического обмена с окружающей средой, т.е. выступают в качестве ресурсов среды обитания. Другие же, поступая в организм животных и растений, не используются как источники энергии или Упластический материалФ, но, действуя в достаточных дозах и концентрациях, способны существенно модифицировать течение нормальных физиологических процессов. Такие соединения называются чужеродными или ксенобиотиками (чуждые жизни).
Совокупность чужеродных веществ, содержащихся в окружающей среде (воде, почве, воздухе и живых организмах) в форме (агрегатном состоянии), позволяющей им вступать в химические и физико-химические взаимодействия с биологическими объектами экосистемы составляют ксенобиотический профиль биогеоценоза. Ксенобиотический профиль следует рассматривать как один из важнейших факторов внешней среды (наряду с температурой, освещенностью, влажностью, трофическими условиями и т.д.), который может быть описан качественными и количественными характеристиками.
Важным элементом ксенобиотического профиля являются чужеродные вещества, содержащиеся в органах и тканях живых существ, поскольку все они рано или поздно потребляются другими организмами (т.е. обладают биодоступностью). Напротив, химические вещества, фиксированные в твердых, не диспергируемых в воздухе и нерастворимых в воде объектах (скальные породы, твердые промышленные изделия, стекло, пластмасса и др.), не обладают биодоступностью. Их можно рассматривать как источники формирования ксенобиотического профиля.
Ксенобиотические профили среды, сформировавшиеся в ходе эволюционных процессов, миллионы лет протекавших на планете, можно назвать естественными ксенобиотическими профилями. Они различны в разных регионах Земли. Биоценозы, существующие в этих регионах (биотопах), в той или иной степени адаптированы к соответствующим естественным ксенобиотическим профилям.
Различные природные коллизии, а в последние годы и хозяйственная деятельность человека, порой существенным образом изменяют естественный ксенобиотический профиль многих регионов (особенно урбанизированных). Химические вещества, накапливающиеся в среде в несвойственных ей количествах и являющиеся причиной изменения естественного ксенобиотического профиля, выступают в качестве экополлютантов (загрязнителей). Изменение ксенобиотического профиля может явиться следствием избыточного накопления в среде одного или многих экополлютантов.
Далеко не всегда это приводит к пагубным последствиям для живой природы и населения. Лишь экополлютант, накопившийся в среде в количестве, достаточном для инициации токсического процесса в биоценозе (на любом уровне организации живой материи), может быть обозначен как экотоксикант.
Одна из сложнейших практических задач экотоксикологии - определение количественных параметров, при которых экополлютант трансформируется в экотоксикант. При её решении необходимо учитывать, что в реальных условиях на биоценоз действует весь ксенобиотический профиль среды, модифицируя при этом биологическую активность отдельного поллютанта. Поэтому в разных регионах (разные ксенобиотические профили, различные биоценозы) количественные параметры трансформации поллютанта в экотоксикант строго говоря различны.
2. Экотоксикокинетика
Экотоксикокинетика - раздел экотоксикологии, рассматривающий судьбу ксенобиотиков (экополлютантов) в окружающей среде: источники их появления; распределение в абиотических и биотических элементах окружающей среды; превращение ксенобиотика в среде обитания; элиминацию из окружающей среды.
2.1. Формирование ксенобиотического профиля. Источники поступления поллютантов в среду
К числу природных источников биодоступных ксенобиотиков, по данным ВОЗ (1992), относятся: переносимые ветром частицы пыли, аэрозоль морской соли, вулканическая деятельность, лесные пожары, биогенные частицы, биогенные летучие вещества. Другим источником ксенобиотиков в среде, значение которого неуклонно возрастает, является деятельность человека
Важнейшим элементом экотоксикологической характеристики поллютантов является идентификация их источников. Решить эту задачу далеко не просто, т.к. порой вещество поступает в среду в ничтожных количествах, иногда в виде примесей к вполне УбезобиднымФ субстанциям. Наконец возможно образование экополлютанта в окружающей среде в результате абиотических или биотических трансформаций других веществ.
2.2. Персистирование
Многочисленные абиотические (происходящие без участия живых организмов) и биотические (происходящие с участием живых организмов) процессы в окружающей среде, направлены на элиминацию (удаление) экополлютантов. Многие ксенобиотики, попав в воздух, почву, воду приносят минимальный вред экосистемам, поскольку время их воздействия ничтожно мало. Вещества, оказывающиеся резистентными к процессам разрушения, и, вследствие этого, длительно персистирующие в окружающей среде, как правило, являются потенциально опасными экотоксикантами.
Постоянный выброс в окружающую среду персистирующих поллютантов приводит к их накоплению, превращению в экотоксиканты для наиболее уязвимого (чувствительного) звена биосистемы. После прекращения выброса персистирующего токсиканта он еще длительное время сохраняется в среде. Так, в воде озера Онтарио в 90-е годы определяли высокие концентрации пестицида мирекс, использование которого было прекращено еще в конце 70-х годов. В водоемах испытательного полигона ВВС США во Флориде, где в 1962 - 1964 годах был с исследовательскими целями распылен Оранжевый Агент, спустя 10 лет ил содержал 10 - 35 нг/кг ТХДД (при норме, по стандартам США - 0,1 пкг/кг, России - 10 пкг/кг).
К числу веществ, длительно персистирующих в окружающей среде, относятся тяжелые металлы (свинец, медь, цинк, никель, кадмий, кобальт, сурьма, ртуть, мышьяк, хром), полициклические полигалогенированные углеводороды (полихлорированные дибензодиоксины и дибензофураны, полихлорированные бифенилы и т.д.), некоторые хлорорганические пестициды (ДДТ, гексахлоран, алдрин, линдан и т.д.) и многие другие вещества.
2.3. Трансформация
Подавляющее большинство веществ подвергаются в окружающей среде различным превращениям. Характер и скорость этих превращений определяют их стойкость.
2.3.1. Абиотическая трансформация
На стойкость вещества в окружающей среде влияет большое количество процессов. Основными являются фотолиз (разрушение под влиянием света), гидролиз, окисление.
Фотолиз. Свет, особенно ультрафиолетовые лучи, способен разрушать химические связи и, тем самым, вызывать деградацию химических веществ. Фотолиз проходит главным образом в атмосфере и на поверхности почвы и воды. Скорость фотолиза зависит от интенсивности света и способности вещества его поглощать. Ненасыщенные ароматические соединения, например полициклические ароматические углеводороды (ПАУ), наиболее чувствительны к фотолизу, т.к. активно поглощают энергию света. Свет ускоряет и другие процессы деградации веществ: гидролиз и окисление. В свою очередь наличие в средах фотооксидантов, таких как озон, окислы азота, формальдегид, акролеин, органические перекиси, существенно ускоряет процесс фотолиза других поллютантов (показано для ПАУ).
Гидролиз. Вода, особенно при нагревании, быстро разрушает многие вещества. Эфирные связи, например, в молекулах фосфорорганических соединений, высокочувствительны к действию воды, чем определяется умеренная стойкость этих соединений в окружающей среде. Скорость гидролиза сильно зависит от рН. В результате превращения химических веществ в окружающей среде образуются новые вещества. При этом их токсичность иногда может быть выше, чем у исходного агента.
Биотическая трансформация
Абиотическое разрушение химических веществ обычно проходит с малой скоростью. Значительно быстрее деградируют ксенобиотики при участии биоты, особенно микроорганизмов (главным образом бактерий и грибов), которые используют их как питательные вещества. Процесс биотического разрушения идет при участии энзимов. В основе биопревращений веществ лежат процессы окисления, гидролиза, дегалогенирования, расщепления циклических структур молекулы, отщепление алкильных радикалов (деалкилирование) и т.д. Деградация соединения может завершаться его полным разрушением, т.е. минерализацией (образование воды, двуокиси углерода, других простых соединений). Однако возможно образование промежуточных продуктов биотрансформации веществ, обладающих порой более высокой токсичностью, чем исходный агент. Так, превращение неорганических соединений ртути фитопланктоном может приводить к образованию более токсичных ртутьорганических соединений, в частности, метилртути. Подобное явление имело место в Японии на берегах бухты Минамато в 50 - 60х годах. Поступавшая в воду залива ртуть со стоками фабрики по производству азотных соединений, трансформировалась биотой в метилртуть. Последняя концентрировалась в тканях морских организмов и рыбы, служившей пищей местного населения. В итоге у людей, потреблявших рыбу, развивалось заболевание, характеризовавшееся сложным неврологическим симптомокомплексом, у новорожденных детей отмечались пороки развития. Всего было зарегистрировано 292 случая болезни Минамато, 62 из них закончились гибелью людей.
2.4. Процессы элиминации, не связанные с разрушением
Некоторые процессы, происходящие в окружающей среде, способствуют элиминации ксенобиотиков из региона, изменяя их распределение в компонентах среды. Загрязнитель с высоким значением давления пара может легко испаряться из воды и почвы, а затем перемещаться в другие регионы с током воздуха. Это явление лежит в основе повсеместного распространения относительно летучих хлорорганических инсектицидов, таких как линдан и гексахлорбензол.
Перемещение ветром и атмосферными течениями частиц токсикантов или почвы, на которых адсорбированы вещества, также важный путь перераспределения поллютантов в окружающей среде. В этом плане характерен пример полициклических ароматических углеводородов (бензпирены, дибензпирены, бензантрацены, дибензантрацены и др.). Бензпирен и родственные ему соединения как естественного (главным образом вулканического), так и антропогенного происхождения (выброс металлургического, нефтеперерабатывающего производств, предприятий теплоэнергетики и т.д.) активно включаются в биосферный круговорот веществ, переходя из одной среды в другую. При этом, как правило, они связаны с твердыми частицами атмосферной пыли. Мелкодисперсная пыль (1-10 мкм) длительно сохраняется в воздухе, более крупные пылевые частицы достаточно быстро выседают на почву и в воду в месте образования. При извержении вулканов пепел содержит большое количество таких веществ. При этом, чем выше выброс, тем на большее расстояние рассеиваются поллютанты.
Сорбция веществ на взвешенных частицах в воде, с последующим осаждением приводит к их элиминации из толщи воды, но накоплению в донных отложениях. Осаждение резко снижает биодоступность загрязнителя.
Перераспределению водо-растворимых веществ способствуют дожди и движение грунтовых вод. Например, гербицид атразин, используемый для защиты широколиственных растений в сельском и парковом хозяйстве США, повсеместно присутствует там в поверхностных водах. По некоторым данным до 92% исследованных водоемов США содержат этот пестицид. Поскольку вещество достаточно стойкое и легко растворимо в воде оно мигрирует и в грунтовые воды и там накапливается.
2.5. Биоаккумуляция
Если загрязнитель окружающей среды не может попасть внутрь организма, он, как правило, не представляет для него существенной опасности. Однако, попав во внутренние среды, многие ксенобиотики способны накапливаться в тканях (см. раздел УТоксикокинетикаФ). Процесс, посредством которого организмы накапливают токсиканты, извлекая их из абиотической фазы (воды, почвы, воздуха) и из пищи (трофическая передача), называется биоаккумуляцией. Результатом биоаккумуляции являются пагубные последствия как для самого организма (достижение поражающей концентрации в критических тканях), так и для организмов, использующих данный биологический вид, в качестве пищи.
Водная среда обеспечивает наилучшие условия для биоаккумуляции соединений. Здесь обитают мириады водных организмов, фильтрующих и пропускающих через себя огромное количество воды, экстрагируя при этом токсиканты, способные к кумуляции. Гидробионты накапливают вещества в концентрациях, порой в тысячи раз больших, чем содержится в воде.
Факторы, влияющие на биоаккумуляцию
Склонность экотоксикантов к биоаккумуляции зависит от ряда факторов. Первый - персистирование ксенобиотика в среде. Степень накопления вещества в организме, в конечном счете, определяется его содержанием в среде. Вещества, быстро элиминирующиеся, в целом, плохо накапливаются в организме. Исключением являются условия, при которых поллютант постоянно привносится в окружающую среду (регионы близ производств и т.д.).
Так, синильная кислота, хотя и токсичное соединение, в силу высокой летучести не является, по мнению многих специалистов, потенциально опасным экополлютантом. Правда, до настоящего времени не удалось полностью исключить, что некоторые виды заболеваний, нарушения беременности у женщин, проживающих близ золотодобывающих предприятий, где цианиды используются в огромных количествах, не связаны с хроническим действием вещества.
После поступления веществ в организм их судьба определяется токсикокинетическими процессами (см. соответствующий раздел). Наибольшей способностью к биоаккумуляции обладают жирорастворимые (липофильные) вещества, медленно метаболизирующие в организме. Жировая ткань, как правило, основное место длительного депонирования ксенобиотиков. Так, спустя много лет после воздействия, высокое содержание ТХДД обнаруживали в биоптатах жировой ткани и плазме крови ветеранов армии США, участников вьетнамской войны. Однако многие липофильные вещества склонны к сорбции на поверхностях различных частиц, осаждающихся из воды и воздуха, что снижает их биодоступность. Например, сорбция бензпирена гуминовыми кислотами снижает способность токсиканта к биоаккумуляции тканями рыб в три раза. Рыбы из водоемов с низким содержанием взвешенных частиц в воде аккумулируют большее количество ДДТ, чем рыбы из эвтрофических водоемов с высоким содержанием взвеси.
Вещества, метаболизирующие в организме, накапливаются в меньшем количестве, чем можно было бы ожидать, исходя из их физико-химических свойств. Межвидовые различия значений факторов биоаккумуляции ксенобиотиков во многом определяются видовыми особенностями их метаболизма.
Значение биоаккумуляции
Биоаккумуляция может лежать в основе не только хронических, но и отсроченных острых токсических эффектов. Так, быстрая потеря жира, в котором накоплено большое количество вещества, приводит к выходу токсиканта в кровь. Мобилизация жировой ткани у животных нередко отмечается в период размножения. В экологически неблагополучных регионах это может сопровождаться массовой гибелью животных при достижении ими половой зрелости. Стойкие поллютанты могут также передаваться потомству, у птиц и рыб - с содержимым желточного мешка, у млекопитающих - с молоком кормящей матери. При этом возможно развитие эффектов у потомства, не проявляющихся у родителей.
2.6. Биомагнификация
Химические вещества могут перемещаться по пищевым цепям от организмов-жертв, к организмам-консументам. Для высоко липофильных веществ это перемещение может сопровождаться увеличением концентрации токсиканта в тканях каждого последующего организма - звена пищевой цепи. Этот феномен называется биомагнификацией. Так, для уничтожения комаров на одном из калифорнийских озер применили ДДТ. После обработки содержание пестицида в воде составило 0,02 частей на миллион (ppm). Через некоторое время в планктоне ДДТ определялся в концентрации 10 ppm, в тканях планктоноядных рыб - 900 ppm, хищных рыб - 2700 ppm, птиц, питающихся рыбой - 21000 ppm. То есть содержание ДДТ в тканях птиц, не подвергшихся непосредственному воздействию пестицида, было в 1000000 раз выше, чем в воде и в 20 раз выше, чем в организме рыб - первом звене пищевой цепи.
В уже упоминавшейся ранее книге Рашель Карсон УМолчаливая веснаФ приводится такой пример. Для борьбы с переносчиком Уголландской болезниФ, поражающей вязы, вязовым заболонником Scolytes multistriatus, деревья обрабатывали ДДТ. Часть пестицида попадала в почву, где его поглощали дождевые черви и накапливали в тканях. У поедающих преимущественно дождевых червей перелетных дроздов развивалось отравление пестицидом. Часть из них погибала, у других нарушалась репродуктивная функция - они откладывали стерильные яйца. В результате, борьба с заболеванием деревьев привела к почти полному исчезновению перелетных дроздов в ряде регионов США.
3. Экотоксикодинамика
3.1. Общие понятия
Экотоксикодинамика - раздел экотоксикологиии, рассматривающий конкретные механизмы развития и формы токсического процесса, вызванного действием экотоксикантов на биоценоз и/или отдельные виды, его составляющие.
Механизмы, посредством которых вещества могут вызывать неблагоприятные эффекты в биогеоценозах, многочисленны и, вероятно, в каждом конкретном случае, уникальны. Вместе с тем, они поддаются классификации. Так, можно выделить прямое, опосредованное и смешанное действие экотоксикантов.
Прямое действие - это непосредственное поражение организмов определенной популяции или нескольких популяций (биоценоза) экотоксикантом или совокупностью экотоксикантов данного ксенобиотического профиля среды. Примером веществ с подобным механизмом действия на человека является кадмий. Этот металл накапливается в организме даже при минимальном его содержании в среде и при достижении критической концентрации инициирует токсический процесс проявляющийся поражением дыхательной системы, почек, иммуносупрессией и канцерогенезом.
Опосредованное - это действие ксенобиотического профиля среды на биотические или абиотические элементы среды обитания популяции, в результате которого условия и ресурсы среды перестают быть оптимальными для её существования.
Многие токсиканты способны оказывать как прямое, так и опосредованное, т.е. смешанное действие. Примером веществ, обладающих смешанным механизмом экотоксического действия, являются в частности гербициды 2,4,5-Т и 2,4-Д, содержащие в качестве примеси небольшое количество 2,3,7,8-тетрахлордибензо-р-диоксин (ТХДД). Широкое использование этих веществ американской армией во Вьетнаме нанесло значительный ущерб растительному, животному миру страны и непосредственно здоровью людей.
3.2. Экотоксичность
Экотоксичность - это способность данного ксенобиотического профиля среды вызывать неблагоприятные эффекты в соответствующем биоценозе. В тех случаях, когда нарушение естественного ксенобиотического профиля связано с избыточным накоплением в среде лишь одного поллютанта, можно условно говорить об экотоксичности только этого вещества.
В соответствии с представлением об уровнях организации биологических систем в экологии принято выделять три раздела (Г.В. Стадницкий, А.И. Родионов, 1996):
Аутэкологию - описание экологических эффектов на уровне организма;
Демэкологию - экологические эффекты на уровне популяции;
Синэкологию - эффекты на уровне биоценоза.
В этой связи и неблагоприятные экотоксические эффекты, целесообразно рассматривать:
На уровне организма (аутэкотоксические) - проявляются снижением резистентности к другим действующим факторам среды, понижением активности, заболеваниями, гибелью организма, канцерогенезом, нарушениями репродуктивных функций и т.д.
На уровне популяции (демэкотоксические) - проявляются гибелью популяции, ростом заболеваемости, смертности, уменьшением рождаемости, увеличением числа врожденных дефектов развития, нарушением демографических характеристик (соотношение возрастов, полов и т.д.), изменением средней продолжительности жизни, культурной деградацией.
На уровне биогеоценоза (синэкотоксические) - проявляются изменением популяционного спектра ценоза, вплоть до исчезновения отдельных видов и появления новых, не свойственных данному биоценозу, нарушением межвидовых взаимоотношений.
В случае оценки экотоксичности лишь одного вещества в отношении представителей только одного вида живых существ, в полной мере могут быть использованы качественные и количественные характеристики, принятые в классической токсикологии (величины острой, подострой, хронической токсичность, дозы и концентрации, вызывающие мутагенное, канцерогенное и иные виды эффектов и т.д.). Однако в более сложных системах, экотоксичность цифрами (количественно) не измеряется, она характеризуется целым рядом показателей качественно или полуколичественно, через понятия УопасностьФ или Уэкологический рискФ.
В зависимости от продолжительности действия экотоксикантов на экосистему можно говорить об острой и хронической экотоксичности.
3.2.1. Острая экотоксичность
Острое токсического действия веществ на биоценоз может явиться следствием аварий и катастроф, сопровождающихся выходом в окружающую среду большого количества относительно нестойкого токсиканта или неправильного использования химикатов.
Истории уже известны такие события. Так, в 1984 году в г. Бхопал (Индия) на заводе американской химической компании по производству пестицидов УЮнион КарбайдФ произошла авария. В результате в атмосферу попало большое количество пульмонотропного вещества метилизоцианата. Будучи летучей жидкостью, вещество образовало нестойкий очаг заражения. Однако отравлению подверглись около 200 тыс. человек, из них 3 тысячи - погибли. Основная причина смерти - остро развившийся отек легких.
Другой известный случай острой токсикоэкологической кататстрофы имел место в Ираке. Правительством этого государства была закуплена большая партия зерна а качестве посевного материала. Посевное зерно с целью борьбы с вредителями подвергалось обработке фунгицидом метилртутью. Однако эта партия зерна случайно попала в продажу и была использована для выпечки хлеба. В результате этой экологической катастрофы отравление получили более 6,5 тыс. человек, из которых около 500 погибли.
В 2000 году в Румынии, на одном из предприятий по добыче драгоценных металлов, в результате аварии произошла утечка синильной кислоты и цианид-содержащих продуктов. Токсиканты в огромном количестве поступили в воды Дуная, отравив все живое на протяжении сотен километров вниз по течению реки.
Величайшим экологическим бедствием является использование высокотоксичных химических веществ с военными целями. В годы первой мировой войны воюющими странами было использовано на полях сражений около 120 тыс. тонн отравляющих веществ. В результате отравление получили более 1,3 млн. человек, что можно рассматривать, как одну из крупнейших в истории человечества экологических катастроф.
Острое экотоксическое действие не всегда приводит к гибели или острым заболеванием людей или представителей других биологических видов, подвергшихся воздействию. Так, среди ОВ, применявшихся в первую мировую войну, был и сернистый иприт. Это вещество, являясь канцерогеном, стало причиной поздней гибели пораженных от новообразований.
3.2.2. Хроническая экотоксичность
С хронической токсичностью веществ, как правило, ассоциируются сублетальные эффекты. Часто при этом подразумевают нарушение репродуктивных функций, иммунные сдвиги, эндокринную патологию, пороки развития, аллергизацию и т.д. Однако хроническое воздействие токсиканта может приводить и к смертельным исходам среди особей отдельных видов.
Проявления действия экотоксикантов на человека могут быть самыми разнообразными и при определенных уровнях интенсивности воздействия оказываются достаточно специфичными для действующего фактора.
Механизмы экотоксичности
В современной литературе приводятся многочисленные примеры механизмов действия химических веществ на живую природу, позволяющие оценить их сложность и неожиданность.
1. Прямое действие токсикантов, приводящее к массовой гибели представителей чувствительных видов. Применение эффективных пестицидов приводит к массовой гибели вредителей: насекомых (инсектициды) или сорняков (гербициды). На этом экотоксическом эффекте строится стратегия использование химикатов. Однако в ряде случаев отмечаются сопутствующие негативные явления. Так в Швеции, в 50-60 гг. для обработки семян зерновых культур широко использовали метилртутьдицианамид. Концентрация ртути в зерне составляла более 10 мг/кг. Периодическое склевывание протравленного семенного зерна птицами привело к тому, что через несколько лет была отмечена массовая гибель фазанов, голубей, куропаток и других зерноядных пернатых от хронической интоксикации ртутью.
При оценке экологической обстановки необходимо иметь в виду основной закон токсикологии: чувствительность различных видов живых организмов к химическим веществам всегда различна. Поэтому появление поллютанта в окружающей среде даже в малых количествах может быть пагубным для представителей наиболее чувствительного вида. Так, хлорид свинца убивает дафний в течение суток при содержании его в воде в концентрации около 0,01 мг/л, малоопасной для представителей других видов.
2. Прямое действие ксенобиотика, приводящее к развитию аллобиотических состояний и специальных форм токсического процесса. В конце 80-х годов в результате вирусных инфекций в Балтийском, Северном и Ирландском морях погибло около 18 тысяч тюленей. В тканях погибших животных находили высокое содержание полихлорированных бифенилов (ПХБ). Известно, что ПХБ, как и другие хлорсодержащие соединения, такие как ДДТ, гексахлорбензол, диелдрин обладают иммуносупрессивным действием на млекопитающих. Их накопление в организме и привело к снижению резистентности тюленей к инфекции. Таким образом, непосредственно не вызывая гибели животных, поллютант существенно повышал их чувствительность к действию других неблагоприятных экологических факторов.
Классическим примером данной формы экотоксического действия является увеличение числа новообразований, снижение репродуктивных возможностей в популяциях людей, проживающих в регионах, загрязненных экотоксикантами (территории Южного Вьетнама - диоксин).
3. Эмбриотоксическое действие экополлютантов. Хорошо установлено, что ДДТ, накапливаясь в тканях птиц, таких как кряква, скопа, белоголовый орлан и др., приводит к истончению скорлупы яиц. В итоге птенцы не могут быть высижены и погибают. Это сопровождается снижением численности популяции птиц.
Примеры токсического действия различных ксенобиотиков (в том числе лекарственных препаратов) на эмбрионы человека и млекопитающих широко известны (см. раздел УТератогенезФ).
4. Прямое действие продукта биотрансформации поллютанта с необычным эффектом. Полевые наблюдения за живородящими рыбами (карпозубые) в штате Флорида позволили выявить популяции с большим количеством самок с явными признаками маскулинизации (своеобразное поведение, модификация анального плавника и т.д.). Эти популяции были обнаружены в реке, ниже стока завода по переработке орехов. Первоначально предположили, что стоки содержат маскулинизирующие вещества. Однако исследования показали, что такие вещества в выбросах отсутствуют: сточная вода не вызывала маскулинизацию. Далее было установлено, что в сточных водах содержался фитостерон, (образуется в процессе переработки сырья), который попав в воду реки подвергался воздействию обитающих здесь бактерий и превращался при их участии в андроген. Последний и вызывал неблагоприятный эффект.
Экотоксикометрия
Общая методология
Экотоксикометрия - раздел экотоксикологии, в рамках которого рассматриваются методические приемы позволяющие оценить (перспективно или ретроспективно) экотоксичнсоть ксенобиотиков.
Все виды классических количественных токсикологических исследований в полной мере используются для определения экотоксичности ксенобиотиков (см раздел УТоксикометрияФ).
Острая токсичность экополлютантов определяется экспериментально на нескольких видах, являющихся представителями различных уровней трофической организации в экосистеме (водоросли, растения, беспозвоночные, рыбы, птицы, млекопитающие). Агентство по защите окружающей среды США требует при определении критериев качества воды, содержащей некий токсикант, определения его токсичности, по крайней мере, на 8 различных видах пресноводных и морских организмов (16 тестов).
Неоднократно делались попытки ранжировать виды живых существ по их чувствительности к ксенобиотикам. Однако для различных токсикантов соотношение чувствительности к ним живых существ различно. Более того, использование в экотоксикологии Устандартных видовФ представителей определенных уровней экологической организации, для определения экотоксичности ксенобиотиков, с научной точки зрения, не корректно, поскольку чувствительность животных даже близких видов, порой отличается очень существенно.
При оценке экотоксичности необходимо учитывать, что хотя практически все вещества могут вызывать острые токсические эффекты, хроническая токсичность выявляется далеко не у каждого соединения. Косвенной величиной, указывающей на степень опасности вещества при его хроническом действии, является соотношение концентраций, вызывающих острые (ЛК50) и хронические (порог токсического действия) эффекты. Если это соотношение менее 10, вещество рассматривается как малоопасное при хроническом воздействии.
При оценке хронической экотоксичности вещества необходимо учитывать следующие обстоятельства:
1. Определение коэффициента опасности является лишь самым первым шагом по определения экотоксического потенциала вещества. В условиях лаборатории пороговые концентрации хронического действия токсикантов определяют, оценивая показатели летальности, роста, репродуктивных способностей группы. Изучение других последствий хронического действия веществ порой может привести к иным числовым характеристикам.
2. Исследования токсичности проводят на животных, пригодных для содержания в условиях лаборатории. Получаемые при этом результаты нельзя рассматривать как абсолютные. Токсиканты могут вызывать хронические эффекты у одних видов, и не вызывать - у других.
3. Взаимодействие токсиканта с биотическими и абиотическими элементами окружающей среды может существенно сказаться на его токсичности в естественных условиях (см. выше). Однако это не подлежит изучению в условия
Токсический эффект вредных веществ - это результат взаимодействия орга-низма, вредного вещества и окружающей среды. Эффект воздей-ствия различных веществ зависит от количества попавшего в ор-ганизм вещества, его физико-химических свойств, длительности поступления, химических реакций в организме.
Токсический эффект зависит от биологических особенностей вида, пола, возраста и индивидуальной чувствительности орга-низма, строения и физико-химических свойств яда, количества
опавшего в организм вещества, факторов внешней среды (тем-пературы, атмосферного давления и др.).
Так, разветвление цепи углеводородных атомов ослабляют токсический эффект по сравнению с неразветвленными изомера-ми Введение в молекулу гидроксильной группы ослабляет ток-сичность (спирты менее токсичны, чем соответствующие углево-дороды). Введение галогена в молекулу органического соедине-ния усиливает его токсичность и т.д.
Весьма различна видовая чувствительность к ядам различных организмов, что обусловлено особенностями метаболизма, мас-сой тела и др. Имеет место определенное различие в формирова-нии токсического эффекта в зависимости от пола: отмечается большая чувствительность женщин к действию органических растворителей, а мужчин к соединениям бора, марганца. Одни яды более токсичны для молодых, а другие для пожилых. Инди-видуальная чувствительность определяется состоянием здоровья.
В ряде случаев интермиттирующее (прерывистое) действие яда усиливает токсический эффект. Усиление лгжсического дей-ствия на организм человека наблюдается при повышении темпе-ратуры, влажности, барометрического давления. При значитель-ной физической нагрузке наблюдается увеличение вентиляции легких, что приводит к интенсивному распределению отравляю-щего вещества в организме. Шум и вибрация также могут усили-вать токсический эффект.
Общая токсикологическая классификация промышленных ядов включает в себя следующие виды воздействия на живые ор-ганизмы:
- общетоксическое (кома, отек мозга, судороги): алкоголь и его суррогаты, угарный газ;
- нервно-паралитическое (судороги, параличи): никотин, некоторые пестициды, ОВ;
- кожно-резорбтивное (местные воспаления в комбинации с общетоксическими явлениями): уксусная эссенция, дихлорэтан, мышьяк;
- удушающее (токсический отек мозга): окислы азота, неко-торые ОВ;
- слезоточивое и раздражающее (раздражение слизистых оболочек глаз, носа, горла): пары крепких кислот и щелочей;
^100- психотропное (нарушение психической активности, созна-ния): наркотики, атропин;
- сенсибилизирующее (аллергии): формальдегид, раствори-тели, лаки;
- мутагенное (нарушение генетического кода, изменение на-следственной информации): свинец, марганец, радиоактивные изотопы;
- канцерогенное (вызывают злокачественные опухоли): хром, никель, асбест;
- тератогенное (влияют на репродуктивную, детородную функцию): ртуть, свинец, стирол, борная кислота.
Три последних вида воздействия вредных веществ - мута-генное, канцерогенное и тератогенное - относят к отдаленным последствиям влияния химических соединений на организм. Это специфическое действие, которое проявляется не в период воз-действия и не сразу после его окончания, а в отдаленные перио-ды, спустя годы и даже десятилетия. Отмечается появление раз-личных эффектов, и в последующих поколениях, особенно для веществ с мутагенными свойствами.
Кроме того, яды обладают и избирательной токсичностью, т.е. представляют наибольшую опасность для определенного ор-гана или системы организма. По избирательной токсичности вы-деляют яды:
- воздействующие на сердце. К ним относятся многие ле-карственные препараты, растительные яды, соли металлов (ба-рия, калия);
- воздействующие на нервную систему и вызывающие на-рушение психической деятельности. Это алкоголь, наркотики, угарный газ, некоторые пестициды;
- накапливающиеся в печени. Среди них следует выделить хлорированные углеводороды, ядовитые грибы, фенолы и альдегиды;
- накапливающиеся в почках. Это соединения тяжелых металлов, этиленгликоль, щавелевая кислота;
- воздействующие на кровь. Это анилин и его производ-ные, нитриты;
- воздействующие на легкие. Это окислы азота, озон, фосген;
- накапливающиеся в костях и воздействующие на крове-творение - стронций.
Для большой группы аэрозолей (пыли), не обладающих вы-раженной токсичностью, надо отметить фиброгенный эффект действия на организм. К ним относятся аэрозоли угля, кокса, са-жи алмазов, пыли животного и растительного происхождения, силикатные и кремнийсодержащие пыли, аэрозоли дезинтеграции и конденсации металлов.
Попадая в органы дыхания, вещества этой группы повреж-дают слизистую оболочку верхних дыхательных путей, что при-водит к развитию бронхита. Задерживаясь в легких, пыль вызы-вает перерождение легочной ткани в соединительную ткань и рубцеванию (фиброзу) легких. Профессиональные заболевания, связанные с воздействием аэрозолей, - пневмокониозы и хрони-ческий пылевой бронхит - занимают второе место по частоте сре-ди всех профессиональных заболеваний в России.
Наличие фиброгенного эффекта не исключает общетоксиче-ского воздействия аэрозолей. К ядовитым пылям относят аэрозо-ли пестицида ДДТ, свинца, бериллия, мышьяка и др. При попа-дании их в органы дыхания, помимо местных изменений в верх-них дыхательных путях, развивается картина острого и хрониче-ского отравления.
На производстве редко встречается изолированное действие вредных веществ, обычно работник подвергается сочетающемуся воздействию негативных факторов разной природы (физических, химических, факторов тяжести и напряженности труда) или ком-бинированному влиянию факторов одной природы, например группы химических веществ. Комбинированное действие - это одновременное или последовательное действие на организм не-скольких ядов при одном и том же пути поступления. Различают несколько типов комбинированного действия ядов в зависимости от эффектов токсичности:
Опубликовано в журнале:
РАКТИКА ПЕДИАТРА, ФАРМАКОЛОГИЯ, Июнь 2006г.
С.С ПОСТНИКОВ, д.м.н, профессор кафедры клинической фармакологии РГМУ, Москва К сожалению, безвредных лекарств нет и, более того, по-видимому, и быть не может. Поэтому мы продолжаем рассказывать о побочных эффектах одной из самой назначаемой группы препаратов - антибактериальных средств.
АМИНОГЛИКОЗИДЫ (АМГ)
К аминогликозидам относят соединения, в состав которых входят 2 или более аминосахаров, соединенных гликозидной связью с ядром молекулы - аминоциклитолом.
Большинство первых АМГ - природные АБ (грибки рода Streptomices и Micromonospore). Новейшие АМГ - амикацин (производное канамицина А) и нетилмицин (полусинтетическое производное гентамицина) получены путем химической модификации природных молекул.
АМГ играют важную роль в лечении инфекций, вызванных грамотрицательными организмами. Все АМГ как старые (стрептомицин, неомицин, мономицин, канамицин), так и новые (гентамицин, тобрамицин, сизомицин, амикацин, нетилмицин) обладают широким спектром действия, бактерицидностью, близкими фармакокинетическими свойствами, сходными особенностями побочных и токсических реакций (ото- и нефротоксичность) и синергидным взаимодействием с β-лактамами (Союзфармация, 1991).
При введении через рот АМГ всасываются плохо и поэтому для лечения инфекций вне кишечной трубки не используются.
Однако АМГ могут в значительной мере абсорбироваться (особенно у новорожденных) при местном применении с поверхности тела после ирригации или аппликации и оказывать нефро- и нейротоксическое действие (системный эффект).
АМГ проникают через плаценту, накапливаются у плода (около 50% материнской концентрации) с возможным развитием тотальной глухоты.
НЕФРОТОКСИЧНОСТЬ АМГ
АМГ почти не подвергаются биотрансформации и выводятся из организма в основном путем клубочковой фильтрации. Указывается также на их реабсорбцию проксимальными канальцами. Из-за преимущественно ренального пути элиминации все представители этой группы АБ потенциально нефротоксичны (вплоть до развития тубулярного некроза с ОПН), только в разной степени. По этому признаку АМГ могут быть расположены в следующем порядке: неомицин > гентамицина > тобрамицина > амикацина > нетилмицина (Е.М.Лукьянова, 2002).
Нефротоксичность АМГ (2-10%) чаще развивается в полярных возрастных группах (дети раннего возраста и пожилые люди) - возрастзависимый токсический эффект. Вероятность нефротоксичности также возрастает с увеличением суточной дозы, длительности лечения (более 10 дней), а также кратности введения, и зависит от предшествующей почечной дисфункции.
Наиболее информативными показателями поражения проксимальных канальцев (мишень для токсического воздействия АМГ) являются появление в моче микроглобулинов (β 2 -микроглобулина и α 1 -микроглобулина), которые в норме почти полностью реабсорбируются и катаболизируются проксимальными канальцами и энзимурия (повышение уровня N-ацетил-β-глюкозаминидазы), а также белков с молекулярной массой больше 33 КД, которые фильтруются клубочками. Как правило, эти маркеры обнаруживаются после 5-7 дней лечения, умеренно выражены и обратимы.
Нарушение азотовыделительной функции почек как проявление почечной недостаточности (повышение уровня мочевины и креатинина сыворотки более, чем на 20%) выявляется лишь при существенном поражении почек вследствие длительного применения АМГ в высоких дозах, потенциировании их нефротоксичности петлевыми диуретиками и/или амфотерицином В.
ГЕНТАМИЦИН: почками кумулируется около 40% АБ, распределяемого в тканях больного (в коре почек более 80% "почечного" АБ). В корковом слое почек концентрация гентамицина превышает наблюдаемой в сыворотке крови более чем в 100 раз. Следует подчеркнуть, что для гентамицина характерна более высокая степень канальцевой реабсорбции и большее накопление в корковом слое почек, чем у других АМГ. Гентамицин накапливается также (хотя и в меньших количествах) в мозговом слое и сосочках почек.
Гентамицин, поглощаясь проксимальными канальцами почек, накапливается в лизосомах клеток. Находясь в клетках, он ингибирует лизосомальную фосфолипазу и сфингомиелиназу, что вызывает лизосомальный фосфолипидоз, аккумуляцию миелодных частиц и клеточный некроз. При электронно-микроскопическом исследовании в эксперименте и биопсии почек у человека выявлено набухание проксимальных канальцев, исчезновение ворсинок щеточной каймы, изменения внутриклеточных органелл при введении гентамицина в средних терапевтических дозах. Лечение высокими (>7 мг/кг в день) дозами гентамицина может сопровождаться острым тубулярным некрозом с развитием ОПН и необходимостью гемодиализа в отдельных случаях, продолжительностью олигурической фазы около 10 дней, при этом, как правило, наблюдается полное восстановление функции почек после отмены препарата.
К факторам, повышающим возможность проявления нефротоксичности гентамицина, относятся: предшествующая несостоятельность почек, гиповолемия, одновременное использование других нефротоксических ЛС (гидрокортизона, индометацина, фуросемида и этакриновой кислоты, цефалоридина, циклоспорина, амфотерицина В), рентгеноконтрастных веществ; возраст больного.
Частота возникновения нефротоксических реакций при лечении гентамицином варьирует от 10-12 до 25% и даже 40% в зависимости от дозы и продолжительности лечения. Эти реакции чаще наблюдаются при максимальной концентрации АБ в крови 12-15 мкг/мл. Однако подчеркивается целесообразность определения минимальных (остаточных) концентраций, поскольку увеличение именно этих значений выше 1-2 мкг/мл перед каждым следующим введением является свидетельством кумуляции препарата и, следовательно, возможной нефротоксичности. Отсюда и необходимость лекарственного мониторинга для АМГ.
ОТОТОКСИЧНОСТЬ АМГ
При применении стрептомицина, гентамицина, тобрамицина чаще возникают вестибулярные расстройства, а канамицин и его производное амикацин преимущественно влияют на слух. Однако это избирательность сугубо относительна и у всех АМГ отмечается "широкий" спектр ототоксичности. Так, гентамицин проникает и длительно сохраняется в жидкости внутреннего уха, в клетках слухового и вестибулярного аппарата. Его концентрация в эндо- и перилимфе значительно выше, чем в других органах и приближается к концентрации крови, а на уровне 1 мкг/мл сохраняется там в течение 15 дней после прекращения лечения, вызывая дегенеративные изменения во внешних клетках мерцательного эпителия основной извилины улитки (Ю.Б.Белоусов, С.М.Шатунов, 2001). В клинической картине этим изменениям соответствует нарушение слуха в пределах высоких тонов, а по мере продвижения дегенерации к верхушке улитки - также средних и низких тонов. К ранним обратимым проявлением вестибулярных расстройств (через 3-5 дней от начала применения препарата) относится: головокружение, шум в ушах, нистагм, нарушение координации. При длительном применении АМГ (более 2-3-х недель) происходит замедление их выведения из организма с повышением концентрации во внутренним ухе, в результате чего могут развиться тяжелые инвалидизирующие изменения органов слуха и равновесия. Однако в случае с гентамицином не выявлено достаточной корреляции между его концентрацией во внутреннем ухе и степенью ототоксичности, и, в отличие от канамицина, мономицина и неомицина, глухота при лечении гентамицином практически не развивается. Вместе с этим существуют выраженные вариации среди АМГ в частоте возникновения этих нарушений. Так, в одном из исследований на 10000 больных было выявлено, что амикацин вызывает нарушение слуха в 13,9% случаев, гентамицин - у 8,3% больных, тобрамицин - у 6,3%, а неомицин - у 2,4%. Частота вестибулярных нарушений составляет соответственно 2,8; 3,2; 3,5 и 1,4%.
Ототоксические реакции при лечении гентамицином развиваются значительно реже у взрослых, чем у детей. Теоретически новорожденные являются группой повышенного риска по развитию ототоксических реакций в связи с незрелостью механизмов элиминации, меньшей скоростью клубочковой фильтрации. Однако, несмотря на широкое применение гентамицина у беременных и новорожденных, неонатальная ототоксичность наблюдается исключительно редко.
Слуховые и вестибулярные токсические эффекты тобрамицина также связываются с его передозировкой, длительностью лечения (>10 дней) и особенностями больных - нарушенная почечная функция, обезвоживание, получение других лекарств, также обладающих ототоксичностью или сдерживающих элиминацию АМГ.
У части больных ототоксичность может клинически не проявлять себя, в других случаях больные испытывают головокружение, шум в ушах, потерю остроты восприятия высоких тонов по мере прогрессирования ототоксичности. Признаки ототоксичности обычно начинают появляться спустя длительное время после отмены препарата - отсроченный эффект. Однако известен случай (В.С. Моисеев, 1995), когда ототоксичность развилась после однократного введения тобрамицина.
АМИКАЦИН. Наличие в 1-м положении молекулы амикацина - 4-амино-2-гидроксибутирил-масляной кислоты обеспечивает не только защиту АБ от разрушающего действия большинства ферментов, продуцируемых устойчивыми штаммами бактерий, но и является причиной меньшей ототоксичности по сравнению с другими АМГ (кроме метилмицина): слуховые - 5%, вестибулярные - 0,65% на 1500 лечившихся этим АБ. Однако в другой серии исследований (10000 больных) контролировавшихся аудиометрией, была показана близкая к гентамицину частота слуховых расстройств, хотя в эксперименте было установлено, что амикацин подобно другим АМГ проникает во внутреннее ухо и вызывает дегенеративные изменения волосяных клеток, однако, как и в случае с гентамицином, не было установлено зависимости между уровнем концентрации амикацина во внутреннем ухе и степенью ототоксичности. Показано также, что волосковые клетки слуховой и вестибулярной системы выживали и при том, что гентамицин обнаружился внутри клеток и через 11 месяцев после прекращения лечения. Это доказывает, что не существует простой корреляции между присутствием АМГ и повреждением органов слуха и равновесия. Именно поэтому было высказано предположение о наличии у отдельных больных генетической предрасположенности к повреждающему воздействию АМГ (М.Г. Абакаров, 2003). Подтверждением этому положению было открытие в 1993 году у 15 больных с тугоухостью из 3-х китайских семей (после лечения АМГ) генетической мутации A1555G позиции 12S РНК, кодирующей митохондриальные ферменты, которая не была обнаружена у 278 пациентов без тугоухости, также получавших АМГ. Это позволило сделать вывод о том, что применение АМГ является пусковым механизмом для фенотипического выявления этой мутации.
В последние годы приобретает все большую популярность новый режим дозирования АМГ - однократное введение всей суточной дозы гентамицина (7 мг/кг) или тобрамицина (1 мг/кг) в виде 30-60-минутной инфузии. При этом исходит из того, что АМГ обладают концентрационно-зависимым бактерицидным эффектом и поэтому отношение Cmax/ mic > 10 является адекватным предиктором клинико-бактериологического эффекта.
Эффективность нового способа введения АМГ была показана при инфекциях различной локализации - абдоминальных, респираторных, мочеполовых, кожных и мягкотканных, как острых по течению, так и хронических (муковисцидоз). Однако возникающие при таком режиме дозирования пиковые концентрации АМГ, нередко превышающие 20 мкг/мл, могут теоретически создавать угрозу нефро- и ототоксичности. Между тем исследования D. Nicolau, 1995; K. Kruger, 2001; T. Schroeter et al, 2001 показывают, что однократное введение АМГ не только не уступают, но даже превосходят по безопасности обычное 3-х разовое применение АМГ, возможно, за счет более длительного отмывочного периода.
ТЕТРАЦИКЛИНЫ
Тетрациклины - остеотропны и поэтому накапливаются в костной ткани, особенно молодой, пролиферирующей. В эксперименте у собак отмечено отложение тетрациклина и в постоянных зубах.
Вследствие своей липофильности тетрациклины проникают через плацентарный барьер и откладываются в костях плода (в виде лишенных биологической активности хелатных комплексов с кальцием), что может сопровождаться замедлением их роста.
Применение тетрациклиновых АБ у детей дошкольного возраста приводит в ряде случаев к отложению препаратов в зубной эмали и дентине, что вызывает гипоминерализацию зубов, их потемнение (дисколорацию), гипоплазию зубной эмали, увеличение частоты кариеса, выпадение зубов. Встречаемость этих осложнений при применении тетрациклинов составляет примерно 20%.
При неосторожном или ошибочном применении тетрациклинов в большой дозе (более 2 г в день) может развиться тубулотоксичность (тубулярный некроз) с клиникой ОПН и необходимостью, в отдельных случаях, гемодиализа.
Поэтому использование тетрациклинов у беременных, кормящих грудью (тетрациклин проникает в грудное молоко) и детей до 8 лет не рекомендуется.
Подводя итоги вышеизложенному, хочется еще раз подчеркнуть, что любое лекарство (а значит, и антибиотики) - это обоюдоострое оружие, что, кстати, было подмечено и отражено в древнерусском определении, где слово "зелье" употреблялось в двойном значении - и как лечебное, и как ядовитое средство. Поэтому, начиная фармакотерапию, нельзя в дальнейшем оставлять больного один на один с лекарством, говоря ему (как это еще нередко бывает в той же поликлинике) "попейте его (лекарство) с недельку-другую и потом приходите". Для некоторых больных это "потом" может и не наступить. Делая упор в своем врачебном сознании на терапевтический эффект, мы (может быть сами того не желая) умаляем значение другого важнейшего правила лечения - его безопасности. Такая потеря бдительности делает нас неготовыми к нужным действиям при возникновении неблагоприятных реакций, что может иногда привести к непоправимым последствиям.
Токсический эффект следует относить к нарушению цикла мочевины во время раннего развития гипераммониемии.
Один из симптомов: прежде чем наступит глубокая кома, часто развиваются судороги, особенно в раннем возрасте.
Однако при хорошем контроле метаболических нарушений симптоматические приступы появляются редко.
Следующими можно выделить нарушения обмена аминокислот при неизлечимой фенилкетонурии. Статистика говорит, что такие эпилептические приступы развиваются в диапазоне от 25% до 50% всех обследованных пациентов.
Хорошо изученный Синдром Веста с гипсаритмией и инфантильными судорогами является наиболее распространенным симптомом, который полностью излечивается при назначении симптоматической терапии.
Некоторые судороги могут сопровождаться так называемой болезнью «кленового сиропа» в неонатальном периоде; в этом случае на электроэнцефалограмме проявляется «гребнеподобный» ритм, похожий на ритм в центральных областях головного мозга.
При назначении адекватной диеты приступы прекращаются и эпилепсия не развивается. При некоторых нарушениях обмена аминокислот приступы могут быть одними из главных симптомов.
Существует вид токсических приступов, вследствие нарушения обмена органических кислот, где разнообразные органические ацидурии могут являться очагом приступа или приводить к эпизодам острой декомпенсации. Среди них наиболее существенными есть пропионовая ацидемия и метилмалоновая ацидемия.
 Во время корректного лечения приступы весьма редки и отражают персистирующее поражение головного мозга. При глутаровой ацидурии первого типа эпилептические приступы могут остро развиваться, и прекращаются после начала адекватной терапии.
Во время корректного лечения приступы весьма редки и отражают персистирующее поражение головного мозга. При глутаровой ацидурии первого типа эпилептические приступы могут остро развиваться, и прекращаются после начала адекватной терапии.
При дефиците 2-метил-3-гидроксибутират-СоА-дегидрогеназы, описанной как врожденное нарушение кислоты, отвечающей за брахиоцефальные ожирения и нарушение обмена изолейцина, выраженная эпилепсия проявляется часто.
Еще один вид эпилептических приступов, обусловленных токсическими эффектами вызван нарушением пиримидинового обмена и пуринового обмена. Такие приступы характерны при дефиците аденилсукцината, чьи «de novo» эффекты вызывают синтез пуринов.
Однако следует заметить, что эпилепсия весьма часто развивается в неонатальном периоде и на первом году жизни человека. У таких пациентов дополнительно обнаруживаются резко выраженные психомоторные нарушения и аутизм.
Диагностика производится с помощью модифицированного теста Браттона - Маршалла, который применяется для исследования мочи. Нужно констатировать, что нет результативного лечения данного заболевания, поэтому медицинский прогноз весьма неблагоприятный. Статистика показывает, что приступы развиваются у 50% из всех обследованных пациентов с дефицитом дигидропиримидин дегидрогеназы.
И заключительный вид эпилептических приступов, обусловленных токсическими эффектами, отмечен в медицинской практике, как некетотичекая гипергликемия.
 Это нарушение вызвано недостаточным расщеплением глицина и довольно рано проявляется, в неонатальном периоде, такими симптомами как, летаргия, гипотония, икота (прим. обнаруживается до рождения), а также офтальмоплегия.
Это нарушение вызвано недостаточным расщеплением глицина и довольно рано проявляется, в неонатальном периоде, такими симптомами как, летаргия, гипотония, икота (прим. обнаруживается до рождения), а также офтальмоплегия.
Следует отметить, что при усугублении комы начинают развиваться апноэ и частые фокальные миоклонические судорожные подергивания. На протяжении последующих нескольких месяцев (обычно это более трех) развивается тяжелая, трудно поддающаяся , которая в большинстве случаев проявляет себя парциальными моторными припадками или инфантильными спазмами.
В раннем возрасте электроэнцефалограмма показывает нормальную фоновую активность, но возникают участки эпилептических острых волн (так называемые вспышки угнетения), сменяющиеся высокоамплитудной медленной активностью с гипсаритмией в течение следующих трех месяцев.
Диагностика основывается на высокой концентрации глицина во всех жидкостях тела и ликворе (значение> 0,08). С помощью магнитно-резонансного томографа показывается нормальная картина или гипоплазия или агенезия.
Глицин является одним из крупнейших ингибиторов нейротрансмиттеров в спинном и головном мозге. Есть предположение, что избыток глицина перенасыщает коантагонист-связывающий участок NMDA-рецептора, способствуя избыточному возбуждению нейротрансмиссии и постсинаптической токсичности.
Изучаемый возбуждающий токсический эффект избыточно активного NMDA-рецептора есть очевидной причиной эпилепсии, а также частичной тетраплегии и задержки умственного развития. Это подтверждают терапевтические испытания NMDA-антагонистов с частичными проявлениями на электроэнцефалограмме. Такая тяжелая форма эпилепсии, как показывает практика, лечится общепринятыми противоэпилептическими средствами. 
Следует помнить, что в классификации эпилепсии также учитывается возрастной критерий. С помощью него выделяют типичную, рано начинающуюся, появляющуюся в первые дни жизни, и атипичную, поздно начинающуюся, проявляющуюся к 35-летнему возрасту.