Ogni cellula ciliata ha 50-70 piccole ciglia chiamate stereocilia e una grande ciglia chiamata kinocilium. Il chinociglio si trova sempre su un lato della cellula e le stereocilia si accorciano gradualmente verso l'altro lato della cellula. I più piccoli collegamenti filamentosi, quasi invisibili anche al microscopio elettronico, collegano la punta di ciascuno stereociglio con lo stereociglio adiacente, più lungo e, infine, con il chinociglio. A causa di questi collegamenti, quando lo stereociglio e il chinociglio deviano verso il chinociglio, i collegamenti filamentosi tirano le stereociglia una per una, tirandole verso l'esterno dal corpo cellulare.
Questo ne apre diverse centinaia canali pieni di liquido nella membrana cellula nervosa attorno alle basi delle stereociglia. Di conseguenza, un gran numero di ioni positivi possono passare attraverso la membrana, che fluiscono nella cellula dal fluido endolinfatico circostante, causando la depolarizzazione della membrana del recettore. Al contrario, la deflessione del fascio di stereociglio nella direzione opposta (lontano dal chinocilio) riduce la tensione degli accoppiatori; questo chiude i canali ionici, portando all'iperpolarizzazione del recettore.
A riposo, lungo il nervo fibre, provenienti dalle cellule ciliate, vengono costantemente effettuati impulsi con una frequenza di circa 100 impulsi/sec. Quando le stereociglia deviano verso il chinociglio, il flusso di impulsi aumenta fino a diverse centinaia al secondo; al contrario, la deflessione delle ciglia lontano dal chinocilio riduce il flusso degli impulsi, spesso spegnendolo completamente. Pertanto, quando l'orientamento della testa nello spazio cambia e il peso degli statoconi devia le ciglia, vengono inviati segnali appropriati al cervello per regolare l'equilibrio.
In ogni macula ciascuna delle cellule ciliateè orientato in una certa direzione, quindi alcune di queste cellule vengono stimolate quando la testa è inclinata in avanti, altre - quando la testa è inclinata all'indietro, altre ancora - quando la testa è inclinata di lato, ecc. Di conseguenza, per ogni orientamento della testa nel campo gravitazionale, appare un diverso “modello” di eccitazione nelle fibre nervose provenienti dalla macula. È questo "disegno" che informa il cervello sull'orientamento della testa nello spazio.
Canali semicircolari. I tre canali semicircolari in ciascun apparato vestibolare, noti come canali semicircolari anteriore, posteriore e laterale (orizzontale), sono ad angolo retto tra loro in modo da rappresentare tutti e tre i piani dello spazio. Quando la testa è inclinata in avanti di circa 30°, i canali semicircolari laterali si trovano approssimativamente orizzontali rispetto alla superficie terrestre, i canali anteriori su piani verticali che sporgono in avanti e di 45° verso l'esterno, mentre i canali posteriori si trovano su piani verticali che puntano indietro e in avanti. 45° fuori.
Ciascun canale semicircolare ha un prolungamento ad una delle sue estremità, che si chiama ampolla; sia i canali che l'ampolla sono pieni di un fluido chiamato endolinfa. La corrente di questo liquido attraverso uno dei canali e la sua ampolla eccita l'organo sensoriale dell'ampolla come segue. La figura mostra una piccola capesante presente in ciascuna ampolla, chiamata capesante ampollare. Dall'alto, questa capesante è ricoperta da una massa di tessuto gelatinoso sciolto chiamata cupola (cupola).
Quando testa umana inizia a girare in qualsiasi direzione, il fluido in uno o più canali semicircolari per inerzia rimane fermo, mentre i canali semicircolari stessi girano con la testa. In questo caso il liquido scorre dal condotto e attraverso l'ampolla, piegando la cupola in una direzione. La rotazione della testa nella direzione opposta fa inclinare la cupola verso l'altro lato.
dentro cupole sono immerse centinaia di ciglia di cellule ciliate situate sul pettine ampollare. Le chinocilia di tutte le cellule ciliate nella cupola sono orientate nella stessa direzione e la deviazione della cupola in questa direzione provoca la depolarizzazione delle cellule ciliate, mentre la sua deviazione nella direzione opposta iperpolarizza le cellule. Dalle cellule ciliate vengono inviati segnali appropriati lungo il nervo vestibolare, informando il sistema nervoso centrale dei cambiamenti nella rotazione della testa e della velocità di cambiamento in ciascuno dei tre piani dello spazio.
Ritorna al sommario della sezione ""
La lumaca, rappresentata schematicamente nella figura seguente, ha una lunghezza 35 mm nella maggior parte delle persone e fa due riccioli e mezzo. Nella scala centrale (scala cocleare) si trova l'organo Corti, l'organo principale della percezione del suono, responsabile della trasformazione delle vibrazioni della perilinfa in un segnale nervoso. L'organo del Corti lo è struttura complessa, che comprende le cellule ciliate esterne ed interne, nonché le cellule di supporto.
cellule ciliate interne formano sinapsi con le fibre afferenti del nervo uditivo e le cellule ciliate esterne - con l'efferente. L'organo del Corti è allungato e corre lungo tutto il canale della coclea. A causa delle peculiarità della composizione ionica, l'endolinfa è caricata positivamente rispetto alla perilinfa. Poiché la composizione elettrolitica è diversa anche nello spazio tra le cellule ciliate interne ed esterne (il tunnel del Corti), in esso si crea un altro spazio funzionale.
Sulle cime cellule ciliate interne ed esterne si trovano le stereocilia, che si elevano al di sopra della membrana tegumentaria. Le oscillazioni della membrana principale provocano lo spostamento delle stereociglia, prima in una direzione e poi nell'altra, a seguito del quale cambia la frequenza di generazione degli impulsi da parte delle cellule ciliate.
sensibile informazioni dalle cellule ciliate poi segue in direzione mediale, lungo la placca a spirale ossea fino al centro nervoso della coclea, l'albero cocleare dell'orecchio medio. I neuroni afferenti sensoriali primari del nervo uditivo sono rappresentati da cellule gangliari spirali di tipo 1 e 2.
Funzione dell'organo del Corti può essere disturbato sotto l'influenza di molti processi patologici. Esiste tutta la linea Malformazioni e disfunzioni congenite dell'organo del Corti. La figura seguente mostra varianti di deformità congenite della capsula auricolare, che si combinano con la disgenesia del labirinto membranoso e la compromissione della funzione dell'organo del Corti. La maggior parte di queste malformazioni possono essere visualizzate sulla tomografia computerizzata in sezioni sottili.
Tuttavia, nella maggior parte dei casi perdita dell'udito congenita la tomografia delle ossa temporali non rivela alcun disturbo, pertanto, negli ultimi anni, l'enfasi principale nella diagnosi è stata posta su test genetici. La principale classificazione della sordità congenita oggi è il sistema dfna/dfnb/dfnx e mito.
Una lumaca a forma di tubo espanso.Le vibrazioni della finestra ovale fanno vibrare la perilinfa del vestibolo della scala,
grazie al quale l'onda sonora viene trasmessa all'elicotrema e alla finestra rotonda.
Neuroepitelio del canale della coclea del labirinto orecchio interno ha un'organizzazione tonotopica,
grazie al quale le alte frequenze vengono percepite meglio dalla finestra ovale,
e le frequenze più basse sono nell'area dell'elicotrema.
 Lo spostamento della membrana basale del dotto cocleare dovuto alle fluttuazioni della perilinfa della scala timpanica ha carattere tonotopico.
Lo spostamento della membrana basale del dotto cocleare dovuto alle fluttuazioni della perilinfa della scala timpanica ha carattere tonotopico. Come risultato delle oscillazioni della membrana basale, cambia la frequenza di trasmissione degli impulsi nervosi da parte delle cellule ciliate dell'organo del Corti.
I segnali afferenti vengono trasmessi lungo le fibre nervose delle cellule gangliari spirali.
In questo sistema dfn denota ereditaria non sindromica; A - con tipo di eredità autosomica dominante, B - con tipo di eredità autosomica recessiva, tipo di eredità X-X-linked, tipo di eredità mito-mitocondriale. La forma più comune di ipoacusia neurosensoriale non sindromica è una violazione della struttura dei geni connessina che codificano per la sintesi delle proteine coinvolte nella formazione delle giunzioni comunicanti. È stato dimostrato che la loro presenza è necessaria per mantenere l'equilibrio sodio-potassio e il normale funzionamento delle cellule neuroepiteliali.
Oltre a questo c'è numerose forme di ipoacusia neurosensoriale legati ad altri sindromi congenite e malattie. Ad esempio, un acquedotto allargato del vestibolo e un sacco endolinfatico allargato possono essere associati alla sindrome di Pendred (gozzo nodulare, ipotiroidismo, ipoacusia neurosensoriale congenita bilaterale). Molte sindromi craniofacciali congenite sono facili da diagnosticare immediatamente dopo la nascita di un bambino: sindrome di Apert (acrocefalosindattilia), sindrome di Crouzon (craniosinostosi, orecchie a impianto basso, ipoplasia mandibola, spesso associata a coartazione dell'aorta e dotto aperto), Wardenburg (pigmentazione anomala dell'iride, capelli bianchi sulla testa o su tutto il corpo, ipertelorismo).
Tutti i bambini con ipoacusia neurosensoriale congenitaè necessario indagare sulla funzione della tiroide e dei reni e anche escludere la sindrome di Usher ( degenerazione pigmentaria retina), per il quale il paziente deve essere accompagnato da un oculista per l'esame della retina ed, eventualmente, un elettroretinogramma. Da escludere la sindrome cardiouditiva, in cui la mutazione dei geni responsabili della sintesi canali del sodio, provoca perdita dell'udito neurosensoriale e prolungamento dell'intervallo QT, viene eseguito un elettrocardiogramma. Non è ancora chiaro esattamente come tali malformazioni congenite e difetti genetici compromettano la funzione delle cellule ciliate a livello cellulare. Al momento il recupero a livello cellulare è impossibile.
Più spesso diagnosi i neonati vengono collocati dopo che non hanno superato lo screening uditivo iniziale. Nei bambini più grandi, puoi aspettare fino a 12 mesi. Se a questo punto il bambino non dice “mamma” o “papà”, la mancanza di diagnosi e prognosi comincia a pesare pesantemente sui genitori. La funzione uditiva può essere schermata mediante emissione otoacustica, che valuta la funzione cocleare, o potenziali evocati uditivi dal tronco encefalico, che consentono la valutazione sia delle funzioni periferiche che di quelle sistema centrale percezione uditiva.
Da questi potenziali sono precoci, dovrebbero verificarsi entro pochi millisecondi dalla presentazione dello stimolo. Nella maggior parte dei casi, il bambino viene quindi inviato per una valutazione da un audiologo, che dovrebbe includere la raccolta dei dati gestazionali e storia famigliare, esami, studi audiometrici adeguati all'età, metodi di ricerca genetica, radiologica e di laboratorio. È importante non prendere decisioni sulla diagnosi o sul trattamento subito al primo appuntamento. Anche se si sospettano forme gravi di perdita dell'udito, può essere molto difficile per i genitori accettare il fatto che ciò possa accadere ai loro figli.
In modo da genitori consapevole del problema, si può provare a prescrivere un apparecchio acustico per un breve periodo, e poi ripetere gli studi audiometrici. Il medico deve essere empatico e, nel consigliare un intervento importante (come un impianto cocleare), assicurarsi che tutte le indagini siano eseguite in modo impeccabile.
A perdita uditiva acquisita in età adulta si verifica abbastanza spesso. La forma più comune di perdita dell'udito è la presbiacusia, caratterizzata da una graduale diminuzione della percezione delle alte frequenze con l'invecchiamento del corpo (curva discendente nell'audiogramma). Meccanismi di sviluppo e metodi di prevenzione dato stato sconosciuto. È noto da tempo che la causa della perdita dell'udito neurosensoriale può essere l'esposizione a suoni forti o l'uso di farmaci ototossici.
 La lumaca fa 2,5 giri consecutivi, ogni successivo è inferiore al precedente.
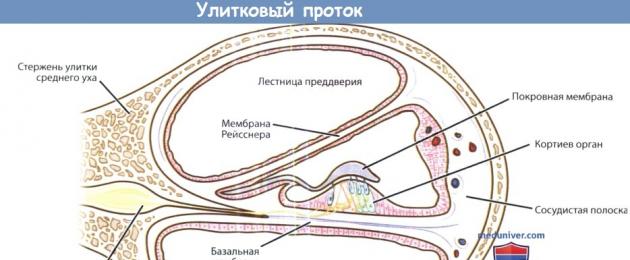
La lumaca fa 2,5 giri consecutivi, ogni successivo è inferiore al precedente. La figura mostra il dotto cocleare (canale cocleare del labirinto dell'orecchio interno) con l'organo del Corti, la scala vestibolo,
scala timpanica, placca spirale ossea, striscia vascolare, modiolo con cellule gangliari spirali, nervo uditivo.
 Organo di Corti.
Organo di Corti. Sono mostrate le cellule ciliate esterne ed interne, il tunnel del Corti e le cellule di supporto.
Le vibrazioni delle stereocilia delle cellule ciliate determinano la velocità di generazione degli impulsi nervosi.
A otosclerosi la perdita dell'udito è trasmissiva o mista. Con la perdita dell'udito autoimmune, o una malattia autoimmune dell'orecchio interno, si verifica una perdita dell'udito irreversibile, e non gradualmente, ma a "salti" successivi. Molto spesso la malattia è bilaterale, ma in alcuni casi l'udito può prima diminuire in un orecchio e poi, di solito dopo 6-12 mesi, nell'altro. Le caratteristiche temporali della perdita dell’udito sono fondamentali per fare una diagnosi. Come con qualsiasi malattia reumatologica, viene dimostrato che il paziente esegue una serie di ricerca di laboratorio che consentono di confermare o smentire la diagnosi di una malattia autoimmune dell'orecchio interno.
Per capire vero motivo perdita dell'udito negli adulti è spesso impossibile. L'audiogramma mostra solo la natura della perdita dell'udito, ma non la sua causa. L'emissione otoacustica, che riflette la funzione delle cellule ciliate esterne, è solitamente assente. Alla TC delle ossa temporali, molto spesso non si riscontrano cambiamenti. Nella risonanza magnetica del cervello con contrasto, prima di tutto, si dovrebbe prestare attenzione allo stato del canale uditivo interno. Ma anche questo metodo lo studio spesso non rivela alcun cambiamento. Molto spesso, al paziente viene lasciata una diagnosi di perdita dell'udito neurosensoriale, la cui causa non è stata chiarita. I pazienti di solito provano sollievo se un esame approfondito può escludere una massa retrococleare come causa della perdita dell'udito.
Uno dei più difficili per forme di perdita dell'udito dei pazientiè "sordità improvvisa" o perdita uditiva neurosensoriale idiopatica acuta, in cui nell'arco di poche ore o minuti si verifica una brusca diminuzione dell'udito in un orecchio (perdita uditiva di 30 dB o più rispetto a un orecchio sano; a tre o più frequenze adiacenti per un periodo non superiore a tre giorni). La vera eziologia è sconosciuta. Si crede che processo patologico localizzato nella coclea. Poiché nessuno muore per questa condizione, l'esame istopatologico non è possibile.
Principale metodo di trattamentoè la nomina di corticosteroidi orali (i corticosteroidi possono anche essere iniettati nella cavità timpanica). Se è prescritta la terapia prime date e in dosaggi sufficientemente elevati c'è la possibilità di ripristinare l'udito. La prescrizione di farmaci antivirali non ha senso.
L'orecchio interno contiene l'apparato recettore di due analizzatori: vestibolare (vestibolo e canali semicircolari) e uditivo, che comprende la coclea con l'organo del Corti.
Viene chiamata la cavità ossea dell'orecchio interno, contenente un gran numero di camere e passaggi tra di loro labirinto . Si compone di due parti: labirinto osseo e labirinto membranoso. Labirinto osseo- si tratta di una serie di cavità situate nella parte densa dell'osso; in esso si distinguono tre componenti: canali semicircolari - una delle fonti di impulsi nervosi che riflettono la posizione del corpo nello spazio; vestibolo; e una lumaca: un organo.
labirinto membranoso racchiuso in un labirinto osseo. È riempito da un fluido, l'endolinfa, e circondato da un altro fluido, la perilinfa, che lo separa dal labirinto osseo. Il labirinto membranoso, come quello osseo, è costituito da tre parti principali. Il primo corrisponde in configurazione ai tre canali semicircolari. Il secondo divide il vestibolo osseo in due sezioni: l'utero e il sacco. La terza parte allungata forma la scala centrale (cocleare) (canale a spirale), ripetendo le curve della coclea.
Canali semicircolari. Ce ne sono solo sei, tre per ciascun orecchio. Hanno una forma arcuata e iniziano e finiscono nell'utero. I tre canali semicircolari di ciascun orecchio sono ad angolo retto tra loro, uno orizzontale e due verticali. Ogni canale ha un'estensione ad un'estremità: un'ampolla. Sei canali sono posizionati in modo tale che per ciascuno vi sia un canale opposto sullo stesso piano, ma nell'altro orecchio, ma le loro ampolle si trovano alle estremità reciprocamente opposte.
Chiocciola e organo di Corti. Il nome della lumaca è determinato dalla sua forma a spirale contorta. Questo è un canale osseo che forma due giri e mezzo di una spirale ed è pieno di fluido. I riccioli circondano un'asta distesa orizzontalmente - un fuso, attorno al quale, come una vite, è attorcigliata una placca a spirale ossea, penetrata da tubuli sottili, dove passano le fibre della parte cocleare del nervo vestibolococleare - VIII coppie nervi cranici. All'interno, su una parete del canale a spirale, per tutta la sua lunghezza, è presente una sporgenza ossea. Due membrane piatte corrono da questa sporgenza alla parete opposta in modo che la coclea si divida per tutta la sua lunghezza in tre canali paralleli. I due esterni sono chiamati scala vestibuli e scala tympani; comunicano tra loro alla sommità della coclea. Centrale, cosiddetto. la spirale, il canale cocleare, termina alla cieca e il suo inizio comunica con il sacco. Il canale spirale è pieno di endolinfa, la scala vestibolare e la scala timpanica sono piene di perilinfa. La perilinfa ha alta concentrazione ioni sodio, mentre l'endolinfa ha un'alta concentrazione di ioni potassio. La funzione più importante dell'endolinfa, che è caricata positivamente rispetto alla perilinfa, è la creazione di un potenziale elettrico sulla membrana che le separa, che fornisce energia per l'amplificazione dei segnali sonori in arrivo.
La scala del vestibolo inizia in una cavità sferica - il vestibolo, che si trova alla base della coclea. Un'estremità della scala attraverso la finestra ovale (finestra del vestibolo) entra in contatto con la parete interna della cavità piena d'aria dell'orecchio medio. La scala timpanica comunica con l'orecchio medio attraverso una finestra rotonda (finestra della coclea). Liquido
non può passare attraverso queste finestre, poiché la finestra ovale è chiusa dalla base della staffa, e quella rotonda da una sottile membrana che la separa dall'orecchio medio. Il canale spirale della coclea è separato dalla scala timpanica dal cosiddetto. la membrana principale (basilare), che ricorda uno strumento a corde in miniatura. Contiene un numero di fibre parallele varie lunghezze e spessori tesi attraverso il canale a spirale, le fibre alla base del canale a spirale essendo corte e sottili. Si allungano e si ingrossano gradualmente verso l'estremità della coclea, come le corde di un'arpa. La membrana è ricoperta da file di cellule pelose sensibili che compongono il cosiddetto. l'organo del Corti, che svolge una funzione altamente specializzata, converte le vibrazioni della membrana principale in impulsi nervosi. Le cellule ciliate sono collegate alle terminazioni delle fibre nervose che, uscendo dall'organo del Corti, formano il nervo uditivo (ramo cocleare del nervo vestibolococleare).
labirinto o dotto cocleare membranoso ha l'aspetto di una protuberanza vestibolare cieca situata nella coclea ossea e che termina ciecamente al suo apice. È pieno di endolinfa ed è una sacca di tessuto connettivo lunga circa 35 mm. Il condotto cocleare divide il canale a spirale dell'osso in tre parti, occupandone il centro: la scala media (scala media), o condotto cocleare o canale cocleare. La parte superiore è la scala vestibolare (scala vestibuli), o la scala vestibolare, la parte inferiore è la scala timpanica o timpanica (scala tympani). Contengono perilinfa. Nella zona della cupola della coclea entrambe le scale comunicano tra loro attraverso l'apertura della coclea (elicotrema). La scala timpanica si estende fino alla base della coclea, dove termina con la finestra rotonda della coclea chiusa dalla membrana timpanica secondaria. La scala vestibolare comunica con lo spazio perilinfatico del vestibolo. Va notato che la composizione della perilinfa ricorda il plasma sanguigno e il liquido cerebrospinale; contiene sodio. L'endolinfa differisce dalla perilinfa per una concentrazione più elevata (100 volte) di ioni potassio e una concentrazione inferiore (10 volte) di ioni sodio; a modo mio Composizione chimica assomiglia al fluido intracellulare. In relazione alla perilinfa è caricata positivamente.
Il condotto cocleare ha una sezione trasversale triangolare. La parete vestibolare superiore del condotto cocleare, rivolta verso la scala del vestibolo, è formata da una sottile membrana vestibolare (Reissner) (membrana vestibularis), che è ricoperta dall'interno da un epitelio squamoso monostrato, e dall'esterno - dall'endotelio. Tra di loro c'è un tessuto connettivo fibrillare sottile. La parete esterna si fonde con il periostio della parete esterna della coclea ossea ed è rappresentata da un legamento a spirale, presente in tutte le spire della coclea. Sul legamento è presente una striscia vascolare (stria vascolare), ricca di capillari e ricoperta di cellule cubiche che producono endolinfa. Inferiore - parete timpanica, di fronte alla scala a tamburo, è la più complessa. È rappresentato da una membrana basilare, o lamina (lamina basilaris), sulla quale è situata una spirale, o organo di Corti, che emette suoni. La placca basilare densa ed elastica, o membrana principale, è attaccata alla placca ossea spirale ad un'estremità e al legamento spirale all'estremità opposta. La membrana è formata da fibre di collagene radiali sottili e leggermente allungate (circa 24mila), la cui lunghezza aumenta dalla base della coclea alla sua sommità - vicino alla finestra ovale, la larghezza della membrana basilare è di 0,04 mm, quindi verso l'alto della coclea, espandendosi gradualmente, raggiunge l'estremità 0,5 mm (cioè la membrana basilare si espande dove la coclea si restringe). Le fibre sono costituite da sottili fibrille che si anastomizzano tra loro. La debole tensione delle fibre della membrana basilare crea le condizioni per i loro movimenti oscillatori.
L'organo dell'udito vero e proprio, l'organo del Corti, si trova nella coclea. L'organo del Corti è la parte recettoresituato all'interno del labirinto membranoso. Nel processo di evoluzione, nasce sulla base delle strutture degli organi laterali. Percepisce le vibrazioni delle fibre situate nel canale dell'orecchio interno e le trasmette alla corteccia uditiva, dove si formano i segnali sonori. Nell'organo di Corti inizia la formazione primaria dell'analisi dei segnali sonori.
Posizione. L'organo del Corti si trova in un canale osseo avvolto a spirale dell'orecchio interno - il condotto cocleare, pieno di endolinfa e perilinfa. La parete superiore del passaggio è adiacente al cosiddetto. scala del vestibolo ed è chiamata membrana Reisner; il muro inferiore confinante con il cosiddetto. scala timpanica, formata dalla membrana principale, attaccata alla placca ossea spirale. L'organo del Corti è rappresentato da cellule di sostegno, o di sostegno, e da cellule recettrici, o fonorecettori. Esistono due tipi di cellule di supporto e due tipi di cellule recettrici: esterne e interne.
Gabbie di supporto esterne si trovano più lontano dal bordo della placca ossea a spirale, e interno- più vicino a lui. Entrambi i tipi di cellule di supporto convergono ad angolo acuto l'uno rispetto all'altro e formano un canale triangolare - un tunnel interno (Corti) pieno di endolinfa, che corre a spirale lungo l'intero organo del Corti. Il tunnel contiene fibre nervose non mielinizzate provenienti dai neuroni del ganglio spirale.
Fonorecettori giacciono su cellule di supporto. Sono sensori secondari (meccanocettori), che trasformano le vibrazioni meccaniche in potenziali elettrici. I fonorecettori (in base al loro rapporto con il tunnel di Corti) si dividono in interni (a forma di fiasco) ed esterni (cilindrici), separati tra loro dagli archi di Corti. Le cellule ciliate interne sono disposte in una fila; il loro numero totale lungo l'intera lunghezza canale membranoso raggiunge 3500. Le cellule ciliate esterne sono disposte su 3-4 file; il loro numero totale raggiunge 12.000-20.000. Ciascuna cellula ciliata ha una forma allungata; uno dei suoi poli è vicino alla membrana principale, il secondo è nella cavità del canale membranoso della coclea. Alla fine di questo polo ci sono i peli, o stereociglia (fino a 100 per cellula). I peli delle cellule recettrici vengono lavati dall'endolinfa e entrano in contatto con la membrana tegumentaria o tettoria (membrana tectoria), che si trova sopra le cellule ciliate lungo l'intero corso del canale membranoso. Questa membrana ha una consistenza gelatinosa, un bordo della quale è attaccato all'osso piastra a spirale, e l'altro termina liberamente nella cavità del condotto cocleare un po' più lontano delle cellule recettrici esterne.
Tutti i fonorecettori, indipendentemente dalla posizione, sono collegati sinapticamente a 32.000 dendriti di cellule sensoriali bipolari situate nel nervo spirale della coclea. Queste sono le prime vie uditive, che formano la parte cocleare (cocleare) dell'VIII paio di nervi cranici; trasmettono segnali ai nuclei cocleari. In questo caso, i segnali provenienti da ciascuna cellula ciliata interna vengono trasmessi alle cellule bipolari simultaneamente attraverso diverse fibre (probabilmente ciò aumenta l'affidabilità della trasmissione delle informazioni), mentre i segnali provenienti da diverse cellule ciliate esterne convergono su una fibra. Pertanto, circa il 95% delle fibre del nervo uditivo trasporta informazioni dalle cellule ciliate interne (sebbene il loro numero non superi 3500) e il 5% delle fibre trasmette informazioni dalle cellule ciliate esterne, il cui numero raggiunge 12.000- 20.000. Questi dati sottolineano l'enorme significato fisiologico delle cellule ciliate interne nella ricezione dei suoni.
alle cellule ciliate sono adatte anche le fibre efferenti: assoni dei neuroni dell'oliva superiore. Le fibre che arrivano alle cellule ciliate interne non finiscono su queste cellule stesse, ma sulle fibre afferenti. Si presume che abbiano un effetto inibitorio sulla trasmissione del segnale uditivo, contribuendo ad aumentare la risoluzione della frequenza. Le fibre che arrivano alle cellule ciliate esterne le influenzano direttamente e, modificandone la lunghezza, ne modificano la fonosensibilità. Pertanto, con l'aiuto delle fibre efferenti olivo-cocleari (fibre del fascio di Rasmussen), i centri acustici superiori regolano la sensibilità dei fonorecettori e il flusso degli impulsi afferenti da essi ai centri cerebrali.
Presa vibrazioni sonore nella lumaca . La percezione del suono viene effettuata con la partecipazione dei fonorecettori. Sotto l'influenza di un'onda sonora, portano alla generazione di un potenziale recettore, che provoca l'eccitazione dei dendriti del ganglio spirale bipolare. Ma come vengono codificate la frequenza e la forza del suono? Questa è una delle domande più difficili nella fisiologia dell'analizzatore uditivo.
L'idea moderna di codificare la frequenza e la forza del suono è la seguente. Onda sonora, agendo sul sistema degli ossicini uditivi dell'orecchio medio, fa oscillare la membrana della finestra ovale del vestibolo, la quale, piegandosi, provoca movimenti ondulatori della perilinfa dei canali superiore ed inferiore, che sfumano gradualmente verso l'alto la coclea. Poiché tutti i liquidi sono incomprimibili, queste oscillazioni sarebbero impossibili se non fosse per la membrana della finestra rotonda, che sporge quando la base della staffa viene premuta contro la finestra ovale e riprende la posizione originaria quando la pressione cessa. Le oscillazioni della perilinfa vengono trasmesse alla membrana vestibolare, così come alla cavità del canale medio, mettendo in movimento l'endolinfa e la membrana basilare (la membrana vestibolare è molto sottile, quindi il fluido nei canali superiore e medio fluttua come se entrambi i canali sono uno). Quando l'orecchio è esposto a suoni a bassa frequenza (fino a 1000 Hz), la membrana basilare si sposta per tutta la sua lunghezza dalla base alla sommità della coclea. Con l'aumento della frequenza del segnale sonoro, la colonna liquida oscillante accorciata lungo la lunghezza si avvicina alla finestra ovale, alla sezione più rigida ed elastica della membrana basilare. Deformandosi, la membrana basilare sposta i peli delle cellule ciliate rispetto alla membrana tettoria. Come risultato di questo spostamento si verifica una scarica elettrica delle cellule ciliate. Esiste una correlazione diretta tra l'ampiezza dello spostamento della membrana principale e il numero di neuroni della corteccia uditiva coinvolti nel processo di eccitazione.
|
Il meccanismo di conduzione delle vibrazioni sonore nella coclea Le onde sonore vengono captate dal padiglione auricolare e inviate attraverso il canale uditivo al timpano. fluttuazioni timpano, attraverso il sistema degli ossicini uditivi, vengono trasmessi attraverso la staffa alla membrana della finestra ovale, e attraverso di essa vengono trasmessi al fluido linfatico. Le vibrazioni del fluido rispondono (risuonano), a seconda della frequenza delle vibrazioni, solo alcune fibre della membrana principale. Le cellule ciliate dell'organo del Corti vengono eccitate toccandole con le fibre della membrana principale e nervo uditivo vengono trasmessi in impulsi, dove viene creata la sensazione finale del suono. |
SOSTANZA: il gruppo di invenzioni si riferisce alla medicina e può essere utilizzato in otorinolaringoiatria per il trattamento della perdita dell'udito neurosensoriale (perdita dell'udito e sordità) varie fasi. A tal fine, sono state proposte opzioni di trattamento che includono un componente che attiva la via di segnalazione delle cellule Sonic hedgehog. La vitronectina viene utilizzata come tale componente nella prima versione dell'agente. Inoltre, contiene inoltre almeno un agente antitumorale. Nella seconda variante dell'agente come tale componente viene utilizzata una miscela di vitronectina e almeno un glucocorticoide. A differenza del primo agente, contiene inoltre almeno una sostanza scelta dal gruppo: vinpocetina, pentossifillina e piracetam. EFFETTO: garantire la rigenerazione delle cellule ciliate danneggiate dell'orecchio interno, compresa la loro proliferazione, senza il rischio di cancro nel corpo, in particolare il retinoblastoma, nonché ampliare i metodi di utilizzo dell'agente per il trattamento della perdita dell'udito neurosensoriale. 2 n. e 5 z.p. f-ly, 6 ill., 2 pr.
SOSTANZA: il gruppo di invenzioni riguarda la biochimica, ovvero il campo del controllo dell'espressione genica, e può essere utilizzato in otorinolaringoiatria come preparati per il trattamento dell'ipoacusia neurosensoriale (sordità e ipoacusia di vari stadi).
Per il trattamento della perdita dell'udito neurosensoriale è noto l'uso dei complessi neurotropici milgamma e milgamma compositum, contenenti una combinazione di vitamine neurotropiche B1, B6 e B12 ad azione sinergica (" Farmacoterapia efficace. Pneumologia e otorinolaringoiatria”, 2011, n. 4, pp. 2-6).
Il miglioramento dell'udito durante il trattamento con questi farmaci è spiegato dalla stimolazione del meccanismo naturale di ripristino dei tessuti nervosi, in particolare del ganglio spirale, tuttavia questi farmaci non forniscono il ripristino delle cellule ciliate della coclea.
È noto l'uso di un fattore neurotrofico della linea cellulare gliale (GDNF) come parte di una composizione farmaceutica per la prevenzione di malattie dell'orecchio interno e/o il trattamento delle cellule ciliate e delle cellule gangliari spirali. Questo prodotto proteico GDNF può essere somministrato all'orecchio interno attraverso un intervento chirurgico o attraverso un impianto cocleare. Inoltre, questo prodotto può essere anche gocce per le orecchie, olio per frizioni o farmaci per via orale, come compresse o sospensioni (IL 121790 A, A61K 38/18, 14/08/2002).
L'essenza dell'invenzione descritta sta nel fatto che le cellule ciliate dell'orecchio interno e i neuroni uditivi in presenza di GDNF sono in grado di resistere agli effetti di sostanze ototossiche come il cisplatino e la neomicina, ma non è noto se il ripristino e la proliferazione di In sua presenza sono possibili anche cellule ciliate danneggiate. Inoltre, gli esperimenti descritti nel brevetto sono stati condotti direttamente con le cellule estratte da animali da esperimento uccisi, e quindi non esiste alcuna prova materiale che questo farmaco sotto forma di medicinale per uso interno o esterno possa essere efficace.
Un metodo noto per il trattamento della perdita dell'udito neurosensoriale con glucocorticosteroidi sullo sfondo di terapia vascolare, in cui, in caso di improvvisa insorgenza di disturbi neurosensoriali, i glucocorticosteroidi, come il prednisolone, vengono prescritti in un ciclo abbreviato per 6-8 giorni, iniziando con una dose di carico con diminuzione graduale (RU 2188642 C1, A61K 31/ 573 del 10.09.2002).
Il regime di trattamento descritto può essere considerato una terapia patogenetica che ha un forte effetto antinfiammatorio, mentre non è in grado né di eliminare le cause della malattia né di ripristinare le cellule ciliate danneggiate. Un leggero effetto di ripristino effettivo delle cellule ciliate, e non di rimozione del sintomo di perdita dell'udito, può essere osservato solo con l'intervento chirurgico e l'introduzione di glucocorticosteroidi direttamente nell'orecchio interno o almeno nell'orecchio medio.
È noto l'uso di vinpocetina (Cavinton), pentossifillina, cerebrolisina, piracetam (nootropil) trattamento complesso perdita dell'udito neurosensoriale (http://otolaryngologist.ru/530, 29/05/2014).
Tuttavia, l’effetto positivo del trattamento con questi farmaci è quello di migliorare l’afflusso di sangue all’orecchio interno, eliminando solo i sintomi della malattia.
È noto un metodo per generare cellule ciliate differenziate dell'orecchio interno, che include l'inattivazione o una diminuzione dell'espressione del gene Rb sufficiente per la crescita di queste cellule. A questo scopo è stato proposto di utilizzare molecole che legano l'Rb come oligonucleotidi antisenso, miRNA RNAi (virus a RNA a doppio filamento), anticorpi intracellulari, adenovirus E1A o antigene T SV40. Inoltre, a questo scopo, è stato proposto di utilizzare attivatori delle chinasi ciclina-dipendenti che fosforilano la proteina pRb o inibitori degli inibitori delle chinasi ciclina-dipendenti, ad esempio l'istone acetiltransferasi (HAT). La molecola di miRNA può essere basata su uno stampo plasmidico (US 2006024278 A1, A61K 48/00, 02.02.2006).
Questo metodo prevede l'inattivazione diretta della proteina del retinoblastoma utilizzando composti difficili da raggiungere. Alcuni di loro possono causare danni irreparabili al corpo. Ad esempio, è noto che la proteina E1A dell'adenovirus stimola l'apoptosi. Insieme all’inattivazione della proteina del retinoblastoma che previene il cancro, esiste una forte possibilità che l’apoptosi accelerata in queste condizioni possa portare a rapida crescita tumore maligno della retina - retinoblastoma, e in misura tale da assumerne uno qualsiasi farmaci antitumorali potrebbe essere inutile. L'uso dell'istone acetiltransferasi (HAT), coinvolto nell'attivazione della trascrizione del DNA, può portare alla sovraespressione di alcuni geni.
L'analogo più vicino è un agente per il trattamento della perdita dell'udito neurosensoriale, che è una proteina Shh mescolata con un inibitore della Shh-ciclopamina. Questo agente è stato utilizzato nel metodo di inattivazione Rb1 descritto in /Na Lu, Yan Chen "Sonic hedgehog inizia la rigenerazione delle cellule ciliate cocleari attraverso la downregulation della proteina del retinoblastoma", Comunicazioni di ricerca biochimica e biofisica, volume 430, numero 2, 11 gennaio 2013: colonna 1 , paragrafo 3 alla pagina 701/, introducendolo nella colonia di cellule ciliate. L'esperimento prevedeva le seguenti fasi. Innanzitutto, sotto anestesia, il neuroepitelio della coclea dei ratti è stato aperto il 2o giorno postnatale, la striscia vascolare, il neuroepitelio e parte della fibra nervosa sono stati trasferiti in un piatto con un mezzo nutritivo e è stata aggiunta neomicina per 24 ore per uccidere le cellule ciliate. Quindi, nei successivi 5 giorni, sono state aggiunte alternativamente una sostanza che attiva la via di segnalazione delle cellule di Sonic hedgehog: la proteina Shh (5 nmol, produttore "R&D Systems") e la ciclopamina (2,5 μmol, produttore "Sigma-Aldrich"). Per determinare il grado di proliferazione, al terreno è stata aggiunta bromodeossiuridina (BrdU) fino a una concentrazione finale di 10 µg/mL. L’esperienza lo ha dimostrato Da questa parte stimola la proliferazione delle cellule ciliate.
Secondo l'esperienza si può presumere che il trattamento con proteina Shh (5 nmol, R&D Systems) e ciclopamina (2,5 µmol, Sigma-Aldrich) sia possibile solo con un metodo operativo, poiché l'effetto di questo farmaco sulle cellule ciliate, per esempio, se assunto per via orale. Inoltre l'inattivazione di Rb1 nel prototipo viene effettuata aggiungendo la proteina Shh della R&D Systems, di difficile reperibilità. L'uso della ciclopamina può portare a gravi violazioni. Questa connessione si interrompe sviluppo embrionale feto e porta alla ciclopia. Inoltre, può inibire la crescita sia del carcinoma basocellulare nella pelle che del midolloblastoma nel cervello. L'attuale mancanza di capacità di eliminare queste carenze non consente l'uso dello strumento prototipo per il trattamento della perdita dell'udito neurosensoriale.
Pertanto, dopo aver analizzato la tecnica precedente, possiamo concludere che, nonostante l'importanza del problema della perdita dell'udito neurosensoriale associata al danno o alla morte delle cellule ciliate, attualmente non esiste un rimedio efficace per il trattamento di questa malattia.
Il compito del gruppo di invenzioni proposto è quello di sviluppare agenti per il trattamento della perdita dell'udito neurosensoriale che non contengano un composto ciclopaminico pericoloso per la salute e costituiti da componenti più accessibili rispetto a quelli inclusi negli agenti che inattivano direttamente Rb (non attraverso l'attivazione di la via di segnalazione delle cellule Sonic Hedgehog).
Il risultato tecnico del gruppo di invenzioni proposto è garantire la rigenerazione delle cellule ciliate danneggiate dell'orecchio interno, compresa la loro proliferazione, senza il rischio di cancro nel corpo, in particolare retinoblastoma, nonché l'ampliamento dei metodi per l'utilizzo delle cellule ciliate agente per il trattamento della perdita dell'udito neurosensoriale.
Per ottenere un risultato tecnico, viene proposto un agente per il trattamento della perdita dell'udito neurosensoriale, comprendente una sostanza che attiva la via di segnalazione delle cellule di Sonic hedgehog, mentre contiene inoltre almeno un agente antitumorale, e la sostanza che attiva la segnalazione delle cellule di Sonic hedgehog la via è la vitronectina.
L'agente di cui sopra può contenere inoltre almeno una sostanza scelta dal gruppo: vinpocetina, pentossifillina e piracetam.
Per ottenere un risultato tecnico, viene anche proposto un rimedio per il trattamento della perdita dell'udito neurosensoriale, comprendente una sostanza che attiva la via di segnalazione delle cellule Sonic hedgehog, mentre contiene inoltre almeno un agente antitumorale, almeno una sostanza selezionata dal gruppo: vinpocetina, pentossifillina e piracetam e la sostanza che attiva la via di segnalazione delle cellule Sonic Hedgehog è una miscela di vitronectina e almeno un glucocorticoide.
Lo strumento di cui sopra può contenere inoltre acido palmitico.
Lo strumento di cui sopra può contenere inoltre laminina.
La maggior parte dei problemi uditivi derivano da danni alle strutture dell’orecchio interno. Pertanto, l'ipoacusia neurosensoriale occupa il 90% di tutti i casi di ipoacusia e sordità.
Tipici motivi sono: eccessiva esposizione al rumore, effetto tossico droghe, reazioni allergiche, il processo di invecchiamento naturale del corpo e lesioni alla testa. Il danno si verifica alle cellule ciliate sottili che svolgono la funzione di convertire l'energia meccanica in energia elettrica e di trasmettere segnali al nervo uditivo. Finora si credeva che nella maggior parte dei casi tali disturbi fossero irreversibili a causa della mancanza di funzione di riparazione delle cellule ciliate dei mammiferi e che l’unico modo per compensare la sordità neurosensoriale fosse l’uso di apparecchi acustici.
Il deficit uditivo neurosensoriale si verifica a causa della perdita di sensibilità dell'organo a spirale della coclea dell'orecchio interno o di disturbi nel funzionamento dei nervi uditivi. Tali disturbi possono portare alla perdita dell'udito di tutti i gradi, da lieve a grave e persino alla completa sordità.
Nella maggior parte dei casi, la perdita dell’udito neurosensoriale negli esseri umani è causata da anomalie delle cellule ciliate nell’organo cocleare del Corti. A volte si verifica una perdita dell'udito neurosensoriale causata da disturbi dell'VIII nervo cranico (vestibolococleare) o delle parti del cervello responsabili dell'udito. In estremamente casi rari Questo tipo di perdita dell'udito soffre solo centri uditivi cervello ( disturbo centrale udito), nel qual caso il paziente sente i suoni con un volume normale, ma la loro qualità è così scarsa che non è in grado di distinguere il parlato.
Le anomalie delle cellule ciliate possono essere congenite o acquisite durante la vita dall'individuo stesso. Questi possono variare da anomalie genetiche a lesioni dovute a rumore intenso e lesioni dovute a malattie infettive.
È noto che nei mammiferi la perdita dell'udito neurosensoriale è presente malattia incurabile, le cellule dell'orecchio interno di pesci, uccelli e rettili hanno la capacità di autoripararsi. Ciò ha suggerito la presenza nei mammiferi di un certo gene, che è un interruttore molecolare che blocca il ripristino di queste cellule e, per questo motivo, svolge contemporaneamente qualche altra funzione necessaria per il normale funzionamento del corpo.
Gli scienziati dell'Università del Massachusetts hanno scoperto un gene responsabile di questa funzione. Gli venne dato il nome Rbl (Charles Q. Choi "Hope for Fixing Gene Defects", SCIENTIFIC AMERICAN, Volume 293, Numero 6, Dicembre 2005, pagina 65). Il gene Rb1 esprime una proteina del retinoblastoma (pRb) che previene la crescita eccessiva delle cellule inibendo il ciclo cellulare finché le cellule non sono pronte a dividersi. Quando la cellula è pronta a dividersi, il pRb viene fosforilato, diventa inattivo e consente al ciclo cellulare di progredire.
Sulla base di quanto sopra, si può concludere che l'inattivazione tempestiva del gene Rb1 può garantire il ripristino delle cellule ciliate cocleari.
La proteina del retinoblastoma nel corpo viene fosforilata da alcune chinasi ciclina-dipendenti e quindi diventa inattiva. La soppressione di Rb è possibile grazie all'attivazione della via di segnalazione Sonic hedgehog (Shh), durante la quale la proteina stessa del retinoblastoma viene fosforilata e la trascrizione del gene corrispondente viene ridotta (Na Lu, Yan Chen "Sonic hedgehog inizia cochlear hair cell rigenerazione attraverso la downregulation della proteina del retinoblastoma", Comunicazioni di ricerca biochimica e biofisica, volume 430, numero 2, 11 gennaio 2013: 6-7 righe dell'abstract a pagina 700; colonna 1, paragrafo 2 a pagina 701).
Nei mammiferi, il gene Shh è un membro del gruppo genetico del riccio (Hh): Sonic hedgehog (Shh), indian hedgehog (Ihh) e desert hedgehog (Dhh). Le glicoproteine secrete di Hedgehogs agiscono attraverso le proteine transmembrana Patched 1 (Ptc1) e Smoothened (Smo) per attivare la via di segnalazione intracellulare.
Ricercatori del centro di ricerca di neurobiologia in Spagna - Istituto di Neurobiologia. Santiago Ramon y Cajal (Institute de Neurobiologia Ramon y Cajal) è stato il primo a scoprire la relazione tra l'attività della via di segnalazione Shh e la vitronectina.
In /Martinez-Morales JR, Barbas JA, Marti E, Bovolenta P, Edgar D, Rodriguez-Tebar A. "La vitronectina è espressa nella regione ventrale del tubo neurale e promuove la differenziazione dei motoneuroni". Sviluppo. dicembre 1997; 124(24): le pagine 5139-5147/ descrivevano la capacità della vitronectina di stimolare la differenziazione dei motoneuroni in vitro e in vivo, si è concluso che la vitronectina può agire sia come effettore a valle nella cascata di segnalazione indotta da Shh, sia come effetto sinenergetico fattore che aumenta la differenziazione dei motoneuroni indotta da Shh.
In /Pons S, Marti E. "Sonic hedgehog sinergizza con la proteina della matrice extracellulare vitronectina per indurre la differenziazione dei motoneuroni spinali". Sviluppo. 2000 gennaio; 127(2): pagine 333-342/ è stato dimostrato che la differenziazione dei motoneuroni è potenziata dall'azione sinergica di N-Shh e vitronectina e che la vitronectina può essere necessaria per il rilascio del morfogeno N-Shh alle cellule bersaglio - differenziando neuroni motori.
In /Pons S, Trejo JL, Martinez-Morales JR, Marti E. "La vitronectina regola l'attività del riccio sonico durante lo sviluppo del cervelletto attraverso la fosforilazione del CREB". Sviluppo. maggio 2001; 128(9): pagine 1481-1492/ presentavano i risultati di uno studio sullo sviluppo del cervelletto attraverso la fosforilazione del fattore di trascrizione CREB. Allo stesso tempo, come negli studi sulla differenziazione dei motoneuroni, è stata rivelata un'interazione tra Shh e componenti della matrice extracellulare - le glicoproteine (principalmente vitronectina), che regolano le fasi successive nello sviluppo delle cellule granulari - piccoli neuroni presenti nello strato granulare del cervelletto. Pertanto, si è scoperto che la differenziazione delle cellule granulari è regolata dalla fosforilazione di CREB indotta dalla vitronectina, il cui evento critico termina con la proliferazione mediata da Shh di queste cellule e rende possibile l'implementazione di un programma di differenziazione cellulare in questo tipo.
Gli scienziati del Dipartimento di Biologia Cellulare della Vanderbilt University (USA) durante gli studi sull'induzione dei motoneuroni modificando l'attività della via di segnalazione Shh hanno anche rivelato un aumento dell'attività Shh sotto l'influenza della vitronectina, facilitando il trasporto di Shh alle cellule bersaglio (articolo Litingtung Y, Chiang C. “Controllo dell'attività Shh e segnalazione nel tubo neurale." Dinamiche dello sviluppo. 2000 ottobre; 219(2): pagine 143-154).
Per quanto riguarda il meccanismo di attivazione della via di segnalazione Shh, è noto che essa può essere innescata da un aumento della concentrazione nucleare di Gli (Gli2 e Gli3). Le glicoproteine Hh secrete (Shh, Ihh e Dhh) agiscono attraverso le proteine transmembrana Patched 1 (Ptc1) e Smoothened (Smo) per attivare un'intricata via di segnalazione intracellulare. Hh lega la proteina Ptcl con 12 domini transmembrana, che determina la repressione di base che Ptcl esercita sulla proteina Smo con 7 domini transmembrana, che è un omologo dei recettori accoppiati alla proteina G. All'interno della cellula, un complesso multimolecolare comprendente Costal2 (Cos2), Fused (Fu) e un soppressore di Fused (Su(Fu)), risponde all'attivazione di Smo in un modo che modifica l'attività delle proteine Gli (Stecca B, Ruiz i Altaba A. "Il potenziale terapeutico dei modulatori della via di segnalazione Hedgehog-Gli". J Biol. 2002 6 novembre; 1(2): pagine 9).
Pertanto, si può presumere che la vitronectina attivi la via di segnalazione Shh aumentando la quantità di fattori di trascrizione Gli in sua presenza.
Nel processo di fibronolisi, la vitronectina è in grado di regolare l'attivazione del plasminogeno. Ha due siti di legame per l'inibitore dell'attivatore del plasminogeno-1 (PAI-1). Il principale si trova all'estremità N, il dominio simile alla somatomedina B. Con esso, la vitronectina lega e stabilizza la molecola PAI-1 (Zhou A, Huntington JA, Pannu NS, Carrell RW, leggi RJ "How vitronectin binds PAI-1 to modulate fibrinolysis and cell migrazione". Nat Struct Biol. 2003 Jul; 10 (7): pagine 541-544).
È probabile che la vitronectina si leghi ad alcune omeoproteine che reprimono Gli in modo simile.
Sulla base degli studi noti sopra descritti riguardanti l'effetto della vitronectina sull'attivazione della via di segnalazione Shh nei motoneuroni e nelle cellule granulari, è stato suggerito che un effetto simile potrebbe verificarsi in relazione alle cellule ciliate.
È risaputo che, nonostante ogni cellula del corpo abbia lo stesso genoma, tutte sono cellule di tipo diverso e hanno caratteristiche individuali, in particolare, espresse dall'una o dall'altra reazione alle stesse condizioni e sostanze.
Per studiare la reazione delle cellule ciliate dell'orecchio interno alla vitronectina, per studiare i fattori che potrebbero causare il loro comportamento sotto l'influenza della vitronectina, piuttosto che il comportamento dei motoneuroni e delle cellule granulari, i cambiamenti morfologici in particolare le cellule ciliate sotto la sua influenza è stata studiata. Pertanto, la microscopia elettronica a scansione e confocale ha dimostrato il recupero, in particolare la proliferazione, di questo tipo cellule.
Si è tenuto analisi quantitativa espressione genica mediante sequenziamento parallelo di RNA ad alto rendimento (RNA-Seq) utilizzando il programma Scripture, che ha dimostrato che la vitronectina potenzia l'attività del gene Shh nella coltura di cellule ciliate della coclea del ratto grigio. La rapida inattivazione di Rb1 in questo caso è spiegata dalla proprietà della vitronectina di diffondere la proteina Shh e consegnarla alle cellule bersaglio, il che rappresenta un vantaggio significativo rispetto all'uso di una sostanza sotto forma di una miscela della proteina Shh e della proteina Shh. Ciclopamina inibitore di Shh (prototipo), in relazione al quale data proprietà Non è stato trovato.
Gli studi sopra descritti suggeriscono che l'attività del gene Shh aumenta in presenza di vitronectina non solo nei motoneuroni e nelle cellule granulari, ma anche nelle cellule ciliate della coclea.
Pertanto, tenendo conto delle pubblicazioni scientifiche precedentemente descritte del Massachusetts Institute of Technology e dello Shanghai Hearing Research Institute sulla possibilità di ripristinare le cellule ciliate cocleari attivando la via di segnalazione Sonic hedgehog (Shh), si può concludere che gli agenti proposti forniscono rigenerazione delle cellule ciliate dell'orecchio e della coclea attivando questa via di segnalazione.
Farmacologicamente dosi efficaci la vitronectina dipende dal grado di perdita dell'udito neurosensoriale, caratteristiche individuali paziente (tipologia, età, peso, ecc.), la forma di dosaggio del farmaco (gocce, crema, olio, balsamo, compresse, soluzione, sospensione, polvere) e il modo in cui viene utilizzato. Quindi, ad esempio, nel trattamento chirurgico di un piccolo animale dosi richieste possono essere inferiori a 0,001 g / ml di mezzo cellulare e, se assunti per via orale da una persona anziana, dovrebbero essere di diversi ordini di grandezza maggiori.
La vitronectina è una glicoproteina grandi quantità presente nel siero animale e nei coaguli di sangue. Fa anche parte della matrice extracellulare di molti tessuti.
La soluzione di vitronectina può essere isolata dal siero umano utilizzando anticorpi monoclonali.
Noto modo semplice per ottenere vitronectina dal plasma umano mediante cromatografia di affinità con eparina. Il siero si ottiene dal plasma aggiungendo calcio e poi centrifugando. L'eparina, che lega la vitronectina attiva, può essere attivata nel siero umano con l'urea. La vitronectina attivata si lega specificamente all'eparina-sefarosio nell'urea ed eluisce in una soluzione di NaCl da 0,5 mol/l contenente 8 mol/l di urea. Come risultato di questa procedura, è possibile ottenere 3-6 mg di vitronectina pura da 100 ml di plasma umano entro 2 giorni (Takemi Yatohgo, Masako Izumi at al. "Novel Purification of Vitronectin from Human Plasma by Heparin Affinity Chromatography" , Struttura e funzione cellulare , volume 13, pagine 281-292, 1988).
Allo stesso modo, è possibile ottenere la vitronectina dal siero bovino (I.G. Shvykova, T.A. Muranova "Proteolytic specificity of plasmin in relationship to adesivi proteine", Bioorganic Chemistry, volume 26, n. 5, pagina 353, colonna 1, paragrafo 3, 2000 ) .
Per potenziare l'attività della proteina Shh è necessario attivare il suo terminale N. Ciò può essere ottenuto con l'acido palmitico che, modificando l'N-terminale, potenzia la funzione della proteina Shh limitandone la diffusione.
Tuttavia, la limitazione della diffusione della proteina Shh da parte dell'acido palmitico è compensata dalla presenza di vitronectina, che, al contrario, può diffondere questa proteina.
Poiché l'acido palmitico può entrare nel corpo umano insieme ad alcuni prodotti alimentari (panna, panna acida, burro, formaggio, ecc.), La sua presenza nelle versioni dell'agente proposto destinate all'uso orale non è necessaria.
Allo stesso tempo, va notato che in assenza di vitronectina, l’acido palmitico non è in grado di agire sulle cellule ciliate dell’orecchio interno, poiché modificando l’N-terminale della proteina Shh, ne limita la diffusione, e quindi la proteina non raggiunge le cellule bersaglio (cellule ciliate). Inoltre, la presenza di vitronectina è obbligatoria, come accennato in precedenza, a causa della capacità di potenziare l'attività del gene Shh e provocare l'attivazione della via di segnalazione Shh.
Vale anche la pena notare che, insieme a ciò, la vitronectina presente nel sangue non è sufficiente per attivare la via di segnalazione Shh e, con ogni probabilità, in considerazione di ciò, le cellule ciliate non possono essere ripristinate solo sotto l'azione della vitronectina presente nel sangue. il sangue ed entrare nel corpo con il cibo acido palmitico.
Studi su topi carenti del recettore dell'ormone nucleare (VDR) della vitamina D3 e su espianti di pelle di topo hanno dimostrato che una debole espressione del gene VDR determina un aumento dell'espressione di diversi componenti della via Hh come Shh, Smo, Gli1, Gli2 e Ptch1.
Da /Immunologia medica, volume 16, n. 6, pagina 504, 1a colonna, 2o paragrafo, 2014/ è noto che il VDR associato sopprime la trascrizione del gene VDR mediante un meccanismo di feedback negativo.
L'espressione di VDR in tutti i tessuti può essere ridotta dai glucocorticoidi, i cui principali rappresentanti sono sostanze come fluticasone furoato, mometasone, mometasone furoato, metilprednisolone aceponato, triamcinolone, idrocortisone, betametasone, budesonide, alklometasone, beclometasone, desametasone, metilprednisolone, metilpredni solone aceponato, f lunisolide, clobetasolo, idrocortisone, cortisone, flumetasone, prednisolone, fluocinolone acetonide.
Pertanto, i glucocorticoidi miscelati con vitronectina possono formare una sostanza che attiva la via di segnalazione cellulare di Sonic hedgehog in misura maggiore rispetto alla sola vitronectina, aumentando l'efficacia dell'agente. Tuttavia, l'uso dei soli glucocorticoidi non fornisce un risultato terapeutico visibile in relazione alle cellule ciliate ed è piuttosto una terapia patogenetica con un forte effetto antinfiammatorio. Ciò potrebbe essere dovuto ad una conoscenza insufficiente delle condizioni per aumentare il grado di inattivazione di Rb1 da parte dei glucocorticoidi attraverso il meccanismo VDR, alla mancanza della loro diffusione nelle cellule ciliate danneggiate e ad una diffusione insufficiente della proteina Shh alle cellule bersaglio. Allo stesso tempo, un leggero effetto sull'effettivo ripristino delle cellule ciliate, e non solo sulla rimozione del sintomo della perdita dell'udito, si osserva solo con l'intervento chirurgico e l'introduzione di glucocorticoidi direttamente nell'orecchio interno o almeno nell'orecchio medio . Queste circostanze attualmente non consentono l’uso dei glucocorticoidi come trattamento efficace indipendente per la perdita dell’udito neurosensoriale.
L'efficacia dello strumento proposto aumenta anche la presenza di acido palmitico.
Per aumentare ulteriormente la sua efficacia stimolando l'attivazione della via di segnalazione Shh nelle cellule ciliate, è necessario migliorare la microcircolazione nella coclea, che può essere garantita dalla presenza nel farmaco di componenti disponibili ed efficaci come vinpocetina, pentossifillina, e piracetam.
Effettuata dallo strumento proposto attraverso l'attivazione della via di segnalazione Shh, l'inattivazione di Rb, che previene la comparsa del cancro, crea la probabilità di un tumore maligno, in particolare del retinoblastoma. Per evitare ciò, è necessario introdurre almeno un agente antitumorale (farmaci antineoplastici alchilanti, antimetaboliti, alcaloidi) nella composizione dell'agente. origine vegetale, antibiotici antitumorali, composti del platino - cisplatino, oxoplatino, carboplatino, oxaliplatino, cicloplatam, antitumorali preparati ormonali). È possibile inserire composti come melfalan, clorambucile, bendamustina, prospidina, spirobromina, mannomustina, prednimustina, estramustina, novembihin, pafencil, lofenal, ciclofosfamide, ifosfamide, mafosfamide, trofosfamide, azacitidina, capecitabina, carmofur, citarabina, decitabina, floxur idina, 5 -fluorouracile.
Va notato che l'inattivazione di Rb non porta al retinoblastoma in tutti i casi. Naturalmente, la maggior parte delle forme di dosaggio dei farmaci proposti, compresi tutti quelli destinati alla somministrazione orale, devono contenere un agente antitumorale che prevenga lo sviluppo del retinoblastoma, ma forme di dosaggio, ad esempio, per il trattamento chirurgico, quando non vi è alcun effetto dell'agente sulla retina dell'occhio, come agente antitumorale, possono contenere sostanze come alcaloidi (elipticina, vinblastina, vincristina) aventi origine naturale, o antibiotici antitumorali, e in concentrazioni molto più basse. Allo stesso tempo, è ancora preferibile la presenza di un agente antitumorale che prevenga lo sviluppo del retinoblastoma, poiché in ogni caso l'insorgenza di qualsiasi cancro all'attivazione della via di segnalazione Shh sarà associata all'inattivazione del gene Rb1. Tuttavia, a seconda del metodo di trattamento e delle caratteristiche individuali del paziente (predisposizione al cancro), come agente antitumorale possono essere utilizzate sostanze completamente diverse.
Con dosi moderate di vitronectina e brevi cicli di trattamento, come agenti antitumorali sono raccomandati alcaloidi vegetali innocui come l'ellipticina.
Al prodotto può essere aggiunta anche la laminina che favorisce la proliferazione cellulare.
Lo strumento proposto può essere introdotto nell'orecchio interno tramite intervento chirurgico o tramite un impianto cocleare. Può anche essere un collirio, una crema, un olio o un balsamo da sfregare o un medicinale orale (compresse, soluzione, sospensione, polvere).
Negli stadi gravi di ipoacusia neurosensoriale, indipendentemente dal tipo di applicazione (orale, esterna, chirurgica), il prodotto deve contenere una miscela di vitronectina e almeno un glucocorticoide, uno o più agenti antitumorali e almeno una sostanza scelta tra il gruppo: vinpocetina, pentossifillina e piracetam.
La necessità di aggiungere acido palmitico al prodotto dipende dalla dieta del paziente, poiché, da un lato, non è auspicabile consentire un eccesso di questo acido nell'organismo e, dall'altro, è auspicabile la sua presenza per l'attivazione del sistema immunitario. Via di segnalazione Shh.
Il raggiungimento del risultato desiderato con l'ausilio dei mezzi proposti è mostrato in Fig. 1-6.
Nella FIG. 1 mostra un confronto tra audiogrammi computerizzati eseguiti con un audiometro automatizzato AA-02, il sistema uditivo di un cane prima del ciclo di trattamento e 3 giorni dopo la fine del ciclo di trattamento.
La curva 1-AD è un audiogramma dell'orecchio destro di un cane con ipoacusia neurosensoriale prelevato prima del trattamento.
La curva 1-AS è un audiogramma dell'orecchio sinistro di un cane con ipoacusia neurosensoriale prelevato prima del trattamento.
La curva 2-AD è un audiogramma dell'orecchio destro di un cane ripreso dopo il trattamento dell'Esempio 1.
La curva 2-AS è un audiogramma dell'orecchio sinistro di un cane ripreso dopo il trattamento dell'Esempio 1.
Nella FIG. La Figura 2 confronta gli audiogrammi computerizzati rilevati con un audiometro automatizzato AA-02 del sistema uditivo umano prima del ciclo di trattamento e 3 giorni dopo la fine del ciclo di trattamento.
La curva 3-AD è un audiogramma dell'orecchio destro di una persona affetta da sordità neurosensoriale prelevato prima del trattamento.
La curva 3-AS è un audiogramma dell'orecchio sinistro di una persona affetta da sordità neurosensoriale prelevato prima del trattamento.
La curva 4-AD è un audiogramma dell'orecchio destro di una persona ripreso dopo il ciclo di trattamento secondo l'esempio 2.
La curva 4-AS è un audiogramma dell'orecchio sinistro di una persona ripreso dopo il ciclo di trattamento secondo l'esempio 2.
Nella FIG. La Figura 3 mostra una fotografia del neuroepitelio della coclea di un ratto grigio con perdita dell'udito neurosensoriale pronunciata, scattata utilizzando un microscopio elettronico a scansione.
Nella FIG. 4 mostra una fotografia del neuroepitelio della coclea di un ratto grigio dopo un'esposizione di 5 giorni ad un agente contenente vitronectina, scattata utilizzando un microscopio elettronico a scansione.
Nella FIG. La Figura 5 mostra una fotografia del neuroepitelio della coclea di un ratto grigio con perdita dell'udito neurosensoriale pronunciata, scattata mediante microscopia confocale dopo l'aggiunta del marcatore immunoistochimico bromodeossiuridina.
La Figura 6 mostra una fotografia del neuroepitelio della coclea di un ratto grigio dopo 5 giorni di esposizione all'agente contenente vitronectina, scattata mediante microscopia confocale dopo l'aggiunta del marcatore immunoistochimico bromodeossiuridina.
Esempi di implementazione
La vitronectina è stata isolata dal siero ottenuto dal plasma sanguigno bovino scongelato mediante cromatografia di affinità con eparina-sefarasi.
Sono stati preparati 420 ml di una soluzione acquosa dell'agente proposto miscelando i componenti nel seguente rapporto, mg/100 ml di soluzione:
La soluzione preparata è stata testata su un cane (peso 43 kg, età 9 anni) affetto da moderata perdita dell'udito neurosensoriale.
Tre volte al giorno le veniva dato un pezzetto di carne imbevuto di 10 ml della soluzione dell'agente proposto.
La durata del ciclo di trattamento è stata di 14 giorni.
Nella FIG. La Figura 1 mostra un confronto tra audiogrammi computerizzati eseguiti con un audiometro automatizzato AA-02 del sistema uditivo del cane prima del trattamento (curva 1-AD - per l'orecchio destro, curva 1-AS - per l'orecchio sinistro) e 3 giorni dopo la fine di trattamento (curva 2-AD - per l'orecchio destro, curva 2-AS - per l'orecchio sinistro).
La non rettilineità delle curve 1-AD e 1-AS, così come la bassa soglia dell'udito che mostrano, indicano una grave perdita dell'udito neurosensoriale.
Insieme a questo, le curve 2-AD e 2-AS sono quasi rettilinee e riflettono la soglia uditiva normale.
Questi dati ci permettono di concludere che l'udito è stato ripristinato grazie alla cura della perdita dell'udito neurosensoriale.
La risonanza magnetica e gli ultrasuoni, condotti 1 e 3 mesi dopo il completamento del ciclo di trattamento, non hanno rivelato segni di retinoblastoma, così come altri tipi di cancro.
Poiché l'esperimento secondo l'esempio 1 prevede esclusivamente la rigenerazione delle cellule ciliate sotto l'azione del farmaco proposto, per chiarire anche la possibilità della loro proliferazione, è stato condotto uno studio clinico su una persona anziana (peso 71 kg, età 64 anni) affetta da dalla sordità neurosensoriale.
Il paziente indossava da tempo un impianto cocleare che trasmetteva informazioni sonore sotto forma di segnali elettrici direttamente al nervo uditivo, aggirando le cellule ciliate cocleari danneggiate/morte, ma ciò successivamente ha portato a processi infiammatori nei punti in cui passava l'impianto . Poiché indossarlo ha permesso al paziente di sentire, si può concludere che la perdita dell'udito neurosensoriale era associata proprio alla morte delle cellule ciliate cocleari e la loro morte, a sua volta, indica l'impossibilità di ripristinare l'udito solo a causa della rigenerazione delle cellule danneggiate, ma non cellule morte.
Per il trattamento della malattia, dopo l'isolamento della vitronectina dal siero ottenuto dal plasma sanguigno bovino scongelato, è stata preparata una miscela in polvere dei componenti dell'agente proposto con un veicolo farmaceuticamente accettabile mediante cromatografia di affinità con eparina-sefarasi. Dalla miscela di polveri sono state preparate 84 compresse del peso di 1,5 g ciascuna.
Una compressa conteneva, mg:
Il paziente ha preso una compressa tre volte al giorno. La durata del ciclo di trattamento è stata di 28 giorni.
Nella FIG. La Figura 2 mostra un confronto tra audiogrammi computerizzati eseguiti con un audiometro automatizzato AA-02, del sistema uditivo del paziente prima del trattamento (curva 3-AD - per l'orecchio destro, curva 3-AS - per l'orecchio sinistro) e 3 giorni dopo la fine di trattamento (curva 4-AD - per l'orecchio destro, curva 4-AS - per l'orecchio sinistro).
La non rettilineità delle curve 3-AD e 3-AS, così come la bassa soglia dell'udito nella gamma di frequenze sonore di 125-4000 Hz e la sordità quasi completa nella gamma di 4000-8000 Hz, indicano un pronunciato disturbo neurosensoriale sordità nel paziente a causa di danni alle cellule ciliate.
Insieme a questo, le curve 4-AD e 4-AS sono quasi rettilinee e riflettono la soglia uditiva normale.
Questi dati ci permettono di concludere che l'udito è stato ripristinato grazie alla cura della sordità neurosensoriale.
Se la sordità neurosensoriale consisteva in un danno alle cellule ciliate della coclea del paziente, come indicato dall'effetto positivo dell'uso di un impianto cocleare da parte del paziente, ciò conferma anche la loro proliferazione, poiché altrimenti è impossibile ripristinare l'udito dopo la sordità neurosensoriale completa .
La risonanza magnetica e gli ultrasuoni, condotti 1 e 3 mesi dopo il completamento del ciclo di trattamento, non hanno rivelato segni di retinoblastoma, così come altri tipi di cancro. Le condizioni del paziente erano normali.
Poiché l’effetto riparatore della vitronectina sulle cellule ciliate è stato precedentemente dimostrato e la natura degli audiogrammi dei pazienti prima e dopo il trattamento descritto negli esempi 1 e 2 indica proprio la cura per la perdita dell’udito neurosensoriale, ne consegue che i rimedi proposti molto probabilmente curano nel sistema uditivo proprio le cellule ciliate. Ciò è dimostrato anche dall'effetto positivo dell'uso di un impianto cocleare in un paziente trattato secondo l'esempio 2. Inoltre, nella maggior parte dei casi, la perdita dell'udito neurosensoriale è associata a un danno a questo particolare tipo di cellule. Allo stesso tempo, per verificarlo in modo affidabile e allo stesso tempo comprendere il vero motivo del miglioramento dell'udito, è stato necessario studiarne i cambiamenti morfologici.
A questo scopo sono state studiate le cellule ciliate della coclea di un ratto grigio morto, che in precedenza aveva vissuto in un cantiere edile in luoghi dove il rumore dovuto ai lavori di riparazione era lungo e spesso superava i 120 dB.
Per prima cosa è stato aperto l'orecchio interno. Una striscia vascolare è stata rimossa dall'organo del Corti ( rete capillare) insieme al neuroepitelio situato su di esso e posto in un mezzo nutritivo.
Dopo la rimozione della membrana tettoria, la struttura della colonia di cellule ciliate è stata studiata utilizzando un microscopio elettronico a scansione. Nella FIG. 3 mostra che la maggior parte di loro morì o era presente condizione critica, le loro stereocilia erano gravemente danneggiate. Eziologia questa malattiaè stato chiaro: lungo soggiorno nei luoghi in cui il rumore supera i limiti consentiti, molto spesso porta alla perdita dell'udito neurosensoriale.
Per testare la proliferazione delle colonie cellulari, la bromodeossiuridina è stata aggiunta al loro mezzo ad una concentrazione di 0,00002 g/ml per unità di volume del mezzo cellulare, dopo di che sono state esaminate utilizzando un microscopio confocale Nikon A1+/A1R+. Non sono stati osservati segni di proliferazione delle cellule ciliate (FIG. 5).
È stata preparata una sospensione acquosa per il trattamento della perdita dell'udito neurosensoriale, contenente g/ml:
Questa sospensione è stata aggiunta alla colonia cellulare per 5 giorni ogni 12 ore nella quantità di 0,001-0,0015 g/ml del mezzo cellulare.
Nella FIG. 4 mostra che dopo questo periodo molte cellule si ripresero, ne apparvero di nuove, le loro stereociglia erano piene.
Dopo aver aggiunto 0,00002 g/ml di bromodeossiuridina al mezzo cellulare, la colonia è stata esaminata utilizzando un microscopio confocale Nikon A1+/A1R+. Colorazione immunoistochimica di singole sezioni del neuroepitelio, mostrata in Fig. 6 indica chiaramente la presenza di cellule proliferanti.
Va notato che un'osservazione di venti giorni non ha rivelato segni di carcinogenesi nel neuroepitelio, come evidenziato dall'assenza di atipia cellulare e, di conseguenza, displasia cellulare. Deviazioni dalla normale struttura dell'intero complesso tissutale durante periodo specificato non sono stati osservati.
Pertanto, è stato scoperto per la prima volta che la vitronectina o la sua miscela con uno o più glucocorticoidi consente di attivare la via di segnalazione Shh specificamente nelle cellule ciliate dell'orecchio interno e quindi di rigenerarle, in particolare, attivando il loro processo di proliferazione , mentre grazie alla sua diffusione facilitata non solo con l'intervento chirurgico e l'impatto diretto su di essi, come nel prototipo, ma anche in altri modi (non operativi), che amplia notevolmente le modalità di utilizzo degli strumenti proposti. La capacità della vitronectina di diffondere anche la proteina Shh e di trasportarla alle cellule bersaglio fornisce un notevole effetto di ripristino delle cellule ciliate, a differenza dell’uso dei glucocorticoidi, in cui questa capacità non è stata riscontrata. Questi fatti ci permettono di concludere che le invenzioni proposte soddisfano la condizione di brevettabilità "attività inventiva".
I mezzi proposti sono i primi ed al momento gli unici mezzi efficaci trattamento della perdita dell'udito neurosensoriale associata a danni alle cellule ciliate. Prima del loro sviluppo in medicina, era ampiamente noto il fatto che “le cellule ciliate umane non possono essere ripristinate in alcun modo” (articolo / C. Lieberman “Perdita dell’udito latente”. Nel mondo della scienza. Ottobre 2015; N. 10: pagina 59, colonna 2, paragrafo 3 /; articolo /Edge AS, Chen ZY (2008), "Hair cell rigenerazione", Current Opinion in Neurobiology 18 (4): pagine 377-382/; , 04/05/2009).
Componenti per la cottura varie opzioni dei mezzi proposti sono facilmente disponibili e per la vitronectina difficile da raggiungere, come menzionato sopra, esistono diversi metodi ben noti e semplici per ottenerla.
L'ulteriore sviluppo del campo del controllo dell'espressione genica aprirà nuove opportunità per il ripristino del corpo. Oltre al gene Rbl, ci sono anche molti altri geni che svolgono un duplice ruolo: sia la loro espressione che la loro soppressione per alcune parti e funzioni del corpo svolgono un ruolo positivo e allo stesso tempo per altre parti e funzioni - un ruolo negativo. uno. Per analogia con come la soppressione competente del gene Rb1 può contribuire al ripristino delle cellule ciliate e allo stesso tempo non provocare la formazione di tumori maligni, allo stesso modo tutto il resto può essere ripristinato in un organismo vivente, compresa la vista, la sensibilità, movimento, sistema digestivo, cervello, denti. Inoltre, controllando l'attività dei geni, è anche possibile ripristinare gli arti e gli organi perduti, ma quest'area non è praticamente studiata. Per chiarire questo problema, lo studio del pool genetico di rettili, uccelli e pesci, in cui, oltre alle cellule ciliate dell'orecchio interno, possono essere ripristinati anche gli arti, i denti e la vista, e quindi si presume che questi fattori hanno fornito ad alcuni tipi di dinosauri un'aspettativa di vita molto lunga.
Uno degli aspetti più importanti in quest'area è anche lo studio approfondito di tutte le funzioni di un particolare gene e delle proteine da esso espresse, poiché, come notato sopra, l'attivazione o la soppressione di un determinato gene per ripristinare una funzione di il corpo può portare a conseguenze irreversibili e distruttive associate al cambiamento o all'arresto di altre funzioni corporee.
1. Un agente per il trattamento della perdita dell'udito neurosensoriale, comprendente una sostanza che attiva la via di segnalazione delle cellule di Sonic hedgehog, caratterizzato dal fatto di contenere inoltre almeno un agente antitumorale, e la sostanza che attiva la via di segnalazione delle cellule di Sonic hedgehog è vitronectina.
2. Agente secondo la rivendicazione 1, caratterizzato dal fatto di contenere inoltre almeno una sostanza scelta dal gruppo: vinpocetina, pentossifillina e piracetam.
3. Agente secondo la rivendicazione 1 o 2, caratterizzato dal fatto di contenere inoltre laminina.
4. Agente secondo la rivendicazione 1, caratterizzato dal fatto che contiene inoltre acido palmitico.
5. Un agente per il trattamento della perdita dell'udito neurosensoriale, comprendente una sostanza che attiva la via di segnalazione delle cellule Sonic hedgehog, caratterizzato dal fatto di contenere inoltre almeno un agente antitumorale, almeno una sostanza selezionata dal gruppo: vinpocetina, pentossifillina e piracetam , e una sostanza che attiva la via di segnalazione cellulare Sonic hedgehog è una miscela di vitronectina e almeno un glucocorticoide.
6. Agente secondo la rivendicazione 5, caratterizzato dal fatto di contenere inoltre acido palmitico.
7. Agente secondo la rivendicazione 5 o 6, caratterizzato dal fatto di contenere inoltre laminina.
Il gruppo delle invenzioni riguarda il trattamento e/o la prevenzione di disturbi vestibolari. Si propone l'uso di un antagonista selettivo del recettore dell'istamina H4 selezionato dal gruppo costituito da 1-[(5-cloro-1H-benzimidazol-2-il)carbonil]-4-metilpiperazina, 1-[(5-cloro-1H -indolo-2-il)carbonil]-4-metilpiperazina, 4-((3R-)-3-amminopirrolidin-1-il)-6,7-diidro-5H-benzocicloeptapirimidin-2-ilammina o cis-4-( piperazin-1 -il)-5,6,7a,8,9,10,11,11a-ottaidrobenzofurochinazolin-2-ammina per il trattamento e/o la prevenzione di disturbi vestibolari e una composizione per lo stesso scopo, inclusi questi composti.
L'invenzione riguarda il settore medico, in particolare l'otorinolaringoiatria, e può essere utilizzata per il trattamento dell'otite media essudativa. Per questo si effettua un effetto di farmacopuntura sui punti corporei: IG4 (wang-gu), IG17 (tian-rong), VB2 (tin-hui), VB8 (shuai-gu), VB10 (fu-bai), VB11 ( tou-qiao-yin), VB12(wan-gu), T14(da-zhui), T20(bai-hui), T22(xin-hui), GI4(he-gu), E36(zu-san-li) , TR20(jiao-sole), TR21(er-men).
L'invenzione riguarda la medicina, in particolare l'ostetricia e la ginecologia, e può essere utilizzata come parte della preparazione preimpianto dell'endometrio per un programma di fecondazione in vitro.
L'invenzione riguarda il campo della biotecnologia, in particolare un metodo per aumentare il periodo di tempo prima della recidiva del tumore, e può essere utilizzata in medicina. Vengono preparati gli antagonisti della neuregulina, che sono anticorpi anti-NRG1, siRNA o shRNA mirati a NRG1 o immunoadesine anti-NRG1 per la somministrazione a un paziente precedentemente trattato con terapia antitumorale, in combinazione con agente terapeutico selezionato tra paclitaxel, cisplatino o una loro combinazione per ritardare il tempo di recidiva del tumore o prevenire lo sviluppo di resistenza delle cellule tumorali al trattamento con un agente terapeutico.
L'invenzione riguarda la medicina, in particolare la pneumologia, e può essere utilizzata per il trattamento di pazienti affetti da malattia polmonare ostruttiva cronica complicata da anemia.
L'invenzione riguarda il campo della biochimica, della biotecnologia e dell'ingegneria genetica, in particolare un farmaco per il trattamento della fibrosi epatica basato su una miscela di due costrutti plasmidici non virali. Il primo costrutto plasmidico non virale è pC4W-HGFopt e contiene il gene che codifica per il fattore di crescita degli epatociti umani. Il secondo è pVax1-UPAopt e contiene il gene che codifica per l'urochinasi umana. Nel farmaco specificato i costrutti plasmidici sono contenuti nelle seguenti concentrazioni: pC4W-HGFopt - da 0,5 a 0,7 mg/ml; pVax1-UPAopt - da 0,3 a 0,5 mg/ml, con una concentrazione di DNA totale di 1±0,01 mg/ml. La presente invenzione descrive un metodo per produrre detto farmaco e un metodo per trattare la fibrosi epatica utilizzando detto farmaco in una quantità farmaceuticamente accettabile. La presente invenzione fornisce un farmaco per il trattamento della fibrosi epatica, avente maggiore efficienza, che è sicuro e facile da ottenere. 3 n. e 9 z.p. f-ly, 28 ill., 4 tab., 9 pr.
SOSTANZA: il gruppo di invenzioni riguarda la medicina e può essere utilizzato in otorinolaringoiatria per il trattamento della perdita dell'udito neurosensoriale a vari stadi. A tal fine, sono state proposte opzioni di trattamento che includono un componente che attiva la via di segnalazione delle cellule Sonic hedgehog. La vitronectina viene utilizzata come tale componente nella prima versione dell'agente. Inoltre, contiene inoltre almeno un agente antitumorale. Nella seconda variante dell'agente come tale componente viene utilizzata una miscela di vitronectina e almeno un glucocorticoide. A differenza del primo agente, contiene inoltre almeno una sostanza scelta dal gruppo: vinpocetina, pentossifillina e piracetam. EFFETTO: garantire la rigenerazione delle cellule ciliate danneggiate dell'orecchio interno, compresa la loro proliferazione, senza il rischio di cancro nel corpo, in particolare il retinoblastoma, nonché ampliare i metodi di utilizzo dell'agente per il trattamento della perdita dell'udito neurosensoriale. 2 n. e 5 z.p. f-ly, 6 ill., 2 pr.
L'invenzione riguarda la medicina, in particolare la fisioterapia. Il metodo prevede la stimolazione di un'area delle cellule sensoriali dei capelli mediante la stimolazione sonora. Per fare ciò, assegnare una banda di frequenza corrispondente all'area danneggiata delle cellule sensoriali dei capelli, che ha un'elevata soglia uditiva. Questa banda è definita come la banda di frequenza target. Viene applicato un segnale audio per stimolare l'area danneggiata delle cellule sensoriali dei capelli. In questo caso, l'interfaccia del modello della coclea viene utilizzata con l'immagine della regione delle cellule sensoriali dei capelli, divisa secondo la risoluzione di 1/k ottava. Un segnale audio della banda di frequenza corrispondente all'immagine selezionata dell'area delle cellule sensoriali dei capelli viene generato nel caso in cui l'utente selezioni almeno un'immagine dell'area delle cellule sensoriali dei capelli. La soglia uditiva viene determinata utilizzando le informazioni di risposta in conformità con il segnale sonoro emesso. In questo caso, il segnale audio corrisponde ad almeno un segnale selezionato dal gruppo, che comprende un segnale di tono modulato in ampiezza, un segnale di tono modulato in frequenza, un segnale di tono pulsato e un rumore a banda stretta modulato in ampiezza o una combinazione di toni. Il metodo migliora l’accuratezza della diagnostica uditiva aumentando la risoluzione dei segnali sonori e può essere utilizzato nel trattamento della perdita dell’udito. 11 w.p. volo, 15 ill.
Disegni del brevetto RF 2525223







Prerequisiti per l'invenzione
La presente invenzione riguarda generalmente un metodo e un apparato per stimolare una cellula sensoriale dei capelli utilizzando un segnale sonoro. Più specificamente, la presente invenzione riguarda un metodo e un apparecchio per diagnosticare accuratamente l'udito di un paziente e per migliorare l'udito (acuità uditiva) come risultato della diagnosi.
Ogni organo che trasmette il suono al cervello è chiamato organo dell'udito.
L'organo dell'udito è diviso in orecchio esterno, orecchio medio e orecchio interno. Il suono che entra dall'esterno attraverso l'orecchio esterno crea vibrazioni nella membrana timpanica, che entrano nella coclea dell'orecchio interno attraverso l'orecchio medio.
Le cellule sensoriali dei capelli uditivi si trovano sulla membrana basale della coclea. Il numero di cellule sensoriali dei capelli situate sulla membrana basale è di circa 12.000.
La membrana basale è lunga circa 2,5-3 cm, le cellule sensoriali ciliate situate all'inizio della membrana basale sono sensibili ai suoni ad alta frequenza e le cellule sensoriali ciliate situate all'estremità della membrana basale sono sensibili ai suoni a bassa frequenza. Questa è chiamata specificità di frequenza (selettività) delle cellule sensoriali dei capelli. Tipicamente, la risoluzione della specificità di frequenza corrispondente ad un'intensità di stimolazione ideale è di circa 0,2 mm (0,5 semitoni) sulla membrana basale.
Recentemente, a causa della diffusione dell'uso di dispositivi audio portatili e dell'esposizione umana a vari rumori, molte persone hanno iniziato a soffrire di perdita dell'udito neurosensoriale.
La perdita dell'udito neurosensoriale è un fenomeno di degenerazione dell'udito causato da danni alle cellule sensoriali dei capelli che si verificano a causa dell'invecchiamento, dell'esposizione al rumore, di una reazione avversa ai farmaci, di cause genetiche e simili.
L’ipoacusia neurosensoriale si suddivide in ipoacusia lieve, ipoacusia moderata, ipoacusia grave e ipoacusia profonda. Di solito è difficile parlare normalmente con una persona che soffre di ipoacusia moderata, grave e profonda.
Si ritiene che attualmente circa il dieci per cento della popolazione totale della terra soffra di una lieve perdita dell'udito, in cui una persona avverte una diminuzione dell'udito. Inoltre, si ritiene che circa 260.000.000 di persone o più soffrano di ipoacusia moderata, grave o profonda solo nei paesi sviluppati.
Tuttavia, non esiste una cura per la perdita dell’udito; sono disponibili solo apparecchi acustici, come quelli per non udenti.
L'apparecchio acustico amplifica il suono esterno in modo che possa essere ascoltato, quindi l'apparecchio acustico non può prevenire la degenerazione (riduzione) dell'udito. Esiste un problema specifico: l'udito di chi indossa l'apparecchio acustico viene ridotto maggiormente dal suono amplificato.
Pertanto, è necessario un metodo per trattare la perdita dell’udito senza l’uso di un apparecchio acustico.
D'altra parte, il metodo di test dell'udito puro (metodo di test dell'udito con tono puro) come metodo per diagnosticare la perdita dell'udito è ampiamente utilizzato come metodo di test dell'udito standard internazionale e il metodo di test dell'udito puro utilizza la specificità di frequenza delle cellule sensoriali dei capelli.
Di solito, quando si testa l'udito puro, si divide uniformemente la membrana basale in sei parti con un intervallo di risoluzione di un'ottava e si determina la specificità di frequenza delle cellule sensoriali ciliate situate su ciascuna di queste sei parti quando esposte a sei segnali di frequenza (ad esempio, 250 , 500, 1000, 2000, 4000 e 8000 Hz).
Nel caso in cui vi sia una specificità di frequenza normale, poiché la cellula sensoriale del capello non è danneggiata, può verificarsi una risposta corrispondente alla specificità di frequenza della cellula sensoriale del capello in risposta ad un'intensità di stimolazione con una bassa pressione sonora.
Ad esempio, quando la specificità di frequenza di una cellula ciliata, corrispondente a 1000 Hz, è normale, la risposta elettrica in questa cellula ciliata avviene ad una frequenza di 1000 Hz con un livello di pressione sonora (SPL) di -1,4 dB.
In un tipico test dell'udito, un operatore esperto genera segnali sonori corrispondenti a porzioni della membrana basale separate da un'ottava utilizzando un sofisticato dispositivo di test. Se la persona esaminata sente i segnali sonori corrispondenti a ciascuna delle parti, preme il pulsante di conseguenza. In questo caso è difficile diagnosi accurata udito perché la risoluzione è bassa. Inoltre, tale diagnosi dell'udito è scomoda.
L'essenza dell'invenzione
In relazione a quanto sopra, lo scopo della presente invenzione è quello di eliminare questi inconvenienti della tecnica nota.
Secondo la presente invenzione, vengono forniti un metodo e un apparecchio per stimolare una cellula sensoriale dei capelli utilizzando un segnale sonoro per consentire il trattamento della perdita dell'udito.
La presente invenzione fornisce inoltre un metodo e un apparecchio per stimolare una cellula sensoriale del capello utilizzando un segnale audio, consentendo una diagnosi più accurata dell'udito di un utente.
La presente invenzione fornisce inoltre un metodo e un apparato per stimolare una cellula sensoriale dei capelli utilizzando un segnale audio, consentendo una diagnosi accurata dell'udito di un utente in una posizione remota e consentendo il trattamento della perdita dell'udito.
Il metodo per stimolare una cellula sensoriale del capello secondo la presente invenzione comprende le seguenti fasi: (a) isolare una banda di frequenza corrispondente ad una regione danneggiata di una cellula sensoriale del capello secondo un algoritmo predeterminato; (b) determinare una banda di frequenza corrispondente all'area danneggiata della cellula sensoriale del capello come banda di frequenza predeterminata; e (c) generare un segnale audio avente un'intensità predeterminata nella banda di frequenza predeterminata per stimolare l'area danneggiata del capello la cellula sensoriale del capello.
Un metodo per stimolare una cellula sensoriale dei capelli secondo un'altra forma di realizzazione esemplificativa della presente invenzione include l'uso di un'interfaccia del modello di coclea avente immagini di una regione delle cellule sensoriali dei capelli separate secondo una risoluzione di 1/k ottava, dove k è un numero intero positivo maggiore di 2; generare un segnale audio di una banda di frequenza corrispondente ad almeno una banda (banda di frequenza) selezionata dal gruppo avente immagini della regione delle cellule sensoriali dei capelli; e rilevamento dell'area danneggiata della cellula sensoriale del capello mediante la risposta dell'utente in conformità con il segnale sonoro emesso (ricevuto dall'utente).
Un metodo per fornire la stimolazione delle cellule sensoriali dei capelli con un dispositivo collegato elettricamente a un cliente tramite una rete di comunicazione, in conformità con un altro aspetto della presente invenzione, comprende le fasi di: (a) fornire al cliente un'applicazione diagnostica dell'udito, detta applicazione comprendente un'interfaccia del modello cocleare avente immagini dell'area della cellula sensoriale dei capelli, separate secondo la risoluzione di 1/k ottava; (b) ricevere informazioni di risposta dell'utente (cliente) in conformità con il segnale audio della banda di frequenza corrispondente ad almeno una delle immagini dell'area della cellula sensoriale dei capelli; (c) determinare la banda di frequenza corrispondente alla regione danneggiata della cellula sensoriale del capello come banda di frequenza predeterminata utilizzando le informazioni di risposta; e (d) trasmettere al cliente un segnale audio della banda di frequenza predeterminata avente l'intensità predeterminata.
Viene inoltre fornito un software leggibile dal computer che implementa i metodi sopra descritti.
Il dispositivo di stimolazione delle cellule ciliate con stimolazione sonora secondo la presente invenzione comprende una sezione di diagnosi dell'udito (acuità uditiva) configurata per misurare una soglia uditiva in una regione delle cellule ciliate utilizzando le informazioni di risposta dell'utente in conformità con uno specifico segnale sonoro; una sezione di rilevamento dell'area di stimolazione configurata per determinare una banda di frequenza corrispondente all'area danneggiata della cellula sensoriale del capello come una banda di frequenza predeterminata utilizzando la soglia uditiva misurata; e una sezione di stimolazione del trattamento configurata per generare un segnale audio avente un'intensità predeterminata in la banda di frequenza predeterminata trovata.
Come già descritto qui sopra, utilizzando il metodo e l'apparecchio per stimolare la cellula sensoriale dei capelli secondo la presente invenzione, l'utente può diagnosticare facilmente e accuratamente l'udito utilizzando l'interfaccia del modello cocleare.
Utilizzando il metodo e l'apparecchio per stimolare le cellule sensoriali dei capelli secondo la presente invenzione, l'utente può controllare visivamente il suono della stimolazione e migliorare l'udito.
Il metodo e il dispositivo per stimolare la cellula sensoriale dei capelli secondo la presente invenzione possono migliorare radicalmente l'udito.
Le suddette ed altre caratteristiche dell'invenzione risulteranno meglio dalla seguente descrizione dettagliata, fatta con riferimento ai disegni allegati, nei quali parti simili hanno gli stessi riferimenti.
Breve descrizione dei disegni
La Figura 1 mostra un primo diagramma a blocchi di un dispositivo per stimolare una cellula sensoriale dei capelli secondo una forma di realizzazione esemplificativa della presente invenzione.
La Figura 2 mostra un secondo diagramma a blocchi di un dispositivo per stimolare una cellula sensoriale dei capelli secondo una forma di realizzazione esemplificativa della presente invenzione.
3 mostra l'interfaccia di un modello di coclea secondo una forma di realizzazione esemplificativa della presente invenzione.
La FIGURA 4 è un primo diagramma di flusso di un metodo di diagnosi dell'udito secondo una forma di realizzazione esemplificativa della presente invenzione.
La Figura 5 mostra un secondo diagramma di flusso di un metodo per stimolare una cellula sensoriale dei capelli secondo una forma di realizzazione esemplificativa della presente invenzione.
La Figura 7 mostra un grafico dei risultati di un test di udito puro di un soggetto.
La figura 8 mostra la banda di frequenza predeterminata determinata per un soggetto secondo la figura 7. La figura 8 mostra la banda di frequenza predeterminata determinata per un soggetto secondo la figura 7.
La Figura 9 mostra la pianificazione del segnale sonoro di stimolazione.
La Figura 12 mostra un grafico della soglia uditiva dell'orecchio destro prima e dopo la stimolazione con un segnale sonoro.
La Fig. 14 mostra una tabella delle misurazioni uditive per l'orecchio destro dopo la cessazione della stimolazione sonora.
La Fig.15 mostra un grafico corrispondente alla tabella mostrata in Fig.14.
Descrizione dettagliata dell'invenzione
Quanto segue descrive forme di realizzazione esemplificative della presente invenzione. Tuttavia, si deve comprendere che i dettagli strutturali e funzionali specifici qui descritti servono solo a spiegare le forme di realizzazione esemplificative descritte della presente invenzione, e queste forme di realizzazione esemplificative della presente invenzione possono essere implementate in varie forme alternative e pertanto questi dettagli non dovrebbero essere interpretato come limitativo delle forme di realizzazione esemplificative qui esposte della presente invenzione.
Pertanto, sebbene la presente invenzione sia suscettibile di varie modifiche e forme alternative, di seguito si descriveranno in dettaglio le sue forme di realizzazione specifiche mostrate a titolo esemplificativo nei disegni. Tuttavia, si deve comprendere che le forme specifiche divulgate non intendono limitare l'invenzione, ma piuttosto l'invenzione copre tutte le modifiche, gli equivalenti e le alternative che rientrano nell'ambito della presente invenzione e rientrano nello spirito della presente invenzione. .
Dovrebbe essere chiaro che sebbene parole come primo, secondo, ecc. possano essere usate per descrivere vari elementi, queste parole non limitano questi elementi. Queste parole permettono solo di distinguere un elemento da un altro. Ad esempio, il primo elemento può essere indicato come secondo elemento e, analogamente, il secondo elemento può essere indicato come primo elemento, senza allontanarsi dall'ambito della presente invenzione. Inoltre, come qui utilizzato, il termine "e/o" include qualsiasi e tutte le combinazioni di uno o più degli elementi elencati combinati.
Si dovrebbe comprendere che quando si dice che un elemento è "connesso" o "associato" ad un altro elemento, esso può essere direttamente connesso o associato ad un altro elemento, oppure (tra) possono essere presenti elementi intermedi. Al contrario, quando si dice che un elemento è "direttamente connesso" o "direttamente connesso" a un altro elemento, non ci sono elementi intermedi. Anche altre parole usate per descrivere le relazioni tra elementi dovrebbero essere interpretate in modo simile (ad esempio, "tra" dovrebbe essere distinto da "immediatamente tra", "adiacente" dovrebbe essere distinto da "immediatamente adiacente", ecc.).
La terminologia qui utilizzata è solo per descrivere variazioni specifiche e non è intesa a limitare l'invenzione. Come qui utilizzate, le forme singolari includono il plurale, a meno che il contesto non indichi chiaramente diversamente. Inoltre, va tenuto presente che termini come "include", "comprende", "comprende" e/o "comprende" qui utilizzati indicano la presenza di caratteristiche (caratteristiche), numeri interi, operazioni, elementi e/o componenti, ma non precludono la presenza o l'aggiunta di una (una) o più altre caratteristiche, numeri interi, operazioni, elementi, componenti e/o gruppi degli stessi.
Se non diversamente specificato, tutti i termini qui utilizzati (compresi i termini tecnici e scientifici) hanno un significato generalmente accettato, comprensibile agli specialisti in questo campo, a cui è destinata la presente invenzione. Dovrebbe anche essere inteso che i termini definiti nei dizionari di uso comune dovrebbero essere interpretati nel senso che corrisponde al significato nel contesto dell'invenzione, e non dovrebbero essere interpretati in un senso idealizzato o eccessivamente formale, se non diversamente specificato.
La Figura 1 mostra uno schema a blocchi di un dispositivo per stimolare una cellula sensoriale dei capelli secondo una forma di realizzazione esemplificativa della presente invenzione.
Come mostrato in FIGURA 1, il dispositivo di stimolazione delle cellule ciliate secondo la presente invenzione comprende una sezione di diagnosi dell'udito 100, una sezione di rilevamento dell'area di stimolazione 102 e una sezione di stimolazione del trattamento 104.
La sezione 100 di diagnosi dell'udito genera un segnale audio corrispondente ad una banda di frequenza specifica dell'utente, e misura l'udito dell'utente in quella banda di frequenza in base alla risposta dell'utente al segnale audio generato. La misurazione dell'udito può essere eseguita utilizzando audiometria tonale PTA, eco OAE ed audiometria della risposta evocata ERA, ecc.
Secondo una forma di realizzazione esemplificativa della presente invenzione, la sezione diagnostica uditiva 100 genera segnali audio in banda di frequenza aventi una risoluzione (con intervalli di frequenza tra loro) inferiore a un'ottava, li fornisce all'utente e rileva la posizione del danneggiato cellule sensoriali dei capelli e il grado di danno alle cellule sensoriali dei capelli in base al segnale sonoro fornito.
Preferibilmente, la sezione di diagnosi uditiva 100 fornisce alla persona esaminata segnali audio in banda di frequenza aventi una risoluzione di 1/k ottava (dove k è un numero intero positivo maggiore di 2), e preferibilmente una risoluzione da 1/3 a 1/24 ottava e diagnostica l'udito dell'utente in base al segnale sonoro fornito. In questo caso, secondo una forma di realizzazione esemplificativa della presente invenzione, il segnale audio fornito all'utente corrisponde a frequenza media nell'intervallo da 250 Hz a 12000 Hz. Nel caso della divisione della banda di frequenza media con una risoluzione massima di 1/24 ottava, l'intera area della cellula sensoriale dei capelli dell'utente può essere divisa in 134 bande di frequenza (regioni di larghezza di banda).
Durante un esame dell'udito, all'utente viene fornito un segnale sonoro in una banda di frequenza specifica selezionata tra 134 bande di frequenza e l'utente immette informazioni di risposta in risposta al segnale sonoro, il cui volume viene regolato.
Le informazioni sulla risposta in base al livello di volume selezionato vengono memorizzate come soglia uditiva corrispondente al segnale audio nella banda di frequenza selezionata. Per soglia uditiva si intende qui la soglia uditiva di una regione di una cellula sensoriale del capello avente una specificità di frequenza rispetto alla banda di frequenza selezionata.
La sezione 102 di rilevamento dell'area di stimolazione rileva l'area di stimolazione utilizzando la soglia uditiva per il segnale audio di ciascuna banda di frequenza. In questo caso, il rilevamento dell'area di stimolazione corrisponde al rilevamento dell'area in cui deve essere generato il suono di stimolazione. In particolare, quando viene rilevata un'area di stimolazione, viene determinata la banda di frequenza corrispondente all'area danneggiata della cellula sensoriale del capello.
La sezione di stimolazione del trattamento 104 emette un segnale sonoro con un'intensità predeterminata nella banda di frequenza dell'area danneggiata della cellula sensoriale dei capelli rilevata dalla sezione di rilevamento dell'area di stimolazione 102. In questo caso, il segnale audio può avere un'intensità (decibel) superiore di un dato livello rispetto alla soglia uditiva memorizzata per la banda di frequenza corrispondente.
Secondo una forma di realizzazione esemplificativa della presente invenzione, il segnale audio corrisponde ad almeno un segnale selezionato dal gruppo costituito da un tono modulato in ampiezza, un tono modulato in frequenza, un tono a impulso e un rumore a banda stretta modulato in ampiezza o una combinazione di toni ...e rumore.
Inoltre, in caso di danni a più aree della cellula sensoriale del capello, il segnale sonoro può essere inviato alle aree danneggiate della cellula sensoriale del capello in un certo ordine a seconda del grado di danno, può essere inviato alle aree danneggiate della cellula sensoriale del capello cellula sensoriale del capello in ordine casuale, oppure può essere somministrato simultaneamente a tutte le aree danneggiate della cellula sensoriale del capello.
Quando il segnale sonoro viene applicato alle regioni danneggiate della cellula sensoriale del capello con intensità diverse, in una forma diversa o in un ordine diverso, l'udito dell'utente può essere migliorato.
La Figura 2 mostra uno schema a blocchi di un dispositivo per stimolare una cellula sensoriale dei capelli secondo una forma di realizzazione esemplificativa della presente invenzione.
Come mostrato in Figura 2, la sezione di diagnosi dell'udito 100 secondo questa forma di realizzazione include una sezione di generazione di UI 200 e una sezione di memorizzazione di informazioni di risposta 202.
Secondo una forma di realizzazione esemplificativa della presente invenzione, la sezione di generazione UI 200 visualizza l'interfaccia del modello cocleare mostrata in FIG.
Come mostrato nella figura 3, l'interfaccia del modello di coclea secondo la presente invenzione presenta un'immagine 300 corrispondente a regioni della cellula sensoriale dei capelli separate utilizzando l'alta risoluzione (separazione ad alta risoluzione). In questo caso, poiché l'intera gamma di frequenze per la diagnosi dell'udito corrisponde alle frequenze medie da 250 Hz a 12.000 Hz, l'interfaccia del modello coclea può avere 134 immagini di 300 aree di cellule ciliate se l'intera gamma di frequenze specificata viene divisa utilizzando una risoluzione di 1/ 24 ottave.
Quando l'utente seleziona una delle immagini 300 dell'area delle cellule ciliate per la misurazione dell'udito, viene generato un segnale audio in banda di frequenza abbinato all'immagine dell'area delle cellule ciliate selezionata. In questo caso per banda di frequenza abbinata ad un'immagine di una regione di cellule ciliate si intende una banda di frequenza avente una specificità di frequenza corrispondente alla specificità di frequenza della regione di cellule sensoriali ciliate associata all'immagine. Inoltre, si dovrebbe notare che l'immagine 300 dell'area delle cellule ciliate può essere selezionata utilizzando pulsanti, un mouse, uno schermo tattile o simili.
Nel caso in cui venga generato un segnale audio (servito all'utente), l'utente può regolare l'intensità del segnale audio ricevuto utilizzando il controllo del volume 302 e fornire feedback riguardo al punto di intensità in cui non sente più il segnale audio.
La sezione 202 di memorizzazione delle informazioni di risposta riceve le informazioni di risposta corrispondenti a ciascun segnale audio dalla sezione di ingresso dell'utente 220 e memorizza le informazioni di risposta ricevute. In questo caso, la sezione di input dell'utente 220 può utilizzare tasti, un mouse o uno schermo tattile. Secondo una forma di realizzazione esemplificativa della presente invenzione, le informazioni di risposta possono essere memorizzate come soglia di banda uditiva associata al corrispondente segnale audio, come descritto qui sopra.
Utilizzando questo metodo è possibile misurare l'acuità uditiva nelle aree delle cellule sensoriali dei capelli.
Come mostrato in figura 2, la sezione 102 di rilevamento dell'area di stimolazione comprende una sezione 204 di confronto della soglia uditiva e una sezione 206 di determinazione della banda di frequenza predeterminata.
La sezione 204 di confronto della soglia uditiva confronta la soglia uditiva dell'utente memorizzata nella sezione 202 di memorizzazione delle informazioni di risposta con una soglia uditiva di riferimento.
La sezione 204 di confronto della soglia uditiva determina se la soglia uditiva nella banda di frequenza misurata è superiore o inferiore alla soglia uditiva di riferimento.
La sezione 206 di determinazione della banda predeterminata determina la banda da trattare in base al risultato del confronto come banda predeterminata. In questo caso, la determinazione (ricerca) di una determinata banda di frequenza è intesa come il rilevamento di una banda di frequenza della corrispondente area danneggiata della cellula sensoriale del capello e la determinata banda di frequenza può essere determinata in unità di una risoluzione di 1/k ottava nello stesso modo in cui viene fatto nella sezione 100 della diagnosi dell'udito. Tuttavia, la determinazione della banda di frequenza predeterminata non è limitata solo a questo metodo. Ad esempio, un intervallo di larghezza di banda corrispondente ad aree danneggiate della cellula sensoriale dei capelli aventi una soglia uditiva elevata e localizzate in modo continuo può essere definito come una larghezza di banda predeterminata.
Le informazioni riguardanti la determinazione di una o più bande di frequenza predeterminate e le informazioni sull'ordine (ordine di stimolazione) in base al grado di danno vengono archiviate nella memoria 208, dove vengono abbinate in base alle informazioni di identificazione dell'utente.
La sezione di stimolazione del trattamento 104 secondo questa forma di realizzazione comprende una sezione di determinazione dell'intensità del segnale audio 210, una sezione di determinazione del tipo di segnale audio 212, una sezione di determinazione dell'ordine di stimolazione del segnale audio 214, una sezione di generazione del segnale audio 216 e una sezione di temporizzazione 218, e uscite un segnale audio all'utente utilizzando le informazioni archiviate nella memoria 208.
La sezione 210 determina l'intensità del segnale sonoro determina l'intensità del segnale sonoro fornito all'utente.
Preferibilmente, la sezione 210 di determinazione dell'intensità del segnale audio determina un'intensità con un livello da 3 a 20 decibel superiore alla soglia uditiva in ciascuna data banda di frequenza come intensità del segnale audio.
Nel caso in cui la banda di frequenza predeterminata sia determinata come la banda di frequenza corrispondente alle aree disposte in modo continuo della cellula sensoriale del capello, la sezione 210 di determinazione dell'intensità del segnale sonoro può determinare l'intensità da 3 a 20 decibel superiore al valore medio dell'udito soglie delle cellule sensoriali dei capelli, come l'intensità del segnale audio.
Vantaggiosamente l'intensità del segnale audio può essere determinata nell'intervallo da 3 a 10 decibel.
La sezione 212 di determinazione del tipo di segnale audio determina il tipo di segnale audio da fornire all'utente, tenendo conto della scelta dell'utente, del grado di perdita dell'udito dell'utente che necessita di trattamento o della banda di frequenza predeterminata.
Secondo una forma di realizzazione esemplificativa della presente invenzione, il segnale audio può essere un tono modulato in ampiezza, un tono modulato in frequenza (di seguito denominato tono punto organo), un tono pulsato, un rumore a banda stretta modulato in ampiezza e simili. In questo caso, la sezione 212 di determinazione del tipo di segnale audio determina almeno un segnale selezionato dal gruppo di uno dei toni, il tono della punta dell'organo e il rumore, o una combinazione di toni, il tono della punta dell'organo e il rumore come audio segnale, dato all'utente.
La sezione 214 che determina l'ordine di stimolazione determina l'ordine del segnale sonoro rispetto a determinate bande di frequenza, tenendo conto della scelta dell'utente, del grado di perdita dell'udito dell'utente che necessita di trattamento o adiacente a una determinata banda di frequenza.
Vantaggiosamente, la sezione 214 di determinazione dell'ordine di stimolazione può determinare l'ordine del segnale sonoro in sequenza a partire dalla banda di frequenza corrispondente alla regione più danneggiata della cellula sensoriale del capello. Tuttavia, va tenuto presente che l'ordine di deposito specificato non si limita solo a tale ordine. Ad esempio, il segnale audio può essere trasmesso in ordine casuale oppure può essere trasmesso simultaneamente in tutte le bande di frequenza indicate.
La sezione di generazione del segnale audio 216 genera un segnale audio avente un'intensità, un tipo e un ordine predeterminati. Nel caso in cui siano presenti bande di frequenza predeterminate e i segnali sonori nelle bande di frequenza predeterminate vengano emessi individualmente, è possibile impostare la temporizzazione di ciascun segnale sonoro. La sezione di temporizzazione 218 determina la temporizzazione di ciascun segnale acustico e controlla la sezione di uscita del segnale acustico 216 in modo che la sezione di uscita del segnale acustico 216 proceda a generare un segnale audio nella successiva banda di frequenza predeterminata o interrompa la generazione di un segnale audio dopo la fine del segnale audio corrispondente. tempo.
In conformità con una forma di realizzazione esemplificativa della presente invenzione, la sezione di generazione UI 200 visualizza informazioni sull'interfaccia del modello di coclea quando viene emesso un segnale sonoro per trattare l'udito di un utente, in cui l'utente vede visivamente se il segnale sonoro viene emesso o meno, e ottiene informazioni sulla sua intensità, tipologia, ecc. .P.
Ad esempio, la sezione di generazione UI 200 può modificare il colore o la dimensione dell'immagine 300 dell'area delle cellule ciliate corrispondente alla banda di frequenza (banda di frequenza predeterminata) del segnale audio attualmente emesso dal controller 230.
Nel caso in cui il segnale audio sia un segnale di tono modulato in ampiezza, la sezione di generazione UI 200 può cambiare il colore o la dimensione dell'immagine corrispondente 300 della regione delle cellule ciliate in sincronismo con i cambiamenti nell'ampiezza del segnale di tono modulato in ampiezza.
Nel caso in cui il segnale audio sia un segnale di tono modulato in frequenza, la sezione di generazione UI 200 può cambiare il colore o la dimensione dell'immagine corrispondente 300 della regione delle cellule sensoriali dei capelli in sincronismo con i cambiamenti nella frequenza del segnale di tono modulato in frequenza.
Nel caso in cui il segnale audio sia un tono di punto d'organo o un tono pulsato, la sezione di generazione UI 200 può cambiare il colore o la dimensione dell'immagine 300 dell'area sensoriale delle cellule ciliari corrispondente in sincronismo con i cambiamenti nel tono di punto d'organo o nel tono pulsato.
Secondo una forma di realizzazione esemplificativa della presente invenzione, l'utente può verificare intuitivamente, utilizzando l'interfaccia del modello cocleare, il miglioramento dell'udito in ciascuna delle aree della cellula sensoriale dei capelli.
La sezione di generazione dell'UI 200 contiene un'interfaccia del modello di coclea, che consente di visualizzare un'immagine 300 della regione delle cellule sensoriali dei capelli di una banda di frequenza predeterminata, determinata secondo la diagnostica uditiva, separata da altre immagini della regione delle cellule sensoriali dei capelli. Inoltre, la sezione 200 di generazione dell'interfaccia utente può visualizzare un'immagine 300 dell'area danneggiata della cellula sensoriale del capello con cambiamenti di colore o dimensione che cambiano a seconda del grado di danno.
La sezione 200 di generazione dell'UI cambia il colore o la dimensione della corrispondente immagine 300 dell'area delle cellule sensoriali dei capelli in base al grado di miglioramento dell'udito in ciascuna delle aree delle cellule sensoriali dei capelli mediante la stimolazione di cui sopra utilizzando un segnale sonoro (di seguito denominato "suono di stimolazione "), in modo che l'utente possa verificare il miglioramento dell'acuità uditiva.
Il miglioramento dell'acuità uditiva può essere rilevato da rimisurazione soglia uditiva in una determinata banda di frequenza.
La Fig. 4 è un diagramma di flusso di un metodo di diagnosi dell'udito secondo una forma di realizzazione esemplificativa della presente invenzione. In questo caso, la sezione di visualizzazione 232 del dispositivo di stimolazione delle cellule sensoriali dei capelli è configurata come uno schermo tattile.
Facendo ora riferimento alla Figura 4, viene mostrato che quando l'utente desidera diagnosticare il proprio udito, nella fase S400, il dispositivo di stimolazione delle cellule ciliate visualizza l'interfaccia del modello di coclea mostrata in Figura 3 sul touch screen 232. In questo caso, viene utilizzata un'interfaccia modello coclea, che presenta una pluralità di immagini di regioni delle cellule sensoriali dei capelli, ed è possibile distinguere visivamente le bande di frequenza ottenute dividendo la gamma di frequenze medie con una risoluzione massima di 1/24 di ottava.
Nella fase S402, viene determinato se l'utente ha selezionato o meno l'immagine 300 dell'area delle cellule ciliate visualizzata sull'interfaccia del modello di coclea.
Nella fase S404, quando l'utente ha selezionato l'immagine 300 dell'area delle cellule ciliate, viene emessa la banda di frequenza audio corrispondente all'area delle cellule ciliate associata all'immagine 300 selezionata.
Nella fase S406, il dispositivo di stimolazione delle cellule ciliate determina se le informazioni di risposta dell'utente sono state ricevute o meno in base al segnale audio.
L'utente può regolare il livello del volume se non sente il segnale acustico e fornisce un feedback sull'intensità con cui inizia a sentire il segnale acustico.
Nell'operazione S408, le informazioni di risposta vengono memorizzate come soglia uditiva nella banda di frequenza corrispondente a ciascun segnale audio.
Nella fase S410, il dispositivo di stimolazione delle cellule ciliate confronta la soglia uditiva dell'utente con la soglia uditiva di riferimento dopo il completamento dell'immissione delle informazioni di risposta.
Nella fase S412, confrontando i risultati, viene determinata una banda di frequenza predeterminata in cui è richiesta la stimolazione con il segnale audio.
Nella fase S414, le informazioni sulla banda di frequenza target vengono archiviate nella memoria 208. In questo caso, le informazioni sulla banda target possono avere informazioni di identificazione dell'utente, informazioni sulla soglia uditiva nella banda di frequenza in cui viene diagnosticato l'udito, informazioni su l'ordine di segnalazione in base al grado di danno e così via.
Nel caso in cui i segnali audio corrispondano alla separazione delle bande di frequenza con una risoluzione di 1/24 di ottava, in ciascuna delle bande di frequenza può essere determinata una determinata banda di frequenza. Tuttavia la determinazione della banda di frequenza predeterminata non si limita a questo caso. In particolare, può essere definito come banda di frequenza data uno specifico intervallo di bande di frequenza in cui le soglie uditive medie sono superiori ai valori di riferimento. Ad esempio, nel caso di misurazione dell'acuità uditiva utilizzando ciascun segnale sonoro corrispondente alle bande di frequenza da 5920 Hz a 6093 Hz (primo intervallo), da 6093 Hz a 6272 Hz (secondo intervallo) o da 6272 Hz a 6456 Hz (terzo intervallo ), ottenuto dividendo la gamma di frequenze medie con una risoluzione di 1/24 di ottava, è possibile determinare una determinata banda di frequenza in ciascuno degli intervalli o in un nuovo intervallo avente i tre intervalli precedenti, cioè da 5920 Hz a 6456 Hz .
La FIGURA 5 è un diagramma di flusso di un metodo per stimolare una cellula sensoriale dei capelli secondo una forma di realizzazione esemplificativa della presente invenzione.
Il dispositivo per stimolare la cellula sensoriale del capello determina l'intensità, il tipo, l'ordine e simili. (segnale) della banda di frequenza predeterminata dopo aver determinato la banda di frequenza predeterminata in conformità con quanto sopra, ed emette un segnale sonoro per migliorare l'udito dell'utente in conformità con i risultati ottenuti.
Facendo ora riferimento alla FIGURA 5, viene mostrato che, nella fase S502, il dispositivo di stimolazione delle cellule ciliate legge le informazioni sulla banda target dalla memoria 208, e quindi determina l'intensità audio della banda target quando l'utente, nella fase S500, richiede segnale sonoro.
Nelle operazioni S504 e S506 vengono determinati il tipo e l'ordine del segnale sonoro.
Come accennato in precedenza, l'ordine dei segnali acustici può essere determinato in base al grado di danno, oppure può essere determinato in modo che il segnale acustico venga emesso in modo casuale o che tutte le aree vengano suonate contemporaneamente.
Nell'operazione S508 viene emesso un segnale acustico in base all'intensità, al tipo e all'ordine di consegna determinati (trovati).
Nella fase S510, nel caso in cui il segnale acustico venga emesso in base al grado di danno o venga emesso in modo casuale, il dispositivo di stimolazione delle cellule sensoriali dei capelli determina se il tempo del segnale acustico è trascorso o meno.
Nella fase S512, nel caso in cui il tempo di alimentazione sia terminato, la successiva banda di frequenza predeterminata inizia a emettere un segnale acustico.
D'altra parte, quando viene emesso un segnale sonoro, il dispositivo di stimolazione delle cellule ciliate sincronizza l'interfaccia del modello della coclea con cambiamenti nell'ampiezza, frequenza o periodo di impulso del segnale sonoro e cambia il colore o la dimensione dell'immagine dell'area delle cellule ciliate 300 sull'interfaccia del modello di coclea in base a queste modifiche.
Il metodo per stimolare la cellula sensoriale dei capelli secondo questa forma di realizzazione può essere implementato utilizzando un computer o un terminale utente portatile, oppure può essere implementato in un ospedale, o simili. Inoltre, questo metodo può essere implementato in remoto in una posizione remota utilizzando una rete di comunicazione.
La figura 6 mostra un sistema di coda per migliorare l'udito secondo una forma di realizzazione esemplificativa della presente invenzione.
Come mostrato in Figura 6, il sistema di coda per l'aumento dell'udito secondo questa forma di realizzazione comprende un server per l'aumento dell'udito 600 collegato elettricamente ad almeno un utente (cliente) 602 utilizzando una rete di comunicazione. In questo caso, la rete di comunicazione include una rete di comunicazione cablata con Internet e una linea di comunicazione privata con Internet senza fili, una rete di comunicazione mobile e una rete di comunicazione satellitare.
Il server di miglioramento dell'udito 600 crea un'applicazione per generare l'interfaccia del modello cocleare mostrata nella figura 3 per l'utente (cliente) 602 in conformità con la richiesta dell'utente. In questo caso, il server di miglioramento dell'udito 600 può creare detta applicazione mediante vari metodi come un metodo di download o un metodo per inserire un'applicazione in una pagina web e simili.
Quando un utente seleziona un'immagine specifica di una regione della cellula ciliata 300 utilizzando l'interfaccia della coclea, l'applicazione emette un segnale acustico sulla banda di frequenza corrispondente alla regione della cellula sensore dei capelli selezionata dall'utente.
Quindi, quando l'utente 602 immette informazioni di risposta sul punto di intensità in cui il segnale audio non viene ascoltato, utilizzando il controllo del volume del segnale audio, queste informazioni di risposta vengono immesse al server di miglioramento dell'udito 600.
Il server di miglioramento dell'udito 600 ha una sezione di rilevamento dell'area di stimolazione, come mostrato nelle FIGURE 1 e 2, e determina una banda di frequenza predeterminata in cui è richiesto il trattamento utilizzando le informazioni di risposta dell'utente ricevute.
In aggiunta, il server di miglioramento dell'udito 600 memorizza informazioni riguardanti la banda di frequenza predeterminata, determina l'intensità, il tipo, l'ordine di consegna e simili. segnale di una determinata banda di frequenza in conformità con la richiesta dell'utente e fornisce un segnale audio di una determinata banda di frequenza all'utente (cliente) 602 attraverso la rete di comunicazione in conformità con i risultati determinati (ottenuti).
L'utente (cliente) 602 può avere un terminale che elabora un'applicazione e dispone di un altoparlante, ed è un computer desktop, un computer portatile (laptop), un terminale di comunicazione mobile e simili.
L'utente (cliente) 602 stimola la propria cellula sensoriale dei capelli con un segnale audio generato dal server di miglioramento dell'udito 600.
Il grado di miglioramento dell'udito fornito dal dispositivo di stimolazione delle cellule ciliate secondo la presente invenzione può essere testato sperimentalmente.
La Figura 7 mostra un grafico dei risultati di un test di udito puro di un soggetto. In particolare, la Figura 7 mostra i risultati di un test dell'udito ottenuto da un test dell'udito nell'intervallo da 2000 Hz a 8000 Hz con una risoluzione di 1/24 di ottava utilizzando una sezione diagnostica dell'udito.
Come mostrato in Fig.7, l'orecchio destro della persona esaminata presenta una perdita uditiva di tipo piatto nella banda di frequenza da 3000 Hz a 7000 Hz.
La FIGURA 8 mostra la larghezza di banda target determinata per il soggetto in oggetto con i risultati mostrati nella FIGURA 7. La FIGURA. Nello specifico, un intervallo di banda di frequenza da 5920 Hz a 6840 Hz avente una soglia uditiva di circa 50 dBHL viene determinato come banda target per il soggetto in oggetto con i risultati mostrati in FIG.
Un segnale audio come un tono modulato in frequenza o un tono a banda stretta modulato in ampiezza associato ad una certa banda di frequenza predeterminata mostrata in Fig. 8 è stato applicato all'orecchio destro per 30 minuti al mattino e alla sera per 15 giorni. In questo caso il segnale audio ha un'intensità compresa tra 5 dBSL (SL - livello di sensazione) e 10 dBSL.
La Figura 9 mostra il programma di stimolazione con un segnale sonoro. In particolare, l'acuità uditiva è stata misurata prima dell'inizio della stimolazione sonora (primo caso), dopo 5 giorni di stimolazione sonora (secondo caso), e dopo 15 giorni di stimolazione sonora (terzo caso), dopodiché sono state misurate le rispettive soglie uditive. rispetto.
In ciascuno di questi casi, l'acuità uditiva è stata misurata 10 volte con una risoluzione di 1/24 di ottava e poi è stata calcolata la media dei risultati della misurazione per eliminare l'errore sperimentale.
La Figura 10 mostra una tabella che confronta i risultati della misurazione dell'udito prima del segnale di stimolazione sonora nell'orecchio destro e dopo il segnale di stimolazione sonora nell'orecchio destro per 10 giorni.
La Fig. 11 mostra una tabella che confronta i risultati della misurazione dell'udito dopo il suono di stimolazione dell'orecchio destro per 10 giorni e dopo il suono di stimolazione dell'orecchio destro per 15 giorni.
Se consideriamo le figure 10 e 11, possiamo vedere che la soglia uditiva in una determinata banda di frequenza diminuisce dopo il segnale di stimolazione sonora, cioè l'udito migliora.
La Figura 12 mostra un grafico della soglia uditiva dell'orecchio destro prima e dopo la stimolazione con un segnale sonoro.
Come mostrato nella Fig. 12, la soglia uditiva (orecchio destro) nella banda di frequenza da 5920 Hz a 6840 Hz prima della stimolazione con un segnale sonoro è 45,4 dBHL. Tuttavia, la soglia uditiva in questa banda di frequenza dopo la stimolazione con un segnale sonoro per 10 giorni diventa 38,2 dBHL, cioè la soglia uditiva diminuisce. Inoltre la soglia uditiva dopo la stimolazione con un segnale sonoro per 15 giorni diventa 34,2 dBHL, cioè la soglia uditiva viene ulteriormente ridotta.
La Fig. 13 mostra la procedura per verificare che lo stato di miglioramento uditivo sia permanentemente mantenuto dopo la cessazione del segnale sonoro di stimolazione nell'orecchio destro.
L'udito è stato misurato da 5 a 15 giorni dopo la cessazione del segnale sonoro di stimolazione.
La Fig. 14 mostra una tabella dei risultati della misurazione dell'udito dopo la cessazione della stimolazione sonora nell'orecchio destro. La Fig.15 mostra un grafico corrispondente alla tabella mostrata in Fig.14.
Facendo riferimento alle figure 14 e 15, si può vedere che l'effetto di miglioramento dell'udito persiste dopo la cessazione del segnale sonoro di stimolazione. Inoltre si può osservare che l'udito migliora di circa 7,9 dB dopo 18 giorni dalla cessazione della stimolazione sonora.
Dovrebbe essere inteso che qualsiasi riferimento nella presente descrizione a "una delle opzioni", "un'opzione", "un'opzione esemplare" o simili. significa che la caratteristica specifica, il dettaglio o la caratteristica descritta con riferimento alla forma di realizzazione specificata è inclusa in almeno una forma di realizzazione dell'invenzione. La comparsa di tali riferimenti in varie parti della descrizione dell'invenzione non significa necessariamente che si riferiscano tutti alla stessa variante. Inoltre, quando una caratteristica, un dettaglio o una caratteristica specifica viene descritta con riferimento a una delle opzioni, si può presumere che gli esperti del settore possano applicare quella caratteristica, dettaglio o caratteristica a qualsiasi altra delle opzioni.
Sebbene siano state descritte le forme di realizzazione preferite dell'invenzione, è chiaro che gli specialisti del settore potranno apportare modifiche ed integrazioni che non esulano comunque dall'ambito delle rivendicazioni.
RECLAMO
1. Un metodo per stimolare l'area delle cellule sensoriali dei capelli mediante stimolazione sonora, che comprende le seguenti operazioni:
(a) isolare una banda di frequenza corrispondente ad un'area danneggiata delle cellule sensoriali dei capelli avente un'elevata soglia uditiva;
(b) determinare una banda di frequenza corrispondente alla regione danneggiata delle cellule sensoriali dei capelli come banda di frequenza predeterminata;
(c) fornire un segnale audio avente un'intensità predeterminata in una banda di frequenza predeterminata per stimolare la regione danneggiata delle cellule sensoriali dei capelli,
in cui l'operazione (a) include:
utilizzare un'interfaccia del modello di coclea avente immagini di una regione sensoriale dei capelli divisa secondo una risoluzione di 1/k ottava, dove k è un numero intero positivo maggiore di 2;
generare un segnale sonoro della banda di frequenza corrispondente all'immagine selezionata dell'area sensoriale dei capelli, nel caso in cui l'utente selezioni almeno un'immagine dell'area sensoriale dei capelli, e determinare la soglia uditiva utilizzando le informazioni di risposta in conformità con la normativa emessa segnale sonoro,
in cui il segnale audio corrisponde ad almeno un segnale selezionato dal gruppo costituito da un tono modulato in ampiezza, un tono modulato in frequenza, un tono a impulso e un rumore a banda stretta modulato in ampiezza o una combinazione di toni;
in cui nella fase (c) il segnale audio viene generato ad un'intensità determinata dalla soglia uditiva.
2. Metodo secondo la rivendicazione 1, in cui quando una pluralità di aree di cellule sensoriali dei capelli sono danneggiate, nella fase (b) viene determinata una banda di frequenza corrispondente alle aree continuamente danneggiate posizionate come una banda di frequenza predeterminata.
3. Metodo secondo la rivendicazione 1, in cui quando vengono determinate una pluralità di bande di frequenza predeterminate, nella fase (c) il segnale sonoro viene emesso in base al grado di danno, oppure il segnale sonoro viene emesso in modo casuale.
4. Metodo secondo la rivendicazione 1, in cui quando viene determinata una pluralità di bande di frequenza predeterminate, nella fase (c) un segnale audio viene emesso simultaneamente in tutte le bande di frequenza predeterminate.
5. Metodo secondo la rivendicazione 1, in cui k è scelto tra valori da 3 a 24.
6. Metodo secondo la rivendicazione 1, in cui nella fase (b) determinare la banda di frequenza della regione delle cellule sensoriali dei capelli in cui la soglia uditiva supera il valore di riferimento predeterminato come banda di frequenza predeterminata,
in cui detto metodo comprende inoltre:
(d) generare un'immagine di una regione di cellule sensoriali dei capelli corrispondente ad una banda di frequenza predeterminata predeterminata, l'immagine di uscita della regione di cellule sensoriali dei capelli essendo osservata visivamente.
7. Metodo secondo la rivendicazione 6, in cui nella fase (c) il segnale audio viene emesso con un'intensità superiore alla soglia uditiva da 3 dB a 20 dB.
8. Metodo secondo la rivendicazione 1, che comprende inoltre:
Generazione di un'immagine dell'area delle cellule sensoriali dei capelli corrispondente alla banda di frequenza del segnale sonoro, nel caso in cui il segnale sonoro sia un segnale tono modulato in ampiezza, e il grado di variazione del segnale tono modulato in ampiezza è osservato visivamente sull'immagine dell'area delle cellule sensoriali dei capelli.
9. Metodo secondo la rivendicazione 1, che comprende inoltre:
generare un'immagine della regione delle cellule sensoriali dei capelli corrispondente alla banda di frequenza del segnale tono modulato in frequenza, nel caso in cui il segnale sonoro corrisponda al segnale tono modulato in frequenza e il grado di variazione del segnale tono modulato in frequenza è visivamente osservato sull'immagine della regione delle cellule sensoriali dei capelli.
10. Metodo secondo la rivendicazione 9, in cui il segnale di tono modulato in frequenza ha una risoluzione inferiore a 1/3 di ottava.
11. Metodo secondo la rivendicazione 1, che comprende inoltre:
Generazione di un'immagine dell'area delle cellule sensoriali dei capelli corrispondente alla banda di frequenza del segnale sonoro, nel caso in cui il segnale sonoro corrisponda al segnale del tono impulsivo, e la determinazione viene effettuata utilizzando l'immagine dell'area di cellule sensoriali dei capelli in cui il segnale sonoro corrisponde al segnale del tono impulsivo.
12. Metodo secondo la rivendicazione 1, in cui l'immagine della regione delle cellule sensoriali dei capelli ha un colore o una dimensione che cambia a seconda del miglioramento del grado di udito.
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0