Malattie autoimmuni sono tra gli importanti problemi medici umanità moderna. Colpiscono il 5% della popolazione il globo. Ad esempio, solo negli Stati Uniti, 6,5 milioni di persone sono affette da artrite reumatoide, la malattia autoimmune più comune. Attualmente gli immunologi conoscono più di 80 diverse malattie autoimmuni. Molti di loro portano a gravi sofferenze e limitazioni abilità fisiche e perfino la morte. Spesso queste malattie si verificano nell'adolescenza e giovane età. Oltre ad un problema puramente medico, le malattie autoimmuni rappresentano anche un problema sociale: in molti casi portano alla disabilità nelle persone in età attiva.
L'assenza selettiva di immunoreattività di un organismo verso un antigene specifico è chiamata tolleranza immunologica. Gli sforzi a lungo termine degli scienziati hanno portato alla comprensione che la tolleranza verso le proprie molecole non è intrinseca nel corpo fin dall'inizio. Viene acquisito durante lo sviluppo fetale.
Dopo la nascita di una persona, la tolleranza immunologica viene mantenuta dai seguenti meccanismi (principali):
Eliminazione delle cellule immunoreattive di specificità indesiderata (cloni proibiti secondo Burnet) - loro distruzione nel timo;
Il risultato dell'attività delle cellule regolatrici con funzioni soppressive;
Potenziamento immunologico con anticorpi, antigeni, CEC, citochine.
Domande per l'autopreparazione.
Concetti sugli autoantigeni, loro tipologie
Ruolo biologico e patogenetico degli autoanticorpi
Malattie autoimmuni, criteri, tipologie
Ipotesi sull'insorgenza di malattie autoimmuni
Meccanismi per l'implementazione di processi autoimmuni
Esempi clinici di malattie autoimmuni
Diagnosi delle malattie autoimmuni
Principi di base del trattamento delle malattie autoimmuni
1. Concetti sugli autoantigeni, loro tipologie.
Gli antigeni contro i quali si sviluppa una risposta autoimmune sono chiamati autoantigeni.
Nel corpo sono presenti i seguenti tipi di autoantigeni:
Autoantigeni naturali (primari) - antigeni dei tessuti immunologicamente barriera (lente, corpo vitreo dell'occhio, tessuto nervoso, antigeni degli spermatozoi, ghiandola tiroidea). Questi antigeni sono anche detti sequestrati: normalmente non entrano in contatto con le cellule del sistema immunitario.
Acquisiti (autoantigeni secondari, modificati) formati sotto l'influenza di fattori fisici, chimici, biologici (microbici):
I veri autoanticorpi reagiscono con l'uno o l'altro antigene tissutale nativo (immutato). Nel corso di una normale risposta immunitaria, il corpo si protegge dagli antigeni estranei (ad esempio il virus HIV, l'epatite B e C), anche a costo della morte delle proprie cellule alterate. Ma gli antigeni modificati possono portare alla rottura della naturale tolleranza immunologica nei confronti delle normali cellule del corpo con lo sviluppo di una reazione autoimmune (contro, nel nostro esempio, i T-helper privi di HIV).
Tra i fattori acquisiti nello sviluppo dell’AD è opportuno parlare dell’esistenza di:
Antigeni incrociati, ad esempio, quando gli agenti infettivi hanno una struttura antigenica simile agli antigeni dei tessuti umani. Allo stesso tempo, per lo sviluppo dell’AD sono necessari disturbi immunoregolatori.
Neoantigeni – incorporamento acidi nucleici virus nel genoma della cellula ospite ed espressione sulla membrana cellulare di neoantigeni indotti dal virus che avviano malattie autoimmuni.
I superantigeni sono proteine immunogeniche secrete da agenti patogeni (micoplasma, streptococco emolitico, stafilococchi, virus), che sono potenti attivatori delle cellule T e B. I superantigeni possono essere attivati senza la necessità di presentazione da parte dei macrofagi (direttamente).
2. Ruolo biologico e patogenetico degli autoanticorpi.
La presenza di autoanticorpi non è sempre un segno patologia autoimmune, e tutti persone sane nel siero del sangue normale sono presenti piccole quantità di autoanticorpi contro il DNA, componenti del citoscheletro, mielina, citocromo C, collagene, transferrina, componenti delle cellule cardiache, reni, eritrociti, fibroblasti; anticorpi antiidiotipici (contro le immunoglobuline), coinvolti nella regolazione della risposta immunitaria. Il titolo anticorpale aumenta con l’età. Ciò vale per la determinazione dei fattori reumatoidi e antinucleari, nonché degli anticorpi rilevati nella reazione Wasserman con antigeni fosfolipidici e cardiolipina. Negli individui di 70 anni vengono rilevati autoanticorpi contro vari tessuti e cellule almeno nel 60% dei casi (senza apposita manifestazioni cliniche). Secondo la teoria dell'invecchiamento di Walford, durante la vita di un organismo, si verifica un cambiamento nei determinanti antigenici a causa di mutazioni, disturbi della trascrizione. Inoltre aumenta la sensibilità dell'organismo che invecchia all'azione di fattori esogeni che possono causare malattie autoimmuni.
Un aumento del titolo di autoanticorpi contro un particolare organo è stato riscontrato anche nella fase di ripristino della sua funzione e struttura, sullo sfondo di passate malattie infettive e terapia farmacologica. È stato ormai definitivamente stabilito che sono presenti a basso titolo in circa il 10% della popolazione normale e sono marcatori di danno tissutale derivante da effetti chimici o di altro tipo, come il danno miocardico ischemico. Con la cessazione di tale esposizione e la rimozione dei tessuti distrutti, gli autoanticorpi di solito scompaiono.
Il ruolo biologico (protettivo) degli autoanticorpi è determinato dal fatto che essi:
Fornire il trasporto dei prodotti metabolici, la rimozione delle macromolecole obsolete rilasciate dalle cellule e dai sub naturali e distrutti strutture cellulari.
Neutralizzano i prodotti metabolici delle cellule che entrano nel sangue e hanno un effetto protettivo (funzione sanitaria).
Sono precursori degli anticorpi contro gli antigeni esogeni.
Agiscono come un meccanismo privato di immunoregolazione (anticorpi antiidiotipici).
Assegnare i seguenti concetti: processi autoimmuni e malattie autoimmuni. Aprocessi autoimmuni comprendono condizioni in cui il sistema immunitario riconosce i determinanti antigenici dei tessuti del corpo e produce autoanticorpi e linfociti antigene-specifici che non hanno alcun significato patogenetico nell'implementazione dell'infiammazione. Con la morte cellulare naturale o iniziata, le strutture intracellulari (intracellulari, "membrana" - simili agli antigeni "barriera") vengono proiettate all'esterno, in relazione all'ambiente cellulare, che indirizzano il sistema immunitario verso tali cellule e sono gli iniziatori della sistema immunitario che svolge la sua funzione sanitaria. Sotto stress vengono prodotti anticorpi specifici di breve durata contro le strutture danneggiate dei sistemi coinvolti, che agiscono come "aspirapolvere" delle strutture danneggiate dallo stress (non vitali). Gli stress a lungo termine e spesso ripetuti causano un ritardo nella produzione di anticorpi, una violazione delle reazioni omeostatiche e possono causare lo sviluppo di malattie autoimmuni, sclerosi e tumori.
Malattie autoimmuni (AD) - processi patologici in cui è dimostrato che le reazioni autoimmuni svolgono un ruolo patogenetico maggiore o significativo. Allo stesso tempo, gli autoanticorpi e i linfociti antigene-specifici interagiscono già con gli autoantigeni invariati di organi e tessuti, provocando in essi reazioni infiammatorie croniche - "infiammazione a base immunitaria".
I criteri per le malattie autoimmuni sono:
In tutti i casi devono essere rilevati autoanticorpi o linfociti sensibilizzati questa malattia, almeno in alcune delle sue fasi.
L'autoantigene(i) che causa (e) lo sviluppo di reazioni autoimmuni deve essere rilevato e caratterizzato.
Dovrebbe essere dimostrata la possibilità di trasferire la malattia (sindrome principale) ad un altro organismo attraverso il trasferimento di anticorpi sierici o di linfociti sensibilizzati.
La malattia deve essere modellata sperimentalmente autoimmunizzando animali con un autoantigene.
Classificazione delle malattie autoimmuni, tenendo conto del fattore eziologico:
IO . Malattie autoimmuni primarie con o senza predisposizione genetica (eziologia sconosciuta):
1. Organo-specifico (tiroidite di Hashimoto, mixedema primario, tireotossicosi, gastrite atrofica, alcune forme infertilità primaria, diabete insulino-dipendente di tipo I, miastenia grave).
2. Organo non specifico (lupus eritematoso sistemico, artrite reumatoide, dermatomiosite, sclerodermia sistemica, malattia mista del tessuto connettivo, policondrite recidivante). Le AD non organo-specifiche sono anche chiamate sistemiche o collagenosi.
3. Tipo intermedio (pemfigo, pemfigoide, cirrosi biliare primitiva, epatite cronica attiva, sindrome di Sjögren, colite ulcerosa, malattia celiaca, sindrome di Goodpasture).
4. Malattie autoimmuni del sangue (autoimmuni anemia emolitica, trombocitopenia autoimmune, neutropenia autoimmune).
A tipo organo-specifico malattie autoimmuni: gli autoanticorpi sono specifici per un componente o gruppo di componenti di un organo. Esempi: tiroidite di Hashimoto - anticorpi contro la tireoglobulina, tireoperossidasi; tireotossicosi - anticorpi contro il recettore superficiale delle cellule tiroidee; anemia perniciosa - anticorpi contro il fattore interno delle cellule di Castle dello stomaco; Morbo di Addison (insufficienza surrenale) - anticorpi contro le cellule delle ghiandole surrenali; oftalmia simpatica - anticorpi contro l'iride e il corpo vitreo, uveite flogogenica - anticorpi contro il cristallino di un occhio sano, nell'epatite cronica autoimmune - anticorpi contro la muscolatura liscia, anticorpi antimitocondriali, fattore antinucleare, microsomi epatici, fattore reumatoide, ecc.
A organo-non specifico In un tipo di malattia autoimmune, gli autoanticorpi e i linfociti sensibilizzati reagiscono con vari tessuti di questa o anche di un'altra specie animale, ad esempio con gli anticorpi antinucleari. La reazione autoimmune si sviluppa sullo sfondo della tolleranza esistente. Esempi: LES (anticorpi contro DNA, nucleo, microsomi, cardiolipina, ribonucleoproteine, proteine ribosomiali). Artrite reumatoide (anticorpi contro il frammento Fc dell'immunoglobulina G), sclerodermia (anticorpi contro il nucleo, frammento Fc delle IgG).
A intermedio tipo di malattie autoimmuni, il processo è localizzato in un particolare organo, ma vengono rilevati anche anticorpi non specifici per l'organo. Tuttavia, la specificità del rilevamento degli anticorpi è ancora oggetto di studio.
II . Malattie autoimmuni secondarie (eziologia nota o sospetta)- reumatismi, sindromi postinfartuali o cartolinatomiche, reazioni autoimmuni da farmaci, cardiomiopatia dilatativa, glomerulonefrite cronica.
III. Malattie con difetti genetici del complemento - angioedema, sindromi simili al lupus.
IV. Infezione virale lenta - sclerosi multipla, reazioni post-vaccinazione.
v. Una combinazione dei gruppi precedenti.
4. Ipotesi sull'insorgenza di malattie autoimmuni
È noto da tempo che la predisposizione alle malattie autoimmuni è spesso familiare e quanto più stretto è il rapporto tanto più è probabile che si abbiano le stesse patologie autoimmuni. Quindi, se uno dei gemelli è malato di una o di un'altra malattia autoimmune, la presenza della stessa malattia nel secondo è molto più spesso osservata nel caso di gemelli identici rispetto ai gemelli fraterni. Allo stesso tempo, la probabilità della presenza della stessa malattia autoimmune nei gemelli identici non raggiunge mai il 100% (di solito 20-30%), il che indica in modo convincente anche l'importanza dei fattori esterni. L’influenza combinata di fattori ereditari e ambientali può essere tracciata analizzando la suscettibilità dei diversi gruppi etnici alle malattie autoimmuni. La popolazione indigena della Siberia orientale, a differenza dei russi, praticamente non soffre di sclerosi multipla, ma la prevalenza della sclerosi multipla tra i russi che vivono in questa regione è 2-4 volte inferiore rispetto ai russi della parte europea della Russia.
Quello la patologia autoimmune è geneticamente programmata , indica anche la ricezione di linee di animali con malattie autoimmuni a sviluppo spontaneo. Esperimenti sull'incrocio di tali animali lineari hanno permesso di determinare che la risposta autoimmune è sotto il controllo di almeno tre geni. I dati ottenuti nello studio delle malattie autoimmuni umane indicano anche la natura poligenica della patologia autoimmune. La suscettibilità all'autoimmunizzazione non dipende da nessun gene, ma è determinata da una combinazione di diversi geni (probabilmente una decina) che controllano sia la risposta immunitaria che le caratteristiche strutturali dei componenti dell'organo bersaglio. Un ruolo importante nella formazione della predisposizione genetica appartiene ai geni del sistema del principale complesso di compatibilità tissutale, i cui prodotti sono necessari per il riconoscimento di antigeni specifici da parte dei linfociti T. La relazione tra lo sviluppo della malattia e le varianti alleliche dei singoli geni di questo sistema complesso è stata dimostrata in modo convincente nel diabete giovanile, nell'artrite reumatoide, nella sclerosi multipla e in altre malattie. Ad esempio, nelle malattie autoimmuni organo-specifiche, l'aplotipo HLA - B8, DR3 è particolarmente comune, sebbene la tiroidite di Hashimoto sia associata al DR 5.
Si può quindi distinguere che diversi fattori sono coinvolti nello sviluppo delle malattie autoimmuni. fattori genetici:
geni che determinano la predisposizione generale alla patologia autoimmune (organo-specifica o organo-non specifica);
geni che determinano un bersaglio specifico: l'antigene o gli antigeni contro i quali è diretta la reazione autoimmune.
Nelle donne si registra una maggiore frequenza di AZ: gli androgeni sono immunosoppressori, gli estrogeni sono immunostimolanti; eliminazione complessi immunitari aumenta sotto l'influenza degli androgeni ed è indebolito dagli estrogeni. A questo proposito, suggerisce la necessità di ricercare i disturbi ormonali nella sindrome dell'immunocomplesso e la possibilità di utilizzare androgeni in questa variante dell'immunopatologia.
Quindi, i fattori scatenanti delle malattie autoimmuni sono:
Infezioni (modifica degli antigeni dei propri tessuti, reazioni crociate, formazione di neoantigeni, superantigeni, linfotropismo, stimolazione diretta delle cellule effettrici).
Modificazione degli antigeni tissutali mediante farmaci.
Compromissione del riconoscimento di sé.
Disfunzione delle cellule immunoregolatorie
L'ipotesi dei tessuti barriera. Violazione delle barriere istagematiche e contatto con cellule immunocompetenti di tessuti verso i quali non esiste tolleranza immunologica: il cristallino e altri elementi dell'occhio, le ghiandole sessuali, il cervello, i nervi cranici contengono antigeni barriera. Dopo un infortunio, incluso (operativo), durante gravi processi infiammatori, entrano nel flusso sanguigno e si formano autoanticorpi contro di loro. Tuttavia, non è chiaro come, in caso di lesione di un occhio, gli autoanticorpi sintetizzati entrino nel cristallino dell'altro occhio con una barriera intatta e lo danneggino durante lo sviluppo dell'infiammazione simpatica (oftalmia simpatica). Tali malattie sono estremamente difficili da trattare.
Ipotesi di cloni proibiti. Cloni autoaggressivi di linfociti compaiono nel corpo, si accumulano, interagiscono con gli antigeni dei tessuti normali, li distruggono, provocando il rilascio di antigeni precedentemente nascosti, stimolanti endogeni e mitogeni che migliorano queste reazioni, in particolare i linfociti B.
L'ipotesi degli antigeni cross-reattivi. Di grande interesse per i ricercatori è la ricerca di agenti infettivi che possano contribuire allo sviluppo di malattie autoimmuni attraverso il meccanismo del mimetismo molecolare. Sono noti molti microrganismi, alcune delle quali presentano alcune somiglianze strutturali con le proteine umane che agiscono come autoantigeni. Tali microrganismi possono innescare una reazione crociata autoimmune sia degli anticorpi che dei linfociti T. In particolare, per i virus della sclerosi multipla, del morbillo e dell'epatite B, il virus Ebstein-Barr è stato nominato come possibile agente che causa il mimetismo molecolare. Le reazioni crociate possono fungere da fattore scatenante per l'autosensibilizzazione agli antigeni batterici. Ad esempio, lo streptococco β-emolitico di gruppo A ha determinanti comuni (eterogenei) con antigeni del sarcolemma miocardico e della membrana basale glomerulare; la struttura antigenica dei tripanosomi ha determinanti comuni con il muscolo cardiaco; l'introduzione di un vaccino contro la rabbia derivato dal tessuto cerebrale del coniglio può portare a danni autoimmuni al cervello del paziente a causa di determinanti antigenici comuni del tessuto cerebrale umano e del coniglio. La somiglianza degli antigeni dei ceppi E. coli 014 e 086 con le strutture della mucosa del colon è di importanza patogenetica per lo sviluppo della colite. La produzione di anticorpi contro il DNA (fattori antinucleari) può essere dovuta a virus contenenti DNA, che si verificano nel lupus eritematoso sistemico (LES). Gli antigeni che reagiscono in modo crociato sono ampiamente distribuiti in natura e spesso causano la produzione di anticorpi, ma i meccanismi di autoaggressione sono relativamente rari.
L'ipotesi di Fyudenberg. Caratteristica è una debolezza geneticamente programmata della risposta immunitaria verso un antigene specifico, ad es. immunodeficienza specifica. Se il portatore dell'antigene è un microrganismo, si sviluppa un'infezione con tendenza a decorso cronico, a seguito della quale è possibile la distruzione dei tessuti, il rilascio di vari autoantigeni, contro i quali vengono prodotti autoanticorpi, linfociti sensibilizzati.
Ipotesi di violazione della funzione soppressore delle cellule del sistema immunitario. Ciò si traduce in un eccesso di cellule T-helper, che possono stimolare le cellule B autoreattive a formare anticorpi. Una diminuzione del potenziale soppressore porta allo sviluppo di AD come: LES, diabete, sclerosi multipla, miastenia grave, artrite reumatoide, anemia emolitica autoimmune, cirrosi biliare primitiva.
Ipotesi di accecamento dei linfociti. Autoanticorpi a certe condizioni bloccano i recettori percettivi dei linfociti, che riconoscono il "proprio" e l'"estraneo", causando la rottura della tolleranza naturale e la formazione processo autoimmune portando a malattie autoimmuni.
induzione dell'espressione HLA - DR - Ag sulle cellule che ne sono sprovviste. Normalmente, c'è molto HLA-DR-Ag sulle cellule APC (macrofagi, cellule di Langerhans, cellule dendritiche della pelle, cellule B, cellule gliali) servono come marcatori mediante i quali i linfociti riconoscono i "loro" macrofagi e altre cellule APC. Ma se gli antigeni HLA compaiono sulla superficie delle cellule dove normalmente non dovrebbero essere, allora queste cellule con i loro antigeni possono essere riconosciute come estranee. Pertanto, nei pazienti con tiroidite autoimmune, sulla superficie delle cellule tiroidee viene espresso l'antigene di istocompatibilità di classe II, per cui gli antigeni tiroidei vengono riconosciuti dai linfociti come estranei e sono in grado di indurre una risposta autoimmune.
Attivazione delle cellule B policlonali (bypass shunt).
Come è noto, gli antigeni timo-dipendenti - lipopolisaccaridi, componenti del bacillo della pertosse e della brucellosi, virus dell'HIV, ecc. possono causare l'attivazione policlonale dei linfociti B. Si ritiene che questo sia uno dei motivi della comparsa di autoanticorpi. L'azione di questo meccanismo spiega la presenza di autoanticorpi freddi contro gli eritrociti nei pazienti con sifilide, agglutinine fredde nella polmonite micoplasmica. È anche importante ridurre l’apoptosi delle cellule T-helper che attivano i linfociti B.
Violazione della rete immunologica "idiotipo-anti-idiotipo"
In questo caso, gli idiotipi (recettori per gli anticorpi regolatori - anti-idiotipi)) delle cellule T e B sono considerati recettori dell'antigene. IN l'anno scorsoè stata dimostrata la presenza di anticorpi anti-recettori contro i recettori cellulari dell'acetilcolina, dell'insulina e di altri ormoni. Alcune forme di diabete mellito resistenti alla terapia insulinica si spiegano con l'autoimmunità con l'accumulo di autoanticorpi contro i recettori cellulari che percepiscono il segnale dell'insulina. I determinanti idiotici reagiscono con strutture anti-idiotipiche complementari di immunoglobuline e linfociti, e gli anti-idiotipi possono agire sia stimolanti che depressivi. Infatti, nel processo di formazione della rete idiottipo-antiidiotipo, la formazione di autoanticorpi è obbligatoria e naturale. Ad esempio, va processo naturale degradazione delle cellule dei tessuti con successivo rinnovamento delle strutture cellulari. Per eliminare le parti non vitali delle cellule, vengono prodotti anticorpi contro di esse (antiidiotipi del 1° ordine). Una volta terminato lo stimolo (eliminazione effettiva di queste strutture), questi anticorpi vengono bloccati dalla produzione di antianticorpi che li controllano (antiidiotipi del secondo ordine). Dati interessanti sono stati ottenuti nello studio degli anticorpi anti-idiotipici. È stato stabilito che la remissione clinica con un numero di malattie sistemiche accompagnata dalla produzione di anticorpi anti-idiotipi. La miastenia gravis si è sviluppata solo in quei neonati in cui non sono stati prodotti anticorpi anti-idiotipi ed è nota effetto terapeutico gammaglobuline ( dosi elevate) è spiegato dalla presenza di anticorpi antiidiotipici nella loro composizione. In assenza della possibilità di sviluppare antiidiotipi del secondo ordine (disturbi del sistema immunitario o deficit energetico-plastico), il processo di produzione di anticorpi contro i tessuti continua e, alla fine, può portare all'autoaggressione. È significativo che la maggior parte delle varianti di immunodeficienza e immunopatologia si sviluppino sullo sfondo di difetti nella sintesi proteica. La carenza proteica (carenza energetica) può contribuire alla scarsa qualità e alla creazione improduttiva di anti-idiotipi e, quindi, alla trasformazione di una reazione “sanitaria” naturale in immunopatologia o autoaggressione. Dal punto di vista della prevenzione dell'AD, in particolare nelle infezioni virali, è a tutti gli effetti dieta proteica e cibi ipercalorici e facilmente digeribili. È molto importante che i medici non si lascino trasportare dalle sfumature della terapia farmacologica, ma creino una solida base sotto forma di fornitura energetico-plastica delle capacità protettive del corpo.
Induzione da parte di virus e altri agenti di mutazione e modifica dell'attività dei geni che regolano la produzione di citochine e dei loro recettori.
La dipendenza della prevalenza delle malattie autoimmuni dalla vita nelle grandi città, da precedenti infezioni, dal livello di contatto con altre persone, nonché dall'identificazione di aree con estremamente tassi elevati morbilità e comparsa di microepidemie: tutto ciò ha suggerito il ruolo degli agenti infettivi come principale fattore ambientale nello sviluppo delle malattie autoimmuni. Alcuni batteri e virus patogeni (stafilococchi, streptococchi, retrovirus) producono i cosiddetti superantigeni: proteine tossiche che possono stimolare in modo non specifico i linfociti, causando una potente risposta immunitaria. Se gli antigeni normali attivano solo una cellula T su 10.000, i superantigeni ne attivano quattro su cinque, cioè la maggior parte dei linfociti T del corpo. È logico supporre che tra loro ci saranno sicuramente quelli autoimmuni e, essendo "più arrabbiati e più mobili" dopo l'esposizione al superantigene, inizieranno a distruggere i tessuti proprio corpo. Questo meccanismo di attivazione è probabilmente coinvolto nello sviluppo dell’artrite reumatoide, una malattia in cui infiammazione cronica articolazioni, cuore, vasi sanguigni e polmoni. Quando un virus entra in una cellula, un attacco enzimatico sulla membrana superficiale della cellula può modificare gli antigeni ivi presenti e gli anticorpi contro questi antigeni, poiché si trovano sulla superficie, possono avere un pronunciato effetto citotossico (indirettamente: attraverso i fagociti, NK cellule o proteine del sistema del complemento). Successivamente, quando lasciano la cellula, le particelle virali trasportano antigeni della parete cellulare incorporati nelle proprie glicoproteine superficiali.
Di grande importanza nello sviluppo delle malattie autoimmuni sono le sostanze tossiche che incontriamo a casa e al lavoro: coloranti chimici, solventi organici, sali di piombo e molto altro ancora. livelli alti l'incidenza di varie malattie autoimmuni è stata notata in aree con industria sviluppata e grave inquinamento ambiente. La distribuzione non uniforme di alcune malattie nelle diverse regioni è associata al clima, alla topografia, alla composizione del suolo e ad altri fattori. caratteristiche geografiche terreno. Sotto l'influenza di alcuni farmaci, anche i tessuti fisici (bruciore, congelamento) cambiano i tessuti del corpo con la formazione di antigeni modificati complessi e intermedi. In una certa percentuale di casi, i disturbi autoimmuni sono causati dall'uso di preparati immunitari e medicinali vari. Questi includono vaccini, sieri, gamma-globuline, interferoni. Quindi la metildopa può causare anemia emolitica, idralazina - LES, sulfamidici - periarterite nodosa, derivati del pirazolone - agranulocitosi. Un certo numero di farmaci tradizionali che non appartengono agli immunostimolanti, ma hanno le loro proprietà, possono, se non indurre, in ogni caso aggravare l'insorgenza dell'immunopatologia. I seguenti farmaci sono dotati di potenza immunostimolante: antibiotici (eritromicina, amfotericina B, levorina, nistatina), nitrofurani (furazolidone), antisettici (clorofillipt), psicotropi (piracetam, nootropil), anfetamine, mesocarb, soluzioni sostitutive del plasma (hemodez, reopoliglyukin , gelatina). Rafforzamento della risposta immunitaria, questi farmaci vengono realizzati in determinate condizioni, a seconda del processo patologico e delle dosi. Le mutazioni somatiche possono contribuire alla comparsa di cloni di autoanticorpi e linfociti sensibilizzati che reagiscono contro le proprie cellule.
Numerose malattie autoimmuni sono accompagnate da una lesione tumorale del tessuto linfoide. Tuttavia, gli individui con malattie linfoproliferative mostrano sintomi di malattie autoimmuni. Tale associazione può essere il risultato di una trasformazione maligna del tessuto linfoide con costante stimolazione antigenica, o di un difetto primario nelle cellule immunocompetenti, o della proliferazione di un clone cellulare anormale (come risultato di una mutazione). La causa comune di tutti questi disturbi può essere un’infezione virale.
I processi autoimmuni accompagnano le immunodeficienze primarie: deficit di IgA, ipogammaglobulinemia, immunodeficienza con iperproduzione di IgM. L'immunodeficienza è accompagnata da una violazione dell'immunoregolazione e può portare all'abolizione della naturale tolleranza immunologica del corpo.
Molto spesso, i processi autoimmuni nell'uomo sono accompagnati da cambiamenti nella ghiandola del timo. I timomi linfoepiteliali si riscontrano nel 10-20% delle persone affette da miastenia grave. Molto spesso viene rilevata una combinazione di autoimmunizzazione con displasia del timo (con LES, tiroidite di Hoshimoto, anemia emolitica autoimmune).
Come stabilito, l’autoimmunizzazione del corpo può essere il risultato di:
- 1) Rilascio di antigeni sequestrati nel flusso sanguigno. È noto che questi antigeni non sono coinvolti nel meccanismo di selezione negativa dei linfociti T e B nel timo e midollo osseo e la tolleranza non si sviluppa a loro in parecchie di queste gabbie. L'interazione delle cellule immunocompetenti con tali antigeni porta sempre all'induzione di una risposta immunitaria con una successiva risposta immunitaria a questi antigeni. Esempi di antigeni sequestrati sono: la proteina basica della mielina, normalmente separata dal sistema immunitario attraverso la barriera ematoencefalica, gli antigeni degli spermatozoi e del cristallino dell'occhio. È stato stabilito che con lesioni, malattie infiammatorie, virali e infezioni batteriche questi antigeni entrano nel flusso sanguigno;
- 2) La comparsa di nuovi determinanti antigenici su cellule e tessuti. Ciò può essere il risultato di un disordine metabolico nei tessuti e nelle cellule (un difetto nella sintesi delle macromolecole, una violazione della loro idrolisi nei lisosomi, anomalie nella glicosilazione delle proteine, ecc.), una modifica delle membrane cellulari sotto l'influenza di farmaci e sostanze tossiche, infezione virale o la formazione di un singolo determinante antigenico da parte di un autoantigene con un peptide virale o un farmaco. Gli anticorpi che compaiono durante l'immunizzazione, grazie alla loro capacità di reagire in modo crociato, sono in grado di attaccare il tessuto normale e indurre in esso processi infiammatori-distruttivi;
- 3) Mimetismo molecolare. È stato stabilito che numerosi virus e batteri contengono determinanti antigenici identici o simili a quelli umani. Uno studio su circa 600 sieri virus-specifici in grado di reagire con 11 tipi di virus ha dimostrato che nel 3% dei casi reagiscono con elevata attività con i normali tessuti umani. Questi dati supportano l'idea che il mimetismo molecolare sia un fenomeno abbastanza comune e comune.
I dati mostrati nella Tabella 11-2 indicano che esiste un mimetismo molecolare tra un'ampia varietà di agenti e strutture infettivi nel corpo umano. A questo proposito va ricordato che i determinanti antigenici delle proteine (cioè quelle formazioni che inducono risposte immunitarie e con le quali interagiscono i prodotti della risposta immunitaria) sono spesso rappresentati da più (7-10) residui aminoacidici.
Il ruolo del mimetismo molecolare nello sviluppo della patologia autoimmune è ben dimostrato dai seguenti dati: sviluppo di encefalite autoimmune dopo immunizzazione di conigli con il peptide della polimerasi dell'epatite B, che è omologa al 60% al peptide della proteina basica della mielina umana; sviluppo di miocardite infezione da streptococco quando gli anticorpi antistreptococco rivelano un'elevata reattività agli antigeni del muscolo cardiaco, ecc. Queste osservazioni indicano che gli anticorpi protettivi (cellule) prodotti per l'infezione, a causa della loro capacità di interazione incrociata con strutture simili possono indurre danni ai tessuti autoimmuni.
4) Espressione aumentata ed atipica delle molecole HLA sulle cellule. Uno studio immunologico sul DIABETE MELLITO insulino-dipendente ha dimostrato che negli individui affetti da questa patologia le cellule beta pancreatiche si esprimono con alta densità, che è molto più grande di individui sani, antigeni HLA di classe I, nonché un gran numero di antigeni HLA di classe II, che normalmente non sono affatto espressi da queste cellule. Dati simili sono stati ottenuti nello studio della malattia di Graves. Nei pazienti con cellule ghiandolari della tiroide si osserva un'espressione atipica degli antigeni HLA di classe II.
Si ritiene che l'espressione atipica degli antigeni HLA di classe II sulle cellule beta del pancreas e sulle cellule ghiandolari della tiroide e la presentazione anormale dell'antigene da parte di essi siano il meccanismo scatenante dell'autoimmunizzazione del corpo. Questa opinione ha anche una convincente conferma sperimentale. È stato dimostrato nei topi transgenici che l'induzione dell'espressione di molecole MHC di classe 2 sulle cellule beta pancreatiche porta allo sviluppo del diabete, che è accompagnato dal quadro infiltrazione linfocitaria isolotti di Langerhans. L'aumento ed atipico dell'espressione degli antigeni HLA di classe II su cellule che normalmente non lo esprimono può essere indotto da sostanze sia di natura microbica che di origine endogena.
Esperimenti in vitro hanno dimostrato che sotto l'influenza dell'IFN-gamma, l'espressione degli antigeni HLA di classe II avviene su vari tipi di cellule: epiteliociti intestinali, cellule beta pancreatiche, cellule ghiandolari della tiroide, epatociti e cellule renali. È interessante notare che nei pazienti con lupus eritematoso sistemico durante il decorso attivo della malattia si osserva un aumento del livello di IFN-gamma nel siero. È noto che infezioni, infiammazioni e traumi possono agire come induttori di questa citochina. Una proprietà importante dell'IFN-gamma è la sua capacità di indurre la produzione di numerose citochine, inclusa IL-1. Nello sviluppo delle reazioni autoimmuni, come risulta da numerosi studi, questa interleuchina è in grado di agire come costimolatore dell'attivazione di cloni di linfociti T autoreattivi.
5) Attivazione policlonale dei linfociti B.
È noto che l'attivazione policlonale delle cellule B può portare alla produzione di anticorpi di diversa specificità. Quando i cloni di linfociti B autoreattivi vengono attivati mediante questo meccanismo, si ritiene che gli autoanticorpi emergenti siano in grado di agire come fattore scatenante della malattia. Molti virus (citomegalovirus, virus Epstein-Barr, virus del morbillo), batteri (gram-negativi) e i loro componenti (tossine, DNA, enzimi proteolitici) hanno le proprietà di attivatori policlonali. A questo proposito va notato che le malattie autoimmuni sistemiche sono sempre accompagnate dalla produzione di autoanticorpi di specificità molto diversa: antinucleari, anti-DNA, anticorpi contro il collagene, l'elastina, i linfociti T e B, le piastrine, gli eritrociti, ecc.
È importante sottolineare che il materiale clinico e sperimentale accumulato fino ad oggi indica la natura multifattoriale dell’eziologia delle malattie autoimmuni. Va anche aggiunto che, secondo i dati moderni, esiste un determinismo genetico del loro sviluppo. È stato stabilito che la predisposizione all'autoimmunopatologia è controllata da diversi geni, alcuni dei quali sono localizzati nel complesso maggiore di istocompatibilità. È stato dimostrato che la maggior parte delle malattie autoimmuni sono associate alla presenza dei seguenti antigeni nel fenotipo HLA: DR2, DR3, DR4, DR5. L'artrite reumatoide è associata a HLA-DR4, la tiroidite di Hashimoto è associata a HLA-DR5, la sclerosi multipla è associata a HLA-DR2 e il lupus eritematoso sistemico è associato a HLA-DR3. Le malattie autoimmuni sono molto più comuni nelle donne che negli uomini.
I dati clinici e sperimentali indicano che lo sviluppo delle malattie autoimmuni si basa sugli stessi meccanismi utilizzati dal sistema immunitario per proteggere il corpo dall'intervento esogeno: anticorpi, linfociti T citotossici. Dall'esperimento è emerso che il ruolo principale nella formazione dei processi autoimmuni è svolto dai linfociti T aiutanti (cellule CD4+). Sul modello dell'encefalite autoimmune sperimentale, della tiroidite e dell'artrite, è stato stabilito che queste malattie possono essere trasmesse da animali sani malati con l'aiuto di T-helper sensibilizzati, e anche soppresse introducendo negli animali anticorpi anti-CD4+, che eliminano o sopprimono l’attività dei linfociti T helper. I risultati ottenuti nello studio dell'encefalite sperimentale indicano che il rapporto quantitativo tra cellule Tn1 e cellule Tn2 gioca un ruolo significativo nello sviluppo delle malattie autoimmuni: le cellule Tn1 contribuiscono allo sviluppo del processo e le cellule Tn2 al contrario, bloccatelo.
Le principali modalità di sviluppo delle reazioni autoimmuni sono mostrate nella Figura 11-4. Nel caso dello sviluppo di una risposta immunitaria cellulare, i T-killer effettori autoreattivi vengono formati da cellule T citotossiche naive con l'aiuto delle cellule Tn. La sensibilizzazione dei linfociti T-citotossici naive si verifica quando interagiscono con un autoantigene presentato dalle stesse cellule bersaglio o da cellule presentanti l'antigene in combinazione con molecole MHC di classe I. I T-killer formati, quando incontrano cellule che trasportano questo autoantigene (cellule bersaglio), interagiscono con esse con l'aiuto di un recettore specifico e ne provocano la lisi attraverso la produzione di perforine. La morte delle cellule bersaglio può anche essere indotta utilizzando frammentine e ligando Fas. In questo caso la morte cellulare si sviluppa per apoptosi. Un tale meccanismo per lo sviluppo della patologia autoimmune è tipico del DIABETE MELLITO insulino-dipendente, della sclerosi multipla multipla.
Nel caso dello sviluppo di una risposta immunitaria umorale ad un autoantigene, le plasmacellule si formano dai linfociti B, con l'aiuto dei linfociti T o senza la loro partecipazione. Gli autoanticorpi che producono possono avere i seguenti effetti:
- 1) lisare le cellule che trasportano un autoantigene specifico (con il coinvolgimento del sistema del complemento nel processo). (Tale meccanismo è alla base dello sviluppo dell'anemia emolitica autoimmune, della sindrome di Goodpasture e di altre malattie);
- 2) avere un effetto stimolante quando si interagisce con la corrispondente struttura antigenica. (Questo risultato è osservato nella malattia di Graves. Gli autoanticorpi contro il recettore stimolante la tiroide delle cellule tiroidee, interagendo con esso, causano un'iperattivazione non regolata della ghiandola tiroidea, che porta allo sviluppo della tireotossicosi);
- 3) hanno un effetto bloccante. (Questo effetto è alla base della miastenia grave. Gli autoanticorpi prodotti in questa malattia sopprimono il lavoro dei recettori dell'acetilcolina nelle sinapsi neuromuscolari e causano anche la loro degradazione, che causa lo sviluppo della malattia);
- 4) formano immunocomplessi interagendo con antigeni solubili. (L'effetto tossico degli immunocomplessi è alla base dello sviluppo di malattie come la glomerulonefrite post-streptococcica, la spondilite anchilosante, l'artrite reumatoide, il lupus eritematoso sistemico). L'effetto dannoso sui tessuti degli immunocomplessi risiede nella loro capacità di attivare il sistema del complemento, concentrare granulociti e monociti nel sito della loro deposizione e anche attivare queste cellule. L'attivazione di granulociti e monociti porta alla produzione di enzimi proteolitici e proteine policationiche nei tessuti circostanti che, insieme ai componenti attivati del complemento (MAC, C3a, C5a), causano processi infiammatori-distrofici nei tessuti.
Malattie autoimmuni- Questo è un gruppo di malattie in cui la distruzione di organi e tessuti del corpo avviene sotto l'influenza del proprio sistema immunitario.
Le malattie autoimmuni più comuni sono la sclerodermia, il lupus eritematoso sistemico, la tiroidite autoimmune di Hashimoto, la tiroidite diffusa gozzo tossico eccetera.
Inoltre, lo sviluppo di molte malattie (infarto del miocardio, epatite virale, streptococco, herpes, infezioni da citomegalovirus) può essere complicato dalla comparsa di una reazione autoimmune.
Il sistema immunitario
Il sistema immunitario è il sistema che protegge il corpo dalle invasioni esterne, oltre a garantire il funzionamento del sistema circolatorio e molto altro ancora. Gli elementi invasori vengono riconosciuti come estranei e ciò provoca una reazione protettiva (immune).
Gli elementi invasori sono chiamati antigeni. Virus, batteri, funghi, tessuti e organi trapiantati, pollini, sostanze chimiche Tutti questi sono antigeni. Il sistema immunitario è costituito da organi e cellule speciali dislocati in tutto il corpo. In complessità, il sistema immunitario è leggermente inferiore al sistema nervoso.
Il sistema immunitario che distrugge tutti i microrganismi estranei deve essere tollerante nei confronti delle cellule e dei tessuti del suo "padrone". La capacità di distinguere il "sé" dall'"estraneo" è la proprietà principale del sistema immunitario.
Ma a volte, come ogni struttura multicomponente dotata di fini meccanismi di regolazione, fallisce: scambia le proprie molecole e cellule per altre e le attacca. Ad oggi si conoscono più di 80 malattie autoimmuni; e nel mondo centinaia di milioni di persone ne sono malate.
Inizialmente la tolleranza alle proprie molecole non è inerente al corpo. Si forma durante lo sviluppo fetale e immediatamente dopo la nascita, quando il sistema immunitario è in fase di maturazione e "allenamento". Se una molecola o cellula estranea entra nel corpo prima della nascita, viene percepita dal corpo per tutta la vita come "propria".
Allo stesso tempo, nel sangue di ogni persona, tra miliardi di linfociti, compaiono periodicamente dei "traditori" che attaccano il corpo del loro proprietario. Normalmente, tali cellule, chiamate autoimmuni o autoreattive, vengono rapidamente neutralizzate o distrutte.
Il meccanismo di sviluppo delle malattie autoimmuni
I meccanismi di sviluppo delle reazioni autoimmuni sono gli stessi della risposta immunitaria all'esposizione ad agenti estranei, con l'unica differenza che nell'organismo iniziano a produrre anticorpi specifici e/o linfociti T che attaccano e distruggono l'organismo. i tessuti propri del corpo.
Perché sta succedendo? Ad oggi, le cause della maggior parte delle malattie autoimmuni rimangono poco chiare. "Sotto attacco" può essere entrambe le cose corpi individuali e sistemi corporei.
Cause delle malattie autoimmuni
La produzione di anticorpi patologici o di cellule killer patologiche può essere associata all'infezione del corpo con un tale agente infettivo, i cui determinanti antigenici (epitopi) delle proteine più importanti assomigliano ai determinanti antigenici dei normali tessuti ospiti. È attraverso questo meccanismo che la glomerulonefrite autoimmune si sviluppa dopo un'infezione streptococcica o autoimmune artrite reattiva dopo aver sofferto di gonorrea.
Una reazione autoimmune può anche essere associata alla distruzione o necrosi dei tessuti causata da un agente infettivo, o ad un cambiamento nella loro struttura antigenica tale che il tessuto patologicamente alterato diventa immunogenico per l'organismo ospite. È attraverso questo meccanismo che l’epatite cronica attiva autoimmune si sviluppa dopo l’epatite B.
La terza possibile causa di una reazione autoimmune è una violazione dell'integrità delle barriere tissutali (istoematiche) che normalmente separano alcuni organi e tessuti dal sangue e, di conseguenza, dall'aggressione immunitaria dei linfociti dell'ospite.
Allo stesso tempo, poiché normalmente gli antigeni di questi tessuti non entrano affatto nel sangue, il timo normalmente non produce una selezione negativa (distruzione) dei linfociti autoaggressivi contro questi tessuti. Ma ciò non interferisce con il normale funzionamento dell'organo finché la barriera tissutale che separa questo organo dal sangue è intatta.
È attraverso questo meccanismo che si sviluppa la prostatite cronica autoimmune: normalmente la prostata è separata dal sangue da una barriera emato-prostatica, gli antigeni tissutali della prostata non entrano nel flusso sanguigno e il timo non distrugge i linfociti “antiprostatici”. Ma con l'infiammazione, il trauma o l'infezione della prostata, l'integrità della barriera emato-prostatica viene compromessa e può iniziare l'autoaggressione contro il tessuto prostatico.
La tiroidite autoimmune si sviluppa secondo un meccanismo simile, poiché normalmente anche il colloide della tiroide non entra nel sangue (barriera ematotiroidea), nel sangue viene rilasciata solo la tireoglobulina con le sue T3 e T4 associate.
Ci sono casi in cui, dopo aver subito un'amputazione traumatica dell'occhio, una persona perde rapidamente il secondo occhio: le cellule immunitarie percepiscono i tessuti di un occhio sano come un antigene, poiché prima hanno lisato i resti dei tessuti dell'occhio distrutto.
La quarta possibile causa della reazione autoimmune del corpo è uno stato iperimmune (immunità patologicamente potenziata) o uno squilibrio immunologico con una violazione del "selettore", la soppressione dell'autoimmunità, la funzione del timo o una diminuzione dell'attività del soppressore T sottopopolazione di cellule e un aumento dell'attività delle sottopopolazioni killer e helper.
Sintomi di malattie autoimmuni
I sintomi delle malattie autoimmuni possono essere molto diversi, a seconda del tipo di malattia. Di solito sono necessari diversi esami del sangue per confermare che una persona ha una malattia autoimmune. Le malattie autoimmuni vengono trattate con farmaci che sopprimono l’attività del sistema immunitario.
Gli antigeni possono essere contenuti nelle cellule o sulla superficie delle cellule (ad esempio, batteri, virus o cellule tumorali). Alcuni antigeni, come il polline o le molecole del cibo, esistono da soli.
Anche le cellule dei tessuti sani possono avere antigeni. Normalmente, il sistema immunitario reagisce solo agli antigeni di estranei o sostanze pericolose Tuttavia, a causa di alcuni disturbi, può iniziare a produrre anticorpi contro le cellule dei tessuti normali: autoanticorpi.
Una reazione autoimmune può portare a infiammazione e danni ai tessuti. A volte, tuttavia, gli autoanticorpi vengono prodotti in quantità così piccole che le malattie autoimmuni non si sviluppano.
Diagnosi delle malattie autoimmuni
La diagnosi delle malattie autoimmuni si basa sulla determinazione fattore immunitario causando danni agli organi e ai tessuti del corpo. Tali fattori specifici sono stati identificati per la maggior parte delle malattie autoimmuni.
Ad esempio, nella diagnosi dei reumatismi viene presa una decisione fattore reumatoide, nella diagnosi del lupus sistemico - cellule LES, anticorpi contro il nucleo (ANA) e contro il DNA, anticorpi contro la sclerodermia Scl-70.
Per determinare questi marcatori vengono utilizzati vari metodi immunologici di laboratorio. Lo sviluppo clinico della malattia e i sintomi della malattia possono servire da fonte informazioni utili per la diagnosi di malattie autoimmuni.
Lo sviluppo della sclerodermia è caratterizzato da lesioni cutanee (focolai di edema limitato, che subiscono lentamente compattazione e atrofia, formazione di rughe intorno agli occhi, levigatura del rilievo cutaneo), danno all'esofago con compromissione della deglutizione, assottigliamento delle falangi terminali delle dita, danni diffusi ai polmoni, al cuore e ai reni.
Il lupus eritematoso è caratterizzato dalla comparsa sulla pelle del viso (sulla parte posteriore del naso e sotto gli occhi) di un rossore specifico a forma di farfalla, danno articolare, presenza di anemia e trombocitopenia. I reumatismi sono caratterizzati dalla comparsa di artrite dopo aver sofferto di mal di gola e dalla successiva formazione di difetti nell'apparato valvolare del cuore.
Trattamento delle malattie autoimmuni
Le malattie autoimmuni vengono trattate con farmaci che sopprimono l’attività del sistema immunitario. Tuttavia, molti di questi farmaci interferiscono con la capacità del corpo di combattere le malattie. Gli immunosoppressori come l’azatioprina, il clorambucile, la ciclofosfamide, la ciclosporina, il mofetile e il metotrexato spesso necessitano di essere assunti per un lungo periodo.
Durante tale terapia aumenta il rischio di sviluppare molte malattie, incluso il cancro. I corticosteroidi non solo sopprimono il sistema immunitario, ma riducono anche l’infiammazione. Il corso di assunzione di corticosteroidi dovrebbe essere il più breve possibile - con uso a lungo termine causano molti effetti collaterali.
Etanercept, infliximab e adalimumab bloccano l’attività del fattore di necrosi tumorale, una sostanza che può causare infiammazione nel corpo. Questi farmaci sono molto efficaci nel trattamento dell’artrite reumatoide, ma possono essere dannosi se usati per trattare alcune altre malattie autoimmuni, come la sclerosi multipla.
A volte la plasmaferesi viene utilizzata per trattare le malattie autoimmuni: gli anticorpi anomali vengono rimossi dal sangue, dopodiché il sangue viene trasfuso alla persona. Alcune malattie autoimmuni scompaiono all’improvviso così come compaiono nel tempo. Tuttavia, nella maggior parte dei casi sono cronici e spesso richiedono un trattamento permanente.
Descrizioni delle malattie autoimmuni
Domande e risposte sul tema "Malattie autoimmuni"
Domanda:Ciao. Mi è stato diagnosticato il PSA e mi è stato prescritto Metojekt 10 volte a settimana per 3 anni. Che rischi avrò per il corpo assumendo questo medicinale?
Risposta: Puoi trovare queste informazioni nelle istruzioni per l'uso del farmaco nelle sezioni: " Effetti collaterali", "Controindicazioni" e "Istruzioni speciali".
Domanda:Ciao. Come posso organizzare la mia vita dopo che mi è stata diagnosticata una malattia autoimmune?
Risposta: Ciao. Sebbene la maggior parte delle malattie autoimmuni non scompaia completamente, puoi prenderle trattamento sintomatico per controllare la malattia e continuare a godersi la vita! Tuo obiettivi di vita non dovrebbe cambiare. È molto importante visitare uno specialista in questo tipo di malattia, seguire un piano di trattamento e condurre uno stile di vita sano.
Domanda:Ciao. Allevia la congestione nasale e il malessere. IN stato immunitario parlare del processo autoimmune nel corpo. Lo stesso vale per l’infiammazione cronica. A dicembre le è stata diagnosticata la tonsillite, è stata eseguita la criodistruzione delle tonsille: il problema è rimasto. Devo continuare a farmi curare da Laura o cercare un immunologo? Se è possibile curarlo in generale?
Risposta: Ciao. In una situazione in cui si verifica un'infezione cronica e cambiamenti nello stato immunitario, è necessario essere trattati sia da un immunologo che da un otorinolaringoiatra: ognuno fa le sue cose, ma in pieno accordo e comprensione del problema. Nella maggior parte dei casi si ottengono buoni risultati.
Domanda:Ciao, ho 27 anni. Da 7 anni mi è stata diagnosticata una tiroidite autoimmune. Le è stato prescritto di assumere regolarmente compresse di L-tiroxina da 50 mcg. Ma ho sentito e letto articoli secondo cui questo farmaco ha un effetto significativo sul fegato e che in Occidente i medici lo prescrivono per un ciclo di non più di 2 mesi. Per favore dimmi, devo prendere sempre L-tiroxina o è davvero meglio a volte, nei corsi?
Risposta: La L-tiroxina è un farmaco completamente sicuro approvato per l'uso nei bambini con infanzia e donne incinte. Non so quali articoli e dove leggi sugli effetti negativi della L-tiroxina, ma la prescriviamo a lungo se necessario. La decisione viene presa in base al livello degli ormoni.
Domanda:Ho 55 anni. 3 anni senza capelli da nessuna parte. Non è stato possibile determinare la causa dell’alopecia universale. Forse il motivo è nel processo autoimmune. Da cosa viene? Come testare una malattia autoimmune? Qual è la connessione con l'alopecia? Quali esami fare, quale specialista rivolgersi?
Risposta: I tricologi si occupano delle malattie dei capelli. Probabilmente dovresti contattare uno specialista del genere. Per identificare la presenza di una malattia autoimmune, è necessario superare (una serie minima di esami) un emocromo completo, proteine e frazioni proteiche, effettuare un immunogramma (CD4, CD8, il loro rapporto), sulla base dei risultati di questo esame , il medico deciderà se continuare una ricerca più approfondita per un processo autoimmune. Per le altre tue domande, scienza moderna non esiste una risposta esatta, ci sono solo supposizioni, torniamo all'inizio, i tricologi sono i migliori a comprendere questo problema.
Riso. Fig. 19. Attivazione dei linfociti T-aiutanti sotto l'influenza del superantigene: a - modo classico di attivazione; 6 - attivazione da parte del superantigene.
L'attivazione degli aiutanti dei linfociti T sotto l'influenza dei superantigeni avviene in un modo completamente diverso. In questo caso, il superantigene non viene assorbito dalla cellula presentante l'antigene e non viene sottoposto alla normale digestione (elaborazione) per formare un peptide. In questo caso, il superantigene, per così dire, bypassa questa fase necessaria per il riconoscimento specifico e si lega in modo aspecifico alla parte variabile della catena beta del recettore di riconoscimento delle cellule T al di fuori della sua zona (sito) antigene-specifica. Esiste una sorta di reticolazione delle molecole del complesso maggiore di istocompatibilità della cellula presentante l'antigene con il recettore di riconoscimento delle cellule T. Nel caso di un tale meccanismo di attivazione degli aiutanti dei linfociti T, è possibile l'attivazione simultanea di un gran numero di essi.
Così, caratteristiche distintive la stimolazione dei linfociti T sotto l'influenza dei superantigeni è la seguente:
- Ciò non richiede la digestione (elaborazione) dell'antigene nella cellula presentante l'antigene;
- Tale stimolazione non dipende dalla specificità antigenica delle molecole del complesso HLA e del recettore di riconoscimento delle cellule T;
- Il superantigene è in grado di stimolare 103-104 volte più linfociti dell'antigene processato;
- Il superantigene allogenico (estraneo) può stimolare sia i linfociti T helper (CD4+) che killer (CD8+);
- Il superantigene autologo (auto) può solo stimolare i linfociti T aiutanti (CD4);
- Per la stimolazione completa dei linfociti T da parte di un superantigene estraneo è necessario un ulteriore segnale di costimolazione.
Sotto l'influenza di questi superantigeni, possono svilupparsi le seguenti malattie (condizioni): avvelenamento del cibo, sindrome da shock tossico, sindrome della pelle squamosa, febbre reumatica, artrite, ecc.
È stato inoltre stabilito che alcuni virus tumorali presenti nel genoma cellulare sotto forma di provirus possono codificare la produzione di una proteina che stimola i linfociti T, agendo come superantigene.
Vengono considerati tre possibili meccanismi di partecipazione dei superantigeni allo sviluppo di malattie autoimmuni.
A. Attivazione dei linfociti T autoreattivi. Dimostrato di essere super
gli antigeni possono attivare direttamente i linfociti T autoreattivi, che poi migrano nei tessuti corrispondenti e causano disturbi autoimmuni, producendo citochine e/o realizzando la loro funzione di uccisione.
B. Attivazione dei linfociti B autoreattivi. Viene effettuato perché il superantigene lega le molecole del complesso HLA di classe II presenti sui linfociti B alla molecola del recettore che riconosce l'antigene delle cellule T. In questo caso, l'attivazione dei linfociti T avviene senza riconoscimento specifico dell'antigene, ma in modo aspecifico sotto l'influenza del superantigene. Tuttavia, un tale linfocita T produce le citochine appropriate, che fanno sì che il linfocita B autoreattivo attivato inizi a produrre autoanticorpi. Questi ultimi formano complessi immunitari e, depositandosi nei tessuti, ne provocano il danno. Non è escluso che i linfociti B possano essere attivati anche attraverso il proprio recettore immunoglobulinico che riconosce l'antigene.
B. Attivazione delle cellule presentanti l'antigene. I superantigeni possono attivare le cellule che presentano l'antigene come i macrofagi. Ciò porta al rilascio di citochine, quelle superossido. anioni e altri mediatori dell'infiammazione. L'attivazione dei macrofagi può anche portare a una compromissione della digestione (elaborazione) degli antigeni con successiva presentazione degli autoantigeni ai linfociti T autoreattivi.
- La teoria della predisposizione genetica. Secondo i dati moderni, esiste una predisposizione geneticamente determinata allo sviluppo di malattie autoimmuni. Questa predisposizione è controllata da almeno sei geni situati su cromosomi diversi. Alcuni di essi si trovano nel complesso maggiore di istocompatibilità (HLA) di una persona il cui ruolo. nell’attuazione della risposta immunitaria è fondamentale. È stato stabilito che la maggior parte delle malattie autoimmuni sono associate alla presenza dei seguenti antigeni nel fenotipo HLA umano: DR2, DR3, DR4 e DR5. Ad esempio, l'artrite reumatoide è associata alla tiroidite HLA-DR4. Hashimoto - con HLA-DR5, sclerosi multipla multipla - con HLA-DR2, lupus eritematoso sistemico - con HLA-DR3.
Nell'ambito della teoria della predisposizione genetica sono state avanzate diverse ipotesi per spiegare il coinvolgimento dei prodotti del complesso HLA nella patogenesi delle malattie in generale e delle malattie autoimmuni in particolare.
- Secondo l'ipotesi del recettore, uno dei primi antigeni HLA sono recettori per i virus, facilitandone la fissazione e la penetrazione nella cellula. Questa ipotesi ha molti argomenti sia a favore che contro. Ad esempio, con una malattia di eziologia chiaramente virale, come la poliomielite, così come con mononucleosi infettiva Non è stata trovata alcuna correlazione significativa con gli antigeni HLA.
- Ipotesi sull'influenza di un ipotetico gene Ir sulla predisposizione alle malattie (violazione della selezione dei determinanti antigenici, presenza di "buchi" nel repertorio dei linfociti T, violazione della soppressione mediata dai linfociti T).
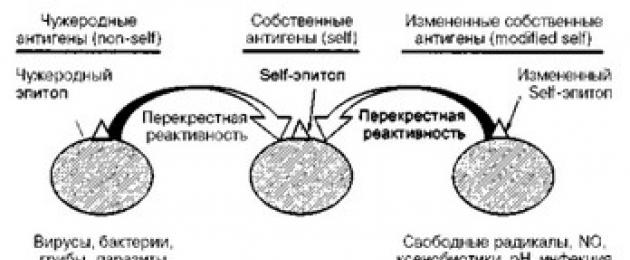
- Teoria del mimetismo molecolare. Il termine "mimetismo" è stato proposto una volta per spiegare la somiglianza, l'identità dei determinanti antigenici di alcuni microrganismi con i determinanti antigenici dell'ospite, e quindi il loro riconoscimento da parte del sistema immunitario non avviene, il che provoca lo sviluppo di una malattia infettiva. Allo stato attuale, la teoria del mimetismo molecolare è cambiata ed è rappresentata da due varianti (Fig. 20).
Avendo riconosciuto un agente estraneo, il sistema immunitario è protetto da due meccanismi principali: 1) produzione di anticorpi umorali;

Riso. 20. Il ruolo del mimetismo nello sviluppo dell'autoimmunità (spiegazione nel testo).
- generazione di linfociti T citotossici. Nel primo meccanismo di difesa, gli anticorpi attaccano gli agenti infettivi extracellulari e le loro tossine, formando immunocomplessi; nel secondo meccanismo, per salvare l'intero organismo, i linfociti T citotossici devono distruggere le proprie cellule, nelle quali si nascondono gli agenti patogeni intracellulari.
I microrganismi esprimono una varietà di antigeni simili, se non identici, a quelli dell'ospite. Se tutti i linfociti T e B in grado di reagire con questi antigeni venissero eliminati durante il periodo di sviluppo della tolleranza, si creerebbero grandi lacune nelle capacità protettive del sistema immunitario, che permetterebbero a questi microrganismi di invadere liberamente il corpo. Tuttavia non è così, quindi i linfociti T e B che riconoscono gli agenti infettivi che hanno antigeni simili agli antigeni dell'ospite (antigeni con reazione crociata) possono reagire con le proprie cellule, cioè avere autoreattività.
Pertanto, quando si crea tolleranza nel periodo embrionale e postnatale, non si verifica la completa distruzione dei linfociti T e B autoreattivi. Trattenendo i linfociti T e B autoreattivi, l'organismo aumenta la capacità del sistema immunitario di resistere agli agenti infettivi che hanno strutture antigeniche simili. Di conseguenza, lo sviluppo di una risposta immunitaria antinfettiva protettiva in determinate condizioni può portare allo sviluppo di una risposta autoimmune (Tabella 17).
Tabella 17. Esempi di mimetismo molecolare nella patologia autoimmune nell'uomo
|
Malattia |
Antigene auto |
Antigene non self |
|
Sclerosi multipla |
proteina basica della mielina |
Virus dell’epatite B, polimerasi, proteina fosfolipidica cerevisiale del Saccharomyces, proteina CRMI |
|
|
Decarbossilasi dell'acido glutammico |
Virus Coxsackie, proteina 32-C |
|
Cirrosi biliare primitiva |
Complesso della piruvato deidrogenasi (RDS-E2) |
Escherichia coli, proteina RDS-E2 |
|
febbre reumatica coinvolgendo il cuore |
Proteine della miosina cardiaca |
Streptococco beta-emolitico, proteina M |
|
La malattia di Chagas |
Catene pesanti della miosina cardiaca |
Trypanosoma cruzi, proteina B13 |
Tuttavia, va tenuto presente che la risposta autoimmune (soprattutto sotto forma di produzione di autoanticorpi umorali dopo malattie infettive) non sempre termina con lo sviluppo di una malattia autoimmune.
B. Secondo la seconda versione della teoria del mimetismo molecolare, gli antigeni (auto-, self-) dell'ospite possono essere modificati sotto l'influenza di vari fattori: esposizione prolungata ad agenti infettivi, influenza dei radicali liberi, N 0, xenobiotici, medicinali, esposizione a fattori ambientali (radiazioni ionizzanti e ultraviolette, esposizione a basse temperature, ecc.). Come risultato di tali influenze, gli autoantigeni cambiano e vengono riconosciuti dal sistema immunitario come estranei (non self). - Gli autoanticorpi prodotti e i linfociti citotossici si legano non solo agli autoantigeni modificati, ma anche ai veri autoantigeni a causa della stessa reattività crociata (mimetismo, somiglianza ).
I meccanismi immunologici del danno tissutale nelle malattie autoimmuni coinvolgono tutti quei meccanismi effettori attraverso i quali il sistema immunitario protegge l'organismo dall'intervento esogeno: anticorpi umorali, immunocomplessi, linfociti T citotossici e citochine. Nello sviluppo del processo patologico, questi fattori possono agire sia separatamente che insieme.
A azione diretta autoanticorpi sulle cellule e sui tessuti del corpo, di norma viene attivato il sistema del complemento, che contribuisce alla loro distruzione. È possibile una variante per "attivare" il meccanismo della lisi mediata da cellule anticorpo-dipendente, cioè con la partecipazione delle cellule K. In alcuni casi, gli autoanticorpi diretti contro i recettori cellulari funzionalmente rilevanti stimolano o inibiscono la funzione cellulare specializzata senza distruggerla.
Nel caso in cui si formino immunocomplessi circolanti, costituiti da autoantigeni e autoanticorpi, motivi diversi possono farli depositare nel sistema microvascolare vari enti(reni, articolazioni, pelle, ecc.) o in luoghi di stress emodinamico, con un andamento turbolento pronunciato (biforcazioni, secrezioni grandi vasi e così via.). Nei luoghi in cui si depositano gli immunocomplessi, il complemento viene attivato, si accumulano granulociti e monociti, che secernono vari enzimi. Tutto ciò porta alla morte delle cellule dell'organo "shock".
La maturazione dei linfociti T citotossici porta al loro accumulo nel tessuto interessato (infiltrazione perivascolare) con conseguente. lo sviluppo soffio dell'effetto omicida, dell'attrazione un largo numero cellule infiammatorie.
Negli ultimi anni, nello sviluppo del danno autoimmune a cellule e tessuti, è stata prestata molta attenzione alle citochine proinfiammatorie - IL-1, alfa-ONF, gamma-IFN, IL-2, nonché all'attivazione dell'apoptosi meccanismi. Oggi esistono prove che il danno tissutale autoimmune può essere realizzato attraverso il meccanismo di legame non specifico di Fas + FasL e l'attivazione dell'apoptosi. Ciò è dovuto al fatto che il recettore Fas appare sulla superficie delle cellule, ad esempio le cellule B del pancreas e gli oligodendrociti, sotto l'influenza di vari stimoli (principalmente citochine). I linfociti T autoreattivi che esprimono FasL possono legarsi al recettore Fas e indurre la morte apoptotica delle cellule bersaglio.
Interessanti sono anche le seguenti osservazioni. Si ritiene che l'espressione costitutiva (iniziale) di FasL sulla superficie cellulare di organi privilegiati (ad esempio, occhi, testicoli) sia protettiva, consentendo l'induzione dell'apoptosi nei linfociti Fas-positivi quando entrano nei tessuti corrispondenti. Tuttavia, la presenza di un recettore Fas e di un ligando Fas sulla superficie della stessa cellula può causare il suicidio autocrino di tale cellula. Un meccanismo simile è considerato una delle cause dello sviluppo della tiroidite di Hashimoto (ci sono FasL sui tirociti e, sotto determinate influenze, i recettori Fas iniziano ad essere fortemente espressi sulla membrana dei tirociti).
La presenza di autoanticorpi di per sé non indica lo sviluppo della malattia. A titoli bassi, gli autoanticorpi si trovano costantemente nel siero sanguigno di individui sani e partecipano al mantenimento dell'omeostasi, assicurano l'escrezione di prodotti metabolici, il controllo idiotipico e altri processi fisiologici.
Sulla base dei dati sopra riportati è possibile definire i concetti di “processo autoimmune” e “malattia autoimmune”.
Il processo autoimmune (autoimmunità) è una forma di risposta immunitaria indotta da determinanti autoantigenici in condizioni normali e patologiche; è uno dei meccanismi per il mantenimento dell’omeostasi. La gravità dei processi autoimmuni in condizioni normali è insignificante.
Una malattia autoimmune lo è processo patologico, nella cui patogenesi giocano un ruolo importante gli autoanticorpi e/o la risposta autoimmune cellulare.
I segni con cui questa o quella malattia possono essere classificate come autoimmuni sono stati formulati da L. Vitebsky (1961).
- La presenza di autoanticorpi o linfociti T citotossici diretti contro l'antigene associato a questa malattia.
- Identificazione dell'autoantigene contro il quale è diretta la risposta immunitaria.
- Trasferimento del processo autoimmune utilizzando siero contenente anticorpi o linfociti T citotossici.
- La possibilità di creare un modello sperimentale della malattia introducendo un autoantigene con lo sviluppo di appropriati disturbi morfologici caratteristico della malattia.
- La presenza di autoanticorpi specifici;
- La presenza di sensibilizzazione cellulare specifica (rilevata utilizzando la reazione di trasformazione blastica - PBT e il test di inibizione della migrazione leucocitaria in presenza del corrispondente autoantigene);
- Aumento dei livelli di gammaglobuline e/o IgG;
- Cambiamento nel numero di T-helper e T-soppressori, che porta ad un aumento dell'indice immunoregolatorio;
- Diminuzione dei livelli dei componenti del complemento C3 e C4;
- Depositi di complessi immunitari nei tessuti colpiti (IgG, IgM, C3, C4 e fibrina);
- Infiltrazione di cellule linfoidi nei tessuti colpiti;
- Determinazione del fenotipo HLA.
Tabella 18. Malattie correlate all'HLA (Lechler, 1994; Yao-Hua Song et al. 1996; Menard, El-Amini, 1996)
|
Malattia |
|
HLA- antigeni |
|
celiachia |
Alfa gliadina |
DR3, DR7 |
|
La sindrome di Goodpasture |
Collagene della membrana basale dei glomeruli renali* |
DR2 |
|
Morbo di Graves |
Recettore della tireotropina* |
DR3, DR5 |
|
Tiroidite di Hashimoto |
Tireoglobulina*, microsomi |
DR3, DR5 |
|
diabete mellito insulino-dipendente |
Decarbossilasi dell'acido glutammico (CHK-65 e DHA-67), recettore dell'insulina, tirosina fosfatasi 1A-2 e 1A-2p, cellule P pancreatiche * |
DR3, DR4 |
|
Sclerosi multipla |
Proteina base della mielina* |
DR2, DR4 |
|
grave miastenia grave |
Recettore dell'acetilcolina* |
DR3 |
|
La malattia di Bechterew |
sconosciuto |
B27 |
|
La sindrome di Reiter |
sconosciuto |
B27 |
|
anemia perniciosa |
H+/K+-ATPasi, fattore interno*, cellule parietali dello stomaco |
DR5 |
|
Narcolessia |
sconosciuto |
DR7 |
|
Sclerosi sistemica progressiva |
DNA topoisomerasi, RNA polimerasi |
DR5 |
|
Psoriasi volgare |
sconosciuto |
DR7 |
|
Artrite reumatoide |
Frammento Fc di IgG*, collagene, calpastatina |
DR7, DR21 |
|
Artrite reumatoide giovanile |
Frammento Fc di IgG*, collagene |
DR5 |
|
LES |
DNA a doppia elica*, cardiolipina, fattori della coagulazione, Sm, RD, RNP |
DR3, DR2 |
|
Vitiligine |
Tirosinasi |
DR4 |
|
Malattia |
Antigene verso il quale si sviluppa una risposta immunitaria |
HLA- antigeni |
|
Dermatite erpetiforme |
Gliadina, reticolina* |
DR3 |
|
Pemfigo volgare |
“Complesso antigenico Re V”, epidermide, giunzioni intercellulari* |
DR4, DRw6 |
|
febbre reumatica |
Miocardio (streptococco) |
¦ - |
|
pemfigoide bolloso |
Antigene della membrana basale della pelle * |
- |
|
Uveite |
Antigene della camera anteriore |
- |
|
Oftalmia simpatica |
Antigene coroide |
- |
|
Anemia emolitica autoimmune |
Eritrociti * |
- |
|
Porpora trombocitopenica idiopatica |
Piastrine * |
- |
|
Cirrosi biliare primitiva |
Mitocondri * |
- |
|
Attivo cronico |
Muscolo liscio*, gene dell'antigene nucleare |
- |
|
epatite |
patocita |
|
|
Colite ulcerosa aspecifica |
Antigene del colon |
- |
|
Morbo di Crohn |
Antigene intestinale (E. coli) |
- |
|
Sindrome di Sjogren |
Antigeni nucleari: SS-A, SS-B * |
- |
|
Dermatomiosite |
Antigene nucleare Go-I*, antigene del muscolo scheletrico |
- |
|
Sclerodermia sistemica |
Antigene nucleare Scl-70* |
- |
|
Malattie miste del tessuto connettivo |
Antigene nucleare RNP* |
- |
- In contatto con 0
- Google+ 0
- OK 0
- Facebook 0